T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
DONÖR-π-AKSEPTÖR TĠPĠ BOYAR MADDELER ĠLE HASSASLAġTIRILMIġ TiO2
VE YARDIMCI KATALĠZÖR OLARAK ALAġIM METAL SÜLFÜRLERĠN KULLANIMI ĠLE HĠDROJEN ÜRETĠMĠ
Emre ASLAN DOKTORA TEZĠ
Kimya Anabilim Dalı
Mayıs-2018 KONYA Her Hakkı Saklıdır
iv ÖZET
DOKTORA TEZĠ
DONÖR-π-AKSEPTÖR TĠPĠ BOYAR MADDELER ĠLE HASSASLAġTIRILMIġ TiO2 VE YARDIMCI KATALĠZÖR OLARAK ALAġIM METAL
SÜLFÜRLERĠN KULLANIMI ĠLE HĠDROJEN ÜRETĠMĠ
Emre ASLAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
DanıĢman: Doç. Dr. Ġmren HATAY PATIR Yıl, 144 Sayfa
Jüri
Prof. Dr. Mustafa ERSÖZ Doç. Dr. Ġmren HATAY PATIR
Doç. Dr. Mustafa CAN Doç. Dr. Ahmet Özgür SAF Doç. Dr. Ġlkay Hilal GÜBBÜK
Güneş ışığı ile suyun hidrojen ve oksijene ayrışması hem güneş enerjisinin depolanmasını hem de etkili, yenilenebilir ve temiz bir yakıt olan hidrojenin üretilmesini sağlamaktadır. Bu reaksiyon doğada gerçekleşen fotosentez reaksiyonuyla büyük benzerlik içerisinde olduğundan ―yapay fotosentez‖ olarak da adlandırılmakta olup büyük önem arz etmektedir. Yapay fotosentezdeki enerji depolamanın belirleyici faktörü yarı iletkenlerin verimliliğidir. Şimdiye kadar fotokimyasal olarak suyun ayrışmasında çok sayıda heterojen ve homojen yarıiletkenler kullanılmış olup, yarıiletken metal oksitlerden kararlı, korozif olmayan, çevre dostu, ucuz ve bol bulunan TiO2 fotokatalizörü yoğun bir şekilde araştırılmıştır. Geniş bant aralığına sahip olan TiO2 sadece UV bölge ışığı ile uyarılabildiğinden, ışık ile ayrılan elektron-boşluk çiftinin yeniden birleşme hızları (rekombinasyon) yüksek olduğundan ve hidrojen üretimi için yüksek potansiyel gerektirdiğinden fotokatalitik aktivitesi düşüktür. Bu fotokatalitik aktivite; TiO2‘in boyalar ile duyarlı hale getirilerek görünür bölge ışığının absorpsiyonun sağlanmasıyla ve/veya etkili hidrojen üretim katalizörlerinin TiO2 fotokatalizörü yanında yardımcı katalizör olarak kullanılmasıyla arttırılabilmektedir.
Bu tez çalışmasında ilk olarak TiO2‘in hidrojen üretimindeki fotokatalitik aktivitesinin arttırılması amacıyla, Cu2WS4 ve MYSx (M = Ni, Co, Fe ve Mn; Y = W ve Mo) yapıları sentezlenmiş ve hidrojen üretiminde yardımcı katalizör olarak kullanılmıştır. Donör ve akseptör gruplara sahip olan etkili ışık absorbsiyonu yapabilecek yeni organik yarı iletken boyaların sentezlenmesi ve bu yapılar ile TiO2‘in foto-duyarlı hale getirilerek elde edilmiş olan bu organik (boyar madde)-TiO2-inorganik (MYSx) hibrit yapının sudan fotokimyasal (fotoelektrokimyasal ve fotokatalitik) hidrojen üretimindeki aktivitesi elektron verici çözelti olan trietanolamin (TEOA) ortamında incelenmiştir. Fotoelektrokimyasal hidrojen üretim çalışmalarında yardımcı katalizör eklenmesi ile TiO2‘in n-tipi yarıiletken yapısından dolayı aktivite artışı gözlenmezken, fotokatalitik hidrojen üretim çalışmalarında fotokatalitik aktivite artışı gözlenmiştir. Fotokatalitik çalışmalarda MYSx yardımcı katalizörlerinin band seviyelerindeki uyumsuzlukları nedeniyle fotokatalitik aktivite artışı sağlanamazken, Cu2WS4 varlığında fotokatalitik aktivitenin yükseldiği rapor edilmiştir. Yardımcı katalizör olarak Cu2WS4‘ün katalitik aktivitesi değerli metal olan Pt ile karşılaştırılmış olup D-π-A türü organik boyar maddelerin fotokatalitik aktivitesi ise ticari bir boyar madde olan Eosin-Y ile karşılaştırılmıştır. Fotokatalitik hidrojen üretim reaksiyonunun mekanizması kullanılan bileşenlerin elektrokimyasal band seviyelerine göre açıklanmıştır. Boyar maddeler arasındaki fotokatalitik aktivite farkları; yapısal, optik, elektrokimyasal ve fotoelektrokimyasal özelliklerine göre açıklanmıştır.
v
Aynı zamanda, doğadaki fotosentez reaksiyonu biyolojik membranlarda gerçekleştiğinden ve birbiriyle karışmayan iki elektrolit çözelti arasındaki arayüzeyler biyomembranlar ile benzer özellik gösterdiğinden, sentezlenen Cu2WS4 ve MYSx yapılarının sıvı/sıvı arayüzeylerde (su/1,2-dikloretan (DCE)) organik elektron verici dekametilferrosen (DMFc) tarafından elektrokatalitik hidrojen üretiminde katalizör olarak kullanılmıştır. Üçlü metal sülfür bileşiklerin katalitik aktiviteleri iki fazlı reaksiyonlar ve 4-elektrotlu voltametri metotlarıyla incelenmiştir. İki fazlı reaksiyonların sonuçları üretilen hidrojen miktarları ve DMFc+ konsantrasyonları sırasıyla gaz kromatografsi ve UV-Vis spektrometresi ile izlenmiştir. 4-elektrotlu voltametri sonuçlarıyla da katalitik aktiviteler belirlenmiş ve iki fazlı reaksiyonlar ile uyum içerisinde olduğu anlaşılmıştır. Elde edilen sonuçlardan MYSx bileşiklerinin katalitik aktivitelerinin metallerin elektronegatiflikleri ve elektron ilgileri ile ilişkili olduğu görülmüştür.
Anahtar Kelimeler: donör-π-akseptör türü boyar madde, fotoelektrokimyasal, fotokatalitik,
vi ABSTRACT
Ph.D THESIS
HYDROGEN EVOLUTION BY USING TiO2 SENSITIZED BY
DONOR-π-ACCEPTOR TYPE DYES AND ALLOYED METAL SULFIDES AS CO-CATALYST
Emre ASLAN
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF DOCTOR OF PHILOSOPHY IN CHEMISTRY
Advisor: Assoc. Prof. Dr. Ġmren HATAY PATIR Year, 144 Pages
Jury
Prof. Dr. Mustafa ERSÖZ
Assoc. Prof. Dr. Ġmren HATAY PATIR Assoc. Prof. Dr. Mustafa CAN Assoc. Prof. Dr. Ahmet Özgür SAF Assoc. Prof. Dr. Ġlkay Hilal GÜBBÜK
The water splitting (WS) into hydrogen and oxygen using solar energy is a promising way to solve both solar energy storage and efficient renewable and green production of hydrogen fuel. This is usually called artificial photosynthesis because these reactions are similar to those in the natural photosynthesis. A decisive factor of energy storage in artificial photosynthesis is the efficiency of the semiconductors. So far, many different heterogeneous and homogeneous semiconductors have been used in fotochemical WS and semiconducting metal oxides, in particular those of TiO2, has been a widely used photocatalyst for photocatalytic water splitting because it is stable, non-corrosive, environmentally friendly, abundant, and cost-effective. However, the large band gap of TiO2 limits its utilization of the solar spectrum only in the UV region. TiO2 requires UV irradiation and shows fast rates of electron–hole recombination and a high overpotential for hydrogen evolution. The resulting poor photocatalytic efficiency can be considerably enhanced by dye-sensitisation of TiO2 to allow for visible light absorption, and/or co-attachment of an efficient hydrogen evolution catalyst.
In this thesis, firstly the synthesis of Cu2WS4 and MYSx (M = Ni, Co, Fe and Mn; Y = W and Mo) structures has been used to increase of photocatalytic activity of TiO2 for hydrogen evolution as co-catalysts. Moreover, the synthesis of new organic semiconductor dyes, which have donor and acceptors groups and are capable of effective light absorption, have been investigated for the photosensitization of TiO2. The obtained organic-TiO2-inorganic hybrid structures have been used for the photochemical hydrogen evolution from WS in triethanolamine (TEOA) as an electron donor solution media. In the photoeletrochemical hydrogen evolution studies, while increasing of photocatalytic activity does not observed in addition of co-catalyst due to the n-type semiconductor structure of TiO2, however photocatalytic activity increasement is observed in the photocatalytic hydrogen evolution. While the photocatalytic activities have not been increased due to the inconformity of the co-catalyst at the band levels in photocatalytic studies, photocatalytic activity is enhanced in the presence of Cu2WS4 co-catalyst. The activities of Cu2WS4 as the co-catalyst and D-π-A dyes as the sensitizer have been compared to noble metal catalyst Pt and commercial dye Eosin-Y, respectively. The mechanism of photocatalytic hydrogen evolution reactions have been explained by using electrochemical band levels of each component. The
vii
differences of photocatalytic activities have been clarified by structural, optical, electrochemical and photoelectrochemical properties of dyes.
Concurrently, the synthesized Cu2WS4 and MYSx structures have been used for the electrocatalytic hydrogen evolution at liquid/liquid interfaces (water/1,2-dichloroethane (DCE)) by organic electron donor decamethylferrocene (DMFc) because in nature, photosynthesis occurs in biological membranes and their analogy with biomembranes of an interface between two immiscible electrolyte solutions (ITIES). The catalytic activities of ternary metal sulfides have been investigated by two-phase reactions and 4-electrode voltammetry methods. The results of two-phase reactions have been monitored by the amounts of evolved hydrogen and DMFc+ concentration with gas chromatography and UV-Vis spectrometer, respectively. The catalytic activities have also been determined by 4-electrode voltammetry and it is observed that these activities are coherent with the results of two-phase reactions. It is reported that the catalytic activities of MYSx are related with electronegativity and electron affinity of metals from obtained results.
Keywords: donor-π-acceptor type dyes, hydrogen evolution, liquid/liquid interfaces, metal
viii ÖNSÖZ
Bu tez çalışması, Selçuk Üniversitesi Fen Fakültesi Biyoteknoloji Bölümü Öğretim Üyesi Doç. Dr. İmren HATAY PATIR danışmanlığında hazırlanmış ve Selçuk Üniversitesi Fen Bilimleri Enstitüsü‘ne Doktora Tezi olarak sunulmuştur.
Öncelikle lisansüstü eğitimim boyunca bilimsel katkıları ve sürekli olarak çalışmaya teşvik etmesi sayesinde kendimi akademik alanda geliştirmemi sağlayan, bu tez çalışması özelinde çalışmalarımın planlanmasından bitirilmesine kadar olan süreçte desteklerini hiç esirgemeyen danışman hocam sayın Doç. Dr. İmren HATAY PATIR‘a en büyük teşekkürlerimi sunarım.
Tez çalışmalarım boyunca beni destekleyerek tezimin incelenmesi ve düzeltilmesinde yardımlarını esirgemeyen TİK üyelerim sayın Prof. Dr. Mustafa ERSÖZ ve sayın Doç. Dr. Ahmet Özgür SAF hocalarıma içtenlikle teşekkür ederim.
Organik boyar maddelerin sentezlerini gerçekleştiren ve bunların analizleri konusunda yorumlarıyla yönlendiren sayın Doç. Dr. Mustafa CAN hocama; yardımcı katalizör sentez çalışmalarını yönetip benim manevi olarak zor bir süreçten geçtiğim doktora eğitimim boyunca desteğini sürekli hissettiren sayın Doç. Dr. Faruk ÖZEL‘e özel teşekkürlerimi sunarım.
Deneysel çalışmalarımda yardımlarını esirgemeyen ve manevi olarak yanımda olduklarını hissettiren lisansüstü öğrencileri ekip arkadaşlarım Gizem YANALAK ve Mehmet Kerem GÖNCE‘ye; ve bu çalışmada kullandığım maddelerin sentez aşamasındaki özverili çalışmaları için Adem SARILMAZ ve Merve KARAMAN‘a çok teşekkür ederim.
Bu tez çalışmasının gerçekleştrilmesinde maddi destek sağlayan TÜBİTAK (215M309) ve SÜ-BAP (17201020) projelerine ek olarak TÜBA-GEBİP programına teşekkür ederim.
Hayatımın her döneminde olduğu gibi bu dönemde de desteklerini eksik etmeyen annem, babam, ablam ve ailesine sonsuz teşekkürlerimi sunar ve bu çalışmayı onlara ithaf ederim.
Emre ASLAN KONYA-2018
ix ĠÇĠNDEKĠLER ÖZET ... iv ABSTRACT ... vi ÖNSÖZ ... viii ĠÇĠNDEKĠLER ... ix SĠMGELER VE KISALTMALAR ... xi 1. GĠRĠġ ... 1
1.1. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretimi ... 2
1.1.1. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretiminin Genel Mekanizması ... 3
1.1.2. Fotokatalizörler ... 4
1.1.3. Yardımcı katalizör ... 6
1.1.4. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretiminde Kullanılan Boyar Maddeler ... 7
1.1.5. Boyar Madde ile Hassaslaştırılmış Fotokatalitik Hidrojen Üretimi ... 9
1.1.6. Boyar Madde ile Hassaslaştırılmış Fotoelektrokimyasal Hidrojen Üretimi 11 1.2. Sıvı/Sıvı Arayüzeylerde Katalitik Hidrojen Üretimi ... 13
1.2.1. ITIES‘in yapısı ve Elektriksel Çift Tabaka ... 14
1.2.2. Galvani Potansiyel Farkı ... 16
1.2.3. ITIES‘te Nernst Eşitliği ... 17
1.2.4. ITIES‘in Polarizasyonu ... 19
1.2.5. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretim Reaksiyonu ve Katalizi ... 23
2. KAYNAK ARAġTIRMASI ... 27
2.1. Boyar Madde ile Hassaslaştırılmış Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretimi ... 27
2.2. Metal Sülfür Katalizörlerinin Kullanılmasıyla Katalitik ve Sıvı/Sıvı Arayüzeylerde Katalitik Hidrojen Üretimi ... 30
3. MATERYAL VE YÖNTEM ... 38
3.1. Kullanılan Kimyasallar ... 38
3.2. Kullanılan Cihazlar ... 39
3.3. Analiz Yöntemleri ... 39
3.3.1. Nükleer Manyetik Rezonans Spektroskopisi ... 39
3.3.2. UV-Vis Absorpsiyon Spektroskopisi... 39
3.3.3. Elektrokimyasal Teknikler ... 40
3.3.4. X-ışınları Kırınımı ... 40
3.3.5. X-ışınları Fotoelektron Spektroskopisi ... 40
3.3.6. Geçirimli Elektron Mikroskobu ... 41
3.3.7. Taramalı Elektron Mikroskobu ... 41
x
3.3.9. İnfrared Spektroskopisi ... 41
3.3.10. Gaz Kromatografisi Yöntemi ... 41
3.4. Organik Boyar Maddelerin Sentezlenmesi ... 42
3.4.1. MZ-235 ve MZ-341‘in Sentezlenmesi ... 42
3.4.2. MC-32 ve MC-048‘in Sentezlenmesi ... 43
3.4.3. MK-2, MK-3, MK4 ve MK-8‘in Sentezlenmesi ... 44
3.5. Fotokatalizör ve Fotoelektrotların Hazırlanması ... 48
3.6. Yardımcı Katalizörlerin Sentezlenmesi ... 49
3.6.1. Cu2WS4 Katalizörünün Sentezlenmesi ... 49
3.6.2. MYSx Katalizörlerinin Sentezlenmesi ... 49
3.7. Hidrojen Üretimi ... 50
3.7.1. Sudan Fotokatalitik Hidrojen Üretimi ... 50
3.7.2. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 51
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 58
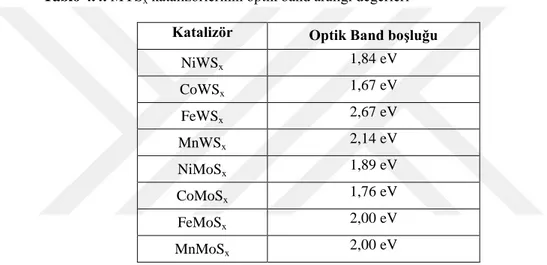
4.1. Katalizörlerin Karakterizasyonu ... 58
4.1.1. Organik Boyar Maddelerin Karakterizasyonları ... 58
4.1.2. Yardımcı Katalizörlerin Karakterizasyonları ... 70
4.2. Fotoelektrokimyasal ve Fotokatalitik Hidrojen Üretimi ... 83
4.2.1. MZ-341 ve MZ-235 Boyar Maddeleri ile Hassaslaştırılmış TiO2 ile Fotoelektrokimyasal ve Fotokatalitik Hidrojen Üretimi ... 84
4.2.2. MC-32 ve MC-048 Boyar Maddeleri ile Hassaslaştırılmış TiO2 ile Fotoelektrokimyasal ve Fotokatalitik Hidrojen Üretimi ... 92
4.2.3. MK-2, MK-3, MK-4 ve MK-8 Boyar Maddeleri ile Hassaslaştırılmış TiO2 ile Fotoelektrokimyasal ve Fotokatalitik Hidrojen Üretimi ... 96
4.3. Sıvı/Sıvı Arayüzeylerde Katalitik Hidrojen Üretimi ... 100
4.3.1. Cu2WS4 Katalizörlüğünde Sıvı/Sıvı Arayüzeylerdeki Hidrojen Üretimi ... 102
4.3.2. MYSx Katalizörlüğünde Sıvı/Sıvı Arayüzeylerdeki Hidrojen Üretimi ... 108
5. SONUÇLAR VE ÖNERĠLER ... 121 5.1 Sonuçlar ... 121 5.2 Öneriler ... 124 KAYNAKLAR ... 125 EKLER ... 133 ÖZGEÇMĠġ ... 138
xi SĠMGELER VE KISALTMALAR Simgeler A : Absorbans λ : Dalga boyu : Aktivite katsayısı hν : Işık (foton)
: İç elektrik potansiyeli (Galvani potansiyeli)
i
a : i iyonunun aktivitesi
: Galvani potansiyel farkı i
: i iyonunun elektrokimyasal potansiyeli
i
: i iyonunun kimyasal potansiyeli0,
i
: i iyonunun standart kimyasal potansiyeli0, tr,i G
: i iyonunun standart Gibbs transfer enerjisi
0
i
: i iyonunun standart Galvani transfer potansiyeli R : İdeal gaz sabiti, 8,314 J/K-1mol-1
F : Faraday sabiti, 96485 C
Kısaltmalar
Ag2SO4 : Gümüş sülfat AgCl : Gümüş klorür
Au : Altın
BACl : Bis(trifenilfosforanilidin)amonyum klorür
BATB : Bis(trifenilfosforanilidin)amonyum tetrakis(pentaflorofenil)-borat CB : İletkenlik bandı (conduction band)
CE : Karşıt elektrot
CNT : Karbon nanotüp
CO2 : Karbondioksit
Cu2O : Bakır (I) oksit Cu2WS4 : Bakır tunsten sülfür
CV : Dönüşümlü voltametri (cyclic voltammetry)
DB : Değerlik bandı
DCE : 1,2-dikloroetan
DFT : Yoğunluk fonksiyonel teorisi (Density functional theory) DMFc : Dekametilferrosen
DMFc+ : Dekametilferrosenyum D-π-A : Donör-π-akseptör
e- : Elektron
EDX : Enerji dağılımlı X-ışını spektroskopisi Et2O : Dietileter
eV : Elektronvolt
EY : Eosin-Y
FT-IR : Fourier transform infrared spektroskopisi
xii GO : Grafen oksit h+ : Boşluk (hole) H+ : Proton H2 : Hidrojen gazı H2PtCl6 : Kloroplatinik asit H2SO4 : Sülfirik asit HCl : Hidroklorik asit
HOMO : En yüksek enerjili dolu molekül orbitali (highest occupied molecular orbital)
HR-TEM : Yüksek Çözünürlüklü geçirimli elektron mikroskopu
ITIES : Birbirine karışmayan iki elektrolit çözelti arasındaki arayüzü simgeleyen (an interface between two immiscible electrolyte solutions)
İB : İletkenlik bandı
LiTB : Lityum tetrakis(pentaflorofenil)-borat
LSV : Doğrusal taramalı voltametri (lineer sweep voltammetry)
LUMO : En düşük enerjili boş molekül orbitali (lowest unoccupied molecular orbital) Mc : Metalosen MC-048 : 3-[7-(4-{bis[4-(hegziloksi)fenil]amino}fenil)-2,3-dihidrotiyeno[3,4-b][1,4]dioksin-5-il]-2-siyanoasetik MC-32 : 3-(4-{bis[4-(hegziloksi)fenil]amino}fenil)-2-siyonaasetik asit MK-2 : 4-[5-{6-[5-(4-{bis[4-(hegziloksi)fenil]amino}fenil)-4-(1-etilhegzil)-2-tiyenil]-1,2,4,5 tetrazin-3-il}-3-(2-etilhegzil)-2-tienil]benzoik asit MK-3 : (2Z)-3-[5‘{6-[5-(4-{bis[4-(hekziloksi)fenil]amino}fenil)-4-(2- etilhekzil)-2-tienil]1,2,4,5-tetrazin-3-il}-3‘-(2-etilhekzil)-2,2‘-bitien-5-il]-2-siyanoakrilik asit MK-4 : (2Z)-3-{5-[5-{6-[5-(4-{bis[4-(hekzilloksi)fenil]amino}fenil)-4-(2-etilhekzil)-2-tienil]-1,2,4,5-tetrazin-3-yl}-3-(2-etilhekzil)-2-tienil]-2-furil}-2-siyano akrilik asit MK-8 : (2E)-3-{4-[5-{6-[5-(4-{bis[4-(hekzilloksi)fenil]amino}fenil)-4- (2-etilhekzil)-2-tienil]-1,2,4,5-tetrazin-3-il}-3-(2-etilhekzil)-2-tienil]-2-fenil}-2-siyanoakrilik asit MV2+ : Metil violojen
MYSx : Üçlü alaşım metal sülfür (M = Ni, Co, Fe ve Mn; Y = W ve Mo) MZ-235 :
4-(4-{bis[4-(hekziloksi)fenil]amino}fenil)-7-okso-7H-benzimidazo[2,1-a]benzo[de]izokinolin-11-karboksilik asit
MZ-341 : 4-[4-(difenilamino)fenil]-7-okso-7H-benzimidazo[2,1-a]benzo[de]izokinolin-11-karboksilik asit
NHE : Normal Hidrojen Elektrot
NiO : Nikel oksit
NMR : Nükleer manyetik rezonans
O2 : Oksijen gazı
OA : Oleik asit
OLA : Oleil amin
PCET : Protonla birleştirilmiş elektron transferi
Pd : Palladyum
Pt : Platin
RE : Referans elektrot
Ru : Rutenyum
xiii
SEM : Taramalı elektron mikroskopu (Scanning electron microscopy) SHE : Standart Hidrojen Elektrot
TBA+ : Tetrabütilamonyum katyonu TBACl : Tetrabütilamonyum klorür TEA+ : Tetraetilamonyum katyonu TEACl : Tetraetilamonyum klorür
TEM : Geçirimli elektron mikroskopu (Transmission electron microscopy)
TEOA : Trietanolamin THF : Tetrahidrofuran TiO2 : Titanyum dioksit
TLC : İnce film kromatografisi (Thin film chromatography)
UV : Ultraviyole
UV-Vis : Ultraviyole-Görünür bölge V : Potansiyel fark (volt)
VB : Değerlik bandı (valance band) XPS : X-ray fotoelektron spektroskopisi XRD : X-ray difraktometresi
1. GĠRĠġ
Enerji; insanlığın varoluşundan beri sanayileşme, toplumların gelişmesi ve üretim gereksinimlerini karşılamada ihtiyaç duyulan en önemli olgulardan biridir. 1950 yılından bu yana dünya nüfusu 2,5 kat artarken, enerji talebi 7 kat artmıştır. Enerji ihtiyacı günümüze kadar farklı kaynaklardan karşılanmıştır. Enerji kaynakları genellikle yenilenebilir ve yenilenemez enerji kaynakları olmak üzere ikiye ayrılır. Dünyada giderek yükselen enerji ihtiyacının yenilenebilir enerji kaynakları ve temiz enerji kaynakları tarafından çevreye zarar vermeden ve sürekli bir dönüşüm sağlanarak giderilebileceği düşünülmektedir. Günümüzde enerji ihtiyacının çok büyük bir bölümü fosil yakıtlardan karşılanmakta olup, yenilenebilir enerji kaynaklarına gerekli önem gösterilmediği için enerji ihtiyacı başta olmak üzere çevre kirliliği sorunları da ortaya çıkmaktadır. Kömür, petrol ve doğal gaz gibi hidrokarbon içeren fosil yakıtlar doğal enerji kaynaklarıdır. Fosil yakıtlar kullanıldığında çevreye CO2 ve CO olmak üzere çeşitli gazlarla birlikte; bazı toz parçacıkları yayılmaktadır. Bunun yanında petrol ve doğalgazın bilinen rezervlerinin giderek azalması yeni ve temiz enerji kaynaklarının araştırılmasına yol açmıştır. Gelecek nesillerin enerji ihtiyacını karşılamak ve çevreye daha az zarar verilmesi için sürdürülebilir enerji kaynaklarına yönelmek gerekmektedir. Enerji kaynaklarını riske atmadan enerji ihtiyacını karşılamak üzere üretilen enerji, sürdürülebilir enerji kaynakları olarak adlandırılmaktadır. Sürdürülebilir enerji kaynakları içerisinde yenilenebilir enerji kaynakları; devamlılığı ve ihtiyacı karşılama yönünden önemli bir rol oynamaktadır.
Yenilenebilir enerji kaynakları; Güneş enerjisi
Rüzgâr enerjisi
Hidrolik (hidroelektrik) enerjisi Jeotermal enerji
Biyokütle enerjisi Hidrojen enerjisi Dalga enerjisi
şeklinde sıralanabilmektedir. Hidrojen enerjisi, yenilenebilir enerji kaynakları arasıda önemli bir yere sahiptir. Hidrojen yakıt olarak kullanılmasının yanısıra birincil enerji kaynaklarından elde edilen ikincil enerji kaynaklarını taşımak için de kullanılabilmektedir. Bu yüzden hidrojen enerji taşıyıcı olarak adlandırılmaktadır.
Günümüzde çok çeşitli hidrojen üretim metotları mevcut olup; daha yüksek verime, daha düşük maliyete, daha çevreci yöntemlerin kullanılmasıyla hidrojen üretimi için araştırmalar devam etmektedir. Güneş enerjisi ve su kullanılarak elde edilebilecek olan hidrojen, ucuz, çevre dostu ve sonsuza kadar temiz enerji sağlayabilecek bir yakıt olarak kullanılabilecektir. Bu nedenle, sudan güneş ışığı vasıtasıyla (fotokatalitik veya fotoelektrokimyasal olarak suyun ayrışması) hidrojen üretimi ucuz ve verimli bir yöntem olarak kabul edilmekte olup, yenilenebilir kaynaklardan hidrojen üretimi ve hidrojen ekonomisine geçiş için büyük önem taşımaktadır.
1.1. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretimi
Işık enerjisinin kullanılmasıyla suyun hidrojen ve oksijen gazlarına ayrışması reaksiyonu için pozitif ve büyük bir Gibbs serbest enerji değişimi gözlenmektedir. Sudan fotokatalitik hidrojen üretimi yenilenebilir hidrojen üretimi ve temiz enerji dönüşümü için büyük önem arz etmektedir. Bu reaksiyon yeşil bitkiler ve klorofil taşıyan canlıların ışık enerjisi kullanarak organik bileşiklerin üretilmesi şeklinde gerçekleşen fotosentez olayıyla termodinamik olarak büyük benzerlik göstermektedir (Şekil 1.1). Bu nedenle suyun ayrışması reaksiyonundan yapay fotosentez olarak da bahsedilmektedir. Suyun ayrışmasından fotokatalitik hidrojen üretim reaksiyonu pozitif Gibbs serbest enerjisi değişiminden dolayı kendiliğinden gerçekleşemeyeceği için bir fotokatalizöre veya katalizöre ihtiyaç duyulmaktadır.
ġekil 1.1. Klorofil taşıyan bitkiler tarafından fotosentez ve bir fotokatalizör varlığında suyun
fotokatalitik ayrışması reaksiyonu (yapay fotosentez) (Aslan, 2014)
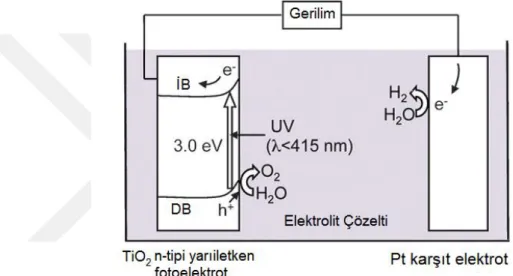
Literatürde en çok kullanılan fotokatalizör olan TiO2 ile güneş ışığından temiz, çevre dostu ve maliyeti düşük fotokatalitik hidrojen üretimi gerçekleştirilebilmektedir. TiO2‘in fotokatalizör olarak kullanılması ile hidrojen üretimi ilk olarak
fotoelektrokimyasal metot ile Fujishima ve Honda (1972) tarafından gerçekleştirilmiştir. Bu çalışmada TiO2 kaplı fotoelektrot fotoanot olarak kullanılmış olup, fotoanotun 190 nm dalga boyundaki UV ışık ile uyarılmasıyla elektron ve boşluk çifti birbirinden ayrılmıştır. Uyarılmış elektron bir elektriksel bağlantı ile Pt karşıt elektrota aktarılmakta ve burada suyun indirgenmesiyle hidrojen üretimi gerçekleşmektedir. TiO2 üzerinde kalan orbital boşluğu suyun yükseltgenmesi sayesinde doldurulmakta ve TiO2 fotoanot üzerinde oksijen üretimi gözlenmektedir (Şekil 1.2).
ġekil 1.2. TiO2 fotoanot kullanılmasıyla suyun fotoelektrokimyasal ayrışmasının örnek diyagramı (İB: İletkenlik bandı, DB: Değerlik bandı, EF: Fermi seviyesi)
1.1.1. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretiminin Genel Mekanizması
Yarıiletken bir fotokatalizör varlığında fotokatalitik veya fotoelektrokimyasal hidrojen üretimi Şekil 1.3‘te görüldüğü üzere 3 temel basamakta gerçekleşmektedir. İlk olarak yarı iletken fotokatalizör üzerine gönderilen fotonların absorplanması gerçekleşmekte ve bu şekilde elektron-boşluk çifti birbirinden ayrılmaktadır (i). Daha sonra ayrılan yüklerin reaksiyonun gerçekleşeceği yüzeydeki aktif bölgelere göç etmesi gerçekleşmektedir (ii). Son olarak yüzey aktif bölgelerinde uyarılmış elektronun suyu indirgeyerek hidrojen üretimi ve boşluğun suyu yükseltgeyerek oksijen üretimi gerçekleşmektedir (iii). Bunun yanında yüklerin ayrılmasından sonra tekrar bir araya gelmesi ile literatürde rekombinasyon olarak bilinen olay meydana gelebilmektedir (ii) ve bu olay fotokatalitik aktivitenin düşmesine neden olabilmektedir. Burada fotokatalitik reaksiyonun gerçekleşmesi için gönderilen ışık enerjisinin yarıiletken fotokatalizörün band aralığından daha fazla olması gerekmektedir. Band aralığından daha yüksek enerjiye sahip ışının fotokatalizör üzerine gönderilmesi ile yükler
birbirinden ayrılarak elektron fotokatalizörün iletkenlik bandına göç ederken değerlik bandında bir orbital boşluğu oluşmaktadır.
ġekil 1.3. Fotokatalitik olarak suyun ayrışmasından H2 ve O2 gazlarının oluşumunun şematik gösterimi (Aslan, 2014)
Suyun ayrışması ile oksijen ve hidrojen gazlarının fotokatalitik reaksiyonlar ile elde etmenin zorluğu ortamda oluşan oksijen gazının sulu çözeltilerde çözünmesi ile hidrojen üretimini engellemesinden kaynaklanmaktadır. Suyun tam ayrışması için genellikle fotoelektrokimyasal sistemler kullanılmaktadır. Bu sistemlerde hidrojen ve oksijen gazları fiziksel olarak birbirinden ayrılmış olan katot ve anotta oluşmaktadır (Yu ve ark., 2015). Bu kısıtlamalardan dolayı elektron verici çözeltiler kullanılarak fotokatalitik hirojen üretim reaksiyonları gerçekleştirilirken elektron alıcı çözeltiler kullanılmasıyla fotokatalitik oksijen üretim reaksiyonları gerçekleştirilebilmektedir (Zhang ve ark., 2016b).
1.1.2. Fotokatalizörler
Işığın etkisiyle reaksiyonları başlatan veya hızını arttıran yarıiletken maddelere fotokatalizör denir. Fotokatalitik hidrojen üretiminde yarıiletken fotokatalizör elektron yönlendirici ve reaksiyon ortamı olarak rol oynamaktadır. Fotokatalitik/fotoelektrokimyasal hidrojen üretimi için kullanılacak yarıiletken fotokatalizörler için bazı gereksinimler vardır. İdeal olarak iletkenlik band seviyesi H+/H2 indirgenme potansiyelinden (-0,42 V vs. NHE, pH = 7 için) daha negatif olmalı değerlik band seviyesi ise O2/H2O indirgenme potansiyelinden (0,81 V vs. NHE, pH = 7 için) daha pozitif seviyede olmalıdır. Buradan kullanılacak olan fotokatalizörün minimum band aralığının 1,23 eV‘tan daha büyük olması gerektiği anlaşılmaktadır. Bunun yanında görünür bölgede çalışacak bir fotokatalizör için ise band aralığının en
fazla 3 eV olması gerekmektedir (λ >400 nm). Bu band aralığı kullanılan fotokatalizörün absorpsion spektrumundan eşitlik 1.1 kullanılarak hesaplanmaktadır (Kudo ve Miseki, 2009).
Band genişliği (eV) = 1240/ λ (nm) (1.1)
Yarıiletken fotokatalizör yüksek yüzey alanına sahip olmalı, kararlı olmalı, iyi elektron transfer özelliklerine sahip olmalı, boyar maddeler ile bağlanabilmeli, boyar madde ve yardımcı katalizörle uygun band seviyesine sahip olmalı; toksik ve pahalı olmamalıdır (Ma ve ark., 2014). Tablo 1.1‘de de özetlendiği gibi bu çalışmayı temel alarak fotokimyasal olarak suyun ayrışmasında yüzlerce yarıiletken fotokatalizör ve yardımcı katalizör sistemi kullanılmıştır (Li ve ark., 2015b).
Tablo 1.1. Suyun ayrışmasında kullanılan fotokatalizör ve yardımcı katalizörler (Li ve ark., 2015b)
Fotokatalizör
Geniş band aralıklı fotokatalizörler
(Eg > 3 eV)
TiO2 (3,2), ZnO (3,2), ZrO2 (5,0), SrTaO7 (4,6), Zn2GeO4 (4,6), Zn2GaO4 (4,6), NaTaO3.La (4,1), Ta2O5 (4,0), β-Ge3N4 (3,8-3,9), ZnS (3,6), K2La2Ti3O10 (3,4-3,5), K4Nb6O17 (3,4), , SrTiO3 (3,2) Görünür ışıkla uyarılabilen fotokatalizörler (Eg < 3 eV)
Oksitler: PbBi2Nb2O9 (2.88), Bi2WO6 (2.8), GaFeO3, WO3 (2.8), VO2 (2.7), InTaO4 (2.6), CoO (2.6), BiVO4 (2.4), SrTiO3:Rh (2.3),Fe2O3 (2.2),Cu2O (2.2), Ag3VO4 (2.0)
Oksit Olmayanlar: GaN:ZnO (2.58), TaON (2.5),
ZnS:Cu (2.5), CdS (2.4), AgInZn7S9 (2.33), ZnIn2S4 (2.3), Ta3N5 (2.1), LaTiO2N (2.1), Sm2Ti2S2O5 (2.0), CdSe (1.7), Bi2S3 (1.28)
Metal içermeyenler: SiC (3.0), grafitik-C3N4 (2.7)
Yardımcı Katalizör
Değerli metal yardımcı katalizörleri
Element/alaĢım: Ru, Rh, Pd, Ir, Pt, Au, Ag, Pt/Ru BileĢikler: RuO2, IrO2, PdS, Ag2S, Ru2S3, Rh2S3, PtOx
Değerli metal olmayan yardımcı katalizörler
Element/alaĢım: Ni, Cu, Co, Ni−Mo, Ni−Mo−Zn, Ni−Zn Sülfürler: MoS2, MoSx, Mo3S4, NiS, CuS, CoS, WS2, Cu2MoS4, Cu2WS4, NiWSx, CoWSx
Oksitler: CoOx, Co3O4, FeCoNiOx, NiOx, Ni2O3, NiO, CuO, NiCo2O4, MnOx, Fe0.2Ni0.2Ga0.6Ox, Ni0.3Fe0.07Co0.2Ce0.43Ox
Hidroksit/oksohidroksitler: Ni(OH)2, Cu(OH)2, Co(OH)2, FeOOH, NiOOH, Ni-katkılanmış FeOOH
Fosfit/fosfatlar: Ni2P, Ni5P4, CoP, MoP, FeP, Co-Pi, NixCo3-x(PO4)2
Borit/Boratlar: MoB, TaB2, Ni-Bi, Co-Bi
Bu fotokatalizörler arasında kararlı, korozif olmayan, çevre dostu, ucuz ve bol bulunan TiO2 suyun ayrışması reaksiyonunda en çok çalışılan fotokatalizördür (Ma ve ark., 2014). Ancak, TiO2‘in geniş bant aralığı (3.2 eV) sadece UV bölgede absorbsiyon yapmasına neden olmaktadır. Ayrıca TiO2 yüzeyinde ışık ile ayrılan elektron-boşluk çiftinin rekombinasyon hızları yüksek olduğundan ve hidrojen üretimi için yüksek potansiyel gerektirdiğinden fotokatalitik aktivitesi düşüktür. Bu fotokatalitik aktivite (i) yardımcı katalizörler kullanılmasıyla ve (ii) TiO2‘in boya ile duyarlı hale getirilerek görünür bölge ışığının absorpsiyonun sağlanmasıyla arttırılabilmektedir.
1.1.3. Yardımcı katalizör
Yarıiletken fotokatalizör üzerindeki yardımcı katalizör rekombinasyon ve fotokorozyon gibi yan etkileri engelleyerek reaksiyonun meydana geleceği aktif bölgeleri artırmakta, yük ayrım performansını yükseltmekte, H2/O2 üretim potansiyellerini düşürmekte ve reaksiyonun meydana geleceği aktif bölgeler olarak görev almaktadır. Fotokatalitik reaksiyonlarda halen yaygın bir şekilde Pt, Pd, Ru, Rh, Au, Ag ve bunların alaşımları gibi değerli metal yardımcı katalizörleri kullanılmakta olup yüksek bir katalitik etki göstermektedir. Ancak, bu katalizörlerin doğada az bulunmaları ve bu nedenle çok pahalı olmalarından dolayı değerli metallerin alternatifi olabilecek ucuz, bol bulunan, yüksek kararlılık ve verimde hidrojen üretebilecek katalizörlerin geliştirilmesi için yoğun çalışmalar yapılmaktadır. Bu yüzden yüksek katalitik etkiye sahip değerli metal içermeyen yardımcı katalizör geliştirilmesi son zamanlarda büyük ilgi uyandırmaktadır. Değerli olmayan metal hidrojen üretim katalizörleri tasarlamada ilk olarak onların yeryüzünde bolluk ve potansiyel maliyeti dikkate alınmaktadır. Şekil 1.4‘te görüldüğü üzere değerli olmayan metallerden bazılarının dünyada bolluk oranları Pt < W = Mo < Co < Cu < Ni << Fe şeklinde sıralanmaktadır ve bu nedenle ucuz ve bol bulunan Fe ve Ni tabanlı katalizörlerin geliştirilmesi için çok sayıda çalışmaya rastlanmaktadır (Zou ve Zhang, 2015).
ġekil 1.4. Hidrojen üretim reaksiyonunda kullanılabilecek metallerin dünya üzerinde bulunma
yoğunluğu (Zou ve Zhang, 2015)
Fotokatalitik hidrojen üretim sistemlerinde fotouyarılmış elektronun yarıiletkenin iletkenlik bandından değerlik bandına geri dönmesinden kaynaklanan rekombinasyonun engellenmesi oldukça önemli bir problemdir ve bu nedenle yardımcı katalizörler kullanılmaktadır. Yardımcı katalizör kullanılarak hem yüklerin ayrımı önemli ölçüde kolaylaştırılmış hem de hidrojen üretimi için aktif bölgelerin oluşması sağlanmış olacaktır (Zhang ve ark., 2016b). Bunlara ek olarak yardımcı katalizör kullanımı ile yarıiletken fotokatalizörün absorpsiyon kapasitesinin de artabileceği rapor edilmiştir (Jin ve ark., 2006). Moleküler yardımcı katalizör olarak hidrojenaz enzim yapılarına benzeyen yapılar seçimli ve tersinir olarak reaksiyonu katalizleyebilmektedir (Lubitz ve ark., 2014). Yüksek katalitik etki göstermesi ve enzim yapılarına benzemesi nedeniyle MoSx ve WSx katalizörleri oldukça ilgi çekmektedir. Son yıllarda MoSx ve WSx katalizörlerine metal katkılanması veya MMoSx ve MWSx yapıları (M = Ni, Co, Fe, Mn, Zn, vb. geçiş metalleri) gibi üçlü metal sülfürler suyun ayrışmasından hidrojen üretim reaksiyonlarında katalizör olarak kullanımı büyük ilgi uyandırmaktadır (Barber ve Tran, 2013; Huan ve ark., 2016).
1.1.4. Fotokatalitik ve Fotoelektrokimyasal Hidrojen Üretiminde Kullanılan Boyar Maddeler
Şimdiye kadar boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretiminde kullanılan boyar madde türleri genellikle kuantum noktalar, metal kompleksleri ve organik boyar maddeler olarak sınıflandırılabilmektedir. Kuantum noktalar 1-10 nm boyutlarındaki inorganik bileşiklerdir. Metal kompleksleri, rutenyum (Ru) kompleksleri ve diğer metal kompleksleri olarak sınıflandırılmaktadır. Ru kompleklerinin literatürde çok çalışması yapılmış olup değerli metal içeriğinden dolayı
kullanımı sınırlıdır. Diğer metal kompleksleri içerisinde porfirin ve ftalosiyanin bileşikleri boyar madde ile hassaslaştırılan hidrojen üretim reaksiyonlarında hassaslaştırma maddesi olarak sıkça kullanılmıştır (Zhang ve ark., 2016b). Metal içermeyen organik boyar maddeler çeşitliliği, düşük maliyeti, ayarlanabilir yapıları ve spektral özelliklerinden dolayı oldukça ilgi çekmektedir. Son zamanlarda özellikle xanthane boyaları, katyonik organik boyar maddeler ve donor-π-akseptör (D-π-A) türü organik boyar maddeler görünür bölge ışığı altında yapılan boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretiminde kullanılmaya başlanmıştır. D-π-A türü organik boyar maddeler; boyar maddeler ile hassaslaştırılmış güneş hücrelerinde (DSSC) yüksek fotovoltaik çevrim verimi sağlamıştır (Wu ve Zhu, 2013). DSSC ile benzer mekanizmalar üzerinden yürüdüğü için D-π-A türü organik boyar maddelerin; boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretiminde kullanımı ilgi uyandırmaktadır (Zhang ve ark., 2016b). D-π-A türü organik boyar maddeler optik ve elektrokimyasal özelliklerinin kolaylıkla ayarlanabilmesinin yanı sıra molekül içi etkin yük transfer özelliklerinden dolayı oldukça ilgi çekmektedir. Bu tipte boyar maddelerde kumarin, merosiyanin, trifenilamin, fenotiazin, karbazol ve bunların türevi donör kısımları oldukça yaygındır (Wu ve Zhu, 2013; Yu ve ark., 2015; Zhang ve ark., 2016b). Şekil 1.5‘te şimdiye kadar boyar maddeler ile hassaslaştırılmış fotokatalitik hidrojen üretim çalışmalarında kullanılan bazı D-π-A türü organik boyar maddeler görülmektedir.
ġekil 1.5. Boyar maddeler ile hassaslaştırılmış fotokatalitik hidrojen üretim çalışmalarında
1.1.5. Boyar Madde ile HassaslaĢtırılmıĢ Fotokatalitik Hidrojen Üretimi
TiO2 gibi geniş band aralığına sahip yarıiletken fotokatalizörlerin ışık absorpsiyonlarını görünür bölgeye kaydırmak için en etkili stratejilerden birisi de yarıiletken fotokatalizör üzerine bağlanacak moleküler fotohassaslaştırıcılar kullanmaktır (O'Regan ve Grätzel, 1991; Hagfeldt ve Grätzel, 2000; Hagfeldt ve ark., 2010). İnorganik metal oksit yarıiletken fotokatalizörlerin aksine, organometalik komplekslerin ve organik boyar maddelerin enerji seviyelerini (LUMO (lowest unoccupied molecular orbital, en düşük enerjili boş molekül orbitali) ve HOMO (highest occupied molecular orbital, en yüksek enerjili dolu molekül orbitali)) ayarlamak molekül yapılarındaki belirli modifikasyonlar yapılması sayesinde daha kolaydır. Bu şekilde spektral özellikleri de ayarlanabilmektedir.
Boyar madde ile hassaslaştırılmış fotokataltik hidrojen üretim sistemlerinde yarıiletken fotokatalizör yük aktarım aracısı olarak görev yapmakta olup boyar madde ve yardımcı katalizörün bunun üzerine bağlanıp ikisi arasında etkin bir şekilde elektron aktarmasını sağlamaktadır. Yarıiletken fotokatalizörün en önemli noktası, iletkenlik bandının boyar maddenin LUMO enerji seviyesinden daha pozitif ve yardımcı katalizörün başlangıç (onset) potansiyelinden daha negatif bir enerji seviyesine sahip olmalı, bu sayede iki bileşen arasındaki köprüyü kurabilecek özellikte olmalıdır.
Işık altında fotokatalizör/katalizör sisteminin çözeltide kolloidal dağılmasıyla fotokatalitik çalışmalar fotoelektrot hazırlamaktan daha basit bir şekilde gerçekleştirilebilmektedir. Boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretimi şekil 1.6‘da şematik olarak gösterilmiştir. Bu sistemde 4 ana bileşen bulunmaktadır; (i) yarıiletken fotokatalizör üzerine bağlanmış boyar madde molekülü, (ii) yariletken fotokatalizör, (iii) yardımcı katalizör (Pt vb.) ve (iv) bir elektron verici madde. Reaksiyon mekanizması temel olarak 4 basamakta ilerlemektedir. İlk olarak (i) boyar madde üzerinden ışık absorpsiyonu ile bir elektron boyar maddenin HOMO enerji seviyesinden LUMO enerji seviyesine uyarılmaktadır. Daha sonra (ii) boyar maddenin LUMO enerji seviyesindeki fotouyarılmış elektron yarıiletken fotokatalizörün iletkenlik bandına enjekte edilmekte ve buradan (iii) hidrojen üretim reaksiyonunun gerçekleşeceği aktif bölgelere transfer edilmektedir (varsa yardımcı katalizör). Son aşamada ise (iv) fotouyarılmış boyar maddeye elektron verici madde tarafından elektron sağlanarak reaksiyonun tam bir çevrimi sağlanmaktadır. Hidrojen üretim reaksiyonu; yük ayrımı performansını arttırmak, Schottky bariyeri oluşturarak etkili elektron
tuzakları oluşturmak ve reaksiyonun gerçekleşebileceği aktif bölgeleri arttırmak için genellikle bir yardımcı katalizöre gereksinim duymaktadır (Maeda ve ark., 2008).
ġekil 1.6. Görünür ışık altında sudan fotokatalitik hidrojen üretim reaksiyonu için boyar madde
ise hassaslaştırılmış yarıiletken sistemin temel çalışma prensibi
Tüm bunlara rağmen bu sistem için olumsuz birkaç durum da mevcuttur. Bunlar: boyar maddenin LUMO enerji seviyesindeki fotouyarılmış elektronların HOMO enerji seviyesine geri dönmesi veya yarıiletken fotokatalizörün iletkenlik bandındaki fotouyarılmış elektronların boyar maddenin HOMO enerji seviyesine geri dönmesi gibi rekombinasyon reaksiyonları ve boyar maddenin kendi kendini indirgeyerek bozunması gibi istenmeyen reaksiyonlardır. Bu yüzden hidrojen üretim aktivitesi ve kararlılığı düşebilmektedir. Bu olumsuzlukları ortadan kaldırmak için bazı gereksinimler vardır. İlk olarak yarıiletken fotokatalizörü hassaslaştırmak için kullanılan boyar maddenin ideal olarak bütün görünür bölge ve yakın kızılötesi bölgesini kapsayan geniş bir absorpsiyon spektrumuna sahip olması gerekmektedir. Bunun yanında boyar maddenin LUMO enerji seviyesinin fotokatalizörün iletkenlik bandından daha negatif, HOMO enerji seviyesinin ise elektron verici maddenin redoks potansiyelinden daha pozitif olması gerekmektedir. Bunlara ek olarak boyar madde ışık karşısında uzun süreler boyunca kararlılığını koruyabilmeli ve ucuz olmalıdır.
Boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretiminde çözeltideki elektron verici madde boyar maddenin rejenerasyonunda ve yarıiletken fotokatalizöre elektron aktarımında oldukça önemli bir rol oynamaktadır. Boyar madde ile hassaslaştırılmış fotokatalitik hidrojen üretiminde en çok kullanılan elektron vericiler trietanolamin (TEOA) ve etilendiamin tetraasetik asittir (EDTA). Yarıiletken
fotokatalizör ve yardımcı katalizörlerin aksine elektron verici enerji band seviyeleri ve band etkileşimleri daha karmaşıktır. Örneğin elektron verici çözeltinin pH‘ının değişimiyle boyar maddenin fotokatalizör üzerine adsorpsiyonu, boyar madde ve fotokatalizörün enerji band seviyeleri, yük transferleri ve elektron enjeksiyon özellikleri değişmektedir. Tüm bu değişkenler ile fotokataltik hidrojen üretim aktivitesi doğrudan etkilenmektedir (Zhang ve ark., 2016b).
1.1.6. Boyar Madde ile HassaslaĢtırılmıĢ Fotoelektrokimyasal Hidrojen Üretimi Geleneksel yarıiletken metal oksit fotoelektrotlarda hem ışığın absorpsiyonu hem de yüklerin ayrımı fotokatalizör üzerinde gerçekleşirken, boyar madde ile hassaslaştırılmış fotokatalizörlerde bunlar birbirinden ayrılmıştır. Işığın absorpsiyonu geniş band aralığına sahip metal oksit yarıiletken fotokatalizöre tek tabaka olarak bağlanmış boyar madde molekülünde gerçekleşirken yük ayrımı yarıiletken/boyar madde arayüzeyinde gerçekleşmektedir.
Fotoelektrokimyasal bir sistemde TiO2 gibi n-tipi yarıiletkenlerin fotoanot olarak ve Pt‘in karşıt elektrot olarak kullanılması ile suyun ayrışması gerçekleşebilmektedir. Burada reaksiyon boyar madde molekülünün fotouyarılması ile uyarılmış elektronun TiO2‘in iletkenlik bandına aktarılmasıyla sonuçlanmaktadır. Yükseltgenen boyar madde molekülü suyun yükseltgenmesini sağlayarak oksijen gazının açığa çıkmasıyla rejenere edilmektedir. TiO2‘in iletkenlik bandına aktarılan elektron dış bir bağlantıyla karşıt elektrota aktarılmakta ve burada suyun indirgenmesiyle hidrojen gazı açığa çıkmaktadır (Şekil 1.7a). Alternatif olarak NiO gibi p-tipi yarıiletkenlerin fotokatot olarak ve Pt‘in karşıt elektrot olarak kullanılması ile suyun ayrışması gerçekleşebilmektedir. Burada boyar maddenin ışık ile uyarılmasından sonra, uyarılmış elektron suyu indirgeyerek hidrojen gazı açığa çıkarırken, karşıt elektrotta suyun yükseltgenerek oksijen gazı açığa çıkarttığı görülmektedir (Şekil 1.7b). Hem n-tipi fotoanot hem de p-tipi fotokatodun bir arada kullanılmasıyla suyun ayrışması ―tandem fotoelektrokimyasal hücreler‖ tarafından da gerçekleştirilebilmektedir (Şekil 1.7c).
ġekil 1.7. Boyar madde ile hassaslaştırılmış fotoanot (a), boyar madde ile hassaslaştırılmış
fotokatot (b) ve boyar maddeler ile hassaslaştırılmış tandem hücreler (c) kullanılması ile suyun fotoelektrokimyasal ayrışmasının çalışma prensipleri (S1 ve S2: organik boyar madde; O2-kat: O2 üretim katalizörü; H2-kat: H2 üretim katalizörü; PDM: Proton değiştirici membran)
Şekil 1.8‘de suyun ayrışmasında kullanılabilecek fotoanot (a) ve fotokatot (b) bileşenlerinin olduğu fotoelektrokimyasal hücrelerin enerji diyagramı görülmektedir. Burada hem fotoanot hem de fotokatot olarak rol oynayan fotoelektrokimyasal hücrelerdeki boyar maddelerin görünür bölge ışığını olabildiğince çok absorplaması gerekmektedir. Şekil 1.8a incelendiğinde ışıkla uyarılan boyar maddedeki bir elektron HOMO seviyesinden LUMO seviyesine aktarılarak buradan TiO2‘in iletkenlik bandına enjekte edilmekte ve buradan da dış bir bağlantı ile karşıt elektroda transfer olarak orada hidrojen gazı açığa çıkartmaktadır. Bu işlemin gerçekleşebilmesi için kullanılacak olan boyar maddenin LUMO seviyesinin kimyasal olarak bağlı olduğu n-tipi bir yarıiletken olan TiO2‘in iletkenlik bandından daha negatif enerji seviyesinde olması gerekmektedir. Bunun yanında kullanılan elektrot maddelerinin (TiO2, boyar madde, varsa O2 üretim katalizörü) ışık ve elektrokimyasal işlemler altında kararlı olması gerekmektedir. Fotoanot üzerinde O2 üretim katalizörü bulunuyorsa bunun onset potasiyelinin boyar maddenin HOMO seviyesinden daha negatif olması gerekmektedir. Şekil 1.8b incelendiğinde ise ışıkla uyarılan boyar maddedeki bir elektron HOMO seviyesinden LUMO seviyesine aktarılarak buradan hidrojen üretim katalizörüne enjekte edilmekte ve hidrojen gazı açığa çıkartmaktadır. Burada önemli olan nokta boyar maddenin
LUMO seviyesinin, hidrojen üretim katalizörünün başlangıç potansiyelinden daha negatif bir enerji seviyesinde olmasıdır. Bunun yanında boyar maddenin HOMO seviyesi kimyasal olarak bağlı olduğu p-tipi bir yarıiletken olan NiO‘in değerlik band seviyesinden daha pozitif bir enerji seviyesinde olması gerekmektedir. Fotokatotun bir dış bağlantı ile bağlı olduğu Pt karşıt elektrot üzerinde ise suyun indirgenmesi ile oksijen gazı açığa çıkmaktadır.
ġekil 1.8. Boyar madde ile hassaslaştırılmış fotoanot (a) ve boyar madde ile hassaslaştırılmış
fotokatotun (b) enerji diyagramı (Eonset: katalitik reaksiyon için onset potansiyeli)
Literatürde fotoanot materyali olarak n-tipi TiO2 kullanılması ile suyun ayrışması oldukça çok çalışılmakta olup ışık ve elektrik potansiyeli altında oldukça kararlı sonuçlar elde edilmektedir (Yu ve ark., 2015). Buna karşın p-tipi materyallerin kullanılması ile fotokatot çalışmaları oldukça sınırlıdır ve ilk kararlı boyar madde ile hassaslaştırılmış fotokatot çalışması 2012 yılında gerçekleştirilmiştir (Li ve ark., 2012a). Bu çalışmada fotokatotta nanoboyutlardaki NiO, D-π-A türü bir boyar madde ile hassaslaştırılmış ve hidrojen üretim katalizörü olarak moleküler kobaloksim kullanılmıştır.
1.2. Sıvı/Sıvı Arayüzeylerde Katalitik Hidrojen Üretimi
Birbiriyle karışmayan veya oldukça az karışabilen (ideal olarak sıfır) ve herbiri bir elektrolit içeren iki sıvı çözelti birbiriyle temas ettirildiğinde bir arayüzey oluşmaktadır. Oluşan bu arayüzey kısaca ITIES (Interface between Two Immiscible Electrolyte Solutions) olarak adlandırılmaktadır. Burada, çözücülerden biri genellikle su, diğeri ise su ile karışmayan organik bir çözücüdür. Bunlardan en yaygın kullanılanları 1,2-dikloroetan (DCE), nitrobenzen (NB) ve oktanoldür. Kullanılan
organik çözücülerin orta veya yüksek dielektrik geçirgenliğe sahip olmaları gerekmektedir (Samec, 2004).
Yük transfer mekanizmalarını çözümlemek için yapılan çalışmalar sırasında yürütücü kuvvet olarak iki faz arasındaki Galvani potansiyel farkının kullanılabileceği ve ITIES‘in polarizlenebileceği gösterilmiştir. ITIES‘de yük transfer reaksiyonlarının incelemesi için kronopotansiyometri gibi elektrokimyasal teknikler kullanılmıştır (Gavach ve Henry, 1974; Gavach ve ark., 1978). Samec ve ark. (1977) tarafından geliştirilen 4 elektrotlu sistemin kullanılmasıyla ITIES çalışmalarındaki IR düşüşünün giderebileceği rapor edilmiştir. Bu sistem sayesinde ITIES‘de yük transfer reaksiyonları dönüşümlü voltametri (Samec ve ark., 1979c; Samec ve ark., 1979b; Samec ve ark., 1979a), akım tarama polarografisi (Homolka ve Mareček, 1980), kronoamperometri (Kakutani ve ark., 1983), diferansiyel puls sıyırma voltametrisi (Mareček ve Samec, 1983), alternatif akım (ac) voltametrisi (Hundhammer ve ark., 1983) ve alternatif akım (ac) impedans spektroskopisini (Samec ve ark., 1982) içeren potansiyel kontrollü tekniklerinin kullanıldığı çalışmalara imkân tanımıştır.
1.2.1. ITIES’in yapısı ve Elektriksel Çift Tabaka
Sıvı/sıvı arayüzeyler dinamik özelliklere sahip ve heterojen moleküler bir yapıdadır. Moleküler dinamik hesaplamalar, yüzey gerilim ölçümleri, kapasitans ve spektroskopik çalışmalardan sıvı/sıvı arayüzeylerin metal/elektrolit çözelti arayüzeyleri ile oldukça benzer özellikleri olduğu anlaşılmıştır.
Bir elektrolit çözelti içerisine metal bir elektrodun daldırılması ile metalin negatif (veya pozitif) bir yükle yüklenerek çözeltideki pozitif (veya negatif) yüklü iyonlar elektroda doğru çekilmektedir. Bunun sayesinde elektrot/elektrolit arayüzeyinde bir potansiyel fark oluşmaktadır. Farklı işaretli yüklerin arayüzeyin her iki tarafında toplanması sayesinde bu bölgede bir elektriksel çift tabaka oluşmaktadır. Elektriksel çift tabaka iki bölgeye ayrılmaktadır:
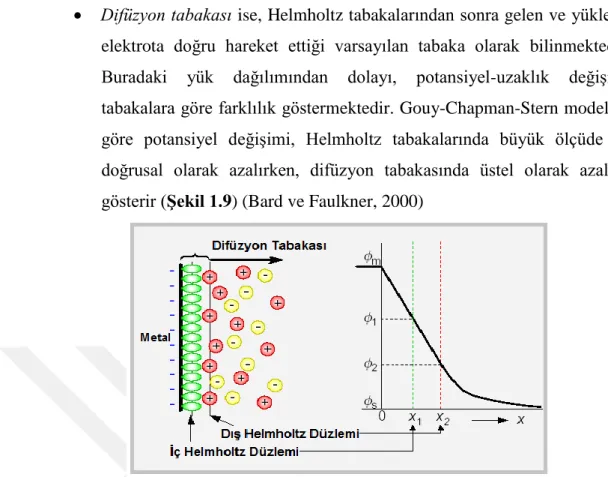
Elektroda yakın olan alanda yüzeye adsorplanmış iyonları bulunduran İç Helmholtz Tabakası (İç Helmholtz Düzlemi, İHP) ve arayüzeyin çözeltiye doğru olan iç kısmında çözücü molekülleri tarafından çevrelenmiş ve elektrot yüzeyinde adsorplanmış iyonların ters işareti şeklindeki anyon ya da katyonların yer aldığı Dış Helmholtz Tabakası (Dış Helmholtz Düzlemi, OHP).
Difüzyon tabakası ise, Helmholtz tabakalarından sonra gelen ve yüklerin elektrota doğru hareket ettiği varsayılan tabaka olarak bilinmektedir. Buradaki yük dağılımından dolayı, potansiyel-uzaklık değişimi tabakalara göre farklılık göstermektedir. Gouy-Chapman-Stern modeline göre potansiyel değişimi, Helmholtz tabakalarında büyük ölçüde ve doğrusal olarak azalırken, difüzyon tabakasında üstel olarak azalma gösterir (ġekil 1.9) (Bard ve Faulkner, 2000)
ġekil 1.9. Elektriksel çift tabaka ve potansiyel farkın uzaklıkla değişimi (Hatay, 2010)
Sıvı/sıvı arayüzeylerde ise birbiriyle karışmayan iki faz arasında bir elektriksel çift tabaka oluşumu gerçekleşmektedir. Sıvı/sıvı arayüzeyler metal/elektrolit arayüzeylerle benzemesine rağmen ayrıldığı noktalar da mevcuttur. Bunlar arasındaki en önemli şekil 1.10‘da görüldüğü üzere her iki fazın da aşırı yük dağılımını taşıyabilmesidir. Ancak metal katı elektrotlarda aşırı yük tamamen dış kaynaktan dolayı meydana gelmektedir. Elektrolit kısmında ise katı elektrot üzerindeki aşırı yükü karşılamak amacıyla zıt yükler birikmekte ve potansiyel düşüşü bu tabakada gerçekleşmektedir (Şekil 1.10a). Sıvı/sıvı arayüzeylerde ise her iki fazdaki aşırı yük bölgeleri elektrolit çözeltiler bulundurduğundan dolayı polarizasyon tamamen iyoniktir (Şekil 1.10b) (Hatay, 2010).
ġekil 1.10. Arayüzeylerdeki aşırı yük dağılımları (a) katı/sıvı ve (b) sıvı/sıvı arayüzeyi, d.t.;
difüzyon tabakası kalınlığı (Hatay, 2010)
1.2.2. Galvani Potansiyel Farkı
Termodinamik olarak boşluktaki bir mol yüklü i iyonunu bir sıvı fazın içerisine getirildiği kabul edildiğinde; gerçekleşen bu transfer için gerekli olan iş elektrokimyasal potansiyel (~i) olarak tanımlanmaktadır:
i
~ = i
+ ziF (1.1)
i
z; iyonun değerlik sayısı, F; Faraday sabiti ve
; galvani potansiyelini göstermektedir.i
(kimyasal potansiyel) ise iyon-dipol etkileşimleri, dağılım kuvvetleri gibi iyon ve çevresi arasındaki tüm kısa mesafeli etkileşimleri gösterir ve genellikle elektrokimyasal potansiyelin kimyasal katkısı olarak isimlendirilir. İdeal bir çözeltide i aşağıdaki gibi
yazılır: i =
io+ RT lnai (1.2) o i
; standart kimyasal potansiyel ai ; i iyonunun aktivitesi olmak üzere Eşitlik 1.1 yeniden düzenlenirse: i ~ = o i
+ RT lnai+ ziF (1.3) Fzi ; bir yükü transfer etmek için gerekli olan elektriksel işle ilgilidir. Temel
elektrostatiğe göre elektriksel iş ziF iki terimi kapsar:
Fazın yüküyle ilgili elektrostatik terim: ziF
: moleküler dipollerin yüzeyde seçimli yönelimlerinden kaynaklanan sıvı fazın yüzey potansiyelidir.
: Yüklü nesnenin yüzeyi ve vakum arasındaki potansiyel farkıdır ve dış potansiyel olarak adlandırılır. Bu nedenle Galvani potansiyeli (iç potansiyel) yüzey ve dış potansiyelinin toplamı olarak tanımlanmaktadır (Hatay, 2010).
= + (1.4)ġekil 1.11. İki faz arasındaki Yüzey potansiyeli, Dış potansiyel (Volta potansiyeli) ve Galvani
potansiyel farkları (Hatay, 2010)
Şekil 1.11‘den görüldüğü üzere, elektrolit iki çözelti içeren ―α‖ ve ―β‖ fazları birbirleriyle temas ettiğinde elektron veya iyon gibi yük taşıyıcıların solvasyon Gibbs serbest enerji farklarından kaynaklı iki faz arasında dağılımları gerçekleşmektedir. İstemli olarak gerçekleşen bu davranış, arayüzey boyunca Galvani potansiyel farkının oluşması için polarize olmuş bir arayüzey oluşturur (elektriksel alan kuvveti sıfırdan farklı). Bu şartlarda aşağıdaki eşitlikler yazılabilir:
- = ( - ) + ( - ) (1.5) = + (1.6)
iki faz arasında meydana gelen Galvani potansiyel farkını göstermektedir (Hatay, 2010).
1.2.3. ITIES’te Nernst EĢitliği
Bir mol ―i” iyonu boşluktan bir sıvı fazın içerisine getirildiği zaman, bu transferi gerçekleştirmek için gerekli olan iş elektrokimyasal potansiyel (~i) olarak
tanımlanmıştır (~i= o i
birbiriyle karışmayan iki çözücü olarak organik (o) ve su (w) fazlarının temas ettirildiğinde su fazından organik faza ―i‖ iyonunun transferi için gerekli olan enerji şu şekilde tanımlanmaktadır: w o o w tr,i i i G
(1.7) Bu eşitlikteki w i ve o i , sırasıyla su ve organik fazlarındaki ―i” iyonunun elektrokimyasal potansiyellerini simgelemektedir.
ġekil 1.12. ―i‖ iyonu organik fazda sulu fazdakinden daha negatif kimyasal potansiyele sahiptir.
İki faz temas ettirildiği zaman, iyon sulu fazdan organik faza transfer olmaya eğilimlidir (Hatay, 2010)
Her iki fazdaki ―i” iyonunun molar Gibbs enerjsi (elektrokimyasal potansiyel) birbirine eşit olduğu zaman termodinamik dengeye ulaşılmaktadır (eşitlik 1.8).
w i = o i (1.8) w o i ,
+ RT ln w i a + ziFw =
i0,o+ RT ln o i a + ziFo (1.9)Eşitlik 1.9‘un tekrar düzenlenmesi ile Galvani potansiyel farkı elde edilir (eşitlik 1.10). w o = w- o= o i w o + F z RT i ln w i o i a a (1.10) w 0 o
i ―i” iyonun standart galvani transfer potansiyelidir ve eşitlik 1.11‘deki
gibi gösterilebilir. 0,w o tr, w 0 o i i i G z F (1.11)
Eşitlik 1.10‘daki eşitlik katı/sıvı arayüzeylerindeki elektron transfer reaksiyonlarında kullanılan klasik Nernst eşitliğine benzemektedir. Bu yüzden sıvı/sıvı arayüzey çalışmalarında iyon transfer reaksiyonu için Nernst eşitliği olarak
adlandırılmaktadır (Samec, 2004). Buradaki farklılık klasik Nernst eşitliğindeki gibi bir redoks reaksiyonu içermemesidir. Eşitlik 1.10‘daki Nernst eşitliğindeki aktivite yerine analitik konsantrasyonu kullanmak daha pratik olduğu için, standart Galvani transfer potansiyeli yerine formal Galvani transfer potansiyelinin 0'
i w o
kullanılması tercih edilir. türlerin aktiflik katsayısını ifade etmekte olup formal transfer potansiyeli için eşitlik 1.12 kullanılmaktadır. ' 0 i w o = 0 i w o + F z RT i ln w i o i (1.12)
Buna ek olarak bu eşitlik analitik konsantrasyonlar kullanılarak aşağıdaki şekilde yazılabilmektedir. w o = 0' i w o + F z RT i ln w i o i c c (1.13) 1.2.4. ITIES’in Polarizasyonu
Sıvı/sıvı arayüzeylere potansiyel uygulandığında veya akım geçtiğinde ideal olarak polarizlenen veya polarizlenemeyen şekilde davranışlar göstermektedir. Bu fark katı/sıvı arayüzeyleri ile benzerlik gösterir. ITIES‘te ideal olarak polarizlenebilen arayüzeylerde akım değişimi çok küçük değerlerdeyken, polarizlenmeyen arayüzeylerde yüksek akım değişimleri görülmektedir. ITIES‘teki polarizasyon iyon aktiviteleri tarafından belirlenmektedir (Bingol, 2007).
1.2.4.1. Ġdeal olarak polarizlenemeyen arayüzeyler
Su ve organik fazlarda 1:1 oranında A1+ ve B1 iyonlarında ayrışan A1B1 elektroliti bulunduğunda ideal olarak polarizlenemeyen bir arayüzey oluşmaktadır (Şema 1.1).
Eşitlik 1.10‘da görülen ve ITES sistemlerindeki Nernst eşitliği olarak tanımlanan eşitlikler şema 1.1‘deki hücre için yazıldığında:
1 1 1 0 ln o A w w o o A w A a RT F a (1.14) 1 1 1 0 ln o B w w o o B w B a RT F a (1.15)
eşitlikleri elde edilmiş olup her iki fazda da A1+ ve B1 iyonları bulunduğundan ötürü Galvani potansiyel farkına her iki iyonun da katkısı vardır. Buradan arayüzey için Galvani potansiyel farkı iyonların aynı konsantrasyonda olmasından dolayı aşağıdaki gibi yazılabilmektedir: 1 1 1 1 1 1 0 0 ln 2 2 w w o w o A o B A B w o w o A B RT F (1.16)
Buradaki wo
, elektrolit konsantrasyonlarıyla ilgisiz olup A1 ve B1 iyonlarının her iki faz arasındaki dağılımı ile belirlenir. Bu potansiyel fark dağılım potansiyeli olarak adlandırılmaktadır. Bu ITIES sistemlerine elektrokimyasal olarak polarizlenemeyen arayüzey denir. Polarizlenemeyen arayüzeylerdeki Galvani potansiyel farkı potansiyostatik olarak kontrol edilememektedir (Hatay, 2010).1.2.4.2. Potansiyostatik polarizasyon
Potansiyostatik polarizasyon için iki metot bulunmaktadır. Bunlardan birisi her iki fazda da bir ortak iyonun bulunduğu çözeltilerin kullanılmasıdır (Şema 1.2).
ġema 1.2. Ortak iyon bulunduran arayüzeyler
Şema 1.2‘de görüldüğü üzere her bir faz A3 iyonunu içermekte iken organik ve su fazlarında ise sırasıyla B1 hidrofobik anyonu ve B2 hidrofilik anyonunu
içermektedir. Arayüzeydeki Galvani potansiyel farkı ise A3 iyonunun aktivitesi ile Nernst eşitliğine göre belirlenir:
3 3 3 3 0 ln o A w w o o A w A A a RT z F a (1.17) 3
A iyonunun her iki fazda da eşit konsantrasyonlarda bulunduğu durumlarda ise aşağıdaki eşitlik yazılabilmektedir:
3 3 3 3 0 ln o A w w o o A w A A RT z F (1.18)
Potansiyostatik polarizasyonu sağlamanın farklı bir metodu ise ideal olarak polarizlenebilen bir arayüzey oluşturmaktır. Burada Galvani potansiyel farkı dışarıdan bir potansiyostat tarafından uygulanmaktadır.
1.2.4.3. Ġdeal olarak polarizlenebilen arayüzeyler ve potansiyel penceresi
Organik fazda lipofilik A1B1 tuzunun su fazında ise hidrofilik A2B2 tuzunun çözeltilerini içeren arayüzeyler ideal polarizlenebilen arayüzey olarak tanımlanır (Şema 1.3) (Koryta, 1979). Burada Galvani potansiyel farkı iyon konsantrasyonları ve aktivitelerine bağlı olarak değil, elektriksel çift tabakadaki elektrik yükü ile kontrol edilmektedir.
ġema 1.3. İdeal polarizlenebilen arayüzey
Polarizlenebilir sıvı/sıvı arayüzeylere iki faz arasına dışarıdan bir potansiyel uygulanmasıyla kimyasal dengeye ulaşmak için bir elektrik akımı oluşmaktadır. Fazlar boyunca uygulanan potansiyele karşı çok düşük akımlar oluşuyorsa bu arayüzey polarizlenebilir arayüzeyler olarak tanımlanmaktadır. Burada düşük akımın görüldüğü aralığa polarizasyon aralığı ya da potansiyel penceresi denilmektedir. Potansiyel penceresi boyunca herhangi bir iyon transferi olmamakla birlikte potansiyel penceresi dışındaki daha düşük veya yüksek potansiyellerde elektrolit iyonların transferi gözlenmektedir. İyon transferleri başladığında ideal olmayan polarizlenebilir arayüzey
duruma gelmektedir. Deneysel çalışmalarda potansiyel penceresi elektrolit iyonların transfer potansiyelleri tarafından sınırlandırılmaktadır. Potansiyel penceresi boyunca arayüzeyin davranışları şekil 1.13‘te şematik olarak gösterilmektedir.
ġekil 1.13. Potansiyel penceresi boyunca arayüzeyin davranışı
Potansiyel penceresi organik fazda daha lipofilik su fazında ise daha hidrofilik elektrolitlerin kullanılmasıyla genişletilebilmektedir. Su fazı için genellikle LiCl, ve Li2SO4 gibi alkali metal tuzları destek elektrolit olarak kullanılırken organik faz için oldukça çeşitli destek elektrolitler kulanılmaktadır. Organik fazda kullanılan destek elektrolitin molekül yapısı şekil 1.14‘te görülmektedir.
ġekil 1.14. Organik destek elektrolit BATB‘nin molekül yapısı
Bu destek elektrolitlerin kullanıldığı sıvı/sıvı arayüzey çalışmalarında kullanılabilecek elektrokimyasal hücreler şema 1.4‘te gösterilmiştir. Bu elektrokimyasal hücrelerin kullanılmasıyla yapılan ölçümlere ait potansiyel pencereleri şekil 1.15‘te görülmektedir (Hatay, 2010).
ġema 1.4. Şekil 1.15‘in elde edilmesinde kullanılan elektrokimyasal hücre
.
ġekil 1.15. Şema 1.4‘teki elektrokimyasal hücrenin kullanılmasıyla elde edilmiş potansiyel
penceresi. Su fazı destek elektroliti: Li2SO4 ; organik faz destek elektroliti BATB (bis(trifenilfosforanilidin) amonyumtetrakis(pentaflorofenil)borat)
1.2.5. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretim Reaksiyonu ve Katalizi
Son zamanlarda sıvı/sıvı arayüzeylerde oksijen üretim reaksiyonu, oksijen indirgenme reaksiyonu, hidrojen üretim reaksiyonu ve karbondioksit indirgenme reaksiyonu gibi enerji uygulamalarının katalizi üzerine yoğunlaşılmıştır. Bu uygulamalarda moleküler kataliz ve elektrokataliz uygulamalarından esinlenilerek sırasıyla moleküler katalizörler ve nanoparçacık tabanlı katı katalizörler kullanılmaktadır (Girault, 2014).
Sıvı/sıvı arayüzeyerdeki hidrojen üretimi ilk olarak Nagatani ve ark. (2004) tarafından gerçekleştirilmiş olup ışık altında çinko 5,10,15,20-tetrafenilporfirin tarafından protonun doğrudan indirgenmesiyle hidrojen üretimi gözlenmiştir. Çalışmada ışık altında gerçekleştirilen elektrokimyasal ölçümlerde akım artışı gözlenmiş olup organik faza elektron verici dekametilosmosenin eklenmesiyle akımdaki yükselme daha da artmıştır.
Kobaltosen ve dekametilferrosen (DMFc) gibi metalosen (Mc) bileşiklerinin elektron verici olarak kullanılmasıyla asitler indirgenerek hidrojen gazı oluşmaktadır. Burada hidrojen üretim reaksiyonu eşitlik 1.21‘de verilmektedir.
2Mco + 2H+s 2Mc+o + H2 (1.21) Bu reaksiyonda o organik fazı s ise su fazını ifade etmektedir.
Kobaltosen ve dekametilferrosen‘in elektron verici olarak kullanılmasıyla hidrojen üretim reaksiyonu metalosen-hidrid yapısı üzerinden ilerlemektedir. Oluşan metalosen-hidrid yapısının protonlanmasının ardından homolitik ayrılma (kimyasal bağ elektronlarının bağı oluşturan atomlara birer elektron düşecek şekilde bağın kopması) üzerinden hidrojen gazı açığa çıktığı düşünülmektedir (Girault, 2014). Şimdiye kadar ferrosen sıvı/sıvı arayüzeylerdeki hidrojen üretim reaksiyonunda kullanılmamış olsa da osmosen (Ge ve ark., 2012b), dekametilosmosen (Ge ve ark., 2013) ve rutenosen (Rivier ve ark., 2015) sıvı/sıvı arayüzeylerde ışık uyarılmasıyla hidrojen üretim reaksiyonunda kullanılmıştır (Şekil 1.16).
ġekil 1.16. Sıvı/sıvı arayüzeylerdeki hidrojen üretim reaksiyonunda kullanılan organik elektron
vericiler ve redoks potansiyelleri
Sıvı/sıvı arayüzeylerde DMFc tarafından hidrojen üretim reaksiyonu yardımlı proton transfer (YPT) mekanizması üzerinden ilerlemektedir. Bu reaksiyon iki basamaktan oluşmaktadır. İlk basamak; YPT basamağında proton DMFc tarafından su fazından DCE fazına DMFcH+
şeklinde transfer edilmektedir.
DMFcDCEH W DMFcH DCE