T.C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ
“FRAKSİYONE PRP’NİN KÖK HÜCRE ÇAĞIRICI
ETKİSİ VE YAĞ GREFTİ YAŞAYABİLİRLİĞİNİN
DEĞERLENDİRİLMESİ”
“Dr. Gökçe YILDIRAN”
TIPTA UZMANLIK TEZİ
PLASTİK, REKONSTRÜKTİF VE ESTETİK CERRAHİ ANABİLİM DALI
Danışman
Konya, 2017 T.C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ
“FRAKSİYONE PRP’NİN KÖK HÜCRE ÇAĞIRICI
ETKİSİ VE YAĞ GREFTİ YAŞAYABİLİRLİĞİNİN
DEĞERLENDİRİLMESİ”
“Dr. Gökçe YILDIRAN”
TIPTA UZMANLIK TEZİ
PLASTİK, REKONSTRÜKTİF VE ESTETİK CERRAHİ ANABİLİM DALI
Danışman
“Yrd. Doç. Dr. Osman AKDAĞ”
i ÖNSÖZ VE TEŞEKKÜR
Bu tez çalışmasında plateletten zengin plazmanın kök hücreyi çağırma etkisi çalışılmış ve bu sayede yeni bir teknikle yağ greftinin yaşayabilirliğinin artırılması amaçlanmıştır.
Çalışmalarım ve öğrenim sürem boyunca bana her türlü imkan ve desteği sunarak tecrübelerini aktaran, tüm çalışmalarımın araştırma aşamasına, yön tayinine ve tamamlanmasına destek olan saygıdeğer hocalarım Prof. Dr. Zekeriya Tosun, Doç. Dr. Mehtap Karameşe ve Yrd. Doç. Dr. Osman Akdağ’a, desteklerini ve sevgilerini hep hissettiğim canım ailem Ayfer – İmran Ünal ve Nuray – Ramazan Yıldıran ile değerli eşim Uzm. Dr. Hüseyin Yıldıran’a teşekkür ederim.
ii İÇİNDEKİLER Sayfa SİMGELER VE KISALTMALAR iv 1. GİRİŞ 1 1. 1. Giriş ve Amaç 1 1. 2. Genel Bilgiler 2 1. 2. 1. Yağ grefti 2 Tarihçe 2
Yağ greftinin genel özellikleri 4
Yağ grefti yaşayabilirliğinin prensipleri 4
Yağ greftinin klinik uygulamaları 7
Yağ greftlemesi uygulama yöntemleri ve sınırlılıkları 9
1. 2. 2. Plateletten zengin plazma (PRP) 10
1. 2. 3. Mezenkimal kök hücre 13
Adipoz kaynaklı kök hücre (ADSC) 14
Yağ kaynaklı kök hücrenin karakterizasyonu 14
Yağ yaşayabilirliğini artırmada mezenkimal kök hücre
eklenmesi 15
ADSC artıran faktörler ve PRP’nin potansiyeli 16
2. GEREÇ VE YÖNTEM 17
2. 1. Yağın elde edilmesi 17
2. 2. PRP’nin elde edilmesi 18
2. 3. Dişlerin oluşturulması 20 2. 4. Gruplar 23 2. 5. Değerlendirme 24 3. BULGULAR 25 3. 1. Flowsitometri bulguları 28 4. TARTIŞMA 36
iii
5. SONUÇ VE ÖNERİLER 42
6. KAYNAKLAR 43
7. ÖZET 48
8. SUMMARY 49
9. EK A: Etik Kurul Kararı 50
EK B: Aydınlatılmış onam formu 51
iv SİMGELER VE KISALTMALAR
ADSC: Adiposit kaynaklı kök hücre CaCl2: Kalsiyum klorür
DMEM: Dulbecco’s Modified Eagle’s Medium EGF: Epitelyal büyüme faktörü
FGF: Fibroblast büyüme faktörü HGF: Hepatosit büyüme faktörü IGF: İnsülin benzeri büyüme faktörü
ISCT: Uluslararası Hücresel Terapi Topluluğu L-PRFM: Lökosit plateletten zengin fibrin matriks L-PRP: Lökosit PRP
PBS: Fosfat tamponlu salin
PDGF: Platelet derive büyüme faktörü PRFM: Plateletten zengin fibrin matriks PRP: Plateletten zengin plazma
TGF: Transforme edici büyüme faktörü VEGF: Vasküler endotelyal büyüme faktörü
1 1. GİRİŞ
1. 1. GİRİŞ VE AMAÇ
Yağ greftlemesi ya da otolog yağ transferi, vücudun bir yerinden herhangi bir şekilde elde edilen yağ dokusunun direk ya da çeşitli işlemlerin ardından baka bir bölgeye nakledilmesidir. Yağ greftlemesi, rekonstrüktif ve estetik cerrahide uzun yıllardır kullanılagelen bir tekniktir. Öyle ki; yüzyıllar önce skar tedavisi ve kontur düzensizliklerinin düzeltilmesi amaçları ile kullanılmış olup, günümüzde de tekniklerin modifikasyonları ve teknoloji ile birleştirilmesi ile yine aynı nedenlerle kullanılmaktadır (1).
Yağ grefti uygulamasının ve yağ enjeksiyonunun en önemli dezavantajlarından biri, yağın rezorbe olmasıdır. Literatürde bunu engellemek üzere çeşitli yöntemler geliştirilmiştir. Bunlardan en çok kabul göreni, yağ greftine mezenkimal kök hücre eklenmesidir. Mezenkimal kök hücre eklenmesi ile yağ grefti kalıcılığının artırıldığı ispatlanmıştır.
Mezenkimal kök hücre eldesi görece zordur; çünkü DMEM (Dulbecco’s Modified Eagle’s Medium) gibi besiyerleri, Fetal Bovine Serum ve Fosfat tamponlu salin gibi ucuz olmayan çözeltiler gerekebilir. Bunun yanında kollajenaz, santrifugasyonlar ve inkübasyonlar gerektirir. Dolayısıyla mezenkimal kök hücre saflaştırılması için zaman, maliyet ve tecrübeye ihtiyaç vardır.
PRP (Plateletten zengin plazma) günümüze kadar pek çok klinik ve deneysel alanda kullanılmış, pek çok etkisi keşfedilmiştir. Güncel literatürde ise PRP’nin kök hücreyi ortama çekebildiği ve /veya ortamda zenginleştirebildiği üzerine çalışmalar vardır.
Zaman ve maliyet gerektiren mezenkimal kök hücrenin izole edilmektense, PRP vasıtasıyla kök hücrelerin ortama çağrılması ya da kök hücrelerin PRP enjekte edilen yerlerde birikmesi klinisyenler için cezbedicidir. Zira, etkileri ve kullanımı çok iyi bilinen PRP kullanılarak daha az maliyet, iş gücü ve zaman ile ortama kök hücre çekilmesi sonucunda yağ kalıcılığının artırılıp artırılamayacağı literatürde henüz
2
çalışılmamıştır. Bunun klinik ya da deneysel olarak gösterilmesi bilimsel literatür açısından anlam kazanacaktır. Çalışmalarda; PRP ile yağ enjeksiyonunun kombine edilmesinin artan kök hücre sayısı sayesinde yağ kalıcılığını artırabileceği kolaylıkla öngörülmektedir. Ne var ki; bunun hangi aralıkla yapılması gerektiği bilinmelidir. Diğer bir deyişle PRP’nin yağ olan bir ortamda ne zaman kök hücreyi en fazla oranda çektiği bilinir ise PRP uygulamasından o kadar süre sonra yağ greftlemesi yapılabilir ve kalıcılık istenen oranda artırılabilir. Kombine uygulamalar bilinmekte ve uygulanmakta olsa da, bu sürenin ne olduğu literatürde henüz gösterilmemiştir.
Bu çalışmanın amacı; yağ bulunan ortamda PRP uygulamasından ne kadar süre sonra ortamda maksimum miktarda kök hücre varlığı olduğunu bulmak, PRP’nin kök hücre çağırıcı etkisini sayısal verilerle ortaya koymak ve yağ yaşayabilirliği için skafold görevi görecek PRP’nin konsantrasyonunu optimize etmektir.
1. 2. GENEL BİLGİLER
1. 2. 1. YAĞ GREFTİ
Tarihçe
Yağın greft olarak ilk kez kullanılması, 1893 yılında Alman cerrah Gustav Neuber tarafından koldan orbitaya, osteomyelit sekeli skarların tedavisi amacıyla olmuştur (1). 20. yüzyılın ilk dekadında Alman cerrah Eugene Hollander doğal bir dolgu olarak yağı önermiş ve hacim kazandırma ameliyatlarında çığır açılmıştır (2).
Yağ grefti uygulamalarından sonra rezorpsiyon, önemli bir problem olarak ortaya çıkmıştır. Bu problemi minimize etmek için Hollander sağlıklı insanlarda elde ettiği yağ dokusunu koyundan elde ettiği daha sert yağ ile karıştırmış, sıvı hale gelene kadar bu karışımı ısıtmış ve vücut sıcaklığında şırınga ile kontur düzensizlikleri, depresyonlar, fasial atrofi ve postmastektomi skarlarına enjekte etmiştir. Tekniğini 1912 yılında yayınlamış ve hastalarda 2-3 gün ağrılı kaşıntılar gördüğünü ne var ki sonucun tatmin edici olduğunu raporlamıştır (2). Bununla birlikte bu fikir sınırlı uygulama alanı bulmuştur.
3
1919’da Alman cerrah Erich Lexer hemifasial mikrozomide, kontur deformitelerinde, mikrogenide, meme asimetrisinde yağ greftini kullanmış; posttravmatik el ve dupuytren hastalığı için yağ transferlerinin başarısını göstermiştir.
1930’larda, artan deneyim ile, iyi erken dönem sonuçlarına sahip olmakla birlikte yağ transferinin uzun dönemde rezorpsiyon oranları, kistler ve fibrozis nedeniyle yüz güldürücü olmadığı gözlenmiştir.
Yağ transplantasyonları 1955’te Lyndon Peer otojen yağ doku transferinden bir yıl sonra yağ hücrelerinin yaklaşık %50’sinin öldüğünü ve bunların fibröz doku ile yer değiştirdiğini göstermiştir (3).
1980’lerde liposakşının keşfi ile yağ greftlemesi popülarize edilmiş elde edilen lipoaspiratın enjektör yardımı ile depresyon ve kontur düzensizliklerine verilmesi lipofilling olarak isimlendirilmiştir (4).
Yağ enjeksiyonlarının ilk olumlu ve uzun ömürlü sonucu 1980’lerde Abel Chajchir tarafından yayınlanmıştır. Ve bu yayında Chajchir rezorpsiyon oranlarını düşürmek için; kırılgan hücreler olan adipositlerin rüptürünü asgariye indirmek için yağın dikkatli manipülasyonu, ölü hücrelerin ortamdan kaldırılması için lipoaspiratın salin ile yıkanması ve yağın iyi vaskülarize bir alıcı yatağa verilmesi gibi kritik adımlar tanımlamıştır (5).
Prosedürün sistematize edilmesi 1990’larda Sydney Coleman tarafından yapılmıştır. Yağın 3 mm künt kanül ile alınması, adiposit travmasını düşürmek için düşük negatif basınç yapılması (10 ml enjektör ile), santrifüj yapılması, enjeksiyonun 18 G kanül ile yapılması ve yağ dokusunun çoklu tüneller ile alıcı yatağa yerleştirilmesi işlemlerinin tamamı Coleman tarafından lipostructure olarak tanımlanmıştır (6, 7, 8).
100 yıllık tarihsel süreçteki tüm bu sistematizasyon ve keşifler yağ greftinin rezorpsiyon probleminin önüne geçmek ve yağın kalıcı hale getirilmesi için yapılmış çalışmalardır.
4 Yağ greftinin genel özellikleri
Otolog yağ greftlemesi, yumuşak dokuların onarımı ve büyütülmesine imkan veren hem estetik cerrahide hem de rekonstrüksif cerrahide, bazı sınırlandırıcı faktörler olmasına rağmen giderek artarak kullanılan bir tekniktir. Otolog yağ dokusu, yumuşak dokularda hacim kazanılması için ideal bir dolgu maddesidir; çünkü biyouyumlu olup immünojen ya da allerjen özellik içermez ve doğal görünümlüdür.
Şekil 1. 1: Yağ greftinin düşük basınçla manuel olarak elde edilmesi şekilde
gösterilmiştir.
Ayrıca yağ greftleri kolay bir şekilde elde edilir donör alan morbiditesi çok azdır (Şekil 1. 1).
Yağ grefti yaşayabilirliğinin prensipleri
Yağ grefti yaşayabilirliğini etkileyen birçok faktör vardır. Bunlar şu temel başlıklar altında sınıflandırılabilir: Yağın elde edilme şekli, elde edilen yağın miktarı, alıcı alana ve hastaya ait faktörler şeklinde sınıflandırılabilir.
Yağın elde edilme şekli: Yağ literatürde tanımlandığı üzere pek çok şekillerde elde edilebilir. Blok olarak kaldırılan bir yağ grefti olabileceği gibi liposakşın ile elde
5
edilebilecek bir lipoaspirat şeklinde de olabilir. Ne var ki; liposakşının pek çok yolu, lipoaspiratın da pek çok enjeksiyona ya da transfere hazır hale getirilme şekli mevcuttur. Bu tekniklerin standardize edilmesi hastaya ve alıcı alana bağlı faktörler nedeni ile çok güçtür.
Tekniğe bağlı bir faktör de liposakşın kanülüdür. Erdim ve ark. 6 mm’lik kanül ile alınan lipoaspirattaki adiposit canlılığının 2 ya da 4 mm’lik kanüllerle alınan aspirattakine göre daha fazla olduğunu saptamıştır (9).
Başka bir faktör; santrifüj, yıkama, filtrasyon gibi muamelenin farklılığıdır. Filtrasyon yöntemindeki farklılıklar ya da santrifüjün hızı, adipoz dokuya olan hasarı belirler (10). Bu da yağ grefti uygulamasının başarısını belirler.
Donör alana ait faktörler: Rohrich ve ark. manuel olarak enjektör yardımı ile çeşitli donör alanlardan yağ grefti almış ve hücre yaşayabilirliklerini değerlendirmişlerdir. Abdomen, flank, uyluk ya da diz bölgesinden elde edilen lipoaspiratlardaki hücre yaşayabilirlikleri arasında fark saptamamışlardır (11). Bununla birlikte, donör alan hazırlık biçimleri arasında bazı farklar olabilir. Örneğin, Agostini ve ark. tümesen solüsyonu yapıldıktan sonra liposakşın uygulanan hastalardaki hücre miktarının kuru tekniğe kıyasla anlamlı olarak daha yüksek olduğunu bulmuşlardır (12). Çeşitli anestetiklerin de kök hücre viabilitesini değiştirebildiği ortaya konmuştur (13).
Alıcı alana ait faktörler: En önemli faktör alıcı alanın vaskülarizasyonudur. Bazı yayınlarda kasa olan enjeksiyonların, kasın yoğun vaskülaritesi nedeni ile daha fazla yaşayabildiği gösterilmiştir. Başka bir çalışmada ise artmış mobilizasyon nedeni ile kas enjeksiyonlarında düşük yaşayabilirlik saptanmıştır (14, 15).Transfer yapılacak yerin üzerindeki cilde travma, yapısal defektin şiddeti de alıcı alana ait faktörlerdendir (16).
Hastaya ait faktörler: Hastaya ait faktörler ise; yaş, sigara içiciliği ve ek hastalıkların bulunmasıdır (16).
6
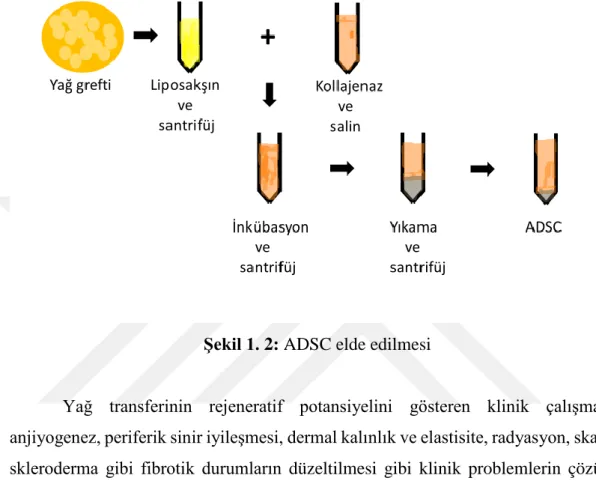
Adipoz dokunun %90’dan fazlası adiposittir, ama toplam hücre sayısının yaklaşık %50’si ADSC, fibroblast, endotel hücreleri ve ekstraselüler matriksteki perisitleri içermektedir. Otolog yağ transferinin rejeneratif potansiyelini gösteren çalışmalar bunun sebebi olarak yağdaki ADSC içeriğini göstermektedir (Şekil 1.2).
Şekil 1. 2: ADSC elde edilmesi
Yağ transferinin rejeneratif potansiyelini gösteren klinik çalışmalar; anjiyogenez, periferik sinir iyileşmesi, dermal kalınlık ve elastisite, radyasyon, skar ve skleroderma gibi fibrotik durumların düzeltilmesi gibi klinik problemlerin çözümü üzerine yapılan çalışmalardır. Peyronie hastalığı, üretral striktürler, stres inkontinansı, romatoid artrit ve osteoartritte kullanılan çalışmalar da bulunmakta ve rejeneratif potansiyelini göstermektedir (17).
Bir yağ greftinde difüzyon ilk olarak en dış tabakadan başladığından, dolayısıyla adipositlerin en dıştaki tabakası hızlı beslendiğinden hipoksiye daha toleranslıdır. Hemen altında yeni adipositleri revaskülarize ve rejenere eden ADSC’lerin rejeneratif zon yer alır. Daha derindeki nekrotik zonda yaşayan hücre yoktur. Rejeneratif zonun azami derinliği ideal koşullar altında 1,6 mm’dir (18). Yağ greftinin revaskülerizasyonu bu maksimum 1,6 mm’lik kalınlığa bağlıdır. Bu nedenle büyük greft hacimlerinin alıcı alana adeta mikrodamlacıklar şeklinde serpiştirilmesi gerektiği önerilmektedir.
7
Tüm bu tür uygulama ve çalışmaya rağmen yaşatmaya yönelik tüm prosedür ve prensiplere rağmen yaşayabilirlik hiçbir zaman tam değildir. Bu nedenle otolog yağ transferinin başarısı literatürde greft yaşayabilirliğinin yüzdesi ile ölçülerek tartışılır.
Konvansiyonel yağ greftlemesi ile ADSC eklenmiş yağ greftlemesini kıyaslayan geniş ve randomize kontrollü klinik çalışmalardan anlamlı farklar bulunamamıştır (19).
Öte yandan son zamanlarda alıcı alanın şartlarını iyileştirmek de mümkün olabilir. Eksternal hacim ekstansiyon cihazları doku vasküleritesini, alıcı yatağın kapasitesini ve mekanik kompliyansı artırır. Adipogenesisi indükler. Özellikle memede yaygın kullanım alanı bulmuş olan bu cihaz ile yapılan preekspansiyonlarda yağ hacmi maksimize edilmektedir (20).
Yağ greftinin klinik uygulamaları
Kontur düzeltilmesi: Uygun bölgelere ince bir tabaka halinde yerleştirilen yağ yüz konturunda etkileyici sonuçlar ortaya çıkarır. Romberg sendromu, fasiyal lipodistrofi ve posttravmatik kraniofasiyal defektlerde otolog yağ transferleri tercih edilen bir alternatif tedavi şeklidir (Şekil 1. 3).
Şekil 1. 3: a. Romberg sendromlu bir hastada sağ hemifasial atrofiye bağlı depresyon
gösterilmiştir. b. Yağ enjeksiyonu sonrası konturun düzeldiği gösterilmiştir.
8
Hacim sağlama: Konturdaki konkavite sadece bir doku eksikliği değildir; bu dokunun yüzeyini aşağı çeken bir fibröz ağ da mevcuttur. Bu nedenle yağın sadece konkav kısmın altına enjekte edilmesi defekti düzeltmez. Bu skarların serbestlenmesi de gerekmektedir. Bu deformitelerde yağın bir doku genişletici olmadığı akılda tutulmalıdır.
Liposakşın ile elde edilen yağ ile meme büyütme sonuçları tarihte kötü sonuçlar ortaya çıkarmış olsa da bugün otolog yağ transferi ile meme büyütme geniş kabul görmüş bir meme büyütme alternatifidir.
Meme rekonstrüksiyonu meme büyütmeden daha zorlayıcıdır. Çünkü alıcı alanın vaskülaritesi ve kompliyansı çok daha azdır. Eğer bu bölge radyasyon alanı ise vasküler yapılarda radyasyona bağlı hasar vardır ve vaskülaritesi azalmıştır. Bölgeye skarların eşlik etmesi sonucu da greft yaşayabilirliği için kötü bir çevre ortaya çıkmaktadır. Günümüzde ekspansiyon ile birlikte uygulanan otolog yağ transferleri meme rekonstrüksiyonunda bir in-vivo doku mühendisliği sayılır.
Gluteal bölgede bir hacim isteniyorsa, memeden çok daha fazla grefte ihtiyaç vardır. Bu nedenle gluteal büyütmede yağ nekrozu sıklıkla görülen problemlerdendir.
Hücre yenilenmesi: Radyasyon kanser hücreleri ile birlikte ADSC’leri de yok eder. Liposakşın aracılığı ile elde edilen yağ ise ADSC açısından zengindir. Bazı çalışmalarda yağ greftlemesinin radyasyon hasarını tersine çevirdiği dahi gözlemlenmiştir (21).
Yağ greftlemelerinin, Dupuytren kontraktüründe hücre rejenerasyonuna bağlı etkileri de çalışılmıştır. Çoklu perkütan aponevrotomiler fibröz kordu yağ alımına hazır hale getirir. Ayrıca abdominal yağın Dupuytren fibroblastlarına inhibitör etkisi olduğu gösterilmiştir (22, 23).
Cilt sklerozu, ağız açıklığında kısıtlılık, sicca sendromu, fasiyal ağrı ve eldeki sklerodermalar için subkutan mikroyağ enjeksiyonları tanımlanmıştır (24).
9
Skar iyileştirilmesi: Yağ grefti skarın yumuşatılması ve pliabilitesinin artırılması için kullanılır (Şekil 1. 4). Skar kontraktürlerinde perkütan aponevrotomi ve lipofilling flep cerrahisine bir alternatif olarak ortaya çıkmıştır (25).
Şekil 1. 4: a. Sol ön koldaki skarın yağ enjeksiyonu öncesi görünümü b. Yağ
enjeksiyonu ile skarın kalitesi artırılmış, skar daha az belirgin hale getirilmiştir.
Yağ greftlemesi uygulama yöntemleri ve sınırlılıkları
Yağ greftlemesi pek çok tıbbi sorun için potansiyel bir çözüm olarak görülse de riskleri ve kısıtlılıkları ortaya konmalıdır. Bunlardan biri yağ dokusunun radyolojik imajları bozmasıdır. Memeye yağ grefti uygulaması sonrasında mamografide yağ nekrozunun malign lezyonlardan ayrımının yapılamamasıdır (26, 27). Bir diğer ciddi risk yağ embolisi olup özellikle gluteal pleksus venleri içerisine yapılan enjeksiyonlardan kaynaklanır.
En büyük kısıtlılığı ise tarihsel süreçte de çeşitli protokollerle giderilmeye çalışılan rezorpsiyon problemidir. Üstelik de bu rezorpsiyonun ne kadar olacağı
a
10
tahmin edilemez ve öngörülemezdir. Literatürde rezorpsiyon oranları %25 ila %80 arasında değişen oranlarda gösterilmiştir (26, 27, 28, 29, 30).
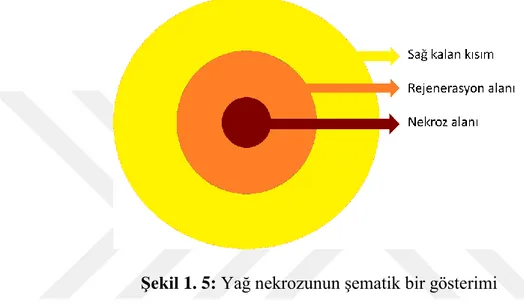
Yağ greftinin kalıclığının değerlendirmesi literatürde transplante edilen yağ greftinin yaşayabilirlik oranına ve histolojiye göre yapılmaktadır. Histolojik analizlerde akut nekroz, yağ kistleri, kalsifikasyonlar ve bağ doku formasyonu gösterilmiştir. Bu histolojik bulgular da yağ nekrozu ile uyumlu bulgulardır (Şekil 1. 5).
Şekil 1. 5: Yağ nekrozunun şematik bir gösterimi
Aktarılan dokunun kaybının nedeni çoğu çalışmada yetersiz vaskülarizasyona bağlanmaktadır. Büyük ve kalın yağ greftlerinin daha fazla rezorpsiyona uğraması bunun destekleyicisidir. Bu greftlerde ciddi miktarda adiposit, iskemiye uğradığından, yağ greftlemesinden sonraki ilk birkaç gün içinde nekroza uğrar (31). Temel greft mantığına uygun olarak; anjiogenez ve neovaskülarizasyon tamamlanana kadar yağ grefti difüzyon ile beslenir.
1. 2. 2. Plateletten zengin plazma (PRP)
PRP, plazmadan elde edilen ve insan plateletlerinin yaklaşık olarak 4 ila 7 kat fazla konsantrasyonunda olan otolog bir solüsyondur. Hastanın kendi kanının santrifüj edilmesiyle hazırlanır ve pek çok alanda yaygın kullanım bulmuştur (32, 33, 34) (Şekil 1. 6).
11 Şekil 1. 6: PPP (Plateletten fakir plazma), PRP (Plateletten zengin plazma) ve
Buffy coat’ın tüpteki yerleşimi gösterilmiştir.
PRP, trombositlere ait büyüme faktörlerinin konsantre olarak verilmesidir. Alfa granül ve yoğun granüller içerir ve bu granüller çeşitli büyüme faktörleri barındırır. Alfa granüller, 7 temel büyüme faktörü içerir: Plateletten derive edilmiş büyüme faktörü PDGF (PDGFaa, PDGFbb, PDGFab), Transforming büyüme faktörü beta (TGFβ1 ve β2), Epitelyal büyüme faktörü EGF ve Vasküler endotelyal büyüme faktörü VEGF. Bu büyüme faktörleri hücre çoğalmasını, farklılaşmasını, anjiogenezi ve kemotaksisi modüle eder (32, 33) (Çizelge 1. 1).
Çizelge 1. 1: Büyüme faktörleri ve görevleri
PDGF Fibroblastlar, düz kas hücreleri, MSC ve osteoblastların mitogenezi Monosit, makrofaj ve nötrofil kemotaksisi stimülasyonu
Makrofaj aktivasyonu
TGF Matriks sentezi
Keratinosit proliferasyonunun regülasyonu Kollajen üretiminin stimülasyonu
EGF Keratinosit kemotaksisinin stimülasyonu
Epitel, mezenşim ve fibroblast mitogenezinin stimülasyonu
Endotel kemotaksisinin, mitogenezin ve anjiogenezinin stimülasyonu Kollajenaz sekresyonunun regülasyonu
VEGF Damar geçirgenliğinin stimülasyonu
12
Yoğun granüller ise biyoaktif faktörler içerir; bunlar serotonin, histamin, dopamin, kalsiyum ve adenozindir. Bu biyoaktif faktörler membran geçirgenliğini artırır ve imflamasyonu modüle eder (32, 33).
Teorik olarak çeşitli PRP alt tipleri vardır:
Saf PRP: Saf PRP bunların içinde en sık kullanılanı olup az lökosit ama çok platelet içeren buffy coat içerir. İçerisinde yalnızca trombosit bulunur.
L-PRP (lökosit ve PRP): Lökositten zengin PRP’dir. Genellikle fibrozisi azaltmak için, klinikte akne skarı gibi alanlarda uygulanan PRP tipidir.
LE-PRP (lökosit ve eritrosit PRP): Hem eritrosit hem de lökositten zengin bir PRP’dir. Klinikteki kullanım alanı kronik yaralardır.
PRFM (plateletten zengin fibrin matriks): Klasik PRP’nin uygulamadan hemen önce trombin ile karıştırılarak klinikte özellikle eklem içi uygulamalarda, kronik yaralarda kullanılmaktadır. Bu sayede PRP’nin uygulandığı bölgede kalıcılığının artırılması hedeflenir (34).
L-PRFM (lökosit ve plateletten zengin fibrin matriks): L-PRFM ise aktivatör ya da antikoagülan içermeyen sadece kandan elde edilen ve hem lökositin hem de plateletin bulunduğu PRP biçimidir.
Platelet aktivasyonu yapmak için trombin ya da kalsiyum klorit gibi aktivatörler kullanılır. CaCl2 eklenmesi ve santrifüj yapılması, PRFM adı verilen
gevşek bir fibrin matriks oluşturur. Bu da büyüme faktörlerini yakalar ve 7 gün boyunca salınımlarını sağlar. PRFM, yağ greftlemesi ya da yumuşak doku büyütmelerinde daha uzun süreli salım sağladığı için daha çok tercih edilir (32, 33).
Son dönemde PRP, pek çok büyüme faktörü kaynağı olması sebebi ile doku mühendisliğinde kullanılmış ve transplante edilen kök hücrelerin özelliklerini geliştirme ve çoğaltmada yeni bir matriks olarak uygulanmıştır (35).
13
PRP insanlarda, yara iyileşmesinde 1970’lerden bu yana kullanılmaktadır; çünkü PRP’nin yüksek büyüme faktörleri ve sekretuar proteinleri içerdiği bilinmektedir. PRP’deki büyüme faktörleri, doku rejenerasyonundaki hücre toplanmasını, proliferasyonunu ve farklılaşmasını destekler (35).
1. 2. 3. Mezenkimal Kök Hücre
Mezenkimal kök hücre, kendi kendini yenileme özelliği olan ve in vitro olarak multipotent farklılaşma gösteren bağımsız kök hücre gruplarını temsil eder.
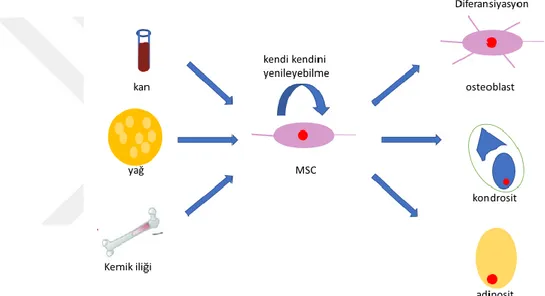
Şekil 1. 7: MSC (Mezenkimal kök hücre) eldesi kan, yağ ve kemik iliğinden
yapılabilir. MSC’nin hem kendi kendini yenileyebilme hem de osteoblast, kondrosit ve adipositlere diferansiyasyon özellikleri vardır.
Mezenkimal kök hücreler hücre rejenerasyonunun gerektiği pek çok klinik uygulamada kullanılmaktadır. Otolog mezenkimal kök hücreler rejeneratif tıp için çekicidir. Bunlar kemik iliği, periferik kan, menstruel kan ve yaklaşık tüm erişkin dokularda (yağ, sinovyum, dermis, periost, diş) ve solid organlarda (karaciğer, dalak, akciğer) bulunan immatür hücrelerdir (35) (Şekil 1. 7).
14 Adipoz kaynaklı kök hücre (ADSC)
2000’li yılların başı Bill Futrell koordinatörlüğündeki Pittsburgh ekibi tarafından adipoz kaynaklı kök hücrelerin (ADSC) keşfine sahne oldu (36).
Yağ Kaynaklı Kök Hücrenin Karakterizasyonu
Adipoz doku; lobüller şeklinde organize olmuş yağ hücreleri ile birlikte preadiposit, fibroblast, vasküler düz kas hücresi, endotel hücresi, monosit makrofajlar, lenfositler ve ADSC’leri içerir (37, 38).
Adipoz dokudan elde edilecek kök hücre miktarı, diğer kök hücre kaynaklarından daha fazladır ve rejeneratif tıpta kullanımı bu nedenle uygundur. Ayrıca plastik cerrahlar tarafından sık ve rutin bir kullanımı olması nedeni ile de kolay elde edilebilir bir kök hücre kaynağıdır. Rutinde, 300 ml %95 saflıktaki bir lipoaspirattan, 107 adipoz kaynaklı kök hücre izole edilebilir (39).
2006 yılında “International Society for Cellular Therapy”, mezenkimal kök hücre için minimal fenotipik kriterleri tanımlamıştır. Ana kriterler şunlardır:
1. Plastiğe adezyon göstermesi
2. Mezenkimal kök hücre popülasyonunun %95’ten fazlasının CD73, CD90 ve CD105 eksprese etmesi ve CD34, CD45, CD11b ya da CD14, CD79 ya da CD19 ve HLA sınıf II eksprese etmemesi
3. 3 nesil farklılaşma potansiyeli
Bunlar içinden sık kullanılan bazı MSC belirteçleri detaylı olarak şunlardır:
1. CD73: Bir ekto-5’-nükleotidaz olup ekstraselüler adenozin monofosfatı adenozine çevirir. Lenfosit, endotelyal hücre, düz kas hücresi, epitel hücresi ve fibroblastlardan eksprese edilir. In vivo çalışmalarda MSC belirteci olarak kullanılıp kullanılamayacağı net değildir (40, 41, 42).
2. CD90: Hücre-hücre ve hücre-matriks etkileşimlerinde görevli glikozilfosfatidilinozitol bağlı proteindir. Vasküler ve lenfatik endotel hücreler,
15
hematopoetik sistem hücreleri, lenfosit, fibroblast ve nöronlarda tespit edilebilir. İn vivo çalışmalarda kullanılabilir (42, 43, 44). Mezenkimal kök hücrenin tespit edilmesinde en önemli belirteçlerdendir.
3. CD105: Vasküler endotelyal hücrelerde eksprese olur. Sinsityotrofoblastlarda, monosit, fibroblast, kondrosit ve hematopoetik progenitör hücrelerde de daha az olmakla beraber eksprese olur. Ne var ki; adipoz doku ilk izole edildiğinde CD105 düşük oranlarda eksprese edilir. Adipoz kaynaklı MSC belirteci için in vivo olarak kullanımı uygun değildir (42, 45).
Yağ yaşayabilirliğini artırmada mezenkimal kök hücre eklenmesi
Yağ greftinin nakledildikten sonra yaşayabilirliğinin nasıl artırılacağı, rezorpsiyonunun ve komplikasyonlarının nasıl azaltılacağı pek çok çalışmada açıklanmaya çalışılmıştır. Genellikle ilk olarak sağ kalan hücreler teorisi kabul edilir ki; bu, transplante edildikten sonra yaşayabilen hücrelerin hep yaşayabileceği anlamına gelir.
Güncel literatürde, yağ grefti tekniklerini, enjeksiyon yöntemlerini değiştirmek ya da yenilerini önermek artık tartışılmamaktadır. Artık çoğu çalışma; yağ greftinin hücresel komponentleri ve ilişkili sitokinler üzerinedir (46, 47, 48).
Bu çalışmalar sayesinde, stromal vasküler fraksiyonun ve ADSC’lerin yağ grefti yaşayabilirliğini artırdıkları artık tartışmasız hale gelmiştir. Çünkü ADSC’lerin multipotasnsiyel diferansiyasyon etkileri ve parakrin etki etme yetenekleri olduğu gösterilmiştir (49, 50, 51, 52).
ADSC’ler, mezenkimal kök hücre ailesinden fibroblast benzeri erişkin kök hücrelerdir. İlk olarak 1960’larda Friedenstein tarafından tanımlanmıştır. Uluslararası Hücresel Terapi Topluluğu (ISCT) mezenkimal kök hücreyi tanımlayabilmek için kullanılması gereken asgari şartları şu şekilde tanımlamıştır: CD73, CD90, CD105 yüzey marker ekspresyonu ve plastik kültür yüzeyine adherans ile birlikte CD34, CD 45, C14 ya da CD11b, CD19 ya da CD79alfa ve HLA-DR yokluğu.
16
Mezenkimal kök hücreler pek çok vaskülarize dokudan izole edilebilir. Özellikle küçük damarların komşuluğundaki perivasküler alanda yoğun bulunabilir ki lokal inflamasyon homeostazis ve dokunun yenilenmesinde rolü olduğu düşünülmektedir (53).
Mezenkimal kök hücreler immünsüpresif, antiimflamatuar ve kısmen trofik etkilere sahiptir ve bu etkilerini parakrin olarak gerçekleştirir.
Ne var ki; adipoz kaynaklı kök hücrelerin kullanılarak hasarlı dokuların rejenere edilmesinin altında yatan mekanizma halen anlaşılabilmiş değildir. Son yayınlarda ADSC farklılaşmasının ana mekanizma olmayabileceği gösterilmiştir.
ADSC artıran faktörler ve PRP’nin potansiyeli
Son çalışmalar VEGF, FGF-2, FGF-4, FGF-6, FGF-7, FGF-9, FGF-17, TGFβ1, TGFβ2, HGF, Keratinosit büyüme faktörü, PDGF-AA ve IGF-1 gibi büyüme faktörlerinin adipoz kaynaklı kök hücreyi artırdığını ve kalıcılığını regüle ettiğini gösterniştir (35, 54).
Plateletler, doku onarım yolaklarında pek çok kritik büyüme faktörü ve mediatör içerir. Plateletlerin kalsiyum klorit ile aktivasyonu, in vitro olarak hızlıca platelet büyüme faktörlerinin salınımını indükler. PRP ise periferik kandan hazırlanır ve yüksek konsantrasyonda depo otolog büyüme faktörleri barındırır. PRP’nin kalsiyum klorit ile maruziyeti, platelet degradasyonunu indükler.
İnsan PRP’si immünmodülatör ve proanjiojeniktir (55). Bunun yanında PRP’nin fibrin ağı, bir skafold görevi de yapmaktadır. Bu ağ yapısı hücreleri tutabilir ve plateletler PRP’nin içinde 3 boyutlu bir dağılım gösterebilir. Bu hücre-PRP ilişkisinin kök hücre oranını artırdığı ve uzamış yaşayabilirlik süreleri ve yaşayabilirlik oranları ile ilişkili olduğu düşünülmektedir (35).
Dolayısıyla araştırmacılar için otolog hücre tedavilerinde ADSC ve PRP’nin birlikte transplante edilmesi cazip bir yaklaşımdır.
17 2. GEREÇ VE YÖNTEM
2. 1. Yağın elde edilmesi:
Çalışmanın yapılabilmesi için 2017/94 sayılı yerel etik kurul onayı alındı (Bkz. EK A).
Çalışmada kullanılacak yağ; Selçuk Üniversitesi Tıp Fakültesi Hastanesi Plastik, Rekonstrüktif ve Estetik Cerrahi polikliniğine üst ekstremitesinde eski travmaya bağlı skara yağ enjeksiyonu yapılmasını talep eden bir hastadan elde edildi. 45 yaşında sağlıklı kadın hasta, bilgilendirilmiş onam formunu yazılı olarak imzalayarak ve sözlü olarak da çalışmaya katılmayı kabul etti (Bkz. EK B).
1000cc izotonik içerisine 1 flakon 400 mg prilokain ve 1 ampul epinefrin konularak tümesen solüsyonu hazırlandı. Genel anestezi altında; hastanın umblikus inferiorundan yapılan mini insizyon ile 500cc tümesen, tüm abdomenin 4 kadrana bölündüğü varsayılarak ve her kadrana 125’er cc olacak şekilde verildi. 30 dakika bekleme süresini takiben yağ, tek plastik cerrah tarafından orta boyuttaki yağ alma kanülü ve 50cc’lik düşük basınçlı enjektör yardımıyla manuel olarak alındı (Şekil 2. 1).
Şekil 2. 1: Manuel, düşük basınçla, abdominal bölgeden liposakşın kanülü ile yağ
18
Liposakşın cihazları ya da yağ elde etmek için kullanılan sistemlerden faydalanılmadı. Toplamda 150cc yağ elde edildi. Elde edilen yağlar, embriyoloji laboratuvarına teslim edildi.
Şekil 2. 2: Alınan yağların laboratuvar şartlarındaki görüntüsü
Burada yağlar, önce 2 kez 100’er cc serum fizyolojik ile sonra da 50cc fosfat tamponlu salin (PBS) ile irrige edildi. Yağ, dişlere transfer için hazır hale getirildi (Şekil 2. 2).
2. 2. PRP’nin elde edilmesi:
PRP yapımı için gereken kan; bilgilendirilmiş onam formunu yazılı olarak imzalayan ve sözlü olarak da çalışmaya katılmayı kabul eden, yağın da elde edildiği, sağlıklı, 45 yaşında kadın hastadan elde edildi.
Bunun için hastaya 1 gece önce bol su içmesi önerildi. Ertesi sabah,10cc sitratlı tüpe, periferik damardan 40cc venöz kan alındı. Elde edilen solüsyon önce 17 santrigrat derecede ve 1100 rpm’de 20 dakika santrifüj edildi (Şekil 2. 3).
19 Şekil 2. 3: Hazırlanan PRP’lerin ilk görüntüsü
Santrifüj sonrası kırmızı kan hücreleri elimine edilerek üst kısım (platelet ve plazma) alındı. Bu, 16 santrigrat derecede ve 3800 rpm’de 10 dakika daha santrifüj edildi. Santrifüj sonrası elde edilen son PRP’nin üzerine bir grupta PRP miktarınca serum, bir grupta ise PRP’nin 3 katı kadar serum eklendi. Böylece dilüsyon faktörü 2 ve 4 olan 2 ayrı PRP oluşturuldu (Şekil 2. 4 ve Şekil 2. 5). %7.5’lik PRP’ler elde etmek amacıyla 7.5cc PRP içerisine 1 cc antibiyotik (Penisilin/Streptomisin ve L-glutamin, Capricorn Scientific GmBH, Almanya) ve 91.5 cc DMEM (Dulbecco’s Modified Eagle’s Medium, Life Technologies, Ghent, Belçika) eklendi.
Şekil 2. 4: a. 4 dilüsyon faktörlü (4 katı ile seyreltik PRP) PRP’nin şematik
görünümü b. 2 dilüsyon faktörlü (2 katı ile seyreltik PRP) PRP’nin şematik görünümü
20 Şekil 2. 5: PRP’nin hazırlanması
2. 3. Dişlerin oluşturulması:
Bu aşamadaki tüm işlemler laminer akım altında yapıldı. Standart boyuttaki dişlerin hassas terazi ile daraları alındı (Şekil 2. 6).
21 Şekil 2. 6: Hassas terazi ile daraların alınması
Hazırlanmış olan yağlar dişlerin muhtelif bölgelerine, hassas terazi ile ölçülerek, 40’ar miligram sabit miktarlarda her bir dişin ortasına ve her biri ayrı steril pipetlerle olacak şekilde yerleştirildi (Şekil 2. 7).
22 Şekil 2. 7: Yağların dişe 40’ar mg olarak ilk yerleştirilmesi
Dişlere yayılan yağlar laminer akım altında 30 dakika kurumaya bırakıldı (Şekil 2. 8).
23 2. 4. Gruplar:
Kurutulan toplamda 24 diş, 3 gruba ayrıldı. Birinci gruptaki yağ içeren 8 dişe DMEM solüsyonu ve %1’lik antibiyotik (Streptozosin, Penisilin, Ergotamin) eklendi ve bu grup kontrol grubu olarak belirlendi. Kontrol grubuna PRP, serum ya da albümin eklenmedi.
İkinci gruptaki 8 dişe; hazırlanan 4 kat dilüe %7.5’lik PRP’den, DMEM ve antibiyotikli solüsyondan eklendi. Grup, DF4 (dilüsyon faktörü: 4) olarak adlandırıldı.
Üçüncü gruptaki dişlere; hazırlanan 2 kat dilüe %7.5’lik PRP’den, DMEM ve antibiyotikli solüsyondan eklendi. Grup, DF2 (dilüsyon faktörü: 2) olarak adlandırıldı.
Her gün hücre çıkışı olup olmadığı mikroskop altında kontrol edildi. İlk çıkışın başladığı günler kaydedildi. 1, 2, 3, 4, 5, 7, 8, 9 ve 12. günlerde her üç grupta da her bir yağ damlası etrafında çıkan kök hücre, mikroskop altında sayılarak
kaydedildi.
Kontrol grubunda, DF2 grubunda ve DF4 grubunda 12. günde, plastik dişlere adezyon gösteren kök hücreler kaldırılarak inkübasyona ve CD 45, CD 73, CD 90, CD 105 ile işaretlenerek flowsitometrik incelemeye tabi tutuldu. Flowsitometriden önce ve sonra sıvı miktarı ölçülerek kaydedildi. Flowsitometride 10000 adet mezenkimal kök hücre sayıldı.
24 Şekil 2. 8: Ekim sonrası 5. günde 4 kat dilüe PRP içeren dişten (DF4) bir mikroskop
görüntüsü; yağdan dışarı çıkan ilk hücreler
2. 5. Değerlendirme:
Her üç grupta da 1, 2, 3, 4, 5, 7, 8, 9, 12. günlerde yağdan dışarı çıkarak her bir yağ damlası etrafındaki kök hücre kitlesini oluşturan kök hücreler sayıldı, Kontrol grubu, DF4 ve DF2 gruplarının kök hücre sayısı sayıldı.
25 3. BULGULAR
DF4 grubunda ilk hücre çıkışı 4. günde, DF2 grubunda 5. günde başladı, kontrol grubunda 12. güne dek hiçbir günde dışarı hücre çıkışı gözlenmedi (Çizelge 3.1 ve Şekil 3.1).
Çizelge 3. 1: Hücre çıkışlarının günlere göre her bir gruptaki sayıları GÜN Kontrol grubu DF4 grubu DF2 grubu
1. Gün 0 0 0 2. Gün 0 0 0 3. Gün 0 0 0 4. Gün 0 1 0 5. Gün 0 10 1 7. Gün 0 1560 3240 8. Gün 0 2280 4920 9. Gün 0 4080 10640 10. Gün 0 12351 33480 11. Gün 0 40312 113657 12. Gün 0 80000 400000
Hücre çıkışları DF2 grubunda 7. günde belirgin miktarda artmaya başlayıp 3240’a ulaşmıştır. DF4 grubunda da 7. günde 1560 kök hücre elde edilmiştir.
26 Şekil 3.1: Günlere göre gruplardaki hücre çıkışları. DF2 grubunda her günde en fazla
çıkış olduğu, 10. günden sonra orantısal olmayan agresif bir artış olduğu ve bunun 12. günde pik yaptığı gözleniyor.
Bu sayıların belirlenmesinde 12. güne kadar mikroskop altında sayım yapılmıştır. DF4 ve DF2 grupları için mikroskopik görüntüleri Şekil 3.2 ve Şekil 3.3’te gösterilmiştir. 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 10 1560 2280 4080 12351 40312 0 0 0 0 1 3240 4920 10640 33480 1. GÜN 2. GÜN 3. GÜN 4. GÜN 5. GÜN 7. GÜN 8. GÜN 9. GÜN 10. GÜN 11. GÜN 12. GÜN
kontrol grubunda çıkan hücre sayısı DF4 grubunda çıkan hücre sayısı DF2 grubunda çıkan hücre sayısı
27 Şekil 3.2: DF4 grubundaki hücre çıkışlarının günlere göre mikroskop altında
gözlenmesi a. 7. gün b. 8. gün c. 9. gün d. 12. gündeki çıkışlar
Şekil 3.3: DF2 grubundaki hücre çıkışlarının günlere göre mikroskop altında
28 3. 1. Flowsitometri bulguları:
Flowsitometrik incelemelerde 4 örnek çalışıldı. Bunlar; DF2 grubu, DF4 grubu ve bu ikisinin kontrol grupları idi (Şekil 3.2, Şekil 3.3, Şekil 3.4 ve Şekil 3.5).
29 Şekil 3.2: DF2 grubunun kontrol verileri
Flowsitometri yapılırken numunelerin kontrol gruplarının okunması önceliklidir. Çalışmamızda kullanılan CD 45, CD 90, CD 73 ve CD 105 boyaları farklı kanallardan okutulmaktadır. PE-A kanalından okutulan belirteç için %96.8 doğruluk (Q1-Q3), Cy5-5-A kanalından okutulan belirteç için %96.1 doğruluk (Q1-1 ve Q3-1), FITC-A kanalından okutulan belirteç için %96.1doğruluk (Q1-2 ve Q3-2), APC-A kanalından okutulan belirteç için % 99.7 doğruluk (Q1-5 ve Q3-5)
31 Şekil 3.3: DF2 grubunun flowsitometri bulguları
DF2 grubunun flowsitometrik verilerine göre CD 45 (-) olan hücreler tüm hücrelerin %38.7’sini oluşturmaktaydı. Buna göre CD 45 (+) olan hücre oranı tüm hücrelerin %61.3’ünü oluşturmaktaydı. Tüm hücrelerin %77.3’ü CD 105 (+) olan hücrelerdi. Tüm hücrelerin %55.6’sı CD 73 (+) olan hücrelerdi. Tüm hücrelerin %64.6’sı CD 90 (+) hücreler olarak saptandı. CD 45 (-) olup CD 105 (+) olma şartını birlikte sağlayan hücre oranı tüm hücrelerin %15.5’ini; CD 45(-) ve CD 90 (+) olan hücre oranı %14.3’ünü, CD 45 (-) ve CD 73 (+) olan hücre oranı ise tüm hücrelerin %14.6’sını oluşturmuştur.
33 Şekil 3.4: DF4 grubunun kontrolü
PE-A kanalından okutulan belirteç için %99.6 doğruluk (Q1-Q3), Cy5-5-A kanalından okutulan belirteç için %99.6 doğruluk (Q1-1 ve Q3-1), FITC-A
kanalından okutulan belirteç için %99.6 doğruluk (Q1-2 ve Q3-2), APC-A kanalından okutulan belirteç için % 99.6 doğruluk (Q1-5 ve Q3-5) saptanmıştır.
35 Şekil 3.5: DF4 grubunun flowsitometri verileri
DF4 grubunun flowsitometrik verilerine göre CD 45 (-) olan hücreler tüm hücrelerin %61’ini oluşturmaktaydı. Tüm hücrelerin %47’si CD 105 (+) olan hücrelerdi. Tüm hücrelerin %35.6’sı CD 73 (+) olan hücrelerdi. Tüm hücrelerin %39.6’sı CD 90 (+) hücreler olarak saptandı. CD 45 (-) olup CD 105 (+) olma şartını birlikte sağlayan hücre oranı tüm hücrelerin %8.6’sını; CD 45(-) ve CD 90 (+) olan hücre oranı %4.1’ini, CD 45 (-) ve CD 73 (+) olan hücre oranı ise tüm hücrelerin %4.7’sini oluşturmuştur.
36 4. TARTIŞMA
Kök hücre ve PRP yoğun kullanılan uygulamalardır ancak kök hücrenin bir yerde yoğunlaştırılması için çok çalışma bulunmamaktadır.
Liposuction kaynaklı yağ greftlerinin kolay elde edilmeleri ve otojen transfere izin vermesi plastik cerrahinin şüphesiz en pratik yaklaşımlarındandır. Rekonstrüktif ve estetik cerrahide popüler bir konu olarak yer bulmuştur (56, 57).
Yağ grefti uygulamaları 1890’larda başlamış, ne var ki öngörülebilirliği ve tutarlılığı konusunda tartışmalar ortaya çıkmıştır. Bazı yayınlar rezorpsiyon oranının %70’lere vardığını raporlamıştır (58). 1980’lerde liposakşının keşfi ile yağ greftlemesi popülarize edilmiş elde edilen lipoaspiratın enjektör yardımı ile depresyon ve kontur düzensizliklerine verilmesi lipofilling olarak isimlendirilmiştir (59). Ne var ki bu yöntemle de materyalin neredeyse tamamının rezorbe olduğu raporlanmıştır.
ADSC eklenmesi, mükerrer enjeksiyonlar yapılması, mikroenjeksiyonlar rezorpsiyonun önüne geçmek için kullanılmış olsa da rezorpsiyon halen tamamen engellenebilmiş değildir.
Yağ greftlemelerinin tarihsel süreci de göstermiştir ki, yağ grefti uygulamalarındaki en önemli sorun yağdaki rezorpsiyondur. Rezorpsiyonun nedeni yapısal destekte eksiklik, olumsuz alıcı çevre, anjiogenezin olmaması ve beslenmede erken defisitler olarak sayılabilir (60). Bunlar göz önüne alındığında, yağ rezorpsiyonunun önlenmesi ve anjiogenezin rolü önem arz etmektedir.
Rezorpsiyonu önlemek için çeşitli yöntemler geliştirilmiştir. Bunlardan biri, çeşitli materyallerin skafold olarak yağ greftinde denenmesi olmuştur. Literatürdeki bazı skafoldlar; Tip 1 kollajen, poliglikolik asit, hyaluronik asit ve PRP’dir (61, 62).
Literatürdeki çoğu çalışma PRP’nin uygun bir skafold olduğunda hemfikirdir. Oh ve ark. farede yağ enjeksiyonu ve PRP kombinasyonunu kontrol grubu ile kıyaslamış, kıyaslamayı 10 hafta sonra fareleri öldürerek histolojik olarak
37
ölçümlemişler ve PRP tedavisinin yağ greftlemesinde hacimsel olarak yaşayabilirliği artırdığını göstermişlerdir (63).
Pietro ve ark.’nın klinik çalışmasına göre meme rekonstrüksiyonu yapılan hastalardan sadece yağ greftlemesi yapılan kontrol grubunda yağ grefti yaşayabilirliği %39 iken, SVF eklenen grupta yaşayabilirlik %63 ve PRP eklenen grupta ise %69 olarak bulunmuştur (64).
Li ve ark. yaptıkları çalışmada PRP ve ADSC’nin yağ grefti yaşayabilirliğini değerlendirmiştir (57). Bu çalışmada çeşitli konsantrasyonlarda PRP’li ve PRP’siz olarak ADSC’ler yağ grefti uygulanan farelere enjekte edilmiş, 105/ml
konsantrasyonda ve PRP içeren bileşimlerin yağ grefti yaşayabilirliğine en etkili olduğu gözlenmiştir. Bu çalışmada ise 2 çeşit konsantrasyondaki PRP’nin ADSC’ler üzerine etkisi de çalışılmıştır.
PRP, içerdiği büyüme faktörleri ve sitokinleri sayesinde doku rejenerasyonu ile ilgili pek çok alanda kullanılmaktadır. Kişinin kendi kanından santrifüj yoluyla hazırlanır ve yara iyileşmesinden antiimflamatuar etkilere kadar pek çok alanda kullanılır. PRP; alfa ve yoğun granülleri içerisinde pek çok büyüme faktörü içerir. Alfa granüller 7 büyüme faktörü içerir: PDGF (PDGFaa, PDGFbb, PDGFab), TGFβ (TGFβ1, TGFβ2), EGF, VEGF. Bu büyüme faktörleri hücre proliferasyonunu, diferansiyasyonunu, anjiogenezi ve kemotaksisi modüle eder. Yoğun granüller; serotonin, histamin, dopamin, kalsiyum ve adenozin gibi biyoaktif faktörler içerir. Bu biyoaktif faktörler membran geçirgenliğini ve imflamasyonu artırır.
PRP’nin teorik olarak 4 alt tipi vardır: Saf PRP, L-PRP, PRFM ve L-PRFM. Çoğu çalışma saf PRP ve L-PRP üzerinedir. Trombin ve kalsiyum klorit gibi platelet aktivatörleri, PRP’yi aktive etmek için kullanılır. Kalsiyum klorit eklenmesi ve santifügasyon, PRFM adı verilen gevşek fibrin matriks oluşumu ile sonuçlanır. PRFM, büyüme faktörlerini yakalar ve 7 günün üzerinde salar (65, 66, 67).
PRP sitokinlerden zengin, uygun plastisitede ve ağ yapısında olduğu için iyi bir skafold olarak kabul edilmektedir (57). PRP yalnızca iyi bir skafold olarak etki
38
gösterdiği için mi yağ grefti kalıcılığını artırmaktadır? Bu noktada PRP’nin ortamdaki kök hücreyi artırma kapasitesi araştırılmıştır.
PRP içindeki büyüme faktörlerinin doku rejenerasyonunda görevli hücreleri çağırdığı, bir araya topladığı ve farklılaşmalarını sağladığı gösterilmiştir (35).
Houdek ve ark.’nın yaptığı çalışmada, PRP’nin dermisten çıkardığı hücre sayısına bakılmış, 4 haftalık süre sonrasında ortalama 3.9x106 hücre sayılmış, kontrol
grubundaki 2.3x106 hücre ile arasında anlamlı fark saptanmıştır. 8 haftalık süre sonunda ise PRP içeren skafoldlardaki 5.9x106 hücre çıkışı ile kontrol grubundaki 3.2x106 hücre arasında da anlamlı fark saptanmıştır (65). Böylelikle PRP’nin
dermisten hücre çağırma etkisi saptanmıştır. Ne var ki literatürde PRP’nin yağ hücresinden ne kadar hücre çağırdığı çalışılmamıştır.
Bilim yıllardır yağ greftlerinin yaşayabilirlik oranını artırmayı araştırmıştır. Bu; yağ alım tekniklerini ve yağ transfer tekniklerini değiştirerek ya da ADSC içeren stromal vasküler fraksiyon eklenmesiyle kısmen sağlanmıştır. Ne var ki klinikte istenen sonuca henüz varılamamıştır (68). Çalışmamızdaki amaç da yağ yaşayabilirliğinin artırılması için ortama PRP eklenmesidir.
Yağ kaynaklı kök hücrelerin yağ yaşayabilirliğine olumlu etkisi kanıtlanmıştır. ADSC’lerin otolog doku transplantasyonunu olumlu etkileme mekanizmasının; adiposit farklılaşması ve ADSC’ler tarafından anjiojenik büyüme faktörleri sekresyonu olduğu ortaya konulmuştur (69). Dolayısıyla literatürde yağ transferi planlanan ancak yağ dokusu az zayıf hastalara ADSC eklenmiş lipotransferlerin etkin olduğu ortaya çıkmıştır (70). Bizim çalışmamızda ise ADSC eklenmeden, sadece PRP aracılığı ile ADSC’lerin ortama çekilip çekilemediği araştırılmıştır.
ADSC’ler otolog yağ greftin yaşayabilirliğinde kritik rol oynarlar ve bu etkileri kök hücrelerin fonksiyonel karakteristikleri ile ilişkilendirilebilir. Kemik iliği kaynaklı mezenkimal kök hücrelerin ise yağ transplantasyonunda faydalı olup olmadığı ise net bilinmemektedir. Bir çalışmada, yağ yaşayabilirliğini kemik iliği kaynaklı kök hücrenin de artırdığı bulunmuştur (68).
39
Illouz ve Sterodimas lipofillingi ilk kez ortaya atmış ve donör alanda liposakşın yoluyla alınarak hemen enjektörle alıcı yatağa verilen yağ greftleri olarak tanımlamışlardır (71). Ne var ki en önemli dezavantajı, rezorpsiyon oranının tahmin edilemez oluşudur. Bu rezorpsiyon oranları %25’ten %80’e varan oranlarda olabilir (26, 27, 28, 29, 30).
Lipotransferin pek çok yolu vardır ve tanımlandığı üzere bu tekniklerin tümünde yağ yaşayabilirliği değişkendir. Bu çalışmada liposakşın yoluyla abdomen bölgesinden alınan yağlar kullanılmıştır. Erdim ve ark., 6 mm’lik kanül ile alınan aspiratta daha çok adiposit canlılığı saptamışlardır, bu nedenle bu çalışmada da 6 mm’lik kanül ile liposakşın yapılmıştır (9).
Bir çalışmada hücre yaşayabilirliğinin, eğer manuel olarak yağ eldesi yapılıyor ise, donör alandan bağımsız olduğu bildirilmiştir, bu nedenle çalışmada da manuel olarak abdomenden elde edilen yağlar kullanılmıştır (11).
Başka bir çalışmada kuru tekniğe kıyasla tümesen teknik liposakşında daha fazla canlı hücre saptanmıştır. Bu nedenle bu çalışmada da tümesen teknik liposakşın ile yağların eldesi yapılmıştır (12). Görülmektedir ki, literatürde pek çok teknik ve pek çok değişken tanımlanmıştır. Üstelik bunlara ek olarak vaskülarizasyon gibi alıcı alana ait faktörler, hastaya ait faktörler de mevcuttur (14, 15, 16). Bu nedenle birkaç literatür ile yağ transferi gibi kompleks bir konunun standardize edilmesi ya da transferlerin optimize edilmesi düşünülemez.
Buna rağmen çalışmamızda ek hastalığı olmayan nispeten genç hastadan yukarda da tartışılan optimal koşullarda elde edilen yağ standart dişlere standart miktarda ekilmiştir. Aynı zamanda aynı miktarda ve aynı medyum (DMEM) ile aynı antibiyotik kullanılmıştır. Bu nedenle her üç grupta da tek değişken PRP’nin konsantrasyonu olmuştur. PRP ve yağ kalıcılığı çalışmalarında in vivo ortamlarda aynı hastada aynı sonuçların elde edilememesi, tüm bunların standardize edilemiyor oluşundandır. Bu nedenle kliniğe uygulanabilirliği açısından in vitro standart koşulları sağlayan çalışmamız değerlidir.
40
Kontrol grubunda hücre çıkışı hiçbir günde olmamıştır. Kontrol grubunda hücre çıkışının saptanmamış olması şaşırtıcı olmamıştır. Çünkü bu gruptaki ortamlarda; yağların yatağına DMEM ve antibiyotikten başka bir solüsyon eklenmemiştir. In vitro koşullarda ADSC’ler için bir skafold olmadığında yağdan dışarı çıkmaları beklenemez. Lequeux ve ark. domuz subkutan yağ dokusunun ADSC’lerini kollajen eklenmiş ortama ekmiş ve daha sonra subkutan dokuya geri vermiştir. Kontrol grubuna göre kollajenli ortamdaki ADSC’lerin, daha fazla matriks üretimi yaptığını ortaya koymuştur (72).
Bu çalışmada kontrol grubuna kollajen gibi bir skafold konulmamasının sebebi, amacımızın PRP ile kollajeni kıyaslamak olmamasındandır. Bu çalışmada gösterilmek istenen, hücrelerin çıkışını sağlayan ana skafoldun PRP olmasıdır. Kontrol grubunda hiç hücre çıkışı olmaksızın çeşitli PRP konsantrasyonları içeren gruplarda çıkış olması, PRP’nin ADSC’ler için uygun bir skafold olduğunu göstermiştir.
do Amaral ve ark. %2.5 ve %10’luk PRP’lerin kondrojenik etkisini değerlendirmiştir. Yaptıkları çalışmada, %2.5’lik PRP skafoldun %10’luk fetal sığır serumundakine benzer şekilde kondrojenik medyumu desteklediği, mezenkimal stromal hücrelerin kondrojenik potansiyelini artırdığını ve kondrojen ilişkili gen ekspresyonlarını artırdığını göstermişlerdir. Ne var ki aynı çalışmada %10’luk PRP’nin bu özelliklerin çoğunu engellediği gösterilmiştir (73).
Yoshida ve ark. ise ön çapraz bağ hücre fonksiyonunu değerlendirebilmek amacıyla 1, 3 ve 5 kat daha yoğun PRP’ler kullanmıştır. Yoğun PRP’lerde hücre fonksiyonunun inhibe olduğu, en iyi kollajen sentezi sonuçlarının konsantre edilmeyen PRP grubunda olduğunu bulmuşlardır (74).
Çalışmamızda DF2 grubunun flowsitometrik verilerine göre CD 45 (-) olan hücreler tüm hücrelerin %38.7’sini oluşturmaktaydı. Buna göre CD 45(+) olan hücre oranı tüm hücrelerin %61.3’ünü oluşturmaktaydı. CD 45(+) olan hücreler hematopoetik olan hücrelerdir. Bu durum; numunelerde CD 45(+) olan hücrelerin; liposakşın ve santrifüj ile parçalanan yağ etrafındaki vasküler yapılardan dışarı çıkan hücreler olduğunu düşündürmüştür. CD 45(+) hücre oranı DF2 grubunda %61.3 iken DF4 grubunda %39 idi. Bu oranın DF2 grubunda daha fazla oluşu, daha konsantre
41
PRP olan yerde hücre çıkışının daha fazla olduğu ve bu nedenle hematopoetik CD 45(+) hücre oranının daha fazla olduğu yönündedir.
Bu çalışmada ise DF2 PRP grubunda etkili hücre çıkışının olması, bu yoğunluktaki bir PRP’nin ADSC skafoldu olarak iyi etki gösterdiğinin bir kanıtı olarak düşünülmüştür. Ne var ki platelet konsantrasyonu %10 ve daha üstüne çıktığında yüksek miktarlarda yoğunluklara varmaktadır. Bu yoğunlukta in vivo ortamda kullanılabilmesi zordur. Bu çalışmada klinik pratikte de kullanılabilecek yoğunluklarda platelet çalışılmıştır. Öte yandan, kondrojenik etkiler ile yağ doku üzerine olan etkilerin aynı olmasının da beklenmemesi gerekir. Önemli olan doğru yoğunlukta ve in vivo kullanıldığında doku nekrozuna ya da hücre azalmasına neden olmayacak PRP’nin seçilmesidir.
Daha yoğun PRP (DF2 grubu); içerisinde daha yoğun platelet ve daha yoğun büyüme faktörü barındıran PRP anlamına gelmektedir. Bu nedenle DF2 grubunda daha fazla kök hücre çıkışı ve/veya dışarı çıkan kök hücrelerde daha yoğun proliferasyon gözlendiği düşünülmüştür. Çalışmamızda olduğu gibi yağ doku hücresi üzerine PRP konsantrasyonunun etkilerinin çalışıldığı bir yayına literatürde rastlanılmamıştır.
Yağ greftlemesi uygulamaları; kontur düzeltilmesi, hacim sağlama, hücre yenilenmesi ve skar iyileştirilmesi başlıkları altında toplanabilir. Çalışmamızda elde edilen bulguların bunların tamamı için etkili olacağı düşünülse de; kontur düzeltme ve hacim sağlama gibi yağ greftinin kalıcılığının, rejenerasyon etkisinin önüne geçtiği durumlarda daha da yarar sağlayacağı düşünülmüştür. Bu çalışmanın sonuçlarını görebilmek ve yağ yaşayabilirliğini in vivo ortamlarda değerlendirebilmek için mutlaka hayvan deneyleri yapılmalıdır.
42 5. SONUÇ VE ÖNERİLER
Hemifasial atrofi, deprese skarlar ya da estetik uygulamalarda olduğu gibi; yağ greftlemesinde hacim etkisinden faydalanılmak isteniyor ise, istenen alana uygulanan yağın yaşayabilirlik oranı ve süresi önem kazanmaktadır.
Adiposit kaynaklı mezenkimal kök hücreler, yağ greftlerinin yaşayabilirliğini artırdığı ispatlanmış hücrelerdir. Dolayısıyla yağ yaşayabilirliğini artırmada yağ greftleri ile ADSC uygulanması literatürde popüler hale gelmiştir. Ne var ki, ADSC izolasyonu zordur. Bu nedenle ADSC’yi de içeren lipoaspirat kısımları kullanılmaktadır. Ne var ki ADSC’ler de lipoaspirattan elde edildiği için; bu kombinasyon yağ elde edildiği anda; yani uygulama esnasında yapılmaktadır.
Bu çalışmada ise ADSC hiç izole edilmeden PRP skafold sayesinde ortama çekilebildiği, ne oranda çekilebildiği ve hangi PRP konsantrasyonlarında daha yoğun çekilebilir olduğu araştırılmıştır.
Çalışmanın sonucunda medyumuna PRP eklenmeyen kontrol grubunda hiç kök hücre çıkışı saptanmamıştır. PRP eklenen gruplarda ise 4 ve 5. günlerde kök hücre çıkışı olmuştur. 2 kat dilüe PRP’nin 4 kat dilüe edilen PRP’ye göre daha çok kök hücre çektiği de ispatlanmıştır. Hücre çıkışları sayılırken, ilk 9 günde orantılı artış ve katlanmalar saptanmış; ancak 10. günden itibaren orantısız ve abartılı hücre artışları bulunmuştur. 9 günden sonra, ilk 9 günde dışarı çıkmış olan hücrelerin dışardaki çoğalmaları bunun bir nedeni olabilir. Dolayısıyla PRP ile kombine edilecek bir yağ grefti uygulaması için yağ greftiyle aynı anda PRP verilmesi doğru olmayabilir. PRP’ye maruz kaldığı müddetçe yağ içinden kök hücre çıkışı olduğu, bu nedenle öncelikle mükerrer PRP uygulamalarının gerekebileceği, bunu takiben yaklaşık 10. günde yağ greftlemesinin yapılmasının uygun olduğu düşünülmüştür ve önerilmektedir.
43 6. KAYNAKLAR
1. Neuber, F. Fat grafting. Cuir Kongr Verh Otsum Ges Chir 1893: 263-7.
2. Mazzola RF, Mazzola IC. The fascinating history of fat grafting. J Craniofac Surg 2013 Jul;24(4):1069-71.
3. Peer LA. Cell survival theory versus replacement theory. Plast Reconstr Surg (1946). 1955 Sep;16(3):161-8.
4. Fournier PF. Microlipoextraction et microlipoinjection. Re´v Chir Esthe´t Lang Fr 1985;10:36-40.
5. Chajchir A, Benzaquen I. Fat grafting injection for soft tissue augmentation. Plast Reconstr Surg 1989;84:921-34.
6. Coleman SR. The technique of periorbital lipoinfiltration. Oper Tech Plast Surg 1994;1:120-6.
7. Coleman SR. Long-term survival of fat transplant: controlled demonstrations. Aesthetic Plast Surg 1995;19:421-5.
8. Coleman SR. Facial recontouring with lipostructure. Clin Plast Surg 1997;24:347-67. 9. Erdim M, Tezel E, Numanoglu A, Sav A. The effects of the size of liposuction cannula on adipocyte survival and the optimum temperature for fat graft storage: An experimental study. J Plast Reconstr Aesthet Surg 2009;62:1210-4.
10. Strong AL, Cederna PS, Rubin JP, Coleman SR, Levi B. The Current State of Fat Grafting: A Review of Harvesting, Processing, and Injection Techniques. Plast Reconstr Surg 2015 Oct;136(4):897-912.
11. Rohrich RJ, Sorokin ES, Brown SA. In search of improved fat transfer viability: A quantitative analysis of the role of centrifugation and harvest site. Plast Reconstr Surg 2004;113:391–5.
12. Agostini T, Lazzeri D, Pini A, et al. Wet and dry techniques for structural fat graft harvesting. Plast Reconstr Surg 2012;130:331e–9e.
13. Keck M, Zeyda M, Gollinger K, et al. Local anesthetics have a major impact on viability of preadipocytes and their differentiation into adipocytes. Plast Reconstr Surg 2010;126:1500–5.
14. Nguyen A, Psyk KA, Bouvier T, Hassett CA, Argenta LC. Comparative study of survival of autologous adipose tissue taken and transplanted by different techniques. Plast Reconstr Surg 1990;85:378–86.
15. Rieck B, Schlaak S. In vivo tracking of rat preadipocytes after autologous transplantation. Ann Plast Surg 2003;51:294-300.
16. Mojallal A, Shipkov C, Braye F, Breton P, Foyatier JL. Influence of the recipient site on the outcomes of fat grafting in facial reconstructive surgery. Plast Reconstr Surg 2009;124:471–83.
17. Khouri RK Jr, Khouri RK. Current Clinical Applications of Fat Grafting. Plast Reconstr Surg. 2017 Sep;140(3):466e-86e.
44 18. Khouri RK Jr, Khouri RE, Lujan-Hernandez JR, Khouri KR, Lancerotto L, Orgill DP. Diffusion and perfusion: the keys to fat grafting. Plast Reconstr Surg Glob Open 2014 Oct 7;2(9):e220.
19. Marks PW, Witten CM, Califf RM. Clarifying Stem-Cell Therapy's Benefits and Risks. N Engl J Med. 2017 Mar 16;376(11):1007-1009.
20. Khouri RK, Schlenz I, Murphy BJ, Baker TJ. Nonsurgical breast enlargement using an external soft-tissue expansion system. Plast Reconstr Surg. 2000 Jun;105(7):2500-12; discussion 2513-4.
21. Rigotti G, Marchi A, Galie´ M, et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg 2007;119 (5):1409-22.
22. Hovius SE, Kan HJ, Verhoekx JS, Khouri RK. Percutaneous Aponeurotomy and Lipofilling (PALF): A Regenerative Approach to Dupuytren Contracture. Clin Plast Surg 2015 Jul;42(3):375- 81.
23. Verhoekx JS, Mudera V, Walbeehm ET, Hovius SE. Adipose-derived stem cells inhibit the contractile myofibroblast in Dupuytren's disease. Plast Reconstr Surg 2013 Nov;132(5):1139-48.
24. Magalon G, Daumas A, Sautereau N, Magalon J, Sabatier F, Granel B. Regenerative Approach to Scleroderma with Fat Grafting. Clin Plast Surg 2015 Jul;42(3):353-64. 25. Khouri RK, Smit JM, Cardoso E, et al. Percutaneous aponeurotomy and lipofilling: a
regenerative alternative to flap reconstruction? Plast Reconstr Surg 2013 Nov;132(5):1280-90.
26. Sinna R, Delay E, Garson S, Delaporte T, Toussoun G. Breast fat grafting (lipomodelling) after extended latissimus dorsi flap breast reconstruction: a preliminary report of 200 consecutive cases. J Plast Reconstr Aesthet Surg 2010; 63:1769–77.
27. Delay E, Garson S, Tousson G, Sinna R. Fat injection to the breast: technique, results, and indications based on 880 procedures over 10 years. Aesthet Surg J 2009;29:360-76.
28. Missana MC, Laurent I, Barreau L, Balleyguier C. Autologousfat tra nsfer in reconstructive breast surgery: indications, technique and results. Eur J Surg Oncol 2007;33:685-90.
29. Khouri R, Del VD. Breast reconstruction and augmentation using pre-expansion and autologous fat transplantation. Clin Plast Surg 2009;36:269-80.
30. Nishimura T, Hashimoto H, Nakanishi I, Furukawa M. Microvascular angiogenesis and apoptosis in the survival of free fat grafts. Laryngoscope 2000;110:1333-8. 31. Mineda K, Kuno S, Kato H, et al. Chronic inflammation and progressive calcification
as a result of fat necrosis: the worstoutcome in fat grafting. Plast Reconstr Surg 2014 May;133(5):1064-72.
45 32. Sommeling CE, Heyneman A, Hoeksema H, Verbelen J, Stillaert FB, Monstrey S. The use of platelet-rich plasma in plastic surgery: a systematic review. J Plast Reconstr Aesthet Surg 2013 Mar;66(3):301-11.
33. Leo MS, Kumar AS, Kirit R, Konathan R, Sivamani RK. Systematic review of the use of platelet-rich plasma in aesthetic dermatology. J Cosmet Dermatol 2015 Dec;14(4):315-23.
34. Tosun Z, Akdağ O. Plateletten Zengin Plazma ve Kök Hücre. Turkiye Klinikleri Journal of Plastic Surgery Special Topics, 2017;6(2): 125-129.
35. Tobita M, Tajima S, Mizuno H. Adipose tissue-derived mesenchymal stem cells and platelet-rich plasma: stem cell transplantation methods that enhance stemness. Stem Cell Res Ther 2015 Nov 5;6:215.
36. Mazzola RF, Mazzola IC. The fascinating history of fat grafting. J Craniofac Surg 2013 Jul;24(4):1069-71.
37. Tobita M, Uysal CA, Guo X, Hyakusoku H, Mizuno H. Periodontal tissue regeneration by combined implantation of adipose tissue-derived stem cells and platelet-rich plasma in a canine model. Cytotherapy 2013;15:1517–26.
38. Mizuno H, Tobita M, Uysal AC. Adipose-derived stem cells as a novel tool for future regenerative medicine. Stem Cells 2012;30:804–10.
39. Romagnoli C, Brandi ML. Adipose mesenchymal stem cells in the field of bone tissue engineering. World J Stem Cells 2014 Apr 26;6(2):144-52.
40. Airas L, Niemela J, Salmi M, Puurunen T, Smith DJ, Jalkanen S. Differential regulation and function of cd73, a glycosyl-phosphatilylinositol-linked 70-kd adhesion molecule, on lymphocytes and endothelial cells. J. Cell Biol. 1997;136:421-431.
41. Strohmeier GR, Lencer WI, Patapoff TW, Thompson LF, Carlson SL, Moe SJ, Carnes DK, Mrsny RJ, Madara JL. Surface expression, polarization, and functional significance of CD73 in human intestinal epithelia. J Clin Invest. 1997 Jun 1;99(11):2588-601
42. Lin CS, Xin ZC, Dai J, Lue TF. Commonly used mesenchymal stem cell markers and tracking labels: Limitations and challenges. Histol Histopathol. 2013 Sep;28(9):1109-16.
43. Craig W, Kay R, Cutler RL, Lansdorp PM. Expression of Thy-1 on human hematopoietic progenitor cells. J Exp Med. 1993 May 1;177(5):1331-42.
44. Saalbach A, Wetzig T, Haustein UF, Anderegg U. Detection of human soluble Thy-1 in serum by ELISA. Fibroblasts and activated endothelial cells are a possible source of soluble Thy-1 in serum. Cell Tissue Res. 1999 Nov;298(2):307-15.
45. Nassiri F, Cusimano MD, Scheithauer BW, Rotondo F, Fazio A, Yousef GM, Syro LV, Kovacs K, Lloyd RV. Endoglin (CD105): a review of its role in angiogenesis and tumor diagnosis, progression and therapy. Anticancer Res. 2011 Jun;31(6):2283-90.
46 46. Gutowski KA; ASPS Fat Graft Task Force. Current applications and safety of autologous fat grafts: A report of the ASPS fat graft task force. Plast Reconstr Surg. 2009;124:272–80.
47. Eaves FF III, Haeck PC, Rohrich RJ. ASAPS/ASPS Position statement on stem cells and fat grafting. Plast Reconstr Surg 2012;129:285–7.
48. Zhao Y, Waldman SD, Flynn LE. Multilineage co-culture of adipose-derived stem cells for tissue engineering. J Tissue Eng Regen Med 2012. Doi: 10.1002/term.1643. 49. Kurita M, Matsumoto D, Shigeura T, Sato K, Harii K, Yoshimura K. Influences of centrifugation on cells and tissues in liposuction aspirates: optimized centrifugation for lipotransfer and cell isolation. Plast Reconstr Surg 2008;121:1033-41.
50. Rehman J, Traktuev D, Li J, et al. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation 2004;109:1292–8.
51. Kilroy GE, Foster SJ, Wu X, et al. Cytokine profile of human adipose-derived stem cells: Expression of angiogenic, hematopoietic, and pro-inflammatory factors. J Cell Physiol 2007;212:702-9.
52. Zhao J, Yi C, Li L, et al. Observations on the survival and neovascularization of fat grafts interchanged between C57BL/6-gfp and C57BL/6 mice. Plast Reconstr Surg 2012;130:398-406.
53. Kfoury Y, Scadden DT. Mesenchymal cell contributions to the stem cell niche. Cell Stem Cell 2015 Mar 5;16(3):239-53..
54. Eom YW, Oh J-E, Lee JI, et al. The role of growth factors in maintenance of stemness in bone marrow-derived mesenchymal stem cells. Biochem Biophys Res Commun 2014;445:16–22.
55. Andia I, Rubio-Azpeitia E, Maffulli N. Platelet-rich plasma modulates the secretion of inflammatory/angiogenic proteins by inflamed tenocytes. Clin Orthop Relat Res 2015;473:1624-34.
56. Eppley BL, Pietrzak WS, Blanton M. Platelet-rich plasma: A review of biology and applications in plastic surgery. Plast. Reconstr. Surg 2006;118:147.
57. Li K, Li F, Li J, et al. Increased survival of human free fat grafts with varying densities of human adipose-derived stem cells and platelet-rich plasma. J Tissue Eng Regen Med 2017 Jan;11(1):209-19.
58. Ersek RA. Transplantation of purified autologous fat: a 3-year follow-up is disappointing. Plast Reconstr Surg 1991 Feb;87(2):219-27; discussion 228.
59. Fournier P. Microlipoextraction et microlipoinjection. Rev Chir Esthet Lang Fr 1985;10:36–40.
60. Kassolis JD, Reynolds MA. Evaluation of the adjunctive benefits of platelet-rich plasma in subantral sinus augmentation. J Craniofac Surg 2005;16:280-7.
61. Itoi Y, Takatori M, Hyakusoku H et al. Comparison of readily available scaffolds for adipose tissue engineering using adipose-derived stem cells. J Plast Reconstr Aesthet Surg 2010;63:858-64.