1
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
GÖZ HASTALIKLARI ANABİLİM DALI
Başkan: Prof. Dr. FİLİZ AFRASHİ
YAŞA BAĞLI MAKULA DEJENERESANSI OLAN
HASTALARDA VİTREORETİNAL ARA YÜZEY
DEĞİŞİKLİKLERİNİN ARAŞTIRILMASI
Dr. Orhan İLİM
UZMANLIK TEZİ
Tez Danışmanı:
Prof. Dr. Cezmi AKKIN
2
İçindekiler
GİRİŞ ve AMAÇ: ... 6
GENEL BİLGİLER:... 7
Makula Anatomisi: ... 7
YAŞA BAĞLI MAKULA DEJENERESANSI (YBMD) ... …………. …8
Epidemiyoloji: ... 8 Prevalans: ... 9 İnsidans: ... 9 Etiyoloji: ... 9 YBMD Histopatolojisi: ... 11 YBMD’de Klinik: ... 13
YBMD’de Tanı Yöntemleri ... 21
YBMD’de Tedavi: ... 22
VİTREUS ... 23
Vitreus Anatomisi: ... 23
Vitreusta Yaşa Bağlı Gelişen Değişiklikler: ... 27
Vitreusun Görüntülenmesi ... 28
Posterior Vitreus Dekolmanı (PVD): ... 29
Senil PVD komplikasyonları: ... 32
GEREÇ VE YÖNTEM ... 36
Olgu Seçimi ... Hata! Yer işareti tanımlanmamış. İncelenen Parametreler ... 36
Ultrasonografi (USG)... 37
3 İstatistik Yöntemler... 38 BULGULAR: ... 39 TARTIŞMA: ... 50 ÖZET ... 61 KAYNAKLAR ... 64
4 KISALTMALAR:
ANCHOR: Anti VEGF Antibody For The Treatment Predominantly Classic CNV In AMD AREDS: Age-Related Eye Disease Study Group
ERM: Epi-Retinal Membran
EİDK: En İyi Düzeltilmiş Görme Keskinliği FA: Floresein Anjiografi
FAZ: Foveal Avasküler Zon FDT: Fotodinamik Tedavi GK: Görme Keskinliği
ILM: Internal Limiting Membran İSYA: İndosiyanin Yeşili Anjiografisi İVL: İntravitreal Lucentis
KMÖ: Kistoid Makuler Ödem KNV: Koroid Neovaskülarizasyonu
logMAR: Logaritm of Minimum Angle Resolution μm: mikrometre
mm: milimetre ml: mililitre
MPS: Macular Photocouagulation Treatment Study OKT: Optik Koherens Tomografi
PED: Pigment Epitel Dekolmanı PKV: Polipoidal Koroidal Vaskülopati PVD: Posterior Vitreus Dekolmanı
5 PDR: Proliferatif Diyabetik Retinopati
RAP: Retinal Anjiomatöz Proliferasyon RPE: Retina Pigment Epiteli
SRVO: Santral Retinal Ven Oklüzyonu USG: Ultrasonografi
VEGF: Vascular Endothelial Growth Factor VMA: Vitreomakuler Adezyon
6
GİRİŞ ve AMAÇ:
Yaşa bağlı makula dejeneresansı (YBMD), retina pigment epiteli, Bruch membranı ve koriokapillarisin ilerleyici ve dejeneratif bir hastalığı olup endüstrileşmiş ülkelerde yaşlı popülasyondaki en önemli görme kaybı nedenidir (1). Özellikle gelişmiş toplumlarda yaşlı nüfusun artması nedeniyle YBMD insidansı giderek artmakta ve bu da günümüzde önemli bir toplum sağlığı sorunu oluşturmaktadır. YBMD kuru (non-neovasküler veya atrofik) ve yaş (neovasküler veya eksudatif) olmak üzere iki gruba ayrılmaktadır. Tanı konulan olguların % 80’ini kuru tip YBMD oluştursa da, yaş tip YBMD olguları bu hastalıkla ilişkili ciddi görme kayıplarının % 80'inden sorumludur (2). Tedavi seçeneklerinin kısıtlı olması hastalığın etiyopatogenezinin ve risk faktörlerinin anlaşılmasına ve hastalıktan korunmaya yönelik çalışmaların önemini arttırmaktadır. YBMD’nin etiyopatogenezi ve risk faktörleri tam olarak bilinmemektedir. Hastalığın gelişiminde suçlanan başlıca faktörler senil değişiklikler, lipid birikimi, hipoksi, iskemi, enflamasyon, oksidatif hasar ve genetik faktörlerdir (3). Son zamanlarda yapılan çalışmalarda persistan vitreomakuler adezyon varlığının hipoksi, iskemi, enflamasyon, sitokin ve serbest radikal üretimine yol açarak yaş tip YBMD progresyonunu tetikleyebildiği belirtilmektedir. Özellikle yaş tip hastalığa sahip olgularda, kuru tip YBMD olguları ve normal kontrollere göre vitreomakuler adezyon insidansının ve parsiyel vitreus dekolmanının daha yüksek ve total PVD insidansının daha düşük olduğu bildirilmektedir (5). Buna göre vitreusta meydana gelen anatomik ve fizyopatolojik değişikliklerin ve posterior vitreus dekolmanı düzeyinin YBMD gelişiminde ve kuru tipten yaş tipe geçişte önemli rolü olabileceği düşünülmektedir.
Bu çalışmadaki amacımız vitroretinal ara yüzey değişikliklerinin YBMD tipleri üzerindeki etkisini değerlendirebilmek üzere; kuru ve yaş tip YBMD’li gözler ile normal gözlerdeki vitreoretinal ara yüzey değişikliklerini inceleyerek, bu olgulardaki vitreoretinal adezyon, parsiyel ve total arka vitreus dekolmanı dağılımlarının araştırılmasıdır.
7
GENEL BİLGİLER:
Makula Anatomisi:
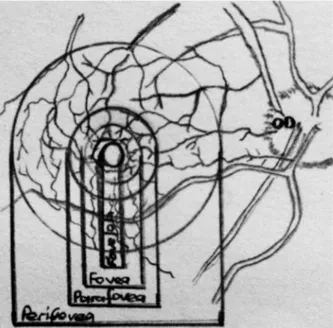
Makula (makula lutea veya santral retina) yaklaşık olarak 5.5 mm çapında bir alandır. Bu alan iki veya daha fazla gangliyon hücre tabakası ile birlikte yoğun ksantofil pigmenti içerir. Sınırları büyük vasküler arkadların seyriyle uyumluluk gösterir. Mikroskobik anatomik özelliklere göre kendi içerisinde foveola, fovea, parafovea ve perifovea gibi zonlara ayrılmaktadır (şekil 1) (6).
Şekil 1. Makula anatomisi (Temel Göz Hastalıkları Aydın P, Akova YA. Güneş Yayınevi, Ankara, 2001. Referans alınarak yeniden çizilmiştir)
Fovea makuler alanın santralinde yaklaşık 1.5 mm veya 1 optik disk çapında olup etrafındaki retinaya göre çok daha fazla pigment içeren bir çöküntü alanıdır. Foveola ise fovea santralindeki 0.35 mm çapındaki alanı tarif edilmek için kullanılmaktadır. Gangliyon hücresi ihtiva etmeyen bu kısım sadece kon ve rodlardan oluşur. Makulanın en iyi görme keskinliğini sağlayan yeri umbo olarak adlandırılmakta olup foveolenın merkezinde yer alan 0.13 mm kalınlığındaki alandır. Foveanın etrafını bir
8 kemer 0.5 mm genişliğinde bir kemer gibi saran parafovea ise gangliyon hücre tabakası, iç nükleer ve dış pleksiform tabaka ile birlikte bipolar hücreleri ihtiva etmektedir. Bu zonu çevreleyen 1.5 mm genişliğindeki alan perifovea olarak adlandırılmaktadır. Bu alanda pek çok gangliyon hücre tabakası ile birlikte bipolar hücreler bulunmaktadır. Foveal avasküler zon (FAZ), foveanın içinde bir sirküler avasküler zon olup vasküler arklarca sarılmıştır. Bu damarlar iç nükleer tabaka seviyesinde bulunur ve aralarında 250- 600 mikrometrelik bir avasküler zon bırakırlar.
YAŞA BAĞLI MAKULA DEJENERESANSI (YBMD)
YBMD geri dönüşümsüz görme kaybına yol açarak yaşam kalitesini önemli düzeyde etkileyen dejeneratif bir hastalıktır. Makuladaki bu dejeneratif değişiklikler kuru ve yaş olmak üzere iki grupta değerlendirilmekle birlikte her iki tipte görme kaybına yol açabilmektedir. Amerika Birleşik Devletleri’nde yaklaşık 8 milyon insanın bu hastalıktan muzdarip olduğu, 1.75 milyon insanın ise hastalığın ileri formuna sahip olduğu bildirilmektedir (7). Yeni tanı ve tedavi yöntemlerine rağmen hastalığın prevalansında 2050 yılında yaklaşık %97 oranında artış olması beklenmektedir (8).
Epidemiyoloji:
YBMD gelişmiş ülkelerde santral görme kaybının en önemli nedenlerindendir. YBMD’li hastaların % 80’ini kuru tip, kalan % 20’sini yaş tip oluşturmaktadır. Yaş tip YBMD’li olguların % 90’ında ciddi görme kaybı mevcuttur (9-11). Dünya Sağlık Örgütü’nün 2002 yılı verilerine göre tüm dünyadaki körlüklerin katarakt ve glokomdan sonra üçüncü en sık nedeni YBMD olarak bulunmuştur (12). Özellikle gelişmiş ülkelerde beklenen yaşam süresinin uzamasına bağlı olarak ciddi sosyal ve ekonomik sorun teşkil etmektedir.
9
Prevalans:
Topluma dayalı yapılan çalışmalarda YBMD prevalansı değişiklik göstermektedir (13-15). Bu değişikliklerin nedeni YBMD tanımlamasının farklılık göstermesi, sınıflamanın farklı yapılması ve çalışma kapsamındaki grupların yaş, sosyodemografik ve genetik farklılık göstermesine dayanmaktadır. Tanı kriterleri birbirine yakın olan en önemli üç çalışma Beaver Dame, Blue Mountain ve Rotterdam çalışmalarıdır. Beaver Dam çalışmasında (13) YBMD prevalansı % 1.6 olarak belirtilmiş olup, hastalığın erken formunun daha sık görüldüğü ancak ilerleyen yaşla birlikte her iki tipin prevalansında da artış görüldüğü bildirilmiştir. Blue Mountain çalışmasında % 1.4 olarak bildirilirken (14), Rotterdam çalışmasında 55-98 yaş aralığındaki YBMD prevalansı % 1.2 olarak bildirilmiştir (15).
İnsidans:
Framingham Eye Study (FES) çalışma grubunda (16) 5 yıllık YBMD insidansı 65 yaş için % 2,5, 70 yaş için % 6,7, 75 yaş için % 10,8 olarak bildirilmiştir. Beaver Dame Eye Study grubunun yaptığı çalışmada 5 yıllık erken YBMD insidansının 43-54 yaşlarda % 3,9’dan 75 yaşlarda % 22,8’e çıktığı bildirmiştir. Tüm olgular ele alındığında 5 yıllık insidans % 0.9, 75 üstü bireylerdeki ileri YBMD 5 yıllık insidansı ise % 5,4 bulunmuştur (17).
Etiyoloji:
Risk Faktörleri:
YBMD gelişimi için en önemli risk faktörü ileri yaştır. Bunun yanında hastalığın gelişminde etkili olduğu geniş ölçekte kabul görmüş diğer risk faktörleri ise pozitif aile hikayesi, sigara kullanımı ve hipertansiyon varlığıdır (18). Yapılan çalışmalarda hastalığın gelişminde ilave risk faktörü olarak suçlanan, ancak yeterince kabul görmemiş faktörler ise kadın cinsiyet, hiperopi, mavi iris, C reaktif protein
10 yüksekliği, artmış akyuvar oranı, vejeteryan diyet ve yetersiz poliansatüre yağ asidi alımıdır (19). Diğer taraftan siyah ırk, balık tüketimi, poliansatüre yağ asidi alımı ve yüksek serum karotenoid düzeyinin düşük risk profili ile ilişkili olduğu belirtilmektedir. Eye Disease Case-Control Study grubunun yaptığı çalışmada ise östrojen replasmanı yapılan kadınlarda kontrol grubuna göre koroidal neovaskülarizasyon gelişme riskinin daha düşük bulunduğu bildirilmiştir (20). YBMD ile ilişkili olduğu düşünülen bir diğer faktör de katarakttır. Kataraktın ışık hasarını önleyerek YBMD gelişimine karşı koruyucu etkisi olduğunu savunan ve katarakt cerrahisi sonrası YBMD riskinin arttığını bildiren çalışmalar olmakla birlikte, katarakt varlığının herhangi bir koruyucu etkisi olmadığını bildiren yayınlar da mevcuttur (21).
Genetik Faktörler:
Aile öyküsü varlığında YBMD gelişme riski daha yüksektir (22). Bu durum makuler dejeneresansı ile ilişkili olabilecek gen veya genlerin olma ihtimalini arttırmaktadır. Özellikle kompleman faktör H için yüksek allelik varyasyon olduğu bildirilmektedir (23). Hastalığın yaşlı popülasyonda görülmesi ise olguların ebeveynleri ile karşılaştırmalı yapılacak genetik araştırmaları kısıtlamaktadır. Yapılan çalışmalarda en çok suçlanan genler ABCR ve APOE4 olmakla birlikte, genel görüş hastalığın gelişiminde birçok farklı gendeki polimorfizmin etkili olabileceği yönündedir (24).
İskemi:
Birçok hastalıkta görme kaybının esas nedeni olan koroidal neovaskülarizasyonun iskemiye sekonder bir kompansatuar mekanizma olabileceği öne sürülmektedir. Laser doppler ile yapılan çalışmalarda 10 veya daha fazla büyük druseni olan olgularda kontrol olgulara göre kan akımında azalma olduğu görülmüştür (25). İskemi ve hipoksiye yanıt olarak üretilen ve anjiogenezi tetikleyen en önemli sitokin VEGF’tir (26). Hayvan modellerinde VEGF inhibisyonu ile neovaskülarizasyonun inhibe olduğu gösterilmiştir (27). YBMD tedavisinde kullanılan AntiVEGF ilaç enjeksiyonları ile koroidal neovaskülarizasyonlarında anjiografik gerileme
11 sağlanmaktadır (28). Ancak KNV’deki büyüme paterni, aktif KNV’deki regresyon, hastalığın diğer histopatolojik bulguları ve hayvan modellerinde elde edilen bulgular tek başına iskemi ile açıklanamamaktadır.
Enflamatuar faktörler:
Yapılan çalışmalar drusen ve YBMD patogenezinde enflamasyonun önemli bir rolü olduğunu göstermektedir. Doku kesitlerinin histolojik incelemelerinde RPE’ye ait hücre atıkları, RPE bazal lamina ve Bruch membranı arasında birikip kronik enflamasyon yoluyla drusen oluşturabildiği görülmüştür. Drusen içerik olarak serum amiloid protein ve diğer kompleman faktörleri gibi kronik enflamatuar yanıt ve yaşa bağlı hastalıklarla ilişkili proteinler içermektedir (29). Enflamasyon anjiogenez ile ilişkilidir ve ileri YBMD’de neovaskülarizasyon gelişiminde rolü olduğu düşünülmektedir (30).
Oksidatif Stres:
Fotoreseptör hücre dış segmentlerinde oksitlenmiş lipidler bulunmaktadır. Bu segmentler RPE hücrelerinde bulunan Scavenger resetpörleri (CD36) yardımıyla fagosite edilmektedir. Okside lipidlerin hergün periyodik olarak fotoreseptör dış segmentleri aracılığıyla fagosite edilmesinin RPE hücrelerinde VEGF üretimi yanıtına neden olabileceği belirtilmektedir (31). RPE hücrelerinin maruz kaldığı oksidatif hasar arttıkça VEGF üretiminin de arttığı ve bu durumun KNV gelişimine zemin hazırladığı savunulmaktadır (32).
YBMD Histopatolojisi:
YBMD’de ilk morfolojik bulgu RPE altında anormal ekstraselüler madde birikimidir. Bazal laminar depozitler (BLD) (içeriği: granüler elektron-yoğun maddeler, pıhtılaşmış membranlar ve fibröz kollajenler) ve bazal lineer depozitler RPE’nin plasma membranı ve bazal membranı arasında birikmeye başlar (33-35). Bu
12 depozitler oftalmoskopik olarak izlenemezler ancak retinada fonksiyon bozukluğuna ve geç fazda anjiografik değişikliklere neden olurlar. Bazal laminar ve lineer madde birikimi yumuşak drusen gelişimine neden olur. Drusen YBMD’nin ikinci bulgusu olup oftalmoskopik olarak YBMD’nin ilk kanıtıdır. Yumuşak drusen, histolojik olarak Bruch membranının iç kısmının anormal kalınlaşmasına karşılık gelir. Klinik olarak yumuşak drusen, RPE’nin altında lokalize sınırları belirgin olmayan, sert drusenden daha büyük (>63μm), sarı-gri renkte lezyonlardır. Bu tip drusen RPE seröz dekolmanına neden olabilir ve KNV gelişiminde rol oynar (36). Sert drusen 63 mikrondan daha küçük, yuvarlak, sınırları belirgin, sarı-beyaz depozitlerdir. Birçok toplulukta görülebilir, yaşa bağlı değildirler ve KNV gelişimi için riski arttırmazlar (37). Drusen üzerindeki RPE hasara uğrarsa, drusen gerilemeye başlar. Daha beyaz, sert görünür, sınırları belirsizleşir, fokal kalsifikasyon olur. Bu lezyon kalsifiye (gerileyen) drusen olarak tanımlanır. RPE’nin fokal hiperpigmentasyonu kuru tip YBMD’nin diğer önemli bir klinik özelliğidir. RPE’nin hipertrofisi, sellüler hiperplazisi ve ağır atrofisi görülebilir. Atrofi küçük noktacıklar şeklinde olduğunda non- geografik atrofi olarak isimlendirilir. Bu küçük lezyonlar zamanla birleşir, coğrafik atrofi adını alır ve sıklıkla altındaki koriokapillarisin atrofisi ile beraberdir. Bu alanda RPE hücrelerinin % 90’ının kaybolduğu ve damarsal yapının azaldığı gösterilmiştir (38).
Neovasküler Değişiklikler:
Yaş tip YBMD’nin temel göstergesi makula bölgesi altında koryokapillaristen gelişen KNV’dir. Makulada KNV, ciddi santral görme kaybının en önemli sebebidir. Neovasküler doku ve diskiform skar yaş tip veya yaş tip YBMD’ye özgü bulgulardır. KNV’nin büyümesi, etiyolojik faktörlere bağlı olmaksızın tamamen RPE ve makulanın dış nükleer tabakasında anjiojenik büyüme faktörlerinin ekspresyonuna bağlıdır. KNV koriyokapillerlerden köken alır ve Bruch membranından hücre yıkımıyla RPE altı ve subretinal boşlukta ilerlerler. Diffüz ve yumuşak drusen varlığı, seröz dekolman varlığı KNV gelişimi ile ilişkilidir. Histolojik kesitlerde KNV dokusunda vasküler endotel ve hiperplastik RPE hücreleri, neovaskülarizasyonların etrafında makrofaj hücreleri, düzensiz vasküler yapılar, doku sınırlarında avasküler yerler, bazal laminer ve lineer depozitler görülmüştür
13 (39). KNV’den sıvı veya hemoraji nedeniyle seröz veya RPE dekolmanı meydana gelebilir. Klasik, okült veya karma tip olarak sınıflandırılır. Okült KNV’de RPE altında fibrovasküler doku, klasik KNV’de subretinal fibrovasküler doku, karma tipte ise RPE’nin her iki tarafında fibrovasküler doku vardır. Neovasküler dokudan kanama yaş tip YBMD’nin son evresi olan diskiform skara yol açar.
YBMD’de Klinik:
YBMD’de en sık görülen şikâyetler, görme keskinliğinde azalma, metamorfopsi ve santral skotomdur. Diğer bulgular ise, renkli görmede azalma, ışık hassasiyeti ve azalmış kontrast hassasiyetidir. Bazı hastalar bu bulguları geç dönemde fark edebilmektedirler, özellikle hastalık tek gözde başladığı durumlarda, hasta gözündeki sorunu ancak diğer göz etkilendiğinde fark edebilmektedir. YBMD non-neovasküler (kuru veya atrofik), neovasküler form (yaş veya eksudatif) olmak üzere iki gruba ayrılabilir.
Kuru veya eksudatif olmayan tip:
YBMD de ilk tespit edilebilen klinik bulgu drusendir. YBMD’nin kuru tipi sık görülen formudur. Karakteristik özellikleri drusen, retinal pigment epitel değişiklikleri ve atrofidir.
Drusen:
Drusen, makulada RPE seviyesinde yerleşen, klinik olarak küçük, yuvarlak, sarı lezyonlardır. Histolojik olarak bu materyal Bruch membranının iç kısmındaki bazal membranın anormal kalınlaşması olup, PAS (+) boyanabilen ekstraselüler materyal depozitlerdir (40).
İçerik:
Drusen nötral yağ ve fosfolipidlerle birlikte spesifik karbonhidrat kalıntılarını içeren glikokonjugatlar içermektedir. Yapılan çalışmalar yumuşak ve sert drusenin aynı kökene sahip olduğunu desteklemektedir. Yumuşak ve sert drusenlerin çoğu karbonhidrattan zengin nüveler içermektedir. Bu nüveler drusen içerisinde santral olarak yerleşim göstermekte olup, tipik olarak Bruch membranına bitişiktir. Bazı
14 araştırmacılar lipid ve drusen ilişkili diğer moleküllerin daha sonra eklendiğini savunmaktadır. Yumuşak ve sert drusende bulunabilen diğer moleküller apolipoprotein E, immunglobulinler, faktör X, amiloid P komponenti, kompleman C5 ve C5-9 terminal kompleksi, fibrinojen ve trombospondindir (39). Vitronektin hem yumuşak hem sert drusenin majör bileşenidir. Vitreonektin mRNA lokal RPE hücrelerinden exprese edilmekte olup, bu molekülün YBMD patogenezine katkıda bulunabileceği belirtilmektedir (41).
Enflamatuar debrisin RPE yüzeyinde bleb formasyonu oluşturduğu ve RPE bazal membranından geçerek yumuşak drusen formuna evrildiği düşünülmektedir. Ultrastrüktürel olarak bu materyal aterom plağını oluşturan ekstrasellüler lipid birikimini andırmaktadır. Fotoreseptör kaybı ile birlikte membranöz debrislerinde kaybolmaya başlaması, debrisin muhtemelen indirekt olarak fotoreseptörlerden derive olan peroksidize lipitlerden doğduğunu düşündürmektedir (42).
Fotoreseptör dış segmentleri poliansatüre yağ asitlerinden zengin olması ışık ve oksijen durumunda serbest radikal üretimine neden olmaktadır. Genetik ve çevresel faktörlerinde eklenmesiyle birlikte RPE hasarı ve membran üretimi tetiklenmektedir. Sert, yumuşak veya granüler, diffüz veya konflüent olmak üzere 3 alt grubu mevcuttur (43);
Sert drusen:
Sert drusen RPE ile Bruch membranı arasında yerleşen, PAS (+) boyanan hiyalin içerikli materyaldir. Keskin sınırılara ve düzgün bir yüzeye sahip olan bu drusen tipinin YBMD'de görülme sıklığı % 6.2 olarak bildirilmektedir (42).
15 Resim 1. Bilateral druseni, subfoveal skarı ve OKT kesitinde VMA’sı olan bir olgu
Yumuşak drusen:
Yumuşak drusen, sınırları düzensiz, birleşmeye meyilli, çapları 63 mikrondan büyük depozitlerdir. Elektron mikroskobik çalışmalarda bu drusenin amorf materyaller ve kalsifikasyon içeren iki tabakalı bir membrandan oluştuğu görülmüştür. Yumuşak drusenin oluşması, Bruch membranın iç tabakasının kalınlaşmasına ve RPE nin ayrılmasına yol açar. Oluşan hidrofobik boşluk KNV gelişimi için potansiyel bir yerdir (43).
Konfluent drusen:
Konfluent drusen, birden fazla yumuşak drusenin birleşmesiyle oluşur (Resim 2). Yumuşak drusenin birleşmesi, kliniğin drusenden seröz dekolmana veya yaş tipe doğru ilerlediğini gösterir. Küçük (<63 mikron) veya sert drusen YBMD ilerlemesinde risk oluşturmaz. Orta büyüklükteki (63–124 mikron arası) drusen, YBMD’nin ilerlemesi ile ilişkilidir ve görme kaybı potansiyeli vardır. Büyük ( 124 mikron) ve yumuşak drusen ise YBMD progresyonu açısından en yüksek riski oluşturur (42).
16
Resim 2. Yumuşak druseni olan bir olgunun OKT’sinde VMA varlığı görülüyor
Geografik atrofi:
RPE’nin sınırları belirgin atrofi alanları olup kuru tip YBMD’nin son evresinde görülen klasik bir bulgudur. Drusen RPE hücre kaybının başlamasıyla ilişkilendirilmekle birlikte, geografik atrofi geliştikten sonra genellikle kaybolmaktadırlar. Histolojik çalışmalarda RPE hücre kaybına diğer nörosensoryel retina tabakalarında (fotoreseptörler, dış nükleer tabaka, dış limitan membran) dejeneresansı, koriokapilleriste belirgin atrofi ve sklerozisin (Bruch membranı bütünlüğü bozulmaksızın) eşlik ettiğini göstermektedir (43).
Eksudatif (Neovasküler) YBMD
Yaş tip YBMD’nin en önemli işareti KNV gelişimidir. Bruch membranındaki herhangi bir bozukluk, drusen, iç tabakanın kalınlaşması veya kuru tip YBMD’deki bulguların bulunması, Bruch membranında çatlak oluşma ihtimalini arttırır ve koryokapillaristen yeni damar yumağının Bruch membranının dış tabakasını delmesini kolaylaştırır. Bu yeni damarlara fibroblastlarda eşlik eder ve koryokapillaris, Bruch membranı ve RPE’nin normal yapısını bozar. Bunun yanı sıra fibroglial ve fibrovasküler doku, fotoreseptör ve dış retina tabakalarının normal yapısını bozarak, diskiform skar gelişimine neden olur. Aktif eksudatif YBMD’de ana klinik bulgular, subretinal hemoraji veya sıvı, RPE altında hemoraji veya sıvı, RPE değişiklikleri ve sert eksudalardır. Kronik eksudatif YBMD ise aktif eksudasyona ait bulgular varlığında ya da yokluğunda subretinal fibrozis ile belirlenir. Geç dönemde ise diskiform skar veya geografik atrofi gelişir (44).
17
Eksudatif YBMD’nin Bulgu ve Semptomları:
Yaş tip YBMD gelişen kişilerde görmede ani azalma, metamorfopsi ve parasantral skotom gelişir. Klinik olarak yaş tip YBMD’de RPE’de elevasyon, subretinal veya intraretinal lipid, sıvı veya kan birikimi, PED retina pigment epitel yırtığı, nadiren de gri yeşil membranın kendisi gözlenir. KNV tanısında altın standart yöntem FA’dır (Flöresein Anjiografi). Eğer lezyonun üzerinde kan varsa veya KNV gizli ise, İSYA (İndosiyanin Yeşili Anjiografisi) karar verme ve tedavi için yol gösterici olur.
Pigment epitel dekolmanı (PED):
Retina pigment epitel dekolmanı; retina pigment epitelinin bazal membranının Bruch membranı iç kollajen tabakasından ayrılmasıdır. Pigment epiteli altındaki materyalin özelliğine göre hemorajik, seröz ya da fibrovasküler olmak üzere farklılık gösterir. Seröz PED’ler, oftalmoskopik olarak sarı renkli, yuvarlak, oval ya da fasulye tanesi şeklinde düzgün konveks yüzeyli olarak görülürler. FA’da uniform bir hiperfloresans mevcuttur ve sınırları belirgindir. Seröz PED’de de KNV gelişimi izlenebilir. Elman ve arkadaşlarının yaptığı çalışmada seröz PED’lerin % 32’sinin ortalama 6 ay içerisinde KNV geliştirdiği saptanmıştır (45). PED ile birlikte KNV mevcut ise, gizli KNV sıklıkla subretinal sıvı, hemoraji ve sert eksudalar ile birliktelik gösterir. PED’ler kendiliğinden düzleşseler bile sonuç görme düşüktür. PED’de girintinin varlığı veya dekolman içine floresein doluşunun yavaş olması gizli KNV’ye işaret eder. Bazen dekolman üzerindeki gerilmiş RPE yırtılır ve bu yırtıktan alttaki damar yapısı görülebilir. Açığa çıkmış koriokapillaris erken floresans verir, geç fazda ise koroid ve sklera boyanır. Kenardaki kıvrılmış epitel floresansı bloke eder. Bazı seröz PED’ler KNV içermez ve bunlar kendiliğinden rezorbe olarak jeografik atrofi alanları oluştururlar. Fibrovasküler PED’lerde FA’daki floresans hafiftir, orta fazda lekeli bir floresans mevcuttur, geç fazda subretinal alanda boyanma veya sızıntı izlenir. Drusenoid PED FA’da hafif bir floresans verir. Lekeli bir görünümü yoktur ve geç fazda floresansı artmaz. Üzerindeki retiküler pigment birikintileri, hipofloresan dallar şeklindedir. İSYA, PED’deki gizli KNV’yi ortaya çıkarabilir. İSYA’da dekolman hipofloresandır. Erken fazda damar ağı, geç fazda hiperfloresan
18 fokal odak veya plak görülebilir. Drusenoid PED’de KNV oluşumu yoktur, ancak fibrovasküler PED sıklıkla gizli KNV ile birliktelik gösterir.
Koroid neovaskülarizasyonu (KNV):
KNV, koryokapillaristen gelişen yeni damarların Bruch membranının dış kısmını çatlatarak RPE altına yürümesidir. Foveadaki KNV YBMD’deki körlüğün en önemli nedenidir. Hastalar genellikle sebebi açıklanamayan, hızlı gelişen görme azalması, santral metamorfopsi veya rölatif santral skotom ile başvururlar. Koroidden neovaskülarizasyonun yanı sıra, fibröz doku Bruch membranının içine yürüyebilir ve beraberinde sensöryel retina ve RPE arasında fibrovasküler veya fibrosellüler doku bulunabilir. Macular Photocoagulation çalışma grubu (MPS) KNV’yi FA’daki görünüme göre klasik ve okült (gizli) KNV olmak üzere iki şekilde tanımlamıştır (46).
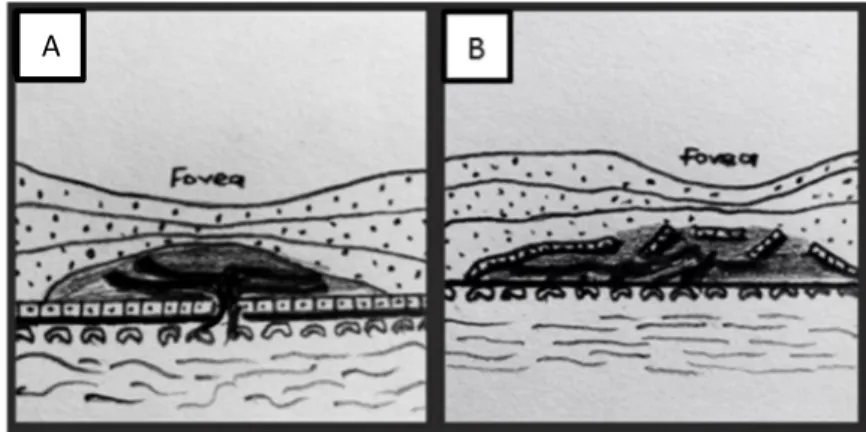
Klasik KNV: Klasik KNV anjiografinin erken fazlarında hiperfloresans gösteren ve transit fazında parlaklığı giderek artan lezyondur ve bu lezyonun sınırları, ilerleyen fazlarda boya sızıntısı nedeniyle silikleşir. Fotodinamik tedavinin gündeme girmesi ile klasik membranlar; ağırlıklı klasik, minimal klasik ve saf okült (gizli) olarak sınıflandırıldı. Buna göre, klasik membran lezyonun % 50 ve daha fazlasını oluşturuyor ise baskın klasik; klasik membran lezyonun % 50’sinden azı ise minimal klasik ve lezyonda klasik komponent miktarı % 0 ise saf okült olarak tanımlandı.
Resim 3. Klasik KNV’si olan bir olgunun fundus görüntüsü (A) ve FA kesiti (B).
Okült KNV: MPS grubu tarafından FA’da 2 farklı gizli KNV floresans paterni belirtilmiştir. Bu paternler fibrovasküler PED ve kaynağı belirsiz geç faz
19 hiperflöresanstır. Fibrovasküler PED, genellikle anjiografinin ilk safhalarında gözlenen RPE’nin benekli, granüler, düzensiz floresansı ile karakterize lezyondur. Anjiografinin ilerleyen safhalarında bu bölgelerden sızıntı meydana gelir ancak klasik KNV’deki sızıntı kadar yaygın ve parlak değildir. Kaynağı belli olmayan sızıntı ise RPE düzeyinde en iyi anjiografinin geç fazlarında değerlendirilen klasik KNV’ye veya anjiografinin erken veya orta fazlarındaki düzensiz RPE elevasyonuna karşılık gelmeyen lezyonlardır. Benekli, iğne ucu hiperfloresans ve yaygın sızıntı vardır. Lezyon sınırları hiçbir zaman tam olarak belirlenemez. İSYA kullanılarak okült KNV’ler fokal, sıcak spotlar; plaklar, bu iki tipin kombinasyonu, retinal-koroidal anastamoz, polipoidal tip olarak ayrılırlar.
FA’da olguların %15 i klasik, %85’i gizlidir. Neovaskülarizasyon RPE altında ya da duyusal retina altında gelişebilir. RPE altı alanda sınırlı kaldığında Tip 1 KNV, RPE’yi penetre edip retina altı alana girdiğinde Tip 2 KNV olarak sınıflandırılır.
Şekil 2. A Tip1 KNV B. Tip 2 KNV. (Grossniklaus H, Gass DM. Clinicopathologic correlations of surgically excised type 1 and type 2 submacular choroidal neovascular membranes. American Journal of Ophthalmology. Volume 126, Issue 1, July 1998, Pages 59–69. Referans alınarak yeniden çizilmiştir.)
KNV lezyonları fovea merkezine uzaklıklarına göre de sınıflandırılırlar;
FAZ merkezine 200 μm‘dan uzak olan lezyon extrafoveal, 1-199 μm uzaktaki juxtafoveal, FAZ merkezinin altında bulunan ise subfoveal lezyondur.
20 Diskiform Skar:
Retina veya RPE altındaki fibrozis sahalarıdır. Yaş tip YBMD’de, özellikle hemorajik formda son dönemde diskiform skar oluşur. FA’da eğer aktif KNV varsa skar dokusu ile birliktelik gösteren sızıntı ya da fibröz dokunun boyanması izlenir. Lezyonun kenarlarının keskin sınırlı oluşu ve geç FA fazlarında keskin, iyi belirlenen sınırlı difüz boyanma tipiktir.
Retinal Anjiomatöz Proliferasyon (RAP):
Yaş tip YBMD’nin bir başka tipidir. Retinal veya subretinal neovaskülarizasyon ile birlikte anormal retina damar kompleksi ile belirlenmiştir. YBMD hastalarının %10-15’inde tespit edilir, genellikle iki taraflı görülür ve prognozu kötüdür (47). YBMD’den farklı olarak daha yaşlı bireylerde gelişir. Retina ve koroid kaynaklı çift kan akımı nedeni ile tedaviye dirençli sızıntı ve PED birlikteliği sıktır. Yannuzzi ve ark. RAP gelişimini 3 evreye ayırarak tanımlamışlardır (48) ; Evre 1: Retina içi neovaskülarizasyon. Evre 2: Seröz PED ile retina altına uzanan neovaskülarizasyon ve retina içi damarlar arasında anastomoz gelişimi. Evre 3: Vaskülarize PED ile birlikte KNV gelişimi.
İdiopatik Polipoidal Koroidal Vaskülopati (PKV):
PKV, YBMD’de gelişen KNV’nin bir alt grubu olarak düşünülmektedir. Hemorajik PED’e benzer çok sayıda, tekrarlayan kan ve seröz sıvı içeren RPE dekolmanları ile karakterizedir. Kan ve seröz sıvı içeren RPE dekolmanları, genelde peripapiller, multifokal, turuncu renkte ve nodüler bir yapıya sahiptirler. Yanuzzi ve ark. yaptığı bir çalışmada yeni tanı almış 167 yaş tip YBMD hastasının 154 (% 92.2)’ünde KNV ve 13 (%7.8)’ünde PKV saptandığı bildirilmiştir (48). YBMD’den farklı olarak uzun dönem görme prognozu iyidir ve fibrotik skar oluşumu izlenmez. Genellikle tek taraflıdır ve erkeklerde daha sık görülür. Vitreus kanaması genelde YBMD’ye göre daha sık görülür ve YBMD’ye ait yumuşak drusen bu hastalarda bulunmaz.
21
YBMD’de Tanı Yöntemleri
Yaşa bağlı makula dejeneresansı tanısında en önemli basamak hastanın semptomları ve oftalmoskopik muayene bulgularıdır. YBMD için en spesifik semptom metamorfopsidir (50). Metamorfopsi, santral veya parasantral skotom, ani, nonspesifik merkezi görme azalması semptomlarından herhangi biri mevcut olan hastalarda YBMD’den şüphelenilmelidir. Direkt ve/veya indirekt oftalmoskopi ile saptanan bulgular ise; gri-yeşil renkte subretinal lezyon, subretinal sıvı ve/veya hemoraji, kistik retinal ödem, RPE elevasyonu ve diskiform skar oluşumu ile karakterizedir.
YBMD tanısında en sık kullanılan görüntüleme yöntemleri: - Fundus Flöresein Anjiografisi (FA)
- İndosiyanin Yeşili Anjiografisi (İSYA) - Optik Koherens Tomografisi (OKT)
22 Fundus Flöresein Anjiografi (FA): Fundus flöresein anjiografi, YBMD tanısında altın standarttır. KNV’nin varlığını tespit etmek, boyutunu, yerleşimini, bileşenlerinin içeriğini değerlendirmek, tedavi endikasyonu olup olmadığına ve eğer endikasyon varsa hangi tedavinin uygun olduğuna karar vermek için büyük öneme sahiptir (51).
İndosiyanin yeşili anjiografi (İSYA): İSYA, koroid dolaşımını gösterir. FA’da sınırları tam belirlenemeyen okült KNV ve PED’in sınırlarının belirlenmesinde kullanılır. Hemoraji, seröz eksudasyon, pigment epitel atrofisi ve hiperplazisi gibi birçok faktör, FA’da KNV’ye ait yeni oluşmuş damar yapılarını gizleyebilir. Bu tür gizli KNV’ler, İSYA’nın erken fazında anormal damar yapıları olarak görülmektedir (52).
Optik Koherens Tomografisi (OKT): Optik koherens tomografi, infrarede yakın spektrumdaki (810 nm) diyod laser ışını kullanır (53). Retina tabakalarının çoğu infrarede yakın ışığa geçirgen olduğu için lazer ışını RPE ve koryokapillarise kadar nörosensoryal retina boyunca geçer. OKT her noktada ölçülen yıkıcı interferans miktarı retina kalınlığı ölçümüne çevrilir ve retina çapraz kesiti grafik olarak, renklendirme yapılarak gösterilir. Göze temas etmeden çekilebilmesi, invaziv olmayışı, yüksek tekrarlanabilirlik özelliğinin bulunması ve retina morfolojisi hakkında doğrudan bilgi verebilmesi önemli avantajlarıdır. Retina hakkında ayrıntılı morfolojik değerlendirme sağlamasının yanında, retina ve retina sinir lifi tabakası kalınlık ölçümü gibi kantitatif analizler yapılabilmesine de olanak sağlar (54).
YBMD’de Tedavi:
Kuru tip YBMD, yaş tip YBMD’ den daha sık görülür. Oksidatif hasarın YBMD’nin patogenezinde rolü olduğu öne sürüldüğünden, erken evredeki YBMD olgularının ileri evreye ilerleyişini durdurmada antioksidanların rolü olabileceği düşünülmüştür. AREDS (Age-Related Eye Disease Study Research Group) grubunun 2001 yılında çıkan raporunda günlük alınan A, E ve C vitaminleri ile çinkonun bu olgulardaki ilerleme riskini azalttığı gözlenmiştir (55).
23 Yaş tip YBMD tedavisinde ise günümüzde gittikçe artan tedavi seçeneklerine karşın, henüz hastalığın tam tedavisi bulunamamıştır. Günümüzdeki en önemli tedavi yöntemi AntiVEGF antikorlardır. Günümüzde pek kullanılmayan veya nadiren tercih edilen diğer tedavi yöntemleri ise fotodinamik tedavi (FDT), submaküler cerrahi, intravitreal triamsinolon, anekortav asetat, rheopheresis ve laser fotokoagülasyondur (56, 57).
VİTREUS
Vitreus Anatomisi:
Vitreus lens ile retina arasındaki boşluğu dolduran, göz hacminin yaklaşık %80’ini oluşturan optik olarak şeffaf, yarı katı jel formunda bir yapıdır. Vitreusun erişkin insan gözünde ortalama ağırlığı 4 gram olup yaklaşık 4 ml yer işgal eder. Kesin ağırlık ve volüm ise yaş ve gözün boyutlarıyla değişir. Vitreusun ortalama aksiyel uzunluğu ise 16.5 mm’dir (58). Vitreus jeli önde lens arka yüzü, zonüller, silyer cisim, pars plana, arkada ise retina iç limitan membranı ve optik disk ile temastadır. Gözün pek çok yapısı ile temasta olduğu için birçok göz hastalığında birincil veya ikincil olarak etkilenmektedir.
Vitreus yapısı santral (kor) ve kortikal olmak üzere iki bölgeye ayrılabilir. Vitreus saydam olmasına rağmen homojen değildir. Kortikal vitreus nispeten daha sıkı ve fibriler bir yapıya sahiptir. Yoğun hyalosit ve fibrosit gibi bağ doku hücrelerini içeren kortikal vitreus, hacmin %2’sini oluşturmakla birlikte vitreusun metabolik olarak aktif merkezidir. Vitreus korteksi vitreus tabanından öne ve arkaya doğru uzanarak ön ve arka vitreus korteksini oluşturur. Vitreusun büyük kısmını kaplayan santral vitreus ise daha çok hücreden yoksun kollajen, hyaluronik asid ve asılı bulunan su molekülleri karışımı olup yaş, refraksiyon ve gözün durumuna göre jel ya da sıvı halde bulunabilir (59).
24 Vitreus Biyokimyası ve Yapı İskeleti:
Vitreus saydam, jel kıvamında ve heterojen viskoelastik ekstraselüler matriks yapısında olup su içeriği yaklaşık %98’dir. Karanlık alan mikroskopisinin verdiği bilgiler doğrultusunda morfolojik olarak arkadan öne uzanan ve vitreus tabanına yapışan liflerden oluşur. Arka yüzünde peripapiller ve premaküler deliklerin olduğu gösterilmiştir (60). Biyokimyasal olarak vitreusun yapı taşları glikozaminoglikanlar, kollajenler ve optisin, fibrillin gibi kollajen olmayan yapısal proteinlerdir. Hyaluronik asit (hyaluronan), kondroitin sülfat ve heparan sülfat proteoglikanlar vitreus glikozaminoglikanlarını oluşturmaktadır. Hyaluronan vitreus yapısındaki en önemli makromoleküllerden bir tanesidir. Birbirine 1-4 bağları ile bağlı tekrarlayan disakkarit ünitelerinden oluşan polimer yapısındadır (61). Vitreusun diğer bir önemli yapı taşı da kollajendir. Vitreus yapısında kollajen tip II, hibrid tip V/XI ve tip IX; %75:10:15 oranında bulunur. Kollajen tip II’nin vitreusun yanı sıra kıkırdak yapısında da en fazla oranda bulunan kollajen olması kollajen metabolizma defektlerinde vitreus patolojilerine eşlik eden eklem bulgularnı açıklar. Kollajenler fibriler yapıda organize olmuşlardır. Tip V/XI merkezde yer alırken, tip II onun etrafında ve tip IX ise yüzeyde yerleşim gösterir (62).
Önceleri Balazs tarafından öne sürülen ve sonra Mayne tarafından desteklenen model vitreus yapısını arasına hyaluronan molekülleri serpiştirilmiş kollajen ağ olarak tarifler (63). Bu modelde kollajen fibriller ana iskelet ağı oluştururken, hidrofilik hyaluronan molekülleri ise bu yapının hacim kazanmasından sorumludur. Comper ve Laurent negatif yüklü hyaluronan ile pozitif yüklü kollajen arasında elektrostatik bağlanmanın söz konusu olduğunu ileri sürmüşlerdir. Teorik olarak eğer bu yapıdan kollajen uzaklaştırılırsa geriye kalan hyaluronan visköz bir solüsyon halini alacak, eğer hyaluronan uzaklaştırılırsa kollajen ağ büzüşecek ancak yok olmayacaktır. Ayrıca yapılan çalışmalar tip IX kollajen üzerindeki kondroitin sülfat zincirlerinin bitişik kollajen fibrilleri arasında köprü vazifesi görerek birbirlerine yapışmayı engellediğini ve bu sayede vitreusun saydamlığını sağladığını göstermektedir (64).
25 Vitreus Korteksi:
Vitreus korteksi ön ve arka olmak üzere iki bölümde incelenir. Ön hylaoid yüz olarak bilinen ön vitreus korteksi ora serratanın 1.5 mm önünden başlar. Bu yüzeyde kollajen lifler yoğun olarak bulunur. Posterios vitreus korteksi 100-110 mm kalınlığındadır ve yoğun olarak sıkıştırılmış ve retinaya tanjansiyel dizayn edilmiş tip 2 kollajen fibriller içerir. Optik diskin hemen önünde korteks kaybolur ve makula ortasında çok ince bir yapı gösterir.
Vitreoretinal Ara Yüzey:
En yüksek konsantrasyonda kollajen liflerini içeren kortikal vitreus ince (100-300 µm) bir tabaka şeklinde santral vitreusu sarmaktadır. Ön korteks, ön vitreus tabanından lensin arka yüzüne doğru uzanır ve ön hyaloid olarak adlandırılır. Bu bölge aköz sıvı ile indirekt bir temasta olduğu için bazı moleküller vitreus içerisinden aköz sıvıya difüze olabilirler. Arka korteks ise retina üzerinden uzanım göstererek ILM’ye yapışır. Posterior vitreusla retina arasında direkt ilişki olmamasına karşın, posterior vitreus korteksi gerçekte retinanın iç limitan membranına (ILM) yapışıktır. Retina bazal laminası ILM’yi oluşturan Müller hücrelerinin temel membranını oluşturur. ILM ultrastrüktürel olarak üç tabakadan oluşur. Müller hücrelerinin ayaklarının hemen yanında lamina rara interna bulunur. Lamina rara eksterna vitreus korteksi ile devam eder. Bu iki tabaka arasında ise lamina densa bulunur. Kortikal vitreusun kollajen lifleri lamina rara eksternaya teğet uzanır. ILM primer olarak tip 4 kollajenden oluşur ancak fibronektin, laminin ve tip 1 kollajen içerir. ILM morfolojisi topografik olarak farklılık içerir; ILM’nin lamina densa tabakası retina periferinde incedir ve posterior retinada kalınlaşarak irregüler bir hal alır. ILM kalınlığı vitreus tabanında 50 nm iken ekvatorda 300 nm, posterior retinada ise 1900 nm’ye kadar artar. Foveada ise ILM 10-20 nm arasındadır. Daha önceleri vitreustaki kollajen fibrillerinin ILM’ye inserte olduklarına inanılırken günümüzde her iki kompartman arasında bir nevi tutkal görevi gören bir ekstrasellüler matriks dokusu olduğu bilinmektedir (65). Vitreoretinal ara yüzeyde kortikal vitreus ILM’ye laminin,
26 fibronektin, kondroitin, heparan sülfat proteoglikanları ve diğer ekstrasellüler matriks komponentleri ile yapışmaktadır. Bunların dışında bu alanda bazı kollajen moleküllerinin de olduğu gösterilmiştir. Ön vitreoretinal ara yüzeyde tip II kollajenle oluşturulmuş güçlü vitreoretinal adezyonlar vardır ve bunlar yaşla birlikte arkaya doğru uzanım gösterirler (66). Bu kompartmanlardaki moleküler doku komponentlerinin kompozisyon ve organizasyonundaki değişiklikler neovaskülarizasyon proçesini etkileyebilmektedir. Koroidal neovaskülarizasyonda (KNV) yeni damarlar Bruch membranı ve çevresinden doğarken, diyabetik retinopatili olgularda yeni damarlar ILM ve çervresinden gelişmektedir.
Vitreusun en sıkı bağlandığı yerler vitre tabanı, disk, makula ve retinal kan damarları olarak bilinir. Foos, ekvatoryal retina ve bazal retinada, Müller hücreleri sitoplazması ve ILM arasında adezyon plakları saptamıştır (67). Vitreus fibrilleri tarafından oluşturulan vitreus traksiyonu bu adezyonlara katkıda bulunabilir. Bu adezyon plakları ILM’nin en ince olduğu fovea hariç ekvator arkasında bulunmamaktadır. Foveadaki bu anatomik varyasyonun vitreomakular traksiyon sendromunun patogenezinde rol oynadığı düşünülmektedir. ILM aynı zamanda ana kan damarları üzerinde de incelmektedir. Bu durum arteryel pulsasyonu azaltıp fizyolojik olarak şok absorbsyonu sağlamaktadır.
Vitreus diğer bağ dokusu yapılarına göre daha az hücre içerir. Bu hücreler vitreus hücreleri, vitreus korteksi hücreleri, vitreosit veya hyalosit gibi isimlerle anılmakta olup arka kortikal vitreusun ince tabakasında gömülü halde bulunur. Morfolojik olarak en büyük kısmı hyalositlerdir. Hyalositler en fazla vitreus tabanında, ikinci sırada arka kutupta, en az ise ekvatorda görülür. Hyalositler retina üzerinde 10-15 mikron çapta oval veya yassı iğ şeklinde hücreler şeklinde bulunurlar. Vitreus tabanında ise bu hücreler daha geniş yuvarlak ve belirgin nükleuslu yıldızsı hücrelerdir. Bu hücreler çok sayıda lizozomal granülleri, fagozomları ve golgi kompleksleri ile metabolik olarak aktiftir. Hyalositler vitreus hyaluronan ve heksozamin gibi vitreus glikozaminoglikanları sentezlerler. Newsome ve arkadaşları tarafından kollajen sentezledikleri gösterilmiştir (68). Hyalositlerin hayatın bazı dönemlerinde vitreusta kollajen sentezinden sorumlu olabileceği düşünülmektedir. Fagositik açıdan aktiflerdir, hücre yüzey reseptörleri mevcuttur, Ig G ve kompleman bağlar, migratuvar ve mitojenik aktivitede ilk ortaya çıkan hücreler olması nedeniyle özellikle proliferatif vitreopatide rol alabileceği düşünülmektedir. Bu yüzden
27 premaküler membranlar başta olmak üzere vitreoretinal ara yüzeydeki tüm proliferatif hastalıkların patofizyolojisi değerlendirildiğinde, bu hücrelerin rolü hesaba katılmalıdır (69).
Vitreusta Yaşa Bağlı Gelişen Değişiklikler:
Yaşam boyunca vitreusta önemli değişiklikler gözlenir. Dördüncü dekaddan sonra jel vitreus volümünde belirgin düşme ve likefiye vitreus volümünde artış olur. Vitreus için yaşlanma sürecinin temeli likefaksiyondur. Vitreus jelinin likefaksiyonu, sinerezisi ile beraber anılır. Likefaksiyon, vitreusun sıvılaşmasıdır. Vitreustaki kollajen fibrilleri demetler halinde çökerek hyalüronik asit molleküllerinin komşu bölgelerde göllenmesine yol açar. Yaşın ilerlemesi ile kollajen çaprazlaşması artar, kollajen liflerini çevreleyen glikoprotein ve proteoglikanlarda yapısal değişiklikler oluşur. Yaşlandıkça sıvılaşmış vitreus oranı artar ve kollajen lifleri daha kalın demetler oluşturur. Vitreusta kollajenin ve hyalüronik asitin bu şekilde ayrılması kendine özgü mükemmel homojen ağsı yapıyı bozar. Bir taraftan sıvılaşan vitreus içeriğinin artışı (likefaksiyon), diğer taraftan çöken vitreus içeriğinin artışı (sinerezis) yapıyı iyice bozarak arka vitreus dekolmanına zemin hazırlar. Yaş ilerledikçe jel/likit oranı düşer. 90 yaşına gelindiğinde vitreus volümünün yarıdan fazlası likefiyedir (70).
Gençlik yaşları boyunca arka vitreus ile ILM arasındaki bağlar vitreus tabanı ve arka kutupta sıkıdır. Yaşla beraber vitreoretinal bölgedeki biyokimyasal değişikliklere bağlı olarak bu adezyonlar zayıflar. Lektin probu kullanılarak yapılan çalışmalarda ekstrasellüler matriksteki bir komponentin (galaktoz B (1,3) - N-asetil glukozamine), gençlerde bulunduğu ancak ileri yaşlarda gösterilemediği bulunmuştur (71). Bu farklılıkların vitreoretinal adezyondaki yaşa bağlı değişikliklerden sorumlu olduğu düşünülmektedir. Elektron mikroskobisi ile yapılan çalışmalarda ekvatoryel ve preekvatoryel ILM incelendiği zaman tip IV kollajende anormal bir seyir izlenmekte, vitreus korteksi içerisine girdiği görülmektedir. Ayrıca tip II kollajenin ILM içerisine penetre olduğu izlenmektedir. Bu durumun yara iyileşme cevabını aktive edebileceği ve posterior vitreus dekolmanı vakalarında patolojik vitreus ayrılmasına yol açabileceği düşünülmektedir (72).
28 Vitreusun Görüntülenmesi
Ultrasonografi: Oftalmolojide kullanılan ultrasonun dalga boyu genellikle 8-10 mHz civarındadır. Posterior vitreus korteksi en kalın yerinde 100 µm kalınlığında olduğu için şu anda mevcut ultrasonografik yöntemlerle görüntüleme mümkün olmamaktadır. Posterior vitreus dekolmanı ultrasonografi ile görülebilir ancak çözünürlüğü çok yüksek olmadığı için kesin tanı koymak mümkün değildir (73). Yakın zamanda görüntü kalitesindeki iyileşmeler ve gerçek zamanlı görüntüleme USG uygulamasını çok kullanışlı hale getirmiştir. Arka hyaloidin tanımlanması ve hareketi gibi değişikliklerin görüntülenmesi günümüzde ortam opasitesi olmayan hastalarda bile mümkündür. Bu şeffaf vitreusun optik olarak değerlendirilmesi normalde oldukça zordur ancak kısa bir eğitimle ultrasonografik olarak kolayca değerlendirilebilir. Klinik olarak arka hyaloidin durumu makuler hol, traksiyonel dekolman ve tam veya parsiyel vitreus dekolmanı gibi çeşitli vitreoretinal hastalıklarda önemlidir (74).
Optik Koherens Tomografi (OKT): OKT’nin oftalmoloji alanında kullanımının temeli laser interferometre ile gözün uzunluğunun ölçümüne dayanmaktadır. İlk kullanıma sunulan OKT teknolojisi time-domain OKT olarak bilinmektedir. Bugün kullanımda olan OKT ise ‘spectral domain OKT olarak isimlendirilmektedir. En karakteristik özelliklerden biri görüntü elde etme hızının 40000 aksiyel görüntü/sn’ye çıkmış olmasıdır. Diğer özellikler ise görüntü kalitesinin artırılması için çok sayıda görüntünün ortalaması alınmakta ve göz hareketleri gerçek zamanlı olarak takip edilebilmektedir. Göz hareketleri takip sistemi ile aynı bölgeden alınan görüntülerin ortalaması elde edilmekte ve sonraki kontrollerde yine aynı bölgeden görüntü alınarak güvenilirlik artmaktadır (75). Spektral domain OKT cihazlarının bir başka önemli özelliği 3 boyutlu (3D) görüntüleme sağlamalarıdır. Standart B scan görüntülere ilave olarak C-scan (en face) görüntüler sağlanmaktadır. Ayrıca ILM, sinir lifi tabakası, iç/dış fotoreseptör bileşkesi ve retina pigment epitelinin segmentasyonun değerlendirilmesi spektral domain OKT’ lerin bir başka özelliğidir (75).
29 Posterior Vitreus Dekolmanı (PVD):
PVD vitreus gövdesindeki likefaksiyona bağlı olarak vitreus korteksi ile ILM arasındaki bağlantıların zayıflamasıyla oluşur. Vitreustaki en sık görülen yaşa bağlı değişiklik olup lokalize, parsiyel ya da total (vitreus tabanının arka sınırına kadar) olabilir (76). Vitreus korteksi/ILM arasındaki adezyonun zayıflaması sıvılaşmış vitreusun retrokortikal aralığa prepapiller delik ve belkide premakuler vitreus korteksi yoluyla geçmesine neden olur. PVD’nin komplikasyonsuz olarak gelişebilmesi için vitreus likefiye olurken aynı anda vitreoretinal adezyonların zayıflaması gereklidir (77). PVD insidansı yaşla birlikte artmaktadır. Otopsi çalışmaları 50 yaşın üstündeki olgularda PVD oranının % 50, 65 yaşında ise % 75 oranında olduğunu gösterilmiştir (78, 79). Weber ve Krause’nin 65-90 yaş grubu arasındaki 703 hastaya yaptıkları çalışmada 65-69 yaşları arasında komplet PVD (parsiyel PVD oranı) oranı % 11 (% 17), 70-79 yaşları arasında % 35 (% 9), 80-89 yaşları arasında % 46 (% 11), 90 yaş üstü % 49 (% 17) oranında saptanmıştır. Her yıl PVD gelişim insidans artış oranı % 1,3-1,6 olarak kabul edilmiştir. Emetrop ve hipermetrop gözlere nazaran myopik gözlerde 10 yıl daha erken PVD oluştuğu ve daha yaygın olduğu gösterilmiştir. Bir çalışmada biri hariç 103 myopik gözün (-6.00 den daha fazla ) hepsinde PVD geliştiği gözlenmiştir (80). PVD riskini arttıran diğer faktörler arasında afaki veya psödofaki, göze travma öyküsü ve intraoküler inflamasyon öyküsü bulunmaktadır. Kadınlar postmenopozal östrojen seviyesinin azalmasına bağlı olarak hyalüronik asit sentezindeki azalmaya sekonder daha erken yaşta PVD gelişmesine yatkındırlar (81).
Vitreus dekolmanı tipik olarak posterior vitreus korteksi ve retinanın ILM tabakası arasında ayrılmaya neden olsa da klinik ve elektron mikroskobik veriler özellikle gençlerde ve patolojik durumlarda her zaman böyle gerçekleşmediğini göstermektedir. Multilaminer bir yapıya sahip olan vitreoretinal yüzeyde kortikal lifler ILM tabakasına girintiler yapmaktadır. Bu girintiler özellikle taban ve fovea gibi ILM’nin ince olduğu bölgelerde daha sıkıdır. Otopsi serilerinde spontan PVD oluşmuş gözlerde foveal bölgede kortikal vitreus bakiyelerine rastlanmıştır (82).
30 Semptomlar:
Floaters (uçuşan cisimler) PVD olan hastaların en sık yakınmasıdır. Kişiler, sinekler veya örümcek ağı gördüklerinden yakınırlar. Bunlar genellikle likefiye vitreustaki kollajen fibrilleri ve epipapiller kaynaklı glial dokunun (posterior vitreus korteksine yapışık olan ) retina üzerinde gölge oluşturması nedeniyle görülmektedir. Floaters özellikle açık renkli yüzeylerin üzerinde, örneğin parlak mavi gökyüzü ya da beyaz bir sayfa üzerinde kitap okurken veya beyaz bir duvara bakıldığında belirginleşir. Posterior vitreus korteksindeki yoğun kollajen fibriller nedeniyle glare (kamaşma) görülebilir. Akut PVD nedeniyle gelişen floaters ile birlikte vitreus hemorajisi eşlik edebilir.
Biomikroskopik incelemede posterior vitreus retinadan ayrıldığında bazen klinik olarak prepapiller vitreus korteksinde bir delik görülebilir. Patognomonik olan bu bulgu Voght ya da Weiss halkası olarak adlandırılır. Weiss halkası, posterior vitreus dekolmanı esnasında prepapiller glial dokunun yırtılması ile ve prepapiller delik bölgesinde, vitreus korteksine yapışık kalmışsa görülebilmektedir. İnkomplet vitreus dekolmanı olan olgularda fokal kondansasyonlara bağlı gelişen mekanik traksiyon etkisiyle vitreusda büzüşme ve vitreomaküler traksiyon (VMT) gelişebilir. Bu hastalarda değişen düzeylerde görme keskinliğinde azalma ve metamorfopsi gelişebilir.
Patofizyoloji:
Vitreus su, inorganik tuzlar, askorbik asit ve iki büyük makromolekül olan kollajen ve glikozaminoglikanlardan (özellikle de hyaluronan) oluşmaktadır. Yukarıda da bahsedildiği gibi vitreus jel yapısı, uzun kollajen fibrillerden oluşan çatının, bu çatının stabilize olmasını sağlayan hyaluronik asit ile yayılımı ile oluşur. Posterior vitreus retinaya en sıkı bağlandığı bölgelerde ILM en incedir. Vitreus tabanı, optik sinir, kristalin lense bağlı Weiger ligamanın olduğu bölge, foveola, geniş retinal damarlar ve anormal sıkı vitreoretinal yapışıklıkların olduğu lattice sınırları ve koryoretinal skarlar posterior vitreus korteksinin retinaya sıkı yapıştığı bölgelerdir (83). Posterior hyaloidin önceden ILM’na direkt bağlandığı düşünülürken, yukarıda
31 da bahsedildiği gibi günümüzde yapılan çalışmalarda bu iki yapı arasında moleküler tutkal görevi gören fibronektin, laminin ve ara yüzeyde bulunan sülfatlanmış proteoglikanlar gösterilmiştir.
Resim 4. Total PVD’si olan bir olgunun A ve B scan USG görüntüsü
PVD ile birliktelik gösteren üç ana faktör; likefaksiyon, vitreoretinal adezyonlarda zayıflama ve vitreusun büzüşmesidir. Vitreusun likefaksiyonu veya diğer adıyla sinkizis vitreusta en sık görülen dejeneratif değişikliktir ve sıklıkla yaşla birlikte artar. Vitreus jel hacminde 45-50 yaşlarda belirgin azalma, vitreus sıvı hacminde ise belirgin artma meydana gelir. Sıvılaşmanın makulanın önündeki santral vitreusta başladığı tespit edilmiştir (84). Otopsi çalışmalarında 4 yaşındaki çocukların gözlerinde vitreus sıvılaşmasının başladığı tespit edilmiş, 14-18 yaşlarında total vitreus volümünün % 20’sinin sıvı form aldığı bulunmuştur (83). Postmortem çalışmalarda 40 yaşından sonra vitreus jelinin azalmasına karşılık sabit bir oranda sıvı vitreusta artış olduğu gösterilmiştir (83). 80-90 yaşlarında vitreus jelinin yarısından fazlası sıvıdır. Diabetes mellituslu olgularda da glukozun kollajen fibrillerine bağlanarak anormal kollajen çapraz bağlar oluşturması ve kollajen fibrillerinin agregasyonu nedeniyle hyalüronan konformasyonunun bozulması sonucu vitreusun likefiye olabileceği tespit edilmiştir (85).
32
Senil PVD komplikasyonları:
Erken evre PVD:
- Epiretinal membran - İdiopatik makuler hole - Vitreofoveal traksiyon
- Vitreomakuler traksiyon sendromu - Traksiyonel diyabetik makula ödemi - Myopik traksiyonel makulopati - Yaşa bağlı makula dejeneresansı - Vitreopapiller traksiyon sendromu İleri evre PVD:
- Retina veya optik sinir hemorajisi - Vitreus hemorajisi
- Retina yırtığı
- Regmatojen retina dekolmanı
Vitreus likefaksiyonuna ek olarak PVD gelişimindeki ikinci kritik basamak yaşa bağlı olarak posterior vitreus korteksiyle ILM arasındaki adezyonların progresif olarak zayıflamasıdır. Vitreus yapışıklıklarında zayıflama mekanizması açık değildir. Yapılan çalışmalarda, posterior vitreus korteksinde bulunan hyalositler ve ILM kalınlığı ile birlikte ekstraselüler matriks değişikliklerinin vitreus yapışıklıkları üzerinde etkisinin olabileceği düşünülmektedir (65). Arka vitreus korteksi ve ILM arasındaki yapışıklığın ayrılmasıyla sıvı vitreusun peripapiller delik veya makula önündeki vitreus korteksi yoluyla retrokortikal boşluğa geçişi olmaktadır. Göz hareketleri sırasında sıvı vitreus, vitreus korteksi ile ILM birbirinden ayrılır ve gerçek PVD oluşur. Santral vitreustan preretinal boşluğa geçen hacim değişikliği vitreusun çökmesine neden olur.
33 Şekil 3. Vitreus likefaksiyonu ve posterior vitreus dekolmanı (Goff MM, Bishop PN.Adult vitreous structure and postnatal changes. Eye (2008) 22, 1214–1222. Referans alınarak yeniden çizilmiştir).
PVD tipik olarak tek superior perifoveal kadrandan başlamaktadır. Vitreoretinal ILM bağlantısı fovea ve optik sinirde diğer alanlar dekole olana kadar devam eder. Foveal bağlantı ayrıldıktan sonra en son optik sinir başından ayrılır ve subhyaloid sıvı vitreus tabanına kadar ilerleyerek komplet PVD’yi oluşturur (Şekil 4). Dördüncü dekatta bazı olgularda PVD, lokalize veya inkomplet olarak başlar fakat yıllar boyu asemptomatik kalıp yavaşça ilerleyebilir. Bugun için en sık kullanılan PVD sınıflandırması Uchino ve arkadaşları tarafından yapılan sınıflandırmadır (83). Senil PVD sınıflandırılması:
Evre 1: Üç kadranda başlayan inkomplet perifoveal PVD.
Evre 2: İnkomplet PVD tüm kadranlara dağılır ve fovea ve optik disk dışındaki tüm alanlarda arka hyaloid dekoledir.
Evre 3: Optik diske reziduel bağlantısı olan inkomplet PVD tüm arka polde dekoledir, sadece optik disk ile bağlantısı bulunmaktadır.
Evre 4: Komplet PVD.
34 Şekil 4. A.Evre 1 PVD B. Evre 2 PVD C.Evre 3 PVD D.Evre 4 PVD (Uchino E, Uernura A, Ohnba N. Initial stages of posterior vitreous detachment in healthy eyes of older persons evaluated byoptical coherence tomography. Arch Ophthalmol 2001; 119(10):1475-9. Referans alınarak yeniden çizilmiştir.)
Anormal Posterior Vitreus Dekolmanı:
Vitreus likefaksiyonu ile oluşan çekinti kuvvetinin vitreoretinal adezyondan fazla olması durumunda traksiyon tüm yüzeye yayılarak anormal PVD gelişimine neden olmaktadır. Bu kuvvet dengesizliğinin birçok nedeni vardır. Marfan, Ehler-Danlos ve Sticker sendromu gibi genetik kollajen metabolizma hastalıklarında anormal PVD insidansı daha yüksektir (86). Anormal PVD gelişimi sırasında uygulanan kuvvet posterior korteksin bölünmesiyle sonuçlanan vitreoskizise yol açabilmektedir. Bu fenomen periferik retinada gelişirse, traksiyonel kuvvetler retina yırtığı ve dekolmanı riskini arttırmaktadır. Makulaya yakın bölgede gelişirse, nörosensöryal retinada traksiyona bağlı makuler pucker gelişimini indükleyebilir (78). Bu patoloji aynı zamanda selofan makulopati, epiretinal membran (ERM), vitreomaküler traksiyon (VMT) sendromu olarak da adlandırılmaktadır. Vitreoskizis, optik disk çevresinde
35 gelişirse, vitreopapiller traksiyon diskte neovaskülarizasyon riskini arttırmaktadır. Yatkın bireylerde proliferatif vitreoretinopati riskini arttırmaktadır.
Anormal PVD ile YBMD ilişkisi retinal yırtık ve dekolman, makular hole ve makular pucker, ileri proliferatif vitreoretinopati gibi hastalıklardaki patogenetik mekanizmalara benzemektedir. İnatçı vitreomakular adezyonlar makuler bölgede düşük evreli inflamasyona neden olur. İnflamasyonun YBMD’nin tüm evrelerinde etkili olduğu bilinen bir durumdur (84). Vitreomakular yüzeyde anormal bir doku varlığında posterior vitredeki yapışıklıklar oksijen ve besin transferini engellemektedir. Persistan vitreomakuler adezyonun düşük dereceli bir enflamasyona yol açtığı, makulaya oksijen ve besin transferini engellediği ve neovaskülarizasyon gelişimini tetikleyen proanjiojenik sitokinlerin (VEGF) üretimini tetkilediği ve bu sitokinlerin makulada VMA bölgelerinde hapsolduğu düşünülmektedir (84).
Günümüzde OKT cihazlarının gelişmesi ve vitreusun topografik olarak incelenmesiyle vitreus ve PVD hakkında birçok detaylı bilgi elde edinilmiştir. OKT ile yapılan incelemelerde parsiyel PVD’nin komplet PVD formuna geçişinin akut bir süreç olmadığını, PVD’nin erken aşamalarının perifoveal bölgede başladığını, kronik olarak aylar ve yıllar içinde parsiyel PVD’nin optik diskten ayrıldıktan sonra vitreus tabanına kadar yayılarak komplet PVD oluşumunun tamamlandığı gösterilmiştir. Parsiyel PVD’nin özellikle erken aşamalarında gelişen komplikasyonlarının birçok maküler hastalığın patogenezinde rol alması erken evre PVD’lerin daha detaylı incelenmesi gerekliliğini göstermiştir.
36
GEREÇ VE YÖNTEM
Çalışmaya yaşları 57 ila 85 arasında değişen 138 hastanın 206 gözü dahil edildi. Olgular 3 gruba ayrıldı, yaş tip YBMD’si olan 67 hastanın 98 gözü grup 1, kuru tip YBMD’si olan 36 hastanın 55 gözü grup 2 ve herhangi bir vitreoretinal hastalığı olmayan 35 hastanın 53 gözü grup 3’e dahil edildi. Hastaların her iki gözü de değerlendirildi ancak sadece dahil edilme kriterlerini karşılayan gözler çalışma kapsamına alındı. Geografik atrofi, drusen ve RPE değişimi olan gözler kuru tip YBMD grubuna, KNV, PED ve diskiform skar yaş tip YBMD grubuna dahil edildi. Çalışmaya dahil edilen yaş tip YBMD hastalarının takibi, enjeksiyon tedavisi kararı retina biriminde farklı hekimler tarafından verildi. Çalışma devam ederken kontrollerine uymayan/gelmeyen hastalar çalışmaya dahil edilmedi. Çalışmaya dahil edilen tüm hastalar (kuru, yaş tip YBMD ve kontrol grubu) takip süresince vitreoretinal ara yüzey değişiklikleri açısından iki hekim tarafından değerlendirildi. Kontrol grubu hastaları herhangi bir vitreoretinal hastalığı olmayan benzer yaş grubundaki hastalardan oluşmaktadır. Retina muayenesini engellemeyecek düzeyde kataraktı olan hastalar çalışmaya dahil edildi. Retina muayenesinde makular hole, enflamatuar hastalıklar, diyabetik retinopati, retina dekolmanı, sinkizis sintillans, vasküler oklüzyonlar, -3 / +3 değerlerinin üzerinde refraksiyon kusuru, KNV’ye neden olan diğer patolojik durumlar, inflamatuar oküler hastalıklar, retina dekolmanı ve önceden vitreoretinal cerrahi öyküsü olan gözler çalışma kapsamına alınmamıştır.
İncelenen Parametreler
Hastalar ilk muayeneden sonraki 6 ve 12. ayda tekrar görüldü. Bu vizitlerde en iyi düzeltilmiş görme keskinliği (EDGK) ve aplanasyon tonometresi ile göz içi basınçları tayin edildi, biomikroskopik bakı yapıldı. Pupilla dilatasyonu sağlanarak 90 D nonkontakt lens ile fundus muayenesi yapıldı. Fundus muayenesinde Weiss halkası varlığı araştırıldı. Makula ve vitreoretinal ara yüzey değişiklikleri açısından OKT tetkiki yapıldı. Akabinde PVD varlığını değerlendirmek için B-mod USG yapıldı. Bu muayeneler her vizitte tekrar edildi. Gerekli durumlarda Renkli Fundus Fotoğrafı, Fundus Floresein Anjiografi yapıldı.
37
Ultrasonografi (USG)
Ultrasonografik değerlendirme için Eye Cubed V4 (Ellex, Adelaide, Australia) cihazı kullanıldı. Dört farklı ultrasonik tanı modu olan bu cihazda 10 Mhz B-scan ile eş zamanlı A-scan modu ile vitreus değerlendirildi. Prob glob üzerinde horizontal-aksial düzlemde tutularak posterior vitreus dekolmanı varlığı değerlendirildi. İşlem sırasında posterior vitreusun hareketini belirlemek amacıyla hastadan gözünü sakkadik olarak sağa sola oynatması istendi. Ultrasonografi tetkikinde vitreus boşluğuna yayılan, sürekli, hafif ekodens, ondüler ve mobil membran retinaya hiçbir bölgede tutunmadığı zaman total PVD; ince, düz ve sürekli bir membranın olduğu ve makulanın tutulduğu duruma lokalize vitreus dekolmanına parsiyel PVD; ince, düz ve sürekli bir membranın olduğu ve makulanın tutulmadığı lokalize vitreus dekolmanına parsiyel PVD; posterior hyaloidin retina yüzeyinden hiç ayrılmadığı ya da farkedilmediği durumda ise PVD’ nin olmadığı kabul edildi.
Biomikroskopik olarak Weiss halkasının görülmesi ve B-mod USG’de gözün sakkadik hareketeri esnasında optik disk, fovea ve orta perifer retina ile bağlantısı olmayan hareket eden arka vitreusun görülmesi ile total PVD doğrulandı. PVD yönünden istatistiksel veriler B-mod USG’ye göre yapıldı.
Optik Koherens Tomografi (OKT)
OKT çekimleri 3D OCT- 2000 (Topcon, Tokyo, Japan) ile yapıldı. Bu tetkikte hem vitreus hem vitreoretinal ara yüzey değerlendirmesinde foveayı merkez kabul eden 6x6 mm’ lik ve 8x3 mm’ lik makula görüntüleri kullanıldı. OKT özellikle B-mod USG ile posterior vitreusun parsiyel olarak dekole olduğunu saptadığımız hastalarda vitreomakular adezyonların varlığını doğrulamada ve lokalizasyonunu göstermede yardımcı oldu. Arka hyaloidin fovea merkezine yapışık iken makula etrafındaki bölgeden ayrılması VMA olarak değerlendirilirken, adezyon bölgesinde lokalize distorsiyon ve deformasyon gelişmesi ve bu bölgedeki traksiyonel güçlerin etkisiyle retinanın bu bölgesinde açısal eğim oluşması ise vitreomakuler traksiyon VMT
38 olarak değerlendirildi (89). OKT ile total PVD % 8.6 oranda saptanabilmekte ve PVD hiç olmayan hastalarda % 29 oranında subjektif sonuç vermektedir (83). Ayrıca Evre 3 parsiyel PVD % 1.9 oranında saptanabilmektedir. Bu nedenle biz çalışmamızda PVD tanısında OKT’yi yardımcı test yöntemi olarak kullandık.
İstatistik Yöntemler
Çalışmada elde edilen verilerin istatiksel olarak incelenmesi SPSS (Statistical Package for Social Science, Worldwide Heaquarters SPSS Inc. Chicago, IL, USA) 16 Windows paket programı ile yapıldı. Çalışma verilerinin normal dağılıma uyup uymadığı Shapiro-Wilk testiyle değerlendirildi. Normal dağılıma uyan verilerden ikili grup karşılaştırmalarında t testi, çoklu grup karşılaştırmalarında ANOVA testi kullanıldı. Normal dağılıma uymayan verilerden grup içi karşılaştırmalarda Wilcoxon, gruplararası ikili karşılaştırmalarda Mann Whitney U testi, çoklu grup karşılaştırmalarında Kruskal Wallis testi kullanıldı. Niteliksel verilerin karşılaştırılmasında ise Ki-Kare testi kullanıldı. Anlamlılık düzeyi p < 0.05 düzeyinde değerlendirildi.
39
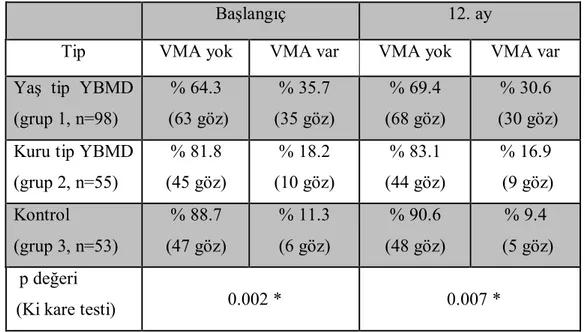
BULGULAR:
Ocak 2012’den itibaren EÜTF Göz Hastalıkları Anabilim Dalı’na başvuran hastanın ve yaşları 57 ila 85 arasında değişen 138 hastanın 206 gözü dahil edildi. Olgular 3 gruba ayrıldı, yaş tip YBMD’si olan 67 hastanın 98 gözü grup 1, kuru tip YBMD’si olan 36 hastanın 55 gözü grup 2 ve herhangi bir vitreoretinal hastalığı olmayan 35 hastanın 53 gözü grup 3’e dahil edildi. Takip sürecinde grup 2’deki 2 olguda yaş tip YBMD gelişmesi üzerine bu olguların 12.aydaki bulguları değerlendirmeye alınmadı.
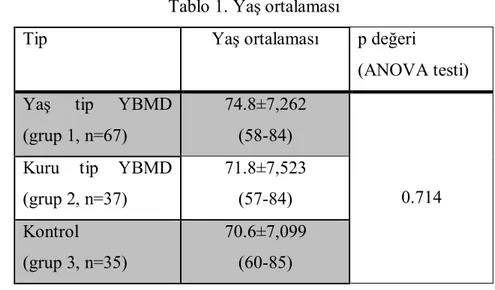
Hastalar arasında yaş ortalaması açısından anlamlı bir fark yoktu. Çalışmaya dahil edilen olguların yaş ortalaması 72.8±7.49’idi (57-85). Yaş tip YBMD’li hastalarda yaş ortalaması 74.8±7,262 (58-84) iken, kuru tip YBMD’li hastalarda 71.8±7,523 (57-84) ve kontrol grubunda 70.6±7,099 (60-85) idi (ANOVA testi, p=0.714) (Tablo 1).
Tablo 1. Yaş ortalaması
Tip Yaş ortalaması p değeri
(ANOVA testi) Yaş tip YBMD
(grup 1, n=67)
74.8±7,262 (58-84)
0.714 Kuru tip YBMD
(grup 2, n=37) 71.8±7,523 (57-84) Kontrol (grup 3, n=35) 70.6±7,099 (60-85)
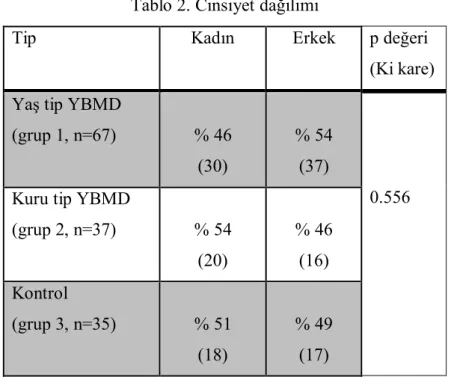
Yaş tip YBMD’si olan hastaların % 46’sı, kuru tip YBMD’si olan hastaların %54’ü ve kontrol grubundaki hastaların % 51’i kadın idi (Ki kare testi, p=0.556) (Tablo 2).
40 Tablo 2. Cinsiyet dağılımı
Tip Kadın Erkek p değeri
(Ki kare) Yaş tip YBMD
(grup 1, n=67) % 46 (30)
% 54 (37)
0.556 Kuru tip YBMD
(grup 2, n=37) % 54 (20) % 46 (16) Kontrol (grup 3, n=35) % 51 (18) % 49 (17)
Yaş tip YBMD’li hastaların % 20.9’sinde (14 olgu), kuru tip YBMD’li hastaların % 27.8’sinde (10 olgu) ve kontrol grubundaki hastaların % 22.9’sinde (8) hipertansiyon mevcut. idi (Ki kare testi, p=0731). Diyabet dağılımı ise yaş tip YBMD’li olgularda % 10.4 (7 olgu), kuru tip YBMD’li olgularda % 5.6 (2) ve kontrol grubundaki olgularda % 8.6 (3) olarak bulundu (Ki kare testi, p=0.702) (Tablo 3).
Tablo 3. Hipertansyon ve diyabet dağılımı Tip Hipertansiyon Diyabet Yaş tip YBMD
(grup 1, n=67) % 20.9 (14)
% 10.4 (7) Kuru tip YBMD
(grup 2, n=36) % 27.8 (10) % 5.6 (2) Kontrol (grup 3, n=35) % 22.9 (8) % 8.6 (3) p değeri