T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
OCRELİZUMAB TEDAVİSİ BAŞLANAN MULTİPL SKLEROZ TANILI HASTALARIN HEPATİT A, HEPATİT B, HEPATİT C VE HIV AÇISINDAN TARANMASI VE HEPATİT A, HEPATİT B, PNÖMOKOK VE TETANOZ AŞI YANITLARI VE TÜBERKÜLOZ PROFİLAKSİSİ AÇISINDAN RETROSPEKTİF
OLARAK DEĞERLENDİRİLMESİ
UZMANLIK TEZİ DR. CANSU BULUT AVŞAR
TEZ DANIŞMANI
PROF. DR. HÜSNÜ PULLUKÇU
İZMİR 2020
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
OCRELİZUMAB TEDAVİSİ BAŞLANAN MULTİPL SKLEROZ TANILI HASTALARIN HEPATİT A, HEPATİT B, HEPATİT C VE HIV AÇISINDAN TARANMASI VE HEPATİT A, HEPATİT B, PNÖMOKOK VE TETANOZ AŞI YANITLARI VE TÜBERKÜLOZ PROFİLAKSİSİ AÇISINDAN RETROSPEKTİF
OLARAK DEĞERLENDİRİLMESİ
UZMANLIK TEZİ DR. CANSU BULUT AVŞAR
TEZ DANIŞMANI
PROF. DR. HÜSNÜ PULLUKÇU
İZMİR 2020
ÖNSÖZ
Sadece tez yazım süresince değil, bütün çalışma hayatım boyunca her açıdan ilham kaynağı olan ve iyi bir hekim olma yolunda her daim desteğini hissettiğim tez danışmanım Prof. Dr. Hüsnü Pullukçu’ ya,
Tıp fakültesi lisans eğitimimden sonra araştırma görevlisi olarak hekimlik hayatıma devam ettiğim Ege Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı’ nda geçirdiğim beş yıllık bu süreçte bilgi, deneyim ve desteğini hiç esirgemeyen başta Anabilim Dalı Başkanı Sayın Prof. Dr. Sercan Ulusoy olmak üzere tüm değerli hocalarıma,
Çalışmamız süresince emekleri ve yardımları için Aşı polikliniği hemşiremiz Nurgül Sandıkçı’ya, Nöroloji Anabilim Dalı’ ndan Prof. Dr. Ayşe Nur Yüceyar ve Nöroloji MS Merkezi hemşiresi Meltem Baklan’a,
Bu zorlu süreçte tüm sorularıma sabırla cevap veren ve yardımını esirgemeyen Uzman Dr. Aytaç Erdem’e,
Başta Dr. Damla Akdağ, Dr. Dilşah Başkol olmak üzere uzmanlık eğitimim süresince beraber çalıştığım bütün asistan arkadaşlarıma ve bu süreçte hep yanımda olan canım arkadaşlarım Dr. Cemre Engin, Dr. Sadettin Dolar, Dr. Sedat Can Güney, Dt. Esin Efe Güney, Dr. Aysu Sinem Koç, Dr. Esra Bahcivan, Dr. Pınar Tezel, Dr. Müge Yılmaz’a,
Her koşulda yanımda olan annem, babam, kardeşim ve eşim Dr. Aytuğ Avşar’a,
Teşekkürlerimle..
Dr. Cansu BULUT AVŞAR
I İÇİNDEKİLER İÇİNDEKİLER……….. I ÖZET………...III ABSTRACT………...V TABLOLAR LİSTESİ………..VII ŞEKİLLER LİSTESİ………..VIII KISALTMALAR LİSTESİ………..IX 1.GİRİŞ……….1 2.GENEL BİLGİLER……….….2 2.1 Aşı Tarihçesi
2.1.1 Türkiye’ de Aşılama Tarihçesi
2.2 Aşı ile İlgili Temel Kavramlar ve Tanımlar 2.3 Bağışıklamayı Etkileyen Faktörler
2.4 Aşı Tipleri 2.4.1 Viral Aşılar
2.4.1.1 Attenüe (zayıflatılmış) canlı viral aşılar 2.4.1.2 İnaktive (ölü) viral aşılar
2.4.1.3 Subunit (alt birimli) viral aşılar 2.4.1.4 Rekombinan antijen aşıları 2.4.2 Bakteriyel aşılar
2.4.2.1 Tam hücreli bakteriyel aşılar 2.4.2.2 Toksoid aşılar
2.4.2.3 Subunit bakteri aşıları 2.4.3 Yeni Aşı Tipleri
2.4.3.1 Rekombinan vektör aşıları 2.4.3.2 Sentetik peptid aşılar 2.4.3.3 DNA aşıları
2.5 İmmun Yanıtın Bileşenleri 2.5.1 Kazanılmış İmmun Yanıt 2.5.2 Aşılama Sonrası İmmun Yanıt 2.6 Multipl Skleroz
2.6.1 Multipl Skleroz Tedavisinde Ocrelizumab ve Enfeksiyon İlişkili Komplikasyonlar
II
2.6.1.2 Hepatit B Reaktivasyonu
2.7 Multipl Skleroz ve Aşılama
2.7.1 Hepatit B Aşısı 2.7.2 Hepatit A aşısı 2.7.3 Pnömokok Aşısı 2.7.4 Tetanoz Aşısı
3. GEREÇ VE YÖNTEM………39
3.1 Çalışmaya alınma kriterleri 3.2 Çalışmaya alınmama kriterleri 3.3 Aşı Uygulamaları 3.4 Laboratuvar Testleri 3.5 Tüberküloz Reaktivasyonunun Değerlendirilmesi 3.6 İstatiksel Yöntemler 3.7 Etik Kurul Onayı 4. BULGULAR………44
5. TARTIŞMA……….…...57
6. SONUÇ VE ÖNERİLER……….……..69
7. KAYNAKLAR………70
III ÖZET
Amaç: Ocrelizumab tedavisi başlanmış olan multipl skleroz tanılı hastaların retrospektif
olarak aşı ile korunulabilen hastalıklar açısından aşılama öncesi taranması ve aşılama sonrası immun yanıtlarını değerlendirmektir. İkincil amaç ise immünsupresif tedavi alan hastaların aşılama programı ve latent enfeksiyonların reaktivasyonu hakkında hekimlerin algısını arttırmak, tedavi öncesi tarama ve aşı ile bağışıklama alışkanlığının kazandırılmasıdır.
Gereç ve Yöntem: Ocrelizumab güvenlik formu doldurulmak üzere 1 Şubat 2019 – 24 Mart
2020 tarihleri arasında Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Aşı Polikliniği’ne yönlendirilen hastaların HAV IgG, HBs, HBsAg, HBc IgG, HCV, Anti-HIV, Anti-VZV IgG, TDT ve akciğer grafisi sonuçları retrospektif olarak değerlendirilmiştir. Aşılama öncesi pnömokok ve tetanoz antikorları kaydedilmiştir. Tüm hastalara uygulanan aşılar kaydedilmiştir. Aşılaması tamamlanıp, birinci ayda Anti-HBs, pnömokok ve Td antikor düzeyleri ölçülmüş olan hastalar çalışmaya dahil edilerek, antikor düzeyleri kaydedilmiştir. TDT ≥ 15mm saptanan, akciğer grafisinde latent tüberküloz bulgusu saptanmayan ve 9 ay süreyle izoniazid profilaksisi amacıyla verem savaşa yönlendirilen hastalar retrospektif olarak incelenmiştir. Belirtilen hasta grubunun demografik verileri (yaş, cinsiyet), aşılama öncesi serolojik durumları, aşılama öncesi ve aşılama sonrası 1. ay antikor titrelerini içeren hasta takip formları doldurulmuştur. Aşılama tarihleri aşı polikliniğinde düzenlenen aşı kartlarından ve T.C Sağlık Bakanlığı aşı takip sistemi üzerinden kontrol edilmiştir.
Bulgular: Çalışma kapsamında değerlendirilen 73 hastanın aşılama öncesi yapılan serolojik tetkiklerinde HCV ve HIV açısından pozitiflik saptanmamış olup, 12 hastanın hepatit A açısından duyarlı olduğu görülmüştür. Dokuz hastanın iki doz aşılaması tamamlanmış ve aşılama sonrası Anti-HAV IgG gösterilmiştir. Tüberküloz reaktivasyonu açısından değerlendirilen 31 erkek (%44,9), 38 kadın (%55) toplamda 69 hastanın yaş ortalaması 49,59 ± 10,34 (min:26, maks:68) bulunmuştur. Bu hastaların TDT ölçümlerinin ortalaması 8,17 ± 7,11 mm (min:0 mm, maks:27 mm) olarak saptanmıştır. Yaşa veya cinsiyete göre TDT sonuçlarının dağılımında istatiksel olarak anlamlı farklılık saptanmamıştır. (sırasıyla p=0,934; p=0,443)Toplam 14 hasta dokuz ay süreyle izoniazid profilaksisi almıştır. Profilaksi alan ve almayan tüm hastalar dahil olmak üzere takip edilen 69 hastada ocrelizumab tedavisi altında tüberküloz reaktivasyonu izlenmemiştir. Çalışma kapsamında değerlendirilmiş olan 63 hastanın pnömokok antikoru pozitif saptanmıştır. Aşılama öncesi medyan pnömokok antikoru düzeyi 235 mg/L (min:27; maks:270 mg/L), aşılama sonrası medyan pnömokok antikor
IV
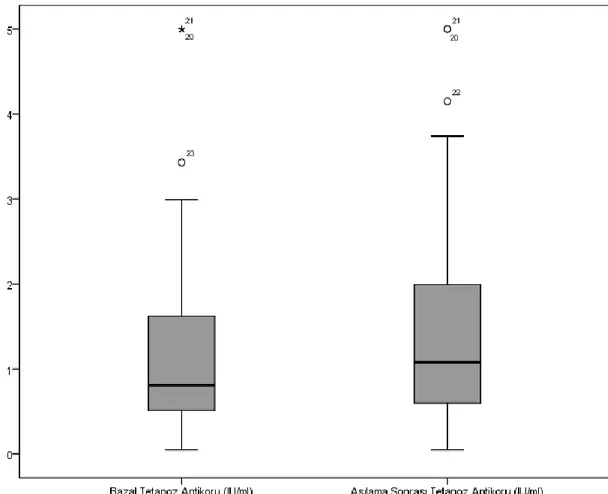
düzeyi 270 mg/L (min:49, maks:270 mg/L) olarak saptanmıştır. Aşılama ile pnömokok antikor düzeyinde istatiksel olarak anlamlı artış saptanmıştır (p=0,000). Yaşla birlikte aşılama sonrası antikor artışında azalma görülmüştür (r=-,180). Tetanoz açısından serolojik tetkikleri tamamlanan 39 hasta değerlendirilmiş ve aşılama sonrası antikor düzeyinde istatiksel olarak anlamlı artış gösterilmiştir. (p=0,000) Medyan bazal tetanoz antikoru düzeyi 0,81 IU/ml (min:0,05; maks:5) ve aşılama sonrası medyan antikor düzeyi 1,08 IU/ml (min:0,05; maks:5) saptanmıştır. HBV reaktivasyonu açısından profilaksi almayan anti-HBc IgG pozitifliği olan 10 hastada izlemde reaktivasyon bulgusu saptanmamıştır. Üç doz aşı şemasını tamamlayan 45 hastada anti-HBs oluşumu sadece beş hastada (%11,1) görülmüştür.
Sonuç: Çalışmamız sonucunda bu hasta grubunda pnömokok, tetanoz ve hepatit A aşılarının
etkinliği gösterilmiş olup, aşı şemasına uygun olarak uygulanması önerilir. Ancak hepatit B aşılaması sonrası aşı yanıtlarının düşük olduğu görülmüştür. Bu nedenle hastaların tedavi başlamadan önce aşılanması önem taşımaktadır. Çalışmamızda elde edilen veriler tüberküloz reaktivasyon riskinin düşük olduğu yönündedir.
V ABSTRACT
Aim: The aim of this study is to evaluate the patients with multiple sclerosis who have started
treatment with ocrelizumab before vaccination and to evaluate the immune responses after vaccination in terms of diseases that can be protected with vaccination. The secondary aim is to increase the physicians' perception of the immunization program and the reactivation of latent infections of patients receiving immunosuppressive therapy, and to gain the habit of screening and immunization with vaccine before treatment.
Method: HAV IgG, HBs, HBsAg, HBc IgG, HCV, HIV,
Anti-VZV IgG, TST and chest X-ray results were of patients who filled the ocrelizumab safety form at the Infectious Diseases and Clinical Microbiology, vaccination outpatient clinic between February 1, 2019 and March 24, 2020 were evaluated retrospectively. Pneumococcal and tetanus antibodies were recorded before vaccination. Vaccines administered to all patients were recorded. The patients who were completed vaccination and whose anti-HbS, pneumococcal and Td antibody levels were measured in the first month were included in the study and antibody levels were recorded. Patients who had TST ≥ 15mm, had no evidence of latent tuberculosis on chest X-ray and were referred to tuberculosis control dispensary for the purpose of isoniazid prophylaxis for 9 months were examined retrospectively. Patient follow-up forms including demographic data (age, gender), vaccination serological status, pre-and post-vaccination antibody titers were filled in the specified patient group. Vaccination dates were checked through vaccination cards issued at the vaccination outpatient clinic and through the Ministry of Health vaccine tracking system.
Results: In the serological examinations of 73 patients evaluated within the scope of the
study, no positivity was found in terms of HCV and HIV, and 12 patients were found to be sensitive to hepatitis A. Nine patients received two doses of vaccination and Anti-HAV IgG was shown after vaccination. A total of 31 males (44,9%) and 38 females (55%) evaluated for tuberculosis reactivation were found to have a mean age of 69 patients 49,59 ± 10,34 (min: 26, max: 68). The mean of TST measurements of these patients was 8,17 ± 7,11 mm (min: 0 mm, max: 27 mm). No statistically significant difference was found in the distribution of TST results by age or gender. (p = 0,934; p = 0,443 respectively) A total of 14 patients received isoniazid prophylaxis for nine months. Tuberculosis reactivation was not observed under ocrelizumab treatment in 69 patients who were followed up, including all patients who received and did not take prophylaxis. The pneumococcal antibody of 63 patients evaluated in
VI
the study was found to be positive. The median pneumococcal antibody level before vaccination was 235 mg / L (min: 27; max: 270 mg / L), the median pneumococcal antibody level after vaccination was 270 mg / L (min: 49, max: 270 mg / L). A statistically significant increase was found in the level of pneumococcal antibody by vaccination (p=0,000). With age, there was a decrease in antibody increase after vaccination (r =-,180). Thirty-nine patients whose serological examinations were completed in terms of tetanus were evaluated and a statistically significant increase in antibody level was shown after vaccination. (p=0,000) The median basal tetanus antibody level was 0,81 IU / ml (min: 0,05; max: 5) and the median antibody level after vaccination was 1,08 IU / ml (min: 0,05; max: 5). Ten patients with anti-HBc IgG positivity who did not receive prophylaxis in terms of HBV reactivation had no signs of reactivation during follow-up. Anti-HBs was observed in only five patients (11,1%) in 45 patients who completed the three-dose vaccination schedule.
Conclusion: As a result of our study, the efficacy of pneumococcal, tetanus and hepatitis A
vaccines has been demonstrated in this patient group and it is recommended to be administered in accordance with the vaccination schedule. However, the vaccine responses were low after hepatitis B vaccination. For this reason, it is important to vaccinate patients before starting treatment. The data obtained in our study is that the risk of tuberculosis reactivation is low.
VII TABLOLAR LİSTESİ
Tablo 1. HBV reaktivasyonu için risk sınıflaması
Tablo 2. Pnömokok Aşılama Algoritması
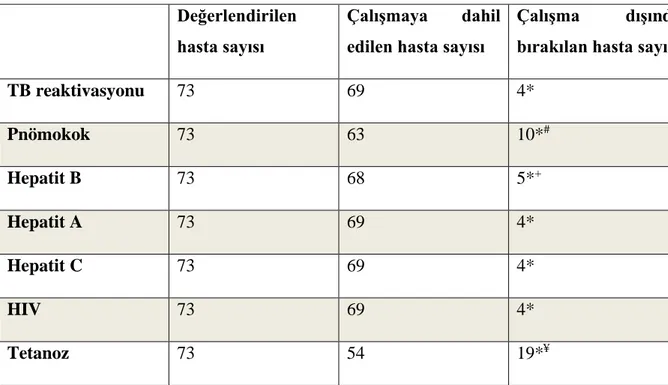
Tablo 3. Çalışmaya dahil edilen ve çalışma dışı bırakılan hastalar
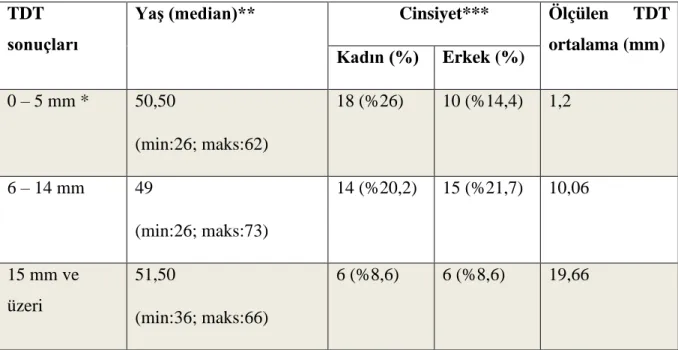
Tablo 4. TDT sonuçları
Tablo 5. TDT ve akciğer grafisi değerlendirmeleri
Tablo 6. HRCT çekilen 13 hastanın TDT ve akciğer grafileri ile sonuçları
Tablo 7. Aşılama sonrası pnömokok antikor düzeyindeki değişim
Tablo 8. Bazal tetanoz antikoru düzeyleri
Tablo 9. Bazal tetanoz antikoru seviyesine göre hastaların korunma düzeyinin değerlendirilmesi
Tablo 10. Aşılama öncesi ve sonrası tetanoz antikor düzeyleri
Tablo 11. Aşılama sonrası tetanoz antikoru düzeyindeki artış
Tablo 12. Aşılama sonrası tetanoz antikor seviyesine göre hastaların korunma düzeyinin değerlendirilmesi
Tablo 13. HBV taşıyıcısı iki hastanın demografik özellikleri ve hepatit B ilişkili serolojik testlerinin sonuçları
Tablo 14. Aşılama sonrası anti-HBs oluşumu
VIII ŞEKİLLER LİSTESİ
Şekil 1. Ülkemizde TDT yanıtının değerlendirilmesi için kullanılan kriterler Şekil 2. LTBE için tedavi endikasyonları
Şekil 3. EKMUD Erişkin Bağışıklama Rehberi 2019 risk gruplarına göre aşılama önerileri Şekil 4. Yaşa göre TDT sonuçlarının dağılımı
Şekil 5. Yaşa göre aşı sonrası pnömokok antikorlarında artış düzeyi Şekil 6. Tetanoz antikoru düzeyleri
Şekil 7. Yaşa göre tetanoz antikorunda artış düzeyi
IX KISALTMALAR LİSTESİ
DBT: Tetanoz toksoidi, difteri toksoidi ve öldürülmüş boğmaca aşısı DSÖ: Dünya Sağlık Örgütü
GBP: Genişletilmiş Bağışıklık Programı BCG: Bacillus Calmette-Guerin
Td: Erişkin tip Difteri-Tetanoz Hib: Hemofilus influenza tip B
EKMUD: Türkiye Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Uzmanlık Derneği DNA: Deoksiribonükleik asid
DC: Dendritik hücreler NK: Doğal öldürücü hücreler
MHC: Major histocompatibility complex TLR: Toll-benzeri reseptörler
NOD: Nükleotid bağlayıcı oligomerizasyon alanı
NLR: Nükleotid bağlayıcı oligomerizasyon alanı benzeri reseptörler PRR: Patern tanıma reseptörleri
MMR: Kızamık-kabakulak-kızamıkçık MS: Multipl skleroz
PPMS: Primer progresif multipl skleroz FDA: U.S. Food and Drug Administration EDSS: Genişletilmiş Özürlülük Durum Ölçeği IFN: İnterferon
LTBE: Latent tüberküloz enfeksiyonu TDT: Tüberkülin deri testi
IGST: İnterferon gama salınım testi INH: İzoniazid
HBV: Hepatit B virüsü
PCR: Polimeraz zincir reaksiyonu TDF: Tenofovir disproksil fumarat TAF: Tenofovir alafenamid fumarat NA: Nükleozid analoğu
RNA: Ribonükleik asit HAV: Hepatit A virüsü
X PVC: Konjuge pnömokok aşısı
Tdap: Erişkin tetanoz-difteri-asellüler boğmaca DTap: Pediatrik difteri-tetanoz-asellüler boğmaca PCP: Pnömokokal kapsüler polisakkariti
EIA: Enzim immunoassay
CMIA: Kemilüminisans mikropartikül immünassay ABD: Amerika Birleşik Devletleri
ELISA: Enzyme Linked İmmunosorbent Assay PPD: Purified protein derivative
HRCT: Yüksek rezolusyonlu akciğer bilgisayarlı tomografisi COVID-19: Yeni koronavirüs hastalığı
RA: Romatoid artrit MTX: Metotreksat
11 1.GİRİŞ
Konak savunmasının bozulmuş olması nedeniyle bağışıklığı baskılanmış hastaların aşılanması, aşı ile önlenebilir hastalıklara bağlı gelişebilecek morbidite ve mortalite açısından önem arz etmektedir. Kullanılan immunsupresif ajanların hücresel ve sıvısal bağışıklık üzerindeki etkilerine göre değişmekle birlikte, bu hastalarda aşıların güvenliği, immünojenik etkisi ve uygun antikor düzeyi oluşumuna dair veriler kısıtlıdır; yapılmış olan çalışmalar genelde küçük hasta grupları içermektedir. Bir anti-CD20 olan ocrelizumab tedavisi altındaki hastalar da yüksek risk taşıyan gruba girmektedir. [1,2]
Çalışmanın ana amacı: Ocrelizumab tedavisi başlanmış olan multipl skleroz tanılı hastaların retrospektif olarak elektronik hasta dosyalarından;
1- HAV, HBV, HCV ve HIV açısından serolojik durumlarını,
2- Serolojik açıdan duyarlı saptananlara yapılan HAV ve HBV aşılarına sekonder antikor
yanıtlarını,
3- Pnömokok ve tetanoz aşılamalarından sonraki antikor yanıtlarını,
4- Tüberkülin deri testi (TDT) ve akciğer grafileri ile tüberküloz profilaksisi gerekip
gerekmediğini saptamaktır.
Çalışmanın ikincil amaçları: İmmünsupresif tedavi alan hastaların bağışıklık durumlarının
ve aşılama şemalarının değerlendirilmesi, aşılama programı ve latent enfeksiyonların reaktivasyonu hakkında hekimlerin algısını arttırmak, tedavi öncesi tarama ve aşı ile bağışıklama alışkanlığının kazandırılmasıdır.
Çalışmanın hipotezi
1- Ocrelizumab tedavisi, bağışıklama programına göre aşılama yapıldıktan sonra antikor yanıtının yetersiz olmasına neden olmaktadır.
2- Ocrelizumab tedavisi sırasında TDT > 5 mm olan hastalar tüberküloz reaktivasyonu açısından anlamlı risk taşımamaktadır.
12 2. GENEL BİLGİLER
2.1 Aşı Tarihçesi
Aktif immünizasyon sağlayan aşılama, bulaşıcı hastalıklardan dolayı gelişebilecek morbidite ve mortaliteyi azaltmanın ve engellemenin en uygun maliyetli, etkin ve güvenli yöntemidir ve her yıl en az 2,5 milyon hayat kurtardığı tahmin edilmektedir. [3,4,5] Koruyucu hekimlik kapsamında aşıların kullanılması için oluşturulan algoritmalar ve hekimlere her geçen gün verilen eğitimler bağışıklamayı güncel bir konu haline getirmiş. Aşılamanın tarihi 1100’ lü yıllarda Çin’ de uygulanan Çiçek aşılarına dek uzanmaktadır. [3] Çiçek hastalığının veziküler lezyonlarından elde edilen sıvının duyarlı kişilere uygulanması ile yapay bağışıklanma elde edilmeye çalışılmıştır. [4] Bu yöntemde çoğunlukla hafif klinik ile hastalık oluşmasına rağmen, nadir olarak ağır komplikasyonlar ile yaygın hastalık tablosuna neden olunmuştur. Osmanlı İmparatorluğu Döneminde 1721’de İngiltere Büyükelçisinin eşi Lady Mary Montagu’ nun yazdığı bir mektupta İstanbul’da çiçek hastalığına karşı “aşı denilen bir şey” (varilasyon metodu) uygulandığını anlatmıştır. Bu mektup aşı yapımına ilişkin ulaşılmış en eski belgedir. [6] 1796 yılında ise Edward Jenner sığır çiçeği bulaşan sütçü kızların çiçek hastalığına da bağışık olduğunu göstermiş ve insanlarda hafif hastalık yapan sığır çiçeği virüsünün çiçek hastalığı için de çapraz koruma sağladığını gösterilmesi zayıflatılmış bir organizmanın uygulanması ile bağışıklık oluşturulabilecek aşıların gelişimini sağlayacak süreci başlatmıştır. [7] Dünya genelinde uygulanan aşılama sonrası 1977’de Somali’de görülen son çiçek hastalığı vakasından sonra çiçek hastalığının eradikasyonu, aşı ile bağışıklama döneminin en büyük küresel başarısı olmuştur. [4] Zayıflatma ilkesi kullanılarak geliştirilen bir sonraki insan aşısı, Pasteur tarafından ilk kez 1885'te Jenner'in deneylerinden yaklaşık bir asır sonra insanda test edilen kuduz aşısı olmuştur. [7] Aşı üretim çalışmalarını yürüten Pasteur, çalışmalarını sürdürebilmek için dönemin devlet başkanlarına maddi katkı için yazı yazar. Bu devlet başkanlarından biri 2. Abdülhamit’tir ve maddi yardım yapabileceğini fakat çalışmalarını İstanbul’da sürdürmesini ister. Pasteur bu teklifi kabul etmeyince ikinci teklif oluşturulur ve Pasteur’a Mecidiye Nişanı ile birlikte 10,000 altın yollanır ve Osmanlı’dan 3 kişinin de yanına asistan olarak yetiştirilmesi istenir. [6] Gönderilen ekip çalışmalara devam edilebilmesi için “kuduz mikrobu” enjekte edilmiş bir kemik iliği ile Osmanlıya geri döner. 1887’nin Ocak ayında Zoeros Paşa’nın kliniğinde Daûl-Kelp ve Bakteriyoloji Ameliyathanesi (Kuduz Tedavi Müessesesi) kurulur. Bu kurum
13
dünya’da üçüncü, doğunun ise ilk kuduz merkezi olmuştur. Daha sonra bu merkez difteri serumu da üretmiştir. [6]
Pasteur tarafından geliştirilen enfekte tavşan beyninden kurutma yöntemi ile attüne edilerek elde edilen bu aşının ciddi yan etkileri olmasından dolayı günümüzde kuduz aşısı doku kültürlerinde inaktive virüslerin elde edilmesi ile üretilmektedir. [7,8] Doku kültüründe virüsleri büyütme yeteneğinin kazanılması, 1950'lerde ve 1960'larda kızamık ve çocuk felci karşı zayıflatılmış aşıların gelişmesini sağlamıştır. [3,7]
Virüsün zayıflatılması prensibi ile geliştirilen tifo, kızamıkçık, grip, rotavirüs ve tüberküloz gibi aşıların en önemli özelliği canlı bileşen nedeniyle güçlü ve sürekli bir bağışıklık yanıtı oluşturması ve aşılanmamış olan kişilere de yayılarak sürü immünitesi ile etkisini toplum içinde de genişletmesi. [3,7] Canlı aşılar kolay ve ucuz olarak üretilebilmektedir. Ancak immunsupresif kişilerde hastalık tablosuna yol açabilmektedir. [3,4] Ölü mikroorganizmaların kullanımı ile daha güvenli aşıların elde edilmesi fikri ile pnömokok, meningokok ve tifo aşıları geliştirilmiş fakat bu aşıların zayıf immunojenik olduğu görülmüştür. Tam hücreli aşılar yerini daha çok subunit aşılara bırakmıştır. Bununla birlikte birden fazla antijen sunabilme avantajı olan tam hücre aşılarına tekrar ilgi duyulmaya başlanmış ve zayıflatılmış pnömokok ve sıtma aşıları üzerinde çalışmalar devam etmiştir. [9,10]
Yine 1920’ lerde modifiye edilmiş toksin (toksoid) ile patogenezinde toksinlerin rol oynadığı tetanoz, difteri gibi hastalıklara karşı uzun süreli bağışıklanma sağlanabileceği gösterilmiştir. 1931 yılında geliştirilmiş olan tetanoz, difteri ve ölü boğmaca toksini içeren (DBT) aşılar çocukluk çağı bağışıklamasının önemli bir parçasıdır. Günümüzde pek çok ülkede tam hücreli boğmaca aşılara daha az reaktojenik olan asellüler formu ile değiştirilmiştir. [7]
1950’ lere gelindiğinde DBT ve çocuk felci aşıları uygulaması sayesinde bir miktar azalmakla birlikte bu dönemde hala aşılama oranları %5’ in altında kalmaktadır. Dünya Sağlık Örgütü (DSÖ) ‘nün başlattığı Genişletilmiş Bağışıklama Programı (GBP) kapsamında bu oran %80’lere çıkmıştır. [7,11] Günümüzde bağışıklama hizmetleri ile çiçek hastalığı eradike edilmiş, çocuk felci hastalığı elimine edilmiş ve birçok aşı ile önlenebilir hastalık kontrolü sağlanmıştır. GBP uygulanması ile her yıl 2,5 milyon 5 yaş altı çocuk ölümünün önüne geçildiği bildirilmektedir. [4]
14 2.1.1 Türkiye’ de Aşılama Tarihçesi
Ülkemizde aşılamanın tarihçesine bakıldığında 1930’larda çiçek, 1937’de difteri-boğmaca, 1952’de Bacillus Calmette-Guerin (BCG), 1963’ de oral çocuk felci, 1968’de DBT ve 1970’ de de kızamık için bağışıklamaya başlandığı görülmektedir. [4]
Yıllara göre bağışıklama sürecindeki gelişmeler ve aşı programları aşağıda listelenmiştir.[4,6] 1930- Çiçek
1937- Difteri, Boğmaca 1952- BCG aşılaması 1963- Canlı polio aşılaması 1968- DBT aşılaması 1970- Kızamık aşılaması 1981- GBP
1985- Türkiye Aşı Kampanyası 1989- Polio Eradikasyonu Programı 1995- Polio Ulusal Aşı Günleri
1996- Kızamık Aşısı Hızlandırma Kampanyası 1997- Polio ‘Mop‐Up’
1998- Son polio vakası ve hepatit B aşılaması 2003- Kızamık Okul Aşı Günleri
2004- Erişkinlere tetanoz aşısı uygulanması gereken durumlarda erişkin tip difteri-tetanoz aşısına (Td) geçilmesi
2005- Kızamık Aşı Günleri
2006- Kabakulak, kızamıkçık ve Hemofilusinfluenza tip B aşısının (Hib) programa eklenmesi, hepatit B ergen aşılamasının başlatılması
2007- Hepatit B ve kızamıkçık aşılarının ilköğretim yaş gruplarında tamamlanması 2008- Beş bileşenli (DaBT-P/Hib) aşının kullanılmaya başlanması
2008- Yedi valanlı konjuge pnömokok aşısının takvime girişi 2009- Anne-yenidoğan tetanoz eliminasyonu
2010- İlköğretim 1. sınıfta Td ve canlı polio aşısı yerinde DaBT-İPA aşısının uygulanmaya başlanması
2011- On üç valanlı konjuge pnömokok aşısının uygulanmasına geçilmesi 2012- Hepatit A aşısının aşı takvimine eklenmesi
15
2013- Suçiçeği aşısının aşı takvimine eklenmesi
Ülkemizde 1981’de yayınlanan GBP ve 2008’de yayınlanan Genişletilmiş Bağışıklama Programı Genelgesi ile difteri, tetanoz, boğmaca, tüberküloz, kızamık, kızamıkçık, kabakulak, polio, hepatit B ve Hemophilus influenza tip b gibi bulaşıcı hastalıkların insidansını ve bu hastalıklara bağlı gelişebilecek morbidite ve mortalitenin azaltılması amaçlanmıştır. [4,13] Globalleşen dünyada ticaret, iletişim, teknoloji ve ulaşımdaki gelişmeler ile ülkeler ve kıtalar arası seyahat, göçler artmış olup bulaşıcı hastalıkların taşınması ve epidemiyolojisindeki değişiklikleri beraberinde getirmiştir. Beklenen yaşam süresinin uzaması diyabetes mellitus, hipertansiyon gibi pek çok komorbid hastalıkların karşımıza çıkma sıklığını arttırmıştır. Aynı zamanda inflamatuar hastalıkların ve kanserlerin tedavisinde yaşanan gelişmeler ile immunsupresif ajanlar daha sık kullanılmaya başlanmıştır. Tüm bunlar erişkin ve yaşlılık dönemlerinde de aşı ile önlenebilen hastalıklardan korunmada Yaşam Boyu Bağışıklama anlayışı ile farkındalığı arttırmaktadır. [4] 2009 yılında Türkiye Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Uzmanlık Derneği (EKMUD) tarafından ilk kez erişkin bağışıklama rehberi oluşturulmuştur. Bu tarihten sonra rehber güncellenerek günümüze dek kaynak olarak kullanılmıştır. Son güncelleme 2019 yılında son gelişmeler ışığında yapılmıştır. [4]
2.2 Aşı ile İlgili Temel Kavramlar ve Tanımlar
Aşı: Öldürülmüş veya virülansı azaltmış mikroorganizmaların kas içi, oral, cilt altı gibi farklı
yollarla uygulanarak organizmada bağışıklık yanıtı oluşturarak kişiyi bulaşıcı hastalıklara karşı koruyan maddelerdir.
Bağışıklama: Organizmanın immün sistemini yapay yollarla uyararak bulaşıcı hastalıklardan
korunmasını sağlama işlemidir. Aşı uygulaması ile aktif, immünglobulinler ile pasif yolla yapılabilir.
Eliminasyon: Belirli bir coğrafi alanda, belirli bir hastalığın planlanan çalışmalar sonucunda
insidansının sıfıra indirilmesidir.
Eradikasyon: Bir hastalığın etkeni ile beraber tamamen yeryüzünden yok edilmesidir.
Serokonversiyon: Etkene yönelik spesifik antikorları oluşturarak aşıya yanıt veren kişilerin
16 Seroproteksiyon hızı: Aşı uygulandıktan sonra koruma sağlamak için yeterli düzeyde antikor
üreten kişilerin yüzdesidir. [4]
2.3 Bağışıklamayı Etkileyen Faktörler
Aşı uygulaması sonrası uygun bağışık yanıtın gelişebilmesi T ve B lenfositlerin birlikte çalışmasına bağlıdır. Çoğunlukla aşılamadan 7 – 10 gün sonrasında yanıt gelişmeye başlar. [4] Aşı içeriğindeki antijen bileşimi, uygulaması ve antijenin sunumu arzu edilen immun yanıtın uyarılması için kritiktir. Aşının immunojenitesinde antijenin kimyasal ve fiziksel özellikleri, uygulanan bireyin genetik özellikleri, yaş, cinsiyet, malnutrisyon ya da obezite gibi fiziksel özellikleri, immun yetmezlik durumları, antijenin sunum şekli (uygulama yolu, doz, dozların zamanlaması, adjuvan varlığı) önem taşımaktadır. [3,5]
Aşıların çoğu T lenfositlere bağlı bir bağışıklık yanıtı üreten protein antijenlerini içerir. T lenfosit aracılı bu yanıt immünolojik hafıza oluşumunu sağlar ve rapel aşı uygulamasıyla antikor yanıtını güçlendirici etkileri ile tüm yaş gruplarında iyi bir bağışıklanma sağlar. Bununla birlikte, saflaştırılmış bakteriyel kapsüler polisakkarit aşıları, immünolojik hafıza oluşmasına yol açmayan ve tekrarlanan dozlar ile arttırılamayan bir T lenfositten bağımsız bağışıklık yanıtına neden olur. Konjuge aşılarda, polisakkarit aşıların bu zayıf immünojenik etkisi polisakkaridin bir taşıyıcı proteine kovalent bağlanması ile T lenfosit bağımlı bir antijene dönüştürülmesi ile güçlendirilir. [3,5] Konjuge Hib, konjuge pnömokok ve konjuge meningokok aşıları bu tip aşılardandır.
Aşı uygulamalarında uygun yanıt için dikkat edilmesi noktalardan biri de aşı – antikor etkileşimleridir. Sıklıkla inaktive aşılar antikorlardan etkilenmediği için immunglobulinler ile eş zamanlı, önce ya da sonra uygulanabilir. Fakat dolaşımdaki antikor, aşı ile verilecek olan antijene karşı oluşacak bağışıklık yanıtı azaltabileceği gibi tamamen de engelleyebilir. Bu yüzden hepatit B, kuduz ve tetanoz gibi aşılar immunglobulin ile eş zamanlı uygulanabilirken canlı aşı yapılmış bir kişiye immunglobulin uygulamasından önce en az enkübasyon süresi kadar ortalama iki hafta beklenmelidir. İmmunglobulin önce yapılmış ise antikorların yıkılmasını beklemek gerekmektedir. Bu süre de immunglobulindeki antikor düzeyine göre değişmektedir. [4,5]
Tüm aşılar eş zamanlı yapılabilir fakat eğer üretici firma tarafından karıştırılarak üretilmediyse aynı enjektörle uygulanmamalıdır. Eğer aynı anda uygulanmadıysa iki canlı aşı
17
arasında dört hafta zaman olmalıdır. Bu kurala dikkat edilmediyse ikinci aşı dört hafta sonra tekrar yapılmalı ya da serolojik tetkikler ile antikor yanıtı değerlendirilmelidir. Oral yolla uygulanan aşılar birbirlerinin ya da enjekte edilen canlı aşılar üzerine olumsuz etki yaratmadıkları için herhangi bir zamanda uygulanabilirler. [4]
Aşılama şeması herhangi bir nedenle yarım kalan kişiler için aşı yapıldığına dair kayıt var ise aşılamaya herhangi bir zamanda kalındığı yerden devam edilebilir. [4] Aşı ile bağışıklama sonrası gelişecek olan immun yanıt pek çok faktöre bağlı olup tüm gelişmelere rağmen kullanımda olan aşılar güvenli ve etkin de olsa hiçbir aşı yüzde yüz koruyucu değildir. [3]
2.4 Aşı Tipleri
Tüm dünyada kullanımda olan temel aşı tipleri, viral aşılar (attenue canlı viral aşılar, inaktive-ölü aşılar, subunit aşılar) ve bakteriyel aşılar (tam hücreli aşılar, toksoid aşılar, subunit aşılar, polisakkarid aşılar) ve kombine aşılardır. [4]
2.4.1 Viral Aşılar
2.4.1.1 Attenüe (zayıflatılmış) canlı viral aşılar:
Patojen virüsün rutinden farklı olarak anormal kültür koşullarında uzun sürede üretilip, 50 veya daha fazla pasajdan geçirilerek zayıflatılması prensibi ile üretilmiş aşılardır. Aşı içeriğindeki virüs zayıflatılmış suş olduğu için hastalık tablosuna neden olmadan bağışıklık yanıtı oluşturabilir. Aşı üretmek için halen daha 1960 ve 1970’ lerde attenüe edilmiş suşlar kullanılmaktadır. (örn. Schwarz kızamık virüsü suşu, poliovirüslerinin Salk suşları ve varisella virüsünün Oka suşu)
Attenüe edilmiş canlı viral aşıların en önemli avantajı uygulandıktan sonra organizmada büyük bir miktarda antijenik uyarı oluşturarak doğal enfeksiyonu taklit etmesi ve bu sayede güçlü bir bağışıklık belleği oluşmasını sağlamasıdır. Yaşam boyu koruma için sıklıkla tek doz aşılama yeterli olmaktadır.
Canlı aşılarda kullanılan virüsün bir miktar patojeniteye sahip olabilmesi veya virülan bir forma dönüşerek hastalığa yol açabilmesi ihtimalinden dolayı bağışıklığı baskılanmış kişilerde ve gebelerde risk oluşturabildiği için kontrendikedir.
Bu aşıların mutlaka +2 ile +8ºC arasındaki ısı ortamında saklanmaları ve taşınmaları gerekmektedir. [4]
18 2.4.1.2 İnaktive (ölü) viral aşılar:
Virüs uygun koşullarda çoğaltılıp, saflaştırılarak, kimyasallar veya ısı ile inaktif hale getirilerek elde edilen aşılardır. Bu işlemler sırasında aşının bağışıklık yanıtını istenen şekilde uyaracak olan antijenlerin yapısının bozulmamalıdır. İnaktivasyon süresince hiçbir virüsün canlı kalmaması gerekmektedir. İnaktive aşılar, canlı aşılar gibi vücutta çoğalacak virüs içermediklerinden antijenik uyarıya neden olmazlar. Bu nedenle, uzun dönemde bağışıklık belleği oluşturabilmek için birden fazla doza gerek duyulabilmektedir. Koruyucu etkiyi sürdürmek için düzenli rapel dozlar uygulanmaktadır. Bu aşılara bağışıklık yanıtını güçlendirmek için adjuvan maddeler eklenmektedir. [4]
2.4.1.3 Subunit (alt birimli) viral aşılar:
Bir virüsün yüksek ölçüde saflaştırılmış bir ya da daha fazla sayıda antijenini içeren, viral nükleik asitlerin serbestleştirilmesi ile elde edilmiş ve bu antijenler dışında antijen içermeyen aşılardır. Trivalan veya tetravalan inaktive influenza aşıları bu aşılara en iyi örneklerdir. İmmün sistemi baskılanmış hastalarda da güvenilirdir. [4]
2.4.1.4 Rekombinan antijen aşıları:
Bakteri, maya veya memeli hücre kültüründe rekombinan deoksiribonükleik asid (DNA) teknolojisi ile herhangi bir protein klonlanarak pürifiye edilmesi ile hazırlanan aşılardır. Bu yöntemle elde edilen ilk aşı hepatit B aşısıdır. [4]
2.4.2 Bakteriyel aşılar
2.4.2.1 Tam hücreli bakteriyel aşılar:
Bakteriyel aşılarda patojenin zayıflatılarak bakteriyel aşı elde edilmesi yöntemi çok başarılı olamamıştır. Öldürülmüş, inaktive bakterilerin kullanımı daha başarılı sonuçlar vermiştir. Tam hücreli bakteri aşıları ateş ve lokal reaksiyona yol açabilen diğer aşı bileşenleri içermektedir. [4]
2.4.2.2 Toksoid aşılar:
Toksoid, kimyasal değişiklikler ile zararsız hale getirilmiş olan fakat antijenik özelliklerini kaybetmemiş bir bakteriyel ekzotoksindir. Bu aşıları üretmek için bakteriler uygun ortamlarda çoğaltıldıktan sonra toksin kültür ortamından çıkartılarak saflaştırılır ve çoğunlukla formalinle inaktive edilmektedir. Toksoid ile yapılan aşılama sonrası oluşan
19
antikorlar toksin ile reaksiyona girip onu etkisiz hale getirmektedir. Bakteri ekzotoksinleri aracılığı ile oluşan hastalıklara karşı etkin koruma sağlamaktadır. Difteri ve tetanoz aşıları buna örnektir. [4]
2.4.2.3 Subunit bakteri aşıları:
Subunit (alt birimli) aşılar ile tam hücreli bakteriyel aşılar ile görülen olumsuz yan etkiler önlenebilmektedir. En önemli örneklerinden biri asellüler boğmaca aşısıdır. Bordatella pertussis’ten üretilen saflaştırılmış antijenler ve pertussis toksoidi içeren asellüler boğmaca aşısındaki bu antijenler cansız bileşenler oldukları için hastalığa neden olmazlar.
Bu grup içerisinde polisakkarit ve konjuge polisakkarit aşılar bulunmaktadır. [4]
Polisakkarit aşılar: Polisakkaridler T lenfositlerden bağımsız antijenler olup B lenfositler ile doğrudan etkileşime girmeleri nedeniyle yüksek immünojenik potansiyel taşımazlar ve bağışıklık belleği ya çok az oluşur ya da hiç oluşmaz. İkinci doz uygulanması da rapel etkisi göstermez. [4]
Konjuge polisakkarit aşılar: T lenfositlerden bağımsız bağışıklık yanıtını uyaran polisakkarit aşılar ile oluşan bağışıklık belleği yetersiz olduğu için polisakkaritler, tetanoz toksoidi gibi bir taşıyıcı proteine bağlatılarak immünojeniteleri artırılmaktadır. “Konjugasyon” adı verilen bu işlem ile polisakkarit antijenlerin T lenfosit bağımlı özellik kazanmaları sağlanarak uzun süreli bağışıklık yanıtı elde edilebilmektedir. [4]
2.4.3 Yeni Aşı Tipleri
2.4.3.1 Rekombinan vektör aşıları: Patojen mikroorganizmanın antijen kodlayan geninin,
vektör görevi gören zayıflatılmış bir virüs veya bakterinin genomuna yerleştirilmesi ile üretilir. Bu aşılar ile ilgili faz çalışmaları devam etmektedir.
2.4.3.2 Sentetik peptid aşılar: Bu yöntemle antijen işlevi gören proteinin aminoasit dizilimi
belirlenir ve bu protein laboratuarda sentetik olarak sentezlenir. Henüz ticari bir preparatı yoktur.
2.4.3.3 DNA aşıları: İstenilen antijenik yapıyı kodlayan DNA parçası, uygun bir
transkripsiyon başlatıcısı ile bir bakteri plazmidine yerleştirilir ve konak hücreye verilen bu plazmid taşıdığı DNA sayesinde özgül proteinlerin konak hücrede eksprese edilmesini sağlar. Bu yöntemle insan immun yetmezlik virüsü (Human Immunodeficiency Virus (HIV)), hepatit B, hepatit C, kuduz vb. ile ilgili çalışmalar yapılmaktadır. [4]
20 2.5 İmmun Yanıtın Bileşenleri
İmmun sistemin fizyolojik olarak işlevi, enfeksiyonların gelişmesini engellemek ya da yerleşmiş olan enfeksiyonları yok etmektir. Sağlıklı olan bireyleri gelişebilecek enfeksiyonlardan korumanın da en etkin, güvenilir ve ucuz yolu da aşı ile bağışıklamadır. [14]
Bağışıklık yanıtı klasik olarak hızlı ve spesifik olmayan doğal bağışıklık ve antijene özgü, uzun süreli bağışıklık hafızası ile sonuçlanan kazanılmış bağışıklık yanıt olarak ikiye ayrılır. Kazanılmış bağışıklık konağı aynı ya da immünolojik olarak benzer etkenle karşılaştığında korumaya yönelik olarak yapılanmış olup, aşılama ile korunmanın da temel prensibini oluşturmaktadır. [3]
Bakteri hücre duvarlarının bileşenleri ile aktive olan kompleman sistemi, mikroorganizmaları ve yabancı antijenleri fagosite eden makrofajlar ve dendritik hücreler (DC) ve virüsle enfekte hücreleri tanıyan ve öldüren doğal öldürücü (NK) hücreler doğal bağışıklık yanıtının temel bileşenleridir. Kazanılmış bağışıklık yanıt ise dendritik hücreler gibi antijen sunan hücreler tarafından aktive edilerek, T ve B lenfositler tarafından organize edilmektedir. [3] Doğal immun yanıt birçok enfeksiyona karşı etkin mücadele etse de patojenler doğal immun yanıt direnç gösterir. Doğal immun mekanizmalar, patojen gruplarındaki ortak bulunan yapıları tanısa da yabancı moleküller arasındaki küçük farklı ayırt edemez. Bu ayrımı yapabilen ve antijene özgül olarak tanıyarak immun yanıt oluşturabilen kazanılmış immun yanıta ihtiyaç vardır. [14]
Yardımcı CD4+ ve sitotoksik CD8+ T lenfositler kazanılmış immun hücresel immunite kolunu oluşturan hücrelerdir. Yardımcı T lenfositler de ağırlıklı olarak hücresel immun yanıttan sorumlu Th1 ve daha çok humoral immun yanıta yol açan Th2 hücreleri olarak ayrılmaktadır. B lenfositler ise CD4+ T lenfositlerin yardımı ile antijene özgü antikor sentezler. Antijen sunan hücreler, yardımcı T lenfositler ve B lenfositler arasındaki etkileşimler sınıf II MHC (major histocompatibility complex) içerirken, sitotoksik T lenfositler ve hedefleri arasındaki etkileşim sınıf I MHC antijenlerini içermektedir. [3,14] Tüm hücre tipleri tarafından salınan interlökin ve interferonların da dahil olduğu sitokinler ise farklı hücre soyları için aktivasyon ya da farklılaşma faktörleri olarak iş görmektedir. Başka bir CD4+ T lenfosit olan Treg lenfositler kazanılmış immun yanıtın düzenlenmesinde rol oynamaktadır. Toll-benzeri reseptörler (TLR) ve nükleotid bağlayıcı oligomerizasyon alanı
21
(NOD)-benzeri reseptörler (NLR) gibi patern tanıma reseptörleri (PRR) antijenleri tanıyarak proinflamatuar sitokinleri indükler ve immun yanıtı aktive ederek kazanılmış immun yanıtı modüle etmektedir. Bu prensip aşı üretiminde kullanılan adjuvanların geliştirilmesi açısından önem arz etmektedir. [3,15]
İnaktive ve subunit aşılar, canlı aşılar kadar immunojenik olmadığı için antijenlerin immunujenitesini arttırmak ve bağışıklık yanıtını güçlendirmek için adjuvan adı verilen maddeler kullanılmaktadır. En sık kullanılanlardan biri olan alüminyum tuzları Th2 aracılı bağışıklık yanıtına neden olup, yüksek düzey antikor yapımını sağlamaktadır. Bazı yeni adjuvanlar bağlandıkları antijenlerin antijen sunan hücrelerle temasını sağlayarak hücresel bağışık yanıtı güçlendirmektedir. [3,4]
2.5.1 Kazanılmış İmmun Yanıt
Doğal immunite, enfeksiyöz bir mikrooganizma veya aşıya maruz kalındığında, organizmada veya adjuvanda bulunan patojenle ilişkili moleküler paternin antijen sunan hücrelerce tanınması yoluyla mobilize edilir. Aktive olmuş olan makrofaj ve dendritik hücreler diğer lökositlerin de enfeksiyon yerine göç etmesini sağlayan proenflamatuar sitokin ve kemokinleri salgılar. Dendritik hücrelerin antijen sunması ile naif CD4+ T lenfositler aktive olur, bu T lenfosit aracılı antikor üretiminin ilk basamağıdır. T lenfosit reseptörleri ile MHC peptid kompleksini tanır ve yardımcı T lenfositlerin olgunlaşmasını sağlayan sitokinlerin salınımını tetikler. İnterlökin-12 (IL-12) varlığında Th1 lenfositler farklılaşır ve IL-2 ve interferon-γ (IFN-γ) salgılar. IL-4 aracılığıyla da Th2 lenfositleri farklılaşarak, B lenfositlerin plazma hücrelerine dönüşümü ve maturasyonunda rol oynayan IL-4 ve IL-5 salınımını indükler. Naif B lenfositler, yüzeylerindeki immünoglobulin reseptörü aracılığı ile antijen üzerindeki spesifik bir antijenik epitopu tanır, fakat T-lenfosit yardımı olmadan antikor salgılayan lenfositlere dönüşemez. Yardımcı T lenfositler, B lenfosit yüzeyindeki MHC-II’ yi tanıyarak differansiasyonu için gerekli sinyali verebilirler. Bunun sonucunda IgM’den IgG ve IgA’ya doğru sınıf değişimi ve afinitenin maturasyonu ile sonuçlanan farklılaşma ile antijene spesifik plazma hücreleri oluşur. Fakat tüm B lenfositler plazma hücrelerine dönüşmez. Bazıları uzun ömürlü ve antijen ile bir sonraki karşılaşmada hızlı ikincil immun yanıtı sağlayan bellek B lenfositlerine olgunlaşır. [3,14]
22 2.5.2 Aşılama Sonrası İmmun Yanıt
Bir aşının ilk uygulamasından sonra, primer yanıt indüklenir ve yaklaşık 2 hafta içinde koruyucu bir bağışıklık yanıtı gelişir. Dolaşımdaki antikorlar genellikle 7 ila 10 gün boyunca ortaya çıkmaz ve yanıtın immünoglobulin sınıfı bu süre boyunca değişir. Genellikle erken dönemde düşük afiniteye sahip IgM sınıfı antikorlar, geç dönemde ise yüksek afinite gösteren IgG sınıfı antikorlar görülür. IgM tipi antikorlar komplemanı fikse eder, fagositoz ve lizisi sağlar. IgG titresi, immünojenik uyarıdan sonraki ikinci haftada yükseldikçe IgM titresi düşer. Büyük miktarlarda üretilen IgG antikorlar ise fiksasyonu, presipitasyonu ve nötralizasyonu sağlar. Antikor titresi 2 – 6 hafta içinde zirveye ulaşır ve sonra yavaş yavaş düşer. [3,14]
Aynı antijen ile ikinci karşılaşmada yükseltilmiş bir humoral veya hücresel yanıt ile karşılaşılır. Bu ikincil immun yanıt efektör T lenfositler ve antikor üreten hücrelerin çoğalmasıyla genellikle 4 – 5 gün içinde, birincil yanıttan çok daha hızlı ve erken dönemde ortaya çıkar. Bellek T hücreleri olarak da bilinen efektör T lenfositleri, birincil bağışıklık tepkisinin belleğine sahip T lenfositleridir. İkincil yanıt, T ve B lenfositlerin birlikte aracılık ettiği ilk maruziyetten sonraki immünolojik hafızaya bağlıdır. Kızamık veya suçiçeği aşıları ile, hücre aracılı humoral yanıtın oluştuğu gösterilmiştir. [3]
Aşılamadan sonra immun yanıt genellikle spesifik serum antikorlarının konsantrasyonu ölçülerek değerlendirilir. Kızamık ve kızamıkçık gibi bazı viral aşılar için, dolaşımdaki antikorların varlığı klinik koruma ile ilişkilidir. Bu, bağışıklığın güvenilir bir göstergesi olsa da, serokonversiyon sadece bağışıklık yanıtının humoral parametresini ölçer.
Nadiren, aşılama sonrası primer immun yanıtsızlık görülebilir. Aşıya cevap verebilecek genetik bir yetersizliğe bağlı olabildiği gibi yaş, cinsiyet, komorbid hastalıklar gibi başka faktörler de söz konusudur. [3,5] Sıklıkla aşılamanın tekrarlanması ile istenen immun yanıt sağlanmaktadır. Örneğin, kızamık-kabakulak-kızamıkçık (KKK) aşısının ilk dozuna immünolojik olarak cevap vermeyen hemen hemen tüm çocuklar, ikinci bir dozdan sonra kızamık bağışıklığı kazanacaktır. Daha önce aşılama sonrası yeterli bir bağışıklık yanıtı geliştirmiş olan bir kişinin zaman içinde korumasını kaybetmesi durumunda ise sekonder immun yanıtsızlıktan bahsedilebilir. [3,16] Bu azalan bağışıklık, patojene tekrarlayan maruz kalma olmadığı için uzun ömürlü bellek B veya T hücrelerinin kaybına bağlanabilir. Ancak, ölçülebilir antikorun olmaması, kişinin korunmasız olduğu anlamına gelmeyebilir. Antikor
23
titresinde düşüş olmasına rağmen, yeniden aşılama veya antijen ile tekrar karşılaşma sonrası, IgM yanıtı çok az olan veya hiç olmayan, IgG antikorlarında ise hızlı bir ikincil tepki gözlenir ve bu da kalıcı koruma anlamına gelmektedir. Bazı aşılar için sadece antikorların varlığı klinik korumayı sağlamak için yeterli değildir, dolaşımda belli bir antikor seviyesi olması gereklidir (örn. 0,01 IU / mL tetanoz antitoksin). [3] Dolaşımdaki fonksiyonel antikor düzeyi, bakteriyel polisakkarit aşılarına bağışıklığın değerlendirilmesinde önemlidir. Opsonofagositik aktivite de, aşı yanıtını izlemek için tercih edilen başka bir test olarak kabul edilir. [3]
Sıklıkla aşı yanıtını ölçmek için, geometrik ortalama titre, korunma (seroproteksiyon) oranı, serokoversiyon oranı ve serokonversiyon faktörü olmak üzere dört genel parametre kullanılır. Geometrik ortalama titrede dört kat artış uygun bir aşı yanıtı olarak belirtilmekle birlikte iki kat artışın yeterli olduğunu söyleyen çalışmalar da mevcuttur. Korunma oranı, %50 koruyuculuk sağladığı düşünülen antikor titresine sahip alıcı yüzdesini temsil eder. Serokonversiyon oranı, aşılama sonrası antikor titrelerinde iki ila dört kat ya da daha fazla artış olan alıcı yüzdesi olarak tanımlanır. Serokonversiyon faktörü ise aşılama sonrası titrenin, aşılama öncesi titreye bölünmesi ile ortaya çıkar. Sıklıkla çalışmalarda geometrik ortalama titreler kullanılmıştır. [17]
2.6 Multipl Skleroz
Multipl skleroz (MS), enflamasyon, demiyelinizasyon ve akson hasarı ile karakterize merkezi sinir sisteminin kronik bir enflamatuar hastalığıdır. [1819]
İlk olarak Jean-Martin Charcot tarafından 1868 yılında tanımlanmıştır. Genellikle genç yetişkinlerde görülür. Prevalansı coğrafi özelliklere göre değişmekle birlikte 100,000 de 2 ile 200 arasındadır. Ataklarla ya da ilerleyici seyreder. [18] MS'in nedeni halen bilinmemektedir. En yaygın kabul gören teori, MS'in otoreaktif lenfositlerle karakterize enflamatuar immün aracılı bir hastalık olarak başlaması ve daha sonra, hastalığa mikroglial aktivasyon ve kronik nörodejenerasyonun hâkim olması üzerinedir. [20,21] Lublin ve arkadaşları tarafından 2013 yılında MS klinik alt tipleri, klinik izole sendrom (KİS), relapsing (ataklı) MS ve progresif (kötüleşen) MS olarak üçe ayrılmıştır. [18] Dört histopatolojik alt tipi tanımlanmış olan MS demiyelinizan lezyonlarının biyopsilerde veya otopside histopatolojik incelemesinde inflamatuar T hücreleri, B hücreleri ve makrofajlar tipik olarak görülür. [22] Beyin omurilik sıvısında (BOS) IgG ve IgM oligoklonal bantların varlığı, periferik kanda, BOS’ta ve
24
demyelinizan plaklarda myelin reaktif T lenfositlerin bulunması, IL-23 aracılı Th17 lenfositlerin yol açtığı immun yanıtın aktif MS lezyonları ile ilişkili olduğunun gösterilmesi otoimmun bir hastalık olduğu yönünde kanıtları arttırmaktadır. [22,23,24] Bununla birlikte, MS'nin otoimmün kökenli bir hastalık olduğunun doğrudan kanıtı yoktur. [25,26]
İnterferon beta gibi Th1 lenfosit aracılı bağışıklık yanıtını azaltan immünomodülatör ilaçlar, Th2 ve T düzenleyici hücresi Th3 yanıtlarını arttıran glatiramer asetat, kandan merkezi sinir sistemine T lenfositlerin göçünü engelleyen natalizumab ve B lenfosit deplesyonu yapan ocrelizumab gibi ilaçlar MS hastalığı aktivitesini azaltmak için etkilidir. [27] Nöroimmünoterapide hedef moleküllerin monoklonal antikorlarla selektif modülasyonu yeni bir terapötik yaklaşım olarak kabul görmektedir. Monoklonal antikorlar immünolojik hedefe yönelik spesifik moleküllerdir ve hedefe direkt olarak bağlanabildiği gibi başka mekanizmaları da kullanabilir. [18]
Uzun yıllar boyu MS başlıca T hücre hastalığı olarak kabul edilmekteydi fakat hayvan deneyleri, BOS’ta saptanan oligoklonal bantlar ve BOS, beyin parankimi ve periferik kanda dolaşan B hücre serilerinin özelliklerini inceleyen çalışmalar, bu hastalığın patogenezinde B hücrelerinin büyük rolü olduğuna göstermektedir.Bu nedenle, B lenfosit deplesyonuna neden olan anti-CD20 monoklonal antikorları MS için etkili bir tedavi stratejisi olarak araştırılmıştır. [18,28] Günümüzde kullanımda olan rituksimab, ocrelizumab ve ofatumumab CD20 proteinine bağlanarak hücre yıkımına neden olur. İlk anti-CD20 antikoru olan rituksimab bir kimerik fare-insan monoklonal antikorudur ve 1997’de B-hücreli lenfoma, 2006’da ise romatoid artrit hastalarında kullanılmak üzere onay almıştır. Bunu izleyen dönemlerde ise endikasyon dışı olarak IgG4 ilişkili hastalık, pemfigus, ANCA vasküliti, nöromyelitis optica, myasthenia gravis ve MS’te kullanılmıştır. [18]
2.6.1 Multipl Skleroz Tedavisinde Ocrelizumab ve Enfeksiyon ile İlişkili Komplikasyonlar
Hümanize edilmiş anti-CD20 antikoru olan ocrelizumab antikor bağımlı hücresel sitotoksisite üzerinden etki göstermekte olup, bununla beraber kompleman bağımlı sitotoksisite, apoptoz ve antikor bağımlı fagositoz yollarını da aktive etmektedir. [18,28]
Primer progresif MS (PPMS) hastalarında yapılan Oratorio çalışmasında ocrelizumab alan hastaların üç yıllık takiplerinde plasebo alan hastalara göre özürlülük birikiminde %25’lik bir azalma olduğu gösterilmiştir. PPMS hastalarında etkinliği ortaya konmuş olan tek ilaç olan
25
ocrelizumab 28 Mart 2017’ de Amerikan Gıda ve İlaç İdaresi (U.S. Food and Drug Administration (FDA)) onayı almıştır. [28,29] Türkiye’de Genişletilmiş Özürlülük Durum Ölçeği (EDSS) skoru 7 ve altında olan primer progresif MS hastalarında ve EDSS skoru 7 ve altında olan ve ataklarla seyreden MS ve/veya sekonder progresif MS hastalarında; en az bir yıl süre ile IFN-β veya teriflunomid veya dimetil fumarat veya glatiramer asetat tedavisine yanıtsız olduğunun gösterilmiş olması halinde kullanılmak üzere 18 Mayıs 2018’ de Sosyal Güvenlik Kurumu tarafından geri ödenen ilaçlar listesine alınmıştır. [30]
Yan etki olarak sıklıkla infüzyon ilişkili reaksiyonlar görülürken yapılan çalışmalarda plasebo ve IFN-β’ ya kıyasla ocrelizumab ile enfeksiyon riskinde artış görülmüştür. (sırasıyla %71,4 - %69,9 ve %58,5 - %52,5) [28] Fakat ciddi enfeksiyon oranları düşüktür. Literatürde %1 – 6 arasında değişen oranlar bildirilmiştir. En sık görülen enfeksiyonlar üst solunum yolu enfeksiyonu, nazofarenjit, idrar yolu enfeksiyonu ve griptir. Ek olarak, herpes virüsü ile ilişkili enfeksiyon, IFN-β’ya kıyasla daha sık görülmüştür. (sırasıyla %5,9 ve %3,4) [29,31] İmmunsupresif tedavi başlanan MS hastalarında, latent enfeksiyonların reaktivasyonu, asemptomatik kronik enfeksiyonların alevlenmesi görülebilmektedir. Hem enfeksiyona sekonder morbidite ve mortaliteyi azaltmak hem de MS tedavisinde kesintilerden kaçınmak için korunma ve var ise profilaksi uygulanması önem taşımaktadır. Bununla birlikte, gereksiz taramalar yapmak, duyarlılığı ve özgüllüğü düşük testler kullanarak elde edilecek olan yanlış negatif ve yanlış pozitif sonuçlar MS tedavisinde gecikme, uygunsuz profilaksi uygulamalarına bağlı yan etkiler ile sonuçlanabilir. Bu nedenle önleyici yaklaşımlar bireysel olarak her hasta için tedavi risk faktörlerine göre özelleştirilerek planlanmalıdır. [19]
2.6.1.1 Tüberküloz
Yetişkinlerde aktif tüberküloz çoğunlukla daha önce immünolojik olarak kontrol altında olan latent odakların reaktivasyonundan kaynaklanır. Tüberküloz reaktivasyonu ile ilişkili olması muhtemel MS ilaçları, hücre aracılı bağışıklığı etkileyen ilaçlardır, oysa sadece CD20 antagonistleri gibi humoral bağışıklığı hedefleyen ilaçların tüberküloz reaktivasyonu üzerinde çok az etkisi olması beklenmektedir. İmmünsüpresif ilaçlardan bağımsız olarak, yüksek tüberküloz insidansı olan ve diyabetes mellitus veya kronik böbrek yetmezliği olan yeni göçmenler gibi yüksek tüberküloz reaktivasyonu riski taşıyan kişiler için latent tüberküloz enfeksiyonu (LTBE) açısından tarama ve tedavisi önerilmektedir. [19,32] Ancak LTBE için kullanılan testlerin zayıf performans göstermeleri ve profilaksi amacıyla kullanılan ilaçların
26
hepatotoksisite, gibi riskleri göz önünde bulundurulduğunda sadece bu tedaviden fayda göreceklerin taranması önerilmektedir. [19,33]
LTBE tanısında altın standart bir test yoktur, bu amaçla iki test kullanılmaktadır. Tüberkülin deri testi (TDT) ve interferon gama salınım testidir (IGST) tüberküloz basiline karşı gelişmiş hücresel bağışıklık yanıtını ölçer. İleride gelişebilecek tüberküloz hastalığını öngörme performansı açısından İGST’ ler ile TDT arasında belirgin bir fark yoktur. [33]
Tüberkülin deri testinin esası, basilin belirli antijenik bileşenlerinin, tüberküloz basili ile enfekte olan kişilerde hücresel immunite ile ilişkili olan gecikmiş tipte bir aşırı duyarlık reaksiyonuna neden olmasıdır. Geçirilmiş enfeksiyon nedeniyle daha önce duyarlı hale gelmiş olan T lenfositler, TDT uygulanan bölgeye gelir ve bu ortamda salınan lenfokinler nedeniyle lokal vazodilatasyon, ödem ve fibrin birikimine neden olur. Böylece ölçülebilen bir endurasyon alanı oluşur. Reaksiyon 5 – 6 saatte başlayarak 48 – 72 saatte maksimuma ulaşır. [33]
Saflaştırılmış protein türevi = “purified protein derivative” (PPD) tüberküloz basili kültürü filtresinden protein presipitasyonu ile elde edilir ve bu tüberkülin antijeninden 0,1 ml doz sol ön kolun 2/3 üst kısmında avuç içine bakan yüze, deri içine uygulanır. İki ila üç gün içinde bu bölgede hiperemi ve endurasyon oluşur. Uygulamadan 72 saat sonra TDT’nin okunması sırasında hiperemi değil, endurasyonun çapı önemlidir. Ön kolun doğrultusuna dik olan çap okunmalıdır. Endurasyonun olmaması negatif olarak değil, sıfır mm olarak değerlendirilmelidir. [33]
TDT için uygulama ve okuma sürecinde deneyimli uzmanlara ihtiyaç varken İGST için taze kan gerekmektedir. Bu testler daha maliyetli ve iyi laboratuvar donanımı gerektiren testlerdir. Tarama amaçlı kullanılacak teste karar vermek için testin düzenli yapılmasının mümkün olup olmadığı, maliyeti ve katkısı göz önünde bulundurulmalıdır. Bu testin yapılacağı grupların belirlenmesi için de önemlidir. Ülkemizde LTBE tanısında hem TDT hem de İGST kullanılabilmektedir fakat öncelikle TDT yapılması önerilmektedir. Ülkemizde TDT yanıtının değerlendirilmesi için kullanılan kriterler Şekil 1’de verilmiştir. [33]
27 Şekil 1. Ülkemizde TDT yanıtının değerlendirilmesi için kullanılan kriterler (33 no’lu kaynaktan alınmıştır.)
Bu testler hem aktif TB hem de LTBE’de pozitif olduğu için aktif TB hastalığı ile LTBE ayrımında kullanılmazlar.[19,33]
28 Şekil 2. LTBE için tedavi endikasyonları (33 no’lu kaynaktan alınmıştır.)
Profilaksi amacıyla sıklıkla 9 ay INH ya da 4 ay rifampisin tercih edilmektedir. [19,33]
LTBE araştırılan her hasta, aktif tüberküloz enfeksiyonunu dışlamak amacıyla ayrıntılı öykü ve fizik muayene ve akciğer grafisi ile değerlendirilmelidir. Aktif hastalık düşündürecek bulgu saptanır ise mutlaka bakteriyolojik inceleme yapılmalıdır.
29
Ocrelizumab CD20 antagonisti etkisi ile hücresel immuniteyi etkilemeden B lenfositler üzerinde deplesyon yapması nedeniyle tüberküloz reaktivasyonu açısından yüksek risk teşkil etmemektedir fakat Türkiye gibi tüberkülozun endemik olduğu ülkelerde ocrelizumab tedavisi öncesi latent tüberküloz taranması önerilmektedir. [19] Literatürde klinik çalışmalarda ocrelizumab tedavisi altında tüberküloz reaktivasyonu saptanmadığı belirtilmiştir. [29,31]
2.6.1.2 Hepatit B Reaktivasyonu
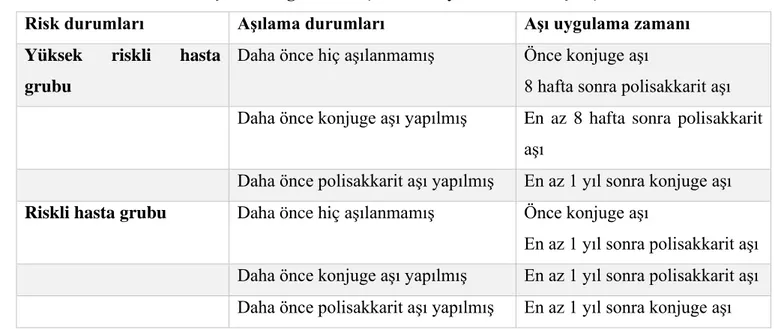
Hepatit B enfeksiyonu olanlarda immünolojik ajan kullanımı, hepatik alevlenmeler açısından risk altındadırlar. Hepatit B reaktivasyonu açısından yüksek risk altında olan hastalar için en köklü strateji, etkili ve güvenli olan antiviral ilaçlarla profilaksidir. Alternatif olarak, hepatit B virüsü (HBV) DNA'nın polimeraz zincir reaksiyonu (PCR) ile 3 ayda bir izlenmesi ve gerekirse antiviral ilaçların başlatılması şeklinde preemtif bir strateji tercih edilebilir. [19] HBsAg-pozitif ve HBsAg-negatif ancak anti-HBc pozitif hastalarda kullanılan immunsupresif ajanların risk sınıflamasına göre hepatit B reaktivasyonu gelişebileceği için tüm rehberler immunsupresif tedavi başlanacak her hastanın tarama amaçlı HBsAg, Anti-HBs ve Anti-HBc tetkiklerinin yapılmasını önermektedir. [34,35] Hepatit B reaktivasyonu riski yüksek (%10), orta (%1-10) veya düşük (%1) olarak sınıflandırılabilir. [34] Ayrıntılı sınıflama Tablo 1’de gösterilmiştir. [36]
Tablo 1. Hepatit B reaktivasyonu için risk sınıflaması
Risk grupları Hepatit B reaktivasyonu ihtimali (HBsAg ya da Anti-HBc pozitif)
Yüksek risk> %10 B lenfosit deplesyonu yapan ajanlar (ritüksimab vb) • HBsAg pozitif: %30 – 60
• HBsAg negatif – Anti-HBc pozitif: > %10 Antrasiklin deriveleri (doksorubisin vb)
• HBsAg pozitif: %15 – 30
≥ 4 hafta kortikosteroid tedavisi (10 – 20 mg /> 20mg)
30
• HBsAg pozitif: > %10
Orta risk %1 – 10 Anti – TNF (etanersept, infliksimab vb) • HBsAg pozitif: %1 – 10
• HBsAg negatif – Anti-HBc pozitif: %1
Diğer sitokin ve integrin inhibitörleri (abatasept, natalizumab vb)
• HBsAg pozitif: %1 – 10
• HBsAg negatif – Anti-HBc pozitif: %1 Tirozin kinaz inhibitörleri (imatinib, nilotinib)
• HBsAg pozitif: %1 – 10
• HBsAg negatif – Anti-HBc pozitif: %1 ≥ 4 hafta kortikosteroid tedavisi (<10 mg)
• HBsAg pozitif: %1 – 10
≥ 4 hafta kortikosteroid tedavisi (10 – 20 mg /> 20mg)
• HBsAg negatif – Anti-HBc pozitif: %1 – 10 Antrasiklin deriveleri
• HBsAg negatif – Anti-HBc pozitif: %1 – 10
Düşük risk <%1 Klasik immunsupresif tedaviler (metotreksat, azatiopürin)
• HBsAg pozitif: < %1
• HBsAg negatif – Anti-HBc pozitif: <%1 İntra – artiküler kortikosteroid uygulaması
• HBsAg pozitif: < %1
• HBsAg negatif – Anti-HBc pozitif: <%1 ≤ 1 hafta kortikosteroid kullanımı
31
• HBsAg negatif – Anti-HBc pozitif: <%1 ≥ 4 hafta kortikosteroid tedavisi (<10mg)
• HBsAg negatif – Anti-HBc pozitif: <%1
HBsAg pozitif kronik hepatit B'li hastalar, immünokompetan hastalara benzer şekilde entekavir, tenofovir disproksil fumarat (TDF) veya tenofovir alafenamid fumarat (TAF) gibi nükleozid analogları (NA) ile tedavi edilmelidir. NA'lar için izleme ve tedaviyi sonlandırma kuralları immünokompetan hastalar ile aynıdır. [34,35]
HBsAg negatif, Anti-HBc pozitif saptanan hastalar kullanılacak olan için immunsupresif ajan ile ilişkili risk durumuna göre profilaksi ya da izlem planlanabilir. Ritüksimab gibi reaktivasyon için yüksek riskli (>%10) ajanlar kullanılacak ise profilaksi başlanmalıdır. Risk <%10 ise preemtif yaklaşım ön plana çıkmaktadır. HBV seronegatif hastaların ise aşılanması önerilir. İmmün sistemi baskılanmış hastalarda anti-HBs cevabı elde etmek için daha yüksek dozlar veya güçlendirilmiş aşı gerekebilir. [34]
Henüz yeni bir ajan olan ocrelizumabın hepatit B reaktivasyonu ile ilişkisini gösteren veriler kısıtlıdır. Bununla birlikte benzer etki mekanizması olan, romatolojik hastalıklar ve hematolojik malignitelerin tedavisinde kullanılan ritüksimab ile ilgili litaratüre bakıldığında, HBsAg negatif, Anti-HBc pozitif 46 lenfoma hastasında izlemde %24 reaktivasyon görülmüş olup, ritüksimab almayan kolda reaktivasyona rastlanmamıştır. Bu nedenle ocrelizumab tedavisinin de hepatit B reaktivasyonu açısından riskli olabileceği düşünülmektedir. [37,38]
2.7 Multipl Skleroz ve Aşılama
MS hastalarında araya giren enfeksiyonlar hastalığın seyrini olumsuz etkilemektedir. Tedavide kullanılan immunsupresif ilaçlar nedeniyle bozulan konak savunması enfeksiyon hastalıklarından korunma ve aşı ile bağışıklama önemli bir konu haline gelmiştir. [2,18] Uygun erişkin bağışıklaması, ocrelizumab gibi anti-CD20 monoklonal antikorları ile tedavi edilen hastalar için enfeksiyon riskinin azaltılmasında ciddi önem arz etmektedir. Canlı olmayan aşılar, özellikle tedaviden 4 hafta önce uygulandığında güvenli ve etkilidir. CD20 hedefli tedavi sırasında ya da hemen sonrasında canlı olmayan aşılamanın etkinliği tartışmalıdır. Literatürdeki klinik veriler, rituksimab uygulamasından sonra en az 6 ay
32
boyunca serokonversiyonun mevcut olmadığını veya ciddi şekilde bozulmuş olduğunu göstermektedir [2,37]
Rekombinan ve inaktive aşıların immunsupresif hasta grubunda enfeksiyon oluşturma riski yoktur fakat yetersiz bir immün yanıt oluşturabilirler. Uygun bağışıklık yanıtın gelişebilmesi için 2 hafta gerektiği göz önünde bulundurulduğunda inaktive aşılar, tedaviyi geciktirmemek kaydıyla, tedavi başlanmadan en az 2 hafta önce, mümkünse 4 hafta öncesinde uygulanmalıdır. Belimumab ve rituksimab haricinde immünsupresif ya da immünmodulatuar ilaçlar kesildikten sonra inaktive aşıların uygulanması için beklemeye gerek yoktur. Bu ajanlar kesildikten sonra yeterli immun yanıt elde edilebilmesi için aşı uygulanması için en az 6 ay beklenmesi, aşı uygulandıktan sonra da ilacın başlanması için 1 ay beklenmesi önerilir. [4] Bununla birlikte, popülasyon çalışmaları aşılamanın hem yaşam kalitesini hem de beklentisini iyileştirebildiğini ve CD20 hedefli tedaviler alan hastalarda aşı şemasını optimize etmeye yönelik klinik çalışmaların devam ettiğini göstermiştir. [37] Literatürde ocrelizumab ile yapılmış aşı çalışması olmadığı için aşı yanıtlarının benzer şekilde etki eden ritüksimab ile aynı doğrultuda olacağı düşünülmektedir.
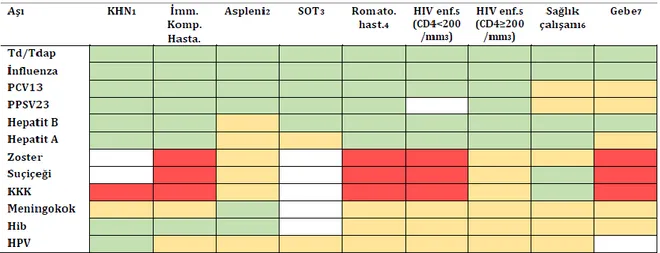
İmmunsupresif hastalarda rehberlerce uygulanması önerilen aşılar şekil 3’te verilmiştir. [4]
Şekil 3. EKMUD Erişkin Bağışıklama Rehberi 2019 risk gruplarına göre aşılama önerileri (4 no’lu kaynaktan alınmıştır.)
33 2.7.1 Hepatit B Aşısı
Hepatit B aşısı ilk kez 1982’ de plazma kökenli bir aşı olarak üretilmiştir. Günümüzde ise HBV’ nin rekombinant DNA teknolojisi ile üretilmiş olan majör yüzey antijenini içeren aşılar kullanımdadır. Bu yüzey antijeni saflaştırılmış ve alüminyüm hidroksit üzerine adsorbe edilmiştir. Antijen, HBV majör yüzey antijenini kodlayan s genini taşıyan maya hücreleri (Saccharomyces cerevisiae, Hansenula polymorpha) kültüründen genetik mühendisliği yoluyla üretilmiş olup rekombinasyon teknolojisi ile üretilen bu aşılar hiçbir enfeksiyöz parça içermedikleri için güvenilirdirler. [4]
Ülkemizde hepatit B aşısı seronegatif ve duyarlı tüm erişkinlere önerilmekle birlikte bazı risk grupları öncelikli olarak belirlenmiştir. EKMUD Erişkin Bağışıklama Rehberi 2019’a da öncelikli olarak belirtilen gruplar aşağıda verilmiştir. [4]
• Sağlık çalışanlarının yetiştirildiği okullardaki öğrenciler dahil olmak üzere bütün sağlık çalışanları,
• Damar içi ilaç bağımlıları, • Hemodiyaliz hastaları,
• Kemik iliği ve organ nakli adayları,
• Hepatit B açısından seronegatif aile içi temaslılar, • HBsAg pozitif anneden doğan çocuklar,
• Sık kan ve kan ürünü uygulanması gereken hastalar, • HBsAg pozitif kişinin anne, baba ve kardeşleri, • Çok sayıda cinsel partneri olanlar, seks işçileri, • Eşcinsel bireyler,
• Kronik karaciğer hastalığı olanlar,
• Cezaevi ve ıslahevindeki çalışanlar ve hükümlüler, • Kuaförler, manikür-pedikür ile uğraşan kişiler,
• Piercing ve dövme yapan ve yaptırmak isteyen kişiler,
• Zihinsel engelli yetiştirme yurtları ve bakım evlerinde kalanlar, • Risk altında olan askerler, itfaiye personelleri, polisler,
• Afetlerde ilk yardım uygulayan kişiler