I T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI PROF. DR. KAAN KAVAKLI
PEDİATRİK HEMATOPOETİK KÖK HÜCRE
TRANSPLANTASYONU YAPILAN HASTALARDA
ENFEKSİYON SÜRVEYANSI
UZMANLIK TEZİ
Dr. Eda KOŞAK ÇAVDAR
DANIŞMAN
Prof. Dr. N. Zafer KURUGÖL
İZMİR 2019
II ÖNSÖZ
Ege Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı’nda yapmış olduğum uzmanlık eğitimim süresince bilgi ve deneyimleri ile eğitimime katkıda bulunan basta Anabilim Dalı Başkanımız Sayın Prof. Dr. Kaan Kavaklı olmak üzere tüm değerli öğretim üyelerine, kıdemlilerime, uzmanlarıma ve birlikte çalıştığım tüm asistan arkadaşlarıma; tez çalışmalarım sırasında yardımlarını esirgemeyen, akademik deneyimlerini tezimin her aşamasında benimle paylaşan değerli hocam ve tez danışmanım Sayın Prof. Dr. N. Zafer Kurugöl’e,
Tezimin oluşturulması ve hazırlanması dahil tüm tez sürecinde her daim sabırla desteğini sunan yardımlarını esirgemeyen Sayın Uzm. Dr. Zümrüt Şahbudak Bal’a,
Tez çalışmam süresince yardımcı olan başta Sayın Prof. Dr. Serap Aksoylar olmak üzere Çocuk Kök Hücre Nakil Ünitesi ekibi’ne,
Ege Üniversitesi Çocuk Hastanesi çatısı altında geçirdiğim eğitim süresi içerisinde beraber çalıştığım, zorlukları beraberce aştığım bütün hemşire arkadaşlarıma ve personellere,
Doğduğum günden beri her zaman yanımda olan desteklerini benden hiç esirgemeyen canım annem Ayfer Koşak, babam Uğur Abbas Koşak ve kardeşlerim Seda Koşak, Furkan Koşak ve İlayda Koşak’a,
Hayatıma anlam katan, varlıkları, destekleri ve sevgileriyle ile her zaman yanımda olan biricik eşim Miraç Çavdar ve kızım Aden Mira Çavdar’a,
Sonsuz teşekkürler…
Dr. Eda KOŞAK ÇAVDAR İzmir, 2019
III İÇİNDEKİLER TABLOLAR DİZİNİ ... VI ŞEKİLLER DİZİNİ ... VIII KISALTMALAR ... IX ÖZET ... XII SUMMARY ... XV 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 3
2.1. Hematopoetik kök hücre transplantasyonu ... 3
2.1.1. Tanımı ... 3
2.1.2. Tarihçe ... 3
2.1.3. Türkiye’de Kök Hücre Nakli ... 3
2.1.4. Kök Hücre Nakli Tipleri ... 4
2.1.4.1. Otolog hematopoetik kök hücre nakli ... 4
2.1.4.2. Allojenik hematopoetik kök hücre nakli ... 4
2.1.4.3. Sinjeneik hematopoetik kök hücre nakli ... 6
2.1.5. Kök Hücre Kaynakları ... 6
2.1.5.1 Kemik İliği ... 6
2.1.5.2. Periferik Kan ... 6
2.1.5.3. Kordon Kanı ... 6
2.1.6. Hazırlama Rejimi ... 7
2.1.6.1. Miyeloablatif hazırlama rejimi ... 7
2.1.6.2. Nonmiyeloablatif hazırlama rejimi ... 7
2.1.6.3. Yoğunluğu azaltılmış hazırlama rejimi ... 8
2.1.7. Engraftman ... 10
2.1.7.1. Erken greft fonksiyonuna (engraftman) etki eden faktörler ... 10
IV
2.2. Hematopoietik Kök Hücre Transplantasyonuna Bağlı Mortalite ... 11
2.3. Hematopoietik Kök Hücre Transplantasyonu Sonrası Gelişen Erken Dönem Komplikasyonlar ... 12
2.3.1. Erken Dönem Enfeksiyonlar ... 13
2.3.2. Akut greft versus host hastalığı ... 15
2.3.3. Greft yetmezliği ... 18
2.3.4. Hemorajik sistit ... 19
2.4. Enfeksiyon Tanımları ... 19
2.4.1. Febril Nötropeni ... 19
2.4.2. Febril Nötropeni Hastalarının Özellikleri ... 20
2.4.3. Febril Nötropenik Hastalarda Enfeksiyon Dışı Ateş Nedenleri ... 21
2.4.4. Enfeksiyon Kategorileri ... 22
2.5. Hematopoietik Kök Hücre Transplantasyonu Sonrası Gelişen Enfeksiyonların Özellikleri ... 23
2.6.Hematopoietik Kök Hücre Transplantasyonu Sonrası Görülen Enfeksiyonların Transplant Dönemine Göre Değerlendirilmesi ... 23
2.6.1. Pre-engraftman dönemi (0-30 gün) ... 23
2.6.2.Post-engraftman dönemi (30-100 gün) ... 24
2.7. Hematopoietik Kök Hücre Transplantasyonu Sonrası Erken Dönemde Görülen Özgül Enfeksiyonlar ... 24
2.7.1. Bakteriyel Enfeksiyonlar ... 24
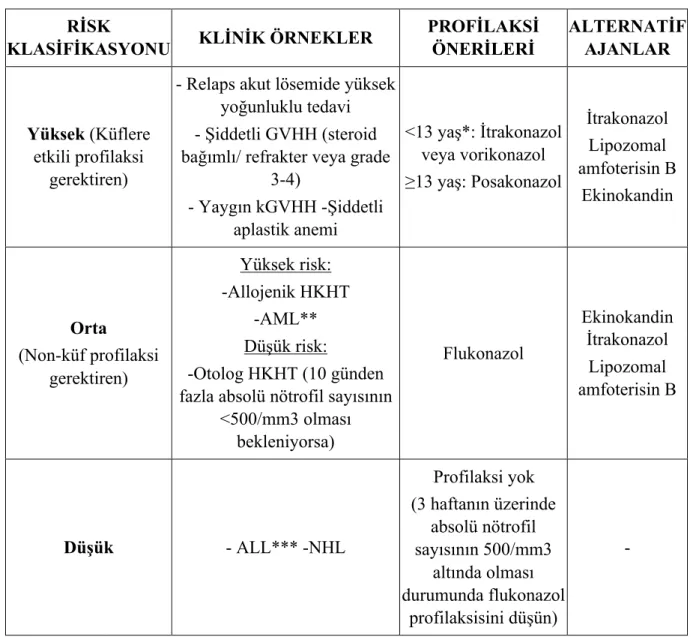
2.7.2. Fungal Enfeksiyonlar ... 25
2.7.2.1.İnvaziv Fungal Enfeksiyon ... 25
2.7.2.2. Aspergillus enfeksiyonları ... 30
2.7.2.3. Kandida enfeksiyonları ... 30
2.7.2.4. Mukormikozis ... 31
V
2.7.2.6. İnvaziv fungal enfeksiyonların tanısında serolojik ve moleküler
yöntemler ... 34
2.7.2.7. İnvaziv fungal enfeksiyon tanısında radyolojik yöntemler ... 34
2.7.3. Viral Enfeksiyonlar ... 35
2.7.3.1. Sitomegalovirüs Enfeksiyonları ... 35
2.7.3.2. Epstein-Barr Virüs Enfeksiyonları ... 39
2.7.3.3. Adenovirüs enfeksiyonları ... 39
2.7.3.4. Solunum Virüs Enfeksiyonları ... 39
2.7.3.5. BK Virüs Enfeksiyonları ... 40
3. MATERYAL METOD ... 41
4.BULGULAR ... 44
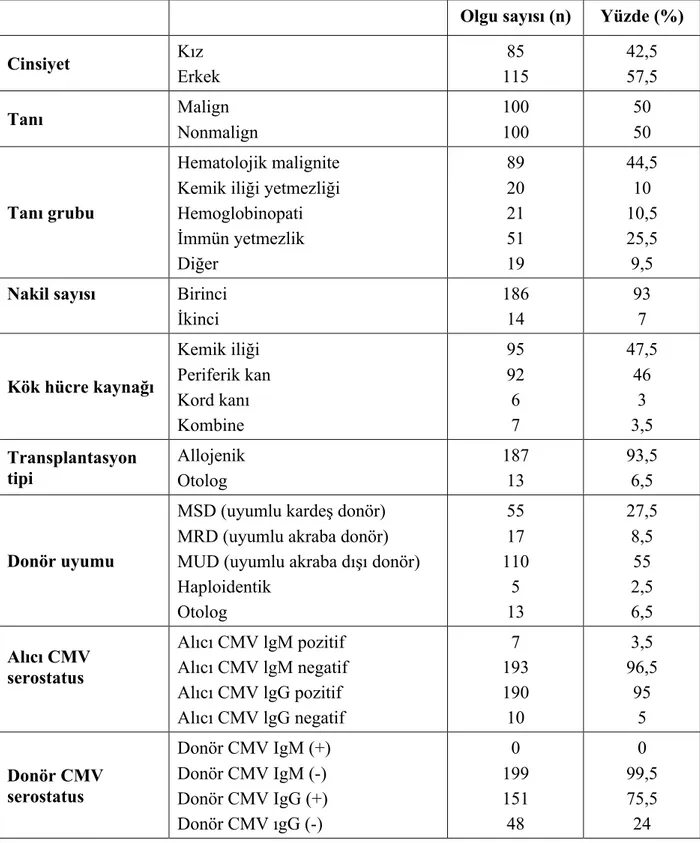
4.1. Hastaların Demografik ve Transplantasyon ile İlgili Verilerinin Değerlendirilmesi ... 44
4.2. Febril Atak ve Bakteriyel Enfeksiyon Sıklıklarının Değerlendirilmesi ... 47
4.3. Sitomegalovirüs (CMV) Enfeksiyonları ve Mortalite Sıklığının Değerlendirilmesi ... 55
4.4. İnvaziv Fungal Enfeksiyon ve Mortalite Sıklığının Değerlendirilmesi ... 56
4.5 Diğer Viral Etkenlerinin Değerlendirilmesi ... 57
4.6.Erken Dönem Transplanta Bağlı Mortalite Sıklığı ve Nedenlerinin Değerlendirilmesi ... 59
5. TARTIŞMA ... 69
6. SONUÇLAR ... 77
KAYNAKÇA ... 83
EKLER Ek 1: Etik Kurul İzni ... 93
Ek 2: Olgu Rapor Formu ... 97
Ek 3: Özgeçmiş ... 101
VI
TABLOLAR DİZİNİ
Tablo 1 : Pediatrik hastalarda otolog hematopoetik kök hücre transplantasyonu
endikasyonları ... 4
Tablo 2 : Pediatrik hastalıklarda allojenik hematopoetik kök hücre transplantasyonu endikasyonları ... 5
Tablo 3 : Yaygın olarak kullanılan ajanlara/kombinasyonlara göre miyeloablatif ve nonmiyeloablatif hazırlama rejimleri örnekleri ... 8
Tablo 4 : Allojenik hematopoetik kök hücre transplantasyonunda yoğunluğu azaltılmış kondisyon rejimleri ... 9
Tablo 5 : Transplantasyon ilişkili mortalite riskinin belirlenmesi ... 12
Tablo 6 : Kök hücre nakli yapılan hastalarda erken dönemde görülen enfeksiyonlar ... 14
Tablo 7 : Akut greft versus host hastalığının klinik belirtileri ... 15
Tablo 8 : Akut greft versus host hastalığında derecelendirme ve evrelendirme ... 16
Tablo 9 : Akut greft versus host hastalığının histopatolojik özellikleri ... 17
Tablo 10 : Febril nötropeni tanılı hastalarda yüksek risk grubu (AEHT) ... 21
Tablo 11 : Endemik mikoz dışı kanıtlanmış invaziv fungal hastalık kriterleri ... 26
Tablo 12 : Endemik mikoz dışı yüksek olası invaziv fungal hastalık tanı kriterleri ... 28
Tablo 13 : Endemik mikoz tanı kriterleri ... 29
Tablo 14 : Pediatrik invaziv fungal enfeksiyon risk grupları ... 29
Tablo 15 : Çocuklarda antifungal profilaksi önerileri ... 33
Tablo 16 : Sitomegalovirüs enfeksiyonunda preemptif ve profilaktik tedavi seçenekleri ... 38
Tablo 17 : Transplantasyon yapılan hastaların demografik ve klinik özellikleri ... 45
Tablo 18 : Nakil olan hastaların genel profili ... 46
Tablo 19 : Febril atak sayısı ... 47
Tablo 20 : Hasta başına bakteriyel enfeksiyon sayısı ... 49
Tablo 21 : Kültürlerinde bakteriyel üreme saptanan olgularda mikroorganizma dağılımı ... 51
VII
Tablo 22 : Miyeloid engraftman öncesi ve sonrası dönemlerde görülen enfeksiyonların sıklığı ... 52 Tablo 23 : Miyeloid engraftman öncesi ve sonrası dönemlerde görülen bakteriyel
enfeksiyonların gram pozitif ve gram negatif etken sıklığı ... 53 Tablo 24 : Transplantasyon sonrası nedeni bilinmeyen ateş ve mikrobiyolojik
dökümente enfeksiyonları laboratuar değerleri ortalamasının karşılaştırması ... 54 Tablo 25 : Mikrobiyolojik dökümente enfeksiyon ve nedeni bilinmeyen ateş saptanan
hastalarda nötropeni sıklığı ... 54 Tablo 26 : Febril atak zamanı mikrobiyolojik dökümente enfeksiyon saptanan
hastalarda nötropeni sıklığı ... 55 Tablo 27 : Posttransplant Sitomegalovirüs gelişimi ile invaziv fungal enfeksiyon’nun
karşılaştırılması ... 56 Tablo 28 : Transplatasyon sonrası invaziv fungal enfeksiyon gelişimi ... 56 Tablo 29 : Antifungal profilaksi kullanımı ile posttransplant invaziv fungal
enfeksiyon gelişiminin karşılaştırılması ... 57 Tablo 30 : Erken/ geç invaziv fungal enfeksiyon tanısı alan hastalardaki tanı
yöntemlerinin dağılımı ... 57 Tablo 31 : Transplantasyon sonrası saptanan diğer viral enfeksiyon etkenleri ... 58 Tablo 32 : Akut greft versus host hastalığı ile transplantasyon sonrası bakteriyel
enfeksiyon, sitomegalovirüs ve invaziv fungal enfeksiyon gelişimi ilişkisi ... 59 Tablo 33 : Transplantasyon sonrası steroid kullanımı ile bakteriyel enfeksiyon,
sitomegalovirüs ve invaziv fungal enfeksiyon gelişimi ilişkisi ... 60 Tablo 34 : Kondisyon rejimi durumu ile transplantasyon sonrası bakteriyel
enfeksiyon, sitomegalovirüs ve invaziv fungal enfeksiyon gelişimi ilişkisi ... 61 Tablo 35 : Kök hücre kaynağının transplantasyon sonrası bakteriyel enfeksiyon
gelişimine etkisi ... 62 Tablo 36 : Transplantasyon sonrası bakteriyel enfeksiyon gelişimi ile şok gelişimi ve
yoğun bakım yatışının karşılaştırılması ... 63 Tablo 37 : Trasplatasyon sonrası erken dönem mortalite nedenleri ... 64
VIII
ŞEKİLLER DİZİNİ
Şekil 1 : Febril atakların febril atak bazında mikrobiyolojik dökümente enfeksiyon dağılımı ... 48 Şekil 2 : Febril atakların hasta sayısı bazında mikrobiyolojik dökümente enfeksiyon
dağılımı ... 48 Şekil 3 : Mikrobiyolojik dökümente enfeksiyonlarda febril atak nedenleri ... 49 Şekil 4 : Kan kültüründe üreme saptanan mikroorganizmaların dağılımı ... 52 Şekil 5 : Hematopoetik kök hücre transplantasyonu sonrası ilk 30 gün ve 31- 100
gün gram pozitif ve negatif etken dağılımı (P= 0,013) ... 53 Şekil 6 : Erken dönem mortalite nedenleri ... 64 Şekil 7 : Primer tanı grubunun genel sağkalım üzerine etkisinin Kaplan-Meier ile
gösterimi ... 65 Şekil 8 : Transplantasyon sonrası sitomegalovirüs gelişiminin genel sağkalım
üzerine etkisinin Kaplan-Meier ile gösterimi ... 66 Şekil 9 : Transplantasyon sonrası bakteriyel enfeksiyon gelişiminin genel sağkalım
üzerine etkisinin Kaplan-Meier ile gösterimi ... 67 Şekil 10 : Transplantasyon sonrası invaziv fungal enfeksiyon gelişiminin genel
IX
KISALTMALAR HKHT : Hematopoetik Kök Hücre Transplantasyonu CMV : Sitomegalovirüs
İFİ : İnvaziv Fungal Enfeksiyon GVHH : Greft Versus Host Hastalığı aGVHH : Akut Greft Versus Host Hastalığı AD : Anabilim Dalı
SVK : Santral venöz kateter
EORTC : European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group
MSG : Mycoses Study Group ALL : Akut Lenfoblastik Lösemi AML : Akut Myeloid Lösemi
ALPS : Otoimmun Lenfoproliferatif Hastalık Hodgkin Lenfoma HL : Otoimmun Lenfoproliferatif Hastalık Hodgkin Lenfoma NHL : Nonhodgkin Lenfoma
MDS : Myelodisplastik Sendrom KML : Kronik Myeloid Lösemi
JMML : Juvenil Myelomonositik Lösemi HLH : Hemafagositik Lenfohistiyositoz MPS : Mukopolisakkaridoz
KGH : Kronik Granülomatöz Hastalık SCID : Ağır Kombine İmmun Yetmezlik HLA : İnsan Lökosit Antijeni
MHC : Major Histokompatibilite Kompleks IL : İnterlokin
X MIP : Makrofaj İnflamatuar Protein
TR : Tam Remisyon
DMSO : Dimetil Sulfoksid
CBV : Karmustin, Siklofosfamid, Etoposid
BEAM : Karmustin, Etoposid, Sitozin arabinozid, Melfalan TBI : Tüm Vücut Işınlama
Gy : Gray
GCSF : Granülosit Koloni Stimülan Faktör
GM-CSF : Granülosit Makrofaj Koloni Stimülan Faktör SSS : Santral Sinir Sistemi
GİS : Gastrointestinal Sistem ATG : Antitimosit Globulin CSA : Siklosporin
MTX : Metotreksat
MMF : Mikofenolat Mofetil VOD : Venookluziv Disease TAM : Trombotik Mikroanjiopati HHV : Human Herpes Virüs
SOS : Sinüzoidal Obstrüksiyon Sendromu İFNγ : İnterferon gama
CO : Karbonmonoksit
DLCO : Akciğerlerin karbonmonoksit difüzyon kapasitesi VZV : Varisella Zoster Virüs
İVİG : İntravenöz immunoglobulin SFT : Solunum Fonksiyon Testi ACTH : Adrenokortikotropik Hormon BOS : Beyin Omurilik Sıvısı
XI BT : Bilgisayarlı Tomografi
MRG : Manyetik Rezonans Görüntüleme BAL : Bronkoalveoler Lavaj
İV : İntravenöz
PCR : Polimeraz Zincir Reaksiyonu
MALDI-TOF MS : Matrix-Assisted Laser Desorption/Ionization Time-Of-Flight Mass Spectrometry
İPA : İnvaziv Pulmoner Aspergilloz KGA : Kanda Galaktomannan Antijen
ECIL : European Conference on Infections in Leukemia MSD : Match Sibling Donor
MRD : Match Related Donor MUD : Match Unrelated Donor
ARDS : Akut Respiratuar Distress Sendromu ESBL : Genişlemiş Spektrumlu Beta-Laktamaz SVP : Solunum viral panel
RSV : Respiratuar sinsityal virüs
XII ÖZET
PEDİATRİK HEMATOPOETİK KÖK HÜCRE TRANSPLANTASYONU YAPILAN HASTALARDA ENFEKSİYON SÜRVEYANSI
Giriş: Hematopoetik kök hücre transplantasyonu (HKHT) çocuk ve adolesan yaş grubunda birçok malign ve non-malign hastalığın tedavisinde etkin bir tedavi seçeneği olarak kullanılmaktadır. Hematopoetik kök hücre transplantasyonu sonrası erken ve geç dönemde gelişen komplikasyonlar, hastaların prognozunu ve yaşam kalitesini etkilemektedir. Nakil sonrası gelişen enfeksiyonlar morbidite ve mortalitenin önemli bir nedenidir ve hastanede kalış süresini uzatır.
Hematopoetik kök hücre transplantasyonu yapılan hastalarda bakteriyel enfeksiyon, invaziv fungal enfeksiyon (İFİ) ve sitomegalovirüs (CMV) viremisi/ reaktivasyonu sıktır. En sık görülen enfeksiyonlar, kateter ilişkili primer kan dolaşımı enfeksiyonları, pnömoni ve idrar yolu enfeksiyonudur. Altta yatan hastalık tipi, genetik polimorfizmler ve farklı kondisyon rejimleri nakil alıcılarındaki enfeksiyonların profilini etkiler. Diğer ilişkili faktörler, bu hastalarda santral venöz kateterler (SVK), komorbidite varlığı, nötropeninin yoğunluğu ve süresi, mukozit ve antimikrobiyal profilaksi kullanımı enfeksiyon komplikasyonlarının gelişimini etkileyebilir.
Kanser hastalarında SVK ile ilişkili enfeksiyonların bu popülasyondaki mortalite oranlarında yedi kat artışla ilişkili olduğu bilinmektedir. Nakil sonrası gelişen enfeksiyon nedeni ile morbidite ve mortalite oranı artmaktadır. Son yıllarda destekleyici bakım önlemlerinde sağlanan gelişmeler, immunsupresyon mekanizmalarının daha iyi anlaşılması, yoğunluğu azaltılmış, hazırlık rejimlerinin, yeni antimikrobiyal ilaçların ve profilaksi stratejilerinin kullanıma girmesiyle birlikte morbidite ve mortalite azalmıştır.
Hematopoetik kök hücre transplantasyonu 1992’den beri Türkiye'de yapılmasına rağmen, az sayıda çalışma ülkemizde çocuk ve ergenlerdeki kendine özgü enfeksiyon özelliklerini ve komplikasyonlarını ele almıştır.
Amaç: Bu çalışmanın amacı Ege Üniversitesi Tıp Fakültesi Çocuk Hastanesi’nde Hematopoetik kök hücre nakil hastalarında retrospektif olarak enfeksiyon etkenlerini, klinik
XIII
bulgularını ve prognozu belirlemektir. Kök hücre nakil komplikasyonlarının nakilden sonraki ilk 100 gün içinde mortalite ve morbidite üzerindeki etkisini değerlendirmektir.
Hipotez: Hematopoetik kök hücre transplantasyonu yapılan hastalarda enfeksiyonlar erken dönem komplikasyon gelişimini etkilemektedir. İkincil hipotez Greft versus host hastalığı (GVHH) ve transplantasyon için kullanılan immunsupresif rejimler, posttransplant fırsatçı enfeksiyon sıklığında artışa neden olmaktadır.
Yöntem: Eylül 2014- Aralık 2018 tarihleri arasında Ege Üniveristesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı (AD) Kemik İliği Transplantasyon Ünitesinde allojenik ve otolog HKHT yapılan ve verilerine ulaşılabilen 200 çocuk hastanın transplantasyon sonrası ilk 100 günü çalışmaya dahil edildi. Hastaların verilerine poliklinik izlem dosyalarından ve elektronik hastane kayıtlarından ulaşıldı. Transplantasyon sırasındaki hasta yaşı, kullanılan kök hücre kaynağı, donör ile ilgili bilgiler, verilen kondisyon rejiminin özellikleri, GVHH profilaksisi, donör-alıcı CMV serolojik durumu, transplantasyon öncesi-sonrası bakteriyel enfeksiyon, CMV ve fungal enfeksiyon varlığı, antifungal, antibakteriyel ve antiviral profilaksi, nötrofil engraftman günleri, posttransplant steroid kullanımı, enfeksiyon üreme yeri, enfeksiyon gelişenlerde tanının hangi yöntemle konulduğu, enfeksiyon etkeni, enfeksiyon saptandığında kan hemogram ve biokimya parametreleri, transplantasyon öncesi-sonrası pik CMV DNA ve EBV DNA düzeyleri, transplantasyon öncesi-sonrası ilk 100 günde mortalite gelişip gelişmediği, mortalite gelişmesi halinde ise nedeni olgu rapor formuna kaydedildi. Araştırmaya yön verecek verilerine ulaşılamayan hastalar çalışma dışı bırakıldı.
Bulgular: Hastaların 115’i (%57,5) erkek, 85’i kız (%42,5) kız olup HKHT yapıldığında ortalama yaş 94,3 ay, median 85 ay (2-252) idi. İzlemde 14 hastaya greft reddi/yetmezliği nedeni ile ikinci kez kök hücre nakli uygulandı. Allojenik kök hücre nakli 187, otolog kök hücre nakli 13 hastaya uygulandı. Hazırlama rejimi dahilinde 33 hastaya TBI uygulandı. Greft versus host hastalığı profilaksisi 182 hastaya verildi. Nötrofil engraftman günü ortalama 17,5 gün, median 17 gün (9-32)’dü ve 7 hastada transplantasyon sonrasında nötrofil sayıları hep 1000/μl üzerinde seyrettiği için nötrofil engraftman gününden bahsedilemedi. 8 hasta greft reddi/ yetmezliği ve 9 hasta eksitus olması nedeniyle 17 hastada engraftman olmadı. Transplantasyon sonrası 200 hastadan 13 hasta ateşli atak geçirmedi. 187 hasta toplam 323 febril atak geçirdi. Transplantasyon sonrası 323 febril atağın 172 tanesi nedeni bilinmeyen
XIV
ateş olarak saptandı. 151 bakteriyel febril atağın 66’sının gram pozitif, 85’inin gram negatif olduğu saptandı. Transplantasyon sonrası 90 hastada CMV gelişimi nedeniyle gansiklovir kullanıldı. Transplantasyon sonrası 21 hastada İFİ gelişti. Transplantasyon sonrası CMV reaktivasyonu gelişimi İFİ açısından riski arttırmamaktadır (P=0.799). Transplantasyon sonrası en sık rinovirüs olmak üzere 40 hastada viral solunum yolu enfeksiyonu saptandı. Transplantasyon sonrası en sık rotavirüs olmak üzere 44 hastada viral gastroenterit enfeksiyonu saptandı. Transplantasyon sonrası 25 hastada idrar BK virüs enfeksiyonu saptandı. Toplam 54 hastada akut GVHH gelişti. Transplantasyon sonrası aGVHH gelişenlerde bakteriyel enfeksiyon riski ve CMV gelişim riski artmaktadır (sırasıyla P=0.002, 0.014). Transplantasyon sonrası İFİ gelişimi ile aGVHH arasında istatistiksel olarak anlamlı ilişki saptanmamıştır (P=0.864). Transplantasyon sonrası steroid kullanımı olanlarda CMV reaktivasyonu daha fazla görülmesine rağmen istatistiksel olarak anlamlı saptanmamıştır (P=0.58). Transplantasyon sonrası steroid kullanımı İFİ gelişim riski arasında anlamlı ilişki saptanmamıştır. (P=0.101). Febril atak öncesi steroid kullanımı olanlarda bakteriyel enfeksiyon gelişim riski artmaktadır (P=<0.001). Kondisyon rejimleri ile bakteriyel enfeksiyon gelişimi, CMV gelişimi ve İFİ riski arasında anlamlı ilişki saptanmamıştır (sırasıyla P=0.111, 0.175, 0.138). Kök hücre kaynağının transplantasyon sonrası bakteriyel enfeksiyon gelişimi, CMV gelişimi ve İFİ gelişimi arasında istatistiksel olarak anlamlı bulunmamıştır (sırasıyla P=0.088, 0.499, 0.143). Bakteriyel enfeksiyon ile şok gelişimi istatistiksel olarak anlamlı saptanmıştır (P=0.001). Bakteriyel enfeksiyon ile yoğun bakım yatışı istatistiksel olarak anlamlı saptanmıştır (P=0.003). Transplantasyon sonrası ilk 100 günde %9 mortalite görülmüştür.
Tartışma: Çocukluk çağında değişik endikasyonlarla farklı hazırlama rejimi, donör ve kök hücre kaynağı kullanılarak HKHT yapılmış heterojen bir hasta grubunda, HKHT sonrası yapılan değerlendirmede hastaların %43,5’unda bakteriyel enfeksiyon saptandı. Akut GVHH gelişen hastarda bakteriyel enfeksiyon riski ve CMV gelişim riskinin arttığı gözlendi. Nakil sonrası steroid kullanımı olanlarda bakteriyel enfeksiyon gelişimi riskinin arttığı görüldü. Bakteriyel enfeksiyon gelişen olgularda yoğun bakım yatış oranı %24,1 idi. Çocukluk çağında HKHT yapılan hastaların enfeksiyon ilişkili mortalite 13 (%6,5) saptandı.
Anahtar Kelimeler: Hematopoetik kök hücre transplantasyonu, Bakteriyel enfeksiyon, CMV viremisi, CMV reaktivasyonu, İnvaziv fungal enfeksiyon, Greft Versus Host Hastalığı, Mortalite
XV SUMMARY
INFECTION SURVEYANCE IN PATIENTS WITH PEDIATRIC HEMATOPOETIC STEM CELL TRANSPLANTATION
Introduction: Hematopoietic stem cell transplantation (HSCT) is an effective treatment for the treatment of many malignant and non-malignant diseases in children and adolescents. Early and late complications after hematopoietic stem cell transplantation affect the prognosis of the disease and life quality of the patients. Post-transplant infections are an important cause of morbidity and mortality and prolong hospital stay.
Bacterial infection, invasive fungal infection (IFI) and cytomegalovirus (CMV) viremia /reactivation are common in patients undergoing hematopoietic stem cell transplantation. The most common infections are catheter-related primary bloodstream infections, pneumonia and urinary tract infection. Type of underlying disease, genetic polymorphisms and different conditioning regimens affect the profile of infections in theese patients. Other related factors, such as central venous catheters (CVC), presence of comorbidity, intensity and duration of neutropenia, use of mucositis and antimicrobial prophylaxis may affect the occurence of infection complications.
It is known that CVC-related infections in cancer patients are associated with a seven-fold increase in mortality in this population. Morbidity and mortality rates increase due to infection after transplantation. Recent advances in supportive care, improved understanding of the mechanisms of immunosuppression, reduced intensity preparation regimens used with new antimicrobial drugs and prophylaxis strategies reduced morbidity and mortality.
Hematopoietic stem cell transplantation is carried out in Turkey since 1992. However, few studies have examined the specific infection characteristics and complications in children and adolescents in our country.
Objective: The aim of this retrospective study is to determine the infectious agents, clinical findings and prognosis of hematopoietic stem cell transplant patients in Children's Hospital of Ege University Faculty of Medicine and to evaluate the effect of stem cell transplantation complications on mortality and morbidity within the first 100 days after transplantation.
XVI
Hypothesis: In patients undergoing hematopoietic stem cell transplantation, infections affect the development of early complications. Secondary hypothesis, graft versus host disease (GVHD) and immunosuppressive regimens used for transplantation increase the frequency of posttransplant opportunistic infections.
Methods: The first 100 days after transplantation of 200 allogeneic and autologous HSCT patients in the Bone Marrow Transplantation Unit of Ege University Faculty of Medicine, Department of Pediatrics (AD) between September 2014 and December 2018 were included in the study. The data was gathered from clinic follow-up files and electronic hospital records. Patient age during transplantation, stem cell source used, information about the donor, properties of the given conditioning regimen, GVHD prophylaxis, donor-recipient CMV serological status, pre and post-transplant bacterial infection, presence of CMV and fungal infection, antifungal, antibacterial and antiviral prophylaxis, neutrophil engraftment days, posttransplant steroid use; when infection was detected, infection site, diagnosis, method used for diagnose of infection, casue of infection, blood hemogram and biochemical parameters, pre-transplant post-transplant peak CMV DNA and EBV DNA levels, mortality in the first 100 days after transplantation, and in case of mortality, the cause were recorded in the case report form. We excluded patients that vital data could not be reached.
Results: 115 (57.5%) of the patients were male and 85 (42.5%) were female. Mean age was 94.3 months and median 85 months (2-252). During follow-up, 14 patients underwent a second stem cell transplantation due to graft rejection / failure. Allogeneic stem cell transplantation was performed in 187 patients and autologous stem cell transplantation was performed in 13 patients. TBI was applied to 33 patients within the preparation regimen. GVHD prophylaxis was given to 182 patients. Neutrophil engraftment day was 17.5 days, median 17 days (9-32). Neutrophil engraftment day could not be mentioned in 7 patients since neutrophil counts were always 1000 / μl after transplantation. There was no engraftment in 17 patients due to graft rejection / failure and 8 patients died.
After transplantation, 13 patients out of 200 had no febrile attacks. 187 patients had 323 febrile attacks. After transplantation, 172 of 323 febrile attacks were defined as fever of unknown origin. Of the 151 bacterial febrile attacks, 66 were gram positive and 85 were gram negative. Ganciclovir was used in 90 patients due to CMV development after transplantation. After transplantation, IFI developed in 21 patients. The development of CMV reactivation
XVII
after transplantation does not increase the risk for IFI (P = 0.799). After transplantation, viral respiratory infection was detected in 40 patients, the most common agent was rhinovirus. Viral gastroenteritis infection was detected in 44 patients, most commonly agent was rotavirus.
Urine BK virus infection was detected in 25 patients after transplantation. Acute GVHD developed in 54 patients. The risk of bacterial infection and CMV development increases in patients with aGVHD after transplantation (P = 0.002, 0.014, respectively). There was no statistically significant relationship between IFI development after transplantation and aGVHD (P = 0.864). Although CMV reactivation was more common in patients with steroid use after transplantation, it was not statistically significant (P = 0.58). There was no significant relationship between the risk of IFI development after steroid use after transplantation. (P = 0.101). The risk of developing bacterial infection increases in patients with steroid use before febrile attacks (P = <0.001).
There was no significant relationship between conditioning regimens and bacterial infection, CMV development and IFI risk (P = 0.111, 0.175, 0.138, respectively). Bacterial infection after transplantation of stem cell source was not statistically significant between CMV development and IFI development (P = 0.088, 0.499, 0.143, respectively). Bacterial infection and shock development were statistically significant (P = 0.001). Bacterial infection and ICU stay were statistically significant (P = 0.003). 9% mortality was observed in the first 100 days after transplantation.
Discussion: Bacterial infection was detected 43.5% of heterogeneous group of patients who underwent HSCT using different preparation regimen, donor and stem cell source with different indications in childhood when we evaluated after HSCT. The risk of bacterial infection and CMV development increased in patients with acute GVHD. The risk of developing bacterial infections was increased in patients with steroid use after transplantation. Intensive care hospitalization rate was 24.1% in cases of bacterial infection. Infection-related mortality was found in 13 (6.5%) patients who underwent HSCT in childhood.
Keywords: Hematopoietic stem cell transplantation, Bacterial infection, CMV viremia, CMV reactivation, Invasive fungal infection, Graft Versus Host Disease, Mortality
1
1. GİRİŞ ve AMAÇ
Hematopoetik kök hücre transplantasyonu (HKHT) malign ve non-malign hastalıklarda potansiyel küratif bir tedavi seçeneğidir [3]. Çocuklarda hematolojik malignitelere ek olarak hemoglobinopatiler, immün yetersizlikler, kemik iliği yetersizlikleri ve doğuştan metabolik hastalıklar gibi birçok hastalıkta kesin tedavi yöntemi olarak kullanılmaktadır. Bu hastalıkların bazılarında tedavi protokollerinin bir parçası, bazılarında ise tek iyileştirici tedavi seçeneği olarak yer almaktadır [11].
Dünya genelinde %80’den fazla sağkalım oranı ile yılda 50.000 HKHT gerçekleştirilmektedir. Transplantasyonla ilişkili morbidite ve mortalite oranları, son yıllarda özel tedavi rejimleri, hassas HLA (insan lökosit antijeni) tipleme, iyileştirilmiş destek tedavisi ve ciddi enfeksiyonlara karşı profilaksi gibi transplantasyon tıbbındaki gelişmeler nedeniyle önemli ölçüde azalmıştır. Hematopoetik kök hücre transplantasyonu sonrası sonuçları iyileştirmek ve komplikasyon oranının daha da azaltılabilmesi için her hastanın risk faktörlerine göre hazırlanmış ayrıntılı tedavi ve takip bakım protokolleri gerekmektedir [12].
Optimal destekleyici bakım ve yüksek çözünürlüklü HLA uyumuna rağmen, Greft versus host hastalığı (GVHH) ve enfeksiyon gibi komplikasyonlar HKHT'nun başarısında büyük engeller oluşturmaya devam etmektedir. Hastalık relapsı nakil sonrası önde gelen ölüm nedenidir (HLA özdeş kardeşten yapılan nakillerdeki ölümlerin %30-%34’ünün nedenidir), ancak transplantasyon ilişkili komplikasyonlar da mortalitede çok önemlidir. Bunlar arasında GVHH (%15-25), majör enfeksiyon (%10-17) ve interstisyel pnömoni ve hepatik venookluziv hastalık gibi diğer tedaviyle ilişkili toksisiteler (%35) yer alır.
Sitomegalovirüs (CMV) reaktivasyonu ve invaziv fungal enfeksiyon (İFİ) gibi fırsatçı enfeksiyonlar HKHT sonrası ciddi morbidite ve mortaliteye neden olmaktadır. Sitomegalovirüs enfeksiyonu/reaktivasyonu sırasında kullanılan gansiklovir kemik iliği baskılanması yaparak nötropenilere de neden olabilmektedir [13].
Hematopoietik kök hücre transplantasyonu uygulanan hastalarda erken dönem mortalite nedenleri akut GVHH, enfeksiyonlar, ilaç toksisitesi ve kanamalar gibi komplikasyonlardır [14]. Enfeksiyonlar, otolog HKHT yapılan hastaların %8’inde, allojenik HKHT alıcılarının%17-20’sinde primer ölüm nedeni olarak bildirilmektedir. Hematopoietik kök hücre transplantasyonu alıcıları, CMV enfeksiyonu ve İFİ gibi fırsatçı enfeksiyonlardan kaynaklanan önemli bir morbidite ve mortalite riski altındadır [13] [15].
Febril nötropeni, özellikle kanser hastalarında ve tedavisi sırasında gelişen bağışıklık yetersizliği nedeniyle hastalarda tanı ve tedavideki gelişmelere rağmen hala mortalite ve
2
morbititenin önemli bir nedenidir. Nötrofiller, vücutta enfeksiyonlarla mücadelede en önemli hücrelerdir. Çeşitli nedenlerle (kemoterapi, edinsel veya konjenital nötropeniler, aplastik anemi) vücutta nötrofil sayısı düştüğünde fırsatçı enfeksiyonlar meydana gelir. Özellikle kemoterapi nedeniyle nötropeni gelişen olgularda nötrofillerin hem sayı hem de fonksiyonları azalmıştır. Nötrofil sayısı azaldıkça ve nötropeni süresi uzadıkça bakteriyel, viral ve mantar enfeksiyonları için risk artmaktadır[16].
Transplantasyon sonrası gelişen GVHH’nın ve kullanılan kortikosteroidlerin İFİ gelişimi riskini artırdığını gösteren çalışmalar mevcuttur. Kortikosteroidler, fagosite edilmiş Aspergillus fumigatus konidiasının alveoler makrofajlar tarafından öldürülmesini önleyerek aspergillus türlerine karşı konakçı bağışıklık yanıtını etkilemektedirler. Nötrofiller ve monositler için önemli olan proinflamatuar sitokinlerin (örneğin, IL-1α ve TNFα) ve kemokinlerin (MİP-1α) alveolar makrofajlar tarafından üretimini azaltmaktadırlar [17].
Bu çalışmada çocukluk yaş grubunda HKHT sonrası gelişen bakteriyel enfeksiyon sıklığı, CMV enfeksiyonu ya da reaktivasyonu, İFİ sıklığı, bu enfeksiyonların gelişimine etki edebilecek immunsupresif ilaçların kullanımı ve nakil sonrası gelişen diğer komplikasyonlar, değerlendirildi.
Hematopoetik kök hücre transplantasyonu yapılan hastalarda enfeksiyonların erken dönem komplikasyonları etkileyip etkilemediği, GVHH ve transplantasyon için kullanılan immunsupresif rejimlerin, CMV ve İFİ gibi posttransplant fırsatçı enfeksiyonların gelişimine etkisi araştırıldı.
3
2. GENEL BİLGİLER 2.1. Hematopoetik kök hücre transplantasyonu
2.1.1. Tanımı
Hematopoetik kök hücre transplantasyonu, hematopoetik progenitör hücrelerin herhangi bir kaynaktan (örn.kemik iliği, periferik kan, göbek kordon kanı) veya donörden kemik iliğini yeniden oluşturmak için verilmesini ifade etmektedir [18].
Hematopoetik kök hücre transplantasyonu, dünya genelinde hematopoetik sistemin birçok konjenital ve edinilmiş hastalığın tedavisi için yaygın bir prosedür haline gelmiştir [19]. Allojenik ve otolog HKHT, başka türlü tedavi edilemeyen lösemi, solid tümör, immün yetmezlik, hemoglobinopati ve metabolik hastalıklarda giderek artan sayıda hasta için terapötik bir seçenek haline gelmiştir [20].
2.1.2. Tarihçe
Kök Hücre Nakli ile ilgili ilk çalışmalar 1939- 1940’lı yıllara dayanır. İlk kayıtlı insan kemik iliği nakli deneyimi 1939 yılında altına bağlı aplazisi olan hastaya, aynı kan grubundan olan erkek kardeşinden yapılmıştır. Transplantasyon başarılı olmamış ve hasta beş gün sonra ölmüştür. II. Dünya savaşına kadar başka bir nakil yapılmamıştır. İlk ümit verici çalışmalar 1949 yılında Jacopson ve arkadaşları tarafından yayınlanmıştır. Dalağı radyasyondan korunan farelerin yaşayabildiğini göstermişlerdir. Dalaktan elde ettikleri hücreleri intraperitoneal olarak enjekte etmişler ve aynı etkiyi sağlandıklarını belirtmişlerdir. Lorenz ve arkadaşları aynı etkiyi kemik iliği hücrelerini enjekte ederek sağlamayı başarmışlardır [11].
Barnes ve arkadaşları 1956’da supralethal ışınlama sonrası normal fare kemik iliği infüzyonu yapılan lösemik farelerin tedavi edilebildiğini bildirmişlerdir. Hematolojik malignitesi olan bir hastaya yüksek doz kemoradyoterapi ve ardından allojenik HKKT ile tedavi etmeye yönelik ilk girişim 1957’de Thomas ve arkadaşları tarafından yapılmıştır. Bu tedavi konsepti II. Dünya Savaşı sırasında radyasyonun kemik iliği fonksiyonunu tahrip ettiği bulgularından geliştirilmiştir. 1965’de Mathe ve arkadaşları lösemili bir hastada ilk kalıcı allojenik ilik grefti elde etmiştir, ancak hasta muhtemelen GVHH ile ilişkili birçok problem nedeni ile ölmüştür [21] [22].
İnsan lökosit antijenlerinin keşfedilmesinden sonra, donörler ve hastalar arasında eşleştirme mümkün hale gelmiştir. 1968’de kemik iliği transplantasyonu sonrası uzun dönem hayatta kalan hastalar ağır kombine immun yetmezliği (SCID) olan hastalardı. Thomas ve
4
arkadaşları tarafından son dönem lösemili hastaların HLA özdeş donörlerden allojenik HKHT ile kurtarılabileceği gösterildikten sonra dünya çapında yapılan nakillerin sayısı artmıştır [22].
2.1.3. Türkiye’de Kök Hücre Nakli
Türkiye’de ilk allojenik kemik iliği nakli 1978'de Hacettepe Üniversitesi Tıp Fakültesi Hastanesi’nde, ilk otolog kemik iliği nakli 1984 yılında Gülhane Askeri Tıp Akademisinde, ilk otolog periferik kan HKHT ise 1992 yılında uygulanmıştır. Pediatrik olgularda ilk kök hücre nakli İstanbul Üniversitesi Tıp Fakültesi’nde gerçekleştirilmiştir. İlk pediatrik otolog kök hücre nakli, 1992 yılında multirelaps Hodgkin lenfomalı bir hastaya yapılmıştır [11].
2.1.4. Kök Hücre Nakli Tipleri
2.1.4.1. Otolog hematopoetik kök hücre nakli
Otolog kök hücre naklinde kullanılan kök hücreler hastanın kendisinden elde edilir. İşlemin esası hastaya yüksek doz kemo/radyoterapi (hazırlık rejimi) uygulamak ve bu sayede tümör eradikasyonu sağlayabilmektir. Greft versus malignite etkisi yoktur. Hazırlık rejimi yapılmadan önce kök hücreler hastadan elde edilir ve donma hasarından koruyucu maddeler (örn: DMSO; dimetil sulfoksid) eşliğinde 80°C mekanik buzdolabı veya sıvı azotta -190°C’de dondurularak saklanıp yüksek doz kemoterapi sonrası hastaya verilir.
Tablo 1: Pediatrik hastalarda otolog hematopoetik kök hücre transplantasyonu endikasyonları [1]
Ø İzole ekstramedüller relaps sonrası akut lenfoblastik lösemi Ø Relaps Hodgkin veya Nonhodgkin lenfoma
Ø Evre 4 veya relaps nöroblastom
Ø Yüksek riskli, relaps veya rezistan beyin tümörleri Ø Evre 4 Ewing sarkom
Ø Konvansiyonel tedavilere dirençli, hayatı tehdit eden otoimmun hastalıklar
2.1.4.2. Allojenik hematopoetik kök hücre nakli
Allojenik hematopoetik kök hücre transplantasyonu bir akrabadan (HLA özdeş, haploidentik ya da uyumsuz) veya akraba dışı donörden (gönüllü ya da umblikal kord donör) elde edilen hematopoetik progenitör hücrelerin transplantasyonudur [18].
5
Allojenik hematopoetik kök hücre transplantasyonu hematolojik ve nonhematolojik malignitelerde, yaşamı tehdit eden bazı nonmalign hastalıklarda uygulanan bir tedavi modalitesidir.
Tablo 2: Pediatrik hastalıklarda allojenik hematopoetik kök hücre transplantasyonu endikasyonları [1]
Ø Akut lenfoblastik lösemi
ü Relaps riski çok yüksek olan hastalar için ilk tam remisyon ü Translokasyon t (9;22) veya t (4;11)
ü Erken timosit prekürsör fenotip
ü Bir haftalık kortikosteroid tedavisi sonrası tedaviye yanıtsız ve T-immunfenotip veya tanıda>100.000 hücre/μl
ü İndüksiyon fazının sonunda remisyonda olmayan ü Hipodiploidi (<43 kromozom)
ü İndüksiyon tedavisi sonunda yüksek düzeyde minimal rezidüel hastalık ü İkinci tam remisyon
ü Üçüncü veya sonrası tam remisyon
Ø İlk tam remisyon Akut myeloid lösemi veya ilerlemiş hastalık fazında Ø Philadelphia kromozomu pozitif kronik miyeloid lösemi
Ø Miyelodisplastik sendromlar
Ø Hodgkin ve Nonhodgkin lenfomalar Ø Seçilmiş solid tümörler
ü Metastatik nöroblastom
ü Konvansiyonel tedaviye dirençli rabdomiyosarkom ü Çok yüksek riskli Ewing sarkom
Ø Şiddetli edinsel aplastik anemi Ø Fanconi anemisi
Ø Konjenital diskeratozis Ø Diamond-Blackfan anemisi Ø Talasemi majör
Ø Orak hücre anemisi
Ø Ağır kombine immun yetersizlik varyantları Ø Hiperimmunglobulin M sendromu
Ø Lökosit adezyon eksikliği Ø Omenn sendromu
Ø Wiskott-Aldrich sendromu Ø Chediak-Higashi sendromu
Ø Kostmann sendromu (infantil malign agranülositoz), kronik granülomatöz hastalık ve diğer ciddi nötrofil defektleri
Ø X’e bağlı lenfoproliferatif hastalık (Duncan sendromu) Ø Hemofagositik lenfohistiyositoz
Ø Trombosit fonksiyon bozukluklarının bazı şiddetli varyantları (örneğin, Glanzmann tromboasteni veya konjenital amegakaryositik trombositopeni)
Ø Seçilmiş mukopolisakkaridoz türleri (Hurler hastalığı) veya diğer lipozomal /peroksizomal hastalıklar (Krabbe hastalığı, adrenolökodistrofi)
Ø İnfantil malign osteopetrozis
6 .1.4.3. Sinjeneik hematopoetik kök hücre nakli
Sinjeneik hematopoetik kök hücre transplantasyonu, özdeş bir ikizden gelen hematopoetik progenitör hücrelerin kullanımı anlamına gelmektedir. Sinjeneik donörler, tümör hücreleri içermeyen ve sadece minimum GVHH riski ile ilişkili olan greft sağlama avantajını sunmaktadır [18].
2.1.5. Kök Hücre Kaynakları 2.1.5.1 Kemik İliği
Hematopoetik kök hücre nakli için klasik olarak kabul edilen kök hücre kaynağı kemik iliğidir. Kemik iliği genel anestezi altında arka iliyak kanattan toplanır. Toplanan kemik iliğinin yeterliliğinde belirleyici olan çekirdekli hücre sayısıdır. Kemik iliğindeki kök hücre miktarını arttırmaya yönelik granülosit koloni stimülan faktör (GCSF) uygulanması, erişkin vericilerde bildirilmekle birlikte, çocuk vericiler ile ilgili veriler çok sınırlıdır [11].
2.1.5.2. Periferik Kan
Pek çok merkezin otolog nakilde tercih ettiği kök hücre kaynağı periferik kök hücredir. Son yıllarda erişkin vericilerden yapılan akraba ve hatta akraba dışı nakillerde artan sıklıkta kullanılmıştır. Benzer şekilde çocuk vericilerde de artan oranda kullanılmaktadır. Periferik kan kök hücre kullanımıyla ilgili en büyük üstünlük beklenen nötrofil ve trombosit engraftman sürelerinin daha kısa olması ve sonucunda enfeksiyöz sorunların, hastane kalım süresinin ve transfüzyon gereksiniminin daha az olmasıdır. Bu etmenlerin tümü nakil maliyetini doğrudan etkileyen etmenlerdir. Ancak toplama işleminin kendisi özellikle de uygun venöz yol sağlama ile ilgili sorunlar, mobilizasyonda kullanılan ilaçların olası kısa ve uzun vadeli yan etkileri ve artmış GVHH riski, kullanım kararında göz ardı edilmemesi gereken temel noktalardır [11].
2.1.5.3. Kordon Kanı
Allojeneik kök hücre nakli gibidir. Ancak burada kullanılan kök hücreler doku grubu uyumlu kardeşin doğumu sırasında toplanan kordon kanı kök hücreleri veya akraba dışı vericiden toplanan kordon kanı kök hücreleridir.
7 2.1.6. Hazırlama Rejimi
Hematopoetik kök hücre naklinde hazırlayıcı rejimin amacı kemoterapi, radyoterapi ve biyolojik tedavi kombinasyonlarının antineoplastik veya immunsupresif ajan olarak hastanın nakil için hazırlanmasıdır ve üç ayrı bileşeni vardır: Kemik iliğinde yer oluşturmak, konağın grefti reddetmesini engellemek için immunsupresyon oluşturmak ve hastalık eradikasyonu sağlamaktır. Hazırlama rejimi ile kemik iliğinde yeterli alan oluşturulursa ve konağın immun sistemi engraftmana uyum sağlarsa başarılı engraftman olur. Hazırlık rejimi ile sağlanan yüksek doz sitoredüksiyon, donör immun sisteminin akseptör hücreler üzerinde eksprese edilen antijenlere karşı oluşturduğu immunolojik reaksiyon ile birlikte hastalıkta kür oluşumuna olanak sağlamaktadır. Hazırlama rejimi konağın immun sistemini suprese etmeli, böylece engraftmanı kolaylaştırmalıdır. Greft içindeki T lenfositlerinin parsiyel deplesyonu başarısızlığa, daha az oranda GVHH’na ve sonuçta daha fazla greft yetersizliği ve relapsa yol açabilir. [23].
Otolog transplantasyonda hazırlama rejiminin ana amacı rezidüel kanseri ortadan kaldırmaktır. Yüksek doz tedavi ile oluşan kemik iliği baskılanmasından önce saklanmış hematopoetik hücreler ile kurtarılma sağlanır. Allojenik transplantasyonda rejim bu amaçla da kullanılır, fakat aynı zamanda engraftman için kemik iliğinde boş alan oluşturmalı, greft rejeksiyonunu önlemek için immunsupresyon sağlamalıdır [23].
2.1.6.1. Miyeloablatif hazırlama rejimi
Konvansiyonel miyeloablatif kondisyon rejimi konak immun sistemini (özellikle T lenfositleri) elimine ederek immun aracılı başarısızlığı ortadan kaldırır ve altta yatan hastalığa ait rezidüel hücreleri olabildiğince eradike eder. Miyeloablatif kondisyon rejiminin klasik örneği, siklofosfamid (120 mg/kg) ve 10 Gy TBI kombinasyonudur. Bu rejimle maksimum miyelosupresyon ve immunsupresyon sağlanır.
2.1.6.2. Nonmiyeloablatif hazırlama rejimi
Nonmiyeloablatif kondisyon rejimi, yaşlı hastalar ve ciddi komorbiditeleri olanlar için yeni bir nakil yöntemi olarak ortaya çıkmıştır. Bu kondisyon rejiminin klasik örneği, 2 Gy TBI’dır. Miyeloablatif rejimlerle karşılaştırıldığında, nonmiyeloablatif hazırlama rejimleri karaciğer, böbrek ve akciğer için daha az toksiktir, daha az enfeksiyona neden olur, daha az
8
trombosit ve eritrosit transfüzyonuna ihtiyaç duyar ve eşlik eden komorbiditesi olan yaşlı hastalarda bile daha düşük bir ölüm oranıyla ilişkilidir [24].
Tablo 3: Yaygın olarak kullanılan ajanlara/kombinasyonlara göre miyeloablatif ve nonmiyeloablatif hazırlama rejimleri örnekleri [2]
Miyeloablatif TBI ≥5 Gy tek doz veya ≥ 8 Gy fraksiyone Busulfan >8 mg/kg PO veya İV eşdeğeri
Nonmiyeloablatif
TBI≤ 2 Gy ± purin analoğu
Fludarabin + Siklofosfamid ± ATG Fludarabin + Sitarabin + İdarubisin Kladribin + Sitarabin
Total Lenfoid Işınlama + ATG
2.1.6.3. Yoğunluğu azaltılmış hazırlama rejimi
Yoğunluğu azaltılmış kondisyon rejimi ilaçların sitotoksik etkisinden ziyade greft versus malignite etkisine dayanmaktadır. Rejimin temel amacı allojenik engraftmana karşı immünolojik direnci ortadan kaldırmak için immunsupresyon sağlamaktır [22].
9
Tablo 4: Allojenik hematopoetik kök hücre transplantasyonunda yoğunluğu azaltılmış kondisyon rejimleri [3]
Rejim ve Doz Endikasyon GVHH
profilaksisi Ø Fludarabin (30 mg/m2/g, -10 ile - 5.günler
arasında)
Ø Busulfan (4 mg/kg/g, -6 ve -5.günlerde) Ø Anti-timosit globülin (ATG) (10 mg/kg/g, -4
ve -1.günler arasında) Hematolojik malignitelerde Miyeloablatif HKHT için kontraendikasyon yoksa Siklosporin (CSA) Ø TBI (2 Gy) Şüpheli hematolojik malignitelerde
Tam remisyondaki AML de
CSA
Ø Fludarabin (25 mg/m2/g, 5 gün) Ø Melfalan (90 mg/m2/g, 2 gün veya 140
mg/m2/g, 1 gün)
50-75 yaş arası hastalarda <50 yaş fakat miyeloablatif HKHT uygun değil ise
Takrolimus Metotreksat (MTX)
Ø TBI (2 Gy)
Ø Fludarabin (30 mg/m2/g, -4 ile -2 günler arası)
Daha önceden miyeloablatif HKHT yapılmış hematolojik malignitelerde
CSA Mikofenolat mofetil (MMF) Ø Fludarabin (30 mg/m2/g, -9 ile -5 günler arası)
Ø Busulfan (4 mg/kg/g, -3 ve -2.günlerde) Ø Alemtuzumab (20 mg/g, -8 ile -4.günler arası)
AML ve MDS CSA
Ø TBI (4 Gy) (-5.günde)
Ø Siklofosfamid (HLA uygun kardeş: 40 mg/kg/g; Akraba dışı ya da uygunsuz donör: 60 mg/kg; -4 ve -3.günlerde)
Ø ATG (HLA uygun kardeş:10 mg/kg; Akraba dışı ya da uygunsuz donör: 20 mg/kg; 4 ile -2.günler arası)
Yüksek risk AML ve MDS
de CSA MMF
Ø TBI (2 Gy/g, 4 gün)
Ø - Fludarabin (30 mg/m2/g, 4 gün)
Miyeloablatif HKHT uygun
olmayan AML hastalarında CSA MTX Ø Alemtuzumab (10-20 mg/g, 5 gün) Ø Fludarabin (30 mg/m2/g, 5 gün) Ø Melfalan (140 mg/m2/g, 1 gün) Miyeloablatif HKHT uygun olmayan AML ve MDS hastalarında CSA
10 2.1.7. Engraftman
Engraftman sağlanması, nakil sonrası erken dönemde greft fonksiyonunun değerlendirilmesi için bir göstergedir ve aşağıdaki kriterlerin oluşması ile gerçekleşir [25]. a. Nötrofil engraftmanı: Parçalı nötrofil sayısının ardışık üç gün >500/mm3 (GCSF
kullanılıyorsa >1000/mm3) olduğu ilk gündür [25].
b. Trombosit engraftmanı: Yedi gün trombosit desteği olmadan trombosit sayısının ardışık üç gün >20.000/mm3 ve bunu izleyen günlerde >50.000mm3 olduğu ilk gündür [25].
Engraftman süresi; nakil sonrası 7- 21 gün arasında değişir. 21 günü aştığında “engraftman gecikmesi” 40 günü aştığında ise “engraftman başarısızlığı” oşarak değerlendrilir. Engraftman yetersizliği; erken (primer) ya da geç (sekonder) olabilir. Nakil sonrası engraftman olduktan sonra greftin kaybedilmesi; geç greft yetersizliği (greft reddi) olarak isimlendirilir. Greft reddi otolog geri dönüşüm ile düzelebildiği gibi, aplazi ve pansitopeni ile de sonlanabilir [25].
2.1.7.1. Erken greft fonksiyonuna (engraftman) etki eden faktörler
Hazırlık Rejimi: Nakil öncesi verilen tedavilerin dozları engraftman oluşumunda rol oynar. Miyeloablatif hazırlık rejimi ile yapılan nakillerde nonmiyeloablatif ya da yoğunluğu azaltılmış hazırlık rejimli nakillere göre engraftman süresi daha uzundur[25].
Kök Hücre Kaynağı: Günümüzde kök hücre kaynağı olarak kemik iliği, periferik kan ve kordon kanı kullanılmaktadır. Periferik kandan yapılan nakillerde nötrofil ve trombosit engraftmanı diğer kök hücre kaynaklarına göre daha erken (sırasıyla 2-6 gün ve 5-8 gün) olmaktadır. Bu durum periferik kana mobilize edilmiş kök hücre ya da öncül hücre sayısının diğer kök hücre kaynaklarındaki hücrelerden daha fazla olması ile açıklanır [25]. Allojenik Hematopoetik kök hücre transplantasyonu’nda verilen donör kaynaklı kök hücre sayısı hastanın kilosuna göre hesaplanır [25].
Greft Versus Host Hastalığı ve profilaksisinde kullanılan ilaçlar: GVHH, allojenik HKHT’larının başarısını engelleyen başlıca faktördür. Greft versus host hastalığının etkilediği başlıca organlar; deri, karaciğer, gastrointestinal sistem (GİS) ve akciğerlerdir. Bununla beraber GVHH’nın kemik iliğini de etkilediğini düşündüren bir miyelosüpresyon gelişebilir. Greft versus host hastalığına bağlı hematopoezisin bozulması çok erken olur ve sistemik GVHH’nın etkisi yoktur [25].
11
2.1.7.2. Sekonder (geç) greft fonksiyonuna etkili faktörler
Allojenik HKHT’ndan sonra gelişen geç sitopeniler ciddi komplikasyonlardır. Etyolojisinde; Miyelotoksik ajanlar (gansiklovir, trimetoprim-sulfametaksazol, MMF gibi), virus enfeksiyonları, hazırlayıcı rejim, kök hücre kaynağı ve verilen CD34+ hücre sayısı gibi nakille ilişkili faktörler yer alır [25].
Nakamea ve arkadaşları HKHT yapılan 1818 hastada nakil sonrası +28. günden sonra oluşan sitopeni nedenlerini araştırdılar. Sitopeni gelişen olguların %6’sında sadece trombositopeni, %7’sinde anemi, %7’inde ise pansitopeni görüldü. Nakil sonrası geç dönemde gelişen nötropeni için başlıca risk faktörleri; ileri hasta yaşı (>40 yaş), alıcıda CMV pozitifliği, CMV riski yüksek hastalar, akraba dışı nakiller, nonmiyeloablatif hazırlık rejimi ile nakil, GVHH proflaksisinde MMF kullanımı ve nakledilen CD34+ hücre sayısı (<6.4x106/kg) olarak belirlendi [25].
Bruno ve arkadaşları ise miyeloablatif hazırlık rejimli nakillerde; akraba dışı donörden nakil, II-IV. derece aGVHH, böbrek yetmezliği, hazırlık rejiminde Busulfan+Siklofosfamid veya tüm vücut ışınlama (TBI) kullanımı, nakledilen CD34+ kök hücre sayısı ve enfeksiyonların sekonder trombositopeni oluşturabilen etmenler olduğunu gösterdiler [25].
2.2. Hematopoietik Kök Hücre Transplantasyonuna Bağlı Mortalite
Hematopoetik kök hücre transplantasyonu sonrası altta yatan hastalığın relapsı, GVHH ve enfeksiyonlar transplantasyon başarısını engelleyen başlıca etmenlerdir. Hematopoetik kök hücre transplantasyonu sonrası sonuçları iyileştirmek için bu problemlerin erken tespiti, azaltılması ve tedavilerin iyileştirilmesi gerekmektedir. Bu durum nakil prosedüründe, tedavide ve hasta seçiminde önemli değişikliklere neden olmuştur. Özellikle 1980’lerin başında siklosporin ve metotreksat kombinasyonunun kullanılmaya başlanması ile akut GVHH önemli ölçüde azalmış ve transplantasyon ilişkili mortalitede iyileşmeler gözlenmiştir. Sitomegalovirüs enfeksiyonu için preemptif tedavilerin uygulanması sonuçları iyileştirmiş, ölümcül CMV hastalığı riskini de azaltmıştır [26].
Hematopoetik kök hücre transplantasyonu uygulamasındaki sonuçlar için ana risk faktörleri hastalığın evresi, hastanın yaşı, tanıdan nakil sürecine kadar geçen zaman, allojenik HKHT için donör/alıcı arasındaki HLA ve cinsiyet uyumudur. İleri evre hastalık, ileri yaş, HLA uyumsuzluğu, erkek alıcılarda kadın donör varlığı, tanıdan nakile kadar geçen sürenin uzun olması durumunda transplantasyon ilişkili mortalite artmaktadır ve sağkalım oranları düşmektedir. Risk faktörleri toplanır ve Tablo 5’de görülmektedir.
12
Tablo 5: Transplantasyon ilişkili mortalite riskinin belirlenmesi [4]
Puan Hastalık evresi
Erken (örnek AML ilk tam remisyon)
Orta seviye (örnek AML ikinci tam remisyon) İleri (örnek refrakter hastalık)
0 1 2 Yaş <20 yaş 20-40 yaş >40 yaş 0 1 2 Tanıdan nakile kadar geçen zaman <12 ay
>12 ay (ilk tam remisyon olan hastalar için geçerli değildir)
0 1 Doku
uyumluluğu
HLA özdeş kardeş Diğer donörler 0 1 Cinsiyet kombinasyonu Diğer
Erkek alıcı/kadın donör
0 1 Ek faktörler Komorbidite/Karnofsky >80 Donör>50 yaş CMV serouygunsuzluğu
Tek yumurta ikizleri (sinjeneik)
Akraba dışı donör 10/10 yüksek çözünürlüklü uyum
1 1 1 -1 -1
2.3. Hematopoietik Kök Hücre Transplantasyonu Sonrası Gelişen Erken Dönem Komplikasyonlar
Transplantasyon tekniklerinde ve destekleyici bakım uygulamalarındaki gelişmeler HKHT alıcılarının sağkalımlarında iyileşmelere yol açmıştır. Hastalar nakil sonrası uzun süre hayatta kaldıklarından pretransplant, peritransplant ve posttransplant maruziyetle ilişkili geç komplikasyonların gelişmesi için risk altındadırlar [27].
Yüksek doz kemoterapi ve/veya radyoterapinin yanı sıra, GVHH’nin profilaksisi veya tedavisi için immünosüpresif ilaçlara ihtiyaç duyulması, HKHT sonrası birçok komplikasyonun gelişmesine neden olmaktadır [28].
Erken komplikasyonlar transplantasyondan sonraki ilk 100 gün içinde meydana gelen komplikasyonlar olarak tanımlanabilir. Bu dönemde hem epitelyal hemde endotelyal hücreler ilaca bağlı toksisiteye maruz kalırlar. Özellikle kemoterapiye bağlı GİS’de oluşan mukozal hasar sonucu oral mukozit, bulantı, kusma, ishal oluşmaktadır. Üriner epitele toksisite sonucu hemorajik sistit; endotel hasarı sonucunda venooklüziv hastalık (VOD), trombotik
13
mikroanjiyopatik anemi (TAM) ya da engraftman sendromu gibi çok farklı klinik tablolar ortaya çıkabilmektedir [28]
2.3.1. Erken Dönem Enfeksiyonlar
Nötrofil sayısı 1000/mm3'ün altına düştüğü zaman fırsatçı enfeksiyon riski artsa da granülosit sayısının 500/mm3 altına düşmesi ile ciddi enfeksiyon gelişmesi için en önemli risk faktörü olduğu gösterilmiştir [29].
Enfeksiyöz komplikasyonlar sitopeni, immun ablasyon ve/veya immunsupresyon nedeni ile HKHT’ndan kısa süre sonrasında sık görülmektedir. İmmun yeniden yapılanma (immun rekonstitüsyon) zaman içinde genellikle 12-18 ay gibi yavaş oluşur ve özellikle umblikal kord kanı, HLA uyumsuz ve T hücre deplesyonu olan greft ile nakil uygulanan allojenik alıcılarda, GVHH olan hastalar ve uzun süreli immunsupresan kullanımı olan hastalarda immun rekonstitüsyon gelişimi daha da yavaştır. Yardımcı T lenfosit sayısı (CD4 sayısı) ve CD4/CD8 oranı immun rekonstitüsyonu belirlemede kullanılan markerlardır ve bazı uzmanlar HKHT sonrası viral veya diğer enfeksiyon profilaksi süresini belirlemek için immün rekonstitüsyonun tamlığını temsil eden belirteçler olarak kullanırlar [27].
Yüksek doz kemoterapi ve allojenik HKHT hümoral immunitenin uzun süreli baskılanmasına neden olabilir. Allojenik HKHT’nda miyeloablasyon için kullanılan sitotoksik ajanların dışında B hücreli malignitelerde kullanılan rituksimab gibi monoklonal antikorlar tedavinin kesilmesinden 6 ay sonrasına kadar B hücreleri tarafından immunglobulin sentezinde önemli düzeyde azalmaya neden olabilir. Transplantasyondan sonra 12 aya kadar immunglobulin düzeylerinin izlenmesi önerilmektedir [29].
14
Tablo 6: Kök hücre nakli yapılan hastalarda erken dönemde görülen enfeksiyonlar [5] Patojen KHT sonrası
risk periyodu Risk faktörleri Klinik sendrom Tedavi
Gram
pozitif kok 1-4 hafta
Nötropeni Mukozit Santral venöz katater Deri bütünlüğünün bozulması
Bakteriyemi Duyarlılık testlerine göre antibiyotikler
Enterobacte
riaceae spp. 1-4 hafta
Nötropeni
Deri bütünlüğünün bozulması GİS mukoza harabiyeti
Bakteriyemi Duyarlılık testlerine göre antibiyotikler Clostridium
difficile 1-8 hafta Antibiyotikler Kolit Metronidazol Oral vankomisin
Candida spp. 1-4 hafta Nötropeni Deri bütünlüğünün bozulması GİS mukoza harabiyeti Kandidemi Mukokutanöz Hepatosplenik
Azoller Ekinokandinler Amfoterisin Aspergillus
spp. 1-4 hafta HLA uyumsuzluğu
Sinüzit Pulmoner nodül
veya infiltrasyonlar Küf spesifik azoller Ekinokandinler Amfoterisin Herpes
simplex virüs
1-4 hafta Alıcı seropozitivitesi Orofaringeal
Özefajit Viremi Asiklovir Valasiklovir Foskarnet Cytomegola virus >4 hafta
Alıcı veya donör seropozitivitesi HLA uygunsuzluğu Akut veya kronik GVHH
Enterit İnterstisyel pnömoni Gansiklovir Foskarnet Valgansiklovir Varicella
zoster virus >4 hafta
Alıcı veya donör seropozitivitesi HLA uygunsuzluğu Akut veya kronik GVHH Kronik immunsupresyon
Kutanöz İnterstisyel pnömoni
Hepatit
Asiklovir Valasiklovir Foskarnet
Ebstein-Barr virus >4 hafta
HLA uygunsuzluğu T hücre deplesyonu Viremi Posttransplant lenfoproliferatif hastalık Rituksimab İmmunsupresyonun azaltılması Sitotoksik kemoterapi
15 2.3.2. Akut greft versus host hastalığı
Greft versus host hastalığı, önemli morbidite ve mortalite ile ilişkili allojenik HKHT’nun majör bir komplikasyonudur. Akut GVHH allojenik HKHT sonrası meydana gelmektedir ve donör immun hücrelerinin alıcı dokularına karşı bir reaksiyonudur. Aktif donör T hücreleri, hazırlama rejiminin yol açtığı inflamatuvar bir kaskadtan sonra konakçı epitelyal hücrelerine zarar verir. Hematopoetik kök hücre transplantasyonu uygulanan hastaların yaklaşık %35-50’sinde aGVHH gelişmektedir. Greft versus host hastalığı için risk hastanın yaşı, kök hücre kaynağı, kondisyon rejimi ve GVHH profilaksine bağlıdır [7] [30].
Akut GVHH’nın etkilediği üç ana doku deri, karaciğer ve GİS’dir. Klinik olarak dermatit, karın ağrısı ± diyare, persistan bulantı, kusma, hepatit (bilirübin veya karaciğer enzim yüksekliği) geliştiğinde tanıdan şüphelenilmelidir. Semptomlar en sık donör engraftmanı ile başlar, ancak daha geç dönemlerde de gelişebilir [7].
Tablo 7: Akut greft versus host hastalığının klinik belirtileri [6] Organ Klinik belirtiler
Deri
Başlangıçta sıklıkla avuç içlerini ve ayak tabanlarını tutan eritematöz makülopapüler döküntü
Bütün vücut yüzeyine yayılabilir. Kaşıntılı ve/veya ağrılı olabilir.
Ağır durumlarda deskuamasyona yol açan büller oluşabilir. Karaciğer Aşikar sarılıkla birlikte olan veya olmayan kolestaz
Kolestaz enzimlerindeki bozukluk transaminazlardakinden daha fazladır.
GİS
İştahsızlık, bulantı, kusma
İshal; tipik olarak yeşil renkli ve sulu
Ağır durumlarda dışkıda taze kan ve mukoza bulunur. Buna abdominal kramp bazen de paralitik ileus eşlik eder.
16
Tablo 8: Akut greft versus host hastalığında derecelendirme ve evrelendirme [7] EVRE (STAGE) DERİ KARACİĞER (Bilirübin) BAĞIRSAK (Gaita çıkışı/gün) 0 GVHH döküntüsü yok <2 mg/dl <500 ml/gün veya persistan bulantı 1 Vücut yüzey alanının <%25 makulopapüler döküntü 2-3 mg/dl 500-999 ml/gün
2 Vücut yüzey alanının %25-50’sinde makulopapüler döküntü
3.1-6 mg/dl 1000-1500 ml/gün
3 Vücut yüzey alanının>%50
makulopapüler döküntü 6.1-15 mg/dl
Yetişkinlerde:>1500 ml/gün
4 Jeneralize eritrodermi+bülloz formasyon >15 mg/dl Şiddetli karın ağrısı ± ileus DERECE (GRADE)
1 Stage 1-2 Yok Yok
2 Stage 3 veya Stage 1 veya Stage 1
3 - Stage 2-3 veya Stage 2-4
4 Stage 4 veya Stage 4 -
Akut GVHH tanısı klinik bir tanı olmasına rağmen birçok semptomu nonspesifiktir. Histolojik konfirmasyon semptomlar atipikse ya da sadece karaciğer ve barsak tutulumu varsa oldukça yararlı olabilir [7].
17
Tablo 9: Akut greft versus host hastalığının histopatolojik özellikleri [6] Organ Histopatolojik özellikler
Deri
Tanısal özellik üst dermiş ve alt epidermisin likenoid infiltrasyonu ve epidermisin bazal tabakasındaki hücrelerde vakuolizasyon, dejenerasyon ve nekrozdur. Grade 1: epidermis bazal hücrelerinde vakuolizasyon
Grade 2: ayrı ayrı nekrotik keratinosit varlığı
Grade 3: nekroz alanlarının birleşmesi ve bül oluşumu Grade 4: epidermisin soyulması
K
ar
ac
iğe
r
En tutarlı histolojik özellik, genellikle kolestazla birlikte görülen ve HKHT’nın diğer komplikasyonlarında nadir görülen küçük safra kanalı hasarıdır.
Bilier epitel hücrelerinde büyük hiperkromatik veya küçük piknotik çekirdekler ve vakuollü bir sitoplazma görülür.
Periportal ve orta zonda hepatosellüler nekroz ve portal traktta minimal lenfositik infiltrasyon
Karaciğer histolojisi için bir histolojik derecelendirme mevcut olmasına rağmen prognostik değeri kanıtlanmamıştır.
GİS
Kriptin çevresinde epitel hücre nekrozu ve bunun sonucunda geriye kalan çekirdek parçacıkları ve sitoplazmik debris ‘Patlayan kript’
Grade 1: ayrı ayrı hücre nekrozu Grade 2: ayrı ayrı kript kaybı
Grade 3: iki veya daha fazla komşu kriptin kaybı ve ülserasyon Grade 4: epitelin soyulması
Greft versus host hastalığı, allojenik HKHT hastalarının % 40-60'ını etkileyen ve allojenik nakil sonrası ölümlerin % 15'inin nedenini oluşturan, nonrelaps morbidite ve mortalitenin temel bir nedenidir [30].
Sadece cildi etkileyen grade I aGVHH tek başına topikal steroidlerle etkili bir şekilde tedavi edilebilir. Daha ileri dereceli hastalıkta sistemik tedavi gerekir ve tedavinin temelini genellikle 7-14 gün süreyle 2 mg/kg/g, ardından kademeli olarak doz azaltılan yüksek doz metilprednizolon (veya eşdeğeri) oluşturur. Greft versus host hastalığı derecesi artıkça tedaviye yanıt alınma oranı azalmaktadır, ancak genel olarak hastaların yaklaşık %40-50’si tedaviye yanıt vermektedir. Standart steroid dozlarına yanıt alınamaması (tedaviye başladıktan sonraki 3-5 gün içinde hastalığın ilerlemesi veya 7-14 gün içinde tam yanıt
18
alınamaması) veya ilk doz azaltılmasından sonra nüks (steroid bağımlılığı) ikinci basamak tedaviyi gerektirmektedir. Bu bağlamda, birçok ajan tek başına veya kortikosteroid ile kombine edilerek denenmiştir. Bunların hiçbiri kalıcı bir etkinlik göstermemiştir. En sık kullanılan ikinci basamak tedavi seçenekleri arasında T hücrelerini tanıyan bir veya daha fazla monoklonal antikorlar veya ATG bulunmaktadır. Monoklonal antikorlar tüm T hücre belirteci olan CD52 için alemtuzumab, aktive olmuş T hücrelerinde eksprese edilen IL-2 reseptörü alfa subüniti için daklizumab veya inolimomab, TNFα için infliksimab’ı kapsamaktadır. Bu ilaçlar genellikle kısa süreli kontrol sağlamaktadır, ancak kalıcı etki nadiren görülmektedir. Özellikle alt GİS tutulumunun olduğu dirençli aGVHH’nın prognozu kötü olup, mortalite oranı yaklaşık %80’dir [6].
2.3.3. Greft yetmezliği
Greft yetmezliği hastayı ölümcül enfeksiyon riskine maruz bırakan ciddi bir komplikasyondur. Primer greft yetmezliği transplantasyon sonrasındaki 21 gün içinde nötrofil sayısının 0.2x109/L’ye ulaşamamasıdır. Sekonder greft yetmezliği başlangıçtaki geçici donör hücrelerinin engraftmanı sonrasında periferik kan sayımındaki kayıptır. Otolog ve allojenik HKHT sonrası greft yetmezliğinin nedenleri içinde uygun olmayan kök hücre dozunun transplantasyonu (sıklıkla çocuklarda kordon kanı transplantasyonu sonrası), CMV veya human herpes virüs tip 6 (HHV6) gibi alıcı makrofajlarını aktive eden viral enfeksiyonlar sayılabilir. Ama allojenik transplantasyon sonrası greft yetmezliği genellikle hazırlıyıcı rejim sonrası yaşayan alıcı tipi rezidual T hücrelerinin greftin immünolojik olarak reddiyle ortaya çıkmaktadır. İmmunolojik mekanizmalar sonucu greft yetmezliğinin tanısı kimerizm durumunun moleküler olarak analiz edildiği periferik kan ve kemik iliği aspirasyon-biyopsisine dayanır. Greft yetmezliği olan allojenik HKHT yapılan hastalarda alıcı kaynaklı lenfositlerin kalıcılığı immünolojik rejeksiyona işaret eder. İmmun ilişkili greft rejeksiyon riski HLA uyumsuz donör, T hücresi azalmış greft, azalmış yoğunluktaki kondisyon rejimi ve az sayıda kök hücre transplantasyonu durumunda ve HLA antijenlerine veya daha az sıklıkla minör histokompatibilite antijenlerine karşı duyarlılığı olan alıcılarda artar. MPS gibi nonmalign hastalık için yapılan HKHT öncesinde sitotoksik ve immunsupresif ilaçların kullanılmaması greft yetmezliğini kolaylaştırır. Talasemide, hematopoetik hücrelerin çoğalması ile greft yetmezliği artar. Bir antimetabolit olan MTX ile GVHH profilaksisi veya gansiklovir ile antienfektif profilaksi de engraftmanı geciktirebilir [1].
Greft yetmezliğinin tedavisi genellikle tüm potansiyel olarak miyelotoksik ajanların tedavi rejiminden çıkarılması ve Granülosit Koloni Stimülan Faktör (GCSF) gibi
![Tablo 3: Yaygın olarak kullanılan ajanlara/kombinasyonlara göre miyeloablatif ve nonmiyeloablatif hazırlama rejimleri örnekleri [2]](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/25.892.122.802.255.538/yaygin-kullanilan-kombinasyonlara-miyeloablatif-nonmiyeloablatif-hazirlama-rejimleri-ornekleri.webp)
![Tablo 4: Allojenik hematopoetik kök hücre transplantasyonunda yoğunluğu azaltılmış kondisyon rejimleri [3]](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/26.892.124.820.152.1054/tablo-allojenik-hematopoetik-transplantasyonunda-yogunlugu-azaltilmis-kondisyon-rejimleri.webp)
![Tablo 6: Kök hücre nakli yapılan hastalarda erken dönemde görülen enfeksiyonlar [5] Patojen KHT sonrası](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/31.1263.90.1146.167.797/tablo-yapilan-hastalarda-donemde-gorulen-enfeksiyonlar-patojen-sonrasi.webp)
![Tablo 7: Akut greft versus host hastalığının klinik belirtileri [6] Organ Klinik belirtiler](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/32.892.124.802.564.960/tablo-versus-hastaliginin-klinik-belirtileri-organ-klinik-belirtiler.webp)
![Tablo 8: Akut greft versus host hastalığında derecelendirme ve evrelendirme [7] EVRE (STAGE) DERİ KARACİĞER (Bilirübin) BAĞIRSAK (Gaita çıkışı/gün) 0 GVHH döküntüsü yok <2 mg/dl <500 ml/gün veya persistan bulantı 1 Vücut yüzey alanının &l](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/33.892.130.811.121.736/hastaliginda-derecelendirme-evrelendirme-karaciger-bilirubin-cikisi-dokuntusu-alaninin.webp)
![Tablo 9: Akut greft versus host hastalığının histopatolojik özellikleri [6] Organ Histopatolojik özellikler](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/34.892.127.815.93.796/tablo-versus-hastaliginin-histopatolojik-ozellikleri-organ-histopatolojik-ozellikler.webp)
![Tablo 11: Endemik mikoz dışı kanıtlanmış invaziv fungal hastalık kriterleri [9] ANALİZ VE](https://thumb-eu.123doks.com/thumbv2/9libnet/3027943.2360/43.892.124.809.121.714/tablo-endemik-disi-kanitlanmis-invaziv-hastalik-kriterleri-analiz.webp)