T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI PROF. DR. SAVAŞ KANSOY
MEFV GENİNDE FARKLI MUTASYONLARI VE
GENOTİPLERİ OLAN AİLESEL AKDENİZ ATEŞİ
HASTALARINDA İNTERLÖKİN-1(IL-1) VE
İNTERLÖKİN-1 RESEPTÖR ANTAGONİSTİ (ILRN1)
GEN POL
İMORFİZMLERİNİN KLİNİK SEYİR VE
TEDAVİ İLE İLİŞKİSİ
UZMANLIK TEZİ
DR. E. ÖZLEM ÇAM DELEBE
DANIŞMAN
PROF. DR. AFİG BERDELİ
ÖNSÖZ
Uzmanlık eğitimim boyunca büyük katkıları bulunan, bilgi ve tecrübelerini esirgemeyen tezimin hazırlanmasında emeği geçen Tez Danışmanım Sn. Prof. Dr. Afig BERDELİ Hocama ve tezin hazırlanma aşamalarında yardımlarını esirgemeyen değerli Hocam ve manevi ablam Sn. Doç. Dr. Betül SÖZERİ’ye Teşekkür etmeyi borç bilirim.
Ege Üniversitesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalında görev yapan, eğitimimize katkıda bulunan, tecrübelerini bizimle paylaşan başta Anabilim Dalı Başkanı Sn. Prof Dr. Savaş KANSOY olmak üzere tüm hocalarıma teşekkür ederim. 5 yıllık bu zorlu süreçte sevgi, hoşgörü, anlayış ve dostluklarıyla hayatımı kolaylaştıran çok değerli asistan arkadaşlarıma teşekkür ederim. Son dönemde nöbet koşullarında birlikte çalıştığımız Yoğun Bakım Ünitesi Hemşireleri ve Uzman Doktorlarına teşekkür ederim.
Yaşamımın her döneminde beni destekleyen, hep doktor olmamı ama herşeyden önce dürüstlük ve iyi niyetten taviz vermememi isteyen, daima beni istediğim herşeyi başarabileceğim konusunda yüreklendiren, hala beni gözettiklerini düşündüğüm canım annem ve babama teşekkür ederim. Son olarakta sevgili eşim aynı zamanda meslektaşım Metin DELEBE'ye teşekkür ederim.
DR. E. Özlem ÇAM DELEBE
ÖZET
MEFV GENİNDE FARKLI MUTASYONLARI VE GENOTİPLERİ OLAN AİLESEL AKDENİZ ATEŞİ HASTALARINDA İNTERLÖKİN-1(IL-1) VE
İNTERLÖKİN-1 RESEPTÖR ANTAGONİSTİ (ILRN1) GEN POLİMORFİZMLERİNİN KLİNİK SEYİR VE TEDAVİ İLE İLİŞKİSİ
Giriş: Ailevi Akdeniz Ateşi (FMF) tekrarlayan ateş ve seröz zarların iltihabı ile karakterize resesif geçişli otoinflamatuar bir hastalıktır.AAA tanısı genellikle klinik bulgularla konulmakta ve genetik incelemelerle desteklenmektedir.Moleküler genetik tekniklerin tanıdaki yeri gün geçtikçe artmaktadır. MEFV üzerinde 150'den fazla mutasyon tespit edilmiş ve bu mutasyonlar hastalığın şiddeti ile ilişkilendirilmiştir
Ailevi Akdeniz Ateşi klinik heterojeniteye sahip bir hastalıktır .Hastalığın kliniği hastadan hastaya değişmektedir. Aynı MEFV mutasyonuna sahip hastalarda bile hastalığın kliniği geniş bir spektrum sergilemektedir. IL-1B otoinflamatuar hastalıkların ve Ailevi Akdeniz Ateşinin patogenezinde önemli role sahip bir sitokindir.IL-1 B sistemik inflamasyonda majör rol oynar. IL-1B ve onun antagonisti olan IL-1Ra arasındaki dengenin bozulması inflamasyonu tetikler. Çalışmamızda IL1-B ve IL-1Ra gen polimorfizlerinin AAA hastalığının şiddetine ve kolşisin direncine etkisi araştırıldı.
Metot: 160 AAA hastası ile 100 sağlıklı çocuk (kontrol grubu) çalışmaya dahil edildi. Hastaların ayrıntılı medikal öykülerini ve demografik verilerini kapsayan olgu rapor formları dolduruldu. Hastalara ait demografik ve tıbbi veriler toplandı. Hasta ve kontrol grubuna ait numunelerde: PCR-RFLP kullanılarak IL-1B + 3953 (C/T) polimorfizmi, PCR kullanarak IL-1Ra VNTR polimorfizimleri çalışılarak genotiplendirildi.
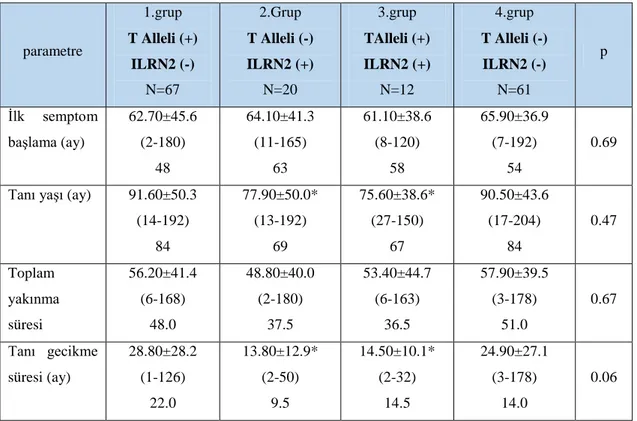
Bulgular: Hastaların yaş ortalaması:119.6± 53.4 ay (min-max.: 13-217), semptomlarının başlma yaşı ise ortalama 64±41.1ay (min.-max.: 2-192), tanı yaşları:88.3±7.0 ay (min.-max.: 13-204) olarak saptandı. Tanı gecikme süresi ortalama 24.4 aydı. Hastalarda ve sağlıklı kontrol grubunda 1+ 3953 (C/T) ve IL-1Ra VNTR polimorfizimlerinin allel ve genotipleri karşılaştırıldı.IL-1Ra ait ILRN2 genotipinin ve IL-1 B +3953 (C/T) polimorfizmine ait T allel sıklığının AAA hastalarında kontrol grubuna göre artığı gösterildi (p:0.006) (p:0.007) Ancak
hastaların kliniklerine etkileri tesbit edilmedi.Ağır hastalık skoru ve kolşisin direnci ile ilişkileri saptanmadı.
Sonuç: IL-1B +3953 (C/T) polimorfizmi ve IL-1Ra polimorfizmlerinin kolşisin direnci ile ilişkisi saptanmadı ve bu polimorfizmlerin hastalıkta ağırlaştırıcı etkisi saptanmadı.
ABSTRACT
THE ANALYSIS OF INTERLEUKIN-1 RESEPTOR ANTAGONIST AND İNTERLEUKIN - IL-1Β GENE POLYMORPHISIMS IN FMF PATIENTS
WHO HAVE DIFFERENT MEFV MUTATIONS AND DIFFERENT GENOTYPES : DO THEY ASSOCIATED WITH COLCHICINE
RESISTANCE AND DISEASE SEVERITY
Introduction: Familial Mediterranean Fever (FMF) is a recessively inherited autoinflammatory disorder characterised by recurrent, self-limited attacks of fever and inflammation of serous membranes (peritonitis, pleuritis, pericarditis, arthritis). The diagnosis is made according to clinical findings and supported bygenetic analysis .Moleculergenetic techniques are increasingly used in diagnosing FMF. More than 150 mutations have been identified on MEFV and these mutations correlate with the severity of disease. M694V mutation is the most common in Turkish population and other populations .Homozygote M694V mutation is also associated with the severity of disease. FMF is a clinically heterogeneous disease. Clinical features of FMF are variable from a patient to another .Even in patients having the same mutation, there can be different clinical spectrum.It is not exactly known why some patients have more severe disease and some have not. IL-1B plays a crucial role in the pathogenesis of inflammation in autoinflamatory disorders such as FMF. IL-1B is a majör mediator of fever and systemic inflammation. In the case of IL-1 mediated immune response, the pro-inflammatory response is downregulated by IL-1Ra. The balance between IL-1 and its competitive antagonist IL-1Ra may contribute to various inflammatory diseases .In view of the inflammatory nature of FMF disease we have invastigated whether IL-1B and IL-1 reseptor antagonist gene polymorphisims may cause more severe disease and resistance to colchicine .
Material and Method: Hundred and sixty patients diagnosed as FMF and a 100 healthy controls were included to our study.Detailed demographic and medical data based on a structured questionnaire and medical records were collected.160 FMF patients and 100 healthy controls samples were genotyped for IL-1B+3953 (C/T) polymorphisms using PCR-RFLP and for IL-1Ra VNTR polymorphisms using PCR.
Results: Mean age of the patients was 119.6± 53.4 months (min-max.: 13-217). Mean age at the onset of the symptoms was 64±41.1 months (min.-max.: 2-192) mean age of diagnosis was detected as 88.3±7.0 months (min.-max.: 13-204). When ages at the onset of the complaints and mean age at diagnosis were evaluated, mean time of delay for diagnosis was detected as 24.4 months . The allele and genotype frequencies of IL-1+ 3953 (C/T) and IL-1Ra VNTR polymorphisms in FMF patients were all compared with those in controls. Our results showed that the ILRN 2 genotype was more frequent in FMF patients compared with controls (p:0.006) and IL-1B +3953 (C/T) polymorphisms was more frequent in FMF patients compared with controls (p:0.007). However, in our study neither IL-1B gene polymorphism: IL-1B+3953 (C/T) nor IL-1Ra genotypes, showed an association with severity of the disease and these polymorphisms are not associated with the resistance of colchicine.
Conclusion: IL-1B +3953 (C/T) polymorphisms and IL-1Ra polymorphisms are not associated with resistance of colchicine in FMF patients. These polymorphisms had no effect on the severity of the disease.
İÇİNDEKİLER ÖNSÖZ ... II ÖZET ... III ABSTRACT ... V TABLOLAR DİZİNİ ... X ŞEKİLLER DİZİNİ ... XV GRAFİKLER DİZİNİ ... XVI KISALTMALAR ... XVII 1. GİRİŞ ve AMAÇ ... 1 2. OTOENFLAMATUAR HASTALIKLAR ... 2
3. AİLEVİ AKDENİZ ATEŞİ ... 6
3.1. AAA Tarihçesi ... 6
3.2. AAA Epidemiyolojisi ... 7
3.3 AAA Patogenez ... 9
3.3.1. Ailevi Akdeniz Ateşi ve Nötrofil Aktivasyonu ... 10
3.3.2. Ailevi Akdeniz Ateşi ve Artmış Sitokin Yanıtı ... 11
3.3.3. AAA ve C5A İnhibitör Proteininin Yetersizliği ... 12
3.3.4. Fiziksel Stres-Katekolamin Metabolizma Bozukluğu ... 12
3.3.5. AAA Patogenezi-Pyrin Rolü ... 12
3.3.5.1. Pyrin İle İlişkili Proteinler ... 18
3.3.5.2. İnflamazom ve IL1 B Rolü ... 22
3.4. AAA Klinik Özellikleri ... 29
3.4.1. Ateş ... 30
3.4.2. Karın ağrısı ... 30
3.4.3. Artrit ve Diğer Kas –İskelet Sistemi Tutulumları ... 31
3.4.4. Göğüs Ağrısı ... 33
3.4.5. Erizipel Benzeri Eritem ve Diğer Cilt Lezyonları ... 34
3.4.6. Akut Skrotum ... 34
3.4.8. Splenomegali, Hepatomegali ... 35
3.4.9. Pelvik Tutulum ... 35
3.4.10. Vaskülit ... 36
3.4.11. Amiloidoz ... 37
3.4.12. Amiloidoz dışı böbrek tutulumu ... 40
3.5. AAA Genetiği ve Genotip-Fenotip İlişkisi ... 40
3.5.1. Genotip-Fenotip İlişkisi ... 49
3.6. AAA Laboratuvar Bulguları ... 51
3.7. Ailesel Akdeniz Ateşi Tanısı ... 53
3.8. AAA Hastalık Ciddiyetinin Değerlendirilmesi ... 58
3.9. AAA Ayırıcı Tanısı ... 59
3.10.AAA Tedavisi ... 61
4. GEREÇ VE YÖNTEM ... 66
4.1. Verilerin tanımlanması ve Analizi ... 66
4.1.1. Veri Analizi ... 68
4.2 . Moleküler Teknikler ... 69
4.2.1. DNA İzolasyon ... 69
4.2.2. DNA'nın kontrolü... 70
4.2.3. Polimeraz Zincir Reaksiyonu ... 70
5. BULGULAR ... 72
5.1. Genotipik Özellikleri ... 76
5.1.1. Hastaların İnterlökin Reseptör Antagonisti Özellikleri ... 80
5.1.2. İnterlökin 1 Beta Geni +3953 (C/T) Polimorfizmi ... 82
5.1.3. ILRN2 Polimorfizmi Taşıyan Hastaların Genotipleri ... 84
5.1.4. İnterlökin 1 Beta Geni +3953 (C/T) Polimorfizmi Taşıyan Hastaların MEFV Gen Mutasyon Dağılımı ... 86
5.2. Atak Sayıları ... 87
5.3. Klinik Özellikler ... 88
5.3.1. Ateş ... 90
5.3.2. Gastrointestinal Sistem Semptomları ... 94
5.3.3. Kas İskelet Sistemi Bulguları ... 96
5.3.5. Cilt Bulguları ... 103
5.3.6. Skrotal Atak ... 104
5.3.7. Diğer Klinik Özellikler ... 104
5.3.8. Hepatomegali-Splenomegali ... 104
5.3.9. Büyüme Geriliği ... 105
5.3.10. Hematüri ve Proteinüri ... 105
5.4. AAA Ağırlık Skoru Analizi (HAS) ... 106
5.5. Laboratuvar Bulgularının Analizi ... 110
5.6. Tedavi Yanıtı ... 114
5.6.1. Kolşisine Yanıtın Değerlendirilmesi ... 115
6. TARTIŞMA ... 117
7. SONUÇLAR ... 132
KAYNAKLAR ... 135
TABLOLAR DİZİNİ
Tablo 3.1. MEFV Geni Genel Yapısı ... 41
Tablo 3.2. 16 kromozom üzerinde bulunan MEFV geninde saptanmış bazı mutasyonlar ... 45
Tablo 3.3. Toplumlardaki mutasyon dağılımları ... 46
Tablo 3.4. Farklı toplumlara ait MEFV mutasyon dağılımı ... 47
Tablo 3.5. MEFV mutasyonlarI ve klinik ilişkisi ... 50
Tablo 3.6. AAA için laboratuvar tanısal kriterleri ... 53
Tablo 3.7. AAA’da Tel Hashomer Tanı Kriterleri ... 55
Tablo 3.8. Livneh tanı kriterleri ... 56
Tablo3.9: Yalçınkaya ve Özen önerdiği kriterleri duyarlılık özgüllük değerleri ... 57
Tablo 3.10. Yalçınkaya ve Özen önerdiği kriterleri duyarlılık özgüllük değerleri ... 57
Tablo 3.11. Pras hastalık şiddet skorlaması ... 58
Tablo 3.12. Çocuklar için modifiye edilmiş Pras skorlaması ... 59
Tablo 3.13. Kalıtsal Otoinflamatuar Hastalıkların Özellikleri ... 60
Tablo 3.14. Ayırıcı tanıda düşünülecek hastalıklar ... 61
Tablo 5.1. Hastalık Başlangıç Yaşı, Tanı Yaşı, İlk Klinik Bulgu Ve Tanı Arasındaki Süre ... 72
Tablo 5.2. Hastaların ailelerinde akrabalık durumu ve AAA aile öyküsü ... 73
Tablo 5.3. Ailede ek romatizmal hastalık öyküsü ... 74
Tablo 5.4. Ek hastalıklar ... 74
Tablo 5.5. DNA Stip analizi yöntemi ile mutasyonu tespit edilen sık görülen mutasyonları taşıyan olgular ve DNA sekans yöntemi ile tek nükleotid polimorfizimleri taşıyan olguların hastalık başlangıç yaşı, tanı yaşı sürelerinin değerlendirilmesi ... 75
Tablo 5.6. Mutasyon tiplerine göre yaş, semptom yaşı, tanı gecikmesi ve toplam yakınma süreleri ... 75
Tablo 5.7. M694V mutasyon durumuna göre semptom yaşı, tanı yaşı ... 76
Tablo 5.9. Sık görülen mutasyonu olan 133 hastanın çalışılan mutasyon
dağılımları ... 79
Tablo 5.10. Sık görülen mutasyonu olan 133 hastanın çalışılan mutasyonlarının dağılımı ve allel sıklıkları ... 79
Tablo 5.11. Sık görülen Mutasyonların tek yada iki allelde bulunması durumunun değerlendirilmesi ... 80
Tablo 5.12. Hastalardaki mutasyonların eksonlara göre dağılımı ve allel sıklığı ... 80
Tablo5.13. ILRN1 saptanan hasta ve kontrol grubu ... 81
Tablo 5.14. ILRN2 polimorfizmi saptanan hasta ve kontrol grubu ... 81
Tablo:5.15. ILRN3: saptanan hasta ve kontrol grubu ... 81
Tablo 5.16. ILRN4 polimorfizmi hasta ve kontrol grubu ... 82
Tablo 5.17. IL-1Beta +3954 C/T polimorfizmi taşıyan ve taşımayan hasta ve kontrol grubu ... 82
Tablo 5.18. ILRN 2 polimorfizmi taşıyan ve taşımayan hastaların hastalık başlama yaşı, tanı gecikme süresi toplam yakınma süresinin değerlendirilmesi ... 83
Tablo 5.19. IL-1Beta +3954 (C/T) polimorfizmi Taşıyan ve taşımayanların tanı yaşı, semptom yaşı, tanı gecikme süreleri ... 83
Tablo 5.20. ILRN2/IL1 B polimorfizmi içerme durumlarına göre hastaların Yaş, tanı yaşı semptom yaşı, yakınma süresi ve tanı gecikme sürelerinin karşılaştırılması ... 84
Tablo:5.21. ILRN2 polimorfizmi olan hastaların MEFV genotipleri ... 85
Tablo 5.22. ILRN2 (+)/IL1 Beta +3953 (C/T) polimorfizmi (+) hastaların MEFV genotipleri ... 86
Tablo 5.23. IL1 Beta +3953 (C/T) polimorfizmi (içeren hastaların MEFV mutasyonları ... 86
Tablo 5.24. Sık mutasyonu olan grup/ polimorifizim içeren grup atak sayıları ... 87
Tablo:5.25. M694V mutasyonu taşıyıp taşımama durumuna göre atak sayıları ... 88
Tablo 5.26. HSP geçiren hastaların MEFV mutasyonları ve ILRN ve IL1B polimorfizm durumları ... 89
Tablo 5.28. Ateş yüksekliği ve cinsiyetler arası fark ... 90
Tablo 5.29. Ateş yüksekliği ILRN2 polimorfizmi ilişkisi ... 91
Tablo5.30. Ateş yüksekliği IL1B +3953 (C/T) Polimorfizmi ilişkisi ... 91
Tablo5.31. Ateş yüksekliği ILRN/ IL1B +3953 (C/T) Polimorfizmi ilişkisi ... 91
Tablo 5.31. Ateş yüksekliği MEFV mutasyon şekli ... 91
Tablo 5.32. M694 V mutasyonu ateş ... 92
Tablo 5.33. M694V durumuna göre ateş süreleri ... 92
Tablo 5.34: Polimorfizim /Sık mutasyon saptanan hastalar ateş yüksekliği ... 93
Tablo 5.35: Sık mutasyon /polimorfizim olan hastalar ateş süreleri ... 93
Tablo 5.36. Mutasyon tiplerine göre ateş ... 93
Tablo 5, 37. Mutasyon tiplerine göre ateş süreleri ... 93
Tablo 5.38. ILRN2/ IL1B +3953 (C/T) Polimorfizmi taşıyan ve taşımayanların ateş süreleri ... 94
Tablo 5.39. GİS bulguları kız /erkek saptanma oranları ... 94
Tablo 5.40. M694V durumuna göre GİS bulguları süreleri ... 95
Tablo 5.41. Mutasyon tiplerine göre GİS semptomları ... 95
Tablo 5.42. ILRN 2 polimorfizmi ve GİS semptomları ... 95
Tablo 5.43. Gis semptomları IL1B +3953 (C/T) Polimorfizmi ... 96
Tablo5.44. ILRN2/ IL1B +3953 (C/T) Polimorfizmi içerme durumlarına göre hastaların GİS semptomları ... 96
Tablo 5.45. Hastaların kas iskelet sistemi yakınmaları ... 97
Tablo 5.46. Cinsiyetlere göre kas iskelet sistemi yakınmaları ... 97
Tablo 5.47. Sık rastlanan mutasyonu olanlarla polimorfizim tipi mutasyonu olanların kas iskelet sistemi yakınmaları ... 98
Tablo 5.48. Mutasyon tiplerine göre kas iskelet sistemi semptomları ... 98
Tablo 5.49. M694V durumuna göre kas iskelet sistemi yakınmaları ... 99
Tablo 5.50. ILRN2 polimorfizmi taşıyan hastalarda kas iskelet sistemi bulguları ... 99
Tablo 5.51. Kas ve iskelet sistemi semptomları IL1B +3953 (C/T) Polimorfizmi Dağılımı ... 100
Tablo 5.52. ILRN2/ IL1B +3953 (C/T) Polimorfizmi içerme durumlarına göre hastaların kas iskelet sistemi semptomları ... 100
Tablo 5.54. Göğüs ağrısı/plevral efüzyon /perikardiyal efüzyon kız ve
erkek hastalarda saptanma oranları ... 101
Tablo 5.55. Sık görülen mutasyon taşıyanlarla / polimorfizmİ taşımayanlarda göğüs ağrısı semptomu ... 101
Tablo 5.56. Mutasyon tipi göğüs ağrısı ... 101
Tablo 5.57. M694V (+) durumu ve göğüs ağrısı ... 102
Tablo 5.58. ILRN2 polimorfizmi ve göğüs ağrısı ... 102
Tablo 5.59. ILRN2/ IL1 BETA +3953 (C/T) polimorfizmi göğüs ağrısı ... 102
Tablo 5.60. Plevral efüzyonu olan hastaların genotipik özellikleri ... 102
Tablo 5.61. Perikardiyal efüzyonu olan hastaların genotipik özellikleri ... 103
Tablo 5.62. Mutasyon tipi döküntü varlığı ... 104
Tablo 5.63. M694V mutasyonu ve döküntü varlığı ... 104
Tablo 5.64. Büyüme geriliği M694V durumu ... 105
Tablo 5.65. Mutasyon tipine göre büyüme geriliği varlığı ... 105
Tablo 5.66. Proteinürisi Olan Hastaların Genotipik Özellikleri ... 106
Tablo 5.67. Mutasyon Tiplerine Göre Pras Skoru Değerleri ... 107
Tablo 5.68. M694V Mutasyon Taşıma Durumlarına Göre Pras Skoru Değerleri ... 108
Tablo 5.69. ILRN2 polimorfizmi içeren ve içermeyen hastalarda PRAS skoru ... 109
Tablo 5.70. IL1 Beta +3953 (C/T) polimorfizmi içeren ve içermeyen hastalarda PRAS skoru ... 109
Tablo 5.71. ILRN / IL1 Beta +3953 (C/T) polimorfizmi içerme durumlarına göre Pras skoru ... 110
Tablo 5.72. Atak döneminde lab. bulgularının analizi ... 110
Tablo 5.73. Tek allelde MEFV gen mutasyonu taşıyanlarda atakta lab .bulguları ... 110
Tablo 5.74. Çift allelde MEFV gen mutasyonu taşıyanlarda atakta lab. Bulguları ... 111
Tablo 5.75. M694V mutasyonu içerme durumlarına göre atakta lökosit değerleri ... 111
Tablo 5.76. M694V mutasyonu içerme durumlarına göre atakta CRP değerleri ... 111
Tablo 5.77. M694V mutasyonu içerme durumlarına göre atakta ESR
değerleri ... 112 Tablo 5.78. M694V mutasyonu içerme durumlarına göre atakta SAA
değerleri ... 112 Tablo 5.79. ILRN2 (-) Grubun laboratuvar analizi ... 112 Tablo 5.80. ILRN2 (+) polimorfizmi taşıyan grubun laboratuvar analizi ... 113 Tablo 5.81. ILRN2 polimorfizmi taşıyan ve taşımayanlarda CRP/SAA
değerleri ... 113 Tablo 5.82. IL1Beta +3953 (C/T) polimorfizmi taşıyanlarda laboratuar ... 113 Tablo:5.83. ILRN2 polimorfizmi ve IL1Beta +3953 (C/T) polimorfizmi
taşıma durumlarına göre lab. Değerleri ... 114 Tablo:5.84. M694V içerme durumlarına göre ilaç öncesi (iö) atak sayısı ve
ilaç sonrası (is) atak sayısı karşılaştırılması ... 114 Tablo 5.85. Hastaların M694V içerme durumlarına göre atak sürelerinin
ilaç öncesi ve ilaç sonrası değişimleri ... 115 Tablo 5.86. Kolşisine yanıtsız hastaların genotipik özellikleri ... 116 Tablo 6.1. Balcı ve arkadaşlarının çalışması ile çalışmamızdaki verilerin
ŞEKİLLER DİZİNİ
Şekil 2.1. IL1 inflamasyon ve denetimi ... 3
Şekil 2.2. Touitou, I. INEFEVERS veri tabanında yer alan otoinflamatuar hastalıklar ve şimdiye kadar bulunan sekans varyantları ... 5
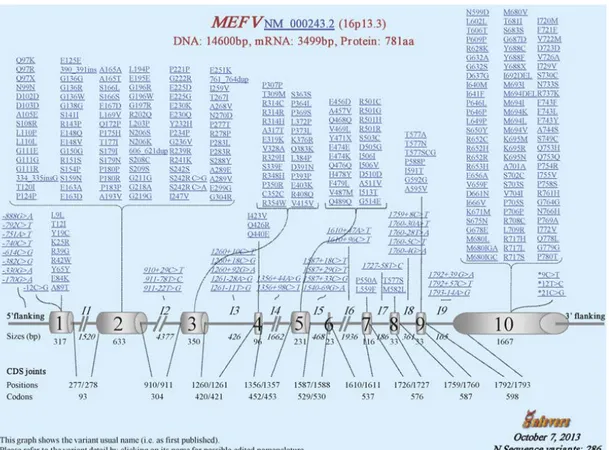
Şekil 3.1. 16. kromozom MEFV gen lokasyonu ve pyrin proteini domainleri ... 7
Şekil 3.2. Göçler ve mutasyonların dağılımı ... 9
Şekil 3.3. MEFV eksonları ve sık gözlenen mutasyonlar ... 14
Şekil 3.4. Pyrin domainleri ... 15
Şekil 3.5. Pyrin ve mutasyon bölgeler ... 16
Şekil 3.6. Pyrin proteininin etki ettiği hastalık patogenezi temel moleküler yolağı. ... 17
Şekil 3.7. Genel İnflamazom Kompleksi ... 19
Şekil 3.8. IL 1 ve caspase ilişkisi ... 19
Şekil 3.9. NLR protein ailesi domain yapısı ... 20
Şekil 3.10. Pyrin Asc Etkileşimi ... 21
Şekil 3.11. IL1B Görevleri ... 22
Şekil 3.12. NLRP3 ve IL1-b etkileşimi... 23
Şekil 3.13. NLR İnflamasomları ... 24
Şekil 3.14. Pyrin Proteininin İnflamasyondaki Rolü ... 25
Şekil 3.15. Sekestrasyon ve inflamasom hipotezi ... 26
Şekil 3.16. 16 Kromozomda MEFV Gen Lokalizasyonu ... 41
Şekil 3.17. MEFV geni ve mutasyonlar ... 42
Şekil 3.18. Mutasyonların eksonlara göre sıklığı ... 43
Şekil 3.19. MEFV geni ve mutasyonlarının ülkelere göre varyasyon oranları ... 48
Şekil 3.20. AAA tanısında moleküler tetkiklerin yeri ... 54
Şekil 3.21. Kolşisinin elde edildiği çiğdem çiçeği; Colchicium autumnale ... 62
GRAFİKLER DİZİNİ
Grafik 5.1. Sık mutasyon/polimorfizm olan hastaların atak sayıları ... 87 Grafik 5.2. M694V mutasyonu taşıma durumuna göre atak sayıları ... 88 Grafik 5.3. M694V mutasyon durumuna göre ateş süreleri ... 92 Grafik 5.4. M694V Mutasyonu Taşıma Durumuna Göre Pras Ağırlık
KISALTMALAR
FMF : Familial mediterranean fever AAA : Ailevi akdeniz ateşi
PCR : Polimeraz zincir rekasiyonu
PCR-RFLP : Polimerase chain Reactian-Restriction Fragment Length Polymorphism
MEFV : Mediterranean fever CRP : C reaktif protein PAN : Poliarteritis Nodosa
HSP : Henoch -Schönlein Purpurası TNF : Tümör Nekroz Faktör IL : İnterlökin
SICAM : Soluble Intersellular adhesion Molecule NSAİ : Non Steroid Antiinflamatur
SAA : Serum amiloid A ELE : Erizipel benzeri eritem dNTP : Deoksinükleotid triposfat EtBr : Etidyum Bromid
RE : Restriksiyon Endonükleaz TAE : Tris-asetik asit-EDTA TBE : Tris borik asit
fL : fentolitre
ASC : Apoptosis-associated speck like protein with a CARD CARD : Caspase recruitment domain
PyD : Pyrin domain
NF-κB : Nuclear factor kappa-light-chain-enhancer of activated B cells ESR : Eritrosit sedimantasyon hızı
TNF-α : Tümör Nekrozis Faktör- alfa sIL-2R : Eriyebilir IL-2 reseptör AA : Amyloid associate chain
MICA : Major histokompatibilite kompleks sınıf I ile ilişkili gen BUN : Kan üre azotu
ALT : Alanin aminotransferaz EDTA : Etilen Diamin Tetra Asetikasit IL-1B: : İnterlökin 1 beta
ILRN : İnterlökin reseptör antagonisti PMR : Polimyaljia romatika
1. GİRİŞ ve AMAÇ
Ailevi Akdeniz Ateşi (AAA, FMF), çoğu kez ateş ile birlikte olan periton plevra ve nadiren de perikardın tutulduğu 12 ile 96 saat devam eden kendi kendine iyileşen akut inflamasyon atakları ile karakterize otozomal resesif geçişli etnik kökenli bir hastalıktır. Dünya çapında 150, 000’den fazla insanı etkilemektedir kalıtsal periyodik ateş hastalıkları arasında en yaygın olanıdır. Akdeniz’e kıyısı olan ülkelerde ve özellikle de Arap, Türk, Ermeni ve Seferad Yahudilerinde görülür (13). Uluslar arası AAA grubu ve Fransız AAA grubu adında iki bağımsız grup, 16p13.3’de yerleşik olan bu genin pozisyonel klonlama tekniği ile moleküler dizisini ve bu gen tarafından kodlanan proteini (pyrin /marenostrin) (12) eşzamanlı olarak keşfetmişlerdir. Geninin klonlanması ile bu hastalık, daha da ilgi çeken bir hastalık haline gelmiştir. Türkiye’de AAA prevalansı bölgesel özellik göstermektedir. Ülkemizde hastalık Akdeniz kıyılarında yaşayanlardan çok, kökleri Ankara Tokat, Sivas, Kayseri gibi İç Anadolu, Kastamonu, Sinop gibi Batı Karadeniz, Gümüşhane, Giresun, Bayburt gibi Doğu Karadeniz, Erzincan, Erzurum, Malatya Kars, Ağrı gibi doğu Anadolu’ya dayananlarda daha sık görülmektedir (22).
Ailesel Akdeniz Ateşi klinik heterojeniteye sahip bir hastalıktır. Hastalığın kliniği ve şiddeti hastadan hastaya hatta aynı hastanın farklı ataklarında bile kendi içinde değişebilmektedir. Hastalığın bu çeşitliliğinin altında:genetik etmenlerden çevresel etmenlere, etnik kökene kadar pek çok neden yatmaktadır. Daha önce genetik heterojenite ve etnik kökenin kliniğe etkisi çok fazla araştırılan bir konudur. Ancak inflamasyonda önemli rol oynayan IL-1 ve IL-1 reseptör anatgonistinin bu klinik heterojenitedeki yeri , tedaviye yanıtsızlık ve ağır hastalık tablosundaki rolü üzerine pek az çalışma yapılmıştır. Calışmamızda amaç: klinik farklılıkta hastalar arasında, inflamatuar yanıtta önemli rolü olan IL1B ve IL1 B Reseptör antagonisti gen polimorfizimlerinin etkisini göstermektir. FMF hastalarındaki atak şiddeti ile IL-1 B ve IL1B reseptör antogonist gen polimorfizimleri arasında ilişki saptanırsa, bu polimorfizimlere göre ilacın dozu ayarlanabilecek veya tedavi değişimi yapılabilecektir.
Bu konuyla ilgili ilk aşama olarak: Ege Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Romatoloji ve Genel Pediatri Polikliniklerinden takip edilen MEFV geninde farklı mutasyonları (genotipleri) olan Ailesel Akdeniz Ateşi hastalarında, IL-1beta ve, ILRN 1 gen polimorfizminin klinik seyir ve tedaviye yanıt ile ilişkisinin araştırılması amaçlandı.
2. OTOENFLAMATUAR HASTALIKLAR:
Ateş; enfeksiyonlar veya aseptik uyarı aracılığı ile tetiklenmiş vücudun kompleks bir cevabıdır. Normal bir vücut savunma mekanizmasıdır. Altta yatan hastalık süresince devam edebilir. Çocukluk çağında önemli ve sık rastlanılan bir bulgudur. En sık neden viral üst solunum yolu enfeksiyonlarıdır (1). Ateşin tekrarladığı ve ayırıcı tanıda enfeksiyonların dışlandığı durumlarda neoplastik ve romatolojik hastalıkların, immün yetmezliklerin, çeşitli endokrin ya da metabolik bozuklukların da bu duruma sebep olabileceği hatırlanmalıdır. Ateşin belirli aralıklarla tekrarladığı ve sebebinin anlaşılamadığı durumlarda ise ‘periyodik ateş sendromları’ düşünülmelidir (1, 2).Periyodik ateş sendromları, tekrarlayan ateş ataklarının eşlik ettiği farklı düzeylerde inflamatuvar bulgularla karakterize, klinik olarak tipik bir infeksiyon hastalığının gösterilemediği, akut faz reaktanlarında artışın görüldüğü hastalık grubudur.
Periyodik ateş sendromları, otoinflamatuar hastalıklar grubu altında toplanmaktadır. Otoinflamatuar hastalıklar, inflamatuar hastalıkların son dönemde tanımlanmıs bir alt sınıfı olup, otoimmün hastalıklarla pek az ortak özellik taşımaktadırlar. Bilinmeyen bir uyarı tarafından ve herhangi otoimmün işaret olmadan tetiklenen periyodik inflamasyon, bu bozuklukların sürmekte olan anahtar özelliği iken; ateş her zaman mevcut olmayabilmektedir. Otoinflamatuar hastalıkların bir çoğunda enfeksiyon bulguları bulunmaz ve birçoğunda da herediter özellik görülür (2-3).Bu nedenle artık bu hastalıklara herediter terimini içeren otoinflamatuvar sendromlar denilmektedir. Tekrarlayan ateş atakları ve bu dönemlerin arasında az veya çok süren ateşsiz dönemler izlenir. Ateş ataklarına genellikle sistemik veya lokalize inflamasyon bulguları eşlik eder. Özellikle eklem, deri, göz ve karına ilişkin semptomlar sık gözlenir.
Otoinflamatuar hastalığı düşündüren durumlar özetlenecek olursa: Altı aydan uzun süren düzenli ya da düzensiz aralıklarla yineleyen ateş atakları, ani başlayan ve ani kaybolan ataklar, solunum bulgularının yokluğu, tüm ataklarda benzer bulguların olması ve ataklar arasında tam iyilik hali olmasıdır. Farklı sistemler ait değişik klinik bulgular eşlik edebilir. Anemi, lökositoz, trombositoz ve artmış akut faz reaktanları mevcutken otoantikor düzeyleri negatiftir. Bu hastalıkların semptomlarının ortak olması kadar patofizyolojilerinin ve tedavilerinin de ortak olması dikkat çekicidir. Son on yılda bu hastalıkların moleküler düzeyde tanımlanması ve klinik gidişinin
anlaşılması ile giderek artan sayıda hasta fark edilmiş, tanı almış ve tedavi edilmiştir. Bu hastalıklar, adaptif immün yanıt bozukluluğuna ait herhangi bir kanıt olmadan doğal immün yanıtın primer disfonksiyonu ile oluşmaktadırlar. Doğal immün sistem anomalileri; lipopolisakkarit ve peptidoglikan gibi patojenler ile ilişkili moleküler düzenlenmelere (PAMPs) verilen anormal, sapmış cevaplar ile kan ve dokularda göze çarpan ciddi nötrofili ve inflamatuar sitokin veya onların reseptörlerinin (IL-1B, TNF-a) disregülasyonunu içermektedir (32). Son dönemde yapılan araştırmalar özellikle IL1 yolağı üzerinde durmaktadır ve ana bozukluğun bu IL1 yolağı olduğu düşünülmektedir. Bu otoinflamatuar hastalıkların moleküler temelinin aydınlatılması, sistemik ve doku inflamasyonunun hastalık patofizyolojisinin artan bir kavrayış ile anlaşılması ve aynı zamanda yeni, patolojik olmayan doğal immün mekanizmaların ortaya çıkışını sağlayacaktır.
Otoinflamatuar hastalıklara ait örnekler; Otosomal Çekinik Geçişliler
–Ailesel Akdeniz Ateşi
–Hiperimmünglobulin D Sendromu –DIRA Sendromu
–Majeed Sendromu
Otosomal Baskın Geçişliler
–TNF Reseptörü ile İlişkili Sendrom (TRAPS) –Kriyoprinopatiler
–PAPA Sendromu
Granulümatoz Hastalıklar –Blau Sendromu
–Erken Başlangıçlı Sarkoidoz Genetik Geçişli Olmayanlar –PFAPA Sendromu
–Sistemik JİA –Behçet Hastalığı –Yineleyen Perikardit
–Kronik Yineleyen Multifokal Osteomiyelit (CRMO)
INFEVERS veritabanı, 2002 yılında kurulmuş ve araştırıcılar için, periyodik ateş sendromları ile ilişkilendirilen tüm sekans varyantları hakkında merkezi bilgi kaynağına giriş sunmaktadır. Sitenin güncel versiyonu ‘ISSAID’, 8 geni içermektedir. Mevcut 6 gen; MEFV, MVK, TNFRSF1A, NLRP3, NOD2, PSTPIP1 olmakla birlikte yeni eklenen 2 gen; LPIN2 ve NLRP7’dir. INFEVERS ‘ISSAID’ veritabanı (şekil 2.2), ilişkili genler dâhilinde 540 sekans varyantının üzerinde içeriğe sahiptir .Türk FMF hastalarda saptanan 9 adet MEFV gen mutasyonu INFEVERS’e kayıt edilerek Türk ve dünya literatürüne kazandırılmıştır.
Şekil 2.2. Touitou, I. INEFEVERS veri tabanında yer alan otoinflamatuar hastalıklar ve şimdiye
kadar bulunan sekans varyantları (Internet Fevers; http://fmf.igh.cnrs.fr/ISSAID/infevers). Bu hastalıklarda gösterilen genlerin kodladıkları protein ürünleri, doğal immünite ve apoptozda yer alan belli bölgeleri paylaşırlar. Periyodik otoinflamatuar sendromlar, apoptoz veya NF-kB sinyalizasyon yolakları için gerekli olan protein-protein interaksiyonlarında yer alan bir ölüm domaini, ölüm efektör domaini ve/veya CARD içeren moleküllerdeki mutasyonlar ile oluşur. Bunlar; TRAPS’ta TNF reseptör Tip1 (TNFRSF1A), FMF’te Pyrin, CINCA’da Cryopyrin ve Blau Sendromda NOD2/CARD15 NACHT domainidir.
Ailevi Akdeniz Ateşi (FMF) kalıtsal otoinflamatuar hastalıklar arasında en sık görülenidir ve dünya üzerinde 150.000 den fazla kişinin hayatını etkilemektedir. Otozomal resesif geçiş gösterir . Ailesel Akdeniz Ateşi (AAA) sıklıkla ateşin eşlik ettiği, periton, plevra, sinoviyum ve nadir de olsa perikardın tutulduğu serozit atakları ile karakterize olan bir hastalıktır. Atakların kendi kendini sınırlaması ve belirsiz aralıklarla gelmesi en önemli karakteristiğidir. Ailesel Akdeniz Ateşi önlem alınmadığı taktirde sekonder amiloidoza neden olduğundan mortalite ve morbiditesi yüksek bir hastalıktır (4).
3. AİLEVİ AKDENİZ ATEŞİ
3.1. AAA Tarihçesi
Ailevi Akdeniz Ateşi (AAA, FMF), çoğu kez ateş ile birlikte olan periton plevra ve nadiren de perikardın tutulduğu 12 ile 96 saat devam eden kendi kendine iyileşen akut iltihap atakları ile karakterize otozomal resesif geçişli etnik kökenli bir hastalıktır. Ailevi Akdeniz Ateşi ilk kez 1900’lü yılların başında bildirilmiştir.1908 de Janeway ve arkadaşları tekrar eden ateş yüksekliği, karın ağrısı ve lökositozu olan 16 yaşında Yahudi kız hastada bu hastalığı tanımlamışlardır (5). Daha sonra 1945 yılında Amerikalı araştırmacı Siegal, 10 vakada “Benign Paroksismal Peritonitis” adı ile tekrarlayan ateş ve karın ağrısı atakları şeklinde görülen hastalığı klinik bir antite olarak tanımlamıştır (6).
İlk AAA’lı Türk hasta 1946 yılında (7) yayınlanmıştır. 1948 yılında Reimann “Periyodik hastalık” tanımlamasını kullanmıştır (8). 1952 yılında Catton ve Mamou hastalığın ailevi olduğuna dikkat çekmiş ve FMF’li hastalarda amiloid gelişebileceğini bildirmişlerdir (9). Heller ve Sohar, 1958 yılında ilk kez “Ailevi Akdeniz Ateşi” tanımını kullanmış (10) ve 1961 yılında hastalığın otozomal resesif kalıtıldığını göstermişlerdir (11). “Ailevi Akdeniz Ateşi” kelimeleri hastalığın 3 özelliğini; otozomal resesif kalıtım modeline sahip olduğunu, Akdeniz’den köken aldığını ve tekrarlayan ateş öyküsünün olduğunu göstermektedir. 1992 yılında Pras ve ark. Ailevi Akdeniz Ateşi’ne yol açan genin 16. kromozomun kısa kolunda olduğunu saptamışlardır. 1997 yılında Uluslararası AAA Grubu ve Fransız AAA Grubu adında iki bağımsız grup, 16p13.3’de yerleşik olan bu genin pozisyonel klonlama tekniği ile moleküler dizisini ve bu gen tarafından kodlanan proteini (pyrin/marenostrin) (12) eşzamanlı olarak keşfetmişlerdir. Genin klonlanması ile bu hastalık, daha da ilgi çeken bir hastalık haline gelmiştir (Şekil 3.1).
Şekil 3.1. 16. kromozom MEFV gen lokasyonu ve pyrin proteini domainleri
(http://www.ncbi.nlm.nih.gov/pubmed).
3.2. AAA Epidemiyolojisi
Ailevi Akdeniz ateşi (FMF), otozomal resesif kalıtım gösteren, dünya çapında 150, 000’den fazla insanı etkileyen, kalıtsal periyodik ateş hastalıkları arasında en yaygın olanıdır. Prevalansı en yüksek olan periyodik ateş sendromudur. Akdeniz’e kıyısı olan ülkelerde ve özellikle de Arap, Türk, Ermeni ve Sefarad Yahudilerinde görülür (13). Taşıyıcılık oranı yüksek olduğu için bazı ailelerde otozomal baskın örneğine uygun geçişe de rastlanmaktadır. Son yıllarda daha iyi tanımlandıkça Polonya, Avustralya, Belçika, İspanya, İtalya, Yunanistan ve Küba’da da bildirilmeye başlanmıştır. Özellikle Kuzey Afrikalı Sefaradik Yahudiler (Endülüs, İspanya) hastalığın en şiddetli seyrettiği, amiloidozun en sık görüldüğü gruptur (14). Hastalık ikinci sıklıkta İspanya’dan Türkiye, Irak ve Balkan ülkelerine göceden Yahudiler’de görülür. Askenazi olmayan Yahudilerde FMF prevalansının 1/250 ile 1/500 arasında olduğu, en sık görüldüğü Kuzey Afrika Yahudilerinde ise 1/256’dan fazla olabileceği bildirilmiştir (15). Askenazi Yahudileri’nde hastalık seyrek görülür ve 1/73000 gibi düşük bir prevalansa sahiptir (16) Lübnan’da yaşayan Ermenilerde prevalans 1/500 olarak hesaplanmıştır (17, 18).
Türklerde FMF prevalansı, Özdemir ve Sökmen (1969)’in yaptıkları bir çalışmada %0.3 olarak bulunmuştur. 1998 yılında Özen ve arkadaşlarının yaptıkları epidemiyolojik bir çalışmada ise, daha önceden FMF tanısı alan hasta prevalansı 1/4347, muhtemel FMF tanısı olan hastalarla beraber bu prevalans 1/1073 olarak saptanmıştır (19).Orta Anadolu’daki hastalık prevalansı ise 1/395 olarak bildirilmiştir (20).
Taşıyıcı sıklığı Sefaradik Yahudilerde 1/5, Ermenilerde 1/3 ve Türklerde 1/5 olarak belirlenmiştir (21, 22, 23).Ülkemizde yapılan başka çalışmada MEFV mutasyon sıklığı %25.7 benzer oranlarda saptanmıştır (24). Türkiye’de AAA prevalansı bölgesel özellik göstermektedir. Ülkemizde hastalık Akdeniz kıyılarında yaşayanlardan çok, kökleri Ankara, Tokat, Sivas, Kayseri gibi İç Anadolu, Kastamonu, Sinop gibi Batı Karadeniz, Gümüşhane, Giresun, Bayburt gibi Doğu Karadeniz, Erzincan, Erzurum, Malatya, Kars, Ağrı gibi Doğu Anadolu’ya dayanan bireylerde daha sık görülmektedir (22). Sivas, Tokat, Kastamonu gibi Orta Anadolu bölgesinde % 0, 88 (25) gibi yüksek prevalansta görülürken, Denizli’de 1/3400 gibi düşük prevalanstadır (26). Türk AAA çalışma grubu da, Türkiye’deki AAA hastalarının %70’inin Doğu ve Karadeniz Bölgesi kökenli, %24’ünün İç Anadolu ve düşük bir kısmının Ege Bölgesi kökenli olduğunu rapor etmişler (22) ve benzer sonuçlara ulaşmışlardır.
Otozomal resesif geçişli bir hastalık olan AAA’da akraba evliliği sıklığı %30‐40 civarındadır (28). Hastalık erkeklerde kadınlara oranla 1.5-2 kat fazla görülmektedir (29). Türkiye de AAA çalışma grubunun saptadığı erkek/kadın oranı 1.2/1 ve erkek kadın oranları birbirine yakın olarak saptanmıştır.
Türkiye için sağlıklı çocuklarda prevalans 1/1000 olarak bulunmuştur (30).Özen ve ark. yaptığı 46.813 çocuğu içeren çalışmada sadece daha önceden kesin FMF tanısı almış çocuklar göz önüne alındığında prevalans 2.8/10000 olarak saptanmış, olası FMF olarak değerlendirilen çocuklarda eklendiğinde prevalans 9.3/10.000 olarak bulunmuştur (19). Cerrahpaşa Tıp Fakültesi Çocuk Romatoloji bölümüne kayıtlı 933 çocuk hasta arasında FMF’in juvenil kronik artritten sonra en sık görülen hastalık olduğu saptanmıştır (31).
Şekil 3.2. Göçler ve mutasyonların dağılımı
3.3 AAA Patogenez
Otoinflamatuar hastalıklar; adaptif immün yanıt bozukluluğuna ait herhangi bir kanıt olmadan doğal immün yanıtın primer disfonksiyonu ile oluşmaktadır. Doğal immün sistem anomalileri, lipopolisakkarit ve peptidoglikan gibi patojenler ile ilişkili moleküler düzenlenmelere (PAMPs) verilen anormal, sapmış cevaplar ile kan ve dokularda göze çarpan ciddi nötrofili ve inflamatuar sitokin veya onların reseptörlerinin (IL-1B, TNF-a) disregülasyonunu içermektedir (32).Konağın kendine olan self immün yanıtının disregülasyonu söz konusudur ve otoinflamasyonla karakterizedirler.
Otoinflamatuar hastalıkların temelinde eskiden otoimmün mekanizmaların olduğu düşünülmüş ancak sonradan yapılan çalışmalar sonucunda spesifik otoantikorların saptanamamış olması, otoreaktif T hücrelerinin bulunmayışı, semptomların steroide yanıt vermemesi nedeni ile bu görüşden uzaklaşılmıştır (33).
Otoinflamatur hastalıkların en sık rastlanılanı olan Ailesel Akdeniz Ateşinin etiyopatogenezinde alttayatan moleküler mekanizma tam olarak açıklanamamakla birlikte immünolojik olayın rol oynadığı düşünülür. Mutant MEFV gen ürünü olan pyrinin veya maeronostrinin bozulmuş fonksiyonu, lipokortin yetersizliği, katekolaminlerin depolanma ve salıverilmesinde dengesizlik, C5a inhibitör proteininin yetersizliği, inflamatuar reaksiyonun rolü, fiziksel ve emosyonel stres,
mensturasyon, enfeksiyonların ve yüksek yağlı diyetin ataklarda rolü olduğu ileri sürülmüştür.
Patogenezde ileri sürülen hipotezlerden en çok kabul göreni; MEFV geninin kodladığı Pyrin/Marenostrin proteininin nötrofil aracılıklı inflamasyonu baskılamasında aksama olmasıdır. Mutasyona uğramış olan genin proteini, yani pyrin inflamasyondaki kontrol görevini yapamamaktadır. Bugün için tam olarak bilinemeyen nedenlerle uyarılmış olan inflamasyon durdurulamamakta ve ateşle birlikte belirli bölgelerde sınırlı inflamasyon atakları ile karakterize klinik tablo ortaya çıkmaktadır .
3.3.1. Ailevi Akdeniz Ateşi ve Nötrofil Aktivasyonu
AAA hastalığında serozal dokularda inflamasyon önemli bir klinik bulgudur. Tutulan serozal dokularda belirgin nötrofil (PNL) hakimiyeti mevcuttur (34). Bunun gözlemlenmesi ile inflamatuar cevapta polimorfonükleer (PNL) lökositlerin rolü ve özellikle de PNL’in fonksiyonları ile ilgili çalışmalara ağırlık verilmiştir.Ataklarda inflamasyon bölgesine gelen PNL’den kemotaktik faktörler salınmakta bunun sonucunda da daha fazla PNL bölgeye göç etmekte ve inflamasyon şiddeti artmaktadır (35). Nötrofil kemotaksisi remisyonda normal, atak sırasında artmış, kolşisin tedavisi ile %50 azalmış bulunmuştur. AAA’de nötrofil fonksiyonları ile ilgili çalışmalarda AAA hastalarının nötrofillerinin normal morfoloji, kemotaksis, fagositoz ve mikrotübüler fonksiyon gösterdikleri fakat AAA olmayan hastaların nötrofilleri ile karşılaştırıldıklarında bazı fonksiyonel farklılıkları olduğu saptanmıştır (35, 36, 37). Asemptomatik AAA hastalarının nötrofillerinden ısı ve hipotonik uyarılar karşısında normalden fazla miktarda lizozom salgılandığı (38), AAA hastalarında interlökin 8 (IL-8), çözünebilir interselüler adezyon molekülü 1 (sICAM1) ve çözünebilir endotelyal adezyon molekülü 1 (sELAM1) seviyeleri yüksek olduğu bulunmuştur. Bundan dolayı da; AAA hastalığında nötrofillerin artmış adezyon yoluyla aktive olduğu iddia edilmiştir.Bazı araştırmalarda AAA hastası plazmasının sağlıklı kişilerin hücrelerinde kromozom hasarı yapabileceği gözlemlenmiştir. Bu gözleme dayanarak da hastalarının nötrofillerinde spontan oksijen radikal üretimi artışının, klastrojenik (DNA da yapısal hasara neden olan) etkiyi artırdığı öne sürülmüştür (39).
Nötrofil odaklı araştırmalar ülkemizde de yapılmıştır. Bu araştırmalarda semptomsuz hastalarda periferik kan lökositleri normal apoptoz göstermiş iken, inflamatuar ataklar süresince nötrofil ve monositlerde artmış apoptoz ve yüksek serum solubl FAS konsantrasyonları gözlemlenmiştir (40, 41).
Patogenezde, nötrofil odaklı hipotezler; AAA hastalığında sitokinlerin ve özellikle pyrinin öneminin ortaya çıkması ile birlikte geçerliliğini yitirmiş, nötrofil artışının neden değil sonuç olduğu görüşü benimsenmiştir.
3.3.2. Ailevi Akdeniz Ateşi ve Artmış Sitokin Yanıtı
Ailesel Akdeniz Ateşi atak döneminde C-reaktif Protein (CRP) ve Serum Amiloid A (SAA) gibi akut faz reaktanlarının arttığı gösterilmiştir. Bazı çalışmalarda ataksız dönemdeki AAA hastalarında ve asemptomatik AAA taşıyıcılarında CRP değerlerinin sağlıklı kontrol grubuna göre daha yüksek olduğu saptanmıştır (44, 45). Atak olmayan dönemlerde bile subklinik inflamasyonun devam ettiği gösterilmiş (46) bu nedenle de ataklar arası yakınmalarda subklinik inflamasyonun rol aldığı düşünülmüştür (47).Akut faz yanıtının ataklarda ve subklinik inflamasyondaki öneminin ortaya çıkmasından sonra da bu akut faz yanıtından sorumlu tutulan sitokinler ile ilgili çalışmalar yapılmıştır. Yapılan çalışmalarda atak döneminde interlökin 2 (IL2), interlökin 6 (IL6), interlökin 8 (IL8), ve tümör nekroz faktör alfa (TNFα) düzeylerinin yüksek olduğu saptanmıştır (43, 48) Artmış interlökin 8 (IL8) salınımının gözlenmesi, IL 8 in proinflamatuar yanıtta rol alabileceğini düşündürmüştür (49). Tümör nekroz faktör alfanın (TNFα) hem hipotalamustaki ateş merkezini uyararak hem de IL1 yapımını artırarak vücut ısısını yükselttiği, nötrofilleri aktive ettiği ve endotel hücre düzeyinde adezyon molekülü ekspresyonunun indükleyerek endotel hücrelerine lökosit adezyonunu artırdığı gösterilmiştir (50). Diğer taraftan TNF alfa, IL6 salınımını akut faz yanıtlarını ve lökotrien oluşumunda da indükleyici role sahiptir IL6’da artan sitokinlerdendir. İnflamatuar süreçte IL6 rolü üzerine çalışmalar yapılmaya devam etmektedir. İnterlökinlerden IL1 in AAA hastalığındaki rolü son dönemde en çok araştırılan konulardan olmuştur.Tüm bu sitokinlerde saptanan değişikliklerin AAA patogenezindeki esas neden olmaktan çok ikincil değişiklikler olduğu kabul edilmektedir.
3.3.3. AAA ve C5A İnhibitör Proteininin Yetersizliği
Ailesel akdeniz ateşindeki (AAA) patolojik değişikleri açıklayan diğer bir hipotez ise; atakların inflamatuar düzenlenmesindeki bir bozukluktan kaynaklandığıdır. Normalde peritoneal ve sinoviyal sıvılar komplemanın C5a fragmanının kemotaktik aktivitesini engelleyen inhibitör bir protein taşırlar. C5A önemli bir inflamatuar mediatör olup nötrofiller için güçlü bir kemotaktik etkiye sahiptir.C5A inhibitör protein ise hem C5a’yı hem hem de güçlü bir proinflamatuar sitokin olan interlökin (IL8) inhibe eder. AAA hastalarının periton ve eklem sıvılarında C5A inhibitör proteinin yetersiz olduğu bu nedenle artmış inflamasyonun ortaya çıkabileceği ileri sürülmüştür (51).
3.3.4. Fiziksel Stres-Katekolamin Metabolizma Bozukluğu
AAA ataklarının emosyonel stresle ortaya çıkmasına dayanarak, patogenezin katekolamin metabolizmasındaki bozukluk ile ilişkili olabileceği ileri sürülmüştür. Barakat ve arkadaşları tarafından, katekolamin metabolizmasındaki olası bozukluğu ortaya koyabilmek için çalışmalar yapılmıştır. Sempatomimetik ajan olan metaraminol kulanılmıştır. AAA düşünülen olgularda metaraminol infüzyonu ile atak benzeri semptomaların ortaya çıktığını ancak sağlıklı grupta semptom oluşmadığını göstermişlerdir. Bu gözlemlerine dayanarak; AAA hastalığında sebebin katekolamin metabolizmasındaki defekt olabileceğini bildirmişlerdir (52). Ancak daha sonra yapılan çalışmalarda bu hipotez desteklenmemiştir.
3.3.5. AAA Patogenezi-Pyrin Rolü:***
AAA patogenezinde en çok kabul edilen görüş; PYRİN’in fonksiyon bozukluğu ve bunun sonucunda inflamasyonun durdurulamamasıdır. Patogenezi anlayabilmek için AAA’da majör rol oynayan, MEFV genini, PYRİN’in yapısını ve pyrinin diğer proteinlerle, sitokinlerle ilişkisini ve etkileşimini anlamak gerekir.
Ailesel Akdeniz Ateşi (AAA) hastalığından sorumlu olan gen MEFV genidir. Mediterranean Fever geni 16 kromozomun kısa kolu üzerinde tesbit edilmiştir. AAA hastalık geni Amerikalı ve İsrailli bir grup ile çoğu Fransız ve bir Türk
araştırmacıdan oluşan diğer bir grup tarafından eş zamanlı olarak bulunmuştur. Bu iki grup keşiflerini 1997’de Kudüs’de yapılan 1. Uluslararası AAA Hastalığı Konferansı’nda sunmuşlardır. Gene MEFV adı verilmiştir (MEditerranean FeVer) (12).
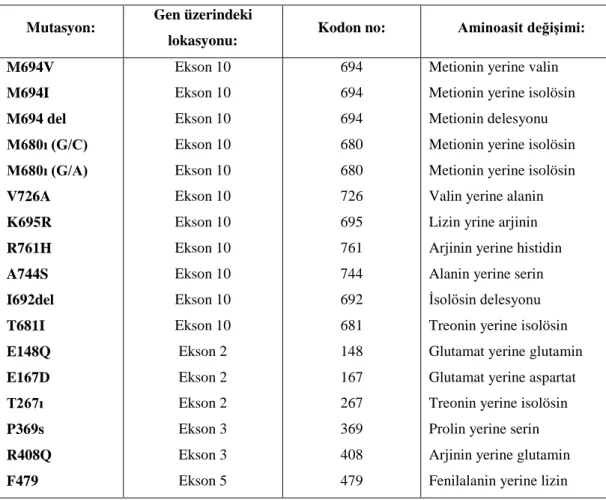
MEFV geni; dominant olarak AAA’daki inflamatuar eksudadaki majör hücre tipini oluşturan nötrofillerde, eozinofillerde ve monositlerde eksprese edilmekte, lenfositlerde ise bulunmamaktadır. MEFV ayrıca dendritik hücrelerde ve sinoviyal fibroblastlarda bulunmaktadır. Monositlerde ifade düzeyi değişken olup proinflamatuar ajanlar olan İnterferon Gama (IFNγ), Tümör Nekroz Faktör (TNF), Lipopolisakkaritler (LPS) ile MEFV’nin ekspresyonu artmaktadır. Sinoviyum, periton, ciltte bulunan fibroblastlarda da MEFV gen ekspresyonu görülmekte olup nötrofillere göre daha düşük seviyededir.Bu dokulardaki ekspresyonu IL1B ve Forbol Miristat Asetat (PMA) ile artmaktadır. Bu durum AAA’daki serozal, sinovyal ve cilt inflamasyonuna yatkınlığı açıklar. Araştırmacılar sadece MEFV genini saptamakta kalmayıp, başlıca mutasyonları da belgelemişlerdir. Bu gende yüzden fazla mutasyon saptanmış olup en sık olanlar da M694V, M694I, M680I ve 726A mutasyonlarıdır. Bütün mutasyonlar ve polimorfizmler INFEVERS isimli web sitesinde (http://fmf.igh.cnrs.fr/infevers/) yayınlanmaktadır. Mutasyonlar sonucunda çeşitli nedenlere uyarılmış olan inflamatuar yanıt durdurulamamakta ve ateş ile birlikte periton, plevra eklem cilt gibi bölgelerle sınırlı klinik tablo ortaya çıkmaktadır.
AAA hastalığında MEFV dışındaki genler lokus heterojenitesi sunarak AAA’e benzer klinik görünümden sorumlu olabilirler (53). Yapılmış olan deneysel ve klinik çalışmalardan anlaşıldığı üzere, ekson 10’da 680 ve 694 kodonlar arasındaki küçük bölgede ortaya çıkan mutasyonlar yüksek penetrans ve AAA oluşum ve prezentasyonu üzerinde ciddi etkiye sahip iken, V726A, P369S ve E148Q genotipleri düşük penetrans ve düşük amiloidoz riski ile ilişkilendirilmektedir (Şekil 3.3). (55). AAA’de MEFV geni mRNA ekspresyonu; mutasyonların sayısı ve tipine bağlı bulunmuştur. M694V mutasyonu, özellikle homozigot durumda, en düşük MEFV mRNA düzeyi ile E148Q mutasyonu ise en yüksek MEFV mRNA seviyesi ile ilişkili bulunmuştur.
Şekil 3.3. MEFV eksonları ve sık gözlenen mutasyonlar (Touitou, I. Internet Fevers;
(http://fmf.igh.cnrs.fr/ISSAID/infevers).
MEFV geninin, 781 aminoasitlik 5 alt parçası olan mikrotübüllerle birlikte olgun nötrofil ve monoitlerden salınan sitoplazmik bir proteini kodladığı belirlenmiştir (53). Amerika-İsrail grubu MEFV geni tarafından kodlanan bu proteine ateş anlamında “pyrin” ismini, Fransız ağırlıklı grup ise Akdenize Romalıların verdikleri “mare nostrum” (bizim denizimiz) isminden hareketle “marenostrin” adını vermişlerdir. Shohat ve arkadaşları tarafından 1999 yılında yapılan bir çalışmada, bu proteinin sistemik lupus ve Sjögren sendromunda görülen otoantijenik bir ribonükleoproteini de içeren iki antiinflamatuar protein ile analog olduğunun saptanıp, proteinin Ro-Ret nükleer faktörler protein ailesinin bir üyesi olduğu bildirilmiştir (12). Pyrin, 781 aminoasitten oluşan, 86 kDa’luk arjinin ve lizin aminoasitlerince zengin, pozitif yüklü bir proteindir bu protein apoptoz ve inflamasyonun regülasyonunda yer alan proteinlerin sınıfına aittir. Antiapoptotik, antienflamatuar, proinflamauar etkileri vardır, FMF’deki fonksiyonu henüz iyi anlaşılamamış olmasına rağmen inflamasyonu direkt veya indirekt baskılayıcı işlevi olduğu düşünülmektedir.
Pyrin proteini, beş fonksiyonel domain içermektedir (56).
1- PYD bölgesi; 195 aminoasitten oluşur. Amino (N) ucundadır .PAD, PyD
veya DAPIN olarak da isimlendirilir. (N terminal uçtadır ASC ile etkileşir)
2- BZıp transkripsiyon faktörü bölgesi;266-280 aminoasitten oluşur, DNA bağlama bölgesidir.
3 -“B Box Zinc Finger” domain (BB-ZF); 375-407 aminoasitten oluşur. (PSTPIP1 ile etkileşir)
4-Alfa helical bölge; 408-594 aa den oluşur
5-Karboksi (C)ucuB30.2domaini; PRY (598-649 aa) ve SPRY bölgesi (650-776) içerir, caspaz1 ile etkileşir.
Şekil 3.4. Pyrin domainleri (Chae JJ. Aksentijevich I, Kastner DL. Advences in the understanding of familial Mediterranean fever and possibilities for targeted therapy. Br J Haematology 2009; 146(5), 467-478).
Pyrin Tripartite Motif (TRIM) protein ailesine dahildir. TRIM familyası proteinlerinde bir RING alt birimi, B-kutusu (B-box) olarak adlandırılan bir veya iki çinko bağlayıcı alt birim ve bir yumaksı sarmal (coiled-coil) alt birim olmak üzere üç alt birime sahiptirler. Pyrin (TRIM 20) TRIM ailesinin RING alt birimi içermeyen atipik bir üyesidir. Bununla birlikte B-box Zing Finger, Alfa Helikal Bölge, Bzıp
Transkripsiyon Faktörü Bölgesi, Amino (N) ucunda PYD Domaini , ve B30.2 alt birimlerini içerir. B30.2 alt birimi pyrinin C terminalinde yaklaşık 200 aminoasitlik bir alt birimdir ve protein-protein etkileşimlerine aracılık eder. Pyrinin N-terminali, apoptoz ve inflamasyonda yer alan bir çok proteinle homoloji gösterir. N-terminalindeki yaklaşık 90 amino asitlik bölgesi PYRIN, PYD, PAAD veya DAPIN olarak adlandırılmaktadır (57). Bu PYD alt birimi ; Ölüm Domeini (DDs), Ölüm Efektör Domeini (DEDs) ve Kaspaz Toplanma Bölgesi (CARDs) içermektedir. DD, DED ve CARD bölgeleri apoptozis ve inflamasyonda görev alan, protein-protein
etkileşiminden sorumlu alt birimlerdir (58).Bu etkileşimlerin varlığı da Pyrinin bir transkripsiyon faktörü olarak proinflamatuar faktörleri kodlayan genlerin ekspresyonunu inhibe ederek yada antiinflamatuar proteinleri kodlayan genlerin ekspresyonunu aktive ederek işlev gösterdiği iddiasını desteklemektedir. Pyrinin B30.2 bölgesinde mutasyonların çoğunun lokalize olması, bu mutasyonların pyrin aktivitesinin kontrolünün aksamasıyla inflamasyona yol açabileceğini düşündürür (59).
Şekil 3.5. Pyrin ve mutasyon bölgeler (Masters SL, et al. Annu Rev Immunol 2009;27:621–68)
Pirin-Marenostrin proteini özellikle nötrofillerde yer almakta ve her dokuda bulunmamaktadır. Pyrin proteini, nükleer lokalizasyon sinyali de içermektedir. Bu sinyal dizisinin varlığı proteinin çekirdekte lokalize olduğunu ve bir transkripsiyon faktörü olarak fonksiyon gördüğü görüşünü düşündürmüştür. Ancak yapılan çalışmalar, pyrinin in transfekto modellerde ve monositlerde sitoplazmada, sinoviyal fibroblastlar ve nötrofillerde ise çekirdekte lokalize olduğunu göstermiştir (60). Bu bulgular, pyrinin bulunduğu hücreye göre farklı proteinlerle etkileşime girerek, farklı fonksiyonları üstlenebileceğini göstermektedir. Örneğin, monositlerin sitoplazmasında gösterilen pyrin tübülinlerle etkileşir ve mikrotübüllerde lokalize olur bu da hastalıkta en etkin tedavi seçeneği olan kolşisinin etki mekanizmasında açıklayıcı olabilir (61, 62).
Pirin-Marenostrin proteini nötrofil aktivasyonunu baskılayarak inflamasyonu inhibe etmektedir. MEFV geninde oluşacak mutasyonlar, pirinin görevini yapamamasına ve inflamasyonun kontrolünün bozulmasına neden olur (63, 64). Sonuçta hastalık bulguları ortaya çıkmakar. Sinovyal ve peritoneal hücrelerdeki
pyrin ekspresyonunun yetersizliği bu proteinin doku spesifik tarzda etkili olmadığını göstermektedir (65).
AAA’da inflamasyon ataklarının periyodik olarak gelişmesi; proteinin normal şartlarda görevini yerine getirebilirken stres durumunda yerine getiremediğini düşündürmektedir. Genelde her iki allelde mutasyon ile hastalığın ortaya çıktığı kabul edilir ancak yapılmış olan bazı çalışmalarda, sadece bir alleli etkileyen MEFV mutasyonlarının da AAA’ya neden olabileceğinin fark edilmesi, normal pyrin aktivitesinin %50’sinin hastalığı önlemeye yetemeyebileceğini düşündürmüştür (65). Pyrin proteininin AAA hastalığındaki fonksiyonu çalışmaları halen devam etmektedir. Pyrinin inflamasyonda direkt veya indirekt bir ‘’down regülatör’’ görevi üstlendiği ve bir transkripsiyon faktörü olarak proinflamatuar faktörleri kodlayan genlerin ekspresyonunu aktive ettiği düşünülmektedir. Pyrinin intrasellüler ortamda PYD domaini içeren komşu proteinlerle özellikle de ASC proteini ile (Apoptosis-Associated Speck-Like Protein-PYCARD) ilişkili fonksiyonunun anlaşılmasıyla sadece AAA patogenezi değil aynı zamanda genel inflamasyon oluşum mekanizmasına açıklık getirecektir (Şekil 3.6).
Şekil 3.6. Pyrin proteininin etki ettiği hastalık patogenezi temel moleküler yolağı. (Church LD et al,
3.3.5.1. Pyrin İle İlişkili Proteinler
Proteinin hücre düzeyindeki fonksiyonuna ışık tutmak amacıyla yapılan maya-2-hibrid sistemi çalışmalarında, pyrin proteini ile ilişkili bazı proteinler saptanmıştır. Bunlardan birincisi ASC (Apoptosis-Associated Speck Like Protein with a CARD) (67), ikincisi PSTPIP1 [Proline Serine Threonine Phosphatase İnteracting Protein 1/CD2BP1 (CD2 Binding Protein 1)] (68), üçüncüsü ise Siva proteinidir.
1.Pyrinle İlişkili Proteinler: ASC (Apoptosis-Associated Speck Like Protein with a CARD)
ASC; ilk olarak apopitotik hücrelerde “speck” şeklinde ifade edilen agregatların oluşumuna sebep olan protein olarak tanımlanmıştır. “Speck” oluşturan hücrelerin %100’ü apoptotik programı tamamlamaktadır (67).ASC geni, 16p12-p11.2 kromozom bölgesinde haritalanmıştır. Bu gen için farklı izoformları kodlayan 2 transkript varyantı bulunmuştur (69). ASC geni, iki protein-protein etkileşim bölgesinden oluşan bir adaptör proteini kodlar. ASC proteini yapısal olarak 195 aminoasitten oluşan, amino ucunda “ Pyrin Domain[PyD]”, karboksi ucunda “Caspase Recruitment Domain (CARD)”i içerir. Normal hücrelerde bu protein sitoplazmaya lokalizedir; ancak apoptoza giden hücrelerde, çekirdeğe yakın bölgelerde kendi üzerine asosiasyonu ile oluşturduğu “speck’’ olarak ifade edilen büyük sitozolik agregatlar halindedir (70). Centola ve arkadaşlarının yapmış olduğu bir çalışmada ASC’nin, PyD domaini sayesinde, diğer PyD içeren proteinlerle (örneğin; Cryopyrin, PYPAF7, DEFCAP proteinleri gibi) protein-protein etkileşimine katıldığı gösterilmiştir (71). (Şekil 3.7) ASC’nin, diğer domaini CARD domaini ise fonksiyonel aktivitesinde önemli olduğu bilinen, IL-1β’nın işlenmesi ve
salgılanması ile ilişkili prokaspaz-1’in oluşturulması ve aktivasyonunda rol alan domainidir (71). (Şekil 3.8)
Şekil 3.7. Genel İnflamazom Kompleksi
.
ASC 3 önemli işlevde rol alır: 1. Apopitoz,
2. IL-1’nın işlenmesi ve salgılanması ile ilişkili prokaspaz-1’in oluşturulması ve aktivasyonu,
3. İnflamatuvar cevabın başlaması ve yayılmasında görevli bir transkripsiyon faktörü olan NF-kB aktivasyonunda rol oynamaktadır (67)
ASC’nin ‘’inflamazom’’ denilen makromoleküler komplekslerde toplandığı gösterilmiştir. İnflamazom kompleksinde yer alan proteinler temel olarak NLR (Mammalian Nucleotide-Binding Oligomerization Domain; NOD-Like Receptor, NLR) protein ailesine aittirler. (Şekil 3.9)
Şekil 3.9. NLR protein ailesi domain yapısı (Sutterwala et al., 2007).
Pirin parçası ASC proteinin pyD bölümüne bağlanır. Böylece apopitozis tetiklenir ve NFkappa B aktive olur. Apopitozis proteinlerinden Caspas 1 ve 5 aktive olur. ASC ve prokaspaz 1 oligomerizasyonu gerçekleştirilir (72). Caspas 1’in aktive olması inflamasyonun en önemli sitokinlerinden olan IL–1β’nın aktivasyonunu ve böylece apopitozis yolunun aktif hale gelmesini sağlar. İnflamazom çalışmalarında hücresiz sistemde endojen seviyede ASC’nin uzaklaştırılması sonucunda kaspaz-1 ve
kaspaz-5 aktivasyonunun durması ile apoptoz engellenmiştir (73). Bu aktivasyon mekanizmasını daha açık şekilde ifade edecek olursak ASC, prokaspaz-1’e (IL-1β converting enzim) bağlanarak onun agregasyonunu ve otoaktivasyonunu sağlamaktadır. Aktif kaspaz-1, pro-IL-1β’yı IL-1β’ya çevirmekte ve salgılanan IL-1, kendi reseptörüne bağlanarak inflamasyonu başlatmaktadır. (Şekil 3.10)
Şekil 3.10. Pyrin Asc Etkileşimi (Chae JJ et al, 2004)
Pyrin proteininin fonksiyonel olduğu zaman, ASC’ye bağlanarak, ASC prokaspaz-1 ilişkisini engellediği ve bu sayede IL-1 işlenmesini baskıladığı düşünülmektedir. Fonksiyonel pyrin proteininin eksprese edilmediği, pyrin geni ortadan kaldırılmış farelerle yapılan çalışmalarda, LPS ve IL-4 ile pyrin ekspresyonu indüklenmiş ve bunun sonucunda farelerin peritoneal makrofajlarında artan IL-1β işlenmesi ve defektif apopitoz görülmüştür. Pyrin mutantlarda artmış kaspaz 1 aktivitesi, apoptoza artmış sensitivite ile ilişkilendirilmiştir. Pyrin mutant farelerde makrofaj apoptozunda gözlenen defektin sebebi, IL-1B ve kaspaz 1’den bağımsız ve muhtemelen ASC veya ASC’nin NF-kappa B aktivasyonundaki modüle edici rolünden kaynaklanmaktadır. Bu araştırmanın sonuçlarına göre pyrin proteininin ASC ile indüklenen IL-1β işlenmesini engelleyerek ve makrofaj apoptozuna izin vererek antiinflamatuar bir molekül olarak görev yaptığı düşünülmüştür (57, 74). Mutant bir pyrin muhtemelen, IL-1 üretimi ve lökosit apoptozunun inhibisyonu ile
kontrolsüz inflamasyona neden olmaktadır. Ancak bu hipotezi desteklemeyen bildiriler de bulunmaktadır. Gumicio vd (67), normal ve mutant pyrinin ASC proteini ile interaksiyonu ve hücre ölümü üzerine etkileri arasında fark olmadığını bildirmiştir.
3.3.5.2. İnflamazom ve IL1 B Rolü
IL-1a ve IL-1b, IL-1R üzerinden etki gösteren steril inflamasyonun başlıca sitokinleridir (75) IL-1b, esas olarak makrofajlarca sentezlenerek nötrofil ve monosit birikiminde gerekli endotel hücre yüzey adezyon moleküllerinin ekspresyonunu ve başka proinflamatuvar aracıların üretimini artırır. (Şekil 3.11)
Şekil 3.11. IL1B Görevleri
IL-1b’nın ateroskleroz, gut ve tip 2 diyabet gibi çeşitli proinflamatuvar has-talıklarla da ilişkili olduğu bildirilmiştir. Gut hastalığında artmış IL-1b üretimi eklem inflamasyonu ve hasarına yol açar (76).Tip 2 diyabet hastalrının pankreas adacık hücrelerinde de artmış IL-1b üretimi gösterilmiştir (77). İnflamatuvar hücreler tarafından
IL-1b üretimi, inflamazom adı verilen ve temel görevi kaspaz-1’in aktivasyonu olan bir multiprotein kompleksi tarafından düzenlenir. İnflamazom kompleksi, sıklıkla NLR ailesinin üyelerinden bir PRR (Patern Tanıma Reseptörü), bir adaptör protein olan ASC [Apoptosis-Related Speck Like Protein Containing a CARD (Caspase Activation and Recruitment Domain)] ve kaspaz-1’in aktif formundan
meydana gelir (46, 91) İnflamazom kompleksinde yer alan proteinler temel olarak NLR (Mammalian Nucleotide-Binding Oligomerization Domain; NOD-like Receptor, NLR) protein ailesine aittirler .Ligandı ile bağlanan NLR oligomerize olur ve protein-bölge etkileşimleriyle ASC adaptör proteinine bağlanır. ASC ise CARD bölgesiyle pro-1’i biyolojik olarak aktif 1’e dönüştürür. Aktif kaspaz-1 ise IL-kaspaz-1b, IL-kaspaz-18 ve IL-33 sitokinlerinin öncül formlarını proteolitik olarak keser ve matür formlarına dönüştürür. IL-1b ve IL-33 steril inflamasyonla ilişkilendirilmişse de IL-18’in steril inflamasyondaki rolü tam olarak açıklanamamıştır. IL’den daha çok IL1 B AAA hastalığı ile ilişkilidir.
Şekil 3.12. NLRP3 ve IL1-b etkileşimi
İnflamazom kompleksleri, bulundurdukları PRR (Patern Tanıma Reseptörü) yapısına göre adlandırılır ve işlev görürler. Dört farklı sınıf altında 20’den fazla NLR gösterilmiş olsa da halen tanımlanmış dört farklı inflamazom kompleksi bulunmaktadır (78)
• NLRP1 (NOD-, LRR- ve Pyrin Domain-Containing 1) inflamazom • NLRP3 (NOD-, LRR- ve Pyrin Domain-Containing 3) inflamazom • NLRC4 (NOD-, LRR- ve CARD Domain-Containing 4) inflamazom • AIM2 (Absent in melanoma 2) inflamazom.
Şekil 3.13. Nlr İnflamasomları
İnflamazom komplekslerinden yalnızca AIM2 ve NLRP3 inflamazomunun mikrobiyal olmayan molekülleri tanıyabildikleri gösterilmiştir. AIM2 inflamazomun mikrobiyal kökenli olmayan çift zincirli DNA (dsDNA)’yı tanıyarak kaspaz-1 aktivasyonu ve IL-1b sekresyonunu sağladığı bildirilmiştir (79). AIM2 inflamazomunda steril inflamasyonda, özellikle de hastaların periferik dolaşım-larında yüksek düzeylerde dsDNA tespit edilmiş SLE gibi otoimmün hastalıklarda rolü olduğu düşünülmüştür (80).
IL-1b üretiminin steril inflamasyonla ilişkisi hakkında bilgilerimizin çoğu NLRP3 inflamazomuyla yapılan çalışmalardan elde edilmiştir. İlk olarak çeşitli otoinflamatuvar hastalıklardaki kronik inflamasyonla ilişkisi gösterilmiş NLRP3’ün steril inflamatuvar hastalıklarda da önemli olduğu bildirilmiştir (81). NLRP3 aracılı IL-1b üretimi iki farklı sinyale ihtiyaç duyar. İnfeksiyon varlığında bu NF-kB aracılı transkripsiyonel artışla olur bu da, lipopolisakarit (LPS) gibi TLR veya NOD2 ago-nistleriyle sağlanır. steril inflamatuvar koşullarda ise TNF ve IL-1’in veya TLR’lere bağlanabilen LDL’nin bu ilk sinyali sağlayabildiği gösterilmiştir (82). NLRP3 inflamazomun aktivasyonu, ve sonrasında kaspaz-1 aktivasyonu ve pro-IL-1b kesimi için gerekli ikinci sinyal ise NLRP3’ü özgül olarak aktive edebilen uyaranlar tarafın-dan sağlanır. NLRP ve AİM2 inflamazomlarında ASC; N terminal PYRİN ve C terminal CARD bölgesi aracılığı ile stres duyarlı komponent (NLR) ile prokaspaz arasında adaptör molekül görevi yapar. NLRP-3 inflamazomunda ASC, N terminal PYRİN-PYRİN etkileşimi ile NALP-3 e C terminal CARD-CARD etkileşimi ile prokaspaza bağlanır (şekil3.12) (83).Kompleks içinde ikinci prokaspaz 1 molekülüne Cardinal eklenir ve proteolitik aktivasyon sonucu aktif katalitik domainler olan p20 ve p10 salınır. Aktif kaspaz -1, pro IL1 parçalayarak IL-1 oluşumuna neden
olur.ASC;PYRİN Domaini aracılığı ile pyrin etkileşimi düşünüldüğünde, NLRP2/3 veya AIM2 İnflamazomunda ya modülatör ya da kendisi bizzat inflamazomun bileşeni olarak rol almaktadır. WT (Wild type) pyrinin B30.2 bölgesi, aktif kaspaz-1 alt birimleri olan p20 ve p10 ile etkileşime girerek, aktifp20/p10 heterodimer oluşumunu önler .AAA ile ilşkili mutant pyrinin B30.2 bölgesinin p20 ve p10 İle etkileşimi WT pyrinden daha azdır ve böylece p20 ve p10 heterodimeri oluşarak pyrini Bzıp ile B-box finger domain ortasındaki Asp 330 bölgesinden ikiye parçalar. Oluşan N terminal pyrin parçası, KB aktivitesini 2 yolla arttırır; ya p65 NF-KB’nin nükleusa girişini artırarak ya da IkB-a nın yıkılımını artırarak artan NF-KB aktivitesi de inflamuar sitokin salımını artırır.
Şekil 3.14. Pyrin Proteininin İnflamasyondaki Rolü (83)
AAA patogenezinde temel rolü oynayan MEFV gen ürünü olan Pyrin, anlatılan mekanizmalar sayesinde önemli bir inflamauar sitokin olan interlökin (IL)-1B aktivasyonunu düzenler ve nükleer faktör kB (NFkB) aktivasyonunu ve apoptozu inhibe eder. Proinflamatuar sitokin IL.1B, AAA hastalığının patogenezinde merkezi konum alır. IL-1 AAA ya yönelik son yıllardaki çalışmalarda ve dirençli hastaların tedavi modelitelerinin araştırılmasında da önemli bir yer tutmaktadır. Daha önce de belirtildiği gibi bu sitokin inaktif bir prekursor tarafından eksprese edilir, kaspaz-1 tarafından bölünerek aktif IL-1B ya dönüşür. Kaspaz-1’in kendisi önce inflammasom kompleksi ile etkileşime girerek aktive edilmeye gereksinim duyar. Kaspaz-1 ve
IL-1b’in aktivasyonuna katılan esas inflammasome kompleksleri cryopyrin veya NALP3 inflammasomlarıdır (84, 85).
Pyrinin IL.1B aktivasyonunda 2 hipotez önerilmiştir (şekil:3.13)
1.Sekestrasyon hipotezine göre AAA mutasyonları pyrinin inhibisyon reaksiyonları ile etkileşmektedir ve IL.1B aktivasyonunun regulasyonunun düzenlenmesinde azalma ile sonuçlanmaktadır (59).
2.Hipotez Yu ve arkadaşları (72) tarafından önerilmiş olup
pyrinnin IL.1B aktivasyonu için kendi spesifik inflammasomunu oluşturduğu şeklindedir.
Şekil 3.15. Sekestrasyon ve inflamasom hipotezi
AAA mutasyonları varsayılan pyrin inflammasomlarının sensitivelerini artıracaktır. Pyrin’in IL.1B’nın regulasyonundaki rolü dışında NFkB veya apoptozis üzerinde de inhibisyondan stimulasyona kadar değişen etkisi olduğuna dair çelişkili bulgular vardır (84) İnsan monositde yapılan deneysel çalışmalarda pirin fonksiyonunun baskılanması sonucu bazılarında IL-1B sekresyonu artmış (59, 74) bazılarında ise baskılanmıştır (86, 87). Pirinin antiinflamatuar bir protein mi