T.C.
KASTAMONU ÜNİVERSİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
FİBROİN ESASLI DOKU İSKELELERİNİN ÜRETİMİNDE
KULLANILAN FİZİKSEL ŞARTLARIN OLUŞAN YAPI
ÜZERİNE ETKİSİNİN BELİRLENMESİ
Gülbahar KIDIMAN
Danışman Dr. Öğr. Üyesi Nuray EMİN Jüri Üyesi Prof. Dr. Meltem ÇELİK
Jüri Üyesi Dr. Öğr. Üyesi Senem YETGİN
YÜKSEK LİSANS TEZİ
MALZEME BİLİMİ ve MÜHENDİSLİĞİ ANA BİLİM DALI KASTAMONU – 2019
ÖZET Yüksek Lisans Tezi
FİBROİN ESASLI DOKU İSKELELERİNİN ÜRETİMİNDE KULLANILAN FİZİKSEL ŞARTLARIN OLUŞAN YAPI ÜZERİNE ETKİSİNİN
BELİRLENMESİ Gülbahar KIDIMAN Kastamonu Üniversitesi
Fen Bilimleri Enstitüsü
Malzeme Bilimi ve Mühendisliği Ana Bilim Dalı Danışman: Dr. Öğr. Üyesi Nuray EMİN
İpek fibroini, doğal yapılı bir biyopolimer olup, biyouyumluluk, biyobozunurluk, biyoinertlik gibi özelliklerinin yanı sıra doğal yara iyileştirici etkiye sahip olması nedeniyle, doku mühendisliği çalışmalarında biyomalzeme olarak sıklıkla tercih edilmektedir. Fibroin yapısında bulunan antiparalel zincirlerden dolayı amfoterik özellik göstermektedir. Fibroinin farklı sıcaklık ve basınç seviyelerine farklı sürelerde maruz bırakılması da yapısında bulunan protein komplekslerini farklı şekillerde etkilemektedir. Bu değişimler fibroinle elde edilen doku iskelelerinin derişimlerini, gözeneklilik yapısını, mekanik mukavemetlerini, fiziksel ve kimyasal özelliklerini etkilemektedir. Yürütülen tez çalışmasında ipek fibroinin amfoterik yapısı dikkate alınarak farklı pH değerlerinde hazırlanan akuajenik çözeltileri kullanılarak farklı basınç ve sıcaklık şartlarında doku iskeleleri üretilerek bunların, elde edilen yapıların fiziksel ve kimyasal özellikleri ile biyouyumluluğuna olan etkileri çeşitli analizler ile incelenmiştir. Biyouyumluluk analizleri kemik iliği mezenkial kök hücreleri kullanılarak MTT reaktifi kullanılarak kalitatif ve kantitatif olarak gerçekleştirilmiştir. Sonuç olarak farklı yöntemlerle üretilen iskelelerin biyouyumlu özellikte olduğu, bazı iskelelerin doku rejenerasyonuna destek olabilecek şekilde biyobozunma süresine sahip olduğu belirlenmiştir. SEM ve ışık mikroskobisi ile iskelelerin üretim yöntemlerine bağlı olarak farklı morfolojilere sahip olduğu, civalı porozimetre ölçümleri ile de toplam yüzey alanı ve gözenekliliklerinde önemli farklılıklar olduğu bulunmuştur. FTIR spektroskopisi incelemesi ile de orijinal fibroin yapısı spektrumlarından farklı olarak yapılan pH değişimleri, sıcaklık ve basınç etkileri sonucunda spesifik pikler gözlemlenmiştir. Termogravimetrik özelliklerinin üretim ve pH değişimlerine göre önemli derecede değişmediği tespit edilen iskelelerin, farklı fizikokimyasal şartlar altında üretiminden kaynaklı olarak kendi amfoterik yapısı sebebiyle çapraz bağlayıcılara ihtiyaç duyulmadan molekül içi çapraz bağlanmaların gerçekleştiği belirlenmiştir. Bu sonuç hazırlanan iskeleleri doku mühendisliğinde daha yüksek biyouyumluluk ile yeni dokuların oluştrulmasında daha yüksek rejeneratif kapasitede işlev görebilecektir. Anahtar Kelimeler: Doku iskelesi; pH Değişimi; sıcaklık etkisi; fibroin; amfoterik 2019, 124 sayfa
ABSTRACT
MSc. Thesis
DETERMINATION OF THE EFFECT OF PHYSICAL CONDITIONS USED IN THE PRODUCTION OF FIBROIN BASED TISSUE SCAFFOLDS ON THE
FORMED STRUCTURE Gülbahar KIDIMAN Kastamonu University Institute of Science and Technology
Department of Material Science and Engineering
Supervisor: Assist. Prof. Dr. Nuray EMİN
Silk fibroin is a natural structure biopolymer and is preferred as a biomaterial in tissue engineering studies since it has a natural wound healing effect besides biocompatibility, biodegradability, bioinertivity. Fibroin structure shows an amphoteric due to antiparallel chains. Exposure of fibroin to different temperature and pressure levels at different times influences the protein complexes in the structure in different ways. These changes affect the concentration, porosity, mechanical strength, physical and chemical properties of tissue scaffolds obtained by fibroin. In the thesis study, by taking into consideration the amphoteric structure of silk fibroin, the different scales of pressure and temperature were used in different pH values. The scaffolds were produced and their effects on the physical and chemical properties and biocompatibility of the obtained structures were investigated with various analyzes. Biocompatibility analyzes were performed qualitatively and quantitatively by using MTT reagent by using bone marrow mezenkial stem cells. As a result, it was determined that the scaffolds produced by different methods have biocompatible properties and some scaffolds have biodegradation time to support tissue regeneration. It has been found that there are different morphologies depending on the production methods of scaffolds by SEM and light microscopy, and there are significant differences in total surface area and porosity with mercury porosimeter measurements. FTIR spectroscopy examination showed that no specific peaks were observed as a result of pH changes, temperature and pressure effects. Due to its amphoteric structure due to the production of thermogravimetric properties of scaffolds, which are determined to be not changed significantly according to production and pH changes, it has been determined that intra-molecule cross-linking occurs without the need of crosslinkers due to their ampHoteric structure. This result will serve to a higher regenerative capacity in the formation of new tissues with higher biocompatibility in tissue engineering of prepared scaffolds.
Key Words: Tissue Scaffold; pH Change; temperature effect; fibroin; amphoteric 2019, 124 pages
TEŞEKKÜR
Yüksek lisans tezimin hazırlığında ve yürütülmesinde bilgileri ve deneyimi ile bana yol gösteren, laboratuvar ortamında yapılması gereken her deney ve aşamada gerekli imkânları sunarak yardımlarını esirgemeyen Danışman Hocam Dr. Öğr. Üyesi Nuray EMİN’e,
Laboratuvar çalışmaları sırasında desteğini esirgemeyen arkadaşım Salma Taher MOHAMMED’e, Buğrahan Ragaip KILINÇ’a, Canan ZORLU, Kıymet NURAL ile her zaman yanımda olan ve desteklerini esirgemeyen kıymetli dostlarıma,
Doku Mühendisliği ve Biyomalzeme Laboratuvarı imkânlarını kullanmamda desteklerini esirgemeyen Kastamonu Üniversitesi Merkezi Araştırma Laboratuvarı Araştırma ve Uygulama Merkezi Müdürlüğü’ne ve burada görevli değerli Hoca’larıma,
Bugünlere gelmemi sağlayan, her şartta maddi ve manevi destekleri ile bana güç veren sevgili Aileme,
Teşekkürlerimi Sunarım.
Gülbahar KIDIMAN Kastamonu, Ocak, 2019
İÇİNDEKİLER Sayfa TAAHHÜTNAME ... iii ÖZET... iv ABSTRACT ... v TEŞEKKÜR ... vi SİMGELER ve KISALTMALAR DİZİNİ ... x ŞEKİLLER DİZİNİ ... xi TABLOLAR DİZİNİ ... xiv 1. GİRİŞ ... 1
1.1. Fibroinin Yapısı ve Kimyasal Özellikleri ... 2
1.1.2. Fibroinin Bombyx Mori İpek Böceğinden Elde Ediliş Yöntemleri ... 13
1.1.3. Fibroinin Doku Mühendisliğinde Kullanım Alanları ... 14
2. FİBROİNİN pH DEĞİŞİMLERİNE TEPKİSİ ... 17
2.1. Fibroinin Protein Yapısında Meydana Gelen Oluşumlar ve Fibroinin Amfoterik Özelliğinin Etkinliği ... 17
3. FİBROİNİN SICAKLIK DEĞİŞİMLERİNE TEPKİSİ ... 22
3.1. Fibroinin Protein Yapısında Meydana Gelen Farklılıklar ve Doku İskelesi Üretimi Üzerindeki Etkileri ... 22
3.2. Buharlı Otoklav Yöntemi ... 25
3.3. Kuru Hava Etüvlerinde Isıl Sterilizasyon ... 25
4. FİBROİNİN BASINÇ DEĞİŞİMLERİNE TEPKİSİ ... 31
4.1. Fibroinin Yapısında Meydana Gelen Farklılaşmalar ve Doku İskelesi Üretimi Üzerindeki Etkileri ... 31
5. MATERYAL ve METOD ... 33
5.1. Kimyasal ve Reaktifler ... 33
5.2. Deney Planı ... 34
5.3. Bombyx Mori İpek Böceği Kozasından Fibroin Eldesi ... 34
5.3.1. Bombyx Mori İpek Böceği Kozasından Serisinin Uzaklaştırılması ... 34
5.3.2. Fibroin Liflerinden Saf Fibroin Çözeltisinin Hazırlanması ... 35
5.3.2.1. Ajisawa metodu ile fibroin çözeltisinin eldesi ... 36
5.3.2.2. Diyaliz işlemi ... 38
5.4. Fibroin Çözeltilerinin Farklı pH’larda Ayarlanması ... 38
5.5. Fibroin İskelelerinin Üretim Yöntemleri ... 39
5.5.1. Liyofilizasyon ile 3B İskele Üretimi ... 40
5.5.2. Vakumlu Etüvde 3B İskele Üretimi ... 40
5.5.3. Fibroin İskelelerin Yapısına Sıcaklığın Etkisi ... 42
5.5.3.1. Buharlı otoklav kullanımı ... 42
5.5.3.1.2. Fibroin çözeltilerinin otoklavlanması sonrası liyofilizasyon ... 44
5.5.4. Etüv-Sterilizatör İşlemleri ... 45
5.6. Biyouyumuluk Analizi ... 45
5.7. Biyobozunurluk Testi ... 46
6. ARAŞTIRMA BULGULARI ... 48
6.1. Işık Mikroskobisi İle Görüntüleme ... 48
6.2. Biyouyumluluk Testi: MTT (Mitokondriyal Dehidrojenaz Aktiviteleri) Analizi... 53
6.3. Biyobozunurluk Süresi Tesbiti ... 56
6.4. Fourıer Dönüşümlü Infrared Spektrofotometre (FTIR) Analizi ... 60
6.4.1. A Serisi Fibroin İskelelerin FTIR Grafikleri ... 60
6.4.2. B Serisi Fibroin İskelelerin FTIR Grafikleri ... 64
6.4.3. C Serisi Fibroin İskelelerin FTIR Grafikleri ... 67
6.4.4. F Serisi Fibroin İskelelerin FTIR Grafikleri ... 71
6.4.5. G Serisi Fibroin İskelelerin FTIR Grafikleri ... 74
6.5. Termogravimetrik Analiz (TGA) ... 79
6.6. Taramalı Elektron Mikroskop (SEM) Analizi ... 82
6.7. Civalı Porözimetre ile Yüzey Analizi ... 93
7. TARTIŞMA VE SONUÇ ... 97
7.1. Kullanılan Fizkokimyasal Şartların Fibroin İskelelerin Kimyasal Yapısı Üzerine Etkisi ... 98
7.1.1. Düşük Basınç ve Düşük Sıcaklık Şartlarının Fibroin İskelenin Yapısına Etkisi ... 98
7.1.2. Fizyolojik Sıcaklık ve Vakum Şartlarının Fibroin İskelenin Yapısına Etkisi ... 99
7.1.3. Düşük Basınç ve Sıcaklıkta Hazırlanan Fibroin İskelenin Kuru Halde Otoklav (121°C-Yüksek Buhar Basıncı) Muamelesinin Yapı Üzerine Etkisi ... 100
7.1.4. Düşük Basınç ve Sıcaklıkta Hazırlanan Fibroin İskelenin Kuru Halde Etüv Sterilizatör (180°C) Muamelesinin Yapı Üzerine Etkisi ... 101
7.1.5. Fibroin Çözeltisinin Otoklav (121°C-Yüksek Buhar Basıncı) Muamelesi Sonrası Standart Liyoflizasyon (-55°C-Vakum) ile Hazırlanan Fibroin İskelelerin Yapısal Özellikleri ... 102
7.2. pH Değişimlerinin Fibroin İskelelerin Kimyasal Yapısı Üzerine Etkisi... 103
7.2.1. pH 5 Değerine Sahip İskelelerin Fonksiyonel Analizleri ... 103
7.2.2. pH 6 Değerine Sahip İskelelerin Fonksiyonel Analizleri ... 104
7.2.3. pH 7 Değerine Sahip İskelelerin Fonksiyonel Analizleri ... 104
7.2.4. pH 8 Değerine Sahip İskelelerin Fonksiyonel Analizleri ... 105
7.3. Üretim Yöntemlerinin Fibroin İskelelerin Morfolojik Yapısı Üzerine Etkisi ... 105
7.4. pH Değişimlerinin Fibroin İskelelerin Morfolojik Yapısı Üzerine Etkisi ... 106
7.4.1. pH 5 Değerine Sahip İskelelerin Morfolojik Analizleri ... 106
7.4.2. pH 6 Değerine Sahip İskelelerin Morfolojik Analizleri ... 107
7.4.3. pH 7 Değerine Sahip İskelelerin Morfolojik Analizleri ... 107
7.4.4. pH 8 Değerine Sahip İskelelerin Morfolojik Analizleri ... 108
7.5. Genel Değerlendirme ... 109
7.6. Sonuç ... 115
KAYNAKLAR ... 117 ÖZGEÇMİŞ ... Hata! Yer işareti tanımlanmamış.
SİMGELER ve KISALTMALAR DİZİNİ
IF İpek Fibroin
KCl Potasyum Klorür HCl Hidroklorik Asit NaCl Sodyum Klorür
SEM Taramalı Elektron Mikroskobu FTIR Fourier Dönüşümlü Infrared spk.
MTT Mitokondriyal Dehidrojenaz Aktiviteleri TGA Termogravimetrik Analiz
NaOH Sodyum Hidroksit
°C Santigrat Derece LiBr Lityum Bromür CaCl2 Kalsiyum Klorür
Ca(CNS)2 Kalsiyum Siyanat
ZnCl2 Çinko Klorür
NH4CNS Amonyum Tiyosiyanat
CuSO4 Bakır(II) Sülfat
NH4OH Amonyum Hidroksit
Ca(NO3)2 Kalsiyum Nitrat
Ca2+ Kalsiyum İyonu Sr2+ Stronsiyum İyonu Ba2+ Baryum İyonu Li+ Lityum İyonu Zn+ Çinko İyonu DMAA Dimetilasetamid DMF Dimetilformamid Cl Klor Br Brom MA Moleküler Kütle LH Hidrodinamik Uzunluk R Dönme Yarıçapı V Hacim Å Ångström kH Huggins sabiti Tg Camsı geçiş sıcaklığı K Kelvin
pH Power of Hydrogen pI İzoelektrik Sabiti kDa kilodalton
ŞEKİLLER DİZİNİ
Sayfa Şekil 1.1. Fibroinin yapısında bulunan beta-tabakalı antiparalel
yapılı polipeptit zincirleri ... 6 Şekil 1.2. Fibroinin amino asit dizileriyle beraber genel kimyasal
yapısı ... 7 Şekil 1.3. Fibroinin yapısında bulunan amino asit türlerinin temel
kimyasal yapıları ... 9 Şekil 1.4. a. Fibroinin makromoleküler protein yapısında bulunan
alfa-helix yapıların gösterimi b. Fibroinin makromoleküler
protein yapısında bulunan beta-katman(beta-sheet) yapıları ... 10 Şekil 1.5. Fibroinden 3 farklı yöntem ile doku iskelesi hazırlanması ... 16 Şekil 2.1. Fibroin membranın su ile etkileşimi sonucu meydana gelen
pH değerleri grafiği ... 19 Şekil 2.2. Fibroin membranın 0,01 M KCl ve HCl ile titrasyonu neticesinde
meydana gelen pH değişim grafiği... 19 Şekil 2.3. Fibroin membranın pH potansiyel grafiği... 20 Şekil 3.1. Sterilizasyon işlemleri sonucunda elde edilen iskelelerin
yapısal görüntüleri ... 26 Şekil 5.1. Ajisawa çözeltisi kullanılarak fibroin çözeltisinin elde edilmesi ... 37 Şekil 5.2. 1:8:2 mol (A) ve B. 1:8:1 mol (B) Ajisawa çözeltisiyle
hazırlanan fibroin çözeltilerinin karşılaştırılması ... 37 Şekil 5.4. A. Liyofilizasyon cihazı B. Liyofilizasyon işlemi için liyofilizatör
cihazına yüklenen numuneler C. Liyofilizasyon işlemi sonrası
elde edilen fibroin iskeleler. ... 40 Şekil 5.5. A.ve C. Vakumlu etüve yüklenmek üzere hazırlanan numuneler
B. Vakumlu Etüv içerisine kurutma işlemenin gerçekleştilmesi. ... 41 Şekil 5.6. Vakumlu etüvde kurutulan pH5 (A), pH6 (B), pH7 (C), ve
pH8 (D) porojen arındırma işlemiyle hazırlanmış, distile su içerisinde NaCl’den arındırılmış ve çeker ocakta kurutulmuş
fibroin iskeleler ... 41 Şekil 5.7. A. Buharlı otoklav B. Liyofilizasyon sonrasında elde edilen
fibroin iskelelerin kuru halde otoklav işlemi için hazırlanmış
numuneler ... 43 Şekil 5.8. A. Sıvı fibroinin otoklavlama işlemine hazırlanması
B. Otoklavlama işlemi sonrası sıvı fibroinler ... 44 Şekil 5.9. A. Otoklavlanan sıvı fibroinin liyofilizasyon işlemine
hazırlanması B. Otoklavlanan sıvı fibroinden liyofilizasyon
Şekil 5.10. Solda(A) Gruplara ait 5, 6, 7 ve 8 pH’larda numunelerden kesitler, Sağda(B), hazırlanan numuneler üzerine Hank’s
dengeli tuz çözeltisi eklenmiş görüntüsü. ... 47 Şekil 6.1. A Serisi için yapılan işlemleri sonunda elde edilen iskelelerin
ışık mikroskobisi görüntüleri. A. pH 5, B. pH 6, C. pH 7,
D. pH 8. ... 49 Şekil 6.2. B grubu işlemleri sonunda elde edilen iskelelerin ışık
mikroskobisi görüntüleri. A. pH 5, B. pH 6, C. pH 7, D. pH 8... 50 Şekil 6.3. C grubu işlemleri sonunda elde edilen iskelelerin ışık
mikroskobisi görüntüleri. A. pH 5, B. pH 6, C. pH 7, D. pH 8... 51 Şekil 6.4. F grubu işlemleri sonunda elde edilen iskelelerin ışık
mikroskobisi görüntüleri. A. pH 5, B. pH 6, C. pH 7, D. pH 8... 52 Şekil 6.5. G grubu işlemleri sonunda elde edilen iskelelerin ışık mikroskobisi
görüntüleri. A. pH 5, B. pH 6, C. pH 7, D. pH 8. ... 53 Şekil 6.6. 14.gün MTT testi, A. MTT ilave edilen hücre iskelelerinin 4 saatlik
inkübasyon sonrası görüntüsü, B. Kuyucuklardan çözeltinin uzaklaştırılması ve iskeleler üzerindeki renk değişiminin (formazan kristallerinin) gözlenmesi, C. Kuyucuklardan uzaklaştırılan çözeltilerin görüntüsü, D. İskelelerde oluşan formazan kristallerinin MTT solventi ile çözülmesi ve
çözeltinin farklı kuyucuklara aktarılmış halinin görüntüsü... 54 Şekil 6.7. 14.gün MTT testi sonrasında iskeleler üzerinde oluşan formazan
kristallerinin görüntülenmesi... 55 Şekil 6.8. Fibron iskelelerde oluşan formazan kristallerinin
UV-spektrofotometresinde absorbans değerlerinin numune türü ve
günlere göre dağılımı ... 56 Şekil 6.9. Biyobozunurluk süresinin deney serileri bazında günlere göre yüzde
bozunmalarının grafikler ile gösterimi. ... 58 Şekil 6.10. Aynı pH değerine sahip fibroin iskelelerin hazırlanma
yöntemlerinin bozunma sürelerine bağlılığının, bozunma yüzdelerinin günlere göre grafikler ile karşılatırmalı
olarak gösterimi. ... 59 Şekil 6.11. A grubunda tüm pH’lara ait fibroin iskelelerin FTIR spektrumları ... 61 Şekil 6.12 A grubuna ait pH 6’da hazırlanan fibroin iskelenin FTIR
spektrumları ve oluşan spesifik alanlar ve alan ölçüleri. ... 62 Şekil 6.13. B grubunda tüm pH’lara ait fibroin iskelelerin FTIR spektrumları ... 64 Şekil 6.14. B grubuna ait pH 6’da hazırlanan fibroin iskelenin FTIR
spektrumları ve oluşan spesifik alanlar ve alan ölçüleri. ... 66 Şekil 6.15. C grubunda tüm pH’lara ait fibroin iskelelerin FTIR spektrumları ... 68 Şekil 6.16 C grubuna ait pH 6’da hazırlanan fibroin iskelenin FTIR
spektrumları ve oluşan spesifik alanlar ve alan ölçüleri. ... 69 Şekil 6.17. F grubunda tüm pH’lara ait fibroin iskelelerin FTIR spektrumları ... 71 Şekil 6.18. F grubuna ait pH 6’da hazırlanan fibroin iskelenin FTIR
spektrumları, oluşan spesifik alanlar ve alan ölçüleri. ... 73 Şekil 6.19. G grubunda tüm pH’lara ait fibroin iskelelerin FTIR spektrumları ... 75
Şekil 6.20. G grubuna ait pH 6’da hazırlanan fibroin iskelenin FTIR
spektrumları, oluşan spesifik alanlar ve alan ölçüleri. ... 76 Şekil 6.21. Deneysel serilerdeki numunelerin artan sıcaklığa bağlı olarak
yapısındaki kütle azalmasının istatistiksel olarak pH bazında
karşılatırmalı gösterimi. ... 80 Şekil 6.22. Aynı pH değerine sahip farklı deney serilerindeki numunelerin
artan sıcaklığa bağlı olarak yapısındaki kütle azalmasının
istatistiksel olarak pH bazında karşılatırmalı gösterimi. ... 81 Şekil 6.23. Standart Liyofilizasyon(A Grubu) prosedürü ile elde edilen ve
pH’ları 5 (A,C) ve 6 (B, D) olan numunelerin farklı
yakınlaştırmalarda alınan SEM görüntüleri. ... 82 Şekil 6.24. Standart Liyofilizasyon (A Grubu) prosedürü ile elde edilen ve
pH’ları 7 (A, B) ve 8 (C,D) olan numunelerin farklı
yakınlaştırmalarda alınan SEM görüntüleri. ... 83 Şekil 6.25. Porojen Arındırma Yöntemi ve Vakumlu Etüv İşlemi
(B Grubu) ile elde edilen pH’ları 5 (A,C) ve 6 (B,D) olan fibroin
iskelelerin farklı yakınlaştırmalarda alınan SEM görüntüleri. ... 84 Şekil 6.26. Porojen Arındırma Yöntemi ve Vakumlu Etüv İşlemi
(B Grubu) ile elde edilen pH’ları 7 (A,C) ve 8 (B,D) olan fibroin
iskelelerin farklı yakınlaştırmalarda alınan SEM görüntüleri. ... 85 Şekil 6.27. Standart Liyofilizasyondan Sonra Kuru Haldeki İskelelerin
Otoklavlanması (C Grubu) ile elde edilen pH’ları 5 (A, C) ve 6 (B, D) olan fibroin iskelelerin farklı yakınlaştırmalarda
alınan SEM görüntüleri. ... 86 Şekil 6.30. Standart Liyofilizasyondan Sonra Kuru Haldeki İskelelerin
Etüvlenmesi (F Grubu) ile elde edilen pH’ları 7 (A,C) ve 8 (B,D) olan fibroin iskelelerin farklı yakınlaştırmalarda alınan
SEM görüntüleri. ... 89 Şekil 6.31. Fibroin çözeltilerinin 121°C’ta otoklavlanmasından sonra
standart liyofilizasyon ile üretilen (G Grubu) pH’ı 5 (A,C) ve 6 (B,D) olan fibroin iskelelerin farklı yakınlaştırmalarda
alınan SEM görüntüleri. ... 91 Şekil 6.32. Fibroin çözeltilerinin 121°C’ta otoklavlanmasından sonra
standart liyofilizasyon ile üretilen (G Grubu) pH’ı 7 (A,C) ve 8 (B,D) olan fibroin iskelelerin farklı yakınlaştırmalarda alınan
TABLOLAR DİZİNİ
Sayfa Tablo 1.2. Fibroinde interatomik mesafeler, hidrojen bağları, yapısal
model ve kristalin alanlar... 9
Tablo 1.3. Fibroinin sulu çözeltilerinin moleküler karakteristik özellikleri ... 12
Tablo 2.1. Fibroinin pH değimi için hazırlanan deney koşulları ve malzemeler ... 17
Tablo 3.1 Fibroin iskelenin gözenek boyutu ölçümleri ... 23
Tablo 3.2. Sterilizasyon tekniğinin avantajları ve dezavantajları ... 29
Tablo 5.1. Fibroin çözeltisi ve fibroin iskelelere uygulanan ısıl işlemler ... 42
Tablo 6.1. Deneylere göre yapılan alfabetik adlandırmalar ... 48
Tablo 6.2. İzlenen deney prosedürlerine göre FTIR spektrumlarının karşılaştırılması ... 78
Tablo 6.3. Deney serilerinndeki iskelelerin toplam yüzey alanı değerleri... 93
Tablo 7.1. Beta-tabakalı yapılarda pH değişimi ve deney şartlarına göre meydana gelen bozulmaların oranları... 110
1. GİRİŞ
İpek fibroini (IF), doğal polimerler sınıfına giren, süpermoleküler lifli protein yapısında olan, biyouyumluluk, biyobozunurluk, biyoinertlik, güçlü kimyasal stabilite, yüksek mekanik mukavemet ve mekanik özelliklerde doğal doku ile karşılaştırılabilme gibi oldukça önemli özelliklere sahip olan doku mühendisliği çalışmalarında sıkça tercih edilen bir biyomalzemedir (Kaplan vd., 1992; Langer ve Vacanti, 1993; Kaplan, 1998; Megeed, Cappello ve Ghandehari, 2002; Altman vd., 2003; Wanga, Kima, Vunjak-Novakovic ve Kaplan, 2006). Bununla birlikte, fibroinler in vivo olarak rahatça kullanılabilen, hücresel destekli bazal membran şeklinde modifiye edilebilen, hücreler için besiyerine eklenen büyüme faktörlerinin fonksiyonlarını destekleyen ve dokulara sıkıştırma özelliklerini veren suyu depolayabilen bir glikosaminoglikan bileşenine de sahiptir (Minoura ve Tsukada, 1990; Tsukada, Freddi, Minoura ve Allara, 1994; Cooper, 2000; Gobin, Froude ve Mathur, 2005).
Yapısal olarak fibroin, genel olarak glisin ve alanin gibi kısa yan zincirli amino asitlerden ve yüksek yan zincirden oluşan daha karmaşık sekanslara sahip hidrofilik bloklardan oluşan, yüksek düzeyde korunmuş tekrarlanan dizi içeren hidrofobik bloklardan oluşan doğal blok kopolimerler olarak karakterize edilir. Yapıda bulunan amino asitlerin büyük bir bölümü yüklü amino asitlerden oluşmaktadır (Winkler ve Kaplan, 1990; Bini, Knight ve Kaplan, 2004). Hidrofobik bloklar, hidrojenle bağlama ve hidrofobik etkileşimler yoluyla beta-tabakaları veya kristalleri oluşturma eğilimindedir ve ipek fibroinlerin mekanik-gerilme mukavemetinin temel oluşturmaktadır (Simmons, Ray ve Jelinski, 1994; Simmons ve Michal, 1996). Burada bahsedilen hidrofobik bloklar, ipek fibroinlerinin esnekliğini ve dayanıklılığını arttırmak için daha az emilen hidrofilik bloklarla birleşmektedir (Vollrath, 2000; Vollrath, 2005).
Canlı dokular ile biyouyumlu olan ipek fibroini aynı zamanda biyobozunurluk özeliğine de sahiptir. Bu özellikleri nedeniyle son yıllarda yapılan araştırmalarda, doku mühendisliği ve ilaç salınım sistemlerine yönelik kullanımları artmıştır
Karageorgiou, Kirker-Head, McCool, Gronowicz, Zichner, Langer, Vunjak-Novakovic ve Kaplan, 2005). Doku mühendisliğinde kullanılan yapı iskelelerinin oluşturulmasında fibroin tek başına kullanılabildiği gibi kollajen, kitosan, jelatin, hiyaluronik asit, seramikler, PLGA, PLA vb.gibi etkinliği daha iyi bilinen ve uzun yıllardır doku mühendisliğinde kullanılan polimerik malzemeler ile kompozit yapıları da test edilmeye başlanmıştır (Rujiravanit vd, 2003; Meinel vd., 2005; Bhardwaj ve Kundu, 2011; Mirahmadi, Tafazzoli-Shadpour, Shokrgozar ve Bonakdar, 2013; Yodmuang, McNamara, Nover ve Mandal, 2015).
Doğal yapılı bir biyopolimer olan ipek fibroini biyouyumluluk ve biyoinertlik gibi özelliklerinin yanı sıra önemli olarak doğal yara iyileştirici etkiye sahiptir. Bu özelliği yüzyıllardır bilinmekte olup, halk arasında yara kapatıcı ve kan durdurucu olarak kullanılmasının yanı sıra medikal firmalarca da ipek yara bantları imal edilerek haricen yara kapatıcı olarak kullanılmaktadır. Biyomalzeme olarak fibroin 3B iskele, lif, jel, film gibi farklı şekillerde ve farklı fiziksel özelliklerde üretilebilmektedir (Kundu, Rajkhowa, Kundu ve Wang, 2013).
1.1. Fibroinin Yapısı ve Kimyasal Özellikleri
İpek fibroin, iki ana zincirden oluşmaktadır. Bunlardan biri ağır bir zincirdir ve yaklaşık 325 kDa’luk zincir ağırlığına sahiptir. Diğeri ise tek bir disülfid köprüsü ile bağlanmış hafif zincirdir ve zincirin ağırlığı yaklaşık 25 kDa’dur.
Gly–X sekansı, Bombyx Mori’den elde edilen ipek fibroinin ağır zincirinin sekansının dikkat çekici bir özelliğidir (Lucas ve Shaw 1958; Zhou, Confalonieri, Medina, Zivanovic, Esnault, Yang, Jacquet, Janin, Perasso, Li, 2000; Zhou, Confalonieri, Jacquet, Perasso, Li ve Janin, 2001). İki zincir, bir serisin kaplama ile birbirine bağlanmaktadır. İpek fibroinin yapısı, kristal ve amorf bölgelerden oluşmaktadır. Kristalin bölge, serin ve tirozin amino asitleri ile birbirine bağlanmış glisin-alanin tekrarlarından oluşmaktadır (Kaplan, Adams, Farmer, Viney, 1994; Kaplan, Mello, Arcidiacono, Fossey, Senecal, Muller, 1998; Altman vd., 2003; Wanga vd., 2006).
Amorf bölge ise, aspartik asit gibi daha büyük amino asitlerden meydana gelmektedir. Alanin-glisin tekrarları antiparalel tabakanın-zincirin sekonder yapısını oluşturan kristalli alanlardır ve daha esnek amorf bölgelerin aralarına serpiştirilmiştir. Bu yapısal konfigürasyon, ipek fibroine esneklik özelliği ile yüksek mukavemeti içeren benzersiz mekanik özellikler kazandırmaktadır. Minoura ve Tsukada, 1990; Paulsson, 1992, Tsukada vd., 1994; Gobin vd., 2005).
İpek fibroin sahip olduğu yüksek mukavemet (doğada bilinen en güçlü fiber olarak 4.8 GPa'a kadar) ve kayda değer sertlik ve elastikiyet oranı (yaklaşık % 35'e kadar) ile mükemmel bir kombinasyon sağlamaktadır. Örneğin, lifli yapıdaki ipeklerin çekme mukavemeti, yüksek mukavemete sahip Kevlar 49 gibi sentetik liflerinkiyle karşılaştırılabilir iken, esnekliği Kevlar 49'dan 4 ila 7 kat daha yüksektir ve kıvrık yapıdaki ipliği koparmak için gereken enerji, 3 ila 4 kat daha yüksektir. Fibroinin olağanüstü mekanik özelliklerine ek olarak, ipekler 250°C'ye kadar termal kararlılık göstererek yapılarını koruyabilir ve geniş bir sıcaklık aralığında işlem yapılmasına imkan sağlayabilmektedir (Winkler ve Kaplan, 1990; Kaplan vd., 1994; Kaplan vd., 1998; Kaplan, 1998; Vollrath, 1999; Foo ve Kaplan, 2002; Rising ve Nimmervoll, 2005).
Malzemenin mekanik özelliklerine ek olarak, çok yönlü işlenebilirlik ve yüzey modifikasyonu seçenekleri ile doku mühendisliğinde hücresel moleküler yapı ve morfolojiyi kontrol etme yeteneği yapılan çalışmalarda başarı yüzdelerini arttırmaktadır.
Çeşitli biçimlerde şekillendirilebilme (filmler, lifler, ağlar, membranlar, iplikler ve süngerler) özelliğiyle ipek fibroin, in vivo kök hücre adezyonunu, proliferasyonunu ve farklılaşmasını desteklediği ve doku rejenarasyonunu in vivo ortamlarda desteklediği gözlenmiştir. Özellikle, 3B ipek fibroin iskeleleri kullanarak kök hücre bazlı doku mühendisliği, deri gibi bağ dokuların yanı sıra kemik ve kıkırdak gibi iskelet dokularının bir dizi mühendislik çalışmalarıyla desteklenerek kullanımı rejeneratif tıp için oldukça umut vaad edicidir (Langer ve Vacanti, 1993; Wanga vd., 2006)
İpek fibroin lifleri su, etanol, seyreltik asitler ve bazlar gibi çoğu çözücüde çözünmezler, ancak formik asit, heksafluoroizopropanol (HFIP), kalsiyum nitrat veya LiBr çözeltilerinde çözünmektedirler (Haider, Megeed ve Ghandehari, 2004; Wanga vd., 2006)
Fibroinler 58 adet kalıntılı C-terminal dizisi içerir. Bu dizi amorf bölgeye homologtur. Bu diziden tamamen farklı olarak bir de N- terminal dizisi mevcuttur ve bu dizi de kristalin bölgesine homolog pozisyondadır. Her bir kristal alan GAGAGS hekzapeptidin tekrarları ile başlayıp ve GAAS tetrapeptid tekrarları ile sonlanmaktadır. Bu yapı ifadesi fibroin için klasik olan Pauling-Corey modelini güçlü bir şekilde desteklemektedir; burada Gly/Gly ve X/X kontaklarının birbirini izleyen katmanlarında birbiri üzerine beta-tabakalar(beta-sheet) paketlenmiştir. Her bir kristalin alanda bulunan beta-tabakaları, fibroin yapısının temelini oluşturan antiparalel zincirin oluşumunu desteklemektedir (Zhou vd., 2001).
Pauling-Corey modeli için Takahashi ve ark.(2001), ipliklerini ve beta-tabakalarını paketlemenin dört yolunu test etmiştir: Bir beta-tabakanın içindeki bitişik şeritler paralel veya antiparalel olabilir ve yan zincirleri ya hepsi aynı yönde (polar mod) veya alternatif olarak Ala/Ser yan zincirleri ile yukarı ve aşağı (antipolar mod) işaret edebilmektedir. Bu ifade ile Pauling-Corey modelinde fibroinin zincir yapısının kutuplu ve antiparalel olduğu gösterilmektedir. Fibroin sekansının sadece poli- (Ala-Gly) olduğu varsayılarak bir dizi 26 kırınım yoğunluğuna en iyi uyumu sağlamaktadır.
Antipolar beta-yaprakların (tabakaların) glisin amino asidine sahip olmadığı için paketlenmeleri Pauling-Corey modeline göre daha az düzenlidir Yapıda bulunan kristalli alan, birbirinin üzerine ya bir beta-levha ya da iki adet beta-tabaka ihtiva etmektedir. Bu beta tabakalar yaklaşık 200Å boyutuna sahiptir ve 6 veya daha fazla alt alan içeren GX1, GX2, GX5, GX7, GX8 ve GX11 sekansları içermektedir. Beta-ipliklerinin ve beta-yapraklarının polariteleri fibroinin bağ kuvvetleri açısından oldukça önemlidir ve N-terminalden C-terminaline olan yönelimler ile desteklenmektedir (Zhou vd., 2001).
Bir uzun zincirli ve kompleks protein yapısını, paralel beta-tabakalarına katlamak için kullanılan doğal bir yol, iki katmanlı bir solenoid yapı oluşturmaktır. Üst ve alt katman arasında değişen ardışık beta-iplikçikleri ile katlanan polipeptit zinciri tarafından yapılan konformasyon, globüler al-beta proteinlerinde yaygındır.
İpek fibroin difraksiyonunda gözlemlenen ve tekrar eden ünitelerinin tek bir beta-ipliği olduğu tesbit edilmiştir. Bu yapıda bulunan aminoasit dizilerinden, sadece poli-(Ala–Gly) tek ipliklidir. Fibroin X-ray kırınım testine maruz kaldığında, düşük açıda poli-(Ala–Gly) birim hücre üzerinde indekslenemeyen zayıf yansımalara sahiptir. Bu yansımalar bu zincirin uzantılarında serinlerin varlığına atfedilmektedir (Rıchard ve Marsh, 1955; Lucas ve Shaw, 1958; Zhou vd., 2000; Zhou vd., 2001).
Fibroin molekülleri hidrofobik alanlardan ve az miktarlarda pozitif ve negatif yüklü amino asitlerden oluşur ve izoelektrik noktası pI = 4,5 civarındadır. Bu nedenle SF membranı amfobiktir. Genel olarak proteinler suda çözünmez ve amfoterdir. Bu proteinler –fibroin ve serisin- hem asitlerle hem de bazlarla birleşerek tuz oluşturmaktadırlar. Ham ipeğin kimyasal bileşiminde %2 oranında parafin(wax) de bulunmaktadır. Özellikle koza içerisindeki parafinin hidrofobik görev aldığı düşünülmektedir.
İpek fibroin protein membranı amfoterik iyon değişimine uygundur. Bu iyon değişimi yüzeylerinde bulunan zayıf asidik ve zayıf bazik gruplardan oluşan kimyasal bağlar ile mümkün olmaktadır. Ayrıca membranın pozitif veya negatif yükü, fibroin solüsyonunun pH değerine bağlıdır. Fibroin çözeltisinin pH'ı 4,5'in altında olduğunda, pozitif yüklü olan fibroin bulunduğu ortamlardaki anyonları algılar. Böylece, fibroin kullanılarak modifiye edilmiş tüm materyallerin mükemmel iyon değişim özellikleri vardır.
Fibroin proteinin yapısında bulunan polipeptit zincirleri çeşitli konfigürasyonlarda bulunur. Bu konfigürasyon deneysel olarak birçok lifli ve globüler proteinin ve sentetik polipeptidlerin ana yapısal bir bileşeni olarak gösterilmiştir. Konfigürasyonda bulunan amid gruplarının bazıları, C-C ve C-N tekli bağları etrafında belirli yönelimlere sınırlıdır (Lucas ve Shaw, 1958; Zhou vd., 2000; Zhou
Polipeptit zincirinde bulunan bir diğer konfigürasyonda ise -C=O- ve -N-H- grupları ardışık biçimde yerleşmişlerdir. Ana zincirde –C-O- ve -N-H- grupları, bu konfigürasyon sarmallarının karşıt taraflarından çıkıntı yapar; onların yönelimi, sarmalın eksenine neredeyse dikdir. Bu pozisyon, bitişik sarmallar arasında yanal -C=O--N-H- hidrojen bağlarının oluşumu için elverişlidir. Bu şekilde birbirine bağlanmış bir sarmallar dizisi, iki tabaka yapısı oluşturabilir. Paralel zincir ve antiparalel zincir kıvrımlı tabakalar, bitişik sarmalların paralel veya antiparalel bir düzenine karşılık gelir, bu iki yapı orijinal olarak, muhtemelen -C-C- ve -C-N- tek bağları etrafında spesifik yönelimler göstermiştir (Rıchard ve Marsh, 1955; Lucas ve Shaw, 1958; Minoura ve Tsukada, 1990; Paulsson, 1992; Simmons ve Michal, 1996; Cooper, 2000; Zhou vd., 2000; Zhou vd., 2001; Bini, Knight ve Kaplan, 2004; Rising ve Nimmervoll, 2005; Vollrath, 2005).
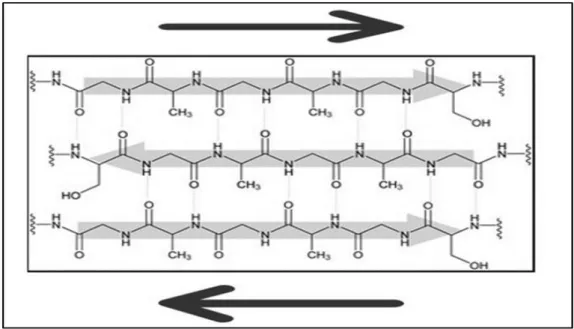
Fibroin materyallerinin X ışını altında yapılan analizleri sonucunda ipek fibroinin temel zincir yapısının yanı sıra bu temel zincire antiparalel olan sanal bir protein zincirinin (Şekil 1.1) varlığı tesbit edilmiştir. Bu zincirde de yine C-O-N atomları spesifik şekilde dizilmişlerdir. Fibroinde bulunan bu antiparalel zincir amfoterik özelliğin oluşmasının ana sebebidir.
Şekil 1.1. Fibroinin yapısında bulunan beta-tabakalı antiparalel yapılı polipeptit zincirleri (Rıchard ve Marsh, 1955)
İpek fibroinin polipeptit zincirinde bulunan aminoasitlerin dizilişi şu şekildedir: Gly-Ala-Gly-Ala-Gly-Ser-Gly-Ala-Ala-Gly-[Ser-Gly-(Ala-Gly)n] sTyr. Ancak fibroinin yapısında genel olarak Şekil 1.2’de olduğu gibi glisin-alanin blokları oluşur ve ana zincir bunlar üzerinden devam etmektedir. Ana polipeptidin dizilişi ise, (Gly, Ser, Gly, Ala, Gly, Ala)n şeklinde bir hekzapeptidin tekrarı şeklindedir. Gözlenen bu 9’lu amino asit sekansı fibroine kristallik özelliği kazandırmaktadır (Lotz ve Cesari, 1979; Sashina, Bochek, Novoselov ve Kirichenko, 2006).
Şekil 1.2. Fibroinin amino asit dizileriyle beraber genel kimyasal yapısı (Lotz ve Cesari, 1979)
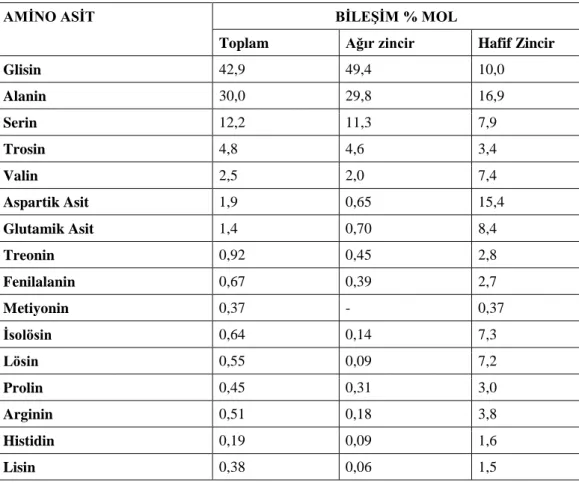
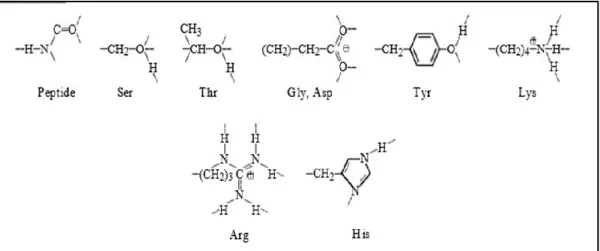
İpek fibroinin ana bileşeni glisindir. Tüm bileşenler ve bulunma oranları Tablo 1.1.’de verilmiştir. Fibroinin yapısında bulunan amino asit türlerinin temel kimyasal yapıları da Şekil 1.3.’te gösterilmiştir. Fibroinin yapısında az miktarlarda bulunan Tyr, Val, Arg ve Asp gibi aminoasitler ana peptit zincirinde büyük yan zincirler oluşturmaktadır. Bunlar yapının yer yer kristal düzeninden sapmasına sebep olmaktadır. (Lotz ve Cesari, 1979; Sashina, Bochek, Novoselov ve Kirichenko, 2006).
Tablo 1.1. Fibroinin protein yapısında bulunan amino asit türleri, yapıda bulunma yüzdeleri ve molekül ağırlıkları (Rıchard ve Marsh, 1955)
AMİNO ASİT BİLEŞİM % MOL
Toplam Ağır zincir Hafif Zincir
Glisin 42,9 49,4 10,0 Alanin 30,0 29,8 16,9 Serin 12,2 11,3 7,9 Trosin 4,8 4,6 3,4 Valin 2,5 2,0 7,4 Aspartik Asit 1,9 0,65 15,4 Glutamik Asit 1,4 0,70 8,4 Treonin 0,92 0,45 2,8 Fenilalanin 0,67 0,39 2,7 Metiyonin 0,37 - 0,37 İsolösin 0,64 0,14 7,3 Lösin 0,55 0,09 7,2 Prolin 0,45 0,31 3,0 Arginin 0,51 0,18 3,8 Histidin 0,19 0,09 1,6 Lisin 0,38 0,06 1,5
İpek liflerin supramoleküler yapısının elemanları, 6,5 Å’a kadar genişliğe sahip olan makrofibrillerdir. Helezonik olarak paketlenmiş nanofibriller 170 nm çapındadır (Sashina vd., 2006). Nanofibriller, ipek fibroinlere artırılmış mukavemet kazandırmakta önemli bir rol oynamaktadır. İpek fibroinin molekül ağırlığı 370000 Da'ya ulaşır; fibroin makro zincir uzunluğu, 150 nm; ve makro halka çapı, 0,45 nm’dir (Tsukada, Gotoh ve Minoura, 1990; Gotoh, Niimi, Hayakawa ve Miyashita, 2004; Sashina, 2006). Fibroin içindeki polar karboksi ve amino grupları ayrıca, dipol etkileşimlerinde ve proton transferi durumunda da elektrostatik etkileşimlerde rol oynayabilmektedir. Fibroindeki asit ve baz gruplarının içeriği düşük olduğundan, sekonder yapının oluşumunda elektrostatik faktör belirleyici değildir; bununla birlikte, fibroin çözünmesinde bu durum belirleyici olabilmektedir (Dill, 1990).
Şekil 1.3. Fibroinin yapısında bulunan amino asit türlerinin temel kimyasal yapıları (Sashina vd., 2006)
Tsukada ve ark. (1994), X-ışını saçılma verilerinden hesaplanan protein zincirlerinin çeşitli uyumları için interatomik mesafeleri ve bağ açılarını bildirmişlerdir. En enerjik olarak uygun model, alanin-glisin bloklarının (AlaGly) iki molekül içi ve bir moleküller arası hidrojen bağı oluşturduğu makro zincirlerin antiparalel düzenlemesi ile ve (AlaGly) 2-SerGly fragmanlarının oluşmasıdır. Ayrıca üç tane içyapıda ve bir de moleküller arası hidrojen bağları (Tablo 1.2.) bulunmaktadır (Sashina vd., 2006).
Tablo 1.2. Fibroinde interatomik mesafeler, hidrojen bağları, yapısal model ve kristalin alanlar (Sashina vd., 2006)
Fibroinin Yapısal Modeli
Moleküller Arası Hidrojen Bağları Molekül içi Hidrojen Bağları
Bağ Atomlar arası Mesafe Açı derecesi Bağ Atomlar arası Mesafe Açı derecesi
Ala-Gly N(Ala)..O(Gly) 2,87 77,7 N(Gly)..O(Ala) 3,02 123,7
N(Ala)..O(Ala) 2,84 83,6 (Ala-Gly)2-Ser-Gly N(Ala)..O(Gly) 2,98 76,9 N(Gly)..O(Ala) 3,13 125,6 N(Ala)..O(Ala) 2,88 86,4 O(Ser)..O(Ala) 2,65 88,5
Fibroinin izoelektrik noktası, çözelti hazırlama koşullarına bağlı olarak pH 3,6-5,2 aralığında değişirmektedir (Tsukada vd., 1990; Altman, Diaz, Jakuba ve ark., 2003; Gotoh, Niimi, Hayakawa ve Miyashita, 2004; Sashina vd., 2006).
Makromoleküller paralel veya antiparalel modda düzenlenir, katlanmış bir tabaka(alfa) oluşturmaktadır. İpek fibroin antiparalel beta-tabakaları yüz yüze, arka arkaya pozisyonunda paketlenmektedir. (Şekil 1.4.) Makromoleküllerin hidrofobik parçaları için bu yapı en düşük enerjiye sahip olduğu için en kararlı yapıyı sağlamaktadır (Lazo ve Downing, 1999; Dwyer, 1999).
Şekil 1.4. a. Fibroinin makromoleküler protein yapısında bulunan alfa-helix yapıların gösterimi b. Fibroinin makromoleküler protein yapısında bulunan beta-katman(beta-sheet) yapıları (Sashina vd., 2006)
Fibroin, konsantre sulu çözeltilerde (fosforik, formik, sülfürik, hidroklorik) ve konsantre edilmiş sulu, organik ve sulu-tuz çözeltilerinde çözülmektedir: [LiCNS, LiBr, CaCl2, Ca(CNS)2, ZnCl2, NH4CNS, CuSO4+, NH4OH, Ca(NO3)2].
Sulu tuz sistemlerinin çözünebilirliği tuz konsantrasyonuna bağlıdır ve aşağıdaki sırayla artar: anyonlar için, sülfat < sitrat < tartrat < asetat < klorid < nitrit < bromür < iyodür < tiyosiyanat < dikloroasetat; katyonlar için, Ca2+ < Sr2+ < Ba2+ < Li+ <
Zn+. Bazı tek bileşenli organik çözücülerde (heksafluoroizopropanol,
A
heksafluoroaseton), fibroin sadece ön aktivasyonundan sonra çözülebilmektedir. Fibroin aktivasyonu, proteinin bir sulu tuz çözeltisi içinde çözülmesinden sonra çözeltinin diyalizinden ve polimerin kuru çözelti ile sulu çözeltiden bir film olarak geri kazanılmasından oluşmaktadır.
Yüksek çözülebilirlik lityum halojenürlerin organik çözücüleri dimetilasetamid (DMAA) ve dimetilformamid (DMF) olarak adlandırılır. Kompleks bir çözücünün önemli bir özelliği, fibroin makromoleküllerinin elektrofilik merkezlerine (hidroksi, amid, amino grupları) saldıran anyonun nükleofilik olmasıdır. Protonsuz çözücülerde anyonlar çözülmez; bu nedenle nükleofilik özellikleri sulu çözeltilerden bile daha yüksek olabilmektedir. Organik tuz çözeltilerinin çözünebilirliği, bir anyona bağlı olarak aşağıdaki sırayla azalır: Cl > Br > SCN. Anyonun nükleofilikliğinde azalma ile korelasyon göstermektedir. Sulu çözeltilerde, bu eğilim terstir, çünkü su molekülleri, fibroin elektrofilik merkezleriyle rekabet eder ve daha nükleofilik anyonlar, suyla, polimerden daha güçlü bir şekilde etkileşmektedir.
Organik çözücüler içinde tiyosiyanatların çözeltileri, sulu bir LiSCN çözeltisinin polimeri kolaylıkla çözdüğü halde, verimsiz olduğunu kanıtlamıştır. Katyonların aktivitesi için, sulu ve organik sistemler de bu açıdan farklıdır. ZnCl2'nin sulu
çözeltileri en etkili çözücülerdir, oysa DMAA, DMF ve N-metil-2pirolidon içindeki ZnCl2 çözeltilerinde, fibroin nispeten seyreltik çözeltiler (ağırlıkça %1-2)
oluşturmak için sadece 155 °C'de çözülmektedir.
Çeşitli sistemlerde fibroin çözünmesinin spesifik özellikleri, moleküler yapısı ile ilişkilidir. Yoğunlaştırılmış asit çözeltilerinde, fibroin makromolekülleri güçlü bir iyon-iyon etkileşimi sayesinde çözülür, bu da polimerin amino ve amid gruplarının protonlanmasıyla mümkün olmaktadır. Tuz sistemlerinde çözünme, çözücü iyonlarının fibroin makromoleküllerin fonksiyonel grupları ile etkileşmesinden kaynaklanır.
DMAA, LiCl sisteminde selülozun çözünmesi ile benzer şekilde, anyonun nükleofilik saldırısının sonucu olarak fibroin yapısındaki moleküller arası ve moleküller arası hidrojen bağlarının koptuğu varsayılabilmektedir. Solvent iyonları,
polar ve yüklü fibroin zincirlerinden oluşan gruplarla etkileşime girerek, makromoleküller arasındaki hidrojen bağlarını koparmaktadır (Parker, 1969; Dawsey ve McCormic, 1990; Dwyer, 1999; Ohgo, Zhao, Kobayashi ve Asakura, 2003; Sashina vd., 2006).
LiCI, LiBr, NaSCN ve KSCN'nin sulu ve sulu-organik çözeltileri, ağırlıkça % 20 fibroine kadar çözülür; Karışımların çözünebilirliği çözücü içindeki suyun nispi içeriğinde bir azalma sağlanması ile artmaktadır (Matsumoto ve Uejima, 1949). Solüsyonların içsel viskozitesi, karışımların su muhtevası ile ters orantılıdır ve 30°C'de 0,3 – 0,7 dl g-1'dir. Huggins sabiti kH, 0,5–1’dir, minimum %10 su
içeriğinde gözlenmektedir. Bu nedenle, sulu ve susuz çözeltilerdeki iyonların çözünmesindeki farklılıklar nedeniyle, fibroin çözeltilerinin özellikleri, su:organik çözücü oranı ile farklılaşmaktadır. Fibroinin sulu çözeltilerinin moleküler karakteristik özellikleri Tablo 1.3.’te bulunmaktadır (Sashina vd., 2006).
Tablo 1.3. Fibroinin sulu çözeltilerinin moleküler karakteristik özellikleri (Sashina vd., 2006)
Özellik Akuajenik Fibroin Diyaliz sonrası Çözeltisi
Moleküler Kütle, Da 188 000
Hidrodinamik Uzunluk, LH, Å 8 563
Dönme Yarıçapı, R, Å 81,5
Enine Kesit Yarıçapı, RC, Å 43,0
Kalıcı Uzunluk, a*, Å 37,3
Hacim, Vx10-6, Å3 2,3
Enine Kesit Alanı, A, Å2 7,9
Çözücü ile etkileşim, mutlaka fibroin makromoleküllerin ve bunların ikincil yapısının konformasyonunda bir değişikliğe yol açmaktadır. Polar olmayan çözücüler, fibroinin hidrofobik fragmanlarını çözmektedir.
Sonuç olarak, amid, hidroksi ve diğer polar gruplar, H bağları vasıtasıyla birbirleriyle etkileşir ve böylece alfa-helix sarmal yapısını sabitlemektedir.
Polar solventlerde, mevcut H bağları kırılır ve bu da alfa yapısına geçişi teşvik eder; işlemde, makromoleküller aynı düzlemde düzenlenir, bitişik makromoleküllerin hidrofobik grupları, düzlemler içinde birbirleriyle etkileşirler ve makromolekül düzleminin dışındaki polar gruplar, iç ve moleküller arası H bağları oluşturmaktadır.
Çözeltilerdeki fibroin makromoleküllerin konformasyonel durumu, çözücüye bağlıdır. Çözeltideki fibroin makromolekülleri, suludan organik çözücülere doğru gittikçe artmaktadır. Sulu tuz sistemlerinde, makromoleküller çoğunlukla rastgele globüller şeklinde bulunur ve düzensiz bir ikincil yapı gözlemlenmektedir. Bir veya başka bir fibroin yapısının prevalansı(oranı) belirli bir organik çözücüye bağlıdır. N-Metilmorfolin, N-oksit, lifler ve filmler halinde fibroin işlenmesi için bir teknolojinin geliştirilmesinde oldukça ümit vaat etmektedir, böylece tuz içeren sulu, sulu-organik ve organik çözücülerle gerekli olan tuz giderme aşaması, ortadan kaldırmaktadır (Matsumoto ve Uejima, 1949; Iizuka, 1966; Parker, 1969; Dawsey ve McCormick, 1990; Dwyer, 1999; Altman vd., 2003; Sashina vd., 2006).
1.1.2. Fibroinin Bombyx Mori İpek Böceğinden Elde Ediliş Yöntemleri
En çok çalışılan ipek türleri, ipekböceği Bombyx Mori ve örümcek NepHila Clavipe'lerinden elde edilen ipek kozalarıdır. İpekböceği kozası, fibroin olarak adlandırılan lifli bir protein içermektedir. İpek lifleri esas olarak iki protein şeklinde, serisin ve fibroinden meydana gelmektedir. Aynı zamanda az miktarda diğer amino asit kalıntıları ve çeşitli safsızlıklar da içermektedir: yağlar, mumlar, boyalar ve mineral tuzları (Wanga vd., 2006).
Koza türüne bağlı olarak, fibroin içeriği % 66,5-73,5 ve serisin içeriği % 26,5-33,5 oranlarında değişmektedir. Hem ağır hem de hafif iplik çekirdeklerini ve fibroin liflerini çevreleyen serişinler, tutkal benzeri proteinleri bir araya getiren zincirlerdir. Serisinler fibroin fiberleri arasına yerleşerek ipek kozasının bütünlüğünü korumaktadır.
İpek fibroin, evcilleştirilmiş ipekböceği Bombyx mori tarafından sentezlenen bir proteindir ve biyouyumluluk, biyo-bozunabilirlik ve minimum enflamatuar özelliklerinden dolayı umut veren bir biyomateryal olarak çalışılmıştır (Bhardwaj ve Kundu, 2011). Fibroinleri kullanmadan önce etraflarındaki serisin kaplamasının çıkarılması, ipek fibroinin doku mühendisliğinde trombojenik ve enflamatuar yanıtlarını ortadan kaldırmaktadır (Gobin, 2005).
1.1.3. Fibroinin Doku Mühendisliğinde Kullanım Alanları
Doku mühendisliğinde, hücrelerin birbirlerine bağlanması neo doku oluşumunu desteklemesi ve yeni doku büyümesi ile karşılaştırılabilir bir oranda bozunmak için yeterli mekanik stabilite amacıyla üç boyutlu gözenekli matrisler kullanılmaktadır. Ayrıca hücre migrasyonu ve genleşmesine yeterli bir fırsat sağlamak için gözeneklilik oldukça önemlidir. İskelelerin mekanik özellikleri aynı zamanda istenen doku onarım sahasındaki gereksinimleri de karşılamalıdır. Bu tasarım gereksinimlerinin bir kısmını karşılayan polimerlerdeki gözenekli üç boyutlu yapıların üretilmesi için bir takım metotlar Şekil 1.5’te bildirilmiştir (Ishaug, Crane, Miller, Yasko ve Yaszemski, 1997; Agrawal ve Ray, 2001; Nazarov, Jin ve Kaplan, 2004). Özellikle, kemik dokusu rejenerasyonu için düşünüldüğünde mekanik dayanım, iskele uygulamasında önemli bir rol oynamaktadır.
Kemiğin in vivo ortamında sıklıkla mekanik kompresyona maruz kalma bulunur; bu nedenle, yeterli bir gözeneklilik ve biyouyumluluk sağlarken, bir iskele bu kuvvete dayanacak şekilde tasarlanmalıdır. Kemik iskeleleri için birçok polimer düşünülmüştür. Bununla birlikte, bozunabilirlik, kontrol edilebilir gözeneklilik, dokunun büyümesi veya biyobozunmayla beraber rejenerasyon(yerine koyma-değiştirme), biyouyumluluk ve gözenekli matrislere işlenebilirlik sırasında uzun süre stabilite kombinasyonu çoğu polimerin kullanımını sınırlandırmaktadır. İpekler, geleneksel olarak tekstilde iplik malzemesi olarak ve binlerce yıldır biyomedikal ihtiyaçlar için ameliyat ipliği şeklinde kullanılmış olan ipekböceği Bombyx mori tarafından üretilen doğal liflerdir (Nazarov vd., 2004).
Son zamanlarda, geniş bir biyomedikal çeşitliliği için ipekler araştırıldığında osteoblast ve fibroblast hücre destek matrisleri ve ligament doku mühendisliği dahil olmak üzere oldukça geniş uygulama alanı bulmaktadır. Fibroin, mekanik özelliklerde bilinen en güçlü doğal elyafları ve diğer doğal polimerlere oranla yüksek performanslı sentetik lifleri temsil etmektedir. Kontrollü salım ilaç salınım sistemleri de ipek fibroin membranlar için bir uygulama alanıdır. İlaç salınım sistemlerinde fibroinin amfoterik özelliğinden yararlanılarak sistem kurulmaktadır.
Doku mühendisliğinde genel olarak fibroinler, başka bir biyobozunur polimer ile kompozit halinde kullanılmaktadır. Fibroin tabanlı kompozit iskelelerde, fibroin oranı toplam kütle içerisinde arttırıldığında iskelenin mekanik mukavemeti artmaktadır. Kompozitlenmiş iskeleler, saf ipek fibroine kıyasla daha yüksek gözenek boyutlarına sahiptir. Ancak fibroin oranı azaltıldığında basınç dayanımı ve modülünün kademeli olarak azaldığı tesbit edilmiştir (Cunniff, Fossey, Auerbach, Song, 1993; Nazarov vd., 2004; Bhardwaj ve Kundu, 2011).
Doku mühendisliğinde fibroin iskeleler, ekstraselüler matrikse (ECM) destek ve güç sağlayarak, homeostaziyi koruyarak ve doku gelişimi ve rejenerasyonunu yönlendirerek doğal dokularda önemli bir rol oynamaktadır. Doku rejenerasyonu için kullanılacak bir biyomateryal, ECM özelliklerinin çoğunu taklit etmesi gerektirmektedir.
Sıvıların fibroin üzerinde serbestçe yayılması yeteneği hücre-besin atıklarının ve besin maddelerinin taşınmasına olanak sağladığından, depolama hem doğal dokularda hem de biyomalzemelerde önemli bir faktördür. Buna ek olarak, sıvının depolanması büyüme faktörlerinin depolanmasına yardımcı olur ve dokunun sıkıştırıcı özelliklerini sağlamaktadır (Hubbell, 2003; Kleinman, Philp ve Hoffman, 2003; Rosso, Giordano ve Barbarisi, 2004; Gobin vd., 2005).
Şekil 1.5. Fibroinden 3 farklı yöntem ile doku iskelesi hazırlanması (Nazarov vd., 2004)
Genel olarak yapılan işlemler sonucunda ipek fibroin konsantrasyonu ne kadar yüksek olursa gözenekler o kadar az olduğu belirtilmiştir. NaCl ile porojen arındırma yönteminde elde edilen iskelelerin gözenek boyutunun, dondurarak kurutma yöntemiyle elde edilen iskelelere göre daha büyük olduğu gözlemlenmiştir (Nazarov vd., 2004).
2. FİBROİNİN pH DEĞİŞİMLERİNE TEPKİSİ
Fibroinin yapısında bulunan antiparalel zincirlerden dolayı amfoterik özellikler göstermektedir. Bu özelliği ile pH değişimlerine spesifik tepkiler vermektedir.
2.1. Fibroinin Protein Yapısında Meydana Gelen Oluşumlar ve Fibroinin Amfoterik Özelliğinin Etkinliği
Bir fibroin membranın izoelektrik noktası, pH 4,5 civarındadır. pH 4,5'in altında bir anyon değiştirici olarak çalışır ve pH 4,5 üzerinde olduğunda ise bir katyon değiştirici olarak görev almaktadır (Chen, Minoura ve Tanioka, 1994).
Chen ve ark.(1994)’nın yaptığı bir çalışmada Tablo 2.1’de belirtilen 5FU, Vc, Res, SPS, BTAC adlı pH etkileyici kimyasallar ile ipek fibroin muamele edilmiş ve fibroinin amfoterik özelliğiyle bu pH değişimlerine tepkileri incelenmiştir.
Tablo 2.1. Fibroinin pH değimi için hazırlanan deney koşulları ve malzemeler(Chen vd., 1994) pH Etkileyici Kimyasallar MW U.V. Dalga Boyu pH(10 -3M) 5FU: C4H3FN2O2 130,08 266 6 Vc: C6H5O6 176,13 265 250(pH:3) 3,7 Res: C6H4(OH)2 110,11 273 6,4 SPS: HOC6H4SO3Na 196,19 230 5,8 BTAC: C6H5CH2N(CH3)3Cl 185,70 208 6
BTAC, sulu çözelti içinde katyonik olduğundan, BTAC'nin geçirgenlik katsayısı, artan pH ile artmıştır. Bu artış, katyonik penetranlar ve membranda sabitlenmiş negatif yüklü gruplar arasındaki elektrostatik etkileşime atfedilebilmektedir.
Ek olarak, izoelektrik noktada (yaklaşık pH 4,5), membran nötr hale gelir ve membran üzerindeki sabit yükün, geçirgenlik üzerinde hiçbir etkisi yoktur. SPS anyonun moleküler büyüklüğü, BTAC katyonununkiyle neredeyse aynı seviyededir (Chen vd., 1994).
İzoelektrik noktada SPS ve BTAC katsayıları hemen hemen aynıdır. 5FU'nun geçirgenlik katsayısı pH 7'nin altındaki pH'a bağlı değildir, pH 7'nin üzerinde ise geçirgenlik katsayısı azalmıştır. Bu işlem ile fibroinin izoelektrik noktasının etkilemediği gözlenmiştir.
5FU'luk geçirgenlik katsayısı, ancak pH 9'daki geçirgenlik, pH 6'daki bir faktörün 1/25'i kadar azaltılmıştır. 5FU'nun pH titrasyon deneyleri; ayrışma sabiti pK 8 civarındadır. Bu, 5FU'nun, pH 7'nin üzerinde bir anyon olarak varolduğu anlamına gelmektedir.
C vitamininin bir anyon (pKal = 4,25) olduğu bilinmektedir. C vitamininin geçirgenlik katsayısı aniden pH 4'ün üzerine düşmüştür. Bu düşüşün nedeni ise ipek fibroin membranının amfoterik iyon değiştirebilirlik özelliği nedeniyle, ipek fibroin membranının farmasötiklere geçirgenliğinin, harici çözeltinin pH değerinin değiştirilmesiyle düzenlenebileceği sonucuna varılmıştır (Chen vd., 1994).
Sulu ipek fibroin solüsyonunun, azalan pH (asidik durum) ile arttığı görülmüştür. Viskozite, pH 4 ve 6 arasında hızla değişmiştir. Sulu ipek fibroin çözeltisinin viskozitesi, pH 3'te yaklaşık 1.4×105(cps)’dir. pH < 4,5 çözeltilerinde elektrot pozitif yüklüdür. İpek fibroin protein membranı amfoterik iyon değişimine oldukça uygundur. Fibroin membranın su ile etkileşimi sonucu meydana gelen pH değerleri grafiği Şekil 2.1’de verilmiştir. Bu membran zayıf asidik ve zayıf bazik gruplardan oluşmaktadır. Membranın pozitif veya negatif yükü, pH değerine bağlıdır.
Şekil 2.1. Fibroin membranın su ile etkileşimi sonucu meydana gelen pH değerleri grafiği (Chen vd., 1994)
Zar ile ayrılan sulu KCl çözeltisi arasında üretilen potansiyel, membrandaki sabit yük grubundan etkilenmektedir. Izoelektrik nokta, sulu KCl çözeltisinin pH'sinin bir fonksiyonu (Şekil 2.2) olarak membran potansiyelinden belirlenmektedir. İzoelektrik nokta yaklaşık olarak pH 4,5'dir. Bu, membranın pH 4,5'in altında bir anyon değiştirici ve pH 4,5 üzerinde bir katyon değiştirici olabileceğini düşündürmektedir. Çözelti pH'ı 4,5'in üzerinde olduğunda, negatif yüklü olan fibroin modifiye elektrot, katyonları tespit etmek için kullanılabilmektedir.
Çözelti pH'ı 4,5'in altında olduğunda, pozitif yüklü olan fibroin modifiye edilmiş elektrot, anyonları algılamaktadır. Böylece, fibroin modifiye edilmiş elektrotun mükemmel iyon değişimi özellikleri vardır. Analitik uygulamada yüksek seçiciliğe sahiptir ve enterferansa karşı dayanıklıdır. Fibroin elektrodu, in-vivo biyoanalizde nörotransmitterleri seçici olarak tespit etmek için kullanılmıştır. İpek fibroin elektrotunun iyon değişimi özellikleri, analitik ve biyoanalitik kimyada çok fazla potansiyele sahip olduğu anlamına gelmektedir (Chen vd., 1994). Terry ve ark.(2004) yaptıkları bir çalışmada hazırladıkları ipek fibroin solüsyonun belirli sürelerde (yaklaşık 5 dk) buhara maruz kaldığında pH dengesine ve son pH'a (2 veya 11) ulaşması için çeşitli işlemler yapılmıştır.
Şekil 2.3. Fibroin membranın pH potansiyel grafiği (Chen vd., 1994)
pH'taki azalma, ipek fibroin yapısının homojen olarak jelleşmesi için yeterli oluştur. Jel oluşumu, sabit gerilme ve frekansta dinamik modülleri ölçerek pH'ın bir fonksiyonu olarak izlenebilmiştir. Sırasıyla asetik asit (pH-2) ve amonyak (pH-11) ile pH düşürülmüş ve yükseltilmiştir. Bombyx mori ipek fibroindeki temel yapısal protein olan H-zinciri fibroin, oldukça düşük tahmin edilen bir pI noktası (4,2) ve asidik yan zincirlerle amino asitlerin ilginç bir dağılımına sahiptir. Oldukça hidrofilik N-terminali, bu bölgedeki temel değerleri fazlasıyla aşan yüksek bir asidik yan zincir yoğunluğu içermektedir.
Molekülün merkez bölgesinde, asitli amino asit grupları sadece uzun hidrofobik bloklar arasında yer alan kısa hidrofilik ara parçaların her birinde görülmektedir. Bu ara parçaların sadece ilk ve sonları da pozitif yüklü amino asitler içermektedir. Böylece, nötr pH'ların yakınında, protein-protein etkileşimlerine güçlü bir itici bileşen sağlayarak negatif yükler ağır basmaktadır.
pH'ın düşürülmesi, asidik grupların iyonizasyonunu, mevcut olduğu düşünülen sıvı kristalin durumunun korunmasından sorumlu olan itici ve çekici kuvvetlerin dengesini bozmaktadır. Bu, hidrofobik blokların, jelin başlangıçta stabilize olması, önerilen hidrofobik etkileşimler üretmek için birbirine yaklaşmasına izin vermektedir.
Belirli prosedürlerle elde edilen fibroin jeli aside daha uzun süre maruz kaldıkça, hidrofobik blokların kısımlarının giderek, içi ve moleküller arası hidrojen bağları ve dolayısıyla jel tabakasını daha güçlü bir şekilde stabilize eden alfa-tabaka formunu oluşturduğu yerlerde denatürasyon meydana gelmektedir. Ayrıca, pH değişikliği katyonların, proteinlerin agregasyonu ve ikincil yapısal geçişleri üzerindeki bilinen etkilerini de modüle edebilmektedir (Vollrath ve Knight, 2001; Terry, Knigh,, Porter ve Vollrath, 2004).
pH'ın, Bombyx mori ipekböceği fibroinin reolojisi üzerinde belirgin bir etkiye sahip olduğunu göstermektedir. pH'ın düşürülmesi, aside maruz kalmanın nispeten kısa olması durumunda tekrar pH yükseltilerek tersine çevrilebilen bir jelin oluşumunu indüklemektedir. Jel, fibroin molekülünün iki bölgesinde negatif yüklerin bastırılması, komşu moleküllerin daha yakın bir yaklaşımına izin verilmesi ve böylece hidrofobik etkileşimlerin oluşumu ve daha sonra moleküller arasındaki hidrojen bağlarının bir sonucu olarak oluşturulabilmektedir. pH kontrolünün, fibroin iskelelerin üretimi aşamasında oldukça önemli olduğu belirlenmiştir (Vollrath ve Knight, 2001; Terry, Knigh,, Porter ve Vollrath, 2004).
3. FİBROİNİN SICAKLIK DEĞİŞİMLERİNE TEPKİSİ
Fibroinler supramoleküler kompleks bir protein yapısındadır. Proteinler ise bağ kuvvetlerinin güçlerine bağlı olarak belirli seviye sıcaklıklarda degrede olabilmektedir. Degrede olmaya başlayan protein yapısıyla birlikte fibroinlerin standart yapılarında da değişiklikler meydana gelmektedir. Meydana gelen bu değişiklikler fibroinlerin her alanda özellikle doku mühendisliğinde tek başına veya diğer polimerlerle kompozit olarak kullanımını etkilemektedir.
3.1. Fibroinin Protein Yapısında Meydana Gelen Farklılıklar ve Doku İskelesi Üretimi Üzerindeki Etkileri
Yeo ve ark.(2003) ve Hino ve ark.(2003), yaklaşık 85 ve 120 °C sıcaklıkta püskürtmeli kurutma sistemi ile oluşturulan fibroin mikrokürelerin genel konformasyon yapısı incelemesinde sırasıyla βeta-tabakaların konformasyonlarının değiştirebildiğini bildirmişlerdir. Suda çözünmeyen fibroin mikroküreleri elde etmek için metanol işlemi gerçekleştirilmiştir. IF mikrokürelerin FTIR spektrumunda metanol muamelesi sonrası βeta-tabakaların karakteristik bantlarını arttırdığını tespit etmişlerdir. Sonuç olarak bu çalışma, konformasyonun rastgele bobin içinden βeta-tabaka formunun değiştiğini kısmen göstermiştir (Srısuwan, Srıhanam ve Baımark, 2009).
Camsı geçiş sıcaklığı, ipek fibroin matrisi içindeki gözeneklerin oluşumunda oldukça önemlidir. Sulu bir çözelti içindeki ipek fibroinin camsı geçiş bölgesi -20 ile -34 °C arasındadır.. Camsı geçişinin üzerindeki donma sıcaklığı ne kadar yüksek olursa buzun oluşması ve büyümesi o kadar uzun sürmektedir. Bu nedenle, buz parçacıklarının gözeneklerin büyüklüğü üzerinde daha büyük bir etkisi olacaktır (Nazarov vd., 2004).
Dondurma süresi ne kadar uzun olursa gözenekler o kadar büyümektedir. Sıcaklık, camsı geçiş bölgesinin altında olduğunda, gözenek boyutu artık sıcaklığa bağlı değildir. Sıcaklığın -80 °C'ye düşürüldüğü zaman, gözenek çaplarının 15 µm’ye düştüğünü (Tablo 3.1) ve ipek fibroinin küçük agregalar oluşturduğunu
göstermektedir. Donma sıcaklığı arttıkça, gözenek çapı artmaktadır. Buz parçacıklarının büyüklüğü büyüme hızına ve zamanına bağlıdır (Cunniff, Fossey, Auerbach, Song, 1993; Ishaug, Crane, Miller, Yasko ve Yaszemski, 1997; Agrawal ve Ray, 2001; Hubbell, 2003; Nazarov vd., 2004).
Tablo 3.1 Fibroin iskelenin gözenek boyutu ölçümleri (Nazarov vd., 2004)
Metot Örnekler Gözenek boyutu(µm)
Porojen Arındırma NaCl/Fibroin 155 ± 114
Dondurarak Kurutma ( -20°C’de 4 saat)
Fibroin 50 ± 20
Dondurarak Kurutma ( -20°C’de 1 saat)
Fibroin 15 ± 7
Camsı geçiş sıcaklığı üzerinde, çözelti makro gözenekli bir yapı oluşturan buz kristallerinin yavaş büyümesine neden olduğu stabil bir bölgede bulunmaktadır. Camsı geçiş sıcaklığı bölgesinin altında, hızlı dondurma işlemi, buz kristallerinin büyüme süresini kısaltır, bu da büyük buz parçacıklarının büyümesini zorlaştırır, dolayısıyla mikro gözenekli birbirine bağlı yapıların oluştuğu dengesiz bir bölgeye neden olmaktadır (Cunniff, Fossey, Auerbach, Song, 1993; Ishaug, Crane, Miller, Yasko ve Yaszemski, 1997; Agrawal ve Ray, 2001; Hubbell, 2003; Nazarov vd., 2004).
Dondurarak kurutma ile hazırlanan iskeleler, incelenen değişkenlere bakılmaksızın % 99'luk gözenekliliklere neden olmuştur. Tuz linçi:porojen arındırma (porojen maddeyi değiştirerek) ve gaz köpürtme yöntemi sonucunda, gözenekler 84 µm’dir. Dondurarak kurutulmuş iskelelerin yapısı, köpük benzeri ve çok gözeneklidir (Nazarov vd., 2004).
Yüksek oranda 3B gözenekli ağlar oluşturmak için kullanılan başka bir yol da, kriyotropik jelleşme veya kriyojenizasyon olarak bilinen düşük sıcaklıklı jelleştirme tekniğidir. Bu yöntem Lozinsky ve çalışma arkadaşlarının öncü çalışmalarından bu yana, bir yüksek sıcaklık ve süper hızlı tepki veren makro gözenekli jeller (kriyojeller) üretmek için yaygın olarak kullanılan bir kriyolasyon tekniğidir.
Bu teknikle, polimerizasyon ve/veya çapraz bağlanma reaksiyonları gerçekleştirilmektedir.
Kimyasal bir çapraz bağlayıcı içeren sulu polimer çözeltisinin dondurulması sırasında, polimer zincirleri ve çapraz bağlayıcı molekülleri, buz kristalleri arasındaki sıvı kanallar içindeki buz konsantratından dışarı atılır, böylece çapraz bağlanma reaksiyonları sadece bu donmamış bölgeler içinde ilerlemektedir. Çapraz bağlandıktan ve buz çözüldükten sonra, mikro yapısı oluşan buzun negatif kopyası olan makro gözenekli bir malzeme üretilmektedir (Cunniff, Fossey, Auerbach, Song, 1993; Ishaug, Crane, Miller, Yasko ve Yaszemski, 1997; Ishaug-Riley, Crane-Kruger, Yazemski ve Mikos, 1998; Agrawal ve Ray, 2001; Hubbell, 2003; Yeo, Lee, Lee ve Kim, 2003; Hino, Tanimoto ve Shimabayashi, 2003; Nazarov vd., 2004).
Faz ayırma tekniği ile hazırlanan mekanik olarak zayıf makro gözenekli jellerin aksine kriyojenler çok serttir ve kalıcı deformasyon veya kırılma olmaksızın çok büyük suşlara dayanmaktadır. Bu teknik ile % 90 gözeneklilik ve sıkıştırma sonrası yüksek mekanik stabilite gösteren makro gözenekli fibroin kriyojenler üretilmiştir. Zayıf ve kırılgan fibroin hidrojellerinin aksine, kriyojellerin içinde su bulunduğu kriyojenler çatlak oluşmadan yaklaşık % 100 suşa kadar sıkıştırılabilmektedir. Sıkıştırılmış kriyojel, orijinal şeklini geri kazanmak için boşaltma sırasında hemen şişmektedir. Fibroin kriyojellerin dondurarak kurutulmasıyla elde edilen çökeltiler, sentez parametrelerine bağlı olarak 50 ila 10 um arasında değişen, birbiriyle bağlantılı çaplarda gözenekler içermektedir. 50 MPa'ya kadar çok yüksek bir basınç modülü sergilemektedirler ve bu da onları kemik doku iskelesi materyalleri olarak iyi bir aday haline getirmektedir (Ak, Öztoprak, Karakutuk ve Okay, 2013).
Fibroin kriyojellerinin şişmesi, esnekliği ve ağ yapısı incelendiğinde ise, jel örnekleri standart fibroinlere göre daha fazla sıkıştırıldığı için önemli farklar gözlemlenmiştir. Fibroin hidrojel, 50°C'de, düşük deformasyon altında kırılarak, uygulanan mekanik stresin, etkili dağılım olmadan lokalize olduğunu göstermektedir. Önemli nokta, kriyojenin pistonun altında veya el ile sıkıştırılmasıyla, jelin tüm suyu serbest bırakarak tamamen sıkıştırılabilmesidir.
Kriyojellerde hiçbir enerji dağıtma mekanizması kullanılmamasına rağmen, stres altındaki gözeneklerden suyun salınması büyük deformasyon oranlarında çatlak oluşumunu önlemektedir. Yükün serbest bırakılmasından sonra jel örneği, serbest bırakılan suyu emerek orijinal şeklini hemen geri kazanmaktadır.
Sıkıştırılmış kriyojel, orijinal şeklini geri kazanmak için boşaltma sırasında hemen şişmektedir. Sıkıştırma döngülerinin % 0 ile % 99,8 arasında değişmesi, fibroin kriyojellerin ayırma işlemlerinde kullanılabileceğini düşündürmektedir. Kriyojellerin dondurularak kurutulması ile elde edilen çökeltiler, sentez parametrelerine bağlı olarak 50 ila 10 um arasında değişen, birbiriyle bağlantılı çaplarda gözenekler içermektedir (Ak, Öztoprak, Karakutuk ve Okay, 2013).
Fibroin çözeltileri veya fibroin iskeleler sterilizasyon işlemlerinde kullanılan sıcaklık ve basınç değerlerine maruz bırakıldığında herhangi bir çapraz bağlayıcı veya reaktif kullanmadan gözenek yapısının arttığı, beta sheet (beta tabakalar)ın arttığı, bağların farklı şekillerde kırılarak yeni bağlar oluşturduğu ve bu sayede mekanik mukavemet kazandığı yapılan çeşitli çalışmalar ile tesbit edilmiştir. Otoklavlama yöntemi, ipek fibroinin kritik yapısal yeniden düzenlemelerine yol açarak, bozunma ve mekanik özellikleri etkilemektedir (Hofmann, Stok, Kohler, Meinel ve Müller, 2014).
3.2. Buharlı Otoklav Yöntemi
İskeleler kuru halde, su ile nemlendirildikten sonra nemli halde, su içerisine daldırıldıktan sonra ıslak halde cam petri kaplarda paketlenmiştir. Buhar sterilizasyonu 121 °C'de ve 20 dakika boyunca 1 bar basınçta gerçekleştirilmiştir.
3.3. Kuru Hava Etüvlerinde Isıl Sterilizasyon
Kuru iskeleler bir cam petride paketlenmiş ve etüvde 30 dakika 180 ° C'de ısıyla sterilize edilmiştir (Hofmann vd.,2014). Sterilizasyon işlemleri sonucunda elde edilen iskelelerin muhtemel yapısal görüntüleri Şekil 3.1’te verilmiştir.