T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
2-AMĠNOPRĠDĠN’ĠN CAMSI KARBON ELEKTROT YÜZEYĠNDE TEMAS AÇISI ÖLÇÜM TEKNĠĞĠYLE ÖZELLĠKLERĠNĠN ĠNCELENMESĠ
Tolga DURAN YÜKSEK LĠSANS TEZĠ KĠMYA ANABĠLĠM DALI
T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
KĠMYA ANABĠLĠM DALI
2-AMĠNOPRĠDĠN’ĠN CAMSI KARBON ELEKTROT YÜZEYĠNDE TEMAS AÇISI ÖLÇÜM TEKNĠĞĠYLE ÖZELLĠKLERĠNĠN ĠNCELENMESĠ
Tolga DURAN
YÜKSEK LĠSANS TEZĠ
KĠMYA ANABĠLĠM DALI BÖLÜMÜ
KONYA, 2009
Bu tez,…/…/….. tarihinde aĢağıdaki jüri tarafından oybirliği/oyçokluğu ile kabul edilmiĢtir.
Doç Dr. Zafer YAZICIGĠL (DanıĢman)
………..
Prof. Dr. Mustafa ERSÖZ Prof. Dr. Yunus ÇENGELOĞLU ……… ……..………
ÖZET
Yüksek Lisans Tezi
2-AMĠNOPRĠDĠN’ĠN CAMSI KARBON ELEKTROT YÜZEYĠNDE TEMAS AÇISI ÖLÇÜM TEKNĠĞĠYLE ÖZELLĠKLERĠNĠN ĠNCELENMESĠ
Tolga DURAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü
Kimya Bölümü
DanıĢman: Doç. Dr. Zafer YAZICIGĠL 2009, 74 sayfa
Jüri: Doç. Dr. Zafer YAZICIGĠL Prof. Dr. Mustafa ERSÖZ
Prof. Dr. Yunus ÇENGELOĞLU
Bu çalıĢmada, 2-Amino Piridin’in (2AP) Camsı Karbon (GC) Elektrot yüzeyi üzerinde sulu ortamda, dönüĢümlü voltametri tekniği (CV) ile elektrokimyasal modifikasyonu gerçekleĢtirilmiĢ ve elde edilen yüzeyin (2AP-GC) özellikleri, yalın GC yüzeyinin özellikleri ile karĢılaĢtırılmıĢtır. Sulu ortam çalıĢmalarında pH= 7 olan Britton Robinson (BR) tampon çözeltisi kullanılmıĢtır. Yüzey modifikasyonu, +0,5/+1,9 V potansiyel aralığında, 100 mV/s tarama hızında ve 30 döngülü olarak gerçekleĢtirilmiĢtir. Yalın GC ve 2AP-GC yüzeylerinin, redoks problar varlığında CV tekniğiyle elektrokimyasal, elektrokimyasal impedans spektroskopisi (EIS) ve temas açısı ölçüm (CAM) tekniğiyle spektroskopik olarak karakterizasyonları yapılmıĢtır. Elektrokimyasal karakterizasyonda sulu ve susuz ortam redoks problarından faydalanılmıĢ, spektroskopik karakterizasyonda ise EIS tekniği ile yüzeylere ait simülasyonlar yapılıp uygun devreler çizilmiĢtir. CAM tekniği ile de yüzeylerin hidrofilik/hidrofobik özellikleri, enerjisi ve pH’ı tespit edilmiĢtir. 2AP-GC’ye ait uygulama alanı bulabilmek amacıyla Cu+2
çözeltisi ile 2AP-GC yüzeyin metal adsorplama özellikleri araĢtırılmıĢtır.
Anahtar kelimeler: 2-Amino piridin, DönüĢümlü Voltametri, Yüzey Modifikasyonu, Temas
ABSTRACT
Master Thesis
THE INVESTIGATION OF PROPERTĠES OF 2-AMĠNO PYRĠDĠNE ON GLASSY CARBON ELECTRODE SURFACE WITH CONTACT ANGLE
MEASUREMENT TECHNIQUE
Tolga DURAN Selçuk University
Graduate School of Natural and Applied Sciences Department of Chemistry
Supervisor: Ass. Prof. Dr. Zafer YAZICIGĠL 2009, 74 pages
Jury: Ass. Prof. Dr. Zafer YAZICIGĠL Prof. Dr. Mustafa ERSÖZ
Prof. Dr. Yunus ÇENGELOĞLU
In this study, the electrochemical modification of 2-Amino pyridine (2AP) on glassy carbon (GC) electrode surface was realized in aqueous solution with cyclic voltammetry (CV) technique and the comparison of the obtained surface in the point of its properties was made with bare GC. The pH=7 Britton Robinson (BR) buffer solution was used in aqueous media experiments. Surface modification was realized in +0.5/+1.9 V potential range, 100 mV/s scan rate as 30 cycle. Both of the surfaces were characterized with CV in the presence of redox probes as electrochemically; electrochemical impedance spectroscopy (EIS) and contact angle measurement as spectroscopically. The aqueous and non-aqueous redox probes gave in benefit for electrochemical characterizations and in addition to this, simulations belonged to EIS technique were made and suitable circuits were drawn. On the other hand the hydrophilic/hydrophobic properties, energy and pH of surfaces were determined with contact angle measurement. In order to find an application area for modified surfaces, the adsorption properties of modified surfaces with Cu+2 solution were investigated.
Keywords: 2-Amino Pyridine, Cyclic Voltammetry, Surface Modification, Contact Angle
ÖNSÖZ
Bu çalıĢma, Selçuk Üniversitesi Fen–Edebiyat Fakültesi Kimya Bölümü öğretim üyelerinden Doç. Dr. Zafer YAZICIGĠL danıĢmanlığında tamamlanarak, Selçuk Üniversitesi Fen Bilimleri Enstitüsü’ne Yüksek Lisans Tezi olarak sunulmuĢtur.
Yüksek lisans tezimi yöneten ve çalıĢmamın her safhasında yakın ilgi ve yardımlarını esirgemeyen değerli danıĢman hocam Doç. Dr. Zafer YAZICIGĠL’e sonsuz saygı ve Ģükranlarımı sunarım.
Tez çalıĢmalarım boyunca devamlı yardım ve desteğini gördüğüm, bilgi ve deneyimleri ile tezimin her aĢamasında yardımlarını esirgemeyen değerli hocam ArĢ. Gör. Dr. Yasemin ÖZTEKĠN’e teĢekkür ederim.
ÇalıĢmalarım süresince ettikleri maddî ve manevî yardımlarının yanı sıra her türlü sorularıma cevap bulabilmeme yardımcı olan Selçuk Üniversitesi Kimya Bölümü Yüksek Lisans öğrencisi arkadaĢlarım Ġlker AKIN ve Tuğçe GÖVER’e ayrı ayrı saygı ve Ģükranlarımı sunarım.
Bu tez çalıĢmasını 09201064 Numaralı proje ile maddi olarak destekleyen S. Ü. Bilimsel AraĢtırma Projeleri Koordinatörlüğüne teĢekkür ederim.
Ayrıca, tez çalıĢmalarım süresince manevi desteklerini hiçbir zaman esirgemeyen, bana güvendiklerini her zaman hissettiğim ve her zaman yanımda olduklarını bildiğim anneme, babama, kardeĢlerime ve niĢanlıma sonsuz teĢekkür ederim.
Tolga DURAN Konya, 2009
ĠÇĠNDEKĠLER ÖZET ... III ABSTRACT ... III ÖNSÖZ ... IV ĠÇĠNDEKĠLER ... VI ġEKĠLLER DĠZĠNĠ ... VIII TABLOLAR DĠZĠNĠ ... XI KISALTMALAR VE SEMBOLLER ... XII
1. GĠRĠġ ... 1
1.1.ELEKTROANALĠTĠK TEKNĠKLER VE SINIFLANDIRILMASI ... 2
1. 2. 1. Dönüşümlü voltametri... 10
1. 2. 1. 1. Tersinir reaksiyonlar ... 11
1. 2. 1. 2. Tersinmez reaksiyonlar ... 15
1. 2. 1. 3. CV ile adsorpsiyon olayının incelenmesi ... 17
1. 2. 1. 4. CV ile elektrot reaksiyon mekanizmasının belirlenmesi ... 19
1. 2. 2. Puls Teknikleri ... 22
1. 2. 2. 1. Diferansiyel puls voltametrisi (DPV)... 23
1.3.MODĠFĠYE ELEKTROTLAR ... 24
1. 3. 1. Modifikasyon Metotları... 25
1.4.PĠRĠDĠN ... 29
1.5.YÜZEY ANALĠZĠ ... 29
1. 5. 1. Yüzey serbest enerjisi ve yüzeylerin reaktivitesi ... 30
1. 5. 2. Temas açısı ... 31
1. 5. 3. CA ölçümleri ... 32
1. 5. 4. Yüzey serbest enerjisi ölçümü ... 32
1. 5. 4. 1. Zisman yaklaĢımı ... 33
1. 5. 4. 2. Saito yaklaĢımı ... 33
1. 5. 4. 3. Adezyon kuvvetleri ... 34
1. 5. 4. 4. Berthelot yaklaĢımı ... 34
1. 5. 4. 5. Geometrik Anlamda ve Harmonik Anlamdaki (Wu) YaklaĢımları 35 1. 5. 4. 6. Fowkes YaklaĢımı ... 36
1. 5. 4. 7. Asit-Baz yaklaĢımı ... 37
1. 5. 5. Elektrokimyasal impedans spektroskopisi ... 37
2. KAYN AK ARAġTIRMASI... 40
3. MATERYAL VE METOT ... 42
3.1. 2-AMĠNO PĠRĠDĠN ÇÖZELTĠSĠNĠN HAZIRLANMASI ... 42
3.2.KULLANILAN DĠĞER KĠMYASAL MADDELER ... 42
3.4.ÇALIġMADA KULLANILAN ELEKTROTLARIN TEMĠZLENMESĠ ... 44
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 46
4.1.ELEKTROKĠMYASAL MODĠFĠKASYON ... 46
4.2.YALIN GC VE 2AP-GCYÜZEYLERĠN KARAKTERĠZASYONU ... 46
4. 2. 1. Yalın GC ve 2AP-GC yüzeylerin elektrokimyasal karakterizasyonu ... 46
4. 2. 2. Yalın GC ve 2AP-GC yüzeylerin spektroskopik karakterizasyonu ... 49
4. 2. 2. 1. Elektrokimyasal impedans spektroskopisi (EIS) ile karakterizasyon ... 49
4. 2. 2. 2. Temas açısı ölçüm tekniği ile karakterizasyon ... 51
4.3.METAL UYGULAMASI ... 57
5. SONUÇ VE ÖNERĠLER ... 59
6. KAYNAKLAR ... 61
ġEKĠLLER DĠZĠNĠ
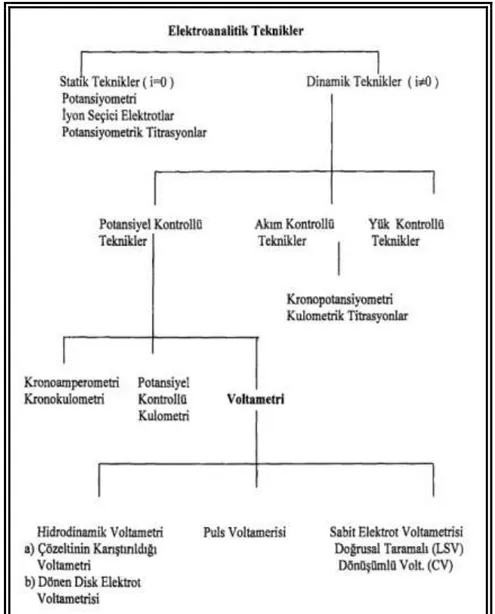
ġekil 1. 1. Elektroanalitik Tekniklerin Sınıflandırılması ġekil 1. 2. Uyarma Sinyalleri
ġekil 1. 3. Hava ile doyurulmuĢ 0,1M KCl çözeltisinde oksijenin indirgenme voltamogramı. Alttaki eğri, çözeltiden azot gazı geçirilerek oksijenin uzaklaĢtırıldığı 0,1M KCl içindir.
ġekil 1. 4. DönüĢümlü voltametrik uyarma sinyali
ġekil 1. 5. a) DönüĢümlü voltametride elektroda uygulanan gerilim programı ġekil 1. 5. b) Elde edilen akım-gerilim eğrisi
ġekil 1. 6. Yarı tersinir bir elektrot reaksiyonunda pik akımının potansiyel tarama hızının karekökü ile değiĢimi.
ġekil 1. 7. Ürünün kuvvetli adsorbsiyonunda gözlenen ön pik
ġekil 1. 8. Ürünün kuvvetli adsorpsiyonunda gözlenen ön pikin tarama hızı ile değiĢimi
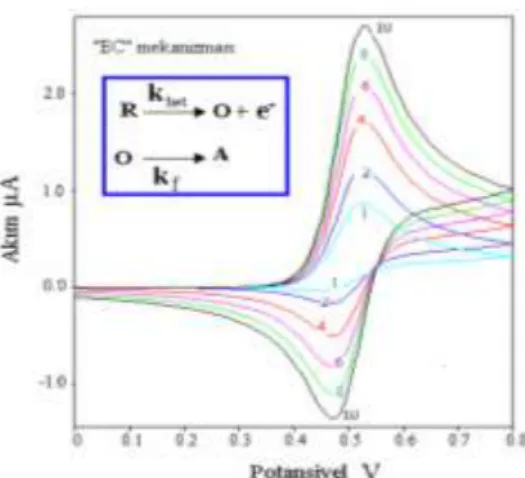
ġekil 1. 9. “EC”mekanizmasının bulunduğu bir proseste, pik akımlarının, tarama hızı ile nasıl değiĢtiğini göstermektedir
ġekil 1. 10. “EC” mekanizması gösteren çoklu tarama yapılmıĢ voltamogram örneği
(v=0,1 0,5 1,0 2,0 V/s)
ġekil 1. 11. Diferansiyel Puls Polarografi için uyarma sinyalleri ġekil 1. 12. Diazonyum tuzu indirgenmesi ile elde edilen yüzey ġekil 1. 13. Amin oksidasyonu yöntemi ile elde edilen yüzey ġekil 1. 14. Alkol oksidasyonu yöntemi ile elde edilen yüzey
ġekil 1. 15. Sıvı molekülleri ve moleküllerin birbirleriyle olan etkileĢim kuvvetleri ġekil 1. 17. Bir katı üzerinde iki farklı sıvı damlası
ġekil 1. 18. Zisman grafiği
ġekil 1. 19. Randles devresinin Ģematik gösterimi
ġekil 4. 1. pH=7 BR ortamında, 0,5/1,9V potansiyel aralığında 100mV/s tarama hızında, 30 döngülü 2AP modifikasyon voltamogramı.
ġekil 4. 2. Yalın GC ve pH=7 BR ortamında 2AP ile modifiye edilmiĢ GC yüzeyinin ferrosen voltamogram karĢılaĢtırması
ġekil 4. 3. Yalın GC ve pH=7 BR ortamında 2AP ile modifiye edilmiĢ GC yüzeyinin HCF (III) voltamogramı
ġekil 4. 4. Yalın GC ve pH=7 BR ortamında 2AP ile modifiye edilmiĢ GC yüzeyinin Rutenyum voltamogramı
ġekil 4. 5. ÇeĢitli tarama hızlarında, 0,5/1,9V tarama aralığında pH=7 BR ortamında 2AP ile modifiye edilmiĢ GC yüzeyine ait modifikasyon voltamogramlarının ilk döngüsü
ġekil 4. 6. Tersinirlik çalıĢmasında, tarama hızının logaritmasına karĢılık, Pik akımının logaritması grafiği
ġekil 4. 7. Tersinirlik çalıĢmasında, pik akımına karĢılık, tarama hızının karekökü grafiği
ġekil 4. 8. (a) GC ve BR pH=7 ortamında elde edilen 2AP-GC’nin Nyquist eğrisi çakıĢtırması
ġekil 4. 8. (b) Yalın GC’nin Nyquist eğrisinin simülasyonu ġekil 4. 8. (c) 2AP-GC’nin Nyquist eğrisinin simülasyonu
ġekil 4. 8. (d) Yalın GC yüzeyine ait Warburg devresi ve değerleri ġekil 4. 8. (e) 2AP-GC yüzeyine ait CPE devresi ve değerleri.
ġekil 4. 8. Aynı pH değerlerinde yalın GC ile 2AP-GC yüzeylerinin temas açısı farkını gösteren Temas açısı – pH grafiği
ġekil 4. 9. ÇeĢitli sürelerde Cu+2
çözeltisinde bekletilen, 2AP-GC yüzeylerinin DPV sıyrılma voltamogramları
ġekil 4. 10. ÇeĢitli sürelerde BR pH=5 tampon çözeltisinde bekletilen 2AP-GC yüzeyinin DPV sıyrılma voltamogramları
TABLOLAR DĠZĠNĠ
Tablo 1. 1. Bazı çözücülerin dielektrik sabitleri Tablo 1. 2. Piridinin kimyasal özellikleri
Tablo 1. 3. 2-Amino piridin’in kimyasal özellikleri Tablo 3. 1. Elektrokimyasal analizörlerin özellikleri Tablo 3. 2. KSV CAM 200 cihazının özellikleri
Tablo 4. 1. Tarama hızlarına göre pik akımı yükseklikleri Tablo 4. 2. Su temas açısı ölçüm sonuçları
Tablo 4. 3. Kullanılan çözücülerin temas açısı ortalamaları Tablo 4. 4. Farklı metotlara göre GC için yüzey enerjisi değerleri Tablo 4. 5. Farklı metotlara göre 2AP-GC için yüzey enerjisi değerleri Tablo 4. 6. Yalın GC ve pH=7 BR ortamında elde edilen 2AP-GC yüzeyinin çeĢitli pH’larda temas açıları
ġekil 4. 8. Aynı pH değerlerinde yalın GC ile 2AP-GC yüzeylerinin temas açısı farkını gösteren Temas açısı – pH grafiği
Tablo 4. 7. CuCl2.2H2O ve BR pH=5 ortamında bekletilen 2AP-GC yüzeyinin DPV
KISALTMALAR ve SEMBOLLER GC : Camsı Karbon
2AP: 2-Amino Piridin
BR: Britton-Robinson Tampon Çözeltisi θ: Temas Açısı
CA: Temas Açısı
CAM: Temas Açısı Ölçümü CV: DönüĢümlü Voltametri
DPV: Difrannsiyel Puls Voltametrisi
EIS: Elektrokimyasal Ġmpedans Spektroskopisi DC: Doğrusal Akım mV: Milivolt ms: Milisaniye V: volt v: Tarama hızı, V/s n: mol sayısı E: Potansiyel E0: Standart Potansiyel Ip: Akım Yoğunluğu, A/cm2
C0: O türünün ana çözelti konsantrasyonu, mol/cm3
D : Difüzyon katsayısı, cm2/s R: Reaksiyon sonunda oluĢan ürün SFE: Yüzey Serbest Enerjisi
γ
sd
:
Dispersif yüzey gerilimiγ
sp
γ
s Tot:
Toplam yüzey gerilimiγ
lv:
Sıvı-gaz arasındaki yüzey gerilimiQ: Yüzey kaplanma oranı
γ
sl:
Sıvı- katı arasındaki yüzey gerilimi1. GĠRĠġ
Analitik Kimya, son 30 yıl içerisinde önemli geliĢmelere sahne olmuĢtur. Bir yandan sağlık, çevre, endüstri, adli tıp gibi alanların artan ihtiyaç ve talepleri bu geliĢmeleri zorlarken diğer yandan da elektronik teknolojisindeki yenilikler, bu ihtiyaç ve talepleri karĢılamak için yeni imkânlar sundu. Ġmkânlar taleplerle doğru zamanda buluĢunca beklenen geliĢmeler yaĢandı ve ortaya farklı bir analitik kimya çıktı. Geçen yüzyılın son çeyreğine kadar kimya alanının kavramlarını kullanarak düĢünen ve nispeten az bir fizik bakıĢı ile yetinen analitik kimyacılar, Ģimdilerde özellikle elektronikten ve istatistikten yeni kavramlar ödünç alma gereği duyuyor. Analitik Kimya, endüstrinin, tıbbın ve fen bilimlerinin her alanlarında kullanılır. Çevremizde gördüğümüz birçok alanda nicel ve nitel ölçüm sonuçlarını değerlendirerek, yaĢam kalitesini arttırmaya yönelik geliĢmelere açık, ekonomik geliĢmelere de cevap verebilen bir bilimdir. Analitik kimya, malzeme biliminden, tıp alanına kadar birçok bilim dalının geliĢmesinde önemli bir rol oynamaktadır. Bu geliĢmeleri incelemek için yüzey kimyası ve elektrokimyasal teknikler oldukça önemli bir rol oynamaktadır. Nanoteknoloji alanındaki geliĢmeler ile spektroskopik tekniklerin hızla değiĢen hassasiyet ve görüntüleme derecesi bu alanda yapılan çalıĢmaları hızlandırmıĢtır. Bu doğrultuda elde edilen çeĢitli yüzeyler, çeĢitli yöntemler ile karakterize edilerek istenen özellikte modifiye yüzeyler elde edilmiĢtir. Bu yüzeylerden faydalanılarak tıbbi ve kimyasal numunelerin daha yüksek hassasiyetle, daha düĢük maliyetlerle ve ppm veya ppb seviyesindeki konsantrasyonlarda bile rahat bir ölçümü sağlanmıĢtır. Bunun yanı sıra elde edilen modifiye yüzeyler incelenerek, metalürji alanında da önem teĢkil eden geliĢmelere sebep olmuĢtur (Skoog, 2004).
Bu çalıĢmada piridin türevi olan 2-Aminopiridin’in (2AP) elektrokimyasal davranıĢları elektrokimyasal tekniklerle ve spektroskopik tekniklerle incelenmiĢtir. 2AP, elektrokimyasal yöntemlerle Camsı Karbon (GC) yüzeyine kaplanarak, elde edilen modifiye elektrot yüzeyinin (2AP-GC) elektrokimyasal karakterizasyonu yapılmıĢ, 2AP-GC’nin yüzey pH’sı, hidrofillik/hidrofobikliği ve yüzey enerjisi değiĢimi çeĢitli yaklaĢımlarla incelenmiĢtir. ÇalıĢmada, 2AP maddesinin analitik saflıkta olması, kullanılan cam ve diğer malzemelerin temiz olması, çözelti ortamından geçirilen gazın yüksek saflıkta olması ve istenmeyen bir safsızlık
yaratmamasına özen gösterilmiĢ, ayrıca modifikasyon ve karakterizasyon iĢleminde kullandığımız cihazların kalibrasyonuna dikkat edilmiĢtir. ÇalıĢmanın elektrokimyasal kısımları Selçuk Üniversitesi Fen Fakültesi Kimya Bölümüne ait Analitik Kimya AraĢtırma Laboratuarında Doç. Dr. Zafer YAZICIGĠL denetiminde gerçekleĢtirilmiĢtir. Temas açısı, yüzey enerjisi ve yüzey pH’sının ölçümleri Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü’nde gerçekleĢtirilmiĢtir.
1. 1. Elektroanalitik Teknikler ve Sınıflandırılması
Elektrokimyasal teknikler, var olan bir çözelti sistemine elektriksel bir etki uygulanması sonucunda, sistemin verdiği tepkinin ölçülmesi esasına dayanır. Genelde akım olarak tepki veren bu cevap, hazırlanmıĢ olan sistem hakkında bilgi verir. Kullanılan tekniğin ismine bakılarak, sistemden alınan cevabın türü ve akım anlaĢılabilir ve bütün elektrokimyasal tekniklerde potansiyel, akım ve zaman gibi parametreler bulunur ve tekniğin ismi bu parametrelere göre isimlendirilir ve kullanılacak teknik hakkında genel bir bilgi edinilebilir. Elektroanalitik tekniklerin sınıflandırılması için çeĢitli metotlar vardır ancak en yaygın sınıflandırma ġekil 1. 1.’de verilmiĢtir. Verilen Ģemada gösterilen elektroanalitik teknikler, genelde net akımın sıfır olduğu denge durumundaki statik metotlar ve denge durumundan uzakta net akımın gözlendiği dinamik metotlar olmak üzere ikiye ayrılır. Sınıflandırılan tekniklerin büyük kısmı akımın veya potansiyelin kontrol edilebildiği tekniklerdir. Potansiyel ve akım kontrolünün esas olduğu bu tekniklerde, bu parametreler büyük aralıklı ve küçük aralıklı olarak uygulanır. Elektroanalitik teknikler ucuz olması, seçici olması, az miktardaki numunelerin analizlerinin yapılabilmesi, alt tayin sınırının düĢük olması, doğrusallık aralığının geniĢ olması ve çok farklı elektrotlarla çalıĢılabilmesi gibi üstünlükler açısından geniĢ kullanım alanlarına sahiptir. Belirtilen bu üstünlüklerinden dolayı, kalitatif analizler, kantitatif analizler, elektrot mekanizmalarını belirlenmesi, kimyasal ve elektrokimyasal reaksiyon kinetiklerinin incelenmesi, adsorbsiyon olaylarının incelenmesi, denge sabitlerinin bulunması, difüzyon katsayılarının bulunması ve standart indirgeme potansiyellerinin belirlenmesi gibi kullanım alanları mevcuttur.
DönüĢümlü Voltametride (CV), asılı duran cıva elektrodu veya baĢka bir katı elektroda uygulanan potansiyel kontrol edilir ve hücreden küçük bir akım geçer. Bu
nedenle dönüĢümlü voltametri, bir potansiyel kontrollü sabit elektrot voltametri metodudur.
ġekil 1. 1. Elektroanalitik Tekniklerin Sınıflandırılması 1. 2. Voltametri
Elektrot potansiyelinin değiĢmesiyle elektrolitik hücreden geçen akımın ölçülmesine dayanan elektroanalitik metotlara genel olarak Voltametri adı verilir. Bir baĢka değiĢle elektrodun polarize olduğu Ģartlar altında akımın, uygulanan potansiyelin bir fonksiyonu olarak ölçülmesinden faydalanılarak, analit hakkında bilgi edinilen bir grup elektroanalitik tekniklere verilen genel isimdir (Skoog, 2004). Potansiyeli değiĢen elektrot, çalıĢma elektrodu olarak adlandırılır. Genellikle polarizasyonu sağlamak için, voltametri de çalıĢma elektrotları, yüzey alanı pek çok
uygulamada birkaç milimetrekare ve bazılarında ise birkaç mikrometrekare olan mikro elektrotlardır. Voltametride çeĢitli çalıĢma elektrotlar kullanılır. Bu elektrotlar, platin, altın, paladyum, nikel, grafit, camsı karbon, karbon pasta, civa v.b. elektrotlardır. ÇalıĢma elektrodu üzerinde maddelerin indirgenmesinden dolayı oluĢan akıma katodik akım, yükseltgenmesinden dolayı oluĢan akıma anodik akım denir. ÇalıĢma elektrodu; incelenen elektrokimyasal olayın gerçekleĢtiği elektrottur ve iĢlevi elektrokimyasal ölçüm bölgesini oluĢturmaktır. Bu elektrotlar amaca bağlı olarak soy (inert) veya soy olmayan metallerden seçilebilir. Camsı karbon, platin, altın, asılı civa damla elektrodu (HMDE) ve civa film elektrot (MFE) voltametride tercih edilen çalıĢma elektrotlarıdır. Genel olarak bir çalıĢma elektrodu, iletken özellikte, çalıĢılan potansiyel aralığında inert, negatif potansiyel sınırı yüksek ve istenilen geometrik Ģekil kolaylıkla verilebilir ve kolay iĢlenebilir özellikte olmalıdır (Skoog, 2004).
Potansiyeli deney süresince sabit kalan elektrot, referans elektrottur. Bu elektrot polarizlenmeyen elektrot olarak da tanımlanır. Referans elektrodun potansiyeli yeterince sabit olup, pil hücresinde potansiyeli ölçülen diğer elektrotlara kıyasla bir karĢılaĢtırma görevi görür. Yeterince sabit teriminden kasıt, potansiyelindeki değiĢimin akım, zaman ve değiĢkenlerdeki değiĢmelerden minimum ölçüde etkilenmesidir. Bu elektrotlar genel olarak ikinci türden metalik elektrotlar olarak bilinirler. Referans elektrot olarak Ag/Ag+, Ag/AgCl, standart hidrojen elektrodu ve doygun kalomel elektrot yaygın Ģekilde kullanılır. Genel olarak ideal bir referans elektrot, tersinir olmalı ve Nernst EĢitliğine uymalı, potansiyeli zamanla değiĢmemeli, az miktarda akım geçmesi ile potansiyelde değiĢme olmamalı ve potansiyeli sıcaklık değiĢiminden fazla etkilenmemelidir.
Üçüncü elektrot yardımcı elektrottur bir diğer ifadeyle karĢıt elektrottur. Görevi, elektronlar için kaynak veya havuz oluĢturmak ve böylece pilden akımın geçmesini sağlamaktır. Çoğunlukla potansiyeli ölçülmez ve bilinmez. Genellikle soy metallerden seçilir.
Voltametri, tam deriĢim polarizasyonu Ģartlarında bir elektrokimyasal hücrede oluĢan akımın ölçülmesine dayanır. Bunun aksine potansiyometrik ölçümler, akımın sıfıra yaklaĢtığı ve polarizasyonun olmadığı Ģartlarda yapılır. Voltametri, deriĢim polarizasyonunun etkilerini en aza indirmek ya da gidermek için gerekli
tedbirlerin alınması yönünden elektrogravimetri ve kulometriden farklılık göstermektedir. Ayrıca voltametride analit minimum miktarda harcanırken, elektrogravimetri ve kulometride, analit tamamen baĢka bir maddeye dönüĢür (Skoog, 2004).
Voltametri, Çekoslovak kimyacı Jaroslav Heyrovsky tarafından 1920’lerin baĢlarında geliĢtirilen ve voltametrinin özel bir tipi olan Polarografi tekniğine dayanarak geliĢtirilmiĢtir (Heyrovsky 1922). Voltametrinin önemli bir kolu olan polarografinin diğer voltametrik tekniklerden en büyük farkı, çalıĢma mikro elektrodu olarak damlayan cıva elektrot kullanmasıdır.
Voltametri, anorganik, fiziko ve biyokimyacılar tarafından, çeĢitli ortamlarda meydana gelen yükseltgenme ve indirgenme iĢlemlerinin incelenmesi, yüzeylerdeki adsorbsiyon iĢlemlerinin araĢtırılması ve kimyasal olarak modifiye edilmiĢ elektrot yüzeylerindeki elektron aktarım mekanizmalarının aydınlatılması gibi temel çalıĢmalar için oldukça yaygın bir Ģekilde kullanılmaktadır. Analitik amaçlarla, değiĢik voltametrik uygulamalar kullanılmaktadır. Sıyırma voltametrisi, günümüzde eser analitik yöntemlerden biri olup özellikle çevre numunelerinde metal tayini için kullanılır. Diferansiyel puls polarografisi ve hızlı taramalı voltametri, farmasötik numunelerdeki tayinlerde önemlidir. Yüksek Performanslı Sıvı Kromatografi (HPLC) ve kapiler elektroforez tekniklerinde voltametrik ve diğer elektrokimyasal dedektörler sıklıkla kullanılmaktadır (Skoog, 2004). Sensör teknolojisinde ve biyolojik açıdan önemli reaksiyonların ve titrasyonların izlenmesinde, amperometrik teknikler oldukça yaygın kullanılmaktadır. Modern voltametrik teknikler, redoks ve adsorbsiyon süreçleri üzerinde çalıĢan çeĢitli alanlardaki kimyacılar tarafından kullanılan güçlü bir araçtır.
Voltametri de, çalıĢma elektrodunun voltajı, sistematik olarak değiĢtirilirken, akım ölçülür. Elektroda, zamana göre değiĢimi çok farklı voltajlar uygulanabilir ve voltaj-zaman fonksiyonlarına uyarma sinyali denir. Bu sinyallerin en basiti, çalıĢma elektrodunun potansiyelinin zamanla değiĢtirildiği doğrusal taramadır. Tipik olarak, çalıĢma elektrodunun potansiyeli 1-2 volt değiĢtirilir. Yaygın olarak kullanılan diğer dalga formları, pulslu dalga formları ve üçgen dalga formlarıdır. Voltametri de en çok kullanılan uyarma sinyallerinin dalga Ģekli, ġekil 1. 2.’de verilmiĢtir.
ġekil 1. 2. Uyarma Sinyalleri
Klasik voltametrik uyarma sinyali aĢağıdaki Ģekilde gösterilen doğrusal taramadır; burada hücreye uygulanan DC potansiyeli zamanın bir fonksiyonu olarak doğrusal bir Ģekilde arttırılır. Bu sırada, hücrede oluĢan akım kaydedilir. Diferansiyel puls ve kare dalga puls tipi uyarma sinyallerinde, akımlar bu pulsların ömrü süresince çeĢitli anlarda ölçülür. Üçgen sinyallerde ise biri maksimum biri minimum olan iki nokta arasında değiĢir, bu artma-eksilme süreci ardı ardına tekrarlanırken, potansiyelin bir fonksiyonu olarak akım ölçülür. DönüĢümlü voltametri, çeĢitli Ģartlar altında yükseltgenme-indirgenme reaksiyonlarının mekanizmaları hakkında bilgi veren bir teĢhis aracı olarak önemli uygulamalar bulmuĢtur. Dengedeki bir elektrokimyasal hücreye dıĢarıdan denge potansiyelinden farklı bir potansiyel uygulanırsa, sistem yeniden dengeye ulaĢmaya çalıĢır ve bu sırada bir elektrot tepkimesi olur, yani akım geçer. Voltametrik hücrede yer alan ve alanı çok küçük
olan bir mikro çalıĢma elektrodu ile bir karĢılaĢtırma elektrodu arasına uygulanan ve değeri zamanla değiĢtirilen potansiyele karĢı, çalıĢma elektrodu ile karĢıt elektrot (iki elektrotlu hücrelerde çalıĢma elektrodu ile karĢılaĢtırma elektrodu) arasındaki akım ölçülür. Voltametride, herhangi bir maddenin elektrokimyasal davranıĢını incelemek için elektroda uygulanabilecek potansiyel aralığın sınırları, kullanılan çalıĢma elektrodu, çözücü ve elektrolitin türlerine bağlıdır.
Ġyon seçici elektrotların kullanıldığı metotlar akımın sıfır olduğu statik elektroanalitik metotlardır. Dinamik teknikler grubunda yer alan elektroanalitik teknikler; elektrot reaksiyonlarının mekanizmalarının belirlenmesinde, kinetiklerin incelenmesinde ve maddelerin miktar tayinlerinin yapılmasında kullanılmaktadır.
Elektrokimyasal hücrelerde kullanılan çözücü ve tuz karıĢımları, katı, gaz ve pasta Ģeklinde bulunabilir. Elektrolitler; baĢta çözücü olmak üzere, destek elektrolit, tampon ve yapılacak olan analize uygun diğer maddelerden oluĢabilir. Bu maddelerin her biri elektrokimyasal hücredeki yapılacak her gözlem sonucunu etkiler. Çözücünün varlığı ve özelliği ise en önemli parametredir. Özellikle çözücü seçiminde dikkat edilmesi gereken özellik dielektrik sabitidir ve mümkün olan en yüksek dielektrik sabitine sahip çözücü seçimi uygun olmaktadır. Elektrokimya da en çok kullanılan çözücüler ve dielektrik sabitleri; Tablo 1. 1.’de verilmiĢtir.
Tablo 1. 1. Bazı çözücülerin dielektrik sabitleri Çözücü Su Sülfoksit Dimetil Asetonitril Dimetil
Formamit Aseton Etil Alkol
Dielektrik Sabiti 80,4 46,7 37,5 36,7 20,7 24,3
Voltametrik çalıĢmalarda, ortam içerisine destek elektroliti ilave etmekte yaygın olarak kullanılan bir metottur. Destek elektrolit, ortamın iletkenliğini arttırmak ve elektroaktif maddenin elektrot yüzeyine difüzyonla taĢınmasını sağlamak için kullanılır. Destek elektrolitin, bu görevlerinin yanı sıra pH tamponu veya ortamda var olan iyonları ĢelatlaĢtıran bir ligant görevi vardır.
Kullanılacak numune ya da madde özelliğine bağlı olarak çözücü seçimi polaritesi düĢük çözücülerden yapıldığı takdirde, iletkenliği yeterince sağlayabilmek
için ortama destek elektrolit ilave edilmesi gerekir. Destek elektrolit olarak kullanılabilecek maddeler çeĢitli tuzlar, asit ve bazlardır.
Elektrokimyasal analizlerin birçoğunda çözücü olarak su kullanılmaktadır. Çözücü olarak su kullanılmasının belli avantajları ve dezavantajları vardır. Suyun, ucuz ve kolay bulunabilir bir çözücü olması, çok yüksek saflıkta elde edilebilmesi ve diğer çözücüler göre birçok maddeyi kolaylıkla çözebilmesi açısından avantajları vardır. Ancak buna karĢılık suyun, organik bileĢik içeren makro molekülleri çözememesi ve hidrojen atomu içeren protik bir çözücü olması sebebiyle elektrokimyasal analizlerde dezavantajı vardır. Ortamda proton bulunan bir çalıĢma yapılığında, suyun içerdiği protonlardan dolayı, elektrolitin tamponlanması gerekmektedir.
Elektrolitin çözücü seçimi için bir baĢka yol ise karıĢık çözücü kullanmaktır. Böylece çözücünün çözme özelliği arttırılabilmektedir. Su ile karıĢtırılarak hazırlanan karıĢık çözücüler, genelde sulu çözelti özelliğine sahip olmakla birlikte, kullanımında dikkat edilmesi gereken bazı hususlar vardır. Bu hususlardan ilki referans elektrottur. Referans elektrotların karıĢık çözeltilerde kullanılması durumunda önemsenmeyecek büyüklükte bir sıvı temas potansiyeli ortaya çıkar ve bundan dolayı susuz referans elektrotların kullanılması tercih edilir. Bu konu ile ilgili olarak dikkat edilmesi gereken bir diğer husus ise; ortamın pH kontrolünün sağlanmasıdır. Suyun H atomu ihtiva etmesinden dolayı, çözelti pH’sı kontrol edilmelidir.
Farklı bir reaksiyon mekanizmasının ve protik bir çözücü istenmesi durumunda, susuz protik çözücüler tercih edilmelidir ki bunlar alkoller, inorganik ve organik asitler olabilir. Susuz çözücülerin geneli aprotik çözücülerden oluĢmaktadır ve bunlara erimiĢ tuzlar ve asetonitril örnek verilebilir. Aprotik çözücü seçimindeki temel amaç, kullanılacak olan kimyasal maddenin sadece bu tür çözücü ortamında çözülebilmesinden ileri gelmektedir. Ancak aprotik çözücü kullanımının da belirli dezavantajları vardır. Bunların baĢında kullanılacak aprotik çözücünün saflaĢtırılmasının oldukça zor ve maliyetli bir iĢ olmasıdır. Ayrıca bu tür çözücülerin, deney Ģartlarında veya atmosferde bulunan su veya oksijenle reaksiyon vermesi
sonucunda istenmeyen safsızlıkların oluĢması söz konusudur. Bu reaksiyonları önleyebilmek için, reaksiyon ortamından inert gaz geçirilmelidir.
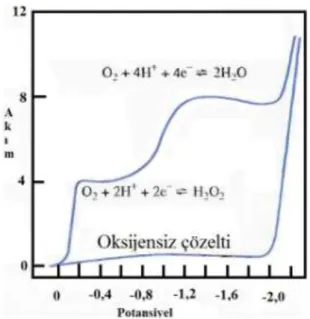
Ortamda çözünmüĢ O2, çeĢitli elektrotlarda kolaylıkla indirgenir; hava ile
doyurulmuĢ sulu bir çözeltide, bu elemente ait iki ayrı dalga gözlenir (ġekil 1. 3.).
ġekil 1. 3. Hava ile doyurulmuĢ 0,1M KCl çözeltisinde oksijenin indirgenme voltamogramı. Alttaki eğri, çözeltiden azot gazı geçirilerek oksijenin uzaklaĢtırıldığı
0,1M KCl içindir.
Bu dalgalardan birincisi oksijenin perokside indirgenmesinden oluĢur: O2(g) + 2H+ + 2e- H2O2
Ġkinci indirgenme ise hidrojen peroksitin indirgenmesine aittir: H2O2 + 2H+ + 2e- 2H2O
Voltametrik ölçümlerde, oksijen varlığı diğer türlerin doğru tayinine çoğunlukla bozucu etki yapar. Bu yüzden, voltametrik iĢlemlerde, ortamdan oksijenin uzaklaĢtırılması genelde ilk basamaktır. Bunu için çözelti ortamından, birkaç dakika inert bir gaz geçirilmesi yeterli olmaktadır. Çoğu zaman azot olan bu inert gaz, oksijenin yeniden adsorbsiyonunu önlemek için analiz süresince çözelti yüzeyinden geçirilir.
Bir elektrokimyasal sistemde, maddeler elektrot yüzeyine, Difüzyon, Elektriksel Göç (Migrasyon), ve Konveksiyon olmak üzere üç farklı metotla taĢınırlar ve deneysel koĢullara bağlı olarak bu olaylardan birisi veya birkaçı kütle aktarımına katkıda bulunabilir. Bir çözeltinin iki bölgesi arasında deriĢim farkı varsa, iyonlar veya moleküller daha deriĢik bölgeden daha seyreltik bölgeye doğru hareket ederler. Bu olay, difüzyon diye adlandırılır ve deriĢim farkı kalmayıncaya kadar devam eder. Bir elektrik alan etkisi altında iyonların hareket etmesi olayı Elektriksel Göç (Migrasyon) olarak adlandırılır ve bir hücre içindeki çözeltide kütle aktarımının ana sebebidir. Ġyonların, elektrot yüzeyinden veya elektrot yüzeyine hızı, elektrot potansiyeli artarken genellikle artar. Yükün bu hareketi potansiyel ile de artan bir akım oluĢturur. Göç sonucu anyonlar pozitif elektroda, katyonlar negatif elektroda doğru çekilir. Pek çok elektrokimyasal yöntemde analit türün göçü istenmez ve destek elektrolit kullanarak, göç en aza indirgenebilir. Maddeler, bir elektroda doğru ve elektrottan dıĢarıya, mekanik yollarla da taĢınabilir. KarıĢtırma veya sarsma gibi olaylarla meydana getirilen Zorlamalı Konveksiyon, elektrot yüzeyindeki difüzyon tabakasının kalınlığının azalmasına sebep olur ve böylece deriĢim polarizasyonu azalır. Ayrıca, sıcaklık ve yoğunluk farkından kaynaklanan Doğal Konveksiyon elektroda doğru veya elektrottan dıĢarıya moleküllerin taĢınmasına sebep olur. 1. 2. 1. DönüĢümlü voltametri
Normal polarografide potansiyel tarama hızı damla ömrüne göre çok yavaĢtır. Örneğin 5 mV/s tarama hızında damla süresi 1 saniye ise bir damla ömrü sırasında
potansiyeldeki değiĢme 5 mV kadardır. Tarama hızı bir damla ömrü için 100-200 mV/s civarında tutulursa ve belli bir potansiyelden sonra ilk taramanın tersi
yönde tarama yapılırsa bu metoda Dönüşümlü Voltametri denir. DönüĢümlü voltametri (CV), önemli ve yaygın kullanılan bir elektroanalitik tekniktir. Bu yöntemde, uygulanan potansiyel, önce bir yönde sonra ters yönde taranırken akım ölçülür. Bir CV deneyinde, küçük boyutlu bir elektrot, durgun bir çözeltide, ġekil 1. 4.’de görülen benzer dalga formuna sahip bir potansiyel değiĢim uygulanarak, bir akım sinyali vermesi sağlanır. Üçgen dalga formu, ileri ve bunun tersi yöndeki potansiyel taramasını temsil eder. Taramanın ters döndüğü potansiyellere dönüş potansiyeli denir. Belli bir deneyde, dönüĢ potansiyelleri, bir veya daha çok difüzyon kontrollü yükseltgenmesini veya indirgenmesini görecek Ģekilde seçilir. Ġlk
taramanın yönü, numunenin bileĢimine bağlı olarak negatif veya pozitif yönde olabilmektedir. Daha negatif potansiyellere gidilerek tarama yapılıyorsa, buna ileri tarama, diğer yöndekine geri tarama denir.
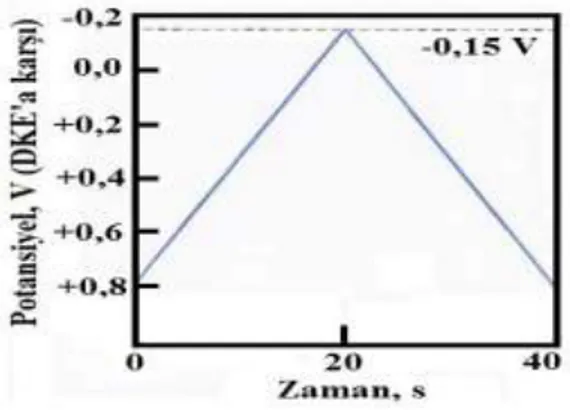
ġekil 1. 4. DönüĢümlü voltametrik uyarma sinyali
Hızlı bir potansiyel taraması elektroda uygulandığı zaman potansiyel, standart indirgeme potansiyeli değerine yaklaĢtığında madde indirgenmeye baĢlar. Potansiyel negatif değerlere ulaĢtıkça elektrot yüzeyindeki maddenin indirgenme hızı ve buna bağlı olarak da akım değeri artar. Ġndirgenme hızı arttıkça elektrot yüzeyine difüzyonla gelen madde miktarı akımı kontrol etmeye baĢlar. Difüzyon tabakası zamanla kalınlaĢtığı için difüzyon hızı ve dolayısı ile akımda azalır. DönüĢümlü voltametri tekniğinde, tarama hızı değiĢtirilerek pik yüksekliklerinin tarama hızı ile değiĢiminden adsorbsiyon, difüzyon ve elektron aktarım sayısına eĢlik eden kimyasal reaksiyon olaylarının var olup olmadığı belirlenebilir. Ayrıca ileri ve geri tarama piklerinden reaksiyon mekanizması hakkında fikir edinilir ve kinetik veriler elde edilebilir.
1. 2. 1. 1. Tersinir reaksiyonlar
Tersinir bir indirgenme reaksiyonunda elektrot reaksiyonunun;
Ģeklinde olduğunu düĢünelim. BaĢlangıçta çözeltide yalnız O maddesi bulunur e-
elektron aktarımı dıĢında herhangi bir kimyasal reaksiyon gerçekleĢmez. Ayrıca elektrot yüzeyinde adsorbsiyon olayının da meydana gelmediği kabul edilir. Potansiyel tarama hızı çok yavaĢ ise i – E grafiği belli bir potansiyelden sonra sınır
akıma ulaĢır ve akım potansiyelden bağımsız hale gelir. Potansiyel tarama hızı arttırılınca i – E grafiği pik Ģeklinde gözlenir ve tarama hızı arttıkça da pik yüksekliği artar.
Kararlı hal durumunda tarama hızı yavaĢ ise herhangi bir potansiyelde elektrot yüzeyinden belli bir uzaklıktaki reaktif konsantrasyonu sabittir. Nernst Difüzyon Tabakası adı verilen elektrot yüzeyine çok yakın bir tabakada konsantrasyon eğimi doğrusaldır. Bu tabakada, tersinir bir reaksiyon için [O] / [R] oranı Nernst eĢitliği ile potansiyele bağlıdır. Potansiyel negatifleĢtikçe reaktifin elektrot yüzeyindeki konsantrasyonu ([O]) azalır, konsantrasyon eğimi artar ve buna bağlı olarak akım da artar. Bu durum aĢağıdaki eĢitlikten kolayca görülebilir.
(EĢitlik 1. 1.)
Son durumda reaktifin elektrot yüzeyindeki konsantrasyonu sıfır olur. Bu potansiyelden sonra artık konsantrasyon eğimi değiĢmez ve buna bağlı olarak akım sabitleĢir.
Tarama hızı yüksek ise difüzyon hızı denge durumunda ulaĢacak kadar yüksek değildir. Dolayısıyla konsantrasyon profili doğrusal olmaz ve E ile [O] / [R] iliĢkisi Nernst eĢitliği ile ifade edilemez. O türünün indirgenebileceği potansiyele ulaĢıldığı zaman yüzey konsantrasyonu çözelti konsantrasyonuna eĢittir. O’nun indirgenmeye baĢladığı potansiyelde elektrot yüzeyi ile ana çözeltideki O konsantrasyonu arasında bir fark oluĢmaktadır. Elektrot yüzeyi ile ana çözelti arasında bu farktan dolayı konsantrasyon eğimi meydana gelmektedir. Bu eğim etkisi ile elektro aktif madde elektrot yüzeyine doğru difüzlenecek ve bunun sonucunda akım oluĢacaktır. Potansiyel negatifleĢtikçe elektrot yüzeyindeki O konsantrasyonu çözeltideki değerine göre daha da azalacaktır. Belli bir potansiyelde O’nun elektrot yüzeyindeki konsantrasyonu sıfır olacaktır.
Elektrot yüzeyindeki O konsantrasyonu sıfır olunca konsantrasyon eğimi azalacak ve akım da buna bağlı olarak azalacaktır. Bu etkilerin toplamında i – E grafiği pik Ģeklinde olacaktır. Pikin yüksekliği de tarama hızındaki artıĢ ile artacaktır. Potansiyel taraması geriye doğru yapıldığı zaman tarama hızlı ise elektrot yüzeyinde
yeteri kadar R bulunacağından E0
değerinden itibaren daha pozitif potansiyellerde R yükseltgenmeye baĢlayacaktır. Bu nedenle ters taramada da akım oluĢacaktır. Ters tarama esnasında E0
değerine kadar O indirgenmeye yani R oluĢmaya devam edecektir. Ters taramada potansiyel pozitifleĢtikçe Nernst eĢitliğine göre R yüzey konsantrasyonu azalacak ve yeteri kadar pozitif değerlerde sıfıra gidecektir. Ġleri taramadaki düĢünce Ģekli ile geri taramada bir pik elde edileceği kolayca anlaĢılabilir. Ancak deney esnasında yüzeyde oluĢan R, çözeltiye doğru difüzleneceğinden ters pik akımı (anodik akım) özellikle düĢük tarama hızlarında katodik akımdan biraz daha düĢük olacaktır. Tersinir bir O + ne
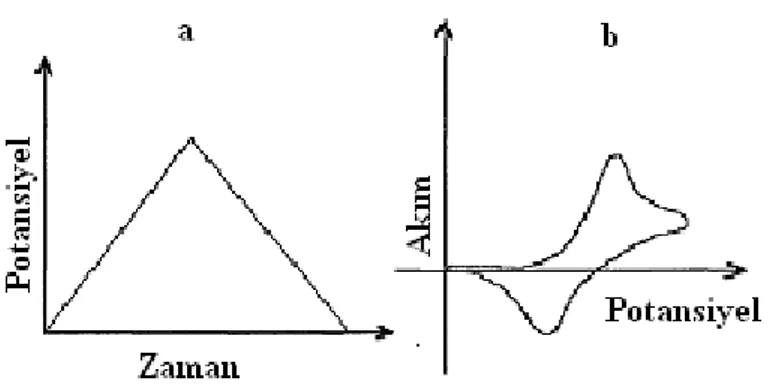
R reaksiyonunun CV voltamogramı ve CV tekniğinde potansiyel-zaman profili ġekil 1. 5.’deki gibidir.
ġekil 1. 5. a) DönüĢümlü voltametride elektroda uygulanan gerilim programı b) Elde edilen akım-gerilim eğrisi
CV’de pik akımının değeri (ip) için sınır durumları ve tarama hızı göz önüne
alınarak ve Do = DR = D kabul edilerek Fick’in ikinci kanunundan matematiksel
olarak aĢağıdaki eĢitlik türetilir.
(EĢitlik 1. 2.)
Bu eĢitlik Randles-Sevcik eĢitliği olarak bilinir. 25°C’da Randles-Sevcik eĢitliği aĢağıdaki Ģekle dönüĢür.
Ip=-(2,69 x 105) n3/2 C0D1/2v1/2 (EĢitlik 1. 3.)
Ip : Akım yoğunluğu, A/cm2
D : Difüzyon katsayısı, cm2/s v: Tarama hızı, V/s
C0: O türünün ana çözelti konsantrasyonu, mol/cm3
n: Aktarılan elektron sayısı
Pik akımı elektroaktif maddenin konsantrasyonuyla ve tarama hızının kareköküyle doğru orantılıdır. Kullanılan elektrodun ultramikro elektrot olması durumunda bu eĢitlik aĢağıdaki gibidir. Burada r, ultramikro elektrodun yarıçapıdır.
İss= 4rnFC0D0 (EĢitlik 1. 4.)
Bir reaksiyonun tersinirlik testi CV verilerinden faydalanılarak yapılabilir. Eğer Ip-v1/2 grafiği doğrusal ise ve orijinden geçiyorsa sistem tersinirdir. Bunlarla
beraber bir sistemin tersinir olabilmesi için diğer bazı özelliklere de sahip olması gerekmektedir.
Tersinirlik kriterleri Ģunlardır; ΔEp= Epa – Epk = 59/n mV
|Ep - Ep/2| = 59/n mV
|Ipa / Ipk | = 1
Ip α v1/2
Ep, v’den bağımsızdır.
Ep’den daha negatif (veya daha pozitif) potansiyellerde I2α t’ dir.
Bir sistemin tersinir olması için yukarıdaki kriterlerin hepsinin geçerli olması gerekmektedir. Bir veya birkaç özellik geçerli değilse sistem tersinir değildir. Yeterince geniĢ bir tarama hızı aralığında Ip ve Ep’nin V ile iliĢkisi test edilmelidir.
Yukarıdaki kriterlerden bir veya bir kaçı geçerli değilse elektrot reaksiyonu tersinmezdir veya kabul edilenden daha kompleks bir mekanizmaya sahiptir.
1. 2. 1. 2. Tersinmez reaksiyonlar
Tersinir sistemlerde bütün potansiyellerde elektron aktarım hızı kütle aktarım hızından büyüktür ve Nernst eĢitliği elektrot yüzeyinde geçerlidir.
Tersinmez sistemlerde ise elektron aktarım hızı yeteri kadar büyük olmadığından Nernst eĢitliği geçerli değildir. Bu durumda CV voltamogramının Ģekli tersinir durumdan farklıdır. Tersinmez durumlarda potansiyel tarama hızı çok düĢük ise elektron aktarım hızı kütle aktarım hızından daha yüksektir ve sistem tersinir gibi gözlenebilir. Tarama hızı arttıkça kütle aktarım hızı artar ve elektron aktarım hızı ile aynı seviyeye gelir. Bu durum tarama hızı arttıkça anodik ve katodik pik potansiyellerinin birbirinden uzaklaĢması ile kendini belli eder.
Fick’in ikinci kanunu sınır değerlerinde çözülürse tersinmez sistemin 25oC’de
pik akımı için aĢağıdaki eĢitlik bulunur.
Ip=(2,99x105) n (αcnα)1/2 CoDo1/2 v1/2 (EĢitlik 1. 5.)
Burada nα aktarılan toplam elektron sayısıdır. Buna hız tayin basamağında
aktarılan elektron sayısı da dahildir. Tersinir durumda olduğu gibi pik akımı konsantrasyon ve tarama hızının kare kökü ile doğru orantılıdır. Ġlaveten transfer katsayısının kare kökü ile doğru orantılıdır. Aktarılan elektron sayısının 1 olduğu durumda eğer αC=0,5 ise tersinmez pik akımı aynı Ģartlardaki tersinir pik akımının %
75,8 'i kadardır.
Tamamen tersinmez bir sistemin en önemli belirtisi ters tarama pikinin (anodik pikin) gözlenememesidir. Ancak unutmamak gerekir ki bunun tersi her zaman doğru değildir. Yani anodik pikin gözlenmeyiĢi mutlaka elektron aktarım basamağının tersinmez olduğunu göstermez. Örneğin elektron basamağını takip eden çok hızlı bir kimyasal reaksiyonda da aynı durum gözlenir. OluĢan ürün hızlı bir Ģekilde baĢka bir maddeye dönüĢeceği için ters taramada yükseltgenme gözlenmeyebilir.
Tersinir durumda Epk, tarama hızının bir fonksiyonu olmadığı halde tersinmez
durumda, v ile aĢağıdaki eĢitliğe göre değiĢir.
(EĢitlik 1. 6.) Bu eĢitlikte,
dir. (EĢitlik 1. 7.) Yani tersinmez bir elektron transfer reaksiyonunun katodik pik potansiyeli, tarama hızı arttıkça negatif bölgeye kayar ve bu kaymanın miktarı her 10 birimlik ν artıĢına karĢı 25°C’de 30/αCnα mV dur. Ayrıca dalganın Ģeklindeki değiĢme kriteri
olarak alınan |Ep-Ep/2| kayması da farklıdır.
| Ep – Ep/2 | = 48/(αcnα) mV. (25°C) (EĢitlik 1. 8.)
Dolayısıyla Epk ve |Ep-Ep/2| kaymalarından αCnα, D ve ks sabitleri
hesaplanabilir.
Özetlenecek olursa tersinmez bir dalganın aĢağıdaki kriterlerin tümüne uyması gerekir.
1. Anodik pik gözlenmez (Ters tarama piki gözlenmez). 2. Ipk
α
v1/23. Epk kayması 25°C’de tarama hızındaki 10 birimlik artmada 30/αCnα dir.
4. Tarama hızı 10 kat artarsa |Ep-Ep/2| = 48/(αCn α) mV’dur.
Sistem yarı tersinir ise, yani akım hem elektron hem de kütle transferinin katkısıyla oluĢuyor ise ks değeri: 0,3ν1/2 ≥ ks ≥ 2 x 10-5 ν1/2 cm/s aralığındadır. Bu
ġekil 1. 6. Yarı tersinir bir elektrot reaksiyonunda pik akımının potansiyel tarama hızının karekökü ile değiĢimi.
Bir reaksiyon aĢağıdaki kriterleri sağlarsa yarı tersinirdir. Ιp, ν1/2 ile artar ancak doğrusal değildir.
Ιpa/Ιpk = 1 dir. (Eğer αc = α a = 0,5 ise)
ΔEp > 59/n mV ve ΔEp, ν ile artar.
Epk, v nin artması ile negatif değerlere kayar.
1. 2. 1. 3. CV ile adsorpsiyon olayının incelenmesi
O + ne- R Ģeklindeki elektrot reaksiyonunun elektrokimyasal cevabı (yani voltametrik i-E eğrisi) O veya R’nin adsorbsiyonu ile önemli ölçüde değiĢebilir. Elektrokimyasal deneye baĢlamadan önce ayrıca adsorbsiyon dengesine ulaĢılıp ulaĢılmadığında bakılmalıdır. Adsorpsiyonun varlığı durumunda, voltametrik metotlarla ilgili daha önce kullanılan eĢitlikler ve ilk sınır değerleri aynıdır. Ancak elektrot yüzeyine olan madde göçü farklıdır. Çünkü elektrot yüzeyinde hem adsorbe olmuĢ “O” elektrot yüzeyinden çözeltiye doğru difüzlenebilir. “O” türünün elektrot yüzeyinde difüzlenebilme hızı ile adsorbsiyon hızının farkı, R türünün uzaklaĢma ve R’nin difüzlenme hızına eĢittir. Bu net olarak belli bir akım verir. Deneyin baĢlangıcında hemen dengeye ulaĢıldığı kabul edilerek ilgili elektrokimyasal metodun eĢitlikleri ve elektron transfer hızı da göz önüne alınır ve aĢağıdaki durumlar için gerekli eĢitlikler türetilir. Yalnız adsorbe olan O’nun elektroaktif olduğu durumda adsorbsiyon hızı çok yüksekse, elektrot yüzeyinde “O” nun
difüzyonu ihmal edilebilir. Çünkü difüzyonla taĢınma hızı, adsorbsiyon hızına göre düĢüktür.
Adsorbe olan maddeler indirgenince bir taraftan da yeni maddeler adsorbe olur. Bu durumda “O” nun adsorbsiyon dalgası, çözünmüĢ “O” nun adsorpsiyon dalgasına göre daha pozitif potansiyellerde gözlenir. Kuvvetli adsorbsiyon durumlarında düĢük konsantrasyon ve yüksek tarama hızlarında oluĢan akım adsorbsiyondan oluĢan akımdır. ÇözünmüĢ “O” nun akıma katkısı ihmal edilir. “O”nun adsorbsiyon hızı ne kadar yüksekse o kadar fazla akım elde edilir.
Ürünün (R) kuvvetli adsorbsiyonu durumunda elektrot yüzeyindeki konsantrasyon, ana çözelti konsantrasyonu ile aynıdır. R’nin adsorbsiyonu sıfırdır. Bu durumda, O ve R’nin difüzyon eĢitlikleri, toplam madde göçü eĢitliği adsorbsiyon izotermi ve adsorbsiyon tersinir kabul edildiği için Nernst eĢitliği ile çözülür. Bir ön dalga veya ön pik gözlenir. Sadece adsorbe olmuĢ türlerin elektroaktif olduğu durumda gözlenen pikin davranıĢı ile bu pikin davranıĢı aynıdır. Ayrıca bu pik difüzyon kontrollü pikten daha pozitif potansiyellerde gözlenir. Çünkü R’nin adsorbsiyon serbest enerjisi; çözünmüĢ R’ye indirgenmesini, O’nun adsorbe olmuĢ R’ye indirgenmesine göre kolaylaĢtırır. Adsorbsiyon olmadığı durumdaki dalgaya benzemesine rağmen difüzyon dalgasının Ģekli değiĢir (ġekil 1. 7.).
ġekil 1. 7. Ürünün kuvvetli adsorbsiyonunda gözlenen ön pik
O türünün, yani reaktantın adsorbsiyonu söz konusu ise adsorbe olmuĢ “O”dan dolayı arka pik gözlenir. Adsorbe olmuĢ türün çözeltideki türe göre daha kararlı olması bu arka pikin ortaya çıkmasının sebebidir. Ġleri taramadaki difüzyon
piki, “O”nun adsorbsiyonundan etkilenmez. Çünkü tarama baĢlamadan önce elektrot yüzeyinden her uzaklıkta ana çözelti konsantrasyonu yüzey konsantrasyonuna eĢittir ve adsorbsiyon dengesine ulaĢıldığı kabul edildiği için difüzyon dalgası değiĢmez. “O”nun indirgenmesi muhtemelen hem serbest yüzeyde hem de adsorbsiyon tabakasında meydana gelir. Bu arka pikin Ģekli paraboliktir ve adsorbsiyon özelliklerini gösterir. (ġekil 1. 8.).
ġekil 1. 8. Ürünün kuvvetli adsorpsiyonunda gözlenen ön pikin tarama hızı ile değiĢimi.
1. 2. 1. 4. CV ile elektrot reaksiyon mekanizmasının belirlenmesi
CV ile elektrot reaksiyonuna eĢlik eden kimyasal reaksiyonların varlığı ve mekanizma araĢtırmaları yapılır.
CE mekanizması: Bir elektrot reaksiyonunda önce elektroaktif maddenin oluĢması ve bunu takiben elektron aktarım basamağının meydana gelmesi CE mekanizması olarak bilinir.
C basamağı çok yavaĢ ve E basamağı tersinir ise akım kinetik kontrollüdür ve CV’de pik gözlenmez. Akım değiĢen potansiyelle belli bir sınır değerine ulaĢır. Elektrot reaksiyonu CE’ye göre ilerliyor ise aĢağıdaki kriterleri sağlar.
Tarama hızı arttıkça Ipk / v1/2 azalır.
EC mekanizması: Bir elektrot reaksiyonu, sırasıyla elektron aktarım basamağı ve kimyasal basamaktan oluĢuyor ise EC mekanizması geçerlidir.
E basamağının tamamen tersinmez olması halinde, kinetik veriler incelenemez. E tersinir olduğunda C basamağı hızlıysa anodik pik gözlenemez. Ancak C’nin hızı düĢük ise anodik pik gözlenir. EC mekanizmasının tersinirlik testleri aĢağıdaki gibidir.
| Ipa / Ipk | < 1 dir. Ancak v arttıkça 1’e yaklaĢır.
Ipk / v1/2 oranı v arttıkça çok az da olsa azalır.
Epk , tersinir durumdakinden daha pozitiftir.
Artan v ile Epk negatif bölgeye kayar ve saf kinetik bölge için v’deki
10 kat artıĢ (reaksiyon birinci dereceden ise 30/n mV kayamaya neden olur.
Reaksiyon ikinci dereceden ise kayma 19/n mV’dur.
ECkatalitik mekanizması: EC mekanizmasının özel bir hali olan katalitik
mekanizmada elektroaktif tür elektrokimyasal değiĢikliğe uğradıktan sonra bir kimyasal reaksiyonla tekrar oluĢur.
Ipk / v1/2 oranı v1/2 nin azalmasıyla artar. Bu durum sadece ECkatalitik
mekanizmasında görülür. Test kriterleri aĢağıdaki gibidir. | Ipk / v1/2 | oranı v arttıkça azalır.
Ipk, düĢük tarama hızlarında sınır değere ulaĢabilir.
Ipk değeri Randles-Sevcik eĢitliğinden beklenenden daha büyüktür.
ġekil 1. 9. “EC”mekanizmasının bulunduğu bir proseste, pik akımlarının, tarama hızı ile nasıl değiĢtiğini göstermektedir
ECE mekanizması: Elektroaktif tür indirgendikten sonra kimyasal bir reaksiyon sonucu yine elektroaktif baĢka bir türe dönüĢür. Bu duruma organik elektrokimyada çok rastlanır.
Bir elektrot reaksiyonunun ECE mekanizmasına göre yürüyüp yürümediğini anlamak için aĢağıdaki testler yapılabilir.
| Ipk / v1/2 | değeri tarama hızı ile değiĢir. Ancak yüksek ve düĢük tarama
hızlarında limit değer ulaĢır ve | Ipk / v1/2 | (düĢük v) > | Ipk / v1/2 | (yüksek v)
dir.
Ipa / Ipk oranı, artan tarama hızı ile artar ve yüksek tarama hızlarında 1’e
yaklaĢır.
ġekil 1. 10. “EC” mekanizması gösteren çoklu tarama yapılmıĢ voltamogram örneği
1. 2. 2. Puls Teknikleri
Elektrokimya ile ilgilenen bilim insanları için doğrusal taramalı polarografi tekniğinin önemini kaybetmesi ile puls tekniklerine geçiĢ yapılmıĢtır. Doğrusal taramalı tekniğin; analizler için yavaĢ olması, kullanımının zor olması ve yapılan analizlerdeki tayin sınırının oldukça düĢük olması gibi sınırlamalardan dolayı puls teknikleri ön plana çıkmıĢtır. Bu sınırlamalar, elektrokimyasal hücreye uygulanan potansiyelin farklı dalga biçimleri ile uygulanması ve çeĢitli elektrotların geliĢtirilmesi ile aĢılmıĢtır. Doğrusal taramalı voltametri, biyoloji ve biyokimyasal önemi olan bir çok madde de dahil olmak üzere çok sayıda anorganik ve organik türün nicel tayininde kullanılıyordu. Günümüzde, yüksek duyarlılığı, kolaylığı ve seçiciliğinden dolayı, puls yöntemleri, klasik yöntemin yerini almıĢtır. Nicel uygulamalarda, genellikle pik yüksekliklerinin analit deriĢimine karĢı grafiğe geçirildiği kalibrasyon eğrileri kullanılmaktadır. Bazı durumlarda standart ekleme yöntemleri de kullanılmaktadır. Her iki durumda da, kullanılan standart maddenin bileĢiminin, hem elektrot deriĢimi hem de pH yönünden numunenin bileĢimine mümkün olduğu kadar benzemesi gerekmektedir. Bu halledilirse, %1 - %3 arasında bağıl kesinlik ve doğruluk elde edilebilir.
Puls yöntemleri, anorganik maddelerin analizinde yaygın olarak kullanılmaktadır. Örneğin, birçok metal katyonu, elektrotta indirgenir. Hatta, destek elektrolitin yüksek potansiyellerde reaksiyona girmemesi kaydıyla, alkali ve toprak alkali metaller bile indirgenebilir. Katyonların baĢarılı bir Ģekilde polarografik tayini, çoğunlukla, kullanılan destek elektrolite bağlıdır. Anyonun iyi seçilmesi seçiciliği, büyük oranda arttırır. Bu yöntem bromat, iyodat, dikromat, vanadat, selenit ve nitrit gibi anorganik anyonların analizinde de kullanılabilir. Genellikle bu anyonların voltamogramları, çözeltinin pH’sından etkilenir, çünkü bunların indirgenmelerinde H+ iyonu rol alır. Puls tekniklerinin keĢfinden bu yana, organik bileĢiklerin incelenmesinde ve analizinde kullanılmaktadır. Birçok yaygın fonksiyonel grup, voltametrik elektrotlarda indirgenebilir ve bu Ģekilde birçok organik bileĢiğin tayini mümkün olur. Genellikle, organik bileĢiklerine bir voltametrik elektrottaki reaksiyonları, anorganik türlerinkinden daha yavaĢ ve karmaĢıktır. Ancak puls teknikleri, organik maddelerin yapı tayinlerinde, karıĢımların nicel analizinde ve nitel belirlenmesinde yararlıdır.
1. 2. 2. 1. Diferansiyel puls voltametrisi (DPV)
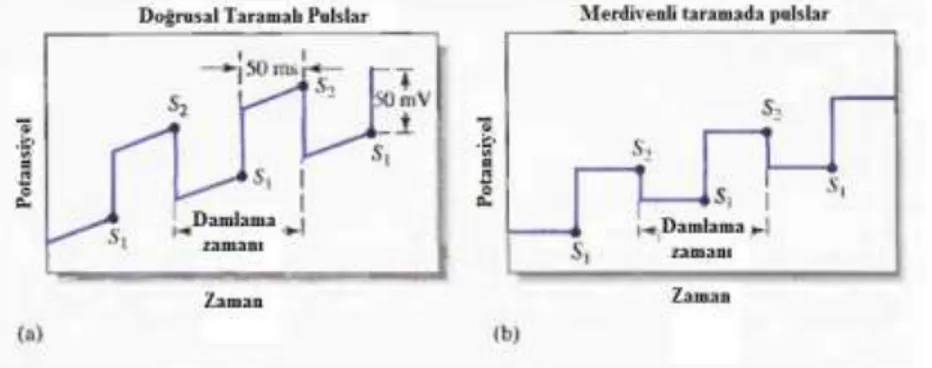
Ticari diferansiyel puls polarografi cihazlarında kullanılan en yaygın iki uyarma sinyali ġekil 1. 11.’de verilmiĢtir. Analog cihazlarda kullanılan birinci sinyal ġekil 1. 11. (a) periyodik bir pulsun doğrusal bir tarama sırasında oluĢturulması ile elde edilir. ġekil 1. 11. (b) ise genellikle dijital sistemlerde kullanılır. Burada da bir puls ile basamaklı sinyal üst üste bindirilir. Her iki durumda da civa damlasının ömrünün son 50 ms’si içinde 50 mV’luk bir puls uygulanır. Burada damla ile puls arasında uyum sağlamak için damla belli bir anda mekanik olarak düĢürülür.
ġekil 1. 11. Diferansiyel Puls Polarografi için uyarma sinyalleri
ġekil 1. 11.’de görüldüğü gibi iki tane akım ölçümü yapılmaktadır. Bunlardan birinci pulstan hemen önce (S1) diğer ise pulsun bitiminden hemen önce (S2) yapılır.
Puls baĢına akımdaki fark (Δi) doğrusal olarak artan potansiyelin fonksiyonu olarak kaydedilir. Elde edilen diferansiyel eğri, pik Ģeklinde olup yüksekliği deriĢim ile doğru orantılıdır. Tersinir bir reaksiyonda pik potansiyeli yarı-reaksiyonun standart potansiyeline yaklaĢık eĢittir. Diferansiyel tip polarogramın bir üstünlüğü, yarı-dalga potansiyelleri 0,04 ile 0,05 V kadar farklı olan maddeler için bile ayrı pik maksimumları elde edilmesidir. Halbuki klasik ve normal puls polarografisi için yarı-dalga potansiyel farkı en az yaklaĢık 0,2 V olmalıdır. Daha da önemlisi diferansiyel puls polarografisi, polarografik yöntemin duyarlılığını arttırır. Genellikle diferansiyel puls polarografisinin gözlenebilme sınırı, klasik polarografinin sınırlarından 100-1000 kat düĢük olup, 10-7
– 10-8 M arasındadır.
Diferansiyel puls polarografisinin yüksek duyarlığı iki sebebe bağlanabilir. Bunlardan birincisi, Faradayik akımın artması; ikincisi ise, Faradayik olmayan yükleme akımının azalmasıdır. Birincisin açıklamak için, potansiyel aniden 50 mV arttırıldığında, elektrodu çevreleyen yüzey tabakasında cereyan eden olayları
incelersek, bu tabakada elektoraktif bir tür varsa, analit deriĢimini yeni potansiyel tarafından istenen seviyeye düĢürecek bir akım artıĢı gözlenir. Fakat, bu potansiyel için gerekli olan denge deriĢimine eriĢilince, akım difüzyonu karĢılayacak bir seviyeye düĢer ki, buna difüzyon kontrollü akım denir. Klasik polarografide, baĢlangıçtaki bu akım artıĢı gözlenmez. Çünkü, ölçümün yapıldığı süre, bu anlık akımın süresinden büyüktür. Diğer taraftan, puls polarografisinde akım ölçümü, bu akım artıĢı tamamen sona ermeden önce yapılır. Böylece, ölçülen akım hem difüzyon kontrollü bir bileĢeni hem de yüzey tabakasındaki deriĢimi, Nernst eĢitliğinin gerektirdiği bir değere indirecek bir bileĢeni içerir. Yani, toplam akım difüzyon akımından birkaç kat daha büyüktür. Damla düĢünce, çözelti analit yönünden yeniden homojen hale gelir. Bu, verilen herhangi bir potansiyel değerinde her potansiyel pulsu için okunan akımda ek bir katkı olması demektir (Skoog, 2004).
Elektroda potansiyel pulsu uygulandığında, damla üzerindeki yük arttığı için, Faradayik olmayan akımda da bir dalgalanma olur. Bu akım, zamanla üstel olarak azalır ve yüzey alanının çok az değiĢtiği damla ömrünün sonuna doğru 0’a yaklaĢır. Dolayısıyla, akımı bu anda ölçmek suretiyle Faradayik olmayan artık akım büyük oranda azalır ve sinyal/gürültü oranı artar. Bunun sonucunda, duyarlılık da artar. 1. 3. Modifiye Elektrotlar
ÇeĢitli iletken substrat yüzeylerini çeĢitli metotlarla değiĢtirerek hazırlanmıĢ yeni elektrot tipleri, elektrokimyadaki aktif araĢtırma alanlarından biridir (Murray, 1992). Modifiye elektrotlar, elektrot yüzeyini, belirli bir amaç doğrultusunda, adsorbsiyon, fiziksel kaplama veya özel türlerin bağlanması ile elde edilir. Elektrot yüzeyini kaplayarak farklı özelliklere sahip yeni bir elektrot elde etme yöntemine modifikasyon denir.
Modifikasyon sonucunda elde edilen elektroda ise, modifiye elektrot denir. Sonuç olarak modifiye edilmiĢ yüzeyle direk olarak temas kesilir. Bu yüzden modifiye elektrotlar iyi bir seçicilik sağlar. Modifikasyon yapılacak elektrot, mikroelektrot olduğu takdirde küçük boyutlu ve belirli türlere karĢı hassas elektrotlar meydana getirilebilir. Normalde modifiye yüzeyler elektro aktiftir ve çözelti ve elektrot-substrat arasındaki elektron transferinde rol oynar.
Platin, Altın ve Karbon kimyasal ve mekanik açıdan kararlılıklarının yüksek olması sebebi ile elektrot materyali olarak sıklıkla kullanılır. Elektrot materyallerinin sınırlı olmasından (Au, Pt, Hg, Ni, Pd, GC) dolayı, elektrot yüzeylerinin tabaka ve filmler ile kaplanarak, elektrot yüzeyindeki elektron aktarım hızlarının değiĢtirilebilmesi, elektrokatalitik özelliği yüksek yüzeyler elde edebilmek ve elektrot yüzeyleri korozyona veya dıĢ etkenlere karĢı korunabilmesi için elektron modifikasyonu yaygın olarak kullanılan bir tekniktir. Modifikasyon iĢlemi öncesinde, elektrodun yüzeyin modifikasyon iĢlemi için uygun fiziksel özelliklere getirmek önemlidir. Bu yüzden elektrot yüzeyinin parlatılması gereklidir böylece elektrot üzerindeki oyuk ve çizikler giderilerek, elektrot modifikasyon için daha uygun hale getirilmiĢ olur. Bu iĢlem için elmas veya alümina tozu kullanılır. Sonrasında su veya nitrik asit ile yıkama iĢlemi yapılır ve elektrodun etrafındaki parçacıkları uzaklaĢtırmak için elektrot sonikasyon iĢlemine tabi tutulur.
Elektrot modifikasyonu yapılarak, belirli türlere karĢı substratın duyarlılığı artırılabilir, elektron aktarım mekanizmaları incelenebilir, enzimlerin modifiye elektrot yüzeyine sonradan tutturulması ile biyosensör yapılabilir ve modifikasyon yardımı ile amaca uygun sonsuz sayıda elektrot elde edilebilir. Modifiye elektrotlar, pek çok uygulama alanı bulunmaktadır. Örnek olarak, yakıt hücrelerinde ve pillerde, renk değiĢtirme özelliğine sahip elektrokromik düzeneklerin üretiminde, moleküler düzeyde elektronik düzenekler (diyot ve transistörler) gibi kullanım alanları vardır. Ayrıca en önemli analitik uygulaması, belirli türler ve fonksiyonel gruplar için hazırlanmıĢ analitik sensörlerdir.
1. 3. 1. Modifikasyon Metotları
Modifiye etme tekniği olarak, istenen fonksiyonel grupları içeren maddelerin elektrot yüzeyinde adsorplanması, böyle bileĢiklerin yüzeye kovalent yoldan bağlanması, elektrot yüzeylerinin polimer filmleriyle veya baĢka maddelerin filmleriyle kaplanması yollarından biri kullanılabilir. Ġstenilen fonksiyonel grubu yüzeye bağlamadan önce elektrot yüzeyine organosilanlar, aminler gibi köprü kurmaya yarayan bileĢikler bağlanır. Polimer filmler, polimer çözeltisine daldırma, döndürerek kaplama, elektro kaplama veya kovalent bağ ile oluĢturulabilir. Elektrot yüzeylerini modifiye edebilmek için çeĢitli metotlar mevcuttur.
Bu metotlardan bazıları;
Sentetik merkezler ile modifikasyon, Özel Ģelatlama bileĢenleri ile modifikasyon, Kendiliğinden oluĢan tek tabaka (SAM), Langmuir-Blodgett (LB) yöntemleri,
Diazonyum tuzu indirgenmesi modifikasyonunda, Amin oksidasyonu modifikasyonu,
Alkol oksidasyonu modifikasyonu Ģeklinde sıralanabilir.
Sentetik merkezler kullanılarak yapılan modifikasyon iĢleminde, taç eterler, kriptantlar, klorodekstrinler gibi makrosiklik bileĢikler elektrodun yüzeyine bağlanır veya adsorbe olurlar ve bu Ģekilde modifikasyon yapılmıĢ olur.
Kuvaterner vinilpiridin ve vinilferrosinin kopolimer filmi gibi özel ĢelatlaĢtırma bileĢikleri kullanılıp, elektrooksidasyon ile biriktirilebilir (Guadalupe et al. Abruna 1985). Bu katyonik film anyonik Ģelatlayıcı bileĢen ile kükürt bağlı betakuprin ile iyon değiĢimi sayesinde meydana getirilebilir ve bu yüzeye uygulanacak olan metaller, yüzeye kompleksleĢtirme veya iyon değiĢtirme etkisi ile bağlanır.
SAM veya LB yöntemlerinde ise katı substrat yüzeylerine uygun moleküller tek tabaka veya çoklu tabakalar seklinde kolayca tutturulabilmektedir (Peterson 1990). SAM ve LB filmleri, organik bir maddenin çözeltisi içerisine katı bir substratın daldırılmasıyla basit bir Ģekilde oluĢturulabilmektedir. Au elektrot yüzeyine alkan tiyollerin tutturulması olayı SAM ve LB yöntemleri ile kolaylıkla yapılabilen modifikasyonlardır.
Diazonyum tuzu indirgenmesi modifikasyonunda, sübstitüent olarak amin grubu bağlı bir molekülün diazonyum tuzu hazırlanır. Diazonyum tuzu sentezinde en çok dikkat edilmesi gereken iĢlem, sıcaklığın 0°C’ı geçmesinin engellenmesidir. Ekzotermik olan çıkıĢ maddesi, tetrafloroborik asitte (HBF4) çözünürse, diazonyum
susuz ortamda CV tekniği kullanılarak, çalıĢma elektroduna modifiye edilir ve ġekil 1. 12.’de görüldüğü gibi bir yüzey elde edilir. Modifikasyon, genellikle çok döngülü olacak Ģekilde yapılır. Çünkü ilk döngüde elektrot üzerinde boĢluklar oluĢabilir ve tam olarak kaplanamayabilir. Ġlk taramada tam olarak kaplanamayan elektrot, ikinci ve daha sonraki taramalarda kaplanır ve modifiye elektrot adını alır.
ġekil 1. 12. Diazonyum tuzu indirgenmesi ile elde edilen yüzey
Diazonyum tuzu ile modifiye edilmiĢ elektrot, zımpara kâğıdı ve alümina tozu kullanılarak yüzeyindeki diazonyum tuzundan temizlenip, parlatılabilir. Daha sonra su ve asetonitril ile sonikasyona tâbi tutulan elektrot, yüzeyi en son N2 gazı
akımında temizlendikten sonra tekrar modifikasyona hazır hale getirilir.
Amin oksidasyonu modifikasyonu, amin grubu bağlı bir molekülün sulu ortamda GC veya Pt, Au gibi metal bir çalıĢma elektroduna CV yöntemi uygulanarak tutturulması ile gerçekleĢmektedir ve oluĢan yüzey ġekil 1.13.’de görüldüğü gibidir. CV voltamogramında, pozitif tarama yapılarak, amin bileĢiğinin yüzeye tutunma piki oldukça belirgin bir Ģekilde görülebilmektedir. Çoklu tarama yapılsa bile, molekül amin oksidasyonu yöntemi ile elektrot yüzeyine genellikle ilk taramada bağlanır ve ondan sonraki döngülerde pik gözlenmez. Ancak pik gözlenmese bile, döngü sayısı arttıkça, elektrot üzerinde çoklu tabakalar da oluĢabilir. Elektrot yüzeyindeki çoklu tabakalar, elektrot ile çözelti içerisindeki redoks probu arasındaki elektron alıĢveriĢini engellediği için pKa tayini için pek istenmeyen bir durumdur.
ġekil 1. 13. Amin oksidasyonu yöntemi ile elde edilen yüzey
Amin oksidasyonu modifikasyonu ile kaplanan elektrot, diazonyum tuzu ile modifiye edilen elektrot kadar kararlı olmayabilir. Bu yüzden amin oksidasyonu ile modifiye edilen elektrodun, kaplandıktan hemen sonra kullanılması gerekmektedir, yani kullanım ömrü çok uzun değildir. Bu modifiye elektrodun temizliği, diazonyum tuzu modifikasyonu ile kaplanan elektrodun temizliği gibidir. Diazonyum tuzu sentezi ile amin grubu içeren molekülün amin grubu, N2 +
grubuna dönüĢür ve modifikasyon sırasında, N2+
grubu ayrılır. Bu molekül elektroda karbon atomundan bağlanır. Ancak amin oksidasyonun da molekül elektroda azot atomundan bağlanır. Diazonyum tuzu modifikasyonu ile amin oksidasyonu modifikasyonu arasındaki bir baĢka fark ise, diazonyum tuzu modifikasyonunun susuz ortamda, amin oksidasyonu modifikasyonunun ise sulu ortamda gerçekleĢmesidir.
Alkol oksidasyonu modifikasyonu, hidroksil grubu bağlı bir molekülün sulu ortamda GC veya Pt, Au gibi metal bir çalıĢma elektroduna CV yöntemi uygulanarak tutturulması ile gerçekleĢmekte ve ġekil 1. 14.’de görüldüğü gibi bir yüzey elde edilmektedir.
ġekil 1. 14. Alkol oksidasyonu yöntemi ile elde edilen yüzey
Alkol oksidasyonu ile modifikasyonda da aynı amin oksidasyonunda olduğu gibi, sulu ortamda çalıĢılır. Modifiye edilen elektrodun temizliği, diazonyum tuzu indirgenmesi ile modifiye edilen elektrodun temizliğine benzer Ģekilde yapılır.
1. 4. Piridin
Piridin (azabenzen ya da azin olarak da bilinir) C5H5N, renksiz, yanıcı, zehirli
bir sıvıdır. Donma noktası 42°C, kaynama noktası 115.5°C’dir. Kimyasal olarak “heterosiklik aromatik üçüncül amin” olarak da adlandırılır. Benzen halkasındaki bir karbon-hidrojen grubunun yerini azot (N) almıĢtır. Piridin türevleri, nonlineer bir madde ve fotokimyasal özellikte olmasından dolayı heterosiklik bileĢikler içerisinde önemli gruptur. Özellikle, piridin türevi içeren bazı kristraller yakın IR bölgeden, görünebilir dalga boyu bölgesine, dalga boyu dönüĢtürücüsü olarak görev yapar (Kaminski 2002).
Tablo 1. 2. Piridinin kimyasal özellikleri Molekül Adı Kapalı Formülü Molekül Ağırlığı Açık Formülü 3D Görüntüsü Piridin C5H5N 79,0999 g/mol N
Tablo 1. 3. 2-Amino piridin’in kimyasal özellikleri Molekül
Adı
Kapalı Formülü
Molekül
Ağırlığı Açık Formülü 3D Görünütüsü
2-Amino
Piridin C5H6N2
94,1154 g/mol
N NH2
Amino piridinler farmokolojik ve medikal anlamda geniĢ kullanıma sahiptir. Bunlardan bazıları anestezik özellik gösterir ve ilerlemiĢ beyin rahatsızlıklarında hap olarak kullanılmıĢtır (Okamato 1997, Szafran 1994 ve Carmona 1993). 2AP ile iĢaretlenmiĢ oligosakkaritler, florasans dedektörlü HPLC ile yapılan hassas kantitatif ve kalitatif analizlerde oldukça sık kullanılır (Okamato 1997). 2AP, sistidin H C N H C N