PATATES, BUĞDAY VE MISIR NİŞASTASINDAN YÜKSEK DEKSTROZ EŞDEĞERLİĞİNE SAHİP
GLİKOZ ŞURUBU ELDESİ
Emine KAPAR YILMAZ Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı Dr. Ögr. Üyesi Ceren BAYRAÇ
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
PATATES, BUĞDAY VE MISIR NİŞASTASINDAN YÜKSEK DEKSTROZ EŞDEĞERLİĞİNE SAHİP GLİKOZ ŞURUBU ELDESİ
YÜKSEK LİSANS TEZİ Emine KAPAR YILMAZ
Ana Bilim Dalı:Biyomühendislik
Tez Danışmanı: Dr. Öğr. Üyesi Ceren BAYRAÇ
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET
Yüksek Lisans Tezi
PATATES, BUĞDAY VE MISIR NİŞASTASINDAN YÜKSEK DEKSTROZ EŞDEĞERLİĞİNE SAHİP GLİKOZ ŞURUBU ELDESİ
Emine KAPAR YILMAZ Karamanoğlu Mehmetbey Üniversitesi
Fen Bilimleri Enstitüsü Biyomühendislik Ana Bilim Dalı Danışman: Dr. Öğr. Üyesi Ceren BAYRAÇ
Ağustos, 2019, 59 sayfa
Bu tez, mısır, patates ve buğday nişastalarında glikoz şurubunun enzimatik olarak elde edilişini ve genel olarak karşılaştırılmalarını içermektedir. Çalışma kapsamında α-amilaz ve amiloglukozidaz enzim kullanılarak aşamalı olarak nişastanın parçalanması gerçekleştirilmiştir. Hammadde olarak kullanılan mısır, patates ve buğday nişastaları glikoz şurubu üretimi öncesi fiziksel, kimyasal ve morfolojik olarak karakterize edilmiştir. Yüksek dekstroz eşdeğerine (DE) sahip glikoz şurubu eldesi için çeşitli optimizasyon çalışmaları yapılmış, sonuç olarak başlangıç nişasta miktarı, amilaz enzimin miktarı ve inkübasyon süresi, amiloglukozidaz enziminin miktarı ve inkübasyon süresine ait optimum koşulları belirlenmiştir. Enzimler için gerekli ortam şartları sağlanıp parçalanmanın sonucunda oluşan şekerlerin analizleri yapılıp karşılaştırılmış ve bu üç farklı nişastadan elde edilen glikoz şurubu ürünleri nem (%) pH, glikoz (%) , maltoz (%), DE %, kuru madde (%) ve renk parametreleri bakımından değerlendirilmiştir.
Anahtar Kelimeler: Mısır Nişastası, Patates Nişastası, Buğday Nişastası, α-amilaz, amiloglukozidaz, glikoz şurubu, dekstroz eşdeğeri
ii ABSTRACT
MsThesis
PRODUCTION OF GLUCOSE SYRUP WITH HIGH DEXTROSE EQUIVALENT VALUE FROM POTATO, WHEAT AND MAİZE STARCH
Emine KAPAR YILMAZ Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Bioengineering Supervisor: Assist. Prof.Ceren BAYRAÇ
August, 2019 59 pages
This thesis covers the enzymatic production of glucose syrup from corn, potato and wheat starches and their comparisons. Within the scope of the study, the hydrolysis of starch was carried out gradually using α-amylase and amyloglycosidase enzymes. Corn, potato and wheat starches used as raw materials were characterized physically, chemically and morphologically before glucose syrup production. Various optimization studies was carried out for the production of glucose syrup with high dextrose equivalent (DE), thus, optimum conditions were determined for the initial amount of starch, the amount and incubation time of α-amylase, the amount and incubation time of amyloglycosidase. The glucose syrups produced under optimum conditions were compared according to their sugar content and they were evaluated in terms of moisture (%), pH, glucose (%), maltose (%), DE (%), dry matter (%) and color parameters.
Keywords: Corn Starch, Potato Starch, Wheat Starch, α-amylase, amyloglycosidase, glucose syrup, dextrose equivalent
iii ÖNSÖZ
İlk olarak yüksek lisans yapmam için bana fırsat veren ve bu süreçte her zaman yanımda olan çalışmalarımı titizlikle takip eden ve beni her zaman gayretlendiren, yüksek lisansımı tamamlamama vesile olan iyi ki tanıdım dediğim biricik danışman hocam Sayın Dr. Öğr. Üyesi Ceren BAYRAÇ ‘a sonsuz teşekkür ediyorum.
Bu süreçte bana her türlü desteği veren Konya Şeker San ve Tic. A.Ş yönetmine ve özellikle Atıştırmalık iş birimi amirlerim ve ekip arkadaşlarıma teşekkür ediyorum.
Bu zorlu süreçte hep yanımda olan beni daima destekleyen biricik eşim Mustafa YILMAZ’a ve çok sevgili çocuklarıma teşekkürlerimi sunarım.
Emine KAPAR YILMAZ Karaman-2019
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÖNSÖZ ... iii İÇİNDEKİLER ... iv ÇİZELGELER DİZİNİ ... vi ŞEKİLLER DİZİNİ ... vii
SİMGELER VE KISALTMALAR DİZİNİ ... viii
1. GİRİŞ ...1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ...3
2.1. Nişasta ...3
2.2.1. Nişasta Çeşitleri ve Kullanım Alanları...4
2.1.2. Nişasta üretimi ...8
2.2. Nişastadan elde edilen ürünler...8
2.2.1. Nişasta Bazlı Şeker Eldesi ve Kullanım Alanları ...9
2.2.1.1. Asitle Şeker Elde Edilmesi ...9
2.2.1.2. Enzim ile Şeker Elde Edilmesi ... 10
2.2.2. Fruktoz Şurupları ... 12
2.2.3. Glikoz Şurupları ... 14
2.2.4. Fruktoz Şurubu İle Glikoz Şurubu Arasındaki Farklar ... 15
2.2.5. Türkiye’de Üretim ve Kullanım Miktarları ... 16
3. MATERYAL VE METOT ... 18 3.1. Kimyasallar ve Nişastalar... 18 3.2. Nişastaların Karakterizasyonu ... 18 3.2.1. Nem Analizi ... 18 3.2.2. pH Analizi ... 18 3.2.3. Nişasta Analizi ... 18 3.2.4. Protein Analizi ... 19 3.2.5. Lif Tayini ... 20 3.2.6. Yağ Tayini ... 21 3.2.7. Kül Tayini ... 21
3.2.8. Taramalı Elektron Mikroskop (SEM) Analizi ... 22
3.2.9. Fouirer Transform Infrared Spektrofotometre (FTIR) Analizi... 22
3.2.10. X-Işınları Kırınım (XRD) Analizi ... 22
v
3.4. Yüksek Performans Sıvı Kromatografisi Analizi (HPLC) ... 24
3.5. Glikoz Şuruplarının Dekstroz Eşdeğerlerinin (DE) Değerlendirilmesi ... 24
4. BULGULAR ... 25
4.1 Nişastaların Kimyasal ve Fiziksel Karakterizasyonu ... 25
4.2 FTIR analizi ... 26
4.3 XRD analizi ... 27
4.4 Nişastaların Morfolojik Karakterizasyonu ... 28
4.5 Nişastadan Glikoz Şurubu Eldesi ... 29
4.5.1. Başlangıç Nişasta Yüzdesinin Son Ürüne Etkisi ... 29
4.5.2. Amilaz Enzimin İnkübasyon Süresinin Son Ürüne Etkisi ... 31
4.5.3. Amilaz Enzimi Miktarının Son Ürüne Etkisi ... 33
4.5.4. Amiloglikozidaz Enzimi Miktarının ve İnkübasyon Süresinin Son Ürüne Etkisi……… ... 36
4.6 Üretilen Şeker Şuruplarının Fizikokimyasal Özellikleri ... 38
5. TARTIŞMA VE SONUÇ ... 39
5.1 Nişastaların Kimyasal ve Fiziksel Karakterizasyonu ... 39
5.2 FTIR analizi ... 40
5.3 XRD analizi ... 41
5.4 Nişastaların Morfolojik Karakterizasyonu ... 41
5.5 Nişastadan Glikoz Şurubu Eldesi ... 42
5.5.1. Başlangıç Nişasta Yüzdesinin Son Ürüne Etkisi ... 44
5.5.2. Amilaz Enzimin İnkübasyon Süresinin Son Ürüne Etkisi ... 45
5.5.3. Amilaz Enzimi Miktarının Son Ürüne Etkisi ... 46
5.5.4. Amiloglikozidaz Enzimi Miktarının ve İnkübasyon Süresinin Son Ürüne Etkisi ……….47
5.6 Üretilen Şeker Şuruplarının Fizikokimyasal Özellikleri ... 48
5.7 Sonuç ... 48
KAYNAKLAR ... 50
vi
ÇİZELGELER DİZİNİ
Çizelge Sayfa
Çizelge 2-1 Nişasta Kesirlerinin Özellikler…………...4
Çizelge 2-2 Kimyasal ve fiziksel olarak modifiye edilmiş nişastalara örnekler...…….…5
Çizelge 2-3 Nişastaların hammaddesine göre karşılaştırması... 7
Çizelge 2-4 Mikroorganizma kaynaklı α-amilaz termostabil sıcaklıkları... 12
Çizelge 3-1 Gıdalara göre faktör değeri……….……… 20
Çizelge 4-1 Üç farklı nişasta çeşidine ait kimyasal özellikler………..………….. 25
Çizelge 4-2 Farklı mısır nişastası miktarlarının son ürüne etkisi………..……....……. 30
Çizelge 4-3 α-Amilaz enzimin inkübasyon süresinin son ürüne etkisi………...…… 32
Çizelge 4-4 α-Amilaz enzim miktarının son ürüne etkisi………..…………. 35
Çizelge 4-5 Amiloglukozidaz enzim miktarının mısır nişastasından (%30) elde edilen son ürüne etkisi……….………..……… 37
Çizelge 4-6 Amiloglukozidaz enzim miktarının buğday nişastasından (%30) elde edilen son ürüne etkisi……….……….……….… 37
Çizelge 4-7 Amiloglukozidaz enzim miktarının patates nişastasından (%30) elde edilen son ürüne etkisi………...………..…...38
vii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2-1 Nişasta moleküllerinde α- (1 → 4) ve α- (1 → 6) bağlantıları…………...….. 3
Şekil 2-2 Doğrudan nişastadan elde edilen endüstriyel ürünler………..……... 8
Şekil 2-3 Enzimatik Yöntemle Fruktoz Şurubu Üretim Prosesi ………..…..………… 13
Şekil 2-4 Enzimatik Yöntemle Glikoz Şurubu Üretim Prosesi ……….……..……….. 15
Şekil 3-1 Çalışma kapsamında kullanılan destilasyon cihazı………..…….….. 20
Şekil 3-2 Hazırlanan nişasta çözeltileri……….………..………….. 23
Şekil 3-3 Çalışma kapsamında kullanılan HPLC cihazı………. 24
Şekil 4-1 Ham nişasta granüllerinin ışık mikroskobu görüntüleri. A mısır nişastasına, B buğday nişastasına ve C patates nişastasına ait 40X görüntüleri………...………. 25
Şekil 4-2 Oda sıcaklığında % 5 içerikli hazırlanan nişasta çözeltilerine ait resim... 26
Şekil 4-3 Buğday, mısır ve patates nişasta granüllerine ait FTIR spektrum analizi; mavi renkli olan spektrum buğday nişastasına, kırmızı renkli olan spektrum mısır nişastasına ve yeşil renkli olan spektrum patates nişastasına aittir……….….…….… 27
Şekil 4-4 Buğday, mısır ve patates nişasta granüllerine ait X ışınım kırınım desenleri………..………....…… 28
Şekil 4-5 Ham nişasta granüllerinin SEM görüntüleri.……….……. 29
Şekil 4-6 Başlangıç nişasta içeriğinin glikoz ve maltoz içeriğine etkisi ………... 30
Şekil 4-7 Amilaz enziminin inkübasyon süresinin glikoz içeriğine etkisi ……… 33
Şekil 4-8 Amilaz enziminin inkübasyon süresinin maltoz içeriğine etkisi ….…….…. 33
Şekil 4-9 Amilaz enzim miktarının glikoz içeriğine etkisi. ………...….…... 35
Şekil 4-10 Amilaz enzim miktarının maltoz içeriğine etkisi ……….…..….. 36
Şekil 5-1 Amiloz ve amilopektin yapısı ……….….……..… 43
viii SİMGELER VE KISALTMALAR DİZİNİ Simgeler Açıklama % Yüzde m/m Kütle/ Kütle g Gram Kg Kilogram α Alfa °C Derece selsiyus Rpm Dönüş/Devir sayısı Dekar 100 m2 Alan Ton 1000 Kg F Faktör Değeri ml Mililitre µL Mikrolitre µm Mikrometre mA Mili Amper N Normalite
DE Dekstroz Eş Değerliği
Kısaltmalar Açıklama TÜİK Türk İstatistik Kurumu ABE Aseton-butanol-etano HMF Hidroksimetil Furfural NBŞ Nişasta Bazlı Şeker
RID Alev İyonizasyon Dedektörü HFS Yüksek Fruktoz Şurubu
HFCS Yüksek Fruktozlu Mısır Şurubu SEM Taramalı Elektron Mikroskop
FTIR Fouirer Transform Infrared Spektrofotometre XRD X-Işınları Kırınım
HPLC Yüksek Performans Sıvı Kromatografisi MES 2 (N-morfolin) Etan Sülfonik Asit TRİS Tris (hidroksimetil) Aminometan F Flor Elementi
Cl Klor Elementi I İyot Elementi
1 1. GİRİŞ
Glikoz şurupları, hazır gıdalar, atıştırmalık ürünler başta olmak üzere şekerleme, unlu mamüller, helva, baklava gibi Türk şerbetli tatlılarında, marmelat, reçel ve bira yapımında kullanılmaktadır. Uygulama alanına göre de farklı işlevsel özellikler kazanmaktadır. Glikoz şuruplarında tatlılık indeksi, ozmotik basınç, kristallenme, nem miktarı, viskozite değerleri gibi başlıca koligatif özellikler şurubun işlevselliğini belirler. Bu tatlandırıcıların en önemli riski, tatlandırıcıların elde edilmesinde; hammadde olarak genetik yapısı ile oynanmış mısır nişastası ve benzeri nişastaların kullanılma ihtimalıdir. Diğer bir risk ise, üretim prosesinde kullanılan aktif karbonun menşeidir. Aktif karbon hayvansal veya bitkisel kökenli bir hammaddedir. Bundan dolayı ise, haram hayvan kemiklerinden üretilmiş olma ihtimalini taşımaktadır. Bitkisel kökenli olan çam ağacından üretilen aktif karbonun kullanılması ve genetiği değiştirilmemiş mısırdan veya şeker pancarından üretimi yapılan şurupların kullanımı bu şüphelerin giderilmesi için uygulanan yöntemlerdendir.
Glikoz şurupları nişastalardan üretimi yapılan basit şekerlerdir. Bu tatlandırıcılar; glikoz, yüksek molekül ağırlığına sahip dekstrinler ve disakkaritlerin farklı oranlarda karışımıdır. Fiziksel olarak ise renksiz, berrak ve viskoz yapıda tatlandırıcılardır. Türk Gıda Kodeksi Şeker Tebliği' nde belirtildiği gibi glikoz şurubu "nişastadan veya nişasta ve dekstroz eşdeğer miktarı en az %20 m/m olan inülinden elde edilen sakarit konsantreleri" olarak tanımlanmıştır. (Türk Gıda Kodeksi Şeker Tebliği, 2006). Aynı tebliğ, glikoz şuruplarını sıvı ve kurutulmuş olarak ikiye ayırmaktadır. Glikoz şuruplarını sıvı, kuru maddesi en az %93 m/m olan glikoz şuruplarını ise kurutulmuş olarak belirtilmiştir. (Türk Gıda Kodeksi Şeker Tebliği, 2006).
Avrupa Birliği ülkelerinde patates, buğday ve mısır nişastalarından nişasta bazlı şeker üretilmektedir. Amerika, Güney Afrika ve Kore 'de mısır nişastası, bazı Asya ülkelerinde ve Güney Amerika’da tapyoka nişastası, Avustralya'da ise buğday nişastasını NBŞ üretiminde kullanılmaktadır. Ülkemizde ise mısır nişasta sanayinde de hammadde olarak tercih edilmektedir.
Nişasta bazlı şekerlerin üretimi, nişastaların kimyasal veya enzimatik yöntemler kullanarak parçalanması ile elde edilir; nişasta yapısında bulunan dekstrin ve basit
2
şekerlere kadar parçalanır. Bu işlem "Nişastanın Hidrolizi" veya "Nişastanın Konversiyonu " olarak adlandırılır. Nişastaların konversiyonunda kullanılan başlıca yöntemler asit, asit-enzim ve enzim-enzim yöntemleridir. Öncelikle nişastalar enzim yardımı ile ve ısıl işlem kullanarak sıvılaştırılarak dekstrinlere ve şekerlere parçalanır. Dekstrin ve şekerleri içeren nişasta sütü filtrasyon ve aktif karbon kullanılarak saflaştırılır ve istenen % kuru madde miktarına getirilir. Elde edilen üründe analizi yapılarak % DE yani glikoz dönüşüm derecesi belirlenir. % DE (dekstroz eşdeğerliği) glikoz şuruplarında yüz gram kuru maddede anhidrit D-glikozun gram olarak sayısı indirgen şekerlerin toplamını ifade eder. Dekstroz, nişasta polimerinin tamamen hidroliz olması ile oluşur. Pazardaki şuruplar ise, değişen DE değerine göre düşük veya yüksek molekül ağırlıklı glikoz şuruplarıdır. Glikoz şuruplarının birbirinden ayırt edilmesini içerisindeki şeker yüzdeleri belirler. Ürünler DE derecesine göre sınıflandırılır ve endüstriyel olarak % 20-95 DE değerlerinde üretimi yapılabilir. Ayrıca glikoz şurupları farklı karbonhidrat kompozisyonlarında da üretilebilir. Şurup özelliklerini belirlemede DE değeri tek başına belirleyici değildir.
Glikozun nişastadan yapılması yukarıda saydığımız gibi sakaroza göre daha fazla nem tutucu, kristallenmeyi engelleme ve daha ucuz olması gibi sebeplerle daha fazla tercih edilmektedir. Üretilen glikozlar genelde mısır nişastasından elde edilmektedir. Bu nedenle bu çalışmanın amacı patates, buğday ve mısır nişastalarından da glikoz şurubu elde edilmesi ve bu şekerlerin % DE karşılaştırmasının yapılması ile yüksek DE değerine sahip şurup hammaddesini tespit etmektir.
3
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
2.1. Nişasta
Nişastalar bitkilerin kök ve gövdelerinden elde edilen ve doğada bol miktarda bulunan doğal bir glikoz polimeridir. Mısır, buğday, patates, fasulye, soya ve muz gibi doğada bol yetişen pek çok bitkinin temel yapısını oluşturur (Pfister ve Zeeman, 2016; Lawal, 2019).
Nişastalar a-glikoz polimerlerinden oluşan bitkilerin kök ve gövdelerinde elde edilen bir polisakkarittir (Pfister ve Zeeman, 2016). Nişastaların yapıları 1-4 amilaz ve 1-6 amilopektin polimerlerinden oluşmaktadır. Amilaz ve amilopektin oranları nişastanın hammaddesine göre farklılıklar göstermektedir. Amilazlar doğrusal, amilopektin dallanmış yapıdadırlar (Zobel,1988).
Şekil 2-1 Nişasta moleküllerinde α- (1 → 4) ve α- (1 → 6) bağlantıları (Wang ve ark., 2014)
Nişastalar molekül yapılarındaki glikoz sayısı değişimi ile de farklı özellik kazanırlar. 23-29 glikoz molekülü olan nişastala tahıldan elde edilen nişastalardır. Yumru köklerden elde edilen nişastalar ise 30-34 glikoz içerir ve amilaz olarak zengindirler. 26-29 glikozlu nişastalar ise baklagillerden elde edilen nişastalardır (Bashir ve Aggarwal, 2019).
4
Amilaz Amilopektin
Moleküler yapı Doğrusal (α -1,4) Dallı (α -1,4; α -1 ,6)
Seyreltik Çözümler Kararsız Kararlı
Jelleri Sert, geri dönüşü olmayan Yumuşak, geri dönüşümlü
Filmler Tutarlı -
Karmaşık Oluşum Olumlu elverişsiz
İyot Rengi Mavi Kırmızı mor
Sindirilebilirlik % 100 % 60
Polimerizasyon Derecesi 1500-6000 3 x 101- 3 x 106 Çizelge 2-1 Nişasta Kesirlerinin Özellikleri (Zobel,1988)
Nişastalar yapılarını protein, yağ asidi ve minerallerin miktarları etkilemektedir. Ayrıca zaman, iklim değişiklikleri, coğrafi koşullar nişasta bileşim oranlarını ve yapısını etkilemektedir. Mısır, buğday ve patates en yaygın nişasta hammaddesidir. Ayrıca; tapyoka, pirinç ve arpa gibi tahıllardan da nişasta üretilip ticari olarak kullanılmaktadır. Farklı hammaddelerden elde edilmesi ve nişastanın jelleşme katkı maddesi olma gibi özelliklerinden dolayı nişastalar çok geniş bir kullanım alanına sahiptir. Pastacılık, atıştırmalık ürünler, şekerleme sektörleri gibi pek çok alanda kullanılmaktadır (Vamadevan ve Bertoft, 2015).
2.2.1.. Nişasta Çeşitleri ve Kullanım Alanları
Nişastalar doğal nişastalar, modifiye nişastalar ve hidroliz edilmiş nişastalar olarak üçe ayrılır (Bashir ve Aggarwal, 2019).
a) Doğal nişastalar, doğrudan içeriğinde bol miktarda nişasta barındıran bitkilerden alındıktan sonra işlem görmemiş nişastalardır (Bashir ve Aggarwal, 2019). Patates nişastası, mısır nişastası gibi hammaddesinin adı ile anılırlar. Beyaz, kokusuz, tatsız ve toz halindedir. Sos, katkı maddesi, unlu mamuller gibi alanlarda kullanılır.
b) Modifiye nişastalar, doğal nişastaların herhangi bir veya daha fazla özelliklerinin fiziksel, kimyasal veya enzimatik olarak değiştirilmesi ile elde edilir. Nişasta
5
doğada en çok bulunan hammaddelerden birisidir. Bu sebeple endüstride nişastaya farklı esnek özellik kazandırması, kullanım alanlarını genişletilmesi ve maliyetin düşürülmesi gibi nedenlerle nişastalar modifiye edilir. Bu sayede nişastanın kullanım alanları genişletilmiş olur (Bashir ve Aggarwal, 2019). Şekerleme, kıvam arttırıcı, film kaplama gibi alanlarda kullanılır.
Nişasta Kaynağı
Yapılan modifikasyon Kaynak
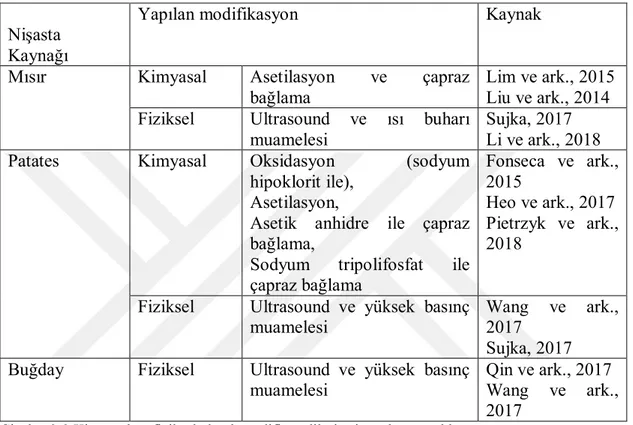
Mısır Kimyasal Asetilasyon ve çapraz bağlama
Lim ve ark., 2015 Liu ve ark., 2014 Fiziksel Ultrasound ve ısı buharı
muamelesi
Sujka, 2017 Li ve ark., 2018
Patates Kimyasal Oksidasyon (sodyum
hipoklorit ile), Asetilasyon,
Asetik anhidre ile çapraz bağlama,
Sodyum tripolifosfat ile çapraz bağlama Fonseca ve ark., 2015 Heo ve ark., 2017 Pietrzyk ve ark., 2018
Fiziksel Ultrasound ve yüksek basınç muamelesi
Wang ve ark., 2017
Sujka, 2017 Buğday Fiziksel Ultrasound ve yüksek basınç
muamelesi
Qin ve ark., 2017 Wang ve ark., 2017
Çizelge 2-2 Kimyasal ve fiziksel olarak modifiye edilmiş nişastalara örnekler
c) Hidroliz edilmiş nişastalar, nişastaların kimyasal ve enzimatik olarak parçalanması ile elde edilen şekerler ve nişasta türevleridir. Şekerli ürünler, etanol, organik asit eldesi gibi kullanım alanlarına sahiptir.
Hammadesine göre isimlendirilen doğal nişastalardan günümüzde en yaygın olarak mısır, patates ve buğday nişastası kullanılmaktadır.
Mısır; dünyada en yaygın ekimi yapılan tahıl ürünlerindendir. Mısır üretiminin %15 gibi bir oranı endüstriyel olarak işlenmeksizin doğrudan insanlar tarafından tüketilmektedir. Mısır kullanım alanı yaygın olan bir bitkidir (Nigam ve Singh, 1995). Mısırdan elde edilen nişasta endüstriyel olarak en az diğer nişastalar kadar önemlidir. Nem tutma kapasitesi şeker kristallerinin oluşmasını engellemesi nedeniyle özellikle pastacılık sektöründe sıklıkla kullanılmaktadır (Ali ve ark., 2016). Ticari olarak nişasta
6
yapımında mısır tercih edilmesi sebeplerinden biri de mısırın mevsim değişimlerinden az etkilemesi ve içeriğinde nişasta miktarının fazla olması etkili olmaktadır (Watson, 1984). Bir diğer özelliği ise, normal mısır nişastası ve waxy mısır nişastası olmak üzere iki çeşidinin bulunmasıdır. Nişasta kaynağına bağlı olarak amiloz ve amilopektin içeriği değişmektedir. Normal nişastada amiloz miktarı yaklaşık % 20 ile 30 arasında iken, amiloz miktarı %70 civarındadır. Bu oranlar waxy nişastalarda tamamen farklı olup, genellikle %100 amilopektin içermektedir (Kalochanpong ve ark., 2015).
Patates de insanların beslenmesinde kullanılan en önemli besinlerden birisidir. Patates C, B6 ve B1 vitaminleri, potasyum mineralleri, fosfor, kalsiyum ve magnezyum mineralleri ve demir ve çinko içerir ve lif bakımından da zengin bir bitkidir. (Bradshaw ve Ramsay, 2009). Patates ilk olarak Amerika’da yetiştirildiği ve oradan dünyaya yayıldığı bilinmektedir. Avrupa’da ilk olarak Hollanda’da yaygınlaştırıp geliştirilmiştir. Hollanda’da patates işleme fabrikaları kurulmuş ve sanayide kullanılmaya başlanmıştır. Ekimi yapılan patatesler insanların doğrudan kullanımı ve sanayi için ayrı ayrı yapılmaktadır. Fabrikalarda işlenecek patatesler ekilirken nişasta miktarı yüksek olan patates cinsi ekilip işlenmektedir (Grommers ve Van Der Krogt, 2009). Patatesten elde edilen nişastanın gıda endüstrisinde kullanımı kadar kağıt ve tekstil endüstrilerinde de kullanımına sıklıkla rastlanmaktadır (Jiang ve ark., 2016).
Buğday canlıların en eski ve önemli besin maddelerinden biridir. Dünyada ekimi ve tüketimi en yaygın yapılan bitkisidir. Buğday aynı zamanda mineral, vitamin ve lif kaynağıdır. (Shewry, 2009). Yapısında bulundurduğu nişasta yapısına ve özelliğine göre buğday ürünlerinin pişme özelliği değişmekte ve bu da onu kek, ekmek, kurabiye ve pasta gibi pastacılık ürünlerinde sıklıkla kullanılır yapmaktadır (Zhou ve ark., 2018).
Mısır, patates ve buğday nişastaların aşağıda belirtilen Çizelge 2.2’de nişasta kaynağına göre çeşitli özellikleri özetlenmiştir. Fonksiyonlarına bakılacak olunursa; mısır nişastasın kek ürünlerinde lif içeriğini artırdığı, bebek formüllerinde kalınlaştırıcı olarak görev yaptığı mısır şurubu üretiminde kullanıldığı bilinmektedir (González-Bermúdez ve ark., 2014; Sitohang ve ark., 2015; Guadarrama-Lezama ve ark., 2016). Buğday nişastasının jelleşme özelliği kattığı, patates nişastasının ise nişasta filmleri oluşturmada ve jelleşme özelliği sağlaması nedeniyle gıdalarda kullanıldığı bilinmektedir (Da Rosa Zavareze ve ark., 2012; Witczak ve ark., 2014; Pongjaruvat ve ark., 2014).
7 Nişasta kaynağı Amiloz Amilopekti
n Ort. Granül Büyüklüğü (μm) Kristallik (%) Patates nişastası 21% 79% 36 23–53 Tapyoka nişastası 17% 83% 14 31–59 Mısır nişastası 26% 74% 14,3 43–48 Pirinç nişastası 17% 83% 6 38 Buğday nişastası 25% 75% 7, 20 36–39
Çizelge 2-3 Nişastaların hammaddesine göre karşılaştırması (Ogunsona ve ark., 2018; Thakur ve ark.,2019)
Nişastalar küçük molekül ağırlıklı glikoz, maltoz, dekstrin gibi organik bileşiklerin üretilmesi için tekstil, laktoz, bira üretimlerinde de kullanılmaktadır (Zainab ve ark,2011). Nişastalar farklı hammaddelerden elde edilmektedir. Bu nedenle de çok sayıda endüstriyel kullanım alanları mevcuttur. Başlıca gıda, ilaç, kağıt, etanol, tatlandırıcı, bira ve laktik asit üretimi gibi sektörlerde kullanılmaktadır (Nigam ve Singh,1995; Waterschoot ve ark, 2015).
Nişastanın en önemli kullanım alanlarından biri de biyoetanol üretimidir. Biyoetonol, nişasta, şeker pancarı ve şeker kamışının fermantasyonu sonucunda üretilir. 2016 yılı baz alındığında 57,7 milyar litre ile dünyada Amerika Birleşik Devletleri en çok etanol üreten devlettir ve hammaddeleri mısırdır (Cheng ve ark., 2019; Abo ve ark., 2019).
Ayrıca, kağıt endüstrisinde de nişasta kullanılmaktadır. Nişastanın dünya üzerinde yaygın olarak üretilmesi ve ucuz olması sebebi ile öncelikli olarak tercih edilmektedir. Nişastanın polimer yapılı olması kağıt kaplanması konusunda kolaylık sağlamaktadır (Li ve ark., 2019).
Nişastalar gıda ve yem sektörü için en önemli enerji kaynaklarındandır. Buğday, patates, ve mısır tahıllar arasında en fazla ekimi yapılan ve tüketilen temel gıda maddesidir (Audilakshmi ve Swarnalatha, 2019).
8 2.1.2 Nişasta üretimi
Bitkilerde nişasta bir fotosentez ürünüdür. Endüstriyel olarak nişasta üretimi ise bitkilerden elde etme prosesidir. Temel olarak yapılan; bitkinin protein, selüloz, yağ ve çözünebilir madde gibi komponentlerinin ayrıştırılması ve nişastanın elde edilmesini içerir. İlk basamak fiziksel olarak ayırma işleminin parçası olan kırma, eleme ve santrifüj gibi işlemleri içerir. İkinci basamakta ise saf nişasta elde edilmesi için gerekli işlemler bulunmaktadır.
2.2. Nişastadan elde edilen ürünler
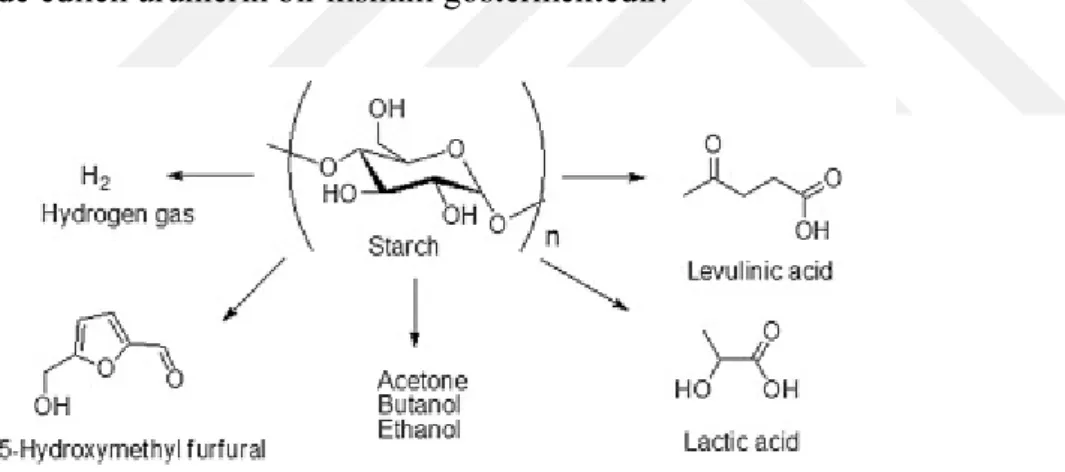
Nişasta çeşitli endüstrilerde doğrudan kullanılmasının yanı sıra çeşitli düşük moleküler ağırlığa sahip kimyasalların sentezlenmesinde de ana kaynak olarak kullanılmaktadır. Doğada en basit, ucuz ve en yaygın olarak bulunan bir bitki polisakkariti olması nedeniyle aseton-butanol-etanol (ABE) ya da 5-hidroksimetil furfural (HMF) gibi küçük organik moleküllerin üretiminde kullanımı sıklıkla görülmektedir. Şekil 2.2 nişastadan elde edilen ürünlerin bir kısmını göstermektedir.
Şekil 2-2 Doğrudan nişastadan elde edilen endüstriyel ürünler (Khlestkin ve ark.,2018).
Üretilen bu küçük moleküllere literatürden örnek vermek gerekirse Zhang ve ark. yaptığı çalışmada bir çalışmada (2007a) 30°C’de 13 enzimin görev aldığı nişastadan direk dihidrojen gazı üretimi glikoz başına 4 hidrojen gazı olarak yüksek verim göstermiştir. Başka bir çalışmada yine direk nişastadan HMF üretiminde asit katalizörlüğünde yaklaşık %68-69 verim elde edilmiştir (Teong ve Zhang, 2014). Levulinik asit çeşitli farmasetik ürünlerde kullanılan ve nişastadan elde edilebilen bir moleküldür. Liu ve ark. yaptığı bir çalışmada (2011) manyetik partiküller aracılığıyla % 95 verimle direk olarak nişastadan levunilik asit elde edilmiştir. Bir karboksilik asit olan
9
laktik asit gıda, kozmetik ve farmasetik endüstrisinde sıklıkla kullanılan bir moleküldür. Yine literatürde laktik asit üreten bakterilerden elde edilen bir çok enzim ile nişastadan laktik asit üretimine ait çalışma bulunmaktadır (Hofvendahl ve Hahn-Hägerdal, 2000; Zhang ve ark., 2007b; John ve ark., 2009; Xiao ve ark., 2011).
Levunilik asit ve laktik asit dışında nişastadan polimer endüstrisinde kullanılan bütirat ve metil laktat gibi çeşitli asit türevleri ve ayrıca 1,3-propanediol ve 2,3-butanediol gibi alkoller de üretilmektedir (Zheng ve ark., 2008; Liu ve ark., 2011; Khlestkin ve ark.,2018).
2.2.1. Nişasta Bazlı Şeker Eldesi ve Kullanım Alanları
Nişastanın hidroliz edilerek şurup eldesi 1811’de başlamıştır. 1831’da ise Amerikada bu metotla şerbet üretimi yapan bir şurup işletmesi kurulmuştur (BeMiller ve Whistler, 2009). Fakat 1970’lere kadar nişasta esaslı şekerlerin üretimi az yapılmıştır Ancak, 1976 yılından sonra üretim kapasitesinde belirgin şekilde artış olmuştur. 2000’lerde 8,5 milyon tonluk yüksek fruktozlu mısır şurubu üretimi ile ABD şeker sektöründeki payını % 45’in üzerine taşımıştır (Toprak, 2007). Dünya şurup üretiminde ABD en başta olmak üzere Japonya, Kanada daha sonra da Avrupa birliği ülkeleri gelmektedir. (Thomas, 1985, Karaoğlu, 2014). Nişasta büyük molekül ağırlığına sahip polimer bir bileşiktir.. Polimer yapının küçük moleküllü organik şeker elde edilmesi iki yöntemle yapılmaktadır. Nişastadan şeker eldesi asitle ve enzimatik hidroliz metodları ile gerçekleştirilmektedir.
2.2.1.1. Asitle Şeker Elde Edilmesi
Nişastalarda sıvılaştırılıp hidroliz edilerek daha küçük birimlere ayrılabilirler. Böylece nişastalardan farklı ürünler elde edilir. Nişastaların hidroliz edilmesi ile nişasta bazlı şekerler de elde edilebilir. Nişastaların sulu çözeltileri ısıtılırsa moleküller şişerler. Nişastalı ortama kuvvetli asit eklenip ısıtmaya devam edersek hidroliz olur ve daha küçük moleküllere ayrılıp monomerlerine kadar parçalanırlar. İlk olarak Kirschoff’un 1811 yılında yaptığı çalışmada sülfirik asit içerisinde kaynayan ham nişastadan tatlı bir şurup elde edilmiştir (Paolucci‐Jeanjean ve ark., 1999). Genellikle hidroklorik asit içerisinde yüksek sıcaklıkta ısıl işleme maruz bırakılarak nişastanın hidrolizi gerçekleştirilir. Bu işlem hidronyum iyonlarının glikosidik bağdaki oksijenlere
10
saldırması ve bağı hidrolize etmesiyle gerçekleşir (Pratiwi ve ark., 2018). Sıcaklık, asitlik ve süre hidrolizi etkileyen en önemli parametrelerdir (Whistler ve ark., 2012). Asit ile hidroliz işlemi nişasta granüllerinin yüzeyine saldırır ve bu nedenle yüzeyde bulunan amiloz ve amilopektin saldırıdan aynı anda etkilenirler. Hidroliz devam ettikçe de nişastanın fonksiyonel özellikleri değişkenlik gösterir (Wang ve Copeland, 2015). Nişastanın fizikokimyasal özellikleri değişirken, yapısı bozulmadan kalabilir (Betancur
ve Chel, 1997).
2.2.1.2.Enzim ile Şeker Elde Edilmesi
Nişastalar enzim ile hidroliz edilerek şeker oluştururlar. Enzimler, protein yapısında biyolojik katalizörlerdir.
Enzimler büyük moleküllerin yıkımı ve oluşturulmasında aktif olarak görev alırlar. Enzimlerle reaksiyon veren maddelere substrat denir. Enzimlerin ortamda aktive olması yani çalışması için sıcaklık, zaman, pH, konsantrasyon gibi faktörler gereklidir. Bu faktörler oluşturulduğunda enzim çalışmaya başlar. Enzimler denatüre edildiklerinde veya parçalandıklarında çalışmazlar.
Enzimler bazı reaksiyonlarda aktive olması için kofakör (Fe2+, Mg2+, Mn2+, Zn2+ gibi inorganik iyon) veya koenzim ( NAD, biotin gibi ) ortama eklenir.
Enzimler çalışma şartlarına göre altı gruba ayrılırlar.
Oksiredüktazlar; Oksidasyon (yükseltgenme) ve redüksiyon (indirgenme) reaksiyonlarında çalışan enzimlerdir
Transferazlar; reaksiyonlarda iki substrat arasında grupların transferini sağlayan enzimlerdir. Hidrojen dışındaki grupların transferini sağlar.
Liyazlar; Yükseltgeme veya hidroliz olmadan bağları koparan enzimlerdir.
İzomerazlar; optik ve geometrik moleküller içi düzenleme yapan katalizörlerdir.
11
Hidrolaz; ortama su molekülü ekleyerek değişik bağların hidrolizini yapan enzimlerdir. (Amilaz gibi)
Hidrolaz enzimleri nişastadan şeker elde etmek için kullanılır. Hidrolazlar, parçalayacağı kimyasal bağın ismine göre gruplandırılırlar. Nişastanın parçalanmasında amilazlar kullanılır. Nişastalardan elde edilen şekerler glikoz şurupları veya maltoz şuruplarıdır. Nişasta bazlı şeker eldesinde enzimatik yöntem asitli eldeye göre daha avantajlıdır ( Zainab ve ark, 2011).
α-amilaz; Hayvansal ve bitkisel kaynaklı besinlerde bulunurlar ve 1-4 glikozid bağlarının parçalanmasında aktiftirler. Bu nedenle NBŞ eldesinde birinci basamak enzim olarak kullanılır (Prakash ve Nivedita, 2010).
β-amilaz; Bitkisel kökenli besinlerde bulunur. 1-4 glikozid bağların parçalamakta kullanılır. Patates buğday soya en önemli kaynaklarıdır.
Glukoamilaz; 1-4 ve 1-6 glikozit bağlarını parçalanmasını sağlar. Nişastanın glikoza kadar parçalanmasını sağlar. Küf ve bakterilerden elde edilir.
Laktaz; Laktozu parçalar. Laktozsuz ürün oluşturmasını sağlar.
İnvertaz; sukrozu parçalar. İnvert şeker oluşumunda kullanılır.
Nişastalar büyük moleküllü bileşiklerdir parçalanmaları için yüksek ısı gereklidir. Bitkisel veya hayvansal kökenli amilaz enzimi yüksek sıcaklıkta denatüre olacağı için daha stabil, ısı ve aside dayanıklı enzimler tercih edilmektedir. Bu enzimler mikroorganizmalardan yani bakteri, mantar, küf gibi kaynaklar kullanılarak yapılmaktadır. Bu sayede enzimlerinde maliyeti düşmektedir. NBŞ’in enzimatik parçalanması için Bacillus licheniformis α-amilaz kullanılmıştır (Prakash ve Nivedita, 2010). α-amilaz hidroliz için kullanılan birinci enzimdir. Alfa amilaz eklenir, uygun pH ve sıcaklıklar ayarlanarak kaynatılan sulu nişasta çözeltisi once polimer yapıyı bozarak disakkaritler ve dekstrinlere parçalanır. Amiloglikozidaz enzimatik hidrolizde kullanılan ikinci enzimdir. Maltoz ve daha büyük moleküllü polisakkaritlerin de glikoz şurubuna dönüşmesini sağlar.
12
Mikroorganizma En uygun sıcaklık (°C)
Licyclobacillus acidocaldarius 75 Bacillus amiloliquefaciens 70 Bacillus flavothermus 60 Bacillus lentus 70 Bacillus licheniformis 100 Bacillus stearothermophilus 70–80 Bacillus subtilis 70 Chloroflexus aurantiacus 71
Çizelge 2-4 Mikroorganizma kaynaklı α-amilaz termostabil sıcaklıkları (Prakash ve Nivedita, 2010) Çizelge 2-4 görüldüğü gibi Bacillus licheniformis kaynaklı α-amilaz 100 °C sıcaklığa dayanıklıdır.
NBŞ eldesinde 95 °C 2-3 saat ısıtılarak hidroliz gerçekleşmekte ve nişastalar oligosakkarit, dekstrin, maltoz ve maltotrioza parçalanmaktadır.
1-4 glikozid bagları parçalanan nişasta glikoza kadar parçalanmak için glukoamilaz enzimi kullanılmalıdır. Aspergillus niger amiloglikozidaz mantardan elde edilen bir enzimdir. Nişastanın kompleks yapısı sebebi ile parçalanma içinde kompleks yapıda bir enzim gerekmektedir. Aspergillus niger amiloglikozidaz 1-6 glikozid bağları kolaylıkla parçalayarak nişastayı monomeri olan glikoza kadar parçalamaktadır (Parshikov ve ark., 2015). Şeker çözeltisine enzim eklenerek 60 °C 12-96 saat arasında bekletilir. Amiloglikozun çözeltiden uzaklaştırılması için ise pH 4-4,6 olarak ayarlanır ve 2 saat 4°C’de bekletilir. 11000 rpm de santrifüj edildikten sonra berrak kısım alınır. %10 aktif karbon eklenerek 55°C’de su banyosunda ortalama yarım saat bekletilir. 11000 rpm 5 dakika santrifüjlenerek berrak kısım alınarak HPLC de % DE bakılır. HPLC kolonuna zarar vermeden berrak bir çözelti elde edilmiş olur (Zainab ve ark, 2011).
2.2.2. Fruktoz Şurupları
Fruktoz, meyvelerde bulunan ve pancar şekeri olan sakkaroza göre 1,2-2 kat daha tatlı olan bir meyve şekeridir. Onun için tatlandırıcı olarak çok sayıda endüstriyel sektörde tercih edilmektedir. Fruktoz endüstride nişastanın enzimatik olarak sentezlenen yüksek fruktoz oranına sahip şeker olarak kullanılır. Genellikle mısır nişastasından üretilmektedir. Nişasta önce amilaz ve amiloglikozidaz ile glikoza dönüştürülür. Daha sonra ise özel bir enzim olan glikoz izomeraz kullanılarak fruktoza (fruktoz şurubu)
13
dönüştürülür (Şekil 2.3). Glikoz izomeraz D-Glukoz / ksiloz izomeraz (D-ksiloz ketol izomeraz; EC 5.3.1.5) dır ve geleceğin en önemli enzimlerinden olarak tahmin edilen ve en çok üretimi yapılan enzimlerdendir. Heterolaktikasit bakterileri tarafından üretimi yapılan glikoz izomeraz 80’lerden sonra nişasta endüstrisinde aktif kullanımına başlamıştır (Bhosale ve ark.,1996).
Fruktoz kullanım alanlarına göre %42, %55, %90… gibi oranlarda üretilmekte ve yüksek fruktoz şurubu (HFS) veya mısırdan üretimi yapılıyorsa yüksek fruktozlu mısır şurubu (HFCS) olarak kullanılmaktadır (Singh, ve ark., 2018). Ayrıca, yüksek fruktoz şurubu (HFS) düşük molekül ağırlığı, yüksek çözünürlük, lezzet, aside dayanıklılık,antioksidan etki ve nem tutuculuk gibi üstünlükler sağladığı için çok sayıda endüstriyel sektörde kullanılan ve tercih edilen önemli bir tatlandırıcıdır (Singh ve ark., 2018).
14 2.2.3. Glikoz Şurupları
Nişastanın hidrolizi ile dekstrin oluşur. Nişasta dekstrin ile monomer olarak aynı kapalı formüle sahiptir [(C6H10O5)n]. Fakat dekstrin küçük moleküllü yapışkan bir maddedir. Nişasta sütünün 200°C asidik ortamda ısıtılarak parçalanmasıyla dekstrin oluşur (Norman, 1982, Nagamori ve Funazukuri, 2004). Dekstrin suda çözünen fakat alkolde çözünmeyen, nem çekici ve tatlımsı bir hammaddedir. Polarize ışığı sağa çevirir. Bulunduğu ortamda Seyreltik asit olduğunda maltoza dönüşür. İyotlu suda üretim prosesine göre farklı renkler verir. Dekstrin kâğıt, kauçuk, döküm ve kozmetik sanayiilerinde ayrıca, yapıştırıcı olarak da tekstil sanayiinde kullanılmaktadır (Anonim, 2017).
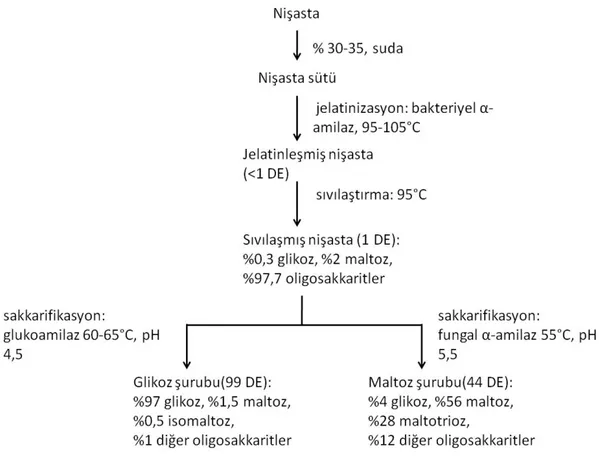
Dekstrinin hidrolizi ile glikoz (glikoz şurubu) oluşur. Glikoz basit şekerdir. Vitamin C ve E vitaminleri, penisilin ve diğer antibiyotikleri üretmek için fermantasyonda da kullanılır. Aynı zamanda sitrik asit, lisin, aminoasitler, etanol, plastik ve poliester gibi petrol türevli malzemeler başka alternatifler üretilmesi için kullanılır. Gıda dışı uygulamalarda kimya, ilaç ve ilaç endüstrisinde de kullanılır (Das ve Pal, 2015). Glikoz şurubu, kontrollü şekilde nişastanın hidrolizi ile elde edilen ve saflaştırılmış glikoz, maltoz, ve diğer glikoz polimerlerinin içeren çözeltidir. Şeker ve beyaz renk için kullanılır. Glikoz şurubu pancardan üretilen şekerin (sakkaroz) yerini tutmaz. Kalorisi düşük ve şekeri daha azdır. Bu nedenle daha çok endüstride kullanılır. Glikoz şurubu nişastanın hidrolizasyon derecesi; zaman, sıcaklık, pH ve seçilen enzime bağlı olarak değişir. Bu etmenler ticari kullanılm amacına göre seçilmektedir. Glikoz şuruplarının piyasada sınıflandırılması dekstroz eşdeğeri (DE) esasına göre yapılır. Glikoz şuruplarının indirgenmiş şeker miktarı DE olup, dekstroz cinsinden hesaplanır (Karaoğlu, 2014; Civan, 2014).
Dekstroz Eşdeğerinin Tayini “İnsan Tüketimine Sunulan Şekerlerin Analiz Yöntemleri Tebliği”nde verildiği gibi birden fazla yöntemle analizi yapılır ve tebliğe göre yapılarak hesaplanır (Türk Gıda Kodeksi Yönetmeliği, No: 2002-26, 2002). DE terimi nişastanın glikozadönüşüm derecesini ifade eder. DE glikoz şuruplarında yüz gram kuru maddedeki anhidrit D-glukozunun gram olarak indirgen şekerlerin toplamını ifade eder. Nişastanın hidroliz olma derecesini son ürünün kompozisyonu belirler. Elde edilen üründe nişastanın tamamen parçalanması ile dekstroz oluşur. Elde edilen şerbet, DE
15
değerine göre yüksek veya düşük molekül ağırlıklı tekli yada çoklu glikoz polimerleri içerir. Glikoz şurubunun yapısındaki karbonhidrat kompozisyonu ve sakkaritin yüzdesi şurupların birbirinden ayırt edilmesini sağlar ve kullanım alanlarını belirlenmesinde yol gösterir. Glikoz şurubu pancar şekeri ile kullanılarak yüksek kalite sağlanmaktadır (Anonim, 2007).
Şekil 2-4 Enzimatik Yöntemle Glikoz Şurubu Üretim Prosesi
2.2.4.Fruktoz Şurubu İle Glikoz Şurubu Arasındaki Farklar
Glikoz tüm canlılar için enerji kaynağıdır. Canlıların yaşamsal faaliyetlerini sürdürebilmesi mesi için glikoz gereklidir. Glikoz hücreler tarafından kolayca sentezlenir. Tükettiğimiz tüm gıdalardaki karbonhidratlar ve şekerler vücüdumuz tarafından glikoza dönüştürülerek kullanılırlar. Glikozun fazlası ise karaciğer tarafından yağa dönüştürülerek depolanır. Glikoz kana karışır ve pankreas kandaki glikozu insülün hormonu sayesinde hücrelere aktarır. Fruktoz ise hücreler tarafından direk kullanılamaz. Fruktoz sadece karaciğer tarafından metabolize edilmektedir. Fazla alınan fruktoz karaciğerde depolanır bir kısmıda trigliserit olarak direk kana karışır. Glikoz açlık
16
hormonunu (leptin) dengeler fruktoz ise açlık hormonunu arttırır ve şişmanlığa sebeb olur.
Doğal gıdalardan direk aldığımız glikoz ve fruktoz belli bir sınıra kadar vucutta kolaylıkla harcanarak kullanılır. Günümüzde hazır gıda kullanımının artması ile NBŞ tüketimi artmıştır. Obezite dünyanın en önemli sorunlarından birisidir. Amerika’da yetişkinlerin %70 inin, çocukların ise %20 sinin obezit olduğu tespit edilmiştir. Yüksek fruktozlu mısır şurubunun da (HFCS) kullanımının yaygınlaşması ile fruktoz şurubu alımların da ciddi bir artış olduğu gözlenmektedir. Yüksek glisemik indeksi içeren gıdaların çok tüketimi, insanlarda kardiyovasküler ve şişmanlık gibi pek çok hastalığın ortaya çıkmasını sağlamıştır. Glisemik indeksinin yükselme sebebi şekerin kana hızlıca geçiş sağlamasıdır (Loureiro ve Martel, 2019).
2.2.5. Türkiye’de Üretim ve Kullanım Miktarları
Avrupa Birliği'nde, patates, mısır ve buğday nişastaları NBŞ üretiminin hammadde olarak kullanılmaktadır. Mısır nişastası ABD, Kore ve Güney Afrika ülkelerinde, buğday nişastası Avustralya'da ve tapyoka nişastası ise Güney Amerika ve bazı Asya ülkelerinde NBŞ üretimi için kullanılmaktadır (Dávila ve ark., 2014).
Türkiye’de şeker üretimi usul ve esasları fiyatlandırması pazarlaması dahil her şey 4634 sayılı kanun ile düzenlenerek 2001 yılında yürürlüğe girmiştir. Bu kanunun uygulanması Sanayi ve Ticaret Bakanlığı’na aittir. Kanuna göre şeker, beyaz şeker ve çeşitleri kahverengi ve esmer şeker pancar şekerinden elde edilen sakkaroz ve nişasta kökenli sıvı ve kurutulmuş glikoz ve izoglikoz ve her ikisinin karışımı invert şeker ve inülin şurubu olarak tanımlanmıştır. Bu kanun ile ülkemizin şeker ihtiyacının %90’nının pancar şekerinden üretilen %10’unun ise NBŞ’den karşılanması planlanmaktadır. Bakanlık ülkenin üretim tüketim durumuna göre gerekli durumlarda şekerler için dönemsel kota getirebilir. Bakanlar kurulun görüşü ile %50 arttırıp azaltabilirler (Şeker Kanunu 4634, 2001).
Şeker, şeker pancarı ve şeker kamışından elde edilmektedir. Şeker kamışından daha ucuza üretilmesine rağmen ülkemizin coğrafi olarak şeker kamışı üretimine el vermemesi sebebi ile şeker pancarından şeker üretimi yapılmaktadır. Şeker pancarını çabuk bozulması sebebiyle ekim alanlarına yakın yerlerde şeker fabrikalarının olması
17
gerekmektedir. Ülkemizde şeker denetimi devlete ait olduğu için ülke nüfusunun artışı ve talebin karşılanması adına 2001 yılına kadar ülkenin farklı yerlerine şeker fabrikaları açılmıştır. Bu sebeple de sürekli olarak şeker üretimi ülke geneline coğrafi olarak yetişebilen alanlara yayılmıştır. Fakat devlet politikası olarak şeker fabrikalarını özelleştirilmesi ve tarımsal hastalıklardan dolayı şeker pancarı üretiminde azalma olmuştur.
Nişasta üretim bitkilerinin ve özelliklerinin değişimi ürünün kullanım alanlarını genişletimektedir. İhtiyaçlar doğrultusunda çalışmalar yapılarak uygun nişastalar üretilmekte ve sanayide kullanılmaktadır. Bu da nişasta çeşidinin artmasına katkı sağlamaktadır. Nişasta fonksiyonel bir üründür. Nişasta tüketiminin 2012 yılında tüketimi 75 milyon tondur (Waterschoot ve ark, 2015). Nişastaların kaynakları mısır (%73), buğday %9, patates %6, tapyoka %11 ve diğer hammaddeler de %2-3 oranlarındadır (Bashir ve Aggarwal, 2019). Görüldüğü üzere piyasada en yaygın olarak mısır nişastası şurubu üretilmekte ve kullanılmaktadır.
Ülkemiz nişasta sanayinde de hammadde olarak mısır kullanılmaktadır. Bu çalışmada buğday, mısır ve patates nişastasından enzimatik olarak glikoz şurubu elde edilmesi ve bu glikozun % DE değerlerini hesaplanıp karşılaştırması yapılmıştır. Elde edilen veriler ilerleyen aşamada Şeker Fabrikalarında ön veri olarak kullanılması düşünülmektedir.
18 3. MATERYAL VE METOT
3.1. Kimyasallar ve Nişastalar
Mısır, patates ve buğday nişastaları sırası ile Cargill, Konya Şeker San ve Tic. A.Ş., Rotel İç ve Dış Ticaret A.Ş’den temin edildi. Enzimler α – amilaz (endo-1,4-α-D-glukan glukohidrolaz, E.C.3.2.1.1) (Bacillus licheniformis’den elde edilen α – amilaz) ve amiloglikozidaz (1,4-α-D-glukan glukohidrolaz, EC 3.2.1.3) Sigma firmasından temin edildi.
3.2. Nişastaların Karakterizasyonu
3.2.1. Nem Analizi
Mısır, patates ve buğday nişastalarının ilk olarak TS 1135 EN ISO 712 standardına göre % nemlerine bakıldı. Daha önce sabit tartıma getirilmiş numune kaplarının tartımı alınıp yazıldı (m). Numune kaplarına onar gram nişasta tartılıp kaydedildi (M1). 102 °C sıcaklıkta 3 saat etüvde bekletilip desikatöre alındı. Soğuyan numune kapları tekrar
tartılarak (M2) yüzde kuru maddesi hesaplandı. Nişastalar etüv (Binder) ile nem
tayinleri yapıldı. Aşağıda belirtilen formül ile % nem değeri hesaplandı.
% Nem = (M − M ) x 100 M − m⁄ (1)
3.2.2. pH Analizi
Nişasta numunelerin pH değerleri TS 11149 standardına göre ölçüldü.
3.2.3. Nişasta Analizi
100 ml’lik balon jojeye 2,5 g öğütülmüş numune tartıldı. İçerisine 50 ml % 1,128 lik HCl çözeltisi ilave edildi. Manyetik karıştırıcılı ısıtıcı üzerine 2000 ml hacimli bir beher konuldu. Yarısına kadar su doldurulup ısıtıcı çalıştırıldı. Su kaynamaya başladığında balon joje beher içerisine konuldu ve karıştırarak 15 dakika bekletildi. Süre dolduktan sonra balon joje çıkartılarak içerisine 5-10 ml saf su ilave edildi ve soğuk su ile soğutuldu. Daha sonra içerisine 5 ml Carez 1 ve 5 ml Carez 2 çözeltilerinden ilave edildi. Saf su ile hacim çizgisine tamamlanarak çalkalandı. Balon joje içerisindeki karışım süzüldü ve süzüntünün optik sapması polarimetreden (ATAGO) okundu.
19 3.2.3. Protein Analizi
Nişasta numunelerinden 1’er g tartıldı. Hidroliz için yakma tüpü içerisine konuldu. İçerisine 2 adet Kjeldahl tablet eklenip üzerine 20 ml %98’lik derişik sülfürik asit ilave edildi. Yakma tüpleri yakma ünitesine yerleştirilerek yakma ünitesinde yaklaşık 45 dakika 420ºC sıcaklıkta bekletildi. Yakma işleminden sonra soğutuldu. Soğutulduktan sonra yakma tüpü destilasyon ünitesine (BUCHİ K355) yerleştirildi. Destilasyon ünitesinde soğutucu altına içinde 25 ml %4 ‘lük borik asit (pH 4,6) olan erlenmayer konuldu. Cihazın kapağı kapatılarak çalıştırıldı. % 40’lık NaOH ve H2O ile destilasyon
yapıldı. Destilasyon cihazı durduktan sonra erlenmayer alınarak içerisine 3-4 damla indikatör çözeltisi damlatıldı ve 0,1N HCl ile titre edildi. Yeşilden mavi-mora renk dönüşümü sağlandı. Renk dönüşümü olduğu andaki sarfiyat kaydedildi. Kör deney için numune konulmadan hidroliz ve titrasyon gerçekleştirildi ve sonucu kaydedildi. Protein miktarı aşağıda belirtilen formüle göre hesaplandı.
% =( − ) 0.014 100 (2)
% = % (3)
Yukarıda verilen formüllerde v1 titrasyonda harcanan H2SO4 çözeltisi veya HCl
çözeltisi miktarını (mL); v0 kör deneme titrasyonunda harcanan H2SO4 çözeltisi veya
HCl çözeltisi miktarını (mL); N titrasyonda kullanılan H2SO4 çözeltisi veya HCl
çözeltisinin normalitesini (0.1 N); 0.014 değeri azotun mili ekivalen ağırlığını; m alınan gıda örneği miktarını (g veya mL) ve F de gıdalara ait katkı sayısını temsil etti. F değeri gıdaya göre Çizelge 3.1 belirtilen faktörlerden belirlendi.
20
Gıda maddesi Faktör
Et, yumurta, fasulye, bezelye 6,25
Çikolata 6,25
Mısır 6,25
Buğday, makarna 5,70
Arpa, çavdar, yulaf 5,83
Un 5,70 Soya ve ürünleri 5,71 Süt ve ürünleri 6,38 Kabuklu yemişler 5,30 Jelatin 5,55 Genel faktör 6,25
Çizelge 3-1 Gıdalara göre faktör değeri
Şekil 3-1 Çalışma kapsamında kullanılan destilasyon cihazı 3.2.5. Lif Tayini
Enzimatik parçalanma için; 50 mL falcon tüplerine 1 g örnek tartıldı. Üzerine 40 mL MES/TRIS çözeltisi eklenerek çözelti karıştırıldı. Üzerine 50 µl α -amilaz çözeltisi eklenip, karıştırıldıktan sonra 95-100C°‘da 30 dakika inkübe edildi. Çözelti 60 C°’ye soğutuldu ve üzerine 50 µl proteaz çözeltisi eklenip, karıştırıldı. Çözelti 60 C°’de 30 dakika bekletildi ve üzerine 5 mL 0.561 N HCL eklenerek çözeltinin pH’yı 4.1-4.8 aralığına getirildi. Çözeltiye 150 µl amiloglukosidaz çözeltisi eklenip 60 C°’de 30 dakika bekletildi.
21
İnkübasyon sonrası örnek 220 mL etanol ile 60 C°’de yıkanarak temiz bir erlene aktarıldı. Daha sonra bu çözelti ağzı kapatıldı ve 1 saat bekletilip, vakum yardımı ile gooch krozesinden süzüldü. Çökelek sırasıyla %78’lik etanol (3x15 mL) , %95’lik etanol (2x10 mL) ve aseton (3x10 mL) ile yıkantan sonra 105 C°’de 1 gece etüvde bekletildi. Bu işlemden sonra tartıma alındı (m2). Örneğe ait tekrarlardan birinde kül (k), diğerinde protein (p) analizi yapıldı. Değerler aşağıda belirtilen formülle hesaplandı.
% = ( − ) − ( + ) 100/ (4)
Yukarıda verilen formüllerde m2- m1 alınan numune miktarını; k kül analiz sonucunu; p
protein analiz sonucunu temsil etti.
3.2.6. Yağ Tayini
Analiz yapılacak numunelerden 3-5 g tartıldı. Üzerine 50-75 ml saf su eklendi ve ısıtıcıya konuldu. Kaynamaya başlayınca 25 ml %37‘lik HCl eklendi. Ortalama 20 dakika kaynatıldı ve hidroliz tamamlandı. Süzgeç kağıdında süzüp sıcak su ile yıkandı. Soxhelet tüplerine koyulup etüvde kurutuldu. Buchi Soxhelet cihazına bağlandı. Soxhelet beherinin darası alınıp tablodaki belirtilen miktarda n-hegzan koyulup cihazın analizi tamamlaması beklendi. Cihazdan soxhelet beherleri alındı etüvde hegzanlar uçuruldu. Kalan miktardan hesaplama yapıldı.
% ğ= ( − ) 100/ (5)
Yukarıda verilen formüllerde m1 analize alınan numune miktarını (g); m2 analiz
sonunda Soxhelet beherinde kalan miktarı (g) temsil etti.
3.2.7. Kül Tayini
Analiz için numuneler hazırlandı. Krozenin darası kaydedildi (m1). Daha sonra
numuneden 3-5 g numune krozeye tartıldı. Kül fırınında yakma işleminden önce yaklaşık 500-550ºC’de ön yakma işlemi uygulandı. Numunelerin üzerine % 67’lik etil alkolden 1-2 ml eklenerek kül fırınına konuldu. Krozeler alev aldıktan sonra dışarı çıkarılarak alevin sönmesi beklendi ve tekrar kül fırına konuldu. Fırın sıcaklığı 500-550
22
ºC’ye ayarlanarak 7-8 saat bekletildi. Krozeler desikatöre alındı oda sıcaklığına gelene kadar bekletildi ve tartım yapıldı (m2).
% ü = − 100 (6)
Yukarıda verilen formüllerde m1 sabit tartıma getirilen krozenin ağırlığını, m2
yakmadan sonraki kroze ve kül ağırlığını ve m alınan numunenin ağırlığını temsil etti.
3.2.8. Taramalı Elektron Mikroskop (SEM) Analizi
Buğday, mısır ve patates nişasta granülleri kritik nokta kurutucusu tarafından kurutulduktan sonra iyon kaplatıcı ile altın kaplandı. Örnekler, Hitachi SU-5500 SEM ile incelendi ve granüllerin partikül boyutları ölçüldü.
3.2.9. Fouirer Transform Infrared Spektrofotometre (FTIR) Analizi
Buğday, mısır ve patates nişasta örnekleri kızılötesi spektroskopisi kullanılarak karakterize edildi. Örneklere ait atomlar arasındaki bağların titreşimiyle oluşan frekanslara karşılık gelen absorbans pikleri FTIR cihazı (Bruker Vertex 70 FTIR) ile 4000–400 cm−1 arasında ölçüldü.
3.2.10. X-Işınları Kırınım (XRD) Analizi
Buğday, mısır ve patates nişastalarının kristaline yapılarını incelemek için X- ışını difraktometresi (XRD) (Bruker D8 DAVINCI) kullanıldı. Örneklere ait difratogramlar 2θ =10-80° aralığında 40 mA akım altında Cu-Kα radyasyonu (λ=1.5406 Å) kullanılarak analiz edildi. Sonuçlar Match yazılımı (Demo version 1) ile 2θ =10-34° aralığında grafik haline getirildi.
3.3. Glikoz şurubu eldesi
Mısır nişastası için önce %2, %5, %20, %30 ve %40’lık sulu çözeltileri hazırlandı. Çözeltilerin pH değerleri 6-6,2’ye ayarlandı. %0,2 (ml/kg) α–amilaz (Sigma A3403) enziminden eklenerek geri soğutucu altında 2 saat 95 ±5 °C ‘de kaynatıldı. Oda sıcaklığına kadar soğutulan çözeltilerin pH değerleri pH 4-4,2’ye ayarlandı. Çözeltilere %0,2 (ml/kg) amiloglikozidaz (Sigma A7095) eklendi. Enzim eklenmesinden sonra nişasta çözeltileri 60±5°C ve sıcak su banyosuna yerleştirildi ve 100 rpm hızda 24 saat
23
bekletildi. İnkübasyon süreleri sonunda çözeltiler alındı. Çözeltilerin pH değerleri 9 olarak ayarlandı ve 7000 rpm santrifüjlendi. Santifüjden sonra berrak kısımdan 0,5 ml alındı ve 5 ml’ye su ile tamamlandı. Çözeltiye 5 ml asetonitril (Merck 1,00030) eklenerek çözüldü ve HPLC analizine alındı.
Şekil 3-2 Hazırlanan nişasta çözeltileri
Kullanılan amilaz enziminin miktar optimizasyonu için %30’luk mısır, buğday ve patates nişastaları hazırlandı. Çözeltilerin pH değerleri ayarlanıp %0, 1, % 0,2 ve %0, 3 α - amilaz enzimi eklendi. Çözelti geri soğutucuda 2 saat 95 ±5 °C ‘de kaynatıldıktan sonra oda sıcaklığına kadar soğutuldu ve çözeltilerin pH değerleri 4-4,2’ye ayarlandı. Çözeltilere %0,2(ml/kg) amiloglikozidaz eklendi. Enzim eklenmesinden sonra nişasta çözeltileri 60±5°C ve sıcak su banyosuna yerleştirildi ve 100 rpm hızda 24 saat bekletildi. İnkübasyon süreleri sonunda çözeltiler alındı. Çözeltilerin pH değerleri 9 olarak ayarlandı ve 7000 rpm santrifüjlendi. Santifüjden sonra berrak kısımdan 0,5 ml alındı ve 5 ml’ye su ile tamamlandı. Çözeltiye 5 ml asetonitril eklenerek çözüldü ve HPLC analizine alındı.
Kullanılan amiloglikozidaz enziminin inkübasyon süresinin optimizasyonu için %30’luk mısır, buğday ve patates nişastaları hazırlandı. Çözeltilerin pH değerleri ayarlanıp % 0,2 α - amilaz enzimi eklendi. 24 saatlik kaynatma işleminden sonra çözeltiler soğutuldu ve pH ayarlaması yapıldı. Çözeltilere % 0,2 (ml/kg)
24
amiloglikozidaz eklendikten sonra nişasta çözeltileri 60±5°C’de, 100 rpm hızda 24, 48 ve 72 saat bekletildi. İnkübasyon süreleri sonunda çözeltiler HPLC analizine hazırlanarak analizleri yapıldı.
3.4. Yüksek Performans Sıvı Kromatografisi Analizi (HPLC)
HPLC analizi için Thermo HPLC cihazı kullanıldı. Mobil faz olarak ¼ oranında su: asetonitril hazırlandı. Kolon olarak Agilent (USCY003689) marka karbonhidrat kolonu kullanıldı. Analiz koşulları akış hızı 1 ml/dak ve sıcaklık 40°C olacak şekilde ayarlandı. Enjeksiyon hacmi 20 µl olup RID dedektör ile 3 enjeksiyon olacak şekilde analiz gerçekleştirildi. Tüm çalışmalar üçer tekrar ile çalışıldı, sonuçlar ortalama ve standart sapma olarak verildi.
Şekil 3-3 Çalışma kapsamında kullanılan HPLC cihazı
3.5. Glikoz Şuruplarının Dekstroz Eşdeğerlerinin (DE) Değerlendirilmesi
Çalışma sonucunda elde edilen glikoz şuruplarının dektroz eşdeğerlerini belirlemek için Lane-Eynon Metodu uygulandı. Elde edilen glikoz şuruplarının DE değerleri aşağıda verilen formülle (7) hesaplandı. Karşılaştırma için saf glikozun DE 100 değerine, saf nişastanın ise DE 0 değerine sahip olduğu bilgisinden yararlanıldı.
DE =
ş ş (%)25 3. BULGULAR
4.1 Nişastaların Kimyasal ve Fiziksel Karakterizasyonu
Bu çalışmada glikoz şurubu eldesi öncesi deney kapsamında kullanılan buğday, mısır ve patates nişastalarının fiziksel, kimyasal ve morfolojik karakterizasyonları gerçekleştirildi. Çizelge 4.1’de üç farklı botanik kökene ait nişasta örneği için nem, nişasta miktarı, pH, protein, lif, yağ ve kül miktarları belirtildi.
Nişasta çeşidi % Nem % Nişasta pH % Protein % Lif % Yağ % Kül Mısır Nişastası 8,81 88,26 4,48 1,34 1,01 0,51 0,07 Patates Nişastası 10,85 86,96 7,64 0,67 0,98 0,29 0,25 Buğday Nişastası 10,25 86,53 6,51 0,86 1,95 0,23 0,18
Çizelge 4-1 Üç farklı nişasta çeşidine ait kimyasal özellikler
Nişastaların fiziksel özellikleri mikroskop altında incelendi ve %5’lik oda sıcaklığında hazırlanan nişasta örneklerine ait mikroskop görüntüleri Şekil 4.1 ‘de verildi. Görsel olarak bakıldığında mısır ve buğday nişastasının ortalama 10 dakikada çökelti oluşturduğu fakat berraklık olmadığı gözlendi. Patates nişastası ise ortalama 5 dakika içerisinde tabana çökelti oluşturdu (Şekil 4.2).
Şekil 4-1 Ham nişasta granüllerinin ışık mikroskobu görüntüleri. A mısır nişastasına, B buğday nişastasına ve C patates nişastasına ait 40X görüntüleri.
26
Şekil 4-2 Oda sıcaklığında % 5 içerikli hazırlanan nişasta çözeltilerine ait resim (Resimdeki P patates nişastasını, B buğday nişastası ve M mısır nişastasını temsil etmektedir).
4.2 FTIR analizi
Buğday, mısır ve patates nişasta granüllerine ait FTIR sonuçları analiz edildi ve Şekil 4.3’de gösterildi. Bu kuru örneklere ait spektraya bakılacak olunursa 3393 cm-1 deki geniş bant O-H gruplarının esneme modunu, 1649 cm-1’deki bant karboksil gruplarına ait hidrojen bağlarını gösterdi. Spektradaki 1148 cm-1 ve 2931 cm-1’de görülen bantlar ise C-O ve C-H esnemelerine aitti. Örneklerin FTIR spektrasında görülen 1700-1200 cm-1 arasındaki bölgeye ait bantlar muhtemelen nişastalardaki protein ve yağ gibi az miktarda bulunan bileşenlerden kaynaklandığı düşünüldü. Her ne kadar bu bileşenlere ait spektralar görülse de, nişastanın temel bileşenleri olan amiloz ve amilopektine ait temel bantlar üç nişasta örneğinde de görüldü. 800 altında kalan bölgedeki bantların glikoz piranoz halkalarının titreşmesinden kaynaklı olduğu ve yaklaşık 932 cm-1’de görülen bandınnişasta amilozundaki glikoz moleküllerinin α-1,4 bağlantısını gösteren iskelet moduna ait olduğu belirlendi.
27
Şekil 4-3 Buğday, mısır ve patates nişasta granüllerine ait FTIR spektrum analizi; mavi renkli olan spektrum buğday nişastasına, kırmızı renkli olan spektrum mısır nişastasına ve yeşil renkli olan spektrum patates nişastasına aittir.
4.3 XRD analizi
X ışınları kristolografisi ile oluşturulan kırınım desenleri nişastanın yarı-kristallin yapısını karakterize etmek amacıyla kullanıldı. Buğday ve mısır nişastalarına ait kırınım deseninde A tipi kristaline görülmesi, patates nişastasında ise B tipi kristaline yapının görülmesi beklendi. Şekil 4.4’de gösterilen kırınım deseninde büyük pikler kristalin bölgelerini temsil ederken daha küçük pikler nişastanın amorf bölgeleri gösterdi. Buğday ve mısır nişastasına ait desenlerde 15° ve 23° ‘de kuvvetli pikler, 17° ve 18°’de çift pikler görüldü. Bunlar dışında, 11°, 20°, 26° ve 30°’de zayıf pikler belirlendi. Patates nişastası kırımın deseninde ise B tipi desene uyumlu olarak 17° ‘de kuvvetli, 15°, 19.7°, 21.8° ve 24°’de daha zayıf pikler görüldü.
28
Şekil 4-4 Buğday, mısır ve patates nişasta granüllerine ait X ışınım kırınım desenleri. 4.4 Nişastaların Morfolojik Karakterizasyonu
Bu çalışma kullanılan buğday, mısır ve patates nişasta örneklerinin morfolojik karakterizasyonu için SEM analizi gerçekleştirildi ve mikroskop görüntüleri Şekil 4.5’de gösterildi. Görüldüğü üzere, nişasta granülleri hem şekil hem de boyut olarak buğday, mısır ve patateste farklılık gösterdi. Buğday nişastasına ait granüller merceksi bir şekle sahip iken, mısır nişastasının granülleri keskin kenarlara sahip düzensiz şekillere sahiptir. Patates nişastasına ait granüller ise düz ve elipsoidal şekle sahipti. Granül boyutları karşılaştırıldığında (Şekil 4-5 C, F ve I) mısır nişastasının diğerlerine
29
göre daha küçük granül boyutuna sahip olduğu görüldü. En büyük granüllere sahip patates nişastasının granülleri ortalama 25,4 µm iken buğday nişastasının ortalama granül boyutu yaklaşık 16,2 µm ölçüldü.
Şekil 4-5 Ham nişasta granüllerinin SEM görüntüleri. A, B ve C buğday nişastasına ait 500X, 1500X ve 2500 X görüntüleri; D, E ve F mısır nişastasına ait 500X, 1500X ve 2500 X görüntüleri; G, H ve I patates nişastasına ait 500X, 1500X ve 2500 X görüntüleri.
4.5 Nişastadan Glikoz Şurubu Eldesi
4.5.1.Başlangıç Nişasta Yüzdesinin Son Ürüne Etkisi
Başlangıç nişasta miktarının glikoz şurubu elde edilmesindeki etkisinin değerlendirilmesi amacıyla ilk yapılan optimizasyon basamağı olarak farklı konsantrasyonlarda nişasta çözeltileri hazırlandı. Bu ve ilerleyen optimizasyon basamaklarında referans nişasta olarak mısır nişastası belirlendi ve % 2, 5, 10, 20, 30 ve 40 mısır nişastası içeren sulu çözeltiler hazırlandı. Çizelge 4.2’de farklı nişasta yüzdeleriyle iki enzimatik basamak sonucunda üretilen şurupların içerikleri belirtildi. % 2’lik nişasta çözeltisinden yaklaşık % 0,22 glikoz ve %88 maltoz elde edilirken, nişasta miktarı 20 kat arttırıldığında glikoz ve maltoz içerikleri de yaklaşık 20 kat arttı. Bu
30
değerlerden elde edilen nişasta miktarına karşılık şeker miktarlarına ait grafiklere bakıldığında glikoz, maltoz ve diğer şekerlerin nişasta yüzdesindeki artışla birlikte arttığı görüldü. Şekil 4.6’da da görüldüğü gibi en yüksek glikoz ve maltoz miktarı % 40’lık nişasta çözeltisi ile elde edildi.
Nişasta yüzdesi Glikoz (%, m/m) Maltoz (%, m/m) Yüksek şeker 1 (%, m/m) Yüksek şeker 2 (%, m/m) Yüksek şeker 3 (%, m/m) % 2 0,213±0,00 6 0,867±0,011 0,163±0,01 4 0,546±0,01 0 0,225±0,00 5 % 5 0,686±0,00 5 2,722±0,094 0,150±0,00 2 1,676±0,00 4 0,605±0,00 5 % 10 1,274±0,01 6 5,107±0,024 0,225±0,13 4,587±0,02 9 1,122±0,00 5 % 20 2,499±0,00 3 9,984±0,012 1,126±0,01 5 5,987±0,00 9 2,260±0,02 7 % 30 3,603±0,00 7 12,964±0,03 0,024±0,00 9 11,349±0,0 13 4,142±0,01 4 % 40 4,182±0,00 9 14,832±0,088 1,440±0,02 7 12,891±0,5 08 4,531±0,01 9
Çizelge 4-2 Farklı mısır nişastası miktarlarının son ürüne etkisi
Şekil 4-6 Başlangıç nişasta içeriğinin glikoz ve maltoz içeriğine etkisi. 0 2 4 6 8 10 12 14 16 2 5 10 20 30 40 Ş e k e r m ik tar ı (% m /m ) Nişasta içeriği (%) Glikoz Maltoz
31
4.5.2.Amilaz Enzimin İnkübasyon Süresinin Son Ürüne Etkisi
Başlangıç nişasta miktarının glikoz şurubu elde edilmesindeki etkisinin değerlendirilmesi ve nişasta çözeltisinin yüzdesinin belirlenmesinden sonra amilaz enziminin inkübasyon süresinin optimizasyon çalışması yapıldı. Bu çalışma için farklı yüzde içeriklerde hazırlanan mısır nişasta çözeltileri % 0,2’lik α-amilaz çözeltisi ile 1, 1,5 ve 2 saat sürelerde inkübe edildi ve işlem sonrası ikinci enzimatik basamaktan sonra elde edilen ürünlerin şeker içerikleri analiz edildi. Çizelge 4.3’ de ürünlerin glikoz, maltoz ve diğer oligosakkaritlerin içerikleri belirtildi. Bu sonuçlardan elde edilen grafiklere bakıldığında tüm nişasta çözeltileri için inkübasyon süresindeki artışla birlikte ürünlerin glikoz ve (Şekil 4.7) ve maltoz (Şekil 4.8) içeriklerinde artış görüldü. Başlangıç nişasta içeriği % 2 olan çözeltiden 1 saat α-amilaz ile inkübasyon sonucunda elde edilen ürünün glikoz ve maltoz içeriği sırasıyla % 0,22 ve % 0,88 iken ikinci saatin sonundaki üründe % 0,38 glikoz ve % 1,51 maltoz bulundu. İnkübasyon süresindeki artışın etkisine ek olarak başlangıç nişasta miktarındaki artışın son ürün şeker içeriğine etkisi yine gözlendi. Başlangıç mısır nişasta içeriği % 2 olan çözeltinin % 0,2 ‘lik α-amilaz enzimi ile 1 saat inkübasyonu sonucu yaklaşık % 0,22 glikoz ve % 0,88 maltoz içeren ürün elde edilirken, nişasta miktarının % 40’a çıkarılması ile ile yine 1 saatlik inkübasyon süresi sonunda yaklaşık % 4,13 glikoz ve %15 maltoz içeren ürün elde edildi. Başlangıç nişasta miktarının 20 kat artmasıyla son üründeki glikoz ve maltoz içeriği de yaklaşık 20 kat artış gösterdi.