PSORİASİSLİ HASTALARDA LİPİD PROFİLİ VE
İNSÜLİN DİRENCİNİN DEĞERLENDİRİLMESİ
(UZMANLIK TEZİ)
TEZ YÖNETİCİSİ Doç. Dr. Sedat AKDENİZ
Dr. Gökçen BALCI
DİYARBAKIR – 2008 T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ Dermatoloji Anabilim Dalı
İÇİNDEKİLER
ÖZET……… 1
SUMMARY……….
2
GİRİŞ………... .
3
GENEL BİLGİLER……….. 4-45
BİREYLER VE YÖNTEM……….. 46-47
BULGULAR……… 48-55
TARTIŞMA……….
56-62
SONUÇ………
63
KAYNAKLAR………. 64-72
EKLER………. 73
ÖNSÖZ
Psoriasis toplumda sık görülen bir deri hastalığıdır. Bazı hastalıklarla birlikteliği bugüne kadar merak uyandırmış ve çalışmalara konu olmuştur. Son zamanlarda psoriasis, hiperlipidemi ve insülin direnci arasındaki ilişki üzerinde durulmaktadır ve birçok çalışmada psoriasisin metabolik sendromun bir sebebi olduğuna dair veriler artmaktadır. Biz de bu çalışmada çeşitli sekonder faktörleri dışlayarak psoriasisin hiperlipidemi ve insülin direnci ile olan ilişkisini değerlendirmeyi amaçladık.
Dermatoloji eğitimim süresince ve tez çalışmamda değerli bilgi ve katkılarını esirgemeyen saygıdeğer hocalarım, başta Doç. Dr. Sedat AKDENİZ olmak üzere, Prof. Dr. Mustafa ARICA, Prof. Dr. Mehmet HARMAN ve Prof. Dr. Sema AYTEKİN’ e şükranlarımı arz ederim.
Dicle Üniversitesi Tıp Fakültesi Endokrinoloji Anabilim Dalı öğretim üyelerinden Yrd. Doç. Dr. Şenay ARIKAN ve Halk Sağlığı Anabilim Dalı öğretim üyelerinden Prof. Dr. Melikşah ERTEM’ e tez çalışmamdaki katkılarından dolayı teşekkürlerimi sunarım.
Asistanlığım ve tezim süresince benden hiçbir desteğini ve yardımını esirgemeyen asistan arkadaşlarıma ve tüm klinik personeline teşekkür ederim.
Ayrıca her türlü desteklerinden dolayı eşim Emre Balcı, oğlum Kerem Balcı ve kardeşim Ecem Ergin ile bugünlere gelmemi sağlayan annem Zehra Ergin ve babam Namık Ergin’e teşekkürü bir borç bilirim.
ÖZET
PSORİASİSLİ HASTALARDA LİPİD PROFİLİ VE İNSÜLİN
DİRENCİNİN DEĞERLENDİRİLMESİ
Psoriasis kronik multifaktöryel deri hastalığıdır ve obesite, anormal lipid profili ve insülin duyarlılığı ile birlikte olabilir.
Bu çalışmada, yeni psoriasis tanısı almış veya en az 6 aydır sistemik, 3 aydır topikal tedavi kullanmayan hastalarda, hiperlipidemi ve insülin direnci yapabilecek sekonder sebepler dışlandıktan sonra lipid profili ve insülin direncinin değerlendirilmesi amaçlanmıştır.
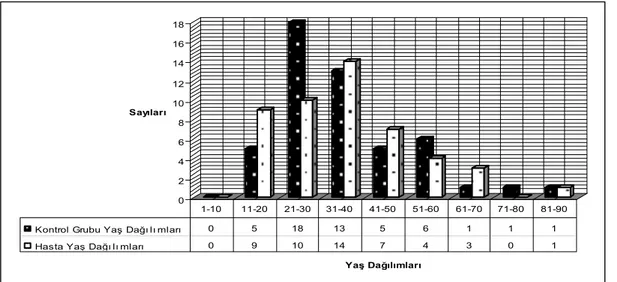
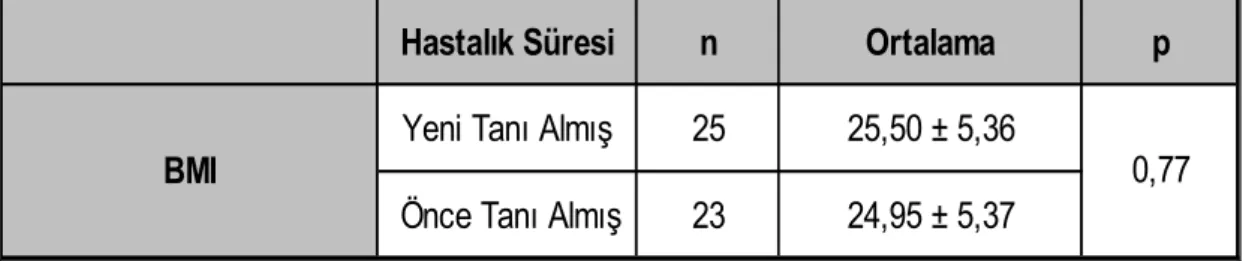
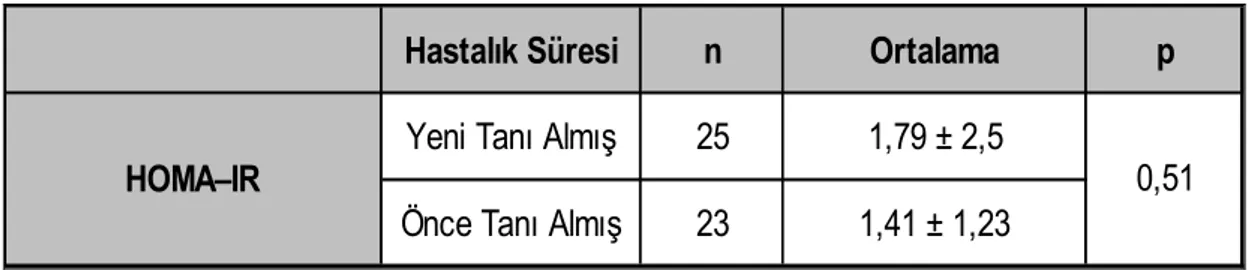
Çalışma kapsamına Aralık 2005–Mayıs 2008 tarihleri arasında Dicle Üniversitesi Tıp Fakültesi Dermatoloji Polikliniğine başvuran 48 psoriasis tanısı alan /almış hasta dahil edildi. Kontrol grubu olarak 50 sağlıklı birey rastgele olarak seçildi ve çalışmaya alındı. Her iki grup cinsiyet, yaş ve vücut kitle indeksi açısından benzer özellikteki bireylerden oluşturuldu. Psoriasisli hastalar ve kontrol grubu lipid profili ve HOMA-IR değerleri açısından karşılaştırıldı.
Psoriasisli hastalar ve kontrol grubu arasında lipid profili ve HOMA-IR değerleri açısından istatistiksel olarak anlamlı fark saptanmadı (p>0,05).
Sonuç olarak, çalışmamızda psoriasisli hastaların lipid profili ve insülin direnci değerlendirilirken, sonuçları etkileyebilecek sekonder faktörlerin dışlanmasıyla kontrol grubuna göre farklılık görülmemesi, psoriasis ile birlikte görülebilen hiperlipidemi ve insülin direnci oluşumunda başka faktörlerin etkili olduğunu desteklemektedir.
SUMMARY
EVALUATION OF LIPID PROFILE AND INSULIN
RESISTANCE IN PATIENTS WITH PSORIASIS
Psoriasis is a chronic, multi factorial inflammatory skin disease and has been associated with abnormal lipid metabolism, obesity and insülin sensitivity.
In this study, in patients recently diagnosed with psoriasis, or who had not received any systemic treatment for six months and topical treatment for 3 months, we aimed to evaluate lipid profile and insulin resistance after excluding secondary causes that might result in hyperlipidemia and insulin resistance.
A total of 48 patients who applied to Dermatology Polyclinic, Medical Faculty, Dicle University between December 2005 and May 2008, and who were diagnosed with psoriasis were included into the study. As control group, 50 healthy subjects were included into the study. Both groups were formed from among individuals with similar characteristics; in terms of sex, age and body mass index. Patients with psoriasis and controls were compared in terms of lipid profile and HOMA – IR values.
There were not any significant difference in lipid profile and HOMA – IR values between the two groups (p>0,05).
In conclusion, statistically, we could not determine any significant difference between psoriasis and control group patients according to their lipid profile and HOMA-IR values. This results supports the opinion that some other factors may be effective in the development of hyperlipidemia and insulin resistance in psoriasis patients.
GİRİŞ
Psoriasis toplumda sık görülen bir deri hastalığıdır. Bu nedenle, birçok başka hastalık ve sistemik bozukluk psoriasise eşlik edebilir. Psoriatik artrit, inflamatuar barsak hastalıkları, Reiter sendromu gibi hastalıkların psoriasis ile ortak patogenetik özelliklere sahip olduğu kabul görmüştür (1).
Son zamanlarda psoriasisde hiperlipidemi ve insülin direnci varlığı üzeride durulmaktadır. Hiperlipidemi ve insülin direncinin, psoriasisde primer mi yoksa hastalığın süresi, kullanılan sistemik ve topikal tedaviler, hastaların alışkanlıkları, vücut biçimi ve hayat şekli gibi çeşitli faktörlerin etkisi ile sekonder mi ortaya çıktığı tartışma konusudur.
Yapılan birçok çalışmada, psoriasisli hastalarda, hiperlipidemi ve insülin direnci değerlendirilirken bu patolojik faktörlere etki edebilecek sekonder sebepler dışlanmamıştır (2-5).
Bu çalışmada, yeni psoriasis tanısı almış veya en az 6 aydır sistemik, en az 3 aydır topikal tedavi kullanmayan, klinik ve histopatolojik olarak doğrulanmış 48 psoriasis hastası ve 50 sağlıklı birey çalışmaya alındı. Hiperlipidemi ve insülin direnci yapabilecek sekonder sebepler dışlandı. Sonuçlar istatistiksel olarak karşılaştırıldı.
GENEL BİLGİLER
TANIM
Psoriasis farklı klinik bulgular içerebilen benign, kronik, tekrarlayıcı, inflamatuar bir deri hastalığıdır. Eritematöz, üzeri grimsi beyaz skuamlarla kaplı papül ve değişik boyutlarda plaklarla karakterizedir. Lezyonlar genellikle simetriktir ve saçlı deri, tırnak, ekstremitelerin ekstansör yüzleri, diz, dirsek, göbek çevresi ve sakral alanlarda lokalizedir. Kaşıntı ve yanma gibi subjektif semptomlar olabilir (6).
TARİHÇE
Hastalıkla ilgili ilk tanımlama (M.Ö. 416-377)’ li yıllarda “Coprus Hippocraticum: Hipokrat Derlemi” adlı yapıtta yer almaktadır (7). Hipokrat; kuru skuamlı erüpsiyonları “lopoi” başlığı altında toplamıştır. Bu gruptaki hastalıklar muhtemelen psoriasis ve leprayı içermektedir. Skuamlı, deskuamasyonun görüldüğü kaşıntılı durumları tanımlamak üzere ilk kez ‘Psora’ terimi Galen tarafından kullanılmıştır. Psoriasis ve lepranın ayrımındaki karışıklık yüzyıllar boyunca devam etmiştir. Ondokuzuncu yüzyılın başlarında Robert Willan psoriasisi bir hastalık olarak tanımlamış, bundan 30 yıl sonra Hebra psoriasisin kliniğinin kesin özelliklerini ve lepra ile farklı antiteler olduğunu ortaya koymuştur (8).
EPİDEMİYOLOJİ
İnsidans
Dünyanın her yerinde görülebilen psoriasisin görülme sıklığı ırksal, coğrafik ve çevresel faktörlere bağlı olarak değişir (9). Psoriasis prevalansı çeşitli ülkeler ve ırklar arasında %0–11,8 arasında saptanmıştır. Türkiye’de yapılan bir çalışmada psoriasis prevalansı %1,3 olarak bildirilmiştir (10). Genellikle soğuk kuzey ülkelerinde tropikal bölgelere göre daha sıktır. Avrupa, Kuzey Amerika ve Avusturalya’da yapılan çalışmalar beyaz ırkın diğer ırklara göre daha çok etkilendiğini göstermiştir. Psoriasis zenciler ve sarı ırkta daha nadir görülmektedir (11,12).
Başlama yaşı
(11). Bununla birlikte hayatın iki döneminde pik yaptığı gözlenmiştir. Birinci pik ortalama 22,5 yaşında görülürken, ikinci pikin başlangıcı ortalama 55 yaş olarak saptanmıştır (13). Kadın ve erkeklerdeki prevalansı eşittir. Birçok çalışmada kadınlarda daha erken başlangıç yaşından bahsedilse de genel bir bilgi olarak kabul edilmemektedir (9,13). Çocuklardaki başlangıç yaşı ortalaması 8,1’dir (11).
Erken başlangıçlı hastalarda pozitif aile hikayesi oldukça yüksektir. Başlangıç yaşı erken ve tutulum alanı geniş olan hastalarda psoriasisin daha şiddetli seyretme olasılığı yüksektir (14).
Kalıtım modeli
Psoriasisli hastaların yaklaşık 1/3’ünde aile anamnezi saptanmıştır (9). Son yapılan çalışmalar bir ebeveynde psoriasis varsa çocuklarında %16,4 oranında hastalık ortaya çıktığını göstermektedir. Hastalık her iki ebeveynde varsa bu oran %41’e yükselmektedir. Monozigotik ikizlerin her ikisinde psoriasis görülme sıklığı çeşitli çalışmalarda %35–73 arasında saptanmıştır (9,15,16). Dizigotik ikizlerde bu oran %30’dir. Bütün bu bilgiler kalıtımın birden fazla genle ilgili olduğunu ve çevresel faktörlerin tetikleyici rol oynadığını desteklemektedir (11).
Psoriasisle ilgili 8 gen lokusu tanımlanmıştır (17). PSORS1 kromozom 6p21.3’de haritalandırılmıştır. Psoriasisde suçlanan major gendir. Psoriasisle ilişkili diğer gen lokusları olan PSORS2 kromozom 17q’da, PSORS3 kromozom 4q’da, PSORS4 kromozom 1q’da, PSORS5 kromozom 3q’ da, PSORS6 kromozom 19q’ da, PSORS7 kromozom 1’p de lokalizedir. Kromozom 16q’da lokalize olan PSORS8 lokusunun hem psoriasis hem de Crohn hastalığı ile ilişkili olduğu saptanmıştır (8).
Son zamanlarda 17q kromozomu üzerindeki potansiyel bir psoriasis geninden bahsedilmektedir. Birkaç kuşaktır psoriasisi olan geniş ailelerde yapılan çalışmalarda, 17q kromozomundaki bir lokus varyasyonunun psoriasis gelişimi ile ilişkili olduğu üzerinde durulmuştur. Bu grupta eklem semptomlarının ve deformitelerinin daha sık görüldüğü gösterilmiştir. Ancak hastalık bu geni taşıyanların küçük bir kısmında gelişmektedir. Muhtemelen psoriasise yatkınlık geni taşıyan kişilerde, tetikleyici faktörlerin etkisi ile hastalık ortaya çıkmaktadır (18).
Psoriasisli hastalarda bazı sınıf I insan lökosit antijeni (HLA) tipleri ile başlangıç yaşı ve klinik özellikler arasında ilişki olduğu da ileri sürülmüştür. Psorasisle en sık birlikteliği
olan antijenler; HLA–B13, –B17, –Bw57 ve Cw6’dır. HLA–Cw 6 fenotipi taşıyan kişilerde psoriasis gelişme riski 9–15 kat daha fazladır (17).
Başlangıç yaşı ve HLA tipine göre psoriasisde iki alt tip tanımlanmıştır.
1. Erken başlangıç tipi: Kırk yaşından önce başlar, HLA–Cw 6, –B57 ve –DR7 genel popülasyondan daha sık saptanır. Ailesel kalıtım vardır. Hastalıktan sorumlu olan genler kromozom 4q6p, 16q, 17q ve 20q üzerinde yer alır.
2. Geç başlangıç tipi: Kırk yaşın üzerinde başlar, HLA birlikteliği zayıftır. Ailesel risk artışı yoktur. Eklem ve tırnak tutulumu daha belirgindir. En sık birliktelik HLA–Cw2 iledir (19,20).
Psoriyatik artrit HLA–B27 ile, eritrodermik psoriasis HLA–B13 ve –17 ile, guttat psoriasis HLA–Cw6 ile, püstüler psoriasis HLAB–17 ve –27 ile daha sık birliktelik gösterir (21).
ETYOLOJİ VE TETİKLEYİCİ FAKTÖRLER
Hastalığın nedeni tam olarak bilinmemektedir. Genetik yatkınlığın psoriasis oluşumunda etkili olduğu düşünülmekte, ancak çevresel faktörler, infeksiyonlar, ilaçlar, psikojenik faktörler ve travmanın hastalığın çıkışını tetiklediği ve alevlemesine neden olduğuna inanılmaktadır (11).
Fiziksel Travma (Koebner Fenomeni)
1872 yılında Koebner, 5 yıl önce psoriasis tanısı almış bir hastada çeşitli travmaların hastanın derisinde psoriasis lezyonları ile sonuçlandığını tanımlamıştır. Psoriasis özellikle hastanın ata binerken sürtünen lezyonsuz bölgelerinde ortaya çıkmış ve kısa sürede jeneralize olmuştur (11).
Çok değişik tipte hasarlar psoriasisde Koebner cevabına sebep olabilse de en iyi tanımlananlar çizikler, ısırık, yanık, infeksiyon yerleri, güneş yanığı, tatuaj ve aşı yerleridir. Koebner fenomeni (isomorfik cevap olarak da bilinir) hep ya da hiç fenomeni olarak da değerlendirilebilir. Eğer psoriasis tek bir hasar alanında oluşuyorsa bu bütün vücutta travma sonrası oluşabileceğini destekler. Genellikle travmadan 7–14 gün sonra lezyon ortaya çıkar ve aktif hastalık veya alevlenme dönemlerine sebep olabilir (9).
Koebner fenomeninin kışın yaza göre daha çok oluştuğu belirtilmiştir. Bu durum muhtemelen ultaviolenin belirgin olduğu yaz aylarında psoriasisin iyileşmesine bağlıdır. Psoriyatik hastalarda Koebner fenomeninin insidansı aktif hastalık döneminde artmaktadır.
Koebner pozitif hastalarda psoriasis genellikle daha erken ortaya çıkmakta ve hastalığın kontrolü daha zor olmaktadır (11,22). Hafif travma sonrası keratinositlerde oluşan sinyalin sebebi bilinmemekle birlikte birçok muhtemel sebep dendritik antijen sunan hücrelerin aktive olmasına neden olmakta ve T hücrelerine antijenik sinyaller ulaşarak aktivasyon oluşmaktadır (23).
Bazı hastalarda ise travma sonrası lezyon tamamen gerileyebilmektedir. Buna ters Koebner fenomeni adı verilir. Koebner ve ters Koebner aynı anda bulunmaz (24).
İnfeksiyonlar
Çeşitli mikroorganizmaların psoriasisin ortaya çıkmasında veya alevlenmesinde etkili olduğu uzun süredir bilinmektedir. Bu mikroorganizmalar; bakteriler (Streptokokus pyogenes, Stafilokokus aureus), mantarlar (Malassezia, Kandida albicans) ve virüsler (papilloma virüs, retrovirüs, endojen retrovirüsler)’ dir (25).
İlk olarak 1916’da (26) streptokokal farenjit ile guttat psoriasis arasındaki ilişki tanımlanmış ve bugüne kadar birçok yayında bu durum doğrulanmıştır (9,25,27). Sıklıkla akut guttat psoriasisin akut streptokokal infeksiyonları izleyen 1–2 hafta içinde ortaya çıktığı bilinmektedir (11). Guttat psoriasisin streptokokal boğaz infeksiyonları ile ilişkisi birçok yayında doğrulanırken deri infeksiyonları ile ilişkili çok az sayıda vaka yayınları vardır (28). Sonuçta; genel olarak deri infeksiyonları psoriasisi tetiklemez veya alevlendirmez denebilir (9).
Streptokokal M proteini keratin 16 ve keratin 17 ile yapısal olarak aynıdır. Guttat psoriasisde Streptokok spesifik T hücreleri tonsillerden deriye doğru göç eder ve keratinositlerden türeyen çapraz reaktif antijenleri tanıyarak inflamatuar aktiviteyi oluştururlar. Eğer etkin çapraz reaksiyon oluşmazsa hastalık kendini sınırlar. Ancak sekonder lenfoid doku gibi davranan deride çapraz reaksiyon etkin bir hal alırsa otoreaktif T hücreler üretilmeye devam eder ve kronik hastalığın oluşmasına sebep olurlar (29).
Lezyonal psoriyatik derinin Stafilokokus aureus ile kolonizasyonu yaklaşık olarak %60 olarak bulunmuştur. Bu oran sağlıklı deride ise %5–30 arasındadır. Vakaların en az yarısında bir veya daha fazla stafilokokal enterotoksin izole edilmiştir. Toksin pozitif hastaların psoriasis alan şiddet indeksleri toksin negatif olan gruba göre yüksek bulunmuştur.
Tüm bu bulgular psoriyatik lezyonlardaki alevlenmenin toksinler yolu ile olduğunu desteklemektedir (30).
Malassezia gövde, sırt ve saçlı deri gibi sebaseöz glandların zengin olduğu alanlarda lokalize olur. Saçlı deri, psoriasisin en sık etkilediği alanlardan biridir ve birçok çalışmada Malassezia ve deri lezyonlarının oluşumu arasında ilişki saptanmıştır (25). Psoriasisli hastaların oral ketokonazol ile tedavisinin saçlı deri lezyonlarında belirgin azalmaya sebep olduğu bildirilmiştir (31,32).
Ek olarak inaktif psoriasisi olan olgularda Malassezia ile yapılan patch testlerde klinik ve histolojik olarak psoriasis lezyonlarına benzeyen lezyonların oluştuğu görülmüştür (33). Son zamanlarda yapılan çalışmalarda Malassezia’ nın keratinositlerden transforming growth faktör β, ısı şok proteini ve integrin zincirleri gibi proliferasyonu arttırıcı maddelerin salınımını arttırdığı da bildirilmiştir (34). Tüm bu bulgular Malassezia’ nın psoriasisin alevlenmesinde etkili olduğunu desteklemektedir (25).
Kandida psoriasis ile ilişkisi olduğu düşünülen başka bir mantardır. Candida albicans ile kutanöz infeksiyonlarda, psoriasisin deri lezyonlarında alevlenme olduğu bildirilmiştir. Yapılan üç ayrı çalışmada psoriasisli hastaların feçeslerinde Candida albicans %68–78 oranında pozitif bulunmuştur. Bu oran kontrol grubunda %29–54 olarak saptanmıştır. Psoriasis alan şiddet indeksi (PASI) ile arasında bir ilişki saptanmamakla birlikte hastalığın erken başlangıcı ile mantar seviyesinde artış istatistiksel olarak anlamlı bulunmuştur (35,36). Kandida ile tetiklendiği düşünülen psoriasisli hastalara sistemik olarak nistatin verilmiş ve %50 hastada belirgin düzelme saptanmıştır (37). Kandidanın superantijenik faktör olarak T hücre aktivasyonunu arttırdığı ve hastalığı tetiklediği düşünülmektedir.
Human immunodeficiency virüs tip I (HIV-I) psoriasisde ciddi alevlenmelere sebep olabilir. HIV pozitif kişilerde psoriasis insidansı artmıştır. Hastalarda iki klinik patern görülmektedir. Biri lokalize psoriasis, diğeri ise palmoplantar keratoderma ile birlikte psoriaziform dermatitdir. Psoriaziform dermatit; HIV infeksiyonunun ilk belirtisi olabilir. Hızlı başlangıçlı akut erüptif psoriasislilerde ve stabil giderken alevlenen olgularda HIV infeksiyonu düşünülmelidir. İmmün yetmezlik gelişirken alevlenen psoriasis terminal dönemde gerileyebilir. Bu durumun regülatuar CD4+ T hücrelerin kaybına ve CD8+ T hücrelerin aktivitesinin artmasına bağlı olduğu düşülmektedir. HIV ilişkili psoriasis standart tedavilere daha dirençlidir. Antiretroviral tedaviler ile psoriasisin gerilemesi ilgi çekicidir (25).
Stres
Akut stres psoriasisin ortaya çıkması veya alevlenmesi ile ilişkili bulunmuştur. Son zamanlarda yapılan 38 hastalık bir çalışmada düşük stresli ve yüksek stresli iki grup oluşturulmuş ve bu iki grup değerlendirilmiştir. Yüksek stresli grupta psoriasis alan şiddet indeksi belirgin şekilde yüksek bulunmuştur (38-41).
Yapılan klinik çalışmalarda da olguların yaklaşık %30–40’ında stresin psoriasisi kötüleştirdiği gösterilmiştir (11). Mallbris ve arkadaşlarının yaptığı bir çalışmada psikososyal stresin psoriasisin başlaması veya alevlenmesinde etkili olduğu bildirilmiştir (42). Stresin P maddesini arttırarak hastalığın ortaya çıkışına sebep olduğu düşünülmektedir (9,43).
İlaçlar
Psoriasisin alevlenmesine en sık sebep olan ilaçlar; β– blokerler, nonsteroidal inflamatuar ilaçlar, antimalaryal ajanlar ve anjiotensin konverting enzim inhibitörleridir. Daha nadir olarak klonidin, potasyum iyodür, olanzapin, amiodaron, digoksin, doksisiklin, gemfibrozil, simetidin, imiquimod, α– ve β– interferon, penisilin, amoksisilin ve ampisilin gibi ilaçlarda psoriasisin tetiklenmesine sebep olabilir (25).
Sigara
Sigara içmenin psoriasisin ortaya çıkmasında ve alevlenmesinde etkili olduğuna dair birçok çalışma vardır. Günde yirmiden fazla sigara içmenin hastalığa yakalanma riskini en az 2 kat arttırdığı gösterilmiştir (44,45). Sigara içmenin psoriasisin klinik ciddiyetini de arttırdığı tespit edilmiştir (44). Palmoplantar psoriasisin sigarayı bırakmakla gerilediği gösterilse de, kronik plak tip psoriasisde yapılmış benzer çalışmalar henüz yoktur (46).
Alkol
Alkol ile psoriasisin çıkışı veya alevlenmesi arasındaki ilişki net değildir. Poikolainen ve ark; psoriasis ile alkol tüketimi arasında bir ilişki tespit etmişler ancak bu durumun hastalığın başlangıcında değil, seyrinde etkili olduğu vurgulamışlardır (45,47). Alkol alımı ile deri yüzey alan tutulumu arasında da pozitif bir ilişki saptanmıştır (47).
Alkolün psoriasis üzerine direkt negatif etkisi olmadığı, ancak tedaviye uyumu azaltarak olumsuz bir etki oluşturduğuna inanılmaktadır (11).
İklim
Ultraviyole radyasyon orta ve ciddi psoriasisde kullanılan tedavi yöntemlerinden biridir. Ekvatorda bulunan ülkelerde psoriasisin daha az belirgin olması doğal ultraviyolenin psoriasis üzerindeki şaşırtıcı olmayan pozitif etkisini göstermektedir. Ancak hastaların az bir kısmında şiddetli güneş ışığı tetikleyici etki gösterebilir. Bu hastalarda yaz aylarında lezyonlarda alevlenmeler görülebilir (21). Nem artışı da psoriasisde pozitif etkiye sahiptir.
Farber ve arkadaşları yaptığı bir çalışmada hastaların %89’unda soğuk havada lezyonlarda kötüleşme, %80’inde ise sıcak havada ve güneşe çıktıklarında lezyonlarda düzelme olduğunu bildirmişlerdir (43).
Endokrin faktörler
Generalize püstüler psoriasisde hipokalseminin tetikleyici bir faktör olduğu gösterilmiştir. Bu hastalarda prognoz daha kötü olmaktadır. Gebelik hastalık aktivitesini değiştirebilir. Yapılan bir çalışmada 65 gebe kadın hasta değerlendirilmiş ve %40’ında lezyonlarda iyileşme, %14’ünde ise kötüleşme saptanmıştır. Doğum sonrası 3 aylık dönemde ise %11 hastada iyileşme, %54 hastada ise kötüleşme olduğu rapor edilmiştir (48). Genel olarak psoriasis seyrinde gebelik dönemince düzelme, sonrasında ise kötüleşme oluyor denebilir.
Bununla birlikte gebelikte püstüler psoriasis gelişebilir ve bu durum bazen hipokalsemi ile ilişkili olabilir (8). Renal dializ de psoriasisi tetikleyebilir (19).
Vücut Şekli ve Yaşam Biçimi
Obez kişilerde psoriasisin daha şiddetli olduğu gösterilmiştir. İlginç olarak obezite hastalığın tetikleyici faktörü gibi gözükmemektedir. Yapılan çalışmalarda hastalığın başlangıcında psoriasisli grupla kontrol grubu arasında vücut kitle indeksi açısından istatistiksel fark bulunamamıştır (4,49).
Son zamanlarda obezitenin kronik düşük seviyede inflamasyon ile seyrettiği kabul edilmektedir. Obezitede; adipositler ve makrofajlar benzer biyolojik ve fonksiyonel özellikler göstererek metabolik ve immün cevapta benzer cevaplar oluşturabilmektedirler (50).
Makrofajlar çok sayıda adiposit gen ürünü (yağ asidi bağlayıcı protein ve peroksizom proliferasyonu aktive edici reseptör) sentezleyebilerken, adipositler de TNF-α ve IL-6 gibi makrofaj proteinleri sentezleyebilmektedirler. İki hücrenin fonksiyonel kapasiteleri de aynıdır. Adipositler lipid depolayabilir ve metabolik homeostazı regüle edebilirken,
makrofajlar inflamatuar cevabı regüle edebilirler. Ancak her iki hücrenin de bu iki fonksiyonu yapabilme yeteneği vardır.
Obezitede; adipoz dokuda inflamasyon oluşmakta ve adipositler inflamatuar sitokinler salgılamaya başlamaktadır. Obez hastalarda TNF-α’nın artması da bu durumu desteklemektedir (50). Artmış TNF–α üretimi insülin direncini arttırmakta ve tip 2 diabetes mellitus ve ateroskleroz gelişimine sebep olmaktadır (51). TNF-α’nın yanında hiperlipidemi ve hipertrigliseridemiye bağlı gelişen intrasellüler stres de inflamasyon aktivasyonuna sebep olmakta ve insülin sinyalizasyonunu inhibe etmektedir.
Kilo kaybı ve dietin kısıtlanması TNF–α ve IL–6 konsantrasyonunun düşmesine sonuç olarak oksidatif stresin azalmasına sebep olmaktadır. İnsülin direnci azalmakta ve insülinin antiinflamatuar etkisi belirginleşmektedir (50).
Obez hastalarda gastrik bypass cerrahisinden sonra psoriasisde tama yakın remisyon sağlanan olgular da bildirilmiştir (52,53).
Tüm bu bilgilerin ışığında kilo kaybı psoriasisde bir tedavi biçimi olabilir. Psoriasisde kilo kaybının etkilerini gösteren prospektif çalışmalar olmasa da düşük enerjili diyet alan psoriasisli hastalarda 4 haftalık diyetten sonra belirgin düzelme olduğunu bildiren bir yayın vardır (54).
Leptin, ghrelin ve alfa– melanosit stimülan hormon gibi birçok hormonun gıda alımı ve enerji dengesi üzerine etkisi vardır. Bu hormonların seviyesi obezite ile değişir ve kilo kaybından etkilenir. Santral sinir sistemi üzerine etkileri dışında bu hormonların immün fonksiyon ve inflamasyon gibi birçok fizyolojik olayda da önemli rolleri vardır (55).
Leptin; vücuttaki toplam yağ dokusu miktarına orantılı olarak salgılanır, gıda alımını azaltır ve enerji tüketimini arttırır. Alfa–MSH’ da gıda alınımını beyinden salgılanan melanokortin aracılığı ile baskılar. Diğer taraftan ghrelin özellikle mide ve pankreastan salgılanır ve gıda alımını stimüle eder, metabolizmayı ve yağ katabolizmasını yavaşlatır (56).
Obez kişilerde leptin ve α–MSH seviyesi zayıf kişilere göre yüksektir. Kilo kaybı leptin seviyesinde belirgin azalmaya sebep olmakta ve insülin duyarlılığı düzelmektedir (57,58).
İnflamasyondaki rolü göz önüne alındığında α–MSH, leptinin tersi etki gösterir. Melanositlerdeki proinflamatuar sitokin olan TNF–α’ nın etkisini tersine çevirerek ve prostoglandinlerin seviyesini azaltarak antiinflamatuar etki oluşturur (59). Bu hormonların psoriasis patogenezindeki rolleri ile ilgili çalışmalar çok azdır. Ancak leptin ile uyarılan inflamasyonun obez hastalarda psoriasis patogenezinde önemli rol oynadığı düşünülmektedir
Sonuç olarak dirençli obez psoriasis hastalarında kilo kaybı mutlaka önerilmelidir. Kilo kaybı TNF–α salınımının ve leptin seviyelerinin azalmasına, insülin duyarlılığının artmasına ve proinflamatuar sitokinlerin baskılanmasına sebep olacaktır (55).
Enerji alımı ve vücut şekli dışında poliansatüre yağ asitleri, selenyum, gluten ve alkol gibi dietle ilgili başka faktörlerin de çok sayıda hastada hastalığın seyrini değiştirdiği gösterilmiştir. Diyette eikozapentaneoik asit gibi n–3 yağ asitlerinden zengin beslenme bu maddenin araşidonik asitin yerini almasına sebep olmakta ve sonuç olarak prostoglandin E2 ve lökotrienler (LTB4) gibi proinflamatuar mediatörlerin salınımı azalmaktadır. Psoriasis tedavisinde n–3 yağ asitinden zengin beslenmenin tedavideki etkinliği tam olarak kesinlik kazanmamıştır (60).
Psoriasisli hastalarda gliadine karşı antikor görülme sıklığı yüksektir. Bir çalışmada 302 psoriasisli hasta değerlendirilmiş ve %16’ sında antigliadin antikorlar pozitif olarak saptanmıştır. Bu hastalara glutenden fakir diyet verilmiş ve 3 aylık takip sonucunda PASI’ da belirgin düzelme görülmüştür. Sonuç olarak antigliadin antikor pozitifliği olan hastalarda glutensiz diet hastalığın gerilemesinde etkili oluyor denebilir (61,62).
Selenyum; esansiyel iz elementtir ve immünomodülatuar ve antiproliferatif etkileri vardır. Selenyum düzeyleri, özellikle hastalığın uzun süredir devam ettiği erkek psoriasisli hastalarda düşük bulunmuştur. Ayrıca selenyum düzeyi düşük hastalarda PASI skorunun da yüksek olduğu tespit edilmiştir. Bu durum diyetteki az selenyum alımı ile ilgili olabilir. Ancak psoriasisde keratinizasyonun ve oksidatif stresin artması ve uzun dönem psoriasisde doğal antioksidanların azalması, aşırı alkol alımı, aktif ve pasif sigara içiciliği ve kullanılan tedaviler gibi faktörler de selenyum miktarında azalmaya sebep oluyor olabilir (63,64).
Beta karoten, vitamin E ve selenyum gibi antioksidanlar psoriasis tedavisinde iki amaçla kullanılanilir: (a) Serbest radikalleri inaktive ederek epidermal dokuda inflamasyonu azaltmak, (b) Membran stabilizasyonun sağlayıp, hasarını önleyerek hücre membranına pozitif etki sağlamak (65) .
PATOGENEZ
Psoriasisde temel fizyopatolojik olay epidermal hücre proliferasyonunun artışıdır. Normal deride epidermal yenilenme süresi 28 gün iken, psoriasisde 3–4 gündür. Psoriyatik deride hücre siklusunda G1 fazı oldukça kısalmakta ve normal deride istirahat halindeki G0 ve G2 fazlarındaki hücreler de mitoz olayına katılmaktadırlar. Tüm bunların sonucunda
epidermal proliferasyon artmaktadır. Epidermal hücre siklusu yaklaşık 8 kat kısalmıştır (8,19). Proliferasyonu etkileyen çeşitli mekanizmalar tanımlanmıştır.
Siklik adenozin monofosfat (cAMP) ile siklik guanozin monofosfat (cGMP) oranındaki anormallik epidermal döngünün artmasına ve farklılaşmanın azalmasına sebep olmaktadır. Normal deride cAMP hücre çoğalmasını inhibe ederken, cGMP hücre çoğalmasını arttırmaktadır.
Psoriyatik epidermisde ise cAMP’ nin azaldığı, cGMP’ nin arttığı gösterilmiştir. Ayrıca psoriyatik deride adenozin trifosfatı cAMP’ ye dönüştüren adenilat siklaz enzim aktivitesinin düşük olduğu saptanmıştır (19).
Psoriasisde; putresin, spermidin, spermin gibi poliaminlerin miktarı da artmıştır. Bu poliaminler hücresel proliferasyonda önemli role sahiptir. Proteaz– antiproteaz sisteminde görev alan plazminojen aktivatörü, α1 antitripsin ve kathepsin 1’de epidermal proliferasyon ve farklılaşmada etkilidir ve proteaz aktivitesi psoriasisde artar (8).
Histolojik olarak hiperkeratoz belirgindir Ancak stratum korneumda nükleus içeren anormal keratinositler bulunmaktadır. Farklılaşma ile ilgili keratin proteinleri (K5/ K14) azalmış, proliferasyon ile ilgili keratin proteinleri (K6/16) ise artmıştır (19). Elektron mikroskopik incelemede tonoflamentlerde azalma ve anormal desmozomlar fark edilebilir.
Psoriyatik lezyonlarda araşidonik asit ürünü olan lökotrien B4, 12–HETE seviyeleri lezyonsuz deriye göre belirgin derecede artmıştır. Araşidonik asit ürünlerinin inflamatuar hücreler için kemotaktik etkisi vardır ve mitotik aktivitenin artmasına sebep olurlar (19). Son yıllarda psoriasis etyopatogenezinde mast hücreleri de suçlanmaktadır. Mast hücre sayısındaki artış ve degranülasyonun psoriasis lezyonlarının gelişmesinde etkili olduğu öne sürülmektedir. Mast hücrelerinin dakikalar içinde birçok mediatörün salınımını sağlayarak T hücre aracılı immün cevap başlamadan önce ortama nötrofil ve lenfositlerin toplanmasına yol açmaktadır (66).
Nitrik oksit (NO) ; fibroblast ve endotelyal hücreler gibi birçok hücreden salgılanan ve psoriyatik inflamasyona katkıda bulunan aktif bir moleküldür. Nitrik oksitin dermal vasküler dilatasyon ve kan akımını arttırdığı bilinmektedir. Serum NO seviyelerinin aktif hastalık döneminde daha yüksek olduğu, PASI ve eritem ile pozitif kolerasyon gösterdiği bildirilmiştir. Psoriyatik fibroblast kültürleri kullanılarak yapılan çalışmalarda; perilezyonel psoriyatik fibroblastların daha yüksek seviyede NO ürettiği ve psoriyatik plağın genişlemesine sebep olduğu gösterilmiştir (67).
Apopitoz; programlı hücre ölümüdür. Apopitozda en önemli mekanizmalardan biri perforin/granzyme B sitolitik yoludur. Perforin; memran yıkıcı proteindir. Granzymelerin hedef hücre içine girmesine ve sitoplazma ile nükleusda parçalanmaya sebep olur. Yapılan çalışmalarda perforin salımının psoriyatik deride ve dolaşan lenfositlerde artması ile hastalığın şiddeti arasında ilişki olduğu üzerinde durulmaktadır (68).
İMMÜNOPATOGENEZ
Önceden psoriasisin primer sebebinin anormal epidermal farklılaşma ile birlikte keratinosit hiperproliferasyonu olduğu üzerinde durulmaktaydı. Bugün ise; hastalıklı deri alanına göç eden CD4+ ve CD8+ T lenfositlerin fokal deri alanlarında immün reaksiyona sebep olduğu ve bu durumun epidermal hiperplaziyle sonuçlandığı bilinmektedir. Bu nedenle artık psoriasis T hücre aracılı inflamatuar bir deri hastalığı olarak kabul edilmektedir (69).
Psoriasisde T Hücreleri
Son zamanlarda yapılan çalışmalarda psoriasis plaklarında CD4+ ve CD8+ T lenfositlerin, dermal Langerhans hücrelerinin ve dağınık halde dermal monositlerin bulunduğu gösterilmiştir.
Ek olarak psoriyazisin, epidermal orijinli immünojenler aracılığı ile sürekli uyarılan T hücre stimülasyonu sonucu oluşan inflamatuar bir durum olduğundan şüphelenilmektedir. Psoriyatik epidermisde majör lenfosit CD8+ T hücrelerdir.
Yapılan çalışmalarda CD4+ ve CD8+ lenfositlerin IL2R ve HLA–DR molekülleri gibi persistan aktivasyon markerları eksprese ettikleri gösterilmiştir. Her iki hücre tipinde de farklılaşma güçlü şekilde tip I yoluna doğru olmaktadır.
Psoriasis lezyonlarındaki esas aktive hücreler tip I helper T hücreler (TH1) (CD4+) ve tip I sitotoksik T hücreler (Tc1) (CD8+)’ dir. Bu hücrelerin IFN–γ ve TNF–α gibi inflamatuar sitokinleri üretebilme yetenekleri vardır ve effektör hücrelerdir (özellikle tip 2 yolundaki regülatuar hücrelerin tersine). Psoriasisde; TH1 hücreler dermisde, Tc1 CD8 hücreler epidermisde yoğun olarak gösterilmiştir (66).
Psoriasisde kronik T hücre stimülasyonu deri lezyonlarında bulunan matür Langerhans hücrelerinden derideki T hücrelerine sürekli uyarıların sonucu gibi görünmektedir. Psoriyatik sürecin; lezyonal deride (periferal lenfoid doku gibi davranan) sürekli devam eden immün cevap şeklinde olduğundan şüphelenilmektedir. T hücre aktivasyonu lenf nodu veya kronik
deri lezyonunda olsa da, antijen reaktif T hücre klonlarının çoğalmasını uyarmak için değişik spesifik moleküler etkileşimlere ihtiyaç vardır (69).
T Hücre Aktivasyonu
T hücrelerinin matür antijen sunan hücreler (APC) ile birleşmesi ve aktivasyonu için T hücre reseptörü (TCR) ve diğer hücrelerden salınan birçok aksesuar sinyallerin stimülasyonu gereklidir. Aktivasyon; primer uyarı, kostimülasyon ve mitotik uyarı basamaklarından oluşur. T hücre aktivasyonunu tetikleyen başlangıç etkileşimi APC yüzeyindeki MHC I ve MHC II antijenik peptidlerin tanınmasıdır.
APC matürasyonu sırasında alınan ve işlemden geçen antijenik peptidler aktive hücre yüzeyindeki ekstrasellüler MHC molekülleri ile ilişkilidir. Antijen tüm T hücreleri yüzeyinde bulunan TCR kompleksi tarafından tanınır. Dendritik hücre yüzeyindeki “örnek” peptidler oluşuncaya kadar T hücre ve APC arasında LFA–1 ve ICAM–1 kontrreseptörler adezyona devam eder. Eğer peptid ve özel TCR varyantları eşleşebilirse kompleks biyokimyasal sinyaller meydana gelir (sırasıyla protein fosforilasyonu, kalsiyum girişi, kalsinörin aktivasyonu ve transkripsiyon faktör aktivasyonu), m–RNA sentezi artar, IL–2 ve IL–2R’ nin α alt grubunun aktivasyonu için gerekli genlerin sentezi meydana gelir.
Aksesuar veya kostimülatuar sinyaller de optimal T hücre aktivasyonu için gereklidir. CD28 T hücre yüzey reseptörüdür ve antijenle tetiklenen matürasyon süresince dendritik hücre yüzeyinde artar. T hücre yüzeyindeki CD28, APC üzerindeki B7 moleküller (CD80 ve CD86) ile bağlanır. TCR ve CD28 yollarının koordineli aktivasyonu birçok sitokinin (IL–2, GM–CSF, IFN–γ ve TNF–α gibi) transkripsiyonunu dengeler. Tersine CD28’in yokluğu sadece parsiyel TCR sinyaline sebep olur ve T hücre cevabı azalır (69).
Bununla birlikte T hücre aktivasyonu CD28 aracılığı ile oluşan primer stimülasyon ve kostimülasyondan çok daha kompleksdir. T hücrelerinden verilen diğer bir uyarı B7 molekülü ile T hücre yüzeyindeki kutanöz T lenfosit antijen 4 (CTLA4) arasında etkileşime sebep olur.
Her ne kadar B7–CD28 etkileşimi T hücrelerine pozitif uyarıcı sinyal sağlasa da, B7– CTLA4 aktivasyonu baskılayıcı sinyallerin artmasına sebep olur. Ek olarak; dendritik APC’ler ve T hücreler üzerindeki diğer protein etkileşimleri de çok sayıda başka aksesuar sinyallerin oluşumunu sağlar. Diğer aksesuar veya kostimülatuar kontrreseptörler ICAM– /LFA–I, LFA–3/CD–2 ve CD40/CD40L’dir. Bu üç grubun sinyalleri T hücresinden IL–2 (aktive T hücreden salınır) ve aktive Langerhans hücresinden IL–12 salınımını sağlar.
Bu sitokinlerin aktive T hücre yüzeyindeki reseptörlere bağlanması mitotik aktiviteyi regüle eder ve T hücrelerinin tip I effektör şeklinde farklılaşmasını sağlar. APC matürasyonunun erken dönemleri antijen yakalama ve GM–CSF, IL–4 ve TNF–α gibi sitokinlerle kontrol edilirken, farklılaşmanın geç dönemlerinde regülasyon T hücreleri aracılığı ile sağlanır. Mesela; CD40’ın T hücre yüzeyindeki CD40L ile etkileşimi dendritik hücre yüzeyinden CD40 salınımını arttırır. CD40–CD40L etkileşimi ayrıca APC üzerindeki B7 sentezini de uyarır. Bu durum T hücre yüzeyinde bulunan ve stimülasyonun devamını sağlayan CD28 ve CTLA4 sentezinin artmasını sağlar. Ayrıca CD40 bağlandıktan sonra, matür dendritik hücreler yüksek seviyede IL–12 salgılar ve IL–12’ de T hücre aktivasyonunu ve farklılaşmasını arttırır. Dendritik hücrelerin yaşam ve aktivitesi TNF–α ilişkili aktivasyon tetikleyici sitokin (TRANCE) ve TRANCE reseptörü arasındaki etkileşim ile sağlanır.
Tümör nekrozis faktör ailesinin bir üyesi olan TRANCE T hücreleri tarafından sentezlenir ve dendritik APC üzerindeki reseptörüne bağlanır. Bağlanma sonucunda dendritik hücre apopitozu inhibe olur (69).
T Hücre Proliferasyonu ve Farklılaşması
Aktivasyondan sonra T hücreleri klonal olarak çoğalır ve birçok farklı effektör hücre şeklinde farklılaşabilir. TH1 veya Tc1 effektör CD4+ ve CD8+ T hücreler; IL–2, IFN–γ ve TNF–α gibi tip I sitokinler üretirler, fakat IL–4 üretemezler.
Bu matürasyon yolu aktive dendritik hücreden salınan IL–12 ile uyarılır. Psoriasisin tip I sitokin yanıtı ile ilişkili bir hastalık olduğu düşünülmektedir (TH1 veTc1) (69,70). Epidermisde CD8+, dermisde ise CD4+ T hücreler vardır ve her iki hücre grubu da tip I sitokinleri üretirler. TipI/tipII dengesini kontrol eden mekanizma bilinmemektedir.
Langerhans hücreleri hem TH1 hem TH2 hücreler için antijen sunabilseler de, T hücre matürasyonunun hangi yolda ilerleyeceğinin belirlenmesine APC karar verir.
Bununla birlikte; tipI/tipII dengesinin belirlenmesinde ortamdaki sitokinler major rolü oynamaktadır. Örneğin; IL–12’ nin yüksek konsantrasyonu tip I yolunda farklılaşmaya sebep olurken, IL–4 tip II farklılaşma yolunu uyarır. Sitokinlerin bu şekilde dağılımı anatomik lokalizasyonlara spesifik olabilir. Mukozal olmayan alanların lenf drenajını sağlayan lenfoid organlardaki T hücreler IL–12 salgılarken, mukozal alanlardakiler IL–4 salgılamaktadır. Bu nedenle; psoriyatik deri lezyonlarından IL–12 ve lezyonal T hücrelerinden IL–12R salınımının artması psoriasisde dolaşan lenfositlerin ve deri lezyonlarındaki lenfositlerin tip I hücre farklılaşmasına eğilimi olduğunu desteklemektedir. Matür Langerhans hücrelerinin
sürekli olması aşırı IL–12 salınımına sebep olmakta ve lezyonal psoriyatik deride TH1 ve Tc1 hücre gruplarının oluşmasını uyarmaktadır (69).
Dendritik hücreler ve makrofajlardan salınan IL–12; p40 ve p35 subünitelerinden oluşur. T hücrelerinden ve NK hücrelerinden IFN–γ salınımı sağlar. IL–12’nin p40 subünitesinin p35’den daha önemli olduğu gözlenmiştir. Yeni tanımlanan IL–23’ün de p40 subünitesi vardır, fakat IL–23 özellikle CD4+ T hücrelerini stimülasyonunu sağlar ve IL–17 salınımını arttırır. IL–17 otoimmün inflamasyonda rol oynayan önemli bir sitokindir ve endotelyal hücreler ve makrofajlardan proinflamatuar sitokinlerin salınımını sağlar. IL–17 ile IFN–γ’nın sinerjistik etki gösterdiğine inanılmaktadır (66,71,72).
Effektör İmmün Cevap (Kutanöz lenfosit ilişkili antijen pozitif (CLA
+) T
Hücrelerin İnflame Deri İçine Trafiği)
Matürasyon süresince, T hücreleri kan damarlarından çıkmak ve deriye toplanmak için yeni hücre yüzey proteinleri salgılarlar. Hafıza T hücreleri üzerinde bulunan en önemli glikoprotein CLA’dır. CLA deri için spesifik bir belirleyicidir. CLA T hücrelerinin yavaşlaması, durması ve deri içine ekstravazasyonu için postkapiller endotelyuma tutunmasına aracılık eden adezyon molekülüdür.
CLA glikoproteini normalde kutanöz mikrodamarlarda E–selektin ve P–selektin ile etkileşir ve düşük konsantrasyonda bulunur, fakat kutanöz inflamasyon süresince salınımı belirgin şekilde artar. Her ne kadar CLA–selektin etkileşimi deriye ekstravazasyonun başlaması için önemli ise de, kemokinler ve integrinler ile hücre adezyon molekülleri arasındaki etkileşim de önemlidir. CLA–selektin etkileşimi sonrası bağlanan T hücreler endotelyal yüzeyde yavaşça yuvarlanmaya başlar. Bu durum T hücrelerinin endotelyal hücreler, keratinositler ve deride bulunan diğer hücre tiplerinden salınan kemokinler ile temas etmesini sağlar.
Bu kemokinler T hücre yüzeyindeki LFA–I ve VLA–4 gibi integrinlerin modifikasyonunu sağlar ve T hücreleri venül yüzeyindeki ICAM–1 ve vasküler hücre adezyon molekülüne sırasıyla bağlanırlar. Sonuç olarak; CLA+ T hücreler durur, düzleşir ve epidermise doğru göç için kemotaktik gradiente cevap olarak endotelyal tabaka boyunca ekstravazasyona uygun hale gelirler. Bu yolda, T hücreleri tarafından CLA gibi özgün reseptörlerin ekspresyonu deri hücrelerinden kemokinler için ligandların üretimini sağlar ve bu süreçlerin hepsi T hücrelerinin deriye olan spesifitelerini arttırır (66,69).
Psoriasis vulgaris lezyonlarındaki T hücre trafiğinde bazı kemokinler artar. Farklı lökosit tiplerinde kemotaktik etki gösteren 40’tan fazla kemokin olsa da; burada bahsedilecek olan kemokinler 1- CLA+ T hücrelerden salınan kemokin veya reseptörler 2- Psoriyatik lezyonlarda salınımı artan kemokinler 3- Psoriyatik lezyonlardaki T hücre yüzeyinden yüksek oranda salınan kemokin reseptörleri olacaktır.
Genelde endotelyal hücreler, keratinositler, monositler ve Langerhans hücreleri gibi çeşitli tip hücrelerden kemokin üretimi antijen reaktif T hücrelerden üretilen IFN–γ ve TNF–α salınımı ile uyarılır (sıklıkla bu iki sitokin arasında kemokin sentezinin stimülasyonunu sağlayan güçlü bir sinerjistik etki vardır). Bununla birlikte CTACK adlı kemokinin deriden salındığı ve T hücrelerinin inflame olmayan dokuda da potansiyel reaktif antijenleri izlemeleri için bulunmalarına izin verdiği saptanmıştır. Bu noktada dermal T hücreler kutanöz antijenler ile aktive oluyor olabilir (69).
Dermisde T hücrelerinden IFN–γ ve TNF–α’ nın salınımı psoriyatik lezyonlarda bulunan birçok kemokinin sentezini stimüle eder. Spesifik kemokin ve kemokin reseptörleri deri lezyonlarında tip I hücrelerin birikmesine sebep olur. CCR–6 özellikle CLA+ T hücrelerden salınan aktive edici ligantdır. Makrofaj inflamatuar protein (MIP–3α) özellikle psoriyatik dokuda yüksek oranda salınır. Benzer şekilde RANTES (regulated upon expression, normal T-cell expressed and secreted) psoriyatik dokudan çok miktarda salınır ve CCR5’ in RANTES ile aktivasyonu tip I T hücrelerini aktive eder (69,71).
T hücrelerinde bulunan CCR4 ve CXCR3 reseptörleri ve bu reseptörlerin etkileştiği keratinositlerden salınan MDC, TARC, MIG, IP–10 gibi kemokinler psoriyatik lezyonlarda artar. Bir kez sitokinlerle aktive olduktan sonra; dermal mikrovasküler endotelyal hücreler TARC, MIG ve IP–10 sentezleyebilir ve CXCR3+ ve CCR4+ T hücrelerin deri içine girişini arttırır. Tc1’in epidermis içine girişi de benzer şekilde regüle edilir. CXCR3+ CD8+ T hücreler psoriasisli hastaların kanları ile karşılaştırıldığında epidermislerinde 10 kat artmıştır. Epidermal keratinositler tarafından sentezlenen CXCR3, MIG ve IP–10 ligandların aktivasyonu IFN–γ salınımı ile sonuçlanır ve bu durum Tc1 hücrelerin epidermis boyunca hareketini sağlar. Ayrıca yeni lenfositlerin üretimi için feed–back oluşturur (69,71).
Psoriasis vulgarisdeki tipik hücresel patolojinin oluşması için birçok hücrenin aktive olması gerekir. Genetik yatkınlık; immün uyarıya epidermal keratinosit gibi hücrelerin aşırı cevap vermesine sebep oluyor olabilir. İmmün aktivasyon psoriasisli hastaların anormal biçimdeki genetik farklılıklarından etkileniyor olabilir. Bugün psoriyatik lezyonlarda normal immün yanıtın artmış bir şekilde olduğu saptanmıştır.
Bu nedenle psoriasis vulgaris periferal dokularda normal TH1veTc1 effektör immün yanıtının olduğu kronik aktivasyonla devam eden bir hastalık modeli olarak değerlendirilebilir (69).
Effektör İmmün Cevap ve Deri Lezyonlarında T Hücre Aracılı
İnflamasyon
Psoriasisde hastalığın klinik aktivasyonu lezyonlu epidermis ve dermisde T hücrelerinin sürekli bulunmalarına bağlıdır. Patogenezin başlaması için TH1veTc1 hücrelerin kutanöz damarlar yolu ile dermis içine girmesi gerekir. TH1 veTc1 hücreler antijenle aktivasyona bağlı olarak IFN–γ ve TNF–α salgılarlar. Bu sitokinler; ICAM–I, CD40 ve epidermal keratinositlerdeki MHC–II proteinler için potent tetikleyicidir. Ayrıca IFN–γ dermal makrofajlar veya monositlerden TNF–α salınımını sağlar. Deri içine IFN–γ enjeksiyonu sonrası epidermal kalınlaşma ile birlikte psoriyatik plak görünümünde lezyonların oluştuğu saptanmıştır (69). Çalışmalar IFN–γ’nın keratinosit apopitozunu inhibe eden Bcl–x proteininin seviyesini de arttırdığını göstermektedir (73,74). Keratinositler tarafından sentezlenen IL–15’inde keratinosit apopitozunu inhibe ettiği ve epidermal kalınlaşmaya katkıda bulunduğu saptanmıştır (66).
Gerçekte; psoriyatik plaklardaki epidermal keratinositlerin yüzeyindeki HLA–DR molekülleri incelendiğinde; psoriasisdeki patolojik keratinosit değişikliklerinde de T hücrelerin rol oynadığından şüphelenilmektedir. Bir kez keratinosit ICAM–I sentezlerse muhtemelen LFA–I+ T hücreler LFA–I/ICAM etkileşimi ile epidermis içine göç etmektedirler. Bununla birlikte; bu yol kullanılabilir olmadan önce, T hücreleri epidermis içine adheziv etkileşim (αeB7 integrin ve E kadherin arasındaki) sonucu da göç edebilmektedir. Son dönemde yapılan çalışmalarda intraepidermal T hücrelerinin regeneratif farklılaşma yolunda epidermal büyümeyi arttırdığı ve keratinosit hiperprolifarasyonunu tetiklediği saptanmıştır. Bazı inflamatuar sitokinler (IL–1, IL–6) direkt keratinosit çoğalmasını arttırmaktadır (69).
Psoriasisde görülen epidermal hiperplazide başka mekanizmalar da rol oynuyor olabilir. Epidermise göç eden lenfosilerin komşu keratinositler arasındaki desmozomları travma yolu ile hasarladığı gösterilmiştir.
Bu durumda migrasyondaki lenfositler tarafından hemidesmozom çiftleri koparılmakta ve bu çiftler sadece bir keratinosit ile ilişkili olmaktadır. Hasarlanma veya kopma hücre
yapısında transient membran defektine sebep olmaktadır. Ek olarak T hücrelerininin epidermal kompartmana girmesi epidermal bazal membranın mutlaka açılması demektir (75).
Epidermisde bazal membran defekti epidermis içine lökosit migrasyonu ile sonuçlanmaktadır. Bu yolla hasara cevap programı (epidermisin regeneratif matürasyonu) tetiklenebilmektedir (69).
Ek olarak; keratinosit yüzeyindeki çok sayıdaki mutajenik sitokin ve reseptörler yara iyileşmesine cevap olarak aktifleşmektedir. Aktive T hücrelerinden inflamatuar sitokinlerin salınımının devam etmesi ve T hücrelerinin epidermis içine migrasyonu psoriyatik lezyonlardaki kronik epidermal hiperplaziyi tetikleyen sinyallerin sürekli gelmesine sebep olabilir.
Kronik plak tip psoriasisde çok iyi tanımlanan epidermisde nötrofil birikimi ve papiller dermisde uzamış ektazik damarlar vardır. İntraepidermal T hücreleri tarafından sitokinlerin salınımı keratinositlerin daha fazla farklılaşmasına ve IL–8 salınımına sebep olmaktadır. Bu sitokin muhtemelen nötrofillerin epidermis içine toplanması için ana kemotaktik sinyaller göndermektedir. Benzer şekilde T hücrelerin tetiklediği vasküler endotelyal büyüme faktörü ve muhtemelen diğer anjiogenik sitokinler de vasküler büyümeye ve psoriasis lezyonlarındaki vasküler yapıya sebep olmaktadır (66,76).
Matür Langerhans hücreleri ile ilişkili olarak bazı doğal T hücreler (sekonder lenfoid doku) deride hafıza hücrelerine dönüşürler. CD11c + APC’nin psoriasisde artmış olması da bu düşünceyi desteklemektedir. Çünkü salınan bu integrin normalde sadece primer lenfoid dokuda bulunmaktadır. CD11c+ dermal DH’lerdir. Bu hücreler matür hale geldiklerinde T hücre aktivasyonu sağlayabilirler. CD11c+’ nin psoriyatik deride normal deriye göre daha fazla olduğu gösterilmiştir. Bu hücreler DH matürasyon markerları (CD83) salgılayabilir ve TNF–α seviyesini arttırabilirler (66,77).
Sonuç olarak; psoriasis T hücrelerince yönlendirilen inflamatuar bir hastalıktır. Hastalığı başlatıcı stimülan antijen tam olarak bilinmemektedir. Sistemik lenfosit aktivasyonunu T hücrelerinin deride birikimi takip eder. Çeşitli sitokinler aracılığı ile T hücreler TH1 veTc1 şeklinde farklılaşır ve bu hücrelerin effektör etkileri ile keratinosit proliferasyonu tetiklenmiş olur (69) .
HİSTOPATOLOJİ
Psoriasis histopatolojisi lezyonun dönemine ve tipine göre değişiklikler gösterir. Görülen en erken değişiklik (ilk 24 saat içinde) papiller dermis damarlarında dilatasyon ve konjesyondur. Beraberinde hafif bir ödem ve perivasküler lenfositik infiltrasyon, az sayıda eritrosit ekstravazasyonu ve perikapiller mast hücre sayısında minimal artış vardır.
Papüler/ erken plak döneminde hafif psoriasiform epidermal hiperplazi, belirgin nötrofil ekzositozu ve nötrofil içeren küçük parakeratoz kubbeleri görülür. Fokal spongioz alanları vardır. Bu dönemde dermisdeki inflamatuar inflitrat genellikle lenfositler, histiositler ve nötrofillerden oluşur. Papüler evrede bazal tabakada mitoz artmıştır, epidermisde psoriaziform akantoz ve üst dermisdeki keratinositlerde kısmen sitoplazmik solukluk görülür.
Klinik olarak tam gelişmiş plak tip psoriasisde belirgin epidermal hiperplazi ile birlikte epidermal rete köprülerinde düzenli uzama, rete köprülerinin uçlarında genişleme, alt bölümlerinde kalınlaşma ve yer yer komşu retelerde birleşme görülür. Papillomatöz nedeni ile suprapapiller epidermisde incelme belirgindir. İnterkorneal nötrofil koleksiyonları (Munro mikroabseleri) sık, spinal tabakadaki benzer koleksiyonlar (Kogoj’ un spongiform püstülleri) daha seyrek görülür (11,17,78).
Munro mikroabseleri; papillalardaki kapiller boyunca suprapapiller epidermise göç eden nötrofil birikimleri ve piknotik nötrofil nükleuslarından oluşur. Kural olarak; Munro mikroabseleri özellikle erken lezyonlarda bulunur lezyon eskidikçe sayıları azalır veya tamamen kaybolabilirler (79). Belirgin hiperkeratoz, yer yer ortokeratoz ve horizontal olarak yaygın fakat vertikal olarak aralıklı parakeratoz alanları vardır. Parakeratoz alanlarında hipogranüloz belirgindir. Mukozal alanlar ve HIV enfekte hastalar hariç plazma hücreleri nadir olarak görülür (11,17,78,79).
Kronik ve gerilemekte olan psoriasis lezyonlarında stratum korneumda nötrofillerde ve parakeratozda azalma belirgindir. Granüler tabaka tekrar oluşmaya başlar ve ortokeratoz alanları artar. Epidermal hiperplastik değişiklikler gerilemeye başlar. Hafif yüzeyel dermal fibroz, papiller dermal kapillerde dilatasyon ve kıvrımlanma görülebilir (11,17,78).
KLİNİK ÖZELLİKLER
Deri
Psoriasis lezyonlarının dört belirgin özelliği vardır; 1– Lezyonlar çok net sınırlı ve simetriktir. 2– Yüzeyinde yapışık olmayan sedefi skuamlar vardır 3– Skuam altında parlak ve homojen eritem izlenir 4– Auspitz fenomeni pozitiftir. Lezyonların boyutu iğne ucu kadar papüllerden çok geniş plaklara kadar varyasyonlar gösterebilir. Lezyonlar genellikle simetrik yerleşmiştir (11,80,81).
Tırnaklar
Psoriasisde tırnak değişiklikleri sıktır. Farber ve Nall’un yaptığı 5600 hastalık anket çalışmasında vakaların %50’sinde el, %35’inde ayak tırnağı tutulumu bildirilmiştir (13). Tırnak plağındaki minör defektlerden ciddi tırnak distrofilerine ve tırnak kaybına kadar pek çok değişik şekilde lezyonlar görülebilir. Psoriasisin tırnağı tutma yeri ve süresine göre farklı görünümler ortaya çıkar. Tırnaktaki belli başlı morfolojik değişiklikler şunlardır:
1- Tırnak plağındaki çukurcuklar, proksimal tırnak kıvrımının dorsal yüzündeki defektif keratinizasyona bağlıdır. El tırnaklarında ayak tırnaklarından daha sık görülür.
2- Onikolizis; genellikle el parmaklarında ve ayak başparmağında görülür. Tırnağın tırnak yatağından ayrılması sonucu oluşur. Beyazımsı opak alanlar şeklinde görülür. Tek bir tırnağı tutabileceği gibi bütün tırnakları da etkileyebilir. Tırnak altında küçük bir alanda olabileceği gibi tırnağın %90’ını kaplayabilir ve tırnak kaybına sebep olabilir. Nadiren onikoliz alanlarında bakteriyel kolonizasyona sekonder yeşil veya siyah renk oluşabilir.
3- Subungual hiperkeratoz; özellikle ayak başparmağında görülür. Tırnak yatağındaki psoriasise sekonder aşırı keratin üretimi sonucu oluşur. Sıklıkla tırnakta deformite oluşturur ve bu durum parmakların normal fonksiyonlarını etkileyebilir.
4- Yağ lekesi olarak adlandırılan sarımsı maküler, tırnak yatağındaki psoriyatik sürece bağlıdır.
5- Onikodistrofi; tırnak matriksinin psoriyatik tutulumuna bağlıdır (11,80).
Püstüler psoriasisde tırnak değişiklikleri tırnak yatağında ve matriksindeki subungual püstüller şeklindedir. Eğer tırnağın büyük bir kısmı bu durumdan etkilenirse tırnağın kaybına ve matriksde hasar sonucu anonişiye sebep olabilir. Tırnak değişlikleri artritli hastalarda daha sıklıkla görülür (11).
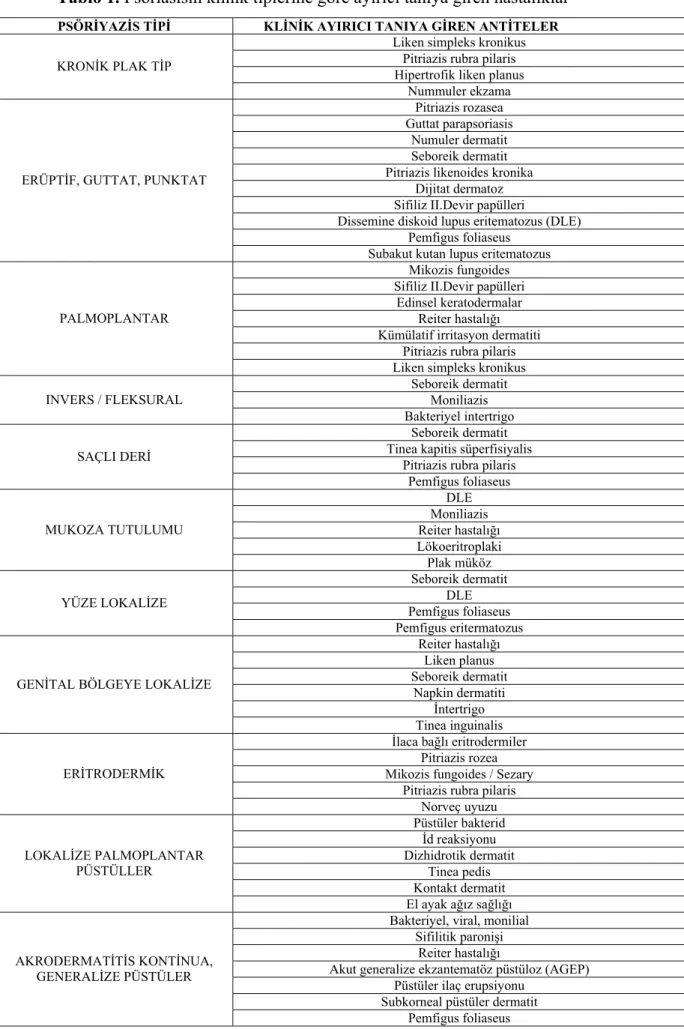
PSORİASİSİN KLİNİK TİPLERİ
Psoriasis Vulgaris
En sık görülen formdur. Eritemli skuamlı lezyonlar aylarca hatta yıllarca kalabilir. Plaklarda skuam oluşumu devam eder, ancak şekil ve patern değişikliği minimaldir. En çok dirsek, diz, saçlı deri, lumbar bölge ve umblikal bölge tutulur. Ayrı ayrı duran küçük lezyonlar birleşerek harita benzeri bir görünüm oluşturabilir (psoriasis geographica). Lateral ilerleyen ve komşu plaklarla birleşen lezyonlar sirsine görünüm alabilir (girat psoriasis). Bazen lezyonun ortası iyileşir ve halka benzeri bir görünüm alabilir (anüler psoriasis) (11).
Psoriasis lezyonları deri kıvrımları olan aksilla, inguinal bölge ve boyuna yerleşebilir (psoriasis inversa). İntertriginöz bölgelere yerleşen plaklarda skuamlar kaybolur, parlak eritemli iyi sınırlı plaklar oluşur. Folliküler psoriasis; gövdede özellikle foliküler lokalizasyonda punktat lezyonlar şeklinde görülür. Üzeri düz lezyonlar olduğunda liken planus ile karışabilir (19).
Rupoid, elefantin, ostraseöz psoriasis terimleri aşırı hiperkeratotik plak lezyonlar için kullanılmıştır. Rupoid psoriasis; deniz salyangozu benzeri koni şeklinde lezyonlar için kullanılır. Elefantin psoriasis; boyunda, sırtta ve ekstremitelerde lokalize, çok direçli, kalın, geniş skuamlı lezyonlar için, ostraseöz psoriasis ise istiridye kabuğu benzeri, konkav yüzeyli halka şeklinde lezyonlar için kullanılan terimlerdir (17).
Erüptif (guttat) Psoriasis
Üst gövde ve proksimal ekstremitelerde küçük (0,5–1,5 cm çapında) papül ve plaklar ile karakterizedir. Daha çok çocuklarda ve genç erişkinlerde görülür. Streptokokal boğaz infeksiyonları guttat psoriasisin başlamasına veya alevlenmesine sebep olabilir. Lezyonlar 2– 3 ay devam edip daha sonra gerileyebilir. Nadiren dirençli olabilir ve kronik plak tip psoriasise dönüşebilir(11,80,81).
Psoriyatik Eritroderma
Bütün vücutun etkilendiği generalize psoriasis formudur. Psoriasise ait bütün semptomlar görülmekle birlikte eritem en belirgin bulgudur ve skuam kronik psoriasise göre daha az belirgindir.
Kronik plak tip psoriasisin zamanla generalize forma dönüşmesi ile ortaya çıkan bir tablo olabileceği gibi, bazen doğrudan eritrodermik şekilde de başlayabilir. İrritan topikal tedavilere yanıt olarak generalize Koebner cevabı şeklinde ortaya çıkabilir.
Generalize püstüler psoriasis eritrodermiye dönüştüğünde püstül formasyonu kaybolur. Tırnak matriksindeki destrüksiyona bağlı tırnak kaybı görülebilir. Eritrodermide püstüler psoriasisin tüm belirtileri mevcuttur (ateş, halsizlik, sık relapslar ve hastalık periyodu uzarsa mortalite artışı). Derideki aşırı vazodilatasyona bağlı kalp yükü artmıştır. Dispne ve periferik ödem görülebilir. Epidermal bariyer kaybına bağlı sıvı elektrolit dengesinde bozukluklar olabilir. Sürekli skuam dökülmesi protein kaybına sebep olabilir. Hasta bu dönemi atlatırsa genellikle psoriasis vulgarise dönebilir, ancak nüksler sıktır (11,81).
Generalize Püstüler Psoriasis (von Zumbusch)
Psoriasisin akut varyantlarından biridir. Ateşle birlikte, 2–3 mm çapında steril püstüller görülür. Püstüller tüm gövdeye, el ve ayaklara, hatta tırnaklara kadar yayılmıştır. Eritemli zeminde minik püstüller şeklinde başlayan lezyonlar birleşerek püstül gölcüklerini oluşturur. Psoriasisin diğer formlarında olduğu gibi yüz genellikle korunmuştur.
Püstüllerin etrafındaki eritem yayılabilir ve eritrodermiyle sonuçlanabilir. Karakteristik olarak ateş ve püstüller periodik ataklar şeklinde ortaya çıkar (11,80,81).
Anüler Püstüler Psoriasis
Püstüler psoriasisin nadir bir formudur. Püstüler erüpsiyon epizodları süresince oluşur. Lezyonlar püstüler psoriasisin başlangıcında olabilir. Halka şeklinde eritemin üzerinde püstüller görülür. Histolojik olarak hafif akantoz ve mikroabse oluşumu ile nötrofil birikimi vardır (11,80).
Lokalize Püstüler Psoriasis
Özellikle avuç içi, ayak tabanı ve topuk kenarlarında eritemli zeminde yerleşmiş steril püstüller ile karakterizedir. Kadınlarda erkeklere göre 2 kat fazla görülür. Genellikle palmoplantar lezyonların dışında klasik psoriasis vulgaris lezyonları saptanabilir. Sıklıkla bilateral ve simetrik tutulum olmakla birlikte unilateral yerleşimde görülebilir. Sistemik semptomların olmadığı bu grupta iki varyant izlenir (11,80).
1- Palmoplantar püstüler psoriasis
Atipik formlar
Seboreik Psoriasis
Lezyonlar özellikle saçlı deri, nazolabial kıvrım, kaşlar, alın, intertriginöz alanlar ve gövde ön yüze lokalizedir. Eğer başka lezyon yoksa seboreik dermatitten ayrımı zor olabilir.
Linear ve Zonal Lezyonlar
Nadir bir formdur. Ekstremitelerde psoriasis lezyonları lineer yerleşim gösterebilir veya gövdede dermatoma sınırlı lezyon bulunabilir. Erişkinlerde etyoloji bilinmemekle birlikte çocuklarda altındaki nevusun psoriasise yatkın kişilerde psoriyatik süreci tetiklediği düşünülmektedir (80).
Genital Lezyonlar
Erkeklerde genital tutulum sık değildir. Penisde psoriasis %2–5 oranında görülmektedir. Bazen sadece genital bölge tutulumunda tanı konulamayabilir. En sık glansın proksimal kısmı tutulur. Tipik lezyonları 0,5–2 cm çapında iyi sınırlı eritemli plaklardır. Kalın beyaz renkte skuamlar genellikle yoktur. Genellikle parlak eritemli patchler şeklinde görülürler. Daha nadiren skrotumda da psoriyatik lezyonlara rastlanabilir. Kadın hastalarda daha çok perivulvar alanda skuamın olmadığı iyi sınırlı eritemli lezyonlar görülür (80).
Müköz Membran Lezyonları
Psoriasisde müköz membran tutulumu çok nadirdir. Eritrodermik formda dudaklarda skuam görülebilir. Generalize püstüler psoriasisde hastaların az bir kısmında oral tutulum olabilir. Genellikle stomatitis areata migrans (coğrafik stomatit) şeklinde lezyonlar görülür. Dilin dorsal yüzeyi dışında, bukkal mukoza, dilin ventral yüzeyi ve gingivada da lezyonlar bulunabilir. Skrotal dil görülebilir (80).
Oküler Lezyonlar
Blefarit, keratit, konjuktivit görüldüğü bildirilmiştir. Primer mi yoksa gözkapağının tutulumuna sekonder mi geliştiği bilinmemektedir (17,80).
LABORATUAR BULGULARI
Psoriasise özgü laboratuar bulgusu yoktur. Serum ürik asit seviyeleri hastaların %50’sinde yüksek bulunmuştur ve hastalığın yaygınlığı ve şiddeti ile orantılıdır. Serum ürik asit seviyeleri tedavi sonrası genellikle normale döner. Ciddi psoriasis vulgarisde, generalize püstüler psoriasisde ve eritrodermide negatif nitrojen dengesi oluşabilir, serum albümin seviyesinde düşüklük saptanabilir.
C–reaktif protein, α–2 mikroglobülin ve sedimentasyon oranları hastalığın aktivitesi ve vücut tutulum alanı ile orantılı olarak yüksek bulunabilir.
Serum IgA seviyesi ve IgA immün kompleks artışı görülebilir. Geçirilmiş streptokoksik infeksiyonlar sonrası guttat psoriasisde ASO yüksekliği saptanabilir (11).
TANI
Tipik psoriasis lezyonlarında klinik bulgular tanı konulması için yeterlidir. Ancak atipik şekiller ve özel lokalizasyonlar tanıda karışıklık yaratabilir.
Mum Lekesi Fenomeni
: Psoriasise özgü bir fenomendir. Psoriasise ait olduğu düşünülen lezyon bir bistüri ile kazınacak olursa skuamlar kuru, beyaz lameller halinde dökülürler.Bu dökülme düz bir yüzey üzerine damlayıp kurumuş bir mum damlasının kazınması sırasındaki beyazlaşma ve tabaka tabaka kalkmasına benzetilerek mum lekesi fenomeni adını alır. Parakeratotik hiperkeratozun bir bulgusudur.
Son Zar Fenomeni
: Psoriasis plağında skuamların kaldırılmasından sonra kazıma işlemine devam edilecek olursa lezyondan yapışık nemli bir tabaka kaldırılabilir. Bu epidermisin dermal papillalar üzerindeki son tabakası olup psoriasis için patognomonik bir bulgudur.Auspitz Fenomeni (Noktavi Kanama Belirtisi) :
Psoriasisdeki skuamlı plaklar kazınmaya devam edilirse skuamların altından önce eritemli bir zemin ortaya çıkar daha sonra küçük kırmızı noktacıklar halinde kanama odakları görülür.Bu kanama odakları uzamış dermal papillaların uçlarına uymaktadır. Psoriasis için spesifik bir özelliktir ve diagnositik değere sahiptir. Ancak invers ve püstüler psoriasis formlarında negatiftir.
Woronoff Halkası:
İyileşen psoriasis plaklarının çevresinde milimetreler ile ölçülebilen eritemsiz hipopigmente bir zon belirir. İlk kez 1926 yılında Woronoff tanımlanan bu belirti Woronoff halkası olarak bilinmektedir (8,11,17,19,81).DİĞER HASTALIKLAR İLE BİRLİKTELİKLERİ
Psoriasisli hastalarda Crohn hastalığı sıklığının arttığı gösterilmiştir. Bu durum genellikle ailesel psoriasis olgularında daha sık görülmektedir (17). Psoriasisli hastalarda özellikle nonmelanoma deri kanserleri ve lenfoproliferatif hastalık sıklığında da belirgin bir
artış saptanmıştır. Bu risk özellikle ciddi prognozlu ve sistemik tedaviler ve fototerapi gören hastalarda belirgindir (82).
Otoimmün büllöz hastalıkların da psoriasisle birlikte görülme sıklığı yüksektir (83). En sık görülen büllöz pemfigoiddir. Küçük vaka serilerine dayanılarak psoriasis tedavilerinin (özellikle fototerapi) büllöz hastalıkları tetiklediği düşünülmektedir.
Kronik tekrarlayıcı multifokal osteomyelit; sebebi belli olmayan, ağrı ve tutulan eklemde şişlikle seyreden bir durumdur. Püstüler ve nonpüstüler psoriasis ile birlikte görülen vakalar bildirilmiştir. SAPHO (sinovit, akne, püstülozis, hiperostozis, osteitis) sendromu ile birlikte bildirilmiş vakalar da vardır (17).
Psoriasis ile vitiligo arasındaki ilişki tam anlaşılamasa da çok sayıda birliktelik bildiren olgu rapor edilmiştir (17).
Psoriasisin lipid metabolizma bozuklukları, insülin sekresyonu ve diabetes mellitus ile olası ilişkisi üzerinde de çeşitli çalışmalar yapılmaktadır. Bu çalışmalardan birinde psoriasisli hastalarda HDL–kolesterol düzeylerinde azalma saptanırken, insülin sekresyonu ve duyarlılığı normal olarak bulunmuştur (84).
Henseler ve arkadaşlarının yaptığı bir başka çalışmada ise psoriasisli hastalarda obesite, diabet, hipertansiyon ve kardiovasküler hastalıkların daha sık olduğunu göstermişler, ancak bu durumun diet alışkanlıklarından mı, yoksa psoriasis ile ilişkili mi olduğu tam olarak ortaya konamamıştır (85).
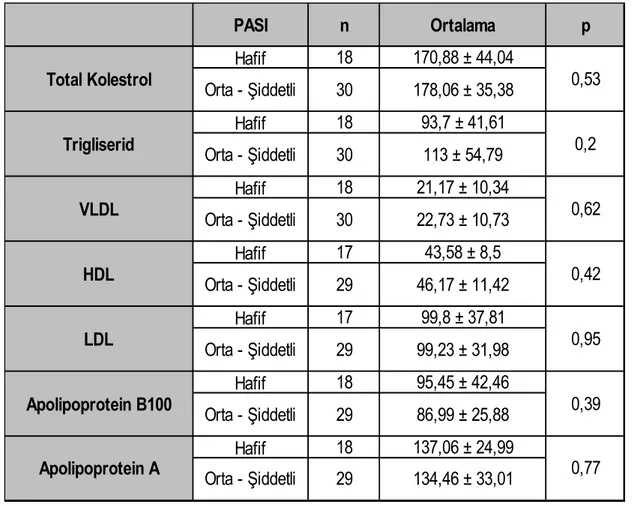
Rocha ve arkadaşlarının yaptığı çalışmada; total kolesterol, trigliserid, LDL, VLDL, lipoprotein a, apolipoprotein A1, apolipoprotein B düzeyleri kontrol grubuna göre yüksek, HDL düzeyi ise düşük bulunmuş ve psoriasisli hastaların kardiovasküler hastalıklar için risk grubunda oldukları ve düzenli aralıklar ile kontrol edilmeleri gerektiği, vitamin A ve E gibi antioksidan vitaminlerden zengin beslenmeleri gerektiği bildirilmiştir (5).
Yapılan bir başka çalışmada; serum lipid, lipoprotein ve apolipoprotein düzeyleri değerlendirilmiştir. Serum lipoprotein a ve trigliserid düzeyleri yüksek olarak saptanmış ve bu durumun kardiovasküler hastalıklar açısından psoriasisde risk oluşturabileceği belirtilmiştir (86).
PROGNOZ
Psoriasisin seyri oldukça değişkendir. Yaş, lokalizasyon ve hastanın tedavi uyumu gibi çeşitli faktörlere bağlıdır. Bazı bireylerde lezyonlar uzun süre stabil kalırken, bazılarında eski lezyonlar gerilemekte ancak yeni lezyon çıkışı olmaktadır (19). Sınırlı süreler ile lezyonsuz
dönemler görülebilir, nadiren tam iyileşme olabilir. Psoriasis vulgarisde pek fazla komplikasyon görülmez. En belirgin komplikasyon atipik psoriasis şekillerine dönüştür. İnvers tipteki lezyronlara sekonder bakteriyel ve kandidal infeksiyonlar eklenebilir (81).
KLİNİK SKORLAMA
Sistemik hastalıklarda tedavi rejimlerinin etkinliğini değerlendirmek için standardize edilmiş yöntemler kullanılmaktadır. Psoriasisde sıklıkla kullanılan skorlama yöntemi Psoriasis Area Severity Indeks (PASI)’dır (Bkz. EK-1). Hastalığın seyrini ve tedavinin etkinliğini değerlendirmede kompleks ve ayrıntılı bir teknik olarak kabul edilmektedir. Mevcut lezyonlardaki eritem, indurasyon ve deskuamasyon dört anatomik alana göre (baş, kollar, gövde ve bacaklar) skorlanır. Maksimum skor 72 olup, ciddi komplet eritrodermik hastalarda görülür (19).
TEDAVİ
TOPİKAL TEDAVİLER
Kortikosteroidlerİlk kullanıma sunuldukları 1950’lerin başından bu yana topikal kortikosteroidler psoriasis tedavisinin ana dayanağı olmuştur (8). Vazokonstrüktif, antiinflamatuar, antimitotik ve antiproliferatif etkileri vardır (87).
Kortikosteroidler sıklıkla hafif, orta dereceli psoriasisde ve diğer topikal tedavilerin irritasyona sebep olduğu fleksural alanlarda kullanılır. Yıllar içerisinde lipofilik özellikleri arttırılarak antiinflamatuar etkileri daha da belirgin hale gelmiştir. Krem, merhem, losyon, jel ve köpük formları vardır (8). Vazokonstrüksiyon geliştirme güçlerine göre 4 gruba ayrılırlar. Psoriasisde genellikle potent ve süperpotent olanlar tercih edilir. Süperpotent kortikosteroidlerin fazla miktarlarda kullanımının generalize püstüler psoriasisi tetiklediği bildirilmiştir (87).
Merhem formu etkinliği en yüksek olan şeklidir. Plastik veya hidrokolloid altında oklüzyon şeklinde uygulanırsa etkinliği daha da belirginleşir. Günde bir kez veya günde iki kez kullanım şekillerinin etkinlikleri benzer bulunmuştur (88). Günaşırı kullanımla uzun süre remisyon sağlanabilir. Yüksek potent kortikosteroidlerle en az %80 hastada kür sağlanmaktadır. En iyi etki 2. hafta sonunda görülmektedir. İdame tedavide betametazon dipropionat sadece hafta sonu kullanımı ile %74 hastada remisyonun devam etmesini sağlamıştır. Plasebo grubunda bu oran %21 olarak saptanmıştır. Sık kullanımlarda taşiflaksi gelişebilir. Bu durumun önlenmesi için intermittan tedavi protokolü uygulanması önerilmektedir (haftada birkaç gün veya hafta sonu) (8).
Topikal antralin, tazaroten ve vitamin D3 analogları ile kombinasyonları oldukça etkili olmuş ve kullanılan kortikosteroid miktarının ve buna bağlı yan etkilerin azalmasını sağlamıştır (88). Kortikosteroidlerin PUVA ile kombinasyonu iyileşme süresini kısaltır, ama remisyon süresinde de azalmaya sebep olur. UVB ile kombinasyonlarında etkinlikte değişiklik olmamış, ancak remisyon süresini kısaltmıştır.
Genel olarak UV tedavileri ile kombine edilmemelidir, ancak dirençli vakalarda izole lezyonlarda denenebilir. Asitretin ile kombinasyonları ile başarılı sonuçlar bildirilmiştir (89).
Kullanım sıklığı, süresi, yeri, oklüzyon şeklinde uygulanması, ilacın gücü ve miktarına bağlı olarak lokal ve sistemik yan etkiler görülebilir.
Lokal yan etkiler; epidermal atrofi, dermal atrofi (özellikle fleksural alanlarda strialar), telenjiektaziler, akneiform erüpsiyonlar, perioral dermatittir. Sistemik yan etkileri; iatrojenik Cushing sendromu, glukoz intoleransı, hipertansiyon, psişik bozukluklar, peptik ülser oluşumu, yara iyileşmesinde gecikme, infeksiyon gelişiminin kolaylaşması, büyümenin baskılanması ve osteoporozdur (8,87,89).
Antralin
Antralin (1,8–dihidroksiantron; signolin, dithranol) Galewsky ve Unna tarafından ilk kez 1916 yılında kullanılmıştır. Halen farklı bazlar ve uygulama şekilleri ile kullanılmaya devam etmektedir. Antralinin en büyük avantajı uzun süreli yan etkilerinin olmamasıdır (11).
Keratinositler üzerine antiproliferatif etkiye sahiptir. Son yıllarda inflamatuar infiltrat hücreleri üzerinden de güçlü antiinflamatuar etkilerinin olduğu gösterilmiştir. Nötrofil ve monosit inhibisyonu yapmaktadır. Interlökin–6, IL–8 ve TNF–α gibi proinflamatuar sitokinlerin salınımını azaltır (11,88).
Sıklıkla kronik plak tip psoriasisde kullanılmaktadır. Guttat psoriasis tedavisinde de etkili bulunmuştur. Günde bir kez düşük konsantrasyonlarda (%0.05–0,1) kullanılmaya başlanmalıdır. Otooksidasyondan korunmak için salisilik asit (%1–2) mutlaka eklenmelidir. Kişinin toleransına göre konsantrasyon yavaş yavaş yükseltilir. Kısa temas süreli tedavi şeklinde de kullanılabilir. Yüksek konsantrasyonlarda antralin (%1–5) kısa süreli periodlarla (10–20 dk) uygulanır ardından silinir. Lezyon geçene kadar uygulama süresi haftalık olarak arttırılır. Tedavi alanlarında lökoderma benzeri görünüm oluşturabilir (11).
İrritasyon sebebi ile yüz, genital bölge ve kıvrım yerlerinde kullanılmamalıdır. İngram metodunda UVB, katran ve antralin birlikte kullanılır. UVB ve katran banyosu ile %0,1’den başlayan düşük konsantrasyonlu antralinin 24 saat uygulamasının kombine edildiği İngram metodu çok başarılı bir rejim olmasına rağmen kullanımının zorluğu sebebi ile günümüzde tercih edilmemektedir. Benzer sebeplerden dolayı PUVA ile kombinasyonu da tercih edilmemektedir. Siklosporin ve kısa temas süreli antralin kombinasyonu ise dirençli vakalarda faydalı olabilir (89).
Yan etkiler; uygulandığı alanda lokal irritan reaksiyonuna ve kahverengi renk değişikliğine sebep olabilir. Oksidasyon ürünleri sonucu oluşan renk değişikliği stratum korneumun üst kısmında lokalize olduğundan antralin uygulanmasının kesilmesinden kısa bir