T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
ADJUVAN ANTRASİKLİN UYGULANAN MEME KANSERİ
HASTALARINDA VÜCUT YAĞ KÜTLESİ ORANI İLE
KEMOTERAPİ TOKSİSİTESİ ARASINDAKİ İLİŞKİ
Dr. HEMRİN KAVAK
TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
ADJUVAN ANTRASİKLİN UYGULANAN MEME KANSERİ
HASTALARINDA VÜCUT YAĞ KÜTLESİ ORANI İLE
KEMOTERAPİ TOKSİSİTESİ ARASINDAKİ İLİŞKİ
Dr. HEMRİN KAVAK
TIPTA UZMANLIK TEZİ
Doç. Dr. M.ALİ KAPLAN
TEZ DANIŞMANI
TEŞEKKÜR
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M. Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Orhan AYYILDIZ Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Ali Kemal KADİROĞLU, Prof. Dr. Alpaslan Kemal TUZCU, Prof. Dr. Kendal YALÇIN ,Prof. Dr. Muhsin KAYA, Doç. Dr. M. Ali KAPLAN, Doç. Dr. Mehmet KÜÇÜKÖNER, Doç. Dr. Zülfikar YILMAZ, Yrd. Doç. Dr.Yaşar YILDIRIM, Yrd. Doç. Dr. Zuhat URAKÇI, Yrd. Doç. Dr. Feyzullah UÇMAK,Yrd.Doç. Dr. Zafer PEKKOLAY, Yrd.Doç. Dr. Abdullah KARAKUŞ, Yrd Doç. Dr.Emre AYDIN ,Yrd Doç.Dr. Fatma Yılmaz AYDIN,Uz. Dr. Elif Tuğba TUNCEL, Uz. Dr. Hüseyin KAÇMAZ, Uz.Dr. Zeynep ORUÇ, Uz.Dr. Halis YERLİKAYA, Uz. Dr. Hikmet SOYLU, Uz. Dr. Ali Veysel KARA’ya teşekkürlerimi sunarım.
Tezimin her aşamasında yardımlarını esirgemeyen saygıdeğer hocam Doç. Dr. M.Ali KAPLAN’a teşekkürlerimi sunarım.
Hayatımın her aşamasında, maddi ve manevi desteklerini benden esirgemeyen, bu günlere gelmemde herkesten çok emek sarfeden sevgili aileme sonsuz teşekkürü borç bilirim. Asla hakları ödenemeyecek olan Remziye KAVAK, Murat KAVAK, Eren KAVAK, Gülbin AYDIN, Gamze DEMİR ve yeğenlerim İlkim-İlkay-Elif DEMİR, Xemgin Zana AYDIN, Murat Evren KAVAK ve sonradan katılarak ailemize güzellikler katan Renas AYDIN, Rojda KAVAK ve Mehmet DEMİR, varlığınıza şükürler olsun. Ayrıca şuan aramızda olmayan ve ilerleyen zamanlarda ailemize katılacak olan tüm güzel insanlara şimdiden teşekkür ediyorum.
NEÜ. Meram Tıp Fakültesindeki tüm hocalarıma,yandal uzmanlarına ve arkadaşlarıma bana verdikleri emek için teşekkür ederim.
Tezimle ilgili yaptığım çalışmanın her aşamasında rehberliğini ve aktif desteğini eksik etmeyen Dr.Beşir KAYA ‘ya teşekkür ederim.
Ayrıca tez çalışmam sırasında gerek veri toplama ve gerek hasta toplama konusunda benden yardımlarını esirgemeyen Hatice BEKLEN’e teşekkür ederim
ÖZET
Giriş ve amaç Obezite meme kanseri için kötü bir prognoz göstergesidir.Bu kötü prognoza katkısı muhtemel olan sebeplerden biri de adjuvan kemoterapinin yetersiz dozda uygulanmasıdır. Çoğu çalışmada gösterilmiştir ki; adjuvan kemoterapi hastalarda yeterli dozda uygulanmadığında(<%85) etkinliği azalır. Morbid obezlerde kemoterapinin dozunun ayarlanması ile ilgili veriler yetersizdir. Normalde kemoterapi dozu vücut yüzey alanına göre hesaplanır (boy ve kilo ile). Bizim çalışmamızın hedefi,vücut yağ kütle oranının grade 3-4 toksisiteyi ön görmede rutinde kullanılan yöntem olan vücut yüzey alanına göre üstünlüğü olup olmadığını araştırmaktır.
Materyal ve metod: 2007-2016 yılları arasında adjuvan tedavi için doksorubisin (60 mg/m2) ve siklofosfamid (600 mg/m2) kullanılan 207 opere meme kanseri hastası ile bu retrospektif çalışma yapıldı. Hastaların demografik özellikleri, toksisiteleri, vücut yağ oranı, vücut yüzey alanı, vücut kitle indeksi hasta dosyalarından değerlendirildi. Hastalar vücut yağ oranı (yüksek ≥35% vs. normal <35%), VKI (obez ≥30 kg/m2 vs. nonobez <30 kg/m2) ve VYA’na (≥1.73 vs. <1.73) göre değerlendirildi.
Bulgular: Ortanca yaş 46 (23-82) ve hastaların %61,8’i (n=128) premenopozaldi. Ortanca vücut yağ oranı, VYA, and VKI düzeyi sırasıyla 37 (10-55), 1,75 (1.3-2.27) and 29,4 (16-54,7). 37 hastada (17,9%) tedavi toksisitesi nedeniyle tedavi ertelenmesi yapılmıştır. Grade ≥3 toksisite 68 hastada (%32,9) gözlendi. Tek değişkenli analizde grade ≥3 toksisite VKI’ne (obez and nonobez hastalarda, 34,8% vs. 31,4%, sırasıyla, p=0,589) ve vücut yüzey alanına (m2 ≥1.73 vs. m2 <1.73, %35,8 vs. %29,6, sırasıyla, p=0,344) göre farklılık göstermezken vücut yağ oranına göre (yüksek ve düşük, %39,1 vs. %25,0, respectively, p=0,031) istatistiksel anlamlı farklılık göstermekteydi. Çok değişkenli analizde vücut yağ oranı [<35 vs >35, OR (odds ratio): 2,341 %95CI:0,39-5.27, p=0.040] grade ≥3 toksisite gelişimini etkilerken, BMI [<30 vs >30; OR:0,876 %95 CI=0,392-1,959, p=0748], VYA [<1,73 vs. >1.73 m2, OR:0,956, %95CI:0,450-2,034, p=0,908], yaş [<50 vs >50, OR:2,171,
%95CI:0,338-13,956, P= 0,414], menopozal durum [premenopozal vs postmenopozal, OR:4,374, %95CI:0,661-28,964, p=0,126], evre [1,2 vs 3, OR:0,535, %95CI:0,279-1,024, p=0,059] ve histolojik alt tip [duktal vs diğer; OR:2,010 %95 CI=0,368-2,010, p:0,729] etkilememişti.
Tartışma: VYA temelli doz ayarlama sitotoksik ilaç dozunu güvenle ayarlamak için onkolojide geniş kabul görmüştür. Bizim çalışmamız obez meme kanseri hastalarında gerçek vucut ağırlıgına gore doz ayarlandığında kemoterapi ile aşırı toksisite riski artışı olmadığını doğrulamıştır. Sonuçta, adjuvan tedavi için AC kullanılmış olan meme kanseri hastalarında vücut yağ oranının grade ≥3 toksisiteyi öngörmede VKI ve VYA’na gore daha değerli olduğu gözlenmiştir.
ABSTRACT
Background: Obesity is a poor prognostic indicator for breast cancer. One of the possible causes of poor prognosis is the inadequate administration of adjuvant chemotherapy. Most studies have shown that; If adjuvant chemotherapy is not administered in sufficient doses in patients (<85%) the efficacy is reduced. The dose related to the adjustment of the dose of chemotherapy in morbid obese is inadequate. Normally chemotherapy is calculated according to body surface area (by height and weight). The aim of our study was to investigate whether body fat mass ratio is superior to body surface area, which is the method used in routine routine, to predict grade 3-4 toxicity.
Patients and methods: We performed a retrospective cohort study of 207 operated breast cancer women treated with doxorubicin (60 mg/m2) and cyclophosphamide (600 mg/m2) for adjuvant setting between 2007 and 2016. Patients’ demographic features, toxicities, fat mass, body mass index (BMI) and body surface area (BSA) were evaluated in their charts. Patients were evaluated according to fat mass (high ≥35% vs. normal <35%), BMI (obese ≥30 kg/m2 vs. nonobese <30 kg/m2), and BSA (≥1.73 vs. <1.73) levels.
Results: Median age was 46 (23-82) and 61.8% of the patients (n=128) were premenopausal. Median fat mass, BSA, and BMI level was 37 (10-55), 1.75 (1.3-2.27) and 29,4 (16-54,7), respectively. Thirty seven patients (17.9%) experienced cycle delay due to treatment toxicities. Grade ≥3 toxicity was observed in 68 patients (%32,9). Although, in univariate analyses there are no differences in terms of grade ≥3 toxicity according to BMI (in obese and nonobese patients, 34,8% vs. 31,4%, respectively, p=0,589), and BSA (in patients with m2 ≥1.73 vs. m2 <1.73, %35,8 vs. %29,6, respectively, p=0,344), statistically significant difference was observed according to fattmass (fatmass high and low, %39,1 vs. %25,0, respectively, p=0,031). In multivariate analyses, fastmass [<35 vs >35, OR (odds ratio): 2,341 %95CI:0,39-5.27, p=0.040] was affect grade ≥3 toxicity, while BMI [<30 vs >30;
OR:0,876 %95 CI=0,392-1,959, p=0748], BSA [<1,73 vs. >1.73 m2, OR:0,956, %95CI:0,450-2,034 , p=0,908], age [<50 vs >50, OR:2,171, %95CI:0,338-13,956, P= 0,414], menopausal status [premenopausal vs postmenopausal, OR:4,374, %95CI:0,661-28,964, p=0,126], stage [1,2 vs 3, OR:0,535, %95CI:0,279-1,024, p=0,059] ve histologic subtype [duktal vs diğer; OR:2,010 %95 CI=0,368-2,010, p:0,729] was not.
Discussion: BSA based dosing has been widely adopted in oncology as a means of safely administering cytotoxic drugs. We have confirmed that overweight breast cancer patients receiving adjuvant chemotherapy are not at excessive risk of dose reduction if dosed according to their actual body weight. Finally, fat mass is most valuable than BSA and BMI for evaluation to grade ≥3 toxicity for breast cancer patients treated with AC in adjuvant setting.
İÇİNDEKİLER Sayfalar TEŞEKKÜR ... ÖZET ... ABSTRACT ... İÇİNDEKİLER ... ŞEKİL LİSTESİ ... TABLO LİSTESİ ... KISALTMALAR... 1. GİRİŞ VE AMAÇ ... 2. GENEL BİLGİLER ... 2.1. Meme Anatomisi ve Fizyolojisi ... 2.1.1. Meme Anatomisi ... 2.1.2. Meme Fizyolojisi ...
2.2. Meme Kanseri ...
2.2.1 Epidemiyoloji ... 2.2.2. Etyoloji Ve Risk Faktörleri ... 2.2.3. Meme Kanserinde Klinik Bulgular ... 2.2.4. Meme Kanseri Tanısı ... 2.2.5 Meme Kanserinin Sınıflandırılması ... 2.2.6. Meme Kanserinde Evreleme ... 2.2.7. Meme Kanserinde Prognostik ve Prediktif Faktörler ... 2.2.8. Meme Kanserinde Tedavi ... 2.3. Diyabetes Mellitus ve Kanser ...
2.3.1. Diabetes Mellitus ve Kanser Arasındaki Olası Bağlantılar ... 2.4. Obezite ve Kanser ... 3.MATERYAL VE METOD ... 4. BULGULAR ... 5. TARTIŞMA ve SONUÇLAR ... KAYNAKLAR ... ÖZGEÇMİŞ ... i ii iv vi vii viii x 1 3 3 3 4 5 5 6 10 12 13 18 21 28 41 41 43 45 47 64 70 96
ŞEKİL LİSTESİ
Sayfalar Şekil 1. Meme anatomisinin şematik gösterimi ...
Şekil 2. Memenin lenfatik drenajı ...
Şekil 3. Epidermal growth faktör reseptör ailesi
...
Şekil 4. HER2 aktivasyonu sonrası aktive olan hücresel yolaklar ...
Şekil 5. Visseral obezite, dismetobolizma ve kanser
ilişkisi ...
Şekil 6. Adinopektin, obezite kanser ilişkisi ...
Şekil 7. Hastaların menopoz durumuna göre dağılımı ...
Şekil 8. Hastaların histolojik alt tiplere göre dağılımı ...
Şekil 9. Hastaların patolojik gradelere göre dağılımı ...
Şekil 10. Hastaların evrelere göre dağılımı ...
3 4 27 27 44 44 51 53 55 56
TABLO LİSTESİ
Sayfalar Tablo 1. Meme Kanserinin risk faktörleri ... Tablo 2. Meme tümörlerinin histopatolojik sınıflaması ...
Tablo 3. Primer tümör (T) ...
Tablo 4. Bölgesel lenf nodülleri (N) klinik sınıflandırma ...
Tablo 5. Patolojik sınıflama (pN) ... Tablo 6. Uzak metastaz (M) ... Tablo 7. Meme kanseri evrelerinin gruplandırılması ... Tablo 8. Meme kanserinde evreye göre 5 yıllık sağkalım oranları ... Tablo 9. Meme kanserinde prognostik ve prediktif parametreler ... Tablo 10. Tümör çapı ile aksiller lenf nodu tutulumu arasındaki ilişki ... Tablo 11. Histolojik alt tiplere göre prognostik dağılım ... Tablo 12. Güncel adjuvan kemoterapi seçenekleri ... Tablo 13. St Gailen Konsensüsü erken evre meme kanseri risk grupları... Tablo 14. Meme kanserli hastaların klinikopatolojik ve demografik özellikleri ... Tablo 15. Meme kanserli hastaların kemoterapi toksisite görülme sıklıkları ... Tablo16. Meme kanserli hastalarımızda yaşa göre kemoterapi toxitesi görülme sıklığı ... Tablo 17. Meme kanserli hastalarımızda menopoz durumuna göre kemoterapi
toksisite sıklığı ... Tablo 18. Meme kanserli hastalarımızda histolojik alt tipe göre kemoterapi
toksisite sıklığı ... Tablo 19. Meme kanserli hastalarımızda grade durumuna göre kemoterapi
toksisite sıklığı ... Tablo 20. Meme kanserli hastalarımızda grade durumuna göre kemoterapi
10 15 18 19 19 20 20 21 22 23 24 38 39 49 50 51 52 54 56 57 58
toksisite sıklığı ... Tablo 21. Hastaların fatmass, VYA, VKİ dağılımlar ... Tablo 22. Meme kanserli hastalarımızda fatmass oranlarına göre kemoterapi
toksisite sıklığı ...
Tablo 23. Meme kanserli hastalarımızda vücut yüzey alanı oranlarına göre
kemoterapi toksisite sıklığı ... Tablo 24. Meme kanserli hastalarımızda VKİ oranlarına göre kemoterapi
toksisite sıklığı ... Tablo 25. Kemoterapi toksisitesine etkili faktörlerin multivariate analizi ...
61
62 63
KISALTMALAR
USG : Ultrasonografi
MRI : Manyetik rezonans görüntüleme DCIS : Duktal karsinoma in situ
LCIS : Lobüler karsinoma in situ
AJCC : American Joint Committee on Cancer ER : Östrojen reseptörü
PR : Progesteron reseptörü EGF : Epidermal büyüme faktörü EGFR : Epidermal growth factor receptor PI3K : Fosfatidil inositol 3-kinaz
SM : Simple mastektomi MKC : Meme koruyucu cerrahi AI : Aromataz inhibitörü
EGFR : Epidermal Büyüme Faktör Reseptörü FİSH : Flöresan in situ hibridizasyon
HER-2: Human Epidermal Büyüme Faktör Reseptör 2 RT : Radyoterapi
TNM : Tümör Nod Metastaz WHO : World Health Organisation
FAC : Fluorourasil & adriamisin & siklofosfamid FEC : Fluorourasil & epirubisin & siklofosfamid TAC : Dosetaksel & adriamisin & siklofosfamid LHRH : Lüteinleştirici hormon releasing hormon HSK : Hastalıksız sağkalım
DC : Dosetaksel-Siklofosfamid AC : Doksorubisin-Siklofosfamid DM : Diabetes Mellitus
IGF : İnsülin Benzeri Büyüme Faktörü mTOR : Mammalian Target Of Rapamycin VKİ : Vücut Kitle İndeksi
ER(-) : Östrojen reseptörü negatif ER(+) : Östrojen reseptörü pozitif IL-1 : İnterlökin 1
IL-6 : İnterlökin 6
PR (+) : Progesteron reseptörü pozitif PR(-) : Progesteron reseptörü negatif TNF-α : Tümör nekroz faktör
LDL : Low density lipoprotein
A.B.D : Amerika Birleşik Devletleri’nde(A.B.D) DNA : Deoksiribonükleik asit
NASH : Nonalkolik steatohepatit
ASCO : American Society of Clinical Oncology CK : Cytokeratin
İİAB : İnce iğne aspirasyon biyopsisi MRM : Modifiye Radikal Mastektomi CI : Confidence İnterval
BRCA : Breast kanser OR : Odds Ratio
1. GİRİŞ VE AMAÇ
Kanser, hastalıklara bağlı ölüm nedenleri arasında ikinci sıradadır ve tüm ülkeler için önemli ve öncelikli bir halk sağlığı sorunu olduğu ifade edilmektedir. Kanser türleri içerisinde de; meme kanserinin birçok ülkede, kadınların sağlığını etkileyen önemli bir kanser türü olduğu görülmektedir (1).
Meme kanseri kadınlarda görülen en sık malign tümör olup, kadınlarda tüm kanserlerin yaklaşık %30’unu oluşturmaktadır (2). Meme kanseri kadınlarda kansere bağlı ölüm nedenleri sıralamasında akciğer kanserinden sonra ikinci sırada yer almaktadır (3). Gelişmiş ülkelerde tarama mamografileri ve postmenopozal kadınlarda hormon replasman tedavisinin daha az kullanımı ile meme kanserinin insidansında azalma kaydedilmiştir (4, 5).
Son 10-15 yıl içinde meme kanserinin erken tanısında sürekli bir artış gözlenmekte, buna karşılık hastalığa bağlı ölüm oranı son 10 yıldır düşme göstermektedir (6). Meme kanserini erken yakalamak için yapılan tarama çalışmalarındaki ve adjuvan tedavideki çarpıcı gelişmelere rağmen, erken evrede tanı konulan hastaların %20’sinde metastatik hastalık gelişmektedir (7,8). Meme kanseri heterojen ve kronik bir hastalıktır; hastalık tanı sonrasında birkaç yıl içinde nüks edebileceği gibi yıllar sonra da geri gelebilir. Tanı anında hastalığın nüks riski ile ilgili bize bilgi veren patolojik ve hastaya ait özel faktörler olduğu gibi, metastaz geliştiğinde de hastalığın seyri ile ilgili yön gösteren klinik ve patolojik faktörler bulunmaktadır. Tedavi seçenekleri bu özelliklerin analizi sonunda belirlenir.
Vücut yağ oranı ya da vücut yağ yüzdesi, kişinin vücudunda bulunan yağ doku ağırlığının kişinin toplam ağırlığına oranıdır ya da yüzdesidir. Sıklıkla kullanılan vücut kitle indeksinin aksine, boy ve kilodan bağımsız olarak vücut kompozisyonu hakkında bilgi veren vücut yağ oranı, kişinin sağlığı ve kondisyonunu belirlemek açısından önemli bir veridir. Kemoterapi uygulamaları genelde vücut yüzey alanı hesaplamalarına göre yapılır. Burda esas olan boy ve kilodur. Ancak obez hastalar gibi yağ oranının yüksek olduğu hastalarda ilacın vücuttaki dağılımında değişim gibi faktörlerle etkinlik ve yan etki profili değişebilir.
Obez kadınlarda optimal kemoterapi dozunu ayarlamak önemli bir problemdir. Genel olarak obez kadınlar vücut kitle indeksine veya vücut yüzeyine
göre düşük dozlarda kemoterapi alır. 5FU ve doxorubicininde aralarında bulunduğu değişik kemoterapi ajanlarına ait farmakokinetik çalışmalarda gösterilen yüksek oranda maruziyeti (9-12) ve ayrı ayrı yapılmış klinik çalışmalarda rapor edilen yüksek toksisite oranlarını (13) takiben profilaktik doz azaltılması yapılır hale gelmiştir. Bununle birlikte, yakın zamanda, obez kadınlarda doz azaltılmasının azalmış toksisite (14,15) ve kötü prognoz (16,17) ile ilişkisini ortaya koymuştur. Yapılan doz azaltılmasının çoğunluğunda sınır kabul edilen vücut yüzey alanını düzeyi genelde iki m2 dir (18). Bu nedenle meme kanseri olan obez kadınlarda doz azaltımı olarak azalmış yaşam süresine neden olabilir (19). Bu yüzden güncel kılavuzlar vücut yüzey alanına göre tam doz ilaç kullanmayı önerir (20). Obez hastalarda tam doz ilaç kullanılmasıyla toksisite oranlarının tanımlandığı kanıtlar yetersizdir. Bunun yanında, obez hastaların tam doz ilaç alması halinde obez olmayan hastalarla aynı toksisiteye sahip olması beklenmektedir. Obez hastalardaki bu tartışmalar kemoterapi dozu hesaplamada kullanılan VYA’nın güvenilir bir yöntem olup olmadığını da sorgulatmaya başlamıştır. Literatürde VKI ile toksisite karşılaştırması yapıaln birçok çalışma ve derleme mevcuttur. Ancak, meme kanserli vücut yağ oranı ile toksisite ilişkisini inceleyen çalışma bulunmamaktadır.
Bu çalışmamızda adjuvan antrasiklin uygulanan meme kanseri hastalarında vücut yağ oranının toksisiteyi öngörmede vücut yüzey alanından daha güvenilir bir yöntem olup olmadığının incelenmesi hedeflenmiştir.
2. GENEL BİLGİLER
2.1. Meme Anatomisi ve Fizyolojisi 2.1.1. Meme Anatomisi
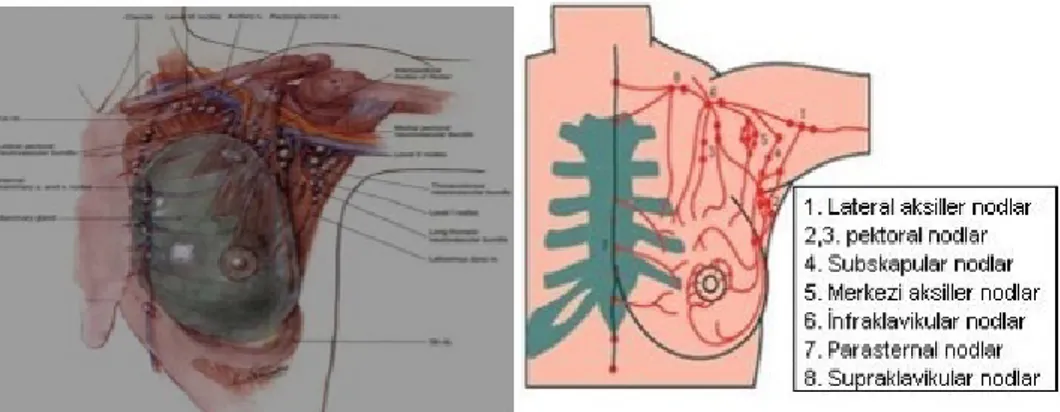
Şekil 1. Meme anatomisinin şematik gösterimi
Meme dokusu, toraksın önünde ve sternumun iki yanında yer alır. Sınırları kadından kadına değişebileceği gibi; aynı kadında gebelik, emzirme, şişmanlama, zayıflama ve yaşlılık nedeniyle farklılık gösterebilir. Genellikle kapladığı alan 2. kosta hizasından 6. kostaya, sternumun yan kenarından ön koltuk altı çizgisine uzanır. Bazı kadınlarda memenin üst dış bölümü pektoralis major kasın alt kenarı boyunca koltukaltına uzanır. Bu bölüm, memenin koltukaltı kuyruğu (Spence’s kuyruğu) olarak adlandırılır. Memenin hemen hemen orta bölümüne rastlayan kısmında meme başı ve areola bulunur (21). Meme dokusunun lenf sistemi: Meme kanserleri, metastazlarını genellikle lenf yolları ile yaptığından; meme lenf sistemi ayrıntılı olarak bilinmelidir (22).
Memenin lenfatik drenajı
Memenin lenfatik drenajı genellikle üç yoldan olur;
1. Aksiller yol: Meme üst ve alt yarısından gelen lenfi toplayan ikinci ve üçüncü interkostal boşluk hizasında yerleşmiş ana istasyondur (%75-97).
2. Mamaria interna yolu: Parasternal yerleşimli meme medialinin ve bir miktar lateralinin lenfatik akımını alan nodlardır (%3-25).
3. Transpektoral yol: Pektoralis majör kasını delerek supraklavikuler nodlara ulaşır (23,24).
Şekil 2. Memenin lenfatik drenajı
2.1.2. Meme Fizyolojisi
Meme dokusu, uterusu etkileyen iki ana hormonun (östrojen ve progesteron) kontrolü altındadır. Menstrüasyonu takip eden endometrial proliferatif fazda, meme stroması sellüler, yoğun ve ödemlidir. Lobüller yalındır ve salgılama yoktur. Endometrial sekresyon fazında, meme lobüllerinin hem büyüklüğü hem de sayısı artar. Epitelyal mitozlar ve ödem oluşur. Lümen içine salgılama başlar. Bu fazın geç devresinde aktif apokrin salgı olur. Menstruasyonun başlaması ile epitelyum dejenerasyonu ve döküntüsü ortaya çıkar. Mitozlar azalır veya durur, stroma yoğunlaşır. Menarşla başlayan bu değişiklikler aynı biçimde artarak ya da azalarak menopoza kadar devam eder (25). İlerleyen yaşla beraber meme, glandüler elemanlarını kaybetmeye başlar ve bunların yerini yağ dokusu alır. Menopozla beraber bu kayıp hızla artar ve atrofi, dejenerasyon ve hyalinizasyon sonucu meme
bezlerinde büyük kayıplar meydana gelir. Bu kayıpların yerini de yağ dokusu alır. Gebelikte ise hem östrojen hem de progesteron kanda yükselir. Bu hormonlar asinüslerin ve duktusların epitellerinde artışa yol açar ve meme büyümeye başlar. Kanda ayrıca prolaktin ve plasental laktojen de artmaya başladığından meme büyümesi daha da hızlanır. Süt salgılamasının olması için östrojen ve progesteron seviyesinin düşmesi, plasental laktojen ve prolaktinin yükselmesi gerekir. Ayrıca kortizol, tiroid hormonu, büyüme hormonu ve insülin de süt oluşumunda önemli rol oynar
2.2. Meme Kanseri
Meme kanseri dünyada kadınlar arasında en sık görülen malign tümör olup, kadınlarda görülen tüm kanserlerin yaklaşık %30`unu oluşturmaktadır.Dünyada yılda 1.38 milyon,Amerika Birleşik Devletleri’nde (A.B.D) yılda 226 bin yeni olgu saptanmaktadır (26,27,28). Yaşla birlikte meme kanseri insidansı artmaktadır ve gelişiminde genetik, çevresel, hormonal, sosyobiyolojik ve fizyolojik faktörler suçlanmaktadır. Meme kanseri gelişiminde çeşitli faktörlerin etken olduğunun bilinmesine rağmen, olguların %70-80’inde hiç bir risk faktörü saptanamamaktadır. Meme kanseri memedeki duktus ya da lobüllerde sıralanan epitelyal hücrelerden köken alan malign bir proliferasyondur. Meme kanseri insidansı yavaşça artmaya devam etse de, mortalite hızı son yirmi yılda düşme eğilimi göstermektedir (29). Bu düşüş, büyük ihtimalle mamografik taramaların artması, daha iyi cerrahi ve radyoterapi, daha iyi sistemik adjuvan kemoterapi gibi birçok faktörün etkisi sonucunda ortaya çıkmaktadır. Meme kanseri patolojik özelliklerine göre sınıflandırıldığında, %85 duktal karsinoma, %5-10 lobular karsinoma, %5-7 meduller karsinoma, %3 musinoz veya kolloid karsinoma,%2 tubuler karsinoma olacak şekilde ayrılmaktadır. İlk başvuru anında hastaların %3-6'sı zaten metastatik hastalığa sahiptir ve geri kalan hastaların %50- 70'i hastalığın seyri boyunca sistemik relaps göstereceklerdir. Relapsların %75'i ilk 5 yıl içinde olsa da, 30 yılla kadar relapslar görülebilir (30). Meme kanseri en sık kemik, karaciğer ve akciğerlere metastaz yapmaktadır (31).
İnsidans
Meme kanseri, kadınlarda en sık görülen kanserdir. Geçen 40 yıl boyunca meme kanseri sıklığı özellikle gelişmiş ve gelişmekte olan ülkelerde sürekli şekilde artmaktadır. Amerika Birleşik Devletleri’nde kadınlardaki bütün kanserlerin % 29'unu meme kanseri oluşturmaktadır (26). Amerikan Kanser Birliği, 2012 yılında Amerika Birleşik Devletleri'nde 226870 yeni meme kanserli hasta ve 39510 meme kanserinden ölüm olacağını hesaplamaktadır (26,27,32). Türkiye’de ortanca yaş 53 olup %40’ı premenapozal dönemdedir. Türkiye’de genç meme kanserlerinin oranı daha yüksektir. Meme kanserindeki artış, tarama yöntemlerinin daha sık ve düzenli kullanılmasına bağlı tanı oranındaki artışa ve toplumların ortalama yaşam sürelerinin uzamasıyla hastalığın ileri yaş grubunda daha sık görülmesi ile açıklanmaktadır (27).
Dünyadaki Trend
Dünyada meme kanseri insidansı bölgelere göre farklılık göstermektedir.Bu durum, beslenme alışkanlıkları ile birlikte endüstrileşmiş modern yaşamda kadınların mensturasyonun daha erken yaşta başlaması, daha ileri doğum yaşı, oral kontraseptif ve hormon replasman tedavisi, menapoz yaşının gecikmesi, uzamış yaşam beklentisi gibi değişikliklerin etkisinde kalmasına bağlanmaktadır (28,33).
Mortalite
Meme kanserine bağlı mortalite Amerika Birleşik Devletleri'nde 1950 ile 1989 yılları arasında aynı oranda kalmıştır. Meme kanserinden ölüm oranı 1990 ile 1999 yılları arasında belirgin şekilde azalmıştır. Bu azalma, erken tanı oranında artma ve tedavilerdeki gelişmelere bağlanmaktadır. Amerika Birleşik Devletleri'nde meme kanseri, akciğer kanserinden sonra kadınlarda kanser ölümlerinden sorumlu ikinci hastalık olmasına rağmen, 5 yıllık sağ kalım oranı beyaz kadınlarda % 63’den %89'a, siyah kadınlarda %46'dan %79’a yükselmiştir (16). Ölüm oranları Afrika kökenli Amerikalılarda hala yüksektir. Bu fark hem tanıda hemde tedavide sağlık hizmetlerine erişimin farklı olmasına bağlanmaktadır (34).
Meme kanserinin gelişiminde genetik, hormonal, sosyobiyolojik ve psikolojik etkenlerin rol aldığı kabul edilmekle birlikte; meme kanserli kadınların %70–80’inde bu risk faktörleri saptanmamaktadır. Hayvanlarda ise bazı kimyasal maddeler, iyonizan radyasyon ve virüsler kanser oluşumuna neden olurlar. Tüm bu ajanların mutasyonlara neden olabileceği ve kromozomal mutasyonların da insanda kanser ortaya çıkış ve gelişimi ile yakından ilişkili olduğu gösterilmiştir. Meme kanserinin risk faktörleri kişiye bağlı ve çevresel faktörler şeklinde gruplandırılabilir. Kişiye bağlı faktörler; yaş ve cinsiyet, ırk, kullanılan ilaç geçmişi, hormonal durum, yaşam şekli, aile öyküsü, genetik yatkınlık, ailesel sendromlar olarak belirtilir (35).
Yaş ve Cinsiyet
Meme kanserinin sıklığı, yaşın artması ile artmaktadır. Bütün meme kanserli hastaların %75'ine postmenopozal dönemde tanı konmaktadır. Cinsiyet açısından bakıldığında kandın/erkek oranı 100/1 olduğu görülmektedir.
Irk
Batı ülkeleri ile Japonya, Tayland ve Hindistan arasında 5 kat sıklık farklılığı olduğu bilinmektedir.
Hormonal Durum
Erken menarş yaşı, geç menopoz, nulliparite, ilk gebelik yaşının ileri olması (gebeliğin > 30 yaşta olması), obezite ve hormon replasman tedavisi meme kanserini arttıran kişisel faktörlerdendir. Oral kontraseptifler meme kanserin gelişme riskini küçük oranda (1.24 kat) artırmaktadır. Oral kontraseptif kullanımının bırakılması ile bu risk azalmakta ve 10 yıl sonra ortadan kalkmaktadır (36). Menopoz sonrası hormon replasmanı meme kanseri riskini artırmaktadır. Bu risk östrojen ve progesteronun birlikte kullanımı ile daha da artmaktadır. Bu risk ilaçların bırakılmasıyla azalmakta ama azda olsa devam etmektedir (37).
Yaşam Şekli
riski arttırır. Tüm dünyada meme kanseri vakalarının %25’inin aşırı kilo, obezite ve sedanter hayat tarzına bağlı olduğu düşünülmektedir.
Aile Öyküsü
Birinci derece akrabada bilinen meme kanseri olması riski 2–3 kat arttırmaktadır. Birinci dereceden akraba iki kişide meme kanseri varsa risk 4–6 kat artmıştır. Bu kişilerden biri 50 yaşından genç veya bilateral meme kanserine sahipse yaşam boyu risk %50’ye ulaşabilmektedir (38).
Radyasyon
Otuz yaşından önce iyonizan radyasyona maruz kalmak meme kanseri riskini artırmaktadır. Kırk yaşından sonra iyonizan radyasyona maruz kalanlarda meme kanseri riskinde artma gözlenmemiştir. Bu nedenle 30 yaşın üzerindeki kadınlarda mamografi meme kanseri riskini artırmamaktadır. Atom bombasına maruz kalmış kadınlarda meme kanseri riski 3 kat artmıştır. Lenfoma nedeniyle radyoterapi alan kadınlarda da özellikle 10. yıldan sonra meme kanseri sıklığı artmaktadır (38). Amerika Birleşik Devletleri’nde meme kanseri olgularının yaklaşık %1'inin tanı amaçlı mammografiye bağlı geliştiği düşünülmektedir (39).
Premalign Lezyonlar
Benign meme lezyonları proliferatif ve non-proliferatif lezyonlar olarak ikiye ayrılır. Non-proliferatif lezyonlar genellikle meme kanseri riskinde artışa sebep olmazlar. Proliferatif lezyonlardan atipi içerenlerde meme kanseri riski 4-5 kat, atipi içermeyenlerde ise bu risk 2 kat artmıştır. Özellikle proliferatif, atipi içeren lezyonu olan ve birinci derece akrabada meme kanseri öyküsü olan kadınlarda bu risk 11 kat artmıştır (40).
Genetik Yatkınlık
Meme kanserlerinin %5-10'u kalıtımsaldır. BRCA 1 (kromozom 17q21) ve BRCA 2 (kromozom 13q12.3) mutasyonları taşıyıcısı olmak genç yaşta meme kanseri için yüksek riskle ilişkilidir. Bu genler, tümör supressör genlerdir ve DNA hasarının onarılması ile ilişkili rolleri vardır (38).
Ailesel Sendromlar
Meme kanseri riskinin arttığı bu sendromlar arasında; Ataxi Telengiectasia (11q22.3), Li Fraumeni Sendromu, PTEN Hamartom tümör sendromu (10q23.3), Cowden Sendromu, Banaya-Riley-Ruvalcaba Sendromu, Proteus Sendromu sayılabilir. Çevresel faktörler arasında ise geçmiş radyasyon maruziyeti önemlidir. Artmış meme kanseri riski ile ilişkilidir ancak latent periyodu 15- 20 yıldır.
Kanser Öyküsü
Daha önce meme kanseri geçiren ve tedavi olan kadınların, diğer memelerinde kanser gelişme olasılığının meme kanseri teşhisi konulmamış kadınlara göre 3-4 kat daha fazla olduğu ifade edilmektedir. Kendisinde daha önce endometrium ya da over kanseri olan hastalarda meme kanseri riski 2 kat artmıştır (38).
Alkol
Alkol tüketimi meme kanseri riskini artırmaktadır. Alkolün meme kanseri üzerine etkisi diyetle düşük folat alımı ile ilişkili olabilir. Diyette bulunan folat alkolün olumsuz etkisini azaltabilir (41).
Tablo 1. Meme kanserinin risk faktörleri 4 Kat Rölatif Risk
-İleri yaş
- Kuzey Avrupa ya da Kuzey Amerika‟da doğmuş olma - Yüksek Premenopozal kan IGF-1 düzeyi
- Yüksek Postmenopozal kan östrojen düzeyi - Anne veya Kız kardeşte meme kanseri öyküsü 2-4 Kat Rölatif Risk
- Yüksek sosyoekonomik durum
-İlk doğumunun 30 yaşın üzerindeyken olması - Bir memede kanser öyküsü olması
- Herhangi birinci derece akrabada meme kanseri öyküsü olması
- Memede benign proliferatif hastalık olması, mamografide displastik değişiklikler görülme si,ya da toraks ve mediasten bölgesine yüksek doz iyonize radyasyon öyküsü 1,1-1,9 Kat Rölatif Risk
-Nulliparite
-Erken Menarş (<11 yaş) -Geç Menopoz (>55 yaş) -Postmenopozal Obezite -Yüksek doymuş yağ diyeti
-şehirde ve kuzey Amerika‟da ikamet etme -45 yaş üstü beyaz ırk
-45 yaş altı siyah ırk
-Endometriyum/ over kanseri öyküsü Koruyucu Faktörler
-Fiziksel Aktivite
-Monoansature yağ tüketimi: Özellikle zeytin yağı tüketiminin fazla olduğu ülkeler -Ġlk adetini 15 yaşından sonra görme
-Asya Irk‟ı
-37 yaşından önce cerrahi kastrasyon
-Erken menopoz
2.2.3. Meme Kanserinde Klinik Bulgular
Literatürde meme kanserinin belirtileri ile ilgili bilgiler incelendiğinde, memede bir kitlenin varlığının, memenin portakal kabuğu şeklinde bir görüntü
almasının, meme derisinde ülser, kızarıklık ve ödem meydana gelmesinin, doğumsal nedenlere bağlı olmaksızın meme basının içe çekilmesinin, meme basından kanlı ya da kansız akıntı gelmesinin, memede ağrı olmasının, lenf bezlerinde şişlik olmasının ve kolda şişlik ve ödem oluşmasının önemli olduğu görülmektedir (42,43).
Meme kanseri yayılımını kan ve lenf yolu ile yapar. En sık metastaz yaptığı organlar; kemik (%71), akciğer (%69), karaciğer (%65), plevra (%51), adrenal bezler (%49), deri (%30), beyin (%20) dir (42,43). Metastatik tümörlerde yayıldığı organa özel belirtiler de klinik tabloya eklenir.
Kitle
Meme kanserli kadınların %70 kadarında ilk bulgu memede bir kitlenin varlığıdır. Hastaların % 33’ü memede palpe ettikleri kitle nedeniyle başvururlar. Kanser nedeni ile oluşan kitlelerin büyük çoğunluğu (% 49) üst-dış kadrandadır. Bunu % 17 ile santral kadran takip eder, üst-iç kadranda % 16, alt dış kadranda % 12, alt-iç kadranda % 6’dır (44). Kitle çoğu kez ağrısızdır ve kadın tarafından rastlantı sonucu bulunur.
Meme başında ve cildinde çekinti
Tümör Cooper bağlarını infiltre etmiş ise deri retraksiyonuna yol açar.Tümör lenf akımını yavaşlattığında ise meme derisinde portakal kabuğu görünümünü kazandırır.
Meme başından akıntı
Meme kanserli kadınların yaklaşık % 10’unda ilk bulgu meme başında akıntı olmasıdır (45).Akıntının tek taraflı olması, kendiliğinden gelmesi, seröz ve/veya kanlı olması meme kanseri açısından daha anlamlıdır.
Meme başı ve areolada ekzamatöz lezyon
Meme kanserli hastaların % 2‘si ise meme başı ve areolada ekzematiform bir lezyon ve erozyon, ileri dönemde ülserasyon bulguları ile klinik gösterir (46).
Meme cildinde kızarıklık ve ödem
Hastaların % 2-4’ü memede inflamasyon bulguları olan kızarıklık, kalınlaşma, ısı artışı, hassasiyet ile başvurlar. Bu hastalarda inflamatuvar meme kanseri düşünülmelidir (47).
Memede ağrı
Meme ağrısı oldukça sık görülen bir yakınmadır.Ancak meme kanserli hastalarda özellikle ilk dönemlerde ağrı yakınması yoktur (48).
2.2.4. Meme Kanseri Tanısı
Anamnez: Yaş, ailenin sağlık öyküsü, menarj yaşı ve düzeni,menopoz yaşı doğum yaşı, meme ile ilgili geçirdiği hastalıklar v.b. anemnezde alınır.
Fizik muayene: İnspeksiyon ile memelerin büyüklüğü, simetrisi, üzerinin ve kenarlarının görünümü, deride renk değişikliği, retraksiyon, ödem, ülserasyon ve meme baslarına bakılır. Palpasyon ile hasta önce oturur sonra yatar duruma getirilerek muayene yapılır. Aksiller ve subraklavikular lenf nodlar muayene edilir.
Mamografi: Klinik olarak şüphe edilen,fakat küçüklüğü nedeni ile palpe edilemeyen kitleleri ortaya koyar,biyopsi alanını belirler, aksiller bölgeye metastaz yapmış ancak memedeki yeri ortaya konulamayan primer lezyonu bulmaya yarar.
Sitoloji: Meme basından gelen akıntıdan habis hücre aranmasıdır.
Ultrasonografi: Memenin kistik lezyonlarının ortaya konmasına yardımcıdır.
MRI: USG yetersiz kalırsa lezyon lokalizasyonu için meme manyetik rezonans görüntüleme (MRI) yöntemi kullanılabilir.
Biyopsi:Memede muayene veya görüntüleme yöntemleri ile saptanan şüpheli bir lezyondan tanı için biyopsi yapılmalıdır.Biyopsi palpabl lezyonlarda ince iğne aspirasyon biyopsisi (İİAB) veya eksizyonel biyopsi ile yapılabilir.Palpabl olmayan lezyonlarda ultrasound (USG) eşliğinde İİAB, biyopsi veya eksizyonel biyopsi yöntemleri ile tanıya ulaşılabilir.Bunun dışında memede saptanan mikrokalsifikasyonlarda,stereotaktik biyopsi veya lezyonun radyolojik tespiti sonrası eksizyonel biyopsi yöntemleri uygulanabilir (49).
2.2.5 Meme Kanserinin Sınıflandırılması Tümörün Histopatolojik Sınıflandırılması
Meme kanseri patolojisi prognoz ve tedaviyi belirlemede büyük önem taşır. İnvaziv tümörlerin yaklaşık %80’ini invaziv duktal karsinom (İDK), %5-14’ünü invaziv lobuler karsinom (İLK) oluşturur. Meduller, tubuler, musinöz kanser gibi daha iyi prognoza sahip daha nadir rastlanan tümör grupları da mevcuttur. Meme tarama ve tanı metodlarının artmasıyla non-invaziv (in-situ) kanserlerin sıklığında artış saptanmıştır (50).
Memenin malign tümörleri 1) Karsinom
a) Non invaziv
i) Lobüler karsinoma in situ (LCIS): Mikroskopik bir lezyon olduğu için palpabl tümör oluşturmaz, insidansı tam olarak bilinmemektedir. Tüm meme karsinomlarının %1-6’sını, non-invaziv karsinomların ise %30-50’sini oluşturur. Olguların %30-40’ında bilateral, %70’inde multisentriktir. Genellikle premenopozal kadınlarda başka nedenlerle yapılan biyopsilerde insidental olarak ortaya çıkar. ER ve PR pozitif, c-erbB-2 negatif bulunur. Sadece biyopsi ile tedavi edilen olgularda 15 -20 yıl içerisinde yaklaşık %20-30 oranında karsinom gelişir (51).
ii) Duktal karsinoma in situ (DCIS): Heterojen bir lezyon grubunu ifade etmektedir. Bunların ortak özelliği malign karakterdeki hücrelerin ön planda duktuslar olmak üzere, membranla çevrili boşluklar içerisinde sınırlı proliferasyonudur. Bazal membran invazyonu yapmamış intraduktal karsinomlardır.
Daha çok postmenopozal kadınlarda görülürler ve tarama mamografilerin yaygınlaşmasıyla bugün meme malign hastalıklarının %30’unu teşkil etmektedir (52). Tedavi edilmediklerinde 10 yıllık izlemde DCIS tespit edilen bölgede %30-50 oranında invaziv duktal karsinom gelişir. Aksilla metastaz oranları %1-2 kadardır ve basit mastektomi ile %99 kür sağlansa da güncel yaklaşım, meme koruyucu cerrahi sonrası radyoterapi minimal rekürrens riski ve kozmetik sonuç nedeniyle önerilmektedir(52).
b) İnvaziv
i) İnvaziv duktal karsinom: Memenin en sık görülen, ancak invaziv karsinomların diğer hiçbir kategorisine uymayan malign tümörüdür. Meme karsinomlarının %47-75’ini oluşturan tipidir. Nekroz nadir görülür. İn situ komponentle birlikteliği sıktır. Olguların yaklaşık %60’ında kalsifikasyon mevcuttur. Prognoz için önemli olan patolojik özellikleri, tümör boyutu, aksiller lenf nodu tutulumu, grad ve lenfatik- vasküler invazyondur. Makroskopik olarak olguların çoğu sert kıvamlı ve düzensizdir. Özellikle büyük boyutlu tümörlerde nekroz, kanama ve kistik dejenerasyon görülebilir. Bu tümörlerin mikroskopik özellikleri oldukça değişkenlik göstermektedir. Bu tür invaziv duktal karsinomlar tipik olarak östrojen ve progesteron reseptörü pozitif olup HER-2/neu (cerbB-2) overekspresyonu göstermezler.
ii) İnvaziv lobüler karsinom: Multifokalite, multisentrisite ve bilateralite sıklığı invaziv duktal karsinoma göre daha yüksektir. Sitolojik özelliklerine göre ve infiltrasyon paterni farklı olan alt tipleri vardır. Bunlar klasik, alveolar, solid, pleomorfik ve mikst tiplerdir.
c) Özel histolojik tipler
i) Meduller karsinom: Tüm meme karsinomlarının %5-7’sini oluşturur. Makroskopik olarak iyi sınırlı, yumuşak kıvamlı, kesit yüzeyi homojen ve gri renkte tümörlerdir. Nekroz ve kanama sıktır.
ii) Papiller Karsinom iii) Müsinöz Karsinom
iv) Tübüler Karsinom
v) Adenoid Kistik Karsinom. vi) Sekretuvar Karsinom vii) Metaplastik Karsinom
d) Meme başının paget karsinomu: Meme başında kısmen krutlu, egzamatoid lezyon şeklinde görülür. Tedavi ve prognoz tümörün invaziv olup olmadığına, boyutuna ve lenf ganglionların durumuna bağlıdır.
2) Sarkom
3) Karsinosarkom
4) Sınıflandırılamayan tümörler
Tablo 2. Meme tümörlerinin histopatolojik sınıflaması (6,37)
1. İntraduktal papillom
A. Benign 2. Memebaşı adenomu
3. Adenom a. Tübüler
b. Laktasyon
1. Non invaziv a.İntraduktal (insitu duktal) karsinom b. İnsitu lobüler karsinom
a. İnvaziv duktal karsinom
b. İntraduktal komponenti baskın invaziv duktal karsinom
I.Epitelyal
Tümörler d. Müsinöz karsinomc. İnvaziv lobüler karsinom
e. Medüller karsinom
B. Malign 2. İnvaziv f. Papiller karsinom
g. Tübüler karsinom h. Adenoid kistik karsinom i. Sekretuar (Juvenil) karsinom j. Apokrin karsinom
k. Metaplastik karsinom l. Diğerleri
3.Meme Başının Paget karsinomu II. Mikst konnektif doku ve epitelyal tümörler a. Fibroadenom
b. Filloides tümör (Sistosarkoma filloides) c.Karsinosarkom
III. Çeşitli tümörler
a. Yumuşak doku tümörleri b. Deri tümörleri
c. Hematopoietik ve lenfoid dokuların tümörleri
IV. Sınıflandırılamayan tümörler V. Meme displazisi/fibrokistik hastalık
VI. Tümöre benzer lezyonlar a. Duktal ektazi b. İnflamatuar psödotümör c. Hamartom
Tümörün moleküler ve immunohistokimyasal sınıflandırılması Östrojen, Progesteron Reseptörleri ve c-erb B2:
Östrojen reseptörü negatif olan tümörler, kötü diferansiye ve yüksek proliferasyon hızına sahiptirler ve hormonal tedaviye cevap vermezler.Yapılan çalışmalarda Östrojen Reseptörü (ER) (+) hastalarda ER (-) olanlara göre daha uzun bir hastalıksız sağkalım süresi olduğu gözlenmiştir. Nod negatif hastalarda progesteron reseptör (PR) durumunun belirleyiciliği net değildir. ER pozitifliği hastalıksız sağkalım için bir belirteç olarak görülmektedir.
Yapısal olarak Epidermal Büyüme Faktör (EGF) reseptörüne benzerlik gösteren cerbB2,tirozin kinaz aktivitesi gösterir.Yapılmış olan çalışmalar neu onkogeninin hücre proliferasyon ve diferansiasyonunun önemli bir medyatörü olduğunu göstermiştir. Bu gen 17. kromozomda lokalizedir. c-erb B2 pozitifliği yüksek histolojik derece, ER ve PR negatif, lenf nodu pozitif ve yüksek proliferasyon oranı gösteren meme kanserlerinde karşımıza çıkmaktadır.Genel olarak sağkalımda bir azalma ile c-erb-B2 pozitifliği arasında bir ilişki mevcuttur.c-erb-B2'nin amplifikasyonu ya da ekspresyonunun agresif meme kanserlerinde daha sık görüldüğü belirtilmiştir (53). Ayrıca konservatif tedaviden sonra gelişen lokal nüks ile c-erb-B2 ilişkisi araştırılmış, lokal nüks oranının c-erb-B2 pozitif tümörlerde negatiflere oranla anlamlı derecede yüksek olduğu bulunmuştur (54). C-erb-B2 ekspresyonun lokal nüks, hastalıksız sağkalım, aksiller lenf nodu tutulumu ile ilişkili olduğu ve meme kanserlerinde negatif bağımsız prognostik faktör olabileceğini belirten çalışmalar vardır.
Bazal/miyoepitel hücreler heterojen özellik gösterirler.Cytokeratin (CK)5/6, CK14, CK17, düz kas aktini, S-100 pozitiftirler. CK5/6 ve CK14 gibi yüksek moleküler ağırlıklı sitokeratinler, bazal tabaka hücrelerinde saptandığı için bazal sitokeratinler olarak bilinmektedirler (55,56). Bu nedenle meme kanserinin bu grubu bazal/miyoepitelyal fenotip gösteren grup olarak adlandırılır.Bu alt grubun diğer özelliği hormon reseptör negatif ve HER–2 negatif olmasıdır.Ayrıca CK5/6 pozitif tümörlerin hormon reseptör ve HER–2 pozitif tümörlerden farklı bir grup
olduğunu gösterilmiştir. Bu grubun p53, EGFR–1 ve yüksek proliferatif indeks eksprese ettikleri saptanmıştır (57). Yapılan bazı çalışmalarda CK5/6 ve CK17'nin pozitifliğinin nod negatiflerde tümör boyutu, grad ve ÖR ve HER-2'den bağımsız prediktif faktör olduğu iddia edilmektedir (58,59). Bu tümörler, daha genç hastalarda görülmekte ve daha saldırgan seyretmektedir (60). Yapılan çalışmalarda EGFR–1 pozitiflik oranı %50–70 oranında bulunmuştur (61,62). Meme kanseriyle ilgilenen konsorsiyum tarafından bazaloid özelliğin BRCA–1 mutasyonu ile ilişkili olabileceği bildirilmekte olup,seçilmiş vakalarda BRCA-1 testinin yapılması önerilmektedir. BRCA–1 germline mutasyonu ile bazal tip meme kanserinin benzer profil gösterdiği saptanmıştır.Genç yaşta görülen bazaloid/medüller morfolojik ve immunfenotipik özellik,ailesel yatkınlık olabileceği yönünde uyarıcı olmalıdır (63,64).
Moleküler ve İmmunohistokimyasal Sınıflama
Çalışmalarda bu sınıflama 5 kategoride incelenmektedir;
I-Luminal A (hormon reseptör pozitif ve HER–2 negatif): Luminal hücre benzeri grubunun hepsi ER pozitiftir. Luminal A grubu en fazla ER ekspresyonu gösteren tümörlerdir. En sık görülen ve rekürrens oranının düşük olduğu gruptur.
II-Luminal B (hormon reseptör pozitif ve HER–2 pozitif): Luminal B grubu tümörler luminal gruba özgü genleri orta düzeyde eksprese eder ve bazıları HER2 pozitiftir, p53 gen mutasyon sıklığı luminal A grubunda luminal B grubundan daha sıktır. Rekürrens oranı luminal A grubuna göre daha yüksektir, hormonoterapi + kemoterapiden fayda görür.
III-HER–2 pozitif: ER ve PR negatif yüksek grade’ li tümör morfolojisine sahiptir. Yüksek oranda p53 mutasyonu gösterir, daha sık aksiler lenf nodu metastazı izlenir.
IV- Basal-like/bazal/bazaloid (hormon reseptör negatif ve HER–2 negatif, CK5/6 ve/veya EGFR–1 pozitifliği):Bazal hücre benzeri grubun %95’i ER negatiftir ve %91’i yüksek grade’dir (65).
V-Null tip veya sınıflandırılamayanlar: Yapılan çalışmalarda bu grupların prognozunun farklı olduğu gösterilmiştir. Bazaloid ve HER–2 pozitif grubun en kısa hastalıksız ve genel sağkalıma sahip olduğu,luminal özellik taşıyan tümörlerin ise daha iyi prognoza sahip olduğu bildirilmiştir (66).
2.2.6. Meme Kanserinde Evreleme
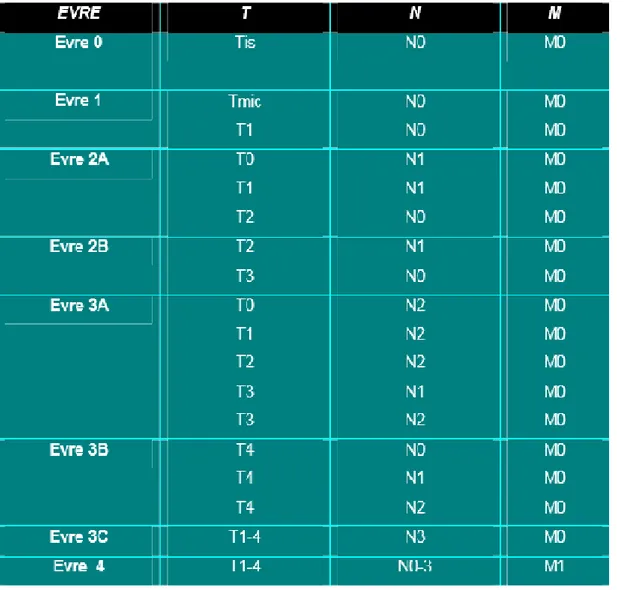
Evreleme sisteminde tümörleri sınıflamak için kullanılan kriterler, tümör boyutu (T), aksiller lenf nodlarına (N) ve uzak bölgelere yayılımdır (M). Tümör evresi meme kanserli hastalarda tedaviye yön veren önemli bir prognostik faktördür. Meme kanseri evreleme sistemi son olarak 2010 yılında güncellenmiştir (67). Bu basımdaki major değişiklik, neoadjuvan tedavi sonrası yeni sınıflama sisitemini içermesi ve metastatik hastalar için dolaşımdaki tümör hücrelerinin saptanması ile ortaya çıkan M0(i+) alt grubudur. Bu kategorideki hastalar T ve N durumuna göre evrelenir ve evre IV olarak kabul edilmezler.
Tablo 3. Primer tümör (T) TX Primer tümör saptanamamaktadır T0 Primer tümör yok Tis:Karsinoma insütu Tis: DCIS Tis: LCIS Tis: PageT
T1 Tümörün en büyük boyutu 2 cm veya daha az
T1mic: En büyük boyutu 1 mm veya daha az olan mikroinvazyon
T1a: En büyük boyutu 0.1 cm'den büyük olan ancak 0.5 cm'yi geçmeyen tümör
T1b:En büyük boyutu 0.5 cm'den büyük olan ancak 1 cm'yi geçmeyen tümör T1c: En büyük boyutu 1 cm'den büyük olan ancak 2 cm'yi geçmeyen tümör
T2 En büyük boyutu 2 cm'den büyük olan ancak 5 cm'yi geçmeyen tümör
T3 En büyük boyutu 5 cm'den büyük olan tumor
T4 Herhangi bir boyutta ancak (a) göğüs duvarına veya (b) cilde direkt yayılım T4a: Pektoral kasa ulaşmamış göğüs duvarı yayılımı
T4b: Meme cildinde ödem veya ülserasyon veya aynı memede satellit deri nodülleri
T4d: İnflamatuar karsinom
Tablo 4. Bölgesel lenf nodülleri (N) klinik sınıflandırma NX Bölgesel lenf nodları saptanamamaktadır NO Bölgesel lenf nodu metastazı yok
N1 İpsilateral level I, II aksiler lenf nodlarına metastaz (fikse değil)
N2 Fikse veya gruplaşmış ipsilateral level I, II aksiller lenf nodlarında metastaz veya klinik olarak belirgin aksiller lenf nodu metastazı olmadığı durumlarda, klinik olarak belirgin ipsilateral internal mammaryal lenf nodlarında metastaz
N3 Aksiller lenf nodu tutulumu olsun ya da olmasın ipsilateral infraklavikular lenf nodları metastazı veya klinik olarak belirgin ipsilateral internal mammaryal lenf nodları metastazı ile birlikte klinik olarak belirgin aksiller lenf nodu metastazı; veya aksiler ya da internal mammaryal lenf nodu metastazı olsun ya da olmasın ipsilateral supraklavikular lenf nodlarında metastaz
Tablo 5. Patolojik sınıflama (pN)
pNX Bölgesel lenf nodları saptanamamakta
pN0 Histolojik olarak bölgesel lenf nodu metastazı yok, izole tümör hücreleri için ek inceleme yok
pN1 1–3 arası aksiller lenf nodlarında ve/veya internal mammaryal nodlarda sentinel lenf nodu diseksiyonu ile saptanan mikroskobik hastalıkla birlikte metastaz
pN2 4–9 aksiller lenf nodunda metastaz veya aksiller lenf nodu metastazı olmadığında internal mammaryal lenf nodlarında klinik olarak belirgin metastaz
pN3 10 veya daha fazla aksiller lenf nodunda veya infraklavikular lenf nodlarında veya bir ya da daha fazla aksiller lenf nodu pozitif olduğunda klinik olarak belirgin ipsilateral internal mammaryal lenf nodlarında metastaz veya internal mammaryal lenf nodlarda klinik olarak negatif mikroskobik metastaz ile birlikte 3'ten daha fazla aksiller lenf nodunda metastaz veya ipsilateral supraklavikular lenf nodlarında metastaz
Tablo 6. Uzak metastaz (M)
MX Uzak metastaz bulunamıyor cM0(i+)
Klinik ve radyolojik olarak uzak organ metastazının olmadığı, fakat moleküler veya mikroskopik olarak kan, kemik iliği ve diğer non-rejyonel lenf nodlarında 0,2 mm den büyük olmayan tümör hücrelerinin tespit edilmesi
M1 Klinik ve radyolojik olarak tesbit edilmiş uzak metastaz ve-veya histopatolojik olarak kanıtlanmış 0.2 mm’den büyük metastaz
2.2.7. Meme Kanserinde Prognostik Ve Prediktif Faktörler
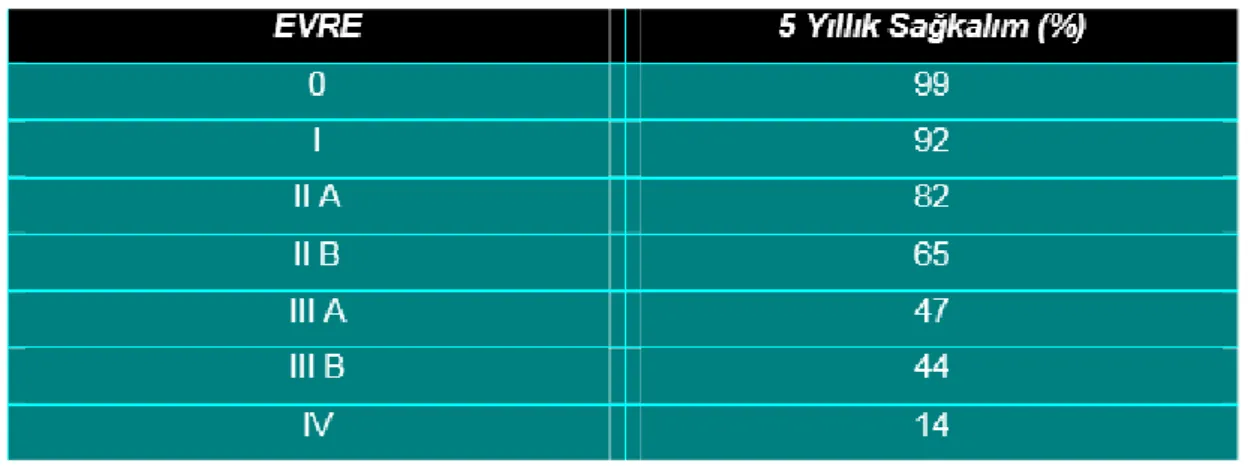
Prognostik faktörler meme kanseri tanısında ya da cerrahisi sırasında tespit edilen parametreler olup hastanın ve hastalığın geleceği ile ilgili bilgiler verir. Bu gibi prognostik faktörler, büyüme, invazyon ve metastatik potansiyelin göstergesidir. Prediktif faktörler ise, tümörün verilen tedaviye yanıt verip vermeme olasılığı hakkında bilgi vermektedir. Adjuvan kemoterapinin yaygın olarak kullanılması, meme kanseri mortalitesini azaltmıştır. Bununla beraber, bu tedaviyi alan çoğu hasta, tedavinin faydasından çok, gereksiz toksisitesine maruz kalmaktadır. Bu nedenle, adjuvan sistemik tedaviden fayda görecek hastaların seçimi ve gereksiz toksisite ve maliyetten kaçınmak için, güvenilir prognostik faktörlerin kullanılması büyük önem taşımaktadır. Prognozun belirlenmesinde rutin patolojik değerlendirme esastır(68). Klasik prognostik faktörler; evre, aksiller lenf nodu durumu, tümör boyutu, tümörün histolojik tipi, histolojik grade, nükleer grade, lenfovasküler invazyon, deri ve meme başı invazyonudur. Yaş ise bağımsız prognostik parametredir. Genç hastalar yaşlılara göre kötü prognoza sahiptirler, en kötü prognoz 30 yaş altı hastalarda gözlenmektedir. Prognozun kötü seyretme riski, 45-50 yaşa göre 30 yaş altında iki kat artmıştır (69). En önemli prognostik değişken, tümörün evresidir
Tablo 8. Meme kanserinde evreye göre 5 yıllık sağkalım oranları.
Prognostik faktörler: Meme kanseri tanısında tespit edilen parametreler olup hastalıksız sağkalım ve genel sağkalım ile ilişkili her türlü parametre prognostik faktör olarak adlandırılır.Prognostik faktörler bir tümörün doğal seyrini önceden belirlemek için kullanılır.
Prediktif faktörler:Tümör tedavisinde yanıtı veya yanıtsızlığı belirleyen faktörlerdir (70).
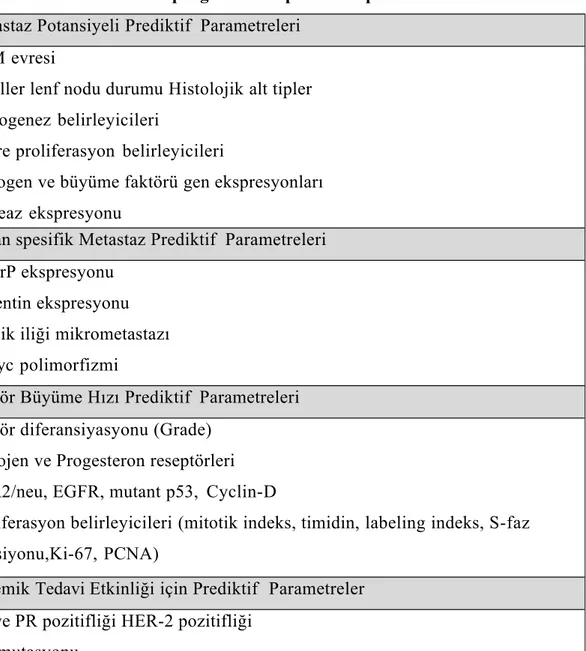
Tablo 9. Meme kanserinde prognostik ve prediktif parametreler Metastaz Potansiyeli Prediktif Parametreleri
TNM evresi
Aksiller lenf nodu durumu Histolojik alt tipler Anyogenez belirleyicileri
Hücre proliferasyon belirleyicileri
Onkogen ve büyüme faktörü gen ekspresyonları Proteaz ekspresyonu
Organ spesifik Metastaz Prediktif Parametreleri PTHrP ekspresyonu
Vimentin ekspresyonu Kemik iliği mikrometastazı L-myc polimorfizmi
Tümör Büyüme Hızı Prediktif Parametreleri Tümör diferansiyasyonu (Grade)
Östrojen ve Progesteron reseptörleri HER2/neu, EGFR, mutant p53, Cyclin-D
Proliferasyon belirleyicileri (mitotik indeks, timidin, labeling indeks, S-faz fraksiyonu,Ki-67, PCNA)
Sistemik Tedavi Etkinliği için Prediktif Parametreler ER ve PR pozitifliği HER-2 pozitifliği
p53 mutasyonu BCL-2 ekspresyonu
pgp ekspresyonu (P Glikoprotein)
Aksiller Nod Tutulumu
Meme kanserinde evreyi ve dolayısıyla prognozu belirleyen en önemli faktör aksiller lenf nodu tutulumu ve metastatik lenf nodu sayısıdır. Tümör boyutu 1
cm’den küçük ve aksiller lenf nodu tutulumu olmayan hastalarda, adjuvan kemoterapiye nadiren ihtiyaç duyulur (71,72). Aksiller lenf nodu metastazı olmayan hastalarda, 10 yıllık hastalıksız yaşam % 70-80, aksiller lenf nodu metastazı varlığında yaklaşık % 30 saptanmıştır. Tutulan lenf nodu sayısı arttıkça sistemik metastaz riski daha fazla artar ve prognoz daha kötüdür. Metastatik lenf nodu sayısı kadar, metastatik lezyonun çapı, lenf nodu çevresi yumuşak dokuya yayılım da prognozu olumsuz yönde etkileyen faktörlerdir (72-74).
Tümör Büyüklüğü
Tümör boyutu; lenf nodu tutulumu ve hastalığın prognozuyla yakından ilişkilidir. Tüm nodal tutulum kategorilerinde tümör çapı büyüdükçe yaşam süresi kısalmaktadır. Tümör çapının 2 cm ya da daha küçük olduğu olgularda prognoz belirgin olarak daha iyidir (74).
Tablo 10. Tümör çapı ile aksiller lenf nodu tutulumu arasındaki ilişki.
Tümörün Histolopatolojik Tipi
Meme karsinomları iyi, orta ve kötü prognozlu histolojik alt tipler olarak üç gruba ayrılabilir (75). Meme kanserinin özel tiplerini belirleyen morfolojinin, bir tümörün % 90’ından fazlasını hatta % 100’e yakın bölümünü oluşturması önemlidir (72,76).
Tablo 11. Histolojik alt tiplere göre prognostik dağılım.
Tümör Gradı
Meme kanserinde en önemli prognostik faktörlerden biri olan histolojik grade tümörün biyolojik özelliklerini, morfolojik değerlendirmesini ve meme kanserlerinin klinik davranışı ile ilgili önemli bilgiler elde edilmesini sağlar. Genom mikroarray tabanlı ekspresyon profil çalışmaları meme kanseri biyolojisinin çeşitli karekteristiklerinin çözülmesini ve histolojik gradın tümör davranışını belirlemede önemli olduğuna yönelik daha fazla kanıt sağlamıştır (77). Nükleer grad tümörün çekirdek özelliklerini ve atipi derecesini yansıtır. Histolojik grad hücresel ve dokuyla ilişkili kriterlere dayandığı için, nükleer graddan daha güvenilir bir prognostik faktör olarak kabul edilmektedir, fakat nükleer gradı sitolojik örneklerde de değerlendirme şansı vardır. En sık kullanılan gradlama sistemleri Scarff- Bloom-Richardson (SBR) sınıflaması ve Fisher’ in nükleer gradlama sistemidir, ancak çoğu zaman bunların modifiye şekilleri kullanılmaktadır (78,79). Meme tümörleri tubul oluşturma, hücrelerin çapları, nükleus çapı, hiperkromatizm derecesi ve mitoz sayısına dayanarak üç histolojik dereceye ayrılır. Grade I iyi, grade II orta ve grade III kötü derecede diferansiye olmuş tümörleri tanımlar (80).
Lenfovasküler ve Perinöral İnvazyon
Primer meme tümörünün etrafındaki lenfatiklerin, kan damarlarının ve perinöral dokunun invazyonun prognostik önemi konusunda da çalışmalar mevcuttur. Meme tümörlerinin üçte birinde lenfatik invazyon mevcuttur. Lenfatik invazyon kötü bir prognostik faktördür. Birçok çalışmada lenfatik invazyon, lenf
nodu pozitifliğini arttırıcı bir risk faktörü olarak bildirilmiştir (81). Kan damarı invazyonu, 4 veya daha fazla lenf nodu tutulanlarda veya lenfatik invazyon olanlarda daha sık görülür. Perinöral invazyon da çoğunlukla lenfatik invazyonla birliktedir (82).
Östrojen ve Progesteron Reseptörleri
Uzun yıllardan beri ileri evre meme kanserinde steroid reseptör durumu tedavi kararlarını vermede kullanılmaktadır. Büyük çalışmalarda ÖR pozitif hastalarda hastalıksız sağkalımın ÖR negatif hastalara göre daha uzun olduğu gösterilmiş olup, San Antonio ve "National Surgical Adjuvant Breast and Bowel Project" verilerine göre hastalıksız sağkalım avantajı 5 yılda %10'dur(83).Progesteron reseptörü (PgR) teorik olarak östrojen uyarılması ile oluştuğu için PgR, ÖR işleme yolunun sağlam olduğunun bir göstergesidir. Çok değişkenli analizlerde ER veya PgR klinik seyirle ilişkili bulunmaktadır.Hem ÖR,hem de PgR düzeyleri proliferasyon ölçümleri ile ters ilişkilidir. ÖR düzeyleri yaş ile doğrusal olarak artar; PgR düzeyleri ise daha çok menopoz durumu ile ilişkilidir (84). ER ve PR ekspresyonu olmayan invaziv meme kanserleri hormonal tedavilere yanıt vermezler. DCIS tanısı konan hastalarda ancak hormon reseptör pozitif hastalar tamoksifen tedavisinden fayda görürler.Patoloji raporlarında, ER ve PR durumları(+) veya (-) şeklinde değil de yüzde oran olarak ifade edilmelidir Sonuç olarak ER ve PR pozitifliği hormonal tedaviye yanıtın en önemli belirleyici faktörüdür.
Proliferasyon Oranı (Kİ-67 oranı)
Çok sayıda çalışmada, ploidi (tümör hücresindeki DNA miktarı), S fazındaki tümör hücresi sayısı, tümör hücrelerinin mitotik indeksi, vb gibi tümör proliferasyon indeksleri ile prognoz ve tedaviye yanıt arasındaki ilişki araştırılmıştır. Çoğu çalışmada ploidi ile prognoz arasında herhangi bir ilişki saptanmamıştır, ancak S fazındaki artmış tümör hücresi sayısı ile azalmış yaşam süresi arasındaki ilişki gösterilmiştir (85,86). Yüksek proliferasyon göstergeleri ile yüksek tümör gradı, genç yaş, ER/PR ekspreyon negatifliği ve HER2 pozitifliği arasında güçlü şekilde ilişki saptanmıştır. Bununla birlikte, yüksek proliferasyon göstergeleri olan meme kanserli hastalar kemoterapiye daha iyi yanıt veren hasta grubunu oluşturmaktadır.
HER2/neu durumu
HER2, “epidermal growth factor receptor” (EGFR) ailesinin bir üyesidir ve bu aile HER1, HER2, HER3 ve HER4’den oluşur. HER2 geni 17q21’de yerleşiktir ve aktivasyonu ile 185-kD transmembran glikoprotein sentezi olur ve bu glikoproteinin intrasellüler kısmını tirozin kinaz oluşturur. Bu glikoproteinin aktivasyonu ile tirozin kinaz yolağı aktive olur ve hücre içi sinyal ileti yolakları üzerinden hücre proliferasyonuna sebep olur. Tüm meme kanserlerinin yaklaşık %20’sinde HER2 gen amplifikasyonu vardır ve transmembran glikoproteinin aşırı ekspresyonuna yol açar. HER2 amplifikasyonu ve aşırı ekspresyonu, yüksek tümör gradı, ER negatifliği, artmış tümör proliferasyon oranı ve kötü prognoz ile ilişkilidir (87,88). HER2 pozitifliği ile kemoterapiye yanıt arasında da ilişki saptanmıştır. Örneğin HER2(+) meme kanserleri antrasiklin içeren protokollere, antrasiklin içermeyen protokollere göre daha iyi yanıt verirler (89).HER–2 normal meme epitelyal ve miyoepitelyal dokusunda %15–30 oranında eksprese olur. Diğer prognostik faktörlerden bağımsız ve olumsuz bir prognostik faktördür.Tümör proliferasyonu, metastaz yeteneği ve ilaç direnci ile ilişkilidir (90,91).
HER-2 aynı zamanda prediktif bir belirleyicidir. HER-2 amplifikasyonu ya da fazla ekspresyonu olan tümörler daha agresif seyir gösterip artmış nüks ve ölüm oranları ile ilişkilidirler. Bu proteinin aşırı ekspresyonu ile bazı sistemik tedavilere direnç arasında ilişki belirlenmiştir. 1990'lı yıllarda ise bu moleküle karşı trastuzumab adı verilen bir monoklonal antikor geliştirilmiştir (92-94). ASCO (American Society of Clinical Oncology) tümör marker paneli, trastuzumab için prediktif faktör olarak kullanılmak üzere, HER-2'nin, tüm primer meme karsinomlarında tanı ve rekürrens anında incelenmesini önermektedir (92-94). EGFR ailesinin 4 üyesi bulunmaktadır
i) EGFR1/HER1 ii) HER2
iii) HER3 iv) HER4
Şekil 3. Epidermal growth faktör reseptör ailesi
Pİ3K-Akt-mTOR yolağı gibi büyüme faktörü sinyal yolaklarını stimüle ederek fonksiyon gösterirler . Bu reseptör ailesinin ekstrasellüler ligand-bağlayıcı domaini, lipofilik transmembran domaini ve intrasellüler tirozin kinaz domaini mevcuttur. Reseptör tirozin kinaz fonksiyonunun aktivasyonu genellikle ligand aracılı hetero veya homo- dimerizasyon yolu ile oluşur. HER2 söz konusu olduğunda ise özellikle de mutasyona uğrayarak veya aşırı eksprese edilerek ligandtan bağımsız olarak da aktivasyonun gerçekleşebildiği düşünülmektedir (95).
Şekil 4. HER2 aktivasyonu sonrası aktive olan hücresel yolaklar.
Trastuzumab ise HER2 proteinin ekstrasellüler domainine bağlanan humanize monoclonal antikordur. Pek çok klinik çalışma 1990’lı yıllardan beri bu bileşiğin potansiyel HER2 pozitif meme kanseri tedavisindeki rolünü incelemiştir.
Çalışmalar HER2 aşırı eksprese eden metastatik kanserlerin tedavisinde özellikle konvansiyonel kemoterapi & trastuzumab kombinasyonunun tek başına kemoterapiye göre belirgin olarak daha etkili olduğunu göstermiştir (96). Bu bulgunun ışığında operabl HER2 aşırı eksprese eden meme kanserlerinin tedavisinde neo-adjuvan veya adjuvan olarak kullanılması gündeme gelmiştir (97,98). Çeşitli klinik durumlarda (erken, lokal ileri veya metastatik) trastuzumabın yüz güldüren faydasına rağmen, rölatif olarak hastaların sadece küçük bir kısmı trastuzumabın tek başına kullanılmasından fayda görmektedir. Trastuzumab tek başına kullanıldığında yaklaşık yanıt oranları %20 düzeylerindedir (99). Ek olarak, trastuzumab geçici bir tümör küçülmesi sağlasa da hemen hemen tüm metastatik hastalarda klinik relaps görülmektedir. HER2 aşırı eksprese eden meme kanserlerinin daha etkili tedavisi için trastuzumaba olan direnç mekanizmalarının daha derinlemesine incelenmesi ve aydınlatılması gerekmektedir.
2.2.8. Meme Kanserinde Tedavi Cerrahi Tedavi
Meme kanserinin erken evrelerde küratif tedavisi cerrahi rezeksiyondur. En sık kullanılan yöntem modifiye radikal mastektomidir. Son yıllarda meme koruyucu cerrahi gittikçe önem kazanmaktadır. Yaşam süreleri bakımından mastektomi ile meme koruyucu cerrahi ve radyoterapi uygulanan erken evre meme karsinomlu olgular arasında anlamlı bir fark yoktur (91,100). Metastatik evrede ise yaklaşım palyatiftir. Ancak, meme kanserinin soliter organ metastazlarında seçilmiş olgularda ilk tedavi yaklaşımının metastazektomi olması yönündeki görüşün günümüzde gittikçe artan sayıda taraftar kazandığı görülmektedir (101,102).
Tarihsel önemi dışında uygulama alanı olan bir tedavi yöntemi değildir. Girişim, tüm meme dokusu, pektoralis major ve minör kası ile birlikte aksiller dokunun çıkarılması esasına dayanır.
Modifiye Radikal Mastektomi
İlk kez 1948’de Patey ve Dyson tarafından yapılmıştır (103). Pektoralis majör ve minor kasları korunurken level 1 ve 2 koltuk altı lenf diseksiyonu ile birlikte tüm meme dokusu ve pektoral majör kasının fasyasının çıkarılması esasına dayanır. Rekonstrüksiyon için uygun olması, morbiditenin düşük olması, kozmetik yönden iyi sonuçlar vermesi, ameliyat süresinin kısa olması nedeniyle giderek radikal mastektominin yerini almıştır.
Modifiye radikal mastektomi endikasyonları: 1. Evre I-II tümörlerde
2. Evre III tümörlerde
3. Büyük tümör, ancak küçük memeye sahip olanlarda 4. Hastanın tercih etmesi durumunda
5. Tümörün yaygın intraduktal komponenti olması 6. Radyoterapiye kontrendike bir durumun olması 7. Tümörün 5 cm’den büyük olması
8. Memeye daha önceden radyoterapi yapılmış olması 9. Ciddi kollajen bir hastalığın varlığı
10. Multifokal,multisentrik lezyonların olması ve mamografide diffüz mikrokalsifikasyonların bulunması hallerinde modifiye radikal mastektomi (MRM) yapılabilir.
Simple Mastektomi
Meme başı, areola, meme cildinin bir kısmı,meme dokusunun tamamı ve pektoralis major kasının fasyasının çıkartılması basit mastektomidir. Ayrıca meme kuyruğunun diseksiyonu sırasında birkaç tane düzey-I seviyesinde lenf bezi de çıkartılabilir.
Simple mastektomi (SM) endikasyonları:
1. Erken veya operabl meme kanserlerinde primer tedavi olarak 2. MKC yapılanlarda gelişen nüksler veya yeni oluşan karsinomlarda 3. İleri evre meme kanserlerinde yaşam kalitesini arttırmak için
Profilaktik Mastektomi Endikasyonları; (104)
A) Meme kanseri olmayan hastalarda bilateral profilaktik mastektomi endikasyonları;
- Bilateral multifokal DCIS varlığı
- Tek taraflı DCIS veya LCIS ile birlikte karşı memede atipik duktal hiperplazi
- Bilateral atipik duktal hiperplazi ve premenopozal 1.derece meme kanserli akraba
- Bilateral orta ve yüksek riskli proliferatif meme dokusu ve 2 veya daha fazla 1.derece akrabada premenopozal bilateral meme kanseri bulunması
- Yukarıdaki seçeneklerden birisi ile birlikte BRCA-1 gen mutasyon varlığı
B) Meme kanserli hastalarda karşı memeye profilaktik mastektomi endikasyonları;
- Diğer memede DCIS, LCIS veya ADH varlığı
- Bir veya daha fazla birinci derece akrabada meme kanseri varlığı - Bu iki faktörün birlikte olması
Meme Koruyucu Cerrahi
MKC, memenin bütünlüğünün korunması ve tümörlü dokunun çevre sağlam dokuyla birlikte çıkarılmasını amaçlar. Meme koruyucu cerrahi lumpektomi, segmental rezeksiyon, kadranektomi ve tilektomi tekniklerinin hepsine birden verilen ortak addır.
Segmentel Mastektomi: Tümör üzerindeki küçük deri parçası ve tümör dokusu ile etrafında sağlam cerrahi sınır sağlayacak meme dokusunun
çıkarılmasıdır.
Lumpektomi: Meme kanseri en az 1 cm’lik bir temiz cerrahi sınır elde etmeye yetecek kadar normal görünümlü meme dokusuyla birlikte eksize edilir.
Kadranektomi: Tümörün bulunduğu meme kadranının üzerindeki deri ve altındaki pektoral faysa ile çıkarılmasıdır.
Tilektomi: Kitlenin etrafındaki meme dokusuyla birlikte geniş çıkarılmasıdır.
Meme koruyucu cerrahi tedavinin gelişmesindeki en önemli etken, mastektominin hastalar tarafından reddedilmesi olmuştur. Gerek sistemik tedavideki ve radyoterapideki gelişmeler, gerekse erken tanı olanaklarının artışı ile meme koruyucu cerrahi tedaviye uygun olguların oransal olarak artışı da rol oynamıştır. MKC yapılmış tüm hastalarda postoperatif meme ışınlaması yapılması standart bir uygulamadır. MKC sonrası radyoterapinin lokal kontrol ve sağkalıma olan katkısı randomize çalışmalarla gösterilmiştir (105,106).
Radyoterapi
“Radyoterapi, erken evre meme kanserinde adjuvan tedavide önemli yer tutmaktadır. Radyoterapinin hem lokal kontrolü arttırdığı, hem de genel sağkalımı uzattığı bildirilmektedir (107). Meme koruyucu cerrahi yapılmış tüm hastalarda postoperatif meme ışınlaması yapılması standart bir uygulamadır. Erken evre meme kanserinde sadece meme koruyucu cerrahi uygulanmış randomize olmayan vakaları içeren serilerde meme içi yineleme oranı % 10– 54 arasında değişmekteyken bu oran radyoterapi uygulanmış uygulanmış serilerde %0-20 arasında değişmektedir (108,109). Ek olarak, cerrahi uygulanamayan erken evre meme kanserli hastalarda cerrahinin alternatifi olarak radikal radyoterapi uygulanabilmektedir. Metastatik meme kanserinde palyatif amaçlı toraks duvarına, aksiler bölgeye veya supraklaviküler fosaya radyoterapi uygulanabilir. Palyatif amaçlı uygulanan bu radyoterapi genellikle kanama, ülsere açık yaralar nedeniyledir ancak ağrı