A n k a r a E c z . Fak. D e r . J . Fak. P h a r m . A n k a r a 14, I (1984) 14, I (1984) M e n a d i o n u n D a y a n ı k l ı l ı ğ ı ( S t a b i l i t e s i ) Ü z e r i n d e B i r A r a ş t ı r m a A R e s e a r c h on the Stability of M e n a d i o n e M u z a f f e r T U N Ç E L ÖZET
Sabit iyon şiddetinde (I = 0.5) y a p ı l a n kinetik deneylerde, çeşitli pH ve sıcaklıklardaki m e n a d i o n çözeltilerinin reaksiyon hız değiş-mezleri saptanmıştır. Bu hız değişdeğiş-mezleri k u l l a n ı l a r a k m o l e k ü l ü n aktivasyon enerjisi 17.6 K c a l / m o l o l a r a k hesaplanmıştır. Reaksiyon hız değişmezlerinin p H ' a göre incelenmesinde, m e n a d i o n u n baz ka-talizli p a r ç a l a n m a s ı n ı n p H 9 ' u n ü z e r i n d e o l d u k ç a hızlı o l d u ğ u sonu-c u n a varılmıştır.
SUMMARY
T h e r e a c t i o n r a t e constants of m e n a d i o n solutions of v a r i o u s p H a n d t e m p e r a t u r e s were d e t e r m i n e d i n t h e kinetic e x p e r i m e n t s carried o u t at c o n s t a n t ionic s t r e n g t h (I = 0.5). By using these r a t e constants, the activation energy of molecule was calculated as 17.6 K c a l / m o l . A c c o r d i n g to t h e changes of t h e r e a c t i o n r a t e constants with p H , it was c o n c l u d e d t h a t the base-catalysed d e g r a d a t i o n of molecule was r a t h e r fast above pH 9.
A n a h t a r K e l i m e l e r : M e n a d i o n , kimyasal kinetik
İ l a ç endüstrisi ve a r a ş t ı r m a l a b o r a t u v a r l a r ı elli y ı l d a n beri d a y a -nıklılık testleri ü z e r i n d e ö n e m l e d u r m a k t a d ı r . Bilindiği gibi
dayanıklı-Redaksiyona verildiği t a r i h : 5 M a r t 1984
2 Muzaffer T U N Ç E L
lık çalışmaları fizikokimyasal temellere d a y a n m a k t a d ı r ve bu d a l a fizikokimyada kimyasal kinetik d e n i l m e k t e d i r . Bu k o n u d a önceleri a m p i r i k k a v r a m l a r d a n y a r a r l a n ı l a r a k çalışmalar yapılmış, b u kav-r a m l a kav-r z a m a n l a geliştikav-rilmiş ve bilimsel temellekav-re o t u kav-r t u l m u ş t u kav-r . Gü-n ü m ü z d e y a p ı l a Gü-n dayaGü-nıklılık deGü-neyleri ile ilaçlarıGü-n b o z u Gü-n m a l a r ı k o n u s u n d a birçok p a r a m e t r e t a y i n edilebilmekte v e p a r a m e t r e l e r a r a s ı n d a k i ilişkiler incelenebilmektedir (1-3).
K i m y a s a l kinetiğin hızla gelişmesi, ilaçların o r g a n i z m a d a k i da-yanıklılıklarının i n c e l e n m e l e r i n e o l a n a k sağlamıştır. Böylece ilaçların o r g a n i z m a d a k i absorbsiyon, dağılım, biyoyararlılık ve atılımının kan-titatif o l a r a k değerlendirilmesi, kimyasal kinetiğe dayalı o l a r a k ya-p ı l a b i l m e k t e d i r (4,5).
K3 v i t a m i n i o l a r a k bilinen m a n a d i o n u n , o r g a n i z m a d a k a n ı n p ı h t ı l a ş m a s ı n a n e d e n o l a n etkisinin y a n ı sıra, oksidatif fosforilasyonda da görev aldığı ileri s ü r ü l m e k t e d i r (6). M e n a d i o n u n çözeltileri ışıkta b o z u l m a k t a ve çeşitli kimyasal reaksiyonlar sonucu iki elektron ala-r a k h i d ala-r o k i n o n i k y a p ı y a d ö n e b i l m e k t e d i ala-r . Bu a ala-r a ş t ı ala-r m a d a , kolayca reaksiyona girebilen bir y a p ı y a s a h i p o l a n m e n a d i o n u n dayanıklılık koşulları; değişmez iyon şiddetinde, sıcaklığa ve p H ' a bağlı olarak incelenmiştir.
MATERYAL VE METOD
M e n a d i o n u n reaksiyon hızı değişmezleri çeşitli p H t a m p o n l a r ı içerisinde ve sıcaklıklarda, kimyasal kinetik çerçevesinde incelenirken aşağıdaki çalışma yolu izlenmiştir.
M e n a d i o n bazik o r t a m d a dayanıklı olmadığı için bazik bir t a m -p o n o l a n N a H C O3 N a O H t a m p o n u n d a n y a r a r l a n ı l a r a k d ö r t d e -ğişik p H ' a s a h i p reaksiyon çözeltileri hazırlanmıştır (7). Bu çözelti-lerin h a z ı r l a n m a s ı n d a k u l l a n ı l a n kimyasal m a d d e l e r , b u n l a r ı n m o l a r derişimleri ve çözeltilerin iyon şiddetlerini I = 0.5 de değişmez t u t -m a k için katıl-ması gerekli N a C l ' ü n -m o l a r derişi-mleri T a b l o I ' d e verilmiştir.
Reaksiyon çözeltileri, T a b l o I ' d e m o l a r değerleri verilen k i m y a -sal m a d d e l e r i n 100 ml için gerekli m i k t a r l a r ı n ı n 85 ml s u d a çözülmesi ve etanol ile 100 ml ye t a m a m l a n m a l a r ı ile elde edilmektedir.
Böy-M e n a d i o n u m Dayanıklılığı Ü z e r i n d e Bir A r a ş t ı r m a 3 [ N a H C O3] [ N a O H ] [ N a C l ] Çözelti I ( Ç - I ) Çözelti I I ( Ç - I I ) Çözelti I I I ( Ç - I I I ) Çözelti I V ( Ç - I V ) 0 . 0 2 5 0 . 0 2 5 0 . 0 2 5 0 . 0 2 5 0 . 0 2 2 7 0 . 0 1 9 1 0 . 0 1 7 0 0 . 0 0 5 0 0 . 4 5 2 3 0 . 4 5 5 9 0 . 4 5 8 0 0 . 4 7 0 0
lece belli pH ve değişmez iyon şiddetinde çözeltiler h a z ı r l a n m ı ş ol-m a k t a d ı r . B u r a d a k u l l a n ı l a n e t a n o l u n görevi ol-m e n a d i o n u n çözücüsü olmasıdır.
p H , sıcaklığın bir işlevi o l a r a k değiştiğinden, h a z ı r l a n a n reaksi-yon çözeltilerinin çalışma sıcaklığındaki gerçek pH değerlerinin öl-çülebilmesi için ö l ç ü m y a p ı l a n p H m e t r e , sıcaklık ile p H değerleri değişen 0.025 M K H2P 04- 0 . 0 2 5 M N a2H P O4 s t a n d a r t t a m p o n u (8) ile çalışma sıcaklığında s a h i p o l d u ğ u p H ' a ayarlanmıştır. H a z ı r l a n a n reaksiyon çözeltilerinin p H değerleri reaksiyonların y ü r ü t ü l d ü ğ ü sıcaklıklarda ayrı ayrı ö l ç ü l m ü ş t ü r . p H ö l ç ü m l e r i n d e Tacussel ( T S 7 0 N - l ) p H m e t r e kullanılmıştır.
R e a k s i y o n u n yapıldığı yağ b a n y o s u d e n e y b a ş l a m a d a n e n a z bir saat önce çalıştırılmıştır. Böylece reaksiyon çözeltileri için h o m o j e n bir sıcaklık sağlanmıştır. Bu a m a ç için Heidolff m a r k a termostatlı yağ banyosu kullanılmıştır.
Balonjojeler içerisindeki reaksiyon çözeltileri yaklaşık iki saat r e a k s i y o n u n yapılacağı y a ğ b a n y o s u n d a dengelenmiş, s o n r a belli derişimlerdeki m e n a d i o n u n etanoldeki çözeltisinden katılarak r e a k -siyon başlatılmıştır.
Kiyasal kinetik d e n e y l e r i n d e n u m u n e a l m a z a m a n l a r ı b ü y ü k ö n e m t a ş ı m a k t a d ı r . Çeşitli sıcaklıklarda y a p ı l a n k a b a deneylerle bu-l u n a n reaksiyon hızı değişmezbu-leri d e ğ e r bu-l e r i n d e n hareketbu-le, başbu-langıç derişiminin y ü z d e 90, 80, 70, 60, 50 ve 40 ı n a karşı gelecek yaklaşık n u m u n e a l m a z a m a n l a r ı h e s a p l a n m ı ş v e b u sürelerde n u m u n e alı-n a r a k d e ğ e r l e alı-n d i r m e y e k a t ı l a alı-n alı-n o k t a l a r ı alı-n geçerliliği sağlaalı-nmıştır.
S ö n ü m l e m e işlemi 10 ml 0.05 M H C 1 b u l u n a n t ü p l e r içerisinde yapılmıştır. Yaklaşık n u m u n e a l m a sürelerine karşı gelen z a m a n l a r d a
T a b l o I : Reaksiyon çözeltilerinin h a z ı r l a n m a l a r ı n d a kullanılan kimyasal m a d d e l e r i n m o l a r derişimleri
i Muzaffer T U N Ç E L
2.0 ml n u m u n e reaksiyon balonjojesinden pipetle alınmış ve b u z l a s o ğ u t u l m u ş t ü p l e r içerisine k a t ı l a r a k reaksiyon d u r d u r u l m u ş t u r . Bu süreçte reaksiyon süreleri kaydedilmiştir.
Bir r e a k s i y o n u n t ü m n u m u n e a l m a işlemleri sona e r d i k t e n sonra a l ı n a n n u m u n e l e r , m e n a d i o n u n e n yüksek s o ğ u r m a verdiği 249 n m de B e c k m a n D G - B T ultraviole spektrofotometresinde ölçülmüş ve elde edilen s o n u ç l a r reaksiyon hız değişmezlerinin h e s a p l a n m a s ı n d a kullanılmıştır.
SONUÇ ve TARTIŞMA
R e a k s i y o n çözeltilerinin p H ' l a r ı çalışma sıcaklıklarında ölçül-m ü ş t ü r . H a z ı r l a n a n çözeltilere verilen siölçül-mgeler ve çalışölçül-ma sıcaklık-l a r ı n d a ösıcaklık-lçüsıcaklık-len p H değersıcaklık-leri T a b sıcaklık-l o I I ' d e verisıcaklık-lmektedir.
T a b l o I I : H a z ı r l a n a n reaksiyon çözeltilerinin çeşitli sıcaklıklardaki p H ' l a r ı
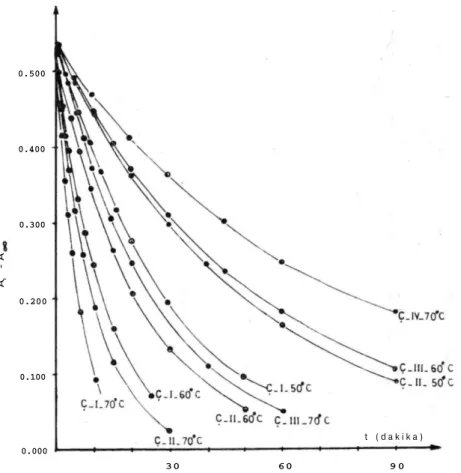
P H değerleri 70°C 6 0 ° C 50°C Ç - I 1 0 . 3 3 10.30 1 0 . 2 8 Ç - I I 10.20 10.16 10.12 Ç - I I I 9 . 8 9 9 . 8 5 9 . 8 2 Ç - I V 9 . 4 2 9 . 3 7 9 . 2 8 R e a k s i y o n sürecinde a l ı n a n n u m u n e l e r i n s o ğ u r m a değerleri ultraviole spektrofotometresinde o k u n m u ş , z a m a n a karşı At-A de-ğerleri Şekil la ve lb de grafiğe alınmışlardır.
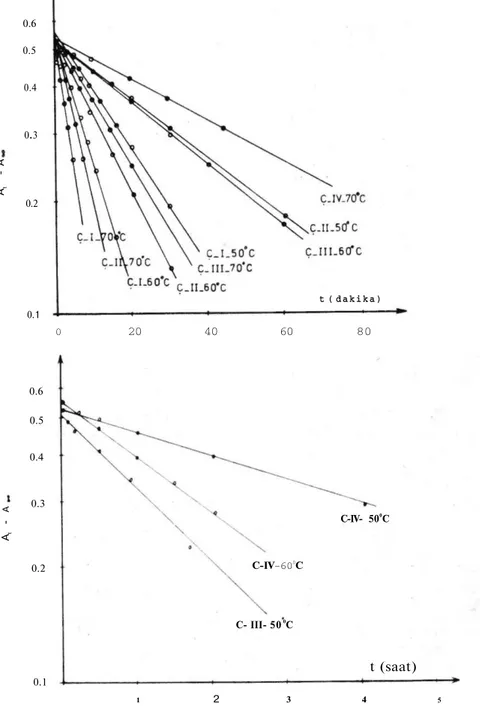
A , m e n a d i o n u n t ü m ü y l e b o z u n m a s ı n d a n s o n r a gösterdiği a b -sorbans o l u p , At - A değerleri m e n a d i o n u n karşı geldiği süredeki derişimini v e r m e k t e d i r . Z a m a n a karşı 1n (At-A ) değerlerinin Şekil 2a ve 2 b ' d e o l d u ğ u gibi doğrusal değişim göstermesi nedeniyle m e n a -d i o n u n b a z katalizli p a r ç a l a n m a r e a k s i y o n u n u n birinci -derece o l -d u ğ u s a p t a n m ı ş t ı r (3).
H e r bir reaksiyon çözeltisi için t z a m a n l a r ı n d a k i ln ( A - A ) değerlerinin regresyon analizleri yapılmış, d o ğ r u l a r ı n eğim ve kesim-leri b u l u n m u ş t u r . B u l u n a n eğim değerkesim-leri reaksiyon hız değişmezine,
M e n a d i o n u m Dayanıklılığı Ü z e r i n d e Bir A r a ş t ı r m a
Şekil l a : Menadionun bozanına eğrileri.
kesim değerleri ise m e n a d i o n u n başlangıç derişimine karşı gelmek tedir. B u değerler T a b l o I I I ' d e toplanmıştır.
R e a k s i y o n hız değişmezlerinin aktivasyon enerjisi ve frekans fak törü ile ilgisi A r h e n i u s d e n k l e m i adı ile bilinen,
k = S e_ H a/R T d e n k l e m i ile verilir. B u r a d a k : hız değişmezini, Ha : aktivasyon enerjisinini, S : frekans faktörünü, 30 60 9 0 0.500 0.400 0.300 At A t ( d a k i k a ) 0.200 0.100 0.000
Muzaffer T U N Ç E L 1 2 Şekil lb : M e n a d i o n u n b o z u n m a eğrileri. R : gaz sabitini, T : m u t l a k sıcaklığı simgelemektedir. D e n k l e m :
l n k = Ha / R T + ln S şeklinde yazıldığında 1 /T - l n k grafiğin-d e eğimin Ha/ R ifadesine eşit olacağı o r t a d a d ı r .
Aktivasyon enerjisinin h e s a p l a n a b i l m e s i için çeşitli sıcaklıklardaki reaksiyon hız sabitleri T a b l o I V ' d e t o p l a n m ı ş t ı r . 6 0.500 0.400 0.300 0.200 0.100 0.000
A
t- A
t ( s a a t ) Ç-IV-50 0C Ç- IV-600C Ç-III-500C 3 4Şekil 2a ve 2b : M e n a d i o n u n birinci d e r e c e b o z u n m a eğrileri. (Grafikler yarı-logarit-mik kağıda çizilmiştir.)
1 2 3 4 5 0.1 At A t (saat) 0 20 40 60 80 0.1 At A t ( d a k i k a ) C-IV- 500C C-IV-600C C- III- 50 0C 0.2 0.3 0.4 0.5 0.6 0.2 0.3 0.4 0.5 0.6
8 Muzaffer T U N Ç E L
T a b l o I I I : Reaksiyon s o n u n d a h e s a p l a n a n reaksiyon hız değişmezleri v e m e n a d i o n baş-langıç derişimleri A„ k ( d a k i k a- 1) C - I - 7 0 ° C 0 . 5 2 4 0 . 1 6 8 9 C - I I - 7 0 ° C 0 . 5 3 5 0 . 1 0 5 4 Ç - I I I - 7 0 ° C 0 . 5 4 9 0 . 0 3 9 9 C - I V - 7 0 ° C 0 . 5 3 0 0 . 0 1 2 4 Ç - I - 6 0 ° C 0 . 5 3 6 0 . 0 8 0 3 Ç - I I - 6 0 ° C 0 . 5 3 0 0 . 0 4 6 3 Ç - I I I - 6 0 ° C 0 . 5 3 0 0 . 0 1 8 1 Ç - I V - 6 0 ° C 0 . 5 5 0 0 . 0 0 5 5 Ç - I - 5 0 ° C 0 . 5 5 7 0 . 0 3 5 1 Ç - I I - 5 0 ° G 0 . 5 3 9 0 . 0 1 9 9 Ç - I I I - 5 0 ° C 0 . 5 2 5 0 . 0 0 8 5 Ç-IV-50 oC 0 . 5 3 0 0 . 0 0 2 5 T a b l o I V : 1/T ve reaksiyon hız değişmezleri Sıcaklık k t ° C 70 60 50 l / T ( ° K- 1) 0.00291 0 . 0 0 3 0 0 0 . 0 0 3 0 9 Ç - I 0 . 1 6 8 9 0 . 0 8 0 3 0 . 0 3 5 1 Ç - I I 0 . 1 0 5 4 0 . 0 4 6 4 0 . 0 1 9 9 Ç - I I I 0 . 0 3 9 9 0 . 0 1 8 1 0 . 0 0 8 5 Ç - I V 0 . 0 1 2 4 0 . 0 0 5 5 0 . 0 0 2 5
T a b l o I V ' d e k i 1 /T ve k değerlerinin doğal l o g a r i t m i k değerleri k u l l a n ı l a r a k A r h e n i u s eğrileri Şekil 3'de grafiğe alınmışlardır. Bu değerlerin regresyon analizleri yapılmış ve aşağıdaki d e n k l e m l e r b u l u n -m u ş t u r . Ç-I y = [23.63 ± (12.71) (0.8158)] — [8728 ± (12.71) ( 2 7 1 . 8 5 ) ] x Ç-1I y = [24.70 ± (12.71) (0.2472)] — [9261 ± (12.71) (82.39)] x Ç - I I I y = [21.77 ± (12.71) (0.3332) ] — [8590 ± (12.71) (111.04) ]x Ç - I V y = [21.49 ± (12.71) (0.0537)] — [8896 ± (12.71) (17.91)] x Bu d e n k l e m l e r i n eğimlerinin o r t a l a m a s ı 8869 ± 289.9 t u r . E ğ i m d e ğ e r l e r i n d e n h a r e k e t l e ; Ha = eğim x R eşitliğinden ak-tivasyon enerjisi 17.6 + 0.6 K c a l / m o l b u l u n m u ş t u r .
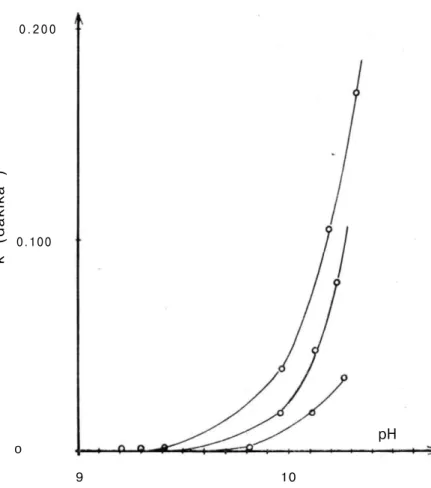
R e a k s i y o n hız değişmezlerinin p H ile değişimini incelemek a m a c ı ile, T a b l o I I ' d e k i pH ve T a b l o I I I ' d e k i k değerleri k u l l a n ı l a r a k Şe-kil 4'deki eğriler elde edilmiştir.
Menadionum Dayanıklılığı Üzerinde Bir Araştırma I n ( k X 1 00 0 ) 5.0 4.0 3.0 2.0 1.0 0.0 0.00290 0.00300 0.00309 Şekil 3 : M e n a d i o n u n A r h e n i u s eğrileri
Sıcaklığın p H üzerine ö n e m l i ölçüde etkidiği göz ö n ü n e a l ı n a r a k h a z ı r l a n a n reaksiyon çözeltilerinin pH ları, pH sı sıcaklık ile değişen s t a n d a r t t a m p o n a göre a y a r l a n d ı k t a n s o n r a ö l ç ü m y a p ı l a r a k t a y i n -lerin duyarlılığı artırılmıştır.
M e n a d i o n u n dayanıklığı k o n u s u n d a yapılmış fazla çalışma ol-m a d ı ğ ı için değerlerin karşılaştırılol-ması o l a n a ğ ı olol-maol-mıştır. D A A B İ S v e S A L E H (9) t a r a f ı n d a n h i d r o t r o p i k t u z l a r ı n ı n m e n a d i o n u n stabi-litesi ü z e r i n e etkisini incelemek a m a c ı ile y a p ı l a n bir ç a l ı ş m a d a me-n a d i o me-n u me-n b o z u me-n m a kime-netiği araştırılmış v e b i z i m b u l g u l a r ı m ı z d a o l d u ğ u gibi r e a k s i y o n u n birinci derece o l d u ğ u b u l u n m u ş t u r . Bu araş-t ı r m a d a iyon şiddearaş-ti ile ilgili h e r h a n g i bir k a y d a r a s araş-t l a n m a m ı ş araş-t ı r . Ayrıca 5 m g m e n a d i o n u n 4 0 m l b o r a t t a m p o n u n d a ısıtılarak çözül-d ü ğ ü , çözülen m e n a çözül-d i o n u n s o ğ u t u l çözül-d u k t a n s o n r a çeşitli sıcaklıklarçözül-da reaksiyona sokulduğu, çalışma sıcaklığına k a d a r ulaşıldıktan s o n r a bu çözeltiden n u m u n e a l ı n m a y a başlandığı belirtilmektedir. Bu ısıt-ma işlemi ve reaksiyon çözeltisinin yağ b a n y o s u n d a d e n g e y e getiril-m e d e n r e a k s i y o n u n başlatılgetiril-ması k o n u l a n tartışılabilir.
10 Muzaffer T U N Ç E L
Şekil 4 : M e n a d i o n u n hız değişmezlerinin pH ile değişim grafiği.
Aynı ç a l ı ş m a d a aktivasyon enerjisi h i d r o t r o p i k t u z l a r b e r a b e r liğinde ve yalnız m e n a d i o n için belirlenmiş, 20.7 K cal /mol b u l u n m u ş -t u r . Bu a r a ş -t ı r m a d a b u l u n a n değer 17.6 K c a l / m o l d ü r . Ak-tivasyon enerjileri a r a s ı n d a k i farkın, p H ' ı n sıcaklıkla değişimi d i k k a t e alın-m a d ı ğ ı n d a n ileri geldiği s a n ı l alın-m a k t a d ı r .
Şekil 4'de b o z u n m a hız değişmezlerinin pH ile d e ğ i ş i m i n d e ; 70 °C de 9.7, 60 °C de p H , 50 °C de 10.2 de çok arttığı g ö r ü l m e k t e dir. B ü t ü n b u b u l g u l a r p H 9 ' u n ü z e r i n d e m e n a d i o n u n d i k k a t e d e -ğer bir hızla b o z u n d u ğ u n u göstermektedir.
9 10 o 0 . 2 0 0 0.100
k (dakika
-1)
pH
M e n a d ı o n u m Dayanıklılığı Ü z e r i n d e Bir A r a ş t ı r m a 11
L İ T E R A T Ü R
1- F r o s t , A. A., P e a r s o n , R. G.: Kinetics and Mechanism, Second E d . , J o h n Wiley a n d Sons Co., N e w York (1961)
2- G l a s s t o n , S., L a i d l e r , K. J., E y r i n g , H . : The Theory of Rate Processes, Mc G r a w - H i l l C o . , N e w York (1941)
3- P a n c h e n k o v , G. M., L e b e d e v , V. P . : Chemical Kinetics and Catalysis, M i r Publishers, M o s c o w (1976)
4- N o t a r i , R. E. : Biopharmaceutics and Clinical Pharmacokinetics, T h i r d E d . , M a r c e l Dekker I n c . , N e w York (1979)
5- W a g n e r , J. G.: Fundamentals of Clinical Pharmacokinetics, D r u g I n l e l i g e n c e P u b l i c a t i o n I n c . , Illinois (1979)
6- R e d f e a r n , E. R.: Mode of Action of Ubiquinones (Coenzymes Q_) in Electron Transport System, V i t a m i n s a n d H o r m o n s . , 2 4 , 465 (1966)
7- B a t e s , R. G., B o w e r s , V. E.,: Alkaline Solution for pH control. A n a l . C h e m . , 28, 1322 (1956) 8- B a t e s , R. G., B o w e r s , V. E. : The Measurement of pH. "Handbook of Analytical Chemistry"
d e E d . L . Meites. B ö l ü m 11. M c G r a w - H i l l Book C o . N e w York (1963)
9 D a a b i s , N. A., S a l e h , A. M . : Effect of Hydrotopic Salts on the Stability of Menadion. C a n a d i -an J. of P h a r m . Sci., 9, 24 (1974)