T.C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ
KARDİYOPULMONER BYPASS İLE AÇIK KALP CERRAHİSİ
UYGULANAN HASTALARDA ORTA VE HAFİF
HİPOTERMİNİN SERUM NÖRON SPESİFİK ENOLAZ (NSE)
VE S 100 DÜZEYLERİ İLE NEAR-INFRARED
SPECTROSCOPY (NIRS) ÜZERİNE ETKİLERİNİN
KARŞILAŞTIRILMASI
Dr. Feyza TÜLEK
TIPTA UZMANLIK TEZİ
ANESTEZİYOLOJİ VE REANİMASYON ANABİLİM DALI
Danışman Doç. Dr. Bahar ÖÇ
T.C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ
KARDİYOPULMONER BYPASS İLE AÇIK KALP CERRAHİSİ
UYGULANAN HASTALARDA ORTA VE HAFİF
HİPOTERMİNİN SERUM NÖRON SPESİFİK ENOLAZ (NSE)
VE S 100 DÜZEYLERİ İLE NEAR-INFRARED
SPECTROSCOPY (NIRS) ÜZERİNE ETKİLERİNİN
KARŞILAŞTIRILMASI
Dr. Feyza TÜLEK
TIPTA UZMANLIK TEZİ
ANESTEZİYOLOJİ VE REANİMASYON ANABİLİM DALI
Danışman Doç. Dr. Bahar ÖÇ
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 13102011 proje numarası ile desteklenmiştir.
TEŞEKKÜR...
Eğitimime başladığım Ağustos 2010’dan bu güne kadar her aşamada yanımda olan, tezimin planlanması, gerçekleşmesi ve bugünkü haline gelmesinde emeği geçen ve ayrıca sevgi ve hoşgörüsünü eksiltmeyen başta tez danışmanım Sayın Doç. Dr. Bahar ÖÇ ile tezimin tüm aşamalarında desteğini esirgemeyen Sayın Prof. Dr. Ateş DUMAN ve Sayın Yrd. Doç. Dr. Oğuzhan ARUN’a sonsuz saygı ve sevgilerimi sunuyorum. Anesteziyoloji ve Reanimasyon ihtisasımda bilgi ve deneyimlerini benimle paylaşan Anabilim Dalı Başkanı Sayın Prof. Dr. Jale Bengi ÇELİK başta olmak üzere diğer değerli hocalarıma,
Başta Kalp ve Damar Cerrahisi Anabilim Dalı Başkanı Sayın Prof. Dr. Mehmet ÖÇ olmak üzere Kalp ve Damar Cerrahisi Anabilim Dalı araştırma görevlileri Dr. Serkan YILDIRIM ve Dr. Murat ŞİMŞEK’e, Anestezi Teknikeri Cansu ÜNAL’a yoğun bakım çalışanları ve ameliyathane ekibine,
Biyokimya Anabilim Dalı Başkanı Sayın Prof. Dr. Ali ÜNLÜ başta olmak üzere tüm biyokimya laboratuvarı çalışanlarına,
Araştırma Görevlisi arkadaşlarım Dr. Aysun ÖZDEMİRKAN ve Dr. Emine ÇEPNİ KÜTAHYA olmak üzere asistanlık eğitimim boyunca birlikte çalışmaktan mutluluk duyduğum tüm araştırma görevlisi arkadaşlarıma,
Hayatım boyunca her konuda destek olan ve beni bu günlere bıkmadan ve yıpranmadan taşıyan annem, babam, canım ablam Dr. Belgin ÖLÇÜCÜER ve sevgili eşim Baykal TÜLEK’e,
Son olarak hayatıma yeni giren minik oğlum Kerem TÜLEK’e varlığından dolayı,
Sonsuz saygı ve teşekkürlerimi sunuyorum.
I. İÇİNDEKİLER
TEŞEKKÜR………..i
İÇİNDEKİLER……….ii
RESİM ve ŞEKİL DİZİNİ…...………vi
TABLO ve GRAFİK DİZİNİ……….vii
SİMGELER ve KISALTMALAR……….viii
1.GİRİŞ……….1
1.1. Beyin Anatomisi, Fizyolojisi ve Patolojileri………...1
1.1.1. Beyin Anatomisi………...1
1.1.2. Beyin Fizyolojisi ………..2
1.1.2.1. Serebral Otoregülasyon………...3
1.1.2.2. Beyin Kan Akımını Etkileyen Faktörler ………4
1.1.3. İntraserebral Patolojiler……….6
1.1.3.1. Nöronal Atrofi……….6
1.1.3.2. Beyin Atrofisi………..7
1.1.3.3. Beyin Ödemi………...7
1.1.3.4. Kafa İçi Basınç Artışı ve Beyin Herniasyonu……….7
1.1.3.5. Global ve Fokal Serebral İskemi ………7
1.1.3.6. İntraserebral Kanama………..8
1.1.4. Kardiyak Cerrahide Serebral Patolojilerin Tanımlanması, İzlem, Tedavi ve Korunma………...8
1.1.4.1. Emboli ………..10
1.1.4.2. Azalmış Serebral Kan Akımı………11
1.1.4.3. Nörokognitif Komplikasyonlar……….12
1.1.4.4. Serebral Patolojilerin Tanımlanması ………13
1.1.4.5. Kardiyak Cerrahide Serebral Patolojilerin İzlenmesi ………..…14
1.1.4.6. Kardiyak Cerrahide Serebral Patolojilerden Korunma Yöntemleri………..…14
1.1.4.6.1. Farmakolojik Yöntemler……….14
1.1.4.6.2. Fizyolojik Yöntemler………..…15
1.1.4.6.4. Cerrahi Uygulamalar ve Teknik Yöntemler………...…19 1.2. Kardiyopulmoner Bypass (KPB)………..……20 1.2.1. Tarihçe ………..…….21 1.2.2. KPB Bileşenleri ve KPB Özellikleri………..…….21 1.2.2.1. Oksijenatörler………22 1.2.2.2. Pompalar………...……23 1.2.2.3. Pulsatil ve Non-Pulsatil KPB………24
1.2.2.4. KPB Sürecindeki Sistemik Kan Basıncı………...……24
1.2.2.5. KPB Sürecindeki Perfüzyon Basıncı………25
1.2.2.6. Hemodilüsyon ve Hemoliz………...……25
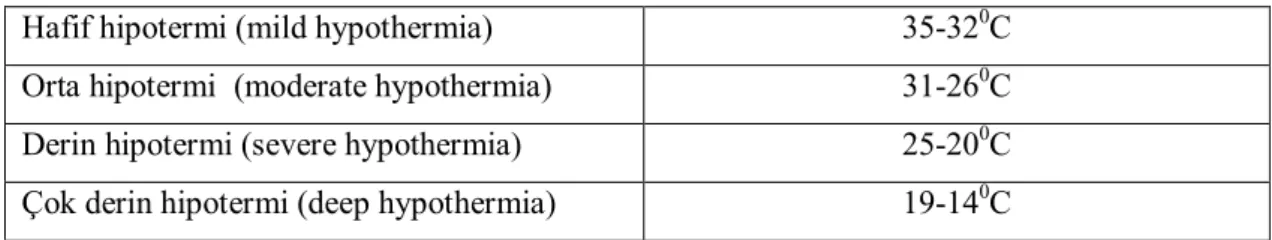
1.2.3. KPB’da Sıcaklık Değişimleri ve Seçimi……….…26
1.2.3.1. Hipotermi………..……28
1.2.3.2. Hipoterminin Etkileri………30
1.2.3.3. Kardiyak Cerrahide Kullanılan Hipotermi Teknikleri………..………31
1.2.3.4. KPB Sırasında Sıcaklık Monitorizasyon Yöntemleri…………...……32
1.2.4. KPB ve Sistemik Etkileri………34
1.2.4.1. KPB’a Bağlı Sistemik İnflamatuar Yanıt (SIR)………34
1.2.4.2. KPB’a Endokrin Yanıt………..………35
1.2.4.3. Kardiyopulmoner Bypassın Organlar Üzerinde Etkileri ……….…….36
1.2.5. KPB Sonrası Rewarming (Yeniden Isınma)……….……..39
1.2.6. KPB’da Asit-Baz Düzenlemesi (pH-stat, Alfa-stat)………..……….40
1.3. KPB Sırasında ve Sonrasında Serebral Fonksiyonların Değerlendirilmesi…..41
1.3.1. KPB’da Serebral Fonksiyonların Klinik Yöntemlerle Değerlendirilmesi..41
1.3.1.1. Nörolojik Muayene………...42
1.3.1.2. Pupil Çapının Değerlendirilmesi………...……42
1.3.2. KPB’da Serebral Fonksiyonların Biyokimyasal Yöntemlerle Değerlendirilmesi………43
1.3.2.1. İdeal Biyokimyasal Biyomarker Nasıl Olmalıdır? ………..…………43
1.3.2.2. S-100 Beta Protein (S-100)……….44
1.3.2.2.1. Tarihçe………44
1.3.2.2.2. Biyokimyasal Yapı……….…….44
1.3.2.2.3. Ölçüm Yöntemleri……….…….44
1.3.2.2.5. Açık Kalp Cerrahisinde Kullanımı……….………45
1.3.2.2.6. Etkileyen Faktörler……….….45
1.3.2.3. Nöron Spesifik Enolaz (NSE) ……….……….46
1.3.2.3.1. Biyokimyasal Yapı……….46
1.3.2.3.2. Ölçüm Yöntemleri……….….46
1.3.2.3.3. Klinik Kullanımı……….46
1.3.2.3.4. Açık Kalp Cerrahisinde Kullanımı………..…...47
1.3.2.3.5. Etkileyen Faktörler……….…….47
1.3.2.4. Laktat………49
1.3.3. KPB’da Serebral Fonksiyonların Monitorizasyon Yöntemleriyle Değerlendirilmesi………49
1.3.3.1. İdeal Nörofizyolojik Monitor Nasıl Olmalıdır? ………..……….50
1.3.3.2. Bilgisayarlı Tomografi (BT)………...…………..50
1.3.3.3. Manyetik Rezonans (MR) ………..………..50
1.3.3.4. Pozitron Emisyon Tomografi (PET) ………51
1.3.3.5. Elektroensefalogram (EEG) ……….51
1.3.3.5.1. Tanım………..……51
1.3.3.5.2. Çalışma Prensibi……….52
1.3.3.5.3. Klinik Kullanımı……….52
1.3.3.5.4. Etkileyen Faktörler………..53
1.3.3.6. Bispektral İndeks Monitörizasyonu (BIS) ………..……….54
1.3.3.6.1. Tarihçe………...…….54
1.3.3.6.2. Çalışma Prensibi ………54
1.3.3.6.3. Klinik Kullanımı……….55
1.3.3.6.4. Açık Kalp Cerrahisinde Kullanımı……….…56
1.3.3.6.5. Etkileyen Faktörler………..56
1.3.3.7. Transkranial Doppler Ultrasonografisi (TCD) ………...…..56
1.3.3.7.1. Çalışma Prensibi………...56
1.3.3.7.2. Klinik Kullanımı……….57
1.3.3.7.3. Etkileyen Faktörler……….…….57
1.3.3.8. Juguler Venöz Oksijen Satürasyonu (SjvO2) ………...……58
1.3.3.8.1. Klinik Kullanımı……….59
1.4.1. NIRS………..….59
1.4.1.1. Tarihçe………..……59
1.4.1.2. Çalışma Prensibi………...……59
1.4.1.3. Klinik Kullanımı………...…61
1.4.1.4. Kardiyak Cerrahide Kullanımı………..61
1.4.1.5. Etkileyen Faktörler………64
1.4.2. Nöropsikolojik Testler………..……64
1.4.2.1. Tanım……….…..…….64
1.4.2.2. Kullanım Amacı ………..….……64
1.4.2.3. Klinik Kullanımı ve Önemi……….……….64
1.4.2.4. Açık Kalp Cerrahisinde Kullanımı………...65
1.4.2.5. İyi Bir Nörokognitif Test Nasıl Olmalı? ………..65
1.4.3. Nörokognitif Bozuklukların Tanımlanması İçin Kullanılan Testler……...66
1.4.3.1. Rey İşitsel-Sözel Öğrenme Testi (Rey Auditory Verbal Learning Test) (RAVLT) ………...66
1.4.3.2. Katagori Akıcılık Testi (Category Fluency Test) ………66
1.4.3.3. Sayı Dizisi Testi (Digit Span) ……….…….67
1.4.3.4. İz Sürme Testi (Trail-Making) (TMT) ……….……67
1.4.3.5. Mini Mental Test (MMT) ………...….67
2. GEREÇ ve YÖNTEM……….70
2.1. Çalışma Dışı Bırakılma Kriterleri ………....70
2.2. Preoperatif değerlendirme……… 71
2.3. Nörokognitif test uygulaması………..…..71
2.4. Çalışma Grupları………...72
2.5. Near Infrared Spektroskopi (NIRS) Monitorizasyonu………..72
2.6. Verilerin kaydedilmesi………...73
2.7. Kan örneklerinin alınması……….73
2.8. Anestezi Uygulamaları………..73
2.9. Sıcaklık ölçümleri……….74
2.10. İdrar takibi………...74
2.11. Cerrahi Uygulamaları……….….75
2.12. Yoğun Bakım Uygulamaları………...75
2.13.1. Human S100………...76 2.13.2. NSE………...76 2.14. İstatistiksel Yöntem……….76 3.BULGULAR………77 4.TARTIŞMA……….94 5.KAYNAKLAR………..……103 6.ÖZET ………114 7.EKLER……….…………...117 8.ÖZGEÇMİŞ………...118
II. RESİM ve ŞEKİL DİZİNİ
Resim 1.1: Serum 100 ’nın yapısı Resim 1.2: NSE’nin yapısı
Resim 1.3: NIRS ölçümünde kullanılan INVOS 5100 C
Şekil 1.1: Serebral kan akımı ve beyin oksijen tüketimi arasındaki ilişki Şekil 1.2: Normal serebral otoregülasyon eğrisi
Şekil 1.3: Serebral kan akımı ve PaO2 arasındaki
Şekil 1.4: Serebral kan akımı ve PaCO2 arasındaki ilişki
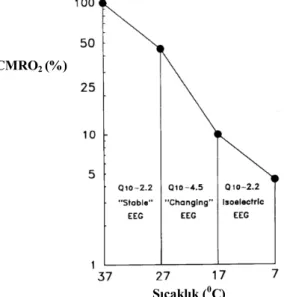
Şekil 1.5: Serebral kan akımı ve serebral perfüzyon basıncı arasındaki ilişki. Şekil 1.6: Sıcaklığın CMRO2 üzerine etkisi
Şekil 1.7: Köpeklerin 7-370C aralığında sıcaklık değişimiyle ilgili Q10 değerleri, ortalama serebral metabolik hızları ve oksijen tüketimlerinin şematik sunumu
III. TABLO ve GRAFİK DİZİNİ
Tablo1.1:Beyin dokusunun kan akımı ve metabolik ihtiyacı Tablo 1.2: İntraserebral kanama etyolojik faktörler
Tablo 1.3: Sentrifügal ve klasik roller pompaların başlıca farkları
Tablo 1.4: Normotermik ve hipotermik KPB’ın avantaj ve dezavantajları Tablo 1.5: KPB’da kullanılan hipotermi sınıflaması
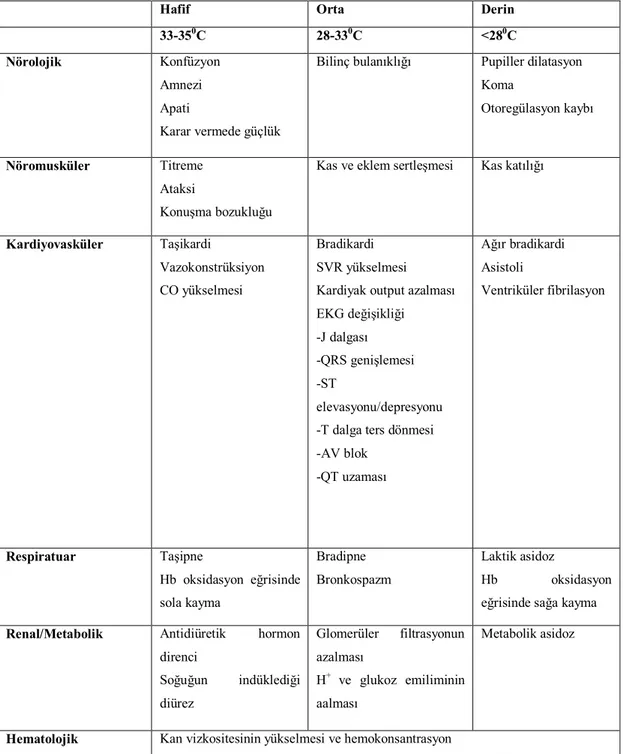
Tablo 1.6: Farklı hipotermi derecelerinde gözlenen organ patofizyolojisi Tablo1.7: pH-stat’a karşı -stat uygulaması
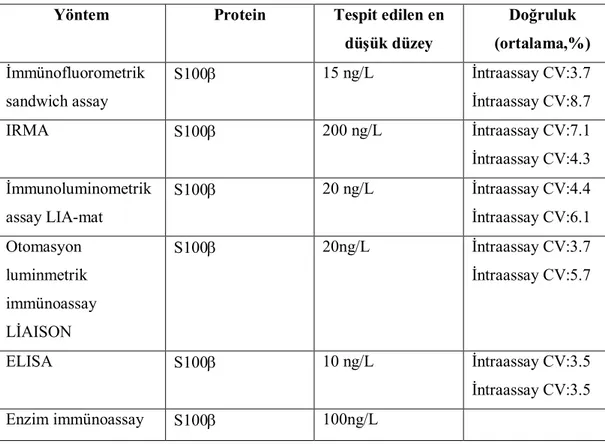
Tablo 1.8: S 100 ölçüm yöntemleri
Tablo1.9: NSE ve S100 düzeylerini etkileyen faktörler Tablo 1.10: KPB’da TCD verilerinin yorumlanması ve öneriler
Tablo1.11:KPB’da NIRS ile serebral oksijenasyon (rSO2) verilerinin yorumlanması ve öneriler
Tablo1.12: NIRS ile TCD’in karşılaştırılması Tablo 3.1: Hastaların demografik özellikleri Tablo 3.2: Grupların cinsiyete göre dağılımı
Tablo 3.3: Hemoglobin (g/dL), Hematokrit (%) ve Trombosit (K/Ul) değerlerinin zamanlara göre değişimleri
Tablo 3.4: İdrar (mL) ve drenaj (mL) miktarlarının zamanlara göre değişimi
Tablo 3.5: İntraoperatif ve postoperatif ES (mL) ve TDP (mL) kullanımı Tablo 3.6: Sağ beyin NIRS (%) değerlerinin zamana göre değişimi Tablo 3.7: Sol beyin NIRS (%) değerlerinin zamana göre değişimi
Tablo 3.8: Grup MLD için sağ ve sol beyin NIRS (%) değerlerinin zamana göre karşılaştırılması
Tablo 3.9: Grup MOD için sağ ve sol beyin NIRS (%) değerlerinin zamana göre karşılaştırılması
Tablo 3.11: Gruplar arası Mini-mental test sonuçlarının zamana göre karşılaştırılması
Tablo 3.12: Mini-mental değişkenlerinin zamana göre değişimi
Tablo 3.13. Serum NSE değerlerinin zamana göre değişimi Tablo 3.14: Serum S100 değerlerinin zamana göre değişimi
Grafik 3.1: Sağ NIRS (%) değerlerinin zamana göre değişim grafiği Grafik 3.2: Sol NIRS (%) değerlerinin zamana göre değişim grafiği
IV. SİMGELER ve KISALTMALAR
ACT: Aktivated Clothing Time AV: Atrioventriküler
ASD: Atrial Septal Defekt BT: Bilgisayarlı Tomografi
BIS: Bispektral İndeks Monitörizasyonu BMH: Beyin metabolizma hızı
BMHO2: Beynin oksijen tüketimi BPB: Beyin perfüzyon basıncı C: Komplemen sistemi
CO: Kardiyak output CVP: Santral venöz basınç
ECC: Ekstrakorporeal sirkülasyon EEG: Elektroensefalogram
EKG: Elektrokardiyogram
FDA: Amerikan gıda ve ilaç dairesi Flow: Akım
GKÖ: Glasgow Koma Ölçeği Hb: Hemogram
Hct: Hemotokrit
HITS: High intensity transient signals IL: İnterlökin
KABG: Koroner arter bypass greftleme KİBAS: Kafa içi basınç artışı sendromu KPB: Kardiyopulmoner bypass
MMT: Mini Mental Test MR: Manyetik Rezonans
NIRS: Near-Infrared Spectroscopy NMDA: N-Metil-D-Aspartat NSE: Nöron Spesifik Enolaz OAB: Ortalama arter basınç
PaCO2:Parsiyel karbondioksit basıncı PaO2: Parsiyel oksijen basıncı
PET: Pozitron Emisyon Tomografi
RAVLT: Rey İşitsel-Sözel Öğrenme Testi rpms: Dakika dönüş hızı
RRT: Renal replesman tedavisi
rSO2: Rejyonel serebral oksijen satürasyonu S-100ß: S-100 beta protein
SIR: Sistemik İnflamatuar Yanıt
SjvO2: Juguler venöz oksijen satürasyonu SKA: Serebral kan akımı
SR: Supression ratio
SVR: Sistemik vasküler direnç TCD: Transkranial doppler TMT: İz sürme testi
TOE: Transözafageal ekokardiyografi TNF: Tümör nekroz faktör
1. GİRİŞ
1.1. Beyin Anatomisi, Fizyolojisi ve Patolojileri 1.1.1. Beyin Anatomisi
Santral sinir sistemi; medulla spinalis, medulla oblongata, pons, serebellum, mesensefalon, diensefalon ve telensefalondan meydana gelmektedir. Santral sinir sisteminin en büyük kısmı olan telensefalon; beyin yarımküreleri (hemisferum serebri), bu beyin yarımkürelerini birleştiren yapılar (korpus kallosum, kommissura anterior gibi) ve iki yarımküre arasında bulunan 3. ventrikülün ön bölümünde yer alan bazı oluşumları içermektedir. Her bir hemisferum serebri; korteks serebri adı verilen ve nöronlar tarafından oluşturulan gri bir cevher tabakası, nöronların uzantılarının oluşturduğu beyaz cevher tabakası, bazal ganglionlar olarak adlandırılan beyaz cevher içerisine yerleşmiş gri cevher kitleleri ve içerisinde beyin-omurilik sıvısının bulunduğu ventrikulus lateralisten oluşmaktadır. İki hemisferum serebriye birlikte serebrum adı verilmektedir (Gökmen 2003).
Beyin hemisferleri, girus adı verilen çıkıntılı kıvrımlar ve sulkus olarak adlandırılan yarıklardan oluşmaktadır. Bu girus ve sulkuslar hemisferlerin en dışında yerleşmiş fonksiyonel beyin tabakası olan korteks serebrinin yüzey alanının anlamlı düzeyde artmasını sağlamaktadır. Bu sayede erişkin bir insanda korteks serebrinin yüzey alanı 2000-2500 cm2’ye kadar ulaşabilmektedir. Beyin üzerinde bulunan sulkus ve giruslardan bazılarının dağılımı, kişisel farklılıklar gösterebildiği gibi aynı şahsın sağ ve sol hemisferleri arasında da farklılıklar olabilmektedir (Arıncı ve Elhan 2014).
Her bir beyin hemisferi bu derin oluklar ve bunların devamı şeklinde oluşturulacak temsili çizgiler aracılığı ile beyin lobları denilen bölümlere ayrılmaktadır. Beyin lobları komşu olduğu kafa kemiğinin ismine uygun olarak lobus frontalis, lobus parietalis, lobus occipitalis, lobus temporalis ve sulkus lareralisin derinlerinde yer alan lobus insularis olmak üzere 5 bölümde incelenmektedir (Gökmen 2003).
Beyin sağlı sollu vertebral arter ve internal karotis arter olmak üzere dört büyük arterle beslenmektedir. Bu arterler beynin alt yüzünde, hipofiz sapı çevresinde birbirleriyle anastomoz yaparak sirkulus anteriosus serebri (Willis poligonu) adı verilen arter halkasını oluşturmaktadır. Halkaya bu arterlerin bazı dalları a. komminicans anterior, a. serebri anterior, a. kommunicans posterior, a. cerebri
posterior da katılmaktadır. Bu halkadan ayrılan santral ve kortikal dallar beyin dokusunu beslemektedir (Arıncı ve Elhan 2014).
1.1.2. Beyin Fizyolojisi
İnsan beyni yaklaşık 1300-1400 gr’dır. Beyin bu küçük ağırlığına rağmen total vücut ağırlığının %2’sini oluşturmaktadır. Beyin vücudun toplam oksijen tüketiminin %20’sinden sorumludur. Beyin metabolizma hızı (BMH), genellikle oksijen tüketimi (BMHO2) deyimi ile ifade edilmektedir ve erişkinlerde yaklaşık 3-3.8 mL/100g/dk (50mL/dk)’dır (Morgan 2008). Serebral kan akımı ve BMHO2 arasındaki ilişki şekil 1.1’de gösterilmiştir.
Şekil 1.1: Serebral kan akımı ve beyin oksijen tüketimi arasındaki ilişki (Hill 2007).
Beyin perfüzyon basıncı (BPB) ortalama arter basıncı (OAB) ile santral venöz basıncın (CVP) arasındaki fark olarak hesaplanmaktadır. BPB normalde 80-100 mmHg arasındadır. BPB’ı 50 mmHg’dan düşük olan hastalarda çoğunlukla EEG’de yavaşlama görülürken 25-40 mmHg arasında tipik olarak düz EEG görülmektedir. BPB’nın 25mmHg’dan az olması ise kalıcı beyin hasarı ile sonuçlanmaktadır (Morgan 2008).
Beynin damar yapısı BPB’ndaki değişikliklere 10-60 sn içinde adapte olmaktadır. Ancak OAB’ndaki ani değişiklikler otoregülasyon sağlam olsa dahi beyin kan akımında geçici değişikliklere sebep olmaktadır. BPB’nda düşme serebral vazodilatasyon, yükselme ise vazokonstriksiyona neden olabilmektedir. Normal kişilerde OAB 60-160 mmHg olduğu zaman beyin kan akımı neredeyse sabit
Serebral kan akımı (mL/100g/dk)
hale gelmektedir. OAB 150-160 mmHg’nın üzerine çıktığı zaman ise kan-beyin bariyeri bozulur, beyin ödemi ve kanama meydana gelebilir (Morgan 2008).
Vücut dokularının çoğu birkaç dakika, bazen 30 dakika süreyle oksijensiz çalışabilmektedir. Oksijensiz kalınan bu sürede dokular kendilerine gerek olan enerjiyi anerobik metabolizma ile sağlamaktadırlar. Beyin anaerobik metabolizma yeteneğine çok fazla sahip değildir. Ayrıca beyin dokusunda oksijen de depolanamadığı için, nöronal aktivitenin çoğu, her saniye kandan gelen glikoz ve oksijenden sağlanmaktadır (Guyton 1996).
Oksijende olduğu gibi, normal koşullarda kapiller kandan dakikalar ve saniyeler içinde alınan glikoz, sadece iki dakikalık bir glikoz sağlaması dışında nöronlarda glikojen olarak depolanmaktadır. Nöronlara glikojen verilmesinin özgün bir özelliği, glikozun hücre zarı boyunca nöronlara transportunun, diğer vücut hücrelerinin çoğunda olduğu gibi insüline bağımlı olmamasıdır. Bu nedenle insülin sekresyonunun bulunmadığı ciddi diyabetik hastalarda bile glikoz, nöronlar içine kolaylıkla difüze olmaktadır; bu da diyabetik hastalarda mental fonksiyon kaybının önlenmesinde büyük bir şanstır (Guyton 1996).
1.1.2.1. Serebral Otoregülasyon
Kan basıncındaki değişikliklere, beyin kendi damar tonusunu ve kan akımını sabit tutarak kan basıncındaki değişikliklerden kendini koruyan özel bir otoregülatuar mekanizması olduğu bilinmektedir (Şekil:1.2). Otoregülasyon ile serebral kan akımıyla metabolik ihtiyacın eşitlenmesi sağlanmaktadır (Paç ve ark 2004).
Şekil 1.2: Normal serebral otoregülasyon eğrisi (Morgan 2008).
Otoregülasyon bazı koşullarda bozulabilmektedir ve buna bağlı serebral hasar ihtimali artabilmektedir. Buna göre;
Ortalama arter basıncı (mmHg) Beyin kan akımı (mL/100g/dk)
İleri yaş ile değişen vazomotor tonus otoregülasyonun olumsuz etkileyebilmektedir.
Uzamış KPB, non-pulsatil akıma uzun süre maruziyete sebep olduğundan otoregülasyonu bozmaktadır.
Kanamaya bağlı gelişen hipotansiyon sebebiyle otoregülasyon
gerçekleşmeyebilmektedir (Paç ve ark 2004).
Otoregülasyonun bozulmasıyla metabolik ihtiyaçtan fazla kan akımının beyne gitmesine luxury perfüzyon denilmektedir. KPB gibi ektrakorporeal dolaşım durumunda pompa volümünün rölatif olarak büyük bölümünün beyne gitmesi mikro ve makro embolilere daha fazla maruz kalma ihtimalini artırabilmektedir. Vazomotor tonu bozuk yaşlı hastalarda, otoregülasyon ile bu volümü ayarlama yeteneklerinin olmamasından dolayı luxury perfüzyonun özel bir önemi vardır ve bu durum ileri yaşla strok insidansının artışını açıklayabilmektedir (Paç ve ark 2004).
1.1.2.2. Beyin Kan Akımını Etkileyen Faktörler
Beyin kan akımı erişkinlerde 57 mL/100g/dk’dır. Kan akımının 20-25 mL/100g/dk altında olması sıklıkla EEG’de yavaşlama ile beraber beyin fonksiyonlarında bozulmaya neden olmaktadır.
Tablo1.1:Beyin dokusunun kan akımı ve metabolik ihtiyacı (Siegel ve ark 1999).
Fonksiyon Her 100 g beyin dokusu için Tüm beyin için (1,400 g)
Serebral kan akımı (mL/dk) 57 798
Serebral O2 tüketimi (mL/dk) 3.5 49
Beyin kan akımını etkileyen faktörler;
Oksijen konsantrasyonu: Beyin kan akımını etkileyen faktörlerden birisi oksijen konsantrasyonudur. Oksijen konsantrasyonundaki azalma beyin kan akımını artırmaktadır.
Hipoksi, direk olarak serebral dokuya etki etmektedir ve adenozin ile prostanoid salınımını uyarararak önemli bir şekilde serebral vazodilatasyona sebep olmaktadır. Hipoksi durumunda ayrıca direk serebrovasküler düz kasları uyarılmaktadır ve bu durum hiperpolarizasyona sebep olarak kalsiyum alınımını azaltarak serebral vazodilatasyonu arttırmaktadır (Hill 2007).
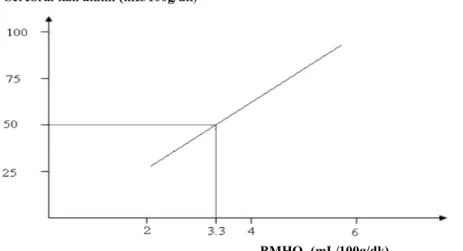
Şekil 1.3: Serebral kan akımı ve PaO2 arasındaki ilişki (Hill 2007).
PaO2:Parsiyel oksijen basıncı
Normoksemik aralıkta serebral kan akımında bir değişiklik olmadığı görülmektedir. Eğer PaO2 50
mmHg’dan daha fazla düşerse, serebral kan akımıın yükseldiği görülmektedir.
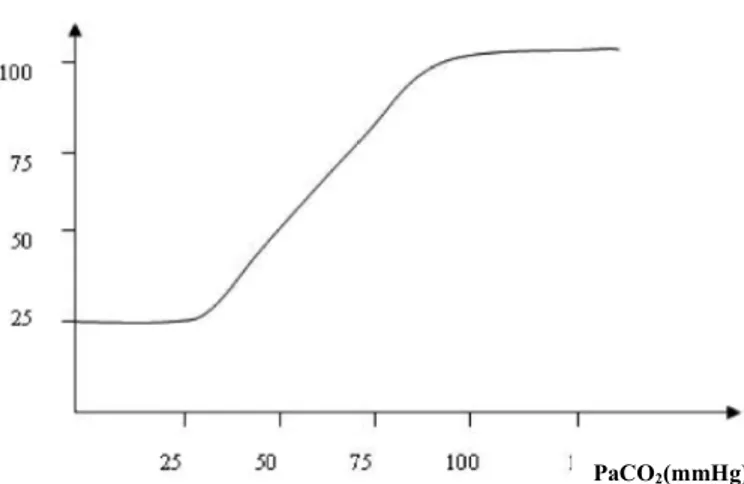
Parsiyel karbondioksit basıncı (PaCO2) ve hidrojen iyon konsantrasyonu: Beyin kan akımı üzerinde etkisi olan bir diğer faktör PaCO2 ve hidrojen iyon konsantrasyonudur. Kan akımı PaCO2 de her mmHg değişiklikle yaklaşık 1-2 mL/100g/dk değişmektedir (Guyton 1996).
Karbondioksidin hemen tümü önce vücut sıvılarındaki suyla birleşerek karbonik asit şekline dönüşmesi ve daha sonra hidrojen iyonlarına ayrışması ile beyin kan akımını arttırdığına inanılmaktadır. Oluşan bu hidrojen iyonları, daha sonra
beyin damarlarının vazodilatasyonuna neden olmaktadır. Hidrojen iyon
konsantrasyonundaki artışla orantılı olarak oluşan vazodilatasyon, beyin kan akımını yaklaşık iki katına kadar çıkarmaktadır (Guyton 1996) (Şekil 1.4).
Serebral kan akımı (mL/100g/dk)
Şekil 1.4: Serebral kan akımı ve PaCO2 arasındaki ilişki (Hill 2007).
Isı: Beyin kan akımını etkileyen bir diğer faktör ısıdır. Her 10C değişiklikle
beyin kan akımı %5-7 değişmektedir. Hipotermi hem beyin metabolik hızını hem de beyin kan akımını azaltırken, hiperpireksi ters etki yapmaktadır. Her 100C ısı artışı ile beynin metabolik hızı (BMH) yaklaşık 2 kat artmaktadır. Tersine, her 100C ısı düşüşünde BMH %50 azalmaktadır (Morgan 2008, Özgünen 2014).
Vizkosite: Beyin kan akımını etkileyen bir diğer faktör kan vizkosite değişikliğidir. Hemotokritin azalması vizkositeyi azaltarak beyin kan akımını artırmaktadır. Ancak hemotokrit azalması aynı zamanda oksijen taşıma kapasitesini azalttığı için oksijen sunumunu bozabilmektedir. Kan vizkositesinin artması ise beyin kan akımını azaltmaktadır. Bazı çalışmalar optimal serebral sunumun yaklaşık %30 hemotokrit değerlerinde olduğunu savunmaktadır (Morgan 2008).
1.1.3. İntraserebral Patolojiler 1.1.3.1. Nöronal Atrofi
Hücre gövdesinde çekilme, sitoplazmada bazofili ve nükleer piknoz ile karakterize geri dönüşümsüz bir hücresel değişikliktir. İltihabi hücre reaksiyonu eşlik etmez. Yavaş nöron ölümüne yol açan çok sayıda patolojik süreç nöronal atrofiye yol açmaktadır. Özellikle nörodejeneratif hastalıklardaki sinir hücresi ölümü buna iyi bir örnektir (Guyton 1996).
PaCO2(mmHg)
1.1.3.2. Beyin Atrofisi
Beyin ağırlığının ve hacminin yaş grubu değerlerine göre azalması olarak tanımlanır. Ana bulgular korteks kalınlığında incelme, sulkusların derinleşmesi ve girusların daralması, beyaz madde hacminin değişen ölçüde azalması ve ventrikül hacminin artmasıdır. Beyin atrofisi birçok nörolojik hastalığın ileri dönemlerinde görülebilmektedir. Bazı hastalıklarda daha yerel başlayıp daha sonra genel atrofiye dönüşebilmektedir. Beyin atrofisinin mikroskopik karşılığı gittikçe artan sayıda nöron ölümüdür (Kumar ve ark 2015).
1.1.3.3. Beyin Ödemi
Su içeriğinin artmasıyla beyin ağırlığında ve hacminde görülen artış olarak tanımlanmaktadır. Vazojenik ödem, en sık rastlananıdır. Kan-beyin bariyerinde geçirgenlik artışı sonucu oluşmaktadır. Kafa travması, infeksiyon, tümör, infarkt ve kanamalara eşlik edebilmektedir. Sitotoksik ödem, hücre içi ozmotik değişiklikleri sonucu hücre sıvı miktarında artıştır. Elektrolit bozukluklarında, hemodiyalizde, ketoasidozda ve iskemide görülmektedir. İnterstisyel ödem, hidrosefali sonucu basınçla ventriküllerden doku içine transepandimal olarak beyin-omurilik sıvısı geçmesidir(Guyton 1996, Kumar ve ark 2015).
1.1.3.4. Kafa İçi Basınç Artışı ve Beyin Herniasyonu
Kafatası içeriği hacmindeki patolojik artışlar (global serebral iskemi ve infarkt sonrası ödem, beyin-omurilik sıvısı birikimi sonucu hidrosefali, apse, hematom, tümör gibi yer kaplayıcı lezyonlar), kraniyal sütürler kapandıktan sonraki dönemde kafatasında büyüme ile kompanse edilemez; böylece kafa içi basınç artısı sendromu (KİBAS) oluşur. Beyin yüzeyi artan basınçla kemiğe doğru yaslanırken, giruslarda düzleşme, sulkuslarda sığlaşma, tentoryal izlerde belirginleşme gözlenmektedir. Böylece beyin herniasyonu, yani gittikçe şişen beyin dokusunun potansiyel boşluklara doğru yer değiştirmesi süreci başlamaktadır (Morgan 2008).
1.1.3.5. Global ve Fokal Serebral İskemi
İskemik beyin hasarı lokalizasyonuna göre fokal ve global olmak üzere iki gruba ayrılmaktadır.
Global iskemi; global hipoksi ile birlikte intraserebral total dolaşım arresti
olarak tanımlanmaktadır. Serebral perfüzyonun durması, kardiyak arrest veya istemli dolaşım arresti nedeniyle olabilirken, global hipoksi şiddetli solunum yetmezliği, boğulma ve asfiksi nedeniyle olabilmektedir (Kumar ve ark 2015).
Fokal iskemi; beyinde bir arterin sulama alanı olan bölgede dolaşımın durması ile meydana gelen doku nekrozu olarak tanımlanmaktadır. Fokal iskeminin nedeni emboli, hemorajik ve aterosklerotik inmeler ve travma olabilmektedir. Öncelikle hipokampusun Sommer bölgesi, Purkinje hücreleri ve neokorteksin 3. ve 5. katmanlarındaki piramidal hücreler etkilenmektedir. Hipoksi devam ettikçe bütün merkezi sinir sistemine yayılmaktadır. Akut hipoksiden sonra dolaşım normale dönerse sadece kırmızı nöron değişikliği görülebilmektedir. Hipoksi veya diğer
sebeplerle eksitotoksik hasar devam ederse kortikal laminer nekroz
gözlenebilmektedir (Guyton 1996).
1.1.3.6. İntraserebral Kanama
İntraserebral kanama santral sinir sisteminde parankim içine kanama olarak ifade edilmektedir. Nörolojik bulguların kanamanın lokalizasyonu, etiyopatogenezi, oluşan kanamanın boyutları ile yakından ilişki olduğu bilinmektedir ve en sık görülen klinik tablosu inmedir
(
Broderick ve ark 1992).İntraserebral kanama için en önemli risk faktörünün yaş olduğu bilinmektedir. İleri yaşla beraber insidans giderek artmaktadır. İntraserebral kanama riski sistolik kan basıncının artışıyla da artmaktadır. İntraserebral kanamaya sebep olan diğer faktörler tablo 1.2’de gösterilmiştir
(
Broderick ve 1992).1.1.4. Kardiyak Cerrahide ve Serebral Patolojilerin Tanımlanması, İzlem, Tedavi ve Korunma
KPB akımının beyin kan akımı ve metabolizması üzerinde major etkilerinin olduğu bilinmektedir. KPB; inme, koma, deliryum ve kognitif fonksiyonlarda azalma gibi bir takım bozuklukları da beraberinde getirmektedir. Yirminci yüzyılın sonlarında geliştirilen cerrahi ve anestezi tekniklerindeki ilerlemeler ile kalp ameliyatlarına bağlı mortalite belirgin oranda azalmıştır (Williams 1993, Taylor 1993).
Tablo 1.2: İntraserebral kanama etyolojik faktörler
(
Broderick ve 1992). Primer (hipertansif) Lipohyolinozis Mikroanevrizmalar Diğer SekonderAnevrizma ve arteriovenöz malformasyon Amiloid anjiopati Venöz tromboz Mikroanjiyom Kavernöz anjiyom Venöz anjiyom Telenjektazi Dural fistül
Septik arterit ve mikotik anevrizma Vaskülit Travma Moya-moya sendromu Hemorajik infakt Diğer nedenler: Kronik hipertansiyon Akut hipertansif kriz Migren Antikoagülan tedavi Antiagregan tedavi Fibrinolitik tedavi Hemofili Lösemi-trombopeni Alkol Amfetminler Kokain
Kalp cerrahisinde gelişen serebral hasar Tip I ve Tip II olarak sınıflandırılmaktadır.
Tip I hasar grubunu; inme, stupor, koma veya hipoksik ensefelopatiye bağlı
ölüm oluştururken;
Tip II hasar grubunu; entelektüel fonksiyonlarda bozulma, konfüzyon,
ajitasyon, hafıza kayıpları veya fokal hasar olmaksızın nöbet geçirilmesi oluşturmaktadır (Roach ve ark 1996).
KPB’ı takiben ortaya çıkan nörolojik komplikasyonların oranının %40 civarında olduğu bilinmektedir. Bu komplikasyonların çoğunu geçici nöropsikolojik
disfonksiyon oluşturmaktadır. İnme gibi ciddi nörolojik komplikasyonlara ise % 2-5 oranında olak üzere daha az rastlanılmaktadır (Morgan 2002). Bununla beraber ileri yaş ve altta yatan hastalığın var olması nörokognitif komplikasyonların görülme sıklığını arttırmaktadır (DiNardo 2002). Ayrıca normotermik KPB cerrahisinde uyanma sırasında, bypass sonrası dönemde ya da postoperatif yoğun bakımda hipotansiyon (SKB<80mmHg) ve/veya düşük kardiyak outputun nörolojik yan etkilerle yakından ilişkisi olduğu düşünülmektedir (Gardner 1985, Shaw ve ark 1989, Slogoff ve ark 1990).
1.1.4.1. Emboli
KPB cerrahisinde çeşitli sebeplerle emboli oluşabilmektedir. Buna göre; -KPB sırasında sistemik dolaşıma mikroskobik ya da makroskobik boyutlarda hava, antiköpük ajanlar (Ehrenhaft ve Claman 1961), yağ (Solis ve ark 1974), lifler (Dimmick 1975), plastik parçalar (Reed ve ark 1974) ile lökosit (Dutton ve ark 1973), trombosit (Guidoin ve ark 1975) ve fibrin agregatları (Dutton ve ark 1974) karışabilmektedir. Bu parçaların sistemik dolaşıma karışarak mikroemboli oluşturmasına bağlı perioperatif nörolojik hasar oluşabilmektedir.
-Transkranial Doppler (TCD) çalışmalarında, KPB sırasında en fazla aortaya manipülasyon sırasında serebral emboli oluştuğu gösterilmiştir (DiNardo 2002). Aortanın kanülasyonu ve klemplenmesi ile ateromatöz materyal yer değiştirerek serebral emboliye sebep olabilmektedir. Barbut ve arkadaşlarının yaptığı bir çalışmada bu ateromların perfüzatın aorta kanülüne uyguladığı basınç yüzünden aorta lümeni içinde toz haline gelebildiği gösterilmiştir (Kaplan 1993).
-Uzamış KPB’ın da muhtemelen ilerleyici ve daha sık serebral emboliler oluşması nedeniyle nörolojik ve nöropsikolojik komplikasyonlar daha sık izlenmektedir.
-Bir diğer emboli kaynağı cerrahi sahadan kaynaklanan arteriyel gaz embolileridir. Yapılan transözafageal ekokardiyografi (TOE) çalışmalarında hava boşaltma işlemi uygulanmasına rağmen kalp boşluklarının açıldığı vakalarda hastaların %100’ünde sol ventrikülde makroskopik/mikroskopik hava kaldığı gösterilmiştir. Boşluklar açılmadan yapılan kardiyak cerrahi girişimlerinde bu oran %15-50 civarında olmaktadır. Aort klempinin kalkması ve sol ventrikül ejeksiyonu ile sistemik ve serebral dolaşıma hava girdiği bilinmektedir (Kaplan 1993).
1.1.4.2. Azalmış Serebral Kan Akımı
KPB cerrahisi sırasında serebral oksijen ihtiyacı vücut sıcaklığına bağımlı iken, serebral kan akımı oksijen ihtiyacına, parsiyel karbondioksit basıncına, hemotokrite ve OAB’na bağlı olmaktadır. Dolayısıyla bu faktörler tek başına ya da birlikte serebral kan akımını artırıp azaltabilmektedirler (Paç ve ark 2004).
Serebral kan akımının kontrolü otoregülasyona bağlı olmaktadır. Serebral kan akımı, sağlıklı hastalarda KPB sırasında 60-140 mmHg arasındaki OAB değerlerinde otoregüle edilmektedir (Christakis ve ark 1994). KPB’a eşlik eden ileri yaş, hipertansiyon ve DM gibi durumlarda otoregülasyon bozulmaktadır ve serebral hasar riski artmaktadır. Ayrıca uzamış KPB süresi de otoregülasyonu olumsuz etkilemektedir ve benzer şekilde hipotermik nonpulsatil KPB cerrrahisinde otoregülasyonun bozulduğu gösterilmiştir (Paç 2004).
Bazı çalışmalarda KPB sırasında, yaşın serebral otoregülasyona etkisinin olmadığını (Newman 1994) ancak diyabetiklerin serebral otoregülasyonunun KPB sırasında bozulduğu gösterilmiştir (Croughwell ve ark 1990).
Serebral kan akımı için önemli olan diğer konu beyin perfüzyon basıncı (BPB)’dır (Şekil:1.5). BPB, ortalama arter basınç ve intrakranial basıncı etkileyen tüm faktörlerden etkilenmektedir. Eğer bu değerlerin ikisinde birden düşme gözlenirse, bu durumda BPB major şekilde düşeceğinden dolayı beyin iskemisi riski artabilmektedir (Hill 2007).
Şekil 1.5: Serebral kan akımı ve serebral perfüzyon basıncı arasındaki ilişki (Hill 2007).
MAP; Ortalama arteriyel basınç, CPB; Serebral perfüzyon basıncı CPB (mmHg)
Hipotermik KPB cerrahisi süresince hedef BPB’nin 40 mmHg’ya da daha yüksek değerde tutulması önerilmektedir. Normotermik KPB cerrahisinde BPB’nin 40 mmHg ya da daha yüksekte tutulmasının güvenli olduğu düşünülmemektedir (Bradley ve John 1993).
KPB cerrahisinde ısınma süresince hedef BPB’a ulaşmak için OAB’ın yavaş yavaş yükseltilmesi tavsiye edilmektedir. Bu pratik uygulama sadece beyin kan akımını korumak için değil aynı zamanda miyokard kan akımını korumak için de önemli olmaktadır (Bradley ve John 1993).
1.1.4.3. Nörokognitif Komplikasyonlar
Nörokognitif komplikasyonları nörolojik ve nöropsikolojik disfonfsiyonlar olarak 2 grupta incelemek mümkündür.
Nörolojik disfonksiyonlar: KPB cerrahisinde ileri yaş ve KPB süresinden
bağımsız olarak hastalar nörolojik zarar konusunda risk altındadırlar. Nörolojik hasara sebep olduğu bilinen embolinin cinsi ve boyutu, nörolojik hasarın türünü de belirlemektedir. Buna göre kalsifik ya da ateromatöz makroembolik debrislerin klinikte strok sendromunun başlangıcı için bir risk faktörü olduğu bilinirken, mikroembolik elementler (gaz halinde ya da partikül halinde) diffüz nörodavranışsal disfonksiyonlar için bir risk faktörü oluşturduğu bilinmektedir (Dinardo 2002). Shaw ve arkadaşlarının 312 hasta üzerinde yaptığı çalışmada görülen nörolojik değişikliklerin %25’ini oftalmolojik değişiklikleroluşturmaktadır. Bunlar retina embolisi, bilateral retinal infarktlar, görsel keskinliğin azalması ve geçici hemianopsidir. Aynı çalışmada hastaların %39’unda primitif refleksler izlenmiştir. Primitif refleksler her ne kadar non-spesifik olsa da serebral disfonksiyonun bir belirleyicisi olabilmektedir. Bunlar; burun refleksi, palmomental refleksler ve bilateral yakalama refleksleridir. Periferik sinir sistemi komplikasyonları ise hastaların %12’sinde görülmüştür. Bunlar; brakial pleksopati (ulnar, radial, median ve frenik nöropati)’dir.Postoperatif psikoz ise olguların %1’inde gözlenmiştir (Shaw ve ark 1985).
Nöropsikolojik disfonksiyonlar: KPB cerrahisi geçiren hastalarda görülen
detaylı muayene edilmemesi ile gözden kaçabilmektedir. Çoğu zaman bu disfonksiyonlar sadece yüksek sofistike test stratejileri ile algılanabilmektedir. Yapılan çalışmalarda teste tabi tutulan hastalarda en çok bozulan kognitif yetenekler sıklıkla psikomotor hız, dikkat ve konsantrasyon, yeni bilgileri öğrenme kapasitesi ve işitsel kısa dönem hafıza olmaktadır (DiNardo 2002).
1.1.4.4. Serebral Patolojilerin Tanımlanması
KPB cerrahisi sırasında sıcaklık değişimi, pulsatil akımın olmaması ve hemodilüsyon gibi sebeplerden ötürü normal serebral fizyolojide değişiklikler görülmektedir.
Sistemik arteriyoskleroz bulgularının varlığı kalp cerrahisi ile ilgili nörolojik hasarın gelişmesinde en kesin risk faktörü olarak karşımıza çıkmaktadır (DiNardo 2002). Öncesinde nörolojik semptomu olan veya var olan semptomları devam eden hastalar da bu komplikasyon için yüksek risk grubunda olmaktadır. Nörolojik semptomu olan hastalarda, daha ciddi serebral ve/veya aorta aterosklerozu ve/veya kötü kollateral perfüzyon olduğu ve bu hastaların serebral iskemiye daha hassas oldukları düşünülmektedir (Kaplan 1993, DiNardo 2002).
Serebral hasarın değişik tipleri için farklı risk faktörleri tanımlanmaktadır. Roach ve arkadaşlarının 2108 hasta üzerinde yaptıkları çalışmada aorta aterosklerozu, nörolojik hastalık öyküsünün olması, intra-aortik balon pompasının kullanımı, eşlik eden diyabet hastalığının varlığı Tip I hasarlar için risk faktörü olmaktayken, alkol kullanımı, önceden KPB öyküsünün varlığı, antihipertansif kullanım öyküsünün olması Tip II hasarlar için, ileri yaş ve ciddi hipertansiyon varlığının ise tüm gruplar için bir risk faktörü olduğu gösterilmiştir (Roach 1996). Öncesinde inme öyküsü olan hastaların fonksiyonel rezervleri daha az olduğu için nörolojik fonksiyonlardaki minör değişiklikler bile bu hastalar tarafından kompanse edilemeyebilmektedir ve klinik olarak daha belirgin olabilmektedir (Kaplan 1993).
Nedeni tam olarak bilinmemekle beraber ileri yaşın serebral hasar oluşumunda belirgin bir risk faktörü olduğu düşünülmektedir (Tuman ve ark 1992, Croughwell ve ark 1994). Aorta ve karotis hastalığı insidansı yaşla beraber arttığı için yaşlı hastalarda cerrahi sırasında daha fazla serebral emboli gelişiyor
olabilmektedir. Ayrıca yaşlı beyinlerin fonksiyonel rezervleri azalmış olduğundan belki de bu hastalarda bu yüzden ataklar daha belirgin olmaktadır (DiNardo 2002).
1.1.4.5. Kardiyak Cerrahide Serebral Patolojilerin İzlenmesi
Beynin göreceli olarak yüksek oksijen tüketiminin olması ve hemen tamamen aerobik glukoz metabolizmasına bağımlı olmasından dolayı iskemik hasara karşı çok duyarlı olduğu bilinmektedir. Serebral perfüzyonun ve metabolik substratın (glukoz) azalması veya şiddetli hipoksemi olması çok hızlı fonksiyon bozukluğuna yol açabilmektedir. KPB sırasında görülen beyin hasarı emboli, azalmış serebral kan akımı veya inflamatuar cevaba bağlı olabilmektedir.Bu mekanizmaların bir kısmı ya da hepsi beyin fonksiyonlarında olumsuz etkilere sebep olabilmektedir (Taylor 1998).
1.1.4.6. Kardiyak Cerrahide Serebral Patolojilerden Korunma Yöntemleri
Nöronal doku hasarını sınırlamak veya önlemek için gösterilen çabalar iskemi ister fokal olsun ister global olsun genellikle aynı olmaktadır. Klinik hedefler KPB’ın optimal koşullarda uygulanmsı, metabolik gereksinimleri azaltmak ve hücresel hasar mediatörlerini bloke etmektir (Morgan 2008). Bu amaçla birçok yöntem kullanılmaktadır. Bu yöntemleri farmakolojik, fizyolojik, anestezik ve cerrahi-teknik olmak üzere dört başlık altında inceleyebiliriz.
1.1.4.6.1. Farmakolojik yöntemler
Kalsiyum kanal blokörleri: Kalsiyumun hücre içinde birikimi serebral
iskemide hücre ölümüne yol açan ana etkenlerden birisi olmaktadır. Nimodipin ve nikardipinin serebral vazodilatör özellikleri vardır. Bu özellikleri sayesinde beyin kan akımını iyileştirebilmektedirler.
Nimodipinin subaraknoid kanaması olan hastaların tedavisinde etkili olduğu gösterilmiştir. Forssman ve arkadaşlarının kalp cerrahisi geçirecek 39 hasta üzerinde yaptığı bir çalışmada, hastaları nimodipin kullanan ve kullanmayan olarak randomize ederek hastaların nörokognitif durumlarını 6 ay sonra değerlendirilmiştir. Çalışmadaki 28 hastanın 6’sında (%28) altıncı ayda nörolojik defisit gösterilmiştir. Nimodipin alanlarda diğer gruptan daha iyi konuşma ve görme özellikleri olduğu
gösterilmiştir. Ancak çalışmadaki hasta sayısının az olmasından dolayı yazarlar tarafından bu çalışmada kesin sonuçların çıkmasının önlendiğinin önemi vurgulanmıştır (Forsman ve ark 1990).
Lidokain: Lidokain beyin metabolik hızı ve kan akımını azaltmaktadır. Ancak
bu etkisi, bu amaçla kullanılan diğer diğer ajanlara oranla daha az olmaktadır. Lidokainin en önemli avantajı hemodinamiyi bozmadan serebral vasküler direnci arttırarak beyin kan akımını azaltmasıdır. Sistemik toksisite riskinden dolayı tekrarlanan dozlarda kullnımı sınırlı olmaktadır (Grupta ve Gelb 2013).
Vazopressörler: Serebral otoregülasyonun bozulduğu durumlarda vazopressörler beyin perfüzyon basıncını artırarak serebrak kan akımını artırmaktadırlar. Beyin metabolizma hızındaki değişikler de genellikle beyin kan akımı değişikliği ile aynı olmaktadır.
.
1.1.4.6.2. Fizyolojik yöntemler
Sıcaklık: Fokal ya da global iskemi sırasında beyni korumak için en etkili yöntem hipotermi olarak bilinmektedir. Hipotermi tüm beyinde hem bazal hem de elektriksel gereksinimleri azaltmaktadır (Morgan 2008).
Beynin korunması hipoterminin oluşturduğu serebral metabolik
baskılanmanın derecesi ile ilişkili olmaktadır. Serebral hipotermi, perfüzyon basıncı ve hemotokritteki azalmaların istenmeyen etkilerini azaltmaktadır ve KPB için gereken süreyi uzatmaktadır. Minimal sıcaklık değişimlerinin bile iskeminin nörokimyasal, nörofizyolojik ve nöropatolojik sonuçları üzerinde önemli etkileri olduğunu gösteren çalışmalar bulunmaktadır.
Serebral iskemi sırasında hipotermi, serebral metabolik hızı azaltarak yüksek enerjili fosfatların kullanımını (Berntman ve ark 1981, Chopp ve ark 1989, Sutton ve ark 1991)ve hücre içi asidoz oluşumunu (Berntman ve ark 1981, Chopp ve ark 1989) yavaşlatmaktadır. Bu yolla hipoterminin iskemik süre boyunca nöronal enerji yetersizliğini ve terminal membran depolarizasyonunu geciktirdiği ya da engellediği düşünülmektedir (DiNardo 2002). Yapılan çalışmalarda 20C’lik hipoterminin bile beyin hasarını anlamlı oranda azalttığı gösterilmiştir (Cook 2000).
Glukoz: Yapılan çalışmalarda kan şekeri yüksekliğinin fokal ya da global iskemi sonrası nörolojik hasarı artırdığı gösterilmiştir (DiNardo 2002, Morgan 2008). Kan şekeri düzeyinin intraoperatif dönemde 200-250 mg/dL’nin altında olmasının serebral hasarı azaltmada faydasının olduğu gösterilmiştir (Cook 2000). Hiperglisemi, anaerobik glikoliz için daha fazla substrat sağlayarak iskemik dokudaki hücre içi laktik asidozu daha çok artırmaktadır. İskemik hücre içi asidoz endotel ve glial hücrelere zarar vererek iskemi sonrası kan beyin bariyerinin hiperglisemi ile daha da bozulmasına sebep olmaktadır (Kaplan 1993).
Ortalama arter basıncı: Optimal serebral perfüzyon basıncını korumanın nörolojik hasarı önlemede önemli olduğu bilinmektedir. Bunun için arteriyel kan basıncı normal veya hafif yüksek olmalıdır. Kalp cerrahisi geçirecek hastaların serebral hasar açısından riskli hasta oldukları göz önüne alınacak olunursa konservatif olarak ortalama arter basıncı otoregülatör sınır olan ≥50 mmHg tutulmalıdır (DiNardo 2002)
Stockard ve arkadaşlarının yaptığı çalışmada perioperatif nörolojik fonksiyon bozukluğunun, intraoperatif kan basıncı ve EEG ile ilişkili olduğu öne sürülmüştür. Çalışmada sistemik akım, arteriyel basınçtan bağımsız olarak 2.2 L/dk/m2’de tutulmuştur. Yazarlar, perioperatif nörolojik bozukluğun tahmininde kullanılan ‘’tm50‘’ (torr minutes), (mmHg minutes) olarak tanımlanan bir hipotansiyon indeksi geliştirmişlerdir.
Bu indeks; 50 torr’un altındaki perfüzyon basıncı olarak tanımlanmıştır. Bu
tanım; geometrik olarak kan basıncı kaydındaki 50 torr çizgisi ile ortalama arteriyel basınç çizgisi arasındaki alanla gösterilmektedir.
Buna göre tm50>100 mmHg.dk olan 7 hastanın altısında anormal EEG bulguları ve postoperatif nörolojik defisitler gelişmiştir. Bu hastalarda serebral hipoperfüzyonun olduğu düşünülmüştür. tm50<100 mmHg olan 16 hastanın ikisinde postoperatif geçici nörolojik defisitler izlenmiş ancak hiçbirisinde anormal EEG bulgularına rastlanılmamıştır.
Sonuç olarak ortalama arter basıncının KPB sırasında en az 50 mmHg ve tm50 >100 mmHg.dk olmasının muhtemelen iskemik zeminde geri dönüşümü olmayan
EEG değişiklikleri ve postoperatif nörolojik fonksiyon bozukluğu açısından risk faktörü olduğu düşünülmüştür (DiNardo 2002).
Ancak bu çalışmada hangi hasta grubuna hipotermik, hangisine normotermik CPB uygulandığı (çalışmada hastaların çoğunun normotermik olduğu söylenmiş) belirtilmemiştir. Bu nedenle bu çalışmanın sonuçlarının normotermik KPB’a uyarlamak daha doğru olmaktadır (DiNardo 2002, Fyman ve Gotta 2012).
Karbondioksit: Parsiyel karbondioksit basıncı serebral kan akımının en önemli belirleyicilerindendir. Parsiyel alveolar karbondioksit basıncı serebral kan akımını serebral oksijen tüketiminden bağımsız olarak etkilemektedir. Hem hiperkarbi hem de hipokarbi iskemi durumunda hiçbir yarar sağlamayacağı hatta zararlı olabileceği için normokarbi korunmalıdır. Hipokarbinin neden olduğu serebral vazokonstriksiyon iskemiyi artırırken hiperkarbi steal fenomenine yol açabilmektedir ya da hücre içinde asidozu artırabilmektedir (Morgan 2008).
1.1.4.6.3. Anestezik Yöntemler
Barbitürat: KPB uygulanan hastalarda nörolojik koruyucu etkisinin olup olmadığı tam olarak anlaşılamamış olsa da, barbitüratlar geleneksel olarak ‘serebral koruyucu’ olarak kabul edilen anestezik ajanlar olarak kabul edilmektediler.
Barbitüratların serebral koruyucu etkisinin olduğunu gösteren ilk çalışma Nussmeir ve arkadaşlarının yaptığı çalışmadır. Bu çalışmaya alınan 182 hasta rastgele olarak tiyopental alan ve kontrol grubu olarak ayrılmışlardır. Tiyopental kullanan gruba KPB süresince düz bir EEG elde edilecek şekilde tiyopental infüzyonu uygulanmıştır. Diğer koşullar standart tutulmuştur. Postoperatif 10. günde kontrol grubunda nöropsikiyatrik bozukluk %7.5 iken, tiyopental alan grupta hiçbir bozukluğa rastlanmamıştır (DiNardo 2002).
Tiyopental serebral metabolizmada doza bağlı bir azalma meydana getirmektedir. Maksimal etkide barbitüratlar EEG de izoelektriksel hat oluşturmaktadır. İzoeektrik EEG ile serebral metabolik ihtiyaçlar neredeyse %50 azalmaktadır. Kalan metabolik ihtiyaçlar da transmembran iyon farklarının sürdürülmesi, protein sentezi ve diğer bazal hemeostatik işlemler ile nöronların yaşaması için hayati olan durum için olmaktadır. Barbitüratların oluşturduğu serebral metabolik baskılama etkisinin, serebral iskemi süresini artırdığı kabul edilmektedir.
Ancak EEG de düz hat oluşturacak kadar ciddi bir iskemi olduğunda barbitüratlar serebral metabolik hızı etkilememektedir. Bu durumda barbitürat uygulamasının muhtemel metabolik ya da enerjik yararı olmamaktadır. ATP depoları boşaldıktan ve serebral kan akımı homeostatik metabolizma için gerekli seviyenin altına düştükten sonra barbitüratların varlığından etkilenmeksizin nöronlar depolarize olup ölmektedir. Böylece barbitüratların oluşturduğu metabolik baskılanma ile en iyi ihtimalle bir miktar süre kazanılmaktadır (DiNardo 2002, Kaplan 1993)
Ketamin: N-Metil-D-Aspartat (NMDA) reseptörlerinde glutamatın etkilerini
bloke edebildiği için serebral koruyucu etkiye sahip olabileceği düşünülmüştür. Ancak ketamin ile yapılan hayvan çalışmalarında sonuçlar çelişkilidir(Morgan 2008).
İnhalasyon anestezikleri: İnhalasyon ajanları, serebral metabolik hızda doza
bağımlı bir azalmaya neden olurken(isofluran, enfluran, desfluran ve sevofluranın % 50'nin üzerinde, halotan % 25'ten az), serebral kan akımını ise artırmaktadırlar. Metabolik hızı azaltırken kan akımını artırmaları lüks perfüzyon olarak adlandırılmaktadır. Global iskemide bu durum yararlı olmasına rağmen, fokal iskemide zararlı olmaktadır (Grupta ve Gelb 2013).
Kanbak ve arkadaşlarıın 2007 yılında yaptıkları çalışmada; isofloran, sevofloran ve desfloran anesteziklerinin, CABG cerrahisi uygulanan hastaların postoperatif nörokognitif fonksiyonları üzerine etkileri ve preoperatif ve postoperatif S100 değerleri üzerine etkileri araştırılmıştır. Bu çalışmaya göre; isofloran anestezisi uygulanan hastaların, desfloran ve sevofloran kullanılan hastalara göre postoperatif daha iyi sonuçları olduğu, sevofloran kullanılan hastaların ise nörokognitif fonksiyon açısından en kötü sonuçları olduğu, S100 ile tanı konulan uzamış beyin hasarının ise en çok desfloran kullanılan hastalarda olduğu gözlenmiştir (Kanbak ve ark 2007).
Nitroz oksit: Nitroz oksit tek başına kullanıldığında beyin kan akımı üzerinde
etkisi minimaldir. İntravenöz ajanlar ve inhalasyon ajanlarıyla birlikte kullanıldığında ise bu etki artmaktadır.
Diğer anestezik ajanlar: Etomidat, propofol ve izofloran beyinde tam elektriksel sessizlik oluşturup, elektriksel aktivitenin metabolik maliyetini ortadan kaldırabilmektedirler. Ancak bu ajanların bazal enerji gereksinimleri üzerine etkilerinin olmadığı bilinmektedir. Üstelik etkileri üniform olmayıp beynin farklı bölgelerini değişen derecelerde etkilemektedir. Bazı hayvan çalışmalarında bu ajanların fokal iskemi durumunda beynin korunmasında etkili olduğu gösterilse de sonuçlar çelişkilidir. Souter ve arkadaşlarının yaptığı bir çalışmada ise propofolün ısınma sırasında serebral venöz oksijen saturasyonunu iyileştirmediği gösterilmiştir (Souter ve ark 1998).
1.1.4.6.4. Cerrahi ve Teknik Yöntemler
Nörolojik morbiditenin cerrahi payına baktığımız zaman en büyük katkının ateroembolizm olduğu görülmektedir. Bu problemi azaltmak için bir takım teknikler üzerinde çalışmalar yapılmıştır. Bunlar; hasta başına pozisyon verilmesi, TOE kullanımı ile hava varlığının gösterilmesi gibi yaklaşımlardır. Buna göre;
-Açık kalp ameliyatı gerektiren her türlü vaka (KABG, kapak onarımı, kapak değiştirilmesi, septal defekt onarımı, konjenital lezyonların onarılması) sonrasında intrakardiyak hava bulunmaktadır (Topol ve ark 1985, Oka ve ark 1985a, 1986b). Bu gibi durumlarda ilk miyokardiyal ejeksiyondan önce bu havanın mümkün olduğunca çıkarılması gerekmektedir. Hava kabarcıkları yüzdüklerinden dolayı yüzeye doğru çıkmaya eğilimli olmaktadır. Bu nedenle klinik pratikte serebral hava embolisini önlemek için aort klempi kaldırılmadan önce hasta baş aşağı pozisyona getirilmelidir. Bu pozisyonda iken sol ventrikül ve aorttaki mikrokabarcıkların ya çıkan aortun önündeki aspirayon hattı ile dışarı atılması ya da brakiyosefalik dolaşımdan inen aortaya doğru dolaşıma karışması beklenmektedir. Ancak Butler ve arkadaşlarının yaptığı bir çalışmada hasta baş aşağı pozisyonda iken bile mikrokabarcıkların düşük hızla da olsa kan akımı yönünde hareket etmeye devam edebileceği gösterilmiştir (DiNardo 2002).
-TCD çalışmalarında aort cross klempin kaldırılması ve ejeksiyonun yeniden başlatılmasıyla intrakranial hava embolisinin insidansının yüksek olduğu dökümente edilmiştir (Vander ve Casimir-Ahn 1991). KABG gibi kalp boşluklarının açılmadığı vakalarda da intrakardiyak havanın %10-30 arasında bulunduğu bilinmektedir (Topol ve ark 1985, Oka 1985, Oka 1986). Robicsek ve Duncan’ın yaptığı çalışmada cross
klemp süresince aortaya ve ve sol ventriküle retrograd olarak havanın girip koroner arterlere ilerlediği gösterilmiştir (Robicsek ve Duncan 1987). Araştırmacılar sol ventrikül ve aort kökündeki havanın çıkarılma çabalarının cross klemp kaldırılmadan önce rutin olmasını savunmaktadırlar (Bradley ve John 1993).
-Hava çıkarma işlemi sırasında TOE kullanılması ventriküllerde kalan hava kabarcıklarının fark edilmesi için değerli bir yöntem olarak bilinmektedir. Bu nedenle bazı yazarlar sol ventrikül ejeksiyonu başlamadan önce hava embolisi monitorizasyonu için TOE kullanımını önermektedirler (DiNardo 2002) Bu şekilde makroskopik ya da mikroskopik hava embolilerinin temizlendiğinden emin olunarak nörolojik hasarın azaltılacağı düşünülmektedir. Topal ve ark.yaptıkları bir çalışmada; kapak değişimi yapılan hastalardaki intrakardiyak mikrokabarcık oluşma insidansı ve ciddiyetinin, KABG hastalarından çok daha fazla olmamasına rağmen nörolojik sonuçlarda iki grup arasında fark olmadığı gösterilmiştir. Bu nedenle en azından bu çalışmaya göre TOE ile saptanmış intrakardiyak mikrokabarcıkların nörolojik sonuçları Belirgin olarak etkilemediği gösterilmiştir (DiNardo 2002).
-Emboli üretimini azaltmak için tavsiye edilen bir diğer teknik de arteriyel line mikrofiltrasyonu ve membran tip oksijenaratörlerin kullanımının öncelikli olarak tercih edilmesidir (Blauth ve ark 1988). Padajachee ve arkadaşlarının TCD kullanılarak serebral embolilerin tanısını koyduğu çalışmalarında, serebral embolilerin bubble oksijenaratör kullanılan hastaların hepsinde oluştuğu, membran oksijenaratörler kullanılan hiçbir hastada oluşmadığı gösterilmiştir. Buna göre membran oksijenatörlerin daha az trombosit ve fibrin embolisi oluşturduğunu ileri sürmektedirler. Bubble oksijenatörlerden mikrokabarcık salınımını artıran faktörler ise;
-Gaz akımının kan akımına doğru olan oranının artırılması -Oksijenatördeki kan düzeyinin düşük olması
-Oksijenatörün çalkalanması olarak bilinmektedir (Paç 2004).
1.2. Kardiyopulmoner Bypass (KPB)
Kalp cerrahisinin uygun bir şekilde yapılabilmesi için ameliyat sahasının kansız ve hareketsiz olması gerekmektedir. Bu durumda kalbin pompalama ve akciğerlerin oksijenleme görevini bir makinenin yapması gerekmektedir. Bu makine; kana oksijen verebilmeli, karbondioksiti kandan temizleyebilmeli ve tüm organları
bu oksijenlenmiş kanla yeterli düzeyde perfüze edebilmelidir. İşte kalp cerrahisi sırasında bu işleri yapan makinaya kalp akciğer makinası denilmektedir. Kalp ile akciğerlerin devre dışı bırakılıp, dolaşımın kalp akciğer makinası ile sürdürüldüğü bu olaya ekstrakorporeal dolaşım; yapılan bu işleme ise kardiyopulmoner bypass (KPB) denilmektedir.
1.2.1. Tarihçe
Kardiyopulmoner bypass cihazının 1950’lerde kullanıma girmesiyle kalp kapağı değişimi, koroner arter bypass greftleme (KABG) cerrahisi, kalp anomalilerinin rekonstrüksiyonu ve kalp transplantasyonu gibi kardiyak girişimler yaygın olarak uygulanmaya başlamıştır. 1951 yılında Minnesota da Clarence Dennis ilk kez kalp akciğer makinesini Atrial Septal Defekt (ASD) kapatılması amacıyla klinikte kullanmıştır. 1953 yılında John Gibbon tarafından mitral stenozlu genç bir kadının cerrahi tedavisinde KPB kullanılmıştır. 1955 yılında Denton Cooley ve DeBakey açık kalp ameliyatı yapma kararı almıştır. 1956 yılında pekçok grup açık kalp ameliyat programlarını başlatmışlardır. 1960'ların başlarında Dr. Starr ve Dr. Edwards tarafından prostetik valv cerrahisi başarıyla tamamlanmıştır.
1.2.2. KPB Bileşenleri ve KPB Özellikleri
Kalp akciğer makinesinin hastadan gelen kanın depolandığı rezervuar, kanın karbondioksitten arındırılıp oksijenlendirildiği oksijenatör, kanı hastaya pompalayan pompa ve kanın ısısını artırıp azaltmayı sağlayan ısı değiştirici bileşenleri bulunmaktadır.
KPB cerrahisinde süperior vena cava ve inferior vena cavaya konulan iki kanül veya sağ atriyuma konulan tek kanül aracılığıyla yerçekimi etkisiyle venöz rezervuarda toplanan kan, pompa başlığı sayesinde oksijenatöre yönlendirilmekte ve soğutularak veya ısıtılarak, bir filtreden geçirilerek genelde asendan aortaya konulan bir arteriyal kanül ile hastaya geri verilmektedir. Aortaya pompalanan kanın kalbe de gitmesini önlemek için, aortanın, aort kanülüyle kalp arasındaki bölümüne, aortayı tamamen tıkayan kros klemp konulmaktadır. Aortanın, kros klemp ile kalp arasında kalan bölümüne kardiyopleji kanülü yerleştirilerek buradan kalbi durdurucu
dağılmaktadır. Bu şekilde vücudun ihtiyacı olan kan dolaşımı sağlanırken, kansız ve durmuş olan kalpte ameliyat gerçekleştirilmektedir.
Kalbe gelen tüm sistemik venöz kanın tutulması ve KPB devresinde toplanarak daha sonra hastaya dönmesine total KPB, kalbe dönen sistemik venöz kanın sadece bir kısmının tutulması ve KPB devresinde toplanmasına ise parsiyel
KPB denilmektedir. Parsiyel KPB sırasında sistemik venöz dönüşün kalan kısmı sağ
atriuma dönmektedir. Parsiyel KPB’ın sorunsuz olabilmesi için kalbin atıyor ve akciğerlerin ventile ediliyor olması gerekmektedir(Kaplan 1993).
Diğer önemli bir nokta da; kanın, kalp akciğer makinesi ve bağlantı hortumlarının pıhtılaşmayı tetikleyici yapay yüzeyleri ile temas edeceği için antikoagülasyon amaçlı heparin kullanılmaktadır. Yetersiz antikoagülasyonun en dramatik sonucu kanülasyon sırasında kanüllerde ve KPB başladığında oksijenatörde belirgin trombüs oluşumudur. Hayati tehlike oluşturan diğer bir sonuç da KPB sona erdikten sonra belirginleşen yaygın damar içi pıhtılaşmadır (Dinardo 2002).
1.2.2.1. Oksijenatörler
Oksijenatörler KPB devresinde akciğerlerin gaz değişim görevini yerine getirmek için kullanılmaktadırlar. Günümüzde kulllanılan oksijenatörler bubble ve membran tip olmak üzere iki çeşittir.
Membran Oksijenatör: Direk bir kan ve gaz teması olmadan ince bir membran boyunca oksijen sunumunu ve karbondioksit eliminasyonu sağlanmaktadır. Genellikle mikrodelikli ve solid olmak üzere iki tipi bulunmaktadır. Membran boyunca O2 ve CO2 değişimini etkileyen faktörler O2 ve CO2 gazlarının kandaki eriyebilirliği ve difüzyon yeteneği ile her iki taraftaki oksijenin parsiyel basıncı olarak bilinmektedir (Dinardo 2002, Paç 2004).
Hava Kabarcıklı (Bubble) Oksijenatör: Gaz kabarcığı ile kan arasındaki yüzey yoluyla kana oksijen verip kandan karbondioksit alarak çalışmaktadırlar. Gaz yüzeyinin sürekli olarak kan ile temas halinde olması fizyolojik değildir ve bu nedenle kan travması membran oksijenatöre göre daha sık olmaktadır (Paç 2004). Bu tip oksijenatörün kolay kurulması ve ucuz olması en belirgin avantajları arasındadır (Dinardo 2002).
1.2.2.2. Pompalar
Günümüzde modern KPB cihazlarında iki tip pompa kullanılmaktdır. Bunlar döner (roller) ve sentrifugal pompalar olarak adlandırılmaktadır. Ventriküler pompalar ise sıklıkla asist device’larda tercih edilmektedir.
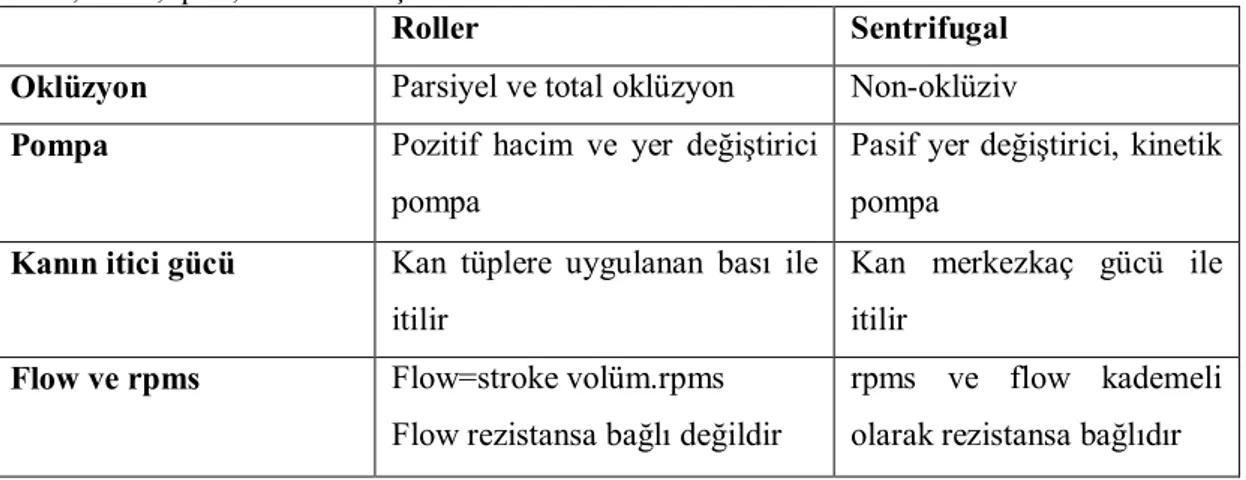
Döner (Roller) Pompa: DeBakey tarafından geliştirilen ve açık kalp cerrahisinde en sık tercih edilen pompa türü olarak bilinmektedir (Dinardo 2002, Paç 2004). Kullanımı kolay ve güvenlidir, ayrıca maliyet olarak uygun olduğu bilinmektedir. Akım hızı tüplerin çapına, bası uygulanan yolun uzunluğuna ve pompa dönüş hızına bağlı olarak değişmektedir. Bu nedenle düzenli aralıklarla kalibrasyonu yapılmalıdır (Paç 2004) (Tablo:1.3).
Sentrifugal Pompa: Sentrifugal pompa kinetik bir pompa olarak bilinmektedir ve yapay girdap mantığı ile çalışmaktadır. Kan, pompadaki girdap tarafından oluşturulan merkezkaç gücü ile pompa boyunca ilerletilmektedir bu sebeple roller pompalara göre kan bileşenlerine daha az zarar verdiği bilinmektedir (Dinardo 2002) (Tablo:1.3).
Tablo 1.3: Sentrifügal ve klasik roller pompaların başlıca farkları (Paç 2004).
Flow; Akım, rpms; dakika dönüş hızı
Roller Sentrifugal
Oklüzyon Parsiyel ve total oklüzyon Non-oklüziv
Pompa Pozitif hacim ve yer değiştirici
pompa
Pasif yer değiştirici, kinetik pompa
Kanın itici gücü Kan tüplere uygulanan bası ile itilir
Kan merkezkaç gücü ile itilir
Flow ve rpms Flow=stroke volüm.rpms
Flow rezistansa bağlı değildir
rpms ve flow kademeli olarak rezistansa bağlıdır
Ventriküler Pompa: Daha güçlü olmakla beraber hantal ve maaliyetleri yüksek olarak bilinmektedir. Bu sebeple rutin olarak kullanımda tercih edilmemektedirler. Sıklıkla Pulsatil Assist Device’larda kullanılmaktadırlar.
1.2.2.3. Pulsatil ve Non-Pulsatil KPB
KPB kanın birçok özelliğini (viskosite) ve damarın özelliğini (arteriyel tonus, boyut, şekil) etkilemektedir. Bunun sonucunda hemodilüsyon, hipotermi, kırmızı hücre deformasyonu ve akış dağılımı etkilenmektedir.
Pulsatil ve non-pulsatil akım arasındaki temel fark her ikisinin de bir hidrolik enerji gerektirdiği ve pulsatil akım uygulandığı zaman kanın bu enerji ile taşınıyor olmasıdır. Bu ekstra kinetik enerjinin kırmızı hücrelerin geçişini sağladığı, kapiller perfüzyonu yükselttiği ve lenfatik fonksiyonlara yardımcı olduğu bilinmektedir (Mavroudis 1978). Pulsatil akımdaki hidrolik güç ani basınç ve ani akış üretimi sağlamaktadır. Literatürlerde bu iki akımın karşılaştırılması hakkında birçok çalışma bulunmaktadır ancak bu çalışmalarda klinik sonuçlar arasında anlamlı bir fark bulunmamaktadır (Edmunds 1982, Hickey ve ark 1983).
Spesifik şartlarda pulsatil akımın doku perfüzyonunu ve endokrin, anatomik durumun non-pulsatil akıma göre daha iyi sunulduğuna inanılmaktadır (Bradley ve John 1993).
1.2.2.4. KPB Sürecindeki Sistemik Kan Basıncı
KPB’daki ortalama arteriyel basınç (OAB), pompa akımı ve sistemik vasküler direnç (SVR) arasındaki ilişki ile belirlenmektedir.
KPB’da santral venöz basınç, yeterli venöz drenaj varsa sıfırdır ve 80 rakamı da değişim faktörü olarak kabul edilmektedir. Buna göre belli bir SVR için OAB pompa akımı değiştirilerek anlık olarak artırılıp ve azaltılabilmektedir.
SVR= [ ( OAB – SVP ) X 80 ] / pompa akım hızı
KPB’daki ortalama arteriyel basıncın güvenli alt sınırı tüm organları düşünerek hesaplanmaktadır. KPB başladıktan sonra serebrovasküler hastalığı olmayan hastalarda 30 mmHg’dan daha yüksek bir OAB kabul edilebilir bir sınır olmaktadır. Serebrovasküler bir hastalığı olduğu bilinen hastalarda ise 50 mm Hg’nın üzerinde bir OAB gerekmektedir. Genellikle OAB’nın serebral otoregülasyon sınırları içinde kalınması ve koroner dışı kollateral kan akımının azaltılması için 70 mm Hg’nın altında olması istenmektedir (DiNardo 2002).
1.2.2.5. KPB Sürecindeki Perfüzyon Basıncı
KPB’daki sistemik kan akımı, perfüzyonistin arteriyel pompa başını çevirme hızıyla belirlenmektedir ve anlık değişebilmektedir. Esas amaç sistemik, özellikle de serebral oksijen sunumunu sağlamak olmasına rağmen KPB’daki optimal akım hızları kesin olarak tanımlanmamıştır (Dinardo 2002).
KPB sırasında organ perfüzyonu; belli miktarlardaki kan volümünün belli bir basınçla verilmesiyle gerçekleşmektedir. Değişik sıcaklıklarda vücudun gereksinim duyduğu debi miktarı cerrahi yapılan sıcaklığın düşmesiyle beraber azalmaktadır.
Hafif ve orta derecede sistemik hipotermi sırasında sıklıkla 2-2.4 L/dk/m2 akımlar kullanılmaktadır. Bununla beraber orta derecede sistemik hipotermi uygulandığında 1.2 L/dk/m2 kadar düşük akımlarda bile tüm vücutta oksijen sunumunun bozulmadığı gösterilmiştir (Fox ve ark 1982, Hickey ve Hoar P 1983, DiNardo J 2002).
Ayrıca somatosensoriyel sinir iletimi bozulmamış olmasına rağmen orta derecede sistemik hipotermi kullanıldığında ve pompa akımı 0.5 L/dk/m2’ye düşüldükten 15 dakika sonra belirgin serebral laktat birikiminin geliştiğini gösteren çalışmalar bulunmaktadır (Rebeyka ve ark 1987).
1.2.2.6. Hemodilüsyon ve Hemoliz
KPB’da hastanın kanı prime solüsyonla seyreltildiği için hemodilüsyon meydana gelmektedir. Hipotermi varlığında viskozitede artış görülmektedir ancak hemodilüsyonla beraber eritrosit kütlesiyle birlikte viskozite de azalmaktadır. Sistemik hipotermi ve hemodilüsyon birlikte olduğunda ise yüksek periferik vasküler dirence bağlı yüksek hat basıncı oluşmadan mikrovasküler akım sağlanmaktadır (DiNardo 2002).
KPB’da hemodilüsyon ile kırmızı kan hücre kütlesi ve oksijen taşıma kapasitesi azaltılarak oksijen sunumu azaltılmaktadır. Hemotokrit düzeyi %20’nin altında olan normovolemik hemodilüsyon varlığında akım hızı yüksek olmasına rağmen total vücut oksijen tüketiminin azaldığı gösterilmiştir. Bu nedenle sistemik hipotermi ve %20-25 düzeyindeki hemotokrit düzeyleri ile vücut oksijen sunumu bozulmadan hemodilüsyonun maksimum avantajı sağlanmış olmaktadır (DiNardo 2002).