T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI
ANABİLİM DALI Prof. Dr. Savaş KANSOY
PERİVENTRİKÜLER LÖKOMALAZİLİ OLGULARDA
NÖROLOJİK VE OFTALMOLOJİK BULGULAR İLE
DİFÜZYON TENSÖR MANYETİK REZONANS
BULGULARININ KARŞILAŞTIRILMASI
ÇOCUK SAĞLIĞI VE HASTALIKLARI A.B.D.
UZMANLIK TEZİ
Dr. Yıldız EKEMEN KELEŞ
Tez Yöneticisi
Prof. Dr. Sarenur GÖKBEN
ii
ÖNSÖZ
Çocuk Sağlığı ve Hastalıkları uzmanlık eğitimim süresince bilgi ve deneyimleri ile eğitimime katkıda bulunan Anabilim Dalı başkanı Prof. Dr. Savaş KANSOY önderliğinde bütün Çocuk Sağlığı ve Hastalıkları Anabilim Dalı öğretim üyelerine, tez konusunun belirlenmesi ve yönlendirmesi, tezimin hazırlanmasında bana yol gösteren ve her aşamasında desteğini esirgemeyen, kendime disiplinli kişiliği ve engin bilgisini örnek aldığım danışmanım Prof. Dr. Sarenur Gökben’e çok teşekkür ederim. Bunun yanında tez yapımında yardımcı olan ve güler yüzü, yardımseverliği için Prof. Dr. Gül Serdaroğlu’na, göz bölümünden birlikte çalıştığım ve hastaların göz muayenelerini yapan ve çok yardımcı olan Uzm. Dr. Elif DEMİRKILINÇ BİLER’ e yine göz bölümünden tüm yardımlarını esirgemeyen Prof. Dr. Filiz AFRASHİ’ye, radyoloji bölümünden tez yapımında yardımları için çok minnettar olduğum Prof. Dr. Cem ÇALLI’ya, hasta seçiminde destek olan ve yeni ufuklar gösteren yenidoğan bölümündeki Prof. Dr. Nilgün KÜLTÜRSAY’a, Prof. Dr. Mehmet YALAZ’a, Doç. Dr. Özge ALTUN KÖROĞLU’na, Uzm. Dr. Sema TANRIVERDİ’ye, track-based yöntemi ile tensör değerlendirmesi yapan Arş. Görev. Onur ÖZYURT’a, nöroradyolojiden Uzm. Dr. Cenk ERASLAN’a birlikte çalışmaktan keyif aldığım ve çok desteklerini gördüğüm ancak isimlerini tek tek sayamadığım tüm diğer bilimdalı öğretim üyesi, uzman, asistan ve çalışanlarına sonsuz teşekkürler.
Çocuk Sağlığı ve Hastalıkları eğitimi çok yoğun geçmektedir. Bu süreç kendi sıkıntılarının yanında insana inanılmaz deneyimler katmaktadır. Tüm bu yıllar süresince mutluluğumu arttıran, her gün hastaneye hevesle gelmem için sebep oluşturan, derin mutsuzluklarımda varlıkları ile sıkıntılarımı azaltan dostlarım Dr. Gonca GÖKMEN, Dr. Seyran BULUT, Dr. Özlem ÇAM, Dr. Selime ÖZEN, Uzm. Dr. Şule GÖKÇE ve Uzm. Dr. Nurşen CİĞERCİ’ye çok teşekkür ederim.
Tezimin uygulanması esnasında içten yardımları için istatistiksel analizleri yapan Yar. Doç. Dr. Timur KÖSE’ye ve tez konusunda özverilerinden dolayı tez hastalarım ve ailelerine minnettarım.
iii
Araştırmamıza destek ve katkılarından dolayı Ege Üniversitesi Bilimsel Araştırma Projeleri çalışanlarına çok teşekkür ederim.
Hayatta en kıymetli varlıklarım aileme ve eşime çok teşekkür ederim. Bugünlere gelmeme vesile olan ve çok sevdiğim babama sonsuz teşekkürler.
Dr. Yıldız EKEMEN KELEŞ Mart-2014, İzmir
Bu çalışma EÜTF Araştırma Projeleri Alt Komisyonu tarafından desteklenmiştir.
iv
İÇİNDEKİLER
KISALTMALAR ... v TABLOLAR ... vi ŞEKİLLER ... vii RESİMLER ... viii 1. GİRİŞ VE AMAÇ ... 1 2. GENEL BİLGİLER ... 2 2.1. Periventriküler Lökomalazi ... 2 2.1.1. Giriş ve Tanım ... 2 2.1.2. Görülme Sıklığı ... 3 2.2. Patoloji ... 3 2.3. Fizyopatoloji ... 72.3.1. Hipoksik ve İskemik Hasarlanma ... 7
2.3.2. Sistemik Enfeksiyon/ Enflamasyon ... 11
2.3.3 Preoligodendrositlerin Hasarlanması ... 12 2.4. Klinik ... 13 2.5. PVL: Görsel Bozukluk ... 16 2.6. PVL: Radyolojik Görüntülemeler ... 18 2.6.1. Ultrasonografi Bulguları ... 18 2.6.2. MRG Bulguları ... 19
2.6.2.1. Difüzyon Tensör Manyetik Rezonans Görüntüleme.... 23
2.7. Tedavi Modelleri ... 31 3. GEREÇ VE YÖNTEM ... 33 4. BULGULAR ... 39 5.TARTIŞMA ... 48 6.SONUÇLAR ... 71 7. KAYNAKLAR ... 76 8.TÜRKÇE ÖZET ... 95 9.SUMMARY ... 98 10. EKLER ... 101
EK 1:Çocuğun Görme İşlevi İçin Egzersizler ... 101
EK-2: Olguların Demografik Verileri ... 102
EK-3: 3. ve 6. Ay Nörolojik Değerlendirme ... 103
v
KISALTMALAR
ADC ATP BOS ÇDDA D DTI DTMRG DTR FA GY H-İ HİE İVK KBB MRG MRS Na Na K ATPaz NMDA NMRG R PKY Pre-OLD ROİ ROP PVL SF SGH SKA T TBİSS USG VEP V-P şant: Görünen Difüzyon Katsayısı : Adenozin Trifosfat
: Beyin Omurilik Sıvısı : Çok Düşük Doğum Ağırlığı : Difüzyon Katsayısı
: Diffusion Tensor Imaging
: Difüzyon Tensör Manyetik Rezonans Görüntüleme : Derin Tendon Refleksi
: Fraksiyonel Anizotropi : Gestasyonel yaş : Hipoksi-İskemi
: Hipoksik İskemik Ensefalopati : İntraventriküler Kanama
: Kan Beyin Bariyeri
: Manyetik Rezonans Görüntüleme : Manyetik Rezonans Spektroskopi : Sodyum
: Sodyum Potasyum ATPaz : N-metil D-aspartat Reseptörü
: Nükleer Manyetik Rezonans Görüntüleme : Gaussian Rastgele Değişkeni
: Postkonsepsiyonel Yaş : Preoligodendrosit
: ‘Region of interest’ ilgilenilen bölge : Prematüre Retinopatisi
: Periventriküler Lökomalazi : Serebral Felç
: Serebral Görsel Hasarlanma : Serebral Kan Akımı
: Zaman
: Tract-based Spatial Statistic : Ultrasonografi
: Görsel Uyarılmış Potansiyeller : Ventrikülo-peritoneal Şant
vi
TABLOLAR
Tablo 1: Periventriküler Lökomalazinin Ultrasonografik Dereceleri ... 19
Tablo 2: Olguların Demografik Özellikleri ... 40
Tablo 3: Olguların Perinatal ve Postnatal Özellikleri ... 41
Tablo 4: Olguların Üçüncü ve Altıncı Ay Psikomotor ve Motor Gelişimi ile Altıncı Ay Kraniyal MRG Sonuçlarının Karşılaştırılması ... 43 Tablo 5: Olguların Free - hand ROİ Yöntemi İle Ortamala FA Değerleri ... 45
Tablo 6: Olguların PKY Üçüncü ve Altıncı Ay Oftalmolojik Değerlendirmeleri ve VEP Sonuçları Verilmiştir ... 47
vii
ŞEKİLLER
Şekil 1: Fokal ve Diffüz Periventriküler Lökomalazi ... 5
Şekil 2: Diffüz Periventriküler Lökomalazide Preoligodendrosit Kaybının Yol Açtığı Sonuçlar ... 7
Şekil 3: Hipoksik-İskemik Hasarlanmanın Fizyopatolojisi: İskemik Faz (Faz 1) ... 9
Şekil 4: Hipoksik- İskemik Hasarın Fizyopatolojisi: Reperfüzyon Fazı (Faz 2) ... 11
Şekil 5: Koronal Kesitte Primer Motor Korteks Görülmektedir ... 15
Şekil 6: Beyindeki İzotropik ve Anizotropik Yayılım ... 25
Şekil 7: Fraksiyonel Anizotropi (FA) Hesaplanması ... 26
viii
RESİMLER
Resim 1: Sekiz Numaralı Olgunun Manyetik Rezonans Görüntülemesi ... 21
Resim 2: Bir ve Üç Numaralı Olguların T2 aksiyel Manyetik Rezonans
Görüntülemesi... 22 Resim 3: Transversal Fraksiyonel Anizotropi Haritası, Renkli Tensör Haritası
ve Bazal Nükleusların Görüntülenmiş Hali ... 26 Resim 4: Traktografi İle Sensörimotor Liflerin Görünümü ... 29
Resim 5: İki Yaşında Sağ Hemiparezili Kız Olgunun DTMRG Görüntüsü .... 29 Resim 6: Periventriküler Lökomalazili Olguların Ailelerine Verilen
Eğitim materyalleri ... 35 Resim 7: Fraksiyonel Anizotropi İskeleti... 44
Resim 8: Free- hand ROİ (Region of İnterest) Yöntemi İle FA
1
1. GİRİŞ VE AMAÇ
Periventriküler lökomalazi (PVL), özellikle prematüre bebekte görülen iskemik beyaz cevher hasarlanması sonucu ortaya çıkan yaşam kalitesinde bozulma ve ağır ekonomik sorunlara yol açan bir durumdur. Günümüzde, prematüre ve çok düşük doğum ağırlıklı (ÇDDA) bebeklerin yaşama şanslarındaki artışa paralel olarak PVL görülme sıklığı da artmaktadır. Manyetik Rezonans görüntüleme (MRG) gibi duyarlı tetkiklerin geliştirilmesiyle PVL saptanma insidansı giderek artmaktadır. Tüm bu gelişmelere rağmen, tüm olgular klasik radyolojik tetkiklerle saptanamamaktadır. Bazı olgulara okul çağında, nörokognitif ve davranışsal sorunlara yol açtığında tanı konulabilir.
Periventriküler lökomalazinin patogenezi tam olarak bilinmemektedir. Birçok faktörün etkili olduğu düşünülmektedir. Çeşitli nedenler ve stres faktörlerine bağlı olarak gelişen iskemi, hipoperfüzyon ve hipoksinin olayı başlattığı düşünülmektedir. İskemi sonrasında reperfüze olan bu alanlarda hasarlanma meydana gelir. Periventriküler alanda bulunan oligodendrosit öncü hücrelerdeki yıkım sonucu, aksonal hasarlanma ve nekroz meydana gelmektedir. Periventriküler alanın görme sinir lifleriyle komşuluğundan dolayı PVL’li bebeklerde göz sorunlarına sık rastlanılır. Bu olgular, prematüre retinopatisi açısından birçok merkezde değerlendirilmesine karşın görme yolları ve kortikal görme algısı açısından rutin olarak değerlendirilmemektedirler.
Difüzyon Tensör Manyetik Rezonans görüntüleme (DTMRG), su molekülünün difüzyonu ile karakterize in vivo bir MRG tekniğidir. İnsan beynindeki beyaz cevher yapısını görselleştirmeyi ve sinir liflerinin görülmesini sağlar. Bu teknik, özellikle PVL’li olgularda yeni kullanıma girmiş olup beyindeki hasarlanmanın boyutu hakkında daha ayrıntılı bilgi vermektedir.
Bu çalışmada, PVL’li hastalarda nörolojik, oftalmolojik bulgular ile DTMRG bulgularının karşılaştırılması amaçlandı. Ayrıca DTMRG bulgularının PVL’li hastalarda nörolojik ve oftalmolojik prognoza katkısının olup olmadığı araştırıldı.
2
2. GENEL BİLGİLER
2.1 Periventriküler Lökomalazi
2.1.1 Giriş ve tanım
Prematüre doğumlar yüksek morbidite ve mortalite nedenidir ve prematüre bebeklerin yaklaşık %12,5’u kaybedilirler (1). Yaşayan infantlarda birçok komplikasyon gelişme ihtimali vardır. Hipoksik-iskemik ensefalopati (HİE), term ve prematüre bebeklerde serebral hasarlanma ve nörolojik sekellerin en önemli nedenidir (2). Periventriküler lökomalazi, beyaz cevherin zedelenmesiyle oluşur ve prematüre bebeklerde serebral felcin (SF) en önemli nedenidir (3).
İlk kez Little (4), 1853 yılında prematürite ve doğum asfiksisine bağlı spastik diplejiyi tanımlamıştır. Virchow (4), on dört yıl sonra postmortem incelemelerde, ventriküllere komşu alanlarda hasarlanma olduğunu ve bu alanlarda enfeksiyon ve enflamasyonu göstermiş ve bu duruma ‘konjenital ensefalomiyelitis’ adını vermiştir. Bu durumun, birçok olguda dipleji ve mental retardasyonun nedeni olduğunu ileri sürmüştür. Parrot (3), immatür beyaz cevherin dolaşım ve beslenme yönünden hassas olduğunu göstermiştir. Ayrıca iskeminin majör rol oynadığını belirtmiştir.
Banker ve Larroche (5) ilk defa, 1969 yılında ‘periventriküler lökomalazi’ terimini kullanmışlar ve beyaz cevherde oluşan bir dizi histolojik değişikliği tanımlamışlardır. Bu değişikliklerin, koagülasyon nekrozu ve likefaksiyon ile başlayıp; makrofaj aktivitesinde artış ve iki hafta sonra kistik kavitasyonla sonlandığını göstermişlerdir.
Periventriküler lökomalazi için predispozan faktörler, prenatal dönemde ilk trimesterde kanama, maternal idrar yolu enfeksiyonu, erken membran rüptürüdür (6). Ayrıca PVL‘li yenidoğanların annelerinde koryoamniyonit sıklığında artış saptanmıştır (7, 8). Perinatal faktörler ise stabil olmayan fetal kardiyak atım, uzamış doğum eylemi, mekonyum aspirasyonu, asidoz (Ph<7.2), düşük apgar skoru olarak sayılabilir. Postnatal faktörler ise uzun
3
süren inotropik destek, mekanik ventilatör ve oksijen gereksinimi, sistemik hipotansiyon ve sepsistir (8).
2.1.2 Görülme Sıklığı
Tüm doğumların yaklaşık %2’si 32 haftanın altında olmaktadır ve bunların yaklaşık %1,5’i çok düşük doğum ağırlıklıdır (ÇDDA, <1500 gram) (9, 10). Çok düşük doğum ağırlıklı bebeklerin %90’ı yaşatılabilmekte ve bunların da yaklaşık %5 - 10’unda SF gelişmektedir (10). Ayrıca yaşayan prematüre bebeklerin %25 - 50’sinde, ileriki yaşamlarında kognitif, sosyal ve davranışsal problemler oluşmaktadır. Tanı zorluğu nedeniyle geçmiş yıllardaki PVL insidansı, ultrasonografik yöntemlerle %5 - 15 arasında değişmekteydi (8, 11). Manyetik rezonans görüntüleme tekniğinin geliştirilmesiyle PVL insidansı %22’lere kadar çıkmıştır (11). Bunun yanında otopsi raporları ÇDDA bebeklerin %20 ile %75’inde PVL olduğunu göstermektedir (8). Doğum haftası ne kadar küçükse PVL insidansı o kadar artmaktadır (11). Fakat gestasyonel yaşı daha büyük ve term bebeklerde de PVL tanımlanmıştır (12). Yapılan çalışmalarda, ultrasonografi (USG) ile kolayca saptanan kistik PVL insidansının giderek azaldığı saptanmıştır. Klinik açıdan daha önemli olan diffüz PVL’nin gerçek insidansı bilinmemektedir (10, 13).
İntraventriküler kanama ve komplikasyonlarının insidansının netleşmesi ile PVL, prematüre bebeklerde en önemli nöropatolojik durum haline gelmiştir. Ayrıca intraventriküler hemorajili olguların yaklaşık %15‘inde periventriküler beyaz cevherde lezyon olmaktadır (14).
2.2 Patoloji
Banker ve Larroche (15), 1962 yılında ilk olarak periventriküler lökomalazide nöropatolojik bulguları bildirmişlerdir. Periventriküler alandaki kortikospinal liflerde aksonal kesintiye neden olan ve optik radyasyonu etkileyen küçük fokal nekroz alanları tanımlamışlardır.
4
Serebral hasarlanan bölge gestasyonel yaşa göre değişir. Prematüre bebeklerde lezyon beyaz cevher ağırlıklı iken, term bebeklerde gri cevher ağırlıklıdır. Bu farklılık serebral vasküler gelişim ile ilişkilidir (16). Term bebeklerde zedelenme ‘sınır bölgelerinde’ meydana gelmekte ve lezyon kortikal gri cevher ve bitişiğindeki subkortikal beyaz cevherde oluşmaktadır (16). Bu sınır bölgeleri, ön ve orta serebral arter kesişme yeri ile orta ve arka serebral arter kesişme yerlerinde yer alır. Bu bölgelerde anastomozlar yoktur ve kan akımı azdır. Karakteristik nöropatolojik lezyon, kortikal laminar nekroz ve subkortikal lökomalazi şeklindedir. Bu alanlardaki lezyonlar genellikle kistik ve ayrıktır. Genellikle frontal ve paryeto-oksipital bölgede meydana gelmektedir. Bu lezyonlarda, akut fazda USG bilgileri yetersiz kalır ve MRG en iyi seçeneği oluşturur (14, 16, 17).
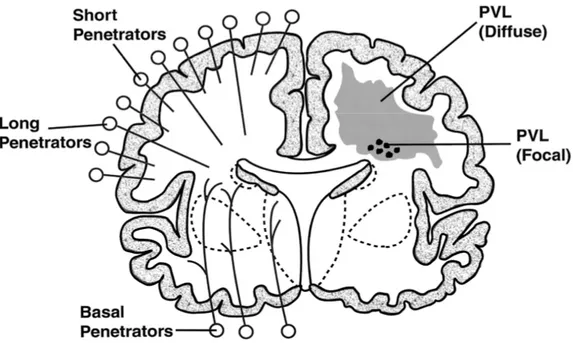
Patolojik olarak PVL fokal ve diffüz olmak üzere iki forma ayrılabilir. Fokal form daha az sıklıkla görülmekle beraber, ağır hipoksi ve iskemi neticesinde gerçekleşmektedir. Fokal form derin beyaz cevherde, uzun penetran arterlerin terminal bölümlerinde oluşmaktadır. Prematürelerde; uzun penetran arterlerin distal kısımları tam gelişmemiş olduğundan serebral kan akımındaki (SKA) azalma, bu bölgede ağır iskemiye neden olur (18). Makro ya da mikroskobik nekrotik fokuslar nedeniyle tüm hücresel elemanlarda yıkım ve aksonal yapım bölgesinde duraklama ile sonuçlanmaktadır (8). Lezyon genellikle trigon, oksipital horn ve optik radyasyonu içeren paryeto-oksipital beyaz cevherdedir (8). Tipik histolojik bulgular, koagülasyon nekrozu ve bunu izleyen mikroglia aktivasyonu, astrosit infiltrasyonudur. Bir hafta sonra nekrotik doku organize olur. Nekrotik doku temizlendiğinde periventriküler kistler oluşur. Haftalar boyunca oluşan multiple kistler ultrasonografik olarak da görülebilir (10, 19). Bazı kistler solid skarlara dönüşürken ağır hasarlarda kavitasyon kalıcıdır. Son yıllarda kistik PVL insidansı giderek azalma göstermiştir (10). Nöropatolojik çalışmalar, fokal nekrotik lezyonların SF ile korele olduğunu desteklemektedir (Şekil 1) (14).
5
Şekil 1: Fokal ve diffüz periventriküler lökomalazi. Koronal kesitlerde bir
hemisferde fokal ve diffüz periventriküler lökomalazi şematize edilmiştir. Diğer hemisferde ise serebral vaskülarizasyon görülmektedir.
*Volpe JJ. Neurobiology of Periventricular Leukomalacia in the Infant. Ped Reseach 2001; 5: 50 553-562.
Diffüz PVL, sıklıkla hafif HİE sonucu gelişir. Uzun penetran arterlerin sınır alanlarında ve kısa penetran arterlerin terminal kısımlarındaki iskemiye bağlı olarak diffüz astrogliozis ve mikrogliozis gelişir. Diffüz PVL’de, preoligodendrositlerde (Pre-OLD) özgül hasarlanma ve kayıp oluşur (10, 18, 20, 21). Bunun sonucu yaygın miyelinizasyon gecikmesi görülür (8, 18). Bu tip hasarlanmada, apopitotik mekanizmaların daha fazla rol aldığı düşünülmektedir (18). Tüm PVL’li olguların %90’nı diffüz tip PVL’dir. Genellikle lezyonlarda fokal ve diffüz PVL beraber bulunurlar. Diffüz PVL’de fokal nekrotik lezyonlar mikroskobik boyuttadır (1 - 2 mm ya da daha küçük) ve kistler yerine glial skarlar oluşmaktadır (10). Diffüz PVL USG ile saptanamaz ve MRG ile spesifik diffüz periventriküler sinyal artışı görülmeyebilir (22). Bu grup PVL hastaları, okul çağlarına geldiklerinde %25 - 50 oranında psikososyal bozukluk görülmektedir (10, 18). Diffüz PVL’de HİE’nin oligodendrositleri ve aksonları bir arada nasıl etkilediği kesin değildir. Bunun yanında fokal PVL’de lezyonların temel özelliği, lokal aksonal
6
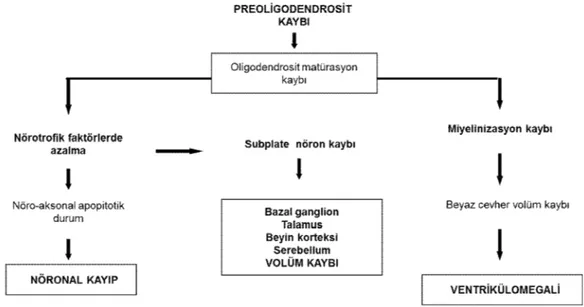
zedelenme oluşudur (23, 24). Diffüz PVL’de ise atlamalı bölümler halinde aksonal hasarlanma olduğu düşünülmektedir (25). Yeni yapılan bir çalışmada Haynes ve arkadaşları (26), diffüz PVL’de yaygın aksonal hasarlanmayı volümetrik MRG ile uzun dönem izlemde göstermişlerdir. Aksonal yıkımın nedeni kesin olmamakla beraber, oligodendrosit hasarına ikincil olabileceği düşünülmektedir. Oligodendrosit öncüleri ile hem miyelin kılıf oluşumu sağlanmakta hem de trofik faktörler aracılığıyla aksonların güçlü ve canlı kalmaları sağlanmaktadır (27). Nörotrofik faktörlerin azalması, aksonal dejenerasyona yol açmakta, antegrad ve retrograd yolla trans-sinaptik etkilerle, kortikal ve talamik projeksiyonu bozarak serebral korteks ve talamusta volüm kaybına yol açmaktadır (28). Aksonal değişme asıl olarak ‘subplate nöronları’ (talamus ve beyin gelişimde rol oynayan nöron grubu) etkilemektedir. Subplate nöronlar, beyaz cevherde yer alan ve 24 - 32 gestasyonel haftalarda pik yapan geçici nöron topluluğudur (29, 30, 31). Diffüz PVL tanısı konulan prematüre bebeklerde yapılan volümetrik MRG analizlerinde, volüm kaybı korteks ve talamus dışında, diğer beyin yapılarında özellikle serebellum ve bazal ganglionlarda saptanmıştır. Günümüzde yapılan nöropatolojik çalışmalarda, serebral volüm kaybı, nöronal kayıp ve glial eleman artışı olduğu saptanmıştır (19).
Bu çalışmalar diffüz PVL’nin karmaşık bir ‘nöronal - aksonal hastalık’ olduğunu varsaymaktadırlar (Şekil 2) (3, 19). Diffüz PVL’de aksonal hasarlanmalar özellikle Nükleer Manyetik Rezonans görüntüleme (NMRG) ve DTMRG gibi ayrıntılı nöronal liflerini gösteren tetkiklerle saptanabilir (3).
7
Şekil 2: Diffüz periventriküler lökomalazide preoligodendrosit kaybının yol açtığı
sonuçlar
2.3 Fizyopatoloji
Periventriküler lökomalazi gelişiminde üç fizyopatolojik mekanizma sorumlu tutulmaktadır:
- Hipoksik-iskemik hasarlanma,
- Sistemik enfeksiyon ve enflamasyon,
- Preoligodendrositlerin hasarlanmaya karşı hassas oluşu ve hasarlanması.
2.3.1. Hipoksik ve iskemik hasarlanma
Fizyopatolojide ana faktör SKA otoregülasyonunda bozulma olarak belirtilebilir (17). Serebral kan akımı, vazokonstriktör ve vazodilatatör humoral faktörlere göre refleks olarak ayarlanır (17, 33). Kan basıncında artış sonucu vazokonstriktör maddelerin (endotelin, tromboksan) yapımı artarak arteriolar dirençte artış olmakta ve SKA azalmakta, sistemik kan basıncında azalma sonucunda, vazodilatatör aminlerin (prostasiklin, nitrik oksit) artışı ile arteriolar
8
dirençte azalma sağlanarak SKA arttırılmaktadır. Otoregülatör mekanizmalar 32 haftadan küçük prematüre bebeklerde yeterli şekilde gelişmemiştir (10, 34). Asidoz, karbondioksit birikimi gibi nedenlerle vazoparalize olan beyin arterleri yeterli otoregülasyon gösterememektedirler (17, 33).
Otoregülasyonda meydana gelen bozulma ile SKA basınç uyarıcılarına karşı pasif kalmakta, artan kan basıncı SKA’ında artışa yol açarak hemorajik durumlara neden olmaktadır. Bunun yanı sıra düşük kan basıncı da iskemik durumlara yol açmaktadır (17, 34). İskemi; SKA’nı azaltarak beyne daha az oksijen ve glikoz sağlanmasına yol açarak glial ve nöronal hücrelerde strese yol açmaktadır. Ağır asfikside, bu durum nekrotik süreçle, orta şiddetli asfikside ise apopitozla sonuçlanmaktadır. Beyin hasarlanmasının ağırlığı, hipoksik-iskemik sürecin uzunluğuna ve şiddetine bağlı olarak artmaktadır (17). Hipoksik süre uzunluğu ve beyin hasarlanması arasındaki ilişki tam bilinmemekle beraber, hayvanlarda yapılan bir çalışmada 7 - 10 dakikalık hipoperfüzyonun beyin hasarlanmasına yol açtığı gösterilmiştir (35).
Küçük prematüre bebeklerde, kardiyak kontraktibilite ve sistemik vasküler tonus immatür olduğundan sistemik hipotansiyon sıkça görülür. Perinatal asfiksi ile doğan tüm yenidoğanlarda asidoz ve hipoksi nedeniyle myokardiyal kontraktilite bozulmuştur. Bu durum prematüre bebekleri serebral iskemiye yatkın hale getirir (17, 36).
Birçok çalışmada gösterildiği gibi hipoksik-iskemik beyin hasarlanması iki fazdan oluşmaktadır: ilk faz ‘iskemik faz’ iskemi alanında nekrotik sürecin oluşması, ikinci faz ‘reperfüzyon fazında’ ise iskemik alanın etrafında reperfüzyon oluşarak apopitotik sürecin etkili olmasıdır. İkinci faz, hipoksik-iskemik hasardan 2 ile 6 saat sonra başlamakta ve tedavi modelleri bu faza etkili olacak şekilde geliştirilmektedir (34, 37).
İskemik fazdaki en önemli olay, hipoksemiye ikincil oluşan anaerobik glikoliz ve metabolik asidozun neden olduğu ATP miktarındaki azalmadır. Bunun sonucu Na K ATPaz ve glial-ATPaz (glutamat reuptake eden enzim) ATP içeren sistemlerde fonksiyon kaybı gelişir. Bu olay nöronal depolarizasyona, hücre içi sodyum ve su artışına, sitotoksik ödeme ve/veya
9
sitokin deşarjı ile hücre lizisine yol açar. Depolarizasyon sonucunda sinaptik ve intersellüler aralıkta glutamat salınımı olur. Glial ATPaz eksikliğinde glutamat birikir. Glutamat, reseptörlerini uyararak hücre içinde proteaz ve fosfolipazları aktive ederek hücre içine masif kalsiyum girişine neden olur. Proteazlar, nöroflamanların yapısını bozarak hücre iskeletinin parçalanmasına ve hücre bütünlüğünün bozulmasına yol açarlar. Fosfolipazlar, fosfolipitleri parçalayarak hücre membran yapısını bozar ve bunun sonucunda araşidonik asitlerin salınımına neden olur. Araşidonik asitler parçalanarak vazodilatatör prostoglandinleri oluşturur ve bu durum reperfüzyon sonrası iskemiye yol açar (Şekil 3) (38).
Şekil 3: Hipoksik-iskemik hasarlanmanın fizyopatolojisi: iskemik faz (Faz 1)
* Distefano G, Praticò A D. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Italian Journal of Pediatrics 2010; 36: 63-9.
10
Reperfüzyon fazında, iskeminin düzelmesi ve hücrelere oksijen sağlanması ile aktive olan ksantin oksidaz ve siklooksijenaz enzimleri ile reaktif oksijen radikalleri oluşur. Oksijen ve asidozun etkisi ile serbest demir miktarı artarak güçlü reaktif oksijen radikali olan hidroksil radikalinin oluşumuna yol açar. Koyunlarda yapılan çalışmalarda, erken reperfüzyon fazda kullanılan deferroksaminin kortikal hücre membran stabilitesini sağladığı görülmüştür (39). Serbest radikallerin etkisi ile hücre membran lipitlerinde peroksidasyon ve iyon kanallarında disfonksiyon oluşarak hücreler arası tight junction yapısı ve KBB bozulmaktadır. Ayrıca serbest radikaller, endotelyal hücrelerden adhezin ve kemokinlerin salınımını arttırarak endoarteriyel nötrofil ve trombosit göçüne yol açarlar; böylece SKA bozulur ve ikincil iskemik nekroz gelişir (Şekil 4) (17). Mitokondriden sitokrom C salınımı sonucu, kaspaz enzim sistemi aktive olup proapopitotik genleri (bax) aktive eder ve hücre ölümü gerçekleşir. Rat serebral dokularında yapılan bir çalışmada, HİE’den sonra verilen %100 oksijen tedavisinin intranükleer ve total nükleer Bax protein seviyelerinde artışa yol açtığı, mitokondriyal ve endoplazmik retikulumda apopitotik mekanizmaları tetiklediği gösterilmiştir (40). Serebral iskemi ve reperfüzyon sırasında nitrik oksit seviyeleride giderek artmakta, ilk olarak nitrik oksit ve hidroksil radikaliyle etkileşerek peroksinitrit oluşmaktadır (41). İkincil olarak, artan nitrik oksit vazodilatasyona yol açmakta; böylece endotelyal geçirgenlik artarak, sitokin ve aktif moleküllerin intraserebral alana geçişi artmaktadır (Şekil 4) (41).
11
Şekil 4: Hipoksik – iskemik hasarın fizyopatolojisi: reperfüzyon fazı (Faz 2)
* Distefano G, Praticò A D. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Italian Journal of Pediatrics 2010; 36: 63-9.
2.3.2 Sistemik enfeksiyon/enflamasyon
Yapılan birçok çalışmada PVL ile intrauterin enfeksiyon, fetal sistemik enflamasyon ya da neonatal sistemik enfeksiyon varlığı arasında ilişki bulunmuştur. Çok düşük doğum ağırlıklı bebeklerin %65’inde bu etkenlerden biri bulunur. Nöropatolojik çalışmalarda, HİE’ye enfeksiyon/enflamasyon eşlik ettiğinde daha fazla mikrogliozis oluşturduğu gösterilmiştir (10). Bunun yanı sıra prematürelerde serebral otoregülasyon bozukluğu nedeniyle enfeksiyonlara persistan sistemik hipotansiyon da eşlik etmektedir. Böylece enfeksiyon/enflamasyon HİE’nin zararlı etkisini arttırmaktadır (10).
12 2.3.3 Preoligodendrositlerin hasarlanması
Periventriküler lökomalazide, hasarlı hücreler immatür oligodendrosit ya da pre-OLD’lerdir. Bu hücreler, aksonal miyelinizasyonunu sağlayan oligodendrositlere dönüşmektedirler (18). Gestasyonun yirmi sekizinci haftasına kadar immatür oligodendrositler total oligodendrositlerin %90’ını oluşturur ve termde bu oran %50’ye kadar geriler (10).
Preoligodendrositlerin hasarlanmasında en önemli etkiyi serbest oksijen radikalleri göstermektedir. Yapılan çalışmalarda, iskemi ve enflamasyonun hücre ölümünü başlıca hidroksi ve oksijen radikallerinin aracılığıyla geçekleştirdikleri saptanmıştır. Bu etkinin nedenleri ise başlıca: pre-OLD’lerin matür formlarına göre serbest oksijen radikaline daha duyarlı olması, pre-OLD’lerin prematüre dönemde beyaz cevherde egemen olarak bulunması ve iskemi - reperfüzyon hasarına daha duyarlı olmalarıdır. Yapılan çalışmalarda PVL tanılı ÇDDA bebeklerin, beyin omurilik sıvısında (BOS) oksijen radikallerinde artış saptanmıştır (42).
Preoligodendrositlerin hasarlanmaya duyarlı olmalarının nedeni ise, bakır, çinko ve manganez bağımlı süperoksit dismutaz ve katalaz gibi antoksidan enzimlerin yeterli miktarda olmamasıdır. Rosenberg ve arkadaşlarının (43) yapmış olduğu çalışmada kültüre edilmiş Pre-OLD’leri, hidrojen peroksit etkisinden koruyan glutatyon peroksidaz ve katalaz enzimlerinin eksik olduğu gösterilmiştir. Hidrojen peroksit, fenton reaksiyonu ile hidroksil radikaline dönüşmekte ve pre-OLD hasarını artmaktadır. Bunu yanında serbest hidrojen ve oksijen radikalleri kaspaz bağımlı apopitozu indüklemektedir. Bu radikallerin kaynağı reaktif astrosit ve mikrogliositlerdir. Diffüz PVL’de bu hücrelerin artışı olduğu gösterilmiştir (10).
Bunun yanında birçok mekanizma ile hücre içi glutamatın artışı, pre-OLD hasarlanmasını da arttırır. İskemi ile inaktive olan Na bağımlı glutamat transporter, sistin-glutamat antiport sistemlerinin baskılanması ile eksitotoksite oluşur. Günümüzde pre-OLD’lerin glutamat aracılığıyla hasarlanmasının reseptör bağımlı olduğu gösterilmiştir. AMPA/ kainat reseptörleri aşırı uyarıldıklarında hücre ölümünü tetiklemektedirler. Ayrıca
13
NMDA reseptörlerinin aktive olmasıyla pre-OLD’lerin matürasyonu bozulmaktadır ve reseptörden bağımsız olarak pre-OLD’in ölümüne yol açmaktadır(10, 40). Glutamat ve sistin antiporter’ın, fazla glutamat nedeniyle baskılmasıyla hücre içi sistin ve sistein azalıp glutatyon sentezi ve glutatyon peroksidaz oluşumu bozulacak, oksidatif stres ve hücre ölümüne yol açacaktır (10).
Nakamura ve arkadaşları (44) yenidoğanlarda postmortem anjiografik çalışmalar sonucu PVL için alternatif bir patogenez ortaya atmışlardır. Derin beyaz cevherde drenaj venlerde meydana gelen hasar ile ödem oluşmakta ve bazı hastalarda da kanama meydana gelmektedir. Bunun sonucunda ise arteriyal akım bozulmakta ve koagülasyon nekrozu oluşmaktadır.
Koryoamniyonit gibi enfeksiyonlara bağlı olarak artan sitokinlerin de PVL patogenezinde sorumlu olduğu; matür ve immatür hayvanlarda yapılan çalışmalarda, beyaz cevherin enfeksiyon ile zedelenebildiği gösterilmiştir (45). İnsanlarda yapılan çalışmalarda da koryoamniyonite ikincil sitokin artışının serebral beyaz cevher hasarlanmasına yol açtığı gösterilmiştir (46). Birçok sitokinin, özellikle interferon gamanın, in vitro olarak pre-OLD için toksik olduğu gösterilmiştir. TNF alfa, IL-2 ve IL-6’nın da PVL patogenezinde rolü olduğu saptanmıştır (8).
Ancak Nelson ve arkadaşlarının (45) yaptığı bir çalışmada, doğumdan sonra ikinci günde bakılan sitokin seviyelerinde, PVL ile kontrol grubu arasında fark saptanmamıştır. Kapsamlı yapılan başka çalışmalarda da benzer şekilde enfeksiyon ile SF arasında kesin bir ilişki bulunamamıştır (47).
2.4 Klinik
Başlangıçta PVL’de klinik bulgular siliktir; doğumdan haftalar ve aylar sonra gelişen spastisite genelde ilk saptanan bulgudur. Bazen de öncesinde hiçbir bulgu olmaksızın okul öncesi ya da okul çağında nörokognitif gelişim geriliği saptanabilir. Fakat genellikle postnatal çekilen USG ve MRG ile tanı konulabilir (48).
14
Periventriküler lökomalazide, lezyon genellikle posterior bölümde, lateral ventrikül trigonuna yakın bölgededir (49). Daha az sıklıkla, ön bölümde interventriküler foramene yakın bölümler tutulabilir (50). Tipik olarak kortikospinal lifler etkilenir. Klinik prezentasyon SF’tir. Serebral felç; prenatal, natal ya da postnatal dönemde immatür beyin dokusunun hasarına bağlı olarak gelişen hareket, tonüs ve postür bozukluğu olup statik bir ensefalopatidir. Serebral felce değişik derecelerde mental retardasyon, epilepsi, otonomik disfonksiyon, görme, işitme bozuklukları, davranış bozuklukları ve ortopedik problemler eşlik edebilir. Önemli kalıcı engellilik nedenlerinden olan SF, tüm dünyada çocukluk dönemi nöromuskuler bozuklukların en yaygını olup ortalama prevalansı bin canlı doğumda 2-5 düzeylerindedir (51, 52). Türkiye’de yapılan bir çalışmada prevelansı ‰4,4 olarak bildirilmiştir (53). Çok düşük doğum ağırlıklı bebeklerin; %5 - 10 kadarında SF gelişmekte olup, %25 - 50’sinde kognitif, davranışsal ve sosyal beceri kaybı görülmektedir (10, 51). Bu olguların hemen tümünde (%90) etyolojide PVL sorumludur (54, 55).
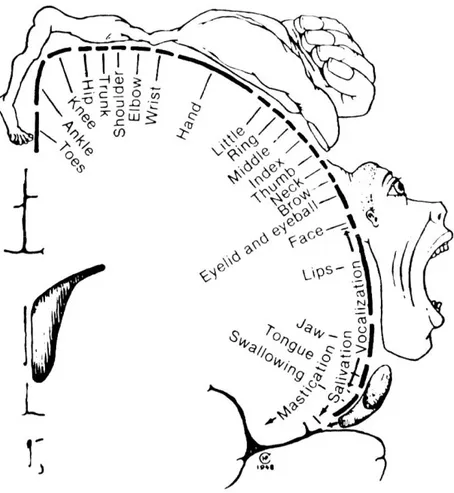
Periventriküler lökomalazide başlıca kortikospinal traktüsler tutulur, alt ekstremiteleri innerve eden lifler ventriküle daha yakın seyrettiği için öncelikle bu grupta zedelenme olur. Üst ekstremitelerde piramidal bulgular hafiftir; hafif tonus artışı ya da yalnızca derin tendon reflekslerinde canlılık gözlenebilir. Üst ekstremitelerin etkilenmesi için daha geniş alanların hasarlanması gerekmektedir. Sonuç olarak, yenidoğanlarda spastik diparezi gelişir ve spastik diparezide alt ekstremitelerde belirgin piramidal etkilenme vardır (Şekil no: 5) (56). Spastik diparezi, SF’in en sık görülen formudur (56, 57). Bunun dışında ataksik, diskinetik ve mikst SF tipleri mevcuttur. Klinik olarak hemiparezi ya da kuadriparezi gelişmesi unilateral ya da bilateral spinal yolların etkilenmesi ile oluşur ve daha az sıklıkla saptanır (56).
15
Şekil 5: Koronal kesitte primer motor korteks görülmektedir.
*Penfield ve Rasmussen (1950)
Periventriküler lökomalaziye motor bulgular, mental retardasyon, epilepsi, işitsel sorunlar, okul başarısında gerilik, davranış sorunları, subnormal görsel beceri, görme kaybı ve göz hareket sorunları gibi problemler de eşlik edebilir (54, 55). Periventriküler lökomalazili prematüre olgularda, sosyal ve davranışsal problemlere (dikkat eksikliği ve hiperaktivite, otizm spektrumu, anksiyete gibi) term doğanlara göre daha fazla rastlanmaktadır (58).
16 2.5 PVL: Görsel Bozukluk
Göz ve görsel sistem HİE’den hem prenatal hem de natal olarak etkilenebilmektedir. Birçok ülkede, prematüre retinopati (ROP) insidansı yeni tedavi modellerinin (kriyoterapi) geliştirilmesi ile azalmıştır. Bu yüzden, gelişmiş ülkelerde, PVL, prematüre bebeklerdeki görsel bozukluğun ana nedeni haline gelmektedir (54, 59, 60).
Klinik olarak ‘serebral görsel hasarlanma (SGH)’, oftalmolojik değerlendirmenin normal ya da görsel azlığı açıklamayacak kadar hafif olduğu durumlarda, görmedeki ağır kayıp olarak tanımlanır. Total görme kaybına, PVL’de, nadir olarak rastlanılır (61).
Serebral görsel hasarlanma; gelişmiş ülkelerde bilateral görme kaybının en sık nedenidir ve her 1000 canlı doğumda 2 oranında görülmektedir (61, 62, 63). Görsel hasarlanma nedeni sadece PVL değil, HİE’nin diğer nedenleri (kardiyak arest), hidrosefali, kafa travması, metabolik hastalıklar, intrauterin ve postnatal enfeksiyonlar, yapısal santral sinir sistemi (SSS) malformasyonları ve meningoensefalitte olabilir (63). Lezyon subkortikal, kortikal ya da her ikisinde de olabilir. Prematüre bebeklerde subkortikal hasara daha fazla rastlanılırken, term bebeklerde görme korteks zedelenmesine daha fazla rastlanılır (61). Birçok hastada hasar, özellikle postkiazmatik bölümde trigona yakın optik radyasyonda ve bilateral inferior görsel yollardadır (59, 64). Banker ve Larroche, 1962 yılında, PVL’yi tanımladıklarında bu bölgede yıkım olduğunu göstermişlerdir (5). Ayrıca görmeyle ilgili diğer alanlarda da (lateral genikulat cisim, kalkarin korteks) hasar oluşabilir (63, 64). Bozukluklar, görme keskinliğinde azalma, okülomotor koordinasyon bozukluğuna ve birçok görsel algısal sorunlara yol açabilir (64, 65). Ön şart olmamakla beraber SGH’ya genellikle görme keskinliğinde azalma eşlik eder (63, 66, 67). Bunun yanı sıra SF ile beraber hafif veya orta derecede görsel algısal problemler görülebilir. Erken çocukluk yaşlarında, özellikle nörolojik defisitin eşlik etmediği durumlarda, bu hastaların tanınması zor olabilir. Görme ve algılama sorunları, ileriki yaşlarda akademik başarısızlıklara neden olabilir (63). Primer görme merkezi ya da prekortikal yollarda meydana gelen hasarlar, görme alanlarında hasara
17
neden olur ve birincil, ikincil görsel işlemler engellenir (62).Bir kısım yazarlara göre PVL’ye bağlı serebral görsel hasarlanmanın en sık görülen şekli görsel algısal bozukluktur. Görsel algısal bozukluk, posterior bölümlerdeki görsel yolların hasarlanmasından çok görme korteksi ile ilişkili bölümlerin etkilenmesine bağlı yüksek görsel işlevlerin kaybını kapsar (64). Patogenezi tam olarak anlaşılmamıştır. Çalışmalarda beyaz cevher volüm kaybı ile görsel algısal bozukluk arasında ilişki olduğu saptanmıştır (54, 64). Görsel algısal hasarlanma, hastaların genel performansını etkileyen tanısı zor olan bir durumdur (64). Yapılan çalışmalarda görsel algısal hasarlanması olan hastaların %75’inde paryetal beyaz cevherde hasar saptanmış olup bu bölge görmenin dorsal sistemini içerir ve özellikle görmeye bağlı hareketler ve beceriden sorumlu bölgesidir (64, 68). Jacobsen ve arkadaşları (65), görüntüleme yöntemi ile tanı konulan 48 PVL’li olguların 36’sında SF (%75) saptamış ve olguların çoğunda inferior görme yollarında defekt saptamışlardır. Bu hastaların çoğunda günlük yaşamda en çok derinlik algısında, eş zamanlı algıda, yüzleri tanımada ve hareketli cisimleri tanımada bozukluk olduğu görülmüştür.
Görme yetisi nörogelişimsel süreçte önemli yer tutmaktadır. Beyinde herhangi bir hasar olmayan kör çocuklarda da nörogelişimsel gerilik görülmektedir (69). Bu yüzden SGH’ya genellikle nörolojik ve oftalmolojik sorunlar da eşlik eder ve nadiren izole olarak rastlanılır (16). Hue ve arkadaşlarının (70) çalışmasında, SGH’sı olan çocukların %75’inde nörolojik defisit eşlik etmektedir. Rogers ve arkadaşlarının (71) çalışmasında ise serebral görme kaybı olan hastaların %53’ünde SF saptanmıştır.
Periventriküler lökomalaziye bağlı görsel sorunlar, görsel - algısal analizde bozukluk, şaşılık, nistagmus, tanıma ile ilgili yüksek görsel işlev kaybı, görsel algı ve hafıza bozukluğu ile bazen okul yaşlarında tanınabilen görsel sorunları içermektedir (54, 72). Erken tanı, rehabilitasyon programının hedefini oluşturmaktadır (60).
Periventriküler lökomalazili hastalarda her zaman MRG bulgularının ağırlığı ile santral görme kaybı arasında korelasyon saptanmamıştır (49, 50, 59, 61). Crawford ve Hobbs’un (73) yaptıkları bir çalışmada, anormal
18
radyolojik ve patolojik bulgularla, klinik ve görme fonksiyon bozukluğu arasında korelasyon bulamamışlardır. Yeni bir hipotez olarak, piramidal yollarda selektif bir yıkım olduğunu ve tek taraflı spesifik trofik faktör eksikliğine bağlı olarak gelişebileceğini ileri sürmüşlerdir. Çalışmalardaki santral görme kaybının tanımlanmasındaki zorluk, olguların koperasyon kuramayacak kadar küçük yaşta olmalarına bağlanmıştır.
2.6 PVL: Radyolojik Görüntülemeler
2.6.1 Ultrasonografi bulguları
Prematüre yenidoğanların çoğu yoğunbakımda izlenmekte olup birçok merkezde yatak başında yapılabilen USG ilk tercih edilen görüntüleme yöntemi olmaktadır (4). Fakat USG, uygulayıcıya bağımlı bir tekniktir.
Periventriküler lökomalazi sonucu oluşan kistik lezyonlar, USG ile ilk kez, 1982 yılında gösterilmiştir (4). Hipoksik-iskemik ensefalopati sonrası 24-48 saat içinde USG’de ekodansite saptanabilir. Normalde periventriküler alandaki dansite koroid pleksustan daha azdır. Etkilenmiş bölümlerde ise en az koroid pleksus kadar dansite artışı görülür (74). Bazı ultrasonografik ekodansiteler geçici, bazısı da bir haftadan daha fazla süren dansitelerdir. Hasarlanma sonrası, 10 - 40 gün içinde periventriküler kist gelişebilir ve USG ile saptanabilir (75). Ayrıca USG ile ventrikülomegali, intraventriküler hemoraji, germinal matriks kanaması ve hemorajik parankimal lezyonlar saptanabilir (75).
Kraniyal USG bulgularına göre Volpe ve De Vries (Volpe 1990; De Vries 1992) PVL’yi sınıflandırmışlardır (Tablo 1). Ultrasonografinin yaygın ya da hafif beyin hasarını göstermede sensitivite ve spesifitesi azdır (76, 77). Özellikle çok immatür infantlarda diffüz beyaz cevher hasarlanmasını göstermede yetersizdir. Otopsi raporlarına göre lezyon 0,5 cm altında ise USG ancak 1/3’ ünü saptayabilmektedir (78). Yapılan bir çalışmada, USG ile saptanan ekodansite ile PVL tanısı ancak hastaların %50’sinde konulabilmiştir (48). Başka bir çalışmada ise histolojik olarak PVL saptanan hastaların, ancak
19
%28’inde USG ile PVL saptanmıştır (74). USG ile geniş kistik lökomalazi saptanması serebral görsel hasarlanma için yüksek derecede prediktif değer taşımaktadır (79). Özellikle oksipito - paryetal yerleşimli kistler görsel gelişim için kötü prognostik bir faktördür. Prognoz, frontal kistik lezyonlarda daha iyidir (3). Yapılan bir çalışmada, ultrasonografide kistler saptanan olguların %60‘ında SF geliştiği görülmüştür (80).
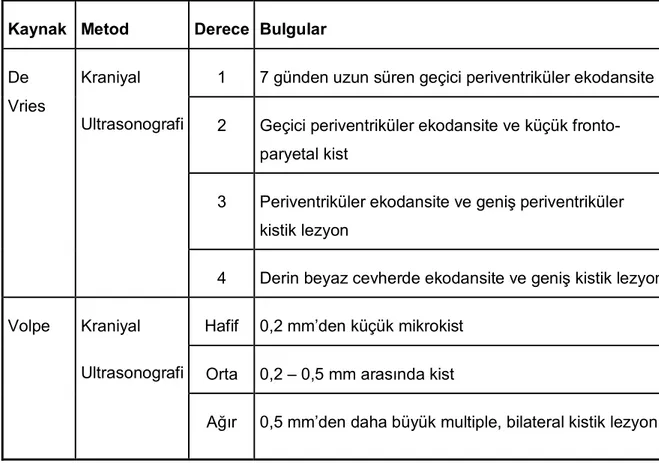
Tablo 1: Periventriküler lökomalazinin ultrasonografik dereceleri
Kaynak Metod Derece Bulgular
De Vries
Kraniyal
Ultrasonografi
1 7 günden uzun süren geçici periventriküler ekodansite
2 Geçici periventriküler ekodansite ve küçük fronto-paryetal kist
3 Periventriküler ekodansite ve geniş periventriküler kistik lezyon
4 Derin beyaz cevherde ekodansite ve geniş kistik lezyon
Volpe Kraniyal
Ultrasonografi
Hafif 0,2 mm’den küçük mikrokist
Orta 0,2 – 0,5 mm arasında kist
Ağır 0,5 mm’den daha büyük multiple, bilateral kistik lezyon
2.6.2 MRG bulguları
Manyetik rezonans görüntüleme tekniğinin gelişmesi ile hayatın ilk yılında PVL tanısı konulması kolaylaşmıştır. Manyetik rezonans görüntüleme, USG’ye oranla daha maliyetli bir yöntemdir ve prematüre bebeklerin transport işlemine tabi tutulmaları gerekmektedir (11).
20
Periventriküler lökomalazide MRG bulguları, özellikle posterior bölümde oksipital hornlar çevresinde ve trigona yakın bölümde belirgin olmak üzere periventriküler beyaz cevherde azalma, korpus kallozumun posterior bölümünde incelme, ikincil olarak ventriküllerde genişleme ve lateral ventrikül sınırlarında düzensizlik; kistik olmayan PVL’de T1 ve/veya T2 ağırlıklı sekanslarda sinyal artışı olarak tanımlanabilir (Resim 1 ve 2) (49, 50, 68, 81, 82).
Periventriküler lökomalazide yaygın hasarlanma özellikle 26 haftadan küçük immatür infantlarda görülür. T2 ağırlıklı MRG görüntülerinde diffüz sinyal artışı şeklinde görülür. Sinyal artışı, ekstrasellüler boşluğun artışı, aksonal yapının azalması ve matürasyon gecikmesine bağlıdır (83). Yirmi altı haftadan büyük infantlarda ise, genellikle hasar kistik formasyon gösteren fokal lezyon şeklindedir (84). Yapılan bir çalışmada, 23 - 30 hafta arasında doğan prematüre bebeklerde T2 ağırlıklı MRG’de, diffüz sinyal artışı %80 oranında saptanmıştır (21). Özellikle konvansiyonel MRG ve USG’de hasar saptanmadığında; yenidoğan döneminde, difüzyon ağırlıklı MRG’de difüzyon kısıtlılığı saptanabilir ve sonraki aylarda bu kısıtlamanın azaldığı görülebilir (21, 74). Bu yüzden difüzyon ağırlıklı MRG’nin doğumdan kısa bir süre sonra yapılması önem taşır (85).
21
Resim 1. Sekiz numaralı olgunun manyetik rezonans görüntülemesi. A) T2
aksiyel görüntülemede solda ağır PVL. Aynı ventrikülde çekilme ve dilatasyon. Korteks ve beyaz cevherde belirgin doku kaybı. Ensefalomalazik alan ve porensefalik kist. B) Koroner FLAİR C) T1 aksiyel görüntüsü. D) Renkli-kod fraksiyonel anizotropi haritası. Kırmızı transvers (x ekseni), yeşil ön-arka (y ekseni), mavi superior-inferior (z ekseni) yönü belirtmekte.
A B
D C
22
Resim 2: A, B) Üç numaralı olgunun T2 aksiyel ağırlıklı MRG’si. Olguda
bilateral ağır PVL mevcut olup bilateral kist (beyaz ok) ve yaygın beyaz cevherde volüm kaybı mevcuttur. C,D) Bir numaralı olgunun T2 aksiyel ağırlıklı MRG görüntülemesi. Olguda solda kaudat nukleus baş kısmı, kapsula eksterna ve talamusta etkilenme mevcuttur.
A B
23
2.6.2.1 Difüzyon tensör manyetik rezonans görüntüleme
Son yıllarda deneysel çalışmalar sayesinde beynin immünokimyasal mekanizmaları spesifik nöropatolojik biyokimyasal testler ve sofistike teknikler geliştirilmiştir. Bu teknikler, difüzyon ağırlıklı görüntüleme, NMRG, DTMRG ve manyetik rezonans spektroskopi (MRS) olarak sıralanabilir (86).
Difüzyon tensör manyetik rezonans görüntüleme, su moleküllerin difüzyonu ile beyindeki nöronal liflerin yapısını gösteren yeni bir tekniktir (87). Difüzyon, moleküllerin belirli bir zamanda rastgele ve ışınsal hareketini tanımlar (88). Su molekülleri uzay boşluğunda her yöne yayılım gösterir. ‘İzotropik yayılım’ olarak da adlandırılan bu durumda su molekülleri, herhangi bir yöne eşit olarak yayılım gösterecektir. Bunun yanında yapısal bir boşlukta, su moleküllerinin difüzyonu bazı bölgelerde zoraki bir yöne olacaktır. Örnek olarak, beyin dokusunda su molekülleri akson duvarını geçmektense akson boyunca daha serbest bir şekilde yayılacaktır (88, 89). ‘Anizotropik yayılım’ olarak adlandırılan bu durumda su molekülleri her yöne eşit olarak yayılmayıp bazı yönlere daha fazla yayılım gösterecektir. Yeterince izotropik ve sabit sıcaklıkta difüzyon denklemle belirlenebilir (88).
r²= 6Dt
Bu denklemde ‘r’ ‘Gaussian rastgele değişkenini’ ifade eder; belirli bir zamanda (t) ve belirli bir difüzyon katsayısında (D) su moleküllerinin yer değişmesini tanımlar. Bunun yanında in vivo difüzyonda, aktif transport ve fizyolojik basınç farklılıklarına bağlı oluşan değişiklikler ayırt edilemez. Bu yüzden difüzyon katsayısına ‘görünen difüzyon katsayısı [ apparent diffusion coefficient (ADC) ]’ denilir. Görünen difüzyon katsayısı değeri aşağıda belirtilen denklemde değerlendirilir (88).
D= -
Bu denklemde ‘S ve S0’ difüzyon ağırlıklı görüntülemede sinyal yoğunluğu değerlerini ifade eder ve ‘D’ , ADC değerini ifade eder ve voksel
24
(pikselin üç boyutlu karşılığı) ile hesaplanır. Denklemdeki ‘ b’ değeri ise ‘difüzyon ağırlıklı değişken’ olarak adlandırılır (88).
Beyaz cevherde ADC değeri, su moleküllerinin gradientinin yönüne bağlıdır. Beyaz cevherin nöronal liflerden zengin oluşu, hücresel elemanlardan dolayı anizotropik sinyal olağan olarak beklenilir. Bunun yanında nöronal liflerin oluşturduğu rotasyonel değişiklikler nedeniyle beyaz cevherde tek bir yöne gradient oluşması beklenmez. Bu yüzden difüzyon tensör, en az altı gradient yönü belirler (88).
D=
Dxx Dxy Dxz
Dyx Dyy Dyz
Dzx Dzy Dzz
Bu denklemde tensörün köşegen elemanları ( Dxx, Dyy, Dzz ) tarayıcı eksenine dik açılı olarak difüze olurlar. İzotropik difüzyonda belirli bir zamanda suyun değişikliği küre şeklinde modellenir. Buna zıt olarak anizotropik yayılımda en büyük yayılımın olduğu eksen şekil değişikliğine yol açarak elipsoid oluşumuna yol açar. Bu elipsoid içerisindeki tüm eksenler, yönsel ve sayısal olarak ayrılabilir. Bir eksendeki ortalama difüzyon mesafesi sayısal önemine göre ‘vektör’ olarak adlandırılır. En uzun, orta ve kısa eksenler ʎ1, ʎ2 , ʎ3 vektörler olarak adlandırılır. Bu üç yöndeki ortalama
difüzyon değeri ‘ total ADC ya da ortalama difüzyon’ olarak adlandırılır. Ana eksendeki difüzyona ‘aksiyal difüzyon ( ʎ1 )’, ortalama ʎ2 ve ʎ3‘dekine ise
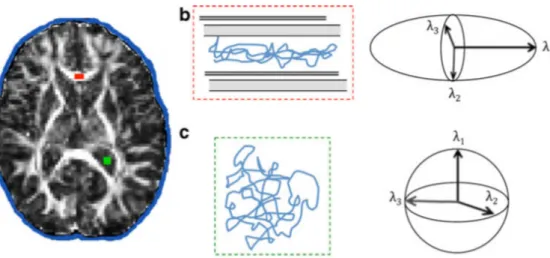
‘radyal difüzyon’ denilir. Fraksiyonel anizotropi (FA), tensörün elipsoid derecesine göre vektörün izotropik ya da anizotropik olacağını hesaplar (Şekil 6) (88).
25
Şekil 6: Beyindeki izotropik ve anizotropik yayılım. (a) Prematüre olarak doğan
olgunun farklı beyin bölgelerindeki FA görüntülenmesi ve suyun difüzyonu. (b) Kırmızı ile gösterilen beyaz cevherdeki korpus kallozumda difüzyon akson boyunca olup anizotropik yayılım ile sonuçlanmıştır. (c) Ventrikül içindeki BOS (yeşil renkte) sınırlandırılmadan izotropik yayılım göstermiştir. Şekil b ve c’de izotropik ve anizotropik yayılım görülmektedir. Her tensör üç vektör değerleri ile belirtilmektedir (ʎ1, ʎ2 , ʎ3). İzotropik yayılımda ʎ1 = ʎ2 = ʎ3 iken, anizotropik yayılımda ʎ1 > ʎ2 > ʎ3 olarak şekillenir.
*Pandit AS, Ball G. Et al. Diffusion magnetic resonance imaging in preterm brain injury. Neuroradiology 2013; 55: 65-95.
Beyaz cevherde FA’yi, hücresel yapıların su moleküllerinin difüzyonunu sınırlaması ile en büyük katkıyı aksonun kendisinin sağladığı düşünülmektedir ve FA hesaplanarak beyaz cevherdeki matürasyon ve hasarlanma hakkında fikir elde edilebilir (89, 90). Song ve ark.’nın (80) yapmış oldukları bir deneyde, demiyelinizasyon oluşturulmuş fareler, normal miyeline sahip farelerle kıyaslandığında, demiyelinize olmuş farelerde %20 kadar FA değer kaybı bulunmuştur. Bu da miyelinizasyonun FA değerine katkıda bulunduğunu göstermektedir. Kortikospinal liflerde birbirine paralel seyreden akson lifleri nedeniyle difüzyon tensör oldukça anizotropik olacak ve ana vektörde liflerle aynı yönde olacaktır. Bu yüzden DTMRG beyaz cevherde spesifik büyük nöronal liflerin yapısını göstermede oldukça değerli bir tekniktir (92).
26
Şekil 7: Fraksiyonel anizotropi (FA) hesaplanması
Fraksiyonel anizotropi değeri, sıfırdan (oldukça izotropik) bire (oldukça anizotropik) kadar değişir (87). Şekil 7’de FA hesaplanması sunulmuştur. Tensör modelinde difüzyonun birçok yönü olmasına karşın en sık kullanılan tek bir yön değerini verir. Bu teknik ile Gaussian olmayan difüzyon değeri ve karmaşık nöronal liflerin anizotropik değeri verilemez. Difüzyonun nörobiyolojik durumla ilişkisi karmaşıktır. ADC değeri yaş ile giderek azalmakta, erişkin dönemde stabil olmakta ve yaşlılıkta ise artmaktadır. Bunun sebebi, gelişimsel olarak su kaybının olması, ekstrasellüler sıvının yaş ile azalması ve miyelin gibi makromoleküllerin giderek artması olabilir. Yaşlılıkta ADC değerinin artması ise miyelin kaybı, aksonal bağlantıların kaybı ve ekstrasellüler sıvının artışıdır (Resim 3) (88).
Resim 3: Transversal fraksiyonel anizotropi haritası (a), renkli tensör haritası (b) ve
bazal nükleusların görüntülenmiş hali (c). (1) Korpus kallozumun genu. (2) Korpus kallozum splenium kısmı. (3) İnternal kapsül anterior kısmı. (4) İnternal kapsülün posterior kısmı. (5) Eksternal kapsül.
*Qiu MG, Zhang J, Zhang Y, et al. Diffusion Tensor Imaging-Based Research on Human White Matter Anatomy. The Scientific World Journal 2012; 5: 30-43.
Difüzyon tensör manyetik rezonans görüntülemede birçok analiz yöntemi bulunmaktadır. Tüm analiz yöntemlerinin ortak özelliği kıyaslama
27
yapılarak sonuçların doğruluğunu garanti almaya dayanmasıdır (çalışılan bölgeler anatomik olarak aynı bölgeleri içerir). Tensör yöntemleri tek, iyi tanımlanmış bölgeleri ya da nöronal lifleri ve beyaz cevherden karşı hemisfere giden lifleri inceleyebilir. Bu değerlendirmeler ‘region of interest (ROİ), voksele dayalı morphometri, tract-based spatial statistics (TBSS) ve difüzyon traktografi’ kullanılarak yapılır (88).
‘Region of interest’ yönteminde spesifik anatomik alanlardaki olası bölgeler kıyaslanarak yapılır. Bölgeler genellikle uzmanı tarafından manuel olarak belirtilir. Diğer yöntemlerin kıyaslamasında altın standart olarak kullanılır. Bu yöntem yaygın ve karmaşık kıyaslama gerekmeyen sınırlı alanlarda kullanılabilir. Manual olarak değerlendirme de fazla vakit harcamaya yol açar. Ayrıca prematüre olguların değerlendirmesi de zordur (88).
Voksele dayalı morphometri, beyaz cevherin yaygın olarak değerlendirmesini sağlayan bir tekniktir. Olgulardaki homojen vektörler kıyaslanarak difüzyon parametreleri oluşturulur. Bu yöntemde görüntüler bölümlere ayrılır ve gri cevher gibi etkilenme olmaması için bir eşik değeri belirtilir. Ayrıca bir vektöre en yakın komşu vektörlerin ortalaması alınarak bir düzeltme işlemi yapılır. İstatistiksel analiz voksel bazlı olarak yapılır ve beyaz cevherde lokal değişiklikler tanınır. Diğer yöntemlere üstün yanı, olası bir bölge ya da liflerden söz etmemesidir. Otomatik olarak yapılabilir ve kısa zamanda sonuç verir. Fakat bu yöntem artefaklardan oldukça etkilenir ve yapılan düzeltmelerin standart olmaması bu yöntemin eksik yönleridir (88).
‘Tract-based spatial statistics’ yöntemi ise voksele dayalı morphometri yöntemine bazı yönleri ile benzeyen bir tekniktir. Beyaz cevherden geçen vektörler arasındaki farklılıklar ele alınır ve FA görüntüleri boşlukta grup olarak hizalanır. Nöronal lifler voksel olarak belirtilir ve beyaz cevher iskeleti oluşturulur. Bireyler arasındaki yüksek farklı FA ve düşük FA değeri olan bölümler çıkarılarak bu iskelet oluşturulur. Fraksiyonel anizotropi iskeletinde belirli bir doğrultuda giden nöronal liflerin merkezinde, FA değeri en yüksek seviyeye ulaşır. Daha sonra bu iskelet bölümlerinde voksel bazlı değerlendirme yapılarak sonuç verilir (Şekil 8) (88).
28
Şekil 8: Tract-based spatial statistics ile FA haritasının oluşturulması
(a) Fraksiyonel anizotropi iskeletinde beyaz cevher lifleri inceltilmiştir. (b) Beyaz cevher topolojisi katman ya da tüp şeklinde belirtilmiş olup, liflerin merkezinde vokselleri içerir. (c) Yanlış kaydı önlemek amacıyla, haritalar üzerindeki iskelete özgün FA değerleri yansıtılır.
*Pandit AS, Ball G. Diffusion magnetic resonance imaging in preterm brain injury. Neuroradiology 2013; 55: 65-95.
‘Tract-based spatial statistics’ voksele dayalı morphometriye göre daha avantajlı bir tekniktir. Voksellerden hesaplanan FA değerleri daha az değişkenlik içerir ve daha güvenilirdir. Tüm beyaz cevher yerine daha belirli bir alanda çalışılan vokseller istatistiksel anlamda daha başarı sonuçlar verir. Belirgin sinyal değişikliği olan beyaz cevher bölümünde ilk çalışılması gereken yöntemdir. Bu teknik majör nöronal liflerle kısıtlı olarak çalışır (88).
Difüzyon traktografi, beyaz cevher liflerinin belirli bir yörüngede tahmini olarak görüntülenmesini sağlayan tekniktir (89). Traktografide bir başlangıç bölümü bulunur ve hedef bölüme kadar voksellerden kopya çıkarılması sağlanır. Traktografi iki yöntem ile yapılır. ‘Belirleyici traktografide’ başlangıç ve bitiş noktaları arasında her bir voksel hesaplanarak majör vektör yönüne doğru çizim yapılmasıdır. Bu hat, FA değeri en alt seviyeye geldiğinde sonlanır. Bu yöntem ile nöronal liflerin yerleşimi daha kesin bir şekilde yapılır. Çaprazlaşan lifler varlığı ve nöronal liflerin yöneliminin net olmadığı durumlar da bu tekniğin kısıtlılığını oluşturur. ‘Olası traktografide’ ise nöronal liflerin yöneliminin net olmadığı durumlarda da kullanılır. Bu yöntemde her bir voksel hesaplanarak olası nöronal liflerin yönü hesaplanır. Traktografi ile bireysel nöronal lifler arasındaki farklılıklar kıyaslanabilir. Ayrıca nöronal liflerin tamamında ya da bir
29
bölümünde difüzyon parametreleri hesaplanabilir. Tahmini nöronal liflerin volümü ve sonlandığı bölümler belirtilebilir (Resim 4, 5) (88).
Resim 4: Traktografi ile sensörimotor liflerin görünümü. Traktografi 3 boyutlu olarak
görülmektedir. On dört aylık kız olgunun beyaz cevherinde hasarlanma yoktur.Motor lifler mor, duyu lifleri yeşil renkte görülmektedir.
*Mukarami A, Morimoto M, et al. Fiber-Tracking techniques can predict the degree of neurologic impairment for periventricular Leukomalacia. Pediatrics 2008; 122; 500-8.
Resim 5: (A) İki yaşında sağ hemiparezili kız olgunun DTMRG görüntüsü. Koronal
kesitte FA değerinde anizotropinin fokal kaybı gözükmektedir. (B) Aynı hastanın traktografi görüntüsü. Lezyon tarafındaki kortikospinal yollardaki kesinti görülmektedir.
30
Yapılan birçok çalışmada, DTMRG’nin gelişmekte olan beyin dokusunda beyaz cevher hasarlanmasında ve nörolojik anormalliği tahmininde konvansiyonel yöntemlere üstün olduğu kanıtlanmıştır (51, 85, 89, 90, 93, 94).
Difüzyon tensör manyetik rezonans görüntüleme anormalliği ile nörogelişimsel nihai sonuç birbiriyle uyumlu olmaktadır. Bu yöntem ile normal beyaz cevher yapısını görmenin yanı sıra akut ve kronik değişikliklerin de görülmesi konvansiyonel tekniklere olan bir üstünlük olarak yorumlanabilir (85). Traktografi ve DTMRG’nin keşfi ile in vivo olarak beynin bağlantılarının ve aksonal liflerinin yörüngelerinin görüntülenmesi mümkün olmuştur (95). Ayrıca duyu ve motor liflerin ayrıntılı görüntülenmesi ile PVL’nin klinik etkilenmesi hakkında daha fazla bilgi vermekte ve optik radyasyon hakkında ayrıntılı bir değerlendirme sunmaktadır (89, 96). Bu yöntemlerin gelişmesi ile kortikospinal yolların preoperatif değerlendirilmesi artacak ve operasyonlara bağlı komplikasyon ihtimali azalacaktır (95).
Difüzyon tensör manyetik rezonans görüntüleme, erişkinlerde birçok hastalığın teşhisinde yararlı olsa da çocuklarda uygulanması zordur (89). Beynin daha küçük olması, hızlı miyelinizasyon, artefaklar buna yol açan nedenlerdir (89). Yenidoğan döneminde de FA değerlerinin beyaz cevherde az oluşu nedeniyle değerlendirilmesi zordur (97). Akson ve miyelinin anizotropiye katkısına rağmen her ikisinden birinde meydana gelen hasar DTMRG’de ayırt edilememektedir (97).
Difüzyon anizotropi teorik olarak mikroskobik anatomiyi değerlendirirken, DTMRG tekniği makroskopik bir değer vermektedir (tipik olarak bir vektör 2-3 mm boyutundadır). Bu yüzden değerlendirilmenin dikkatli yapılması gerekmektedir (98). Diğer bir hususta çaprazlaşan nöronal liflerin değerlendirilmesidir; FA değerini arttıran bir vektör, akson ya da miyelin yapısında bozulma olmadan, sadece farklı uzaysal dağılımı olan nöronal liflerden kaynaklanmış olabilir. Beyaz cevherde hesaplanan vektörlerin tahminen %90’ı çaprazlaşan nöronal liflerden oluşmaktadır ve bu yüzden traktografi ve anizotropi değerlerine önemli ölçüde etkilerler (99).
31
Difüzyon tensör manyetik rezonans görüntüleme ile yalnızca çok homojen ve büyük nöronal lif demetleri gösterilebilir. Hesaplanan bir vektörden küçük olan nöronal lifler teknik olarak görülemezler (100). Manyetik rezonans görüntüleme cihazının çözünürlüğü de diğer bir etkendir. Tek bir vektörde çoklu nöronal liflerin hesaplanması zordur. Bunun dışında çekim esnasında meydana gelebilecek bir artefakta yanlış sonuçlara yol açabilir (101).
2.7 Tedavi Modelleri
Periventriküler lökomalazide temel tedavi pre-OLD hasarlanmasının önüne geçmektir. Önemli mekanizmalardan HİE ve enflamasyon/ enfeksiyonların önlenmesi ve serbest oksijen radikallerinin etkilerinin ortadan kaldırılmasıdır. Bu amaçla stabil SKA sağlanmalıdır. Ayrıca anti-apopitotik ilaçların geliştirilmesi, pre-OLD ölümlerinin önüne geçmeye olanak sağlayacaktır (18). Farelerde yapılan bir çalışmada HİE sonrasında verilen minosiklinin mikroglia aktivasyonunu azalttığı görülmüştür (18).
Yeni yapılan çalışmalarda, HİE sonrasında bir takım sellüler mekanizma ile tamir mekanizmalarının aktive olduğu görülmüştür. Subventriküler zonda hem nöronal hücrelere hem de oligodendrositlere dönüşebilen progenitör hücreler olduğu görülmüştür. Yang ve arkadaşlarının (102) fareler üzerinde yapmış oldukları bir çalışmada, farelerde ilaçlarla sağlanılan HİE sonrasında etkilenen hemisferde bu progenitör hücrelerin bir haftada karşı hemisfere kıyasla fazlaca oluştuğu gösterilmiştir. Bu hücreler HİE sonrasındaki tamir sürecinde çok önemli bir role sahip olabilir ve HİE tedavisinde hedef noktası olabilirler (102).
Preoligodendrositlerin eksitotoksisitesinin önlenmesi amacıyla NMDA ve AMPA glutamat reseptör blokerleri ile yapılan çalışmalar umut vadetmektedir (18). AMPA blokeri topiramat ve NMDA reseptör bloker Memantin’in hayvan deneylerinde pre-OLD üzerine koruyucu etkileri olduğu görülmüştür (18)
32
Antenatal glukokortikoid uygulanan anne bebeklerinde PVL gelişme riskinde azalma saptanmıştır. Pluripotent kök hücreleri ile yapılan çalışmalarda adipoz stromal hücrelerin nöronal ve glial hücrelere farklılaşabildiği görülmüştür. Kent ve arkadaşları (103), fareler üzerinde yaptıkları çalışmada adipoz stromal hücrelerin iskemik alana yerleştirildiğinde bu hücrelerden nöronal spesifik markerları sentezlediği görülmüştür. Adipoz stromal hücreler HİE tedavisinde yeni bir hedef olabilir (103). Çalışmalarda PVL’yi önlemede hayvan modellerinde nöroprotektif uygulamalar geliştirilmiş olsa da insanlara yönelik tedavi modelleri için uzun yıllara ihtiyaç vardır (78).
33
3.GEREÇ VE YÖNTEM
Çalışmaya Kasım 2012 - Eylül 2013 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı Çocuk Nörolojisi ve Yenidoğan Bilim Dalları tarafından izlenen postkonsepsiyonel yaşı (PKY) üç ay ve altında olan ve PVL’li olan olgular alındı.
Çalışmaya alınma kriterleri: - PKY üç ay ve altında olması,
- Kraniyal ultrasonografi ve/veya kraniyal MRG ile PVL saptanması, - Grade 1 intraventriküler kanama (İVK) varlığı/yokluğu,
- Evre 1 prematüre retinopati varlığı/yokluğu. Çalışma için dışlanma kriterleri:
- Grade 2 ve üzeri intraventriküler kanama olması, - Evre 2-3 prematüre retinopati olması,
- Optik sinir atrofisi olması, - Ağır kırma kusuru olması,
- Ağır genetik veya kardiyak anomali varlığı, - Nörometabolik hastalık varlığı,
- Hidrosefali olması,
- Ventrikülo-peritoneal (V-P) şant takılması
Demografik olarak olguların gestasyonel yaşları, cinsiyetleri, doğum kilosu, doğum asfiksisi veya koryoamniyonit varlığı, mekanik ventilatör ihtiyacı ve süresi, sepsis öyküsü ve anne yaşı kaydedildi.
Olguların PKY’ları sıfır-üç ay arasında iken, üçüncü ve altıncı ayı tamamlandığında nörolojik bakıları aynı hekimler (YEK, SG) tarafından yapıldı. Olguların baş çevreleri ölçüldü ve persantil eğrileri ile karşılaştırıldı. Yenidoğan refleksleri, kraniyal sinir bakısı, ışık ve ses yanıtları (optikofasyal refleks ve akustikofasyal refleksleri), motor sistem ve psikomotor gelişimleri
34
değerlendirildi. Ayrıca nöbet geçirip geçirmediği belirtildi. Bulgular nöroloji poliklinik dosyalarına kaydedildi.
Olguların ayrıntılı oftalmolojik değerlendirmesi PKY üçüncü-beşinci ayda ve altıncı ayda aynı hekim (EDB) tarafından yapıldı. Dört olguda (Olgu no:1, 3, 4, 5) PKY 12. ayda göz muayenesi yinelendi. Oftalmolojik değerlendirmede sikloplejik refraksiyon kusuru, okülomotor durum (şaşılık muayenesi ), ön segment ve göz dibi bakısı yapıldı ve flash görsel uyarılmış potansiyel (VEP) kaydı yapıldı. Flash VEP yanıtları, amplitüd, latans ve konfigürasyon açısından değerlendirildi. Flash VEP yanıtları, amplitüd ve latans değerleri hastanemizin aynı yaş grubu normal değerler referans alınarak yorumlandı. Olguların VEP değerleri altı aydan sonra bakılması anlamlı olduğu ve görme ile ilgili fiksasyon, obje takibi gelişmesi altıncı aya kadar ancak tamamlandığı için muayenelerin bu ayda yapılması amaçlandı (104). Bulgular göz poliklinik dosyalarına kaydedildi. Tüm PVL’li olguların ailelerine görsel eğitim yazısı ve materyaller verildi (Resim no: 6). Verilen broşür içeriğinde aşağıdaki öneriler yazılıdır:
- Çocuğun kıyafetleri ve yatak çarşafları çizgili (özellikle beyaz ve kırmızı) olmalı,
- Yatak başına renkli ve ışıldaklı oyuncaklar takılmalı, - Anne kırmızı, parlak ruj ve allık kullanmalı,
- Renkli ampul takılmış el fenerleri ile direkt göze yöneltmeden duvara tutularak hareketler yapılmalı,
- Parlak oyuncaklar, renkli toplar, balonlar, renkli büyük suratlı oyuncaklar, kukla, ışıklı ve sesli oyuncaklar, büyük peluş oyuncaklar ile bebeğin ilgisi çekilmeli,
- Duvarlara renkli büyük resimler asılmalı,
- Televizyona ve pencereden dışarıya baktırılmalı, - Kırmızı renkli, parlak çarşaf ve kıyafetler kullanılmalı,
35
Resim 6: Periventriküler lökomalazili olguların ailelerine verilen eğitim materyalleri.
(A) Serebral görsel hasarlanması olan olguların renkli görmeleri etkilenmediği için kırmızı-beyaz çizgili rulo verildi. (B) Görme egzersizi için verilen oyuncaklar (renkli toplar ve ışıklı oyuncaklar).
Olguların tümünde neonatal dönemde kraniyal USG çekildi. Kraniyal USG’de PVL saptanan veya kuşkulu PVL bulguları gösteren olgulara PKY üç ay altında iken kraniyal MRG yapıldı. Manyetik rezonans görüntüleme sadece bir olguda yapılmadı. Görüntüleme yapılmayan olgu ikiz eşi idi ve kardeşinde PVL tanısı mevcuttu. Olguların PKY’ları altı ay olduğunda DTMRG çekimleri yapıldı. Manyetik rezonans görüntüleme çekimleri, sedasyon altında ve 50-100 mg/kg kloralhidrat uygulanarak yapıldı. Sedasyon uygulandıktan 30 dakika sonra 3 tesla manyetik rezonans görüntüleme cihazı ile Kraniyal MRG, difüzyon MRG ve DTMRG çekimleri yapıldı. İşlem esnasında pulse oksimetri ile olguların kardiyak nabız ve kan oksijen satürasyonları izlendi. Ses izolasyonu amacıyla olgulara kulaklık ve