İN VİTRO KOŞULLARDA TÜYLÜ FİĞ (Vicia villosa Roth)’İN SÜRGÜN REJENERASYONUN
OPTİMİZASYONU Nuray KARADAĞ Yüksek Lisans Tezi Biyoloji Ana Bilim Dalı Doç. Dr. Muhammad ASIM
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
İN VİTRO KOŞULLARDA TÜYLÜ FİĞ (Vicia villosa Roth)’İN SÜRGÜN REJENERASYONUN OPTİMİZASYONU
YÜKSEK LİSANS TEZİ Nuray KARADAĞ
Ana Bilim Dalı: Biyoloji
Tez Danışmanı: Doç. Dr. Muhammad ASIM
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
ÖZET
Yüksek Lisans Tezi
İN VİTRO KOŞULLARDA TÜYLÜ FİĞ (Vicia villosa Roth)’İN SÜRGÜN REJENERASYONUN OPTİMİZASYONU
Nuray Karadağ
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyoloji Ana Bilim Dalı
Danışman: Doç. Dr. Muhammad ASIM Ocak, 2019, 32 sayfa
Tüylü fiğ (Vicia villosa Roth) Türkiye tarım için çok önemli bitki olup hayvan yemi olarak kullanılmaktadır. Kışa dayanıklı tek yıllık, bazen de iki yıllık fiğ türleri serin ve nemli bölgelerin bitkisidir. Fiğ bitkilerini geliştirmedeki temel amaç üretimin arttırılması ve yem kalitesini geliştirmektir. Çalışmalarda besi ortamını hazırlamak için %0.44 Murashige and Skoog (MS) medium, %3 sükroz ve %0,6 gr lık agar karıştırılarak kullanılmıştır. Hazırlanan ortamların PH’sı 5.6-5.8 arasında tutmak için 1N NAOH veya HCl kullanılmıştır. Daha sonra 1.2 atmosfer basınçta otoklavda sterilizasyon yapılmıştır. Yapılan çalışmalarda besi ortamına farklı dozda ve oranlarda bitki büyüme düzenleyicileri olarak sitokinin olarak 6-Benzilaminopurin (BAP), Kinetin (KİN) ve Thidiazuron (TDZ) ile beraber İndol butirik asit (IBA) kullanılmıştır. Çalışmalar beyaz LED ışık (16/8 saat ışık/karanlık fotoperiyodu) ve 24+1 0C sıcaklıkta yapılmıştır. İn vitro koşullarda çalışmaların sonunda sürgün rejenerasyon oranı (%), eksplant başına düşen sürgün sayısı, sürgün uzunluğu (cm) ve kök oluşumu oranı (%) kaydedilmiştir. Genel olarak baktığımızda en başarılı uygulama BAP+IBA ortamlarında kaydedilmiştir ve köklenmiş bitkiler oluşmuştur. Buna karşı, TDZ+IBA ortamlarında kök oluşumu kaydedilmemiştir. Direkt köklendirilen bitkiler daha sonra adaptasyon için saksılara aktarılmış ama istenilen başarı elde edilmemiştir. Köklenmemiş bitkiler ise naftalinasetikasit (NAA) veya indolasetikasit (IAA) kullanılarak köklendirilmiştir. Vermikülit içeren saksılara aktarılıp, polietilen poşetler ile kapatalarak adaptasyon sağlanmıştır.
ABSTRACT
Ms Thesis
OPTIMIZATION OF IN VITRO SHOOT REGENERATION OF HAIRY VETCH (Vicia villosa Roth)
Nuray Karadağ
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Biology
Supervisor: Assoc. Prof. Dr. Muhammad ASIM January 2019, 32 pages
Hairy vetch (Vicia villosa Roth) is an important crop for agriculture of Turkey which is used as forage crop. The plant is annual or biennial, cultivated in cold and humid regions and shows cold resistance. The basic objective of developing new cultivars is based on increased yield or forage quality. In this study, 0.44% Murashige and Skoog (MS) medium, 3% sucrose and 0.6% agar were used for preparing basal medium. 1N NaOH or HCl was used fort eh automation of medium’s pH to 5.6-5.8. Thereafter, it was followed by sterilization in autoclave at 1.2 atmosphere. Different concentrations of cytokinins like Benzylaminopurine (BAP), Kinetin (KİN) and Thidiazuron (TDZ) along with Indole butyric acid (IBA) were used as plant growth regulators. The experiments were carried out under White LEDs (16/8 h light/darkness photoperiod) and 24+1 0C temperature. Data regarding shoot regeneration frequency (%), shoots per explants, shoot length (cm) and rooting frequency (%) were recorded at the end of study under in vitro conditions. Among plant growth regulators, combination of BAP+IBA was most superior compared to other combinations used which also produced rooted plantlets. Contraraily, combination of TDZ+IBA failed to induce any rooting. Direct rooted plantlets were shifted to pots for adaptation but failed to survive. Whereas, application of NAA or IAA in the culture medium induced in vitro rooting of shoots. Pots filled with vermiculite were used for adaptation of rooted plantlets followed by closing the pots with polyethylene bags for successful adaptation.
ÖNSÖZ
Yüksek Lisans’a başlamama vesile olan ilk danışmanım sayın Prof. Dr. Mehmet KARATAŞ hocama teşekkürlerimi sunarım. Tez çalışmalarıma başladığım andan sonuna kadar benden yardımını ve bilgisini esirgemeyen, elinden gelen tüm desteği gösteren sayın danışmanım Doç. Dr. Muhammad ASIM hocama sonsuz teşekkür ediyorum. Laboratuar çalışmalarımda bilgisiyle yardımlarını esirgemeyen Dr. Muhammet DOĞAN hocama teşekkürlerimi sunarım.
Yüksek Lisans’a başladığım andan sonuna kadar yanımda destekçim olan sevgili eşim Yücel KARADAĞ ve manevi desteğini esirgemeyen anneme, babama ve kardeşime teşekkürü bir borç bilirim.
Nuray Karadağ Karaman-2019
İÇİNDEKİLER Sayfa ÖZET ... İ ABSTRACT ...ii ÖNSÖZ ...iii ÇİZELGELER DİZİNİ ... v ŞEKİLLER DİZİNİ ... vi
SİMGELER VE KISALTMALAR DİZİNİ ... vii
1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 3
3. MATERYAL VE METOT... 10
3.1. Deneme Yeri... 10
3.2. Bitki Materyali ... 10
3.3. Büyüme Ortamları ve Büyüme Koşulları ... 10
3.4. Büyüme Düzenleyicilerinin Çözücüleri ve Saklama Koşulları ... 10
3.5. Yüzey Sterilizasyonu ... 11
3.6. İn Vitro Çimlenme ve Eksplant İzolasyonu ... 11
3.7. Köklendirilmesi ve Adaptasyon ... 11
3.8. İstatistik Analizi ... 12
4. BULGULAR VE TARTIŞMA ... 13
4.1. Sterilizasyon Çalışmaları ... 13
4.2. Farklı BAP-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri ... 14
4.3. Farklı TDZ-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri ... 18
4.4. Farklı KİN-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri ... 21
4.5. Köklendirme ve Adaptasyon ... 24
5. SONUÇLAR VE ÖNERİLER ... 26
KAYNAKLAR ... 28
ÇİZELGELER DİZİNİ
Çizelge Sayfa Çizelge 3-1 Denemelerde kullanılmış olan büyüme düzenleyicilerinin çözücüleri, stok konsantrasyonu ve saklama koşulları…..……….…….. 11 Çizelge 4-1 Farklı NaOCl oranın ve süresinin V. villosa tohumlarının sterilizasyona ait varyans analizi……….…..… 13 Çizelge 4-2 Farklı NaOCl oranın ve süresinin V. villosa tohumlarının sterilizasyona ait veriler ………...….. 14 Çizelge 4-3 Tüylü fiğ (V.villosa Roth) bitkisinde farklı BAP oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi………..………15 Çizelge 4-4 Tüylü fiğ (V.villosa Roth.) bitkisinde BAP-IBA oranlarının rejenerasyonuna etkileri………. 16 Çizelge 4-5 Tüylü fiğ (V.villosa Roth.) bitkisinde farklı TDZ oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi……… 18 Çizelge 4-6 Tüylü fiğ (V.villosa Roth.) bitkisinde TDZ-IBA oranlarının rejenerasyonuna etkileri………...20 Çizelge 4-7 Tüylü fiğ (V.villosa Roth.) bitkisinde farklı KİN oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi………. 22 Çizelge 4-8 Tüylü fiğ (V.villosa Roth.) bitkisinde KİN-IBA oranlarının rejenerasyonuna etkileri………..23
ŞEKİLLER DİZİNİ
Şekil Sayfa Şekil 1-1 Tüylü fiğ (Vicia villosa) bitkisinin görünümü ... 2 Şekil 4-1 BAP-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu………..17 Şekil 4-2 TDZ-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu………..19 Şekil 4-3 KİN-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu………..21
SİMGE VE KISALTMALAR DİZİNİ
Kısaltmalar Açıklama
°C Santrigrat
BAP 6-Benzil Amino
Pürin/benziladenin
HCl Hidroklorik Asit
IBA İndol 3 bütirik Asit
NaOH Sodyum Hipoklorit
NaOCI Sodyum Hidroksit
MS Murashige ve Skoog Besi Ortamı
TDZ Thidiazuron
NAA Naftalinasetikasit
KİN Kinetin
LED Light Emitting Diodes
WPM IAA DMRT S$D VK KO
Woody Plant Medium Indolasetikasit Duncan Testi Serbestlik Derecesi Varyasyon Kaynakları Kareler Ortalaması Simgeler Açıklama M Mikromol Cm Santimetre Dk Dakika Dsu Distile su G Gram L Litre Mg Miligram ml Mililitre
1. GİRİŞ
Hayvansal üretimin artırılmasında bakım ve beslemenin iyileştirilmesi ile mümkün olur. Yapılan çalışmalarda besleme seviyesi hayvanların verimini en çok etkileyen faktördür. Bu sebeple hayvanların beslenme istekleri, hayvanlara beslenmeleri için verilen yemler farklı hayvan çeşitlerine uygun bir şekilde hazırlanarak, hayvan yemlemenin özünü oluşturan faktörlerin en doğru şekilde bilinmesi gerekmektedir. Şöyleki çeşitli hayvansal ürünün ekonomik olarak uygun olması için miktar ve kalitenin uygun yemler kullanılarak mümkün olur (Kutlu, 2008). Tüylü fiğ (Vicia villosa Roth.) bu şekilde kullanılabilecek alternatif yem bitkilerinden birisidir (Özpinar ve ark., 2000).
Vicia cinsi esas olarak dünyada tropikal ılıman ve subtropikal bölgelerde bulunmaktadır
ve yaklaşık 166 tür içermektedir (Maxted, 1993). Bunların çoğunun kromozomları diploid olup, (x=5, 6 veya 7) (Maxted ve ark.,1991), sadece 6 tür poliploid genom yapısı göstermektedir (Cremonini ve ark., 1992). Tüylü fiğ kışa dayanaklı baklagil tek yıllık yem bitkisidir. Dünyanın birçok yerinde bikisel ve hayvansal üretim için ot ve tane amaç için yetiştirilmektedir. Yaygın olarak çiftlik hayvanlarının beslenmesi için kullanılmaktadır (Ramos ve ark., 2000; Açıkgöz, 2001; Cabellero ve ark., 2001; Chowdhurry ve ark., 2001; Han, 2010). Fiğ bitkisi besleyici olmakla birlikte proteince zengin bir yemdir. Çok sayıda ülkede yaygın bir şekilde tüketilmektedir. Ülkemizle beraber birden fazla ülkede Ortadoğu ve Akdeniz bölgesinde fiğ taneleri kaba yemlerle tahıl taneleri ile birlikte karıştırılarak hayvan besini olarakta kullanılmaktadır. Fiğ iyi bir yeşil gübre olarak ve otlatma bitkisi olarak ta kullanılmaktadır (Karakurt ve ark., 2002). İki yıllık fiğ türleri serin ve nemli bölgelerde bulunmaktadır. Kumlu topraklarda iyi bir gelişme gösterirken, kıraç veya kurak bölgelerde verimde düşüş olur. Yetiştirmek için uygun pH ise 4.8-9.2 arasında değişir. Erozyonu karşı etkili olan (Verhallen ve ark., 2003) tüylü fiğ toprakta azot fiksasyonu ile toprağa azotça zenginleştirir (Smith ve ark., 1987).
Tüylü fiğ bitkisinin kök sistemi dallanmış ve derinlere inebilmektedir. Gövde ince ve zayıf olması nedeniyle kolaylıkla yatar ve ot üretimi için tahıllarla birlikte yetiştirilmesi önerilmektedir. Yapraklar karşılıklı birleşik olup, 4-10 yaprakçık ile oluşmaktadır. Bitkinin tüm organları ince tüylerle kaplıdır ve bazı tüysüz çeşitleri de bulunmaktadır.
Çiçekler yaprak koltuğundan çıkan sap üzerinde yer almaktadır. Çiçeklerin renkleri birbirinden farklıdır (Şekil 1-1). Meyveler, 2-3 cm uzunluğunda düz fasulye şeklindedir ve bir meyvede 2-8 tohum bulunmaktadır. Tohumların renkleri birbirinden farklı olup, sarıdan siyaha kadar değişen renklerde tohumlar vardır. Tüylü fiğ genel olarak beslenme değeri yüksek olduğu için kuru ot veya silaj olarak kullanılmaktadır. Tüylü fiğ, Türkiye tarım için çok önemli bitki olup, hayvan yem olarak kullanılmaktadır.
Şekil 1-1 : Tüylü fiğ (Vicia villosa) bitkisinin görünümü
Fiğ bitkilerini geliştirmek amacıyla yapılan ıslah çalışmalarındaki temel amaç; üretimin arttırılması, yem kalitesinin geliştirilmesi, fazla vejetatif gelişim özellikleri üzerinde değişimin yaratılması ve birçok biyotik veya abiyotik stres koşullarına dayanıklılığın artırılmasıdır. Son zamanlarda bitki biyoteknoloji araçları kullanılarak bitki ıslah ve geliştirme çalışmaları yapılmaktadır. Bitki doku külütürü teknikleri ile farklı eksplantlar ve bitki hormon kullanarak in vitro koşullarda mikroçoğaltım yöntemleri geliştirilerek daha sonra sekonder metabolit, gen aktarım gibi farklı amaç için kullanılabilmektedir. Yaptığımız bu çalışmada amacımız V. villosa bitkisinin farklı sitoknin-oksin içeren ortamında daha hızlı ve verimli üretim yapılmasıdır.
2. KURAMSAL TEMELLER ve KAYNAK ARAŞTIRMASI
Bitki doku kültürleri bitkinin çeşitli kısımlarından alınan küçük bir doku parçasını (eksplant) sterilizasyon edilmenin ardından, in vitro şartlarda besi ortamlarında ve uygun çevre koşullarında (ışık, rutubet, sıcaklık) kültüre alınmasıdır (Dağüstü, 2018) .
Bitki doku kültürü, bitkilerin hücre, dokularıyla birlikte organlarınıda kullanarak kozmetikte, farmasötikle tarımsal olarakta sekonder metabolitler üretilebilmektedir. Daha verimli bir üretimle daha ucuz olmasının yanında ürünün daha çok miktarda üretilmesi için amaçlanarak çok daha farklı çalışmalar yapılması gerekmektedir. Moleküler biyolojik araştırmalar yapılarak ürün verimini artırarak, başka bir materyalden fazla ürün alınmasıyla genetiği değiştirilmiş bitkilerden yeni bitkiler elde edilmesi için metotlar geliştirilmiştir. Bu metotlarla üretilen doğal hammaddelerden yararlanılarak yan etki göstermeyen “güvenli” ilaçlar elde edilebilmektedir (Yağcı ve ark., 2008).
Genetikçiler doku kültürünü, seçilmiş olan genotiplerin değerlendirilmesi, hızlı büyüyen fertlerin ortaya çıkarılmasıyla, soğuğa, kuraklığa, hastalıklara, tuzluluğa ve herbisitlere dayanıklılık gösteren bireylerin seçilmesinde etkin bir şekilde kullanılmıştır İn vitro teknikleri ile genellikle problemsiz ve hızlı bir üretim ile, daha gelişmiş ıslah çalışmaları kullanılarak önemli kazançlar sağlamaktadır (Dağüstü, 2018).
Normal hücresel metabolizma sırasında bitkiler devamlı olarak ROS (Reaktive oxygene species) üretirler. Onlar aynı zamanda antioksidan enzimler ve metabolitlerin yardımıyla bu ROS’ları temizlerler (Younis ve ark., 2010). Gen transfer teknolojileri orgonogenez veya emriyogenez yoluyla ortaya çıkan ya direk olarak ya da indirek olarak kesilmiş dokudan yeterli ve uygun rejenerasyon sistemi olan geleneksel üretme programlarıdır (Kuchuk, 2001).
Bitkilerin çoğaltılması için kullanılmış olan hücre ve doku kültürü çalışmalarında meydana gelen farklılaşma tipleri, kök ve sürgün üretimidir. Meydana gelen iki olaya organogenez adı verilmektedir. Bu süreçler dışarıdan bir etki olmaksızın düzenli bir şekilde (zigotik bitki embriyolarındaki gibi) oluşur ve buna somatik veya adventif embriyogenez olarak adı verilmektedir ( Dinçer, 2010).
Stresin verim üzerindeki etkisini anlamak ve çözümlemek büyük bir tarımsal ve bilimsel mücadeledir ve biyoteknolojik üretmede de etkili bir alternetif olacaktır. Bununla birlikte rejenatörler ve transformantlar arasındaki somaklonal varyasyonların riskini azaltmak için, bunları somatik emriyogenez yoluyla üretmek daha iyidir (Ochatt, 2017)
Arafeh ve ark. (2003), origanum syriacum’un in vitro koşullarda çoğaltımı üzerine yaptıkları araştırmada, farklı konsantrasyonlarda (0, 0,4, 0,8, 1,2, 1,6 veya 2,0 mg/l) KİN, BAP veya TDZ içeren MS ortamları hazırlanmıştır. En çok sürgün 0,4 mg/l KİN ve 0,8 veya 1,2 mg/l BAP kombinasyonundan elde edilmiştir. Farklı olarak bu çalışmada tek başına BAP’ın sürgün indüksiyonunda çok etkili olmuştur.
Arikat ve ark. (2004), Salvia fruticosa (Anadolu adaçayı)’ın mikroçoğaltımı için NN (Nitsch ve Nitsch), B5 (Gamborg B5) ve MSgibifarklı besin ortamlarında BAP, KİN, ve TDZ’nın etkisi için kültür ortamlarına alınmışlardır. Eksplant olarak koltuk altı ve sürgün uçları kullanılmıştır. Sürgün sayısı en çok 0.75 μM dozu içerin besi ortamında belirlenmiştir. Bununla birlikte araştırıcılar meydana gelen sürgünleri köklenmesi için farklı oksin hormonları (IBA, IAA, NAA) denemişlerdir. Köklenmesi için en çok başarı 2,7 μM IBA ile sağladığı belirlenmiştir. Ayrıca, in vitro ve in vivo şartlarda S.
fruticosa’nın türünün uçucu yağ bileşenlerini de araştırmışlardır. Temel bileşenler
olarak α-pinene, borneol, 1.8-cineole ve camphor’un olduğunu tespit edilmiştir. Ancak bu bileşenlerin in vitro şartlardaki bitkilerde in vivo şartlarakarşın daha yüksek oranda bulundukları kaydedilmiştir.
Misic ve ark. (2006), tarafından S. brachyodon’a ait koltukaltı eksplantlarında BAP ve TDZ’nin sürgün rejenerasyonu üzerine etkisi araştırılmıştır. Elde edilen sonuçlara göre, artan BAP veya TDZ dozu ile sürgün rejenerasyonu da bağlı olarak bir artış gözlemlenmiştir. Ancak, sürgün oluşumunda BAP hormonun daha etkili olurken, TDZ’nin sürgün boyu için olumsuz etkilediği kaydedilmiştir.
Siddique ve Anis (2007), Ocimum basilicum’un hızlı çoğaltımı için olgun bitkiden alınan sürgün ucu eksplantı farklı süre (4, 8, 12 ve 16 d) ve 5-100μ M TDZ içeren sıvı besi ortamda geliştirilmeye alınmıştır. Sürgün oluşumu için optimum koşulların 50 μM TDZ’ın 8 günlük indüksiyonu sonrasında TDZ olmayan besi ortamına ait alt kültüre
adet) ve sürgün uzunluğu (4,8 cm) olduğu gösterilmiştir. 8 günden fazla indüksiyona bırakıldığında birleşmiş ve biçimsiz sürgün gerçekleştirilmiştir. Çalışmadan elde edilmiş sürgünler 1 μM içeren IBA hormonu bulunan bir ortamda köklendirilip, başarıyla toprağa aktarılmıştır.
Aasim ve ark. (2008) tarafından yapılan çalışmada kırmızı adasoğanı (Urginea
maritima L.) bitkisinin tek ve ikili pul yapraklardan in vitro koşullarda soğan çoğaltımı
işlemi yapılmıştır. Eksplantlar farklı oranda TDZ içeren MS ortamında 8 hafta karanlıkta ve 16 saat ışık fotoperiyot altında bekletilmiştir. Çalışma sonuçlarına göre, karanlıkta tutulmuş ortamı eksplantlardan rejenerasyona olumsuz etki bırakmıştır. 16 saat ışık fotoperiyot altında tutulan eksplantlar üzerinde ise hızlı şekilde soğan rejenerasyonu kaydedilmiştir. İkili pul yapraklar, tekli pul yapraklara göre soğan rejenerasyon için daha uygun bulunmuştur. İkili pul yapraklar üzerinde hem adventif hemde aksil soğan oluşumu gözlenmiştir. TDZ’nın bütün konsantrasyonlarda, adventif soğan oluşuma göre yan soğan oluşumu daha fazla kaydedilmiştir. Çoğltilmış soğanları 1 mg/l IBA ile köklendirme yapılmıştır. Tüm soğanlar alıştırıldıktan sonra tarlaya aktarılmıştır.
Irina (2008), S. officinalis bitkisinde farklı oksin (NAA ve IBA) ve sitokininlerin (BAP, KİN) sürgün rejenerasyonda nasıl etki ettiğini için denemeler yapılmıştır. Sürgünün daha iyi gelişimi için BAP hormonunun gerekli olduğunu ve başarılı sürgün gelişiminin 2.22 μM BAP dozunda gerçekleştiği kaydedilmiştir.
Narbon fiğ tarımsal olarak önemli yem bitkisidir ve orta Asya’dan başlayıp Asya kıtasında bulunmuştur. Kendir ve ark. (2008) tarafından yapılan bu çalışmada 4-5 ile 14-15 gunluk bitkilerden elde edilen kotiledon boğum eksplantı kullanılmıştır. Çalışma sonucunda 4-5 günlük kotiledon boğum eksplantından daha fazla sürgün rejenerasyon kaydedilmiştir. Sürgünler 50 mg/l IBA ile ön biçalışmaya tabi tutulup köklendirilmiştir. Sahin-Demirbag ve ark. (2008a), önemli yem ve çayır bitkisi çayır üçgülü [Trifolium
pannonicumJ ACQ. Subsp. Elongatum (WILLD)]’nun hipokotil, kotiledon boğumu ve
kotiledon eksplantı kullanılmıştır. En fazla sürgün oluşum oranı, sürgün sayısı ve en uzun sürgünler hipokotil eksplanttan 1 mg/l BAP-0.1 mg/l NAA içerdiği MS ortamdan kaydedilmiştir. Oluşan sürgünler farklı oranda IBA içeren MS ortamda köklendirilme
belirlenmiştir. Meydana gelen bu bitkiler saksılara aktarılmış ve adaptasyon sağlayan bitkilerden çiçekler ve daha sonra tohum elde edilmiştir.
Sahin-Demirbag ve ark. (2008b), farklı oranda TDZ içeren MS ortamda Macar fiğ (Vicia pannonica) bitkisinin kotiledon boğum eksplantından hızlı çoğaltım yapılmıştır. Elde edilen sonuçlarına göre TDZ nın konsantrasyonları, sürgün oluşum oranı ve eksplant başına sürgün sayısına etkilemiştir. En çok sürgün oluşum oranı 0.45 mg/l TDZ içeren MS ortamda belirlenmiştir. Oluşan bu sürgünler 50 mg/l IBA ile ön muamele yapılıp köklendirme sağlanmıştır.
Sahin-Demirbag ve ark. (2008c), baklagil yem bitkisi olup önemli bir potansiyele sahip olan mürdümük bitkisinin kotiledon boğum eksplantları değişik oranlarda TDZ içeren MS ortamlarına kültüre alınmıştır. En fazla sürgün rejenerasyonu (100%) ile en yüksek sürgün sayısı (11,83 adet) 0,2 mg/L TDZ ve 300 mg/L Casein hdyrolsate içeren besin ortamlarında kaydedilmiştir. En iyi bir adventif sürgün gelişimiyle sürgün uzunluğu farklı TDZ hormonları uygulanmasıyla farklılığı önemli bulunmamıştır. Köklendirme oranına bakıldığında ise IBA‟da 5 ve 7.30 dk‟da bekletildikten sonra önemli farklılık olmamıştır. Bekleme sürelerinde de %60.0’ın üzerinde köklenme oranı elde edilmiştir. Bu çalışmanın sonunda mürdümük bitkisinin kotiledon boğumlarından az bir süre içerisinde yüksek adventif sürgün rejenerasyon sistemi gösterilmiştir.
Aasim ve ark. (2009), çemen (Trigonella fonemgraecum L.) bitkisinde in
vitro rejenerasyonu için sürgün ucu ve kotiledon yaprak eksplantları farklı oranda TDZ
veya TDZ-IBA içeren ve agarla katılaştırılmış MS ortamda kültüre alınmıştır. En fazla sürgün rejenerasyonu 0.40 mg/l TDZ içeren MS ortamda kaydedilmiştir. Elde edilen sürgünlerde köklendirme oluşmamıştır.
Kendir ve ark. (2009), narbon fiğ (V. narbonensis L.) da mikroçoğaltım için 4-5 ve 14-15 günlük bitkilerden elde edilen kotiledon boğum eksplantı kullanılmıştır. Eksplantları 2-6 mg/l Kinetin-0.1 mg/l IBA ortamınada kültüre konulmuştur. Çalışma sonucunda 14-15 günlük kotiledon boğum eksplantlar üzerinde sürgün rejenerasyonu bulunmamıştır. En fazla 3.81 adet, 2.11 cm uzun sürgünler ile %93.33 sürgün oluşum oranı 4-5 günlük zigotik embriyoları meydana gelmiştir. In vitro çoğaltılmış sürgünler 50 mg/l IBA ile 7 dk ön muamele yaparak köklendirme yapılmıştır. Elde edilen bitkiler morfolojik olarak
Aasim ve ark. (2010), trigonella bitkisinin in vitro koşullarda çimlenen 8-10 günlük fidelerden elde edilen kotiledon boğum eksplantları 0.05 ile 0.80 mg/l KİN, 0.25 ile1.0 mg/l BAP + NAA (0, 0.20 mg/l) ve 0.05 ile 0.80 mg/l TDZ + IBA (0, 0.10 mg/l IBA) ve gelrit ile katılaştırılan besi ortamlarında kültüre alınmıştır. Eksplant başına en fazla 22.21 adet sürgün 0.40 mg/l TDZ içeren ortamda belirlenmiştir. In vitro çoğaltılmış sürgünler 0.1- 1.0 mg/l IBA veya NAA ortamlara köklendirme alınmıştır ama bitkiler köklendirilmemiştir.
Aasim ve ark. (2011), tüylü fiğ (V. villosa Roth) bitkisinin çoklu sürgün elde etmesi için tohum eksplantları 0.05 – 1.6 mg/l TDZ + IBA (0, 0.10 mg/l IBA) içerdiği besi ortamında kültüre alınmıştır. Sürgün rejenerasyon yüzdesi %45.83-75.00 kaydedilmiştir. Eksplant başına en fazla 28.6 adet sürgün 0.20 mg/l TDZ-0.10 mg/l IBA içeren ortamda gösterilmiştir. Ortamda IBA olmasına rağmen TDZ oranı artışı ile sürgün uzunluğunda azalma kaydedilmiştir. Genel olarak, IBA içeren ortamdan IBA olmayan ortama göre daha uzun sürgün belirlenmiştir. Elde edilen sürgünler köklendirme için 50 mg/l IBA ile 5, 10 ve 20 dk muameleye tabi tutulmuştur.
Verma ve ark. (2011), Digitalis lamarckii (bodur yüksükotu) bitkisinde sürgün organogenezisi için yapılan birinci çalışmada in vitro şartlarda çimlendirilmiş bitki fidelerinden elde edinilen yaprak eksplantları kullanılarak, BAP, KİN, TDZ ve zeatin (ZEA)’in farklı konsantrasyonları kıyaslanmıştır. İkinci yapılan çalışmada ise ilk çalışmada optimize edilmiş eksplantlar kullanılarak IBA, BAP, KİN, TDZ ve ZEA ile kombinasyonlarında kültüre alınmıştır. Sürgün rejenerasyonunda (birinci deneme) meydana gelen sonuçlar incelendiğinde, TDZ’nin, BAP’den daha etkili sonuç verdiği gözlenmiştir. En yüksek eksplant başına ortalama 10,3 sürgün, 1.0 mg/l dozunda kaydedilmiştir. Diğer çalışmaya baktığımızda ise sürgün sayısı 0,2 mg/l IBA+0,2 mg/l TDZ (16,5), BAP (11,0), ZEA (5,5) veya KİN (4,0) kullanılarak elde edilmiştir. Sürgünlerde rejenere olanlarında, 0,5 mg/l IAA içerenlerde kolay bir şekilde köklendirilmiştir. Köklendirilmiş olan rejenerantlar, saksılara aktarılarak normal bir oluşum gösterip olgunlaşma sürecini tamamlamışlardır.
Aasim ve ark. (2012), adı fiğ (V. sativa L.)’ın olgunlaşmamış kotiledon eksplantları 0.05-0.80 mg/l TDZ-0.10 mg/l IBA ile zenginleştirilmiş besi ortamında kültüre alınmıştır. 0.80 mg/l TDZ-0.10 mg/l IBA içeren ortamda sadece kallus oluşumu
gözlenirken, sürgün oluşmamıştır. Sürgün rejenerasyon frekansı (%) ve sürgün sayısı sırasıyla %25.0-58.33 ve 8.33-19.33 adet olarak belirlenmiştir. Maksimum sürgün rejenerasyon yüzdesi (58.33%) ve sürgün sayısı (19.33 adet) 0.20 mg/l TDZ-0.10 mg/l IBA içeren MS ortamında gözlenmiştir. En uzun sürgün ise eşit miktardaki TDZ-IBA içeren ortamda elde edilirken, 5 cm olarak belirtilmiştir. Ortamda çoğu sürgünlerde köklendime olmuştur.
Atalay ve Erişen (2014), kritik endemik Centaurea lycaonica bitkisinin in vitro çoğaltım araştırılmıştır. Yaprak eksplantları, BAP, TDZ, KİN gibi sitokinin ile NAA, Dicamba, Picloram, IBA, IAA, 2,4-Diklorofenoksiasetik asit (2,4-D) gibi oksin kullanılmıştır. En fazla 32.27 adet sürgün, 0.5 mg/L BAP + 0.2 mg/L NAA birlikteliğinde bulunmuştur. KİN hormonlu ortamlarda eksplantların öldüğü belirlenmiştir. Daha sonra 0.5 mg/L BAP içerdiği ortamında oluşan sürgenlerden elde edilmiş nodal segment eksplantlarından 8.73 adet sürgün alınmıştır. Sürgünlerin köklenmesi için 2.0 mg/L IAA en uygun olduğunu kaydedilmiştir.
Arslan ve ark. (2016), Iris galatica bitkisinin in vitro şartlarda olgunlaşmamış embriyolar ve oluşan sürgünlerden elde edilmiş yaprakların farklı oranlarda ve TDZ, BAP ve NAA içeren besi ortamında kültüre alınmıştır. Eksplant başına 4.85 (olgunlaşmamış embriyo) ve 3.04 (yaprak) adet sürgün belirlenmiştir. Rejenere olmuş sürgünler 3-5 cm uzunluğa geldiklerinde 1 mg/l IBA veya NAA ortamlarda köklendirme yapılmıştır.
Dadaşoğlu ve ark. (2017), yapılan çalışmada korunga (Onobrychis sativa L.) türünün, farklı hormonlar (NAA, BAP, KİN, TDZ) kullanılarak çoğalım çalışmaları yapılmıştır. 42 farklı yöntem denenmiş olup deneyi iki aşamada gerçekleştirilmiştir. İlk aşamada tohumları hormonsuz bir şekilde çimlendirilirken, ikinci aşamada ise tohumlar hormon kullanılarak çimlendirilmiştir. Tohumlardan oluşan fidancıklardan alınan hipokotil, kök ve kotiledon eksplantları farklı oranlarda aktarılmıştır. En yüksek sürgün oluşumu (29.0), 1.5 mg/l BAP kullanılarak 90. gün sonunda kök eksplantından kaydedilmiştir. Kotiledonlarda ise en çok sürgün (7.8), 1.0 mg/l TDZ’da 90. günün sonunda belirtilmiştir. Hipokotil eksplatından en başarılı kök oluşumunu 14. 8 adet ile 0.4 mg/l NAA kullanılarak kaydedilmiştir.
Yorgancılar ve ark. (2017), tıbbi endemik bir bitki olan Astragalus trojanus Stev. bitkisinin nodal kültürler ile klonal çoğaltımı yapılması amacıyla kültüre alınarak çalışmalar yapılmıştır. Bitki tohumları besi ortamında çimlendirilerek ve meydana gelen steril bitkiciklerinden elde edilen nodal segmentleri kullanılmıştır. İlk MS ve Woody Plant Medium (WPM) besin ortamlarının sürgün çoğaltımına etkilerinin buluması amaçlanmıştır. Değişik olarak kullanılan eksplantlarda konsantrasyonlarda BAP (0.2, 0.5, 1.0, 2.0 mg/L) içeren MS besin ortamlarında kültüre alınmıştır. Kültüre alınan eksplantların 4 haftanın sonunda en çok sürgün sayısı (2.80), 0.5mg/L BAP ve WPM ortamında belirtilmiştir. Daha sonra ise nodal segmentler, BAP, TDZ, KİN’in farklı konsantrasyonlar (0.2, 0.5, 1.0, 2.0 mg/L) ve WPM temel besin ortamında çalışma yapılmıştır. 4 hafta bekledikten sonra TDZ ve KİN’in sürgün sayılarına birbirlerine benzer etki gösterirken, en yüksek sürgün sayısının (2.09) BAP’dan meydana geldiği kaydedilmiştir. Rejenere sürgünler köklenmek için 1 veya 3 mg/l IBA, NAA veya IAA içeren WPM kültür ortamlarına alınmıştır. Kültür yapıldıktan 4 hafta sonra en yüksek köklenme (%80), 3 mg/l IBA içeren WPM ortamında, en fazla kök sayısı (4.33) 3 mg/l IAA içeren WPM ortamından belirlenmiştir. Kökleri oluşan fidecikler 1:1 (torf:perlit) oranında içeren plastik bardaklara aktarılmış dış ortama başarıyla aktarılmıştır. Tam bitki gelişimi ise 15 hafta sonunda bitirilmiştir.
Aasim ve ark (2018), Melissa officinalis (L.) bitkisinin in vitro’de çimlenmiş 8-10 günlük fidelerden izole edilmiş kotiledon yaprkları adventif sürgün rejenrasyonu için farklı oranda TDZ (0.10, 0.20, 0.40 and 0.80 mg/l) ve IBA (0, 0,10 mg/l) ile zenginleştirilmiş MS ortamına kültüre alınmıştır. 2-3 hafta sonra eksplantlarda nekroz görülmeye başladı ve eksplanlar TDZ-IBA ile 1.0 mg/l PVP içerdiği yeni ortamına aktarılmıştır. Deneme sonucunda kallus rejenerasyonu (%2,22-83,33), sürgün rejenerasyonu (%0-61,11), sürgün sayısı (0-9.40) ve sürgün uzunluğu (1,89-3,43 cm) olarak bulunmuştur. En yüksek sürgün rejenerasyonu (%61,11) ve sürgün sayısı (9.40) TDZ+IBA (0,40+0,10 mg/l) içerdiği ortamından elde edilmiştir. En uzun sürgün (3,43 cm) ise 0,80 mg/L TDZ+0,10 mg/L IBA ile zenginleştirilmiş ortamında kaydedilmiştir.
İn vitro çoğaltılmış sürgünler IBA ile köklendirildikten sonra başarı ile saksılarda
3. MATERYAL ve METOD
3.1. Deneme Yeri
Bu çalışma, Karamanoğlu Mehmetbey Üniversitesi, Kamil Özdağ Fen Fakültesi, Hidrobiyoloji Laboratuarında yürütülmüştür.
3.2. Bitki Materyali
Bitki materyali olarak kullanılan tüylü fiğ tohumları, Tarla Bitkileri Araştırma Merkezi, Ankara’dan temin edilmiştir.
3.3. Büyüme Ortamları ve Büyüme Koşulları
Bu çalışmalarda besi ortamın hazırlanması için MS, mineral tuz ve vitaminleri kullanılmıştır. Besi ortamı için %3 sükroz (Duchefa) ve % 0.6g’lük agar (Duchefa) ile katılaştırılmış MS besin ortamı kullanılmıştır. Besi ortamının hazırlanması için distile saf su kullanılmıştır. Yapılan çalışmalara uygun olarak farklı dozlarda bitki büyüme BAP, TDZ ve KİN gibi sitokinin ile oksin olarak 0.1 mg/l IBA ilave edilmiştir. Hazırlanan ortamların pH’sı 1N NaOH/HCl yardım ile 5,6-5,8 arasında ayarlanlanmıştır. TDZ içerdiği ortamda ise TDZ ilave ettikten sonra pH’sı ayarlanmıştır. Daha sonra, besi ortamları 1,2 atm basınç ve 121oC sıcaklıkta 20 dk tutularak sterilizasyonu yapılmıştır. Tez kapsamında yapılacak bütün çalışmalar beyaz LED ışık altında 16/8 saat ışık/karanlık fotoperiyodunda ve 24+1oC sıcaklıkta yapılmıştır.
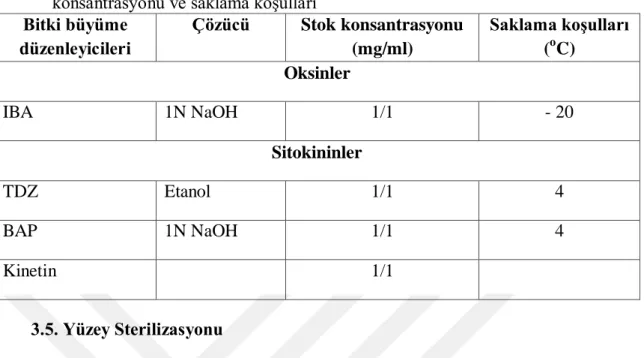
3.4. Büyüme Düzenleyicilerinin Çözücüleri ve Saklama Koşulları
Tez kapsamında kullanılan tüm kimyasallar farklı şirketlerden (Duchefa, Merck ve Sigma Aldrich Chemical Co.) temin edilmiştir. İn vitro rejenerasyon için kullanılan sitokinin ve oksin hormonların stok solüsyonları için ilk önce uygun çözücülerle çözülüp (Çizelge 3.1) ardından 1 mg/l şekilde hazırlanmıştır. Filtre steril edilmiş KİN ve IBA hormonları ortamlara otoklavdan sonra ve BAP ile TDZ steril edilmeden önce ilave edilmiştir. Hazırlanan stok solüsyonlar uygun sıcaklıkta 6-12 ay muhafaza edilmiştir (Çizelge 3-1).
Çizelge 3-1 : Denemelerde kullanılmış olan büyüme düzenleyicilerinin çözücüleri, stok konsantrasyonu ve saklama koşulları
Bitki büyüme düzenleyicileri Çözücü Stok konsantrasyonu (mg/ml) Saklama koşulları (oC) Oksinler IBA 1N NaOH 1/1 - 20 Sitokininler TDZ Etanol 1/1 4 BAP 1N NaOH 1/1 4 Kinetin 1/1 3.5. Yüzey Sterilizasyonu
Tüylü fiğ’e ait tohumların sterilizasyonu çamaşır suyu kullanılmıştır (Aasim ve ark. 2011). Sterilizasyon için farklı oranda (%25, %50 ve %75) çamaşır suyu (%5 NaOCl-ACE) farklı sürelerde (10, 15 ve 20 dk) kullanılmıştır. Ardından 3 kez distile saf su ile durulanarak sterilizasyon tamamlanmıştır.
3.6. İn Vitro Çimlenme ve Eksplant İzolasyonu
Sterilizasyonun ardından tohumlar; steril edilmiş magentalar içerisinde sükroz (%3 veya 30 g/l) ve agar (%0,65; 6,5 g/l) içerdiği MS ortamlarına aktarılarak, 24+1oC’de 16/8 saat ışık/karanlık fotoperiyotda çimlenme için kültüre alınmıştır. İn vitro koşullarda çimlenmiş bitkiciklerden, in vitro koşullar altında kotiledon boğum (KB) eksplantları; hasar vermeden dikkat edilerek izole edilip, hormon içeren besi ortamına yerleştirilmiştir. Yapılan tüm in vitro doku kültürü ve köklendirme çalışmaları steril kabın tamamlanmıştır.
3.7. Köklendirilmesi ve Adaptasyon
Besi ortamında yüksek oranda köklü bitkicikler elde edildiği için köklendirme çalışmaları yapılmamıştır. Ayrıca, köklenmemiş sürgünlerin köklendirilmesi için farklı oranlarda NAA veya IAA (0,25, 0,50, 0,75, 1,0 mg/l) kullanılmıştır. Köklendirme ortamında köklenmiş bitkilerin adaptasyonu için ilk olarak agardan uzaklaştırılıp, saf su ile yıkanmıştır. Bu bitkiler toprağa aktarılana kadar su içinde bekletilmiştir. Daha sonra,
saksılarda homojen nem içeren substrata (vermikülit) aktarılmıştır. Saksılar polietilen poşet ile kapatılıp, iklim odasında büyüme için yerleştirilmiştir. 2 hafta sonra poşetlerde delik açılarak tamamen dış koşullarda adaptasyon çalışması yapılmıştır (Aasim ve ark., 2013).
3.8. İstatistik Analizi
Denemeler, tesadüf parselleri deneme desenine göre kurulmuş olup, 3 defa tekrarlanan Magenta GA7 kutuları veya petrilerden oluşturulmuştur. Deneme sonucunda veriler ise “SPSS 20 for Windows’’ programıyla varyans analizine tabi tutulmuştur. Ortamları karşılaştırmak amacıyla Duncan Multiple Range Test (DMRT) kullanılmıştır. Yüzde değerler, istatistik analizi yapmadan önce arcsin değerlerine çevrilmiştir. (Snedecor ve Cochran, 1967).
4. BULGULAR ve TARTIŞMA
4.1. Sterilizasyon Çalışmaları
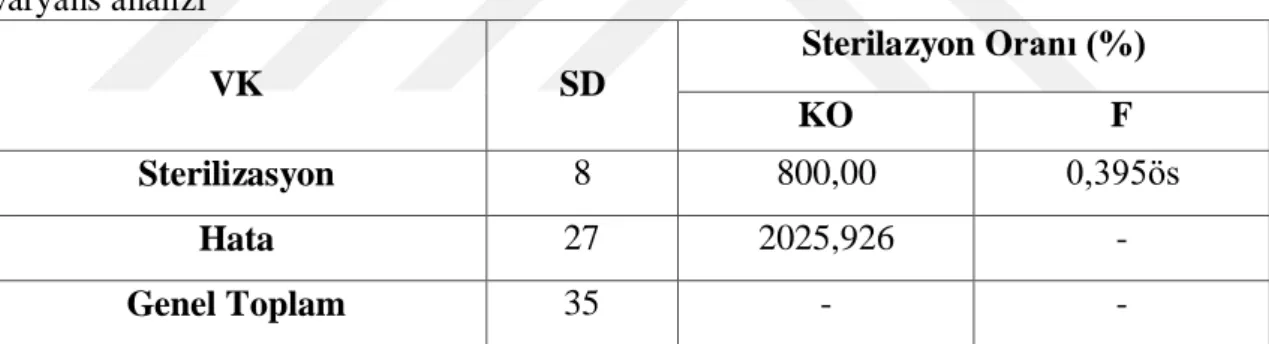
Tüylü fiğ tohumların sterilizasyonu için %5 NaOCl içeriyi olan ticari çamaşır suyu (ACE) kullanılmıştır (Asim ve ark., 2011). Çamaşır suyu birçok kültür bitkilerin tohumlarının sterilizasyonu için yaygın olarak tercih edilmektedir (Mirici, 2004; Erdoğan ve ark., 2005; Özdemir ve Kürşat, 2014; Dadaşoğlu ve Tosun, 2017). Yapılan sterilizasyon çalışmasında tohumlar %25, %50 ve %75’lik oranlarda ve farklı sürelerde (10, 15 ve 20 dk) çalkalanmıştır. Daha sonra steril distile su ile 3 kere 5 dk’ lık yıkama işlemleri yapılmıştır. Tüylü fiğ bitkisinde daha önce yapılmış çalışmada %100 çamaşır suyu kullanılmıştır (Asim ve ark., 2011). Sterilizasyon yaptıktan sonra, tohumlar MS ortamına kültüre alınmıştır ve iki hafta boyunca gözlemlenmiştir. Çizelge 4.1. V. villosa tohumunda yapılan sterilizasyona ait varyans analizi gösterilmiştir.
Çizelge 4-1 : Farklı NaOCl oranın ve süresinin V. villosa tohumlarının sterilizasyona ait varyans analizi VK SD Sterilazyon Oranı (%) KO F Sterilizasyon 8 800,00 0,395ös Hata 27 2025,926 - Genel Toplam 35 - -
ös: önemsiz, VK: varyasyon kaynakları, SD: serbestlik derecesi, KO: kareler ortalaması
Çizelge 4-1 bakıldığında NaOCl oranının ve süresinin tohumların sterilizasyonunda istatistiksel olarak herhangi etkisi bulunmamıştır. Ayrıca, elde edilmiş olan veriler ise çizelge 4-2’de verilmiştir.
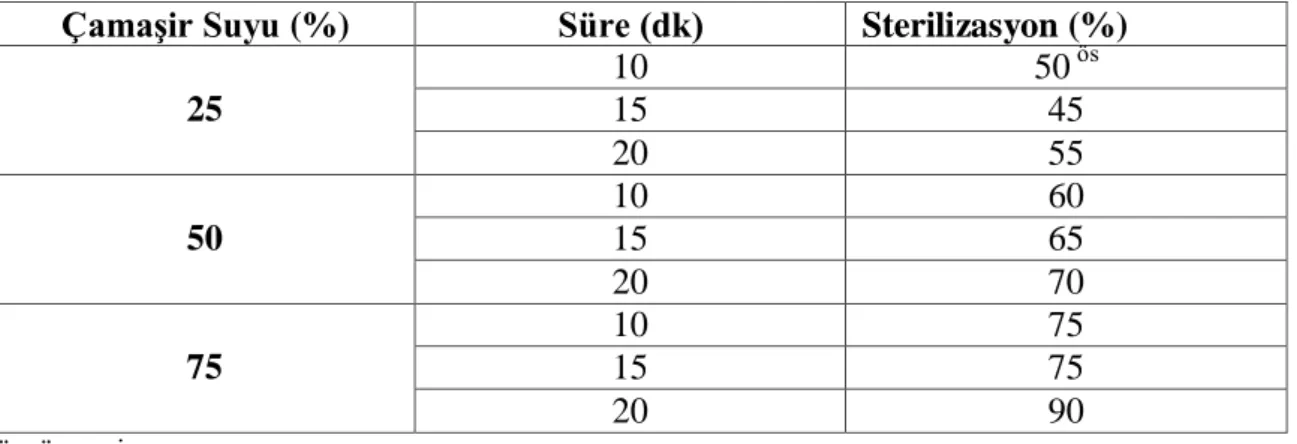
Çizelge 4-2 Farklı NaOCl oranın ve süresinin V. villosa tohumlarının sterilizasyona ait veriler
Çamaşir Suyu (%) Süre (dk) Sterilizasyon (%) 25 10 50 ös 15 45 20 55 50 10 60 15 65 20 70 75 10 75 15 75 20 90 ös: önemsiz
Çizelge 4-2 incelendiğinde %25 lik oranda tohumların 10 dk’lık süre bekletilmesiyle %50’lik sterilizasyon, 15 dk’da %45 ve 20 dk’da %55 sterilizasyon gösterdiği kaydedilmiştir. %50 lik oranda tohumların 10 dk bekletilmesiyle %60 sterilizasyon, 15 dk bekletilmesiyle %65 sterilizasyon ve 20 dk bekletilmesiyle %70 sterilizasyon gösterdiği belirlenmiştir. Son olarak %75 lik oranda sterilizasyon yapılmış ve 10 dk’lık süre tohumlar bekletildiğinde %75 lik sterilizasyon, 15 dk bekletildiğinde %75 sterilizasyon ve 20 dk bekletildiğinde ise %90 sterilizasyon gösterdiği kaydedilmiştir. Ayrıca, tüm oranlarda 20 dk’lık sterilizasyon sonucunda en iyi sterilizasyon olduğu kaydedilmiştir. Tohumların sterilizasyonu için en iyi sonuçlara bakıldığında %75 lik oranda 20 dk bekletildiğinde %90 oranında sterilizasyon gösterdiği belirlenmiştir. Asim ve ark. (2011) tarafından yapılmış sterilizasyon çalışmasında %100 çamaşır suyu ve 20 dk süre sonucunda %100 çimlenme elde edilmiştir. Bu sonuçlar gösteriyor ki çamaşır suyu oranı arttığında çimlenme miktarı da artmıştır. Çamaşır suyu daha önce farklı oranda ve süre ile farklı bitkilerin tohumların sterilizasyonu için başarı ile kullanılmıştır (Mirici, 2004; Erdoğan ve ark., 2005; Özdemir ve Kürşat, 2014; Dadaşoğlu ve Tosun., 2017).
4.2. Farklı BAP-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri
Birinci denemede V. villosa bitkisinin in vitro koşullarda çimlenme sağlayan iki haftalık fideciklerden kotiledon boğum eksplantları alınarak farklı dozlarda BAP (0,10, 0,20, 0,40, 0,80 ve 1,60 mg/l) ve IBA (0,10 mg/l) ile zenginleştirilmiş ortamlarda kültürü alınmıştır. Denemeler sürekli kontrol edilirken altıncı haftaya kadar besi ortamında
gelişim için bekletilmiştir. İkinci hafta izlenimlerde eksplantlarda uzama ve kök oluşumuna rastlanılmıştır. Dördüncü hafta izlenimlerinde ikinci haftaya göre daha yoğun sürgün çıkışı ve büyüme gerçekleşmiştir. Altıncı haftaya doğru ilerledikçe çok fazla sürgün çıkışları, sürgünlerde gelişme ve boylarda uzama görülmüştür. Ayrıca, BAP-IBA kullandığında eksplantlarda kallus oluşumu da gözlemlenmemiştir. İn vitro besi ortamda sitokinin-oksin kullandığında farklı bitkilerde kallus oluşumu rapor edilmiştir (Mirici, 2004; Özdemir ve Kurşat, 2014). Altıncı haftada diğer haftalara göre kök oluşumu daha belirgin olarak kaydedilmiştir. Besi ortamında BAP-IBA varlığında sürgün rejenerasyonu ile beraber kök oluşumu daha önce Acinos rotundifolius bitkisinde rapor edilmiştir (Özdemir ve Kurşat, 2014). Elde edilmiş olan veriler istatiksel analize tabi tutulmuştur (Çizelge 4-3).
Çizelge 4-3 Tüylü fiğ (V. villosa Roth.) bitkisinde farklı BAP oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi
VK SD Rejenerasyon oranı (%) Sürgün uzunluğu (cm) KO F KO F Hormon 4 296,415 2,286* 3,257 1,220* Hata 10 129,681 - 2,670 - Genel Toplam 14 - - - - Eksplant başına sürgün sayısı Kök oluşumu (%) Hormon 4 0,537 2,500* 898,107 6,925** Hata 10 0,215 - 129,681 - Genel Toplam 14 - - - -
** p < 0,01 düzeyinde önemli, * p < 0,05 düzeyinde önemli, VK: varyasyon kaynakları, SD: serbestlik derecesi, KO: kareler ortalaması
Çizelge 4-3 de görüldüğü gibi BAP-IBA ortamlarda rejenerasyon oranı, sürgün sayısı ve sürgün uzunluğu p<0,05 düzeyinde farlılık derecesine sahipken kök oluşumu p<0,01 düzeyinde önemli olarak bulunmuştur. Çizelge 4-4’te Duncan testi ile farklılığın önem düzeyini belirlemek amacı verilmiştir.
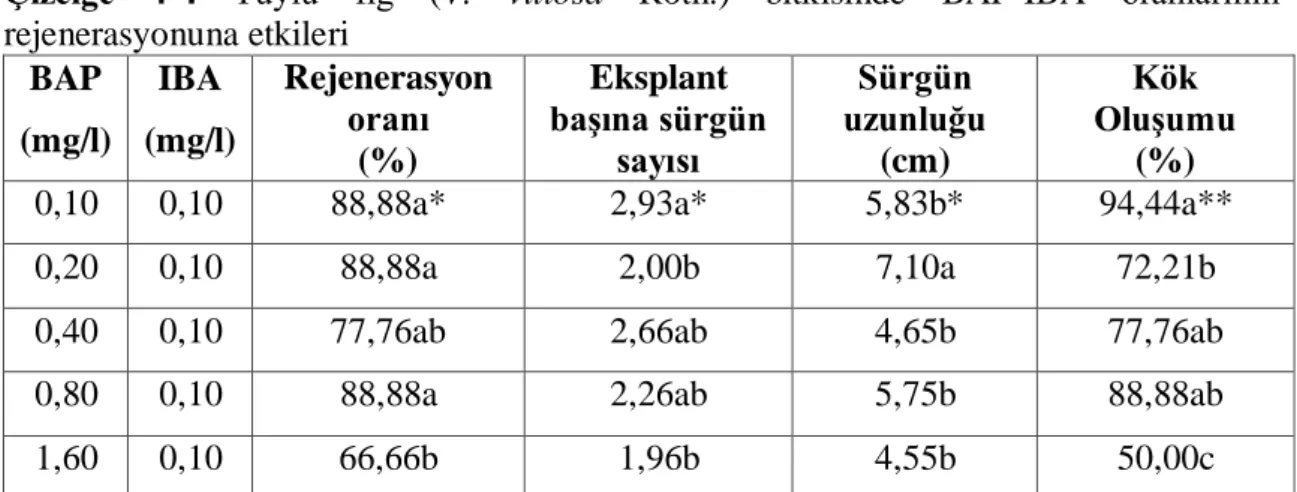
Çizelge 4-4 Tüylü fiğ (V. villosa Roth.) bitkisinde BAP-IBA oranlarının rejenerasyonuna etkileri BAP (mg/l) IBA (mg/l) Rejenerasyon oranı (%) Eksplant başına sürgün sayısı Sürgün uzunluğu (cm) Kök Oluşumu (%)
0,10 0,10 88,88a* 2,93a* 5,83b* 94,44a**
0,20 0,10 88,88a 2,00b 7,10a 72,21b
0,40 0,10 77,76ab 2,66ab 4,65b 77,76ab
0,80 0,10 88,88a 2,26ab 5,75b 88,88ab
1,60 0,10 66,66b 1,96b 4,55b 50,00c
**Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,01 düzeyinde önemlidir. *Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,05 düzeyinde önemlidir.
Çizelgede 4-4’te görüldüğü gibi BAP hormonu kullanıldığında sürgün rejenerasyon yüzdesi, eksplant başına sürgün sayısı ve kök oluşumunda oransal bir sonuca rastlanmamıştır. Sürgün rejenerasyon oranı %66.66-88.88 arasında olduğu bulunmuştur.
Acinos rotundifolius bitkisinde yaptığı çalışmada BAP-IBA kullandığında %28-91
arasında sürgün rejenerasyonu elde edilmiştir (Özdemir ve Kurşat, 2014). En düşük rejenerasyon oranı (%66,66) 1,60 mg/l BAP ve 0,10 mg/l IBA içeren ortamında kaydedilmiştir. En yüksek rejenerasyon oranı (%88,88) 0,10 mg/l BAP+0,10 mg/l IBA içeren ortamlarda görülmüştür. Sonuçlar gösteriyor ki BAP-IBA oranlarının belirgin bir etkisine rastlanmamıştır.
Eksplant başına düşen sürgün sayısı 1,96-2,93 adet olarak bulunmuştur. Eksplant başına en çok sürgün sayısı (2.93) 0,10 mg/l BAP ve 0,10 mg/l IBA içeren MS ortamında belirlenmiştir. Buna karşılık olarak ortamda eşit oranda BAP ve IBA kullanılarak en yüksek eksplant başına sürgün sayısı A. rotundifolius bitkisinde de kaydedilmiştir (Özdemir ve Kurşat, 2014). Eksplant başına en az (1,96) sürgün sayısı 1,60 mg/l BAP ve 0,10 mg/l IBA ortamında kaydedilmiştir. Besi ortamdaki BAP ve IBA’nın oranı geven bitkisinde eksplant başına sürgün sayısı için önemli olduğunu rapor edilmiştir (Mirici, 2004). Benzer şekilde besi ortamda BAP-NAA oranının sürgün sayısına etkilendiği rapor edilmiştir (Erdoğan ve ark., 2004).
Şekil 4-1 : BAP-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu
Sürgün uzunluğuna bakıldığında ise 4.55-7.10 cm olarak bulunmuştur. En uzun sürgünler 0,20 mg/l BAP ve 0,10 mg/l IBA içeren MS ortamında 7.10 cm iken, en kısa sürgün uzunluğu ise 1,60 mg/l BAP ve 0,10 mg/l IBA içeren ortamda 4,54 cm olarak kaydedilmiştir. A. rotundifolius bitkisinde en uzun sürgünler 0,5 mg/l BAP+0,5 mg/l IBA içeren ortamda elde edilmiştir (Özdemir ve Kurşat, 2014).
Eksplantlarda BAP hormon kullanıldığında kök oluşumu da gözlemlenmiştir. Kök oluşumu %50.00-94.44 arasında bulunurken en düşük (%50.00) kök oluşumu 1,60 mg/l BAP+0,10 mg/l IBA içeren ortamda kaydedilmiştir. En yüksek (%94.44) kök oluşumu ise 0,10 mg/l BAP ve 0,10 mg/l IBA içeren ortamda bulunmuştur. Eksplantlarda kök oluşumu ortamdaki oksin (IBA) içerdiği için düşünülmüştür. Benzer şekilde besi ortamda oksin varlığında eksplantlarda kök oluşumu A. rotundifolius (Özdemir ve Kurşat, 2014) ve korunga (Dadaşoğlu ve Tosun, 2017) gibi bitkilerinde de rapor edilmiştir.
Genel olarak en düşük sürgün rejenerasyon yüzdesi, eksplant başına sürgün sayısı, sürgün uzunluğu ve kök oluşumu 0,80 mg/l BAP+0,10 mg/l IBA içerdiği ortamda kaydedilmiştir. En iyi sonuçlar ise ortamda 0,10 mg/l BAP+0,10 mg/l IBA eklendiğinde elde edilmiştir.
4.3. Farklı TDZ-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri
V. villosa bitkisinin tohumları in vitro koşullarda çimlenerek iki haftalık fideciklerinden
kotiledon boğum eksplabtları alınarak farklı oranlarda TDZ (0,10, 0,20, 0,40, 0,80 ve1,60 mg/l) ve IBA (0,10 mg/l) içerdiği ortamlarda kültüre alınmıştır. İkinci haftada bazı TDZ-IBA (0,10-0,10 mg/l, 0,80-0,10 mg/l ve 1,60-0,10 mg/l) içeren ortamlarında sürgün uçları çıkışı görülmüştür. Benzer şekilde daha önce V. villosa bitkisinde TDZ-IBA içeren ortamında tohum eksplantından 10-12 gün içinde de sürgün oluşumu elde edilmiştir (Aasim ve ark., 2011). Dördüncü hafta sonunda çoklu sürgün oluşumu bazı ortamlarda daha belirgin şekilde görülürken, kök oluşumu kaydedilmemiştir. Altıncı hafta sonunda ortamlarda sürgün uzunluğunda da artış kaydedilmiştir. Besi ortamda TDZ ile beraber IBA olmasına rağmen kallus oluşumu rastlanmamıştır. Buna karşı, V.
villosa bitkisinde daha önce tohum eksplantlarda TDZ-IBA kullandığında radikula
kısmından kallus oluşumu rapor edilmiştir (Asim ve ark., 2011). Benzer şekilde V.
ervilia bitkisinin kotiledon boğum eksplantında öncelikle kallus oluşumu ve bu
kalluslardan da sürgün oluşumu rapor edilmiştir (Erdoğan ve ark., 2003). Adı fiğ bitkisinde yapılan çalışmada kallus oluşumu sadece 0,80 mg/l TDZ-0,10 mg/l IBA içerdiği ortamında rapor edilmiştir (Aasim, 2012). Altı hafta sonunda oluşan veriler ise istatistik analizine tabi tutulmuştur (Çizelge 4-5)
Çizelge 4-5 Tüylü fiğ (V. villosa Roth.) bitkisinde farklı TDZ oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi
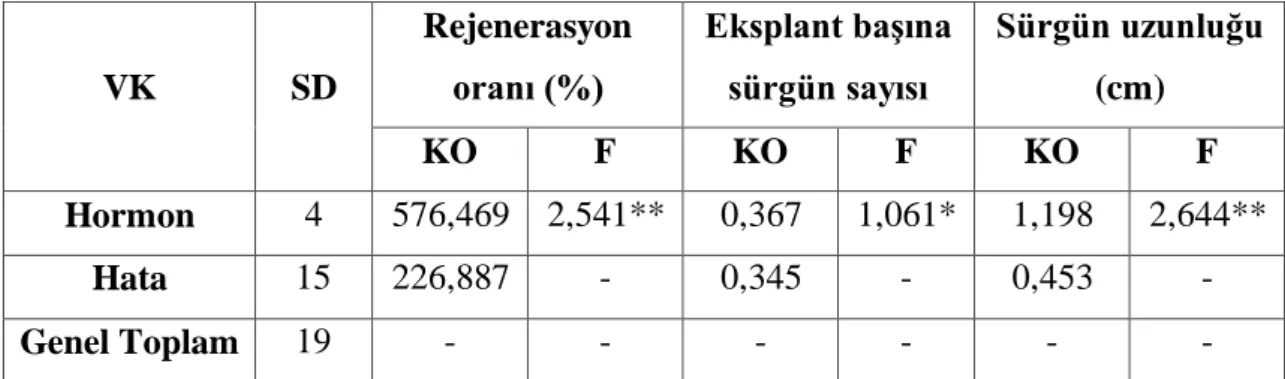
VK SD Rejenerasyon oranı (%) Eksplant başına sürgün sayısı Sürgün uzunluğu (cm) KO F KO F KO F Hormon 4 576,469 2,541** 0,367 1,061* 1,198 2,644** Hata 15 226,887 - 0,345 - 0,453 - Genel Toplam 19 - - - -
** p < 0,01 düzeyinde önemli, * p < 0,05 düzeyinde önemli, VK: varyasyon kaynakları, SD: serbestlik derecesi, KO: kareler ortalaması
Çizelge 4-5 de görüldüğü gibi TDZ-IBA rejenerasyon oranı (%) ve sürgün uzunluğu
p<0,01 düzeyinde önemli olduğu belirlenmiştir. Eksplant başına düşen sürgün sayısı ise p<0,05 düzeyinde önemli bulunmuştur. Çizelge 4-6’ da Duncan testi bu farklılığın
önem düzeyini belirlemek için verilmiştir.
Şekil 4-2 TDZ-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu
Besi ortamda büyüme düzenleyici tipi ve oranı sürgün oluşumu için çok önemlidir. Yapılan bu çalışmada (Çizelge 4-6) TDZ-IBA kullandığında sürgün rejenerasyonu etkilendiğini görülmüştür (Erdoğan ve ark., 2003; Asim ve ark., 2011). Korunga bitkisinde yapılan çalışmada TDZ tek kullandığında sürgün oluşumuna herhangi etki etmemiştir. Ancak, TDZ+NAA kombinasyon halinde çoklu sürgün oluşumu rastlanmıştır. (Dadaşoğlu ve Tosunu, 2017).
Sürgün rejenerasyon oranı %62,50-87,50 arasında olduğu kaydedilmiştir. Rejenerasyon oranı en az (%62,50) 0,80 mg/l TDZ+0,10 mg/l IBA MS ortamlarında olduğu kaydedilmiştir. En fazla rejenerasyon oranı ise (%82,50) 0,20 mg/l TDZ+0,10 IBA ve 0,40 mg/l TDZ+0,10 mg/l IBA ortamlarında olduğu bulunmuştur. A. tuberosum bitkisinde en yüksek rejenerasyon oranı (%40) 0.5mg/l TDZ+0.04mg/l NAA besi ortamında bulunmuştur (Alizadeh, 2008). V. villosa bitkisinde TDZ-IBA kullandığında en yüksek sürgün rejenerasyon (%75) besi ortamda 0,05 mg/l TDZ+0,10 mg/l IBA ilave edildiğinde kaydedilmiştir (Asim ve ark., 2011). Besi ortamlarda 0.80 mg/l TDZ oranına kadar artışı ile rejenrasyon yüzdesinde de artışı kaydedilmiştir. Benzer sonuçlar
daha önce Macar fiğ bitkisinde (Sahin-Demirbag ve ark., 2008) ve adı fiğ bitkisinde (Aasim, 2012) yapılan in vitro rejenerasyon çalışmada da elde edilmiştir.
Çizelge 4-6 Tüylü fiğ (V.villosa Roth.) bitkisinde TDZ-IBA oranlarının rejenerasyonuna etkileri TDZ (mg/l) IBA (mg/l) Rejenerasyon oranı (%)** Eksplant başına sürgün sayısı* Sürgün uzunluğu (cm)** 0,10 0,10 66,66ab 1,96a 0,85b
0,20 0,10 87,50a 2,00a 1,67ab
0,40 0,10 87,50a 2,14a 1,68ab
1,60 0,10 83,33ab 2,62a 2,24a
0,80 0,10 62,50b 2,51ab 1,10b
**Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,01 düzeyinde önemlidir. *Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,05 düzeyinde önemlidir.
Eksplant başına sürgün sayısı 1,96-2,62 adet olarak belirlenirken, en düşük sürgün sayısı (1,96 adet) 0,10 mg/l TDZ+0,10 mg/l IBA içeren MS ortamlarında iken, en fazla sürgün sayısı (2,62 adet) 0,80 mg/l TDZ+0,10 mg/l IBA ortamında kaydedilmiştir. V.
villosa bitkisinde yapılan başka bir çalışmada en yüksek sürgün sayısı 0,20 mg/l
TDZ+0,10 mg/l IBA ile zenginleştirilmiş ortamda kaydedilmiştir (Asim ve ark., 2011). Besi ortamda TDZ oranın artışı ile eksplant başına sürgün sayısında artış gözlemlenmiştir. Benzer sonuçlar daha önce tüylü fiğ (Asim ve ark., 2011) ve Macar fiğ bitkisinde de rapor edilmiştir (Sahin-Demirbag ve ark., 2008). A. trojanus bitkisinde eksplant başına düşen sürgün sayısı uygulanan farklı oranlarda düzenli olarak artış gösterirken, çalışmada sürgün sayısı TDZ oranları arttıkça düzenli olarak azalmıştır (Yorgancılar ve ark., 2017).
Besi ortamda TDZ-IBA varlığının sürgün uzunluğuna belirgin bir etkisi kaydedilmemiştir. Buna karşı TDZ oranın artışı ile düşük sürgün uzunluğu daha önce V.
villosa (Asim ve ark., 2011) ve macar fiğ (Sahin-Demirbag ve ark., 2008) bitkisinde
rapor edilmiştir. Sürgün uzunluğu 0,85-2,24 cm arasında bulunmuştur. En kısa sürgün uzunluğu (0,85cm) 0,10 mg/l TDZ+0,10 mg/l IBA kaydedilirken en kısa sürgün uzunluğu (2,24cm), 0,80 mg/l TDZ+0,10 mg/l IBA içeren ortamlarda kaydedilmiştir. Buna karşı V. villosa bitkisinde en yüksek sürgün 0,05 mg/l TDZ+0,10 mg/l IBA ile
4.4 Farklı KİN-IBA Oranlarının İn Vitro Rejenerasyonuna Etkileri
V. villosa bitkisinin in vitro koşularda iki haftalık çimlenmiş fideciklerden alınan
kotiledon boğum eksplabtları izole edilerek farklı oranlarda KİN (0,10, 0,20, 0,40, 0,80 ve 1,60 mg/l) ve IBA (0,10 mg/l) içerdiği ortamlarda kültüre alınmıştır. Ortamlarda KİN-IBA ve kotiledon boğum eksplantları kullanılarak narbon fiğ bitkisinin başarıyla sürgün rejenerasyon elde edilmiştir (Kendir ve ark., 2009). Denemeler altıncı haftaya kadar sürekli oluşum izlenilmiş ve değişimler kaydedilmiştir. İkinci haftada tüm ortamlarda, doğrudan sürgün çıkışları görülmüştür. Ayrıca, tüm ortamlarda ikinci haftadan itibaren kök çıkışı da kaydedilmiştir. Buna karşılık kök oluşumunda KİN hormonu uygulamasıyla 30 günün sonunda istatiksel anlamda çok önemli farklılıklar izlenmiştir. (Dadaşoğlu, 2017). Ortamlarda farklı KİN oranları ve IBA varlığın olmasına rağmen kallus oluşumu görülmemiştir. Dördüncü haftada eksplantlar incelendiğinde ikinci haftaya göre oranla sürgün ucu sayısında artış ile sürgün boylarında ve köklerinde uzama kaydedilmiştir. Altıncı hafta sonunda elde edilmiş olan veriler istatiksel analize tabi tutulmuştur (Çizelge 4-7).
Şekil 4-3 KİN-IBA içeren ortamında Tüylü Fiğ (V. villosa Roth.) bitkisinin in vitro koşullarda oluşan sürgün rejenerasyonu
Çizelge 4-7 Tüylü fiğ (V. villosa Roth.) bitkisinde farklı KİN oranları ile 0.1 mg/l IBA oranlarının rejenerasyonuna ait varyans analizi
VK SD Rejenerasyon oranı (%) Sürgün uzunluğu (cm) KO F KO F Hormon 4 241,721 2,085* 7,741 2,649** Hata 15 115,954 - 2,922 - Genel Toplam 19 - - - - Eksplant başına sürgün sayısı Kök Oluşumu (%) Hormon 4 1,075 3,771** 1861,181 8,553** Hata 15 0,285 - 217,613 - Genel Toplam 19 - - - -
** p < 0,01 düzeyinde önemli, * p < 0,05 düzeyinde önemli, VK: varyasyon kaynakları, SD: serbestlik derecesi, KO: kareler ortalaması
Çizelge 4-7 de görüldüğü gibi KİN–IBA ortamlarında kök sayısı, eskplant başına düşen sürgün sayısı ve sürgün uzunluğu p< 0,01 düzeyinde önemli bulunurken, sürgün rejenerasyon yüzdesi ise p< 0,05 düzeyinde önemli olduğu kaydedilmişti. Bu farklılığın önem düzeyini belirtmek için yapılan Duncan testi çizelge 4-8 de verilmiştir.
Çizelge 4-8 gösterildiği gibi rejenerasyon oranı %66,66-%87,42 arasında olduğu bulunmuştur. Rejenerasyon oranı en düşük (%66,66) 0,80 mg/l KİN+0,10 mg/l IBA içeren ortamlarda kaydedilirken, en yüksek rejenerasyon oranı (%88,88) 0,10 mg/l KİN+0,10 mg/l IBA ortamlarında belirlenmiştir. Buna karşı, MS besi ortamında farklı oranlarda kullanılan KİN ile rejenerasyon oranında herhangi değişikliğe sebep olmamış ve rejenerasyon oranı %100 olarak kaydedilmiştir (Uyanık, 2017). Bu sonuçlar arasındaki fark ise farklı genotipten kaynaklanmaktadır.
Çizelge 4-8 Tüylü fiğ (V. villosa Roth.) bitkisinde KİN-IBA oranlarının rejenerasyonuna etkileri KİN (mg/l) IBA (mg/l) Rejenerasyon oranı (%)* Eksplant başına sürgün sayısı** Sürgün uzunluğu (cm)** Kök Oluşumu (%)** 0,10 0,10 87,42a 1.79b 5,45b 87,50 0,20 0,10 83,33ab 3,10a 5,69b 58,33b 0,40 0,10 79,16ab 2,27ab 5,00b 41,66bc 0,80 0,10 66,66b 2,28ab 6,20ab 33,33c 1,60 0,10 79,16ab 1,87b 8,53a 41,66bc
**Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,01 düzeyinde önemlidir. *Aynı sütunda farklı harflerle gösterilen ortalamalar arasında fark p < 0,05 düzeyinde önemlidir.
Eksplant başına sürgün sayısı 1,79-3,10 adet olarak kaydedilmiştir. Eksplant başına en az sürgün sayısı (1,79) 0.10 mg/l KİN+0,10 mg/l IBA içeren MS ortamında elde edilirken, en yüksek sürgün sayısı (3,10) ise 0,20 mg/l KİN+0,10 mg/l IBA içeren ortamlarda kaydedilmiştir. Yorgancılar ve ark. (2017) tarafından yapılan çalışmada besi ortamındaki 0.20 mg/l KİN ile en düşük sürgün sayısı izlenmiştir. Benzer şekilde Dadaşoğlu (2017) tarafından yapılan değerlendirmede eksplant başına düşen sürgün sayısı KİN VE KİN+NAA içeren ortamlarda izlenmiştir.
Sürgün uzunluğu ise 5,00 cm–8,53 cm aralığında kaydedilmiştir. En kısa sürgün uzunluğu (5,00 cm) 0,40 mg/l KİN+0,10 mg/l IBA MS ortamında kaydedilmiştir. En uzun sürgün uzunluğu ise (8,53 cm) 1,60 mg/l KİN+0,10 mg/l IBA MS ortamında olduğu bulunmuştur. Buna karşı, sürgün sayısında KİN hormon uygulamasında istatiksel bir fark rastlanmamıştır (Uyanık, 2017).
Kök oluşumu ise %33,33-87,50 aralığında iken en az kök oluşumu (%33,33) 0,80 mg/l KİN+0,10 mg/l IBA ortamlarda görülmüştür. En yüksek kök oluşumu (%87,50) ise 0,10 mg/l KİN+0,10 mg/l IBA ortamlarında elde edilmiştir.
4.5. Köklendirme ve Adaptasyon
Baklagil bitkilerde in vitro ile çoğaltılan sürgünlerin köklendirilmesi genel olarak zordur (Aasim ve ark., 2013). Yapılan bu çalışmalarda BAP-IBA ve KİN-IBA kullanıldığında yüksek oranda köklenmiş bitkiler elde edilmiştir. Bu bitkiler direkt olarak toprağa aktarılmıştır. Ancak, toprakta adaptasyon çok düşük olduğu kaydedilmiştir. Ancak, TDZ-IBA içeren ortamında kökler rastlanmamıştır. Tüylü fiğ bitkisinde yapılan bir önceki çalışmada sürgünlerin köklendirilmesi oluşmamıştır (Aasim ve ark., 2012). Besi ortamında TDZ’nın varlığında kök oluşumuna olumsuz etkileri baklagil bitkilerde rapor edilmiştir (Aasim 2012; Aasim ve ark, 2012).
İn vitro ortamlarda çoğaltılan bitkilerin köklendirilmesinde farklı oranlarda (0,25, 0,50,
0,75, 1,0 mg/L) NAA veya IAA kullanılarak kültüre alınmıştır. İki hafta sonra belirgin bir kök oluşumu gözlenmezken, dördüncü hafta sonunda bazı sürgünlerde kök oluşumu başlamıştır. Altıncı haftada bitkilerde çoklu kök oluşumu gözlenmiştir. Tüylü fiğ bitkisinde daha önce yapılan çalışmada kök oluşumu gerçekleşmemiştir (Aasim ve ark., 2012). Buna karşı, narbon fiğ bitkisinde yüksek oranda IBA ile muamele yapıldığında kök oluşumu sağlanmıştır (Kendir ve ark., 2009).
Köklendirme ortamında kök oluşumu ile beraber çoklu sürgün oluşumu da gözlemlenmiştir. Köklendirme ortamında çoklu sürgün oluşumu kök oluşumuna engellenirken, kök ve sürgün arasında kallus oluşumunu da sebep olur. Bu durumda köklenmiş bitkilerin adaptasyonu zor olur. Bu çoklu sürgün oluşumu daha önce börülce (Aasim ve ark., 2008), çemen (Aasim ve ark., 2011), mercimek (Aasim, 2012) ve nohut (Aasim ve ark., 2013) gibi diğer baklagil bitkilerde de rastlanmıştır. Bunun sebebi ise besi ortamındaki oksin varlığının ve sitokininin etkisi olduğu rapor edilmiştir (Aasim ve ark., 2008, 2013).
Köklendirilmiş bitkiler adaptasyon için agardan zarar vermeden çıkarılmıştır ve ardından agarı uzaklaştırmak amacıyla çeşme suyu ile durulanmıştır. Daha sonra, homojen nem içeren torf+perlit karışımı içeren saksılara aktarılmıştır. Ardından, saksılar şeffaf poşet ile kapatılıp, adaptasyon için 23±1 °C sıcaklıkta iklim odasında bekletilmiştir (Aasim ve ark., 2013). Bir hafta sonra poşetlere delik açılıp ve daha sonra poşetler tamamen çıkartılmıştır. Ancak, çok düşük oranda (%10) adaptasyon
oranda adaptasyon sağlanmıştır (Aasim 2012). Baklagil bitkilerde köklendirmeden sonra adaptasyon da zor bir aşamadır ve bazı bitkilerde rapor edilmiştir (Aasim ve ark., 2013).
5. SONUÇLAR ve ÖNERİLER
Tüylü fiğ hayvan yemi olarak kullanılan önemli bitkilerden birisidir. Yapılan bu çalışmada temel amaç, üretimin arttırılması ve yem bitkisinin kalitesini geliştirmek amacı yapılmıştır. Bitkilerde modern biyoteknolojik araçları kullanmak için önce in
vitro doku kültürü optimizasyonuna ihtiyaç duyulmaktadır. Bu çalışmada bitki doku
kültürü teknikleriyle sterilizasyon, in vitro şartlarda çoğaltım, köklendirme ve adaptasyon sağlanması yapılmıştır. Farklı eksplantlarla farklı oranlarda hormonlar (BAP+IBA, KİN+IBA, TDZ+IBA) kullanılarak in vitro koşullarda çoğaltım yapılmıştır. Çalışma sonucunda elde edilen sonuçlar ve öneriler aşğıdaki şekilde özetlenmiştir.
V. villosa tohumunun sterilizasyon çalışmasında en iyi sonucu %75 oranında çamaşır suyu kullanılarak 20dk. bekletilerek %90 oranında bir başarı elde edilmiştir. Bu sonuçlar gösteriyor ki çamaşır suyunun oranını arttırarak %100 sterilizasyon sağlanabilmektedir.
V. villosa bitkisinin in vitro koşullarda çoğaltılması için üç farklı hormon (BAP+IBA, KİN+IBA, TDZ+IBA) ve farklı oranlarda kullanılmıştır.
Kullanılan farklı hormonlar olmasına rağmen kallus oluşumu gözlemlenmemiştir.
Besi ortamlarda BAP+IBA veya KİN+IBA uygulamalarında kök oluşumu meydana gelirken, TDZ+IBA kök oluşumu kaydedilmemiştir.
Rejenerasyon yüzdesi (%) baktığımızda en çok başarı elde edilen hormon uygulaması BAP+IBA %88.88 oranında kaydedilmiştir. Genel olarak BAP-IBA’ nın tüm oranlarda diğer hormonlara göre en iyi rejenerasyon yüzdesi kaydedilmiştir.
Eksplant başına sürgün sayısı incelendiğinde hormonların tipi ve oranların etkileri ortaya çıkmıştır. Eksplant başına düşen en fazla sürgün sayısı 0.20 mg/l KİN+0.10 mg/l IBA uygulamasında 3.10 oranında belirtilmiştir. BAP-IBA ortamlarda en fazla 2.93 adet sürgün 0.10 mg/l BAP+0.10 mg/l IBA ortamından
elde edilmiştir. TDZ-IBA ortamlarda en fazla eksplant başına sürgün (2,62 adet) 0,80 mg/l TDZ+ 0.10 mg/l IBA içerdiği ortamında kaydedilmiştir.
Genel olarak besi ortamlarında TDZ-IBA, BAP+IBA ve KİN+IBA hormonlarına göre sürgün uzunluğu daha az olduğu kaydedilmiştir. Sürgün uzunluğu en düşük 0,10 mg/l TDZ + 0,10 mg/l IBA içerdiği ortamda 0,85cm olarak kaydedilmiştir. Buna karşı BAP-IBA veya KİN-IBA kullanıldığında 4,0 ile 7,0 cm arasında uzun sürgünler elde edilmiştir.
Genel olarak bitkilerin in vitro koşullarda yapılan köklendirmede farklı oranlarda NAA veya IAA kullanılmıştır. Yapılan bu çalışmada çoklu sürgün çıkışları ile birlikte kök oluşumu da kaydedilmiştir.
Köklendirilmiş bitkilerin adaptasyon çalışmaları uygun şartlarda gerçekleştirilmesine karşın adaptasyon oranı düşük kaydedilmiştir. Bu konuda daha kapsamlı çalışmalar yapılması gerekmektedir.
Dünyada ve ülkemizde yem bitkilerin verim ve kalite ile ilgili çalışmalar hızla artmaktadır. Hem laboratuvar hem de tarla çalışmalar ile tüylü fiğ gibi bitkilerinin geliştirilmesi için daha yoğun çalışmalar gerekmektedir. Tüylü fiğ bitkisinin ıslah amacıyla yeni ve tekrarlanabilir mikroçoğaltım yöntemlerin geliştirilmesi çok büyük önem arz etmektedirler. Bu nedenle Türkiye’nin gelecekte ıslah edilmiş tüylü fiğ bitkisinden maksimum fayda sağlanabilmesi için mikroçoğaltım yöntemlerine yönelik araştırmaların hızlandırılması ve sürdürülmesi gerekmektedir.
KAYNAKLAR
Aasim, M., Khawar, KM. ve Ozcan, S., 2008. In vitro Regeneration of Red Squill Urginea maritima (L.) Baker. using Thidiazuron. Biotechnol. Biotechnol. Eq. 22(4), 925-928.
Aasim, M., Khawar, KM. ve Ozcan, S., 2009. In vitro shoot regeneration of Fenugreek(Trigonela foenumgraecum L.). American Eurasian Journal of
Sustainable Agriculture, 3(2), 135-138.
Aasim, M., Hussain, N., Umer, EM., Zubair, M., Hussain, SB., Saeed, S., Rafique, TS. ve Sancak, C., 2010. In vitro shoot regeneration of fenugreek (Trigonella
foenum-graecum L.) using different cytokinins. African Journal of Biotechnology, 9, 7174-7179.
Aasim, M., Sahin-Demirbag, N., Khawar, M.K., Kendir, H. ve Özcan, S., 2011. Direct axillary shoot regeneration from the mature seed explant of the hairy vetch (Vicia
villosa Roth). Archives of Biological Sciences, 63 (3), 757-762.
Aasim, M., 2012. In vitro shoot regeneration of common vetch (Vicia sativa L.) using ımmature cotyledons. Journal of Applied Biological Sciences, 6, 43-45.
Aasim, M., 2012. Micropropagation of lentil (Lens culinaris Medik.) using pulse treatment of immature plumular apices. Pakistan Journal of Agricultural
Sciences, 49(2), 149-154.
Aasim, M., Özcan S.F., Khawar, K.M. ve Özcan, S., 2012. Comparative studies on the competence of axillary shoot regeneration on unsliced and longitudinally sliced cotyledon nodes of cowpea (Vigna unguiculata (L.) Walp.). Turkish Journal of
Botany, 37(2), 281-287.
Aasim, M., Day, S., Rezaei, F. ve Hajyzadeh, M., 2013. Multiple shoot regeneration of plumular apices of chickpea. Turkish Journal of Agriculture and Forestry, 37, 33-39.
Aasim, M., Kahveci, B., Korkmaz, E., Doğanay, F., Bakırcı, S., Sevinc, C., Akin, F., Kirtiş, A. 2018. TDZ-IBA induced adventitious shoot regeneration of water balm (Melissa. officinalis L.). Journal of Global Innovation on Agriculture and
Social Sciences, 6:35-39.
Açıkgöz, E., 2001. Yem Bitkileri, Uludağ Üniversitesi Ziraat Fakültesi Tarla Bitkileri Bölümü, No: 182, Bursa, 410s.
Alizadeh, B., Royandazagh, S.D., Khawar, K.M. ve Özcan, S., 2013. Micropropagation of garlic chives (Allium tuberosum ROTTL. EX SPRANG) using mesocotyl axis. The Journal of Animal & Plant Sciences, 23, 543-549.