T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ KALP VE DAMAR CERRAHİSİ ANABİLİM DALI
KARDİYOPULMONER BYPASSIN APELİN VE SALUSİN
EXPRESYONLARINA ETKİLERİ VE SALUSİNİN AORT,
SAFEN, VEN VE ARTERYEL GREFTLERDE LOKAL OLARAK
SENTEZLENİP SENTEZLENMEDİĞİNİN ARAŞTIRILMASI
Dr. SUNA AYDIN TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ KALP VE DAMAR CERRAHİSİ ANABİLİM DALI
KARDİYOPULMONER BYPASSIN APELİN VE SALUSİN
EXPRESYONLARINA ETKİLERİ VE SALUSİNİN AORT,
SAFEN, VEN VE ARTERYEL GREFTLERDE LOKAL OLARAK
SENTEZLENİP SENTEZLENMEDİĞİNİN ARAŞTIRILMASI
Dr. SUNA AYDIN TIPTA UZMANLIK TEZİ
DANIŞMAN
Prof. Dr. M. NESİMİ EREN
ÖNSÖZ
Dicle Üniversitesi Tıp Fakültesi Kalp ve Damar Cerrahisi Anabilimdalı’nda; uzmanlık eğitimimde; mesleki bilgi, beceri, pratik ve teorik anlamda yetişmemi sağlayan, sağlam ve anlayışlı kişiliği, hastaya yaklaşımı, sahiplenmesi, titizliği ile her zaman örnek, iyi bir eğitimci ve yönetici olan Anabilim Dalı Başkanımız ve danışmanım Sayın Profesör Dr. M. Nesimi EREN’e sonsuz saygı ve şükranlarımı sunarım.
Ayrıca tüm klinik hocalarıma, asistan, ameliyathane, yoğun bakımda, servislerde çalışan hemşire ve sağlık personeli arkadaşlarıma,
Sonsuz hak ve emekleri, asla ödenemeyecek olan anneme, babama, yoğun nöbetler nedeni ile yeterli zaman ayıramamı büyük olgunlukla karşılayan biricik oğlum Mustafa Ata’ma
Her zaman yanımda olup, bir an olsun desteğini esirgemeyen sevgili eşim Süleyman AYDIN’a
Teşekkür etmekten büyük mutluluk ve onur duyarım.
Dr. Suna AYDIN
ÖZET
Bu çalışma koroner arter hastalığı nedeniyle koroner arter bypass greft operasyonu (KABG) geçirecek kişilerde kardiyopulmoner bypass (KPB)’ın salusin-α, salusin-β ve apelin-36 biyoaktif peptidlerinin üzerine etkilerini incelemek, bu peptidlerin insan aort, safen ve arter dokularında üretilip üretilmediğini de araştırmak amaçlanmıştır. Çalışmaya KPB ile KABG’lemesi yapılan yaş ve vücut kitle indeksleri birbiri ile uyumlu 15 hasta dahil edildi. Salusin-α, salusin-β ve apelin–36 düzeyleri için anestezi indüksiyon öncesi (T1), KPB öncesi (T2), kros klemp alınmadan 5 dakika önce (T3), kros klemp alındıktan 5 dakika sonra (T4), yoğun bakıma alındığında (T5), postoperatif 24. saat (T6) ve 72 saatlerde (T7) venöz kanlar alındı. KPB’dan önce otojen greft olarak hazırlanan vasküler yapılarda salusin ve apelin-36 expresyonlarını belirlemek için 1’er cm’lik örnekler alındı. Dokuların salusin ve apelin ekspresyonları immünohistokimyasal yöntemle gösterildi. Serumların ve dokuların peptid miktarı ise Enzim-Bağlı İmmün Assay (ELISA) yöntemi kullanılarak ölçüldü. Damarlardaki salusinlerin üretimi aortta media’da fibroblast hücrelerinde, LİMA ve safende ise media’larının düz kas hücrelerinde olmaktadır. Apelin, aortta intimanın endotel hücreleri ve medianın fibroblast hücreleri tarafından, LİMA ve safende, media’larının düz kas hücreleri tarafından üretilmektedir. Salusin-α miktarlarının değişimleri istatistiksel olarak anlamlı değildi. T1 ve T2 kanlarının salusin-β miktarları benzer bulunurken, T3 kan örneklerinde miktarlarının azaldığı, T4 kan örneklerinde miktarları en düşük düzeyde olduğu, T5-T7 kan örneklerinde ise düzeyleri kademeli olarak arttığı gözlemlendi. Apelin–36 seviyelerinin değişimleri salusin-β değişimlerine benzerdi. Sonuç olarak; salusin-α, salusin-β ve apelin–36’nın arter ve venlerde sentezlendiği, KPB’da salusin-β ve apelin–36’nın takipte önemli markırlar olabileceği ve β peptidinin salusin-α’ya göre daha özgül olduğu gözlemlendi.
ABSTRACT
The present study aimed to examine the effects of cardiopulmonary bypass (CPB) on salusin-α, salusin-β and apelin-36 bioactive peptides in people who are planned to undergo coronary artery bypass graft operation (CABG) due to coronary artery disease and to explore whether these peptides are produced in human aortic, saphenous and arterial tissues. The study included age- and BMI-matched 15 patients who underwent CABG operation by CPB. In order to determine salusin-α, salusin-β and apelin-36 levels, venous blood samples were collected before induction of anaesthesia (T1), before CPB (T2), 5 minutes before the removal of cross-clamp (T3), 5 minutes after the removal of cross-clamp (T4), upon arrival in the intensive care (T5), at postoperative 24th hour (T6) and 72nd hour (T7). Before CPB, 1 cm samples were taken from the vascular structures prepared as autogenous grafts to establish salusin and apelin-36 expressions. Salusin and apelin expressions of the tissues were shown by immunohistochemical method. Peptide amounts of sera and tissues were measured using Enzyme-Linked Immunosorbent Assay (ELISA). Salusin production by vessels occurs in fibroblast cells of the media in the aorta and smooth muscle cells of the media in the LIMA and saphena. Apelin is produced by endothelial cells of the intima and fibroblast cells of the media in the aorta and by smooth muscle cells of the media in the LIMA and saphena. Changes in the levels of salusin-α were not statistically significant. Salusin-β amounts of T1 and T2 blood samples were found similar, while they dropped in T3 blood samples, were the lowest in T4 blood samples and gradually increased in T5 to T7 blood samples. Changes in apelin-36 levels were similar to those in salusin-β. In conclusion, it was observed that salusin-α, salusin-β and apelin–36 were synthesized in the arteries and veins, that salusin-β and apelin–36 might be important markers in the CPB, and that salusin-β peptide was more specific in comparison to salusin-α.
Key words: Cardiopulmonary bypass, salusines, apelin, artery, ven
İÇİNDEKİLER Sayfa No ÖNSÖZ……….i ÖZET………...ii ABSTRACT………...iii İÇİNDEKİLER………..iv KISALTMALAR DİZİNİ………...vi TABLOLAR DİZİNİ………..………....viii ŞEKİLLER DİZİNİ………...ix 1. GİRİŞ ve AMAÇ……….1 2. GENEL BİLGİLER………3 2.1. Kan Damarları………6 2.2. Arterler………...………8 2.3. Venler………...………11
2.4. Koroner Arter Bypass Cerrahisi Greft Materyalleri……….13
2.4.1. Left internal mammarian arter………..…….13
2.4.2. Safen ven……….…..14
2.5. Koroner Arter Bypass ve Endokrin Sistem………..……15
2.6. Salusinler………..17
2.6.1. Salusinlerin biyokimyasal ve fizyolojik etkileri……...……….18
2.6.2. Kardiyak depressör olarak sentetik salusinler………...………20
2.7. Apelin………...22
2.7.1. Apelinlerin biyosentez ve yapıları………..………...23
2.7.2. Apelinlerin biyokimyasal ve fizyolojik etkileri...………..…...23
2.7.3. Kardiyovasküler sistem ve apelin.……….………...27
2.7.4. Apelinin sıvı dengesindeki rolü………...…..………...28
2.7.5. Apelinin vasküler tonus üzerine etkileri……...………...28
2.7.6. Apelin ventriküler disfonksiyondaki rolü……...……...……...30
2.7.7. Apelinin vasküler etkileri………...…………...30
2.7.8. Apelinin kontraktil aktivite üzerine etkileri...…...….………...31
2.7.10. Koroner Arter Bypass ve Apelin……….32
3. GEREÇ VE YÖNTEM……….………33
3.1. Anestezik Uygulama ve Cerrahi İşlem………33
3.2. Miyokardın Korunması………34
3.3. Hemodinamik Ölçümler………...………34
3.4. Örnek Toplama.………...………35
3.4.1. Aort, lima ve safen eldesi ve saklanması……….…….35
3.4.2. Aort, lima ve safen doku homojenizasyonu……….………….35
3.5. Kullanılan Analitik Yöntemler……….36
3.5.1. Enzim-bağlı immün assay (enzyme-linked immunosorbant: ELISA)………...36
3.5.1.1. Prensibi………...36
3.5.1.2. Serum ve dokularda salusin-α, salusin-β ve apelin-36 analizleri………..…………...36
3.5.2. İmmünohistokimyasal Analizler………...37
3.5.2.1. İmmünohistokimyasal yöntemin ilkesi…….……….37
3.5.2.2. Aort, lima ve safen dokularının immünohistokimyası (İHK)……….……...…37
3.6. İstatistiksel Analizler………..………..38
4. BULGULAR………..39
4.1. Hastaların Demografik Özellikleri………...39
4.2. Hastaların Biyokimyasal Verileri……….40
4.3. Hastaların Operatif Karekteristikleri………41
4.4. Hastaların Laktat Değişimleri……….……….42
4.5. Hastaların Hemodinamik Verileri………43
4.6. Doku Salusin-α, Salusin-β ve Apelin-36 Dağılımları………..48
4.7. Doku Salusin-α, Salusin-β ve Apelin-36 Düzeyleri……….54
4.8. Serum Salusin-α, Salusin-β ve Apelin-36 Düzeyleri………...57
4.9. Hemodinamik ve Biyokimyasal Bulguların Korelasyonları………60
5. TARTIŞMA……….………..62
6. SONUÇLAR ve ÖNERİLER………...71
7. KAYNAKLAR………...……...73
KISALTMALAR DİZİNİ
aa : Aminoasit
ABC : Avidin-Biotin-peroxidase Complex ACAT : Açil-KoA kolesteril açil transferaz
ACT : Aktive pıhtılaşma zamanı (Activated Clotting Time)
ADH : Antidiüretik hormon
Akut-MI : Akut miyokard enfarktüsü (kalp krizi ) APJ : Anjiotensin like 1 reseptör
AT-II : Anjiotensin-II
AV : Atrio ventriküler
BNP : Brain natriuretic peptide
Ca : Kalsiyum
cGMP : Siklik guanozin mono fosfat
CI : Kardiak index
CO : Kardiyak output
CVP : Santral venöz basınç
H : Hidrojen
HIV : Human immun virus
HR : Nabız (Hard Rate)
KABG : Koroner arter bypass greft KIU : Kallikrein Inhibitor Unit
KOAH : Kronik obstrüktif akciğer hastalığı
KPB : Kardiyopulmoner bypass
LAD : Left anterior descending LİMA : Left internal mammarian arter LVEDP : Sol ventrikül end diastolik basınç LVSWI : Sol ventrikül stroke work indexi MAP : Ortalama arteriyel basınç
Mİ : Miyokard infarktüs
MPAP : Ortalama pulmoner arter basıncı
Na : Sodyum
nmol/L : nanomol/Litre
NO : Nitrik oksit
PCWP : Pulmoner kapiller saplama basıncı
PKC/MAPK : Calcineurin protein kinaz C (PKC) / mitogen activated protein kinaz (MAPK)
PVR : Pulmoner vasküler rezistans RVSWI : Sağ ventrikül stroke work indexi
SVI : Stroke volüm indexi
SVR : Sistemik vasküler direnç
T1 : Anestezi indüksiyon öncesi
T2 : Kardiyopulmoner bypass öncesi
T3 : Kros klemp alınmadan 5 dakika önce
T4 : Kros klemp alındıktan 5 dakika sonra
T5 : Yoğun bakıma alındığında
VKİ : Vücut kitle indeksi
VSM : Safena magna greftleri
VSMC : Vasküler düz kas hücreleri
TABLOLAR DİZİNİ
Sayfa No
Tablo 1: Vasküler sistem üzerine etkili hormonların kardiyopulmoner
bypass’a bağlı değişimleri………...………16
Tablo 2: Hastaların demografik değerleri…………..………39
Tablo 3: Hastaların biyokimyasal değerleri……….………..40
Tablo 4: Hastaların operatif karekteristikleri…..………...41
Tablo 5: Aort, Lima ve safenin; salusin-α, salusin-β ve apelin-36 ekspresyonları…………...………..53
ŞEKİLLER DİZİNİ
Sayfa No
Şekil 1 : Kalbin anatomik yapısı………..4
Şekil 2 : Kalp-akciğer pompasının genel yapısı………..5
Şekil 3 : Kan damarlarının histolojik yapısı………7
Şekil 4 : Salusin-α’nın aminoasit dizilimi……….17
Şekil 5 : Salusin-β’nın aminoasit dizilimi……….18
Şekil 6 : Prepro apelin’in aminoasit dizilimi……….………25
Şekil 7 : Apelin-36’nın aminoasit dizilimi………26
Şekil 8 : Apelin-17’nin aminoasit dizilimi………26
Şekil 9 : Apelin-13’ün aminoasit dizilimi……….…27
Şekil 10 : Hastaların kardiyopulmoner bypass bağımlı Laktat değerlerindeki değişimler………42
Şekil 11 : Hastaların santral venöz basınç değişimleri………43
Şekil 12 : Hastaların nabız değişimleri………44
Şekil 13 : Hastaların ortalama arteriyel basınç değişimleri……….45
Şekil 14 : Hastaların ortalama pulmoner arter basıncı değişimleri……….46
Şekil 15: Hastaların pulmoner kapiller wedge basıncı değişimleri………47
Şekil 16: Aort (A1), lima (B1) ve safen’in (C1) negatif İmmünohistokimyası………..48
Şekil 17: Pozitif kontrol (tükürük bezi) dokularında salusin-α (A2), salusin-β (B2) ve apelin-36’nın (C2) immünohistokimyasal ekspresyonları……….49
Şekil 18: Aort’ta salusin-α (A3), salusin-β (B3) ve apelin-36’nın (C3) immünohistokimyasal ekspresyonları……….50
Şekil 19: Lima’da salusin-α (A3), salusin-β (B3) ve apelin-36’nın (C3) immünohistokimyasal ekspresyonları……….51
Şekil 20: Safen’de salusin-α (A3), salusin-β (B3) ve apelin-36’nın (C3) immünohistokimyasal ekspresyonları……….52
Şekil 21: Aort’ta salusin-α, salusin-β ve apelin-36 ekspresyonları………..…..54
Şekil 22: Lima’da salusin-α, salusin-β ve apelin-36 ekspresyonları…………..55
Şekil 23: Safen’de salusin-α, salusin-β ve apelin-36 ekspresyonları…….……56
Şekil 24: Kardiyopulmoner bypass öncesi, süreci ve sonrası serum
salusin-α seviyelerinin değişimleri……….……….57 Şekil 25: Kardiyopulmoner bypass öncesi, süreci ve sonrası serum
salusin-β seviyelerinin değişimleri……….……….58 Şekil 26: Kardiyopulmoner bypass öncesi, süreci ve sonrası serum
1. GİRİŞ ve AMAÇ
Kardiyopulmoner bypass (KPB) dolaşımın vücut dışından sürdürüldüğü nonfizyolojik bir olaydır. Bu süreç esnasında tüm organlar dolaşımlarında ortaya çıkan değişimlerden etkilenmektedir. Bu değişimden etkilenen en önemli organlardan biri endokrin dokulardır. Çünkü endokrin dokular kardiyopulmoner bypass (CPB) esnasındaki değişimi kompanse etmek amacı ile lokal olarak ürettikleri biyoaktif yapıdaki peptidlerin sentezini etkilemektedirler (1). Cerrahi koşullarda kalbin normal fizyolojik uyumuna destek olan bu biyoaktif yapıdaki peptidlerin miktarları; günümüzde hem sentezlendikleri dokulardaki, hem de dolaşımdaki seviyeleri Enzyme-linked immunosorbent assay (ELISA), yöntemi ile kuantifiye edilebilmekte (2,3), bununla birlikte bu biyoaktif yapıdaki peptidlerin immunohistokimyasal yöntemle de lokal olarak üretilip üreritilmedikleri gösterilebilmektedir [3].
Lokal olarak üretilen bu biyoaktif yapıdaki peptidlerin bir kısmı damar kasıcı [apelin gibi (4)], bir kısmı da damar gevşetici ajanlar [salusin gibi (5)] olarak görev yapmaktadır. Bilindiği gibi kalp ve damarların yapısal ve işlevsel bozuklukları, bu biyoaktif peptidlerden lokal sentezindeki değişikliklerle ve dolaşımdaki miktarları ile yakından ilişkilidir. Vazodilatator biyoaktif peptid olan salusin, ratların birçok dokusunda çalışılmış olup tükürük bezi, akciğer, adrenal korteks, iskelet kası, testis, kalp ve aortta sentezlendiği immunohistokimyasal olarak gösterilmiştir (6). İnsanların kalp ve aort dokularında preprosalusin mRNA’sının varlığı rapor edilmesine (5) rağmen insan arteri, aortu ve safeni tarafından lokal üretilip üretilmediği henüz bilinmemektedir. Ratların kalp ve aortunda bulunduğuna göre, insan ve ratların organlarının homoloji gösterdiği hatırlanacak olursa; insan aort, safen ve arterlerinde de sentezlenebileceği hipotezini ileri sürmekteyiz. Bilindiği gibi eğer bir peptidin mRNA’sı herhangi bir dokuda var ise teorik olarak peptidin kendisi de mevcuttur. Çünkü prepro mRNA’sı öncül olup daha sonra peptide çevrilecektir.
Bu tezde araştırılan bir diğer biyoaktif peptid ise salusine zıt etkili apelindir. Apelinin en iyi bilinen formları apelin–36, apelin–17 ve apelin-13’dür. Apelinin sağındaki bu sayılar amino asit (aa) sayılarını göstermektedir (5,6,7). Venöz ve
arteriyel vazodilatasyona yol açan apelinler anjiotensin reseptör-like-1 (APJ) reseptörleri aracılığı ile kardiyovaskuler homeostazisi sağlayan önemli mediyatördürler (8). Kardiyopulmoner sistem üzerinde etkili olduğu düşünülen formu ise en fazla amino asit ihtiva eden formu olan 36'dır. Çünkü apelin-36’nın brain natriuretic peptide (BNP) konsantrasyonlarının değişmeden kaldığı normal kardiyak fonksiyonu olan kronik pulmoner hastalıklı hastalarda azaldığı bildirilmiştir (8). Literatürde kardiyopulmoner bypass ile koroner arter bypass greftlemesinde (KABG) apelinle ilgili sadece bir çalışma mevcut olup, bu çalışmada da off pump ve on pump olarak gerçekleştirilen koroner bypass sonrası natriüretik peptidler apelin değerlerindeki değişiklikler ve bunların myokardiyumdaki etkileri araştırılmıştır (9). Apelin’in post op dönemde anlamlı bir şekilde arttığı bildirilirken off pump ve on pump tekniklerinin ise apelin seviyelerine etki etmediği rapor edilmiştir (9).
Yukarıdaki bilgiler ışığında bu tezde amaçlarımız;
1) Koroner arter hastalığı nedeniyle KABG operasyonu geçirecek kişilerden anestezi indüksiyon öncesi, kardiyopulmoner bypass öncesi, kros klemp konmadan 5 dakika önce, kros klemp alındıktan 5 dakika sonra, yoğun bakıma alındığında ve postoperatif 24. saat’lerde kan alınarak serum apelin–36, salusin düzeylerinin nasıl değiştiğini incelemek ve aralarında bir korelâsyonun olup olmadığını ortaya çıkarmaktır.
2) Aort, left internal mammarian arter (LİMA) ve safen dokularının salusin ve apelin-36’yı lokal olarak üretip üretmediğini ortaya koymaktır.
2. GENEL BİLGİLER
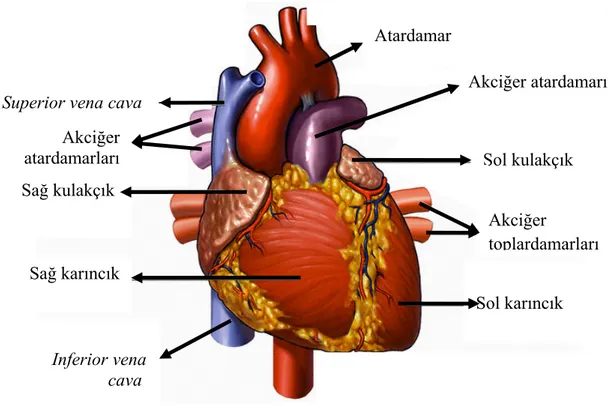
Kalp vücuttaki hücrelere oksijen, hormonlar, regülator moleküllerin, gıdaların ulaştırılması metabolik atıkların uzaklaştırılması görevini üstlenmiş ve ağırlığı yaklaşık olarak erkeklerde 280–340 gr. kadınlarda ise 230–280 gr. arasında değişen bir organdır (10-13). Ortalama bir insan ömüründe yaklaşık olarak 300 milyon litre kan pompalamaktadır (10). İnsan kalbi longitudinal olarak sağ ve sol kısma ayrılıp atrium ve ventrikül olmak üzere de odacık ve karıncıklara ayrılmaktadır (Şekil 1). Kalbin fonksiyonu venöz sistemden gelen kanı arteriyel sisteme pompalamaktır. Kalbin sağ tarafı periferal dokulardan vena kavalardan gelen oksijenden fakir kanı alır pulmoner artere akciğer dolaşımı için pompalar. Kalbin sol tarafı oksijenden zengin kanı pulmoner venler aracılığı ile alır daha sonra tüm periferal dokulara aorta yolu ile dağıtır (10-13). Kalp tüm bunları yaparken kendini besleyen koroner arterler zaman içinde aterosklerotik olarak daralmakta ve beslenmesi sekteye uğramakta, yeterli beslenemeyen kalp, koroner arter bypass ameliyatı ile düzeltilmektedir (14-18). Bu ameliyat esnasında (greftlemeyi yaparken) kalp akciğer makinesi kullanılmaktadır. Dünya tarihinde ilk kez 1953 yılında Dr. John Gibbon kalp akciğer makinesini kullanarak ilk başarılı açık kalp cerrahisini gerçekleştirdi (19). Dr. Aydın Aytaç kalp akciğer makinesini kullanarak açık kalp cerrahisini gerçekleştiren ilk Türk hekimidir (20). Ülkemizde ise 1960 yılında ekstra korporeal dolaşım kullanmak suretiyle ilk açık kalp ameliyatı Hacettepe Hastanesi’nde gerçekleştirilmiştir (11). Dicle Üniversitesi Hastanesinde ise tam 38 yıl sonra 1991’de ilk açık kalp cerrahisi başarı ile yapılmıştır (21).
Kalp-akciğer makinesi ile vücut kan dolaşımı sağlanırken ısı değiştirici ile kanın ısısı azaltılarak, normalde 36.5 °C olan vücut sıcaklığı birçok kalp ameliyatında genellikle 28 °C 'ye düşürülür. Çünkü soğuğun, hücrelerin oksijen ve enerji gereksinimlerini azaltarak koruyucu etkisi vardır. Örneğin vücut sıcaklığı 20 °C 'nin altına indirilirse hücrelerin ihtiyaçları normalin %5'i kadar olmaktadır. Bu şekilde, aortanın, beyne giden damarların çıktığı bölümünü ilgilendiren ameliyatlarında vücut sıcaklığı 19 °C 'ye düşürülerek kan dolaşımı 30 dakika süreyle güvenli bir şekilde tamamen durdurulabilir (bu süre içerisinde kalp-akciğer makinesi de çalıştırılmaz) (hipotermik sirkülatuvar arrest = soğuk dolaşım durdurulması) (22).
Açık kalp ameliyatlarında, kan dolaşımından mahrum bırakılan kalp hücrelerini korumak için de kalbin etrafına özel olarak hazırlanmış yumuşak buz yerleştirilir. Ayrıca, kardiyopleji kanülünden 20 dakikada bir kalbi besleyici sıvılar verilerek kalp kansızlığın etkilerinden korunmaktadır (1).
Şekil 1: Kalbin anatomik yapısı (10).
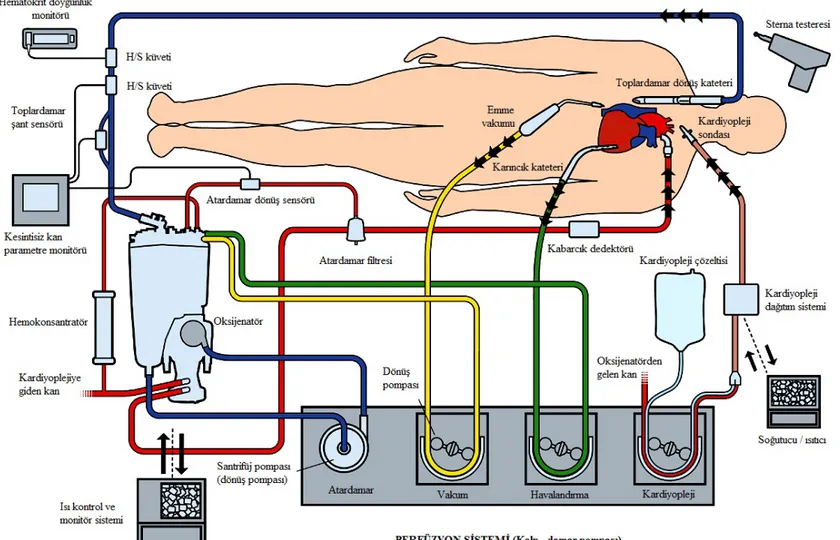
Kalp-akciğer makinesinin, hastadan gelen kanın depolandığı rezervuar, kanın karbondioksitten arındırılıp oksijenlendirildiği oksijenatör, kanı hastaya pompalayan pompa ve kanın ısısını artırıp azaltmayı sağlayan ısı değiştirici bileşenleri vardır. Ayrıca atardamar hattında hava ve parçacık filtresi vardır (Şekil 2). Milyonlarca yıldır, yüzeyi pıhtılaşmayı önleyici özel hücrelerle kaplı damarlar içinde akan kan, kalp-akciğer makinesi ve bağlantı hortumlarının pıhtılaşmayı tetikleyici yapay yüzeyleri ile temas edeceği için, pıhtılaşmayı önlemek üzere hastalara heparin yapılmaktadır (1,23-25).
Akciğer atardamarı Sol kulakçık Akciğer toplardamarları Sol karıncık Inferior vena cava Sağ karıncık Sağ kulakçık
Superior vena cava
Atardamar
Akciğer atardamarları
Şekil 2: Kalp-akciğer pompasının genel yapısı (1).
Hastanın sağ atriumu veya vena kavalarına yerleştirilen toplardamar (venöz) kanülü vasıtasıyla yerçekimi kuvvetiyle rezervuarda toplanan kan oksijenatörde karbondioksitten arındırılarak ve oksijenlendirilerek, hastanın asendan aortasına yerleştirilen atardamar (arteriyel) kanülüyle pompanın itici gücü kullanılarak aortaya pompalanır (23). Aortaya pompalanan kanın kalbe de gitmesini önlemek için, aortanın, atardamar kanülüyle kalp arasındaki bölümüne, aortayı tamamen tıkayan kros klemp konulur. Aortanın, kros klemp ile kalp arasında kalan bölümüne kardiyopleji kanülü yerleştirilerek buradan kalbi durdurucu sıvı verilir; bu sıvı koroner arterler vasıtasıyla kalbe dağılır. Bu şekilde, vücudun ihtiyacı olan kan dolaşımı sağlanırken, kansız ve durmuş olan bir kalpte ameliyat gerçekleştirilir (1,23-25).
Yukarıdaki bilgilerden de anlaşıldığı gibi kardiyopulmoner bypass (KPB), kanın kalp-akciğer makinesi ile karbondioksitten temizlenerek ve oksijenlendirilerek vücudun diğer organlarına pompalanması suretiyle kalbin ve akciğerin devre dışı bırakılıp, dolaşımın vücut dışından sürdürüldüğü nonfizyolojik bir olaydır. Bu yöntem kullanılarak yapılan kalp ameliyatlarına açık kalp ameliyatı denilmektedir. Bu cerrahide, temel amaç arter ya da ven greft materyalleri kullanılarak, koroner arterdeki aterosklerotik olarak daralan bölgeye myokardiumun beslenmesi için gerekli kanı sağlayacak greft materyallerini by pass yöntemi ile yerleştirmektir. Greftleme genel olarak kalp durdurularak yani “kardiyopulmoner bypass” ile yapılmaktadır. Fakat eğer greftleme kalp durdurulmadan yani off pump ile yapılırsa “beating heart tekniği” adını almaktadır (26). Bu cerrahide arter ve safen ven gibi değişik greft tipleri farklı konfigürasyonlarda kullanılmaktadır. Kullanılan bu greftler kan damarları olduğundan kan damarlarının yapısına göz atmakta fayda bulunmaktadır.
2.1. Kan Damarları
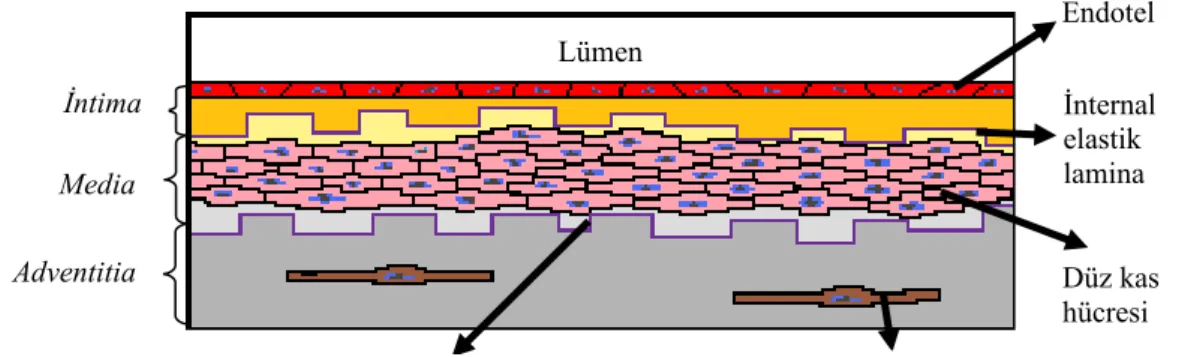
Oksijen, besin maddeleri ve hormonları dokulara, karbondioksit ve diğer metabolik artıkları da boşaltım sistemlerine taşıyan kan damarları arter, ven, kapiller ve lenfatik damarlardan oluşmaktadır (27-30). Bu damarların yapısında ise tunika
intima tunika media ve tunika adventisya olmak üzere üç ana tabaka bulunmaktadır (Şekil 3).
Şekil 3: Kan damarlarının histolojik yapısı (30).
Tunika intima (İç tabaka): En içte endotel hücre dizisi bulunmaktadır. Endotel hücre dizisini takiben bazal lamina ve gevşek bir fibroelastik bağ dokusundan oluşan subendotelial tabaka yer almaktadır. Membrana elastika interna Subendotelial tabakanın dış kısmında elastik fibrillerin yoğunlaşması ile oluşmaktadır. Subendotelial tabakada arasıra düz kas hücreleri de görülür. Bağ dokusu fibrilleri ve düz kas hücreleri subendotelyal tabakada longitudinal olarak düzenlenmiştir (27,28).
Tunika media (Orta tabaka): Tunika media tabakası sirküler yapıdaki düz kas hücrelerinden oluşmaktadır. Elastik ve kollajen fibriller ile proteoglikanlar Kas hücreleri arasında dağılmış bir şekilde bulunmaktadır. Arterlerde çok iyi gelişmiş olan bu tabaka ekstrasellüler matriks düz kas hücrelerince oluşturulmaktadır. Tunika adventisya (Dış tabaka): Bu tabaka en dış tabaka olup kollajen ve elastik fibrillerden oluşmaktadır. Venlerde bu tabaka düz kas hücrelerinden oluşmaktadır. Bu bölgede elastik fibrillerin yoğunlaşması ile membrana elastika eksterna tabakası oluşturulmaktadır. Venlerin duvarlarındaki en belirgin tabakayı Adventisya tabakası teşkil etmektedir (27-30).
Tunika adventisya tabakası çevre bağ dokusu ile devam eder. Büyük damarlarda adventisya içinde “vaza vazorum” olarak adlandırılan küçük kan
7 Endotel İnternal elastik lamina Düz kas hücresi İntima Fibroblast hücresi Eksternal elastik lamina
Media Adventitia
damarları bulunur. Adventisya ve media tabakaları lümenden diffüzyonla beslenemeyecek kadar kalın olduğu için vaza vazorumlar yardımı ile beslenmektedirler. Bu damarlar arterlerde daha az sayıda bulunmaktadır. Vaza vazorumların arterlerdeki bulunduğu yer sadece adventisya tabakasıdır. Vaza vasorumlar venlerde daha çok sayıdadır. Venlerde media tabakasına kadar ulaşmaktadır. Venlerde intima ve medianın en iç tarafı damarsızdır ve kandan diffüzyonla beslenmektedir. Lenfatik kapillerler; arterlerde sadece adventisyada bulunmaktayken, venler de ise media tabakasına kadar ulaşmaktadırlar.
Kan damarı duvarlarındaki düz kaslar myelinsiz sempatik sinir ağı (vazomotor sinirler) ile uyarılmakta olup bu sinirler norepinefrin içermektedirler. Norepinefrin salınımı damarlarda vazokonstriksiyona neden olmaktadır. Kolinerjik vazodilatatör sinirler İskelet kasındaki arterleri de ayrıca desteklemektedirler. Efferent sinirlerin arterleri etkileyebilmesi için norepinefrinin media tabakasına girmediğinden, diffüze olması gerekmektedir. Tunika Media tabakasındaki düz kas hücreleri arasında bulunan gap junctionlar, nörotransmitterlerin daha içteki kas hücrelerine taşınmasını sağlamaktadır. Sinir uçları Venlerde hem adventisyada hem de mediada bulunmaktayken genel olarak arterler daha zengin sinir hücresi yoğunluğu içermektedirler (27).
2.2. Arterler
Kapiller yatağa kalbin pompaladığı kanı ulaştıran Arterler kalpten uzaklaştıkça çapları azalarak devam ederler. Atardamar olarak kalpten iki ana arter çıkmaktadır. Bunlardan biri sağ ventrikülden çıkan truncus pulmonalis ve sol ventrikülden çıkan aortadır. Aorta ise kalbin üst tarafından yukarı doğru çıkıp daha sonra sola doğru bir kıvrım yaparak aşağı dönmektedir (27-30).
Aort, insan vücudundaki en büyük arterdir. Dolaşım sisteminin ana damarı olma özelliğini taşır. Aort kalbin sol ventrikülünden çıkar. Üç santimetre çapında olup sol 3. kıkırdak kaburganın alt kenarı seviyesindedir. Manibrium sterni’nin orta hizasına çıktıktan sonra, sol akciğer kökü üzerinde sola ve arkaya doğru yön değiştirir. Göğüs boşluğunun arka duvarında ve omurganın sol tarafında olmak üzere aşağı doğru iner. 12. torakal omurun alt kenarı hizasında diyaframın arka bölümünün
orta kısmında bulunan hiatus aorticusdan geçerek karın boşluğuna girer. Karın boşluğunda 4. lumbal omurun alt kenarı hizasında terminal dalları olan arteria iliaca communis dextra ve arteria iliaca communis sinistraya ayrılır. Buraya kadar olan seyri esnasında birçok dal vermesi nedeniyle, başlangıçta 3 cm olan çapı azalarak 1,75 cm'ye kadar inmektedir. Arterler çaplarına göre dört gruba ayrılmaktadır (29).
Büyük tip arterler (elastik arterler): Bu grup arterler arasında Aorta, arteria
pulmonalis, arteria carotis communis, arteria subclavia ve arteria iliaca communis
bulunmaktadır. Bu grup arterlerde damar duvarının çaplarına göre daha ince olduğu görülmektedir. Ayrıca media tabakasında elastik fibriller bulunmaktadır. Elastik arterler, kalp vurumlarının da yardımı ile akımın devamlılığını sağlamak üzere yardımcı bir pompa olarak görev yapmaktadırlar. Bu arterlerin histolojik yapısı (27-30);
Tunika intima: Bu tabaka oldukça kalındır. Aortada, total duvar kalınlığının yaklaşık % 20’sini intima tabakası oluşturmaktadır. Arterin lümene bakan yüzü tek sıra yassı endotel hücre dizisi ile örtülmektedir. Endotel hücreleri birbirleriyle zonula okludens ve bazen de gap junctionlar ile bağlanmaktadır. Subendotelial tabaka kalın olmakla birlikte burada uzunlamasına yerleşim gösteren kollajen ve elastik fibriller ile düz kas hücreleri görülmektedir. Kas hücreleri intimada bulunan çeşitli tip intersellular maddeleri üretmektedirler (29).
Tunika media: Büyük damarlarda kalınlığı 500 mikrona (0.5 mm) kadar
ulaşır. Yeni doğanlarda 40, yetişkinlerde 70 kadar pencereli düzenlenmiş elastik membran içermektedir. Elastik membranlar arasında kollajen fibriller ve düz kas hücreleri de bulunmakta olup bu membranlar arasındaki düz kas hücreleri elastin, kollajen ve proteoglikanları üretmektedir.
Tunika adventisya: Elastik arterlerde ince olup farklı yönlerde seyreden
kollajen ve elastik fibriller içermektedir. Damarın sistolde aşırı dilate olmasını Kollajen lifler engellemektedir. Bu tabakada bulunan diğer hücresel yapılar; fibroblastlar, düz kas hücreleri, diğer tip bağ dokusu hücreleri, damarlar (vaza vazorum) ve sinirlerden ibarettir.
Orta tip arterler (müsküler arterler, dağıtıcı arterler): Arteria Brakialis,
arteria femoralis, arteria radialis ve dalları gibi arteriyel sistemdeki damarların çoğu
orta tip arterlerden sayılmaktadır. Bu tip damarlardaki histolojik yapı (27-30);
Tunika intima: Lümene bakan tabaka tek sıra endotel hücre dizisinden oluşmaktadır. Endotel altında ince bir subendotelial tabaka bulunmaktadır. Media tabakasına yakın dış kısımda damar enine kesitlerinde kıvrıntılı bir yapı olarak membrana elastika interna belirgin şekilde görülmektedir.
Tunika media: Bu tabakanın kalınlığı düz kas hücrelerinin dairesel şekilde oluşturduğu 3–4 tabakadan 40 tabakaya kadar değişmektedir. Düz kas hücreleri arasında bu hücreler tarafından sentez edilerek ve salgılanan kollajen ve elastik fibriller görülmektedir.
Tunika adventisya: Müsküler arterlerde adventisya tabakası tunika media
kadar ya da daha kalın olabildiği gibi uzunlamasına düzenlenmiş elastik fibriller ve daha az miktarda da kollajen fibriller içermektedir. Müsküler arterlerin duvarındaki elastik fibrillerin çoğu adventisya tabakasında bulunmaktadır. Media tabakasına yakın iç kısımda sınırları belirgin olmaksızın çevre bağ dokusu ile devam eden membrana elastika eksterna gözlenmekte olup Adventisyada ayrıca vazomotor sinirlerden oluşan bir sinir ağı ve lenfatik damarlar da bulunmaktadır (27).
Küçük arterler (Arteriol): Daha küçük ve duvarı daha ince çapa sahip olup orta tip duvar yapısına benzer özellikler göstermektedir. Arterioller arteriyel sistemin çapı 30 ile 400 mikron arasında değişen en küçük terminal dalları olup prekapiller kısımdan oluşur. Arteriollerin histolojik yapısı (28-30);
Tunika intima: En küçük arteriollerde sadece endotel hücresi ve bazal
membran bulunmaktadır.
Tunika media: Arteriollerin bu tabakasında 2–6 sıra düz kas hücresi bulunmaktadır. Metarteiol de denilen bu grup arteriollerde düz kas hücreleri arteriol duvarını çepeçevre sarmamaktadır. Prekapiller sfinkter yapısı denilen kısım Metarteriollerin başlangıç bölümünde düz kas hücre halkasından oluşmaktadır. Buradaki sfinkter kapillerlere girecek kan miktarını kontrol etmektedir.
Tunika adventisya: Arteriollerde media tabakası kadar kalın olabilecek olan
bu tabaka ince gevşek bir bağ dokusundan ibaret olup Kollajen ve elastik fibrillerden oluşmaktadır. Arterioller (prekapiller damarlar), küçük tip arterlerin en uç kısımları rezistans damarlar olarak bilinmektedir. Bu bölge kanın periferde karşılaştığı en büyük direnç bölgesidir; periferik direncin oluşumunu ve kontrolünü sağlamaktadırlar (27).
2.3. Venler
Kapiller ağdan başlayan venüller aracılığı ile önce küçük çaplı venlere dökülmektedir. Küçük çaplı venler daha büyük çaplı venleri oluşturduktan sonra vena cava inferior ve vena cava superioru oluşturarak kalbin sağ atriumuna dökülmektedirler. Kapasitans damarlar da denilen Venler, duvarları ince olduğu için kolayca gerilir ve kan yüklenim damarları veya ven yatağı olarak da anılmaktadırlar. Venler bu özellikleri ile intravasküler basıncın artmasını engellemektedirler. Kapasitans damarlardan kalbe dönen kan miktarı, ön yükü belirleyen önemli bir faktördür (27-29).
Ven duvarlarında ven kapakçıkları denilen karşılıklı intimal kıvrımlardan ibaret oluşumlar bulunmaktadır. Kapakçıklar; iki yüzü endotel ile örtülü olup orta bölümü ise elastik fibrillerden zengin subendotelial tabakadan oluşmaktadır. Buradaki kapaklar özellikle alt ekstremitedeki venlerde çok sayıda bulunmaktadır. Venöz sistemin kapak bulunmayan kısımları Merkezi sinir sistemi ve visseral organ venleri ile büyük venlerden oluşmaktadır. Venler de arterler gibi çaplarına göre dört gruba ayrılmaktadır:
Venüller: Başlıca üç tip venül bulunmaktadır. Bunlar; Postkapiller venüller,
Toplayıcı venüller, Müsküler venüller.
Küçük venler: Müsküler venüllerin devamını teşkil etmektedir. Orta tip venler: Orta tip venlerin tabakaları; Tunika intima, Tunika media, Tunika
adventisya’dan oluşmaktadır. Büyük venlerin histolojik yapıları (27-29);
Tunika intima: Dış tarafında membrana elastika interna bulunmaktadır. İç
kısımda endotel hücre dizisi ve altında orta tip venlere göre daha fazla olmak üzere 11
elastik ve kollajen lifler içermektedir. Tunika media: Bu tabakada çok miktarda bağ dokusu ve bir kaç sıra düz kas hücresi bulunmaktadır. Tunika adventisya: Bu tabakada bol miktarda vaza vazorum bulunmaktadır. Geniş bir tabaka olup kalın bir kollajen fibril demeti, uzunlamasına düzenlenmiş düz kas hücrelerinden ve elastik fibrillerden ibarettir.
Venöz sistem anatomik olarak yüzeyel ve derin venöz sistem olarak iki kısımda incelenir. Koroner arter by pass’da greft amaçlı kullanılan safen ven grefti Yüzeyel venler grubunda incelenmektedir.
Yüzeyel venler alt extremitede, vena safena magna ve vena safena parva olmak üzere iki ana ven şeklinde incelenmektedir. Yüzeyel venler mebranoz fasyanın üzerinde olup destek dokusundan yoksun olarak seyretmektedirler. Yüzeyel venler derin venler gibi kas kompartmanında yer almadıkları için destek dokusu içermemektedirler. Vena safena magna ayak dorsalinde v. marginalis mediyalisin devamı olarak dorsal venöz arktan başlar iç malleol önünden geçip baldır iç yüzünde ilerleyerek popliteal boşluğun posteromediyal kenarından uyluk iç yüzüne gelmektedir. Buradan yukarıya doğru seyrederek yüzeyel inguinal düzeyde fossa
ovalis bölgesinde femoral vene dökülür. Vena safena magna v communicans lar ile
vena safena parva ile v perforanslar yardımı ile derin venöz sistem ile bağlantı kurmaktadırlar. Vena safena magnaya dökülen varikoz küme oluşumunda önemli olan dallar Posterior ark venidir; (Leonardo veni) ki bu ven üç cocketts perforan ven grubunu drene etmektedir (31).
Safen ven ağının anteriyor dalı patella altında seyretmektedir. Bu grup venler bacağın anteriyor ve lateral yüzlerinin kanını toplamaktadırlar. Safen venin Posteriyor dalı baldırın anteromediyal yüzeyinde bulunmaktadır. Postero mediyal uyluk veni ve anteromediyal uyluk veni gibi diğer dallar kasığın yakınlarında safen sistemde sonlanmaktadır. Vena safena parva yani küçük safen ven ise ayak lateralindeki dorsal venöz arktan başlayarak baldır orta kesiminden yukarı doğru seyreder. Küçük safen ven derin fasyayı penetre ederek politeal vene dökülmektedir (28,29).
Yüzeyel venlerin distalinde bulunan kapakçık sayısı proksimaldekinden fazladır. Bileşke bölgelerindeki kapakçıklar daha kuvvetlidir. Venlerin bu kapakçık içeren kısımlarındaki duvarında belirgin sinüzoid genişlemeler görülmektedir. Vena safena magnada da en az 6 kapakçık bulunmaktadır. Olguların %85 inde bir kapakçık safenofemoral bileşkenin 2-3 cm distalinde bulunmaktadır. Küçük safen vende ise kapakçıklar birbirine yakın olup sayıları 4-13 arasında değişmektedir (29).
2.4. Koroner Arter Bypass Cerrahisi Greft Materyalleri
Dünya genelinde her yıl yaklaşık olarak 1 milyon insana koroner by pass operasyonu yapılmaktadır. Gordon Murray ilk kez 1953 de arteriyel greftlerin koroner dolaşımdaki rollerini mammarian, axillar ya da carotid arterlerin hastalıklı
left anterior descending (LAD) arter üzerine suturizasyonunu çalışarak göstermiştir
(32). Bundan dört yıl sonra Sidney Smith safen veni bacaktan çıkararak aortadan direkt olarak myokardiuma by pass yolu ile kan akımını sağladığını bildirmiştir (33). Günümüzde left internal mammarian arter (LIMA), radial arter, gastroepiploik arter ve safen ven gibi değişik greft tipleri farklı konfigürasyonlarda kullanılmaktadır. Fakat koroner arter bypass cerrahisinde LIMA ve safen ven günümüzde en sık kullanılan greft materyalleridir (1).
2.4.1. Left internal mammarian arter
Left internal mammarian arter (LIMA) boyun kökünde anterior skalen kasın
medialinde subklaviyan arterin ilk kısmının inferiyorundan köken almaktadır. Klavikula ve 1. kostal kıkırdağın arkasından toraksa inerek, sternumun lateralinde seyretmektedir. Posteriyorda plevranın üzerindedir ve frenik sinir tarafından çaprazlanmaktadır. Superiyor 6. kostal kıkırdağın arkasında interkostal kaslar arasından seyretmektedir. Üçüncü kostal kıkırdaktan sonra transversus thoracis kasının anteriyorundan seyreder ve 6. kostal kıkırdakta superior epigastric ve musculophrenic arterler ayrılarak sonlanmaktadır. LIMA’nın LAD artere bypassı sık olarak kullanılmaktadır (34). Sol internal torasik arterin çoğunlukta koroner arter by pass da safen ven yerine kullanımı 1980 lerde anjiyografik çalışmalarda yaygın olarak kabul edilmiştir (35,36). Bilateral LIMA’nın greft olarak kullanımı da koroner by pass sonrası tekrarlayan myokardial iskemi de sağkalımı arttırdığı bildirilmiştir
(37,38). Koroner arter by pass greft operasyonlarında LIMA’nın greft olarak kullanımı operasyona bağlı komplikasyonlar dışında operatif mortaliteyi azaltmaktadır (39,40). LIMA’nın özellikle de sol ön inen koroner artere by passı uzun dönem patensi oranlarına sahiptir. LIMA’nın safen ven grefti yerine LAD arterine by passı uzun dönem mortalite ve morbidite üzerine olumlu etkileri olduğu bildirilmiştir (41,42). Safen ven greft materyali olarak kullanıldığında in situ LIMA’ ya nispeten daha yüksek bir akım kapasitesi sağladığı rapor edilmiştir (43,44).
2.4.2. Safen ven
Distal veya proximal safen ven koroner arter bypass da sıklıkla kullanılmaktadır. Safen venin femoral kısmı daha geniş ve kalın yüzeyi nedeni ile de greftlemede tercih nedenidir. J. Kunlin tarafından1950’de ilk olarak femoro popliteal bypassda greft olarak safen ven kullanımı değişik lokalizasyonlarda gerçekleştirilmiştir (45). Safen venin kalitesi, uzunluğu, histolojik yapısı ve endotelyal hücrelerin durumu greft olarak yararlılığını etkileyen durumlar olagelmiştir (41). Safen venin greft materyali olarak Aortokoroner bypassdaki başarısının perivenöz yağ dokusunun mevcudiyeti, travmaya maruz kalmamış olmasına bağlı olduğu rapor edilmiştir (1). Ayrıca Safen venin etraf dokularına papaverin muamelesi ile de patensinin arttığı bildirilmiştir (46). Venöz greftler birçok bölgede kullanılmaktadır. Femoropopliteal bypass, ters yönde olduğu gibi kapakları çıkarıldıktan sonra aynı yönde de kullanılabilmektedir (1,47). Ayrıca tibiyal damarlara ayak bileğine ayağa büyük safen ven ya da küçük safen ven ya da koldan elde edilen venler greft olarak kullanılabilmektedir. Safen venin kullanılabildiği hepatik-renal bypass, iliorenal bypass, aortokoroner bypassda vazgeçilmez greft materyali olagelmiştir (48). Karotid darlıklarda da endarterektominin imkânsız olduğu durumlarda yine safen ven greft materyali olarak seçilmiştir (1). Safen venin daha az hasar ile yerinden çıkarılabilmesine yönelik olarak no touch teknikler de geliştirilmiştir. Nitelikli greft materyali için baldır bölgesinden çıkarılmış, mümkün olan en az kapak içeren, 5 mm çapında ve hasarsız safen tercih edilmektedir (48,49). Yapılan çalışmalarda substans P vazoaktif intestinal peptid, kalsitonin gen reated peptid, nöropeptid Y ve somatostatin gibi nöroppeptidlerin insan safen veni üzerine etkileri değerlendirilmiş ve vazoaktif
peptidlerin vaskuler tonus üzerine birçok etkilerinin olduğu bu etkinin de endotel bağımlı olduğu tespit edilmiştir (50). Ayrıca bu etkilerin by pass için kullanılan greft materyallerindeki performansı arttırıcı rolü için daha fazla çalışma yapılması gerektiği düşünülmektedir.
2.5. Koroner Arter Bypass ve Endokrin Sistem
Kardiyopulmoner bypass (KPB) bağlı olarak tüm organlar; anestezi, cerrahinin yarattığı stres ve hipotermi gibi birçok etkenin varlığından etkilenmektedir (10,11). Bu değişimden etkilenen en önemli organlardan biri endokrin dokulardır. Ayrıca endokrin organlar kardiyopulmoner bypass (KPB) esnasındaki değişimi kompanse etmek amacı ile yerel olarak ürettikleri biyoaktif yapıdaki peptidlerin sentezini etkiledikleri gibi birbirlerinin salgılarını da etkilemektediler (Tablo 1). Gerek amino asit türevi hormonlar, gerek peptid yapıdaki hormonlar gerekse de steroid yapıdaki hormonların sekresyonları KPB ile değişmektedir (11).
Tablo 1: Vasküler sistem üzerine etkili hormonların kardiyopulmoner bypass’a bağlı değişimleri.
Hormon KBP öncesi KBP sonrası
ADH + + BNP + + Noradrenalin + + Adrenalin – + Kortizol – + ACTH – + TSH – + PTH – + İnsulin – + Aldosteron – – T3 – – T4 – – Apelin ? ? Ghrelin ? ? Nesfatin ? ? Obestatin ? ? Preptin ? ? Salusin ? ?
ADH: antidiüretik hormon. BNP: beyin natriüretik peptid. ACTH: adrenokortikotropik hormon. TSH: tiroid stimüle edici hormon. PTH: paratiroid hormon. T3: triiyodotronin. T4: tiroksin. +: artış. –: azalış.
2.6. Salusinler
Kardiovasküler sistem üzerine bir takım biyoaktif peptidler etki göstermektedir. Salusin de böyle bir biyoaktif peptid olup Shichiri ve arkadaşları tarafından 2003 yılında keşfedilmiştir (5). Çok fonksiyonlu olan bu biyoaktif peptid kanda, idrarda ve dokularda salusin-α (28 amino asid, Şekil 4) ve salusin-β (20 amino asid, Şekil 5) olmak üzere iki formda bulunmaktadır (51-54). Her iki molekül de preprosalusinden türemektedir (5). Salusinler ratlarda birçok organda (mide, ince bağırsak, karaciğer, böbrekler, adrenal medulla, timus, lenf nodu, kemik iliği, dalak dahil) çok iyi eksprese edildiği gösterilmiştir (6,55,56). Ratların tükürük bezi, akciğer, adrenal korteks, iskelet kası, testis, kalp ve aort da ise çok az miktarda sentezlendiği immunohistokimyasal olarak gösterilmiştir (6). Salusin-α ve salusin-β’nın immunohistokimyasal olarak bazı insan dokularında varlığı gösterilmiştir (54). Kalp dahil insan dokularında preprosalusin mRNA’sı da mevcuttur (57). İnsan salusin’leri vasküler düz kas hücrelerinde ve kalp kası hücrelerinde hipertrofiye neden olmaktadır. Yapılan başka bir çalışmalarda insan koroner arterlerinde immunohistokimyasal analizlerle ateromatoz plaklar ve yağlı çizgilenmeler de de salusin-α ve salusin-β ile pozitif olarak boyandığı rapor edildi. Ek olarak salusin-β vasküler düzkas hücrelerinde (VSMC), fibroblast ve makrofajların membranında yüksek oranda sentezlendiği bildirilmiştir (57).
Şekil 4: Salusin-α’nın amino asit dizilimi.
17 A A r r g g A A r r g g A A la la A A la la GG ly ly G G ly ly PPrr o o P P r r o o G G ln ln G G ln ln A A la la A A la la AA r r g g A A r r g g L L e e u u L L e e u u A A la la A A la la A A la la A A la la GG ly ly G G ly ly PP r r o o P P r r o o P P r r o o P P r r o o AArr g g A A r r g g P P r r o o P P r r o o A A la la A A la la A A la la A A la la P P r r o o P P r r o o A A la la A A la la P P r r o o P P r r o o P P r r o o P P r r o o L L e e u u L L e e u u A A la la A A la la G G ly ly G G ly ly S S e e r r S S e e r r G G ly ly G G ly ly A A la la A A la la L L y y s s L L y y s s CO OH CO OH NH2 NH2 A A r r g g A A r r g g A A la la A A la la P P r r o o P P r r o o P P r r o o P P r r o o CO OH CO OH
Şekil 5: Salusin-β’nın amino asit dizilimi.
2.6.1. Salusinlerin biyokimyasal ve fizyolojik etkileri
Özellikle salusin-β en potent hipotansif peptid olup indirek vazodilatator etkiye sahiptir (57). Bu peptid kolinerjik mekanizma ile hipotansiyon, bradikardi ve kardiyak disfonksiyonu indüklemektedir. Aynı zamanda salusin-β; kardiyomyozit gelişimi ve antiapoptozisi tetiklemektedir. Salusin-β vaskuler düz kas hücrelerinin ve fibroblastların proliferasyonu ile birlikte c-myc ve c-fos gibi büyüme ile ilgili genlerin expresyonunu da indüklemektedir (57). Salusinlerin vaskuler düzkas hücreleri ve fibroblastlar üzerinde mitojenik etkileri ve hemodinamik homeostaziste rolleri bulunmakta olup, salusinlerin koroner aterosklerozisten kaynaklanabileceği de düşünülmektedir. Bu fonksiyon aterosklerozisin önemli bir karakteristiği olarak öngörülmektedir (6,57). Salusin-β ile aynı etkileri gösteren salusin-α ratlardaki salusin-β’ya göre daha az potent olarak bulunmuştur. İnsan salusin’leri ise vasküler düz kas hücrelerinde ve kalp kası hücrelerinde hipertrofiye neden olmaktadır. Aynı zamanda kalp kası hücrelerinde apoptozisi de engellemektedir (54,57).
Kültüre edilen makrofajlardan türetilen monositlerde salusin-α ile kolesterol ester birikimi düşmekte olup salusin-β ile artış göstermektedir (56). Kolesterol
NH2 NH2 AlaAlaAAlala IIll e e I Ill e e P P h h e e P P h h e e I Ill e e I Ill e e IIeeIeIellll P P h h e e P P h h e e A A r r g g A A r r g g T T r r p p T T r r p p L L e e u u L L e e u u L L e e u u L L e e u u L L e e u u L L e e u u LL y y s s L L y y s s G G ly ly G G ly ly H H is is H H is is H H is is H H is is G G ly ly G G ly ly
metabolizmasında ve safra tuzu biyosentezinde önemli rol oynayan enzimlerden ACAT (açil-KoA kolesteril açil transferaz) ACAT–1 ve ACAT–2 olmak üzere iki grup enzimdir. Salusin-α özellikle steroid üreten dokular (böbrek üstü kabuğu / adrenal korteks), yağ bezleri ve makrofajlarda yoğunlukla bulunan ACAT 1 expresyonunu konsantrasyona bağlı bir şekilde azaltmaktadır (55,58). Tersi bir şekilde salusin-β (maximal etkiyi 0,6 n mol de gösterecek şekilde) 2.1 misli oranda ACAT–1 expresyonunu artırmaktadır. Salusinin bu etkileri G protein c-src, tirozin kinaz protein kinaz c ve mitojen aktive protein kinaz inhibitörleri tarafından azaltılmaktadır (59).
Yapılan başka bir çalışmada anjiyografik olarak koroner arter darlığı ve orta derecede hipertansiyonu olan hastaların serum salusin-α seviyeleri kontrollere göre azaldığı bildirilmiştir. Hipertansif hastalarda serum salusin-α (anti-atherogenic peptide) seviyelerindeki azalmanın karotik aterosklerozis ile ilişkili olabileceği ileri sürüldü (57). Salusin-α düzeyleri akut koroner sendromda azalmıştır. Hatta üç damar hastalığı olan olgularda tek damar hastalığı olan olgulara göre salusin-α düzeyleri daha düşük olduğu rapor edilmiştir. Serum salusin-α düzeyleri aynı zamanda orta dereceli hipertansif hastalara kıyasla iskemik kalp hastalıklı olgularda daha düşük olarak tespit edildi (57). Ayrıca serum salusin-α düzeyleri aterosklerotik kalp hastalığının ciddiyeti ile de doğru orantılı olarak düşük seviyede tespit edilmiştir. Bu bilgiler ışığında serum salusin-α düzeylerinin aterosklerozis gelişiminde önleyici faktör olabileceği ileri sürülmüştür (58).
Yapılan çalışmalarda salusin-α ile tedavi sonrası salusin-β nın VSMC’lere bağlanmasında herhangi bir inhibisyon gözlemlemediği bildirilmiştir. Salusin-α’nın salusin-β ya göre daha zayıf etki gösterdiği gözönünde tutulacak olursa bu iki biyoaktif maddenin aynı reseptöre daha düşük affinite ile bağlanabileceği savı ileri sürülmüştür. Yapılan bir başka çalışmada da salusin-α ve salusin-β’nın makrofaj köpük hücre formasyonunda çok sayıda reseptör üzerinden etki ettikleri, hatta zıt etki gösterdikleri yönünde bulgular mevcuttur. Salusinlerin sinyal transduksiyon yolaklarının rat kardiyomyozitlerinde Ca calcineurin protein kinaz C (PKC)/mitogen activated protein kinaz (MAPK) üzerinden olduğunu YU ve arkadaşları göstermiştir (59). Salusinler ile ACAT–1 regulasyonunun G protein c-Src tirozin kinaz PKC veya
MAPK aracılığı ile olabileceği savıda ileri sürülmüştür (60). Bilindiği gibi ACAT–1 endoplazmik retikulumda bulunup aterosklerotik lezyonlarda makrofajların da yardımı ile kollesterol ester birikimine katkıda bulunan bir enzimdir. Aterosklerotik lezyonlarda makrofajlar üzerinde ACAT–1 expresyonu yükselmektedir. Aterosklerotik lezyonlarda VSMC’ler ve fibroblastlarda otokrin ve parakrin olarak salusin birikimi bulunmaktadır (57).
2.6.2. Kardiyak depressör olarak sentetik salusinler
Salusinler intravenöz olarak ratlara verildiklerinde geçici ve derin bir hipotansiyona neden olmaktadırlar. Özellikle de salusin-β’nın etkisi göze çarpmaktadır (61). Yapılan bu çalışmada ratlardaki salusinin kardiyak fonksiyona olan etkileri salusini vermeden önce ve verdikten sonraki sistemik hemodinamikleri; çalışan ve çalışmayan kalpler üzerinde incelendi. İntravenöz olarak salusin-β’nın verilmesi ile anestezi almış ratlarda sistemik vaskuler rezistans etkilenmeksizin hipotansiyon ve bradikardi ile birlikte aortik kan basıncında geçici hızlı derin bir düşüş olduğu bildirilmiştir. Salusin-β’nın indüklediği hipotansiyon ve bradikardi propranolol ile bloke edilemeyip atropin muskarinik reseptör antagonisti ile tamamen bloke edilmektedir (61). İn vitro rat kalplerinde salusin-β kardiyak outputu, aortik akım ve strok işini azaltmaktadır. İzole olarak çalışan veya çalışmayan kalplerde koroner akımı etkilememektedir (59). Yapılan bu çalışmaların sonucuna göre salusinler negatif inotropik ve kronotropik aktivite ile potent bir hipotansif ajan olarak kabul edilmiştir (57). Salusin-β kalbe vagal akımı sağlayarak aktivasyon göstermektedir. Salusin-β’nın negatif inotropizmi direkt myotropik etki ile gerçekleşmektedir (61).
Sistemik olarak salusinlerin verilmesi hızlı derin bir bradikardi ve hipotansiyona neden olmaktadır. Salusinlerin hipotansif etkisi hemen hemen çoğu hipotansif peptidlerin etkisi kadardır (61). Diğer endojen hipotansif peptidler hipotansiyon ile birlikte bradikardiyi tetiklememektedir. Ancak salusinler açıklanamayan bir mekanizma ile hipotansiyon ile birlikte bradikardiyi tediklediği rapor edilmiştir. Kalpteki preprosalusin expresyonu sınırlı olmasına rağmen salusin benzeri immunoreaktiviteler insan plazma ve idrarında bulunmaktadır. Böylece Salusinlerin hemodinamik regülasyonun sağlanması için, kardiyovaskuler sistemde
rol alabileceği bildirilmektedir. Salusin-β’nın hipotansif aktivitesinin kardiyak kontraktilitenin baskılanması ile olduğu ileri sürülmüştür (61).
Adrenomedullin ve nitrik oksit (NO) gibi çoğu potent endojen hipotansif faktörlerin vasorelaxan aktivite yolu ile kan basıncını düşürdüğü gösterilmiştir. Adrenomedullin vasorelaxasyon sonrası kardiyak output (CO) ve kalp hızını artırır, vasodilatasyon etkisinden bağımsız olarak perfüze edilen rat kalplerinde vazodilatasyondan bağımsız olarak pozitif inotropik etki gösterir diğer yandan NO ve urotensin II nin kardiyak fizyolojide daha komplex ve çok yönlü bir fonksiyona sahip olduğu düşünülmektedir. Natriüretik peptidler diürezi indükler siklik guanozin mono fosfat (cGMP) bağımlı bir yolak ile myokardiyal kontraktiliteyi azaltır. Bu faktörlerin aksine salusinlerin sebep olduğu hızlı ve belirgin hipotansiyon sistemik vasküler rezistansta (SVR) değişiklik olmaksızın derin bradikardi ile seyir etmektedir. Anestezi almış ratlara NO verilmesi de salusinin indüklediği hipotansiyon ve bradikardiyi ortadan kaldıramamaktadır (59). Salusinler izole torasik aorta şeritlerinde vazodilator etkiden yoksundur. Yapılan çalışmalarda salusin-β’nın doz bağımlı olarak hipotansiyon ve bradikardi gelişimi ile arteriyel kan akımını azalttığı, arteriyel kan akımındaki derin düşüş sonucunda da ortalama arteriyel basınç (MAP) ve kalp hızını azalttığı ortaya konulmuştur. Arteriyel kan akımındaki belirgin düşüş ile birlikte salusin-β dP/dtmin ve sol ventrikül end diastolik basınç (LVEDP)’yi artırırken dP/dtmax azaltmaktadır. Salusinlerin ventriküler performansı baskılayarak negatif inotropik ve kronotropik etki gösterdikleri rapor edilmiştir (61).
Salusin-β kardiyak out put strok volüm ve stroku atrialnatriüretik peptid veya NO gibi bilinen diğer faktörlerden daha fazla etkilemektedir. Strokda ki düşüş 1 nmol/L’lik salusin-β sonrasında %22,3’e ulaşmaktadır. Salusin peptidlerinin hipotansif etkileri direk myotropik etkilerinden kaynaklandığı bildirilmiştir. Hatta rat kalbinin salusinlerin hemodinamik fonksiyonları için primer hedef olduğu ileri sürülmüştür (59,61). Salusin-β’nın indüklediği hemodinamik aktiviteler muskarinik reseptörler ile benzerdir. Atrial M2 reseptörlerin stimulasyonu memelilerin kalplerinde dominant kısımdır. Ventriküllerdeki M2 reseptörlerin aktivasyonu ile direk negatif inotropik ve kronotropik etkisi olduğu düşünülmekte iken ventriküllerdeki M2 reseptörlerin indirekt olarak inotropik etkileri de mevcuttur.
Parasempatik stimulasyonun kalbin sistolik ve diastolik fonksiyonlarını azalttığı bilinmektedir. Salusin-β ile oluşan hemodinamik değişiklikler parasempatomimetik aktiviteye benzerdir. Salusin-β nöropeptid olarak potansiyel bir rol üstlenmiştir. Salusin-β’nın kalpte vagal deşarja neden olarak negatif inotropizm ve kronotropizme neden olduğu sonucuna varılmıştır (56). Salusin-β’nın neden olduğu kardiyak kontraktilitedeki azalma koroner vasokonstriksiyon ilişkili olduğu bildirilmiştir (61). Kardiyopulmoner bypass ile KABG operasyonu geçiren hastalarda salusinlerle ilgili henüz hiç çalışma olmadığı gibi; salusinin aort, safen ve arter gibi dokularında lokal olarak salusin sentezleyip sentezlemedikleri de henüz açıklığa kavuşturulmamıştır.
2.7. Apelin
Apelin adipokininlerden biri olup 1998 yılında Tatemoto ve arkadaşları tarafından ilk kez mide dokusunda keşfedilmiştir (51). Apelin mideden başka, kalp, akciğer, böbrek, karaciğer, yağ doku, gastrointestinal sistem, beyin, adrenal gland, endotel gibi birçok dokuda sentezlenmektedir (8,62). Apelinin ön hipofizdeki reseptörü adrenal nörohormonal aksta bulunmaktadır (63). Apelinin geniş olarak dağılımı farklı organlarda geniş bir etkinlik spektrumuna sahip olduğu manasına gelmektedir. Ayrıca apelin ve anjiotensin reseptör-like-1 (APJ) mRNA'sı da hemen hemen bütün dokularda tespit edilmiştir (7,8). Apelin ve APJ reseptör dağılımı anjiotensin-II ve anjiotensin-II tip 1 reseptörlerinin dağılımına benzemektedir. Ayrıca anjiotensin-II, anjiotensin-I reseptörleri yapısal olarak birbirine benzemesine rağmen bağlanma reseptörleri farklıdır (8). Anjiotensin-I reseptörüne benzer şekilde bir reseptör geni 1992 de tespit edildi. Bu bağlamda bilinen bir ligand yoktu ve APJ reseptörü (anjiotensin reseptör-like-1) olarak adlandırıldı. APJ reseptörü 377 aa 7
trans membran domain protein grubuna ait olup kromozom 11’in uzun kolunda da G coupled reseptör geni ihtiva etmektedir. APJ reseptörünün keşfi apelinin keşfine
olanak sağlamıştır (8). Çünkü apelin jukstakrin, parakrin ve otokrin gibi fizyolojik etkilerini APJ yolağı aracılığı ile göstermektedir.
Taşıdıkları amino asit (aa) sayısına göre farklılık gösteren çeşitli apelinler vardır. Bu farklı apelinler 77 aa’lik preproapelinden türemektedir (Şekil 6). Apelin sentezi bilinen protein sentezi kurallarına uymaktadır (8,51). Apelinin N-terminal ucu bir sinyal peptid kısmı ihtiva etmektedir. Apelinin yapısındaki 13 amino asit dizilimi tüm apelin formlarında aynı olduğundan, temel apelin yapısı apelin-13 olarak adlandırılmaktadır. Endoplazmik retikuluma aktarılıp sinyal peptidin de ayrılması ile 55 amino asit kalmakta ve bununda bazı aktif fragmentleri 42-77’ye denk gelen 36 aa lik fragment (Apelin-36) 61-77 ‘lik dizilime denk gelen 17 amino asitlik peptid (Apelin-17) 65-77’lik dizilime denk gelen 13 amino asitlik peptid (Apelin-13) formları oluşmaktadır. Ancak apelinlerin biyolojik aktivitesini belirleyen kısım, apelinin enzimatik olarak yıkılmasını engelleyen N-terminopiroglutamat kısmıdır (59). Apelin–13; karakteristik olarak N-terminal piroglutamat rezidülerine sahiptir. Bu rezidü sayesinde apelinin enzimatik olarak parçalanması önlenmiş olur. Böylece biyolojik aktivitesi korunmaktadır. Apelinin en iyi bilinen formları apelin-36 (Şekil 7), apelin-17 (Şekil 8) ve apelin-13’dür (Şekil 9). Bu sayılar ise aa sayılarını göstermektedir (7,8).
2.7.2. Apelinlerin biyokimyasal ve fizyolojik etkileri
Venöz ve arteriyel vazodilatasyona yol açan apelinler APJ reseptörleri aracılığı ile kardiyovaskuler homeostazisi sağlayan önemli mediyatördürler (7). APJ reseptörleri vasküler sistemde, endotelyal hücreler, vaskuler düz kas hücreleri ve kardiyomyozitlerde bulunmaktadır. Apelinlerin en potent izoformu piroglutaminize apelin-13 dür (8). Kardiyopulmoner sistem üzerinde etkili olduğu düşünülen formu ise en fazla amino asit ihtiva eden formu olan apelin-36'dır. Çünkü apelin-36’nın brain natriuretic peptide (BNP) konsantrasyonlarının değişmeden kaldığı normal kardiyak fonksiyonu olan kronik pulmoner hastalıklı hastalarda azaldığı bildirilmiştir (8).
Apelinler güçlü inotroplardır ve yapılan hayvan ve insan çalışmalarında kalp yetmezliğinin patolojisinde rol oynadığı bildirilmekte olup bunu da anjiontensin II fonksiyonunu düzenleyerek yaptığı rapor edilmektedir (64). Apelin kalp yetmezlikli hastalarda düşmektedir (65). Sol ventrikül remodelize olduğunda ise apelinin yükseldiği bildirilmiştir (8,65). Apelin–APJ sistemin endotelyal oksidatif sistem ve
koroner aterosklerotik plak formasyonunda rolü olduğu bildirilmiştir. Hem APJ hemde Apo-E sentezi yapamayan fareler yüksek kollesterollü diyet ile beslendirilerek sadece Apo-E’yi sentezleyemeyen farelerle karşılaştırılmış ve çalışma sonunda kolesterol miktarında bir değişiklik bulunmaz iken aterosklerotik plak miktarında ise azalma tespit edilmiştir. Her ikisinin de sentezlenmediği farelerde oksidatif stres ve vaskuler düz kas hücrelerinin belirteçlerinde de azalma tespit edilmiştir. Hiper kolesterolemili kişilerde plazma apelin düzeyleri kontrol grubuna göre düşük bulunmuştur (66,67). Bu hormon insülin ve steroid ile upregüle edilmektedir (68).
Apelin aynı zamanda human immun virus (HIV I)’e koreseptör rolü üstlenerek APJ’ye virüs yerleşmesini önleme yolu ile CD4+ hücrelere HIV 1 viral girişini de inhibe etmektedir (69). Apelin injeksiyonu su alımını artırır (70) ayrıca apelin hipotalamusta antidiüretik hormon vazopressin salınımını azaltır (8,62,70). Apelinin hipotansif etkisi ile ilgili olduğu düşünülen diüretik etkisi vücut sıvılarının homeostatik dengesinde önemli rol oynamaktadır (71). Apelin aynı zamanda beynin iştahı kontrol eden merkezlerinde tespit edilmiş olup iştah ile ters orantılı bir ilişki içindedir (72). Midede parietal hücreler tarafından salgılanan apelinin enterochromaffine-like hücreleri aktive etmesi enterochromaffine-like hücrelerden histamin salınımını inhibe etmektedir (73,74). Apelin kalbin erken embriyolojik dönemde progenitor hücelerin migrasyonunu düzenleyerek kontraktil hücre ve kardiyomyozitlerin farklılaşmasını sağlamaktadır (75). Büyükbaş hayvanlarda suprafizyolojik düzeyde apelin verilen küçükbaş hayvanlarda gözlenmeyecek şekilde %50 gibi bir atrio ventriküler (AV) blok tespit edilmiştir (76). Apelin aynı zamanda endotelyal nitrik oksit sentaz (NOS) ile NO’in artışı yardımı ile diyabetik farelerde renal arteriyel tonusu anjiotensin-II’ye yanıt olarak düzenlemektedir (77). Ratlarda izoproteranolün indüklediği myokardiyal hasarda apelin ve APJ genleri down regüle olmaktadır (78). V V V V GGGG GGGG SSSS ly C C C C y LLLL MMMM PP