T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
ORGANOMETALİK FERROSEN UÇLU SCHİFF BAZLARININ SENTEZİ VE
KARAKTERİZASYONU Mükerrem FINDIK
DOKTORA TEZİ
Kimya Anabilim Dalını
Haziran-2014 KONYA Her Hakkı Saklıdır
TEZ BİLDİRİMİ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Mükerrem FINDIK 26.06.2014
iv
ÖZET
DOKTORA TEZİ
ORGANOMETALİK FERROSEN UÇLU SCHİFF BAZLARININ SENTEZİ VE KARAKTERİZASYONU
Mükerrem FINDIK
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
Danışman: Prof. Dr. Emine ÖZCAN 2. Danışman: Doç.Dr. Ersin GÜLER
2014, 141 Sayfa Jüri
Prof. Dr. Emine ÖZCAN Prof. Dr. H. İsmet UÇAN Prof. Dr. Emin KARAPINAR
Doç. Dr. Haluk BİNGÖL Doç. Dr. Ersin GÜLER
Bu çalışmada çıkış maddesi olarak α-klorasetilferrosen kullanıldı. α-Klorasetilferrosen; ferrosenin Friedel-Crafts açillemesi sonucu önceden yayınlanan literatürler referans alınarak elde edildi. 2-hidroksibenzaldehit ve 2-hidroksi-1-naftaldehit ile dört farklı amino asit metilester (glisin metilester hidroklorür, L-alanin metilester hidroklorür, L-fenilalanin metilester hidroklorür, L-valin metilester hidroklorür) kullanılarak Schiff bazları sentezlendi. α-Klorasetilferrosen ve Schiff bazlarının kondenzasyonu sonucu ferrosen uçlu yeni bileşikler elde edildi. Elde edilen bileşiklerin yapıları elementel analiz, FT-IR, UV-Vis, 1H NMR, 13C NMR spektroskopisi, DSC tekniği ve Dönüşümlü Voltametri (CV) kullanılarak karakterize edildi.
Anahtar Kelimeler: α-klorasetilferrosen, amino asit metilester, dönüşümlü voltametri (CV), Schiff bazı
v
ABSTRACT
Ph.D THESIS
SYNTHESIS AND CHARACTERIZATION OF ORGANOMETALLIC FERROCENE-ENDED
SCHIFF BASES Mükerrem FINDIK
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELCUK UNIVERSITY
Advisor: Prof. Dr. Emine ÖZCAN Advisor: Doç. Dr. Ersin GÜLER
2014, 141 Pages Jury
Prof. Dr. Emine ÖZCAN Prof. Dr. H. İsmet UÇAN Prof. Dr. Emin KARAPINAR
Doç. Dr. Haluk BİNGÖL Doç. Dr. Ersin GÜLER
In this study, chloroacetylferrocene have been used as starting compound. α-chloroacetylferrocene; Friedel-Crafts acylation of ferrocene results were obtained with reference to the published literature. Schiff bases were synthesized from 2-hydroxybenzaldehyde and 2-hydroxy-1-naphthaldehyde with four different amino acid methylesters (glycine methylester hydrochloride, L-alanine methylester hydrochloride, L-phenylL-alanine methylester hydrochloride, L-valine methylester hydrochloride). Ferrocene-ended novel compounds was obtained by condensation of α-chloroacetylferrocene with Schiff bases. The structures of the obtained compounds were characterized by using elemental analysis, FT-IR, UV-Vis, 1H NMR, 13C NMR spectroscopy, DSC techniques and cyclic voltammetry (CV)
Keywords: α-chloroacetylferrocene, amino acid methylester, cyclic voltammetry (CV), Schiff base
vi
ÖNSÖZ
Bu çalışma, Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü öğretim üyelerinden Prof. Dr. Emine ÖZCAN ve Doç. Dr. Ersin GÜLER danışmanlığında tamamlanarak, Selçuk Üniversitesi Fen Bilimleri Enstitüsü’ne Doktora Tezi olarak sunulmuştur.
Yüksek Lisans ve Doktora çalışmalarım süresince her türlü yardım ve desteğini benden esirgemeyen, her an bilgi ve tecrübelerinden yararlanabildiğim değerli hocam Prof. Dr. Emine ÖZCAN’a sonsuz saygı ve şükranlarımı sunuyorum.
Çalışmalarım süresince fikir ve önerileri ile yol gösteren, bilgi ve tecrübeleriyle bana her zaman yardımcı olan çok değerli hocam Prof. Dr. H. İsmet UÇAN’a, Tez İzleme Komitesi’nde bulunan Doç. Dr. Emin KARAPINAR’a, laboratuvarlarında çalışma imkanlarını sağlayan Doç. Dr. Ersin GÜLER ve Prof. Dr. Mustafa ERSÖZ’e, hem kimyasal destek sağlayan hem de bilgi ve tecrübelerinden faydalandığım Prof. Dr. Mustafa YILMAZ ve Doç. Dr. Haluk BİNGÖL’e, elektrokimyasal çalışmalarımda destek veren Doç. Dr. İmren HATAY PITIR ve Arş. Gör. Dr. S. Zeki BAŞ’a, Yüksek Lisans ve Doktora çalışmalarım süresince her türlü yardım ve desteğini benden esirgemeyen Arş. Gör. Dr. Mustafa ÖZMEN’e, çalışmalarımın analiz aşamasında yardımcı olan değerli arkadaşım Soner BEREKET’e teşekkür ederim.
Ayrıca hazırladığım tezde emeği geçen ve laboratuvar çalışmalarım boyunca bana yardımcı olan, birlikte her türlü zorluktan başarıyla çıkmış olduğum kıymetli dostum Asuman UÇAR’a çok teşekkür ederim.
Yaşamım boyunca bana her koşulda inanan, güvenen ve her konuda desteklerini hiç eksik etmeyen canım aileme sonsuz teşekkürlerimi sunarım.
Mükerrem FINDIK KONYA-2014
vii İÇİNDEKİLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi İÇİNDEKİLER ... vii SİMGELER VE KISALTMALAR ... x 1. GİRİŞ ... 1
1.1. Schiff Bazları ve Özellikleri ... 1
1.1.1. Schiff Bazlarının Fiziksel Özellikleri ... 3
1.1.2. Schiff Bazlarında Hidrojen Bağı ... 3
1.1.3. Schiff Bazlarının Termokromik ve Fotokromik Etkileri ... 4
1.1.4. Schiff Bazlarının İsimlendirilmesi ... 5
1.1.5. Schiff Bazlarının Geometrik İzomeri ... 6
1.1.6. Schiff Bazlarının Sınıflandırılması ... 11
1.1.7. Schiff Bazlarının Sentezi ... 12
1.1.8. Schiff Bazları Kullanım Alanları ... 14
1.1.9. Schiff Bazlarının Spektroskopik Özellikleri... 17
1.2. Amino Asitler ... 20
1.2.1. Amino asit tanımı ... 20
1.2.2. Standart Amino Asitler ... 21
1.2.3. Standart Amino Asitlerin Sınıflandırılmaları ... 22
1.2.4. Amino Asitlerin Schiff Bazı Oluşum Tepkimeleri ... 23
1.3. Ferrosen ve Ferrosen Grubu İçeren Schiff Bazları ... 24
1.3.1. Ferrosenin Yapısı Sentezi ve Bazı Reaksiyonları... 24
1.3.2. Ferrosen Grubu İçeren Schiff Bazları ... 29
1.4. Dönüşümlü voltametri ... 35
2. KAYNAK ARAŞTIRMASI ... 38
3. MATERYAL VE METOT ... 43
3.1. Kullanılan Kimyasallar ve Cihazlar ... 43
3.1.1. Kullanılan Cihazlar ... 43
3.1.2. Kullanılan Kimyasallar ... 43
3.1.3. Elektrokimya Deneylerinde Kullanılan Elektrotlar ve Elektrot Temizliği 44 3.1.4. Elektrokimya Deneylerinde Kullanılan Çözeltilerin Hazırlanması ... 44
4. DENEYSEL BÖLÜM ... 45
4.1. α-Klorasetilferrosen Sentezi (1) ... 45
4.2. N-(salisiliden)-glisinmetilester (2) ... 45
4.3. N-(salisiliden)-L-alaninmetilester (3) ... 46
viii 4.5. N-(salisiliden)-L-valinmetilester (5)... 47 4.6. N-(2-hidroksinaftaliden)-glisinmetilester (6) ... 48 4.7. N-(2-hidroksinaftaliden)-L-alaninmetilester (7)... 49 4.8. N-(2-hidroksinaftaliden)-L-fenilalaninmetilester (8) ... 49 4.9. N-(2-hidroksinaftaliden)-L-valinmetilester (9) ... 50 4.10. (E)-metil-2-[2-(2-oxo-2-ferroseniletoksi)benzilidenamino]asetat (10) ... 51 4.11. (E)-metil-2-[2-(2-oxo-2-ferroseniletoksi)benzilidenamino]propanoat (11) .. 52 4.12. (E)-metil-2-[2-(2-oxo-2-ferroseniletoksi)benzilidenamino]-3-fenilpropanoat (12) ... 53 4.13. (E)-metil-3-metil-2-[2-(2-oxo-2-ferroseniletoksi)benzilidenamino]bütanoat (13)………...54 4.14. (E)-metil-2-[(2-(2-oxo-2-ferroseniletoksi)naftalen-1-yl)metilenamino]asetat (14) ... 55 4.15. (E)-metil-2-[(2-(2-oxo-2-ferroseniletoksi)naftalen-1-yl)metilenamino]propanoat (15) ... 56 4.16. (E)-metil-2-[(2-(2-oxo-2-ferroseniletoksi)naftalen-1-yl)metilenamino]-3-fenilpropanoat (16) ... 57 4.17. (E)-metil-3-metil-2-[(2-(2-oxo-2-ferroseniletoksi)naftalen-1-yl)metilenamino]bütanoat (17) ... 58 5. BULGULAR VE TARTIŞMA ... 59
5.1. Sentezlenen Bileşiklerin Element Analizi Sonuçları ... 59
5.2. FT-IR spektrumları ile ilgili yorumlar ... 60
5.3. 1H-NMR spektrumu ile ilgili yorumlar ... 61
5.3.1. α-Klorasetilferrosen bileşiği ... 61 5.3.2. (2) ve (10) bileşiklerinin 1H-NMR spektrumu ... 62 5.3.3. (3) ve (11) bileşiklerinin 1H-NMR spektrumu ... 63 5.3.4. (4) ve (12) bileşiklerinin 1H-NMR spektrumu ... 63 5.3.5. (5) ve (13) bileşiklerinin 1H-NMR spektrumu ... 64 5.3.6. (6) ve (14) bileşiklerinin 1H-NMR spektrumu ... 65 5.3.7. (7) ve (15) bileşiklerinin 1H-NMR spektrumu ... 66 5.3.8. (8) ve (16) bileşiklerinin 1H-NMR spektrumu ... 66 5.3.9. (9) ve (17) bileşiklerinin 1H-NMR spektrumu ... 68
5.4. 13C-NMR spektrumu ile ilgili yorumlar ... 69
5.4.1. α-Klorasetilferrosen bileşiği ... 69
5.4.2. (10) ve (14) bileşiklerinin 13C-NMR spektrumu ... 69
5.4.3. (11) ve (15) bileşiklerinin 13C-NMR spektrumu ... 70
5.4.4. (12) ve (16) bileşiklerinin 13C-NMR spektrumu ... 71
5.4.5. (13) ve (17) bileşiklerinin 13C-NMR spektrumu ... 72
5.5. UV-vis spektrumu ile ilgili yorumlar ... 73
5.5.1. (10-13) bileşiklerinin UV-vis spektrumu ... 73
5.5.2. (14-17) bileşiklerinin UV-vis spektrumu ... 74
5.6. Sentezlenen Bileşiklerin Elektrokimyasal Davranışları ... 74
6. SONUÇLAR VE ÖNERİLER ... 77
KAYNAKLAR ... 79
ix
EK-1 IR Spektrumları ... 86
EK-2 1H NMR Spektrumları ... 104
EK-3 13C NMR Spektrumları ... 122
x
SİMGELER VE KISALTMALAR
FTIR: Fourier transform infrared spektroskopisi NMR: Nükleer Magnetik Rezonans
DTA: Diferansiyel Termal Analiz UV: Ultra Violet
CV: Dönüşümlü voltametri GC: Camsı karbon elektrot
DSC: Diferansiyel Taramalı Kalorimetri α-KAF: α-klorasetilferrosen
DMSO: Dimetilsülfoksit e.n.: Erime Noktası
1. GİRİŞ
1.1. Schiff Bazları ve Özellikleri
İlk kez 1864’te Alman kimyacı H. Schiff tarafından bir primer amin ve bir aktif karbonil grubunun kondenzasyonundan elde edilen ve azometin grubu içeren bileşiklere “Schiff Bazları” denir (Tüzün, 1996). Bu bileşikler ilk defa 1930’larda Pfeiffer ve arkadaşları tarafından kullanılmışlardır (Ölmez ve Yılmaz, 1998). Bu koordinasyon bileşikleri açısından önemli bir olaydır. Çünkü o güne kadar bilim adamları –NH2, H2
N-NH2, C2O4-2 ve CN- gibi küçük moleküllü ligandları kullanmak zorundaydılar.
Bu bileşiklerin oluşum mekanizmaları ve kompleks oluşturma özellikleri oldukça geniş çaplı incelenmiştir. Schiff bazları aminotiyoller, o-aminofenoller, α-aminoasitler ve aminoalkollere, asetil aseton veya salisilaldehit katılmasından türetilebilir (Şener, 1999).
Schiff bazları iyi bir azot donör ligandı (>C=N-) olarak da bilinmektedir. Bu ligandlar koordinasyon bileşiğinin oluşumu sırasında metal iyonuna bir veya daha çok elektron çifti vermektedir. Schiff bazlarının oldukça kararlı 4, 5 veya 6 halkalı kompleksler oluşturabilmesi için, azometin grubuna mümkün olduğu kadar yakın ve yer değiştirebilir hidrojen atomuna sahip ikinci bir fonksiyonel grubun bulunması gereklidir. Bu grup tercihen hidroksil grubudur (Patai, 1970). Schiff bazları RCH=NR’ genel formülüyle de gösterilebilir, bu formülde R ve R’ alkil veya aril sübstitüentleridirler.
Aldehitlerin primer aminlerle reaksiyona girmesiyle oluşan N-sübstitüe iminler kararsızdır. Ancak azometin veya Schiff bazları denilen ve aromatik aldehitlerden oluşan N-sübstitüe iminlerde ikili bağ içeren karbon atomu üzerinde bir veya iki aril grubu bulunduğundan, bu bileşikler rezonans nedeniyle kararlıdırlar. Azot atomu üzerinde alkil grubu yerine aril grubu içeren azometinler daha da kararlıdırlar (Oskay, 1990).
Azometin grubundaki azot atomuna elektron salıcı bir alkil ya da aril grubu bağlandığında azometin bileşiğinin kararlılığı artmaktadır. Azot atomunda –OH taşıyan oksimler, -NH taşıyan fenilhidrazon ve semikarbazonlar, karbonil bileşikleriyle, primer aminlerin kondenzasyonundan oluşan N-alkil veya N-aril sübstitüe imin yapısındaki Schiff bazlarına göre hidrolize karşı çok daha dayanıklıdır. Özellikle düşük pH’larda kendisini meydana getiren karbonil ve amin bileşiklerine ayrılır.
R
H
O
+
R - NH
2-H
2O
R
H
N
R
Şekil 1.1. Schiff bazı oluşumu reaksiyonu
Reaksiyon iki yönlüdür ve denge genel olarak hissedilir bir hızla gerçekleşir. Reaksiyon azot atomunda en az bir tane çiftleşmemiş elektron içeren elektronegatif atom bulunan aminlerle (hidroksilamin, semikarbazit, hidrazin vb.) yapıldığı takdirde tek yönlüdür. Bu durumda reaksiyon ürünü kolay hidrolize uğramadığından yüksek bir verimle izole edilebilir.
Hidrolize yatkın olmaları nedeniyle Schiff bazlarının elde edilmesinde daha çok susuz ortamda çalışılır. Reaksiyon sonucu meydana gelen su, azeotrop oluşturan bir çözücü ile uzaklaştırılır. Diaril ve alkil-aril ketonlardan Schiff bazı elde edilirken, reaksiyon suyunun uzaklaştırılması gerekli olduğu halde, aldehit ve dialkil ketonlardan Schiff bazı sentezinde suyun uzaklaştırılmasına ihtiyaç duyulmamaktadır. Buradan diaril ve alkilaril ketiminler hidrolize karşı aldiminlerden ve dialkil ketiminlerden daha az dayanıklı olduğu sonucu çıkarılabilir (Pratt ve Kamlet, 1961).
Aromatik aldehitler düşük sıcaklıkta ve uygun bir çözücü ortamında aminlerle reaksiyona girerler. Aromatik aldehitlerin aromatik aminlerle kondensasyonunda, para pozisyonunda elektron çekici bir sübstitüentin aldehitte bulunması halinde reaksiyon hızının arttığı, aminde bulunması halinde ise reaksiyon hızının azaldığı anlaşılmıştır (Pratt ve Kamlet, 1961).
Aldehitler primer aminlerle kolayca Schiff bazı verebildikleri halde, ketonlardan Schiff bazı elde edilmesi oldukça zordur. Ketonlardan Schiff bazı elde edebilmek için reaksiyon sırasında açığa çıkan su ile azeotrop oluşturan bir çözücü seçilmesi, katalizör seçimi, uygun pH aralığı ve uygun reaksiyon sıcaklığının seçimi gibi çok sayıda faktörün dikkate alınması gerekir. Özellikle aromatik ketonlardan Schiff bazlarını elde edebilmek için, yüksek sıcaklık, uzun reaksiyon süresi ve katalizör gereklidir (Patai, 1970).
1.1.1. Schiff Bazlarının Fiziksel Özellikleri
Azot atomunda substituenti bulunmayan küçük molekül ağırlıklı alifatik iminler kolaylıkla polimerleşirler ve bu yüzden bu iminler hakkında literatürlerde çok az bilgi verilmektedir.
Kaynaklarda formaldiminle, (CH2=NH), ilgili hiçbir bilgiye rastlanmazken,
formaldimin elde etmek için kullanılan tüm reaksiyonlar aromatik hekzametilentetramin [(CH2)6N4)] bileşiğini meydana getirmişlerdir. Asetaldimin (CH3CH=NH) sıvı olarak
elde edilmiştir fakat yüksek sıcaklıklarda katı trimer’e dönüştüğünden kaynama noktası ölçülememiştir. Benzaldimin (PhCH=NH) kararsız bir yağ iken, benzofenon imin (PH2C=NH) kararlı bir yapıya sahiptir. Azot atomunun substitusyonu iminlerin
kararlılığını fark edilir miktarda arttırır. İminler, karşılıkları olan aminlerden daha az baziktirler.
1.1.2. Schiff Bazlarında Hidrojen Bağı
Orto konumunda OH grubu içeren aromatik aldehitlerden hazırlanan Schiff bazlarında iki tip molekül içi hidrojen bağı (O-H---N veya O---H-N) oluşmaktadır. Hidrojen bağının tipi molekülün stereokimyasına ve azot atomuna bağlı sübstitüe gruba bağlı değildir. Yalnızca kullanılan aldehitin türüne bağlıdır (Gavranic, 1996).
Salisilaldimin komplekslerinin X-ışınları kristaloğrafisi ile yapılarının aydınlatılması konusunda pek çok çalışma yapılmasına rağmen serbest ligandları oldukça az çalışılmıştır. Benzer bileşik olan 2-hidroksi-1-naftaldimin bileşiklerinde yapılan çalışmalarda (Gavranic, 1996; Hökelek, 1995) çok kuvvetli O-H---N şeklinde (Bağ uzunluğu 1,936Ao) hidrojen bağının olduğu bulunmuştur. Bu tür hidrojen bağının sonucu olarak bileşik keto formuna kaymaktadır. Enolimin formunda C-O bağının uzunluğu 1.362 Ao
iken keto-amin formunda C=O bağının uzunluğu 1.222 Ao bulunmuştur. Ayrıca bu etkiden dolayı oksijenin bağlı olduğu karbona komşu C=C bağının da kısaldığı görülmüştür (Gavranic, 1996).
Hidrojen bağının varlığı IR, 1H-NMR spektroskopik yöntemleri ile de bulunmuştur. IR spektrumlarında hidrojen bağı yapmamış bileşiklerde 3600 cm-1 de görülen OH gerilme titreşimi, hidrojen bağı oluşturmuş bileşiklerde 2300-3300 cm-1
Schiff bazlarındaki O-H---N hidrojen bağının varlığı orto sübstitüe OH grubu bulunduran ve bulundurmayan bir seri Schiff bazı ligandlarının potansiyometrik titrasyonu ile baziklikleri karşılaştırılarak bulunmuştur. Bu seride orto hidroksi aromatik aldehit ve orto hidroksi aromatik aminlerden hazırlanan Schiff bazlarında hidrojen bağlarının iki OH grubu arasında O-H---O şeklinde olduğu ve OH grubu bulundurmayan Schiff bazları ile aynı veya yakın bazik özelliğe sahip olduğu görülmüştür. O-H---N hidrojen bağı oluşturan tek OH grubuna sahip Schiff bazlarında ise yarı nötralizasyon potansiyel değerinin büyüdüğü yani iki OH grubu bulunduran ve hiç bulundurmayan Schiff bazlarına göre bazlık kuvvetinin azaldığı gözlenmiştir.
Molekül içi hidrojen bağının oluşmasıyla beşli ya da altılı yalancı (pseudo) halka oluşmaktadır. Altılı halkanın beşli olana göre daha kuvvetli olduğu sonucu spektroskopik olarak bulunmuştur (Garnovskii, 1993).
1.1.3. Schiff Bazlarının Termokromik ve Fotokromik Etkileri
Katı hal çalışmalarında Schiff bazı bileşiklerinin aldehit tarafında orto konumunda hidroksil grubunun varlığı hem termokromik (ısıyla renk değiştirme) hem de fotokromik (ışıma ile renk değiştirme) etkilerin temel şartı olarak kabul edilebilir. o-Hidroksi Schiff bazlarının büyük bir bölümü ışık ve ısı etkisiyle proton transferi meydana getirirler. Bu özellikleri onların fotokromizm ve termokromizm göstermesine neden olmaktadır. Schiff bazlarının fotokromizm ve termokromizm göstermesinin tek nedeni proton transferi değildir. Kristal ve moleküler yapının bu özelliklerine etkisi büyüktür. Termokromizm gösteren Schiff bazları düzlemsel bir yapıya sahiptir ve sıkı bir biçimde istiflenirlerken, fotokromizm gösteren bileşikler düzlemsel olmayıp daha gevşek bir biçimde istiflenmişlerdir (Hadjoudis vd., 1987).
Termokromik türler cis-keto yapı ile meydana gelirken fotokromik türler trans-keto yapıyla oluşmaktadır. Cis-trans dönüşümü termokromik moleküllerin düzlemsel olarak paketlenmelerinden dolayı mümkün değilken fotokromik olanlarda bu dönüşüm kolaylıkla sağlanmaktadır. Bir Schiff bazının fotokromizm gösterebilmesi için iki molekül arasındaki uzaklığın en az 3.5 A0
olması gerektiği bildirilmiştir. Bu uzaklık moleküler dönmeyi sağlamaktadır. Değerin 3.5 A0’dan daha düşük olması moleküler dönmeyi engellediğinden molekülün fotokromizm göstermesine engel olmaktadır (Hadjoudis vd., 1987).
Kristal yapıda aşağıda önerilen model, düzlemsel moleküllerde sıcaklığa duyarlı bir denge olarak termokromizmi sergiler; I: Enol formu; düşük sıcaklarda kararlı, II: Keto formu; Yüksek sıcaklıklarda kararlı, III: Trans keto formu; düzlemsel olmayan yapı, yüksek enerjiye dayalı proton transferi oluşturan yapı (Moustakali-Mavridis vd., 1978). C OH H N R C O H HN R C O H H N R
I: Enol form II: Keto form III: Trans Keto form Şekil 1.2. Salisilaldehitten türeyen Schiff bazlarının kristal formları
1.1.4. Schiff Bazlarının İsimlendirilmesi
Literatürde, Schiff bazlarının farklı isimlendirilme yöntemleri kullanılmıştır. Aromatik yapıdaki bileşiklerin birçoğu salisilaldehit ve türevi bileşiklerden sentezlendiği için bu bileşikler salisilaldimin, benzaldimin, imino veya salisiliden anilin şekillerinde isimlendirilmiştir. H3CO OH C H N HS a O2N HO H3CO C H N N b HC O N Ni O N CH H3C CH3 c
Şekil 1.3. Schiff bazlarının isimlendirilmesi
(a) 3-metoksisalisiliden-2-aminotiyofenol
(b) N-(pridil)-3-metoksi-4-hidroksi-5-nitrobenzaldimin (c) Bis(N-metilsalisilaldiimino)Ni(II)
Schiff bazlarına azometinler veya iminler de denilmektedir. En yaygın adlandırma alkiliden amin şeklindeki adlandırmadır. Schiff bazları genellikle türetildikleri aldehit ya da ketonun adına –imin kelimesi eklenerek veya –aldimin ve – ketimin son ekleri kullanılarak adlandırılırlar (Forman, 1964).
1.1.5. Schiff Bazlarının Geometrik İzomeri
Aldiminlerde, syn-izomeri, C=N çift bağı çevresindeki hidrojen ve azota bağlı substitüentin çift bağ düzleminin aynı tarafında olması halinde kullanılır.
OH
C N
H H
Şekil 1.4. Salisilaldiminin syn-izomeri
C=N bağı etrafındaki dönmenin C=C bağına göre daha kolay olması steroizomerlerin birbirlerine dönüşebilmesini sağlar. Bunun nedeni ise karbona göre daha elektoronegatif olan azot atomunun azometin bağında bir polarizasyona yol açmasıdır. Eğer azometin grubundaki N atomunda elektron verici grup varsa, (oksimler ve hidrazonlarda olduğu gibi) elektronegatif grubun N atomunun negatif yüklerini karbona doğru itmesi polarizasyonun azalmasına ve kovalent çift bağ karakterinin artmasına neden olur. Yani azot atomunda elektron salıcı bir grubun bulunması azometin bağı (C=N) etrafındaki dönmeyi zorlaştırır (Bıçak, 1980).
Azometin grubunun içerdiği azotun nükleofil oluşu nedeniyle Schiff bazlarında oldukça sabit bir tautomerizm ortaya çıkar. Bu tautomerleşme de OH grubundaki proton diğer azota aktarılır.
Schiff bazlarının tautomeritik formlarını tanımlamadan önce karbonil bileşiklerinin tautomeritik formlarını tanımlamak gerekir. Karbonil bileşiklerinde α-hidrojen asitliği, kuvvetliği bir baz olmaksızın bile belirgindir. Asidik α-α-hidrojeni taşıyan karbonil bileşikleri, tautomerler adıyla bilinen iki yapıda bulunabilirler.
Tautomer, birbirine dönüşebilen özel bir yapı izomeridir. İki yapının birbirine göre farkı yalnızca çift bağın ve α-hidrojeninin yerinden kaynaklanır. Basit bir ketonun iki tautomeri vardır; enol ve keto tautomerler karbonil bileşiğinin bilinen yapısı, aynı zamanda onun keto tautomeridir. Vinil alkol yapısında olan enol tautomeri ise alfa
karbonundan asidik bir hidrojenin karbonil oksijenine geçmesi ile oluşur. Bir hidrojen atomu farklı yerde bulunduğu için, iki tautomer birbirinin rezonans yapıları değildir. Bunlar dengede bulunan iki farklı yapıdır (Yılmaz, 2000).
Saf bir sıvı içinde enol’e göre keto şeklinin bağıl çokluğu, IR ya da NMR spektroskopisi yardımıyla ölçülebilir. Basit aldehit ve ketonların çoğu öncelikle keto şeklinde bulunmaktadır.
Salisilaldehit ve türevlerinin primer aminlerle kondenzasyon reaksiyonu sonucu oluşan Schiff bazları farklı tautomerik yapılar meydana getirmektedir. Pridoksal ve salisilaldehit ile yapılan çalışmalarda, Schiff bazlarının ketoamin ve enolimin formlarının bulunduğu ifade edilmiştir (Metzler ve Christen, 1985). Bunlar aşağıdaki şekilde gösterilebilir. Spetrofotometrik olarak yapılan bu çalışmalarda, ketoamin ve enolimin türlerinin yüzdesinin çözücü polaritesine bağlı olarak değiştiği ve düşük polaritedeki çözücülerde, polar enoliminin tautomerisinin daha fazla bulunduğu ispatlanmıştır. Su ve dimetilformamid daha yüksek dielektrik sabitine sahip çözücülerde ise ketoamin türleri baskındır. Schifff bazlarının spektrofotometrik olarak yapı aydınlatılması, tautomerik dengeler esas alınarak yapılmaktadır (Yılmaz, 2000).
N OH R N O H R O N H R
Fenolimin yapısı Bipolar iyon Ketoamin yapısı
Bu iki tautomerik yapının varlığı 13
C NMR, 1H NMR, UV gibi spektroskopik yöntemleri ve X-ışınları kristaloğrafi yöntemi ile belirlenmiştir (Salman vd., 1990).
Bu bileşiklerdeki tautomerleşme ilk defa Dudek ve Holm tarafindan 1961 yılında 1-hidroksinaftaldimin bileşiklerinde gösterildi (Isıklan, 1997). Daha sonra 2- hidroksi-1-naftaldehit ile bazı aromatik ve alifatik (R=amonyak, metilamin ve fenilamin) aminlerden hazırlanan Schiff bazlarında yapılan çalışmalarda bu tautomerleşmenin baskın formunun kloroform gibi polar çözücülerde keto, apolar çözücülerde ise fenol formunun olduğu UV ve 1
H-NMR spektroskopik yöntemleri ile bulundu (Dudek ve Dudek, 1964; Dudek ve Dudek, 1966). Keto formunun polar çözücüde baskın form olduğu, polar çözücüde alınan UV spetrumunda 400 nm’den büyük dalga boylarında yeni bir absorpsiyon bandının oluşması ile de gözlenmiştir
(Salman, 1990; Dudek ve Dudek, 1966). 1-(N-fenilformimidol)-2-naftol bileşiğinin mutlak alkolde alınan UV spektrumunda 430-480 nm arasında absorpsiyon bandı gözlenmiş, siklohekzanda alınan ve 430-480 nm arasındaki absorpsiyon bandının kaybolduğu ve 350-400 nm arasında yeni bir absorpsiyon bandının oluştuğu gözlenmiştir (Dudek ve Dudek, 1966).
Tautomerleşme sonucu naftalin halkasından birisinin aromatikliğini kaybetmesi, rezonans enerjisini 80-90 kJ/mol kadar azaltır (Salman vd., 1990).
OH N
O NH
Orto hidroksi grup içeren aldehitlerden elde edilen Schiff bazlarında fenol-imin ve keton-amin olmak üzere iki tip toutomeri mevcuttur. Bu iki toutomerin varlığı 13 C-NMR, 1H-NMR, UV spektroskopik yöntemlerle ve X-ışınları kristaloğrafi yöntemi ile belirlenmiştir.
Toutomerizm kimya alanında ve biyokimyada önemli rol oynar. Moleküller arası proton transferi özellikle lazer boyalarında, yüksek enerjili radyasyon dedektörlerinde ve polimer koruyucularında gözlenir (Joshi vd., 2002).
Crown eter içeren ve –OH grubuna sahip Schiff bazlarında da fenol-imin keto-amin tautomerisi incelenmiş ve baskın olan formun fenol-imin olduğu tespit edilmiştir (Havyalı vd., 1999). Buna göre çözeltilerdeki tautomerizm çözücü polaritesine ve hidrojen bağı yapma kabiliyetine bağlıdır. Örneğin etanolde keto-amin tautomer oranı, DMSO, CHCl3 ve C6H6 çözeltilerindeki oranından daha fazladır. Bu da etanolün diğer
çözücülere göre daha fazla hidrojen bağı yapabilme kabiliyetinden kaynaklanmaktadır. Çözelti polaritesinin azalmasıyla keto-amin konsantrasyonu da o ölçüde azalmaktadır (EtOH>CHCl3>C6H6).
O O O O O H C O N H O O O O O H C O N H R O O O O O H C O N H O O O O O H C O N H R O O O O O H C O N H O O O O O H C O N H R
Şekil 1.5. Crown eter içeren ve orto –OH grubuna sahip Schiff bazlarında fenol-imin keto-amin tautomerik dengesi
o-Hidroksi Schiff bazlarının fenol halkasındaki sübstitüentler hidrojen bağının kuvvetini etkilediği gibi tautomerik dengenin de değişmesine neden olmaktadır. OH grubuna göre o- ve p- pozisyonunda elektron çekici grupların varlığı asitliğinin artmasını sağladığı gibi, keto yapısını rezonans ve indüktif etkiyle kararlı halde tutabildiği için hidrojenin azot atomuna göçmesine neden olur. Böyle bir proton transferi keto tautomer oranını artırmaktadır (Filarowski vd., 1999; Filarowski vd., 2002; Wozniak vd., 1995). o-Hidroksi Schiff bazlarının fenol halkasındaki sübstitüentler hidrojen bağının kuvvetini etkilediği gibi tautomerik dengenin de değişmesine neden olmaktadır. OH grubuna göre o- ve p- pozisyonunda elektron çekici grupların varlığı asitliğinin artmasını sağladığı gibi, keto yapısını rezonans ve indüktif etkiyle kararlı halde tutabildiği için hidrojenin azot atomuna göçmesine neden olur. Böyle bir proton transferi keto tautomer oranını artırmaktadır (Filarowski vd., 1999; Filarowski vd., 2002; Wozniak vd., 1995).
OH N O N H O N H O N H O N H Şekil 1.6. Schiff bazlarında oluşan rezonans yapılar
Schiff bazlarının enerjetik olarak tercih edilen konformasyonu düzlemsel olmayan yapıdır (Garnovskii vd., 1992). Şekil 1.7.’de gösterildiği gibi N-Ar sübstitüe olanlar genellikle C=N düzleminde ȹ2 açısı ile döndürülmüş iken, aldehit aromatik
halkalı azometin grubu ile aynı konumdadır (ȹ1= 0o). Bu konformasyon kuantum
mekaniği hesaplamaları ile doğrulanmıştır (Garnovskii vd., 1992).
N R1 R R2 R3 φ 1 φ2
Şekil 1.7. Schiff bazlarının stereokimyası
Schiff bazlarının düzlemsel olmayan yapıları sterik ve elektronik etkilerin toplamı ile hesaplanabilmektedir. Örneğin amin tarafındaki R2 grubu elektron çekici bir
grup ise ȹ2 açısı büyümekte, elektron verici ise ȹ2 açısı küçülmektedir. Orto hidroksi
sübstitüe olanlarda OH grubu molekülün konformasyonuna çok az etki etmektedir. Örneğin N-fenilbenzaldiminde (R=R2=R3=H) ȹ2 açısı 55,2o iken,
N-fenilsalisilaldiminde (R=R2=R3=H, R1=OH) açı 49o bulunmuştur. Bu açı katı halde ve
çözeltide pek değişmemektedir. N-fenil-2-hidroksi-1-Naftaldimin kristalde 41,3o
iken, dioksan çözeltisinde 48o olarak ölçülmüştür (Garvovskii vd., 1992). Schiff bazlarının yapılarını tautomerik konformasyonlar ve farklı tiplerde oluşan hidrojen bağları belirlemektedir.
1.1.6. Schiff Bazlarının Sınıflandırılması
Schiff bazı oluşumunda en fazla kullanılan karbonil bileşikleri; salisilaldehit, ß-diketonlar, fenonlar, pridoksal, o-hidroksi naftaldehit, diasetil piridin, 4-propanoil pirazolen, diformil fenol ve piruvik asittir. Kullanılan amin bileşikleri ise daiminler, aminopirinler, alkil aminler ve aminoasitlerdir.
Schiff bazlarının sınıflandırılması türedikleri amin bileşiğine göre yapılmaktadır. 1. Primer bir aminden meydana gelen iminler
R R O + R NH2 R R N + H2O
2. Anilinden meydana gelen aniler
R R O + H2N N H R + H2O
3. Hidrazinden meydana gelen hidrazon ve azinler
R R O + H2N NH2 R R N NH2 + R R O R R N N R R
4. Hidroksilaminden meydana gelen oksimler
R R O + H2N R R N OH OH
5. Aminoasitlerden meydana gelen iminler
H H O + R H2N COOH H H N R COOH + H2O
6. Sübsitüe aromatik aminlerden türeyenler
OH H O + H2N R OH H N R - H2O 7. Diaminlerden türeyenler (X=2-12)
OH
N
HO
N
(CH2)X
Diaminler ile elde edilen Schiff bazları genel olarak iki ana başlıkta toplanabilir. Bunlar simetrik ve simetrik olmayan (asimetrik) Schiff bazlarıdır. Bunlardan simetrik ve simetrik olmayan Schiff bazları da donör atom sayısına ve çeşidine göre tekrar bölümlere ayrılır (Chattopadahyay vd., 2006).
1.1.7. Schiff Bazlarının Sentezi
Schiff Bazları primer amin grubu içeren bileşiklere aromatik veya alifatik aldehit bileşiklerinin katılarak su ayrılması sonucu elde edilebilir. Örneğin aminotioller, o-aminofenoller, -amino asitler ve amino alkollere asetilaseton veya salisilaldehit ve benzerlerinin katılması ile elde edilebilir.
C O + H2N R C O NH2 R C OH NH R H3O+ C OH2 NH R -H2O N C H R H2O C N R + H3O+
Aldehit veya Keton
1oAmin
Şekil 1.8. Schiff bazlarının sentezi
Karbonil bileşikleriyle primer aminlerin reaksiyonundan elde edilen Schiff bazlarının oluşumunun mekanizması iki basamaklıdır. Birinci basamakta, primer aminle karbonil grubunun kondensasyonundan bir karbinolamin ara bileşiği meydana gelir. İkinci basamakta ise bu karbinolamin ara bileşiğinin dehidratasyonu sonucunda Schiff Bazı oluşur. Amonyak ile elde edilen Schiff bazları dayanıklı değildir ve
bekletildiğinde polimerleşebilir. Ancak amonyak yerine primer aminler kullanıldığında daha dayanıklı bileşikler elde edilebilir.
1. Basamak katılma R C R O + R NH2 R C R O NH2 R 2. Basamak ayrılma R2CNHR OH H+ R2CNHR OH2 -H2O CR2 NR H -H+ CR2 NR
Şekil 1.9. Schiff bazlarının genel oluşum mekanizması
Amonyak, aminler ve diğer benzer bileşikler azot atomumda ortaklanmamış elektron içerirler ve karbonil karbonuna karşı nükleofil olarak davranırlar. Reaksiyonda ilk oluşan dörtyüzlü katılma ürünü bir yarı asetale benzer, ancak oksijenlerden birisinin yerine NH geçmiştir. İminler oksijen yerine –NR grubunun geçtiği karbonil bileşiklerine benzerler. Bunlar bazı biyokimyasal tepkimelerde, özellikle pek çok enzimde bulunan amino grubuna karbonil bileşiklerinin bağlanmasında önemli ara ürünleridirler.
Karbonil bileşikleri ile primer aminlerin kondensasyonundan oluşan N-alkil veya aril sübstitüte imin yapısındaki Schiff bazlarının kondensasyonunda reaksiyon dengesi sulu ve kısmen sulu çözeltilerde büyük ölçüde hidrolize kaymaya yatkındır.
Kondensasyonlar genellikle suyun azeotrop teşkili ile destilasyon yoluyla ortamdan uzaklaştırılabildiği çözücülerde yapılır. α-pozisyonunda bir sübstitüent taşımayan aldehitler çoğu zaman aminlerle başarılı kondensasyon yapamazlar. Çünkü bu durumlarda başlangıçta oluşmuş iminler daha sonra dimerizasyon veya polimerizasyon reaksiyonlarında dönüşebilirler. Tersiyer alkil guruplarına sahip aminlerle alifatik aldehitler başarılı kondensasyona uğrarlar. α- Pozisyonunda dallanmış bulunan alifatik aldehitler aminlerle iyi bir verimle kondense olurlar. Tersiyer alifatik aldehitler oda sıcaklığında hemen hemen kantitatif miktarlarda imin verirler. Aromatik aldehitler, reaksiyonla teşekkül eden suyun çoğu kez uzaklaştırılması gerekmeksizin kondensasyon yapılabilir.
İmin vermek hususunda ketonlar aldehitlerden daha az reaktiftirler. Asit katalizi kullanarak yüksek reaksiyon sıcaklığında ve çok uzun reaksiyon süresinde teşekkül eden suyun uzaklaştırılmasıyla, iyi verimle Schiff bazları elde edilebilir. Ketonların daha az reaktif oluşları, aldehitlere nazaran sterik bakımdan engelli bir yapıda olmasıyla açıklanabilir. İminlerin hidroliz ve kondensasyon hızlarına asidin etkisinden, mekanizma hakkında çok sayıda ipucu çıkarılmıştır. Genel olarak kondensasyon, hidroliz ve aldol kondensasyonundan sakınmak için orta bazik çözeltilerde (katalizsiz) pH’dan bağımsız bir reaksiyon gösterir. Nötral ve asidik çözeltilerde ise asit katalizli bir reaksiyon gösterir. Orta derecede asidik çözeltilerde hem hidroliz hem de kondensasyon hızı asiditenin artmasıyla artar. İminlerin teşekkülünde kuvvetli asitlerden kaçınılmalıdır. Çünkü zayıf asitlerle iyi sonuçlar alınabilmektedir (Moffet ve Hoehn, 1947; Grewe vd., 1953).
Aromatik aldehitler ve ketonlar oldukça kararlı azometin bağı oluşturabilirler. Azometinler anti izomerleri halinde oluşurlar. Ancak bu izomerler arasındaki enerji farklarının çok düşük olması, bunların izolasyonunu hemen hemen imkânsız kılar.
Aromatik aldehitlerin aromatik aminlerle kondenzasyonunda, aldehitin para pozisyonunda elektron çekici bir sübstitüentin bulunması reaksiyon hızının arttığı, aminde bulunması halinde ise reaksiyon hızının azaldığı anlaşılmıştır (Pratt ve Kamiet, 1961).
1.1.8. Schiff Bazları Kullanım Alanları
Schiff bazları ve bunların metal kompleksleri çeşitli kalitatif ve kantitatif tayinlerde, radyoaktif maddelerin zenginleştirilmesinde, ilaç sanayinde, boya endüstrisinde ve plastik sanayinde kullanımının yaygınlaşması, biyokimyasal aktivitesi nedeniyle büyük ilgi çekmesi ve özellikle son yıllarda sıvı kristal teknolojisinde kullanılabilecek pek çok Schiff bazının sentezlenmesi bu maddelerle ilgili çalışmaların önemini artırmıştır.
Günümüzde, spektral yöntemlerin gelişmesiyle biyokimyasal bazı reaksiyonların mekanizmaları açıklanabilmiştir. Canlılarda bazı reaksiyonların Schiff bazları üzerinden yürüdüğü; Schiff bazlarının aldehit ve amin komponentlerinin toksik etkilerini yok ettikleri ve serbest metal iyonlarını şiddetle bağladıkları bu şekilde belirlenmiştir. Bu yüzden Schiff bazları farmakolojide ve biyoorganik kimyada yaygın olarak kullanılır.
Likit kristal yapımında kullanılan madde türevlerinin çoğu Schiff bazlarıdır. Ayrıca Schiff bazı metal kompleksleri radyofarmostik madde olarak da radyoloji alanında kullanılır.
Schiff bazlarıyla yapılan çalışmaların artmasının nedenlerinden birkaçını sıralarsak;
1) Schiff bazları uygun aldehit veya ketonun primer aminle kondenzasyonuyla çok kolay elde edilebilir. Çoklu kondenzasyon proseslerinde kompleksin düzlemsel ya da üç boyutlu bileşikleri bir basamakta elde edilebilir.
2) Genellikle ilave olarak dönor grupları (O, S, P, vb) içerebilir ve bu yapılar biyolojik sistemlerin aydınlatılması ve metal iyon kompleksleri için uygun yapılardır.
3) Alternatif olarak Schiff bazları template etkiyle elde edilebilir. Bu yöntem istenen kompleksleri doğrudan doğruya verir. Bununla beraber, bu kompleksler farklı metal tuzlarıyla reaksiyona girdiği zaman metallerin yer değiştirmesi reaksiyonlarına uğrayabilir. Bu sentetik yöntem, başka türlü yöntemlerle erişilemeyen kompleksleri verir. Bu yöntem yeterli saflıkta ve yüksek yüzdede istenilen kompleksleri verirler.
4) Schiff bazları aldehit ya da ketonun ve amin gruplarının alifatik yada aromatik zincirlere uygun grupların eklenmesiyle işlevsel hale gelebilir.
5) Daha esnek ve hidrolize daha az duyarlı poliimin türevleri, uygun indirgenlerle muamele edildiğinde indirgenerek kompleksin bozunmasına yol açabilir. Bunlar uygun sentez yöntemleriyle indirgenirse NH grupları içeren bileşikler oluşur ve daha fazla işlevsel hale gelebilir.
6) Bazı Schiff bazlarında olağandışı kompleksleşme görülebilir, örneğin sarmal yapılar, uygun dönor ya da uygun zincirler içeren imin türevleriyle elde edilebilir.
7) Silika gibi uygun bir desteğe bağlanabilir. Böylece değişik katalizör ve değişik yüzey elde edilmiş olur.
8) Spesifik metal iyonları için taç eter, tiyoeter, poliaza türevleri gibi ligandlarla birlikte bulunduğunda çok iyi ligandlardır. Böylece tek liganda (Schiff bazı ve taç eter parçası) farklı koordinasyon birleşmesi ve farklı metal iyonları tanıma proseslerini ya da çeşitli seçicilik kabiliyetiyle ilginç sistemlere yol açar (Vigato ve Tamburini, 2004).
Schiff bazları ya da iminler, R2C=NR-, primer aminlerle aldehit ya da ketonların
kondenzasyon ürünleridir ve bunlar metal komplekslerinin hazırlanmasında kapsamlı olarak kullanımlarını sağlar. Böyle ligandlar iki yönlü optik verileri depolamak için organik malzemeler gibi potansiyel uygulamalarıyla beraber ilginç foto-fiziksel özelliklere sahiptir (Rix vd., 2005).
İmin bağı, çok yönlü fiziksel ve kimyasal özelliklere sahiptir ve iminler biyolojik katalizde önemli rol oynarlar. C=N bağı kararsız, tekrar biçimlenebilir ve hidrolizlenebilir. C=N gerilme frekansındaki yükselme genellikle Lewis asitleri reaksiyonuyla ya da iminlerin protonlanmasıyla olur (Wang ve Poirier, 1997).
Schiff bazları sentetik patlayıcı olan siklonik (RDX)'in hazırlanmasında, lastiğin vulkanizasyonunda hızlandırıcı ve ayrıca antioksidan olarak kullanılır. Schiff bazları boya, parfüm ve ilaç endüstrisinde kullanılmakta (Biricik vd., 2005) ve salisilaldimin gibi bazı Schiff bazlarının güçlü antioksidan özelliğinin yanı sıra yağların kokuşmasını da önlediği bildirilmektedir (Tas vd., 2005).
Genelde renksiz, saydam katılar olmasına rağmen bazıları renklidir. Bu özelliklerinden yararlanılarak boya endüstrisinde kullanılabilmektedir (fenilin mavisi ve naftol mavisi gibi...) Ayrıca parfüm ve ilaç endüstrisinde de oldukça fazla kullanılmaktadır. Bunun yanında özellikle biyokimya ve analitik kimya açısından da gittikçe önem kazanmaktadır. Bu bileşiklerin sentetik oksijen taşıyıcı, enzimatik reaksiyonlarda ara ürün oluşturucu gibi özelliklerinin yanında bazı metal iyonlarına karşı seçici ve spesifik reaksiyon vererek spektrofotometrik reaktif olarak analitik kimyada kullanımları da önem taşımaktadır. Oluşan Schiff bazları keskin erime noktalarına sahip oldukları için karbonil bileşiklerinin tanınmasında ve metallerle kompleks verebilme özelliklerine sahip olmaları nedeniyle de metal miktarlarının tayininde de kullanılmaktadırlar. Ayrıca Schiff bazları fungisid ve böcek öldürücü ilaçların bileşiminde de bulunabilmektedir.
Salisilaldehitin etilendiamin ve propilendiamin gibi alkillerin diaminlerle kondensasyonu sonucu meydana gelen Schiff bazları gaz yağı içerisinde metal deaktivatör olarak kullanılır. Polisikloksan ve PVC'nin stabilazyonu için disalisitidenpropilendiamin kullanılmaktadır. Aynı zamanda bu Schiff bazın nikel şelatının termoplastik reçineler için ışık stabilizatörü olarak kullanılmasının uygun olduğu rapor edilmiştir.
Formaldehit, amonyakla halkalı yapıda bir bileşik olan hekzametilentetramin oluşturur. NH3'ün formaldehide katılması ile başlayan ve bunu izleyerek H2O
eliminasyonu reaksiyonunda ele geçen hekzametilentetramin, ürotropin adı altında tıpta üriner sistem antiseptiği olarak değer taşır.
İminler ya da Schiff bazlarının en ilgi çekici biyolojik aktivitelerinden biri aminoasit biyo-sentezinde oynadıkları roldür. Schiff bazları α-aminoasitlerin, RCH(NH2)COOH, biyosentezinde önemli ara bileşiklerdir, α-aminoasitler organizmada
proteinlerin sentezinde kullanılır. Yiyeceklerin yeterli miktarda alınması zorunlu aminoasit içermemesi sonucu organizma bazı durumlarda ihtiyaç fazlası bir aminoasidi transaminasyon tepkimesiyle gereksinim duyduğu aminoasite dönüştürür. Bu işlemde, ihtiyaç fazlası aminoasidin amino grubu, bir keto-aside taşınır.
1.1.9. Schiff Bazlarının Spektroskopik Özellikleri
1.1.9.1. UV-Vis
C=N sistemi ultraviyole alanda absorbsiyon gösteren zayıf bir kromofordur. Fenil gruplarıyla konjugasyon absorbsiyonu görünür bölgeye kaydırır. Aromatik aldehit ve ketonların anilleri genellikle sarıdır (Smith, 1966).
Schiff bazlarının UV-Vis spektrumları incelendiğinde 210-400 nm arasında iki pik verdiği gözlenir. Bunlar Tablo 1.1.’de gösterilmiştir.
Tablo1.1. Schiff bazlarının UV-Vis Spektrumları
n → π* geçişleri hidrojen bağı C=N grubu π-π* geçişleri 280-400 nm 400 nm 210-272 nm 1.1.9.2. Infrared (IR)
Geçis metal komplekslerinin IR spektrumlarında metal-ligand titreşim bantları uzak-IR’de (650–500 cm–1) görünür. Metal-azot (M-N) titreşim bantları amin komplekslerinde 500–650 cm–1 de ortaya çıkar (Djebbar vd., 2001).
Asetonil aseton ve türevlerinin metal kompleksleri ile yapılan çalışmalarında metaloksijen (M-O) titreşim bandları 500–400 cm–1 aralığında, metal-kükürt (M-S) titreşim bandı 420–440 cm–1 arasında bulunmuştur (Burger ve Ruff, 1965). Sulu komplekslerde ise su molekülü, koordinasyon suyu halinde veya kristal suyu halinde bulunur.
Su molekülü koordinasyon halinde ise –OH düzlem içi ve düzlem dışı eğilme titreşim bantları 650–880 cm–1 aralığında ortaya çıkar. Eğer su molekülü kristal suyu halinde ise zayıf hidrojen köprüleri vardır. Suyun gerilme titreşimleri 3350–3200 cm–1
aralığında, eğilme titreşimleri 1630-1600 cm–1 aralığında ortaya çıkar (Gül ve Bekaroğlu, 1982).
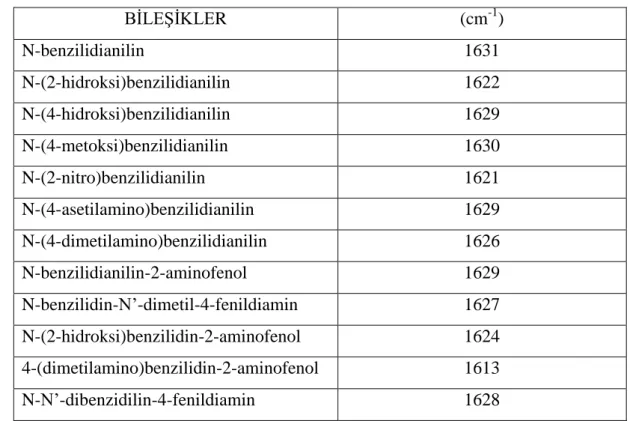
Ar-CH=N-Ar tipindeki bileşiklere son zamanlarda ilgi artmıştır. Moleküller incelendiğinde 1637-1626 cm-1 bölgesinde frekans verir. Cloughert, Sousa ve Wyman inceledikleri on yedi anil’in frekans sıklığını 1631-1613 cm-1
bulmuşlardır. Sodyum borhidrit ile N-benzilanilinlerin benzerliği seçilen bileşikler azaldığı zaman absorbsiyonun gözden kaybolması yüzünden band aralığı elde edilememiştir (Patai, 1970 ).
Tablo 1.2. Aromatik Schiff bazlarının C=N IR spektrumları (cm-1)
BİLEŞİKLER (cm-1) N-benzilidianilin 1631 N-(2-hidroksi)benzilidianilin 1622 N-(4-hidroksi)benzilidianilin 1629 N-(4-metoksi)benzilidianilin 1630 N-(2-nitro)benzilidianilin 1621 N-(4-asetilamino)benzilidianilin 1629 N-(4-dimetilamino)benzilidianilin 1626 N-benzilidianilin-2-aminofenol 1629 N-benzilidin-N’-dimetil-4-fenildiamin 1627 N-(2-hidroksi)benzilidin-2-aminofenol 1624 4-(dimetilamino)benzilidin-2-aminofenol 1613 N-N’-dibenzidilin-4-fenildiamin 1628
Azometin taşıyan çok sayıda bileşiğin incelenen IR spektrumlarında karbonda ve azotta değişik sübstitüentler bulunmasına ve konjugasyona göre C=N gerilim bandının 1610-1670 cm-1 arasında çıktığı görülür. Witkop aromatik Schiff bazlarında C=N gerilim bandının 1626-1639 cm-1 arasında olduğunu ortaya koymuştur (Witkop ve Beiler, 1954).
Hidroksil grubu içeren Schiff bazlarının IR spektrumları, karakteristik υ(C=N) ve ʋ(OH) frekanslarının gözlemlenmesi amacıyla alınır. Ayrıca, orto-hidroksi grubu hidrojeni ile azometin azotu arasındaki muhtemel hidrojen bağı oluşumundan kaynaklanan υ(OH) frekansındaki kaymalar incelenir. Azometin azotu ile yapılan H
bağından dolayı oluşan konjuge-şelat halka sisteminin yaklaşık 2700-2800 cm-1 aralığında bandı gözlenir ve 3500 cm-1
in üzerinde π bağında OH grubuna ait geniş bir band gözlenir. Kompleks oluşumu ile OH bandı kaybolur. Schiff bazlarının yapısındaki –N=C– grubunun düzlem içi titreşimlerinden ileri gelen absorpsiyonlar çevresindeki elektronik değişikliklere karşı çok duyarlı olup iminlerde yaklaşık 1640-1630 cm-1 de gözlenmektedir.
IR spektrum ile yapı tayini Schiff bazlarında C=N çift bağına ait gerilme titreşim frekansı ve diğer bağlara ait titreşim frekansları Tablo 1.3’te gösterilmiştir.
Tablo 1.3. Schiff bazları ve diğer grupların IR Spektrumlarındaki frekansları
Grup Titreşim frekansı, cm-1
-C=N- 1690-1600
N-H 3500-3350, 1600
C=O 1750-1650
C-N 1400
C=C 1610-1670
Azometin (C=N-) grubunun absorbsiyonu 1689-1471 cm-1 bölgeleri arasında gözlenmektedir. C=N gerilme titreşimi, değişken şiddette olmakla beraber, C=C gerilme titreşimlerinden daha şiddetlidir (Silverstein vd., 1981). o-hidroksi Schiff bazlarında keto formunun delokalize π bağı taşıyan karbonil C=O grubundan kaynaklanan keskin bandlar 1600 cm-1’den daha büyük değerde gözlenmektedir. 5-Nitro-N salisilidenetilamin üzerine yapılan çalışmalarda asetonitril içerisinde alınan spekturumda karbonil frekansının 1680 cm-1 geldiği gösterilmiştir (Majers vd., 2000). Bu da keto karakterin artmasıyla karbonil frekansının yükseldiğini göstermektedir.
IR spektrumlarında azometin grubu dışında moleküle bağlı diğer grupların titreşimlerini de gözlemek mümkündür. Nitro grubunun bağlı olması durunda 1550-1500 cm-1 ve 1360-1290 cm-1 bölgesinde iki kuvvetli absorbsiyon gösterir. Molekül içi hidrojen bağlı sistemlerde 3200-2500 cm-1 arasında zayıf ve yayvan bir pik meydana gelirken moleküller arası hidrojen bağlı sistemlerde 3550-3450 cm-1 arasında absorbsiyon gözlenmektedir. Aromatik C-H gerilme titreşimleri 3100-3000 cm-1 bölgesinde ortaya çıkarken aromatik C=C gerilme titreşimleri 1600-1585 cm-1
ve 1500-1400 cm-1 bölgesinde ve CH2 için alifatik C-H asimetrik gerilmesi 2926 cm-1 ve
simetrik C-H gerilmesi 2853 cm-1, CH3 için asimetrik C-H gerilmesi 2962 cm-1 ve
simetrik C-H gerilmesi 2872 cm-1 gözlenir. Aromatik halkaya klor bağlanmasıyla oluşan C-Cl bağı gerilme titreşimi 1096-1089 cm-1, florun varlığında C-F gerilme titreşimi 1250-1100 cm-1, C-Br gerilme titreşimi 1090-1025 cm-1 ve C-I gerilme titreşimi de 1080-1025 cm-1 aralığında gelmektedir (Silverstein vd., 1981; George ve Mcintyre, 1987; Gündüz, 1988; Köksal, 1996).
1.1.9.3. NMR
Aromatik azometinlerin NMR çalışmaları, azot ve hidroksi grubu arasındaki hidrojen bağına yönelikti. Ancak Hammet, p sabiti ile azometin protonunun kimyasal kaymasına substituent etkilerini ilişkilendirmiştir ve aldehit halkasındaki para substituentlerle bir ilişkisinin varlığı gösterilmiştir. Azometinlerin NMR spektrumları, aromatik aldehit halkasında para substitusyonunun, substituentlerin konjugatif etkisi ile aynı doğrultuda azometin protonunun kimyasal kaymasında değişiklik oluşturduğunu göstermektedir. Jeong ve arkadaşları sentezledikleri 1,2-bis(naphthylideneimino)ethane isimli Schiff bazına ait 1
H ve 13C NMR spektrumlarında azometin protonunu 9,16 ppm, karbonunu ise 177,6 ppm de tespit etmişlerdir.
1.2.Amino Asitler
1.2.1. Amino asit tanımı
Amino asitler, yapılarında hem amino grubu (−NH2) hem de karboksil grubu
(−COOH) içeren bileşiklerdir. Doğada 300 kadar farklı amino asit bulunmaktadır. Amino asitlerin standart amino asitler diye bilinen 20 tanesi, karakteristik sayı ve diziliş sırasında bir düz zincirde birbirlerine kovalent olarak bağlanarak proteinleri oluştururlar. Standart amino asitler, DNA tarafından kodlanan ve proteinleri oluşturan birimlerdir.
Bir standart amino asit polipeptit zinciri yapısına girdikten sonra bir düzenlenmeye uğrarsa standart olmayan amino asitler diye bilinen bazı amino asitler oluşabilir. Örneğin prolin, kollajen içerisinde hidroksiproline okside olur. Birçok enzim aktivitesi, serin, treonin ve tirozin birimlerinin fosforilasyonu ile düzenlenir. Glikoproteinlerde serin, treonin, asparajin amino asitlerine, galaktoz, glukoz, mannoz,
diğer şekerler veya oligo sakkaritler bağlanmıştır. Tiroglobulin yapısındaki tirozin, tiroit hormonlarına dönüştürülür.
Proteinlerin yapısında bulunmayan fakat hücrede çok değişik biyolojik fonksiyonlara sahip amino asitler de vardır.
1.2.2. Standart Amino Asitler
Standart amino asitler, aynı karbon atomuna bağlanmış bir amino grubu ve bir karboksil grubu içerirler. Fizyolojik pH’da, amino grubu proton taşır ve pozitif yüklüdür; karboksil grubundan ise proton ayrılmıştır ve negatif yüklüdür.
H3N H O O Karboksil Grubu Amin Grubu R Yan Zincir
Şekil 1.10. Standart amino asit.
Standart amino asitlerde (Şekil 1.10.), amino ve karboksil gruplarının bağlı olduğu karbon atomu α-karbon atomu diye anılır. R grubu bir zincirde ek karbonlar içeriyorsa bu karbonlar β, γ, δ, ε gibi harflerle belirtilirler.
Tablo 1.4. Amino asitler ve kısaltmaları
Amino asit Kısaltma Amino asit Kısaltma
Glisin Gly G Treonin Thr T Alanin Al A Sistein Cys C Valin Val V Metiyonin Met M Lösin Leu L Asparajin Asn N İzolösin Ile I Glutamin Gln Q Prolin Pro P Aspartat Asp D Fenilalanin Phe F Glutamat Glu E Tirozin Tyr Y Lizin Lys K Triptofan Trp W Arjinin Arg R Serin Ser S Histidin His H
1.2.3. Standart Amino Asitlerin Sınıflandırılmaları
Standart amino asitler birbirlerinden yan zincirlerindeki yani R gruplarındaki yapı, büyüklük, elektrik yükü, amino asidin sudaki çözünürlüğüne etkisi bakımından farklıdırlar (Tablo 1.5). Bazı amino asitler, fizyolojik pH’da, amino grubundaki pozitif yüke ve karboksil grubundaki negatif yüke ek olarak yan zincirde de bir yük taşımaktadırlar. Bazı yan gruplar polar iken bazı yan gruplar apolardır. Amino asitlerin fonksiyonları ve protein yapısındaki rolleri, yan zincirlerinin kimyasal özellikleri ile bağlantılıdır.
Tablo 1.5. Standart Amino Asitlerin Sınıflandırılması
Aminoasit sınıfı Sınıf üyesi aminoasitler
Apolar, alifatik R grubu aminoasitler Genellikle apolar, aromatik R gruplu aminoasitler COO -H +NH 3 CH2 COO -H +NH 3 CH2 OH COO -H +NH 3 C CH2 H C NH
Polar, fakat yüksüz R gruplu aminoasitler COO -H +NH 3 CH2OH COO -H +NH 3 COO -H +NH 3 CH2 COO -H +NH 3 CH2 CH2 COO -H +NH 3 C CH3 COO -H +NH 3 CH2 CH2 C H OH CH3 SH Serin Treonin Sistein S CH3 H2N O C H2N O Metiyonin Asparajin Glutamin Negatif yüklü R gruplu aminoasitler COO -H +NH 3 CH2 COO -COO -H +NH 3 CH2 CH2 COO -Aspartat Glutamat Pozitif yüklü R gruplu aminoasitler COO -H +NH 3 CH2 CH2 COO -H +NH 3 C CH2 CH2 CH2 NH3+ COO -H +NH 3 CH2 CH2 CH2 NH C NH3+ NH2 H N N N Lizin Histidin Arjinin
1.2.4. Amino Asitlerin Schiff Bazı Oluşum Tepkimeleri
Amino asitler primer amin grubu içerdikleri için aldehitlerle Schiff bazı reaksiyonu verirler. Amino asitlerdeki –NH2 grubu, -COOH grubunun indüktif etkisiyle
etkileştiğinden, aldehitlerle diğer alifatik primer aminlerden daha kolaylıkla Schiff bazı reaksiyonu verirler. Benzaldehitle olan reaksiyon örnek alınırsa,
CHO + H2N C H R COOH -H2O C H N CH R COOH
meydana gelen Schiff bazları kolaylıkla tautomerleşirler ve tautomer türünün hidrolizi sonunda benzilamin ve bir keto asit meydana gelir (Tüzün 1991).
C H N CH R COOH H2 C N C R COOH H2O H2 C NH2 + O C R COOH
Benzilamin Keto asit
1.3. Ferrosen ve Ferrosen Grubu İçeren Schiff Bazları
1.3.1. Ferrosenin Yapısı Sentezi ve Bazı Reaksiyonları
Ferrosen sandviç bileşiklerin yani metallosenlerin ilk örneğidir. İlk sandviç bileşiği olan ferrosenin keşfinden sonra C5H5 halkaları arasına çeşitli metal atomlarının
geçtiği sandviç bileşikleri ile farklı organik liganların kullanıldığı çok çeşitli bileşikler sentezlenmiştir. Bütün metalosenler arasında en kararlı olan bileşiktir. Ferrosen dışındaki metalosenler paramagnetiktir ferrosen ise diyamagnetik olmasına karşın renklidir.
1951’de siklopentadienil bromürden yola çıkarak fulvalen sentezlemeye çalışan Kearly ve Pauson, bu amaçla susuz dietil eter ortamında FeCl3 tuzuyla C5H5MgBr
Grignard reaktifini tepkimeye sokmuşlardır. Bu tepkimede fulvalen yerine formülü (C5H5)2Fe olan turuncu renkli bir katı elde edilmiştir. Ayrıca Grignard reaktifleri ile
organoçinko ve organokadmiyum reaktifleri gibi metel alkil sigma bağları içeren diğer rektifler, organik kimyada sentezleme yöntemlerinin gelişmesinde çok önemli rol oynamışlardır (Shriver et al, 1990).
Fulvalen
siklo-C5H5MgBr + FeCl3 (C5H5)Fe
Oluşan ürün beklenmeyecek şekilde kararlıdır, havada bozunmadan süblimleşebilir. Diels-Alder tepkimesi ve katalitik hidrojenlenmeye karşı dayanıklıdır.1956’da X-ışınları kırınım yöntemi, molekülde birbirine paralel C5H5
halkaları arasında bir demir atomu bulunduğunu ve yapının sandviçe benzediğini göstermiştir. Fakat yapının ayrıntıları çelişkilidir.
Bu konuda yapılan ilk çalışma, halkaların çapraz bir şekilde (D5d) olduğunu
belirtirken, gaz fazındaki elektron kırınım çalışmaları ferrosendeki halkaların çakışık (D5h) veya çakışığa çok yakın bir biçimde olduğunu ifade eder. Yakın zamanda yapılan
X-ışınları kırınım çalışmaları, katı ferrosenil çeşitli kristal fazlarda tespit edebilmiştir. Ferrosen 98 K’de çakışık biçimdedir. Yüksek sıcaklıklarda halkalar hafifçe dönmekte ve çarpık bir biçim (D5) almaktadır.
Şekil 1.11. Ferrosenin konformasyonları
Ferrosende halkalar birbirine paralel ve metal atomu aralarında olacak şekilde sandviç biçiminde düzenlenmiştir. Buradaki incelemede ferrosenin çakışık D5h biçimi
de benzer molekül orbitalleri elde edilir. Ferrosendeki bağlanmanın açıklanması genellikle molekülün en kararlı biçimi olduğuna inanılan D5d simetrisine dayandırılır.
Ferrosendeki elektron sayımı iki yolla yapılabilir; ilk yönteme göre ferrosen, iki tane 6-elektronlu siklopentadienil (C5H5-) iyonu içeren bir demir(II) kompleksidir.
İkinci yönteme göre ise iki nötral 5-elektronlu C5H5 ligandı içeren bir demir(0)
kompleksidir. Ferrosendeki gerçek bağlanma oldukça karmaşıktır ve çeşitli metal ligand etkileşimlerinin analizi gereklidir. Fe atomu orbitalleri ile iki C5H5 halkasının orbitalleri
ancak uygun simetrili ise etkileşir. Ayrıca orbitallerin enerji düzeyi birbirine ne kadar yakın ise etkileşimi o kadar kuvvetli olur (Shriver et al, 1990).
Bir çift C5H5 halkasının grup orbitalleri oluşturmak için, aynı enerjiye yani aynı
sayıda düğüme sahip molekül orbitalleri eşleştirilir. Örneğin, bir halkanın sıfır-düğümlü orbitali diğer sıfır düğümlü orbitali eşleştirilir. Bu işlem sırasında düğüm düzlemleri birbirine uyan molekül orbitalleri eşleştirilmelidir.
Ayrıca her bir eşleşmede halkadaki orbitallerin olası iki yönelimi vardır; Birbirine doğru yönelmiş aynı işaretli orbital lobları ile birbirine doğru yönelmiş zıt işaretli orbital lobları. Örneğin, C5H5 halkasının sıfır-düğümlü orbitalleri Şekil 1.12’de
gösterilebildiği gibi iki şekilde eşleştirilebilir.
Şekil 1.12. Birbirlerine doğru yönelmiş aynı ve zıt işaretli orbital lobları
Ferrosenin molekül orbital diyagramını oluşturmak için grup orbitalleri ile arasındaki etkileşim görülmektedir. Bu grup orbitali Şekil 1.13’te gösterilen düğümlü grup orbitallerinden biridir. Bu etkileşim sonun da bir bağ ve bir karşı bağ molekül orbitalleri meydana gelir.
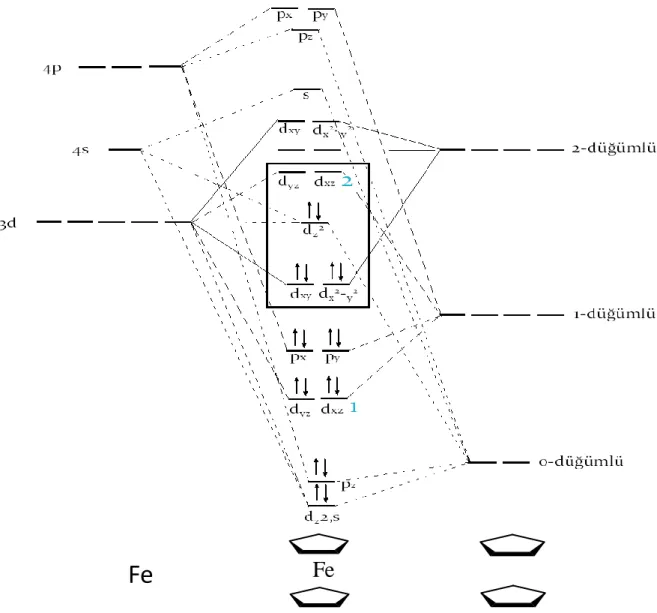
Ferrosenin molekül orbital diyagramını oluşturmak için, grup orbitalleri ile Fe üzerindeki uygun simetrili s, p ve d orbitalleri eşleştirilmelidir. Ferrosen molekül orbital diyagramı Şekil 1.14’deki gibidir.
Şekil 1.14. Ferrosenin molekül orbital enerji düzeyleri
Şekil 1.14’da 1 ile gösterilen kısımda metalin dyz orbitalinin etkileşmesi ile
oluşan bağ orbitalinin etkileşmesi ile oluşan bağ orbitali belirtilmiştir ve bir elektron çifti içerir; 2 ile gösterilen kısımda ise karşı bağ orbitali belirtilmiştir.
Ferrosen orbitallerinin en ilginç yanı, büyük oranda d orbitali karakterine sahip olmalarıdır. Şekilde çerçeve içinde gösterilmiş olan HOMO ve LUMO orbitalleri de d orbitali karakterine sahiptir. Büyük oranda dxy ve dx2-y2 karakterine sahip olan bu
molekül orbitalleri, zayıf bağ orbitalleridir ve doludur. Bir sonraki orbital büyük oranda dz2 karakterine sahiptir, aslında bağ yapmayan orbitaldir ve doludur. Bundan sonraki iki
orbital, başlıca dxz ve dyz karakterine sahiptir ve boştur.
Fe
Fe
Ferrosenin bağlanması söyle özetlenebilir. η5-C5H5 ligandlarının dolu orbitalleri,
demir ile etkileşerek kararlı hale gelmişlerdir. Metal ile bağ etkileşmesi yapan, sıfır-düğümlü ve bir-sıfır-düğümlü grup orbitallerinin enerjilerindeki düşmeye özellikle dikkat edilmelidir. Oluşan molekül orbitalleri ağırlıklı olarak ligand karakterlidir.
Sonraki en yüksek enerjili orbitaller, büyük oranda demirin d orbitallerinden türemiştir; d6 demir (II) iyonunda bu orbitaller 6 elektron tarafından doldurulur; bu
molekül orbitalleri dz2’den oluşmuş molekül orbitali hariç daha az ligand karakterine
sahiptir. dz2 şeklinde işaretlenmiş molekül orbitali hemen hemen hiç ligand karakteri
içermez; çünkü koni şeklindeki düğüm yüzeyine sahip bu orbital, doğrudan grup orbitallerinin loblarına doğru yönelir; bu nedenle çok zayıf örtüşme meydana gelir; aslında demir üzerine yayılmış bağ yapmayan molekül orbitalini oluşturur. Ferrosenin molekül orbital gösterimi 18 elektron kuralına uyar.
Ferrosen genel olarak Fe(II) klorür ile siklopentadienilin reaksiyonu ile elde edilir. Ferrosenin eldesine örnek yollardan biri, sodyum metali ile hidrokarbonun deprotonlanmasını içerir. Oluşan sodyum tuzu daha sonra Fe(II) ile reaksiyona girer.
Başka bir yol KOH veya NaOH gibi güçlü bir baz ve siklopentadienil karışımının Fe(II) ile reaksiyona sokulmasıdır. Reaksiyona ilişkin eşitlikler aşağıda verilmiştir.
(C5H5)2Fe sentezine ilişkin diğer bir yöntem C5H5MgBr Grignard reaktifini
kullanmak ve Fe(II) iyonu ile bunu reaksiyona sokmaktır.
Metal tuzu ve siklopentadienil karışımı üzerine bir baz eklenmesi ile (C5H5)2Fe
sentezlenebilmektedir.
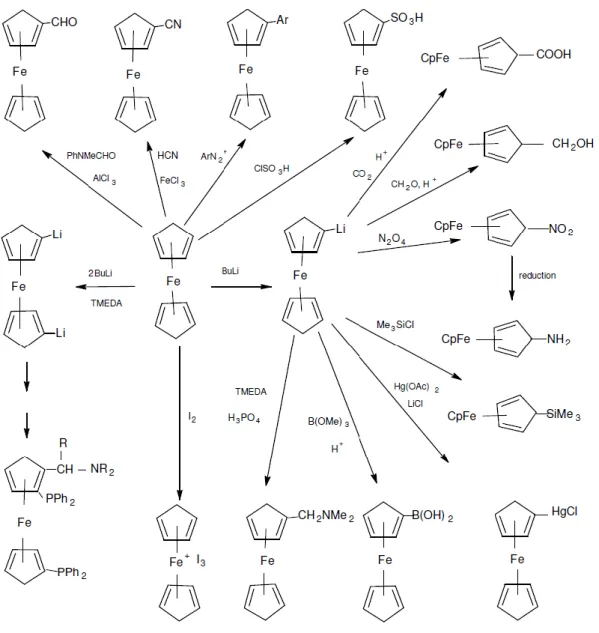
Ferrosen çok çeşitli tepkimeler verir. Bazıları siklopentadienil halkası üzerinde gerçekleşir. Ferrosenin verdiği tepkimelerden bazıları Şekil 1.15’de verilmiştir.
C5H6 +
2KOH + KC5H5 KOH.H2O
C5H6 + Na THF C5H5Na + ½ H2 THF
Şekil 1.15. Ferrosenin yer aldığı bazı tepkimeler
1.3.2. Ferrosen Grubu İçeren Schiff Bazları
Son yıllarda ferrosen içeren şelat ligandları ve bunların metal iyonları ile kompleks oluşumları üzerine araştırmalar yapılmış manyetik ferrosenyum radikalleri ve paramanyetik metal iyonları arasındaki etkileşimler araştırılmıştır.
Ferrosen içeren ligandlar kataliz, moleküler tanıma ve algılama gibi bu tür çeşitli uygulamalarda kullanıldığından koordinasyon kimyasında oldukça ilgi çekicidir. Bu uygulamaların çoğunda, çok dişli ligandlar, meydana gelen metal komplekslerin üzerinde yol açtıkları yapısal ve elektronik özeliklerin değişmesinden dolayı değişik açil ferrosenlerden sağlanan Schiff baz ligandları, geniş çapta kullanılan çok dişli ligandların yararlı bir sınıfını oluştur.
Ferrosenkarboksialdehit (FcCHO) ve farklı amin türevlerinden kondenzasyon reaksiyonu ile elde edilen çok sayıda ferrosen grubu içeren Schiff bazı sentezi literatürlerde mevcuttur. Yapısı Şekil 1.16’de verilen N,N' bis(ferrosenilmetilen)etilendiamin (FcNN) Schiff bazının, sentezi ve yapı karakterizasyonu üzerine farklı gruplar tarafından çalışmalar yapılmıştır (Zhang et al 2001).
N,N'-bis(ferrosenilmetilen)etilendiamin (FcNN) Schiff bazı ferrosenkarboksialdehit ve etilendiaminin sodyum karbonat ile susuz metanol içindeki reaksiyonundan elde edilmiştir. Schiff bazı diklorometan, etanol ve metanolde çözünür, fakat bunun kompleksleri DMF ve DMSO’da çözünür ya da az çözünür (Zhang et al 2001).
Şekil 1.16. N,N'-bis(ferrosenilmetilen)etilendiamin’in yapısı
Li ve arkadaşları FcNN ligandından (L1), yapısı Şekil 1.17’de verilen ferrosen
grubu içeren, R grubunun H, Me, Cl, NO2 olarak değiştiği
[1,2-bis(ferrosen-1-ilmetilenamino)benzen (L2), 4-metil (L3), 4 kloro (L4) ve 4-nitro(L5)] Schiff bazlarını
hazırlamışlardır.
R
N N
Fe Fe
Şekil 1.17. Çift dişli diferrosenil Schiff baz türevleri (R = H(L2), Me(L3), Cl(L4), NO2(L5))
Ferrosen-1,1'-dikarbaldehit ve etan-1,2-diaminin reaksiyonundan Schiff bazı türevi 2,5,19,22-tetraaza[6,6](1,1')ferrosenofan-1,5-dien sentezlenerek kristal yapısı X-ray analizi ile belirlenmiştir. 2,3,19,22-tetraaza[6,6](1,1')ferrosenofan-1,5-dien’in
Fe C H N H2 C CH2 Fe C H N
LiAlH4 ile hidrojenasyonu ile kristalloğrafik olarak tanımlanan
2,5,19,22-tetraaza[6,6](1,1') ferrosenofan amini Tendero ve arkadaşları tarafından rapor edilmiştir (Tendero et al, 1996). CHO Fe CHO + H 2N NH2 N N N N Fe Fe LiAlH4 N H NH H N H N Fe Fe
Şekil 1.18. 2,5,19,22-tetraaza(6,6)(1,1') ferrosenofan amininin sentezi
Beer ve arkadaşları tarafından sentezlenmiş Şekil 1.19 (a)’da verilen susuz 1, 1’-Bis(5-metil-2,5 diazahekzil) ferrosen, 1,1diformil ferrosen ve N-metiletanın-1,2 diaminle metanolde geri kaynatılmasıyla oluşur. Şekil 1.19 (b)’de verilen N,N-dimetil ve 1,1’-bis(2,5-diazahekzil) ferrosen ise şekil (a)’daki Schiff bazının LiAlH4’le
indirgenmesi sonucu oluşur. (a) ve (b) komplekslerinin çözeltileri; bir gece boyunca geri kaynatılarak bunların parlak sarı renkli çözeltilerinden hazırlanır. Şekil 1.19 (a)’daki Schiff bazıyla Ni(II), Cu(II), Cd(II), Zn(II) iyonları 1:1 oranında reaksiyona sokularak tek ve çift çekirdekli kompleksler oluşur. Kompleksler tek zincirlide iki zincirlide olabilir. Şekil 1.19 (c)’de verilen 1,1’-Bis(1-amino-5,8diokza-2azadekil) ferrosen 1,1’diformilferrosenin 2-2’-etilendioksobisetilendiaminle reaksiyonundan, Şekil 1.19 (d)’de verilen 1,1’-Bis (5-morfolin-2azapentil) ferrosen, aminoformorfolin 1,1diformil ferrosenin NaBH4’le indirgenmesi ile oluşur (Vigato et al, 2004).
(a) (b)
(c) (d)
Şekil 1.19. Bis (5-metil-2,5ddiazahekzil) ferrosen (a) ve bis(2,5-diazahekzil) ferrosen (b) 1,1’-Bis (1-amino-5,8diokza-2azadekil) ferrosen (c) 1,1’-1,1’-Bis (5-morfolin-2azapentil) ferrosen (d)
Asselin ve arkadaşları tarafından uygun poliaminle formilferrosenin 2:1 molar oranındaki reaksiyonuyla Şekil 1.20’deki a’dan c’ye kadar olan birbirinden farklı Schiff bazları sentezlenir. Schiff bazları 1,3 diaminobenzenle dimetilformamid ve 1,1’-
didodesilferrosendikarbaldehitin yer değiştirme reaksiyonundan asitle ya da asitsiz olarak sentezlenir. Schiff bazları genellikle kloroform, THF gibi çoğu organik çözücülerde çözünür. Şekil 1.20’deki Schiff bazlarından a suda b’den daha çok çözünür. Bunların tetra ve hegza karbonilli molibden kompleksleri de sentezlenmiştir (Vigato et al, 2004).
a
b
c
Şekil 1.20. 1,1’-didodesilferrosendikarboaldehit türevli 1,1’-didodesilditiyoferrosenle dimetilformamidin reaksiyonu sonucu sentezlenen Schiff bazları
Fe NH N CH3 CH3 NH N CH3 CH3 Fe NH N H CH3 NH HN CH3 Fe NH O O NH2 NH O O NH2 Fe NH NH N O O N Fe N L Fe N L L L N N N N N N N N N n-C10H21
Redoks fonksiyonları gösteren Şekil 1.21’de verilen 1,4,7,10,13,16- hekza(ferrosenmetil)-1,4,7,10,13,16-hekzaazosiklooktadekan sentezlenerek elektrokimyasal ve metal ekstraksiyon özellikleri Lloris ve arkadaşları tarafından rapor edilmiştir (Lloris et al, 1998; Lloris et al, 1999; Lloris et al, 2001).
Şekil 1.21. 1,4,7,10,13,16-hekza(ferrosenmetil)-1,4,7,10,13,16 hekzaazosiklooktadekanın yapısı
Makro siklik olmayan Schiff bazlarına bir örnek de, Şekil 1.22’te verilmiştir. Bu Schiff bazı 1,1’-diformilferrosenin uygun poliamin olan 1,4 diaminometilbenzenle 1:1 molar oranında reaksiyona girmesiyle oluşur (Vigato et al, 2004).
Şekil 1.22. 1,1’-diformilfrosenin uygun aminle 1:1 molar oranında reaksiyona girmesiyle oluşan farklı bir Schiff bazı N N N N N N Fe Fe Fe Fe Fe Fe Fe N N Fe N N Fe O O NH2 NH2