T.C
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
ĐSKĐLĐP (ÇORUM) YÖRESĐNDEKĐ SÜT SIĞIRLARINDA BOVINE HERPESVĐRUS TĐP 1 (BHV)’ ĐN PREVALANSI
Uzeyir Taha ĐŞCAN
YÜKSEK LĐSANS TEZĐ
BĐYOLOJĐ ANABĐLĐM DALI
ÖZET Yüksek Lisans Tezi
ĐSKĐLĐP (ÇORUM) YÖRESĐNDEKĐ SÜT SIĞIRLARINDA BOVINE HERPESVIRUS TĐP 1 (BHV-1)’ĐN PREVALANSI
Uzeyir Taha ĐŞCAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
Danışman : Yrd. Doç. Dr. Rüstem DUMAN 2010, 42 Sayfa
Jüri : Yrd. Doç. Dr. Rüstem DUMAN Doç. Dr. Orhan YAPICI
Doç. Dr. Hasan Hüseyin DOĞAN
Bu çalışmada, Türkiye’nin Orta Karadeniz Bölgesi’nde yer alan Çorum iline bağlı Đskilip ilçesindeki solunum sistemi semptomu gösteren süt sığırlarında Infectious Bovine Rhinotracheitis (IBR)’e neden olan Bovine Herpesvirus Tip 1 (BHV-1)’in prevalansı araştırıldı. Bu amaçla, küçük aile işletmelerinde bulunan, aşılanmamış, 1 yaş ve üzeri 5200 hayvan tarandı ve solunum sistemi hastalık semptomu gösteren, vücut ısısı normalin üstünde olan 250 hayvandan nazal svap ve kan örnekleri alındı. Toplam 250 adet nazal svap örneği ve aynı sığırlardan alınan kan örnekleri, ticari olarak temin edilen Enzyme Linked Immunosorbent Assay (ELISA) kitleriyle, sırasıyla, BHV-1’e karşı antijen ve antikorların varlığı yönünden test edildi.
Örneklenen sığırlarda BHV-1 antijenlerinin prevalansı, %0.8 (2/250) olarak tespit edildi. Araştırmanın serolojik kısmında, örneklenen aynı hayvanlarda BHV-1 spesifik antikorların seroprevalansı %21.2 (53/250) olarak tespit edildi. Sonuç olarak Đskilip yöresinde bulunan aile işletmelerindeki sığırlarda BHV-1 enfeksiyonunun varlığı/yaygınlığı belirlendi ve enfeksiyonun kontrolü amacıyla ciddi önlemlerin alınması gerektiği kanaatine varıldı.
ABSTRACT Master Thesis
PREVALENCE OF BOVINE HERPESVĐRUS-1 IN DAIRY CATTLE IN ĐSKĐLĐP (ÇORUM) REGION
Uzeyir Taha ĐŞCAN
Selçuk University
Institute of Natural and Applied Sciences Department of Biology
Supervisor : Assist. Prof. Dr. Rüstem DUMAN 2010, 42 Page
Jury : Assist. Prof. Dr. Rüstem DUMAN Assoc. Prof. Dr. Orhan YAPICI
Assoc. Prof. Dr. Hasan Hüseyin DOĞAN
In this study, it has been researched that prevalence of BHV-1 which causes IBR in dairy cattle with respiratory system disorders in Iskilip ( Çorum in the black sea region of Turkey).
Swap and blood samples collected from 250 cattle with high body temperature, has respratory system disorders and unvaccinated. For this purpose 5200 cattle older than one year from dairy farms possesses of public were investigated before samples collected. Commerces ELISA kits were used for detecting BHV-1 antijens and antibodies against to BHV-1.
While BHV-1 antijen prevalance was detecting as 0.8 % (2/150), it was detected BHV-1 seroprevalence as 21.2 % (53/250). In conclucion, BHV-1 infection was determined in Iskilip region and it was thought that needs some prevention programmes of BHV-1 infectious.
ÖNSÖZ
Bana bu konuda çalışma olanağı veren Danışman Hocam Sayın Yrd. Doç. Dr. Rüstem DUMAN’a, çalışmamın tüm aşamalarında yardım ve desteklerini gördüğüm aynı zamanda Selçuk Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı’nın tüm olanaklarından faydalanmamı sağlayan Sayın Hocam Prof. Dr. Sibel YAVRU’ya, çalışmam süresince bana yardımcı olan Selçuk Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı’ndaki Araştırma Görevlisi ve Doktora Tezi yapan arkadaşlarıma, bu araştırmayı proje olarak kabul eden ve maddi açıdan destekleyen Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü’ne ve tez çalışmam boyunca benden sabrını ve desteğini esirgemeyen aileme teşekkürü bir borç bilirim.
Đ
ÇĐNDEKĐLER
ÖZET... iii ABSTRACT... iv ÖNSÖZ ... v ĐÇĐNDEKĐLER ... vi SĐMGELER... viii 1. GĐRĐŞ ... 1 2. KAYNAK ARAŞTIRMASI ... 4 2.1. Etiyoloji ... 4 2.2. Epidemiyoloji ... 5 2.3. Patogenez ve Patoloji ... 6 2.4. Klinik Belirtiler ... 6 2.5. Teşhis ... 8 2.5.1. Direkt teşhis... 8 2.5.2. Đndirekt teşhis ... 9 2.6. Đmmunite ... 10 2.7. Korunma ve Kontrol ... 112.8. Dünya’da ve Türkiye’de Sığırlarda BHV-1 Enfeksiyonu... 12
3. MATERYAL VE METOT ... 17
3.1. Materyal ... 17
3.1.1. Sığırlar... 17
3.1.2. Nazal svap örnekleri... 18
3.1.3. Serolojik araştırmada kullanılan serum örnekleri ... 18
3.2. Metot ... 18
3.2.1. BHV-1 antijenlerinin tespiti için ELISA... 18
3.2.1.1. Kit bileşenleri ... 19
3.2.1.2. Testin prensibi... 20
3.2.1.3. Prosedür ... 21
3.2.2. BHV-1’e özgü antikorların tespiti için ELISA ... 22
3.2.2.1. Kit bileşenleri ... 22
3.2.2.2. Testin prensibi... 23
3.2.2.3. Prosedür ... 24
3.2.2.4. Testin geçerlilik kriterleri... 27
3.2.2.5. Sonuçların değerlendirilmesi ... 27
4. ARAŞTIRMA SONUÇLARI VE TARTIŞMA ... 28
5. SONUÇ VE ÖNERĐLER ... 33
SĐMGELER
Kısaltmalar
BAV : Bovine Adenovirus- Sığır Adenovirus. BHV-1 : Bovine Herpes Virus Tip 1.
BRSV : Bovine Respiratory Syncytial Virus. BT : Bluetongue – Mavidil
BVDV : Bovine Viral Diarrhea Virus. DNA : Deoksiribonükleik asit. EBL : Enzootic Bovine Leucosis
ELISA : Enzyme Linked Immunosorbent Assay. FAT : Floresan Antikor Testi.
IBR : Infectious Bovine Rhinotracheitis.
IBR/IPV : Infectious Bovine Rhinotracheitis/ Infectious Pustular Vulvovaginitis. IPB : Infectious Pustular Balanoposthitis
IPV : Infectious Pustular Vulvovaginitis. mNT : Mikronötralizasyon Testi.
nm : Nanometre.
OIE : Office International Des Épizooties
PCR : Polimerase Chain Reaction – Polimeraz Zincir Reaksiyonu. PHT : Pasif Hemaglütinasyon Test
PIV-3 : Parainfluenza Virus-3. RSV : Respiratory Syncytial Virus SN : Serum Nötralizasyon. SNT : Serum Nötralizasyon Testi. VN : Virus Nötralizasyon
VNT : Virus Nötralizasyon Testi
1.
GĐRĐŞ
BHV-1 enfeksiyonu ya da Infectious Bovine Rhinotracheitis (IBR), evcil ve yabani sığırların akut, bulaşıcı, ateşli bir viral hastalığıdır. Hastalık ilk olarak 1950’li yıllarda Amerika Birleşik Devletleri’ nde teşhis edilmiş (Merchant ve Packer 1971) ve o zamandan bu yana da dünyanın pek çok ülkesinde tespit edilmiştir. IBR, solunum güçlüğü, depresyon, burun akıntısı ve kondisyon kaybının eşliğinde üst solunum yolunun şiddetli inflamasyonu ile karakterize edilen, ekonomik önemi olan bir hastalıktır. BHV-1, akut gastroenteritis, konjunktivititis, ensefalitis, abort ve mastitise de neden olabilmektedir (Kahrs ve Smith 1965, Fenner ve ark. 1993). Virus, genital sistemi de enfekte edebilmekte ve dişilerde pustular vulvovaginitise, erkeklerde balanopostitise neden olabilmektedir. Morbidite son derece yüksek iken (% 80’ den fazla), mortalite düşüktür (% 10), fakat Bovine Viral Diarrhea (BVD) ile Pasteurella sp. gibi koenfeksiyon veya sekonder enfeksiyonlar meydana geldiğinde ölüm oranı yüksektir (Leary ve Splitter 1992).
BHV-1 solunum sistemi enfeksiyonlarının teşhisi, nazal sekresyonlardan veya ölüm sonrası toplanan akciğer veya trakea dokularından virusun izolasyonunu gerektirmektedir (Kahrs 1977). BHV-1 bir sürüde enfeksiyon çıkmasına katkıda bulunduğu zaman, semptomların teşhis edilmesiyle, numunelerin laboratuarda toplanması ve nakledilmesiyle ve virus izolasyonunun yapılmasıyla ilişkili süre, 5– 15 güne ulaşabilmektedir. BHV-1 salgınları esnasında tedaviyi ve önleyici kontrol önlemlerini başlatma ihtiyacı ilk başlarda hissedilir, oysa ki teşhis ekseriya bu kritik zamandan sonra yapılmaktadır. Bu nedenle BHV-1 enfeksiyonunun: (i) pnömoni gelişimine iştirak eden şartların hızlı kanıtlanması; (ii) bir salgın esnasında uygun önleyici önlemleri alma ihtiyacı; (iii) sığırların bir arada tutulma işlemleri esnasında yaygın BHV-1 ortaya çıkması göz önünde bulundurularak daha çabuk teşhisinin yapılması lüzumuna dikkat çekilmektedir (Collins ve ark. 1985). Viral enfeksiyonların direkt teşhisine yönelik birçok hızlı yöntem geliştirilmiştir. Bunlar, mukozal kazıntılardan elde edilen hücrelerin (Corey ve ark. 1982, Edwards ve ark. 1983, Schmidt ve ark. 1983) veya viral izolasyon amacıyla inokule edilmiş olan doku kültürlerinin (Miller ve Howell 1983, Nerurkar ve ark. 1983) floresan antikor veya
immunoperoksidaz boyama yöntemi ile incelenmesini ve lezyonlar veya vücut sıvılarından toplanan materyallerde uygulanan enzyme-linked immunosorbent assay (ELISA)’i (Beards ve Bryden 1981, Edwards ve ark. 1983, Herrmann ve ark. 1979, Morgan ve Smith 1984, Vestergaard ve Jensen 1981, Yolken 1982) içine almaktadır. ELISA’nın numunelerin virusun en yüksek oranda saçıldığı hastalık seyrinin başlangıcında toplanması şartıyla, az zaman ve ekipman gerektirdiği, sonuçların birkaç saatte elde edildiği ve bazı durumlarda testin sensitivitesinin virus izolasyonununkine yaklaştığı için, özellikle hızlı teşhiste faydalı olduğu bildirilmiştir (Land ve ark. 1984, Vestergaard ve Jensen 1981). BHV-1’e özgü antikorların tespit edilmesinde virus nötralizasyon testi (VNT) ve ELISA yaygın olarak kullanılmaktadır. Bu testlerin her birinin BHV-1 enfeksiyonunun teşhisinde bir rolü vardır. Bir testin ya da başka bir testin seçimi, büyük ölçüde test amacına bağlıdır. VNT ekseriya semen ve embriyo vericilerinin belgelendirilmesi için mevzuata yönelik amaçlar yönünden istenmektedir. Đndirekt ELISA, sonuç elde etmede daha kısa zamana ihtiyaç göstermesi ve çok sayıda örneğin taranmasında uygunluğu yüzünden son yıllarda VNT’ne göre daha çok kullanılmaktadır (http://www.scahls.org.au/data/assets/pdf_file/0003/1280874/ibr.-pdf).
Karadeniz Bölgesi’nin Orta Karadeniz bölümü ile Anadolu’yu bağlayan geçit bölgede kurulmuş bir ilimiz olan Çorum, 39°51’ ve 41°20’ kuzey enlemleri ile 34°04’ ve 35°28’ doğu boylamları arasında yer almaktadır. Çorum’un birisi merkez olmak üzere 14 ilçesi vardır. Bunlar; Çorum (merkez), Bayat, Dodurga, Đskilip, Osmancık, Kargı, Sungurlu, Ortaköy, Oğuzlar, Uğurludağ, Laçin, Mecitözü, Alaca ve Boğazkale’dir. Araştırmanın yapıldığı Đskilip ilçesi, Çorum’a 55 km uzaklıkta olup, Çorum-Kastamonu arasında uzanmaktadır. Yüzölçümü 1.187 km2, deniz seviyesinden yüksekliği 720 m’dir. Đskilip ilçesinin ekonomisi tarım ve ticarete dayanmaktadır. Đklim olarak ılıman karasal iklime sahiptir. Genel olarak yazları sıcak ve kurak, kışları bol yağışlıdır. Đskilip’in ekonomik yapısında, hayvancılık önemli bir yer işgal eder. Tarımla uğraşan her ailede hayvancılık da yapılır. Đlçede büyükbaş hayvan sayısı 23.061, küçükbaş hayvan sayısı 7.419’dur (http://tr.wikipedia.org/wiki/%C4%B0skilip,_%C3%87orum).
gözyaşı akıntısı, durgunluk tablosu, vs.) sahip olduğu belirlenen, 250 adet hasta sığırdan alınan nazal swab ve kan serumu örneklerinde BHV-1 varlığının ticari olarak temin edilen ELISA kitleri ile virolojik ve serolojik olarak ortaya konularak bölgede BHV-1’in prevalansının belirlenmesi amacıyla yapılmıştır.
2. KAYNAK ARAŞTIRMASI
2.1. Etiyoloji
Virusun saha şartlarında varlığını devam ettirmesinde ortamdaki nemin büyük önemi vardır, Elazhary ve Derbyshire’ın (1979) bildirdiğine göre optimal şartlar % 90 nem ve düşük ısıdır. Virus pH 6 ile 9 arasında stabil kalır. Bu aralık bulaşmanın gelişiminde çok önemlidir, çünkü solunum sistemi mukozasının pH’sı 7’nin biraz altında, erkek genital kanalında 8’in üstünde ve dişi genital kanalında biraz daha değişkendir (Griffin ve ark. 1958).
IBR çevre şartlarında kışın 30 gün, binalar içinde 6–13 gün, bahar aylarında dış ortamda 5–9 gün, 37°C’de 10 gün, −20°C’de bir yıl kadar, −65°C’de çok uzun süre enfeksiyözitesini koruyabilmektedir (Hahnefeld ve ark. 1963, Straub 1970).
Virus 63°C’nin üstünde dakikalar içinde inaktive olur. IBR zarflı bir virus olduğundan eter ve kloroform gibi yağ eriticiler ve deterjanlarla muamele edildiğinde enfeksiyözitesini kaybeder. Etken % 0.5 NaOH, % 0.01 HgCl2, % 1 CaCl2 ve % 1 fenol solüsyonlarında saniyeler içinde inaktive olur (Straub ve ark. 1990).
Restriksiyon enzim analiziyle BHV-1’in iki alt tipi tanımlanmıştır. BHV-1 alt tip 1 infectious bovine rhinotracheitis (IBR) olarak isimlendirilen solunum hastalığına sebep olan suşları temsil ederken, alt tip 2 genital hastalıklara, örneğin, infectious pustular vulvovaginitis (IPV) ve infectious balanoposthitis (IBP)’e sebep olan şuşları içermektedir (Engels ve ark. 1981, Radostits ve ark. 2000).
Metzler ve ark. (1985), ayrıca alttip 2’yi 2a ve 2b şeklinde klasifiye etmek için DNA restriksiyon enzim analizini kullanmışlardır.
BHV-1 virionları zarflı ve yaklaşık 150 nm çapında olup, ikozahedral simetriye sahiptirler. Kapsid 150 hekzamer ve 12 pentamerden oluşan 162 kapsomerden meydana gelir. Kapsid, tegument adı verilen globuler bir materyal ile çevrilmiştir ve bu yapı üzerinde birçok küçük glikoprotein peplomer olan lipoprotein zar bulunmaktadır. Genom tek linear molekül halinde çift iplikçikli DNA’dan oluşmuştur (Straub ve ark. 1990).
Alttipler 1 ve 2a aborte fetüslerden izole edilmiştir, oysa ki daha az virulent olan alttip 2b’nin abort ile ilişkili olduğu bildirilmemiştir (Edwards ve ark. 1991, Miller ve ark. 1991).
Klasik serolojik testlere göre BHV-1’in sadece bir antijenik serotipi vardır. BHV-1 ile enfeksiyonun yabani ruminantlarda ve domuzlarda da ortaya çıktığı bildirilmiştir (Varady ve ark. 1994, Radostits ve ark. 2000).
Bovine herpesvirus tip 1 (BHV-1) Herpesviridae familyası, Alphaherpesvirinae subfamilyasının bir üyesi olup, sığırların önemli bir patojenidir (Ackermann ve Engels 2006).
2.2. Epidemiyoloji
Enfeksiyon, solunum ve genital yollar vasıtasıyla meydana gelir. Virus daha çok direkt ve indirekt temas (fomitler) ve aerosol damlacıklar gibi horizontal bulaşma aracılığıyla ya da çiftleşme vasıtasıyla enfekte boğalardan ve suni veya doğal tohumlama aracılığıyla enfekte semenlerle sürü içerisinde ve arasında yayılmaktadır. Diğer herpesviruslarda olduğu gibi BHV-1 ile enfeksiyon, ömür boyu latent enfeksiyona yol açmaktadır. Bu, klinik bulguların yokluğunda ve saptanabilir serum antikorunun yokluğunda meydana gelebilmektedir. Kortikosteroid tedavi enfeksiyonun nüksetmesine ve virus salınımına sebep olabilmektedir. Doğal çıkarım stresi takiben meydana gelebilmektedir, ancak latens ve aktivasyon mekanizması henüz yeterince aydınlatılamamıştır. BHV-1 izolat alt tiple ilişkisiz bir biçimde virulans bakımından farklıdırlar. Kapalı bir sürüye ya da yurtdışından ithal edilen hayvanların içerisine yeni hayvanlar konulduğu zaman, antikor taşıyan bu hayvanlar kabul edilmemelidirler, çünkü bu hayvanlar latent enfeksiyona sahiptirler. Seronegatif hayvanlar antikor yönünden tekrar tekrar kontrol edilmeli, tercihen kortikosteroid ile işleme tabi tutulmalı ve damızlık hayvanın girişine izin vermeden önce virus çıkarımı yönünden örneklenmelidir (http://www.scahls.org.au/data/assets/ pdf file/0003/1280874/ibr.-pdf).
2.3. Patogenez ve Patoloji
BHV-1 replikasyonu üst solunum sisteminin ve genital mukozanın mukozal epitelyal yüzeylerinde gerçekleşir ve virus nazal ve genital sekresyonlarla saçılır. Semen, ejakülasyon esnasında kontamine olabilmektedir. Lokal sinir hücresi uçları enfekte olur ve virus ömür boyu latent enfeksiyonun tesis edildiği trigeminal ve sakral ganglionlara nakledilir. Hayvanlar bir kez enfekte oldu mu, ömür boyu virus taşıyıcısı olurlar. Latent enfeksiyon, klinik belirtilerle birlikte veya klinik belirtiler olmaksızın, peryodik olarak tekrar aktif hale geçebilir; virus giriş yerine geri taşınır ve potansiyel bulaşmayla başka hayvanlara yayılır. Seropozitif hayvanların hepsi değilse bile büyük bir kısmı latent olarak enfektedirler ve virus saçılımı, stres veya kortikosteroid işlemi takiben tekrar aktif hale geçebilmektedir. Viremi oluşmakla birlikte nadiren tespit edilir. Komplike olmayan BHV-1 enfeksiyonu ile ilişkili makroskopik değişiklikler genellikle üst solunum sisteminin (larinks ve trakea dahil) ve cinsel organların epitelyumunun yüzeysel ülserasyonu ve püstülar formasyonundan oluşmaktadır. Bazı olgularda larinks ve trakea epitelyumunun şiddetli nekrotik ülserasyonu olabilmektedir. Pnömoni oluştuğunda, değişiklikler patognomik değildirler ve virus ile sekonder bakteriyel enfeksiyonların etkilerinin kombinasyonundan ileri gelmektedirler. Komplike olmayan solunumla ilgili olgularda meydana gelen histolojik değişiklikler, akut kataral inflamasyonla olan değişikliklerdir. Larinks ve epiglot mukozasında nekrotik odaklarla birlikte epitelyum yıkımı vardır. Bronkopnömonik lezyonlar, bakteriyel komplikasyondan kaynaklanabilmektedir. Đntranükleer inklüzyonlar, enfeksiyonun ilk safhaları esnasında solunum sistemi epitel hücrelerinde bulunabilmektedir (http://www.scahls. org.au/data/assets/pdf_file/0003/1280874/ibr.-pdf).
2.4. Klinik Belirtiler
BHV-1 enfeksiyonu aşağıdaki şekillerde solunum ya da üreme sistemlerini etkileyen akut, bulaşıcı bir hastalığa neden olur:
Solunum yolu enfeksiyonu: Hastalığın solunum formu en çok intansif koşullarda (örneğin, besi üniteleri) yetiştirilen sığırlarda gözlenmekte ve çoğu kez
sığırlarda otlatma koşullarında fark edilmemektedir. Sığırların BHV-1 enfeksiyonunun klinik belirtileri ve patolojik değişiklikleri karakteristik değildir ve kolaylıkla diğer birçok patojenlerce meydana getirilen hastalıklarla karıştırılabilmektedir. Bu yüzden laboratuvar teyidi gereklidir. Đnkübasyon periyodu 2-7 gün arasında değişmektedir. Eğer vakalar komplike değilse, hastalık sadece hafif seröz burun akıntısı ve vücut sıcaklığında 1-2 gün süresince az bir artışla birlikte çok hafif olabilmektedir. Pek çok vaka fark edilmez. Daha ağır vakalarda, birkaç gün süreyle devam edebilen, 40-42°C’a ulaşan yüksek ateş vardır. Hastalıktan etkilenen hayvanlar artan solunum hızı ile birlikte depresedirler ve süt üretiminde azalma görülür. Başlangıçtaki seröz burun akıntısı ekseriya birkaç gün içerisinde mukopurulent bir özellik kazanır. Burun deliklerinin mukozaları kızarır ve yüzeysel erozyonlar bulunabilir. Bazı hayvanlarda aşırı salivasyon görülür. Seyrek olan oral lezyonlar, oral mukozanın yüzeysel erozyonlarından ibarettir. Bazı hayvanlarda tek taraflı veya çift taraflı konjonktivit gelişir ve daha sonra mukopurulent olabilen berrak bir oküler akıntıları vardır. Besi ünitelerinde veya intansif yetiştirilen sığırlarda sekonder bakteriyel enfeksiyonlarla komplike olan şiddetli necroze laryngotracheitis ve pnömoni olabilmektedir. Bu enfeksiyonlara genellikle besi ünitesine konulan hayvanların ilk 3-4 haftası dahilinde rastlanır. Bazen besi ünitesine alındıktan daha sonraki zamanlarda BHV-1 enfeksiyonu yüzünden şiddetli
pnömoni içeren salgınlar olabilmektedir
(http://www.scahls.org.au/data/assets/pdf_file/0003/1280874/ibr.-pdf).
Genital enfeksiyon: BHV-1 ile genital enfeksiyon her iki cinsiyette de meydana gelir ve bu herpesvirus enfeksiyonunun otlaktaki sığırlarda daha sık rastlanan bir belirtisidir. Enfeksiyon vulva ve vajinanın mukozasında veya penis ve prepüste veziküllerin, püstüllerin ve erozyonların ya da ülserlerin gelişimiyle sonuçlanabilmektedir (Snowdon 1964, Studdert 1989). Infectious pustular vulvovaginitis (IPV) olarak bilinen ağrılı durum, çiftleşmenin birkaç günü dahilinde gözlenebilmektedir. Sık işeme ve kuyruğun yukarı kalkması ilk klinik belirtilerdir. Vulvanın ve vajinanın posterior üçte birinde hiperemi veya ödem olabilmektedir. Püstüller şeklinde (0.5–3 mm çapında) küçük kırmızı‒beyaz ülserler meydana gelir. Özellikle sekonder bakteriyel enfeksiyonla komplike vakalarda, koyu sarı veya beyaz mukopurulent eksudat olabilmektedir (Snowdon 1964, Studdert 1989). Boğalardaki
hastalık infectious pustular balanoposthitis (IPB) olarak bilinmektedir. 2–3 günlük bir inkübasyon peryodundan sonra, penis ve prepüsün mukozal yüzeylerinde püstüller ortaya çıkar (Bitsch 1973). Bu püstüller mukopurulent bir akıntı ile birlikte ülserlere dönüşebilir ve boğanın görev yapmasını önleyebilirler. Enfekte boğaların bir kısmı da semenlerinde virus taşıyabilirler. O halde, Enfekte semen doğal veya suni tohumlama yoluyla duyarlı dişileri enfekte edebilir (http://www.scahls.org.au/data/ -assets/pdf_file/0003/1280874/ibr.-pdf).
Konjonktivit: BHV-1 enfeksiyonunun ‘epidemik konjunktivit’i andıran konjunktival formu oldukça seyrek görülür. Ara sıra korneaya yayılabilmekte ve panoftalmit olabilmektedir (http://www.scahls.org.au/data/assets/pdf_file/0003/1280-874/ibr.-pdf).
2.5. Teşhis
BHV-1 enfeksiyonu genellikle virusa karşı konakçı yanıtının saptanmasıyla (örneğin, serumdaki antikorlar) ya da etkenin direkt tespiti ile teşhis edilmektedir (http://www.scahls.org.ua/data/assets/pdf_file/0003/1280874/ibr.-pdf).
2.5.1. Direkt teşhis
BHV-1 solunum sistemi enfeksiyonlarının direkt teşhisi, nazal sekresyonlardan veya ölüm sonrası toplanan akciğer veya trakea dokularından virusun izolasyonunu gerektirmektedir (Kahrs 1977).
ELISA az zaman ve ekipman gerektirdiği, sonuçlar birkaç saatte elde edildiği ve bazı durumlarda testin sensitivitesi virus izolasyonununkine yaklaştığı için, özellikle hızlı teşhiste faydalı olmuştur (Vestergaard ve Jensen 1981, Land ve ark. 1984).
Viral enfeksiyonların hızlı tanısı amacıyla birçok yöntem geliştirilmiştir. Bunlar; mukozal kazıntılardan elde edilen hücrelerin (Corey ve ark. 1982, Edwards ve ark. 1983, Schmidt ve ark. 1983) veya viral izolasyon amacıyla inokule edilmiş olan doku kültürlerinin (Miller ve Howell 1983, Nerurkar ve ark. 1983) floresan
antikor veya immunoperoksidaz boyama yöntemi ile incelenmesini ve lezyonlar veya vücut sıvılarından toplanan materyallerde uygulanan enzyme-linked immunosorbent assay (ELISA)’i (Herrmann ve ark. 1979, Beards ve Bryden 1981, Vestergaard ve Jensen 1981, Yolken 1982, Edwards ve ark. 1983, Morgan ve Smith 1984) içine almaktadır.
BHV-1 bir sürüde enfeksiyonun çıkmasına katkıda bulunduğu zaman, semptomların teşhis edilmesiyle, numunelerin laboratuvarda toplanması ve nakledilmesiyle ve virus izolasyonunun yapılmasıyla ilişkili süre 5 – 15 güne ulaşabilmektedir. Tedaviyi ve önleyici kontrol önlemlerini başlatma ihtiyacı, BHV-1 salgınları esnasında ilk başlarda hissedilir, oysa ki teşhis ekseriya bu kritik zamandan sonra yapılmaktadır. Bu nedenle BHV-1 enfeksiyonunun daha çabuk teşhisi lüzumu: (i) pnömoni gelişimine iştirak eden şartların hızlı kanıtlanması; (ii) bir salgın esnasında uygun önleyici önlemleri alma ihtiyacı; (iii) sığırların bir arada tutulma işlemleri esnasında yaygın BHV-1 ortaya çıkması nezdinde dikte edilmektedir (Collins ve ark. 1985).
Numunelerin virusun en yüksek oranda saçıldığı hastalık seyrinin başlangıcında toplanması karşılığında, ELISA prosedürleri son derece faydalıdır (Collins ve ark. 1985).
2.5.2. Đndirekt teşhis
Sağılmayan gruplardan elde edilen bireysel veya birleştirilmiş serumlara ait veriler, sürünün durumunu daha kesin olarak göstermektedir. Buna ilaveten, bazı ELISA’lar aşılanmış bir populasyondaki enfekte sığırları tespit etmek için marker aşılar ile birlikte kullanılabilmektedir (van Oirschot ve ark. 1997, Wellenberg ve ark. 1998).
Uygun bir eşik değeri ile birlikte kullanılan tank sütündeki testlerin, bir sürüdeki BHV-1’in varlığını ölçtüğü bildirilmiştir (Pritchard 2001).
BHV-1’e karşı spesifik antikorlar ilk kez enfeksiyondan 7–10 gün sonra saptanabilmektedir. Akut faz sonrası ve latent dönem esnasında, BHV-1 ile enfekte sığırlar esas olarak BHV-1’e karşı spesifik antikorların varlığıyla tespit edilirler. Serumda BHV-1’e karşı antikorların saptanmasında genellikle virus nötralizasyon
testleri ve değişik ELISA’lar kullanılmakta ve ELISA testlerinin giderek virus nötralizasyon (VN) testlerinin yerini aldığı görünmektedir. BHV-1 ELISA testlerinin çeşitli tipleri ticari olarak mevcut olup, onların çoğu sütte antikorları saptamak için de uygundur (Kampa 2006).
2.6. Đmmunite
Antikor taşımayan veya düşük titrede taşıyan anneleri emen yavrular ile kolostrum alamamış yavrularda hastalık şiddetli ve sistemik seyretmektedir (Rosner 1968, Kahrs ve ark. 1977).
Doğumdan sonraki ilk 12 saatte bağışık annelerden kolostrum alabilen yavrularda yeterli seviyede antikor bulunur. Anneden alınan antikor seviyesine bağlı olarak maternal antikorlar yavruyu 3–4 aya kadar koruyabilir (Straub 1969).
Kan ve sütte tespit edilebilir antikor eş zamanlı olarak şekillenmektedir (Afshar ve Bannister 1970).
Enfekte hayvanlarda deride aşırı duyarlılık geliştiği (Darcel ve Dorward 1972), seratonin ve depomin nedeniyle akciğerlerde alerjik bozukluklar olduğu gösterilmiştir (Eyre 1978).
Selüler immunitede immun savunma sistemi olarak etkindir. T lenfositlerinin de önemli bir rolü olduğu Rouse ve Babiuk (1974) tarafından bildirilmiştir.
Akut IBR enfeksiyonu sonrası kanda farklı sınıflardan immun globulin sentezleri şekillenir. Bunlar 2. hafta sonunda maksimum titreye ulaşan IgA ve IgM ile 2–4 hafta sonra maksimum titreye ulaşan IgG’dir (Matthaeus ve Straub 1978). Enfeksiyondan etkilenen hayvanların bronko-alveolar yıkama sıvılarında lenfosit hücreleri belirlenmiştir (Bouffard ve ark. 1982).
IBR ile meydana gelen ilk enfeksiyonda primer immun yanıt sonucu IgG1 şekillenir ancak enfeksiyona yeniden maruz kalma durumlarında IgG2 antikorları sentezlenir (Guy ve Potgieter 1985). Her ne kadar antikorlar kanda uzun süre kalmasına rağmen antikor titresi enfeksiyonun bulaştığı bölgeye göre değişiklik gösterir, solunum yoluyla gelişen enfeksiyonlarda olusan titrenin genital sistem yoluyla meydana gelen enfeksiyondan daha yüksek şekillendiği bildirilmiştir (Straub ve ark. 1982). Ancak oluşan antikorlar uzun süre yüksek titrede kalmazlar, antikor
titresinin azalması ile birlikte latent olan virus reaktive olup tekrar saçılmaya başlar. Antikor seviyesi yüksek olsa bile steroid uygulamalarını takiben virus yeniden reaktive edilebilir (Huck ve ark. 1973).
2.7. Korunma ve Kontrol
Aşılama yapılmaksızın ‘test-ve-öldürme’ Danimarka, Finlandiya, Avusturya, Đsveç ve Đsviçre gibi ülkelerde son derece başarılı bir biçimde kullanılmıştır (Ackermann ve ark. 1989, Ackermann ve ark. 1990, Nylin ve ark. 1998, Kofer ve ark. 1999, Vonk Noordegraaf ve ark. 2000, Paisley ve ark. 2001).
Teste tabi tutma ve aşılama ile kontrol, örneğin; Almanya, Belçika, Macaristan, Đtalya’ nın bir ilinde ve Hollanda’ da uygulanmıştır (Tanyi ve Varga 1992, Nardelli ve ark. 1999, Limbourg ve ark. 2002, Trapp ve ark. 2003, Vonk Noordegraaf ve ark. 2004). Bununla birlikte, aşılama kapsamına alınan tek bir ülke bile, BHV-1’i eradike etmeyi başaramamıştır (Ackermann ve Engels 2006).
Aşılama ile BHV-1’in neden olduğu klinik hastalığın şiddeti azaltılabilmesine rağmen, latent enfeksiyonlar önlenemez (Kaashoek ve ark. 1994).
Konvansiyonel aşıların başka bir dezavantajı, rutin serolojik diyagnostik testlerle karıştırılmalarıdır. Marker aşılar bu problemi ortadan kaldırırlar, fakat seroloji uygun diyagnostik araçlara dayandırılmalıdır (Kaashoek ve ark. 1994, Babiuk ve ark. 1996, van Oirschot ve ark. 1997, de Wit ve ark. 1998, Wellenberg ve ark. 1998).
Sistematik projeler yönünden biyogüvenlik, BHV-1’in başarılı eradikasyonu için en önemli faktördür. BHV-1’in biyogüvenliği hijyenik önlemlere dayanmaktadır. Hastalıktan ari bir sürüye sokulan sığırlar için ideal olarak 4 haftalık bir karantina süresi uygulanır. Karantinadan sonra sadece seronegatif hayvanların sürüye girmesine izin verilebilir. Hayvan bir defa enfekte oldu mu, ömür boyu BHV-1’in potansiyel yayıcısı olarak kabul edilir ve bu yüzden sürüden ayrılıp öldürülebilir ya da uzaklaştırılabilir. BHV-1’den ari sürülere veya Suni Tohumlama (AI) istasyonlarına virusun girme riskini en aza indirmek için, latent taşıyıcılar olan hayvanların teşhisi ve uzaklaştırılması, kontrol programları ve uluslararası ticaret faaliyetlerinde önemlidir (Kramps ve ark. 1996).
BHV-1, OIE’nin B listesi hastalık kapsamına girmektedir ve bu yüzden uluslararası kanunlar ve kontrol açısından bir hedef teşkil etmektedir. Virus, ulusal/bölgesel/sürü düzeyinde ya ‘test-ve-öldürme’ ya da aşılama projeleriyle birlikte veya aşılama projeleri olmadan ‘test-ve-ayırma’ aracılığıyla sistematik olarak kontrol edilir (Kampa 2006).
Pek çok ülkede BVDV ve BHV-1 enfeksiyonlarını yok etmek için sistematik önlem, hiçbir surette sürü ya da bölge seviyesinde ele alınmamıştır; profilaksi, multivalan BVDV ve BHV-1 aşılarının kullanımıyla ‘sürü kararı’ na dayanmaktadır. Ayrıca bazı ülkelerde bu enfeksiyonları önlemeye çalışmak için geçmişte hiçbir surette önlem alınmamıştır (Kampa 2006).
2.8. Dünya’da ve Türkiye’de Sığırlarda BHV-1 Enfeksiyonu
Türkiye’de IBR-IPV enfeksiyonunun epidemiyolojisine yönelik ilk çalışma Erhan ve ark. (1971) tarafından Đnanlı Çiftliği ve Karacabey Harası’nda gerçekleştirilmiştir. Araştırıcılar 100 sığıra ait kan örneğinde, serum nötralizasyon testi (SNT)’ni kullanarak yaptıkları çalışmada BHV-1 spesifik nötralizan antikor oranını %28 olarak tespit etmişlerdir.
Gürtürk ve ark. (1974), Doğu ve Orta Anadolu Bölgeleri’nden alınan 928 adet sığır kan serumunda BHV-1’e karşı %56.1 oranında nötralizan antikor varlığı saptamışlardır.
Burgu ve Akça’nın (1982) yaptığı bir çalışmada Gelemen Devlet Üretme Çiftliği’ne ait 61 adet kan serumunda %55.73 oranında BHV-1 spesifik nötralizan antikoru tespit edilmiştir.
Burgu ve Akça (1987), 18 ay yaştaki bir sığıra ait burun akıntısı materyalinden Türkiye’de ilk BHV-1 izolasyonunu gerçekleştirmişlerdir.
Đsviçre’de 1978-1988 arasında yapılan 10 yıllık bir eradikasyon programıyla IBR hastalığı ülkeden eradike edilmiş ve bu kapsamda BHV-1 antikor pozitif olan toplam 51.911 hayvan kesime gönderilmiştir. Bugün Đsviçre, Danimarka ve Finlandiya gibi ülkelerde hastalık tamamen eradike edilmiş durumdadır (Ackermann ve ark. 1990).
Ghram ve Minocha (1990) Tunus’da ELISA ve SNT’ni kullanarak yaptıkları araştırmalarında, sığırlarda BHV-1 pozitifliğini %25.9 olarak tespit etmişlerdir. Bilge (1996), mastitisli ineklere ait 96 adet süt örneğinden birinde BHV-1 izolasyonunu gerçekleştirmiş ve sütün enfeksiyonun epidemiyolojisinde önemli olabileceğine dikkat çekmiştir.
Renukaradhya ve ark. (1996) Hindistan’da sığır ve mandalar üzerinde gerçekleştirdikleri çalışmada, BHV-1 seroprevalansını %50.9 bulmuşlardır.
Bitgel (1997), Trakya bölgesinde solunum sistemi enfeksiyonu belirtisi gösteren sığırlarda yaptığı çalışmada, topladığı kan (lökosit), burun akıntısı, göz akıntısı ve akciğer örneklerinin %4.2’sinde BHV-1 antijeni tespit etmiştir.
Macaristan’da Tekes ve ark. (1999), küçük ve büyük sığır sürülerinden topladıkları süt ve kan serumlarında ELISA tekniğini kullanarak BHV-1 enfeksiyonunun pozitifliğini araştırmışlar ve büyük sürülerde %64.1, küçük sürülerde ise %13.5-15.7 oranlarında seropozitiflik tespit etmişlerdir.
Biuk-Rudan ve ark. (1999), %60.8 oranında infertilite problemi bulunan 4 farklı çiftlikten topladıkları süt sığırlarına ait serumlarda IBR pozitifliğini %85.8 olarak bildirmişlerdir.
Boelaert ve ark. (2000) Belçika’da yaptıkları çalışmada, BHV-1 seroprevalansını %33-67 oranları arasında tespit etmişlerdir.
Çabalar ve Can-Şahna (2000), Doğu ve Güneydoğu Anadolu Bölgesi’nde bulunan 12 özel ve 5 kamu işletmesine ait süt sığırlarından topladıkları 471 kan serumunu BHV-1, Parainfluenza Virus-3 (PIV-3) ve Respiratory Syncytial Virus (RSV) spesifik antikorlar yönünden SNT ile kontrol etmişlerdir. Araştırıcılar, BHV-1’e karşı işletme bazında ve işletmeler genelinde sırasıyla %94.1 (17 işletmeden 16’sında) ve %52.4 olmak üzere seropozitiflik oranları saptamışlardır.
Solis-Calderon ve ark. (2003), 35 sürüden topladıkları 564 sığıra ait kan serumu örneğinde, SNT’ni kullanarak yaptıkları çalışmada %54.4 oranında IBR seropozitifliği tespit etmişlerdir. Sürü düzeyinde pozitifliği ise %97.14 olarak bildirmişlerdir.
Mweene ve ark. (2003), Zambia’nın Southern Eyaleti’nde pazara sevkedilen sığırlarda IBR’ye neden olan BHV-1’in prevalansını belirlemek için yaptıkları araştırmalarında, toplam 116 nazal sekresyon örneğini direkt floresan antikor testi
(FAT) ile, aynı sığırlardan aldıkları kan örneklerini ise ticari olarak temin ettikleri ELISA kitiyle incelemişlerdir. Araştırıcılar, sığırlarda BHV-1 antijenlerinin prevalansını %23.28 (27/116), BHV-1 antikorlarının ortalama prevalansı ise %48.28 (56/116) olarak tespit etmişlerdir.
Elhassan ve ark. (2005), Sudan’ın değişik bölgelerindeki solunum ve genital sistem semptomları gösteren sığırlardan topladıkları 81 adet nazal ve vajinal swab örneğini BHV-1’in varlığını ortaya koymak amacıyla doku kültüründe izolasyon yöntemini kullanarak test etmişlerdir. Araştırıcılar tipik hastalık semptomları gösteren 5 sığırdan virusu izole etmişler; aynı zamanda SNT, ELISA ve Pasif Hemaglütinasyon Test (PHT)’lerini kullanarak hastalığın varlığını doğrulayan nötralizan antikorları da tespit etmişlerdir.
Yıldırım ve Burgu (2005), Kuzeydoğu Anadolu bölgesindeki sığırlarda mavidil (BT), IBR, PIV-3, Enzootic Bovine Leucosis (EBL) virus enfeksiyonlarının seroprevalanslarını araştırmak amacıyla 8 ildeki özel sektöre ait organize yetiştiricilik yapılan ve aile işletmelerinde bulunan sığırlardan aldıkları toplam 506 kan serumu örneğini mikronötralizasyon testine tabi tutarak, IBR virusuna karşı % 59.48 oranında bir seropozitiflik belirlemişlerdir.
Yavru ve ark. (2005), Konya Et ve Balık Kurumu Mezbahası’ndaki farklı yaş, cinsiyet ve ırktaki sığırlardan aldıkları toplam 254 kan serumu örneğini mikronötralizasyon testi (mNT) ile BAV- 1, 2 ve 3, IBR/IPV, PIV-3, BRSV ve BVDV nötralizasyon antikorları yönünden kontrol ederek, 145 (% 57.08) hayvanda IBR/IPV virusuna karşı nötralizan antikor varlığı tespit etmişlerdir.
Bulut ve ark. (2006), süt sığırcılığı işletmelerinde BHV-1 ve Bovine Viral Diarrhoea Virus (BVDV) enfeksiyonlarının durumlarını belirlemek amacıyla yaptıkları araştırmalarında, 2000–2006 yılları arasında Konya ve çevresinde bulunan 35 farklı işletmedeki toplam 6418 sığırdan rastgele örnekleme metodu ile 1288 adet kan numunesi toplayarak, kan örneklerini BHV–1 ve BVDV’una karşı antikor varlığı, BVDV’una karşı ise ayrıca antijen varlığı yönünden ELISA ile incelemişlerdir. Đnceledikleri kan serumlarından 204 (%15.8)’ünü BHV-1’e, 693 (%53.8)’ünü de BVDV’una karşı oluşan antikorlar yönünden seropozitif olarak belirlemişlerdir.
Okur-Gümüşova ve ark. (2007), Türkiye’ nin Samsun ilindeki aşılanmamış, 1-3 yaş arasındaki 188 sığırdan aldıkları kan serumu örneklerini, SNT’ ni kullanarak, sığırlarda solunum sistemi hastalıklarına neden olan 5 virusa (BHV-1, BVDV, PIV-3, BAV-1 ve BAV-3) karşı antikorlar yönünden test ederek, BHV-1’ e karşı % 61.17 oranında bir seropozitiflik tespit etmişlerdir.
Yeşilbağ ve Güngör (2007), Marmara bölgesinde bulunan 7 ildeki 39 sığırcılık işletmesinden topladıkları toplam 584 kan serumu örneğini BHV-1, BVDV, BRSV, PIV-3, BAV-1 ve BAV-3’ e spesifik nötralizan antikorlar yönünden inceleyerek, BHV-1’ in seroprevalansını % 17.1 olarak saptamışlardır. Ayrıca, BHV-1, BVDV ve BRSV’nin seroprevalansının büyük kapasiteli süt sığırı işletmelerinde küçük kapasiteli işletmelere oranla son derece yüksek olduğunu tespit ederek, sürü kapasitesinin solunum yolu virusları açısından çok önemli bir risk faktörü olduğunu bildirmişlerdir.
Duman ve ark. (2007), BHV-1 enfeksiyonlarının varlığını SNT ile ortaya koymak için Türkiye’nin orta (Konya) ve güney (Denizli) bölgelerinden üç yaş ve üzeri, sağlıklı, BHV-1’e karşı aşılanmamış 3001 besi sığırından kan serum örnekleri almışlardır. Test sonucunda, BHV-1 enfeksiyonunun seroprevalansını, Đç Anadolu’da %35.08 ve Güney Anadolu’ da %38.75 olarak tespit ederek, sonuçları Türkiye’ nin orta ve güneyindeki sığır populasyonlarında BHV-1 enfeksiyonunun prevalansında bir azalma olduğu şeklinde yorumlamışlardır.
Đspanya’nın Galicia bölgesindeki sığırlarda BHV-1’e karşı serum antikorlarının prevalansının belirlendiği iki sörvey çalışmasının sonuçlarının bildirildiği bir araştırmada; birinci sörvey çalışması 2000 yılında bölgenin tüm sığır populasyonunda, ikincisi 2004 yılında aynı bölgede ADSG (Sağlık Koruma Ekipleri) tarafından sevk ve idare edilen bir grup çiftlikteki sürülerde yapılmıştır. Bölgedeki tüm süt ve besi sürülerindeki 1 yaşın üzerindeki hayvanlardan alınan kan serum örneklerinin indirekt ELISA ile test edildiği 2000 yılında yapılan ilk sörvey çalışmasında; ortalama bireysel hayvan ve sürü prevalansı, sırasıyla, %38.4 (%37.3-%39.5 arasında değişen; %43.2 süt sığırları, %26.8 besi sığırları) ve %50.4 (%46.4-%54.4 arasında değişen; %58.3 süt sığırları, %48.1 besi sığırları) olarak tespit edilmiştir. 2004 yılında gerçekleştirilen ikinci sörvey çalışmasında ADGS çiftliklerinin sürü ve hayvan nezdinde ortalama prevalansı, sırasıyla, %47.2
(%44.9-%49.5; %51.5 süt sığırları, %45.2 besi sığırları, %42.3 karışık) ve %35.7 (%35.3-%36.1; %37.8 süt sığırları, %33.1 besi sığırları, %25.5 karışık) olarak tespit edilmiştir (Eiras ve ark. 2009).
Gencay ve ark. (2009), Kayseri iline bağlı çeşitli ilçelerdeki halk elinde bulunan sığırlardan topladıkları 552 adet kan serumu örneğini BHV-1’e spesifik nötralizan antikorlar yönünden inceleyerek, BHV-1’ in seroprevalansını % 51.63 olarak saptamışlardır.
3.MATERYAL VE METOT
3.1. Materyal
3.1.1. Sığırlar
Araştırmada, Çorum iline bağlı Đskilip ilçesindeki küçük aile işletmelerinde bulunan, aşılanmamış, 1 yaş ve üzeri 5200 hayvanın solunum sistemi hastalık semptomları yönünden taranmasıyla toplam 250 süt sığırı örneklendi. Örneklemelerin yapıldığı yerleşim alanı Şekil 3.1’de görülmektedir.
3.1.2. Nazal svap örnekleri
Nazal svap örnekleri, solunum sistemi semptomları gösteren 250 adet sığırdan alındı. Burun sıvılarının alınmasında Bio-X Diagnostics (Belçika)’den ticari olarak temin edilen toplama kitleri kullanıldı. Hayvanın burun deliğine uygun boyda bir tampon seçilerek burun deliğinin içerisinde 5 dakika süresince tutuldu. Islanmayla şişen tampon hayvanın burun deliğinden çıkarılarak, konik tabanlı, kenarlı bir polipropilen tüpün (Greiner 201250 tüp, 24x90 mm) içine konuldu. Bu tüp, tıpası kapatılmadan, 50 ml’lik konik tabanlı kenarsız bir polipropilen tüpün (Greiner 227261 tüp, 30x115 mm)içerisine yerleştirildi. Bu ikinci tüpün ağzı kapatıldı ve tüp içindeki tüp mümkün olduğunca çabuk laboratuvara getirildi. Tüp laboratuvara getirilir getirilmez, 1500 rpm’de 20 dakika süreyle santrifüj edildi. Đç tüp uzaklaştırılarak, dış tüpün dibindeki sıvı başka bir tüpün içerisine alındı. Bu sıvı, ELISA ile test edilmeden önce dilüsyon buffer’ıyla yarı yarıya sulandırıldı.
3.1.3. Serolojik araştırmada kullanılan serum örnekleri
Steril şartlarda kaolinli polistren tüpler içine alınan kan örnekleri serumun ayrılması için 2000 rpm’de 10 dk süreyle santrifüj edildi. Elde edilen serumlar daha sonra 30 dk süre ile 56°C’lık su banyosunda inaktive edildi ve testte kullanılıncaya kadar 1 ml’lik kısımlar halinde −20°C’ta derin dondurucuda saklandı.
3.2. Metot
3.2.1. BHV-1 antijenlerinin tespiti için ELISA
Nazal svap örneklerindeki BHV-1 antijenlerinin tespit edilmesi amacıyla, Bio-X Diagnostics (Belçika) firmasından ticari olarak temin edilen ELISA kiti [Bio-Bio-X Pulmotest BHV-1 (BIO K 189)] kullanıldı.
3.2.1.1. Kit bileşenleri
• Mikropleytler: 96 gözlü 2 adet mikrotitrasyon pleyti. B, D, F, H gözleri non-spesifik antikorlar tarafından hassaslaştırılırken (kontrol antikoru), A, C, E, G gözleri anti-BHV-1 spesifik antikorlar tarafından hassaslaştırılmıştır.
• Yıkama solüsyonu: 1 adet 100 ml’lik şişede 20x konsantre yıkama solüsyonu. Bu solüsyon soğukken kendiliğinden kristalleşmektedir. Eğer solüsyonun sadece bir bölümü kullanılacaksa, kristallerin tümü çözününceye kadar şişe oda ısısında bekletilir. Solüsyon iyice karıştırılıp, gereken miktar alınır. Solüsyon 1:20 oranında distile yada demineralize su ile sulandırılır. Sulandırılmış solüsyon 4ºC’ta saklanır.
• Lizis Tamponu (Lysis Buffer): 1 adet 50 ml’lik şişede 5x konsantre buffer. Solüsyon 1:5 oranında distile ya da demineralize su ile sulandırılır. Sulandırılmış solüsyon 4ºC’ta saklanır.
• Sulandırma Tamponu (Dilution Buffer): 1 adet 50 ml’lik şişede 5x konsantre buffer. Bu konsantre solüsyon 1:5 oranında distile ya da demineralize su ile sulandırılır. Sulandırılmış solüsyon 4ºC’ta saklanır.
• Konjugat: 1 adet 0.5 ml’lik şişede, 50 kat yoğunlaştırılmış anti− BHV– 1−biotin konjugat.
• Avidin: 1 Adet 0.5 ml’lik şişede, 50 kat yoğunlaştırılmış anti−avidin peroxidaz konjugat.
• Kontrol antijeni: Kontrol antijeni içeren 2 şişe. Bu antijen 0.5 ml distile ya da demineralize su ile yeniden hazırlanır. Yeniden hazırlanan ayıraç −20ºC’ta saklanabilmektedir. Tekrarlanan dondurma ve çözme işlemlerine mani olmak için yeniden hazırlanan antijen iki porsiyona bölünür. Eğer bu önlemler alınırsa, ayıraç birkaç ay süreyle saklanabilmektedir.
• Kromojen solüsyonu: 1 adet 2 ml’lik kromojen tetrametilbenzidin içeren damlalıklı şişe. 4ºC’ta saklanır.
• Substrat solüsyonu: 1 adet 30 ml’lik şişede Hidrojen peroksit substrat solüsyonu. Bu ayıraç 4ºC’ta saklanır.
• Durdurma solüsyonu: 1 adet 15 ml’lik 1 M fosforik asit durdurma solüsyonu içeren şişe.
3.2.1.2. Testin prensibi
Test, BHV-1 için spesifik antikorlar tarafından sensitize edilmiş 96 gözlü mikrotitrasyon pleytleri içerir. Bu antikorlar, örneklerde (homojenize edilmiş akciğer dokusu, bronkotrakeal sıvı, nazal eksudat veya kültür vasatı) bulunan ilgili patojenlerin spesifik tutunmasına olanak sağlar. A, C, E, G gözleri bu antikorlar ile hassaslaştırılmıştır ve B, D, F, G gözleri spesifik olmayan antikorlar içerir. Bu kontrol gözleri, yalancı pozitifleri elimine etmek amacıyla spesifik immunolojik reaksiyonlar ile non-spesifik bağlanmalar arasında ayırıma imkan vermektedir.
Örnekler lizis solüsyonu ile sulandırılır ve mikropleytte 1 saat oda ısısında inkübe edilir. Bu ilk inkübasyon aşamasından sonra, pleyt yıkanır ve peroksidazla işaretlenmiş bir anti-BHV-1 spesifik monoklonal antikor olan konjugatla 1 saat süreyle inkübe edilir. Bu ikinci inkübasyondan sonra pleyt tekrar yıkanır ve enzim substratı (hidrojen peroksit) ile kromojen (tetrametilbenzidin) ilave edilir. Bu kromojen, diğer peroksidaz kromojenlerine göre daha duyarlı olma ve kanserojen olmama avantajına sahiptir.
Eğer örneklerde BHV-1 varsa, konjugat ilgili mikropleyt gözlerine bağlanarak kalır ve enzim, renksiz kromojenin pigmentli bir bileşik haline dönüşmesini kataliz eder. Enzimatik reaksiyon asidifikasyonla durdurulabilmekte ve sonuçta oluşan 450 nm’deki optik dansite fotometreyle kaydedilebilmektedir. Mikropleytin negatif kontrol gözleri için kaydedilen veriler, mikropleytin karşılık gelen pozitif kontrol gözleri verilerinden çıkartılır. Kontrol antijeni, test sonuçlarının geçerliliğini denetlemek için kit ile birlikte sağlanır. Bu kontrol antijeni, liyofilize BHV-1 kültüründen oluşmaktadır.
3.2.1.3. Prosedür
1) Testin bütün bileşenleri kullanmadan en az 30 dakika önce oda ısısına getirilmelidir.
2) Mikropleyt kabından çıkartılır.
3) Örnekler aşağıdaki gibi göz başına 100 µl oranında dağıtılır: A1-B1 gözlerine Örnek 1, C1-D1 gözlerine Örnek 2, vs. Aynı şekilde kontrol antijeni de konulur (örneğin: G1-H1).
4) Pleyt oda ısısında 1 saat kadar inkübe edilir.
5) ‘Kit bileşenleri’ kısmında bildirildiği gibi hazırlanan yıkama solüsyonu ile pleyt yıkanır. Bundan sonra, mikropleytteki bileşenler yavaşça vurularak boşaltılır. Mikropleyt temiz bir kurutma kağıdına ters çevrilerek içindeki tüm sıvı boşalana kadar yavaşça vurulur. Bu işlem 2 kere daha yapılır. Bu 3 yıkama işlemi tamamlandıktan sonra diğer basamağa geçilir.
6) Konjugat sulandırma buffer’ı ile 1:50 oranında sulandırılır (örneğin; 1 pleyt için 250 µl konjugat, 12.25 ml sulandırma buffer’ı ile sulandırılır). Sulandırılmış konjugattan her göze 100 µl konulur. Oda ısısında 1 saat inkübasyona bırakılır.
7) Pleyt 5. basamakta anlatıldığı gibi yıkanır.
8) Avidine peroksidaz konjugat 1:50 oranında sulandırma buffer’ı içerisinde sulandırılır (örneğin; 1 pleyt için 250 µl konjugat, 12.25 ml sulandırma buffer’ı içerisinde sulandırılır).
9) Sulandırılmış solüsyon her göze 100 µl konulur. 10) Oda ısısında 1 saat inkübe edilir.
11) Pleyt 5. basamakta anlatıldığı gibi yıkanır.
12) 12 damla (500 µl) kromojen 9,5 ml substrat solüsyonuna ilave edilerek indikatör karışım hazırlanır. Hazırlanan karışımdan her göze 100 µl konulur. Bu solüsyon renksiz olmalıdır. Eğer mavi bir renk görülür ise solüsyon peroxidaz ile kontamine olmuş demektir. Eğer kontaminasyon gerçekleşmiş ise bu solüsyon atılmalıdır ve temiz malzemeler ile tekrar hazırlanmalıdır.
13) Oda ısısında inkübe edilmelidir ve 10 dakika ışıktan uzak tutulmalıdır. 14) Her göze 50 µl stop solüsyonu konulmalıdır.
15) Mikropleyt spektrofotometre ile 450 nm’de okunur. Sonuçlar stop solüsyonu ilave ettikten hemen sonra okunmalıdır.
3.2.1.4. Sonuçların değerlendirilmesi
• Antijen için pozitiflik sınırı 0,150 olmalı. • 0,150’den büyük ya da eşit olursa pozitif. • 0,150’den küçük olursa negatif.
3.2.2. BHV-1’e özgü antikorların tespiti için ELISA
Kan serumu örneklerinde BHV-1 spesifik antikorların tespit edilmesi amacıyla, ticari ELISA test kiti (ELISA IBR Serum and Milk Screening, Version: P03140/04, Institut Pourquier, France) prosedürüne uygun olarak kullanıldı.
3.2.2.1. Kit bileşenleri
• Mikropleytler: Tüm gözleri BHV-1 viral antijeni ile kaplanmış olan 5 adet 96 gözlü mikropleyt.
• Yıkama Solüsyonu: 1 adet 100 ml’lik şişede 20x konsantre yıkama solüsyonu. Solüsyonda + 5°C (± 3°C)’ta kristaller oluşabilir, fakat bunlar + 21°C (± 5°C)’ta süratle ortadan kalkar. Solüsyonun hafifçe çalkalanması, kristallerin çözünmesini hızlandırır.
• Dilüsyon Buffer 2: 1 adet 120 ml’lik şişede, örneklerin sulandırılmasında kullanılan, açık yeşil renkli, + 5°C (± 3°C)’ta saklanması gereken buffer.
• Dilüsyon Buffer 1: 1 adet 120 ml’lik şişede, konjugatın sulandırılmasında kullanılan, açık mavi renkli, + 5°C (± 3°C)’ta saklanması gereken buffer.
• Pozitif ve Negatif Kontroller: 1 ml’lik şişeler halinde 1’er adet pozitif ve negatif kontroller. Kontroller + 5°C (± 3°C)’ta saklanmalıdır.
• Anti-bovine IgG-Peroksidaz Konjugat: 1 adet 1.5 ml’lik şişede, + 5°C (± 3°C)’ta saklanması gereken konjugat. Sulandırılmış konjugat solüsyonu saklanamaz. • Revelation (Açığa Çıkarma) Solüsyon 3 (TMB): 1 adet 120 ml’lik şişede kullanıma hazır solüsyon. + 5°C (± 3°C)’ta hafifçe mavimtrak olabilen bu solüsyon, + 21°C (± 5°C)’ta renksizleşmektedir. Bu yüzden, ihtiyaç duyulduğunda hemen kullanıma hazır olması için, +21°C’ta 1 haftaya kadar damlalıkta bırakılabilmektedir (şişenin hava sızdırmaz bir biçimde kapatılması şartıyla).
• Durdurma Solüsyonu (H2SO4 0,5M solüsyon): 1 adet 120 ml’lik şişede + 5°C (± 3°C)’ta saklanması gereken stop solüsyon. Đhtiyaç duyulduğunda hemen kullanıma hazır olması için, şişenin hava sızdırmaz bir biçimde kapatılması şartıyla, + 21°C (± 5°C)’de 1 aya kadar saklanabilmektedir.
3.2.2.2. Testin prensibi
Testin prensibi şunlardır:
1) Mikropleytlerin tüm gözleri BHV-1 viral antijeni ile kaplanmıştır.
2) Test edilecek örnekler gözlerde sulandırılır ve inkübe edilirler. Serumda bulunan herhangi bir BHV-1’e spesifik antikor, BHV-1− antikor immun kompleksini oluşturacak ve gözlerde bağlı kalacaktır.
3) Yıkama işleminden sonra, enzimle birleştirilmiş anti-bovine antikor immunoglobulin inkübe etmek için ilave edilir. Bu konjugat immun komplekse bağlanacaktır.
4) Başka bir yıkama işleminden sonra, gözlere enzim substratı (TMB) eklenir. Eğer gözlerde konjugat tespit edilirse; enzim, mavi bir bileşik halindeki substratı yapışma sonrası sarıya dönüştürecektir. Rengin yoğunluğu, test edilen örnekteki mevcut antikor oranlarının bir ölçüsüdür.
Pozitivite sınırı, her mikropleyte eklenilmek zorunda olan kit ile birlikte verilmiş olan kontrol serumu ("pozitif kontrol") kullanarak belirlenir.
3.2.2.3. Prosedür
1) Örneklerin Yerleştirilmesi:
Örnekler ve kontroller aşağıdaki metot kullanılarak 1/20 oranında sulandırılır (açıklamalar 2 ve 3 ile şekil 3.1’e bakınız):
• Dağıtılır:
- göz başına 190 µl "dilüsyon buffer 2" - A1’e 10 µl sulandırılmamış negatif kontrol - B1 ve C1’e 10 µl sulandırılmamış pozitif kontrol - sadece tek gözün içine test edilecek serumdan 10 µl
• Pleytler hafifçe çalkalanarak gözlerin içerikleri homojenize edilir (açıklamalar 1’e bakınız).
• Pleytlerin üzeri kapatılır (kapak, alüminyum folye ya da yapıştırıcı bant ile) ve 37°C (± 3°C)’de 1 saat (± 5 dk) süreyle inkübe edilir.
Bu metot, testin 12 saatten az süre içerisinde uygulanmasına imkan vermektedir.
Şekil 3.1. Örneklerin Dağıtımı
Açıklamalar:
1. Laboratuvarlarımızda, özgün bir biçimde komplement fikzasyon testi mikrometoduna yönelik olarak mikropleyt shaker kullanılmaktadır.
2. 96 gözün ayrı ayrı doldurulması bazen uzun bir süreçtir. Serumların inkübasyon süresini standardize etmek için, kontroller ve serum örnekleri 96 gözlü, U şekilli tabanlı pleytlerde hazırlanmaktadır. Bu yüzden onları çok kanallı bir pipet kullanarak
süratle aktarmak (kolondan kolona) mümkündür. Bununla birlikte kontrollerde olduğu gibi aynı şekilde örneklerin sulandırmalarını yapmak gereklidir.
3. A1, B1 ve C1’deki kontrollerin pozisyonu önemli değildir. Onlar pleytteki herhangi bir yere dağıtılabilirler.
2) Yıkama:
a) Bir şişe "konsantre (20x) yıkama solüsyonu" 1900 ml distile su ile sulandırılır. Bu solüsyon bundan sonra "Yıkama solüsyonu" olarak isimlendirilir. Bu sulandırma, 100 ml’lik şişenin tamamının kullanılması şartıyla, daha önce +5°C (±3°C)’de ortaya çıkan kristallerin eliminasyonundan önce yapılabilmektedir.
b) Pleytin içeriği hafifçe tıklayarak ya da en iyisi elle veya otomatik yöntemle boşaltılır.
c) Pleytin tüm gözlerine yıkama solüsyonu doldurulur; daha sonra yıkama solüsyonu tekrar boşaltılır.
d) c) aşaması iki kez tekrarlanır (toplam 3 yıkama). Açıklama:
Aynı anda birkaç pleyt işleme tabi tutulduğunda, testin geçerliliğini modifiye etmeksizin pleytleri 1 saat süresince "Yıkama solüsyonu" ile dolu bırakmak mümkündür (tüm basamakları senkronize etmek için).
3) Konjugatın Konulması:
a) Konjugat, "Dilüsyon buffer 1" ile 1/100 oranında sulandırılır. b) Sulandırılan konjugattan göz başına 100 µl dağıtılır.
c) Pleytin üzeri kapatılıp (kapak, alüminyum folye veya yapıştırıcı bant ile), 37°C (±3°C)’ta 30 dakika süreyle inkübe edilir.
4) Yıkama:
a) Hafifçe tıklayarak ya da başka bir otomatik olmayan veya otomatik metotla pleytin içeriği boşaltılır.
b) Pleytin bütün gözleri Yıkama solüsyonu ile doldurulur; daha sonra yıkama solüsyonları tekrar boşaltılır.
c) b basamağı iki kez tekrarlanır (toplam 3 yıkama). Açıklama:
1. En son yıkamaya özen gösterilmesi, iyi test sonucu alınmasında çok önemlidir. 2. Eğer yıkama işlemi elle yapılırsa, son yıkamadan sonra gözleri tamamen boşaltmak için mikropleytin bir emici altlık üzerinde tıklatılması mümkündür.
5) Açığa Çıkarma (Revelation):
a) Kullanıma hazır "Açığa Çıkarma (Revelation) Solüsyonu"ndan göz başına 100 µl dağıtılır.
b) Pleytler +21° (± 5°C)’ta 20 dakika süreyle inkübasyona bırakılır (ışıktan uzak). c) Göz başına 100’er µl "Durdurma Solüsyonu" eklenir.
d) Renkli solüsyon homojenize oluncaya kadar pleyt hafifçe çalkalanır. Pleytin alt kısmı iyice kurulanır.
Açıklama:
1. Yukarıda ana hatlarıyla belirtilen 20 dakikalık açığa çıkarma/revelation periyodu, laboratuvarlarımızda uygulandığında, "Sonuçların Değerlendirilmesi" bölümünde verilen O.D. değerlerini vermektedir. Bununla birlikte açığa çıkan renk oranları, değişik faktörler (yıkamaların kalitesi, kullanılan suyun kalitesi, pipetlemenin duyarlılığı, reaksiyon sıcaklığı) tarafından hafifçe modifiye edilebilmektedir. Çalışma koşullarıyla ilgili olarak, açığa çıkarma basamağı beklenilenden daha yüksek veya daha düşük OD değerleri verebilmektedir. Bu yüzden kullanıcı, reaksiyonu 20 dakika ± 10 dakikada durdurabilir.
2. Okuma işlemi, pleytlerin karanlıkta saklanması koşuluyla, reaksiyonun durdurulmasından 1 saat sonrasına kadar yapılabilmektedir.
6) Okuma:
Optik dansiteler 450 nm (OD.450)’de okunur. Fotometre ilk önce havada sıfırlanmalıdır.
3.2.2.4. Testin geçerlilik kriterleri
Eğer, pozitif kontrolün 0.350 minimal ortalama OD.450 değeri varsa ve pozitif kontrolün ortalama OD.450 değeri ile negatif kontrolün OD.450 değeri arasındaki oran 3,5’a eşit veya daha büyükse, sonuçlar güvenilir olarak kabul edilebilir.
3.2.2.5. Sonuçların değerlendirilmesi
Her örnek için S/P yüzde oranı hesaplanır:
% S/P = (örneğin OD.450 değeri – negatif kontrolün OD.450 değeri) / (pozitif kontrolün ortalama OD.450 değeri – negatif kontrolün OD.450 değeri) x100
• % S/P ≤ %45 olan herhangi bir örneğin, BHV-1 ile temasta bulunmamış bir hayvandan alındığı kabul edilir.
• S/P yüzde oranı %45 ile %55 arasında olan herhangi bir örnek, şüpheli olarak kabul edilir (açıklama 1’e bakınız).
• % S/P ≥ %55 olan herhangi bir örneğin, BHV-1 ile temasta bulunmuş olan bir hayvandan alındığı kabul edilir.
Açıklama:
1. Kontrol gözü kapsayan bir Elisa Testi ile veya rekabet prensibini kullanan bir ELISA ile şüpheli bulunan serumların doğrulanması tavsiye edilir.
2. Canlı veya inaktif aşıların kullanılması, belirgin bir serolojik reaksiyona neden olmaktadır.
4.
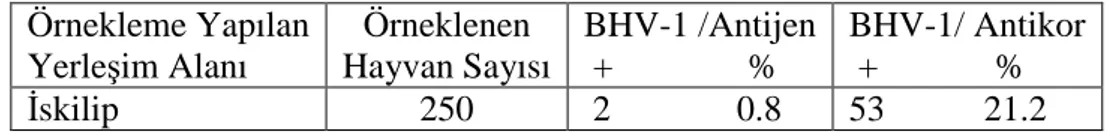
ARAŞTIRMA SONUÇLARI VE TARTIŞMAAraştırmada, 250 adet aşılanmamış sığırdan alınan nazal svap ve kan serumu numunelerine uygulanan ELISA yöntemi sonucunda; örneklenen sığırlarda BHV-1 antijenlerinin prevalansı yöre genelinde %0.8 (2/250) olarak tespit edilirken, örneklenen aynı hayvanlarda BHV-1 spesifik antikorların seroprevalansı %21.2 (53/250) olarak tespit edildi (Tablo 4.1).
Tablo 4.1. ELISA Antijen ve Antikor Sonuçları
Sığırlarda Infectious Bovine Rhinotracheitis (IBR) olarak bilinen hastalığa neden olan BHV-1, Đsviçre, Danimarka ve Finlandiya gibi hastalığın tamamen eradike edildiği birkaç ülke dışında (Ackermann ve ark. 1990), dünyanın her tarafında görülmektedir. Ghram ve Minocha (1990) Tunus’da ELISA ve SNT’ni kullanarak yaptıkları araştırmalarında, sığırlarda BHV-1 pozitifliğini %25.9 olarak tespit etmişlerdir. Renukaradhya ve ark. (1996) Hindistan’da sığır ve mandalar üzerinde gerçekleştirdikleri çalışmada, BHV-1 seroprevalansını %50.9 bulmuşlardır. Macaristan’da Tekes ve ark. (1999), küçük ve büyük sığır sürülerinden topladıkları süt ve kan serumlarında ELISA tekniğini kullanarak BHV-1 enfeksiyonunun pozitifliğini araştırmışlar ve büyük sürülerde %64.1, küçük sürülerde ise %13.5-15.7 oranlarında seropozitiflik tespit etmişlerdir. Biuk-Rudan ve ark. (1999), Hırvatistan Cumhuriyeti’ndeki %60.8 oranında infertilite problemi bulunan 4 farklı çiftlikten topladıkları süt sığırlarına ait serumlarda IBR pozitifliğini %85.8 olarak bildirmişlerdir. Solis-Calderon ve ark. (2003), Meksika’da 35 sürüden topladıkları 564 adet besi sığırına ait kan serumu örneğinde SNT’ni kullanarak yaptıkları
Örnekleme Yapılan Yerleşim Alanı Örneklenen Hayvan Sayısı BHV-1 /Antijen + % BHV-1/ Antikor + % Đskilip 250 2 0.8 53 21.2
(2003), Zambia’nın Southern Eyaleti’nde pazara sevkedilen sığırlarda IBR’ye neden olan BHV-1’in prevalansını belirlemek için yaptıkları araştırmalarında, toplam 116 nazal sekresyon örneğini direkt floresan antikor testi (FAT) ile, aynı sığırlardan aldıkları kan örneklerini ise ticari olarak temin ettikleri ELISA kitiyle incelemişlerdir. Araştırıcılar, sığırlarda BHV-1 antijenlerinin prevalansını %23.28 (27/116), BHV-1 antikorlarının ortalama prevalansı ise %48.28 (56/116) olarak tespit etmişlerdir. Đspanya’nın Galicia bölgesindeki sığırlarda BHV-1’e karşı serum antikorlarının prevalansının belirlendiği iki sörvey çalışmasının sonuçlarının bildirildiği bir araştırmada (Eiras ve ark. 2009) birinci sörvey çalışması 2000 yılında bölgenin tüm sığır populasyonunda, ikincisi 2004 yılında aynı bölgede ADSG (Sağlık Koruma Ekipleri) tarafından sevk ve idare edilen bir grup çiftlikteki sürülerde yapılmıştır. Bölgedeki tüm süt ve besi sürülerindeki 1 yaşın üzerindeki hayvanlardan alınan kan serum örneklerinin indirekt ELISA ile test edildiği 2000 yılında yapılan ilk sörvey çalışmasında; ortalama bireysel hayvan ve sürü prevalansı, sırasıyla, %38.4 (%37.3-%39.5 arasında değişen; %43.2 süt sığırları, %26.8 besi sığırları) ve %50.4 (%46.4-%54.4 arasında değişen; %58.3 süt sığırları, %48.1 besi sığırları) olarak tespit edilmiştir. 2004 yılında gerçekleştirilen ikinci sörvey çalışmasında ADGS çiftliklerinin sürü ve hayvan nezdinde ortalama prevalansı, sırasıyla, %47.2 (%44.9-%49.5; %51.5 süt sığırları, %45.2 besi sığırları, %42.3 karışık) ve %35.7 (%35.3-%36.1; %37.8 süt sığırları, %33.1 besi sığırları, %25.5 karışık) olarak tespit edilmiştir. Sonuç olarak, dünyanın değişik ülkelerindeki süt ve besi sığırlarında %0-%85.8 arasında değişen seroprevalans oranları bildirilmiştir. IBR Türkiye’de ilk kez 1987 yılında Burgu ve Akça (1987) tarafından 18 ay yaştaki bir sığırın burun akıntısı materyalinden izole edilmiş ve o günden bu yana da ülkenin değişik yerlerinde BHV-1 enfeksiyonlarının varlığı genellikle SNT kullanılarak serolojik yöntemlerle ortaya konulmuştur. Bu araştırmalar sonucunda ülke genelinde %15.8-%61.17 arasında değişen seropozitivite oranları belirlenmiştir. Erhan ve ark. (1971) Đnanlı Çiftliği ve Karacabey Harası’ndaki 100 sığıra ait kan örneğinde SNT’ni kullanarak yaptıkları çalışmada, BHV-1 spesifik nötralizan antikor oranını %28 olarak tespit etmişlerdir. Gürtürk ve ark. (1974), Doğu ve Orta Anadolu Bölgeleri’nden alınan 928 adet sığır kan serumunda BHV-1’e karşı %56.1 oranında nötralizan antikor varlığı saptamışlardır. Burgu ve Akça’nın (1982) yaptığı bir
çalışmada, Gelemen Devlet Üretme Çiftliği’ne ait 61 adet sığır kan serumunda %55.73 oranında BHV-1 spesifik nötralizan antikoru tespit edilmiştir. Çabalar ve Can-Şahna (2000), Doğu ve Güneydoğu Anadolu Bölgesi’nde bulunan 12 özel ve 5 kamu işletmesine ait süt sığırlarından topladıkları 471 kan serumunu BHV-1, Parainfluenza Virus-3 (PIV-3) ve Respiratory Syncytial Virus (RSV) spesifik antikorlar yönünden SNT ile kontrol etmişlerdir. Araştırıcılar, BHV-1’e karşı işletme bazında ve işletmeler genelinde sırasıyla %94.1 (17 işletmeden 16’sında) ve %52.4 olmak üzere seropozitiflik oranları saptamışlardır. Yıldırım ve Burgu (2005), Kuzeydoğu Anadolu bölgesindeki sığırlarda mavidil (BT), IBR, PIV-3, Enzootic Bovine Leucosis (EBL) virus enfeksiyonlarının seroprevalanslarını araştırmak amacıyla 8 ildeki özel sektöre ait organize yetiştiricilik yapılan ve aile işletmelerinde bulunan sığırlardan aldıkları toplam 506 kan serumu örneğini mikronötralizasyon testine tabi tutarak, IBR virusuna karşı %59.48 oranında bir seropozitiflik belirlemişlerdir. Yavru ve ark. (2005), Konya Et ve Balık Kurumu Mezbahası’ndaki farklı yaş, cinsiyet ve ırktaki sığırlardan aldıkları toplam 254 kan serumu örneğini (mNT) ile BAV- 1, 2 ve 3, IBR/IPV, PIV-3, BRSV ve BVDV nötralizasyon antikorları yönünden kontrol ederek, 145 (% 57.08) hayvanda IBR/IPV virusuna karşı nötralizan antikor varlığı tespit etmişlerdir. Bulut ve ark. (2006), süt sığırcılığı işletmelerinde BHV-1 ve Bovine Viral Diarrhoea Virus (BVDV) enfeksiyonlarının durumlarını belirlemek amacıyla yaptıkları araştırmalarında, 2000–2006 yılları arasında Konya ve çevresinde bulunan 35 farklı işletmedeki toplam 6418 sığırdan rastgele örnekleme metodu ile 1288 adet kan numunesi toplayarak, kan örneklerini BHV–1 ve BVDV’una karşı antikor varlığı, BVDV’una karşı ise ayrıca antijen varlığı yönünden ELISA ile incelemişlerdir. Đnceledikleri kan serumlarından 204 (%15.8)’ünü BHV-1’e, 693 (%53.8)’ünü de BVDV’una karşı oluşan antikorlar yönünden seropozitif olarak belirlemişlerdir. Okur-Gümüşova ve ark. (2007), Türkiye’ nin Samsun ilindeki aşılanmamış, 1-3 yaş arasındaki 188 sığırdan aldıkları kan serumu örneklerini, SNT’ ni kullanarak, sığırlarda solunum sistemi hastalıklarına neden olan 5 virusa (BHV-1, BVDV, PIV-3, BAV-1 ve BAV-3) karşı antikorlar yönünden test ederek, BHV-1’ e karşı % 61.17 oranında bir seropozitiflik tespit etmişlerdir. Yeşilbağ ve Güngör (2007), Marmara bölgesinde bulunan 7 ildeki 39 sığırcılık işletmesinden topladıkları toplam 584 kan serumu örneğini BHV-1, BVDV,