T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ACİL TIP ANABİLİM DALI
DENEYSEL ÖZOFAGUS VE MİDE ALKALİ KOROZİV
YANIKLARINDA HYPERİCUM PERFORATUM’UN
(SARI KANTARON) İYİLEŞTİRİCİ ETKİSİNİN
ARAŞTIRILMASI
UZMANLIK TEZİ
Dr. Erkan GÜVENÇ
Bornova-İZMİR 2014
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ACİL TIP ANABİLİM DALI
DENEYSEL ÖZOFAGUS VE MİDE ALKALİ KOROZİV
YANIKLARINDA HYPERİCUM PERFORATUM’UN
(SARI KANTARON) İYİLEŞTİRİCİ ETKİSİNİN
ARAŞTIRILMASI
UZMANLIK TEZİ
Dr. Erkan GÜVENÇ
TEZ DANIŞMANI
Doç. Dr. G. SELAHATTİN KIYAN
ARAŞTIRMACILAR
Doç. Dr. YİĞİT UYANIKGİL
Yrd. Doç. Dr. E. ÖYKÜ ÇETİN UYANIKGİL
Uzm. Biyolog FATİH KARABEY
Uzm. Dr. TÜRKER ÇAVUŞOĞLU
Biyolog BURAK GÖKÇE
Ege Üniversitesi Bilimsel Araştırma Projeleri Fonu tarafından 2013TIP-079 no’lu proje olarak desteklenmiştir.
Bornova-İZMİR 2014
TEŞEKKÜR
Uzmanlık eğitimim süresince, gerek tıbbi, gerekse diğer konularda engin bilgi ve deneyimlerini büyük bir özveri ile bize aktaran, her konuda bize yol gösteren, bilgi ve deneyimini esirgemeyip, her türlü yardımda bulunan, Doç. Dr. Murat Ersel, Doç. Dr. Selahattin Kıyan,Yrd. Doç. Dr. Funda Karbek Akarca, Uzm. Dr. Yusuf Ali Altuncı, Uzm. Dr. İlhan Uz, Uzm. Dr. Enver Özçete’ye, asistanlığım süresince güzellik, dostluk ve yardımlarını paylaştığım ikinci ailem olan tüm acil tıp asistan arkadaşlarıma, öğretim üyesi hocalarıma, tezin hazırlanması sırasında bilgi, beceri ve deneyimlerini benimle paylaşan, her türlü desteğini gördüğüm başta tez danışmanım Doç. Dr. Selahattin Kıyan ve Doç. Dr. Yiğit Uyanıkgil olmak üzere, Yrd. Doç. Dr. Emel Öykü Çetin Uyanıkgil, Uzm. Biyolog Fatih Karabey, Biyolog Burak Gökçe, Uzm. Dr. Türker Çavuşoğlu’na, asistanlık eğitimim boyunca hep birlikte çalışmaktan büyük zevk aldığım ve ayrıca da yaşamımda ayrı yerleri olan tüm çalışma arkadaşlarıma, desteklerinden dolayı Ege Üniversitesi BAP kuruluna,
Eğitim hayatım boyunca hep yanımda olup, zorluklara göğüs germemde hem en büyük silahım hem de en büyük kalkanım aileme, eşime ve kızıma teşekkürü borç biliyorum.
İÇİNDEKİLER
Sayfa ŞEKİLLER DİZİNİ... vi TABLOLAR DİZİNİ ... viii KISALTMALAR ... xi ÖZET ... xii ABSTRACT ... xiv 1-GİRİŞ VE AMAÇ ...1 2-GENEL BİLGİLER ...3 2.1. ÖZOFAGUS EMBRİYOLOJİSİ ...3 2.2. ÖZOFAGUS HİSTOLOJİSİ ...3 2.2.1. Tunica Mukoza ...3 2.2.2. Tela Submucoza ...3 2.2.3. Tunica Muscularis ...4 2.2.4. Tunika Adventisya ...4 2.3. ÖZOFAGUS ANATOMİSİ ...5 2.3.1. Özofagusun Bölümleri ...5 2.3.1.1. Pars Cervicalis ...5 2.3.1.2. Pars Thoracica ...5 2.3.1.3. Pars Abdominalis ...62.3.2. Özofagusun Anatomik Darlıkları ...7
2.3.3. Özofagus Sfinkterleri ...7
2.3.4. Özofagusun Damar ve Sinirleri ...8
2.4. ÖZOFAGUS FİZYOLOJİSİ ...8 2.5. MİDE EMBRİYOLOJİSİ ...9 2.6. MİDE HİSTOLOJİSİ ... 10 2.6.1. Tunica mukoza ... 10 2.6.2. Tunica submukoza ... 12 2.6.3. Tunica muscularis ... 12 2.6.4. Tunica seroza ... 12
2.7. MİDE BÖLÜMLERİNE GÖRE HİSTOLOJİ ... 13
2.7.1. Kardia... 13
2.7.2. Fundus ve korpus ... 13
2.7.2.1. Kök hücreler... 14
2.7.2.2. Müköz boyun hücreleri ( kollum hücreleri ) ... 14
2.7.2.4. Şef hücreler ( Chief, esas, zimojen, peptik hücreler ) ... 15 2.7.2.5. Enteroendokrin hücreler ... 16 2.7.3. Pilor ... 16 2.8. MİDE ANATOMİSİ ... 16 2.8.1 Midenin Bölümleri ... 17 2.8.1.1 Pars kardiyaka ... 17 2.8.1.2 Fundus gastrikus ... 18 2.8.1.3 Korpus gastrikus ... 18 2.8.1.4 Pars pilorika ... 18 2.8.1.5 Pilorus ... 18
2.8.2. Midenin damar ve sinirleri ... 18
2.9. MİDENİN FİZYOLOJİSİ ... 19
2.10. KOROZİV YANIKLAR ... 20
2.10.1. Görülme Sıklığı ve Fizyopatoloji ... 21
2.10.2. Koroziv maddeler ... 23
2.10.3. Koroziv madde yanıklarının dereceleri ... 26
2.10.4. Koroziv madde yanıklarının histopatolojik evreleri ... 26
2.10.4.1. Birinci evre: Akut nekrotik faz (1-4 gün arası) ... 26
2.10.4.2. İkinci evre: Subakut faz (4-15 gün) ... 26
2.10.4.3. Üçüncü evre: Skatrizasyon fazı (15-28) ... 27
2.10.5. Klinik ... 29 2.10.6. Tanı ... 30 2.10.7. Tedavi ... 32 2.10.8. Komplikasyonları ... 34 2.10.8.1. Erken Dönem ... 34 2.10.8.2. Geç Dönem ... 34 2.11. KORUYUCU HEKİMLİK ... 35
2.12. TEDAVİDE GÜNCEL SORUNLAR ... 35
2.13. HYPERİCUM PERFORATUM (SARI KANTARON) ... 36
2.13.1. Hypericum perforatum’un Sistematiği ... 37
2.13.2. Hypericum perforatum’un Genel Özellikleri ... 38
2.13.3. Hypericum perforatum’un Aktif Bileşenlerinin Yapıları ... 40
2.14. SERBEST OKSİJEN RADİKALLERİ... 42
2.14.1. Serbest Radikallerin Tepkimeleri ... 43
2.14.2. Serbest Oksijen Radikallerinin Organizmadaki Etkileri ... 43
2.14.3. Lipid Peroksidasyonu ... 45
2.15.1. MDA (Malondialdehyde) ... 46
2.15.2. SOD (Superoxide dismutas) ... 47
2.15.3. Katalaz (CAT) ... 48
2.15.4. Glutatyon peroksidaz (GPX) ... 49
3-MATERYAL METOD ... 50
3.1. DENEYSEL GEREÇ VE YÖNTEM ... 50
3.1.1. Deneysel Gereçler ve Kullanılan İlaçlar ... 50
3.1.1.1. Deneysel Gereçler... 50
3.1.1.2. Kullanılan İlaçlar ... 51
3.1.1.3. Sarı Kantaron Bitkisinin Ekstraksiyonu ve Analizi... 52
3.1.1.4. Sarı Kantaron İçeren Oral Formulasyonun Hazırlanması ... 55
3.1.1.5. Sarı Kantaron İçermeyen Boş Jelin Hazırlanması ... 56
3.1.2. Deneklerin Gruplandırılması ve Deneysel Yöntem ... 57
3.2. MİKROSKOPİK GEREÇ VE YÖNTEM ... 61
3.2.1. Işık Mikroskopik Gereç ... 61
3.2.2. Işık Mikroskopik Yöntem ... 61
3.2.3. Işık Mikroskopik Boyama ... 63
3.2.3.1. Hematoksilen-Eozin Boyama ... 63
3.2.3.2. Mallory Azan Boyama ... 64
3.3. HİSTOPATOLOJİK YÖNTEM ... 65
3.4. BİYOKİMYASAL YÖNTEM ... 68
3.5. İSTATİKSEL YÖNTEM ... 74
4-BULGULAR ... 75
4.1. Özofagus Histopatolojik Bulgular ... 75
4.2. Mide Histopatolojik Bulgular ... 77
4.3. Ağırlık İstatiksel Bulgular ... 81
4.4. ÖzofÜagus Histopatolojik Bulguların İstatiksel Analizi ... 91
4.5. Mide Histopatolojik Bulguların İstatiksel Analizi ... 100
4.6. Özofagus Stenoz İndeksi Ve Epitel Kalınlığının İstatiksel Analizi ... 112
4.7. Enzimlerin İstatiksel Analizi... 114
4.8. Gruplar Arası Stenoz İndeksi, Epitel Kalınlığı Ve Enzimlerin İstatiksel Analizi ... 118
4.9. Sitotoksitenin İstatiksel Analizi ... 125
5-TARTIŞMA ... 126
6-SONUÇLAR ... 148
ŞEKİLLER DİZİNİ
Şekil No Sayfa No
Şekil 1: Özofagus Histolojik Yapısı ... 4
Şekil 2: Özofagus Anatomik Bölümleri ... 6
Şekil 3: Mide histolojik kesit ...10
Şekil 4: Gastrik bezin histolojik yapısı ...13
Şekil 5: Mide Bölümleri ...17
Şekil 6: Hypericum perforatum L.’nin görünümü...38
Şekil 7: Hiperforin ve adhiperforin kimyasal yapısı ...40
Şekil 8: Hiperisin ve psödohiperisin kimyasal yapısı ...41
Şekil 9: Protohiperisin ve protopsödohiperisin kimyasal yapısı ...41
Şekil 10: Rutin, hiperozit, izokersitrin, kersitrin ve kersetin kimyasal yapısı ...42
Şekil 11: Oksijen Radikallerinin Hücresel Kaynakları ...44
Şekil 12: Lipid peroksidasyonunun şeması ...45
Şekil 13: MDA’nın kimyasal yapısı ...46
Şekil 14: SOD ile dismutasyon ...47
Şekil 15: CAT, SOD ve GPX reaksiyonları ...48
Şekil 16: Hiperforin standardına ait kromatogram 270 nm RT: 50.80 ...54
Şekil 17: Psödohiperisin standardına ait kromatogram 590 nm RT: 44.89 ...54
Şekil 18: Hiperisin standardına ait kromatogram 590 nm RT: 53.73 ...54
Şekil 19: Ekstre örneğinin analizlerine ait kromatogramlar 270 ve 590 nm ...55
Şekil 20: H.Perforatum oral formulasyon ve boş jel formulasyonu ...56
Şekil 21: Deney hayvanlarının kafes görünümleri ...57
Şekil 22: İnfant feeding sonda görünümü ...58
Şekil 23: Feeding sondanın deney hayvanına uygulanması...59
Şekil 24: Diseksiyon aşamalarının sıralı görünümleri ...60
Şekil 25: Diseksiyon sonrası organların görünümü...60
Şekil 26: Mide diseksiyonu ...61
Şekil 27: Histolojik kesit alma ve boyama için kullanılan ekipman görünümü ...62
Şekil 28: Histopatolojik ve biyokimyasal olarak incelenecek örneklerin hazırlanması...65
Şekil 29: Özofagus epitel kalınlığı ölçümünün Image-Pro Express 4.5 (Media Cybernetics, inc. USA) programı kullanılarak gösterilmesi ...67
Şekil 31: Stenoz indeksi hesaplama. Randomize olarak özofagus duvarının 4 farklı yerden
ölçümü ve lümen çapı ölçümü ...68
Şekil 32: Canlılık oranı hesaplanma formülü ...70
Şekil 33: Sitotoksisitede kullanılacak olan fibroblastların kültivasyon işlemleri ...71
Şekil 34: Sitotoksisiste MTT testi ...72
Şekil 35: İn vitro testler için kullanılan fibroblastların pasajlanması ...72
Şekil 36: İn vitro sitotoksisite testi için kullanılan fibroblastların pasajlanmaları ve mikroskobik gözlemi ...73
Şekil 37: İn vitro testlerde kullanılan insan erişkin dermal fibroblastlarının kültür ortamındaki mikroskobik görünümleri ...73
Şekil 38: Özofagusa ait tüm grupların histopatolojik görünümü. ...77
Şekil 39: Mideye ait tüm grupların histopatolojik görünümü...79
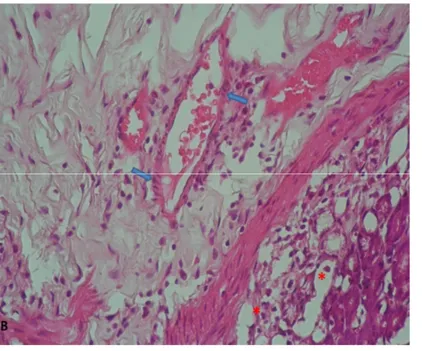
Şekil 40: Yanık grubu mide dokusuna ait histopatolojik görünüm ...80
Şekil 41: Tedavi grubu mide dokusuna ait histopatolojik görünüm ...81
TABLOLAR DİZİNİ
Tablo No Sayfa No
Tablo 1: Koroziv maddeler ... Tablo 2: Yaralanma şiddetinin endoskopik olarak evrelendirilmesi ...
(Di Costanzo Gradeleme Sistemi)...
Tablo 3: İnsan dokularının Cu, Zn-SOD içeriği ... Tablo 4: İnsan dokularının Katalaz ve GPX içeriği ... Tablo 5: HPLC analiz metodu ... Tablo 6: H.perforatum ekstresinin kimyasal içeriği... Tablo 7: Çalışma grupları………..
Tablo 8: Histopatolojik Skorlama……… ... Tablo 9: Ağırlık değerlerinin, birbirinden bağımsız gruplar arası karşılaştırmaları ... Tablo 10: Deney Grupları Ağırlık / Kruskal Wallis Test ... Tablo 11: Deney Grup 1 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 12: Grup 1 Ağırlık Friedman Test Analiz ... Tablo 13: Grup 1 Ağırlık box-pilot analiz ... Tablo 14: Deney Grup 2 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 15: Grup 2 Ağırlık Friedman Test Analiz ... Tablo 16: Grup 2 Ağırlık box-pilot analiz ... Tablo 17: Deney Grup 3 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 18: Grup 3 Ağırlık Friedman Test Analiz ... Tablo 19: Grup 3 Ağırlık box-pilot analiz ... Tablo 20: Deney Grup 4 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 21: Grup 4 Ağırlık Friedman Test Analiz ... Tablo 22: Grup 4 Ağırlık box-pilot analiz ... Tablo 23: Deney Grup 5 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 24: Grup 5 Ağırlık Friedman Test Analiz ... Tablo 25: Grup 5 Ağırlık box-pilot analiz ... Tablo 26: Deney Grup 6 / Grup içi ölçülen ağırlık değerlerinin karşılaştırılması ... Tablo 27: Grup 6 Ağırlık Friedman Test Analiz ... Tablo 28: Grup 6 Ağırlık box-pilot analiz ... Tablo 29: Submukozal Kollajen Birikimi * Deney Grupları Çapraz Tablo ... Tablo 30: Submukozal Kollajen Birikimi * Deney Grupları 1 ve 2 ...
Tablo 31: Submukozal Kollajen Birikimi * Deney Grupları 1 ve 3 ... Tablo 32: Submukozal Kollajen Birikimi * Deney Grupları 1 ve 4 ... Tablo 33: Submukozal Kollajen Birikimi * Deney Grupları 1 ve 5 ... Tablo 34: Submukozal Kollajen Birikimi * Deney Grupları 1 ve 6 ... Tablo 35: Muskülaris Mukoza Hasarı * Deney Grupları Çapraz Tablo ... Tablo 36: Muskülaris Mukoza Hasarı * Deney Grupları 1 ve 2 ... Tablo 37: Muskülaris Mukoza Hasarı * Deney Grupları 1 ve 3 ... Tablo 38: Muskülaris Mukoza Hasarı * Deney Grupları 1 ve 4 ... Tablo 39: Muskülaris Mukoza Hasarı * Deney Grupları 1 ve 5 ... Tablo 40: Muskülaris Mukoza Hasarı * Deney Grupları 1 ve 6 ... Tablo 41: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları Çapraz Tablo ... Tablo 42: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları 1 ve 2 ... Tablo 43: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları 1 ve 3 ... Tablo 44: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları 1 ve 4 ... Tablo 45: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları 1 ve 5 ... Tablo 46: Tunika Muskülaris Hasarı ve Kollajen Birikimi * Deney Grupları 1 ve 6 ... Tablo 47: Mukozal PMNL İnfiltrasyonu * Deney Grupları Çapraz Tablo ... Tablo 48: Mukozal PMNL İnfiltrasyonu * Deney Grupları 1 ve 2 ... Tablo 49: Mukozal PMNL İnfiltrasyonu * Deney Grupları 1 ve 3... Tablo 50: Mukozal PMNL İnfiltrasyonu * Deney Grupları 1 ve 4... Tablo 51: Mukozal PMNL İnfiltrasyonu * Deney Grupları 1 ve 5... Tablo 52: Mukozal PMNL İnfiltrasyonu * Deney Grupları 1 ve 6... Tablo 53: Mukozal Ödem * Deney Grupları Çapraz Tablo ... Tablo 54: Mukozal Ödem * Deney Grupları 1 ve 2 ... Tablo 55: Mukozal Ödem * Deney Grupları 1 ve 3 ... Tablo 56: Mukozal Ödem * Deney Grupları 1 ve 4 ... Tablo 57: Mukozal Ödem * Deney Grupları 1 ve 5 ... Tablo 58: Mukozal Ödem * Deney Grupları 1 ve 6 ... Tablo 59: Gastrik Bez Dilatasyonu * Deney Grupları Çapraz Tablo ... Tablo 60: Gastrik Bez Dilatasyonu * Deney Grupları 1 ve 2... Tablo 61: Gastrik Bez Dilatasyonu * Deney Grupları 1 ve 3... Tablo 62: Gastrik Bez Dilatasyonu * Deney Grupları 1 ve 4... Tablo 63: Gastrik Bez Dilatasyonu * Deney Grupları 1 ve 5... Tablo 64: Gastrik Bez Dilatasyonu * Deney Grupları 1 ve 6...
Tablo 65: Submukozal PMNL İnfiltrasyonu * Deney Grupları Çapraz Tablo ... Tablo 66: Submukozal PMNL İnfilitrasyonu * Deney Grupları 1 ve 2 ... Tablo 67: Submukozal PMNL İnfilitrasyonu * Deney Grupları 1 ve 3 ... Tablo 68: Submukozal PMNL İnfilitrasyonu * Deney Grupları 1 ve 4 ... Tablo 69: Submukozal PMNL İnfilitrasyonu * Deney Grupları 1 ve 5 ... Tablo 70: Submukozal PMNL İnfilitrasyonu * Deney Grupları 1 ve 6 ... Tablo 71: Deney Grupları Stenoz İndeksi ve Epitel Kalınlığı Çapraz Tablo ... Tablo 72: Deney Grupları Stenoz İndeksi ve Epitel Kalınlığı / Kruskal Wallis Test ... Tablo 73: Gruplar Arası Stenoz İndeksi box-pilot analizi ... Tablo 74: Gruplar Arası Epitel Kalınlığı box-pilot analizi ... Tablo 75: Deney Grupları Enzimler Çapraz Tablo ... Tablo 76: Deney Grupları Enzimler / Kruskal Wallis Test ... Tablo 77: Gruplar Arası MDA box-pilot analizi ... Tablo 78: Gruplar Arası CAT box-pilot analizi ... Tablo 79: Gruplar Arası SOD box-pilot analizi ... Tablo 80: Gruplar Arası GPX box-pilot analizi ... Tablo 81: Grup 1 ve 2 Karşılaştırma / Mann-Whitney Testi... Tablo 82: Grup 1 ve 3 Karşılaştırma / Mann-Whitney Testi... Tablo 83: Grup 1 ve 4 Karşılaştırma / Mann-Whitney Testi... Tablo 84: Grup 1 ve 5 Karşılaştırma / Mann-Whitney Testi... Tablo 85: Grup 1 ve 6 Karşılaştırma / Mann-Whitney Testi... Tablo 86: Grup 2 ve 3 Karşılaştırma / Mann-Whitney Testi... Tablo 87: Grup 2 ve 4 Karşılaştırma / Mann-Whitney Testi... Tablo 88: Grup 2 ve 5 Karşılaştırma / Mann-Whitney Testi... Tablo 89: Grup 2 ve 6 Karşılaştırma / Mann-Whitney Testi... Tablo 90: Grup 3 ve 4 Karşılaştırma / Mann-Whitney Testi... Tablo 91: Grup 3 ve 5 Karşılaştırma / Mann-Whitney Testi... Tablo 92: Grup 3 ve 6 Karşılaştırma / Mann-Whitney Testi... Tablo 93: Grup 4 ve 5 Karşılaştırma / Mann-Whitney Testi... Tablo 94: Grup 4 ve 6 Karşılaştırma / Mann-Whitney Testi... Tablo 95: Grup 5 ve 6 Karşılaştırma / Mann-Whitney Testi... Tablo 96: Özofagus yanığı tarihçesi ... Tablo 97: Gastrointestinal sistem ve derideki yara iyileşmesi süreçlerinin karşılaştırılması ....
KISALTMALAR
°C: Celcius°F: Fahrenheit
AIDS: Akut İmmün Yetmezlik Sendromu Cm: Santimetre CO: Karbonmonoksit CO2: Karbondioksit H&E: Hematoksilen-Eozin Boyama HPLC: Yüksek basınç sıvı kromatografisi Hy: Hyperisin IP: İntraperitoneal Kg: Kilogram NS: Normal Salin SF: Serum Fizyolojik
USA: Amerika Birleşik Devletleri ATP : Adenozin trifosfat NO : Nitrik oksit VIP : Vazoaktif İntestinal Polipeptid
GER : Granüllü Endoplazmik Retikulum
PAS : Peryodik Asit Shift K-ATPaz : Potasyum adenozin trifosfataz
NaOH : Sodyum Hidroksit OH- : Hidroksil İyonu H+ : Hidrojen iyonu F : French
KOH : Potasyum Hidroksit Ba(OH)2 : Baryum Hidroksit Ca(OH)2 : Kalsiyum Hidroksit NH3: Amonyak
NH2-OH : Hidroksilamin H2SO4 : Sülfirik asit HCl : Hidrojen klorür LiOH : Lityum Hidroksit VEGF: Vasküler Endotelyal Büyüme Faktörü
FGF: Fibroblast Büyüme Faktörü TGF– β: Transforme Edici Büyüme Faktörü
EGF: Epitelyal Büyüme Faktörü PDGF: Trombosit Büyüme Faktörü
IFN–γ: İnterferon γ H2O2: Hidrojen Peroksit ONOO- : Peroksinitriti NADPH : Nikotinamid Adenin Dinükleotid Fosfat
LO• : Lipid Oksi Radikali OH• : Hidroksil radikali NO• : Nitrik Oksit Radikal O2• – : Süperoksit Radikal Cu: Bakır
Fe: Demir Zn : Çinko
Mn : Mangan
SOD: Süperoksit Dismutaz CAT: Katalaz
GPX : Glutatyon Peroksidaz MDA : Malondialdehyde TBA : Tiyobarbutirik Asit GSH : Glutatyon Trx/TrxR : Tiyoredoksin /Tiyoredoksin Redüktaz Ref-1 : Redoks faktör-1 DNA : Deoksiribonükleik asit AREL : Araştırma ve Eğitim Laboratuvarı
DAD : Diode Array Detector Na-CMC : Sodyum Karboksimetilselüloz MC : Metil selüloz HPC : Hidroksipropilselüloz HPMC:Hidroksipropilmetilselüloz PVA : Polivinil alkol
Sİ : Stenoz indeksi
PMNL: Polimorfonükleer Lökosit MTT: (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide
PBS: Fosfat tampon solüsyonu LC50: Letal konsantrasyon 50 DMSO: Dimetil sülfoksit
ÖZET
DENEYSEL ÖZOFAGUS VE MİDE ALKALİ KOROZİV YANIKLARINDA HYPERİCUM PERFORATUM’UN (SARI KANTARON) İYİLEŞTİRİCİ
ETKİSİNİN ARAŞTIRILMASI
GÜVENÇ, Erkan
Tıpta Uzmanlık Tezi, Ege Üniversitesi Tıp Fakültesi Acil Tıp AD.
Tez Danışmanı: Doç. Dr. G. SELAHATTİN KIYAN
AMAÇ: Koroziv yanıklarda en sık etyolojik neden alkali maddeler olduğu için, Hypericum Perforatum’un deneysel özofagus ve mide alkali koroziv yanık modelinde etkili olup olmadığının belirlenmesidir. ve yeni tedavi arayışlarına ışık tutması amaçlandı.
YÖNTEM: Araştırmada 42 adet, 200-300 gram ağırlığında, Wistar Albino sıçanlar seçildi.
Koroziv maddeler ve diğer ajanlar sıçan ağzından girilip servikal özofagus seviyesinde sonlandırılan bir infant feeding tüp ile verildi. Grup 1’e (kontrol grubu) herhangi bir işlem veya tedavi uygulanmadı. Grup 2’de (yanık grubu) sodyum hidroksit (%5 NaOH, 0.2 ml) ile hafif-orta derecede koroziv yanık oluşturulduktan ve serum fizyolojik ile irrigasyondan sonra herhangi bir tedavi metodu uygulanmadı. Grup 3’ te (kantaron grubu) koroziv yanık oluşturulduktan sonra Hypericum perforatum’un oral formulasyon formu 50 mg/kg/gün verildi. Grup 4’ e (plasebo grubu) koroziv yanık oluşturduktan sonra aynı orana sahip dozda boş jel uygulandı. Deneysel yanık modelinin olmadığı Grup 5’ te (normal doku etki grubu) Hypericum perforatum’un normal doku üzerine etkisini incelemek için oral formulasyon aynı oranda uygulandı. Deneysel yanık modelinin olmadığı Grup 6’ da (normal doku plasebo grubu) ise boş jel formulasyonundan aynı dozda uygulandı. 14 gün süren (subakut dönem) bu işlemlerden sonra 15. gün diseksiyon uygulanarak alınan özofagus, mide ve karaçiğer doku örneklerinden, histopatolojik ve biyokimyasal parametrelere (SOD, GPX, MDA, CAT) bakıldı. Uygulanan ilaç formulizasyonunun fibroblastlar üzerine sitotoksitesi için invitro koşullarda erişkin insan dermal fibroblast hücre hattı kullanıldı.
BULGULAR: Ağırlık değerlerinin karşılaştırmasında Grup 1, 3, 4 ve 6 da ağırlık artışı saptanırken, Grup 2’ de ağırlık kaybı saptandı, Grup 5’ te ise anlamlı bir fark saptanmadı. Ağır yanık bulgusu olan muskülaris mukoza hasarı açısından tüm grupların karşılaştırılmasında anlamlı bir fark saptanmadı. Özofagusun histopatolojik değerlendirilmesi
sonucunda, inflamasyon bulgusu olan; submukozal kollajen birikimi, tunika muskülaris hasarı ve kollajen birikimi açısından, kontrol grubu ve kantaron grubu arasında anlamlı bir fark saptanmadı. Mide dokusunun histopatolojik değerlendirilmesi sonucunda, mukozal hasarı gösteren; PMNL infiltrasyonu, mukozal ödem, gastrik bez dilatasyonu ve submukozal PMNL infiltrasyonu açısından kontrol grubu ve kantaron grubu arasında anlamlı fark saptanmadı. Özofagus hasarı ve etkilenme derecesini gösteren, stenoz indeksi ve epitel kalınlığı ile oksidatif stres parametrelerinin değerlendirilmesi sonucunda; gruplar arasında Süperoksit dismutaz (SOD) ve Glutatyon peroksidaz (GPX) değerleri açısından anlamlı fark saptanmadı. Kontrol grubu ve kantaron grubu arasında yapılan analizde; stenoz indeksi, epitel kalınlığı ve lipid peroksidasyonunu gösteren Malondialdehid (MDA) arasında anlamlı fark saptanmışken, Katalaz (CAT) değerleri arasında anlamlı fark saptanmadı. Yanık grubu ve kantaron grubu arasında yapılan analizde; Stenoz indeksi, epitel kalınlığı ve MDA arasında anlamlı fark saptanmasına karşın CAT değerleri arasında ise anlamlı fark saptanmadı. H.Perforatum formulasyonunun verildiği Grup 3 ve Grup 5’te ise MDA düzeylerinde artış saptandı. Oral formulasyonun insan dermal fibroblastlarına uygulanması sonucunda sitotoksite gözlenmedi.
TARTIŞMA: Bu çalışmada acil kliniğe kaza veya suicidal amaçlı koroziv alımlarda
başvurular, ağızdan alım sebebiyle oldugu için sıçan ağzından girilip servikal özofagus seviyesinde sonlandırılan infant feeding tüp ile koroziv maddeler ve diğer ajanlar verildi. Yanık iyileşmesinde histopatolojik olarak, tedavi grubuyla yanık grubu arasında belirgin farklılıklar mevcutken, kontrol grubuyla tedavi grubunun benzer olduğu gözlendi. Antioksidan özelliği olan Hypericum perforatum’ un lipid peroksidasyonunu gösteren MDA düzeylerine bakıldığında sayısal olarak belirgin bir fark olmamasına rağmen, oral formulasyonun uygulandığı grup 3 ve grup 5’ te istatiksel olarak anlamlı fark bulundu. Bu durumun ise enzimsel fonksiyonu etkileyen ve tam olarak netleşmemiş birçok mekanizmayla etkilenebileceği gibi daha önce benzer çalışmalarda da gözlenen çalışma süresinin etkisi olabileceği düşünüldü.Bu yüzden doz, formulasyon içeriği ve uygulama süresi çeşitliliğinde tekrar eden çalışmalar gerekmektedir. Bu çalışma sonucunda koroziv yanıkların tedavisinde ve yeni tedavi arayışlarında Hypericum perforatum’un iyileştirici etkilerinin göz önünde tutulması faydalıdır.
SONUÇ: Yanık iyileşmesinde histopatolojik olarak, tedavi grubuyla yanık grubu arasında
belirgin farklılıklar mevcutken, kontrol grubuyla tedavi grubunun benzer olduğu gözlendi. Lipid peroksidasyonunu gösteren MDA düzeylerine bakıldığında sayısal olarak belirgin bir
fark olmamasına rağmen, oral formulasyonun uygulandığı grup 3 ve grup 5’te istatiksel olarak anlamlı fark bulundu. Bu çalışmada, 14 günlük H.Perforatum tedavisinin hafif-orta dereceli ve subakut dönemdeki alkali koroziv yanıklarında etkili olduğu gösterilmiştir.
Anahtar kelimeler: Özofagus, mide, koroziv, alkali, yanık, acil, hypericum perforatum, St.John’s Wort, sarı kantaron, in vitro sitotoksisite
ABSTRACT
INVESTIGATION HYPERICUM PERFORATUM (ST. JOHN'S WORT) THERAPEUTIC EFFECTS ON THE EXPERIMENTAL MODELS OF
ESOPHAGEAL AND GASTRIC ALKALI CORROSIVE BURNS
GÜVENÇ, Erkan
Supervisor: Assoc. Prof. Dr. G. Selahattin KIYAN, MD, PhD
OBJECTIVES: To survey Hypericum perforatum effects in the experimental models of
esophageal and gastric alkaline corrosive burns and intended to shed light on the search for new treatments.
METHOD: In current study, fourty two 200-300 g in weigth Wistar Albino rats (6 group,7
rat for per group) selected. Any interference and treatment in group 1 (control group). In group 2 (Burn group) firstly made corrosive burns with sodium hydroxide and than irrigation with saline. Any treatment used in group 2. In group 3 (treatment group) 50 mg/kg/day oral formation of Hypericum perforatum administration after made corrosive burn. In group 4 (placebo group) administration null gel, same Hypericum perforatum dose used. Same dose oral formation Hypericum perforatum was used in group 5 (normal histo group) for investigated effects on normal tissue. In group 6(normal histo placebo group) same dose null gel administrated. These interference made for 14 day and than dissection was make in fifteenth day . Histopathological and biochemical parameters investigated from the tissue samples.
RESULTS: Comparison of weights, gain of weight detected in group 1, 3, 4 and 6, weakening observed in Group 2 and any significant differences were found in group 5. As a result of the histopathological evaluation of the esophagus, there was no significant difference between Group 1 and Group 3 for submucosal collagen deposition, tunica muscularis in terms of damage and collagen deposition which were evidence of inflammation. In the comparison of groups, there was no significant difference for damages of muscularis mucosa which proved severe burns.
As a result of the histopathological evaluation of the stomach tissue, there was no significant difference between treatment group and the control group for PMNL infiltration,
mucosal edema, gastric dilatation and submucosal glands which were signs of mucosal damages.
Evaluation of results of stenosis index and the thickness of the epithelium showing the degree of esophageal damage and oxidative stress parameters; there was no significant difference between groups about value of superoxide dismutase (SOD) and glutathione peroxidase (GPX) .The statistical analysis of; stenosis index, indicating the epithelial thickness and malondialdehyde (MDA) which is sign of lipid peroxidation, significant differences was detected, but for values of the Catalase (CAT) any significant difference detected between group 1 and 3.Result of the statistical analysis significant difference was detected for stenosis index, epithelial thickness and MDA between Group 2 and Group 3. Although there was no significant difference between the values of CAT. Increase of MDA levels detected in group 3 and 5 which were treated with H.Perforatum formulation Cytotoxicity was not observed after implemented oral formulation in vitro to human dermal fibroblasts for investigation the effect to collagen tissue.
DISCUSSION: Significant differences between treatment group and burn group also treatment group was similar to the control group were observed for histopathologic signs of healing burns. Although there is no quantative distinct difference for in MDA levels, which indicating lipid peroxidation of Hypericum perforatum, but statistically significant difference was detected between group 3 and group 5(p<0.05). In these groups oral formulation were administered. This situation is not clarified by several mechanisms which affected enzymatic function. As previously observed in similar studies was thought to be the effect of working time. Therefore repeated studies must doing with differently dose, content of formulation and application time. As a result of this study, new treatments and therapeutic effects of Hypericum perforatum is helpful for treatment of corrosive burns.
Keywords: Esophagus, stomach, corrosive, alkaline burns, emergency, Hypericum perforatum, St.John 's Wort, in vitro cytotoxicity
1.GİRİŞ VE AMAÇ
Türkiye’de yöresel olarak binbirdelik otu, kan otu, kılıç otu, mayasıl otu, yara otu, kuzu kıran ve ingilizcede St. John’s wort adıyla bilinen Hypericum perforatum L. Hypericaceae familyasına dahil ve Avrupa, Asya, Kuzey Afrika ve Amerika Birleşik Devletlerinde yetişen çok yıllıklı bir ottur [1].
H. perforatum yüzyıllardır tıbbi amaçla kullanılmaktadır. Gerard, 1633’te H.perforatum L.’nin yara iyi edici olarak yanık tedavisinde ve zehirli hayvanlar ısırdığı
zaman kullanıldığını ifade etmiştir. 1619 yılında yazılan ilk farmakopede sarı kantaronun çiçeklerinden elde edilen yağdan bahsedilmiştir [2].
H.perforatum geleneksel folklorik ilaç olarak dahilen ağrı giderici, yatıştırıcı, parazit
düşürücü, ülser tedavi edici ve haricen de yara iyileştirici olarak ülkemizde kullanılmaktadır [3]. Ülkemizde 110 gram sarı kantaronun çiçekli olan uç dalları taze iken toplanır, bekletilmeden 1 kg zeytin yağının içine konur. Ağzı kapalı vaziyette bir cam kavanoz içinde tam 41 gün güneşin altında bekletilir. Sarı zeytin yağı ve sarı çiçekli kantaron bitkisi güneş altında olgunlaşırken koyu kırmızı bir renk alır. İşte bu yolla elde edilen kantaron yağı yukarıda belirtilen amaçlarla kullanılır [4].
H.perforatum üzerinde yapılan farmakolojik çalışmalar çoğunlukla bitkinin hypericin
ve hyperforinden kaynaklanan antidepresan etkisi üzerinedir. Yakın dönemde hafif ve orta şiddette depresyon için kullanımı dikkat çekmiştir [5-7]. Yapılan araştırmalarda bu bitkinin antitümör [8], antiviral [9], antimikrobiyal [10], antibakteriyel [11], analjezik [12], hepatoprotektif [13], gastroprotektif [14] etkilerinin de olduğu belirtilmiştir.
H.perforatum’dan ekstre edilen etken madde hypericinin çok sayıda virüse karşı etkili
olmasından dolayı AIDS tedavisinde kullanılabileceği belirlenmiştir [15].
Sadece bir kaç çalışmada, sistemik uygulamayı takiben in vivo antinflamatuar özellikleri belgelenmiştir. İn vitro çalışmalar H. perforatum ekstresi ya da içeriklerinin inflamatuar reaksiyon sürecindeki bazı basamakları inhibe ettiğini göstermiştir [12, 16, 17].
Özellikle H.perforatum ekstresi serbest radikal üretimini, myeloperoksidaz, siklooksijenaz-1, 5-lipoksijenaz ve indüklenebilir siklooksijenaz ve nitrik oksit sentaz basamaklarını inhibe eder [18-20].
Yapılan literatür taramasında koroziv özefagus ve mide yanık modellerinde H.
perforatum’ un etkisi üzerine klinik ve deneysel çalışmaların olmadığı, gastrik ülser ve
gastroprotektif etkilerinin ise oldukça az, yetersiz ve kıymetli olduğu dikkat çekmektedir. Bu nedenle uzun zamandır yanık ve yara iyileşmesi üzerine etkili olduğu düşünülen
H.Perforatum’un koroziv özofagus ve mide yanıklarına etkili olup olmadığının belirlenmesi
2. GENEL BİLGİLER
2.1 ÖZOFAGUS EMBRİYOLOJİSİ
Orofarengeal membran ile kloakal membran arasında uzanan primitif barsak tüpü ön, orta ve son olarak üç kısma ayrılır. Embriyoda gelişiminin 4. haftasından sonra ön barsakta trakeo-özofageal kıvrımlar belirir. Bu yapılar daha sonra birleşerek trakeo-özofageal septumu oluşturur. Gelişimin 6-7. haftaları arasında septumun ventralinden trakeobronşial yapılar, dorsalinden ise özofagus meydana gelir [21].
Gelişim sırasında özofagusun endodermal katı hızlı bir şekilde prolifere olarak lümeni kapatır, daha sonra rekanalizasyon lümen açılır. Çok katlı yassı epitel, mukozal ve submukozal bezler endodermden; lamina propria, muskularis mukoza, submukoza, kas tabakası ve adventisya mezodermden gelişir. Özofagus başlangıçta kısadır ancak kalp ve akciğerlerin gelişmesi ile uzar [21, 22].
Çevre mezenkim dokusundan meydana gelen dıştaki kas tabakasının üst 2/3 kısmı çizgilidir ve vagus siniri ile innerve edilir. Alt 1/3 özofagus ise düz kastan oluşmuştur ve splanik pleksusdan innerve olur [21, 23].
2.2. ÖZOFAGUS HİSTOLOJİSİ
Özofagus histolojik olarak dört tabakadan oluşmaktadır (Şekil 1).
2.2.1. Tunica Mukoza
Keratinize olmayan çok katlı yassı epitel ile örtülüdür. Aşağıda özefago-gastrik bileşkede kolumnar epitel ile uzanır. Lamina propria ve lamina muscularis mucosae’ya sahiptir. Lamina propria üst bölümünde gl.oesophagea propria olarak adlandırılan tübüloalveolar bezler, aşağıda kardiaya yakın bölümde gl.cardiaca oesaphagei olarak adlandırılan tübüler bezler bulunur. Buradaki bezler müküs salgılar [24].
2.2.2. Tela Submucoza
Gevşek bağ dokusundan oluşmuştur ve kolojen lifler, kan damarları, lenf kanalları, sinirler ve derin müköz bezleri içerir. Derin müköz bezler tubuloalveolar yapıdadır ve yaptıkları salgılar ile özofagus içeriğinin ısıtılmasını sağlarlar. Tela submukozada bezlerin ve
düz kasların fonksiyonlarını idare eden “pleksus nervorum submukosus (Meissner pleksusu)” bulunur [24].
2.2.3. Tunica Muscularis
İçte sirküler dışta longitudinal seyirli kaslardan oluşur. 1/3 üst bölümü çizgili kas, 1/3 alt bölümü düz kas ve 1/3 orta bölümü karışık yapıdadır. Özofagus başlangıç bölümündeki sirküler kas lifleri, sphincter pharygooesaphagealisi oluşturur. Kardioözofageal geçişte böyle bir anatomik sfinkter olmayıp, fizyolojik bir sfinkter vardır. Sirküler ve longitudinal seyirli kas katmanları arasında pleksus nervorum myentericus (Auerbach pleksusu) yer almaktadır [24].
2.2.4. Tunika Adventisya
Gevşek bağ dokusundan oluşan bu katman, özofagusu örter ve komşu yapılara bağlar. Paraözofageal doku, küçük damarları, lenfatik kanalları ve sinir liflerini içerir. Abdominal özofagusun dış kısmı tunica seroza (periton) ile kaplıdır. Özofagusun serozasının olmaması kolay delinme ve sonucunda mediastinit tehlikesini doğurmaktadır. Özellikle torasik özofagusta bu çok belirgindir [24].
2.3. ÖZOFAGUS ANATOMİSİ
Özofagus, krikoid kıkırdak seviyesinde farinksin alt ucundan başlayıp, mediasten ve diyafragmayı geçtikten sonra kardia bölgesinde mideyle birleşen, dinamik, müsküler ve tübüler bir organdır. Başlıca görevi ağız yoluyla alınan maddelerin mideye kadar taşınmasını sağlamaktır. Krikoid kıkırdağın alt kenarında 6. servikal vertebra seviyesinden başlayıp, 10. veya 11. torakal vertabra seviyesinde mide ile birleşir. Bu nokta göğüs ön duvarında processus xiphoideus tabanına rastlamaktadır. Özofagusun uzunluğu yetişkinde 25–30 cm, yenidoğanda ise 9–10 cm dir. Diş kavisinden mideye kadar olan mesafe yetişkinde 40–45 cm, yenidoğanda ise; 18cm dir. Duvar kalınlığı 3–4 mm dir [26].
2.3.1. Özofagusun Bölümleri
Anatomik olarak faringo-özofageal, servikal, torasik ve abdominal kısımlardan oluşur (Şekil 2).
2.3.1.1. Pars Cervicalis
Altıncı servikal vertebra hizasından ikinci torakal vertebra hizasına kadar uzanan kısımdır ve 0,5 cm sola deviye halde seyreder. Komşulukları önde trakea, arkada “ fascia prevertebralis”, yanlarda “n. Laryngeus recurrens”, “carotis” kılıfları ve sol yanda tiroid bezinin sol lobudur. Trakea ile yakın komşuluk nedeniyle özofagus perferasyonu durumunda trakeo-özofageal fistüller görülebilir [27].
2.3.1.2. Pars Thoracica
Üst sınırı sternumun “incisura jugularis” inden geçirilen yatay bir plan ile gösterilebilen, 2. ve 10.torakal vertebralar arasında uzanır. Posterior, aynı zamanda superior mediastende yer alır. Bu kısım arkada; 5. torakal vertebra düzeyine kadar direkt olarak torakal vertebraların önünde bulunur, daha aşağıda “aorta thoracica”, “ductus thoracicus”, “v.azygos”, “v.hemiazygos”, sağ yanda “aa.intercostales”, sempatik sistemin “pars thoracica” sı, sol yanda “a.subclavia sinistra”, “a. Carotis communis sinistra” ile komşuluk yapar. Aort ile yakın komşuluğu nedeniyle korozif maddelere veya diğer nedenlere bağlı özofagus perforasyonu durumlarında aorta-özofageal fistüller görülebilir [27].
2.3.1.3. Pars Abdominalis
Özofagus diyaframın arka kısmında onuncu torasik vertebra hizasındaki “hiatus esophageus” adı verilen delikten geçerek karın boşluğuna girer. Bu parçanın üst sınırı hiatus esophagus‟ tan geçirilen yatay bir plan; alt sınırı onbirinci torasik vertebra hizasından geçirilen yatay plandır. Abdominal özofagus, arkada aorta abdominalis ve “turuncus vagalis posterior”, sağda karaciğerin “lobus caudatus”u, solda midenin fundusu, önde karaciğerin “lobus hepatis sinister” in arka yüzü ve “truncus vagalis anterior” ile komşuluk yapar. Abdominal özofagusun ön ve yan tarafları periton ile kaplıdır [27].
2.3.2. Özofagusun Anatomik Darlıkları
Özofagusun üç yerinde darlık vardır. Bu bölgelerde gıdalar bir süre bekler. Bu yüzden korozif maddeler özellikle bu bölgelerde daha fazla yanığa neden olur [27].
Üst kısımdaki darlık krikofarengal kas tarafından oluşturulur. Ortalama lümen çapı 1,5 cm‟dir ve özofagusun en dar yeridir [27].
İkinci darlık, sol ana bronşun aortik arkı çaprazladığı kısımda bulunan komşu özofagusta bulunur. Ortalama lümen çapı 1,6 cm dir [27].
En alttaki darlık, diyafram hiatusundadır ve alt özofagus sfinkter mekanizması tarafından oluşturulur. Burada özofagusun lümen çapı değişkendir ve 1,6-1,9 cm arasındadır. Normal kasılmalarla yavaş geçiş sağlandığından, yiyeceklerin yutulması sırasında bu bölgelerde bekleme olabilir [27].
Tarif edilen her 3 fizyolojik darlığın klinik açıdan önemi; yanıklar, yabancı cisimler ve karsinomalar gibi özofagus patolojilerinde bu bölgelerin en sıklıkla etkilelenen bölgeler olmalarıdır [27].
2.3.3. Özofagus Sfinkterleri
Üst özofagus sfinkteri, krikoid kıkırdak seviyesinde krikofarengeal kasın özofagus etrafında bir halka yaparak aynı kıkırdağa tutunması ile oluşmuştur. Özofagus sirküler kas tabakasının da bu sfinkter ile devamlılığı vardır. Üst özofageal sfinkterin başlıca görevi lümen içindeki maddelerin oral kavite ve larenkse regürjitasyonunu engelleyerek, bireyi boğulma ve aspirasyondan korumaktır [26].
Alt özofagus sfinkteri gerçek bir sfinkter yapısında değildir. Mide ve özofagus arasında yüksek bir basınç zonu oluşturan bu sfinkter, mide içeriğinin özofagusa reflüsünü önleyen en önemli oluşumdur. Normal yetişkinde özofagustan mideye geçiş için 3 cm su basıncı yeterli iken, mideden özofagusa reflünün gerçekleşebilmesi için 100 cm su basıncı gereklidir [26].
2.3.4. Özofagusun Damar ve Sinirleri
Özofagusun kendine ait arter, ven ve lenfatikleri yoktur. Damarları çevre organların arter, ven ve lenfatiklerinden kaynaklanır. Özofagusun servikal kısmının arterleri “a. tyroidea inferior”, torakal kısmının aort ve bronş arterlerinin özofagusa ait dallarından, abdominal kısmı ise “a. gastrica sinistra” ve “a. phrenica abdominalis sinistra” dan beslenir [27].
Özofagusun venleri submukoza ve özofagusun dışında olmak üzere iki yerde ağ yapar. Bu ağlardan gelen venöz kan “ v. thyroidea inferior”, “v. azygos” ve “v. hemiazygos” aracılığı ile “v.cava superior” a, özofagusun en alt kısmına ait venöz kan ise “v. gastrica sinistra” aracılığıyla “v.porta” ya dökülür [27, 29].
Özofagusun lenfatikleri kas tabakasını delip özofagus duvarı içerisinde uzunlamasına bir seyir gösterir. Özofagusun 1/3 üst kısmının lenfatikleri derin servikal, 1/3 orta kısmın lenfatikleri mediastinal, 1/3 alt kısmının lenfatikleri ise çölyak lenf düğümlerine akar [27].
Özofagusun sinirleri hem iki vagustan hem de sempatik zincirden gelir. ”n.larengeus recurrens”ler özofagusun 1/3 bölümündeki çizgili kasların inervasyonundan sorumludur. Bu üst bölüm aynı zamanda 9,10,11 inci kafa çiftlerinden ve sempatik zincirden dallar alır. Parasempatikleri “n. vagus” tan gelir ve özofagusta peristaltizmi ve bezlerin salgılarını arttırıcı etki yapar. Sempatikleri ise “truncus sympaticus” un “pars thoracica” sından gelir. Sempatik uyarı gastrointestinal sistemde sekresyon ve motor aktivitede inhibisyona, sfinkterlerde ve kan damarlarında kontraksiyona neden olur [27, 29].
2.4. Özofagus Fizyolojisi
Özofagus yutulan maddelerin farenksten mideye taşınmasını sağlayan bir kanal görevi görür. Yutma işlemi istemli başlar, refleks olarak devam eder. Yutma trigeminal, glossofaringeal ve vagus sinirlerindeki afferent uyaranları ile başlar. Bu uyaranlar ponsun aşağısında ve medullada organize edilir. Efferent lifler trigeminal, fasial ve hipoglossal sinirler içinde farenks kaslarına ve dile gelir. Ağız içinde alınan gıdalar ağız gerisine istemli olarak itilir. Bu farengeal kaslarda, alınan gıdayı farenksten özofagusa iten istemsiz kasların kasılma hareketini başlatır [24].
Bu sırada solunum inhibe olur ve glottis kapanır. Besinlerin trakeaya geçişi epiglottisin trakea üzerinde kapanması ile engellenir. Yutma sırasında farenks ve özofagus arasında bulunan üst özofagus sfinkteri (bu sfinkter düz çizgili kaslardan yapılmış olup tamamen vagal liflerin
kontrolündedir) gevşer ve gıda özofagusa geçer. Üst özofagus sfinkterinin altında 3-5 cm/sn hızla oluşan peristaltik hareketler (primer peristaltik) ve yerçekiminin etkisi ile özofagus alt kısmına ilerleyen gıda mideye geçer. Primer peristaltik hareket yutma ile başlar, beyinde yutma merkezinden kaynaklanan vagal liflerle kontrol edilir [30].
Özofagusun mideyle birleşen kısmındaki sfinkter (alt özofagus sfinkteri; düz kaslardan yapılmıştır) istirahat halinde 20–30 mmHg basınçla kapalı durumdadır. Mide içeriğinin özofagusa kaçmasını önlemede önemlidir ve bu durum enterik sinir nöronları ile kontrol edilir. Vagal liflerde asetilkolin salgılanması bu sfinkterin kasılmasına, bir kısım vagal liflerin innerve ettiği internöronlardan salınan ATP, NO (nitrik oksit) ve VIP (vazoaktif intestinal polipeptid) bu sfinkterin gevşemesine neden olur. Eğer primer peristaltik hareket özofagustan besinin tam olarak geçmesine yetmediyse gerilim nedeniyle özofagusta peristaltik hareket başlar. Özofagus duyusal liflerinden gelen uyarılar enterik ve merkezi sinir sistemine ulaşır ve peristaltizmi düzenler. İkinci peristaltik hareket daha çok özofagusun intrensek nöronları ile kontrol edilir [23, 30].
2.5. MİDE EMBRİYOLOJİSİ
Mide embriyonik hayatta ön bağırsağın distal kısmından gelişim gösteren bir gastrointestinal sistem organıdır. Önceleri basit tübüler bir yapı şeklinde görülen ön bağırsakta 4. hafta sonlarında orta kesimde bir dilatasyon göze çarpar. Bu bölge midenin gelişeceği bölgedir. Bu dilatasyon alanı giderek büyüyüp genişlemeye başlar; ancak bu gelişim sırasında dorsal kısmın ventral kısımdan daha hızlı geliştiği dikkat çekmektedir. 7.-8. haftalar civarında, mide ekseninde kraniokaudal ekseni boyunca dönme hareketi görülür ve midenin ventral kısmı sağa doğru yer değiştirirken, dorsal kısmı sol tarafa doğru yer değiştirir [31, 32]. Bu rotasyon süresince önceleri median eksende yerleşik olan midenin kranial ve kaudal uçları da yer değiştirir ve kranial kısım sola ve hafifçe aşağıya doğru hareket ederken kaudal kısmı sağa ve yukarı doğru yön değiştirir. Rotasyon sonrasında midenin ekseni vücudun uzun eksenine hemen hemen transvers olacak şekilde bir yerleşim gösterir. Bu rotasyon sonunda aynı zamanda sol nervus vagus midenin ön duvarını inerve ederken sağ nervus vagus midenin arka duvarını inerve etmeye başlar. Mukozal ve submukozal gelişim ise 8. ve 9. haftalar civarında görülür. Diğer gastrointestinal sistem organlarının aksine herhangi bir villus oluşumu görülmez ancak gastrik girinti adı verilen yapılar göze çarpar. 10. hafta civarında pariyetal hücreler pilor ve kardiada ortaya çıkar. Asit salgısı 32. hafta civarında başlar. Bununla birlikte, intrensek faktörün 11. haftadan sonra ortaya çıktığı ve giderek
pariyetal hücrelerin sayısına paralel olarak arttığı bilinmektedir. Esas hücreler ise 12-13. haftalar civarında ortaya çıkar ama pepsinojen içermeye başladığı dönem olan doğum anına kadar görüntülenemez [31].
Mide embriyolojik gelişimi wistar albino sıçanlarında da yukarıda anlatıldığı şekildedir.
2.6. MİDE HİSTOLOJİSİ
Ağız boşluğundan sonra dört büyük organ farklılaşmıştır: Yemek borusu, mide, ince bağırsak ve kalın bağırsak. Bu organların her birinde dört tabaka bulunur (Şekil 3).
Şekil 3: Mide histolojik kesit [33]
2.6.1. Tunica mukoza
Mukoza; kardia, mide (fundus ve korpus) ve pilor bezlerini saran lamina propria denen gevsek bağ dokusundan ibarettir. Retiküler ve kollajen lifler lamina propriada daha çoktur ve elastik lifler nadirdir. Lamina proprianın hücre elemanları fibroblastları, lenfositleri, mast hücrelerini, eozinofilleri ve birkaç plazma hücresini kapsar. Muskularis mukoza, bezlerden salgı salınmasını kolaylastırmak için mukozaya ince kas hücreleri seritleri gönderebilir [34]. Yaklasık olarak 0,3-1,5 mm kalınlığındadır. Makroskobik olarak iç yüzey incelendiğinde, ruga olarakta adlandırılan submukozanın longutidinal katlantıları göze çarpmaktadır. Mide
tamamen dolduğunda bu rugalar düzlesirken, gevsediğinde ise rugalar yassılasırlar. Bunun yanında en iyi tarayıcı elektron mikroskop ile ortaya konulabilen çok sayıda açıklığı mide yüzeyinde görmek mümkündür. Bu açıklıklar gastrik çukurcuklar (foveola gastrika) olarak adlandırılır. Mide bezleri içeriklerini gastrik çukurcuğun dibine bosaltır. Yüzey mukus hücreleri, midenin iç yüzeyini ve gastrik çukurcukları döser. Tek katlı prizmatik olan bu epitelyum hücrelerinin apikallerinde musinojen granülleri yer alır. Nukleus, golgi kompleksi ve az sayıda granüllü endoplazmik retikulumu (GER) bu musinojen granüllerinin altında yer alır. Yüzey mukus hücrelerinden salgılanan mukus buğulu görünümdedir ve görünen mukus olarak adlandırılır. Bu mukus tabakası, mide epitelini asidin yakıcı etkisine karsı koruyucu görev üstlenir. Bununla birlikte içerdiği yoğun miktardaki bikarbonat sayesinde de asidin nötralizasyonunda rol oynar [35].
Mide mukozası tek katlı prizmatik epitelin altında uzanan lamina propria ve daha derinde bulunan bir düz kas tabakası olan muskularis mukozadan oluşur ki bu düz kas tabakası submukoza ile mukoza sınırını teskil eder. Mide bezleri mukozanın tüm kalınlığını olustururlar ve lamina propriadan muskularis mukozaya doğru uzanırlar. Yüzey epitelinin altında ve bezlerin arasındaki gevsek, hücreden zengin lamina propriada lenfoid hücreleri, değisik bağ dokusu ve düz kas hücreleri serpilmis olarak bulunurlar ve yaygın kapiller ağı içerir. Mukozal bezlerin çok sayıda ve çok yoğun olmasından dolayı lamina proprianın görülmesi zor ve genellikle yetersizdir. Ana gastrik bezler uzun, düz ve sıklıkla çatallaşmışlardır [35].
Uzunlamasına kesitte bezler (özellikle fundusta olanlar) üç bölüme sahiptir. Üst bölüm-istmus-gastrik çukura açılır. Orta bölge-boyun-boyun mukus hücreleri ve pariyetal hücrelerden olusur. Hem istmus hemde boyun bölgesinde bezlerdeki hücreleri artıran kök hücreler bulunur. Alt bölge (veya ana bölge): üst kısım pariyetal ve bir miktar mide esas (chief) hücreleri içerir; alt kısımda tabanda ise, çoğunlukla esas hücreler bulunur. Kardia ve fundustaki bezler (bilesik tübüler bezler) çoğunlukla mukus salgılayan hücreleri içerirler [35].
Lamina propria gevsek bağ dokusundan ibarettir. Retiküler ve kollajen lifler lamina propriada daha çoktur ve elastik lifler nadirdir. Lamina proprianın hücre elemanları fibroblastları, lenfositleri, mast hücrelerini, eozinofilleri ve birkaç plazma hücresini kapsar [36]. Muskularis mukoza, bezlerden salgı salınmasını kolaylastırmak için mukozaya ince kas hücreleri seritleri gönderebilir. Mide lamina propriası gastrik çukurcukları ve bezleri
çevreleyen kan ve lenf damarlarından zengin gevsek bağ dokusu içeren oldukça dar bir alan olusturur. İnflamasyon durumlarında bu tabakada nötrofil hücrelerini görmek te mümkün olabilmektedir. Ayrıca bazen bezler ve lenfoid dokuda görülebilir. Muskularis mukoza tabakası içte sirküler dısta longutidinal olmak üzere iki ince laminadan olusur. Bazı bölgelerde üçüncü sirküler bir tabaka daha görülebilir [35, 37].
2.6.2. Tunica submukoza
Submukoza, içinde kollajenöz ve elastik liflerin çok olduğu sıkı düzensiz bağ dokusundan olusur. Çok sayıda arteriyol, venöz pleksus ve lenfatik damarlar, bol miktarda lenfoid hücre, makrofaj ve mast hücresi, değisen miktarda yağ dokusu, sinir lifleri ve submukozal (Meissner) sinir pleksusunu içerir. Meissner sinir pleksusu, submukozada yer alan kan damarları, düz kas hücreleri ve muskularis mukozayı olusturan düz kas liflerini innerve eder [37, 38].
2.6.3. Tunica muscularis
Mide muskularis eksterna tabakası geleneksel olarak 3 düz kas tabakasından oluşmuştur. Dışta longutidinal, ortada sirküler ve son olarak içte oblik olarak seyreder. Bunlardan en iyi tanımlanan ve süreklilik arzeden tabaka sirküler olandır. Ancak midenin en ön ve en arka bölümlerinde longutidinal lamina kesintiye uğrarken, periözefagial bölgede sirküler tabaka az gelismistir. Kas tabakasındaki bu üç yönlü dizilim midenin karıstırıcı ve ince barsağa iletici fonksiyonu açısından elzemdir. Ganglion hücreleri ve myelinsiz sinir liflerinin bir araya gelerek olusturduğu myenterik sinir pleksusunu (Auerbach) kas laminaları arasında görmek mümkündür [35, 37].
2.6.4. Tunica seroza
Tunika seroza, periton boşluğuna bakan tek katlı yassı epitel (mezotel), onun altında bazal lamina ve en altta da çok az oranda gevşek bağ dokusundan meydana gelmiştir. Hücreler arası bağlantılarla birbirine bağlanan hücreler apikal yüzeylerinde mikrovilluslara sahiptirler. Hücreler, abdominal organların serbestçe hareket etmesine izin veren ve nemli bir yüzeyin oluşmasını sağlayan ince seröz sıvıdan oluşan bir film tabakası üretirler. Omentum majus vasıtasıyla abdominal kavitenin pariyetal peritonu ve karaciğerin visseral yaprağının devam ettiği omentum minus ile devam eder [37, 38].
2.7. MİDE BÖLÜMLERİNE GÖRE HİSTOLOJİ
2.7.1. Kardia
Kardia, özefagus ile mide arasında geçiş bölgesinde 1,5–3 cm genişliğinde dar sirküler bir banttır. Epiteli tek katlı prizmatiktir. Lamina propriası, basit ya da dallanmış tübüler kardiak bezler içerir. Bu bezler yapı olarak özefagusun son parçasındaki kardiak bezlere benzer ve bezlerin son kısımları genellikle kıvrımlıdır. Geniş bir lümene sahiptir ve salgı yapan hücrelerin çoğu mukus ve lizozim üretir [38].
2.7.2. Fundus ve korpus
Fundus yemek borusunun soluna doğru uzanır. Korpus ise geniş merkezi bir bölgedir [34]. Fundus ve korpusun yüzeyi tek katlı prizmatik epitel ile çevrilidir [39]. Bu bölümlerin lamina propriası dallanmış tübüler gastrik bezler (fundus bezleri) ile doludur [38]. Bunların üç veya yedisi birlikte bir gastrik çukurcuğun dibine açılır. Yaklaşık 15 milyon mide bezi 3,5 milyon civarındaki mide çukurcuğuna açılır. Mide sıvısının büyük bir kısmı fundus ve korpus bölgesinin mide bezleri tarafından oluşturulur [34].
Fundus ve korpustaki bezler (gastrik bezler); istmus, boyun ve taban olmak üzere üç bölgeden oluşmuştur [38]. Bu bezlerde beş büyük hücre tipi bulunur (Şekil 4).
Bezlerin istmus bölgesinde müköz, kök ve pariyetal hücreler; boyun bölgesinde kök, müköz boyun (istmustaki müköz hücrelerden farklı) ve pariyetal hücreler; taban bölgesinde ise pariyetal, esas (zimojen) ve enteroendokrin hücreler bulunur [38].
2.7.2.1. Kök hücreler
Kök hücreleri alçak prizmatik hücreler olup, istmus ve boyun bölgesinde bulunurlar. Oval çekirdekleri hücre bazaline yakındır. Yüksek mitotik aktiviteye sahip olan bu hücrelerin bazıları çukurcuk ve yüzeydeki müköz hücrelerin yerini almak üzere yüzeye doğru hareket ederler. Müköz hücrelerin yenilenme döngüsü 5–7 gündür. Diğer yavru hücreler bezlerin daha derin kısımlarına göç ederler ve müköz boyun hücreleri ile pariyetal, esas, enteroendokrin hücrelere farklılaşırlar. Bu hücreler yüzeydeki müköz hücrelerden çok daha yavaş yenilenirler [38].
2.7.2.2. Müköz boyun hücreleri (Kollum hücreleri )
Fundus ve korpus mide mukozasında, mukus üreten iki sınıf hücre vardır. Bunlar; mide çukurcuklarını örten yüzey müköz hücreleri ve mide bezinin başlangıcında yerleşmiş olan müköz boyun hücreleridir [34]. Müköz boyun hücreleri, mide bezlerinin boyun bölgesindeki pariyetal hücreler arasında kümeler halinde ya da tek olarak bulunur. Bu hücrelerin müköz salgısı yüzeydeki müköz epitel hücrelerinin salgısından oldukça farklıdır. Şekilleri düzensiz olan bu hücrelerin çekirdekleri hücrenin bazalinde bulunur. Apikal yüzeye yakın oval ya da yuvarlak PAS ile koyu boyanan granülleri vardır [38]. Bu granüller, yüksek moleküler kütleli glikoprotein yapısındaki musinleri üretirler. % 95’i su, % 5’i ise musinden ibaret olan mukus salgısı, koruyucu bir mide mukozası bariyeri oluşturmak üzere mide mukozası yüzeyine bağlanan ve çözünmeyen bir jel oluşturur. Bu koruyucu mukus örtüsü bikarbonat iyonlarını tutar ve müköz yüzey hücrelerinin apikal bölgesine komşu mikro çevrenin değerini yaklaşık olarak pH 7‘ye dönüştürür [34].
2.7.2.3. Pariyetal hücreler (okzintik hücreler)
Pariyetal hücreler, daha çok mide bezlerinin üst yarısında boyun bölgesinde, seyrek olarak da taban bölgesinde bulunurlar [34]. Pariyetal hücreler yuvarlak ya da piramidal hücreler olup, bağlantı kompleksleriyle şef hücrelere bağlanırlar [38]. Merkezi yerleşimli, yuvarlak tek çekirdekleri vardır ve sitoplazmaları oldukça eozinofiliktir. Pariyetal hücreler üç farklı özelliğe sahiptir [34, 38].
1. Elektron mikroskobu ile incelendiğinde hücre hacminin % 40’ını işgal edecek kadar çok mitokondri içerirler. Hücre içinde bol kristalı mitokondriler ve bazale yakın belirgin bir golgi kompleksi içerir. Salgı granülleri yoktur.
2. Apikal plazma membranının yaptığı derin sirküler girintiler olan hücre içi kanalcıklar içerirler. Bu kanalcıklar çok sayıda yoğun mikrovilluslarla kaplanmıştır.
3. H, K-ATPaz’ca zengin tübüloveziküler bir sistem bulunur ve bunlar pariyetal hücrenin dinlenmesi esnasında salgı kanalcıkları boyunca dağılmışlardır.
Dinlenme halindeki hücrenin uç bölgesinde plazmalemmanın hemen altında çok sayıda tübüloveziküler yapılar görülebilir. Bu aşamada hücre az sayıda mikrovillusa sahiptir. Stimülasyonu takiben, hidroklorikasit salgısı için uyarıldığında tübüloveziküller hücre membranı ile kaynaşır ve kanalikül aralığında çok sayıda mikrovillus ortaya çıkar. Böylece hücre membranı yüzeyinde büyük bir artış sağlanmış olur. Membran birleşmesi, H,K-ATPaz miktarını artırır ve hücre içi kanalikül yaygınlaşır. Tübüloveziküller arasında bu yapıların etkileşimlerinde rolleri olduğu sanılan aktin filamentleri bulunur. Böylece pariyetal hücreler salgılarını mide lümenine bırakırlar [34, 38].
Pariyetal hücreler mide sıvısının hidroklorik asidini ve üst ince bağırsakta vitamin B12 emilimini kolaylaştırmak için B12 ile bağlanan bir glikoprotein olan intrinsik faktörü üretirler [39].
2.7.2.4. Şef hücreler ( Chief, esas, zimojen, peptik hücreler )
Esas hücreler mide bezlerinin üçte bir altında daha çoktur. Esas hücreler kardia bezlerinde yoktur ve pilor antrumunda nadir bulunurlar. Esas hücreler protein sentezi yapan ve salgılayan hücrelerin bütün özelliklerine sahiptir. Esas hücreler ekzokrin pankreasın zimojen hücreleriyle yapısal bir benzerliğe sahiptirler. Bazal sitoplazma bölgesi yaygın bir kaba endoplazmik retikulum içerir ve bazofilik görünümlüdür. Hücrenin apikal bölgesinde sitoplazmalarındaki granüllerde (zimojen granüller) inaktif pepsinojen enzimi bulunur [34, 38]. Zimojen granüllerde depolanan bir proenzim olan pepsinojen, bezin lümenine salgılanır ve midenin asit ortamında çoğu proteinleri sindirebilen proteolitik bir enzim olan pepsine dönüştürülür. Pepsinojenin salgılanması hızlı olup, açlıktan sonra gıda alınması ile uyarılır. İnsanda bu hücreler ayrıca lipaz enzimini de üretirler [41].
2.7.2.5. Enteroendokrin hücreler
Bu hücreler mide bezlerinin tabanında bulunur. Sindirim sisteminin hormon üreten hücreleri olan enteroendokrin hücreler özefagustan kolona kadar epitel içinde yoğun olarak bulunan küçük piramidal hücrelerdir. Embriyonik endodermden köken aldığı düşünülmektedir. Yerleşimi mukoza ile sınırlıdır. Metabolik ve boyanma özellikleri temel alınarak arjentaffin, arjirofil veya apud (amin prekürsor uptake ve dekarboksilasyon) hücreleri olarak adlandırılırlar. Rutin kesitlerde görülmeleri zordur. İmmünhistokimyasal ve elektron mikroskobik olarak görülebilirler. Lamina propriaya bitişik bazal laminaya oturmasına karşın bazıları lümene ulaşabilir. Enteroendokrin hücreler küçük ve membranla çevrili olup, yoğunlaşmış, elektron yoğun salgı veziküllerine sahiptirler [34].
Sitoplazmalarında küçük bir golgi kompleksi, birkaç mitokondri ve yaygın olarak izlenen granüllü endoplazmik retikulum bulunur. Hücreler hedef hücrelerde güçlü bir etkiye sahip, kan dolaşımına giren veya lokal olarak etkili çeşitli peptit ve aminler üretirler. Gastrin, motilin, kolesistokinin, somatosatin, 5-hidroksi triptamin (serotonin), sekretin ve vasoaktif intestinal polipeptid gibi otuzdan fazla gastrointestinal hormon üretirler [34, 35].
2.7.3. Pilor
Pilor midenin duodenuma açıldığı yerde son bulur [34]. Pilorun yüzeyi tek katlı prizmatik epitel ile döşelidir ve goblet hücresi içermez [39]. Midenin fundusuyla pilor mukozası karşılaştırıldığında, pilor mukozasının epitel çukurcukları daha derindir. Bu çukurcuklar mukozanın tüm kalınlığının büyük bir bölümünü kapsarlar [42]. Pilor derin gastrik çukurcuklara sahiptir ve bunların içine dallanmış tübüler pilor bezleri açılır [39]. Kardiyak bölgenin bezleriyle karşılaştırıdığında pilor bezlerinin daha uzun çukurcukları ve daha kısa kıvrımlı salgılayıcı bölümleri bulunur. Bu bezlerden lizozim ve mukus salgılanır. Gastrin salgılayan gastrin (G) hücreleri pilor bezlerinin müköz hücreleri arasında bulunur [38].
2.8. MİDE ANATOMİSİ
Karın boşluğunda regio hipokondriaka sinistra, regio epigastrika ve regio umbilikalis’te yer alan mide, gastrointestinal kanalın J şeklindeki genişlemiş olan bölümüdür [43]. Midenin iç hacmi yasa göre değişmektedir. Yeni doğanda yaklaşık 30 cm³, pubertede 1000 cm³ ve eriskinlerde 1500 cm³ kadardır. Ancak yaklaşık 500 cm³ lük bir içerik mideyi normal dolu pozisyonuna getirir, mide bundan sonra genişlemeye başlar. İçerisindeki içeriğe,
mide hareketlerine, kas tabakasının gelişme durumuna ve komşusu olan organların doluluk-boşluk durumuna göre midenin şekli değişiklik arzetmektedir. Mideyi özofagusa bağlayan deliğe, kalbe yakın olması nedeniyle, ostium kardiakum (kardia) denilir. Normal şahıslarda karın ön duvarından yaklaşık 10 cm derinde bulunan ostium kardiakum, kesici dislerden de 40 cm uzaklıkta bulunur [44]. Özofagusun koni şeklinde olan abdominal bölümünün taban kısmı, ostium kardiakum ile birleşir. Mideyi duodenum’a birleştiren deliğe, ostium pilorikum denilir. Midenin ön ve arka olmak üzere iki yüzü, bu yüzleri birbirinden ayıran kurvatura minor ve majör olmak üzere, ikide kenarı vardır. Kurvatura ventrikuli minor’a omentum minus tutunur. Omentum minus’un mideye tutunan kısmında ve iki yaprağı arasında a.gastrika sinistra ve dekstra uzanır. Kurvatura major, midenin sola, aşağı ve birazda öne bakan konveks kenarı olup, kurvatura minor’dan 4-5 kat daha uzundur. Buraya omentum majus tutunur.Bununla birlikte midenin ön ve arka yüzleri peritonla örtülüdür [43, 44].
2.8.1 Midenin Bölümleri
Mide anatomik olarak, pars kardiaka, fundus gastrikus (ventrikulare), korpus gastrikus (ventrikulare), pars pilorika ve pilorus olmak üzere 5 bölümden oluşur (Şekil 5)[44].
2.8.1.1 Pars kardiaka
Ostium kardiakum yakınındaki bölge olup, mideyi özofagusa bağlayan deliğe komsudur, diğer bölümler kadar belirgin değildir [44].
2.8.1.2 Fundus gastrikus
Midenin insisura kardiaka’dan geçen horizontal bir düzlemin yukarısında kalan bölümüdür. Kubbe seklinde olan bu bölüm, genellikle gazla doludur ve diyafragma ile komsuluk yapar [44].
2.8.1.3 Korpus gastrikus
Fundus gastrikus ile ins.angularis arasında kalan midenin en büyük bölümüdür. Fundus ile korpus arasında belirgin bir sınır bulunmaz ve bu iki bölüm midenin büyük kısmını oluşturur [44].
2.8.1.4 Pars pilorika
İns.angularis’ten pilorus’a kadar olan bölümdür. Antrum pilorikum ve kanalis pilorikus olmak üzere iki bölüme ayrılır. İlk bölüm olan antrum pilorikum geniş, ikinci bölüm olan kanalis pilorikus ise, 1-2 cm uzunluğunda dar bir kanal seklinde olup, duvarı da diğer bölümlere göre daha kalındır. Bu nedenle, kontraksiyon yaptığında lümeni tamamen kapanabilir. Halbuki diğer bölümlerin lümenleri kapanmaz [44].
2.8.1.5 Pilorus
Midenin duodenuma yakın olan bölümüdür. Bu bölümün etrafında m.sfinkter pilori denilen düz kastan yapılmıs bir sfinkter bulunur. Normal durumlarda kontraksiyon yapan bu kas, sindirim esnasında zaman zaman gevşer ve yoğrularak sindirilebilir hale getirilmis gıda maddesinin mideden duodenum’a geçmesine müsaade eder. Mideyi duodenum’a bağlayan geçite de ostium pilorikum denilir [44].
2.8.2. Midenin damar ve sinirleri
Kurvatura ventrikuli minor’da a.gastrika sinistra (trunkus soliyakus’un dalı) ve a.gastrika dekstra (a.hepatika kommunis bazen de a.hepatika propria’nın dalı) omentum minus’un iki yaprağı arasında yer alır ve bu iki dal arasında anastomoz mevcuttur. Kurvatura
ventrikuli major’da omentum majus’un iki yaprağı arasında a.gastro-omentalis sinistra ve a.gastro-omentalis dekstra yer alır. Bu arterler arasında anastomozlar mevcuttur. Aa.gastrikae breves (a.splenika’nın dalları) midenin fundus bölümünü besler [44].
Midenin venleri, arterlerini takip ederler ve aynı isimleri alırlar. Bunlar v.porta’ya açılırlar. V.gastrika sinistra ile özofagusun abdominal venleri arasında önemli anastamoz (porto-kaval anastamoz) yaparlar [44].
Midenin Lenf damarları, kurvatura ventrikuli minor ve major boyunca arterlere eşlik ederler. Bu lenf damarları midenin ön ve arka yüzünden topladıkları lenfayı nodi lemfatiki gastriki ve nodi lemfatiki gastro-omentales’e dökülmek üzere kurvatura ventrikuli minor ve major’e doğru ilerler. Bu lenf nodlarından çıkan efferent damarlar büyük damarlara eşlik ederek nodi lemfatiki soliyaki’ye dökülürler [44].
Preganglionik simpatikleri 6-9. torakal medulla spinalis segmentlerinden çıkan n.splanknikus’lar aracılığı ile pleksus soliakus’a gelir. Bu lifler ggl.soliyakum’da nöron değiştirirler. Postganglionik lifleri midenin damarları etrafında ağlar oluşturarak mideye girerler. Parasempatikleri N.vagus’un aşağıdaki devamı olan trunkus vagalis anterior ve posterior’dan gelir. Bu iki turunkus da, a.gastrika sinistra’nın mideye ulaştığı yerde bulunur. Bunlar da organ duvarındaki intramural gangliyonlarda nöron değiştirirler [44].
2.9. MİDENİN FİZYOLOJİSİ
Mide, yiyecekleri sindiren ve hormon salgılayan hem ekzokrin, hem de endokrin bir organdır. Yutulan yarı katı besinleri kimyasal olarak işler ve homojenize eder. Midenin kas duvarının kontraksiyonları ve mide mukozası tarafından salgılanan asit ve enzimler bu fonksiyona katılırlar [34]. Midenin temel görevi ağızda başlayan karbonhidrat sindirimini devam ettirmek, mideye gelen besinlere asidik bir sıvı eklemek, bunları müsküler aktiviteyle visköz bir kitle haline dönüştürmek, pepsin ile proteinlerin sindirimini başlatmaktır. Mide ayrıca lingual lipazın da yardımı ile trigliseridleri sindiren bir gastrik lipaz üretir [38]. Mide otonom sinir sistemi ile innerve edilir. Sempatik, parasempatik ve enterik komponentlerden ibarettir. Sempatik sinir lifleri göğüs ve bel spinal kordundan, parasempatik sinir lifleri ise medulla oblongatanın vagal dorsal motor çekirdeğinden çıkarlar. Viseral duyusal sinir lifleri ise spinal dorsal kök ganglionlarından köken alırlar [34, 38].