T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
BAZI ANJİYOTENSİN II RESEPTÖR ANTAGONİSTLERİNİN (ARA-II) FLORESANS ÖZELLİKLERİNİN
İNCELENMESİ VE FLORİMETRİK YÖNTEM İLE İYONLAŞMA SABİTLERİNİN TAYİNİ
Teslime ERŞAN YÜKSEK LİSANS Kimya Anabilim Dalı
Temmuz-2011 KONYA Her Hakkı Saklıdır
TEZ BİLDİRİMİ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Teslime ERŞAN Tarih:
ÖZET YÜKSEK LİSANS
BAZI ANJİYOTENSİN II RESEPTÖR ANTAGONİSTLERİNİN (ARA-II) FLORESANS ÖZELLİKLERİNİN İNCELENMESİ VE FLORİMETRİK
YÖNTEM İLE İYONLAŞMA SABİTLERİNİN TAYİNİ
Teslime ERŞAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
Danışman: Yrd. Doç. Dr. S.Beniz GÜNDÜZ 2011, 102 Sayfa
Jüri
Yrd. Doç. Dr. S.Beniz GÜNDÜZ Prof. Dr. Erol PEHLİVAN
Yrd. Doç. Dr. Semahat KÜÇÜKKOLBAŞI
Anjiyotensin II Reseptör Antagonistleri (ARA-II), hipertansiyon ve kalp yetmezliği tedavisinde etkin maddelerdir ve geleneksel anjiyotensin dönüştürücü enzim (ADE) inhibitörlerine alternatif olarak düşünülmüştür. Çünkü bunlar, renin-anjiyotensin sistemde anjiyotensin tip 1’i (AT 1) seçimli olarak bloke edebilirler. İrbesartan, losartan, kandesartan, valsartan ve telmisartan birçok özelliği ADE inhibitörlerininkine benzeyen özgül anjiyotensin II reseptör antegonistleridir. Anjiyotensin II Reseptör Antagonistleri amfoterik bileşiklerdir ve yapısal olarak bağlı bifenilkarboksilik asit kısmı içeren telmisartan dışında, aynı bifeniltetrazol kısmına sahiplerdir. Anti-hipertansif ilaçlar olarak ARA II’lerin iyonlaşma sabitlerinin birkaç uygun yöntem ile tam olarak tayini, etki mekanizmalarının anlaşılmasında ve biyoyararlanabilirlikleri açısından oldukça önemlidir.
Bu tez kapsamında öncelikle ARA-II’lerin organik çözücü-su ortamlarında florimetrik parametreleri (uyarma ve emisyon dalga boyu, floresans şiddeti) belirlenmiştir. Florimetrik parametrelerin belirlenmesi için, öncelikle saf asetonitril, metanol, DMF ve su içerisinde, daha sonra %10 organik çözücü - %90 su karışımlarında ilaç etken maddelerinin uygun derişimlerdeki çözeltileri hazırlanarak, uyarma dalga boyları 10’ ar nm aralıklarla değiştirilip emisyon spektrumları alınmış ve her bir ilaç etken maddesinin, her bir organik çözücü-su ortamında maksimum floresans şiddetine sahip oldukları uyarma ve emisyon dalga boyları belirlenmiştir. ARA II’lerin molekül yapılarında karboksil (-COOH) ve amin (-NH) grupları gibi, asidik ve bazik fonksiyonlu gruplara sahip olduklarından, optimum koşullarda %10-40 asetonitril-su ortamlarında, bu ilaç etken maddelerinin iyonlaşma sabitleri spektroflorimetrik ve spektrofotometrik yöntemlerle hem pH-floresans şiddeti grafiklerinden hem de pKa değerlerini deney koşullarında hesaplayan bir bilgisayar programı olan STAR programıyla iyonlaşma sabitleri tayin edilmiştir. Deneysel yöntemlerle elde edilen pKa değerleri, SPARC programından (online teorik pKa hesaplama programı) hesaplanan teorik pKa değerleriyle karşılaştırılmıştır.
Anahtar Kelimeler: Anjiyotensin II reseptör antagonistleri (ARA II), İrbesartan, Kandesartan,
Losartan, pKa, Spektroflorimetri, Spektrofotometri, Telmisartan, Valsartan
ABSTRACT
MS THESIS
INVESTIGATION OF THE FLUORESCENCE PROPERTIES OF SOME ANGIOTENSIN II RECEPTOR ANTAGONISTS (ARA II) AND DETERMINATION
OF THEIR IONIZATION CONSTANTS BY USING FLUORIMETRIC METHODS
Teslime ERŞAN
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN CHEMİSTRY Advisor: Asst. Prof. Dr. S. Beniz GÜNDÜZ
2011, 102 Pages Jury
Asst. Prof. Dr. S. Beniz GÜNDÜZ Prof. Dr. Erol PEHLİVAN
Asst. Prof. Dr. Semahat KÜÇÜKKOLBAŞI
Angiotensin II receptor antagonists (ARA-II), are effective materials in hypertension and in the treatment of cardiac failure and is used as an alternative to conventional angiotensin converting enzyme (ACE) inhibitors because they can selectively block angiotensin type-I (AT I) in renin-angiotensin system. Irbesartan, losartan, candesartan, valsartan and telmisartan have many similarities to ACE inhibitors and are specific angiotensin II receptor antagonists. Angiotensin II receptor antagonists are amphoteric compounds and apart from telmisartan which contains biphenilcarboxilic acid in structure, they all have bipheniltetrazol fraction. The exact determination of ionization constants using several suitable methods is quite usefull in understanding the action mechanisms and bioavailability of ARA II anti-hypertensive drugs.
For this reason in this study, the fluorimetric parameters of ARA IIs in organic solvent-water media are determined. In order to specify the fluorimetric parameters (excitation and emission wavelength, fluorescence intensity), the efficient drug components were prepared at suitable concentrations primarily in acetonitrile, methanol, DMF, DMSO and in pure water, and then in 10-90 % organic solvent-water mixtures. The emission spectra were obtained by changing the excitation wavelength at 10 nm intervals and the excitation and emission wavelengths were determined for every efficient drug molecule, in every organic solvent-water medium in which they had the maximum fluorescence intensity. Since ARA IIs contain acidic and basic functional groups such as carboxyl (-COOH) and amine (-NH) groups, under optimum conditions, 10-40 % acetonitrile-water medium, the effective drug materials’ ionization constants were determined by spectrofluorimetric and spectrofluorimetric methods both from the pH-fluorecence intensity graphics and from the STAR programme which calculates the pKa values during experimental conditions. The pKa values obtained experimentally were compared to theoretic pKa values obtained from SPARC programme (online theoretic pKa calculation programme).
Keywords: Angiotensin II receptor antagonists (ARA II), Candesartan, Irbesartan, Losartan,
pKa, Spectrofluorimetry, Spectrofotometry, Telmisartan, Valsartan
ÖNSÖZ
Bu çalışma Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü öğretim üyelerinden Yrd. Doc. Dr. S. Beniz GÜNDÜZ danışmanlığında tamamlanarak Selçuk Üniversitesi Fen Bilimleri Enstitüsü’ ne Yüksek Lisans Tezi olarak sunulmuştur.
Bu çalışma aynı zamanda S.Ü Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından FBE 10201027 no’ lu proje olarak desteklenmiştir.
Yüksek lisans eğitimimin ve çalışmamın her aşamasında beni destekleyen, her daim bana sevgiyle yaklaşan, bizlere bir anne gibi davranan, hiçbir zaman yardımlarını esirgemeyen, bilgi ve deneyimlerini büyük bir hoşgörüyle bana aktaran kendisiyle çalışmaktan mutluluk duyduğum çok değerli hocam Yrd. Doç. Dr. Beniz GÜNDÜZ’ e, tez hazırlama sürecinde her konuda yardımını gördüğüm, bilgi ve tecrübelerini benimle paylaşan sevgili hocam Yrd. Doç. Dr. Semahat KÜÇÜKKOLBAŞI’ na, ilaç analizleri konusundaki engin bilgi ve deneyimlerini bizimle paylaşan, bu konuda yardımlarını esirgemeyen sayın Prof. Dr. Sibel ÖZKAN’ a ve iyonlaşma sabitlerinin tayini konusunda büyük bilgi desteğiyle, bu tezin yapılmasında sonsuz katkıları bulunan Prof. Dr. Güleren ALSANCAK’a sonsuz şükran ve saygılarımı sunarım.
Tez çalışmalarım boyunca bana laboratuar imkanı sağlayan Kimya Bölüm Başkanı Sayın Prof. Dr. İbrahim KARATAŞ’ a ve Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü’ nde görev yapan çok değerli hocalarıma teşekkür ederim.
Laboratuar çalışmalarım boyunca beni yalnız bırakmayan çalışma arkadaşlarım Şükran KÜÇÜKKARTALLAR’a ve Eda EDİZ’e, yaşamım boyunca hep yanımda olan; sevgi ve desteklerini esirgemeyen aileme, benden desteğini esirgemeyen eşime ve bu süreçteki sabrı için oğluma sonsuz teşekkürlerimi sunarım.
Teslime ERŞAN KONYA-2011
İÇİNDEKİLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi İÇİNDEKİLER ... vii SİMGELER VE KISALTMALAR ... x 1. GİRİŞ ... 1 2. TEORİK KISIM ... 3
2.1. Moleküler Floresans ve Fosforesans ... 3
2.1.1. Floresans ve fosforesans spektroskopisi yöntemleri ... 4
2.1.2. Lüminesans spektrofotometreleri ... 5
2.1.3. Spektroflorometrelerin ayarlanması ... 7
2.1.4. Fotolüminesans kuantum verimi ve floresansı etkileyen faktörler ... 8
2.1.5. Floresans analizin avantaj ve dezavantajları ... 12
2.1.6. Fosforesans ... 13
2.1.7. Fosforesans ölçme ... 13
2.1.8. Florimetri ve uygulama alanları ... 13
2.1.9. Florimetrik uygulamalarda karışımların tayinleri ... 16
2.2. İyonlaşma Sabiti Tayin Yöntemleri ... 19
2.2.1. Potansiyometrik yöntemle iyonlaşma sabiti tayini ... 19
2.2.2. Spektroskopik yöntemle iyonlaşma sabiti tayini ... 20
2.2.3. Sıvı kromatografik yöntemler ... 22
2.2.4. Elektroforetik yöntemler ... 22
2.2.5. Florimetrik yöntemler ... 23
3. ANJİYOTENSİN II RESEPTÖR ANTAGONİSTLERİ ... 26
3.1. Anjiotensin II Reseptör Antagonistlerinin Kimyasal Yapıları ve SPARC Programı İle Hesaplanan Maksimum pKa Değerleri ... 28
3.1.1. Valsartan ... 28
3.1.1.1. Valsartanın makraskopik pKa değerleri ... 29
3.1.1.2. Valsartanın SPARC programında çizilen pH grafikleri ... 30
3.1.2. Losartan ... 30
3.1.2.1. Losartanın makraskopik pKa değerleri ... 31
3.1.2.2. Losartanın SPARC programında çizilen pH grafikleri ... 32
3.1.3. Kandesartan ... 32
3.1.3.1. Kandesartanın makraskopik pKa değerleri ... 33
3.1.3.2. Kandesartanın SPARC programında çizilen pH grafikleri ... 34
3.1.4. Telmisartan ... 34
3.1.4.1. Telmisartanın makraskopik pKa değerleri ... 35
3.1.4.2. Telmisartanın SPARC programında çizilen pH grafikleri ... 36
3.1.5. İrbesartan ... 37
3.1.5.1. İrbesartanın makraskopik pKa değerleri ... 37
3.1.5.2. İrbesartanın SPARC programında çizilen pH grafikleri ... 38
4. KAYNAK ARAŞTIRMASI ... 40
5. MATERYAL VE YÖNTEM ... 47
5.1. Kullanılan Kimyasal Maddeler ... 47
5.2. Kullanılan Çözücüler ... 48
5.3. Kullanılan Cihazlar ... 48
5.4. Çözeltiler ... 49
6. DENEYSEL İŞLEM ... 50
6.1. Çözeltilerin Hazırlanması ... 50
6.1.1. Valsartanın çözeltilerinin hazırlanması ... 50
6.1.1.1. Valsartanın metanol-su ortamındaki çözeltisinin hazırlanması ... 50
6.1.1.2. Valsartanın asetonitril-su ortamındaki çözeltisinin hazırlanması ... 50
6.1.1.3. Valsartanın su ortamındaki çözeltisinin hazırlanması ... 50
6.1.2. Losartanın çözeltilerinin hazırlanması ... 51
6.1.2.1. Losartanın metanol-su ortamındaki çözeltisinin hazırlanması ... 51
6.1.2.2. Losartanın asetonitril-su ortamındaki çözeltisinin hazırlanması ... 51
6.1.2.3. Losartanın su ortamındaki çözeltisinin hazırlanması ... 51
6.1.3. Kandesartanın çözeltilerinin hazırlanması ... 51
6.1.3.1. Kandesartanın metanol-su ortamındaki çözeltisinin hazırlanması ... 51
6.1.3.2. Kandesartanın asetonitril-su ortamındaki çözeltisinin hazırlanması ... 52
6.1.3.3. Kandesartanın su ortamındaki çözeltisinin hazırlanması ... 52
6.1.4. Telmisartanın çözeltilerinin hazırlanması ... 52
6.1.4.1. Telmisartanın metanol-su ortamındaki çözeltisinin hazırlanması ... 52
6.1.4.2. Telmisartanın asetonitril-su ortamındaki çözeltisinin hazırlanması ... 53
6.1.4.3. Telmisartanın su ortamındaki çözeltisinin hazırlanması ... 53
6.1.5. İrbesartanın çözeltilerinin hazırlanması ... 53
6.1.5.1. İrbesartanın metanol-su ortamındaki çözeltisinin hazırlanması ... 53
6.1.5.2. İrbesartanın asetonitril-su ortamındaki çözeltisinin hazırlanması ... 53
6.1.5.3. İrbesartanın su ortamındaki çözeltisinin hazırlanması ... 54
6.1.6. Titrant çözeltisinin hazırlanması ... 54
6.2. Baz Ayarlanması ... 54
6.3. Asit Ayarlanması ... 55
7. ARAŞTIRMA SONUÇLARI VE TARTIŞMA ... 56
7.1. Anjiyotensin II Reseptör Antagonistlerinin Spektroflorimetrik Özelliklerinin Belirlenmesi ... 56
7.1.1. Kandesartanın asetonitril ve metanoldeki emisyon spektrumları ... 56
7.1.2. İrbesartanın asetonitril ve metanoldeki emisyon spektrumları ... 57
7.1.3. Losartanın asetonitril ve metanoldeki emisyon spektrumları ... 59
7.1.4. Telmisartanın asetonitril ve metanoldeki emisyon spektrumları ... 61
7.1.5. Valsartanın asetonitril ve metanoldeki emisyon spektrumları ... 62
7.2. Floresans Şiddetine Çözücü Yüzdesinin Etkisinin İncelenmesi ... 64
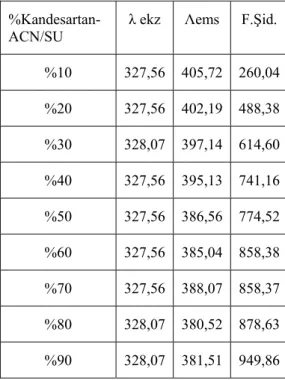
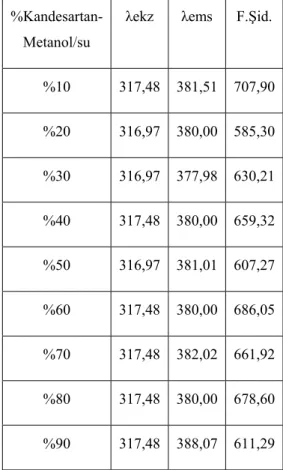
7.2.1. Kandesartanın farklı çözücü yüzdelerinde alınan emisyon spektrumları ... 64
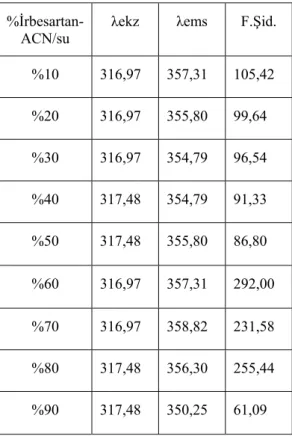
7.2.2. İrbesartanın farklı çözücü yüzdelerinde alınan emisyon spektrumları ... 67
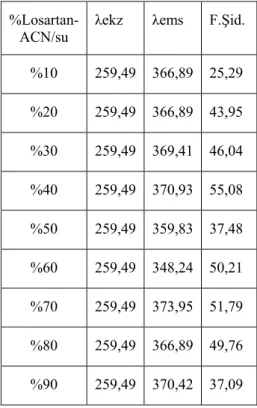
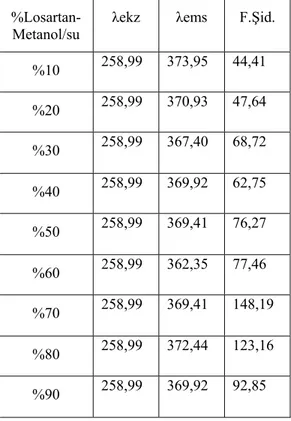
7.2.3. Losartanın farklı çözücü yüzdelerinde alınan emisyon spektrumları ... 69
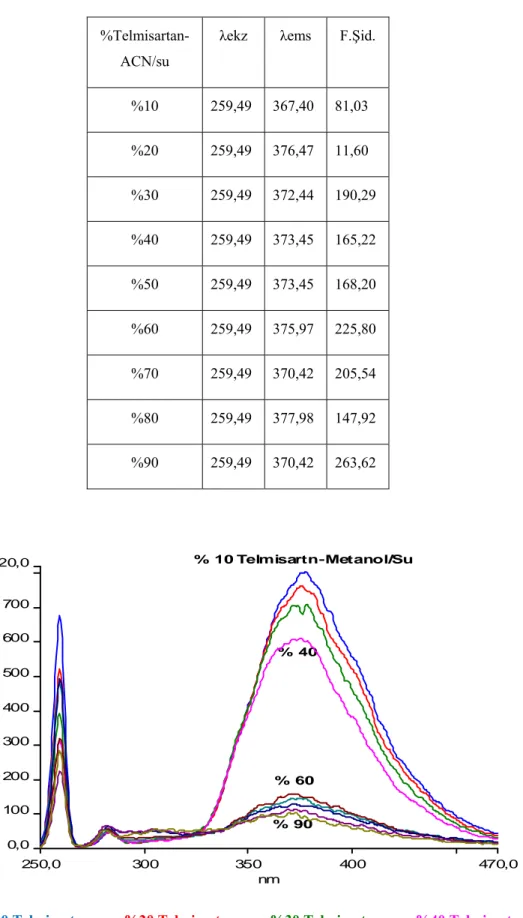
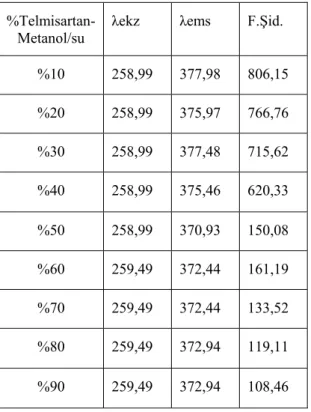
7.2.4. Telmisartanın farklı çözücü yüzdelerinde alınan emisyon spektrumları ... 72
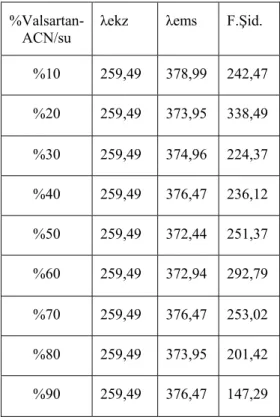
7.2.5. Valsartanın farklı çözücü yüzdelerinde alınan emisyon spektrumları ... 74
7.3. Anjiyotensin Reseptör Antagonistlerinin İyonlaşma Sabitlerinin Tayini ... 77
7.3.1. Spektroflorimetrik yöntemle iyonlaşma sabitlerinin tayini ... 77
7.3.1.1. Losartanın % 10-40 ACN-Su ortamlarında farklı pH’lardaki emisyon spektrumları ... 78
7.3.1.2. Valsartanın % 10-40 ACN-Su ortamlarında farklı pH’lardaki emisyon spektrumları ... 80
7.3.2. ARA II bileşiklerinin pH-floresans şiddeti titrasyon grafikleri ... 82
7.3.2.1. Losartanın %10-40 ACN/Su ortamlarındaki pH-floresans şiddeti titrasyon grafikleri ... 82
7.3.2.2. Valsartanın %10-40 ACN/Su ortamlarındaki pH-floresans şiddeti titrasyon grafikleri ... 84
7.3.3. Spektrofotometrik yöntemle iyonlaşma sabitlerinin tayini ... 86
7.3.3.1. Losartanın % 10-40 ACN-Su ortamlarında farklı pH’lardaki absorpsiyon spektrumları ... 87
7.3.3.2. Valsartanın % 10-40 ACN-Su ortamlarında farklı pH’lardaki absorpsiyon spektrumları ... 91 8. SONUÇLAR VE ÖNERİLER ... 96 8.1. Sonuçlar ... 96 8.2. Öneriler ... 97 KAYNAKLAR ... 98 ÖZGEÇMİŞ ... 102 ix
x SİMGELER VE KISALTMALAR Simgeler α : Bağıl derişim φ : Nötralizasyon kesri Kısaltmalar ACN Asetonitril
ARA Anjiyotensin reseptör antagonistleri
DMF Dimetil Formamit
HPLC Yüksek Performans Sıvı Kromatografisi
IUPAC “International Union of Pure and Applied Chemistry”
PKPOT Potansiyometrik pKa
SPARC “Performs Automated Reasoning in Chemistry”
1. GİRİŞ
İlaçlar, günlük yaşamımızda önemli bir yer teşkil etmektedir. Değişik maksatlarla çok çeşitli ilaçlar kullanılmakta ve bunlara her geçen gün yenileri eklenmektedir. Bunların üretiminden kullanımına hatta vücuttan atılımına kadar olan tüm noktalarda yapılan analizler büyük önem arz eder. İlaçların tablet üretiminde tablet içine konulan miktar, kullanılan kimyasal maddelerin asit-baz özellikleri sağlığımız için çok önemlidir. Alınan dozların fazla olması önemli sağlık problemlerine neden olurken, az olması hastalıkların tedavisine bir fayda sağlamayabilir. Bu yüzden yapılacak olan ilaç analizlerinin titiz bir çalışmadan geçirilmesi insan sağlığı açısından çok önemlidir. Söz konusu olan ilaç analizlerinin yapılabilmesi için, önemli olan öncelikle analiz için kullanılacak aletler ve elde edilecek verilerin anlaşılabilir hale getirebileceği matematiksel metotlardır.
Günümüzde ilaç analizi için HPLC, MS ve ICP gibi son derece hassas ve pahalı birçok cihaz bulunmaktadır. Kullanılan bu yöntemler diğerlerine göre daha karışık ve nispeten pahalı konumdadır. Oysaki, floresans spektroskopisi optik bir yöntem olarak gittikçe artan bir önem kazanmaktadır (Gündüz, 1995). Floresans spektroskopisi yönteminin duyarlı ve seçimli olması, uygulama alanını genişletmiş ve son yıllarda çok fazla kullanılabilir bir metot haline getirmiştir. Ayrıca florimetri farmakolojide klinik numune analizlerinin kullanımının dışında, numunelerde çok düşük derişimlerdeki türlerin tayinine olanak sağladığı için biyokimyada; besin endüstrisinde; nadir toprak elementlerinin analizinde; son yıllarda büyük önem kazanan çevre kimyasında hava ve çevre kirliliğine yol açan bazı zehirli gazların, atık organik bileşiklerin ve eser metal atıklarının tayinlerinde de yaygın olarak tercih edilen bir yöntemdir.
Bu çalışmada insan sağlığı için büyük önem taşıyan antihipertansif ilaç grubu olan Anjiotensin II Reseptör Antagonistlerinin florimetrik olarak pKa hesaplamaları yapılmıştır.
Anjiyotensin II Reseptör Antagonistleri (ARA-II), hipertansiyon ve kalp yetmezliği tedavisinde etkin maddelerdir ve geleneksel anjiyotensin dönüştürücü enzim (ADE) inhibitörlerine alternatif olarak düşünülmüştür. Çünkü bunlar, renin-anjiyotensin sistemde anjiyotensin tip 1’i (AT 1) seçimli olarak bloke edebilirler. İrbesartan, losartan, kandesartan, valsartan ve telmisartan birçok özelliği ADE inhibitörlerininkine benzeyen özgül anjiyotensin II reseptör antegonistleridir. ARA-II’ler oral yolla alımından sonra hızlı bir şekilde absorplanır ve 0,5-4 saat sonra plazmadaki derişimi
maksimum konsantrasyona ulaşabilir. Bununla birlikte, oral yolla alımından sonra bu ilaçların bazıları plazmada ng/ml seviyesindeki düşük derişimlerde oluşur ki bu da onların tayini ve/veya görüntülenmesi için problemler ortaya çıkarır. İnsan vücudunda bu ilaçların tayini için yine de duyarlı bir yöntem oluşturulabilir. Anjiyotensin II Reseptör Antagonistleri amfoterik bileşiklerdir ve yapısal olarak bağlı bifenilkarboksilik asit kısmı içeren telmisartan dışında, aynı bifeniltetrazol kısmına sahiplerdir. Antihipertansif ilaçlar olarak ARA II’lerin iyonlaşma sabitlerinin birkaç uygun yöntem ile tam olarak tayini, etki mekanizmalarının anlaşılmasında ve biyoyararlanabilirlikleri açısından oldukça önemlidir.
Bu nedenle bu çalışmada öncelikle, bu bileşiklerin çeşitli çözücü ortamlarında floresans özelliklerinin incelenmesi ve daha sonra aynı ortamlarda florimetrik ve spektrofotometrik yöntemlerle iyonlaşma sabitlerinin tayini amaçlanmaktadır. Deneysel yöntemlerle elde edilen veriler teorik verilerle, SPARC (online teorik pKa hesaplama programı) sonuçlarıyla ve literatür verileriyle karşılaştırılmıştır.
2. TEORİK KISIM
2.1. Moleküler Floresans ve Fosforesans
Bir atom veya molekülün en kararlı elektron konfigürasyonu elektronların en düşük enerjili orbitallere Hund kuralına göre yerleşimi ile ortaya çıkar ve bu durum atomun veya molekülün temel enerji düzeyini veya temel halini oluşturur. Elektronların daha üst enerji düzeylerine yerleşmesi ile atom veya molekül uyarılmış hale gelir.
Floresans ve fosforesansın her ikisi de, ışın enerjisini absorblayarak uyarılmış hale gelen bir molekül, iyon veya atom tarafından, absorplanan bu ışın enerjisinin ışın yayılması şeklinde geri verilmesi anlamına gelen fotolüminesans’ın çeşitleridir. Uyarılmış bir atom veya molekül kararsızdır; fazla enerjisini atarak temel hale dönmek ister. Atom veya molekül temel enerji düzeyine dönerken fazla enerjisinin tümünü veya bir kısmını ışık şeklinde atabilir ve böylece sistemden bir ışık yayılması (ışık emisyonu) gözlenir. Bu ışık yayılması olayına genel olarak lüminesans denir (Gündüz, 2002).
Uyarılmış bir singlet sistemden temel haldeki singlet bir sisteme geçiş sırasında yayılan ışığa floresans denir. Uyarılmış bir triplet sistemden temel haldeki singlet bir sisteme geçiş sırasında yayılan ışığa fosforesans denir. Uyarılma (eksitasyon) ortadan kalkınca floresans olayı 10-10-10-6s sürer; fosforesans ise 10-6-102s sürer.
• Uyarılma enerjisi bir kimyasal tepkimeden sağlanıyorsa, bunun sonucu gözlenen lüminesans olayına kemilüminesans adı verilir.
• Uyarılma enerjisi elektrot tepkimesinden sağlanıyorsa, bunun sonucu gözlenen lüminesans olayına elektrolüminesans veya elektrokemilüminesans adı verilir.
• Uyarılma olayı atom veya molekülün fotonları absorplaması sonucu gerçekleşiyorsa gözlenen ışık emisyonuna fotolüminesans denir.
Maddenin floresans özelliği üzerine kurulmuş olan tayin metoduna florimetri veya floresans spektroskopisi denir. Bazı yönleriyle absorpsiyon spektroskopisine benzemekle beraber ondan daha üstün özelliktedir. Florimetrik metotların selektiflikleri de yüksektir.
2.1.1. Floresans ve fosforesans spektroskopisi yöntemleri
1.Fotolüminesans emisyonu: Uyarılmış bir singlet sistemden temel haldeki singlet bir
sisteme geçiş sırasında yayılan ışığa floresans (hv2) denir. 1S0 + hv1 1S*II (uyarılma)
1S*1 1S0 + hv2 (floresans)
Uyarılmış bir triplet sistemden temel haldeki singlet bir sisteme geçiş sırasında yayılan ışığa ise fosforesans (hv3) adı verilir.
1S0 + hv1 1S*II (uyarılma) 1S*1 3T* (sistemler arası geçiş) 3T* 1S0 + hv3 (fosforesans)
2. İç dönüşüm: Işın absorpsiyonu sonucu oluşan uyarılmış bir molekül fazla enerjisini
tamamen veya kısmen ışımasız yoldan da atabilir. Bir molekülün elektronik enerji düzeyleri, titreşim enerji düzeylerinin üst üste çakışmasına olanak sağlayacak kadar yakın ise, şekilde gösterilen ve fazla enerjinin ısı şeklinde atıldığı iç dönüşüm olayı gerçekleşir.
1S*II 1S*1 + ısı
3. Sistemler arası geçiş: Uyarılmış singlet türü bir molekülden yine ışımasız yoldan
daha düşük enerjili triplet türü uyarılmış bir molekül oluşabilir. Olasılığı oldukça az olan ve bu nedenle yavaş bir biçimde gerçekleşen bu olayda üst orbitaldeki elektronun spini terse çevrilir. Bu olaya sistemlerarası geçiş adı verilir.
1S* 3T*
4. Çarpışmalı söndürme: Absorpsiyon yapan madde çözelti halindeyse, uyarılmış
madde çarpışmalar sonucu enerjisini titreşim enerjisi halinde çözücünün moleküllerine aktarabilir. Böylece çözücü moleküllerin kinetik enerjileri artar ve ortam az da olsa ısınır. Işın absorpsiyonu için 10-15 s gibi çok kısa bir süre gerekir ve uyarılmış singlet halde bulunan bir molekülün ömrü 10-10–10-6 s, uyarılmış triplet halde bulunan bir
molekülün ömrü ise 10-6–102 s’dir. İç dönüşüm ve sistemlerarası geçiş olaylarının süreleri ise sırasıyla yaklaşık 10-12 s ve 10-8 s’dir. Floresans olayı sistemi uyaran ışıma ortadan kalkınca 10-10–10- 6 s kadar daha sürerken, böyle bir durumda fosforesans 106–102 s kadar daha devam eder. Temel hale dönme süresi maddenin molar absorplama katsayısının artmasıyla azalır.
Oda sıcaklığında S1 düzeyine uyarılmış bir türün, fazla enerjisini kaybederek S1 düzeyinden S0 düzeyine dört farklı şekilde dönmesi söz konusudur (Gündüz, 1995). Şekilde bunlar kısaca açıklanmıştır.
Şekil 2.1. Bir moleküldeki ışımalı ve ışımasız geçişler
2.1.2. Lüminesans spektrofotometreleri
Fotolüminesans ölçümlerinde kullanılan alet Şekil 2.2 de şematik olarak görülmektedir (Skoog, 1996).
Ultraviyole (UV) ve görünür bölgede ışın yayan bir ışık kaynağından gelen ışın bir monokromatörden (uyarma monokromatörü) geçtikten sonra örneğe gönderilir. Örnekten kaynaklanan lüminesans genellikle uyaran ışığa göre 90° lik bir açıdan toplanarak dedektöre ulaşır. Böylece numuneyi uyaran ışının dedektöre ulaşması
önlenir. Lüminesans spektrumunun elde edilmesi için ikinci bir monokromatörün (emisyon monokromatörü) örnek ile dedektör arasına yerleştirilmesi gerekir. Daha basit aletlerle monokromatörler yerine uygun filtreler kullanılır. Filtreli aletlere, kullanıldığı amaca göre florimetre veya fosforimetre, monokromatörlü aletlere ise spektroflorimetre
veya spektrofosforimetre adı verilir. Lüminesans ölçümü yapan aletlerin tek kanallısı
olduğu gibi, çift kanallı türleri de vardır.
Şekil 2.2. Fotolüminesans ölçümleri için kullanılan cihaz
Civa ark lambası hat şeklinde ışık yaydığından çok filtreli aletlerde kullanılır. Ölçümlerin UV bölgesi yerine görünür bölgede yapıldığı durumlarda, tungsten lambası veya çeşitli lazerler de ışık kaynağı olarak kullanılabilir. Fotolüminesans ölçümlerinde kullanılan örnek kapları absorpsiyon ölçümleri için kullanılanların aynısıdır. 320nm’den daha kısa dalgaboylu emisyon ölçümlerinde pireks kaplar yerine kuartz veya silika kaplar kullanılmalıdır. Fosforesans ölçümleri genellikle sıvı azot sıcaklığında (77K) yapıldığından örnek kabı azot içeren bir Dewar kabına yerleştirilir. Kullanılan Dewar kabının uyaran ve yayılan ışını geçiren pencereleri olması gerekir. Fotolüminesans ölçümlerinde kullanılan dedektör, fotoçoğaltıcı tür dedektördür.
Lüminesansın ölçüldüğü dalgaboyu sabit tutulup, uyarma monokromatöründeki dalgaboyu ayarı değiştirildiğinde, bu lüminesansa yol açan uyarıcı ışının spektrumu elde
edilir. Bu spektruma, uyarma spektrumu adı verilir. Uyarma spektrumu, spektroflorimetre ile elde edilmesine yani yayılan ışının ölçümüne dayanmasına rağmen, molekülün absorpsiyon spektrumu ile aynı dalgaboyu aralığında elde edilir ve bir bakıma molekülün düzeltilmemiş absorpsiyon spektrumu gibidir
Uyarma dalgaboyu sabit tutulup emisyon monokromatöründeki dalgaboyu ayarı değiştirilirse, örnek için lüminesans spektrumu elde edilir. Lüminesans spektrumu, uyarma spektrumundan daha uzun dalgaboyu bölgesindedir. Hem uyarma hem de emisyon monokromatöründeki dalgaboyu ayarları aralarında belli bir dalga boyu farkı, Δλ, uygulanarak ve aynı hızda birlikte değiştirilerek lüminesans ölçümü yapılabilir. Bu tür spektrum elde etme yöntemine senkron spektroflorimetri yöntemi denir ve bu yöntem özellikle birden fazla floresant madde içeren karışımların kantitatif analizinde kullanılır. Uyarma, lüminesans ve senkron lüminesans spektrumlara ait örnekler Şekil2.3. ’de görülmektedir.
Şekil 2.3. Antrasenin uyarma, lüminesans ve senkron lüminesans spektrumları
Fotolüminesans ölçümlerinden önce, uyarma ve emisyon spektrumu ve lüminesans kuantum verimi bilinen bir madde ile (örneğin kinin sülfat çözeltisi) ölçüm yapılarak, aletin kalibre edilmesi gerekir.
2.1.3. Spektroflorometrelerin ayarlanması
Bir spektrofotometre kullanmadan önce standart maddelerle ayarlanmalıdır. Bu amaçla çok çeşitli maddeler kullanılabilir. Bunlara florofor maddeler de denir. Florofor
maddelerden en çok kullanılan kinin sülfattır. Kinin sülfat çözeltisi (1.10-5 M) dalga boyu 350 nm olan bir ışınla uyarıldığı zaman dalga boyu 450 nm olan şiddetli bir ışın demeti verir. Salisilik asit de bu amaçla kullanılabilir. Salisilik asit çözeltisi 308 nm dalga boyunda bir ışınla uyarılırsa, o da 450 nm dalga boyunda, bir floresan ışın demeti verir. Bu amaçla çok kullanılan bir başka ayar maddesi de asetil salisilik asittir (ASA). Bu madde 278 nm dalga boyunda bir ışınla uyarıldığında 335 nm dalga boyunda şiddetli bir floresans ışını verir (Gündüz, 1995).
2.1.4. Fotolüminesans kuantum verimi ve floresansı etkileyen faktörler
Yayılan foton sayısının, absorblanan foton sayısına oranı o molekülün
fotolüminesans kuantum verimi, φ, olarak tanımlanır. Uyarılmış singlet molekülün
enerjisi ile temel haldeki molekülün enerjisi birbirinden ne kadar farklı ise, iç dönüşüm olayının olasılığı o kadar azalır ve dolayısıyla floresans verimi artar. Benzer biçimde bir molekülün uyarılmış triplet hallerinin enerjileri ne kadar farklı ise sistemlerarası geçiş olasılığı o kadar azalır ve floresans verimi artar. Uyarılmış singlet ve uyarılmış triplet hallerinin enerjileri birbirlerine yaklaşırsa, sistemlerarası geçiş olasılığı o kadar azalır ve fosforesans verimi artar. Hem maddenin çevresi, hem de yapısı floresans özelliğini (floresans verimi, emisyon dalga boyu ve ışın şiddetini) büyük ölçüde etkiler. Bunlardan başlıcaları aşağıda açıklanmıştır (Skoog, 1998 ve Gündüz, 2002).
1. Maddenin yapısının etkisi 2. Yapısal rijiditenin etkisi 3. Sıcaklık ve çözelti etkisi 4. pH etkisi
5. Çözünmüş oksijen etkisi
6. Gelen ışının dalga boyunun ve şiddetinin etkisi 7. Konsantrasyon etkisi
1. Maddenin yapısının etkisi: Moleküllerde düzlemsellik, dönmenin engellenmiş
olması, konjugasyon ve halka sayısının artması genellikle floresans verimini arttırır. Halkalı bir organik molekülde halkanın elektron yoğunluğunu arttıran sübstitüentler de molekülün floresans veriminin artmasını sağlar.
En şiddetli floresans ışınlarını yapısında düşük enerjili π π* geçişine imkan veren aromatik halka ihtiva eden bileşikler verir. Ayrıca yapısında çok sayıda konjuge çifte bağ ihtiva eden alifatik ve alisiklik aromatik halkalar da floresan özellik
gösterirler. Ancak, bunların sayısı aromatik bileşiklerin sayısına göre çok azdır. Birçok sübstitüe olmamış aromatik bileşik floresan özellik gösterir. Bunların kuantum verimleri halka sayısıyla ve bu halkaların kondanse olma dereceleriyle orantılı olarak artar. Ancak, aromatik olmalarına rağmen, floresans özelliği göstermeyen bileşikler de vardır. Bunlara piridin, furan, pirol gibi maddeler örnek verilebilir.
Bunun nedeni; böyle bileşiklerde en düşük enerjili geçişin n π* olmasıdır. Bu tip bir geçiş sonucu uyarılan maddeler kolylıkla triplet hale geçerler ve sadece fosforesans özellik gösterirler. Buna karşılık bunlara bir benzen halkası kondense olursa, molar absorptiviteleri artar. Bilindiği üzere molar absorptivitesi artan bir maddenin uyarılmış ömrü çok kısalır. Ömrü böle kısa olan maddeler de şiddetli floresans ışını yayarlar. Buna göre yukarıda verilen halkalardan meydana gelen kinolini indol gibi maddeler oldukça şiddetli floresans özelliği gösterirler(Gündüz, 1995).
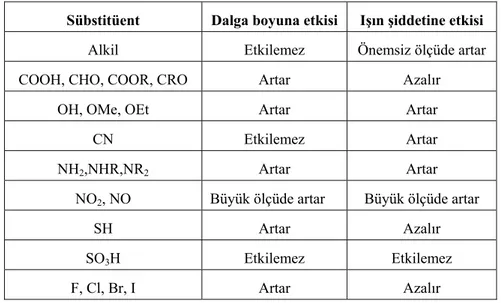
Floresans verimine sübstitüentlerin etkisi, benzen halkası ve benzen halkasına bağlanan bazı sübstitüentler üzerinde incelenecek olursa, benzen halkasının sübstitüsyona uğradığı zaman hem absorpsiyon, hem de floresans bandında bir değişmenin olduğu ve floresans şiddetinin de çoğu kez değiştiği görülür. Buna bazı örnekler aşağıdaki tabloda verilmiştir.
Çizelge 2.1. Benzenin floresans özelliğine sübstitüsyonların etkisi (etanol içinde)
Madde Floresans dalga boyu(nm) Bağıl floresans şiddet
Benzen 270-310 10 Toluen 270-320 17 Propilbenzen 270-320 17 Florobenzen 270-320 10 Klorobenzen 275-345 7 Bromobenzen 290-380 5 İyodobenzen --- 0 Fenol 285-365 18 Fenolat 310-400 10 Anisol 285-345 20 Anilin 310-405 20 Anilinyum iyonu --- 0 Benzoik asit 310-390 3 Benzonitril 280-360 20 Nitrobenzen --- 0
Lüminesant bir bileşikteki, bileşiğin pi (π) elektronlarını delokalize edebilen sübstitüentler genellikle, uyarılmış singlet hal ve temel hal arasında oluşan muhtemel bir ışın geçişini arttırır. Bu sonuç floresansı da arttırır. Genellikle orto- ve para- pozisyondaki sübstitüentler halkaya elektron verirler ve muhtemelen oluşacak floresansı arttırırlar. Meta-pozisyondaki sübstitüentler halkadan elektron çekerler ve muhtemel floresansı azaltırlar. Aromatik bileşiklerin floresansına bilinen bazı sübstitüentlerin etkileri aşağıdaki tabloda verilmiştir.
Çizelge 2.2. Emisyon dalga boyu ve ışın şiddetine birkaç sübstitüentlerin etkilerinin listesi
Sübstitüent Dalga boyuna etkisi Işın şiddetine etkisi
Alkil Etkilemez Önemsiz ölçüde artar COOH, CHO, COOR, CRO Artar Azalır
OH, OMe, OEt Artar Artar
CN Etkilemez Artar
NH2,NHR,NR2 Artar Artar
NO2, NO Büyük ölçüde artar Büyük ölçüde artar
SH Artar Azalır
SO3H Etkilemez Etkilemez
F, Cl, Br, I Artar Azalır
Molekülün bünyesinde veya molekülün çözündüğü çözücüde bulunan ağır bir atom (I veya Br gibi) molekülün floresans verimini azaltır, triplet oluşumu verimini arttırır ve bu nedenle genellikle fosforesans verimi artar.
2. Yapısal rijiditenin etkisi: Bir molekülün yapısının rijid (sabit, hareketsiz) olması
onun floresans özelliğini arttırır. Örneğin, florenin floresansı bifenilden beş defa daha şiddetlidir.
CH2
Floren Bifenil
Floresans özelliği gösteren boya, bir yüzeyde adsorbe edilince emisyon şiddeti daha da artar. Bunun nedeni boyanın tutulduğu yüzeyde rijiditesinin artmasıdır.
Şelat kompleksi veren bir ayıraç bir katyonla kompleks verdiği zaman, rijiditesi ve dolayısıyla floresans emisyonu artar. Örneğin çinko katyonunun 8-hidroksikinolinle verdiği kompleksin floresansı şiddetlidir.
N O
Zn
2
Rijid olmayan moleküllerde iç dönüşme daha kolay olduğundan, ışımasız enerji kaybı olasılığı çok daha fazladır. Bu hal, bilindiği gibi, floresans şiddetini azaltır. Bundan başka rijid olmayan bir molekülün bir tarafı, öteki tarafına göre daha zayıf enerjiyle uyarılmış olabilir. Bu da floresans emisyonunu azaltan bir etkendir.
3. Sıcaklık ve çözücü etkisi: Uyarılmış molekül, temel haline oranla daha polar ise,
çözücünün polaritesinin artması ile uyarılmış enerji düzeyi daha kararlı hale geleceği için, uyarılmış ve temel enerji düzeyleri arasındaki enerji farkı azalır ve floresans dalga boyu artar. Bu durum, uyarılma ve emisyon olaylarının π ve π* orbitalleri arasında gerçekleştiğinde ortaya çıkar. n→π* türü bir uyarılma için ise, çözücünün polaritesinin artması ile n orbitalinin daha kararlı hale gelmesi, yani enerji-sinin azalması söz konusudur. Böylece, bu tür moleküllerde çözücü polaritesi arttıkça uyarılmış ve temel enerji düzeyleri arasındaki enerji farkı artar ve floresans dalga boyu azalır.
Sıcaklığın artması ile uyarılmış moleküllerin çarpışma olasılığı da artacağından iç dönüşüm olayının verimi artar ve floresans verimi azalır. Fosforesans verimi, sıcak-lık azalması ile önemli ölçüde artar.
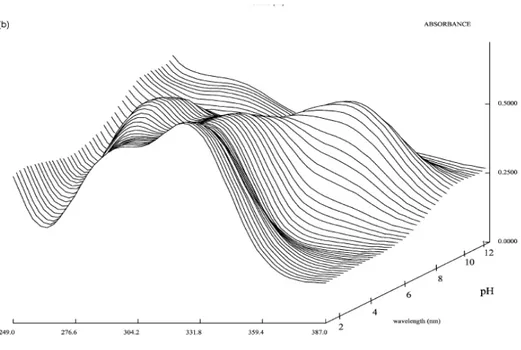
4. pH etkisi: Proton aktarımı reaksiyonları çok hızlı reaksiyonlar olduğundan proton
aktarımının temel durumdaki moleküllerde olduğu gibi, uyarılmış moleküllerde de gerçekleşme olasılığı çok yüksektir. Ortamın pH’sındaki değişmeler, hem temel hem de uyarılmış molekülleri etkileyeceği için pH, bir molekülün floresans verimini etkileyen bir faktör olabilir. Asit veya baz grubu içeren maddelerin iyonlaşmış ve iyonlaşmamış hallerinin floresans ışımalarının dalga boyları ve şiddetleri birbirlerinden farklıdır.
5. Çözünmüş oksijen etkisi: Çözücü ile hidrojen bağı yapabilen moleküllerde çözünmüş
oksijen ile molekülün yaydığı ışını absorplayabilecek bir başka madde, lüminesans verimini önemli ölçüde azaltır. Özellikle fosforesans çalışmalarında çözünmüş oksijenin ortamdan uzaklaştırılması gerekir. Çözünmüş oksijen genellikle floresans ışımasının
şiddetini azaltır. Moleküler oksijen paramanyetik olduğundan, singlet halin triplet hale dönüşmesini kolaylaştırıp floresansı azaltır. Öteki paramanyetik maddeler de benzer şekilde davranırlar.
6. Gelen ışının dalga boyunun ve şiddetinin etkisi: Lüminesans verimi, sadece iç
dönüşüm, sistemler arası geçiş ve enerji aktarımı gibi fiziksel olaylarla değil, uyarılmış düzeylerde ortaya çıkabilecek bağ kopması (fotoayrışma) ve ürün oluşması (fotokimyasal reaksiyon) gibi olaylar yüzünden de azalabilir. Ayrıca gelen ışının şiddetinin (yoğunluğunun) artması floresansı arttırır.
7. Konsantrasyon etkisi: Floresans ışımasının şiddeti, maddenin derişimiyle orantılıdır.
Floresans, derişim arttıkça artar, ancak belli bir noktada derişim çok fazla arttırıldığında artık derişimle orantılı olarak artmaz ve hemen hemen sabit kalır.
Kemilüminesans olayında molekülün yaydığı ışıma, molekülün floresans, fosforesans veya ekzimer emisyonu spektrumunun aynısıdır. Yani, kemilüminesansda ışımanın başladığı hal, uyarılmış singlet veya triplet halidir (Gündüz, 1995).
2.1.5. Floresans analizin avantaj ve dezavantajları
Floresans analizin başlıca iki avantajı, spektrofotometrik analizden çok daha düşük derişimlerde ölçüm yapılabilmesi ve potansiyel olarak çok daha seçici olmasıdır. Çünkü uyarma ve emisyon dalga boylarının her ikisi de değiştirilebilir. Ayrıca ve en önemli avantajı florimetrik analizin, numunenin molar absorptivitesi, kuantum verimi ve kaynağın şiddetine bağlı olarak 10-8-10-9 M’ a kadar duyarlı olmasıdır. Molar absorptivite veya kuantum verimi küçük olduğunda, kaynak veya monokromotor, istenildiği gibi ayarlanabilir. Bu ayarlama normalde absorpsiyon spektrofotometresinde yapılamamaktadır (Gündüz, 1995).
Diğer bir avantajı aynı zamanda dezavantajı da, sadece bazı aromatik molekül-lerin floresant olmasıdır. Bu floresant olmayan aromatik moleküller kadar bütün asiklik ve alisiklik molekülleri florimetriden dışlar, dolayısıyla bir floresant aromatik molekül ve birkaç asiklik veya alisiklik molekül içeren bir karışım analiz edildiği zaman elbette bir avantajdır.
Floresans analizde diğer dezavantajlar, istenmeyen uyarılmış düzey etkileşme-leriyle meydana gelmektedir. Bu olay, kuançing yani söndürme şeklinde ortaya çıkar. Birçok floresant olmayan molekülden dolayı, hatta eser miktarlarda, S1 düzeyindeki floresant bir molekülü söndürebilir, bu nedenle de bir ayırma işlemi yapmaksızın
kompleks karışımının doğrudan analizi nadiren yapılabilir. İkinci olarak, ultraviyole ışınla uyarıldığı zaman, organik bileşiklerin çoğunda fotokimyasal reaksiyonlar olur. Özellikle şiddetli kaynaklarla kantitatif analitik ölçümler yaparken fotoparçalanma-dan kaçınılmalıdır.
Son olarak, floresans analizde diğer bir genel dezavantaj, çok yüksek kesinlik veya doğruluk göstermemesidir, tipik bir doğruluk seviyesi ± % 2-10’dur. Pek çok numune için, günümüzde yüksek duyarlılık, seçicilik ve doğruluğa sahip florimetrik analiz yöntemleri geliştirilmektedir.
2.1.6. Fosforesans
Uyarılmış bir molekülün temel haline dönmesi fosforesan ışınları yaymak suretiyle de gerçekleşebilir. Bir molekülde singlet-triplet geçişinin ihtimali, triplet-singlet geçişinin ihtimalinden çok daha fazla olduğundan, fosforesans ışınları meydana gelir. Ancak bunlar şiddet bakımından floresan ışınlarından daha zayıftır. Uyarılmış bir fosforesan halin ömrü 10-4 saniyeden dakikalara hatta saatlere kadar uzayabilir. Bunun sonucu olarak, uyarıcı ışın kaynağı ortadana kaldırıldıktan sonra bile molekül bir süre daha ışın yaymaya devam eder (Gündüz,1995).
2.1.7. Fosforesans ölçme
Fosforesans ölçmede kullanılan cihazlar floresans ölçmede kullanılan cihazlara benzer. Onlardan sadece iki bakımdan farklıdır. Bunlar;
1. Numuneyi kesikli olarak uyaran bir mekanik sistem ve numune kabı,
2. Aydınlatmadan belirli bir süre sonra fosforesans ışınlarının şiddetini ölçen bir cihazdır.
Bu iki parça spektroflorometreye monte edilirse, spektroflorometre cihazı, fosforesans ölçmelerinde de kullanılır (Gündüz, 1995).
2.1.8. Florimetri ve uygulama alanları
Florimetri, çok düşük derişimlerdeki numunelerin tayinine olanak sağladığı için besin endüstrisinde, farmakolojide, klinik numunelerde, biyokimyasal bileşiklerin analizinde, hava ve çevre kirliliği tayinlerinde, tarım kimyasında ve pek çok organik ve
inorganik bileşiğin analizinde tercih edilen bir enstrümental yöntemdir. Bütün bu uygulama alanları ve florimetrik olarak tayin edilen bazı maddeler Çizelge 2.3’ de verilmiştir.
Ayrıca florimetrinin analitik uygulanmasında rutin olarak aşağıdaki üç gruptan biri tercih edilir.
a. Analit molekülün kendi doğal floresanının ölçüldüğü direkt metotlar:
Nadir toprak elementlerinin analizleri ve floresans özelliğe sahip uranil (IV) iyonunun(UO2+2) tayini, floresein, rodamin-B, kuvartz ve bir kalsiyum florür minerali olan fluorspar’ın tayini örnek olarak verilebilir.
b. Floresent olmayan bir analitin, floresent bir türeve dönüştürüldüğü veya
floresent olan bir kompleks oluşturmak üzere şelatlaştırıcı bir madde (ajan) ile analitin reaksiyonuna dayanan türevlendirme metotları: Bazı organik bileşiklerin geçiş metal
katyonlarıyla verdikleri kompleks bileşiklerin tayini, benzokinonun siyanürle reaksiyonuyla floresent 2,3-disiyano-dihidroksikinon halinde tayini örnek olarak verilebilir.
c. Analitin quenching (engelleme, söndürme) etkisinin, bazı floresans
türlerin analitik sinyalinin şiddetinin azalmasına sebep olduğu quenching metotları: Bu
metodun prensibi, floresent türlere ait floresans emisyonunun analit tarafından söndürülmesidir. Bunun sonucunda da analit konsantrasyonu artarken floresans şiddeti düşer. Floresans, floresent türlerin analit ile kimyasal bir reaksiyon vererek bozulmasından dolayı azalır. Bu metot, farklı quenching etkisine sahip birden fazla benzer özellikteki maddenin seçimli olarak tayin edilmesinde kullanılan bir metottur. Örneğin, halojenürlerin seçimli tayinleri (Cl-, Br-, I-) kinin üzerine farklı engelleme etkisinde bulunma özelliklerinden yararlanarak yapılabilir. Quenching verimi halojenin kütlesiyle orantılı olarak artar.
Metodun dezavantajı; tamamen spesifik olmaması ve ölçülen floresans şiddetinin artan konsantrasyona karşılık azalmamasıdır. Be nedenle kalibrasyon eğrisi doğrusal değildir (Gündüz,1995).
Çizelge 2.3. Florimetrinin bazı uygulama alanları
KULLANIM ALANI ANALİT TÜRÜ ÖRNEKLER
İnorganik bileşiklerin analizi
Anyonlar Siyanür, florür, sülfat, iyodür, bromür, klorür, nitrat, fosfat
Katyonlar
Alüminyum, arsenik, berilyum, bor, kadmiyum, seryum, kalsiyum, galyum, demir, lityum, mağnezyum, nadir toprak elementleri, selenyum, kalay, tungten, silisyum, çinko,
zirkonyum
Organik bileşiklerin analizi
Aromatik Hidrokarbonlar
Benzen, toulen, o–, m–, p–ksilenler, mesitilen, fenol, krezol, o–, m–, p–hidrobenzoik asitler, anilin, o–, m–, p–anisidinler, bifenil, bibenzil,
difenilamin, bibenziletilen, difenilmetan, floren, naftalen, antrasen, fenantren ve benzeri
halkalı bileşikler Heterosiklik bileşikler
Piridin, pirol, diazin, piron, kinolin, akridin, karbazol, alloksazin, lumazin, kumarin ve
benzerleri
Organik boyalar akridin, reomin–A, magdala kırmızısı, safranin, Fluoran, floresein, eosin, eritrosin, rodamin–B, tionin, metilen mavisi
Asit, alkol, aldehit ve ketonlar
Etandikarbosilik asit, antranilik asit, umbelliferon-4-karbosilik asit,
1,3-dihidroksibenzen (rezorsinol), 1,2-diformilbenzen (ftalaldehit), 3,5-diasetil-1, 4-dihidroksi-2, 6-lutidin, 2-difenilasetil-1, 3-indandion-1-monohidrazon
Tarım kimyası
İnorganik tarımsal
bileşikler Selenyum, mağnezyum, bor florürler, alüminyum ve kalay bileşikleri Organik tarımsal
bileşikler İnsektisit ve pestisitler Tabii ürünler Klorofiller, pigmentler Vitaminler A1, B1, B2, B6, C, D ve E
Proteinler Süt proteinleri (kazein, laktik asit)
Sağlık hizmet sektörü ve çevre kimyası
Çevre kirliliği yapan bileşikler
İnsektisit kirlilik ürünleri, su ve hava kirlilik ürünleri (azot bileşikleri, sülfür bileşikleri,
ozon ve bazı kanserojen aromatik hidrokarbonlar
Zehirli metal Bileşikleri
Berilyum, bor, kurşun, uranyum, kadmiyum ve bileşikleri
Besin kimyası
Karbonhidratlar Glukoz, fruktoz, maltoz, laktoz, sellobiyozun rezorsinol ve ksantenon ile türevleri
Farmakoloji İlaçlar
Barbitüratlar, salisilatlar, aspirinden salisilik asit, indol, prokain penisilin, alkaloidler, LSD (lizerjik asit dietilamid), tetrasiklinler, N-asetil
sistein
Bakteriyoloji Bakteri Çeşitli bakteri teşhis ve sayımları İmmünoloji Kan numuneleri Floresant antikor ve antijenler
Klinik patoloji
Elektrolit Ca2+, Mg2+, inorganik sülfat ve fosfatlar
Steroidler Kortikosteroidler, östrojen, projesteron, androjen, testosteron, adrenalin
Lipidler Lipoproteinler, fosfolipitler, kolesterol, trigliseritler
Plazma proteinleri, aminoasitler ve
metabolitler
Serum albümini, adenin, sistein, guanidin, triptofan, serotonin, fenilalanin, tirozin, katekolaminler, tiramin, 3-OH tiramin, histidin,
histamin, kreatinin, arjinin, homovanilik asit, kinurenik asit, folik asit (nikotinamid), kan
glikozu, porfirinler, karbosilik asitler ve ketonlar, kandaki üre azotu, NH3, hippurik asit,
hemoglobin demiri, kolesterol, kortizon Enzimler kreatinkinaz, LDH-izoenzimler, peroksidazlar Dehidrojenazlar, transaminaz, fosfataz, lipaz, Alkaloidler Kodein, morfin, papaverin, nikotin
2.1.9. Florimetrik uygulamalarda karışımların tayinleri
Analit içerisinde birden çok lüminesent bileşik mevcutsa, analizler çok daha zor olur. Bir karışımdaki birden çok bileşiğin aynı anda tayinine olanak sağlayan çeşitli metotlar bulunmaktadır. Karışım, eğer mümkünse bileşenlerine ayrılmalı ve her bir bileşen ayrı ayrı tayin edilmelidir. Bu işlem biraz yorucudur ve analizle ilgili ekstra basamaklar nedeniyle hataların artmasına sebep olabilir. Genellikle ön ayırmasız analiz yapma daha iyidir.
Karışımlar, bileşenlerin aksitasyon (uyarılma) ve emisyon spektrumundaki farklılıkların sağladığı avantajlardan dolayı spektrofotometreler kullanılarak çok kolay bir şekilde tayin edilebilirler. Eğer bilşenlerden biri eksitasyon spektrumunda diğer bileşenin hiç ışık absorplamadığı bir dalga boyuna sahipse, bu bileşen bu dalga boyuna kadar ışık kaynağı ve hücre arasındaki monokromatör ayarlanarak tayin edilebilir. Yalnızca bir bileşen uyarıldığı için, sadece bu bileşen ışık yayabilir ve bu tayin, diğer bileşenlerin bozucu etkilerinden bağımsızdır. Bu metodun kullanımı, temel halde bulunan çözeltideki diğer analit olmayan moleküller ve uyarılmış haldeki analit arasında enerji transferinin olmadığını kabul eder.
Benzer şekilde, bilşenin emisyon spektrumunda yalnızca bir bileşenin ışık yaydığı bir dalga boyu bulunuyorsa, hücre ile dedektör arasındaki monokromatör bu
değere göre düzeltilebilir. Yine tayin, diğer bileşenlerin bozucu etkisinden bağımsız olabilir, çünkü diğer bileşenlerin hiçbiri seçilen dalga boyunda ışık yaymaz.
Maalesef pek çok maddenin eksitasyon spektrumu ve emisyon spektrumunun her ikisi de geniştir ve bundan dolayı karışımdaki diğer bileşenlerin spektrumuyla girişim (overlap) yapması muhtemeldir. Bu durumda, farklı dalga boylarında absorpsiyon yapan maddelerin aynı anda tayin edilmesinde UV ve görünür bölge spektrumlarındakine benzer problemler meydana gelir. Karışımın her bir bileşeni için belirli bir eksitasyon ve emisyon dalgaboyu seçilir. Herbir bileşen için, belirli bir dalga boyunda konsantrasyonun (C) değişmesiyle cihazın lüminesent cevabındaki değişim (K) deneysel olarak saf bileşenlerin standart çözeltilerinden tayin edilir ve eş zamanlı bir seri eşitlik belirli bir dalga boyunda kurulur.
Eşitlikler aşağıdaki şekilde verilir;
I (karışım, dalgaboyu 1) = K (Bileşen 1, dalgaboyu 1) C1 +K (Bileşen 2, dalgaboyu 1) C2 + ………..
+K (Bileşen N, dalgaboyu 1) CN (2.1) Karışımın lüminesansı belirlenen her dalgaboyunda ölçülür, alınan lüminesent cevabı ve karışımın lüminesansı eş zamanlı herbir eşitlik içerisinde yerine konur ve eşitlikler bileşenlerin her birinin konsantrasyonu için çözülür.
Karışımındaki bileşenlerin florimetrik analizi için uygulanacak bir başka yöntem ise senkron florimetridir. Şekilde bir hidrokarbon karışımını içeren çözeltinin normal floresans spektrumu ile senkron florimetri yöntemiyle elde edilen spektrum görülmektedir.
Şekil 2.4. Bir hidrokarbon karışımının normal ve senkron floresans spektrumu
Şekilden görüldüğü gibi, normal floresans spektrumu, sabit bir uyarma dalga boyu ayarlanarak ölçülmüş olup, elde edilen spektrumda iki bileşenin spektrum bantları
birbiri içine girmiştir. Uyarma ve emisyon dalga boylarının her ikisinin birden aralarında belli bir dalga boyu farkı ile taranması sonucu elde edilen senkron sinyal ise her bir bileşenin floresans spektrumunun belli dar bir kısmını içermektedir. Böylece bileşenlere ait sinyaller birbiri ile örtüşmeden elde edilir ve bileşenlerin nicel analizleri daha kolay yapılabilir.
Alternatif olarak, karışımın emisyon spektrumu kaydedilebilir ve bir bilgisayar her bir komponent için spektrumun kısımlara ayrılmasında kullanılır. Ayrılan spektrum bileşenlerin konsantrasyonunu hesaplamak için kullanılır. Fosforesent çalışmalar için kullanılan bazı cihazlar, bir titreşim kaynağının kullanımında ve her bir döngüde kaynağın kapatılmasından sonra farklı zamanlarda lüminesans ölçümünde hassaslardır. Titreşim lazerleri de bu çalışmalarda kaynak olarak kullanılabilir. Farklı bileşenler farklı emisyon ömrüne sahiplerse, analizler, ölçüm zamanının bir fonksiyonu olarak lüminesent şiddetinin logaritmasının bir grafiği hazırlanarak yapılabilir. Bileşenlerin ömürleri önemli ölçüde farklıysa, grafik her bir bileşen için doğrusal bir kısma sahiptir. Sıfır noktasına ekstrapolasyondan sonra her bir lineer kısma karşılık gelen ışık şiddeti, karşılık gelen konsantrasyonla orantılıdır. Çalışma eğrisi metodu, standart çözeltilerle hazırlanan benzer grafikler çizildikten sonra kullanılır. Karışımdaki maddeleri tayin etmek için birkaç metot daha kullanılabilir, fakat genellikle bu metotlar pek çok laboratuarda mevcut olmayan cihazlara gereksinim gösterir (Gündüz, 1995).
Yapılan bazı çalışmalarda karışımlar nitel ve nicel olarak senkron floresans spektroskopisi ile incelenmiştir. Senkron yöntemi ile ilk çalışmalar 1970 lerde Llyod tarafından yapılmıştır.
Örneğin Llyod tarafından ilk olarak yapılan bir çalışmada antrasen, benzopiren, perilen benzoflaranten karışımları ölçülerek kıyaslanmış ve sonuçların senkron yöntemiyle daha net şeklide sonuçlar verdiği tespit edilmiştir.
Yine aynı şekilde (senkron yöntemi ile) yapılan bir çalışmada adli olaylar incelenmiş, kurum, katran, petrol atıkları, yağ damlacıkları, kauçuk gibi madde karışımlarının çok az miktarlardaki numuneleri kolaylıkla tayin edilmiştir.
Vo-Dinh ve ark. tarafından yapılan bir çalışmada ise öncesinde herhangi bir ayrıştırma işlemi yapılmadan kömür ekstraktından seçilmiş polinükleer hidrokarbonlar kolaylıkla tespit edilmiştir.
Latz ve ark. tarafından yapılan bir çalışmada Antrasen, 9-10 difenilantrasen, perilen ve tetrasen in tekli ve ikili karışımları çalışılmış ve senkron yöntemi ile ayrıştırmaları kolaylıkla sağlanmış.
2.2. İyonlaşma Sabiti Tayin Yöntemleri
İyonlaşma sabiti bir molekülün iyonlaşma davranışını belirleyen parametredir. İyonlaşma sabitlerinin sudaki tayinleri, bileşiğin sudaki çözünürlüğünün az olması durumunda su-organik çözücü ikili karışımlarının kullanılmasını zorunlu kılar. Günümüzde su-organik çözücü karışımları, sıvı kromatografik, kapiler elektroforetik ayırmalarda kullanılması nedeniyle tercih edilmektedir. Ayrıca bu ortamlarda suyun kendi hidrojen bağlı sistemini oluşturabildiği koşulda pH aynen sudaki gibi belirlenebilmektedir. Bu nedenle suda çözünmesi yeterli olmayan ve su ortamında iyonlaşma sabitleri tayin edilemeyen bileşiklerin bu sabitlerinin tayinlerinde sıklıkla su-organik çözücü ikili karışımları kullanılır.
İyonlaşma sabitlerinin tayininde alternatif yöntemler kullanılmaktadır. Bunlar; 1. Potansiyometrik yöntemler
2. Spektroskopik yöntemler 3. Sıvı kromatografik yöntemler 4. Elektroforetik yöntemler 5. Florimetrik yöntemler dir.
2.2.1. Potansiyometrik yöntemle iyonlaşma sabiti tayini
İyonlaşma sabitlerinin tayininde bilinen ilk yöntemdir. Potansiyometrik titrasyon düzeneği, sıcaklık kontrollü ve inert atmosfer uygulanabilir şekilde hazırlanır. Kullanılan elektrodun kararlı ve çalışılan ortama uygun olması gereklidir. Son zamanlarda elektrot teknolojisindeki gelişmeler tekrarlanabilirlik ve duyarlığı yeterli hale getirmiştir. Su-organik çözücü karışımlarında IUPAC'ın önerdiği titrant KOH'dir. Ayarlı olması gerekir; titrasyon karbonat hatası getirmeyecek koşulda yapılmalıdır. İyonlaşma sabitinin tayininde son zamanlarda su-organik çözücü karışımlarında elektrot standardizasyonları yapılabildiği için elde edilen iyonlaşma sabitleri, termodinamik değerlerdir. Tüm titrasyon koşullarını, iyonik şiddet de dâhil olmak üzere dikkate alan ve sistematik yaklaştırmayı temel alan doğrusal olmayan (non-lineer) regresyon programları bu amaçla kullanılmaktadır. Su-organik çözücü karışımlarının özelliklerinin bilinmesi, iyonlaşma sabitlerinin yorumlanmasını sağlamaktadır. Potansiyometrik yöntemle iyonlaşma sabiti tayininde 3–5 mM derişim yeterlidir. Suda çözünmeyen ve bu nedenle su ortamında iyonlaşma sabitleri tayin edilemeyen ilaçların iyonlaşma
sabitleri potansiyometrik yöntemle su organik çözücü karışımında tayin edilir. Bu çalışmalarda iyonik şiddet fizyolojik iyonik şiddet olan 0,15 M değerine ayarlanır. Yasuda –Shedlovski ektrapolasyonu uygulanarak sudaki değer belirlenir (Takacs-Novak ve ark., 1997; Avdeef ve ark., 1999).
Potansiyometrik pKa tayini, potansiyometrik titrasyonda bileşiğin derişimi sıçrama aralığını yeterli sağlayacak şekilde seçilir. Suyun otoprotoliz değerleri bellidir. Ancak su-organik çözücü karışımları ile çalışmada su-otoprotoliz değerleri gereklidir. Bu tip bir çalışmada öncelikle potasyum asit ftalatın titrasyonu ile kuvvetli baz, kuvvetli bazın titrasyonu ile asit ayarlanır.Veriler uygun şekilde kullanılarak otoprotoliz sabitine geçilir. Kuvvetli asit - kuvvetli baz titrasyonundaki veriler, bazda karbonat hatasının belirlenmesine imkan sağlar.İyonik şiddet sıklıkla 0,1 M olarak kullanılır.
Titrasyon verilerinden pKa hesaplanmasında; • Gran
• 1.türev • 2.türev
Shwartz fonksiyonları kullanılır.
2.2.2. Spektroskopik yöntemle iyonlaşma sabiti tayini
İyonlaşma sabitleri spektrofotometrik ölçümler ile de tayin edilebilir (Polster ve Lachmann, 1989). Bunun için belli bir dalga boyu aralığında kaydedilen absorbans verilerinden yararlanılır. Bu tayinde aşağıdaki bağıntı esas alınmaktadır.
A abs - AM
pK = pH + log (2.2) AI – Aabs
Bu bağıntıda AM moleküler formun, AI iyonlaşmış türlerin absorbans değerlerini ifade etmektedir. Absorbans pH a karşı grafiğe geçirilerek veya log ((A-A’)/(A’’-A)) pH ya karşı grafiklenerek kesim noktasından pKa değerleri bulunabilir (Şekil 2.5.). Spektrofotometrik yöntemin avantaj ve dezavantajları şunlardır;
• Yöntemin doğruluğu ve kesinliği yeterlidir. • 10-5 – 10-6 M derişim çalışma için uygundur. • Çalışılan bileşikler saf olmalıdır.
• Yapıda en az bir tane kromofor grubun bulunması ve bunun absorbans özelliklerinin yeterli olması gereklidir.
• Nötral ve iyonlaşmış formların spektral özelliklerinin yeterince farklı olması gerekir.
Şekil 2.5. Spektroskopik bir çalışmada (a) A - λ/nm ve (b) log absorbans farkı – pH grafikleri (A’:
moleküler türün absorbansı; A’’: iyonik türün absorbansı)
Spektroskopik yöntemle tayinde günümüzde DAD sistemleri kullanılmakta ve bu sistemler LC-DAD ve CE-DAD olarak ayırma yöntemleri ile kombine olarak kullanılmaktadır (Beltran ve ark., 2003). Absorbanstaki en büyük değişme, pH’ nın pKa civarında olduğu koşulda gözlenir. Bu yaklaşımla suda az çözünen ilaçların pKa değerleri tayin edilebilmektedir (Akay ve ark., 2002). Bu amaçla geliştirilmiş bilgisayar programları, pH ile dalga boyu ve absorbans arasındaki ilişkiyi temel alır (Ando ve Heimbach, 1997; Allen ve ark., 1998; Mitchell ve ark., 1999). Spektroskopik yöntemle elde edilen veriler, potansiyometrik yöntemle elde edilen verilerle uyumludur.
2.2.3. Sıvı kromatografik yöntemler
Yöntem, özellikle sıvı kromatografik ayırmada yararlanılan organik çözücü – su karışımlarına uygulanabilmektedir. Çalışılan bileşiklerin alıkonma davranışları ile mobil faz pH’ sı arasındaki ilişkilerden yararlanılarak iyonlaşma sabitleri tayin edilir. Kapasite faktörünün pH ile değişimi, sigmoidal davranış gösterir. Bu sigmoidalin orta noktasındaki pH değeri, o bileşiğin çalışılan ortamdaki iyonlaşma sabitini verir (Poole ve Poole, 1997; Hardcastle ve Jano, 1998). Ayrıca asidik veya bazik bileşiklerin pKa sabitlerinin tayininde ortamın iyonik şiddetini de dikkate alarak hesaplama yapabilen non-lineer regresyon programları da geliştirilmiştir.
Bu yöntem ile çalışmanın bazı avantajları vardır; • Bileşiğin saf olması gerekmez.
• ppm ve ppb düzeyinde analit ile çalışma imkanı sağlar. • Çalışılan ortam su-organik çözücü ikili karışımıdır.
• Bu ortamlardaki pH standardizasyonunun bilinmesi gereklidir.
2.2.4. Elektroforetik yöntemler
Bu yöntem, özellikle büyük molekül kütleli bileşiklerin ayrılmasına uygulanabilmektedir. Kapiler elektroforez yönteminde (CE) çok düşük örnek hacimleri ve derişimleri ile çalışabilme olanağı vardır. Asidik veya bazik türlerin iyonlaşma sabitlerinin tayininde farklı pH 'lardaki mobiliteler kullanılır. Sıvı kromatografi yönteminden farklı olarak suda pKa tayini yapabilmemiz mümkündür. Ayrıca CE ile elde edilen pKa değerlerinin CE-DAD ile karşılaştırma olanağı sağlar (Geiser ve ark., 2005; Poole ve ark., 2004).
Bu yöntem ile çalışmanın bazı avantajları vardır; • Geniş bir pH aralığında çalışılabilir (pH 2-11). • Yeterli doğruluk ve kesinlikte sonuçlar elde edilir. • Bileşiklerin saf olması gerekmez.
• Sudaki çözünürlükleri düşük olan bileşiklerin tayini için uygundur. μM düzeyinde analit ile çalışma imkanı sağlar.
• Uygun kalibrasyon yöntemleri ile su-organik çözücü karışımlarında çalışma imkanı getirir.
2.2.5. Florimetrik yöntemler
Absorbanstaki değişim yeterli değilse ve bileşiğin yapısında floresans özellik içeren gruplar varsa florimerik yöntemle iyonlaşma sabitleri tayin edilebilir. Molar absorplama katsayısı biliniyorsa hesaplama kolaydır. Ancak pK değerleri birbirine çok yakınsa bilgisayar programları kullanmayı gerektirir. Spektrum taramalarını kullanarak pK hesaplayabilen bilgisayar programları geliştirilmiştir (Parker, 1968).
pK2 − pK1 ≥ 4 olması durumunda değerler rahatlıkla hesaplanabilir.
Florimetrik analizin organik ve biyokimyasal türlere çok sayıda uygulaması vardır. Örneğin, Weissler ve White, çok çeşitli organik bileşikler, enzimler ve koenzimler, tıbbi maddeler, bitkisel ürünler, steroidler ve vitaminleri içeren 200’ün üzerindeki maddenin tayini için yöntemler vermiştir. Florometrinin en önemli uygulamaları; gıda ürünleri, ilaç, klinik numuneler ve doğal ürünlerin analizleri ile ilgilidir. Yöntemin duyarlılığı ve seçiciliği, bu yöntemi böyle alanlarda özellikle değerli bir araç yapmıştır.
Floresans Spektrumları ve Denge Sabitlikleri Arasındaki İlişki; Bir molekül,
absorpsiyonda 0-0 geçişlerinden hemen sonra daha az enerjiyle biraz dinlenir. Buna karşılık en aşağı enerjiyle uyarılmış hale geçer. 0-0 geçişiyle floresans emisyonundan sonra, hemen aynı relaksasyon oluşur. Bu relaksasyonların sonucunda temel durumda kararlı konfigürasyon ve ilk uyarılan durum arasında enerji farklılıkları oluşur. İlk uyarılma halinde enerji absorpsiyon için hν’den daha az, fakat emisyon için hν’den daha fazladır. İlk uyarılmış singlet halinde enerji için en iyi ölçüm elde edildi ve bu da iki değerle ifade edildi.
Es=1/2(hνabs+hνem) (2.3) Absorpsiyon ve emisyon bantları hiç titreşimsel bir yapı göstermediklerinde, 0-0
geçişlerinin konumunu bulmak mümkün değildir. Es için en iyi ölçüm, yukarıdaki eşitliğin hνabs ve hνem maksimum spektrumlarından elde edildi. Es’ nin kullanılan bu değerlerini; temel hal ile uyarılmış hal arası enerji geçişlerini gösteren şekildeki enerji diyagramından bulabiliriz.
Şekil 2.6. Asitik ve bazik hallerin enerji seviyeleri
Örneğin β-naftol gibi bileşiklerde uyarılmış halindeki molar entalpi değeri (ΔH*), temel haldeki molar entalpi (ΔH) değerinden daha azdır. Bu durumda; E1-E2= ΔH- ΔH* elde edilir. Bu uygulamalar ΔH ve ΔH* ‘ in kesin değerlerinin pozitif, nötr ve negatif olduğu durumlarda uygulanır.
Temel ve uyarılmış halde bir reaksiyon entropisinin varlığını varsayarsak, (elde edilen gerçek değerleri doğrulayan bir varsayım);
ΔG= ΔH - T ΔS = - RTInK (2.4) (2.5) RT Nh RT E E K K 3 . 2 ) 2 ) / log( ( 3 . 2 1 * = − = Δν
burada; Planck sabitini yerine koyar, mikrona çevirirsek; 6,25 x 103
pK* = pK - (Δv-) T
pK* = pK – 21,4 (Δv-) elde edilir. (2.6)
Şekil 2.7. Asidik ve bazik formda floresans şiddetinin eğrileri
Bu eğrilerin şekli;
• pK ve pK* değerlerine,
• Asitik (ε1) ve bazik (ε2) formun kısa dalga boyu ekzitasyonundaki sönüm katsayıları ile bazik formun uzun dalga boyu ekzitasyonundaki sönüm katsayısına (ε2'),
• Uyarılan türün ömrüyle karşılaştırılarak elde edilen uyarılmış haldeki dengenin elde edilme oranına,
• Asidik ve bazik formun floresans verimlerine Фo ve Фo ' bağlıdır. Floresans etkileri ve ömürleri güçlü asitlerde ya da güçlü alkali çözeltilerde ışın yayılmasıyla gözlemlenir. Bu yüzden aşağıdaki gibi bir eşitlik elde edilir.
Фo=kf/(kf+kg+kn)=kfτ (2.7)
Uyarılmış haldeki seyreltilmiş çözeltilerde de disosiyasyon ya da asosiyasyon yokluğunda floresans şiddeti gözlemlenir.
F=ω Ioε Фo c (2.8) Burada; ω: enstrümental sabit, c: konsantrasyon, Io; uyaran ışın şiddeti, Фo:floresans verimidir.
3. ANJİYOTENSİN II RESEPTÖR ANTAGONİSTLERİ
Günümüzde her geçen gün yeni ilaçlar üretilmekte ve bu ilaçlar çeşitli hastalıklar için kullanıma hazır hale getirilmektedir. İlaçların etkili olan kısımları ilaçların etken maddeleridir. İlaçların imalat ve piyasa kontrolleri sırasında ilaç etken maddelerin miktarlarının doğru olarak tayini ilaçların kullanımı için çok önemlidir. Eksik etken madde içeren ilaçlar hastalıklar için gerekli faydayı sağlamamakta, fazla etken madde içeren ilaçlar ise birçok yan etkiye sebep olmaktadır.
Anjiotensin reseptör antagonistleri (ARA) ise yeni bir antihipetansif ilaç
grubudur.
Antihipertansif ilaçlar 4 grupta incelenir.
Diüretikler; Kan hacmini azaltırlar, damar genişletici etkileri vardır,
Sempatoplejikler; Periferik damarsal direnci düşürürler, kalp fonksiyonlarını
inhibe ederler, periferik venlerde göllenmeyi arttırırlar,
Direkt vazodilatörler; Damar düz kasını gevşetirler
Anjiyotensin antagonistleri; Anjiyotensin üretimini veya etkilerini bloke ederek
periferik vasküler direnci ve dolaşan kan hacmini azaltırlar.
Sentez edilip denenmeye başlanan non-peptid anjiyotensin reseptör blokerleri ağızdan alınabilir ve antihipertansif ilaç olarak klinik kullanıma girmiştir. Bunlardan ilk çıkanı losartandır. ARA, renin anjiotensin sistemi (RAS)’nin spesifik inhibitörleridirler. ARA-II’ler oral yolla alımından sonra hızlı bir şekilde absorplanır ve 0,5-4 saat sonra plazmadaki derişimi maksimum konsantrasyona ulaşabilir. Bununla birlikte, oral yolla alımından sonra bu ilaçların bazıları plazmada ng/ml seviyesindeki düşük derişimlerde oluşur ki bu da onların tayini ve/veya görüntülenmesi için problemler ortaya çıkarır.
Anjiotensin II Reseptör Antagonistleri (ARA-II) hipertansiyon tedavisinde, yan etkileri
diğer bir antihipertansif ilaç grubu olan ADE inhibitörlerine göre daha çok tercih edilmektedir. Bunların en büyük seçicilikleri uzun süreli hareket ve iyi tolere edilebilir olmalarıdır (Cagigal, Gonzalez, Alonso, Jimenez, 2001).
Anjiotensin reseptör antagonistleri ile diüretiklerin ikili ilaç kombinasyonları
effektif ve iyi tolere edilebilir bulunmuştur. ARA II ler, ADE inhibitörlerine alternatif olarak, özellikle de bifenilimidazol yapısında olan Losartan ile klinik kullanıma başlanmış, daha sonra losartana valsartan, irbesartan, kandesartan ve telmisartan eklenmiştir.
İki tip anjiotensin II reseptörü vardır. Anjiotensin II tip 1 (AT1) reseptörleri damar daralması, kalp kasılabilirliği ve böbrek tübüler sodyum geri emiliminde artış, kalp ve damarlardaki hacim artışından sorumludurlar. Anjiotensin II tip 2 (AT2) reseptörleri hücre çoğalmasını engeller. ARA losartan, valsartan, irbesartan, telmisartan, candesartan, eprosartan ve olmesartan medoxomil’dir. Hepsi oral yoldan verilebilir ve günde tek doz uygulanırlar.
Losartan; Kullanıma ilk giren ilaçtır. AT1 reseptörlerini yarışmalı olarak bloke
eder.
Valsartan, aktif bir metabolitine çevrilmesi gerekmez. İlacın %80’i değişmeden
atılır, %20’si metabolize edilir.
İrbesartan, aktif bir metabolitine çevrilmesi gerekmez. Besinler emilimini
etkilemez. Kandesartan, Kandesartan cilexetil formunda kullanır. Gastrointestinal sistemde kısa sürede aktif madde kandesartan’a dönüşerek emilir. Besinler emilimini etkilemez.
Telmisartan, besinler emilimini %6-20 azaltır.
ARA kan basıncını düşürücü etkiyle sahiptir. ARA, ACEİ ’ni tolere edemeyen kalp yetmezliği olan hastalar için uygun seçenektir. ARA ve ACEİ ’nin kombinasyonu maksimum RAS blokajı elde etmek için önerilmiştir.
Bu ilaçlar uzun dönem kullanımda bile düşük yan etkilere sahiptirler. Anjiotensin reseptör blokerlerinin yan etkileri ACE inhibitörlerine benzer ancak öksürük ve anjioödem gözlenmez.
Kandesartan ve losartan ön ilaçtır ve metabolitleri resptörlerin nonkompetetif inhibitörüdür. Eprosartan, irbesartan ve valsartan ön ilaç değildir ve anjiotensin reseptölerini kompetetif olarak inhibe ederler.
Son yıllarda yapılan çalışmalarda AT-II reseptör blokerlerinin antiinflamatuar etkilerinin de olduğu belirtilmiştir. Anjiotensin II Reseptör Antagonistleri amfoterik bileşiklerdir ve yapısal olarak bağlı bifenilkarboksilik asit kısmı içeren telmisartan dışında, aynı bifeniltetrazol kısmını sahiplerdir. Anti-hipertansif ilaçlar olarak ARA
II’lerin iyonlaşma sabitlerinin birkaç uygun yöntem ile tam olarak tayini, etki mekanizmalarının anlaşılmasında ve biyoyararlanabilirlikleri açısından oldukça önemlidir.
ARA II’ ler, deneysel tekniklerde, asit-baz sabitlerinin belirlenmesinde, potansiyometri, Uv-Vis spektrofotometri, sıvı-sıvı ekstraksiyon ve iyonik değişimde genellikle kullanılır. Potansiyometri ve Uv-Vis homojen fazlarda denge sabitlerinin çalışmaları çok yönlü ve yeterlidir (Cagigal, Gonzalez, Alonso, Jimenez, 2001).
3.1. Anjiotensin II Reseptör Antagonistlerinin Kimyasal Yapıları ve SPARC Programı İle Hesaplanan Maksimum pKa Değerleri
3.1.1. Valsartan
3.1.1.2. Valsartanın SPARC programında çizilen pH grafikleri
Şekil 3.2. Valsartanın α- pH ilişkisi ve 1. türev eğrisi
3.1.2. Losartan
3.1.2.2. Losartanın SPARC programında çizilen pH grafikleri
Şekil 3.4. Losartanın α- pH ilişkisi ve 1. türev eğrisi
3.1.3. Kandesartan
3.1.3.2. Kandesartanın SPARC programında çizilen pH grafikleri
Şekil 3.6. Kandesartanın α- pH ilişkisi ve 1. türev eğrisi
3.1.4. Telmisartan
3.1.4.2. Telmisartanın SPARC programında çizilen pH grafikleri