iii
SÜLFOSALİSİLİK ASİT TÜREV KOMPLEKSLERİNİN KARBONİK ANHİDRAZ İZOENZİMLERİ ÜZERİNDE İNHİBİSYON ETKİLERİNİN İNCELENMESİ
Büşra ÇAKMAK
Dumlupınar Üniversitesi Fen Bilimleri Enstitüsü
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü Biyokimya Anabilim Dalında
YÜKSEK LİSANS TEZİ Olarak Hazırlanmıştır.
Danışman: Prof. Dr. Metin BÜLBÜL
v
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının %... çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı taktirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
SÜLFOSALİSİLİK ASİT TÜREV KOMPLEKSLERİNİN KARBONİK ANHİDRAZ İZOENZİMLERİ ÜZERİNDE İNHİBİSYON ETKİLERİNİN İNCELENMESİ
Büşra ÇAKMAK
Biyokimya, Yüksek Lisans Tezi, 2019 Tez Danışmanı: Prof. Dr. Metin BÜLBÜL
ÖZET
Karbonik anhidrazlar (CA) (E.C 4.2.1.1.) canlı organizmalarda karbondikoksit ile suyun, bikarbonat ve hidrojene geri dönüşümü reaksiyonlarını tersinir olarak katalizlenmesini sağlayan enzim ailesidir. Aktif merkezinde çinko iyonu içeren ve toplamda 16 adet izoenzimi bulunan CA metaloenzimi, insan göz dokusunda ve çeşitli dokularda dağılış göstermektedir. Karbonik anhidraz inhibitörleri göz içi sıvı akışını azaltarak göz sıvı basıncının düşürülmesini sağlar ve glokom hastalığının tedavisinde kullanılırlar. Bu çalışmada, glokom tedavisi için aday, yeni sentezlenen sülfosalisalik asit türevi bileşiklerin karbonik anhidraz hCA I ve hCA II izoenzimleri üzerindeki inhibisyon etkileri in vitro olarak araştırılmıştır. Bu amaçla ilk olarak, insan eritrositlerinden hCA I ve hCA II izoenzimleri afinite kromotografisi yöntemi ile ayrı ayrı saflaştırıldı ve SDS-PAGE elektroforezi ile enzimlerin saflığı kontrol edildi. Daha sonra yeni sentezlenen bileşiklerin insan eritrosit hCA I ve hCA II izoenzimleri üzerindeki inhibisyon etkileri incelendi. Çalışmalarda bu bileşiklerin inhibisyon etkisini belirlemek için karbonik anhidraz enziminin esteraz aktiviteleri ölçüldü. Elde edilen sonuçlara göre, inhibisyon etkisine sahip bileşiklerin %Aktivite-[I] grafikleri çizildi, IC50 değerleri belirlendi. Lineweaver-Burk
grafikleri çizilerek Ki sabitleri hesaplandı. Esteraz IC50 değerleri hCA I için 4,8-65,9 μM
arasında, hCA II için 7,2-52,4 μM arasında bulundu. Ki değerleri ise hCA I için 1,7-3,5 μM
arasında, hCA II için 3,1 μM bulundu.
INVESTIGATION OF INHIBISION EFFECTS ON CARBONIC ANHYDRASE ISOENZYMES OF SULFOCALICYLIC ACID DERIVATIVE COMPLEXES
Büşra ÇAKMAK
Biochemistry, M.Sc. Thesis, 2019 Thesis Supervisor: Prof. Dr. Metin BÜLBÜL
SUMMARY
Carbonic anhydrases (CA) (E.C 4.2.1.1.) are the family of enzymes that catalyze the reversible reaction of carbon dioxide and water to bicarbonate and hydrogenation reactions in living organisms. CA metaloenzyme, which contains zinc ion in its active center and has total of 16 isoenzymes, is distributed in human eye tissue and various tissues. Carbonic anhydrase inhibitors reduce intraocular fluid flow, reduce eye fluid pressure and are used to treat glaucoma. In this study, the inhibition effects of newly synthesized sulfocalicylic acid derivatived compounds on carbonic anhydrase hCA I and hCA II isoenzymes, candidates for glaucoma treatment were investigated in vitro. For this purpose, at first hCA I and hCA II isoenzymes of human erythrocytes were separately purified by affinity chromatography and the purity of the enzymes was checked by SDS-PAGE electrophoresis. Then, the inhibitory effects of the newly synthesized compounds on human erythrocyte hCA I and hCA II isoenzymes were examined. In the studies, to determine the inhibitory effect of these compounds the esterase activities of the carbonic anhydrase enzyme were measured. According to the results,% Activity- [I] graphs of the compounds with inhibition effect were drawn and their values in IC50
were determined. Ki constants were calculated by plotting Lineweaver-Burk graphs. The IC50
values of compounds for esterase activity were between 4,8-65,9 μM for hCA I and 7,2-52,4 μM for hCA II, respectively. The Ki values of these inhibitors are in the range of 31 μM for
hCA II.
TEŞEKKÜR
Tez çalışmalarım sırasında bana çalışma ortamı sağlayan, bu çalışmanın devamında her daim destek olan kıymetli danışman hocam Prof. Dr. Metin BÜLBÜL’e, fikir ve yardımlarını esirgemeden çalışmalarımda yardımcı olan değerli hocalarım Dr. Öğr. Üyesi Ekrem TUNCA’ya, Öğr. Gör. Zeynep SARIOĞLU’na ve dostum Sema ERDEN’e sonsuz şükranlarımı sunarım.
Tüm hayatım boyunca yanımda olan, kişiliğimin ve karakterimin oluşmasında daima örnek aldığım, öğrenim hayatım boyunca hiçbir fedakârlıktan kaçınmadan her zaman bana destek olan sevgili annem Emine ÇAKMAK, sevgili babam Sait ÇAKMAK’a ve kardeşlerime en içten teşekkürlerimi sunarım.
İÇİNDEKİLER
Sayfa ÖZET...v SUMMARY...vi ŞEKİLLER DİZİNİ...x ÇİZELGELER DİZİNİ...xiiiSİMGELER VE KISALTMALAR DİZİNİ...xvi
1. GİRİŞ...1
2. ENZİMLER ... 2
2.1. Karbonik Anhidrazlar ... 9
2.1.1. α- Karbonik anhidrazlar (α-CA) ... 10
2.1.2. β Karbonik Anhidrazlar (β-CA) ... 15
2.1.3. γ Karbonik Anhidrazlar (γ-CA) ... 15
2.1.4. δ Karbonik Anhidrazlar (δ-CA) ... 15
2.1.5. ζ, η ve θ Karbonik Anhidrazlar ... 15
2.1.6. Karbonik Anhidraz enziminin katalitik mekanizması ... 16
2.2. Karbonik Anhidraz İnhibitörleri ... 18
3. GLOKOM ... x
4. MATERYAL VE METOD ... 22
4.1. Çalışmada Faydalanılan Kimyasal ve İnhibitör Bileşikler ... 22
4.2. Kullanılan Cihaz ve Aletler ... 22
4.3. Kullanılan inhibitör maddeler ve çözeltiler ... 25
4.4. Uygulanan Yöntemler ... 27
4.4.1. Protein tayin yöntemleri ... 27
4.4.2. Karbonik anhidraz aktivitesi tayin yöntemi ... 27
4.4.4. İnsan eritrosit hücrelerinden karbonik anhidraz izoenzimleri olan hCA I ve hCA II enzimlerinin saflaştırılması ... 30
4.4.5. Sentezlenen yeni bileşiklerin insan eritrosit karbonik anhidraz izoenzimleri üzerindeki inhibisyon etkilerinin incelenmesi ... 31
İÇİNDEKİLER (devam)
Sayfa
5.SONUÇLAR VE TARTIŞMA ... 33 5.1. hCA I ve hCA II İzoenzimlerinin Afinite Kromatografisi İle Saflaştırılması ... 33 5.2. Sentezlenen Yeni Bileşiklerin İnsan Eritrosit Karbonik Anhidraz Enzimleri (hCA I ve
hCA II) Üzerindeki İnhibisyon Etkilerinin In Vitro Olarak İncelenmesi ... 34
5.2.1. Sentezlenen yeni bileşiklerin hCA I ve hCA II esteraz aktiviteleri üzerindeki inhibisyon etkilerinin in vitro olarak incelenmesi ... 34 5.2.2. Sentezlenlen yeni bileşiklerin insan eritrosit karbonik anhidraz enzimlerinin
estereaz aktivitesi üzerindeki Ki sabitlerinin belirlenmesi ... 63
KAYNAKLAR DİZİNİ...72 ÖZGEÇMİŞ
ŞEKİLLER DİZİNİ
Şekil Sayfa
2.1. Yarışmalı inhibisyon türünün şematik gösterimi ... 6
2.2. Yarışmasız inhibisyonun reaksiyon halinde gösterimi... 7
2.3. Yarı yarışmalı inhibisyonun reaksiyon halinde gösterimi ... 7
2.4. Afinite kromatografisi basamakları ... 9
2.5. İnsan karbonik anhidraz aktif bölgesinin şematik gösterimi ... 17
2.6. CA enziminin CO2 hidratasyon reaksiyonunun kataliz mekanizmasının şematik gösterimi. ... 18
3.1. Sistemik ve topikal karbonik anhidraz inhibitörlerinin kimyasal gösterimleri ... 21
4.1. İnhibitör bileşiklerin kimyasal gösterimi ... 24
4.2. Afinite jelinin hazırlanma basamakları. ... 29
5.1. SDS-PAGE Sonuçları... 34
5.2. 1 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...35
5.3. 2 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...36
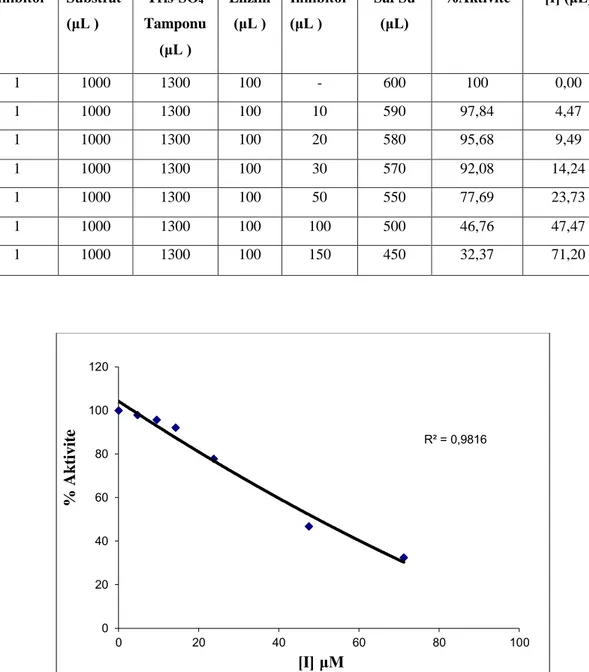
5.4. 3 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...37
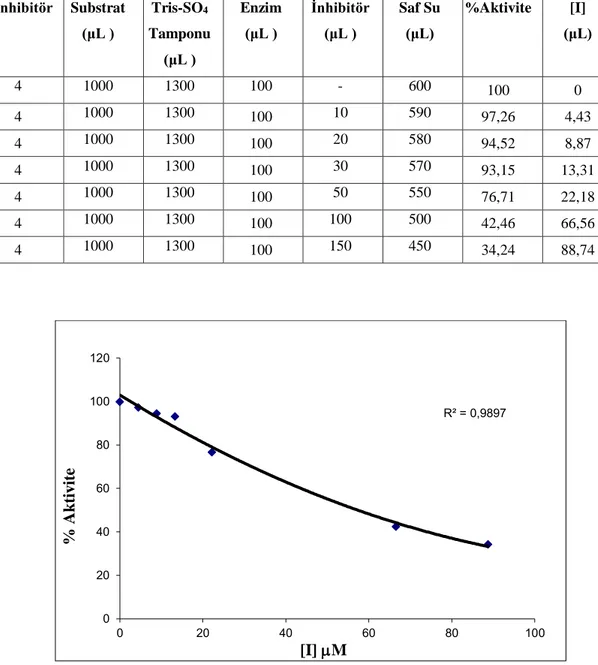
5.5. 4 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...38
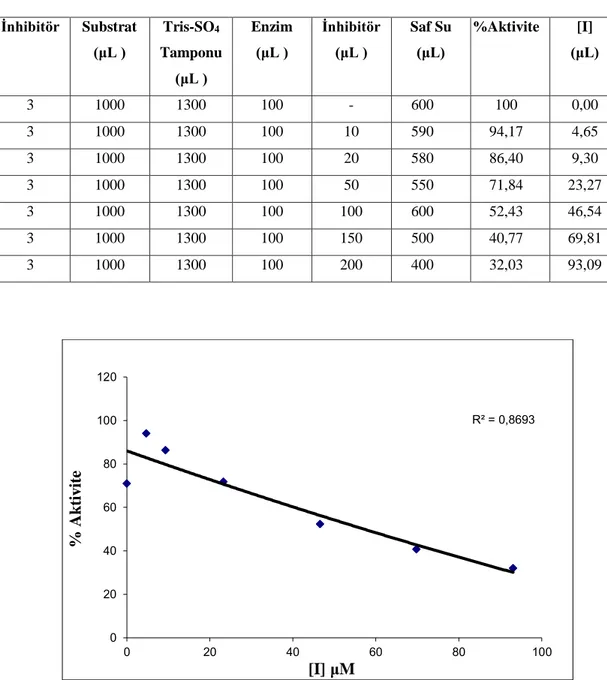
5.6. 5 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...39
5.7. 6 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...40
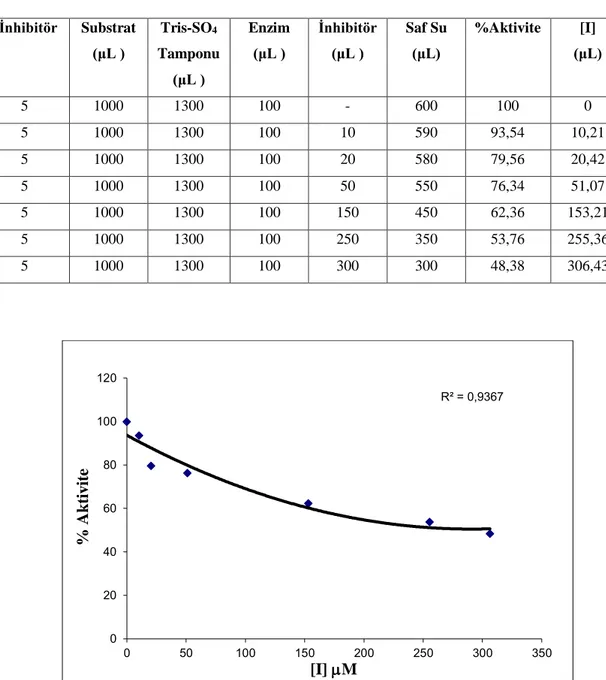
5.8. 7 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...41
5.9. 8 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...42
5.10. 9 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...43
5.11. 10 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...44
5.12. 11 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...45
5.13. 12 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...46
5.14. 13 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...47
5.15. 14 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...48
5.16. 1 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...49
5.17. 2 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...50
ŞEKİLLER DİZİNİ (devam)
Şekil Sayfa
5.19. 4 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...52
5.20. 5 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...53
5.21. 6 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...54
5.22. 7 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...55
5.23. 8 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...56
5.24. 9 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...57
5.25. 10 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...58
5.26. 11 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...58
5.27. 12 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...59
5.28. 13 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...60
5.29. 14 no’lu bileşiğin hCA I izoenzimi üzerinde esteraz aktivitesine etkisi...61
5.30. hCA-I için 1 bileşiğinin Lineweaver-Burk grafiği...64
5.31. hCA-I için 2 bileşiğinin Lineweaver-Burk grafiği...65
5.32. hCA-I için 3 bileşiğinin Lineweaver-Burk grafiği...66
5.33. hCA-I için 4 bileşiğinin Lineweaver-Burk grafiği...67
ÇİZELGELER DİZİNİ
Çizelge Sayfa
2.1. α - Karbonik Anhidrazlar aktivitesi ve fonksiyonları. ... 14 2.2. Canlılarda bulunan Karbonik Anhidraz Gen Ailesi Enzimleri ... 16 4.1. İnhibitör maddelerin adlandırılmaları ve kodları ... 24 5.1. 1 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri .. 35 5.2. 2 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri.. 36 5.3. 3 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri.. 37 5.4. 4 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri .. 39 5.5. 5 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri .. 39 5.6. 6 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri.. 40 5.7. 7 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri .. 41 5.8. 8 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerleri.. 42 5.9. 9 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon değerler. .. 43 5.10. 10 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 44 5.11. 11 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 45 5.12. 12 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 46 5.13. 13 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 47 5.14. 14 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 49 5.15. 1 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 49 5.16. 2 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 50 5.17. 3 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 51 5.18. 4 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
ÇİZELGELER DİZİNİ (devam)
Çizelge Sayfa
5.19. 5 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 53 5.20. 6 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 54 5.21. 7 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 55 5.22. 8 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 56 5.23. 9 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 57 5.24. 10 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 58 5.25. 11 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 59 5.26. 12 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 60 5.27. 13 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 61 5.28. 14 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesinden elde edilen inhibisyon
değerleri... 62 5.29. 1 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesindeki Ki değerinin hesaplanmasında
kullanılan veriler... 64 5.30. 2 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesindeki Ki değerinin hesaplanmasında
kullanılan veriler...65 5.31. 3 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesindeki Ki değerinin hesaplanmasında
kullanılan veriler...66 5.32. 4 no’lu bileşiğin hCA I izoenzimi esteraz aktivitesindeki Ki değerinin hesaplanmasında
kullanılan veriler...67 5.33. 2 no’lu bileşiğin hCA II izoenzimi esteraz aktivitesindeki Ki değerinin hesaplanmasında
ÇİZELGELER DİZİNİ (devam)
Çizelge Sayfa
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklama α Alfa β Beta γ Gama δ Delta ζ Zeta η Eta θ Teta μ Mikro M Molarite nm NanometreKi İnhibisyon denge sabiti
Km Maksimum hızın yarısına ulaşıldığı andaki substrat konsantrasyonu
IC50 Enzim aktivitesini %50 oranında azaltan substratın konsatrasyonu
Vmax Maksimum hız
mL Mililitre
rpm Dakikada yapılan devir sayısı °C Celcius
[S] Substrat konsantrasyonu [I] İnhibitör konsantrasyonu
Kısaltmalar Açıklama
CA Karbonik Anhidraz
TEMED N,N,N',N'- tetrametil etilendiamin SDS Sodyum dodesil sülfat
SDS-PAGE Sodyum dodesil sülfat poliakrilamid DMSO Dimetilsülfoksit
1. GİRİŞ
Yerküre üzerinde yaşam gösteren tüm canlıların hayatlarını devam ettirebilmelerinin temal şartı, kendilerine benzer yeni bireyler oluşturmaları ve biyokimyasal tepkimeleri verimli bir şekilde biyolojik ortamda kataliz edebilmeleridir. Canlı sistemler yaşam fonksiyonlarını yerine getirebilmek için çevrelerindeki enerji kaynaklarından faydalanırlar. Bu kimyasal süreçte gerçekleşen termodinamik olaylar elverişli olduğu halde oldukça yavaş ilerler. Canlı organizmalarda biyokimyasal reaksiyonları hızlandıran, hücrelerden ekstrakte edilebilen ve daha sonra birçok önemli işlemi katalize etmek için kullanılan protein yapılı biyolojik katalizörler enzim olarak adlandırılır. Enzimler enerji açısından hayati önem taşıyan metabolizma olaylarında, gen ekspresyonu, hücre bölünmesi, bağışıklık sistemi de dahil olmak üzere tüm yaşam süreçlerinde önemli bir rol oynar. Katalitik özellikteki RNA moleküllerinin bir grubu haricinde genel olarak tüm enzimler protein yapılı özellik göstermektedir (Gürdöl ve Ademoğlu, 2006; Robinson, 2015; Nelson ve Cox, 2005). Enzimlerin aktif kısmının katalitik özelliklerini doğrudan ya da dolaylı yoldan etkileyerek reaksiyon aktivitesini azaltan inhibitörler, enzim inhibisyonuna sebep olmaktadır. Enzim inhibisyonu dünya çapında son zamanlarda incelenen önemli biyokimyasal konulardan biridir. Enzimatik aktivitedeki inhibisyon mekanizmasının işleviyle birçok farmakolojik madde ve bileşik etkisini göstermektedir. İnhibitörler, enzim üzerindeki etki alanlarına, enzimleri kimyasal olarak değiştirip değiştirmediğine veya etkiledikleri kinetik parametrelere göre sınıflandırılabilir. İnhibitörler enzim etki metabolizmalarının ve metabolik yolların aydınlatılmasında önemli rol oynamaktadır (Murray, 2009; Keha ve Küfrevioğlu, 2004). Glokom, giderek artan göz içi sıvı basıncının optik sinirleri tahribata uğratması sonucu oluşan ve görme yetisinin kaybolmasına sebep olan bir hastalık türüdür. Dünya çapında kalıcı körlüğün en büyük nedenlerinden biri olan glokom, katarakttan sonra ikinci sırada gelmektedir. Yapılan araştırmalar sonucunda yeryüzünde 70 milyonu aşkın glokomlu birey ve 6 milyonu aşkın glokoma bağlı körlük yaşandığı tespit edilmiştir (Ermiş, 2016; International Council of Ophthalmology, 2015).
Glokom hastalığının tedavisinde öncelikle optik sinir hasarı ve sonrasında görme kaybına yol açabilen göz içi basıncının azaltması amaçlanmaktadır. Karbonik anhidraz inhibitörlerinin göz içi sıvı akışını azaltarak göz içi basıncını düşürdüğü tespit edilmiş, bu bileşikler yıllarca glokom tedavisi için kullanılmıştır (Kasımoğulları vd., 2009). Yaptığımız araştırmalar sonucunda amacımız; glokom hastalığının tedavisinde faydalanmak üzere daha etkin, yeni sentezlenen sülfosalisalik asit türevi karbonik anhidraz inhibitörlerini literatüre kazandırmaktır.
2. ENZİMLER
Enzimler canlı organizmalarda meydana gelen kimyasal reaksiyonların en yüksek verimde ve hızda gerçekleşmesini sağlayan protein yapılı biyolojik katalizörlerdir. Biyokimyasal tepkimelerde yan ürün oluşturulmasına olanak sağlamadan, %100’lük ürün veriminin elde edilmesini sağlarlar.
Hücrelerde meydana gelen tüm kimyasal faliyetler enzimler aracılığıyla gerçekleşmektedir. Protein yapısına sahip olan enzimler, kalıtımsal merkez olan DNA aracılığıyla şifrelenmektedir. Hücrede meydana gelen bütün faaliyetler DNA düzeyinde düzenlenerek denetlenmektedir (Keha ve Küfrevioğlu, 2004).
Canlılık faaliyetlerinin devamını sağlayan metabolik reaksiyonların kusursuz bir biçimde tamamlanabilmesi için enzimler hayati önem taşımaktadır. Enzimlerin canlı metabolizmasındaki düzenli reaksiyon fonksiyonlarıyla besinsel biyomoleküller parçalanarak yüzlerce tepkime basamağı katalizlenir. Böylece kimyasal enerji korunarak dönüştürülebilir hale getirilerek basit öncüllerden biyolojik makromoleküllerin üretimi sağlanmaktadır (Nelson ve Cox, 2005).
Enzimler bilinen en etkili katalizörlerdir, katalizlenmemiş tepkimeye göre reaksiyon hızını 1020 kata kadar arttırabilirlerken, enzimatik olmayan katalizörler reaksiyon hızını tipik
olarak 102 ila 104 arasında değişen faktörlere göre arttırırlar (Reece, 2013). Tüm enzim
molekülleri saniyede 100 ile 1000 substrat molekülünü ürün haline dönüştürebilmektedir (Champe ve Harvey, 1997).
Enzim türleri katalizledikleri reaksiyon çeşitlerine ve ürüne dönüşümünü sağladıkları substrata karşı spesifik özellik taşımaktadır. Canlı yapısındaki tüm doku ve akışkanlarında bulunan enzimler katıldıkları tepkime sonrası tüketilmeden ve değişime uğramadan tekrar tekrar kullanılabilmektedir.
Enzimler geleneksel olarak substratlarının sonuna ’’az’’ ekinin getirilmesiyle (amilaz, lipaz) veya katalizlenen reaksiyon tipiyle ilgili sözcüğün eklenmesiyle (DNA polimeraz, laktat dehidrogenaz) adlandırılmışlardır. Ancak bu isimlendirmelerin birçoğu enzimlerin işlevlerini eksik bildirmesi ve keşfedilen enzim sayısının artması sebebiyle Uluslararası Biyokimya Birliği’nin (IUB) çalışmaları sonucu yeni bir sistematik sınıflandırma yapılmıştır.
Bu sistematik sınıflandırmaya göre reaksiyonları katalizleyen enzimler altı ana sınıfa (oksidoredüktazlar, transferazlar, hidrolazlar, liyazlar, izomerazlar ve ligazlar) bunlar da kendi içinde alt gruplara ayrılmıştır. Her enzime dört rakamlı sistematik kod numarası (E.C) verilmiştir.
Enzim katalizli bir reaksiyonda, enzim kompleks oluşturmak üzere substrata bağlanır. Substrat enzimin etkileyerek değişime uğrattığı kimyasal moleküllerdir. Enzimlerin organik maddelerden veya metal iyonlarından meydana gelen özelleşmiş kısımları aktif bölge olarak adlandırılır (Keha ve Küfrevioğlu, 2004).
Aktif bölge protein içinde bir yarık veya ara kesit içinde yer alır ve enzimatik aktivite için gerekli olan belirli amino asitlerden oluşur (Reece, 2013). Aktif bölge ile substrat bağlanarak enzimin aktivitesi sağlanmaktadır. Enzimin aktif bölgesine substratın bağlanmasıyla enzim–substrat (ES) kompleksi oluşturulur. Enzim–substrat (ES) kompleksinden enzimin ayrılmasıyla ürün veya ürünlere dönüştürülür.
Enzimlerin bir kısmı sadece protein yapılıyken, bir kısmı da metal iyonu, şeker yada lipitler gibi ek bileşenlere gerek duyarlar. Enzim yüzeyine sıkıca bağlanmış, protein yapılı olmayan ‘prostetik grup’ olarak adlandırılan bu yapı katalitik aktiviteden sorumludur. Bu prostetik grup bir ya da birden çok inorganik ve organik iyon ile birlikte metal iyonu bulundurduğunda koenzim (kofaktör) olarak isimlendirilir. Bir enzim, koenzimi ile beraber katalitik açıdan tamamen aktif hale getirildiğinde holoenzim olarak adlandırılır. Holoenzimden dializ edilemeyen, protein yapılı, ısıya dayanıksız kısmına apoenzim adı verilir. Apoenzimlerin aminoasit çeşitleri ve dizilişleri enzimlerde çeşitlilik sergilemektedir. Bu sebeple apoenzim kısmı enzimlerin özgüllüğünü ve işlevini belirlemektedir. Apoenzim katalitik olarak inaktif haldedir, bir koenzimle kompleks hale gelerek aktif hale getirilir (Özata ve Kutlu, 2000).
Bazı hastalıkların tanısında, özellikle kalıtsal bozukluklarda bir ya da birden fazla enzimin eksikliği veya tamamen yokluğu gerekçe olabilir. Enzimin fazla aktive olması da farklı bir diğer hastalığın nedeni olabilmektedir. Kan plazmasında bulunan enzim aktivitelerinin, doku örneklerinde veya eritrositlerde ölçümü ile bazı hastalıkların tanısı konulabilmektedir. Pek çok ilacın biyolojik etkisi enzimlerle etkileşerek ortaya çıkarmaktadır (Nelson ve Cox, 2005). Bu nedenle enzimlerin kinetik parametreleri ilaç çalışmaları için önem gerektirmektedir.
Enzim kinetiği, enzimin katalize ettiği reaksiyonun hızını incelemektedir. Menten M. ve Michaelis L. 1913 yılında enzim reaksiyonlarındaki ilk kinetik çalışmaların öncüleridir.
Yaptıkları çalışmalarla enzimli reaksiyonların ilk aşamasında Enzim-Substrat kompleksinin oluşumundan ve enzimlerin doygunluk özelliğinden dikkate alarak bir model geliştirdiler.
Tanımlanan bu model aracılığıyla birçok enzimin kinetik özelliği açıklanabilmiştir. Bir substrat molekülünü kapsayan model aşağıda gösterilmiştir.
Enzim-Substrat etkileşimi k1 hız sabitiyle Enzim-Substrat kompleksini (ES) meydana
getirir. ES kompleksi k2 hız sabitiyle tekrar enzim ve substrata ayrışabilir veya k3 hız sabitiyle
ürüne dönüşebilir (Keha ve Küfrevioğlu, 2004). Reaksiyondaki k3 hız sabiti enzimin saniyede
etki ettiği substrat molekülü sayısını (turnover sayısı) göstermektedir.
V
0=Vmax[S] Km[S]
Michaelis-Menten eşitliği
Enzim ile katalize edilen reaksiyonun başlangıç hızıyla (V0) substrat konsantrasyonu [S] ve enzimin bazı özellikleri arasındaki miktar yönünden ilişkilerini ifade eden hiperbolik eğrinin denklemdir (Sözbilir ve Bayşu, 2008). Bu eşitlik enzim etkisinin kinetiğinde esas olsa da deneysel çalışmalarda elde edilen grafiklerde sağlıklı sonuçlar vermeyebilir. Pratikte bu hiperbolik eğri bir doğru denklemine dönüştürülebilir. Michaelis-Menten eşitliğinin değiştirilmesiyle oluşan Lineweaver-Burk eşitliği ile eşitlik sonucu oluşturulan doğrusal grafik çalışmalarda sıklıkla kullanılmaktadır (Keha ve Küfrevioğlu, 2004).
1 V= KM Vmax 1 [S]+ 1 Vmax Lineweaver-Burk eşitliği
Enzimli reaksiyonların katalizleme derecesi turnover sayısı olarak tanımlanmaktadır. Uygun şartlarda bir mol enzimin 60 saniyede ürüne dönüştürdüğü substratın mol sayısıdır. Karbonik anhidraz ailesi maksimum turnover sayısına sahip olan (36x106 dk-1) enzim grubudur
Bir doku ekstraktı veya çözeltide bulunan enzim konsantrasyonu enzimin katalitik aktivitesinden faydalanılarak bulunur. 1 mikromol (10-6 mol) substratın optimum şartlarda ve
25 °C’da bir dakika içersinde ürüne dönüşümünü sağlayan enzim miktarı “1 enzim ünitesi (EU)” olarak adlandırılır. Uluslararası ölçü sisteminde, bir mol substratın bir saniyede ürüne dönüşmesini sağlayan enzim aktivite birimi katal olarak tanımlanmaktadır.
Enzimlerle katalizlenen tepkimelerin hızları, enzim aktivitesi bazı etmenler tarafından etkilenmektedir. Bu faktörler;
pH
Sıcaklık
Substrat konsantrasyonu
Enzim konsantrasyonu
İnhibitör veya aktivitör konsantrasyonu
Kofaktör konsantrasyonu (mevcutsa)
İyonik şiddet
Enzimler pH değişimlerine karşı çok hassastırlar. Enzimin en aktif olduğu pH değerine optimum pH denir. Optimum pH çeşitli enzimlerde farklılık gösterir. Optimum pH değerinin alt veya üst sınırının aşılması halinde enzim aktivitesinde düşüş meydana gelir. Birçok kimyasal reaksiyonda olduğu gibi enzimlerle katalizlenen reaksiyonlarda da ısı arttıkça tepkime hızı da artış gösterir. Reaksiyon ortamının sıcaklığı 50 °C’yi geçmesi halinde enzim aktivitesinde düşüş gözlenir. Yüksek sıcaklıkta enzimlerin yapısındaki proteinlerin denatürasyonu bu duruma sebep olmaktadır (Kalaycıoğlu vd., 2000).
Enzimler biyokimyasal görevlerinin gereği olarak, hücre içindeki fizikokimyasal koşullara göre devamlı olarak aktivitelerini değiştirirler. Bu durum enzim aktivasyonu veya enzim inhibisyonu olarak tanımlanır (Sözbilir ve Bayşu, 2008). Enzimlerin aktivitelerini azaltan, yavaşlatan ya da yok eden bileşiklere inhibitör denir. Enzimlerin inhibitör maddelerle in vivo ve in vitro aktivitesinin düşürülmesi durumuna enzim inhibisyonu adı verilir. Enzim aktivitesinin inhibisyonu biyolojik sistemlerde ana kontrol basamağı oluşturduğu için tedavilerde kullanılan pek çok ilaç ve zehirli bileşik etkilerini enzim inhibisyonu yoluyla göstermektedir.
Enzim inhibitörleri dönüşümlü (reversibl) inhibisyon ve dönüşümsüz (irreversibl) inhibisyon olarak ikiye ayrılır. Dönüşümsüz inhibisyon reaksiyonlarında inhibitör madde enzime kovalent bağ ile bağlanır veya kompleks yapı meydana getirir.
Bir veya birden fazla fonksiyonel grubu etkilenen enzim tekrar aktivite gösteremez duruma gelmektedir. Dönüşümlü inhibisyon türlerinde enzim ve inhibitör etkileşmesiyle denge reaksiyonu oluşmaktadır. Dönüşümlü inhibisyon kendi içersinde dört grupta incelenmektedir (Keha ve Küfrevioğlu, 2004).
Yarışmalı (kompetitif) inhibisyon: Yarışmalı kompetitif inhibisyon en basit dönüşümlü inhibisyon çeşitidir. İnhibitör madde ve substrat enzimin aktif bölgesini doldurmak için birbirleriyle yarış durumundadır. Substrat ile inhibitör molekülleri kimyasal yapı itibariyle birbirlerine benzer durumdadır. İnhibitör madde reversibl olarak enzime bağlanarak enzimin aktif bölgesine substratın bağlanmasını engeller (Sözbilir ve Bayşu, 2008). Fakat yüksek substrat konsantrasyonu ile enzim üzerindeki inhibitör etkisi yok edilebilir. Bu tür inhibisyonda substrat için belirlenen Km değeri (Michaelis sabiti) artarken Vmax değeri değişmez. Yarışmalı
inhibisyonda, inhibitör bileşiğin bulunduğu durumda maksimum hızın yarısına ulaşması için fazla miktarda substrat madde gerekmektedir (Supuran ve ark., 2000; Sly ve Hu, 1995).
Şekil 2.1. Yarışmalı inhibisyon türünün reaksiyon gösterimi.
Yarışmasız (nonkompetitif) inhibisyon: Bu tür inhibisyon reaksiyonlarında inhibitör madde serbest haldeki enzime veya enzim-substrat kompleksine bağlanmaktadır. Bu inhibitörler substratın bağlanmasını engellemezler fakat enzim-substrat-inhibitör kompleksi oluşturarak enzimatik aktiviteyi yavaşlatır ya da durdururlar. Enzimin Vmax değeri azalış halinde iken, Km değeri sabit durumda kalır. İnhibitör ile substrat farklı kısımlardan enzime bağlandığı için substrat miktarı inhibisyonu engellemez (Kalaycıoğlu vd., 2000).
Şekil 2.2. Yarışmasız inhibisyon türünün reaksiyon gösterimi.
Yarı yarışmalı (unkompetitif) inhibisyon: Dönüşümlü inhibisyon tipi olan yarı yarışmalı inhibisyonda; enzimi etkisiz hale getirmek için başka bir maddeyle yarışmaya girmeyen inhibitör enzim-substrat kompleksine bağlanır (Sözbilir ve Bayşu, 2008). Substrat konsantrasyonunun arttırılmasıyla inhibisyon ortadan kalkmaz. İnhibitörün varlığında ortamdan Enzim-Substrat kompleksi uzaklaştığı için Km değeri düşer, Enzim-Substrat-İnhibitör kompleksi devamlı oluşacağı için Vmax değeri düşüş gösterir.
Şekil 2.3. Yarı yarışmalı inhibisyon türünün reaksiyon gösterimi.
Yarı yarışmalı inhibisyon tek substratlı reaksiyonlarda nadiren gerçekleşirken, iki ya da daha fazla substratlı reaksiyonlarda bu inhibisyon çeşidi daha yaygındır.
Lineer karışık tür inhibisyon: Lineer karışık tür inhibisyonu, yarışmasız (nonkompetitif) inhibisyonunun özelleşmiş bir türüdür. Bu inhibisyon türünde E, S ve I farklılaşmış bir bağlanma denge sabiti göstermektedir. İnhibitör ES kompleksine, substrat EI kompleksine bağlandığında inhibisyon meydana gelir.
Her iki durumda katalitik olarak inaktif halde olan ESI kompleksi oluşur. Fakat meydana gelen EI kompleksinin substrata olan ilgisi serbest enzimden daha azdır (Arslan, 2003).
Canlı metabolizmasında meydana gelen reaksiyonlar ve oluşan biyomoleküllerin kataliz basamağındaki işleyişi hakkındaki bilgilere ulaşılması, bugüne kadar yapılan saflaştırılan enzimlerin araştırılması ile sağlanmıştır. Kinetikler, kofaktörler, aktif yerler, yapı ve etki mekanizmalarına dair güvenilir bilgiye sahip olmak için ileri derecede saflaştırılmış enzimlere ihtiyaç duyulur.
Enzim saflaştırması, içinde pek çok başka bileşen bulunan ham bir tam hücre ekstratından özel bir enzim proteinin izolasyonunun sağlanmasıdır (Özata ve Kutlu, 2000). Enzimler protein yapılı olması sebebiyle, proteinlerde kullanılan saflaştırma basamakları enzimler için de kullanılmaktadır. Kimyasal ve fiziksel olarak birbirine benzeyen yüzlerce protein karışımından istenilen enzimin elde edilmesi için öncelikle yapılması gereken hücreleri parçalamaktır. Hücrelerin parçalanmasıyla proteinler ham özüt olarak adlandırılan çözeltiye karışır ve sonrasında gerekli görüldüğünde santrifüjleme basamağı tamamlanır. Çözeltiye karışan proteinlerin farklı özelliklerinden yararlanılarak, proteinler fraksiyonlarına ayrışabilmektedir. Çoğunlukla tercih edilen saflaştırma yöntemlerinden olan afinite kromatografisi, insan eritrosit hücrelerinden tedariği sağlanan karbonik anhidraz enziminin izole edilmesi için en doğru ve sağlam sonucu veren metottur. Afinite kromatografi kolonlarında sadece hedeflenen molekülü kendine bağlama yeteneğine sahip katı bir desteğe tutturulmuş ligandlar kullanılır.
Hedef molekül olan enzim kolon içinde ligandlara bağlanırken, diğer moleküller kolondan dışarı atılır. Bağlanan hedef molekülü kolondan almak için ikinci aşamada kolona enzimin bırakılmasını sağlayacak bir tuz çözeltisi kullanılır.
Afinite kromatografisi oldukça pahalı bir metot olmasına rağmen tek basamakta başarılı sonuçlar veren bir yöntemdir (Yıldız, 2007).
Afinite kromatografi şekilde olduğu gibi şematize edilebilir. Şekildeki basamaklarda afinite jeli oluşumu, numunenin jele tutunması ve istenilen enzimin saf bir şekilde elüsyonu gösterilmiştir.
Şekil 2.4. Afinite kromatografisi basamakları (Aslan, 2014).
Çoğunlukla hedeflenen molekül ile matriks arasındaki sterik engelden dolayı kolondaki liganda saflaştırılmak istenen molekülün bağlanması zorlaşmakta ve kolonda istenen verimin azalmasına sebep olmaktadır. Kolona uygun uzantı kolu kullanımı ile bu sorun ortadan kaldırılabilir.
2.1. Karbonik Anhidrazlar
Karbonik anhidraz (E.C. 4.2.1.1) yaşamsal fonksiyon gösteren organizmalarda yer alan, karbondioksit (CO2) ile bikarbonat (HCO3-) arasındaki dönüşümü katalizleyen ve yapısında Zn+2
iyonu bulunduran bir metaloenzim grubudur (Andany vd. 2015).
Göz lensi, böbrek ve gastrik mukoza dokularındaki H+ ve HCO
3- birikimi karbonik
anhidraz enzimi tarafından gerçekleşir.
Karbonik anhidraz enzimi omurgalılarda, yeşil bitkilerin sitoplazma hücresinde, çift ve tek çenekli bitkilerin kloroplast organelinde, bakteriler ve alglerde yer almaktadır. Arkea ve bazı deniz diatomları türlerinde üç boyutlu yapıya sahip CA türleri bulunmaktadır.
Karbonik anhidraz enzimi ilk olarak 1933 yılında, insan akciğerinin yüzeyinde kan transport sisteminde CO2 taşınımı esnasında eritrosit hücrelerinden elde edilmiştir (Smith ve
Ferry, 2000). Daha sonrasında sıçan eritrositleri ve tükürüğü, sığır kemiği ve lökositleri, balık eritrositleri, çeşitli bakteri ve bitki türleri dahil olmak üzere pek çok gruptan saflaştırma çalışmaları yapılmıştır (Çomaklı vd., 2012).
Solunum olayında meydana gelen yukarıdaki reaksiyon katalizör olmadan çok yavaş bir süreçte gerçekleşir. İnsan eritrosit CA’sı, doku kılcal damarlarındaki karbondioksiti bikarbonata, daha sonra da akciğer pulmoner kapilerdeki bikarbonatı karbondioksite katalizleme fonksiyonu ile reaksiyonu saniyede 106 kat hızlandırma özelliğine sahiptir (Chegwidden ve
Carter, 2000).
Karbonik anhidraz kataliz reaksiyonu, metabolizma dokuları ile akciğerler arasında CO2’in solunumu ve bikarbonatın taşınması, CO2’e pH homeostazinin sağlanması, çeşitli
dokular ve organlara elektrolit salgılanması, biyosentetik reaksiyonlar (glukoneojenez, lipogenez, kemik erimesi, kalsifikasyon ve tümör oluşumu gibi) dahil olmak üzere pek çok patolojik ve fizyolojik süreçte yer almaktadır (Supuran, 2008).
Bugüne kadar yapılan araştırmalar sonucunda α-CA, β-CA, γ-CA, δ-CA, ζ-CA, η-CA ve son olarak θ-CA olmak üzere 7 tip karbonik anhidraz gen ailesi keşfedilmiştir ve bunlar canlı organizmalar arasında seçici olarak dağılmıştır (Supuran ve Capasso, 2014). Yüksek yapılı bitkiler, alg ve siyanobakteriler α, β, ve γ-CA ailesinde yer alırken omurgalılar sadece α-CA ailesinde yer almaktadır (Kaul vd., 2011). β-CA’lar baskın olarak bakteri, mantar ve algler dahil olmak üzere ve tek-çift çenekli bitkilerin kloroplastlarında mevcuttur. γ –CA’lar başlıca arkea ve bazı bakterilerde, δ-CA’lar deniz diatomlarında, merkezinde kadmiyum metali içeren ζ-CA’lar yine deniz diatomlarında bulunur (Innocenti vd., 2008)
2.1.1. α- Karbonik anhidrazlar (α-CA)
Karbonik anhidraz enzimi izoformları; katalitik aktivite, hücre altı lokasyonu, doku dağılımı ve inhibitörlere karşı duyarlılık açısından farklılık göstermektedir. Bunların spesifik fizyolojik rolü ve eksikliği veya işlev bozukluğundan türetilen patofizyolojik bozukluklar çoğunlukla insanlarda bilinmediği için araştırmalar devam etmektedir. (Andany vd. 2015).
α- Karbonik anhidrazlar insanlarda ve yüksek omurgalılarda yaygın olmak üzere, bazı mantarlarda, alg ve bakterilerde, yeşil bitkilerin sitoplazmalarında bulunur. Günümüze kadar yapılan çalışmalarda insanlar dahil olmak üzere yüksek omurgalı canlılarda, fizyolojik öneme sahip 16 farklı CA izoformu izole edilmiş ve tanımlanmıştır. Bu izoenzimlerin 15’i insan dokularında dağılış göstermektedir fakat CA-XV formu insanlarda bulunmamaktadır (Neri ve Supuran, 2011).
α- Karbonik anhidraz izoenzimlerinin fizyolojik fonksiyonları
İlk kez memeli eritrositlerinden izole edilen karbonik anhidraz izoenzimleri, metabolik olarak yalnızca CO2 dönüşümünü sağlamakla kalmayıp pek çok dokuda HCO3 ve H+ transferini
gerçekleştirerek solunumda görev almaktadır. İnsan eritrosit hücrelerinden saflaştırılan hCA-I izoenzimi eritrositlerde II’den daha fazla bulunmasına rağmen katalitik aktivitesi hCA-II’den daha düşüktür.
Üzerinde en fazla çalışma yapılan karbonik anhidraz türü olan hCA-II pek çok çeşitli dokuda dağılım göstermektedir (Aydın, 2007; Lindskog 1997).
CA-I sitolozik bir izoenzim olup; bol miktarda eritrositlerde, epitel hücrelerinde, kornea endotelinde, gastrointestinal sistem hücrelerinde ve ter bezlerinde bulunmaktadır (Davis vd., 1986). Sağlıklı yetişkin eritrosit hücrelerinde bulunan CA-I izoenziminin, total CA aktivitesinin %50’sini oluşturduğu tespit edilmiştir (Sarışın, 2018).
CA-II, karbondioksit hidrasyonu reaksiyonu için diğer izoenzimlerle kıyaslandığında maksimum hızda katalitik aktivite gösteren tek sitozolik izoenzimdir. Bu özeliğinden dolayı en çok çalışma yapılan izoformlardan biridir (Aggarwal vd., 2012). Gastrointestinal sistemin epitelyumunda, beyin ve safra kesesi dahil olmak üzere; karaciğer, ter bezleri, böbrek tübülü, adipoz doku, kas, epidermis ve endotel hücrelerinde yer almaktadır (Parkkila vd.,1994; Sly vd., 1983). Aynı zamanda göz dokusuna sodyumun taşınmasında ve göz içi basıncının ayarlanmasında rol almaktadır. Yapılan araştırmalar sonucu CA-II izoenziminin glokom hastalığının tedavisinde hayati önem taşıdığı tespit edilmiştir.
CA-III izoenzimi karbondioksit hidratasyonu katalizi için en düşük aktiviteye sahip olan sitozolik izoformdur. Genellikle kırmızı iskelet kasında ve bazı farklılaşmış adipositlerde bulunmaktadır. Ayrıca sülfonamid türevi asetazolamid inhibitörlerine karşı yüksek direnç göstermektedirler (Cabiscol ve Levine., 1995). 4- nitrofenil asetat hidroliz aktivitesi gösteren CA-III’ün aynı zamanda fosfataz aktivitesine sahip olduğu tespit edilmiştir (Lindskog, 1997).
CA-IV bir glikozil-fosfatidil inositol bağı yoluyla hücre membranına bağlı halde bulunmaktadır. Yüksek aktivite özelliğinden dolayı CA-II ile benzerlik göstermektedir. İnsan kolon enterositleri, safra kesesi epitel hücreleri ve safra kanalları dahil olmak üzere; pankreas kanalları, tükürük bezleri, proksimal böbrek tübül, iskelet kası, düz kas ve endotelyal pulmoner mikrovasküler sistemin hücrelerinde bulunmaktadır (Andany vd. 2015).
V mitokondriyal bir izoenzimdir. VA ekspresyonu karaciğere özgü iken, CA-VB hücrelerde daha geniş bir dağılım göstermektedir. İskelet kası ve kalp kasında, pankreas, tükürük bezleri, böbrek ve omurilikte varlığı tespit edilmiştir (Fujikawa-Adachi vd., 1999).
CA-VI α- Karbonik anhidraz grubundaki tek salgı izoenzimidir. Tükürük ve süt bezinde yüksek konsantrasyonda bulunmakta, aynı zamanda özofagal ve gastrik epitelyumu asit hasarından korunmasında rol almaktadır (Kallio, 2011).
CA-VII sitozolik CA izoformu olup yüksek katalitik aktiviteye (kcat 9.5 × 105 s−1 ) sahiptir (Vullo vd., 2005). Çoğunlukla beyinde, daha sonra kolon, karaciğer, iskelet kası ve tükürük bezinde eksprese edilmektedir (Montgomery, 1991; Frost, 2014). Son zamanlarda yapılan araştırmalarda CA-VII’nin CA-III ile birlikte reaktif oksijen türlerinin oluşumu üzerine oksidatif hasarın meydana geldiği hücrelerdeki savunma işlemlerinde katılabileceği öne sürülmektedir (Monti ve De Simonte, 2017).
CA-VIII izoenzimi ile CA-X ve CA-XI izoformları katalitik aktiviteye sahip değillerdir. Karbonik anhidraz aktivitesi ve çinko bağlama için gerekli olan histidin aminoasidi (His94, His96, His119) eksik bulunmaktadır (Nishimori vd., 2013). CA-VIII sitolozik izoenziminin insan ve farelerde motor koordinasyonun sağlanmasında rol almaktadır (Aspatwar vd., 2013).
Yapılan çalışmalarda CA-VIII ve CA-XI izoenzimlerinin gastrointestinal stromal tümör gelişimi oluşturduğu tespit edilmiştir.
CA-IX karbonik anhidraz enzim ailesinin tümörle ilişkili izoenzimlerinden olup; mide, kolon ve pankreasta lokalize olamaktadır. pH düzenlenmesinin yanı sıra hücre poliferasyonu ve bağlanmasında yer aldığı bilinmektedir (Hilvo vd., 2008).
CA-X VE CA-XI izoenzimleri katalitik aktiviteye sahip değillerdir (Neri ve Supuran, 2011).
CA-XII izoenzimi sıvı homeostazının düzenlenmesinde görev alan, böbrekte lokalize olmuş membrana bağlı enzim türüdür (Halmi vd., 2004). CA-XII'nin dönüştürülmüş hücrelerde ekspresyon prevalansı incelendiğinde, doku ile ilişkili ve dolaşımın yüksek seviyelerde olduğu
CA-XII, sırasıyla tiroid ve skuamöz akciğer kanserlerinin belirteçleri olarak önerilmiştir (Kopecka vd., 2016).
Hem insanlarda hem de farelerde geniş çapta yaygınlık gösteren CA XIII izoenzimi spesifik olarak insanlarda; ince bağırsak, dalak, prostat, yumurtalık ve testiste bulunmaktadır. Farelerde ise akciğerde, dalak, böbrek, kalp, beyin, iskelet kası ve testiste dağılım göstermektedir. Üreme sisteminde yoğun bir şekilde bulunması fertilizasyonun sağlanmasında büyük önem taşıdığını ortaya çıkarmaktadır (Lehtonen vd., 2004).
CA-XIV gözde lokalize edilmiş zara bağlı bir izoenzim olup retinal ışık tepkisinin oluşumunda rol aldığı tespit edilmiştir (Ogilvie vd., 2007).
Son zamanlarda yeni keşfedilen CA-XV izoenzimi insan ve şempanzelerde ifade edilemeyen tek α-CA olarak bilinmektedir. Yapılan ilk filogenetik araştırmalar XV’nin CA-IV izoenzimi ile ilişkili olduğunu göstermektedir. CA-XV izoenzimi CA-CA-IV gibi plazma zarında bulunan GPI (Glikosilfosfotidilinositol) bağlantılı bir izoenzimdir ve çoğunlukla böbreklerde lokalize olmaktadırlar (Renner, 2017).
Çizelge 2.1. α - Karbonik Anhidrazlar aktivitesi ve fonksiyonları (Renner, 2017). Hücre içi Yerleşimi İzoenzim Kcat (x 105) (s-1)
İşlevi Bulunduğu Dokular
Sitozolik I 2 • Solunum
• pH dengesi
Gastrointestinal sistem, Göz, Ter Bezi, Eritrositler
Sitozolik II 14 • Solunum
• pH dengesi
Tüm Dokular
Sitozolik III 0,1 • Metabolizma
• Serbest radikal oluşumu
Yağ Dokusu, İskelet Kası
Sitozolik VII 9,5 • Nöbetler
• Serbest radikal oluşumu • Kanser oluşumu
Beyin, Kolon, Karaciğer ve İskelet Kası, Tükürük bezi
Sitozolik XIII 1,5 • Üreme fonksiyonu Üreme Organları, İnce Bağırsak, Dalak
Sitozolik VIII --- • Motor koordinasyonu
• Kanser çoğalması
Beyin
Sitozolik X --- • Merkezi sinir sistemi Merkezi Sinir Sistemi
Sitozolik XI --- • Merkezi sinir sistemi
• Kanser çoğalması
Merkezi Sinir Sistemi
Membrana Bağlı IV 11 • Solunum
• Sperm hareketliliği
Akciğer, Böbrek, Safra kesesi,
Membrana Bağlı IX 3,8 • Gastrik homeostaz
• Kanser çoğalması • Hipoksi
Mide, Kolon, Pankreas
Membrana Bağlı XII 4,2 • Sıvı dengesi
• Kanser çoğalması
Böbrek
Membrana Bağlı XIV 3,1 • Fotoreseptör
• Sinyalizasyon
Beyin ve Göz
Membrana Bağlı XV 4,7 • Bilinmiyor Böbrek
Mitokondrial VA 2,9 • Üre sentezi
• Glukoneogenez • Lipogenez
Karaciğer
Mitokondrial VB 9,5 • Üre sentezi
• Glukoneogenez • Lipogenez
Bütün Dokular
Salgısal VI 3,4 • Tat algılaması
2.1.2. β Karbonik Anhidrazlar (β-CA)
β-CA izoenzim türleri genellikle eubakterilerde, bitki kloroplastında, Arkea’larda, kırmızı ve yeşil alglerde farklı yapısal formda bulunan çinko meteloenzimlerdir. Yapısal ve işlevsel özellikler çok fazla bilinmeyen β-CA’ların genel olarak damarlı bitkilerde fotosenteze yardımcı olduğu tespit edilmiştir. Genellikle 25-30 kDa'lık moleküler ağırlığa sahip 2 ila 6 monomerden oluşan dimer, tetramer veya oktamerlerdir (Kimber, 2000; Strop vd., 2001; Rowlett, 2010).
2.1.3. γ Karbonik Anhidrazlar (γ-CA)
γ-CA izoenzim sınıfı genellikle 70 kDa'lık moleküler ağırlığa sahip homotrimer olup, çoğunlukla arkea ve bazı bakteri türlerinde dağılış göstermektedirler. İlk kez bir archebacteria türü olan Methanosarcina thermophila’dan karakterize edilen γ-CA izoenzimi yapısal olarak α ve β-karbonik anhidrazlardan farklı özelliğe sahiptir. Üç boyutlu yapısı sol-el paralel β-heliks katlanma özelliği içermektedir. Çinko iyonu bulunduran bazı γ-CA izoenzimlerinin koordinasyon geometrisi üçgen bipiramit, kükürt iyonu içerenler γ-CA’larda koordinasyon geometrisi oktahedral görünümdedir (Supuran, 2007).
2.1.4. δ Karbonik Anhidrazlar (δ-CA)
δ-CA sınıfı izoenzimi, 1997 yılında bir deniz diatomu olan Thalassiosira weissflogii'den saflaştırılmış olup (TCWA 1), 27 kDa'lık monomerik bir yapıya sahiptir. Katalitik çinko iyonu, α ve γ sınıfı karbonik anhidraz türlerinin aktif bölgelerine benzer bir şekilde, üç histidin ve bir su molekülü tarafından çevrelenmiş, x-ışını absorpsiyon spektroskopisi ile belirlenmiştir (Tripp vd., 2001). δ-CA sınıfı, yüksek bitkilerin β-CA’larından oldukça farklı özelliğe sahip olup diğer karbonik anhidraz sınıfları ile herhangi bir sekans benzerliği göstermediği yapılan çalışmalarla belirlenmiştir (Supuran ve Scozzafava, 2007).
2.1.5. ζ, η ve θ Karbonik Anhidrazlar
ζ-CA izoenzim türünün yapılan çalışmalarda δ-CA gibi bazı deniz diatomlarında bulunduğu, yapısal olarak aynı protein molekülü üzerinde üç farklı aktif bölgeye sahip olduğu tespit edilmiştir. η-CA sınıfı izoenzimleri Plasmodium cinsinin pek çok türünden izole edilmiştir. Daha önceden α-CA grubuna dahil bilinen η-CA’ların yapılan son çalışmalarla içerdiği metal iyon kalıpları dahil olmak üzere bir dizi benzersiz özelliğe sahiptir (Lionetto vd., 2016).
Pt43233 proteini, Cys-Gly-His-rich (CGHR) protein ailesinin bir üyesidir. Son yapılan araştırmalarda Pt43233 proteininin daha önce tanımlanamayan bir karbonik anhidraz grubu θ-CA olduğu keşfedilmiştir.
θ-CA izoenzim sınıfı sistein, histidin ve bazen Zn koordinasyonu için aspartat kullanan β ve ζ -CA'lara benzerlik göstermektedir. Phaeodactylum tricornutum adlı deniz diatomu türünün tilakoid lümeninde Pt43233 proteini tanımlanmıştır. Bu proteinin aşırı ekspresyonu ve RNAi mutantlarının analizi sonucunda, bu CA'nın bu diatomda fotosentetik etkinlik ve büyüme için gerekli olduğu tespit edilmiştir. θ-CA'nın biyokimyasal özellikleri diğer bilinen CA'lardan farklılık göstermektedir (Kikutani vd., 2016)
Çizelge 2.2. Canlılarda bulunan Karbonik Anhidraz Gen Ailesi Enzimleri (Aspatwar, 2018).
KARBONİK ANHİDRAZ SINIFI
ENZİM METAL İYONU BULUNDUĞU
ORGANİZMALAR α-CA Monomerik, dimerik Zn+2 Hayvan hücresi, prokaryot, mantar ve bitki
β-CA Multimerik Zn+2 Bitki, bakteri ve mantar
γ-CA Trimerik Zn+2 Fe Co Bitki, arkea, bakteri ve
mantar
δ-CA Monomerik Cd ve Zn Deniz diatomu
ζ-CA Monomerik Co Deniz diatomu
η-CA Monomerik Zn+2 Plasmodium cinsi
θ-CA Monomerik Zn+2 Deniz diatomu
2.1.6. Karbonik Anhidraz enziminin katalitik mekanizması
Karbonik anhidraz enzim grubunun katalitik aktivitesini belirlemek üzere yapılan çalışmalar sonucunda enzimin aktif bölgesinde Zn+2 iyonu ve ona bağlı hidroksil grubu
bulunmuştur. X-ray kristalografi verileri, bir H2O molekülü/hidroksit iyonu ve üç histidin
rezidüsü (His94, His96 ve His119) tarafından koordine edilen bu iyonun aktif bölge yarığının 15Å derinliğine yerleştiğini tespit etmiştir.
Çinko bağlı H2O molekülü, Glu106 rezidüsünün karboksilat kısmı aracılığla köprü
oluşturan Thr199 kalıntısının OH- ucuna hidrojen bağı etkileşimleriyle bağlanmaktadır. Çinko iyonunun bağlanmasıyla H2O molekülünün nükleofilitesini artar ve substratı (CO2) gerekli
lokasyona yönlendirmektedir.
Şekil 2.5. İnsan karbonik anhidraz aktif bölgesinin şematik gösterimi (Crichton, 2012).
Enzime Zn+2 iyonunun hidroksil grubuna bağlanmasıyla aktif form oluşmaktadır. Aktif
forma geçen enzim, güçlü nükleofil yapısıyla Zn+2 iyonuna bağlı bikarbonatı oluşturmak için
CO2 ile etkileşime girer. Bikarbonat iyonu (HCO3-) su molekülüyle yer değiştirerek çözeltiye
bırakılır. Böylece Zn+2 iyonu ve su molekülüne tutunarak enzimin asit formunu meydana
getirir, enzimin bu formu katalitik olarak inaktif haldedir.
Enzimin aktif bölgesindeki His64 kalıntısı ortamda yer alan tamponlar vasıtasıyla etrafına proton transferi gerçekleştirilerek aktif formu tekrardan kazandırılır (Supuran, 2008).
Şekil 2.6. Karbonik anhidraz enziminin CO2 hidratasyon reaksiyonunun kataliz
mekanizmasının şematik gösterimi.
2.2. Karbonik Anhidraz İnhibitörleri
Karbonik anhidraz enzimlerinin güçlü ve özellikli organik inhibitörlerinin aromatik ve heterosiklik sülfonamidler olduğu tespit edilmiştir. Sülfonamidler hidrofilik bölgeye ek olarak aromatik ve heterosiklik hidrofobik bölgeye sahip etkili inhibitörlerdir.
Kolaylıkla iyonik yapı kazanabilen sülfonamidlerin ligand olarak kullanıldığı bu iyonik yapı özelliği CA enzimi üzerindeki inhibisyon etkisi için önem taşımaktadır (Kohn ve Wilchek, 1978).
Genellikle diüretik ve sistemik antiglokom ilaçların üretiminde kullanılan sülfonamidler aynı zamanda epilepsi, kalp yetmezliği, osteoporoz ve nörolojik hastalıkların tedavisinde yardımcı olarak kullanılmaktadır.
Karbonik anhidraz inhibitörleri sistemik ve topikal inhibitörler olmak üzere iki sınıfta incelenirler. Sistemik inhibitörler asetazolamid, metazolamid ve diklorfenamid olarak sınıflandırılırlar. Topikal inhibitörler ise dorzolamid ve brinzolamidlerdir.
Asetazolamidler farklı sitotoksit ajanlarla kombinasyon halinde olan antikanser tedavilerinde potansiyel olarak kullanılan güçlü inhibitörlerdir. Humor aköz yapımını azaltıp
metabolik asidoza yol açan asetazolamidlerin metabolik asidoz etkisi, optik sinir kan akışını arttırarak glokom hastalarında görme yetisini koruduğu bilinmektedir (Hoşgör, 2012 ; Yılmaz, 2014 ; Supuran vd., 2001).
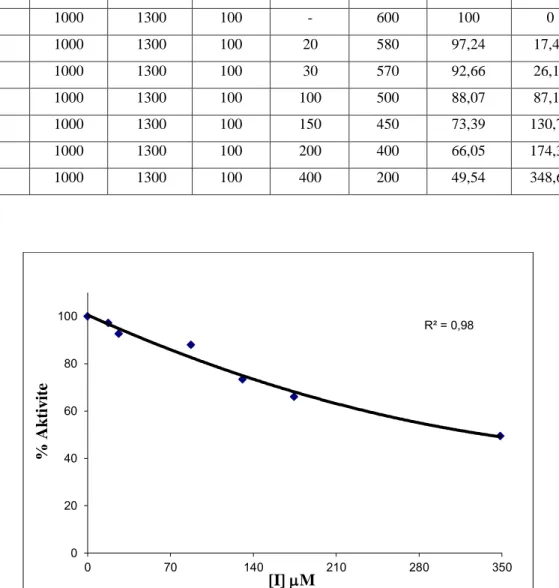
Glokom hastalığının tedavisinde kullanılan topikal ve sistemik CA sülfonamidlerinin izoenzim seçiciliği olmadığı için ciddi yan etkileri bulunmaktadır. Bu nedenle izoenzim seçiciliğine sahip sülfonomidlerin geliştirilmesi amacıyla pek çok çeşitli inhibisyon araştırmaları yapılmaktadır. Çalışmamızda sülfosalisilik asit türevi komplekslerinin karbonik anhidraz izoenzimleri üzerindeki inhibisyon etkisi incelenmiştir. Yapılan araştırmalar sonucunda elde edilen veriler sonucunda IC50 ve Ki değerleri hesaplanmıştır.
3. GLOKOM
Yüksek göz içi basıncı nedeniyle optik sinir uçlarında geri dönüşümsüz bir hasara sebep olan glokom hastalığı, (göz tansiyonu) ilerleyen evrelerde görme fonksiyonunun kaybına ve körlüğe yol açan göz bir hastalığıdır (Supuran, 2008). Önlenebilir körlüğün ikinci sebebi olan glokom hastalığının 2020 yılında tüm dünyada 80 milyon kişiyi etkileyeceği tahmin edilmektedir (Yaman, 2018).
Göz içi basıncı, aköz humor sıvısı olarak gözün damar tabakası içersinde üretilir ve göz içersine salgılanır. Göz içersindeki sıvının üretimi ile göz dışına çıkışı arasında bir denge mevcuttur. Bu denge ile göz içersinde sabit bir basınç oluşmaktadır. Sağlıklı kişilerde normal göz içi basıncı 10-21 mmHg arasında iken hasta kişilerde bu aralık 5-40 mmHg arasında değişmektedir. Oluşan basınç görme duyusu için gerekli dokuların bütünlüğünün korunmasında önemli rol oynamaktadır. Aköz humor içerdiği oksijen ve besin maddeleri ile başta kornea olmak üzere birçok dokuyu besler ve metabolik ürünlerin uzaklaşmasını sağlamaktadır (TOD, 2018 ; Timothy 2007).
Glokom hastalığının tedavisinde kullanılan yöntemlerin çoğunluğunu göz içi basıncını düşürmeye yönelik çalışmalar oluşturmaktadır. Cerrahi müdahale, lazer tedavisi veya ilaç tedavisi ile göz içi basıncının düşürülmesi sağlanmaktadır. Karbonik anhidraz inhibisyonu göz içi basıncının düşürülmesinde ve kontrolünde önemli rol oynamaktadır (Ritch vd., 1996).
Karbonik anhidrazların güçlü inhibitörleri olan sülfonamidler, yükselen göz içi basıncını düşürmek amacıyla glokom tedavisinde uzun yıllar kullanılmaktadır. Sistemik inhibitörler olan asetazolamid, metazolamid, etokzolamid ve diklorfenamid bileşikleri tedavi amaçlı ilaçlarda etken madde olarak bulunmaktadır. Asetazolamid bileşikleri, ideal farmakokinetik ve toksisite özellikleriyle göz içi basıncının etkili bir şekilde azalmasını sağlaması nedeniyle uzun süre sıklıkla kullanılanılmıştır. Bu inhibitörler gözün arka kamarasındaki silier cisimi epitelinde yer alan CA-II ve CA-IV izoenzimlerini aktivitesini yavaşlatarak HCO
-3 oranının azalmasını sağlarlar. İnhibisyonun gerçekleşmesiyle humor aköz
üretimi azarlır ve göz içi basıncı düşer. Glokom hastalığının tedavisi için humor aközün salgılanmasını %25-30 oranında azaltan sülfonamid inhibitörleri göz dışındaki dokularda bulunan CA enzimlerine etki ettiğinden dolayı ciddi sistemik yan etkiler meydana getirirler.
Oluşan yan etkilerin azaltılması amacıyla, lokal olarak göze uygulanabilen ve farklı dokulardaki CA enzimlerini inhibe etmeyen, daha etkin özellikte topikal CA inhibitörleri olan brinzolamit ve dorzolamid bileşikleri sentezlenmiştir.
Suda çözünebilen, korneaya nüfuz olabilmek için yağda yeterince çözünme özeliğinde olan brinzolamit ve dorzolamid, hidroklorür tuzu veya serbest baz olarak topikal uygulanabilen topikal CA inhibitörleridir. İki inhibitörde yüksek göz içi basıcının düşürülmesinde etkili olup ve daha az yan etki göstermektedir. Dorzolamid göz damlası çözeltisinin asidik pH’sı nedeniyle göz yanması, batması, kaşıntı ve bulanık görme gibi yan etkiler gözlemleniştir (Supuran, 2008a). Yapılan çalışmalar sonucunda sentezlenen bileşiklerin yan etkisinin en az olması, yüksek enzim aktivitesine sahip olması amaçlanmış ve bugüne kadar pek çok bileşik sentezlenmiştir.
4. MATERYAL VE METOD
4.1. Çalışmada Faydalanılan Kimyasal ve İnhibitör Bileşikler
Çalışmalarımızda yararlanılan CNBr Sepharose-4B, N,N,N',N'- tetrametil etilendiamin çözeltisi (TEMED), p-nitrofenil asetat, tris(hidroksimetil) aminometan (TRIS), L-tirozin, sodyum klorür, sodyum sülfat, sodyum asetat, sodyum hidrojen fosfat, sodyum perklorat, sodyum barbital, sodyum bikarbonat, fosforik asit, hidroklorik asit, aseton, etanol, akrilamid, N,N' metilen bisakrilamid, sülfürik asit, Coomassie Brillant Blue G-250 ve R-250 boyar maddesi, sodyum hidroksit ve karbon dioksit gazı Merck ve Sigma Aldrich firmalarından tedarik edilmiştir.
Çalışmalarımızda faydalanılan inhibitör bileşikler anorganik kimya laboratuvarında Doç.Dr. Nurgün Büyükkıdan tarafından sentezlenmiştir. İnhibitör bileşiklerin formülleri ve isimleri aşağıdaki şekil ve çizelgede yer almaktadır.
4.2. Kullanılan Cihaz ve Aletler
Çalışmalarımız esnasında aşağıdaki malzemeler ve aletlerden yararlanılmıştır. Faydalanılan alet-araçlar Dumlupınar Üniversitesi Biyokimya Araştırma Laboratuvarında yer almaktadır.
Spektrofotometre: Shimadzu UV-1700 Pharma Spec. Soğutmalı Santrifüj: Sigma K30
Santrifüj: Nüve NF800 pH metre: WTW Inolab 7110
Peristaltik Pompa: Ismatec MS-4/8 Reglo Digital Magnetik Karıştırıcı: Daihan MSH-20A
Vorteks: Heidolph Reax Top Hassas Terazi: Ohaus-Adventurer Otomatik Pipetler: Biohit Proline Elektroforez Sistemi: WEALTEC Elite 300
Molekül ağırlığı: 702,16 (g/mol) Molekül ağırlığı: 718,16 (g/mol)
1 2
Molekül ağırlığı: 716,15 (g/mol) Molekül ağırlığı: 751,19 (g/mol)
3 4
Molekül ağırlığı: 326,33 (g/mol) Molekül ağırlığı: 347,28 (g/mol)
5 6
Molekül ağırlığı: 386,46 (g/mol) Molekül ağırlığı: 382,41 (g/mol) 7 8
Molekül ağırlığı: 326,33 (g/mol) Molekül ağırlığı: 128,17 (g/mol)
9 10
Molekül ağırlığı: 168,28 (g/mol) Molekül ağırlığı: 114,19 (g/mol)
11 12
Molekül ağırlığı: 163,22 (g/mol) Molekül ağırlığı: 130,19 (g/mol) 13 14
Şekil 4.1. (Devam) İnhibitör bileşiklerin kimyasal gösterimi.
Çizelge 4.1. İnhibitör maddelerin adlandırılmaları ve kodları.
Kodu Bileşiğin Adı
1 CussaEtpip : Etilpiperazin+H3SSA Bakır kompleksi
2 CussaHOEtpip : Hidroksietilpiperazin+ H3SSA Bakır kompleksi
3 CussaAcpip : Asetilpiperazin+ H3SSA Bakır kompleksi Etanol ile
4 Cussapypip : 2 piridin+piperazin+SSA Bakır kompleksi 5 ssaHOEtpip : Hidroksietilpiperazin+SSA
6 ssaAcpip : Asetilpiperazin +SSA 7 ssacypip : Sikloheksil +pip+ H3SSA
8 ssapypip : 2 piridin+piperazin+ H3SSA
9 ssaEtpip : Etilpiperazin +H3SSA
10 Acpip : 1- Asetil piperazin 11 Cypip : 1- Sikloheksil piperazin 12 Etpip : 1- Etil piperazin 13 Pypip : 2- Piridin piperazin 14 HOEtpip : 1- Hidroksietil piperazin
4.3. Kullanılan İnhibitör Maddeler Ve Çözeltiler
Deneysel çalışmalar için gerekli olan çözeltilerin hazırlanış şekilleri ile kullanıldığı aşamalar sırasıyla aşağıda açıklanmıştır.
1. Esteraz aktivitesinin ölçümü ve diyalizde kullanılan tamponun hazırlanması için: 0,05 M
6,055 g Tris-SO4 tartıldı, 950 mL saf suda çözülerek 1 N H2SO4 ile pH 7,4'e sabitlendi ve hacmi
saf su ile toplamda 1 litreye sabitlenerek tampon çözelti hazır hale getirildi.
2. Sepharose-4B matriksi üzerinde afinite jelinin hazırlanmasında yer alan tampon için: 0,2 M
16,8 g NaHCO3 tartıldı, 950 mL saf suda çözülerek 1 N NaOH ile pH 8,8’e sabitlendi ve hacmi
saf su ile toplamda 1 litreye tamamlanarak tampon çözelti hazırlandı.
3. Afinite jelinin dengelenmesinde kullanılan tamponun hazırlanması için: 3,0275 g 25 mM
Tris-HCl ve 14,2 g 0,1 M Na2SO4 tartıldı, 950 mL saf suda çözülüp 1 N HCl ile pH 8,7’ye
ayarlandıktan sonra hacim saf su ile toplamda 1 litreye sabitlenerek tampon çözelti elde edildi.
4. Hemolizat tatbikinden sonraki aşamada afinite jelinin yıkanmasında kullanılan tamponun
hazırlanması için: 3,0275 g 25mM Tris-HCl ve 3,124 g 22 mM Na2SO4 tartıldı, 950 mL saf suda
çözülüp 1 N HCl ile pH 8,7’ye ayarlandı ve hacmi saf su ile toplamda 1 litreye tamamlanarak tampon çözelti hazırlandı.
5. İzoenzimlerin elüsyonunda kullanılan çözeltiler;
Kolona bağlanmış hCA I izoenzimin elüsyonunda yer alan tamponun hazırlanması için: 8,875 g 0,025 M Na2HPO4 ve 14,625 g 1 M NaCl bileşiği tartıldı, 200 mL saf su ile çözülüp 1N HCl ile
pH 6,3’e ayarlandı. Sonrasında toplam hacim saf su ile 250 mL ye tamamlanarak tampon hazırlandı.
Kolona bağlanmış hCA II izoenziminin elüsyonunda yer alan tamponun hazırlanması için: 9,187 g 0,5 M NaClO4 ve 2,09 g 0,1 M NaCH3COO.H2O bileşiği tartıldı, 120 mL saf suda
çözünerek 1 N HCl ile pH 5,6'ya getirildi. Sonrasında toplam hacim saf su ile 150 mL ye tamamlanarak tampon hazırlandı.
6. SDS-Elektroforezinde yer alan numune tamponunun hazırlanması için: 0,65 mL 1 M
Tris-HCl (pH 6,8), 1 mL %100 lük gliserin, 3 mL %1'lik SDS ve 1 mL %0,1 lik brom timol mavisi karıştırıldı ve son hacmi saf su ile 10 mL ye tamamlanarak tampon hazırlandı. Kullanılmadan hemen önce 950 μL numune tamponunda 50 μL olacak şekilde merkaptoetanol eklendi.
7. SDS- Elektroforezinde yer alan yürütme tamponunun hazırlanması için: 1,5 g Tris ile 7,2 g
glisin 50 mL suda çözülerek üzerine 5 mL %1'lik SDS eklendi. Toplam hacim saf su ile 500 mL ye tamamlanarak tampon çözelti hazır hale getirildi.
8. Proteinlerin kantitatif tayininde yer alan çözelti için: Coomassie brillant blue G-250 boyar
reaktifi: 100 mg coomassie brillant blue G-250, 50 mL %95 lik etanolde çözülerek 100 mL %95 lik fosforik asit eklendi. Sonrasında toplam hacmi saf su ile 1 litreye sabitlendi.
9. SDS-elektroforezde jelin boyanmasında yer alan çözeltinin hazırlanması için: Boyama çözeltisi: %50 metanol, 0,1 g Coomassie brillant blue R-250 boyar maddesi, %10 asetik asit ve %40 saf su karıştırılarak yeteri miktarda hazırlandı.
10. SDS-elektroforezde jelin yıkanma çözeltisinin hazırlanması için: Su ve %10 asetik asit
olacak şekilde metanol karıştırılarak yeterli miktarda hazırlandı.
11. SDS-elektroforezde jeldeki proteinlerin sabitleştirilmesinde yer alan çözeltinin hazırlanması
için: %50 izopropanol, %10 TCA, %40 saf su olacak şekilde yeteri kadar hazırlandı.
12. İnhibitör stok çözeltileri: Karbonik anhidraz inhibitörü olarak yeni sentezlenen 1-14
bileşiklerinin %1 lik çözeltilerini hazırlamak için; her bileşikten 5 er mg alındı ve 5 mL dimetilsülfoksitde (DMSO) çözücüsünde çözülmesi sağlandı.
4.4. Uygulanan Yöntemler
4.4.1. Protein tayin yöntemleri
Kalitatif protein tayini
Aynı hacimde alınan bütün franksiyonlarda, spektrofotometrede 280 nm de ilgili köre (tampon çözeltisine) karşı kalitatif protein tayini yapıldı ve absorbans değerleri kaydedildi.
Bradford yöntemi ile protein tayini
Afinite kromatografisiyle saflaştırılan izoenzimlerde ve hemolizatta Bradford yöntemi ile protein tayini gerçekleştirildi. Meydana gelen kompleks yapı, 595 nm de en yüksek absorbans değerini göstermektedir. Boyanın proteinle reaksiyonu çok hızlı şekilde gelişmektedir (Bradford, 1976).
Protein tayini sürecinde; 1 mL sinde 1 mg protein bulunduran standart çözeltiden 10-100 μL (10’ar μL artan hacimlerde) alındı ve toplam hacmi saf su ile 0,1 mL ye tamamlandı. Coomassie boyar reaktifinden 5 mL tüplere eklenerek vorteks yardımıyla karıştırıldı.
3 mL lik küvetlerde, 595 nm de 10 dakika sonrasında önceden hazırlanan köre karşılık absorbans değerleri kaydedildi. Kör karışımı 0,1 mL aynı tampon ve 5 mL Coomassie boyar reaktifinden elde edildi.
4.4.2. Karbonik anhidraz aktivitesi tayin yöntemi
Esteraz aktivitesi tayini
Bu tayin yönteminde karbonik anhidraz enzimi substrat olarak seçilen p-nitrofenil asetat bileşiğini p-nitrofenol veya p-nitrofenolata olarak parçalamakta ve 348 nm de absorbans göstermektedir.
p-nitrofenol substratı ve p-nitrofenolat 348 nm de birebir absorbans değeri göstermektedir. Fenol grubunda bulunan H+ iyonunun ayrışma durumu ölçümde etkili değildir
p-nitrofenil asetat substratının kör olarak kullanılmasının nedeni bu dalga boyunda çok az absorbsiyon göstermesidir. İlk aşamada kuvars küvetlere 1,3 mL tampon, 1 mL substrat, 0,6 mL su ve 0,1 mL enzim eklenerek 348 nm de, 25 ˚C de 3 dakika boyunca absorbansdaki değişimi kaydedildi. Spektrofotometreye enzim yerine 0,1 mL tampon eklenerek, karışımın 3 dakika sonraki absorbansı sıfıra ayarlandı. Böylece 3 dakika süresince esterin kendiliğinden parçalanan kısmı ile p-nitrofenil asetatın absorbsiyonu için düzeltme yapıldı. İnhibitörlü çalışmalarda suyun hacmi azaltılarak yerine o kadar miktarda inhibitör madde eklenerek aktivite ölçümleri gerçekleştirildi.
p-nitrofenil asetat (substrat) çözeltisi taze olarak hazırlandı. 1 mL aseton içinde 27,2 mg esterin çözülmesi sağlandı ve 49 mL saf suya yavaş yavaş eklendi. Diğer organik çözücülerle kıyaslandığında hidroliz reaksiyonunu en az inhibe eden çözücü olduğu için aseton çözücü olarak seçildi (Armstrong vd., 1966). 0,05 M Tris-SO4 (pH 7,4) çözeltisiyle enzim çözeltisinin tamponlanması ayarlandı (Kohn ve Wilchek, 1978).
4.4.3. Afinite jelinin hazırlanması
Tirozin CNBr ile aktifleştirilmiş Sepharose-4B üzerine kovalent olarak bağlandı. Sonraki aşamada diozalanmış sülfonamid tirozine kenetlendi. Sülfanilamid bileşikleri karbonik anhidraz izoenzimlerinin spesifik bir inhibitördür. Afinite jelinin yapısına katılarak seçici şekilde CA enzimin saflaştırılmasını sağlamaktadır (Kohn ve Wilchek, 1978).
Siyanojen bromürle aktifleştirilmiş sepharose-4B üzerine tirozinin bağlanması
80 mg tirozin pH’ı 10 olarak ayarlanan 20 mL NaHCO3 tamponuna alındı. Üzerine saf
su ile şişirilmiş 7,5 g CNBr aktifleştirilmiş Sepharose-4B eklendi. Sonraki aşamada tüm hacim saf su ile 250 mL’ye tamamlandı. Elde edilen karışım 4 ˚C de 16 saat bekletildi ve daha sonra jele bağlanmayan tirozini uzaklaştırmak için 280 nm de absorbans göstermeyinceye dek yıkandı (Arslan vd., 1997; Laemmli, 1970).