Ankara Üniv Vet Fak Derg, 52, 165-170, 2005
Tavşanlarda farklı süperovulatör ajanların oosit kalitesi ve in vitro
fertilizasyonu üzerine etkisi*
Necmettin TEKİN1, Serpil SARIÖZKAN2, Ongun UYSAL1, Ergun AKÇAY1 1 Ankara Üniversitesi, Veteriner Fakültesi, Dölerme ve Sun’i Tohumlama Anabilim Dalı, Ankara;
2 Hayvancılık Merkez Araştırma Enstitüsü, Lalahan.
Özet: Bu çalışmada iki farklı süperovülatör ajanın tavşan oositlerinin kalite, kantite ve in vitro fertilizasyonu üzerine etkisini araştırmak amaçlanmıştır. Araştırmada 16 dişi, 2 erkek Beyaz Yeni Zelanda ırkı tavşan kullanılmıştır. Bir grup dişi tavşana (n=8) kas içi yolla 24 saat arayla 3 kez 75 IU PMSG, diğer bir grup tavşana (n=8) ise kas içi yolla günde 2 kez 3 gün süreyle 7.5 IU FSH enjek-te edilmiştir. Son hormon uygulamasından 24 saat sonra her iki gruba 100 IU hCG damar içi yolla enjekenjek-te edilmiştir. HCG enjeksi-yonundan 15 saat sonra oviduktlar yıkanarak oositler toplanmıştır. PMSG uygulanan grupta toplam 34 adet oosit elde edilirken, FSH uygulanan grupta toplam 77 oosit alınmıştır. Gruplar arasındaki oosit sayısı farkı önemli bulunmuştur (p<0.01). Dejenere oosit oranı PMSG uygulanan grupta %14.71 (5/34), FSH uygulanan grupta ise %18.18 (14/77) olarak kaydedilmiştir. Ancak, gruplar arası deje-nere oosit sayısı farkının istatistiki açıdan önemli olmadığı saptanmıştır (p>0.05). Oositlerin in vitro fertilizasyonunun değerlendiril-mesinde, fertilizasyona alınan oositlerin ikiye bölünme aşamasına ulaşmaları kriter alınmıştır. Kültür periyodu sonunda fertilizasyon oranları PMSG uygulanan grupta % 44.83 (13/29), FSH uygulanan grupta ise %52.38 (33/63) bulunmuştur. Farkların istatistiki açı-dan önemli olmamasına rağmen kantitatif farklılık tavşanlarda süperovulasyon oluşturmak için FSH kullanımını desteklemektedir (p>0.05). Ancak, tavşanlarda FSH ile daha etkili süperovulasyonun uygulanabilmesine rağmen, daha ucuz oluşu ve uygulama kolay-lığı gibi avantajlarından dolayı PMSG’nin de tercih edilebileceği kanısına varılmıştır.
Anahtar sözcükler: In vitro fertilizasyon , oosit, süperovulasyon, tavşan..
Effect of different superovulator agents on the oocyte quality and in vitro fertilization in rabbits
Summary: The aim of this study was to investigate the effect of two different superovulator agents on oocyte quality, quantity and in vitro fertilization of rabbits. In this study 16 female and 2 male New Zealand White rabbits were used. A group of female rabbits (n=8) was intramusculary injected with 75 IU PMSG 3 times with 24 hours intervals. Another group of female rabbits (n=8) was injected (intramuscular) with 7.5 IU FSH twice daily during three consecutive days. Twentyfour hours after the last hor-mon injection both groups of animals ovulation was induced by an intravenous injection of 100 IU hCG. Fifteen hours after hCG injection, oocytes were collected by flushing the oviducts. A total of 34 oocytes were obtained from PMSG applied group and 77 oocytes were collected from FSH applied group. Difference between groups for oocyte number was found significant (p<0.01). In the PMSG applied group the percentage of degenerated oocytes was 14.71 % (5/34), and in the FSH applied group it was 18.18 % (14/77). The difference between groups for degenerated oocytes was not statistically significant (p>0.05). Detection of embryos reaching to 2-cell stage was approved as criterion for the assesment of in vitro fertilization of oocytes. At the end of the culture period, the fertilization rates were 44.83 % (13/29) for superovulated group with PMSG and 52.38 % (33/63) for superovulated group with FSH. Although differences were not statistically significant (p>0.05), numerical differences supported the use of FSH to superovulation in rabbits. It was concluded that although more efficient superovulation in rabbits may be obtained by FSH, PMSG can be used due to advantages like lower cost and easier handling.
Key words: In vitro fertilization, oocyte, superovulation, rabbit.
Giriş
Tavşanların (Oryctolagus cuniculus) seksüel aktivi-telerinde bir ritim olmasına rağmen düzenli östrus siklusu göstermezler. Ovarial aktivite yazdan kış mevsimine geçiş dönemi dışında tüm üreme sezonu boyunca devam etmektedir. Provake ovulasyon görülen tavşanlarda ovulasyon çiftleşmeden, LH (Luteinizing Hormon) ve hCG (Human Chorionic Hormon) enjeksiyonlarından,
dişinin fiziksel ya da erkek hayvanla mekanik uyarımın-dan 10-13 saat sonra oluşur (8, 9).
Multifollikülasyon ve süperovulasyonun temel amacı belirlenen bir zamanda bir hayvandan elde edilen kullanılabilir oosit ya da embriyoların sayısını artırmak olarak belirtilmektedir (7). Reprodüktif biyoteknolojik uygulamalardan birçoğunun ilk aşaması hayvanların süperovulasyona sevkedilmesi ile başlar. Ovum pick up
(OPU), in vitro embriyo üretimi (IVEP), intrauterin to-humlama (IUI), gamet intrafallopian transfer (GIFT), oosit ya da IVE embriyolarının dondurulması, embriyo transferi, gamet fizyolojisinin araştırılması veya sexing çalışmaları, pronuklear DNA mikroenjeksiyonu, intra sitoplazmik sperm injection (ICSI) gibi gamet maniplasyonları için ihtiyaç duyulan çok sayıda oosit ya da embriyolar süperovulasyonun başarılmasıyla gerçek-leştirilebilmektedir (1, 24). Bu amaçla eksojen gonado-ropinler birçok laboratuvar hayvanı ile evcil hayvanlarda ovulasyonun uyarılmasında başarıyla kullanılmaktadır. Multifollikülasyon ve süperovulasyonu sağlamak ama-cıyla hipofiz kökenli gonadotropinler FSH (Follicle Stimulating Hormone), LH (Luteinizing Hormone) ve HMG (Human Menopausal Gonadotropin), plasental kökenli gonadotropinler PMSG (Pregnant Mare Serum Gonadotrophin) ve hCG (Human Chorionic Gonadotro-in), pituitar extrat ve GnRH (Gonadotrophin Releasing Hormone) preparatları ile Clomiphene citrate, Difenile-ilen türevleri gibi bazı sentetik preparatlar kullanılmakta-dır (15, 20, 30). Treloar ve ark. (26), süperovulasyon uygulanmış dişilerden elde edilen embriyo sayısının bireyler arasında değişiklik gösterdiğini belirtmişlerdir. Araştırıcılar kullanılan hormonun tipi ve dozuna bağlı olarak bireysel cevabın farklı olması yanında, çiftleşme sırasında tavşanın oviductundaki mevcut mature ovum sayısı ve çiftleşme zamanı ile kullanılan sperma kalitesi-nin fertilize ovum sayısını etkilediğini kaydetmişlerdir.
Ayrıca tekrarlanan süperovulasyon uygulamalarına karşı şekillenen antikorlara bağlı olarak verilen yanıt azalabilir. Antikor üretiminin azaltılması gonadotropin uygulamalarının aralığını uzatarak ya da hormon uygu-laması yapılacak olan aynı türden derive edilen gonadotropinlerin kullanılması ile minimize edilebilir (7).
Hayvan başına daha fazla sayıda embriyo elde et-mede FSH’nın PMSG’ye göre daha iyi sonuç verdiği kaydedilmiştir (25). Süperovulasyonu indüklemek için FSH yarılanma ömrünün kısa oluşu ve cevap vermesi gibi kimi belirli avantajlara sahip olması nedeniyle çoğu embriyo transfer merkezinde tercih edilmektedir. PMSG süperovulasyonun uyarılmasında daha zayıf yanıt oluş-turması ile bireysel cevaptaki çeşitlilik dezavantajı ya-nında, daha ucuz ve kolay temin edilebilir olması nede-niyle potansiyel bir kaynak olarak kabul edilir (21, 23). PMSG yüksek molekül ağırlıkta ve yarılanma ömrü diğer gonadotropinlere oranla daha uzun olan bir glikoprotein-ir. PMSG’de yarılanma ömrü 26 saat, hipofiz kökenli FSH’da ise 2-4 saat olarak belirtilmiştir (2). Aynı za-manda PMSG’nin residüel etkisine bağlı olarak ovulas-ondan sonra ovaryumlarda folliküller gözlenmektedir. Ovule olmamış bu follikülerden salgılanan yüksek doz-daki östrojen sekresyonu PMSG uygulanmış tavşan uterusundan embriyo ve oosit toplanmasını kısıtlamakta-dır (23). FSH ile süperovulasyon uygulamaları sonunda
GnRH'ya kıyasla embriyo sayısında 2-3 kat artış olmakla birlikte kromozomal, morfolojik anomalilerin artışıyla embriyo canlılığı ve kalitesinde düşmeler gözlenmektedir (3). Ratlarda süperovulasyonun uyarılmasında PMSG ile FSH 'yı karşılaştıran Popova ve ark. (22) zigot sayısı, in
vitro blastosist gelişimi ve yavru doğumları açısından
arada önemli bir fark bulmadıklarını belirtmişlerdir. Bu çalışmada, süperovulasyon uygulamalarında kullanılan iki farklı süperovulatör ajanın (PMSG ve FSH) tavşanlardan oosit elde edilmesi ve toplanan oositlerin kantite ve kalitesi ile in vitro fertilizasyonu üzerine olası etkilerinin araştırılması amaçlanmıştır.
Materyal ve Metot
Deney materyalinin seçimi ve bakımı
Çalışmada en az bir kez doğum yapmış16 dişi, 10-12 aylık 2 adet erkek Beyaz Yeni Zelanda ırkı olmak üzere toplam 18 sağlıklı tavşan kullanılmıştır. Tüm dişi tavşanlar deneylerde kullanılmadan 21 gün önce yalancı gebeliğin önlenmesi amacıyla bireysel kafeslere alınmış-tır .
Multifollikülasyon ve süperovulasyonun oluşturulması Süperovulasyonu sağlamak amacıyla bir grup dişi tavşana (n=8) 24 saat arayla 3 gün süreyle 75 IU PMSG (Pregnant Mare Serum Gonadotophin, Folligon, 1000 IU/ flakon, İntervet), diğer bir gruba (n=8) ise 7.5 İÜ FSH (Metrodin, Urofollitrophin, 75, Serono) günde 2 kez 3 gün süreyle kas içi yolla uygulanmıştır. Son hormon uygulamasından 24 saat sonra ovulasyonu indüklemek için her iki gruba 100 IU hCG (Pregnyl ampül, 500 IÜ / ml, Organon) damar içi yolla uygulanmıştır. Bu çalışma-da, tavşanlarda süperovulasyon oluşturmak amacıyla süperovulatör ajanların optimum dozları seçilmiş ve kullanılmıştır.
Oositlerin toplanması ve değerlendirilmesi
HCG uygulamasından 15 saat sonra genel anestezi altında laparatomi uygulanıp dişi tavşanların her iki oviduktları, 3 mg/ml Bovine Serum Albumin (BSA, Fraksiyon V, A-9418, Sigma) içeren Dulbecco’s Phosphate Buffered Saline (PBS D- 5773, Sigma) ile yıkanmıştır. Yıkama sonu toplanan oositler stereo mik-roskopta incelenerek değerlendirilmiş, kompakt yapı, expanse kumulus hücreleri ve homojen ooplazmaya sahip olanlar değerlendirilerek modifiye defined mediumla (mDM) iki kez yıkanmıştır.
Spermanın hazırlanması
Erkek tavşanlardan sun'i vajen ile sperma alındıktan sonra jel kısım uzaklaştırılmıştır. Motil spermato-oonların seçilmesi amacıyla spermaya swim-up yöntemi uygulanmıştır. Spermatozooa kapasitasyonu ve final konsantrasyonu, fertilizasyon ortamında 105 spermatozoa
(sp) olacak şekilde 20 µg/ml dozda heparin içeren mDM ile sulandırılarak 380C, % 5 CO
2’li inkübatörde 15
In vitro fertilizasyon ve kültür periyodu
Dişi gametlerinin fertilizasyonu amacıyla mDM kullanılmıştır. Fertilizasyon mediumundan 95 µl'lik mikrodamlalar hazırlanarak üzeri mineral yağ ile
kap-lanmış, % 5 CO2’li inkubatörde bekletilmiştir. Oositler
fertilizasyon ortamına alınmadan önce iki kez aynı medima yıkanmıştır. Her bir mikrodamla içerisine 10 adet oosit konulup üzerine final yoğunluğu 105 sp olacak
şekilde 5 µl sperma ilave edilmiştir. Oositler ile
spermatozoa 380 C’ de % 5 CO
2 ve % 95 nem içeren
ortamda 5 saat inkübe edilmiştir. Bu sürenin sonunda fertilizasyon mediumundan alınan oositler Ham’s F 10 kültür mediumuna aktarılarak 18-21 saat kültür edilmiş-tir.
In vitro fertilizasyonun değerlendirilmesi
Kültür süresinin tamamlanmasından sonra gametle-rin bulunduğu petri kutuları stereo (invert) mikroskopta incelenerek fertilizasyon yönünden değerlendirilmiştir. Dışarıya alınan oositlerdeki gelişim durumları, blastomerlerin homojenliği, büyüklükleri, sitoplazmala-rının görünüşleri ve dejeneratif değişiklikler dikkate alınarak kontrolleri yapılmıştır. Normal bölünmelerin gözlendiği ve eşit büyüklükte blastomerlere sahip en az iki hücreli basamağa ulaşmış olan ovumlarda fertilizasyonun gerçekleştiği kabul edilmiştir (1).
Çalışmada süperovulatör ajanlarının toplanan oosit-lerin kantitesine olan etkisinin belirlenmesinde Mann-Whitney U test, ovulasyon oranları, fertilizasyon öncesi ve sonrasında oosit kalitesi ile fertilizasyon oranlarına olan etkisinin belirlenmesinde ise ki-kare testinden yarar-lanılmıştır.
Bulgular
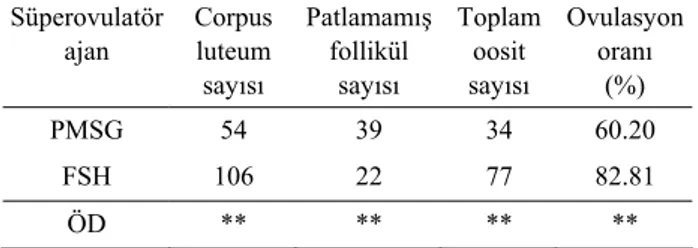
Süperovulasyon uygulamaları sonunda FSH uygu-lanan grupta ovaryumlarda hayvan başına ortalama 2.75±0.10 patlamamış follikül, 13.25±2.17 corpus luteum sayılmış olup toplam 9.63±1.08 oosit toplanmıştır. Ovulasyon oranı % 82.81 olarak saptanmıştır. PMSG uygulanan grupta ise ovaryumlarda hayvan başına orta-lama 4.88±0.44 patorta-lamamış follikül, 7.38±2.08 corpus luteum sayılmış olup toplam 4.25±1.03 oosit elde edil-miştir. Ovulasyon oranı % 60.20 olarak saptanmıştır. Toplam corpus luteum sayısı PMSG ile 54 olurken, FSH ile 106 olarak kaydedilmiştir. FSH ve PMSG uygulama-ları sonrası elde edilen bulgular arasındaki farklar önemli bulunmuştur (p<0.01) (Tablo 1).
FSH uygulanan grupta ovidukt yıkamasıyla topla-nan 77 oositten dejenere ve granüllü sitoplazmaya sahip olan 14 oosit (%18.18) fertilizasyona alınmamıştır. PMSG uygulanan grupta ise toplam 34 oositten 5'inde (%14.70) dejenerasyonların gözlenmesi sebebiyle fertilizasyona alınmamıştır. Dejenere oosit oranları ara-sındaki bu fark istatistiki açıdan önemli bulunmamıştır (p>0.05).
Tablo 1. Farklı süperovulasyon uygulamaları sonrası ovaryum reaksiyonları.
Table 1. Ovarial reactions after different superovulation applications. Süperovulatör ajan Corpus luteum sayısı Patlamamış follikül sayısı Toplam oosit sayısı Ovulasyon oranı (%) PMSG 54 39 34 60.20 FSH 106 22 77 82.81 ÖD ** ** ** ** n : 8 Ö.D.: Önemlilik derecesi
** : (p<0.01) Gruplar arasındaki fark önemlidir.
Ancak FSH ve PMSG ile superovulasyona sevkedilen tavşanlardan elde edilen oositler kompakt yapı, homojen ooplazma, düzenli kumulus dikkate alına-rak değerlendirilmiş ve FSH grubunda 77 oositden 63 tanesi, PMSG grubunda 34 oositden 29 tanesi in vitro fertilizasyona alınmıştır. Elde edilen sağlıklı oosit sayıla-rı arasındaki farklılıklar önemli bulunmuştur (p<0.01). FSH uygulanan grupta in vitro kültür periyodu sonunda ikiye bölünme oranı % 52.38 (33/63), PMSG uygulanan grupta ise % 44.83 (13/29) olarak saptanmıştır. Bölünme oranları ile dejenere oosit sayıları açısından aradaki bu farkın istatistiki açıdan önemli olmadığı saptanmıştır (p>0.05). İn vitro kültür periyodu sonrası değerlendirme-ler Tablo 2'de gösterilmiştir.
Tablo 2. Tavşan oositlerinin in vitro fertilizasyon ve kültür sonrası bulguları.
Table 2. Findings after in vitro fertilization and culture of rabbit oocytes. Süperovulatör ajan Seçilen oosit sayısı Bölünen oosit sayısı (%) Dejenere oosit sayısı (%) PMSG 29 13 (44.83) 5 (14.71) FSH 63 33 (52.38) 14 (18.18) ÖD ** - - n : 8 Ö.D.: Önemlilik derecesi
** : (p<0.01) Gruplar arasındaki fark önemlidir. - : (p>0.05) Gruplar arasındaki fark önemsizdir.
Tartışma ve Sonuç
FSH veya eCG ile LH’nın kombinasyonları tavşan superovulasyonunda sıklıkla kullanılmaktadır. Ancak FSH ve eCG’nin tavşanlara uygulama dozu ve süresi süperovulasyonun başarısını etkileyen en önemli faktör-lerden biridir. ECG her hayvan için 50-100 IU 1-3 doz arasında verilebilirken, FSH 0.155-0.5 mg 12 saatte bir ve 6-8 doz enjeksiyonu yeterli olmaktadır. Ayrıca FSH ve hCG’nin tekrarlanan uygulamaları hemorojik ve kistik
folliküllerin artmasına, ovule olan follikül sayısının azalmasına neden olduğu gibi, in vivo spermatozoa kapasitasyonunda aksamalara ve kromozom anomalileri-ne yol açmaktadır. Ancak süperovulasyona sevkedildiğinde donör tavşandan maksimum sayıda canlı ve yapısal olarak sağlam embriyolar elde edilmesi çalış-maların başarısı ve etkinliği için gerekmektedir. Bu ne-denle araştırmalar maksimum ovulasyon yanıtı ve mak-simum embriyo eldesine yönelik olarak, süperovulasyon için optimal hormon dozlarının, kombinasyonlarının ve etkilerinin saptanmasına odaklanmıştır (27).
Çalışmada PMSG uygulanan hayvanlarda sayılan tavşan başına düşen ortalama CL sayısı (7.38±2.08) Taneja ve ark.'nın (23) belirttiği 13.00±1.48, Pabuççu-oğlu ve İleri'nin (18) söylediği 15.50±3.59 ve KılıçPabuççu-oğlu ve Tekeli'nin (13) ifade ettiği 19±1 değerinden düşük bulunmuştur. Bu durum PMSG'nin dozuna bağlı olarak süperovulasyon uygulanan hayvanlarda ovaryum reaksi-yonlarının çeşitlilik gösterebileceği bir başka değişle tavşanların PMSG’ye karşı bireysel yanıtlarının farklı olabileceği görüşüne bağlanmıştır (23). FSH uygulanan grupta da elde edilen CL sayısı (13.25±2.17) benzer şekilde Fischer ve Meuser-Odenkirchen' in (6) elde ettiği 30, Kennely ve Foote 'nin (12) belirttiği 53.7 ve Cheng ve ark 'nın (4) ifade ettiği 28±3.2 değerinden düşük bu-lunmuştur. Bu durumda yukarıda açıklanan bireysel farklılığa bağlı olarak meydana gelmiş olabilir.
Çalışmadaki PMSG uygulanarak elde edilen ovulasyon oranları Usta ve İleri'nin (28) % 79.78 değe-rinden düşük, Pabuççuoğlu ve ark.'nın (19) % 52.09 ile Pabuççuoğlu ve İleri'nin (18) % 54.57 değerinden daha yüksek bulunmuştur. Bu çalışmada FSH ile elde edilen ovulasyon oranı istatistiki açıdan PMSG'den önemli ölçüde yüksek kaydedilmiştir (p<0.01). Munoz ve ark. (16), farelerde FSH (%64.26) ile PMSG'ye (%33.85) göre daha iyi ovulasyon yüzdesi elde etmişler ve elde edilen bu veriler çalışmada ulaşılan sonuçlara paralellik göstermektedir. Değişik araştırıcıların aynı ırktan (4, 26) veya ayrı ırktan (12, 14) tavşanlarda, farklı laboratuvar, çalışma koşullarında ve değişik tekniklerle (5, 11) ve farklı amaçlarla (10, 27) yaptıkları araştırmalarda doğal olarak farklılıklar gözlenmiştir.
Bu araştırmada, PMSG ile süperovulasyona sevkedilen grupta hayvan başına ortalama 4.25±1.03, FSH uygulanan grupta ise 9.63±1.08 adet oosit toplan-mıştır. PMSG kullanan Pabuççuoğlu ve İleri (18), 14.3±43.76 embriyo, Usta ve İleri (28) hayvan başına 19.7 embriyo, Özkoca ve ark. (17) ise 5.5±5.80 embriyo toplamışlardır. FSH uygulamalarını takiben Fischer ve Meuser-Odenkirchen (7) hayvan başına 22.7 embryo, Kennely ve Foote (12) 39.8, Treolar ve ark. (26) 37, Al-Hasani ve ark (1) ise 33 oosit , Techakumphu ve ark (24) 19.1 oosit toplamışlardır. Bu değerlerin sunulan çalışma-nınkinden daha yüksek bulunması, belirtilen çalışmalarda
oosit yerine embriyo toplanması ve bu amaçla ovidukt yıkamalarının 24-96. saatlerde yapılmış olmasından, kullanılan gonadotropinlerin çeşidi ve dozu, enjeksiyon sayısı, ovulasyonu uyarma metodu ve donörlerin yaşı gibi çeşitli faktörlerden ileri gelmektedir. Taneja ve ark (23), PMSG uygulamasını takiben 4.17±1.44 embriyo toplamışlar ve elde edilen değer bu çalışmayla paralellik göstermiştir.
Çalışmada PMSG uygulanan grupta ovidukt yıka-ması sonrası toplanan oositler arasında kaydedilen deje-nere oosit oranı % 14,71 (5/34) olurken, FSH uygulanan grupta % 18.18 (14/77) bulunmuştur. Hormon uygulama-ları arasındaki farkın elde edilen dejenere oosit oranuygulama-ları üzerine etkisi yönüyle istatistiki açıdan önemli olmadığı saptanmıştır (p>0.05). Bu çalışmada kaydedilen dejenere oosit oranı Usta ve İleri’nin (28) PMSG uygulaması sonu % 33.50, Taneja ve ark’nın (23) ise % 52.78 olarak kay-dettiği dejenere embriyo oranından daha düşük bulun-muştur.
Belirtilen çalışmalarda PMSG uygulaması sonrası in vivo gelişen embriyolar toplanmış olup dejenere emb-riyo oranı kaydedilmiştir. Dolayısıyla değişik amaçlarla yapılan araştırmaların sonuçları arasındaki farklılıklar normal karşılanabilecek bir durumdur. Munoz ve ark (16), farelerdeki çalışmalarında FSH ile % 10.57 PMSG ile %15.11 anormal embriyo elde etmişler, Techakumphu ve ark. (24) ise, FSH uygulaması sonu toplanan oositlerin %90’dan fazlasında morfolojinin normal olduğunu bil-dirmişlerdir. Elde edilen bu veriler çalışmada ulaşılan sonuçlara benzerlik göstermektedir.
İn vitro fertilizasyonları yapılmış oositlerin in vitro kültür periyodunu takiben ikiye bölünme oranları sırasıy-la PMSG ile süperovusırasıy-lasyona sevkedilen grupta % 44.83 (13/29), FSH enjekte edilen grupta ise % 52.38 (33/63) olarak saptanmıştır. Embriyoların ikiye bölünme oranları üzerine etkileri yönüyle her iki süperovulatör ajan arada-ki farkın istatistiarada-ki açıdan önemli olmadığı (p>0.05) sonucuna varılmıştır.
FSH ile süperovulasyon uygulamaları sonrası doğal çiftleşme ile şekillenen in vivo fertilizasyon oranlarını Fischer ve Meuser-Odenkirchen (6), % 88, Kennely ve Foote (12), % 66, Treloar ve ark. (26), % 72.26, Cheng ve ark (4) ise % 56.25 olarak belirtmişlerdir. PMSG ile süperovulasyona sevkedilen tavşanlarda Usta ve İleri (28) % 97.97, Pabuççuoğlu ve İleri (18) % 84.84, Kılıçoğlu ve Tekeli’nin (13) % 96.3 olarak kaydettikleri in vivo fertilizasyon oranlarının da bu çalışma ile ulaşılan değerlerden çok daha yüksek bulunması, sözü geçen araştırmalarda in vivo fertilizasyondan sonra yine in vivo gelişen embriyoların toplanıp in vitro kültüre alınması ve böylece dişi gametinin daha kısa süre in vitro ortama maruz kalması ile açıklanabilir. Oysa bu çalışmada mature olmuş oositlerin toplandıktan sonra fertilizasyon-larının in vitro yapılması söz konusudur ve bu durum sonuçları etkilemiş olabilir. Benzer çalışmalarında Uysal
ve ark. (29) tavşanlarda süperovulasyon oluşturmak ama-cıyla bir günde 8 saat arayla enjekte ettikleri 0.3 IU FSH ile, diğer uygulamalara oranla önemli ölçüde yüksek sayıda tek hücreli embriyo elde etmelerine rağmen, in
vitro kültüre bırakılan bu embriyoların morula/blastosiste
ulaşma oranlarını tam tersine önemli ölçüde düşük bul-muşlardır (p<0.01). Çoklu FSH enjeksiyonu ile elde edilen embriyoların kimilerinde morfolojik deformasyon-lar gözlendiğini ya da kimilerinde in vivo fertilizasyonun gerçekleşmemiş olabileceğini ifade etmişlerdir.
Sonuç olarak, oositlerin in vitro fertilizasyona alın-maları ve kültürleri sonunda her iki superovulatör ajan ile benzer fertilizasyon ve bölünme oranları elde edildiği halde, FSH ile daha etkili süperovulasyon sağlandığı ve daha çok oosit toplandığı gözlenmiştir. Ancak, tavşanlar-da süperovulasyon uygulamalarıntavşanlar-da tavşanlar-daha ucuz oluşu ve maniplasyon kolaylığı nedeniyle PMSG’nin de tercih edilebileceği kanısına varılmıştır.
Kaynaklar
1. Al-Hasani S, Trotnow CS, Hahn, J (1986): In vitro
fertilization and embryo transfer of pre- ovulatory rabbit oocytes. Eur J Obstet Gynecol Reprod Biol, 21, 187-195.
2. Apparially F, Cadoret V, Lecompte F (1994): Structure
function relation ships and mechanism of action of pitui-tary and placental gonadotrophins. Reprod Fertil Dev, 6,
157-163.
3. Carney EW, Foote RH (1990): Effects of superovulation,
embryo recovery, culture system and embryo transfer on development of rabbit embryos in vivo and in vitro. J
Re-prod Fertil, 89, 543-51.
4. Cheng H, Dooley MP, Hopkins SM, Anderson LL, Yibchok-anun S, Hsu WH (1999): Development of rabbit
embryos during a 96-h period of in vitro culture after su-perovulatory treatment under conditions of elevated ambi-ent temperature. Anim Reprod Sci, 56, 279-290.
5. Chrenek P, Makarevich A, Vasicek D, Laurincik J, Bulla J, Gajarska T, Rafay J (1998): Effects of
superovulation, culture and microinjection on development of rabbit embryos in vitro. Theriogenology, 50, 659-66.
6. Fischer B, Meuser-Odenkirchen G (1988): A 2 year
follow-up of biotechniques on reproduction in the domestic rabbit, Oryctolagus cuniculus. Lab Anim, 22, 5-15.
7. Hafez ESE (1993): Assisted reproductive technology:
ovulation manipulation, 461-502. In: B Hafez and ESE
Hafez (Ed), In Vitro Fertilization/Embryo Transfer, Re-production in Farm Animals. 6th Ed. Lea & Febiger, Philadelphia.
8. Hafez ESE (1970): Rabbits. 273. In: ESE Hafez (Ed), Reproduction and Breeding Techniques for Laboratory Animals. Lea & Febiger, Philadelphia.
9. Harkness JE, Wagner JE (1989): The Biology and
Medi-cine of Rabbits and Rodents. Lea & Febiger, Philadelphia,
London.
10. Hashimoto S, Kuramochi T, Aoyagi K, Takahashi R, Ueda M, Hirao M, Kamei M, Kitada K, Hirasawa K (2004): Refined porcine follicle stimulating hormone
pro-motes the responsiveness of rabbits to multiple-ovulation treatment. Exp Anim, 53, 395-397.
11. Kauffman RD, Schmidt PM, Rall WF, Hoeg JM (1998): Superovulation of rabbits with FSH alters in vivo development of vitrified morulae. Theriogenology, 50, 1081-92.
12. Kennely JJ, Foote RH (1965): Superovulatory response
of pre- and post pubertal rabbits to commercially available gonadotrophins. J Reprod Fertil, 9, 177-188.
13. Kılıçoğlu Ç, Tekeli T (1981). Tavşanlarda embryo
trans-feri. Ankara Üniv Vet Fak Derg, 28, 1-4.
14. Maurer RR, Hunt WL, Foote RH (1968): Repeated
superovulation following administration of exogenous gonadotrophins in dutch-belted rabbit. J Reprod Fertil, 15,
93–102.
15. Mcdonald LE (1980): The pituitary gland. In: In: LE Mc Donald (Ed),Veterinary Endocrinology and Reproduction, Lea & Febiger, Philadelphia.
16. Munoz I, del Nino Jesus A, Josa A, Espinosa E, Gil I (1995): Use of follicle stimulating hormone (FSH) to
in-crease the in vitro fertilization (IVF) efficiency of mice. J
Assist Reprod Genet, 12, 738-43
17. Özkoca A, İleri İK, Sayın T (1984): Tavşanlarda ovidukt yıkaması yöntemiyle embryo kazanımı ve transplantasyon üzerinde araştırmalar. İstanbul Üniv Vet Fak Derg, 10, 1-15.
18. Pabuççuoğlu S, İleri İK (1994): PMSG’nin iki farklı
uygulaması ile kazanılan tavşan embryolarının değişik va-satlarda in vitro kültürleri ve transferleri. Turk J Vet Anim
Sci, 18, 53-48.
19. Pabuççuoğlu S, Usta S, İleri İK (1994): Tavşan
em-bryolarının in vivo gelişim safhaları kazanıldıkları yerler.
İstanbul Üniv Vet Fak Derg 20, 123-130.
20. Pineda MH, Bowen RA (1980): Embryo transfer in
do-mestic animals. In: LE Mc Donald (Ed), Veterinary
Endo-crinology and Reproduction, Lea & Febiger, Philadelphia. 21. Pintado B, Gutierrez- Adan A, Perez Llano B (1998):
Superovulatory response of Murciana goats to treatments based on PMSG/ Anti-PMSG or combined FSH/PMSG administration. Theriogenology, 50, 357-64
22. Popova E, Krivokharchenko A, Ganten D, Bader M (2002): Comparison between PMSG- and FSH- induced
superovulation for the generation of transgenic rats. Mol
Reprod Dev, 63, 177-82
23. Taneja M, Pareek PK, Jatkar PR (1990):
Superovula-tion and embryo recovery in rabbits (Oryctolagus cunicu-lus) using different doses of pregnant mare serum gonad-otrophin (PMSG). Indian J Exp Biol, 28, 1031-1033.
24. Techakumphu M, Numchaisrika P, Suktrakun V, Pha-nitkitcharoen S, Kaewnanuer A, Suwajanakorn S (2002): Superovulation responses in rabbits to different
doses of follicle stimulating hormone. Thai J Vet Med, 32,
53-58.
25. Techakumphu M (1986): Superovulation in rabbits. Thai J Vet Med, 16, 272-285.
26. Treloar AF, Schabdach, DG, Sansing S, Keller LS (1997): Superovulation of New Zealand White Rabbits by
continuous infusion of follicle- stimulating hormone, using a micro- osmotic pump. Lab Anim Sci, 47, 313-316.
27. Tsiligianni T, Saratsi A, Besenfekder U, Anastasiadis A, Vainas E, Saratsis P, Brem G (2004): The use of
cytological examination of vaginal smears CEVS) in the selection of rabbits for superovulation. Theriogenology,
28. Usta S, İleri İK (1994): Superovulatör ajanların tavşan
embryolarının nitelik ve niceliklerine etkisi. Turk J Vet
Anim Sci, 8, 175-180.
29. Uysal O, Demiral O, Yıldız S (2003): Effect of
superovu-laion on in vitro embryo culture in rabbit. Indian Vet J, 80,
1113-1115.
30. Yoshimura Y, Hosoi Y, Atlas, SJ (1988): Effect of the
exposure of intro follicular oocytes to clomiphene citrate on prefnancy outcome in the rabbits. Fertil Steril, 50,
153-158.
Geliş tarihi : 01.03.2005 / Kabul tarihi: 07.04.2005
Yazışma adresi:
Prof. Dr. Necmettin Tekin
Ankara Üniversitesi Veteriner fakültesi Dölerme ve Sun‘i Tohumlama Anabilim Dalı 06110 Dışkapı/Ankara