T.C.
EGE ÜNĠVERSĠTESĠ
TIP FAKÜLTESĠ
AMNĠYOTĠK MEMBRAN ĠLE YAPILAN YENĠ
MĠKROVASKÜLER ANASTOMOZ MODELĠ
Dr. Burak Sercan ERÇĠN
PLASTĠK, REKONSTRÜKTĠF VE ESTETĠK CERRAHĠ ANABĠLĠM
DALI
UZMANLIK TEZĠ
Tez Yöneticisi: Prof. Dr. Tahir GÜRLER
T.C.
EGE ÜNĠVERSĠTESĠ
TIP FAKÜLTESĠ
AMNĠYOTĠK MEMBRAN ĠLE YAPILAN YENĠ
MĠKROVASKÜLER ANASTOMOZ MODELĠ
Dr. Burak Sercan ERÇĠN
PLASTĠK, REKONSTRÜKTĠF VE ESTETĠK CERRAHĠ ANABĠLĠM
DALI
UZMANLIK TEZĠ
Tez Yöneticisi: Prof. Dr. Tahir GÜRLER
i
ÖNSÖZ
Uzmanlık eğitimim boyunca benden desteğini esirgemeyen, sadece bir hoca olarak değil, adeta aileden bir büyüğüm gibi gördüğüm, bir güven kaynağı olarak her zaman arkamda olan, tez sürecimde yardımlarıyla bu ürünün ortaya çıkmasında destek olan sayın tez hocam Prof. Dr. Tahir GÜRLER’e,
Bir plastik cerrah olarak yetiĢmemde bilgi, tecrübe ve vizyonlarıyla bana her zaman yol gösteren sayın hocalarım Prof. Dr. Yalçın AKIN, Prof. Dr. Ecmel
SONGÜR, Prof. Dr. Cüneyt ÖZEK, Prof. Dr. Ufuk BĠLKAY, Prof. Dr. Yiğit Özer TĠFTĠKÇĠOĞLU’na
Bana bir asistandan ziyade kardeĢi gibi davranan, sabır gösteren, vakalarda desteğini her zaman hissettiren sayın uzman ağabeyim Op. Dr. Ahmet BĠÇER‟e,
Tez çalıĢmamda benden maddi ve manevi yardımlarını esirgemeyen ve her türlü desteği veren sayın Doç. Dr. Yiğit UYANIKGĠL‟e, Uz. Dr. Türker
ÇAVUġOĞLU‟na, AraĢtırma Görevlisi Gürkan YĠĞĠTTÜRK, Uzm. Dr. Celal ÇINAR, Uzm. Dr. Halil BOZKAYA ve Dr. Mehmet GÜRDAL‟a
Tezim sırasında maddi ve manevi yardımlarını esirgemeyen sayın Op. Dr.
Elcil Kaya Biçer’e
Deney aĢamasında bana büyük destek sağlayan sayın Vet. Tek. Özge SARI ve Hasan SAYAN‟a,
Birlikte çalıĢmaktan büyük zevk duyduğum asistan ağabeylerim ve kardeĢlerim Dr. Candan MEZĠLĠ, Dr. Hakan TEYMUR, Dr. Mircafer
SEYĠDOV, Dr. Ersin GÜR, Dr. Çağıl Meriç ERENOĞLU, Dr. ġenol DURUKAN, Dr. Mehmet Emre YEĞĠN, Dr. Mehmet ERDEM, Dr. Yakup IġIK, Dr. Orhan Fahri DEMĠR’e
Mesaide ve nöbette sırt sırta vererek yoldaĢlık ettiğimiz emekli ve aktif çalıĢan tüm klinik hemĢirelerimize,
Her türlü kahrımı çeken kliniğin görünmeyen kahramanları tüm diğer
ii Eğitimimin bir döneminde yanlarında çalıĢarak bilgi ve görgümü artırma fırsatı bulduğum çok değerli Prof. Dr. Pedro C. CAVADAS, Doç. Dr. Deniz
DAYICIOĞLU, Prof. Dr. Paul SMITH, ve Op. Dr. Alessandro THIONE’ ye
Bu güne gelmemi sağlayan, her zaman yanımda olan sevgili annem Gönül
ERÇĠN, babam Yüksel ERÇĠN ve kardeĢim Mustafa Erkin ERÇĠN’e,
Zorlu asistanlık sürecimde bana her zaman destek ve yoldaĢ olan, sevgisiyle, yardımlarıyla ve sabrıyla bu tezi bitirmemi sağlayan sevgili eĢim ve oğlumun annesi
Fatma ERÇĠN’e,
Zorlu tez döneminde varlığıyla motivasyon kaynağım olan biricik oğlum
Toprak Arslan ERÇĠN‟e
iii
ĠÇĠNDEKĠLER TABLOSU
ÖZET ... vii
2. GĠRĠġ VE AMAÇ ... 10
3. GENEL BĠLGĠLER ... 3
3.1 Arter ve Venlerin Histolojisi ... 3
3.1.1 Damar Duvarının Tabakaları... 3
3.1.2 Damar Endoteli ... 4
3.1.3 Arterler ... 5
3.2 Amniyotik Membran Histolojisi ve Fizyolojisi ... 10
3.3 Biyokimyasal Markırlar ... 14
3.3.1 Endotelyal Nitrit Oksit Sentaz (E-NOS) ... 14
3.3.2 Vasküler endotelyal büyüme faktörü (VEGF) ... 17
3.4 Mikrovasküler Anastomoz Modelleri ... 19
3.4.1 Standart Damar Anatomozu ... 20
3.4.2 DeğiĢik dikiĢ teknikleriyle yapılan anastomozlar: ... 20
3.5 Sıçanda Deneysel Femoral Arter ve Ven Modeli ... 30
4. GEREÇ ve YÖNTEM ... 32
4.1 Etik Kurul Onayı ... 32
4.2 Deney Hayvanları ve Deneyin Yapıldığı Ortam ... 32
4.3 Kullanılan Araç-Gereç ve Ġlaçlar ... 32
4.4. Deney Grupları ... 36
4.4.1. Deney (Amniyon zarı) Grubu (n=11) ... 36
4.4.2. Kontrol Grubu ... 38
4.5 Doku Takibi, Gömme ve bloklama ... 40
Kesit Alma ... 41
5. BULGULAR ... 44
5.1. Süre Değerlendirilmesi: ... 44
5.2 Damar Patens Oranları ... 45
5.3 Histopatolojik Değerlendirme ... 46
5.4 Radyolojik Değerlendirme ... 53
iv
7. SONUÇ ... 63 8. KAYNAKLAR ... 64
v
ġEKĠLLER TABLOSU
ġekil 1 Damar Katmanları ... 3
ġekil 2 Damar kesit yüzeyinde endotel tabakasının illüstrasyonu ... 4
ġekil 3 Elastik arterin (aort) histolojik kesit görünümü ... 6
ġekil 4 Elastik arter ve Müsküler arter histolojik farkları ... 7
ġekil 5 Musküler arterin histolojik kesit görünümü. ... 8
ġekil 6 Küçük arterin (arteriyol) histolojik kesit görüntüsü. ... 9
ġekil 7 Amniyotik Membran Histolojik Tabakaları... 10
ġekil 8 Amniyotik membran makroskobik görüntüsü ... 10
ġekil 9 Amniyotik membranın histolojik görünümü ... 11
ġekil 10 NOS anjiogenezis aktivitesi ... 15
ġekil 11 NO aktivite Ģeması ... 17
ġekil 12 Kontinü DikiĢ Tekniğiyle Damar Anastomozu ... 21
ġekil 13 Matris DikiĢ Tekniğiyle Damar Anastomozu ... 22
ġekil 14 Open Loop Tekniğiyle Damar Anastomozu ... 23
ġekil 15 Back-wall first Damar Anastomozu ... 24
ġekil 16 Üçgen Damar Anastomozu ... 24
ġekil 17 Teleskop Damar Anastomozu ... 25
ġekil 18 Damar Coupler cihazı ... 28
ġekil 19 Sıçan Femoral Bölge Anatomisi ... 31
ġekil 20 Deneyde Kullanılan Cerrahi Aletler ... 35
ġekil 21 Mikrocerrahi aletler ... 35
ġekil 22 Sol femoral bölgenin traĢlandıktan sonraki görüntüsü. ... 36
ġekil 23 0-120 ve 240 derece noktalarına 10-0 etilon dikiĢ konuldu. ... 37
ġekil 24 Femoral arterin etrafına amniyon zarı rulo Ģeklinde sarıldı. ... 37
ġekil 25 Amniyotik membran sarıldıktan sonra 30.dk görüntüsü... 38
ġekil 26 Ġnguinal bölge insizyonu 4-0 Ethilon ile çift kat dikildi ... 38
ġekil 27 Femoral arterin konvansiyonel teknikle anastomozu ... 39
ġekil 28 H&E boyaması genel görünümü.. ... 49
ġekil 29 Mallory Azan boyaması genel görünümü. ... 50
ġekil 30 Anti- eNOS boyaması . ... 51
vi ġekil 32 Image Pro Express programı ile damar duvar çaplarının ölçümü ... 52 ġekil 33 Femoral Arter damar kalınlığının istatistiksel değerlendirilmesi. ... 53 ġekil 34 KAM grubu sol taraflı anastomoz yapılmıĢ femoral arter dinamik
anjiografisi. (A‟dan D‟ye sırasıyla) ... 54 ġekil 35 ASAM grubu sol taraflı anastomoz yapılmıĢ femoral arter dinamik
vii
ÖZET
Teknolojinin de geliĢmesiyle birlikte özellikle ikinci dünya savaĢı sonrası ciddi travmalar sonrası uzuv kayıpları geliĢen tekniklerle azalmaya baĢlamıĢ ve uzuv kurtarıcı cerrahiler ön plana çıkmaya baĢlamıĢtır. Uzuv kurtarıcı cerrahilerin artması mikrocerrahi tekniklerin ilerlemesi ile paralel olarak ilerlemiĢtir.
Mikrovasküler anastomoz tekniğinin tanımlanması, mikrocerrahide en kritik cerrahi basamaklarından biri olmuĢtur. Ġlk damar anastomoz tanımı Alexis Carrel tarafından yapılmıĢtır (1). Carrel tarafından ortaya konulan prensipler doğrultusunda ilerleyen mikrocerrahi deneyimi, geliĢen teknolojiyle birlikte yeni sütür materyalleri, cihazlar ve ilaçların bulunmasıyla yeni anastomoz yöntemlerinin tanımlanmasına neden olmuĢtur. Yeni yöntemlerin araĢtırılmasındaki temel amaçlar anastomoz sonrası damar patensini en yüksek yapan, damarı normal anatomisine en uygun Ģekilde iyileĢtirici, lümende en az trombus oluĢturucu, kolay öğrenilebilir ve hızlı uygulanabilir, maliyeti en ucuz anastomozu sağlayıcı yöntemleri geliĢtirmektir.
Bütün bu amaç ıĢığında daha önce uygulanmamıĢ bir model olarak amniyotik membran kullanılan anastomoz modeli uygulandı. 11 kontrol ve 11 deney hayvanı olmak üzere toplam 22 adet Wistar-Albino cinsi sıçan kullanıldı. Anestezi altında tek taraflı femoral arterleri kesilerek amniyotik membranın az sayıda dikiĢle kombine edildiği anastomoz modeli uygulandı. Kontrol grubuna ise konvansiyonel anastomoz tekniği uygulandı. Deney sonunda yapılan modelin damarların patensi ve histolojik yapısına olan etkileri değerlendirildi.
Sonuç olarak, tüm anastomozlarda radyolojik ve makroskobik olarak patens saptandı. Hiçbir denekte tromboz veya anevrizma izlenmedi (n=0). Yapılan anjiyografik çalıĢmada kontrol ve deney gruplarında damar patensinin olduğu gözlendi. Deney grubunun anastomoz süresi istatistiksel olarak anlamlı Ģekilde daha kısa sürede tamamlanmıĢtır. Histolojik çalıĢmalarda, anti-e-NOS boyama sonucunda deney grubunun endotelinin anlamlı olarak fazla boyandığı saptandı.
Uygulanılan bu yöntem, mikrovasküler cerrahide, yeni bir anastomoz modelini tanımlamakta olup, sonuçları ek deneysel çalıĢmalar için ve kliniğe uygulanım açısından umut vaat edicidir. Ek çalıĢmalarla bu deneysel tekniğin klinik uygulamaya geçebileceği düĢünülmektedir.
viii
SUMMARY
With the development of technology, especially after second world war, limb amputations have begun to decrease with developing surgical techniques and limb salvage procedures have begun to come to the forefront. The increase in limb salvage surgeries has progressed parallel to the development of microsurgical techniques.
The identification of the microvascular anastomosis technique has been one of the most critical surgical steps of microsurgery. Microvascular anastomosis was first described by Alexis Carrel (1) The microsurgery experience advancing in the direction of the principles described by Carrel, along with the developing technology, new suture materials, devices and medicines have led to the identification of new anastomosis methods. The main goals of investigating the new methods are obtaining the highest post-anastomotic vessel patency, repairing the vessel in anatomic fashion with minimum thrombosis, inventing easy, fast and cheaper anastomose methods.
For this purpose, an anastomosis model using amniotic membrane was performed as a model that was not performed before. A total of 22 Wistar-Albino rats, 11 control and 11 experimental animals, were used in this study. Under general anesthesia, anastomosis model was applied to rat femoral artery in which amniotic membrane was combined with few stitches. Conventional anastomosis technique was performed to the control group. At the end of the experiment, the effects of the model on the patency and histological structure of the vessels were evaluated.
As a result, normal patency was determined radiologically and macroscopically in all anastomoses. No thrombosis or aneurysm was detected in any anastomoses (n:0) In the angiographic study, vessel patency was detected in control and experimental groups. The duration of the anastomosis of the experiment group was completed in a shorter period in a statistically significant manner. In histological studies, anti-e-NOS staining revealed that endothelin was significantly oversprayed in the experimental group.
This method describes a new anastomosis model in microvascular surgery and The results are promising for additional experimental studies and for implementation in the clinic. With additional studies, we believe that this experimental technique can
ix be put into clinical practice as an alternative to the conventional microvascular anastomose technique.
2. GĠRĠġ VE AMAÇ
Günümüzde yapılan araĢtırmalarda her yıl Amerika BirleĢik Devletleri‟nde 185000 amputasyon gerçekleĢmektedir (2). Bunun %45‟lik kesimi sadece travmalar nedeniyle olmaktadır (3). Teknolojinin de geliĢmesiyle birlikte özellikle ikinci dünya savaĢı sonrası ciddi travmalar sonrası uzuv kayıpları, geliĢen tekniklerle azalmaya baĢlamıĢ ve uzuv kurtarıcı cerrahiler ön plana çıkmaya baĢlamıĢtır. Uzuv kurtarıcı cerrahilerin artması mikrocerrahi tekniklerin ilerlemesi ile paralel olarak ilerlemiĢtir.
alıĢmamız temel olarak deneysel sıçan modelinde amniyotik membran yardımıyla yapılan anastomoz sonrası damarda ve damarın perfüze ettiği alanlarda oluĢan etkileri histokimyasal, immünohistokimyasal ve morfolojik parametreler kullanarak araĢtırılmasına dayanmaktadır.
Birçok alanda kullanılan ve etkisi kanıtlanan amniyotik membranın mikrovasküler anastomozda da önemli bir yardımcı materyal olabileceği hipotezini savunan çalıĢmamızda standart teknikten daha az kullanılan sütür (sadece 3 sütür) ile uç-uca getirilmiĢ olan rat femoral arteri anastomoz hattı çevresine rulo Ģeklinde amniyotik membran sarılarak anastomozun salim olarak tamamlanması planlanmaktadır. Bu teknikle yapılan anastomozlar konvansiyonel mikrovasküler anastomoz modeli ile objektif parametreler kullanılarak kıyaslanacaktır. Bu Ģekilde anastomoz aynı güvenlik ve baĢarılı Ģartlarda anastomoz süresinin oldukça hızlanarak uzuv kayıplarında iskemi süresinin oldukça kısalacağı hipotezini savunmaktayız.
Amniyotik membranın ucuz ve kolay elde edilebilmesinin yanında kanıtlanmıĢ birçok etkisi vardır. Yara iyileĢmesinde, oftalmolojide, yanık tedavisinde, sinir iyileĢmesinde birçok çalıĢmayla yararlı etkisi kanıtlanmıĢtır (4). Daha önce de az dikiĢ kullanılarak tasarlanan mikrovasküler anastomoz modelleri olmakla birlikte bu çalıĢmalarda yardımcı ürünler olarak pahalı yapıĢtırıcı materyaller kullanılmıĢtır (5).
Bu araĢtırma, amniyotik membranın mikrovasküler anastomozda kullanılması açısından bir ilk niteliğinde olacaktır. Bu çalıĢmayla birlikte ucuz, kolay temin
edilebilir ve birçok alanda faydaları kanıtlanmıĢ olan amniyotik membranın rekonstrüktif mikrocerrahide büyük bir sorunu çözmeye yönelik bir tekniğin öncü çalıĢmasının parçası olacağını düĢünmekteyiz. Bununla birlikte bu çalıĢmanın birçok yeni klinik çalıĢmanın önünü açacak nitelikte olduğunu varsaymaktayız.
3
3. GENEL BĠLGĠLER
3.1 Arter ve Venlerin Histolojisi
3.1.1 Damar Duvarının Tabakaları
Arter ve venler; tunika denilen üç ayrı tabakadan oluĢur.
ġekil 1 Damar Katmanları
(http://iws.collin.edu/cdoumen/histoccccd/labslides/histoepith_ssq.html)
Tunika intima, damarın en içte bulunan tabakasıdır. En içte tek tabaka
halinde yassı epitel hücrelerinden oluĢan endotel, hemen altında endotel hücrelerinin bazal tabakası ve gevĢek bağ dokusundan oluĢan endotel altı tabaka olmak üzere 3 tabakadan oluĢur. Seyrek Ģekilde düz kas hücreleri gevĢek bağ tabakası dokusu içine serpilmiĢtir. Arteriol ve arterlerde intimanın endotel altı tabakası iç elastik membran denilen ve pencereli elastik materyalden oluĢan bir tabaka içermektedir.
Tunika media, ya da orta tabaka, primer olarak sirküler düzenlenmiĢ düz kas
hücrelerini içeren bir tabakadır. Arterlerde daha kalın olarak bulunmaktadır. Bununla birlikte internal elastik membrandan eksternal elastik membrana kadar uzanmaktadır. Eksternal elastik membran, tunika media ile tunika advetisyayı ayırmaktadır. Düz
4 kas hücrelerinin arasında proteoglikanlar, elastin, ve retiküler fiberler bulunmaktadır. Tunika medianın tüm hücre dıĢı içeriği düz kas hücreleri tarafından üretilmektedir.
Tunika adventisya baĢlıca uzunlamasına düzenlenmiĢ kollajenöz içerikten
ve bir miktar elastik fiberden oluĢmaktadır. Bu bağ dokusu elemanları, damarların çevresindeki gevĢek doku ile aĢamalı olarak birleĢir. Tunika adventisya, arterlerde rölatif olarak inceyken venlerde belirgin olarak kalınlaĢmaktadır. Venlerde damar duvarının ana komponentlerinden birisi olmaktadır. Ayrıca büyük damarların tunika adventisyası damar duvarının kasılmasını kontrol eden ve nervi muskularis adı verilen otonom sisteme bağlı sinirsel ağın yanında, damar duvarını besleyen vaza vazorum denilen bir damar sistemi içermektedir. Histolojik olarak farklı tipteki arter ve venler birbirinden damar duvarı kalınlığı ve tabakaların içeriğindeki farklarla ayırdedilirler.
3.1.2 Damar Endoteli
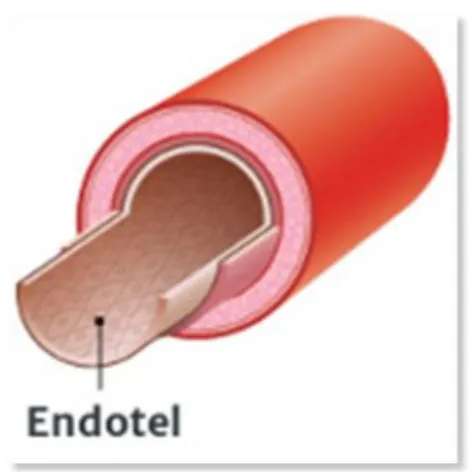
Endotel, kan damarlarının iç yüzeyini oluĢturan bir epitel türüdür, lümende dolaĢımdaki kan veya lenf ile damar duvarının geri kalan kısmı arasında bir arayüz oluĢturur (6). Endotel hücreleri adı verilen basit yassı epitel hücrelerinden oluĢan bir tabakadır. Kanla doğrudan temas halinde bulunan endotel hücrelerine vasküler endotel hücreleri denirken, lenf ile doğrudan temasta bulunan hücrelere lenfatik endotel hücreleri denir.
ġekil 2 Damar kesit yüzeyinde endotel tabakasının illüstrasyonu
(https://www.washingtonpost.com/apps/g/page/world/deadly-ebola-virus-on-the-move-in-africa/904/)
5 Vasküler endotel hücreleri, tüm dolaĢım sistemini, kalpten en küçük kılcal damarlara kadar uzanır. Bu hücrelerin vasküler biyolojide benzersiz fonksiyonları vardır. Bu iĢlevler arasında, böbrek glomerülünde sıvı damıtılması, kan damarı tonusunu ayarlama, hemostaz, nötrofil dolaĢımı ve hormon alıĢveriĢi yer alır. Kalp odacıklarının iç yüzeylerinin endoteline endokard denir.
Endotel, köken olarak mezodermaldir. Hem kan hem de lenfatik kılcal damarlar, tek tabaka olarak adlandırılan tek bir endotel hücresi tabakasından oluĢur. Bir kan damarının düz bölümlerinde, vasküler endotel hücreleri tipik olarak sıvı akıĢı yönünde hizalanır ve uzar (7).
3.1.3 Arterler
Arterler (Yunanca ἀρτηρία (artēria), 'nefes borusu, arter' anlamındadır) kalpten uzağa kan taĢıyan kan damarlarıdır. oğu atardamar oksijenli kan taĢırken, pulmoner ve umblikal arterler olmak üzere iki istisna vardır. Arteryel kan hacmi, arteriyal sistemi dolduran hücre dıĢı sıvının etkin arteryal kan hacmidir.
Arterler dolaĢım sisteminin bir parçasıdır. Normal çalıĢması, tüm hücrelere oksijen ve besin maddelerinin verilmesinden ve aynı zamanda karbon dioksit ve atık ürünlerin uzaklaĢtırılmasından, optimum pH değerinin muhafaza edilmesinden ve bağıĢıklık sisteminin protein ve hücrelerinin dolaĢımından sorumludur. GeliĢmiĢ ülkelerde önde gelen ölüm nedenleri olan miyokard enfarktüsü (kalp krizi) ve felç, yıllarca bozulma ile yavaĢ yavaĢ ve aĢamalı olarak tehlikeye atılmıĢ arteriyel bir sistemden doğrudan kaynaklanabilir.
6 ġekil 3 Elastik arterin (aort) histolojik kesit görünümü
Geleneksel olarak arterler, boyutları ve tunika medialarının karakteristikleri temel alınarak üç tip olarak sınıflandırılmaktadırlar.
3.1.3.1 Büyük (elastik) arterler:
Elastik bir arter, tunika medyasında çok miktarda kollajen ve elastin filaman bulunan ve darbeye yanıt olarak gerilmeyi sağlayan bir arterdir (8). Bu elastikiyet aynı zamanda kan dolaĢımının doğasına rağmen atardamarlarda nispeten sabit bir basıncın muhafaza edilmesine yardımcı olan Windkessel efektine neden olur. Elastik arterler, vücudun kalbe en yakın arterleridir. Pulmoner arterler, aorta ve dalları birlikte vücudun elastik arter sistemini oluĢturur. Elastik arterler, difüzyon yoluyla beslenen küçük damarların aksine kendi vazo vazorumları tarafından beslenirler.
7 ġekil 4 Elastik arter (a) ve Müsküler arter (b) histolojik farkları
3.1.3.2. Orta boy (Musküler) arterler :
Musküler arter, elastik arterden kan alan ve küçük arterler ve arterioller de dâhil olmak üzere "direnç damarları" içine dallanan orta büyüklükte bir arterdir. Elastik arterlerin, kalbin kontraksiyonu tarafından üretilen enerjiyi depolamak için kullandığı mekanizmanın aksine, arterlerin dağılımı, düz kas tabakalarını içermektedir.
Dağıtıcı arterler mikroskop altında açıkça tanımlanmıĢ iç esnek tabaka ile tanımlanabilir. Elastik tabaka, Verhoeff lekesi kullanılarak en iyi Ģekilde görselleĢtirilir, ancak diğer teknikleri kullanarak iyi tanımlanmıĢ bir negatif boyama bölgesi olarak boyanan örneklerde kolayca bulunabilir.
8 ġekil 5 Musküler arterin histolojik kesit görünümü.
(https://www.studyblue.com/notes/note/n/cto/deck/8656410)
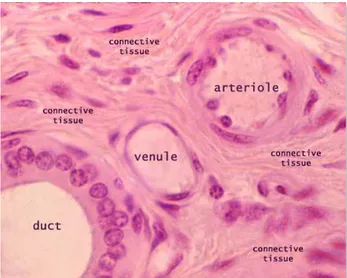
3.1.3.3. Küçük arterler ve arterioller:
Bir arteriol mikrosirkülasyonda, bir arterden uzanan ve dallanarak kılcal damarlara açılan küçük çaplı bir kan damarıdır.
Arteriollerin kas duvarları (genellikle düz kasın sadece bir ila iki katı) bulunur ve vasküler direncin birincil alanıdır. Kan basıncında ve kan akıĢındaki hızdaki en büyük değiĢiklik arteriollerin kılcal damarlarına geçiĢinde ortaya çıkar. Kılcal damarlarda azalan akıĢ hızı, Bernoulli ilkesine bağlı olarak kan basıncını arttırır. Bu, kılcalın dıĢındaki düĢük ozmotik basınca bağlı olarak, gaz ve besin maddelerinin kandan hücrelere hareket etmesini sağlar. Tersi venüllerde oluĢur. Arterioller, otonom sinir sistemi innervasyonuna girerler ve çaplarını düzenlemek için çeĢitli dolaĢımdaki hormonlara cevap verirler. Gerilme, karbondioksit, pH ve oksijene verilen lokal yanıtlar arteriol tonusunu etkiler. Genellikle, norepinefrin ve epinefrin (sempatik sinirler ve adrenal bez tarafından üretilen hormonlar) alfa 1-adrenerjik reseptörlere etki eden vazokonstriktiftir. Bununla birlikte, iskelet kası, kalp kası ve pulmoner dolaĢımın arteriyolleri, beta-adrenerjik reseptörler üzerinde hareket edince bu hormonlara yanıt olarak vazodilate olur. Genellikle, gerilme ve yüksek oksijen konstrüksiyona, karbon dioksit ve düĢük pH vazodilatasyona neden olur. Pulmoner arteriyoller, yüksek oksijene tepki olarak vazodilatlandıkları için dikkate değer bir istisnadır. Beyin arteriyolleri, özellikle pH düĢüĢü vasodilatasyonu
9 destekleyen pH'ya duyarlıdır. Anjiyotensin II (vazokonstriktif), endotelin (vazokonstriktif), bradikinin (vazodilatasyon), atriyal natrüretik peptit (vazodilatasyon) ve prostasiklin (vazodilatasyon) gibi arteriol tonusunda bir dizi hormon etkilidir.
Vücudu besleyen arterlerdeki kan basıncı, kalp tarafından pompalanan kalp debisini ve buna cevaben oluĢan vasküler direncin bir sonucudur. Hipertansif arteriollerde (arterioloskleroz) vasküler duvar kalınlaĢması ve / veya lumenal çapın azalması nedeniyle medyanın lumenal çap oranına olan bir artıĢ gözlemlenmiĢtir. Birbirlerinden tunika mediadaki düz kas tabakalarının sayısına göre ayırdedilmektedirler. Tanım olarak, arterioller tunika mediada sadece bir ya da iki tabakaya, küçük arterler ise tunika mediada sekiz kadar düz kas tabakasına sahiptirler.
ġekil 6 Küçük arterin (arteriyol) histolojik kesit görüntüsü. (https://www.pinterest.com/pin/369928556873431439/)
10
3.2 Amniyotik Membran Histolojisi ve Fizyolojisi
ġekil 7 Amniyotik Membran Histolojik Tabakaları
ġekil 8 Amniyotik membran makroskobik görüntüsü
11 Amniyon zarı, plasentayı oluĢturan en içte bulunanıdır. Tek katlı epitelden oluĢan parlak ve yapıĢmayan dıĢ yüzey, kalın kollajen iplikler içeren bazal membran ile mat, pürtüklü ve yapıĢkan avasküler stromal matriksten olusan iç yüzey olmak üzere üç katmandan oluĢur (9-11) .Amniyotik membran vasküler yapı içermeyen translusent bir tabakadır (12).
Amniyotik membran, mat ve pürtüklü iç yüzeyi yapıĢkan özellikte olması nedeniyle uygulandığı bölgeye iyi uyum sağlar. Ayrıca parlak ve yapıĢmayan dıĢ yüzeyinin ise dokular arasında biyolojik bir bariyer görevi yaparak adezyon oluĢumunu engellediği bildirilmektedir (4,13,14).
ġekil 9 Amniyotik membranın histolojik görünümü
Bünyesinde birçok büyüme faktörünü Epidermal growth faktör (EGF), keratocyte growth faktör (KGF), hepatocyte growth faktör (HGF), transforming growth faktör (TGF), steroid hormonları (östrojen, progesteron), hidrolitik enzimleri, oksidasyon-redüksiyon enzimleri, sekonder enzimleri ve daha birçok faktörü
bulundurur (Tablo 1) (15,16).
Amniyotik membran, bir tür bazal lamine iĢlevi yaparak, epitelizasyonun uyarılmasında rol oynar. Bu efektin en temel nedeni epitelyal hücrelerin büyümesini uyaran büyüme faktörlerinin üretimidir. (KGF, EGF, bFGF gibi)(17). Amniyotik membran, aynı zamanda apoptozisi engelleyici etkisi ile (18) özellikle apoptozisi
12 indükleyici etkisi olan radyasyonun etkilerini tersine döndürme özelliğine sahip olabilir.
Amniyotik membranın immünite üzerine etkileri de çalıĢılmıĢtır. nceleri amniyotik membran üzerinde herhangi bir HLA antijeninin olduğu gösterilememiĢtir. Fakat daha sonra yapılan çalıĢmalar göstermiĢtir ki amniyotik membranın epitelyal, mezenkimal hücrelerinde ve fibroblastlarında HLA antijenlerinin yanında, immun baskılayıcı bir faktör olan CD 59 olduğunu göstermiĢtir (19). Bu özellikleri ile amniyotik membran immunolojik açıdan ayrıcalıklı bir yapıdır. Yapılan çalıĢmalarda doku reddine rastlanmamıĢtır.
Amniyotik membranın anti-inflamatuar etkisi ile ilgili yapılan çalıĢmalarda içerdiği antienflamatuar sitokinlerin, amniyotik membranın antienflamatuar etkisinin temelini oluĢturduğu ileri sürülmüĢtür. Ayrıca IL türlerinden bazılarını içermesi gibi yüksek potentli pro-inflamatuar sitokinlerin üretimlerinin de amniyotik membran ile inhibe olduğu görülmüĢtür (20).
Amniyotik zarın anjiogenezise etkisi çalıĢmalarda gösterilmiĢtir, fakat bir kısmında sonuçlar tartıĢmalıdır. Faulk ve ark., kronik ülseri olan hastalarda yaptıkları çalıĢmada, ülserleri amniyotik membran ile sarıp, aldıkları biyopsiler neticesinde anlamlı derecede damar proliferasyonu olduğunu ileri sürmüĢlerdir (12). Bir baĢka çalıĢmada ise vestibüloplastilerde kullanılan amniyotik membranların vaskülarizasyonu incelenmiĢ ve amniyotik membranın anlamlı derecede vaskülarizasyonu artırdığı gösterilmiĢtir (21).
Amniyotik membranın çalıĢılan bir diğer etkisi de antimikrobial özelliğidir. Robson ve ark.ın çalıĢmasında sıçanlarda oluĢan bir yanık modeli üzerine Pseudomonas Aeruginosa inoküle edilmiĢ ve 4.günde yapılan bakteri sayımında, amniyotik membranlı gruptaki bakteriyel aktivite, deri greftli ve greftsiz yaralardakine göre daha düĢük bulunmuĢtur (12). Ayrıca amniyotik membran antiviral özelliği olan Sistatin içermektedir (22). Daha önce bahsedilen antienflamatuar özellikleri de antimikrobiyal aktivitesine katkı sağlamaktadır.
13 Amniyotik membranın yaralara uygulandığı klinik çalıĢmalarda ağrının anlamlı derecede azaldığı görülmüĢtür. Bu etki, amniyotik membranın yaranın tamamına yapıĢması ve açığa çıkan sinir uçlarını kapatması sonucunda ortaya çıkmaktadır.
Amniyotik hücrelerin pluripotent özelliği olduğu, bu nedenle doku transplantasyonu ve doku mühendisliğinde kullanıĢlı olabileceği belirtilmiĢtir. Bu hücreler her üç germ tabakasının (endoderm, mezoderm, ektoderm) hücrelerine dönüĢebilirler. Son yıllarda yapılmıĢ olan bir çalıĢmada, embriyonik hücrelerde gösterilmiĢ yüzey belirteçleri, amniyotik membran hücreleri üzerinde de gösterilmiĢtir (23).
Birçok araĢtırmacı amniyotik membranın zamanla uygulandığı bölgedeki dokunun özelliğini aldığını, bu nedenle yeni bir cerrahi iĢleme gerek olmayacağını bildirmektedir (9,15,24-26).
Yukarıda bahsedilen özellikleri nedeniyle, daha önce oftalmolojide (korneal ülserler, konjunktiva rekonstrüksiyonu, glokom cerrahisi ve komplikasyonlarında), venöz ülserlerde, oral ve maksillofasiyal cerrahide kullanılan amniyotik membranın, problemli bir yara türü olan ve plastik cerrahi açısından önem arz eden radyasyon yaralarında etkili olabileceği düĢünülmüĢtür. Sonuç olarak amniyotik membranın etki mekanizmaları; epitelizasyon için substrat olarak görev yapması, epitelyal hücre göçüne yardımı, bazal epitelyal hücrelerin yapıĢmasını indüklemesi, epitelyal farklılaĢmayı teĢvik etmesi, epitelyal apoptozisi önlemesi, doku metalloproteinaz inhibitörleri salgılayıp doku tahribatını engellemesi, fibroblastik aktiviteyi artırıp kollajen sentezine katkıda bulunması ve yapısında bulunan birçok büyüme faktörü ve bazı enzimler sayesinde yara iyilesmesini hızlandırmak olarak sıralanabilir (9,16,27,28).
14 Tablo 1 Amniyotik Membran Büyüme Faktörleri ve Enzimler (12)
Human korionic gonadotropin(HCG), Equine gonadotrophic hormon (eCG) Tireotropik hormon
Transforminggrowthfactor (TGFß1-2-3) Basic fibroblast growth factor (bFGF) Epidermal growth factor (EGF)
Transforming growth factor- α (TGF-α ) Keratocyte growth factor (KGF)
Hepatocyte growth factor (HGF) Brain natriuretic peptide (BNP) Nerve growth factor (NGF)
Growth factor mRNA (GFmRNA)
Steroid hormonlar ( strojen, Progesteron) Hidrolitik enzimler
Oksidasyon ve redüksiyon enzimleri Sekonder enzimler
3.3 Biyokimyasal Markırlar
3.3.1 Endotelyal Nitrit Oksit Sentaz (E-NOS)
Nitrik oksit sentaz 3 (NOS3) veya yapısal NOS (cNOS) olarak da bilinen endotelyal NOS (eNOS), insanlarda 7 nolu kromozomun 7q35-7q36 bölgesinde bulunan NOS3 geni tarafından kodlanan bir enzimdir (29). Bu enzim, çeĢitli biyolojik süreçlere katılan küçük bir molekül olan nitrik oksit (NO) sentezleyen üç
15 izoformdan biridir (30). ENOS esas olarak vasküler endotelde NO üretilmesinden sorumludur (31). ENOS tarafından vasküler endotelde üretilen NO, damar tonusu, hücre proliferasyonu, lökosit adhezyonu ve trombosit agregasyonunun
düzenlenmesinde önemli rol oynamaktadır (32).
ġekil 10 NOS anjiogenezis aktivitesi
(http://blogqpot.com/images/enos%20cgmp%20pathway)
ENOS, nikotinamid adenin dinükleotid fosfat (NADPH), flavin
mononükleotid (FMN) ve flavin adenin dinükleotit (FAD) için bağlanma yerlerini gösteren bir redüktaz alanından oluĢan iki özdeĢ monomeri ve bir oksidaz alanını içeren bir dimerdir. Heme grubu, çinko, kofaktör tetrahidrobiyopterin (BH4) ve L-arginin substratı için bağlanma yerlerini gösterir.(33) Redüktaz alanı, bir kalmodulin-bağlayıcı sekansla oksidaz alanıyla bağlantılıdır. Vasküler endotelde NO, eNOS ile L-arginin'den sentezlenir ve eNOS'un heme grubuna bağlanan moleküler oksijen azaltılır ve sonunda NO ve L-sitrulin'i oluĢturmak için L-arginine dâhil edilir (34). KoFaktör BH4'ün bağlanması eNOS'un etkin bir Ģekilde NO üretmesi için gereklidir. Bu kofaktörün yokluğunda, eNOS, dimerik bir halden monomerik forma geçer ve böylece bağlanmaz hale gelir. Bu konformasyonda, NO sentezlenmesi yerine eNOS, kardiyovasküler sisteme zararlı sonuçlar veren oldukça reaktif bir serbest radikal olan süperoksit anyon üretir.
Anjiogenez
EC Migrasyon
16 ENOS, NO üretimiyle alakalı, kardiyovasküler sistemde koruyucu bir iĢleve sahiptir. Vasküler tonusun düzenlenmesi, kardiyovasküler sistemde NO'nun en bilinen rollerinden biridir. Bir kez endotel hücrelerinde üretilen NO, vasküler düz kas hücresi membranlarında yayılır ve guanozin trifosfatın siklik guanozin monofosfata (cGMP) dönüĢmesini katalize eden enzim çözünür guanilat siklaz (sGC) 'yi aktive
eder. CGMP, hücresel Ca2+ konsantrasyonlarını düĢüren ve vasküler gevĢemeyi
arttıran hücresel hedeflerin çok sayıda fosforilasyonunu hızlandıran protein kinaz G'yi (PKG) harekete geçirir (35).
NO, cGMP'ye bağlı Ca2 + akıĢını inhibe ederek veya DNA sentezi için gerekli
olan poliamid üretimini azaltarak doğrudan arjinaz ve ornitin dekarboksilaz aktivitesini inhibe ederek antiproliferatif etkiler yapar (36). NO ayrıca trombosit zarı
ile sGC aktivasyonu arasındaki difüzyon sonucunda oluĢan trombosit
agregasyonunun inhibisyonuna neden olan antitrombotik etkilere sahiptir. Ayrıca NO, kemokinlerin ve adezyon moleküllerinin vasküler endotelyal ekspresyonunu indükleyen nükleer faktör kappa B'yi (NF-κB) inhibe ederek vasküler endotele yapıĢmayı etkiler (37). Bu iĢlevlere ek olarak, eNOS tarafından üretilen NO, süperoksit anyonunun hidrojen peroksit haline dönüĢmesini katalize eden bir antioksidan enzim olan süperoksit dismutaz'ın ekspresyonunda NO ile indüklenen artıĢların bir sonucu olarak süperoksit anyon oluĢumunu azalttığı için antioksidan özelliklere sahiptir.
17 ġekil 11 NO aktivite Ģeması (http://keywordsuggest.org/gallery/780453.html)
Ayrıca, NO'nun antioksidan özelliklerinin bir kısmı, kan damarlarındaki süperoksit anyon konsantrasyonlarını düĢüren hem-oksijenaz-I ve ferritin ekspresyonunun yükseltilmesine atfedilebilir (38).
ENOS ekspresyonu ve aktivitesi, transkripsiyonel, transkripsiyon sonrası ve posttranslasyonel seviyelerde bulunan çok sayıda birbirine bağlı düzenleme mekanizmaları tarafından dikkatle kontrol edilir.
BozulmuĢ NO üretimi, hipertansiyon, preeklampsi, diabetes mellitus, obezite, erektil disfonksiyon ve migren gibi çeĢitli hastalıkların patogenezinde rol alır. Bu bağlamda, çok sayıda çalıĢma, NOS3 genindeki polimorfizmlerin bu hastalıklara duyarlılığı etkilediğini göstermiĢtir.
3.3.2 Vasküler endotelyal büyüme faktörü (VEGF)
Vasküler endotelyal büyüme faktörü (VEGF), vaskülogenezisi ve anjiyogenezi uyaran hücreler tarafından üretilen bir sinyal proteinidir. Kan dolaĢımı yetersiz olduğunda dokulara oksijen sağlayan sistemin bir parçasıdır (39). VEGF'nin normal fonksiyonu, embriyonik geliĢim sırasında yeni kan damarları oluĢturmak, yaralanmadan sonra yeni kan damarları oluĢturmak, egzersiz sonrası kas oluĢumuna yardımcı olmak ve kollateral dolaĢım oluĢturmaktır.
vazodilatasyon LDL oksidasyonu Süperoksit radikal inhibisyonu Düz kas proliferasyonu Monosit Adezyonu Platelet Agregasyon
18 VEGF aĢırı eksprese edildiğinde, hastalıklara katkıda bulunabilmektedir. VEGF'yi eksprese edebilen kanserler büyüyebilir ve metastaz yapabilirler.
VEGF, büyüme faktörlerinin alt grubundandır. Spesifik olarak, trombosit kaynaklı büyüme faktörü (PDGF) ailesindendir. Hem vaskülogenezis (embriyonik dolaĢım sisteminin de novo oluĢumu) hem de anjiyogenezis (önceden var olan damarlardan kaynaklanan kan damarlarının büyümesi) ile ilgili önemli sinyal proteinleridirler.
VEGF ailesi memelilerde beĢ üyeden oluĢur: VEGF-A, plasenta büyüme faktörü (PGF), VEGF-B, VEGF-C ve VEGF-D. Sonuncusu VEGF-A'dan sonra keĢfedilmiĢtir ve keĢfinden önce VEGF-A'ya sadece VEGF adı verildi. Virüslerle (VEGF-E) kodlanan ve bazı yılanların zehirinde (VEGF-F) bulunan bir dizi VEGF ile ilgili protein de keĢfedilmiĢtir.
VEGF-A'nın isminden de anlaĢılacağı gibi, bir takım diğer hücre tipleri (örn., monosit / makrofaj göçü, nöronlar, kanser hücreleri, böbrek epitelleri) üzerinde etkileri olmasına rağmen çoğunlukla vasküler endotelyum hücreleri üzerindeki etkisi çalıĢılmıĢtır. Hücreler). In vitro olarak, VEGF-A'nın endotel hücresi mitogenezisini ve hücre göçünü uyardığı gösterilmiĢtir. VEGF-A aynı zamanda bir vazodilatatördür ve mikrovasküler geçirgenliği arttırır ve aslen vasküler geçirgenlik faktörü olarak anılmaktadır.
VEGF ailesinin tüm üyeleri, hücre yüzeyindeki tirozin kinaz reseptörlerine (VEGFR‟ler) bağlanarak hücresel tepkileri uyarır ve bu da farklı zaman ve yaygınlıkta olmakla birlikte dimerize olmalarına ve aktifosforilasyon yoluyla aktive olmalarına neden olur. VEGF reseptörleri, 7 immünoglobulin benzeri alanı, tek bir transmembran yayılım bölgesi ve bir bölünmüĢ tirozin kinaz alanı içeren bir hücre içi kısımdan oluĢan bir hücre dıĢı kısımı içerir. VEGF-A, VEGFR-1 ve VEGFR-2‟ye bağlanır.(40) VEGFR-2‟nin, VEGF‟ye bilinen hemen hemen tüm hücresel yanıtlara aracılık ettiği görülmektedir. VEGFR-1‟in fonksiyonunun daha az bilimesiyle birlikte VEGFR-2 sinyalini modüle ettiği düĢünülmektedir.(41) C ve VEGF-D, lenfanjiogeneze aracılık eden üçüncü bir reseptör için ligandlardır. VEGFR-3, hedef hücreler üzerindeki ligandların sürekli eylemine ve fonksiyonunaaracılık eden ana ligandların bağlanma bölgesidir. Vasküler endotel büyüme faktörü-C, lenfanjiogenezi ve VEGFR2 vasıtasıyla anjiogenezi uyarabilir.
19 VEGFR'lere bağlanmanın yanı sıra, VEGF hem nöropilinlerden hem de VEGFR'lerden oluĢan reseptör komplekslerine de bağlanmaktadır. Bu reseptör kompleksi, endotel hücrelerinde (kan damarları) VEGF sinyal aktivitesini arttırmıĢtır (42). Neuropilinler (NRP) pleitrofik reseptörlerdir ve bu nedenle diğer moleküller NRP/VEGFR reseptör komplekslerinin sinyalleĢmesini etkileyebilir. rneğin, Sınıf 3 semaforinler NRP bağlanması için VEGF165 ile rekabet eder ve bu nedenle VEGF aracılı anjiyogenezi düzenleyebilirler.(43)
VEGF-A üretimi, yeterli oksijen almayan hücrede indüklenebilir. Bir hücrede oksijen yetersiz olduğunda, HIF, hipoksi ile uyarılabilir faktör, bir transkripsiyon faktörü üretir. HIF, diğer fonksiyonların yanı sıra (eritropoezisin modülasyonu dâhil) VEGF-A'nın salınmasını uyarır. DolaĢan VEGF-A, daha sonra endotel hücrelerindeki VEGF Reseptörlerine bağlanır ve anjiyogeneze yol açan bir Tyrosine Kinaz Yolunu baĢlatır. VEGF yokluğunda anjiyopoietin-2‟nin ekspresyonu, endotel hücresi ölümüne ve vasküler gerilemeye neden olur.
3.4 Mikrovasküler Anastomoz Modelleri
Damar cerrahisinin baĢlangıcı Hallowell‟in 1759 yılında aksiller arter yaralanmasında kullandığı iğne yardımıyla damar onarımını gerçekleĢtirdiği tekniğe dayanmaktadır.1900 lü yıllardan baĢlayıp hızla geliĢen damar cerrahisi dalında 1950‟lere kadar birçok anastomoz tekniği denenmiĢtir. 1950 den sonra by-pass cerrahisi ve mikrovasküler doku nakilleri ile rutin günlük cerrahi kullanımına girmiĢ ve dikiĢ kullanılan teknikler ön plana çıkmıĢtır.
Damar anastomozu, kalp damar cerrahisi, rekonstrüktif mikrocerrahi, transplantasyon cerrahisi beyin cerrahisi gibi farklı cerrahi branĢların kullandığı yöntemdir. Bu disiplinlerde farklı boyutlardaki damarlar farklı koĢullarda yapılmaktadır. Daha küçük çapta damarların anastomozlarının yapıldığı rekonstrüktif mikrocerrahide dikiĢler tek tek atılırken organ nakli gibi büyük damarların anastomozlarının yapıldığı anastomozlarda daha sıklıkla kontinü dikiĢ teknikleri kullanılmaktadır.
Anastomoz üzerine yapılan çalıĢmaların çoğu anastomozun daha kolay, daha hızlı ve daha güvenilir yapılması üzerinedir.
20 Ġyi bir anastomoz; iskemiye neden olmayacak kadar hızlı, atravmatik ve kolay uygulanabilir olmalıdır. Bu liste rahatlıkla uzatılabilir.
3.4.1 Standart Damar Anatomozu
Mikrocerrhlar arasında en yaygın olarak kullanılan, „‟altın standart‟‟ yöntem olarak kabul edilmektedir. Her iki damar ucu tazelendikten ve 3-6 mm kadar adventisektomi yapıldıktan sonra önce 0 derece olarak adlandırılan karĢı damar uçlarına, tek bir sütür konur. Sıklıkla 180 derece olarak adlandırılan paralel kenara ya da 120 dereceye ikinci sütür atılır. Tek tek tekniğe uygun dikiĢler geçilerek önce ön duvar sütüre edilir. Ardından mikro-klempler 180 derece döndürülerek arka duvar mikroskop tarafına çevrilir. Aynı ön duvar dikiĢinde olduğu gibi arka duvar da tek tek sütüre edilir.
3.4.2 DeğiĢik dikiĢ teknikleriyle yapılan anastomozlar: 3.4.2.1 Devamlı DikiĢ Tekniği
Tek tek dikiĢlere göre daha hızlı anastomoz yapılan bir tekniktir. Klinik rutininde çok küçük çaplı damarlarda pek kullanılmayan bir yöntemdir. Daha sıklıkla organ nakillerinde tercih edilmektedir (44).
Daha az bağlama yapıldığından dolayı konvansiyonel yönteme göre daha hızlı yapılmaktadır. Ancak dikiĢ geçme noktalarını ayarlamak daha fazla özen gerektirmektedir ve bununla birlikte dikiĢ gerginliğini ayarlamak oldukça önemlidir. Olması gerekenden fazla olan gerginlik damar uçlarını üst-üste bindirip anastomoz hattında büzüĢme ve daralmalara yol açabilirken; olması gerekenden gevĢek dikiĢ ise anastomoz hattından kaçaklara sebep olabilmektedir.
21 ġekil 12 Kontinü DikiĢ Tekniğiyle Damar Anastomozu
Büyük çaplı damarlarda baĢarısı artmakla birlikte dikkat edilmesi gereken diğer önemli bir unsur ise ipliğin klemplere takılmamasına özen göstermektir. Standart anastomozlarda olduğu gibi damar hazırlığı yapıldıktan sonra ilk dikiĢ 0 dereceye atılır ve bir ucu uzun olarak bırakılır. Ġkinci dikiĢ 180 dereceye atılarak 0 dereceye doğru kontinu olarak dikiĢ atılır. Damara takla attırılarak arka yüz de aynı Ģekilde dikilir.
3.4.2.2 Matris DikiĢlerle Anastomoz
Kontinü ve tek tek olmak üzere iki Ģekilde atılmaktadır. Damar hazırlığı sonrası basit kontinü dikiĢte olduğu gibi 0 ve 180 derecelere atılan iki askı dikiĢi ile baĢlanır. nce ön ve sonra arka yüze olmak üzere tek tek ya da kontinü dikiĢler atılarak anastomoz tamamlanır.
22 ġekil 13 Matris DikiĢ Tekniğiyle Damar Anastomozu
ıkıĢ nedeni dikiĢ ipliklerinin lümendeki kan ile daha az temasının tromboza yatkınlığı azaltacağı hipotezidir. Fakat ipliklerin intimal alanda yarattığı sorun sanılanın aksine o kadar da önemli bir problem değildir (45). Bir diğer avantajı damar duvarlarını everte etmesidir. Arter anastomozlarında damar duvarlarının inversiyonu önemli bir sorun değildir. Fakat özellikle büyük çaplı venlerde bu eversiyon avantaj sağlayabilmektedir.
Dezavantajlarından birisi matris dikiĢi içinde kalan damar dokusu iskemik değiĢikliklere maruz kalabilmektedir. Anastomoz sonrasındaki dönemde anastomoz hatlarındaki anevrizma bazı çalıĢmalarda gösterilmiĢtir (46). Portegünün hem forehand hem de backhand kullanımının gerekmesi ve anatomozdan kaçak oluĢmasının nadir görülmemesi diğer dezavantajlarıdır.
3.4.2.3 Açık Ġlmek Tekniği (Open Loop)
Devamlı dikiĢ tekniğinden türetilmiĢtir. Devamlı dikiĢ tekniğinin hızı ve arka duvar kontrolünün avantajından yararlanılan bu teknikte ipler tek tek bağlanarak devamlı sütür tekniğinin anastomozu büzücü etkisinden uzaklaĢılmıĢtır. Düğümlerin tek tek bağlanması nedeniyle devamlı sütür tekniği kadar hızlı olmamakla birlikte mikroskop kullanımı esnasında düğüm bağlanmasında zoom in ve out yapılmasındaki zaman kayıpları minimuma indirilmiĢtir. (47)
Damarların standart hazırlığı sonrası 0 ve 180 derecelere askı dikiĢleri konulmaktadır. 180 dereceye yakın baĢlanarak ve ip sonu düğüm atmaya yetecek kadar uzun bırakılarak iğne 0 dereceye doğru kontinu olarak ve iplik halkaları gevĢek
23 bırakılacak Ģekilde geçilir. Ġp sonundan iğneye doğru her halka bağlanarak düğümler tamamlanır. Aynı iĢlem arka duvara da uygulanır. (47)
Teknik konvansiyonel yönteme göre daha hızlı, kontinü yönteme göre daha yavaĢ olmaktadır. GevĢek bırakılan iplik halkalarının takılmamasına özen gösterilmelidir.
ġekil 14 Open Loop Tekniğiyle Damar Anastomozu
3.4.2.4 Önce Arka Yüz Tekniği (Backwall First)
Klinikte her zaman anastomoz koĢulları deneysel mikrocerrahide olduğu kadar optimal olmayabilmektedir. ok küçük bir alanda, kısa damar güdüğünde, çukur bir alanda, aletlerin manipulasyonunun kolay olmadığı pozisyonlarda anastomoz yapmak gerekebilmektedir. Bu anastomozlar için ideal teknik olduğu düĢünülebilir. (48)
24 ġekil 15 Back-wall first Damar Anastomozu
Standart damar hazırlığı sonrası ilk dikiĢ arka duvarların ortasına atılmaktadır. Daha sonra arka duvarda atılan bu dikiĢin sağına soluna dikiĢler atılarak arka duvar tamamlanıp sonra standart ön yüz anastomozu yapılmaktadır.
Arka duvar hep görüĢ açısında olduğundan backwall hatası minimuma indirilmekte ve damara takla attırmak gerekmemektedir. Ancak bu dikiĢ yöntemi de backhand kullanımı gerektirmektedir. Bu da bir dezavantaj sayılabilir.
3.4.2.5 Üçgen Anastomoz Tekniği:
Carrel tarafından bulunan bu teknikte önce standart damar hazırlığı sonrası önce 0 ve 120 derecelere iki dikiĢ konulmaktadır (49). Daha sonra 240 dereceden dikiĢ geçilerek damar çapları 3 eĢit parçaya ayrılmıĢ olur. Bu 3 askı dikiĢi arası kontinü ya da separe Ģekilde dikilerek anastomoz tamamlanır.
ġekil 16 Üçgen Damar Anastomozu
25 0-180 derece dikiĢinden farklı olarak damarın ön yüzü arka yüzüne göre iki kat kısa kaldığından dolayı askı dikiĢleri gerildiği zaman arkadaki uzun damar yüzü aĢağı doğru sarkmakta; bu da arka duvardan da aynı anda dikiĢ geçme ihtimalini azaltmaktadır.
Smith (50) ve Cobbett (51) tarafından küçük damarlarda çalıĢılan bu anastomoz Ģekli arka duvar güvenliğini sağlamakla birlikte nispeten daha yavaĢ bir anastomozla sonuçlanmaktadır.
3.4.2.6 Teleskop Tekniği:
Ġlk olarak Bougle (52) tarafından tanımlanmıĢtır. Lauritzen (53) tarafından 1978 yılında tekrar popülerize edilmiĢtir. Kan akımının yukarısında kalan damar aĢağısında kalan damarın içine geçirilerek damar lümeninden geçmeyen iki dikiĢle birlikte tutturulur.
Lümenden geçmeyen iki dikiĢle yapılması, az travmaya neden olması ve hızlı yapılması avantajlarıyken en önemli dezavantajı iki damarın iç içe geçmesi nedeniyle oluĢan darlıktır.
ġekil 17 Teleskop Damar Anastomozu
Wieslander ve ark. (54) 1984 yılında yaptığı çalıĢmada teleskop tekniğinin damarda yaptığı değiĢiklikleri incelemiĢlerdir. Erken dönemde trombüs ihtimalinin arttığı ama ileri dönemde içeride kalan damarın endotelinin döküldüğü ve konvansiyonel yöntemlere göre anlamlı bit daralmanın kalmadığını ortaya koymuĢlardır.
26
3.4.2.7 Kılıf Tekniği:
Damar duvarına seyrek dikiĢ atıp etrafını streç film sararak anastomoz fikri ilk olarak Buncke (55) ve McLean (56) tarafından ortaya atılmıĢtır. Hemostaz için ise üzerine yağ dokusu koymak Acland tarafından ortaya konmuĢtur (57). Fakat bunlar kaçakları tam olarak önleyememekte ve dikiĢ aralıklarından kaçan kanla temas eden trombojenik yüzeyler tromboza sebep olabilmektedir. Harris ve arkadaĢları iç yüzeyi trombojenik olmayan bir materyalin kılıf olarak kullanmasını önermiĢlerdir (58).
Mikrovasküler anastomozda tromboz nedenlerinden bir tanesi de dikiĢlerin travmatik olarak atılması ve lümende çok sayıda dikiĢ materyali bulunması gösterilebilir. Bu nedenle hem hızlı hem de daha az travmatik bir teknik olan kılıf ile anastomoz tekniği geliĢtirilmiĢtir.
Bu teknikte karĢılıklı anastomoz yapılacak damarların çapından hafifçe geniĢ bir ven greft olarak alınarak proksimal veya distal damara geçirilir. KarĢılıklı damarlar normalden az (2 ya da 3) dikiĢle uç uca tutturulur. Daha önce geçirilmiĢ olan damar anastomoz hattının üzerine kaydırılarak anastomoz hattını çevreler. Eğer kılıf olarak kullanılan damar anastomoz hattının üzerinden kaymaya meyilli ise bir iki dikiĢle akım sağlayan damarların adventisyasına tutturulabilir. Akım geldiğinde damarın üzerine bir süre kaçak nedeniyle basmak gerekmektedir. zellikle küçük damarlarda daha az dikiĢ atılması endeniyle avantajlı olduğu düĢünülen anastomoz Ģeklinin en önemli dezavantajı akım geldiğinde normalden fazla olan kaçaktır.
3.4.2.8 DikiĢsiz Anastomoz Teknikleri:
19.yüzyılın sonunda damar cerrahisindeki potansiyelin farkına varılmasıyla birlikte damarları ağızlaĢtırıp birbirine bağlamak için birçok yol denenmeye baĢlanmıĢtır. Fakat o dönemde gerek pıhtılaĢma mekanizmalarının tam olarak anlaĢılamaması; gerekse yeterli teknik ekipman olmaması nedeniyle çok baĢarılı olunamamıĢtır. DikiĢle baĢarılı olunamaması nedeniyle baĢka yöntemler denenmeye baĢlanılmıĢtır. Abbe tarafından yapılan denemede köpek femoral arter iki ucu arasına cam tipler yerleĢtirilerek dikiĢsiz anastomoz çalıĢmaları bir nevi baĢlamıĢtır (59). Daha sonra Nitze fildiĢi tüpler ile baĢarılı sonuçlar bildirmiĢtir (60). Daha sonraki çalıĢmalarda da baĢarılı sonuçlar bildirilmesine karĢılık sonuçların tekrar edilebilir
27 olmaktan uzak olması nedeniyle baĢka arayıĢlar sürmüĢtür. Daha sonra Payr tarafından yapılan çalıĢmalarla ilkeleri günümüze kadar ulaĢan bilezik ve iğneli kelepçe yöntemleri ortaya çıkmıĢtır (61). DikiĢsiz yöntemler hala kullanılmakla birlikte dikiĢli yöntemler kadar kullanımı yaygın değildir.
3.4.2.8.1 Bilezikle Anastomoz:
Payr tarafından tanımlanmıĢtır (62). Ġlk bulunma nedeni dikiĢlerin büyük arter anastomozlarında basınca dayanamayacağının düĢünülmesidir. Bu yöntemde akımın proksimaldeki tarafı magnezyum bir bilezikten geçirilir ve bileziğin üzerinde geriye katlanarak bağlanır. Distal taraf dilate edilerek aynı bilezik üzerine geçirilerek bağlanır. Böylece lümende dikiĢ materyali kalmamıĢ olur. Ve bununla birlikte intimaların birbirine temas etmesi de tromboza yatkınlığın daha az olmasına yardımcı olur. Ayrıca bu kullanılan magnezyum bileziklerin zamanla resorbe olduğu ve yabancı cisim reaksiyonuna neden olmadığı öne sürülmektedir. Ayrıca bilezik atel görevi yaptığından mural trombüslerin tıkayıcı trombüslere dönüĢme ihtimali daha azdır. Bununla birlikte damar spazmını engelleyici görev de görmektedir. Bu yöntemin kolaylıkları kadar zorlukları da ortaya konmuĢtur. Cerrahi ekipman ve sütür materyalleri geliĢtikçe konvansiyonel anastomoz tekniği daha kullanıĢlı hale gelmiĢtir. DeBakey‟in ikinci dünya savaĢındaki deneyimleriyle birlikte dikiĢli yöntemin daha güvenilir olduğu düĢünülmeye baĢlanmıĢtır (63). Daniel poliglaktin bilezikle yüksek baĢarı elde etmesi yine de standart teknik önüne geçirememiĢtir (64).
28 ġekil 18 Damar Coupler cihazı
Tekniğin en önemli dezavantajlarından birisi damar çapına uygun bilezik bulma zorluğudur. Diğer sorun ise dikiĢle bileziğin üzerine bağlanan damardaki nekrozdur. Ayrıca bu tekniğin uygulanması için eli mikrocerrahiye alıĢkın bir asistan da gerekmektedir. Ayrıca bu iĢlem rekonstrüktif mikrocerrahi ve süpermikrocerrahide damar çaplarının oldukça küçük olması ve bileziğin üzerine geçirmenin zor olabileceği gerekçesiyle kullanıĢlı görülmemektedir.
Landon bileziğe çengel ekleyerek yöntemi modifiye etmiĢtir. Donetski de bilezik yönteminin aynısını bağlayarak değil çengellere takarak modifiye etmiĢtir. Yöntem teorikte oldukça kolay görünmesine rağmen pratikte o kadar da kullanıĢlı bulunmamıĢtır.
3.4.2.8.2 Zımba ve Kelepçe Yöntemleri:
Hümer Hültl mide güdüğünü kapatmada zımba yöntemini kullanmaya baĢlamıĢtır. Damar cerrahisinde ilk zımba ise von Brücke tarafından geliĢtirilmiĢtir (65). Kullanılan bu sistem kağıt zımbasına benzemekle birlikte sistemin kompleks olması nedeniyle çok geniĢ kullanma alanı bulamamıĢtır. Ġğneleri birbirinin içine geçen iki halkadan oluĢan düzenek Holt ve ark. (66) tarafından denenmiĢ; Nakayama bugün de yaygın olarak kullanılan geliĢtirilmiĢ iğneli halka sistemini bulmuĢtur. Nakayama‟nın tasarımı iki kelepçe ile 1 mm‟den biraz daha büyük damarlara anastomoz yapılma imkânını sağlamaktaydı (67). Unilink sistemi daha sonraki yıllarda 1 mm‟lik damarların anastomozuna olanak sağlamıĢtır. Temeli Payr‟ın çalıĢmasına dayanan bu düzeneklerde tek bir sisteme bağlı, birbirlerine bakan
29 yüzlerinde iğneler olan kelepçelerin içinden her iki damar da geçirilerek kelepçelere takılır. (ġekil 18) Daha sonra sistem kapatılarak kelepçeler birbirine yaklaĢır ve iğneler karĢı kelepçelerdeki boĢluklara yerleĢerek anastomoz sağlanmıĢ olur. Yöntem kolay görünmekle birlikte baĢlangıçta standart anastomoz kadar sürdüğü ve belirli bir öğrenme eğrisinin olduğu belirtilmektedir. Günümüzde birçok klinikte doppler probu içeren formu sıklıkla venöz anastomozlarda kullanılmakla birlikte iyi bir asistans gereksinimi ve arterler için kullanıĢlı olmaması tekniği yine de standart anastomozun gölgesinde bırakmaktadır.
3.4.2.8.3 Doku Tutkalı ve Lazerle Damar Anastomozları:
Tutkallar günümüzde, fistül onarımı, hemostaz yapmak, sinir onarımı ve yaraları kapatmak gibi nedenlerle sıklıkla kullanılmaktadır. Damar anastomozunda kullanım amacı ise lümendeki sütürü azaltmak ve intimal hasarı azaltmak amaçlıdır. Tutkalla anastomozdaki amaç çok seyrek atılmıĢ dikiĢler ile uç-uca getirilmiĢ damar uçlarının birarada durmasını kolaylaĢtırmak ve yapıĢmasını sağlamak esasında dayanmaktadır. Yalnız daha önceki çalıĢmalar da yakın zamandaki çalıĢmalarda henüz istenilen baĢarı elde edilememiĢtir. Endotelizasyonun gecikmesi media tabakasında nekroza yol açmakta; hatta damarın içine tutkal kaçması ani tromboza sebep olabilmektedir (68). Ancak sinir koaptasyonunda; özellikle de sinir greftlemelerinde fasiküllerin birleĢiminde baĢarılı bulunmuĢtur.
Cerrahi amaçlı olarak fibrin ve siyanoakrilat yapıĢtırıcılar kullanılmaktadır. Fibrin yapıĢtırıcılarda çok nadir kan ürünü olması nedeniyle hastalık taĢıma riski olmasına rağmen asıl kullanımının yaygın olmamasının nedeni oldukça pahalı ürünler olmasıdır.
Siyanoakrilat kullanımı fibrin kullanımına göre oldukça nadirdir. Bunun sebebi siyanoakrilatın vasküler duvara oldukça toksik olmasıdır. Damar duvarını inceltip anevrizmalara neden olabilmektedir.
Lazerin plastik cerrahide kullanımının yaygınlaĢması sonrası deneysel mikrocerrahi çalıĢmalarında anastomoz tekniğinde kullanılmaya da baĢlanmıĢtır. 1979 yılında ilk olarak Jain tarafından YAG lazer kullanarak deneysel damar anastomozu yapılabildiği gösterilmiĢtir (69). Bu teknikte tutturucu seyrek dikiĢlerle birbirine ağızlaĢtırılan damarların dikiĢler arasında kalan kısımlara lazer uygulanmıĢ,
30 tutkal benzeri mekanizmayla anastomoz sağlanmıĢtır. Tam mekanizması bilinmemekle birlikte yüksek ısı nedeniyle birbirine temas eden damarlardaki kollajenlerin sıcaktan eriyerek birbirine yapıĢtığı düĢünülmektedir. Brian Cooley‟in bu mekanizmayı düĢünerek yaptığı çalıĢmada lazerle yapılan anastomozlar ile bipolar koter ile yapılan anastomozlar arasında baĢarı açısından anlamlı bir fark olmadığı bildirilmiĢtir (70). Gerçek mekanizma ne olursa olsun psödoanevrizma oranları standart tekniğe göre yüksektir (71).
3.5 Sıçanda Deneysel Femoral Arter ve Ven Modeli
Sıçanda femoral damarları inguinal ligamanın altından geçtikten sonra bacağın iç yüzünden ilerleyerek adduktor brevis ile kaudo-femoral arasından geçip popliteal fossaya ulaĢır ve popliteal arter adını alarak diz altına doğru devam eder. Seyri boyunca mikrocerrahi araĢtırmalarında kullanılmaya uygun önemli bazı dallar verir. Yüzeyel sirkumfleks iliak arter femoral arterin inguinal ligaman altından çıktıktan sonra ilk verdiği daldır. Bu dal iliak kas üzerinde fasya planının hemen altında ilerledikten sonra iliopsoas ve kuadriseps femoris kaslarına besleyici dallar verir. Daha distaldeki dallardan yüzeyel epigastrik arter kasık ve karın fleplerini, musküler dal en sık kullanılan kas fleplerinden biri olan grasilisisi kanlandırdığı için önemlidir. Bunlardan baĢka bazı kaynaklarda farklı adlandırılmakla birlikte arteria profunda femoris femoralden çıkıp derin plana inen önemli bir yan daldır. Mikrocerrahi çalıĢma iprogramlarında sıklıkla kaza ile yaralandığı için “Murphy dalı” olarak adlandırılan profunda femoris dalı femoral bölge kasları ve femurun endosteal dolaĢımında rol oynayan önemli bir damardır.Femoral arter, genu suprema ve superfisiyel epigastrik dalını verdikten sonra biri derin diğeri yüzeyel planda devam eden iki dal vererek sonlanır. Femoral arterin, yüzeyel olarak aĢağı kadar izlenebilen dalı safen arter, adduktor kanaldan derine giden dalı ise popliteal arter olarak isimlendirilir. Tibia medialinden aĢağı inerken, safen arter, medial tarsal dal ve komünikan dalları verir ve ayrıca medial malleol üzerinde üç dala daha ayrılarak ayağın hem plantar hem de dorsal yüzünü besler. Bu bölgedeki damar anatomisi değiĢkenlik gösterdiği için çeĢitli yayınlarda farklı tanımlarla karĢılaĢılabilmektedir. Bununla birlikte diz eklemi diz altı kas ve kemiklerinin ve bacak arası derisinin dolaĢımı popliteal arterin verdiği en büyük dallar olan superior musküler arter (bazı
31 yayınlarda kaudal femoral arter), superfisiyel sural arter, ortak sural arter dıĢında lateral, medial, superior ve inferior geniküler dallardan gelen kan ile beslenir. Bu dallar diz eklemi, biseps femoris, semitendinosus, gastroknemius ve soleus kasları ve fibula kemiklerine dolaĢım sağlayan yoğun bir damarsal ağ oluĢtururlar. Popliteal arter yaklaĢık 1 cm uzunluğundadır ve yukarıda sayılan dalları verdikten sonra anterior ve posterior tibial arterlere ayrılarak sonlanır. Posterior tibial arter diz altı bölgesi kasları ve bilek eklemini kanlandırıp anterior tibial rekürran, peroneal ve musküler dalları vererek ayak sırtına iner ve popliteal arterin büyük dalı olan yüzeyel sural arter ile birlikte dorsalis pedis ile dorsal metakarpal arterleri oluĢturur. Plantar metatarsal arterler ise safen arterin devamı olan arktan çıkar.
Venöz sistem çok büyük oranda arteryel sisteme koĢut bir anatomi sergiler. Arterlerin yanında seyreden konkomitan venler kural olarak aynı isimlerle adlandırılırlar.
32
4. GEREÇ ve YÖNTEM 4.1 Etik Kurul Onayı
AraĢtırma, Ege Üniversitesi Tıp Fakültesi Yerel Hayvan ve Klinik alıĢmalar Etik Kurulu‟ndan onay alındıktan (2016-056 Sayılı 27/07/2016 tarihli) sonra Ege Üniversitesi Deney Hayvanları Uygulamaları ve AraĢtırma Merkezi‟nde yapılmıĢtır.
4.2 Deney Hayvanları ve Deneyin Yapıldığı Ortam
AraĢtırmanın her evresi Ege Üniversitesi Deney Hayvanları Uygulamaları ve AraĢtırma Merkezi‟nde gerçekleĢtirilmiĢtir. alıĢma süresince 22 adet ortalama 250-300 gram ağırlığında erkek Wistar Albino cinsi sıçan kullanıldı. Sıçanlar kafeslerde tekli olarak barındırıldı. Oda sıcaklığı 24±1 0C‟de tutuldu. Deney süresince uygun Ģekilde ıĢık almaları sağlanan bir ortamda 12 saat aydınlık/karanlık siklusu içinde ve hergün temizlenen uygun kafeslerde barındırıldı. Yem ve suları ad libitum olarak verildi, altlık olarak talaĢ kullanıldı. alıĢmadan önceki son 12 saatte sadece beslenme kesildi. AraĢtırmacılar laboratuvarı her gün ve günün her saati kullanabildiğinden kontrol ve bakımları düzenli ve aralıksız olarak yapıldı. Anestezi için intramusküler 50 mg/kg Ketamine (Ketalar, Pfizer Warner Lambert, Türkiye) ve analjezi ve sedasyon için 15 mg/kg Xylasine (Alfazyne, Alfasan International B.V. Hollanda) kombine olarak kullanıldı. Tüm cerrahi iĢlemler tek cerrah tarafından gerçekleĢtirildi.
4.3 Kullanılan Araç-Gereç ve Ġlaçlar
-
Markır-
Enjektör (1, 2, 5 ve 20 ml)-
Kâğıt ve Keten Plaster-
Batikon-
11 ve 15 numara bisturi-
Adson Brown ve DeBakey penset33
-
Portegü-
Mikromakas-
Mikropenset-
Damar dilatatörü-
10/0 Etilon dikiĢ-
Acland Aproksimatör Klempi-
Heparin-
Steril gazlı bez-
Serum seti-
Lastik-
Ġğne-
Soğuk Santrifüj (Hettich Universal 16 R)-
Homojenizatör (Braun Biotech International Potter S)-
pH metre (ĠnoLab WTW)-
Su banyosu (Memmert)-
Hassas Terazi (Scaltec SBC 31)-
Tartı (Chyo MK-200 B)-
Derin dondurucu (Sanyo ultra low)-
Buzdolabı (Vestel S4350)-
Manyetik karıĢtırıcı (Heideolph)-
Mikroplate okuyucu (Termo)-
Otomatik pipetler-
Yüksek devirde santrifüje ve ısıya dayanıklı 15 ml‟lik koreks tüpler-
Ksilol (Merck)-
Parafin (Surgipath 1F-200, Mavi boncuk)-
Hematoksilen solüsyonu (Merck)-
Mercuric oksit (Merck)-
HCl (Merck)34
-
Zeiss Cerrahi Mikroskop-
IĢık Mikroskobu (Olympus BX-51)-
Dijital fotoğraf makinesi (Canon EOS 600D)-
Iphone 5S cep telefonu-
Etanol (Merck)-
Eozin-
Ketamin HCl35 ġekil 20 Deneyde Kullanılan Cerrahi Aletler; soldan sağa üst sıra: 1-düz klemp, 2- portegü, 3- Adson penset, 4- Gillies penset, 5- Howard elevatör, alt sıra: 1- Mayo makas, 2- Metzenbaum makas 3- Disseksiyon makası, 4- Iris makas, 5- Bisturi sapı
ġekil 21 Mikrocerrahi aletler; soldan sağa: 1- Mikromakas 2- Saatçi penseti, 3 MĠkropenset, 4- Hassas moskito, 5- Siyah eğri pens, 6- Mikroportegü
36
4.4. Deney Grupları
4.4.1. Deney (Amniyon zarı) Grubu (n=11)
ġekil 22 Sol femoral bölgenin traĢlandıktan sonraki görüntüsü. Ġnsizyon hattı femoral damarların uzanımına dik olarak planlandı.
Genel anestezi altında sol femoral bölge traĢlandıktan sonra batikon ile boyanarak femoral arter-ven-sinir paketine dik olacak Ģekilde deri insizyonu yapıldı
(ġekil 22).
Yağ yastıkçığı (fat pad) disseksiyonla serbestlenerek ekarte edildi. Bu aĢamadan sonraki iĢlemler operasyon mikroskobu altında uygulandı. Femoral arter ve ven, inguinal ligamandan itibaren superfisyal epigastrık pediküle kadar serbestlenerek verdikleri dallar koterize edildi. Arter ve ven birbirinden ayrılarak serbestlendi.
Femoral arter Murphy dalı koterize edilerek tam serbestlenme sağlandı. Zemine arkaplan fon yerleĢtirilerek arter zeminden ayrıldı. 1x1 cm boyutlarında amniyon zarı yama olarak kesilerek hazırlandı. Acland aproksimatörü yerleĢtirilerek damar keskin bir Ģekilde tam kat olarak kesildi. Damarlar heparinli solüsyon ile yıkanarak içinde kalan kanlardan temizlendi. Yeterli adventisektomi yapılarak damar uçları dilate edildi. Bu andan itibaren süre takibi baĢlatıldı. 0-120 ve 240 derece noktalarına 10-0 etilon dikiĢ konularak damar uçları birbirlerine ağızlaĢtırıldı. (ġekil 23)
37 ġekil 23 0-120 ve 240 derece noktalarına 10-0 etilon dikiĢ konularak damar uçları birbirlerine ağızlaĢtırıldı.
Hazırlanan amniyotik membranın kaygan yüzü (fetal yüzü) anastomoz hattına temas edecek Ģekilde rulo olarak anastomoz hattının etrafına sarıldı (ġekil 24).
ġekil 24 Femoral arterin etrafına amniyon zarı rulo Ģeklinde sarıldı.
Damar lidokainli solüsyon ile yıkandı. Klempler açılarak yağ yastıkçığı damarın üzerine bastırıldı. 30 dakika sonra anastomoz milking testi ile mikroskop altında kontrol edildi. (ġekil 25) Daha sonra inguinal bölge insizyonu 4-0 Ethilon ile çift kat kontinü olarak dikildi (ġekil 26).
38 ġekil 25 Amniyotik membran sarıldıktan sonra 30.dk görüntüsünde anastomozda kaçak yok ve damar patensi mevcut.
ġekil 26 Ġnguinal bölge insizyonu 4-0 Ethilon ile çift kat dikildi
Ġnsizyon bölgelerine batikon sürülerek iĢlemin bu aĢaması sonlandırıldı. Denekler, tekli kafeslerine aktarıldı ve anesteziden uyanmaları beklendi. 21. günde genel anestezi intrakardiyak opak madde verilerek ratlara dinamik anjiografi yapıldı. Ratlar ex olmadan eski insizyon bölgesinden girilerek uzamıĢ femoral arter ve ven eksplore edildi. Anastomoz hattını içeren femoral arter ve ven bir arada olacak Ģekilde histolojik inceleme için örneklendi. Biopsi sonrasında ratların hepsinin ex halinde olduğu gözlendi.
4.4.2. Kontrol Grubu
Genel anestezi altında sol femoral bölge (n=11) traĢlandıktan sonra batikon ile boyanarak femoral arter-ven-sinir paketine dik olacak Ģekilde deri insizyonu yapıldı. Yağ yastıkçığı (fat pad) disseksiyonla serbestlenerek ekarte edildi. Bu
39 aĢamadan sonraki iĢlemler operasyon mikroskobu altında uygulandı. Femoral arter ve ven, inguinal ligamandan itibaren superfisyal epigastrik pediküle kadar serbestlenerek verdikleri dallar koterize edildi. Arter ve ven birbirinden ayrılarak serbestlendi.
Femoral arter Murphy dalı koterize edilerek tam serbestlenme sağlandı. Zemine arkaplan fon yerleĢtirilerek arter zeminden ayrıldı. Acland aproksimatörü yerleĢtirilerek damar keskin bir Ģekilde tam kat olarak kesildi. Damarlar heparinli solüsyon ile yıkanarak içinde kalan kanlardan temizlendi. Yeterli adventisektomi yapılarak damar uçları dilate edildi. Bu andan itibaren süre takibi baĢlatıldı. 0-120 derece noktalarına 10-0 etilon dikiĢ konularak damar uçları birbirlerine ağızlaĢtırıldı. nce ön duvar ardından arka duvar tek tek atılan 8 ya da 9 dikiĢle anastomoze edildi
(ġekil 27).
Damar lidokainli solüsyon ile yıkandı. Klempler açılarak yağ yastıkçığı damarın üzerine bastırıldı. 30 dakika sonra anastomoz milking testi ile mikroskop altında kontrol edildi. Ġnguinal bölge insizyonu 4-0 Ethilon ile çift kat dikildi.
ġekil 27 Femoral arterin konvansiyonel teknikle anastomozu
Ġnsizyon bölgelerine batikon sürülerek iĢlemin bu aĢaması sonlandırıldı. Denekler, tekli kafeslerine aktarıldı ve anesteziden uyanmaları beklendi. 21. günde genel anestezi altında eski insizyon bölgesinden girilerek uzamıĢ femoral arter ve ven eksplore edildi. Mikroskop altında milking testi yapılarak anastomoz patens kontrolü yapıldı. Anastomoz hattını içeren femoral arter ve ven bir arada olacak