T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
TÜRKĠYE’DE YETĠġTĠRĠLEN BAZI KOYUN IRKLARINDA MHC (MAJOR
HISTOCOMPATIBILITY COMPLEX) GEN BÖLGESĠNDE GENETĠK VARYASYONUN
BELĠRLENMESĠ Fatma İLHAN
DOKTORA TEZĠ Zootekni Anabilim Dalı
Mart-2015 KONYA Her Hakkı Saklıdır
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Fatma İLHAN 23/03/2015
ÖZET
DOKTORA TEZĠ
TÜRKĠYE’DE YETĠġTĠRĠLEN BAZI KOYUN IRKLARINDA MHC (MAJOR HISTOCOMPATIBILITY COMPLEX) GEN BÖLGESĠNDE
GENETĠK VARYASYONUN BELĠRLENMESĠ
Fatma ĠLHAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Zootekni Anabilim Dalı
DanıĢman: Doç. Dr. Ġsmail KESKĠN 2015, 75 Sayfa
Jüri
Doç. Dr. Ġsmail KESKĠN Prof. Dr. Mehmet Ali YILDIZ
Prof. Dr. Birol DAĞ Doç. Dr. Fulya ÖZDĠL
Yrd. Doç. Dr. Abdurrahman TOZLUCA
Koyunlarda Major Histocompatibility Complex genleri (Ovar-MHC) diğer evcil hayvanlara oranla daha az çalışılmıştır. Ancak MHC‟nin sınıf 1, sınıf 2 ve sınıf 3 bölgelerinden oluşan temel yapısı diğer memelilerle yüksek oranda benzerlik göstermektedir. Bu çalışmada Türkiye‟de yetiştirilen sekiz koyun ırkının (Akkaraman, Dağlıç, İvesi, Sakız, Kıvırcık, Karayaka, Malya ve Morkaraman) Ovar- MHC sınıf 2 genlerinden DRB1 ve DRB3 gen bölgeleri, polimeraz zincir reaksiyonu (PCR) ile çoğaltılmıştır. PCR ürünleri DRB1 gen bölgesinde 5 restriksiyon enzimi (NciI, SacI, SacII Hin1I ve DdeI) ile ve DRB3 gen bölgesinde ise 2 restriksiyon enzimi (NdeII ve BsaI) ile kesilmiştir. DRB1 gen bölgesinin NciI, SacI,
SacII, Hin1I enzimleri ile kesimi sonucu 3 genotip ve iki allel belirlenmiştir. DRB3 gen bölgesinde NciI, SacI, SacII ve Hin1I enzimleri ile kesim sonucu yaygın bulunan allel frekansları sırasıyla 0.69,0.65,0.91
ve 0.57 bulunmuştur. DRB1 gen bölgesinin DdeI restriksiyon enzimi ile kesimi sonucunda 4 genotip ve 3 allel belirlenmiş ve allel frekansları 0.62, 0.28 ve 0.10 olarak hesaplanmıştır DRB3 gen bölgesinin NdeII restriksiyon enzimi ile kesimi sonucunda 3 genotip ve 2 allel; BsaI restriksiyon enzimi ile kesimi sonucunda 2 genotip ve 2 allel belirlenmiştir. Her iki enzim için yaygın bulunan allel frekansları ise sırasıyla 0.72 ve 0.96 olarak tespit edilmiştir. Bu tez çalışmasında Türkiye‟deki yerli koyun ırklarının MHC DRB1 ve DRB3 genlerinin ekzon 2 bölgesindeki genetik profili ortaya konmuş ve yerli koyun ırkları MHC genleri bakımından sınıflandırılmıştır.
Anahtar Kelimeler: MHC (Major Histocompatibility Complex), Türk koyun ırkı, ovar- DRB1, Ovar- DRB2
ABSTRACT
Ph.D THESIS
THE IDENTIFICATION OF GENETIC VARIATION IN MHC (MAJOR HISTOCOMPATIBILITY COMPLEX) GENE REGION IN SOME TURKISH
SHEEP BREEDS Fatma ĠLHAN
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF DOCTOR OF ANIMAL SCIENCE Advisor: Assoc.Prof.Dr. Ġsmail KESKĠN
2015, 75 Pages Jury
Assoc. Prof. Dr. Ġsmail KESKĠN Prof. Dr. Mehmet Ali YILDIZ
Prof. Dr. Birol DAĞ Assoc. Prof. Dr. Fulya ÖZDĠL Assist. Prof. Dr. Abdurrahman TOZLUCA
The major histocompatibility complex (MHC) in sheep, Ovar-Mhc, is poorly characterised, when compared to other domestic animals. However, its basic structure is similar to other mammals, comprising class I, II and III regions. In this study, the Ovine MHC class II DRB1 and DRB3 genes were amplified by Polymerase Chain Reaction (PCR) in eight sheep breeds (White Karaman, Dağlıç, Awassi, Sakız, Kıvırcık, Karayaka, Malya, Morkaraman) that are reared in Turkey. Informative Restriction Fragment Length Polymorphism (RFLP)‟s were obtained with five restriction enzymes (NciI, SacI, SacII
Hin1I and DdeI) for DRB1 gene and with two restriction enzymes (NdeII and BsaI) for DRB3 gene. The
digestion of exon 2 of DRB1 gene with NciI, SacI, SacII, Hin1I each resulted 3 genotypes, and two alleles viz., a and b with frequency range of 0.69 and 0.31; 0.65 and 0.35; 0.91 and 0.09; 0.57 and 0.43, respectively. The digestion of exon 2 of DRB1 gene with DdeI resulted 4 genotypes, and 3 alleles viz., a, b and c with frequency range 0.62, 0.28 and 0.10 respectively. On the oher hand the digestion of exon 2 of DRB3 gene with NdeII, BsaI each resulted 3 genotypes, and two alleles viz., a and b with frequency range 0.72 and 0.28; 0.96 and 0.04 respectively. This study presents the genetic profile of MHC gene region of exon 2 of DRB1 and DRB3 genes in native sheep breeds in Turkey.
Keywords: MHC (Major Histocompatibility Complex), Restriction Fragment Length Polymorphism (RFLP), Native Turkish Sheep
ÖNSÖZ
Her konuda bilgi, öneri ve tecrübelerinden faydalandığım danışman hocalarım Sayın Yrd. Doç. Dr. Abdurrahan TOZLUCA ve Doç. Dr. İsmail KESKİN‟e, tezimin laboratuar ve yazım aşamasında her türlü desteğini gördüğüm Sayın hocam Doç. Dr. Fulya ÖZDİL‟e, kan örneklerinin temininde yardımcı olan Sayın Prof. Dr. Mehmet Ali YILDIZ hocama teşekkür ederim.
Çalışmama ekonomik desteği sağlayan S.Ü. Bilimsel Araştırma Projeleri Koordinatörlüğüne ve çalışmamı gerçekleştirdiğim S.Ü. Ziraat Fakültesi Hayvan Biyoteknolojisi laboratuarının kurulması ve geliştirilmesinde büyük emeği olan Sayın Prof. Dr. Saim BOZTEPE, Doç. Dr. Fulya ÖZDİL ve Dr. İbrahim AYTEKİN‟e teşekkürü bir borç bilirim.
Son olarak bu günlere gelmemde önemli payları olan annem ve babama, doktora çalışmam sırasında sabrını ve desteğini esirgemeyen eşim Uğur İLHAN‟a, yaşama sevincim canım kızım Melis Berra‟ya ve bana her zaman manevi olarak destek olan arkadaşım Dr. Rabia GÖÇMEN‟e teşekkür ediyorum.
Fatma İLHAN KONYA-2015
ĠÇĠNDEKĠLER ÖZET ... i ABSTRACT ... ii ÖNSÖZ ... iii ĠÇĠNDEKĠLER ... iv SĠMGELER VE KISALTMALAR ... vi 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 3 2.1. İmmün Sistem ... 3
2.1.1. Major histocompatibility complex (MHC)‟nin yapısı ... 7
2.2.1. Sınıf 1 genleri ve molekülleri ... 8
2.2.2. Sınıf 2 genleri ve molekülleri ... 10
2.2.3. Sınıf 3 genleri ve molekülleri ... 13
2.3. MHC genlerinin kalıtımı ve allellerin adlandırılması ... 13
2.4. MHC gen ürünlerinin işlevleri ... 14
2.4. Moleküler Genetik Tanımlama Yöntemleri ... 18
2.4.1. PCR (Polimeraz zincir reaksiyonu) ... 18
2.4.2. RAPD (Rasgele Çoğaltılmış Polimorfik DNA Yöntemi) ... 19
2.4.3. RFLP (Kesilen Parça Uzunluk Polimorfizmi) ... 20
2.4.4. AFLP (Çoğaltılmış Parça Uzunluk Polimorfizmi) ... 21
2.4.5. Mikrosatelitler ... 22
2.4.6. SSCP (Tek Zincir Konformasyon Polimorfizmi) ... 22
2.4.7. SNP ler (Tek Nükleotid Polimorfizmleri) ... 23
2.5. Türkiye‟de yerli koyun ırkları ile ilgili yapılmış tez çalışmaları ... 24
2.6. MHC ile ilgili yapılmış çalışmalar ... 29
2.6.1. DRB1 gen bölgesi ... 29
2.6.2. DRB3 gen bölgesi ... 32
2.6.3. Diğer MHC gen bölgeleri ... 35
3. MATERYAL VE YÖNTEM ... 37
3.1. Materyal ... 37
3.1.1. Canlı materyal ve örnekleme ... 37
3.1.2. Araç ve gereçler ... 37
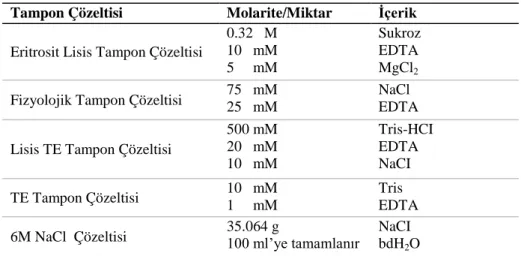
3.1.3. Tampon çözeltiler ... 38
3.2.Yöntem ... 38
3.2.1.Kan Örneklerinin alınması ... 38
3.2.2.Genomik DNA izolasyonu ... 39
3.2.3. Genomik DNA miktarının hesaplanması ... 40
3.2.4. Çalışılan OLA-DRB Bölgelerinin PCR ile Çoğaltılması ve Restriksiyon Enzimleri ile Kesimi ... 41
3.2.5. Genetik Analiz ... 43
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 44
4.1. DRB1 ekson 2 gen bölgesi ... 44
4.1.1. NciI restriksiyon enzimi ile kesim ... 44
4.1.2. SacI restriksiyon enzimi ile kesim ... 46
4.1.3. SacII restriksiyon enzimi ile kesim ... 47
4.1.4. Hin1I restriksiyon enzimi ile kesim ... 49
4.1.5. DdeI restriksiyon enzimi ile kesim ... 51
4.2. DRB3 ekson 2 gen bölgesi ... 52
4.2.1. NdeII restriksiyon enzimi ile kesim ... 53
4.2.2. BsaI restriksiyon enzimi ile kesim ... 55
5. SONUÇLAR VE ÖNERĠLER ... 57
KAYNAKLAR ... 61
SĠMGELER VE KISALTMALAR
MHC Major Histocompatibility Complex
QTL Kantitatif karakter lokusu
RFLP Restriksiyon Fragman Uzunluk Polimorfizmi
SNP Tek Zincir Konformasyon Polimorfizmi
SSCP Basit Tekrar Dizileri
AFLP Çoğaltılmış Fragman Uzunluk Polimorfizmi
RAPD Rastgele Çoğaltılmış Polimorfik DNA
PCR Polimeraz zincir reaksiyonu
DNA Deoksiribonükleik asit
UV Ultraviyole μl Mikro litre ml Mili litre o C Santigrat derece M Molar mM Mili molar nm Nanometre OD Optik Densite dNTPs Deoksiribonükleozid trifosfat A Adenin nükleotid T Timin nükleotid G Guanin nükleotid C Sitozin nükleotid bp Baz çifti dk Dakika sn Saniye MgCl2 Magnezyum klorür TE Tris-EDTA EDTA Ethylendinitrilotetraaceticacid TBE Tris-Borate-EDTA
U Ünite (1 μg λ DNA kesimi için gerekli enzim miktarı)
χ² Kikare Testi
KM Klinik Mastitis
HLA Human Leukocyte Antigen
OLA Ovine Leukocyte Antigen
BoLA Bovine Leukocyte Antigen
SCC Somatic hücre sayısı
TCR T hücresi antijen reseptörü
CD Küme belirleme
NK Natural Killer
K Killer
Ig İmmünoglobulin
1. GĠRĠġ
Türkiye‟de 2013 yılı Türkiye İstatistik Kurumu verilerine göre 14.415.257 baş sığır, 29.284.247 baş koyun ve 9.225.548 baş keçi mevcudu vardır. Bu hayvan varlığı ile Türkiye Dünyanın sayılı ülkeleri arasında yer almasına rağmen hayvansal ürünler bakımından hala gerilerde yer almaktadır. Fert başına tüketilen et, süt ve yumurta gibi hayvansal ürün miktarları da yeterli düzeyde değildir (Öztürk, 2000). Bu hayvan varlığı içerisinde büyük bir yer tutan koyun varlığımız ne yazık ki her geçen gün azalmakta, verim yönünden de ileri bir adım atılamamaktadır. Türkiye‟de koyunculuğun geri kalmasında birçok faktör etkilidir. Bunların en önemlilerinden bir tanesi de ıslah faaliyetlerinin yetersizliğidir. Islah faaliyetlerinin yürütülebilmesi için öncelikle Türkiye koyun varlığının genetik yapısını bilinmesi gerekmektedir. Bu amaçla yapılacak genetik araştırmalar önem kazanmaktadır.
Hayvancılıkta verimin düşmesine neden olan en önemli faktör hastalıklardır. Hastalıklar nedeniyle ölümler veya verimde düşmeler işletmeleri önemli ölçüde ekonomik kayba uğratmaktadır. Bu nedenle hastalıkların mümkün olduğunca azaltılması ve minimum düzeye getirilmesi gerekmektedir. Hayvanlar hastalandıktan sonra alınacak tedbirler hem zaman kaybı hem de masraflı olacağından hayvanların genetik olarak bağışıklık sistemlerinin gelişmiş olması istenmektedir. Kısacası bir canlının yaşamını en iyi şekilde sürdürebilmesi için öncelikle hastalıklara karşı dirençli olması gerekmektedir. Bu nedenle immün sistem üzerinde önemli rol oynayan MHC (Major Histocompatibility Complex) genleri hayvancılıkta üzerinde durulması gereken genler arasında yer almaktadır.
Bağışıklık sisteminin kendinden olanı ve olmayanı tanıması için gerekli olan “doku antijenlerini” kodlayan gen bölgesi Büyük Doku Uyum Kompleksi Major Histocompatibility Complex olarak adlandırılmaktadır (Roit ve Delves, 2001). MHC immünolojik ve immünolojik olmayan fonksiyonları olan genlerin bulunduğu bir bölge olup bütün omurgalılarda bulunmaktadır (Tizard, 2004). Evcil ve çiftlik hayvanları arasında sığırda MHC ile ilgili çok sayıda araştırma yapılmıştır (Schmutz ve ark.,1992; Dietz ve ark., 1997; Starkenburg ve ark., 1997; Sharif ve ark., 1998, 2000; Maillard ve ark., 1999; Gilliespie ve ark., 1999; Juliarena ve ark., 2008; Pashmi ve ark., 2009; Yoshida ve ark., 2012;). Koyunlarda ise MHC diğer evcil hayvanlara göre daha az karakterize edilmiştir (Dukkupati ve ark., 2006). Bu nedenle, Türkiye‟deki hayvan populasyonlarında öncelikle MHC genleri bakımından genotiplerin belirlenmesi önem arz etmektedir. Daha sonraki aşamada belirlenen genotipler ile hayvanların bağışıklık özellikleri arasında ilişki kurmak ve bu şekilde seleksiyon amacıyla bu genotiplerin kullanılması söz konusu olabilecektir. Bu
amaçla bu tez çalışması Türkiye‟deki koyun populasyonlarında MHC genleri bakımından genotiplerin ortaya konması açısından öncü bir çalışma olma niteliği taşımaktadır. Bu tez çalışmasında Türkiyede yetiştirilen 8 koyun ırkının MHC DRB1 ve DRB3 gen bölgelerinin polimorfizmi PCR-RFLP tekniği ile araştırılmıştır. DRB1 gen bölgesi için 5 restriksiyon enzimi, DRB3 gen bölgesi için 2 restriksiyon enzimi kullanılarak ırkların genotip ve allel frekansları hesaplanmıştır.
2. KAYNAK ARAġTIRMASI
2.1. Ġmmün Sistem
Canlıların doku ve organları, bütün yabancı organizma ve toksinlere karşı direnme yeteneğindedir. Bazı mikroorganizmalara ise hayat boyu yenilmeden kalırlar ki bu yeteneğe bağışıklık (immünite) denir. İmmün sistem bireyi enfeksiyon ve dış etkenlerden korumak üzere gelişmiştir. Latince „immunis‟ (vergi vermeyen) sözcüğünden türemiştir (Tekin, 2004).
Organizma için yabancı olan ve immun sistemi uyaran elemanlar „antijen‟ adını alırlar. Proteinler, karbonhidratlar, nükleik asitler antijenik moleküllerdir. Ayrıca yaşlı eritrositler, polen taneleri, bakteri toksinleri, bakteri ve virüslerin kendileri antijen niteliğinde birçok kimyasal bileşik içerirler (Başaran, 2002, Roitt ve ark., 2001). Ağız, burun ve deri gibi organlar bu antijenlerin girebileceği noktalardır. Bu bölgelerde antibakteriyal maddeler salgılanarak korunma sağlanmaktadır. Eğer mikroorganizma vücuda girerse çeşitli seviyelerde immün sistem ile karşılaşacaktır.
Bağışıklık sisteminin organları lenfoid dokulu organlardır. Bu organlar, birincil lenfoid organlar ve ikincil lenfoid organlar olarak iki grup halinde incelenseler de birbirleriyle sürekli ilişki halindedirler. Birincil lenfoid organlarda, lenfositlerin üretim işleri yapılırken; ikincil organlarda lenfositler ilk defa antijenlerle yüzleşirler (Erganiş ve İstanbulluoğlu, 1993).
Birincil Lenfoid organlar: Lenfositlerin üretimi ve farklılaşması bu organlarda düzenlenir (Tizard, 2004).
Timus: Memelilerde timus toraksta yerleşmiş iki loblu, kalbin ve büyük kan damarlarının üzerini örten, fibroz ve yağlı bir dokudur (Erganiş ve İstanbulluoğlu, 1993). Antijene bağımlı olmaksızın timusta türeyen T lenfositlerin oluşmasını ve olgunlaşmasını, timus hormonları salgılayarak immun fonksiyonları düzenler ve oto antijenlere karşı lenfositleri uyararak otoimmun hastalıklardan koruyucu etki sağlar. Timus yokluğunda T lenfositler oluşmayarak Di George sendromu denilen ağır immun yetmezlikler ortaya çıkabilir (Baban ve Siyahhan, 1998).
Kemik iliği: Yetişkin kemik iliği, B lenfosit oluşma bölgesi bulundurmaktadır. Ayrıca antikor üreten plazma hücreleri ve T lenfositlerini de barındırdığından önemli bir birincil lenfoid organdır (Erganiş ve İstanbulluoğlu, 1993).
Ġkincil Lenfoid organlar: Lenfositler birincil lenfoid organlarda olgunlaştıktan sonra ikincil lenfoid organlara göç ederler (Erganiş ve İstanbulluoğlu, 1993).
Dalak: Karın boşluğunun sol üst tarafında bulunan ve eski kırmızı kan hücrelerinin yıkımından sorumlu bir organdır. İki pulpadan oluşmaktadır. Beyaz pulpa B ve T lenfositlerin yerleşim bölgesidir. Kırmızı pulpa, eritrosit, makrofaj ve çevrelerinde dentrik hücreleri içerir. Yaşlanmış ya da yıpranmış kan şekilli elemanları (eritrositler, lökositler, trombositler) dolaşımdan uzaklaştırır, kanı yabancı maddelerden temizler, hemoglobini bilirubine çevirir (Özbal, 1999).
Lenf düğümleri: B ve T hücrelerinin bulunduğu merkezlerdir. Lenf veya doku sıvılarında bulunan antijenlerin filtre edildiği vücudun her tarafını ağ gibi saran bir sistemin parçasıdır. Vücuda girmiş antijenlere T ve B lenfositleri tarafından bağışıklık tepkileri burada verilir (Erganiş ve İstanbulluoğlu, 1993).
İmmün Sistem Hücreleri: İmmün cevap oluşumunda ana görevi lenfositler ile makrofajlar yapar. Granülositler ise katkıda bulunurlar. Bu hücrelerin hepsi lökositler olarak bilinirler (Erganiş ve İstanbulluoğlu, 1993). Bu hücrelerin bir kısmı konağa giren antijen özelliğindeki molekülleri fagozite eder. Diğer bir kısmı, antijen uyarımı ile farklılaşarak onlara karşı immün cevap ürünleri çıkartmakta ve antijenleri yok etmektedir (Özbal, 1999).
Lenfositler: Yerleşim bölgeleri ve fonksiyonlarına göre lenfositler üç gruba ayrılmaktadır. Bunlardan ilk ikisi, yüzeylerinde antijen tanıyan reseptörleri bulunan ve immün cevap ürünlerinin yapımından sorumlu olan B ve T lenfositlerdir. T lenfositler timus kontrolünde, B lenfositler kemik iliği kontrolünde olgunlaşmaktadırlar. Üçüncü grup lenfositler ise killer (K) ve natural killer (NK) hücreleridir (Özbal, 1999).
T lenfositler, kemik iliğinde yapılırlar ve timusa geçerler. Bu hücreler gelişimleri sırasında çeşitli ve bir kısmı T hücresinin tipine özel CD antijenleri taşırlar. CD (Cluster designation=küme belirleme) terimi insan lökosit antijenine (HLA) karşı çeşitli laboratuarlarda elde edilmiş monoklonal antikorların bilgisayar analizleri sonucunda türetilmiştir. Benzer özellikteki spesifik monoklonal antikorlara belirli bir CD numarası verilir. CD moleküllerinden ayrı olarak T hücrelerinin T hücresi antijen reseptörü (TCR) adı verilen bir markeri daha vardır. T hücrelerinin yüzeyinde bulunan spesifik markerlere göre T
lenfosit türleri ayırt edilir. T4, T8 gibi. Bununla ilgili olarak farklı MHC antijenleri, farklı T
lenfositleri tarafından tanınmaktadır (Baban ve Siyahhan, 1998).
T lenfositleri; yardımcı Th, sitotoksik Tc, baskılayıcı T, bellek T, geç tip aşırı
duyarlılıkta etkili T lenfositleri gibi alt tiplere sahiptirler.
Yardımcı Th lenfositleri genellikle B lenfositlerini uyararak daha fazla sayıda antikor
yapmalarını sağlarlar. Baskılayıcı T lenfositleri çoğunlukla immün sistemin herhangi bir antijene verdiği cevabın durdurulmasında görevlidirler. Sitotoksik Tc lenfositleri makrofaj
yada B lenfositleri gibi arada herhangi bir hücre olmadan antijenlere öldürücü etki gösterirler. Geç tip aşırı duyarlılıkta etkili T lenfositler alerjenlere lenfokinler salgılayarak etkileyen lenfositlerdir. Bellek T lenfositler antijenlerin ikinci kez vücuda girmesinde kısa sürede tepkinin oluşturulmasında önemli olan hücrelerdir (Erganiş ve İstanbulluoğlu, 1993).
B lenfositlerin diğer lenfositlerden en önemli farkları, B lenfositlerin membranında immünoglobulin reseptörleri taşımalarıdır. Bu özelliklerinden yararlanılarak, immünofloresan yöntemi ile B lenfositlerin tanımı yapılmaktadır. Periferik kanda bulunan B lenfositlerin membranında çoğunlukla monomer formda IgM ve IgD olmak üzere takriben hücre başına 150000 kadar Ig reseptörü bulunmaktadır (Özbal, 1999).
Lenfoid hücreler arasında yabancı hücrelere karşı sitotoksik etki gösteren Tc
lenfositlerinden farklı K ve NK hücreleri vardır. K hücreleri, yüzeylerindeki antijenlere karşı oluşmuş kendi antikorlarıyla kaplanmış hedef hücrelerini eritirler. Yüzeylere yapışma ve fagositoz özelliklerinden yoksun olmalarıyla makrofajlardan, hücre zarında yüzeysel immünoglobulinlerin bulunmamasıyla B lenfositlerden, rozet oluşturamamalarıyla da T lenfositlerden ayrılmaktadırlar. Konakta oluşabilecek neoplastik hücreleri yok etmekle görevli olan NK hücreleri K ve Tc lenfositlerden farklı bir gruptur. Tümör hücrelerinin yanı
sıra, virüsle enfekte hücreler ve IgG1 ve IgG3 antikorlarıyla kaplı hedef hücreler üzerinde öldürücü etkisi vardır. NK hücrelerinin öldürücülük etkisi interferon bulunması halinde görülmektedir (Özbal, 1999).
Makrofajlar:
Kemik iliğinden köken alan monositler dolaşıma katılarak birkaç saat dolaşımda kaldıktan sonra bir daha geri dönmemek üzere dokulara yerleşir ve burada makrofajlara dönüşürler. Makrofajların lenfositlerden farkları antikor sentezlememeleridir. Ancak lenfokinlere benzer etkilerde bulunan monokinleri sentezlerler. En önemli görevleri ise fagositozdur (Erganiş ve İstanbulluoğlu, 1993). Makrofajların fagositozdan başka, antijeni lenfositlere sunma (tanıtma) görevleri vardır. İnsanda aktif makrofajlarda, MHC sınıf II yönetimindeki HLA-DR, HLA-DQ ve HLA-DP antijenleri oluşmaktadır. Antijenle
uyarılmış makrofajların MHC-II yönetimindeki antijenleri, B ve T lenfositlerin membranında bulunan CD4 reseptörleri ile bağlanarak lenfositler uyarılmaktadır (Özbal,
1999).
Granülositler
İçerdikleri granüllerin boyanmalarına göre nötrofil, eozinofil ve bazofil olarak gruplandırılmaktadırlar. Enfeksiyonlarda sayısal olarak artan bu hücrelerin asıl görevi mikrorganizmaları fagosite etmektir (Özbal, 1999).
Antikor ve antijenler
Antikorlar immünoglobulinler olarak bilinen proteinlerdir. Plazma proteinlerinin % 20‟sini oluştururlar (Baban ve Siyahhan, 1998). İmmünoglobulinler her biri özel fonksiyon için gelişmiş 5 ana gruptan oluşurlar. Bunlar IgG, IgM, IgA, IgD ve IgE‟dir. Bütün antikor molekülleri 2 hafif ve 2 de ağır zincir olmak üzere 4 polipeptid zincir yapısından oluşmaktadır. Farklı antikor moleküllerinde bu hafif ve ağır zincirlerin her ikisi de farklıdır (Coleman ve ark, 1989).
Bir B hücresinde 100000 kadar immünoglobulin bulunmaktadır. Bu immünoglobulin molekülleri antijenler için reseptör görevi görürler. Bir antijen ancak kendisi ile yüzeyinde en iyi uyumu gösterebilen Ig reseptörü taşıyan B lenfositi ile reaksiyona girmektedir. Bir organizma yaklaşık 107
-108 farklı antikor molekülü yapabildiğinden, B hücreleri üzerinde hemen hemen tüm antijenlere uyan bir reseptör çeşidi bulunur (Erganiş ve İstanbulluoğlu, 1993).
Canlı bir organizmaya verildiği zaman antikor oluşmasına neden olan maddeler antijen adını alır. Antijenlerin büyük bir kısmını proteinler oluşturmaktadır. Proteinlerin yanı sıra polisakkaritler, nüleik asitler ve kompleks yapılı lipitler de antijen özelliği taşırlar (Baban ve Siyahhan, 1998).
Aynı türün/ırkın bireyleri arasında bile antijen bakımından farklılıklar bulunmaktadır. Bireyler arasındaki bu antijenik farklılığına “alloantijenler” adı verilmektedir. Alloantijenler nakledilen bir organın reddedilmesine neden olduklarında “histocompatibility” antijenlerden söz edilir. Nakledilen organın hücrelerinin yüzeylerindeki alloantijenler, organın nakledildiği bireyde immün cevabın başlamasına yol açabilirler. Bu alloantijenler, MHC genlerinin ürünleri olup genomun bu bölgesinin dışında kalan kısmının tümü birçok zayıf histocompatibility antijenleri içermektedir. Bu antijenlere ise “Minor histocompatibility antijenleri” denmektedir (Baban ve Siyahhan, 1998).
2.1.1. Major histocompatibility complex (MHC)’nin yapısı
Büyük Doku Uyum Kompleksi (MHC, Major Histocompatibility Complex)‟in keşfi bilim adamlarının doku ve organ nakli çalışmaları sırasında gerçekleşmiştir. 1930‟lu yıllarda R.A. Gorer ve G.D. Snell farelerde doku nakli çalışmaları sırasında doku antijenlerinin varlığını belirlemiş ve bunların gen bölgelerine doku uyum kompleksi adını vermişlerdir (Uçar ve ark, 2001). MHC‟nin ilk bilinen rolü doku uyuşmasıdır. MHC‟nin bağışıklık sistemindeki önemi bu lokusun keşfinden ancak 20 yıl sonra ortaya çıkmıştır. Daha sonra diğer birkaç fonksiyonu daha keşfedilmiştir. MHC‟nin başlıca fonksiyonu özel antijen koruma reseptörü olan ve doku uygunluk molekülleri veya MHC molekülleri olarak bilinen glikoproteinleri kodlamaktır (Roitt ve Delves, 2001).
Son 30 yıl içerisinde MHC molekülleri kristalize edilmiş, rekombinant DNA yöntemleri kullanılarak MHC kompleksi genlerinin baz dizilimi ve bu genlerin sentezini sağladığı MHC antijenlerinin aminoasit dizileri ortaya konmuştur (Roitt ve Delves, 2001).
İnsan ve fare MHC‟ si diğer memelilere oranla daha detaylı incelenmiştir. İnsan MHC‟ si insan lökosit antijeni (Human leukocyte antigen-HLA) olarak isimlendirilmiştir. Eksprese olan HLA genlerinin % 40 civarı bağışıklık sistemi içerisinde fonksiyon yapmaktadır. MHC gen bölgesi kodlanan proteinlerin özelliklerine göre 3 farklı bölgeye ayrılmaktadır. Telomerik sınıf 1, sentromerik sınıf 2 ve sentral sınıf 3 (Klein, 1976). MHC‟nin farklı fonksiyonel rolleri olan, 3 ana bölge içeren bu genel yapısı, memeli türleri arasında homoloji göstererek, ortak nükleotid dizilimine sahip olacak şekilde korunmuştur (Amills ve ark., 1998). Ancak farklı memeli MHC‟ leri arasında bazı bölgelerin yüksek oranda homoloji göstermeleri yanında büyük farklılıkların da olduğu tespit edilmiştir (Kelley ve ark., 2005).
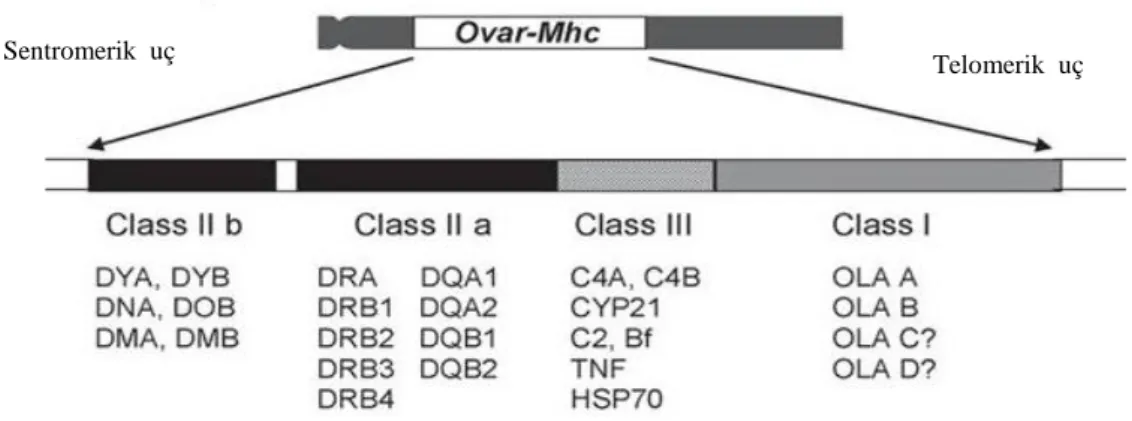
Şekil 2.1: Koyun MHC‟sinin şematik gösterimi (Dukkipati ve ark., 2006) Sentromerik uç
MHC koyunda 20. kromozomda, keçide ve sığırda ise 23. kromozom üzerinde bulunmaktadır (Bozkaya ve ark., 2007). Her tür için MHC, farklı isimlendirilmiş; koyun MHC‟si OLA (Ovine leukocyte antigen) veya ovar MHC, keçi MHC‟si CLA (caprine leukocyte antigen) ve sığır MHC‟si BOLA (bovine leukocyte antigen) olarak ifade edilmiştir. MHC ruminantlarda da diğer memelilerde olduğu gibi 3 gen bölgesinden oluşmaktadır (Dukkipati ve ark., 2006).
MHC bilinen en polimorfik gen bölgelerinden biridir. MHC gen bölgesinden kodlanan MHC sınıf 1 molekülleri, vücuttaki tüm çekirdekli hücrelerde bulunurken, sınıf 2 molekülleri ise makrofajlar ve B-lenfositler gibi bazı özel hücre gruplarında bulunmaktadır. Sınıf 3 molekülleri olarak adlandırılan diğer bir grup ise C2, C4 kompleman proteinleri, p 450 sitokrom 21-hidroksilaz, faktör B, non-MHC genlerini içeren ayrı bir kategori içinde değerlendirilmektedirler (Ikuta ve ark., 2002; Dissanayake ve ark., 2004). MHC genlerinin hastalıklar üzerindeki etkisinin T-lenfositlerin antijen tanımadaki fonksiyonları ile ilgili olduğu öngörülmektedir (Yakut, 2004).
İnsanlarda yapılan çalışmalar sonucunda bağışıklık hastalıklarının çoğunun MHC ile ilişkisi olduğu düşünülmektedir, diğer bir ifadeyle belli hastalıklar belli allelleri taşıyan bireylerde daha sık görülür. MHC‟ye bağlı hastalıklardan en önemlileri Romatoid Artrit ve İnsüline Bağımlı Diyabet hastalığıdır (Dalva, 2004). Hastalıklarla ilişkili bulunan alleller daha çok sınıf 2 genlerinde bulunur.
2.2.1. Sınıf 1 genleri ve molekülleri
Polimorfik sınıf 1 genleri, T lenfositlere peptit-antijen sunumuna aracılık etmekten sorumlu transmembran glikoproteinleri kodlarlar. Sınıf 1 genleri DNA molekülünün yaklaşık 4.5 kb‟lık bir bölümünü oluşturur ve 6 veya 8 ekzondan oluşmaktadır (Mak ve Simard, 1998). Sınıf 1 lokusu hem klasik hem de klasik olmayan genleri içerir. Klasik sınıf 1 genleri immünoglobulin gen familyasının üyeleridir. Bu familya genellikle intraseluler protein ve parazitlerden türemiş peptidlerden korunmayı içerir. Aynı zamanda doğal öldürücü (NK, natural killer) hücre ölümünden korunmak için NK ile birbirlerini etkilemek için bulunurlar (Reyburn ve ark., 1997). Klasik olmayan sınıf 1 genleri evrimsel olarak ilişkilidir ve immün cevap ile ilişkili farklı fonksiyonlara sahiptirler. İnsanlarda MHC, üç klasik (MHC A, B ve C) ve üç de klasik olmayan (MHC E, F ve G) sınıf 1 genleri
içermektedir. Ruminantlarda ise sınıf 1 bölgesi çok az çalışıldığından gen sayısı konusunda farklı görüşler bulunmaktadır. Koyunda yapılan son çalışmalarda 4 farklı polimorfik ve klasik sınıf 1 genleri olduğu bildirilmektedir (Miltiadou ve ark., 2005).
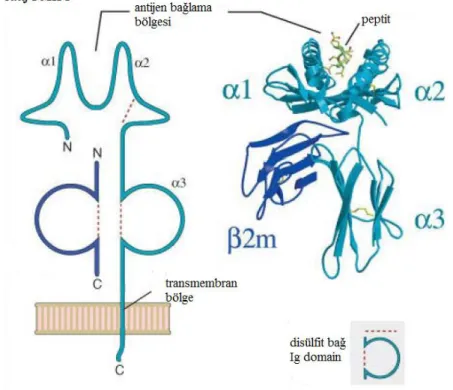
HLA sınıf 1 molekülleri, kovalent olmayan bağlarla bir arada tutulan, iki polipeptid zincirinden oluşmuş heterodimerlerdir. Bunlardan ağır olan α zinciri MHC bölgesinden kodlanır, hücre membranı boyunca ilerleyen bu molekülün amino ucu membranın dışında yer alır. Membran dışındaki α zinciri, α1, α2 ve α3 altbirimlerinden (domain) oluşmaktadır. Zincirin membranı geçen kısmını takiben sitoplazmik kısa bir uzantısı vardır. Molekülde bulunan hafif zincir ise β2 mikroglobulin MHC dışındaki polimorfik olmayan bir lokus tarafından kodlanır (Hughes ve Yeager, 1998).
Molekülün üç boyutlu yapısına bakıldığında membran dışında homoloji gösteren bölgelerin karşılıklı gelmesi ile iki çift alt birim bölgesi oluştuğu görülür; α1 ve α2 membrana en uzak, α3 ve β2 de membrana yakın bölgede karşılıklı yer alırlar (Şekil 2.2). Karşılıklı yerleşen α1 ve α2 zincirleri, antijenlere ait 8-10 amino asit büyüklüğünde peptidlerin yerleşebileceği kovuğa benzer bir yapı oluştururlar (Şekil 2.2). β2 mikroglobulin, molekülün üç boyutlu yapısının korunmasında rol almaktadır. Sınıf 1 molekül genleri, kodlama yapan 8 exon ve kodlama yapmayan 7 introndan oluşur. Polimorfik bir yapı gösteren α1 ve α2 bölgeleri, ekson 2-3 tarafından kodlanır. Altıncı kromozom üzerinde sınıf 1 molekülleri kodlayan genlerden önce sınıf 1 genleri düzenleyen genlerin kodlandığı bir bölge yer almaktadır. Bu kontrol bölgesi, farklı sınıf 1 genleri, hatta farklı aleller için de farklı olabilmektedir (Klein ve Sato, 2000).
Sınıf 1 moleküllerinin yapı-fonksiyon ilişkisi, HLA-A2 molekülünün kristal yapısının açığa çıkmasıyla daha da açıklığa kavuşmuştur. α veya ağır zincir (44-47 kD ağırlığında) ve non-kovalent bağlı hafif β2 mikroglobulin zinciri (12 kD ağırlığında) içeren bir heterodimerdir. α zincirleri MHC içerisindeki polimorfik sınıf 1 lokusu tarafından kodlanır. β2 mikroglobulin MHC dışındaki polimorfik olmayan bir lokus tarafından kodlanır (Hughes ve Yeager, 1998). 338 aminoasitten oluşan α zinciri, 3 bölgeye ayrılmaktadır; ekstrasellüler hidrofilik bölge (1-281 aminoasit), transmembran hidrofobik bölge (282-306 aminoasit), ve intrasellüler hidrofilik (307-338 aminoasit) bölgelerdir. Ekstrasellüler bölge 3 altbirime ayrılır; 1-90 aminoasitten oluşan α1, 91-180 aminoasitten oluşan α2, ve 181-271 aminoasit dizilimli α3 bölgeleridir. β2 mikroglobülin ve α3 bölgeleri, molekülün alt
bölümünü oluşturan ve immünglobilin etki alanına benzer bir β kıvrımlı yaprak yapısına sahiptir. α1 ve α2 bölgelerinin her biri 4 β iplikçiği ve bir α heliksten ibarettir ve bunlar molekülün üst kısmını oluştururlar. Bu iki etki alanının 8 β ipliği iki α heliksi destekleyen
bir platform olarak görev yapan bir β kıvrımlı yaprağı oluştururlar. Bu iki α heliks büyük bir antijenden elde edilen bir peptid fragmanı ile birleşecek, bir antijen bağlanma bölgesi olarak görev yapan oyuk bir alan oluşturur (Abbas ve ark, 1994). Sınıf 1 moleküllerinin gösterdiği polimorfizmin önemli bir kısmı bu α helikslerde ve oyuk bölgenin tabanını oluşturan β kıvrımlı yaprak platformunda oluşmaktadır. Böylece, antijen bağlama bölge alanları, bir sınıf 1 molekülünden diğerine çeşitlilik gösterir ve belirli bir sınıf 1 molekülü yalnızca sınırlı sayıdaki peptid fragmanlarını bağlayabilir. Sınıf 1 moleküllerinin antijen bağlama bölgeleri her ne kadar bağladıkları peptid fragmaları bakımından bir seçicilik gösterseler de bunlar immünoglobülünlerin çok özel olan özgünlüğü bakımından antijen bağlama bölgelerinden oldukça farklıdırlar. İki α heliksi (α1 ve α2) bağlı antijenik bölge ile birlikte sadece sınıf 1 moleküllerini taşıyan CD8T hücreleri üzerindeki T hücre reseptörü tarafından tanınan bir bağlanma meydana getirirler (Stites ve Terr, 1991).
Şekil 2.2: MHC Sınıf I molekülünün şematik gösterimi
2.2.2. Sınıf 2 genleri ve molekülleri
Sınıf 2 genleri, DNA‟molekülünün 500 kb‟lık bir kısmını oluşturmaktadır (Mak ve Simard, 1998). Sınıf 2 genleri; CD4+ deki TCR‟ye yardımcı T hücreleri, parazitlerin ve ekstraselüler proteinlerden türemiş antijenik peptitlerin sunumunda fonksiyonel olarak ayrılmış genlerin immünoglobulin süper familya üyeleridir. α ve β zincirli genler çok sıkı bir
şekilde lokalize olmuşlardır. Bu şekilleri ile iki genli duplikasyon ünitesine benzerler. Bütün setler her iki zincirde de gen içermezler çoğu pseodogendir (Tizard, 2004). MHC genleri içerisinde en polimorfik lokus sınıf 2 de bulunan DRB lokusudur. DRB genlerinin bir kısmı fonksiyonel bir kısmı fonksiyonel olmayan çoklu kopyasının bulunduğu bildirilmiştir (Andersson and Rask,1988).
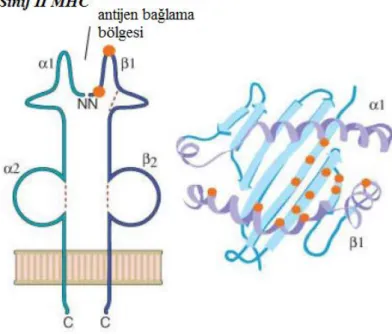
HLA sınıf 2 moleküller, kovalent olmayan bağlarla bir arada tutulan α ve β olmak üzere iki adet transmembran glikoprotein zincirinden oluşan heterodimerlerdir. Her iki zincirin de hücre zarı dışında sırasıyla C1, α2 ve β1, β2 olmak üzere 2 domainleri bulunur (Şekil 2.3). Membranın distalinde yerleşen ve polimorfik bir yapı gösteren α1 ve β1 zincirleri sınıf 1 moleküllerde olduğu gibi antijenlere ait peptidlerin yerleşebileceği kovuğa benzer bir yapı oluştururlar. Buraya yerleşenler, hücre dışından kaynaklanan (eksojen), daha büyük peptidlerdir. α1 ve α2 bölgeleri, sınıf 1 moleküllerdeki gibi Ig benzeri yapılar oluştururlar. α zinciri A, β zinciri ise B genleri tarafından kodlanır. Bu nedenle sınıf 2 bölgesinde yer alan DR, DQ ve DP bölgeleri sırasıyla DRA ve DRB, DQA ve DQB, DPA ve DPB olarak ikiye ayrılırlar. DR bölgesinde α zinciri kodlayan tek gen varken, β zinciri için 9 farklı bölge vardır. Bunların bir kısmı kodlama yapmayan genler olup; sadece DRB1, DRB3, DRB4, DRB5 kodlayıcı genlerdir ve farklı beta zincirlerini kodlarlar. DRB1, 1-18 arasında değişen büyük HLA DR antijenleri için kodlama yaparken; DRB3, DRB4, DRB5, DRB1 antijenlerine bağlı olarak eksprese edilen sırasıyla DR53, DR54, DR51 antijenleri için kodlama yaparlar. HLA DQ ve DP bölgelerinde DR dekinden daha az sayıda alt bölge bulunur. DR bölgesinden farklı olarak DQ ve DP bölgelerinde a genleri de çeşitlilik gösterir. DRB genlerinin ancak %6 sı kodlama yapar. Kodlama yapan 6 eksondan ekson 2, polimorfik olan β1 domainini, ekson 3 ise β2 domainini kodlar (Klein ve Sato, 2000).
Her bir sınıf 2 molekülü bir 34 kD 'lik α zinciri ve diğeri 29 kD 'llik β zinciri olan iki glikoprotein zincirinin oluşturduğu bir heterodimer yapıdadır ve bu zincirler non kovalent bağlanmışlardır. α zinciri 229, β zinciri 237 amino asitten oluşur. Sınıf 1 moleküllerinin ağır zinciri gibi sınıf 2, α ve β zincirlerinin her biri bir ekstraselüler hidrofilik, bir transmembran hidrofobik bölge ve intraselüler hidrofilik bölgeden ibarettir. Bunların son ikisi hücre membranı içine tutunmuşlardır. Ekstraselüler hidrofilik bölgedeki α zinciri α1 ve α2, β zinciri de β1 ve β2 olarak iki ayrı bölgeyi oluştururlar. α lar (l-84 ve 85-188), β 'lar (1-91 ve 92-192) aminoasit sırasındadırlar. α2 ve β2 bölgeleri immünoglobilin sabit bölgelerine benzeme açısından önemli bir homoloji gösterirler. DQ ve DP moleküllerinin yapısal özellikleri DR ile benzer şekildedir. DQ α zinciri 234, DQ β 229 aminoasit içerirken DP'nin her α ve β zincirleri 229 amino asit içerir. Sınıf 2 moleküllerinin kristalize yapısı henüz tam
bilinmemekle birlikte sınıf 2 molekülleri arasındaki benzerlik, sınıf 2 moleküllerinin yapısının bilgisayar ile varsayımlı şekilde tanımlanmasına olanak verir. Sınıf 2 α2 ve β2 bölgelerinin molekülün hücre membranı üzerindeki proximal bölgeyi oluşturduğu ve α1 ve β1 bölgelerinin distal alt bölgesini desteklediği düşünülmektedir. Bu son bölge (α1 ve α2) 8 β iplikçiği ve iki α heliks içeren aktif bir yapıdır ve sınıf 2 moleküllerindeki α1 ve α2 bölgeleriyle yakın bir benzerlik göstermektedir. Sınıf 2 molekülünün iki α heliksi ve β kıvrımlı yaprağın bir kısmı yarık veya oyuk bölgeyi oluşturulan sınıf 2 moleküllerinin polimorfizmi bu oyuk alanda lokalizedir ve her bir sınıf 2 moleküllü için farklı antijen bağlama bölgesi olmasını sağlar. Böylece belirli bir sınıf 2 molekülü sadece sınırlı sayıda antijenik peptid fragmanı bağlayabilir (Morimoto ve ark, 2004). Sınıf 2 moleküllerinin bu antijen bağlama alanları böylece antijenler için seçicilik gösterir. Ancak bu seçicilik immünglobilin antijen bağlama bölgesi hassaslığından yoksundur. Bu aktif antijenik peptid fragmanı iki α heliksi ve alt platformunca oluşturulan bu bölgedeki antijen bağlama oyuğu tarafından yakalanır. Bu α heliksleri ve antijenik peptid fragmanı CD4 T lenfositlleri üzerindeki reseptörlerce tanınan bir ligand oluştururlar. CD4 T lenfositlerce sınıf 2 molekülleri üzerindeki tanıma olayı CD8 T lenfositlerce sınıf 1 molekülleri üzerindeki tanıma olayı ile benzerlik gösterir (Yakut, 2004).
2.2.3. Sınıf 3 genleri ve molekülleri
Bunlar diğer MHC parçaları ile ilişkilidir. Bu bölge yüksek gen yoğunluğuna sahiptir ve en az pseodogene sahiptir (Kulski ve ark., 2002). Bu bölgede lokalize olmuş genlerin bazıları immün sistemi içermez. İmmünobiyolojide açık rolü olan sınıf 3 genleri kademeli bileşenlerin üyelerini (C4A, C4B, C2 ve BF), TNF α, LTA ve LTB gibi genleri içerir (Campbell ve ark., 1986). Pek çok kompleman kompanenti için gereken yapısal genler, glikokortiokoidlerin biyosentezi için kritik bir enzim olan 21-Hidroksilaz için gereken genlerde burada kodlanır. Bu bölge 60 gen içermektedir (Roitt ve Delves, 2001). Sınıf 3 bölgesi çok az karakterize edilmiştir (Schwaiger ve ark., 1996).
Sınıf 3 bölgesindeki koplement lokusu tarafından belirlenen kompleman bileşenleri de polimorfizm gösterirler. Elektroforetik hareketlilikleri ile ayırt edilebilen Properdin faktör B (BF)‟ nin 4 alternatif formunu belirleyen 4 allel vardır. C2‟nin iki yaygın formunu (C2‟ C) ve (C2‟ A) belirleyen C2 allelleri ve nadir görülen yetersiz (C2' QO) alleli bulunmaktadır. C4 lokusu, C4 genetik lokusunun iki ayrı mesafesinde iki ayrı bölgeye dublike olmuştur. C4 A, C4 komplemetinin elektroforetik olarak daha asidik grup içeren bölümü olarak belirlenir. C4 B, C4 komplementinin elektroforetik olarak daha fazla bazik grubunu içeren bölümü olarak belirlenir. C4 A lokusunda 7 yaygın yapısal allel ve bir yetersiz allel C4 B lokusunda ise 3 yaygın yapısal allel ile bir yetersiz allel bulunmaktadır (Abbas ve ark., 1994). Bu bölgeden kodlanan moleküller serumda serbest halde bulunurlar. Tranplantasyon immünolojisinde rol oynamadıkları gibi, T hücrelerine de antijen sunmamaktadırlar (Stites ve Terr, 1991).
2.3. MHC genlerinin kalıtımı ve allellerin adlandırılması
MHC genleri mendel kalıtımı ve eş-baskın (co-dominant) özellik gösterirler. Kalıtım haplotipler olarak birbirine bağlı gen blokları halindedir. Her birey bir paternal ve bir maternal haplotip alarak her ikisinide eksprese eder (Rodney, 2000; Warrens ve Lechler, 2000). Rekombinasyon görülme sıkılığı %1-3‟tür. Her bölgede yer alan allellerin sayısı göz önüne alındığında, populasyonlarda beklenenden daha az sayıda haplotip olduğu görülür. Bu durum bağlantı dengesizliği olarak ifade edilir ve bazı haplotiplerin korunma çabası ile açıklanmaktadır (Blasczyk, 1998; Klein ve Sato, 2000).
MHC genlerinde benzersiz bir genetik çeşitliliğin bulunduğu bilinmektedir. Bu genetik çeşitlilik farklı mekanizmalarla sağlanmaktadır. Sınıf 1 genlerinde polimorfizmi çok sayıda psödogen ve fizyolojik rolleri henüz bilinmeyen klasik olmayan genler sağlar. Sınıf 2 genlerinde ise DR alt bölgesindeki genlerin yapısı ve psödogenler etkilidir. MHC genleri içinde farklı allellerin oluşmasına sebep olacak şekilde dizi farklılıkları vardır. Bu çeşitlilik özellikle antijen sunulması sırasında T hücre reseptörü (TCR) ile ilişkiye giren zincirleri kodlayan genlerde dikkat çekicidir ( sınıf 1 genleri için ekson 2-3, sınıf 2 genleri için ekson 2). Alleller arasındaki farklar, peptidin taşındığı kovuğun üç boyutlu yapısı üzerinde etkili olduğundan; taşınabilecek peptitlerin seçilmesinde de önem kazanmaktadır(Klein ve Sato, 2000). MHC bölgelerindeki bu çoklu allelik formlar pek çok çeşit mekanizma ile sağlanabilir; nokta mutasyonu, rekombinasyon ve gen değişimi gibi (Roitt ve Delves, 2001).
Terminolojik olarak HLA-DRB1*0401 gibi bir örnek verildiğinde anlatılmak istenen şudur; moleküler tiplendirme sonucunda (* bunu göstermektedir) sınıf 2 nin R ailesinde β1 zincir geninde 0401 allelik varyantı saptanmıştır. Bu allele karşılık gelen serolojik antijen HLA-DR 04‟tür. Saptanan allelin serolojik karşılığı olan numara ilk iki rakamı oluştururken bunu takip eden iki basamakta moleküler tiplendirme ile ulaşılan yüksek çözünürlükteki allel tipi verilir. Eğer düşük çözünürlükte bir analiz yapıldı ve 3. ve 4. Basamak karşılıkları bilinmiyorsa “XX” koyulacaktır. Örneğin HLADRB1*04XX (Dalva, 2004).
2.4. MHC gen ürünlerinin iĢlevleri
İmmün sistemin en önemli özelliği, daha önce belirtildiği gibi kendinden olanla olmayanı ayırt ederek infeksiyöz ajanlara karşı cevap verebilme yeteneğidir. Yüzeylerinde antijene spesifik reseptörler bulunan T ve B lenfositleri tarafından antijen tanınır, bir dizi immünolojik olaylarla sitotoksik T lenfositler ve antijene spesifik antikorlar oluşur. İnfeksiyöz ajanlara karşı immün cevabın başlaması ve düzen içinde devamı için birçok hücre dizileri arasında işbirliğinin olması gereklidir. Patojen ajanların çoğunun bu dizide yer alan hücre tarafından tanınabilmesi için önce antijenin tutulup işlenmesi ve dizide bir sonraki hücreye tanıtılması ve hücredeki spesifik reseptör tarafından fark edilmesi gereklidir. Antijenin spesifik reseptör tarafından fark edilmesine ilave olarak lenfositlerin çözünmüş poliklonal nonspesifik faktörlerce farklılaşması gerekir. Monosit ve makrofaj serisi hücrelerce yapılan monokinler ve Th (helper) lenfosit serisi hücrelerce yapılan lenfokinler, poliklonal farklılaşma faktörlerini sağlarlar. Sonuçta B lenfosit dizilerince antikor yapımı ve/veya T lenfosit dizilerince sitotoksik T hücre yapımı oluşur. Kompleman sisteminin
devreye girerek hızlandırmasıyla sitoliz, doğrudan T lenfositle sitotoksisite veya antikora bağlı hücresel sitotoksisite oluşur( Erdoğdu, 2007).
a. T-hücre ve TCR Repertuvarlarının Oluşturulması: T hücrelerinin çoğu α ve β zincirinden oluşan reseptörleri eksprese ederler (Roitt ve Delves, 2001). T hücre reseptörleri, antijenleri MHC sınıf 1 ve ya 2 molekülleriyle ilişkili olan hücrelerin yüzeylerinde saptarlar (Germain, 1999). T-hücrelerinin timustaki olgunlaşma sürecinde seleksiyon işlevi bu kapsamda önemlidir. Bu süreç, T-hücre reseptörü (TCR) self MHC afinitesi düzeyinde kontrol edilen, pozitif ve negatif seleksiyon (apoptozis) işlemleri sonucunda yaklaşık % 2-5 T-hücresinin sağ kalabildiği bir seçimdir. Normal bir T hücresinden beklenen, sonuçta yalnızca kendi MHC molekülleri üzerinde sunulan yabancı peptidleri tanıyıp yanıt vermesidir. Bir başka anlatımla T hücrelerinden "self-MHC restricted" ve "self tolerant" olmaları beklenir. Bu uygunluk kendi MHC moleküllerine afinitesinin düzeyi ile yakın ilişki gösterir (Yiğitbaş, 2006).
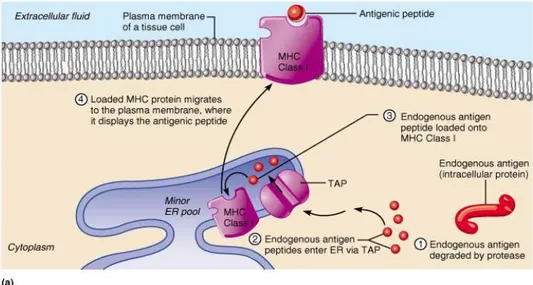
b. T-hücrelerine Antijen Sunumu: T-hücrelerinin peptidleri tanıyabilmeleri için, öncelikle antijenlerin antijen sunum hücreleri içinde işlenerek MHC molekülleri üzerinde T-hücrelerine sunulması gereklidir. Antijenlerin sınıf 1 ve sınıf 2 MHC molekülleri ile sunumları bazı benzerlikler gösterse de temelde farklılıklar vardır. Sitoplazmadaki yabancı proteinler (örneğin virus ile enfekte hücreler) endojen antijen yolunda işlenerek, endoplazmik retikulumda TAP (transporter associated with antigen processing proteins) aracılığı ile ağır zincir-β2 mikroglobulinden oluşan sınıf 1 moleküllerine bağlanır, hücre yüzeyinde CD8+ T-hücrelerine sunulur ve bu hücrenin eliminasyonu sağlanır. Sınıf 2 sunumunda ise; hücre içine alınan ekstraselüler moleküller enzimatik parçalanma işleminden geçirilerek, MHC-DM aracılığıyla sınıf 2 molekülleri üzerine bağlanarak hücre yüzeyinde CD4+ T-hücrelerine sunulur ve ekstraselüler antijenlerin eliminasyonuna giden mekanizmaların aktivasyonu sağlanır. MHC‟ye bağlı sunum sayesinde organizmadaki hücrelerin büyük bir çoğunluğu yabancı antijenler yönünden taranmış olur (Yiğitbaş, 2006). Böylece genel olarak, endojen protein antijenleri sınıf 2 sunumu için işlenirken, ekzojen protein antijenleri sınıf 2 sunumu için işlenir. Bu iki antijen sunumu şekillerle aşağıda açıklanmıştır.
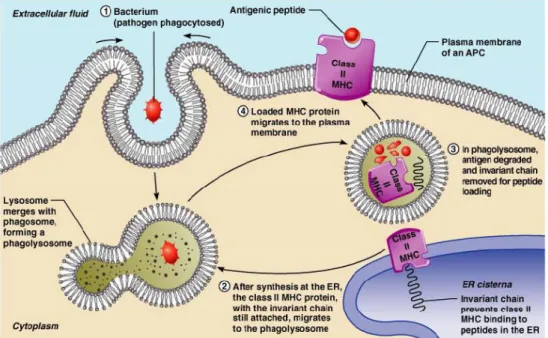
Şekil 2.4: Endojen antijen sunumu
Endojen antijen sunumununda MHC sınıf 1 molekülleri rol alır. Viral protein önce hücresel proteozom tarafından parçalanır (1)(Şekil 2.4). Parçalanan ürünler TAP aracılığı ile Endoplazmik Retikulum içine taşınır (2)(Şekil 2.4). Endoplazmik Retikulumda viral peptitler şaperonların yardımıyla aşama aşama MHC molekülleri ile birleşirler (3)(Şekil 2.4). MHC 1 molekülü daha sonra vesiküller ile Golgi aygıtına hareket eder. Golgi aygıtındaki modifikasyonlardan sonra MHC I kompleksi viral antijeni CD8 T hücrelerine sunacağı hücre membranına hareket ederler (4)(Şekil 2.4). MHC glikoproteinlerinin bazıları bakteri ve viruslara ait proteinlere bağlanarak onları işaretler ve immun sistemin diğer hücrelerini de uyarır. Bu süreç immun cevabın ilk aşaması olan Antijen işlenmesi (antigen processing) olarak adlandırılır.
Şekil 2.5: Eksojen antijen sunumu
Eksojen antijen sunulumunda ise MHC sınıf 2 molekülleri rol alır.
Patojen (eksojen bir antijen, örn viral protein) içeren bir fagozom bir lizozomla birleşir (1)(Şekil 2.5). Viral proteinler lizozomlarda proteazlar tarafından parçalanır (pH düşük) (2)(Şekil 2.5). Endoplazmik retikulum lümenindeki bir protein (invariant protein) MHC sınıf 2‟ye diğer peptidlerin bağlanmasını engeller. Sınıf 2 MHC proteinler antijenin parçalandığı ve invariant proteinin uzaklaştırıldığı fagozomlara göç eder (3)(Şekil 2.5). Sınıf 2 molekülleri hücre membranına göç eder ve CD4 hücreleri için antijeni sunar (4)(Şekil 2.5). c. Natural Killer (NK) Hücre Aktivasyonunun Düzenlenmesi: NK hücreleri, T-hücreleri ile aynı progenitörden gelen öldürücü (killer) hücreler olmakla birlikte, doğal immün sistemin hücreleridir. NK hücreleri TCR gibi duyarlı sistemler kullanmazlar ve daha az seçicidirler. NK hücrelerinin yanıtı iki temel şekilde kontrol edilir. Birincisi, self-MHC‟ nin bulunmadığı durumda aktivasyon, ikincisi ise, self-MHC‟nin bulunduğu durumda oluşan inhibisyondur. NK hücrelerinin kuvvetli aktivatörlerinden biri de MHC sınıf 1 bölgesinden eksprese edilen MICA molekülleridir MICA ve MICB, MHC sınıf 1 benzeri moleküllerdir. MICA genleri Isı-şok proteinleri (Heat-Shock Proteins, Hsp) promotor dizileri taşıdığından stres ile indüklenirler ve normalde NK hücrelerini inhibe eden MHC moleküllerinin varlığında bile kuvvetli aktivasyon yapabilirler. NK hücreleri bu özellikleri sayesinde Sitotoksik T lenfositlerin yedeklenmesi görevini yaparlar. Sitotoksik T-hücrelerin atağından kurtulan hücreler NK‟lar tarafından elimine edilirler (Yiğitbaş, 2006).
d. Gebelik: Fetüsün maternal immün ataktan korunabilmesi, steroidler ve korionik gonadotropinler gibi immünsupresan plasental hormonlar dışında iki önemli mekanizmayla sağlanmaktadır. Plasental trofoblastlar MHC-A, B, C gibi sınıf 1 moleküllerini eksprese etmezler, dolayısıyla Sitotoksik T-hücrelerin saldırısından korunurlar. Diğer yandan yüksek oranda eksprese olan MHC-G ve MHC-E ise NK hücrelerinin inhibisyonunu sağlamaktadır (Yiğitbaş, 2006).
e. Eşleşme Tercihi: Eşlenme tercihindeki içgüdüsel mantık, kendisinden farklı MHC repertuvarı taşıyan organizmayı tercih ederek, yeni kuşağı daha geniş çeşitlilikteki antijenlere karşı koruyabilmektir. Tümü de olfaktör reseptörlere dayalı üç hipotez fare ve insan deneyleriyle doğrulanmıştır. HLA Sınıf 1 bölgesinde olfaktör reseptörleri kodlayan genlerin gösterilmesi de bu görüşleri destekler niteliktedir (Roitt ve ark., 2001; Klein ve Sato, 2000).
2.4. Moleküler Genetik Tanımlama Yöntemleri
Son 30 yıl içinde DNA molekülü temelinde ve moleküler genetik işaretleyiciler (marker) olarak tanımlanan çeşitli teknolojiler geliştirilmiştir. Bu teknolojiler hayvancılıkta; populasyonların tanımlanmasında, gen fonksiyonlarının belirlenmesinde, evrim hakkındaki bilgilerin geliştirilmesinde, genom haritalarının çıkarılmasında, ebeveyn tayini çalışmalarında ve seleksiyonda yaygın olarak kullanılmaktadır. Bu teknikler ile ırklar içi/arası genetik varyasyonlar belirlenebilmektedir. Hayvancılıkta son yıllarda yaygın olarak kullanılan moleküler yöntemlerlerin büyük bir kısmı polimeraz zincir reaksiyonu (PCR) tepkimesine dayanmaktadır. PCR‟a dayalı en yaygın kullanılan moleküler marker teknikleri; RAPD (Rasgele Çoğaltılmış Polimorfik DNA Yöntemi), RFLP (Kesilen Parça Uzunluk Polimorfizmi), AFLP (Çoğaltılmış Parça Uzunluk Polimorfizmi), Mikrosatelitler, SSCP (Tek Zincir Konformasyon Polimorfizmi) ve SNP (Tek Nükleotid Polimorfizmleri) markerleridir. Bu tekniklerin klasik ıslah yöntemleri ile birlikte kullanımı ve ıslah çalışmalarına katkıları gün geçtikçe artmaktadır (Avise, 2004).
2.4.1. PCR (Polimeraz zincir reaksiyonu)
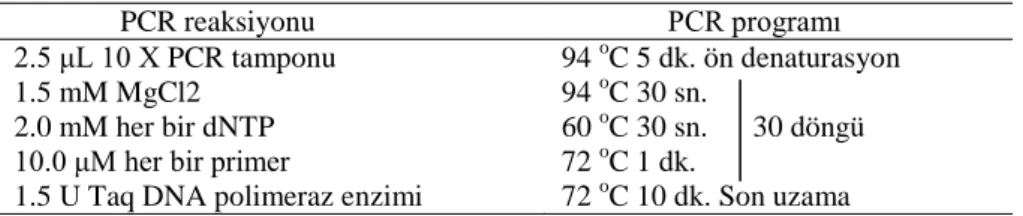
PCR doğal DNA replikasyon işleminin temel bileşenleri kullanılarak DNA molekülünün laboratuar (in vitro) koşullarında çoğaltılması ya da kopyalanmasıdır. PCR, üzerinde durulan bir gen yada DNA bölgesinin belirli primerler kullanılarak in vitro ortamda
çoğaltılmasını sağlayan bir yöntemdir. PCR yöntemininin temel prensipleri ilk defa 1985‟de Kary Mullis tarafından ortaya konmuş, ancak daha sonra bu teknik Saiki et al. (1985) tarafından değiştirilmiştir. PCR yönteminin geliştirilmesi moleküler biyoloji alanında çok önemli bir dönüm noktası olarak kabul edilmektedir (Saiki ve ark., 1988).
PCR yöntemi genel olarak üç basamaklık bir döngünün defalarca tekrarlanmasına dayanan bir teknik olup üç aşamadan oluşmaktadır. Bu aşamalar;
a) DNA eksenlerinin birbirinden ayrılması (denaturation),
b) Primerlerin komplementer DNA bölgesiyle hibrit oluşturması (annealing) ve c) Yeni eksenlerin sentezinin yapılması (extension) aşamalarıdır.
Kalıp DNA‟nın iki ekseni, yaklaşık 94-95 oC ‟lık sıcaklık uygulamasıyla birbirinden
ayrılmaktadır. PCR‟ın ilk aşaması olan bu işlem DNA eksenlerinin birbirinden ayrılması olarak bilinmektedir. Eksenlerin ayrılması, 15 saniyeden birkaç dakikaya kadar olabilmektedir. İkinci aşama oligonükleotid primerlerinin (6-30 bazlık) kalıp DNA üzerindeki tamamlayıcı (complementary) sıralara eşlenmeleri ve hibritlenme olayının olmasıdır. Bunun için denatürasyon sıcaklığından daha düşük hibritlenme sıcaklığına reaksiyon soğutulmaktadır. Primerlerin doğru bir biçimde hibritlenmesi için sıcaklığın 40-72
o
C (optimum 55 oC) arasında olması gerekmektedir. Reaksiyon bu sıcaklıklara soğutulduğunda primerlerin tamamlayıcı DNA ile hibritlenmesi sağlanmış olur. Primerlerin bağlanması için 55 oC‟de 1-2 dk tutmak yeterlidir. En son aşama olarak optimum sentez
sıcaklığında (72 o
C), sıcaklığa dayanıklı özgün bir DNA polimeraz enzimi, primerlerin 3‟OH uçlarına deoksiribonükleotidleri ekleyerek yeni eksenleri kalıp sıraya komplementer olacak şekilde sentezlemektedir. Bu son aşama yeni DNA eksenlerinin sentezinin yapılması olarak bilinmektedir. Uzama aşamasının 1- 3 dk kadar olması önerilmektedir (Mullis, 1990; McPherson ve Møller, 2001).
PCR yöntemi geliştirildikten sonra hedeflenen gen bölgesinin çoğaltılması çok daha kolay olmuş ve PCR temelli çok sayıda marker (işaretleyici) tekniği geliştirilmiştir. Bu tekniklerin bir kısmı aşağıda özetlenmiştir.
2.4.2. RAPD (Rasgele ÇoğaltılmıĢ Polimorfik DNA Yöntemi)
DNA işaretleyicileri geliştirmek için en fazla kullanılan yöntemlerden biri RAPD tekniği olmuştur. İki ayrı araştırmacı grubu 1990 yılında (Welsh ve McClelland, 1990; Williams ve ark.,1990) özgül nükleotid dizisi bilgisine gereksinim olmadan PCR yöntemi ile
polimorfizmin tek bir primer kullanılarak ortaya konabileceğini göstermişlerdir. Bu yöntem ile DNA düzeyindeki çeşitlilik diğer yöntemlere göre daha çabuk ve kolay bir şekilde ve daha ucuza saptanabilmektedir (Cushwa ve Medrano, 1996). PCR yöntemine (Mullis, 1990) dayalı olan bu teknikle, sentetik olarak oluşturulan rasgele nükleotid dizisine sahip primerler (örneğin ACGGTCACTG), genomik DNA‟nın çeşitli bölgelerinin çoğaltımında kullanılmaktadır (Cushwa ve Medrano, 1996). Aynı PCR reaksiyonu esnasında her bir RAPD primeri farklı lokuslardan bir dizi DNA bölgesini (1 ile 10 arası veya daha fazla) çoğaltma kapasitesine sahiptir. RAPD analizlerinde, yaygın olarak 10 bazlık uzunluğa sahip primerler kullanılmaktadır (Cushwa ve Medrano, 1996). Daha kısa veya uzun baz dizisine sahip primerleri düzenleyip kullanmak da olasıdır. Ancak primerin boyutunun uzun veya kısa olması genomda karşılık gelen bölge sayısını doğrudan etkilemektedir (Binbaş, 2006).
Diğer yöntemlere göre ucuz olması, çabuk sonuç vermesi ve DNA baz dizisine yönelik ön bilgi gerektirmemesi gibi nedenlerden dolayı türlerin belirlenmesi, populasyon içi veya populasyonlar arası genetik benzerlik ve farklılıkların belirlenmesi için RAPD tekniği 90‟lar ve 2000‟li yılların başında sıklıkla kullanılmıştır (Bardakçı, 2000). Bunun yanında, babalık testleri ve genetik kaynakların korunmasına yönelik strateji belirleme gibi amaçlar için nadir de olsa kullanılmaktadır (Cushwa ve Medrano, 1996). Yöntemin en büyük dezavantajları ise dominant kalıtım göstermesi ve tekrarlanabilirliğinin düşük olmasıdır (Frankham ve ark., 2005). RAPD yöntemi başlangıçta bitki ve mikroorganizmalara yönelik çalışmalarda yaygın olarak kullanılmasına karşın daha sonraki dönemlerde çiftlik hayvanlarında da etkin bir şekilde kullanılmaya başlanmıştır. Koyunlara yönelik olarak farklı yurt dışı çalışmalarda RAPD yöntemi gerçekleştirilmiştir (Cargill ve ark., 1995; Cushwa ve ark., 1996; Ali, 2003). Ülkemizde ise sığır ve tavuklarda yapılan kimi çalışmalar (Güneren, 1999; Ivgin ve Bilgen, 2002) yanında yerli koyun genotiplerimizin tanımlanmasına yönelik çok sayıda çalışmaya rastlanmıştır (Budak, 2003; Mercan, 2004; Arıca ve ark., 2006; Aytekin, 2006; Binbaş, 2006; Saygılı, 2007; Budak ve Arıca, 2009).
2.4.3. RFLP (Kesilen Parça Uzunluk Polimorfizmi)
Restriksiyon parçacık uzunluk polimorfizmi (RFLP) yöntemi, restriksiyon endonükleazlar kullanılarak DNA molekülünün özgün noktalardan kesilmesi işlemine dayanmaktadır. Linn ve Arber (1968) ile Meselson ve Yuan (1968) yaptıkları çalışmalarda DNA üzerindeki bazı özel dizileri tanıyan ve DNA molekülünü bu dizilerden kesen restriksiyon endonükleaz bakteri enzimlerini elde etmişlerdir. Restriksiyon endonükleaz
enzimleri, çift iplikçikli DNA üzerindeki özgül bölgeleri tanımakta ve DNA‟daki iki ekseni de keserek bir bölgeyi ya da bir bölgedeki DNA parçasının ortaya çıkarılmasında görev almaktadırlar. Değişik bakteri suşlarından baz sayıları ve tanıma dizileri farklı olan kesim enzimleri oluşturulabilmektedir. DNA üzerindeki restriksiyon tanıma dizilerinde oluşan herhangi bir SNP ve mutasyonda, restriksiyon enziminin o bölgeyi tanıyamaması sonucu, kesim gerçekleşmeyebilmektedir. RFLP kesim ürünlerinin analizi, genellikle agaroz jel elektroforezinde etidyum bromür ile ultraviyole (UV) ışıkta görünür duruma getirilerek yapılmaktadır. Jel görüntüsünde elde edilen bantlar arasındaki farklılıklar, tanıma bölgelerindeki nükleotid polimorfizmlerinin varlığını göstermektedir. Bir bölgedeki DNA dizisinde gözlenen insersiyon ve delesyonlar değişikliklere neden olabilmektedir. Bu değişiklikler her birey için karakteristik olan nükleotid değişimlerinin varlığını göstermektedir ve bireyler arasındaki genetik polimorfizmlerin değerlendirilmesine olanak sağlamaktadır. PCR ile çoğaltılmış belirli bir gen bölgesi, RFLP yöntemi kullanılarak, tanımlanmış özel mutasyonlara karşı uyumlu restriksiyon enzimi ile taranabilmektedir. Analiz edilen gen bölgesinin, agaroz jel görüntüsündeki bantların sayılarına, büyüklüklerine bakılarak allel polimorfizmleri tespit edilebilmekte, lokusa ait homozigot ve heterozigot genotip frekansları saptanabilmektedir (Klug ve Cummings, 2003).
Moleküler biyoloji alanında elde edilen büyük buluşların çoğu restriksiyon enzimlerinin keşfinden sonra gerçekleşmiştir. Moleküler genetik laboratuvarlarında, restriksiyon enzimleri, restriksiyon uzunluk polimorfzmini analiz etmede geniş uygulama alanına sahiptir. Bütün RFLP uygulamaları bir veya daha fazla restriksiyon enzimi ile DNA kesimini içerir ve jel elektroforezi ile meydana gelen DNA parçaları birbirinden ayrılır. Daha sonra çeşitli boyuttaki DNA parçaları ya manüel ya da otoradyografi yöntemi ile gözlenir (Başıbüyük, 2000).
2.4.4. AFLP (ÇoğaltılmıĢ Parça Uzunluk Polimorfizmi)
AFLP tekniği, RAPD ve RFLP tekniklerinin kombinasyonu olan bir uygulamadır. AFLP tekniğinin polimorfizm oranı çok yüksektir. Çok sayıda lokusu aynı anda ve etkili bir şekilde tarar. Bu teknik tür, ırk ve çeşitlere ait genetik ilişkilerin ortaya çıkarılması, ekotip ve klonal polimorfizmin belirlenmesi ve genetik haritalama çalışmalarında yaygın bir şekilde kullanılmaktadır (Vos ve ark., 1995).
AFLP yönteminin kullanılmasındaki esas amaç, iki restriksiyon endonükleaz enzimiyle muamele edilerek kesilmiş çok sayıda genomik DNA parçacığının bulunduğu bir
karışımda yer alan restriksiyon parçacıklarının özel bir alt grubunun çoğaltılmasıdır (Avise, 2004). AFLP tekniği ile polimorfizm elde etme olasılığı oldukça yüksektir ve genom hakkında herhangi bir ön bilgi olmadan bu teknik uygulanabilmektedir. Elde edilen her bir marker oldukça güvenilir ve bilgi sağlayıcıdır. AFLP tekniğinin en önemli eksikliği dominant markerler vermesidir. Ayrıca bu teknikte 50-100 gibi çok sayıda çoğaltılmış parçacık elde edildiği için bunların analizlerinin otomatik olarak bilgisayar kontrolünde yapılması gerekmektedir. Genetik haritalamada AFLP markerleri genellikle kromozomların sentromer ve telomer (uç bölgeleri) bölgelerinde toplanmaktadır. Bu durum kromozomların diğer bölgelerinin analizlerini güçleştirmektedir (Zabeau ve Vos, 1993; Vos ve ark., 1995).
2.4.5. Mikrosatelitler
Mikrosatellitler genom içerisinde mono, di, tri yada tetra nükleotid permutasyonların herhangi biri şeklinde tandem olarak tekrarlanan kısa DNA sekanslarıdır (Ellegren, 1993) Mikrosatellitlerin en önemli özellikleri polimorfik olmalarıdır. Mikrosatellitler genom içerisinde rastgele dağılmışlardır. Mikrosatellitler temel olarak tüm populasyon içerisinde benzer özellikler göstermesine rağmen bireyden bireye tekrar sayıları bakımından farklılıklar göstermektedirler. Bu nedenle mikrosatellitler, genom analizi ve gen kartlarının çıkarılması, ebeveyn analizleri gibi alanlarda yaygın olarak kullanılmaktadırlar. Bir çok omurgalı hayvanda bulunan mikrosatellitlerin temel motifi (CA)n dir (Hearne ve ark., 1992). Eşbaskın (ko-dominant) kalıtım gösteren mikrosatellitler, 2-6 nükleotid uzunluğunda kısa, tekrarlanan DNA dizilerini içermektedirler (Avise, 2004; Freeland, 2005). Polimorfik bir lokusta tekrarların sayısı bireyden bireye 5‟ten 100‟e kadar değişebilmektedir. PCR ürünleri her bir lokusa göre değişen ve genel olarak 75 ile 300 baz çifti uzunluğu arasında olabilmektedir (Allendorf ve Luikart, 2007). Mikrosatellitler, eşbaskın kalıtım özellikleri lokusa özgü olmaları, genom içinde düzgün ve geniş yayılımları, yüksek mutasyon oranı ve informatif değerleri yanında PCR‟ ye dayalı bir teknik olmasından dolayı birçok türde yaygın olarak kullanılmaktadır (Van-Zeveran ve ark., 1995; Canon ve ark., 2006).
2.4.6. SSCP (Tek Zincir Konformasyon Polimorfizmi)
Tek zincir konformasyon polimorfizmi (SSCP), bilinmeyen mutasyonların saptanması için PCR‟a dayalı ucuz, kolay, duyarlı ve güvenilir bir tarama yöntemidir (Jordan ve ark., 1997, Kukita ve ark., 1997). Bu yöntem genellikle küçük insersiyon ve
delesyon mutasyonları ile nokta mutasyonlarının saptanması için tercih edilmektedir. Özellikle gen dizisi büyük olan gen bölgelerinde dizi analizi yapılacak bölgeyi önceden saptamak için en sık kullanılan yöntemlerden biridir. Bu yöntem ile mutasyon saptama oranı % 80 ile % 90 arasında değişmektedir (Sheffied ve ark., 1993).
Metodun temeli, nükleotid dizisindeki değişikliklerin DNA tek eksenlerinin konformasyonunu etkilemesi sonucu elektrik hareketiyle farklı bantlar vermesidir. SSCP analizleri güvenirliği ve hassaslığı nedeniyle doğal mutasyonların ve DNA fragmentlerinin incelenmesi için uygundur. Çevresel değişkenlik DNA konformasyonu üzerinde doğrudan etkilidir. Böylece sıcaklık, iyonik güç, pH ve jelde denatürasyon ve parametreler elektroforetik hareketliliği etkiler. SSCP analizi, tek zincirli DNA molekülündeki bir veya birden fazla nükleotid değişiklerinin, elektroforetik mobiliteyi değiştirme etkisine dayanarak mutasyonları saptayabilen bir yöntemdir. SSCP, dizi analizine alternatif olan bir yöntemdir ve tek bir nükleotid farklılığı dahi belirlenebilmektedir (Orita ve ark., 1989). Nokta mutasyonları, DNA dizi analizi ile kesin teşhis edilebilmesine rağmen aranacak DNA parçası büyüdükçe, teşhis süresi ve analiz maliyeti artmaktadır. Bunu önlemek amacıyla; mutasyon içeren gen, kısa DNA parçacıkları halinde çoğaltılıp SSCP yöntemiyle taranarak mutasyonun bulunduğu fragment belirlenir. Böylece, büyük bir genin tümünü analiz etmek yerine sadece mutasyon içeren parçanın incelenmesi, süreci kısaltmasıyla maliyeti de azaltmaktadır. Burada asıl amaç mutasyonun bulunduğu bölgeyi belirlemektir. Yöntem, mutasyonu aranacak olan genin, primerler ile parçalar halinde çoğaltılması ve baz dizisinin veri tabanındaki diziden farklı olup olmadığının araştırılması ilkesine dayanmaktadır (Orita ve ark., 1989).
2.4.7. SNP ler (Tek Nükleotid Polimorfizmleri)
SNP en basit tanımla ile iki birey arasındaki belli bir DNA parçasındaki tek nükleotid farklılığıdır. Bir populasyondaki bireyler arasında yüksek yer değiştirme (substitüsyon) oranı gösteren, bir nükleotid olarak da tanımlanabilir (Wang ve ark., 1998). Brookes (1999) tarafından yapılan farklı bir tanımlamaya göre SNPler, (allel sıklığı en az % 1 veya daha fazla olan) bazı populasyonlardaki normal bireylerde bulunan farklı sekans alternatifli genomik DNA‟lardaki tek baz değişimidir. Sıklıkla ortaya çıkan bu durum SNP‟leri nadir nokta mutasyonlarından ayırır ve genetik marker olarak kullanımını daha uygun hale getirmektedir. Bazı araştırmacılar SNP tanımı içine tek nükleotid substitüsyonlarını ilave etse de, SNP markerleri biçimsel olarak tek nükleotid ekleme veya çıkarımlarını içermez (Cho ve ark.,1999). SNP‟ler transisyonlar (bir
pürin bazın “A/G” diğer bir pürin bazıyla veya bir pirimidin bazın “C/T” diğer pirimidin bazıyla değişmesi) ve transversiyonlar (bir pürin bazının bir pirimidin bazına değişimi veya tersi) gibi baz değişimlerini içermektedir. Genomda transversiyon olma ihtimali transisyonlardan daha yüksek olmasına rağmen transisyon sıklığı transversiyon sıklığından daha yüksektir. G>A ve C>T transisyonları, insan genomundaki SNP‟lerin % 25‟ini oluşturmaktadır (Brookes, 1999).
Bir populasyondaki tek bir baz değişiminin frekansı % 1‟den büyük ise bu değişim SNP, % 1‟den küçük ise mutasyon olarak adlandırılmaktadır. Çok yakın akraba bireylerde SNP gibi markerlerin potansiyeli oldukça büyüktür. İnsan genomu yaklaşık 2.91 milyar baz çiftine ve 25.000 gene sahiptir. Tüm insanların baz diziliminin % 99.9‟u birbirinin aynıdır. Gen dizilimindeki % 0.1‟lik varyasyon insanlar arasındaki çeşitliliğin genetik kökenini açıklamaktadır. Bu değişiklikler; zararsız (fenotipteki değişiklikler), zararlı (diyabet, kanser, kalp hastalığı, kansızlık) ya da gizli olabilir (kodlanan ve düzenleyici bölgelerde bulunmayan değişiklikler). Genetik olarak uzak İki birey arasındaki 1250 bp‟deki 1 farklılık toplam 2.3 milyon farklılık demektir ki insan genomunda 10-30 milyon arasında SNP olduğu bildirilmektedir (Sönmezoğlu ve ark., 2010).
2.5. Türkiye’de yerli koyun ırkları ile ilgili yapılmıĢ tez çalıĢmaları
Türkiye yerli koyun ırklarının tanımlanması amacıyla öncelikli olarak morfolojik karakterler bakımından sınıflandırmalar yapılmış, daha sonraki çalışmalarda ise yerli koyun ırklarımızın genetik olarak tanımlanmasında biyokimyasal markerler ele alınmıştır. Son yıllarda ise DNA düzeyinde yürütülen genetik tanımlama çalışmaları hızla artmış ve Türkiye yerli koyun ırklarının tanımlanması amacıyla farklı DNA marker yöntemleri kullanılarak çok tez çalışması ve makaleye rastlanılmıştır.
Türkiye yağlı kuyruklu koyun ırklarından, Akkaraman, Morkaraman, Güney Karaman, İvesi ve Dağlıçta genetik varyasyonu ortaya koymak amacıyla Balcıoğlu (1995)‟nun yaptığı doktora tezinde, potasyum (K), hemoglobin (Hb), transferrin (Tf) ve arilesteraz (EsA, E. C. 3. 1.1. 2) polimorfizmi üzerinde çalışılmıştır. Akkaramanda Hb, İveside EsA lokusları hariç, çalışılan bütün lokuslarda polimorfizm gözlenmiştir. En yüksek ortalama heterozigotluk 0.231 ile iveside, en düşük ise 0.1532 ile Akkaramanda gözlenmiştir. Populasyonlar arasındaki genetik ilişkilerin tahmin edilmesi için hesaplanan Nei'in genetik uzaklık değerleri 0.004 ile 0.144 arasında değişmiştir, çizilen dendograma göre yapılan sınıflandırmada Güney Karaman, Dağlıç aynı sınıfı, Akkaraman, Morkaraman ve İvesi diğer sınıfı meydana getirmiştir.