TRICHOLOMA ANATOLICUM DOĞAN & INTINI
VE CANTHARELLUS CIBARIUS FR.' UN
ANTĠOKSĠDAN, ANTĠMĠKROBĠYAL ETKĠLERĠNĠN VE YAĞ ASĠDĠ KOMPOZĠSYONUNUN BELĠRLENMESĠ
YÜKSEK LĠSANS TEZĠ
UFUK USLU
BĠYOLOJĠ ANABĠLĠM DALI
T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
TRICHOLOMA ANATOLICUM DOĞAN & INTINI VE CANTHARELLUS
CIBARIUS FR.' UN ANTĠOKSĠDAN, ANTĠMĠKROBĠYAL ETKĠLERĠNĠN VE
YAĞ ASĠDĠ KOMPOZĠSYONUNUN BELĠRLENMESĠ
Ufuk USLU
YÜKSEK LĠSANS TEZĠ BĠYOLOJĠ ANABĠLĠM DALI
Bu tez 17.08.2007 tarihinde aĢağıdaki jüri tarafından oybirliği ile kabul edilmiĢtir
( DanıĢman) (Üye) (Üye) Yard.Doç.Dr. Hasan Hüseyin DOĞAN Yard.Doç.Dr. Rüstem DUMAN Yard.Doç.Dr. Necdet ġEN
T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
TRICHOLOMA ANATOLICUM DOĞAN & INTINI VE CANTHARELLUS
CIBARIUS FR.' UN ANTĠOKSĠDAN, ANTĠMĠKROBĠYAL ETKĠLERĠNĠN VE
YAĞ ASĠDĠ KOMPOZĠSYONUNUN BELĠRLENMESĠ
UFUK USLU YÜKSEK LĠSANS TEZĠ BĠYOLOJĠ ANABĠLĠM DALI
ÖZET Yüksek Lisans Tezi
TRICHOLOMA ANATOLICUM DOĞAN & INTINI VE CANTHARELLUS CIBARIUS FR.' UN ANTĠOKSĠDAN, ANTĠMĠKROBĠYAL ETKĠLERĠNĠN VE
YAĞ ASĠDĠ KOMPOZĠSYONUNUN BELĠRLENMESĠ Ufuk USLU
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
DanıĢman : Yard. Doç. Dr. Hasan Hüseyin DOĞAN 2007, 103 Sayfa
Jüri :
Yard.Doç.Dr. Hasan Hüseyin DOĞAN Yard.Doç.Dr. Rüstem DUMAN
Yard.Doç.Dr. Nejdet ġEN
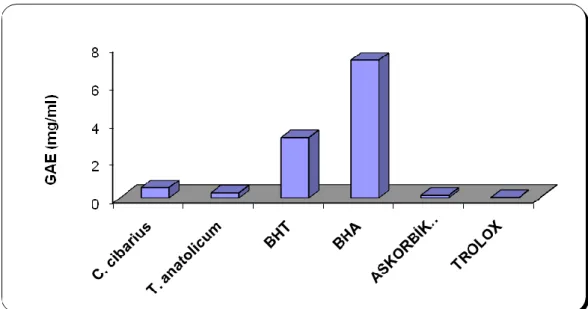
ÇalıĢmada C. cibarius ile T. anatolicum mantarlarının, DPPH radikallerini süpürme etkisi, β- karoten- linoleik asit sistemindeki etkisi, indirgeme gücü, toplam fenolik içeriği ve CUPRAC ile toplam antioksidan kapasitesi gibi deneylerle antioksidan aktivitelerinin belirlenmesi amaçlandı. Mantarların antioksidan aktiviteleri, BHA, BHT, troloks gibi standart antioksidanlar ile kıyaslandı. Linoleik asit sisteminde mantarların ekstraktlarının ve standartların artan konsantrasyonu ile orantılı olarak inhibisyon değerlerinin arttığı gözlendi. Fenolik madde miktarı C.
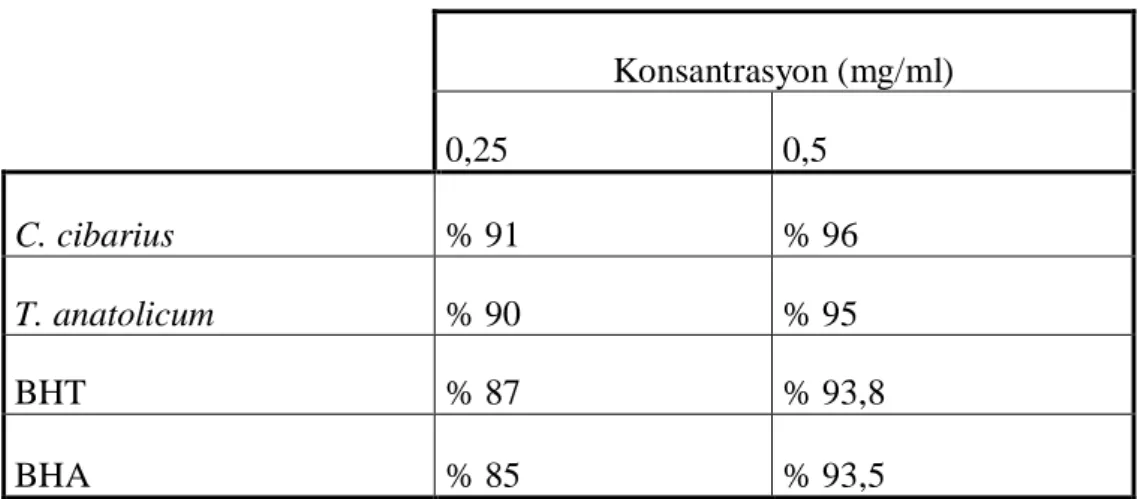
cibarius‟ da 0,5391 ± 0.10 mg ml-1 ve T. anatolicum‟ da 0,265 mg ml-1 (Gallik asit eĢdeğeri) olarak bulundu. DPPH radikallerini süpürme etkisi 250 µg/ml‟ de C.
cibarius‟ da % 91 ve T. anatolicum‟ da % 90 olarak bulundu. C. cibarius‟ un
indirgeme gücü 0,4 mg/ml‟ de 0,5‟ ten daha yüksek bir absorbans vererek mükemmel bir antioksidan aktivite gösterdiği tespit edildi.
C. cibarius ve T. anatolicum‟un hekzan, aseton, kloroform ve metanolik
ekstraktları 6 Gram pozitif, 4 Gram negatif bakteriye ve 1 mayaya karĢı denendi. Mantarların yeterli antimikrobiyal etkisinin olmadığı görüldü.
Cantharellus cibarius ve Tricholoma anatolicum‟ un yağ asidi kompozisyonları gaz kromatografi metoduyla araĢtırılmıĢtır. Bu iki mantar türünde
toplam 31 farklı yağ asidi belirlenmiĢtir. Bu yağ asitleri C 10 ile C 24 arasında değiĢiklik göstermiĢtir. Mantarlarda en çok doymamıĢ yağ asitleri asitleri tespit edilmiĢtir. Ġki mantarın yağ asidi bileĢimlerinin benzer olduğu görüldü.
Anahtar Kelimeler: Cantharellus cibarius, Tricholoma anatolicum, antioksidan aktivitesi, antimikrobiyal aktivitesi, gaz kromatografi, yağ asidi bileĢimi,
ABSTRACT MS Thesis
THE IDENTIFICATION of ANTIOXIDANT, ANTIMICROBIAL EFFECTS and FATTY ACIDS COMPOSITION of TRICHOLOMA ANATOLICUM
DOĞAN & INTINI and CANTHARELLUS CIBARIUS FR. Ufuk USLU
Selçuk University
Graduate School of Natural and Applied Sciences Department of Biyology
Supervisor : Assist. Prof. Dr. Hasan Hüseyin DOĞAN 2007, 103 Page
Jury :
Assist. Prof. Dr. Hasan Hüseyin DOĞAN Assist. Prof. Dr. Rüstem DUMAN
Assist. Prof. Dr. Nejdet ġEN
This study was aimed to determine to the antioxidant activity (DPPH free radical-scavenging, β-carotene/linoleic acid systems), reducing power, total phenolic content and CUPRAC total antioxidant capacity assay of Cantharellus cibarius and
Tricholoma anatolicum. Those various antioxidant activities were compared to
standard antioxidants such as butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), and -tocopherol. Inhibition values of mushrooms and the standards increased parallel with the elevation of concentration in the linoleic acid system. Total phenolics were determined 0,5391 ± 0.10 mg ml-1
and 0,265 mg ml-1 (Gallic Acid equivalent) for C. cibarius and T. anatolicum respectively. DPPH free radical-scavenging activities were found at concentrations of 250 µg/ml as 91 % -and 90 % for Cantharellus cibarius and Tricholoma anatolicum respectively. It was determined that the reducing power of C.cibarius showed higher absorbance than 0.5 at 0.4 mg/ml, and this result is excellent antioxidant activity.
The antimicrobial effect of C. cibarius and T. anatolicum with hexan, acetone, chloroform and methanol extracts were tested against to six species of Gram positive bacteria, four species of Gram-negative bacteria and one species of yeast. The mushrooms extracts did not exhibit perfect antimicrobial activity.
The fatty acid compositions of two mushrooms species, Cantharellus cibarius and Tricholoma anatolicum were investigated by gas chromatographic method. Totally, 31 different fatty acids were determined in two mushrooms. These fatty acids were C 10 – C 24. The major fatty acids were unsaturated fatty acids in mushrooms. -3/ -6 rate was found to be C. cibarius and T. anatolicum 0,19 and 0,04, respectively. Similar fatty acid compositions were found between two mushrooms.
Key Words: Tricholoma anatolicum, Cantharellus cibarius, antioxidant activity, antimicrobial activity, gas chromatography, fatty acid composition
ÖNSÖZ
Yüksek lisans tez çalıĢmam boyunca yardımlarını esirgemeyen ve fikirleriyle beni yönlendiren değerli hocam, sayın Yard.Doç.Dr. Hasan Hüseyin DOĞAN‟a Ģükranlarımı sunarım.
Bilgileriyle bana yardımcı olan ve her türlü desteği sağlayan hocam ArĢ.Gör. Yener TEKELĠ‟ ye, antimikrobiyal aktivite analizleri sırasında yardımlarını esirgemeyen sayın hocalarım Yard.Doç.Dr. Rüstem DUMAN, Yard.Doç.Dr. Birol ÖZKALP ve değerli arkadaĢlarım Ġbrahim ARI ve Rabia AÇIKGÖZ‟ e teĢekkür ederim. Yağ asitleri analizleri konusunda bana yardımcı olan sayın hocam Teknisyen Özcan BarıĢ ÇĠTĠL‟ e teĢekkür ederim. Ayrıca çalıĢmamı destekleyen BAP kurumu (Proje No: 06201074) ile tüm çalıĢanlarına ve aynı süre içinde her türlü fedakarlığa katlanan değerli aileme teĢekkürü bir borç bilirim.
Konya, 2007 Ufuk USLU
ĠÇĠNDEKĠLER
1. GĠRĠġ... 1
2. GENEL BĠLGĠLER ... 5
2.1. Reaktif Oksijen Türleri ... 5
2.2. Antioksidanlar ... 8 2.2.1. Antioksidanların sınıflandırılması ... 9 2.2.1.1. Doğal antioksidanlar ... 9 2.2.1.1.1. Tokoferoller ... 9 2.2.1.1.2. Flavonoidler ... 10 2.2.1.1.3. Fenolik Asitler ... 10 2.2.1.1.4. Askorbik Asit ...11 2.2.1.1.5. Karotenoidler ...11 2.2.1.2. Sentetik antioksidanlar ...13
2.2.2. Antioksidanların etki mekanizmaları ...13
2.3. Antimikrobiyal Aktivite Bakımından Makrofunguslar ...14
2.4. Yağ Asitleri ...15
2.4.1. Yağ asitlerinin sınıflandırılması ...16
2.4.1.1. DoymuĢ yağ asitleri ...16
2 .4.1.2. DoymamıĢ yağ asitleri ...17
2 .4.1.2.1. Tekli doymamıĢ yağ asitleri ...17
2 .4.1.2.2. Çoklu doymamıĢ yağ asitleri ...18
3. KAYNAK ARAġTIRMASI ... 19
4. MATERYAL VE METOT ... 23
4.1. Makromantarların Toplanması, TeĢhisi ve Genel Özellikleri ... 23
4.2. Mantarların Antioksidan Aktivitelerinin Belirlenmesinde Ġzlenen Metot ve Materyal ...27
4 .2.1.Mantar ekstarktlarının hazırlanması ...27
4.2.1.1. Materyal ...27 4.2.1.2. Metot ...27 4.2.2. Ġndirgeme gücü ...27 4.2.2.1. Materyal ...27 4.2.2.2. Metot ...27
4.2.3. DPPH radikallerini süpürme etkisi ...28
4.2.3.1. Materyal ...28
4.2.3.2. Metot ...28
4.2.4. Toplam fenolik madde tayini ...29
4.2.4.1 Materyal ...29 4.2.4.2 Metot ...29 4.2.5. CUPRAC yöntemi ...29 4.2.5.1. Materyal ...29 4.2.5.2. Metot ...29 4.2.6. β – karoten-linoleik asit metodu ...30
4.2.6.1. Materyal ...30
4.2.6.2. Metot ...30
4.3. Mantarların Antimikrobiyal Etkilerinin Belirlenmesinde Ġzlenen Materyal ve Metot ...31
4.3.1. Materyal ...31
4.3.1.1. Kullanılan cihazlar ve kimyasallar ...31
4.3.1.2. Test mikroorganizmaları ...31
4.3.2. Metot ...32
4.3.2.1. Ekstraktların hazırlanıĢı ...32
4.3.2.2. Ekstrakt Ġçeren disklerin ve mikroorganizma kültürlerinin Hazırlanması ...32
4.4. Mantarların Yağ Asitlerinin BileĢiminin Tespit Edilmesinde Ġzlenen Metot ve Materyal ...33
4.4.1. Materyal ...33
4.4.2. Metot ...34
4.4.2.1. Mantarların öğütülmesi ...34
4.4.2.2. Yağ asidi analizi için kullanılacak olan yağın elde edilmesi ...34
4.4.2.3. EsterleĢme iĢleminin yapılm ...34
4.4.2.4. Numunelerin gaz kromotografiye enjekte edilmesi ...34
5. BULGULAR ...36
5.1. Antioksidan aktivite bulguları ...36
5.1.1. Ġndirgeme gücü bulguları ...36
5.1.2. DPPH radikallerini süpürme etkisi bulguları ...38
5.1.3. Toplam fenolik madde bulguları ...42
5.1.4. CUPRAC bulguları ...43
5.1.5. β-karoten- linoleik asit sistemi bulguları ...45
5.2. Mantarların Antimikrobiyal Aktiviteleri Bulguları ...47
5.3. Mantarların Yağ Asidi Analizi Bulguları ...52
7. TARTIġMA VE SONUÇ ...54
7.1. Mantarların Antioksidan Kapasitesi ...54
7.1.1. Ġndirgeme gücü ...54
7.1.2. DPPH radikallerini süpürme etkileri ...56
7.1.3. Toplam fenolik madde ...60
7.1.4. CUPRAC ...63
7.1.5. β-karoten – linoleik asit ...63
7.2. C. cibarius ve T. antolicum‟un Antimikrobiyal Aktivitesi ...64
7.3. C. cibarius ve T. antolicum‟un Yağ Asidi Kompozisyonları ...70
8. KAYNAKLAR ...78
ġEKĠLLER LĠSTESĠ
ġekil 1. - tokoferolün kimyasal formülü ...9
ġekil 2. Flavonoidlerin genel kimyasal formülü ...10
ġekil 3. Genel bir fenolün kimyasal formülü ...11
ġekil 4. Askorbik asidin kimyasal formülü ...11
ġekil 5. - karotenin kimyasal formülü …...12
ġekil 6. Bir yağ asidinin genel formülü ...16
ġekil 7. DoymuĢ yağ asidi zincirinde C atomları ...16
ġekil 8. DoymamıĢ yağ asidi zincirinde C atomlar ...17
ġekil 9. Tricholoma anatolicum ...26
ġekil 10. Cantharellus cibarius ...26
ġekil 11. Yağ analizi sırasında meydana gelen reaksiyon (Alcantara 2000)...35
ġekil 12. Mantarların ve standartların indirgeme güçleri ...36
ġekil 13. BHT standartının indirgeme gücü ...37
ġekil 14. C. cibarius‟ un indirgeme gücü ...37
ġekil 15. T. anatolicum‟ un indirgeme gücü ...38
ġekil 16. DPPH kalibrasyon eğrisi ...39
ġekil 17. BHT’ nin DPPH radikallerini süpürme etkisi ...40
ġekil 18. BHA’ nın DPPH radikallerini süpürme gücü ...40
ġekil 19. C. cibarius‟ un DPPH radikallerini süpürme etkisi ...40
ġekil 20. T. anatolicum‟ un DPPH radikallerini süpürme etkisi ...41
ġekil 21. Mantralar ve standartların IC50 değerlerinin karĢılaĢtırılması ...41
ġekil 22. GA kalibrasyon eğrisi ...43
ġekil 23. Mantarlar ve standartların GAE’ leri ...43
ġekil 24. Troloksun kalibrasyon grafiği ...44
ġekil 25. T. anatolicum’un CUPRAC’a bağlı antioksidan aktivitesi ...44
ġekil 26. C. cibarius’un CUPRAC’a bağlı antioksidan aktivitesi ...44
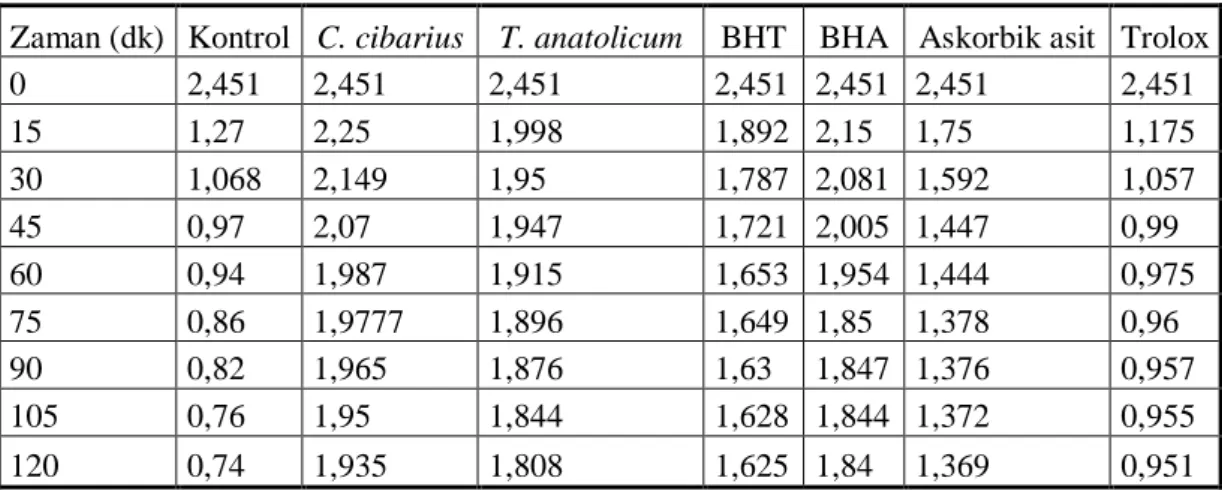
ġekil 27. Linoleik asidin zamana bağlı olarak gerçekleĢen oksidasyonu...45
ġekil 28. Linoleik asidin oksidasyonunu engelleme yüzdeleri ...46
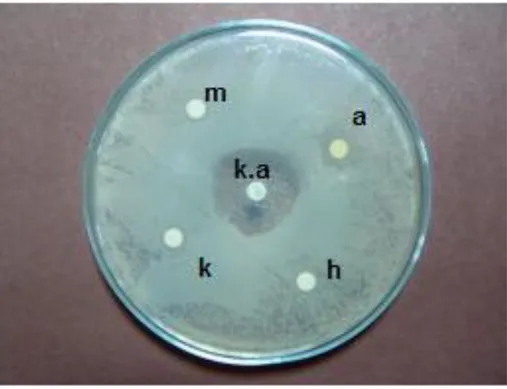
ġekil 29. C. cibarius‟ un, Listeria monocytogenesis bakterisini içeren petride oluĢturduğu inhibisyon zonları ...48
ġekil 30. T. anatolicum’ un, Escherichia coli bakterisini içeren petride oluĢturduğu inhibisyon zonu ...48
ġekil 31. C. cibarius‟ un, Escherichia coli bakterisini içeren petride oluĢturduğu inhibisyon zonu ...49
ġekil 32. T. anatolicum’ un, Streptococcus mutans bakterisini içeren petride oluĢturduğu inhibisyon zonu ...49 ġekil 33. C. cibarius’ un, Streptococcus mutans bakterisini içeren petride
oluĢturduğu inhibisyon zonu ...50 ġekil. 34 Tricholoma anatolicum‟da en çok bulunan yağ asidi türleri ...70 ġekil. 35 Cantharellus cibarius‟ da en çok bulunan yağ asidi türleri ...71 ġekil 36. ÇeĢitli bitkisel ve hayvansal yağ asitlerinin mantar yağ asitleri ile karĢılaĢtırılması ………...76
TABLOLAR LĠSTESĠ
Tablo 1. Ġndirgeme gücü için konsantrasyona bağlı olarak elde edilen
absorbans değerleri ...36
Tablo 2. DPPH radikallerini süpürme etkisi için konsantrasyona bağlı olarak elde edilen absorbans değerleri ...38
Tablo 3. Mantarların ve standartların DPPH radikallerini inhibisyon yüzdeleri ...39
Tablo 4. Mantarlar ve standartların absorbansa bağlı GAE’ leri ...42
Tablo 5. Mantarların ve Troloksun konsantrasyona bağlı absorbans değerleri ... 43
Tablo 6. Linoleik asidin zamana bağlı olarak gerçekleĢen oksidasyonu ...45
Tablo 7. Linoleik asidin oksidasyonunu engelleme yüzdeleri ...46
Tablo 8. Mantarların antimikrobiyal aktivitesi ...51
Tablo 9. Mantarların Yağ asidi BileĢimleri ...53
Tablo 10. T. anatolicum‟ un yağ asidi kompozisyonu ...72
Tablo 11. C. cibarius’ un yağ asidi kompozisyonu ...73
SĠMGELER DĠZĠNĠ
ROS : reaktif oksijen türleri
LDL : düĢük yoğunluklu lipoprotein HDL : yüksek yoğunluklu lipoprotein Cu(II)-Nc : bakır(II)-neokuprin Cu(I)-Nc : bakır(I)-neokuprin
CUPRAC : bakır(II) iyonu indirgeme antioksidan kapasitesi TEAC : troloks eĢdeğeri antioksidan kapasitesi
GA : gallik asit
GAE : gallik asit eĢdeğeri
BHA : butillenmiĢ hidroksi anisol BHT : butillenmiĢ hidroksi toluen TBHQ : tersiyer butil hidrokinon DPPH : 1,1-difenil-2-pikrilhidrazil ω : omega
EPA : eikosapentaenoik asit DHA : dokosahekzaenoik asit
SFA : saturated fatty acid, doymuĢ yağ asitleri UFA : unsaturated fatty acid, doymamıĢ Yağ Asitleri
PUFA : poli unsaturated fatty acid, çoklu doymamıĢ yağ asitleri MUFA : mono unsaturated fatty acid, tekli doymamıĢ yağ asitleri
TFAs : Trans yağ asitleri
h : hekzan
a : aseton
k : kloroform
m: metanol
k.a: kontrol antibiyotiği
K : kloramfenikol
Ns : nistatin
1. GĠRĠġ
Medikal mantarların ortaya çıkıĢ tarihi geleneksel doğu terapilerine kadar uzanır. Modern klinik uygulamalarında Japonya, Çin, Kore ve diğer Asya ülkelerinde kurutulmuĢ mantar materyallerine günümüzde de güvenilmeye devam edilmektedir. Mantarlar doğu kültüründe uzun yıllardır çay ve besleyici gıda olarak kullanılmaktadır. Bunun baĢlıca nedeni kendilerine has kokuları ve yumuĢak yapılarıdır (Manzi ve ark., 1999). Tatlı ve besleyici bir gıda olarak değerlendirilen birçok yabani mantar türü, dünya genelinde farklı milletler tarafından düzenli olarak toplanır ve sonra direkt olarak ana besin kaynağı olarak kullanılır ya da yemeğe katılırlar. Antik Romalılara göre; mantarlar tanrıların yiyecekleriydi, Mısırlılar mantarları tanrı Osiris‟ten bir hediye olarak nitelendirirken, Çinliler de mantarları hayatın iksiri olarak düĢünmüĢlerdir. Ġlk kavimler, deneme yanılma yoluyla yenilebilen ve yenilemeyen zehirli mantarlar hakkında bilgi sahibi olmuĢlardır (Smith, Rowan ve Sullivan, 2002).
Breene (1990), mantarlar, birçok et ve sütten daha az ancak birçok sebzeden daha çok protein içeren, kolayca sindirilebilir bir protein kaynağıdır. Protein miktarı ( kuru ağırlık ) %10-40 arasında değiĢebilir. Mantarlar esansiyel tüm amino asitleri içerir ancak metiyonin, sistin ve sülfür amino asitlerini az miktarda bulundurur. Ġçeriklerine bakıldığında mantarlar büyük oranda fosfor ve potasyum, az miktarda demir ve kalsiyum dahil, var olan tüm mineralleri geliĢimlerinin tüm basamaklarında bulundururlar. Mantarlar özellikle tiyamin(B1), riboflavin(B2), niyasin, biyotin ve askorbik asit (C vitamini) gibi vitaminlerin kaynağıdırlar. Özellikle Ģapkalı mantar türleri, B1 (thiamin), B2 (riboflavin), B3 (pantotenik asit), B5 (nikotinik asit), B7 (biothin) ve C (askorbik asit) vitamini yönünden zengin besinlerdir. Ayrıca bu mantarlar folik asit bakımından da zengin olduğundan kansızlık tedavisinde kullanılabilir. Mantarlar potasyum, fosfor, kalsiyum, demir ve bakır yönünden de oldukça zengindir. Bazı türler fark edilebilir miktarda β-karoten ve ergosterol içerir. (Bunlar ultraviyole ıĢınlarına maruz kaldıklarında aktif D vitaminine dönüĢürler) Mantarlardaki ham yağlar, yağ asitleri mono-, di- ve tri- gliserid‟leri, sterolleri, sterol esterleri ve fosfolipidleri dahil tüm ana lipid bileĢenlerini içerir. Yağ seviyeleri
genelde düĢük olup kuru mantarın yaklaĢık % 2-8 „ini oluĢturur. Hiç Ģüphesiz yenen mantarların tazeyken ve iĢlendikten sonraki halleri birçok insan için, özellikle de vejetaryenler için önemli bir besin kaynağıdır (Smith, Rowan ve Sullivan, 2002).
Breene (1990), uzun zamandan beri lezzetine ve yapısına değer verilen mantarlar, Ģimdilerde besleyici bir yiyecek olmalarının yanı sıra az da olsa biyolojik aktif maddeleri ile de tanınmaktadırlar (Smith, Rowan ve Sullivan, 2002). Buna bağlı olarak lezzeti bakımından komplementer olan ticari mantarlar ayrıntılı olarak çalıĢılmaktadır (Yang ve ark. 2002).
Bensky ve Gamble (1993), Çin‟de “Yakuzen” ifadesi tıbbi mantarlar için kullanılır. Doğuda birkaç bin yıl önce yenen ve yenilmeyen bazı mantarların sağlığa faydalı olabilecekleri biliniyordu (Smith, Rowan ve Sullivan, 2002). Tedavi amaçlı kullanıldığında tıbbi mantarlar normalde daha çok pudra haline getirilmiĢ konsantreler olarak veya sıcak su ekstraktları yapılarak kullanılır. Sıvı konsantreler veya kurutulup pudra haline getirilmiĢ mantarları içeren kapsüller, ek besin olarak kullanılırlar ve sağlığa potansiyel katkıları vardır (Smith, Rowan ve Sullivan, 2002). Chang ve Buswell (1996), sıvı konsantrasyon halinde veya kuru toz haline getirilmiĢ mantar ekstraktlı kapsüllerin, diyet maddesi veya sağlıklı yaĢamı destekleyecek besin maddesi olarak rahatlıkla kullanılabileceğini bildirmiĢtir (Smith, Rowan ve Sullivan, 2002).
Mantarların tıbbi özellikleri arasında
1- Antimikrobiyal etkileri 2- Antioksidan etkileri
3- Hepatoprotektif etkileri ( karaciğer koruyucu etkileri ) 4- Antidiyabetik etkileri
5- BağıĢıklık sistemini düzenleyici özelliği 6- Antitümör etkileri
7- Kolesterol düĢürücü özelliği
8- ġeker düĢürücü özelliği vardır.
Asfors ve Ley (1993), yeni tedavi yöntemleri üzerine çalıĢan bilimsel kuruluĢlar, bu çalıĢmalarında çok sayıda çeĢitli mantarları da kullanmaktadırlar ve bu mantarlarda antikanserojenik, antiiltihap, bağıĢıklık sistemini destekleyici ve antibiyotik etkileri gibi çeĢitli terapik etkiler keĢfedilmiĢtir. (Türkoğlu ve ark., 2006 a). Wasser ve Weis (1999), son zamanlarda bazı ticari mantarların antitümör, antiviral ve immuno düzenleyici gibi birkaç tedavi edici tıbbi aktivitesi daha bulunmuĢtur (Türkoğlu ve ark., 2006 b).
Breene (1990), tüm mantarlar arasında birkaç türün yada ekstraktlarının antitümör aktivitesi olduğu bildirilmiĢtir. Bu türler: Agaricus bisporus (Lange) Sing.,
Auricularia auricula (L. ex Hook.) Underw, Collybia confluens(Pers: Fr.) Kummer,
Coriolus versicolor (Linnaeus) Fries, Flammulina velutipes (Curtis : Fries) Singer., Ganoderma applanatum (Pers.) Pat., G. lucidum (Leyss. ex Fr.) Karst., Lentinus edodes (Berk.) Sing., Pholiota nameko (T. Ito) S. Ito et Imai, Pleutorus ostreatus
(Pers. ex. Fr.) Konr. et Maubl., Schizophyllum commune Fr., Tremella fuciformis Berk., Tricholoma matsutake (S.Ito. et Imai) Sing. ve Volvariella volvacea (Bulliard: Fries) Singer (Johl ve ark., 1995).
Wasser ve Weis (1999), son zamanlarda Grifola frondosa (Dicks. : Fr.) S.F. Gray‟ nın ve Hericium erinaceus (Bull.:Fr.) Pers.‟un da içinde bulunduğu özel mantarların antitümör, immuno düzenleyici ve kronik bronĢit gibi hastalıklar üzerine tedavi edici etkisi gibi tıbbi aktiviteleri bulunmuĢtur (Mau ve ark., 2002).
Mantarların hipertansiyon, hiperkolesterol ve kanser gibi hastalıklara karĢı koruyucu bir besin olarak kullanıldıkları bildirilmiĢtir. Bu karakteristik fonksiyonların temel nedeni kimyasal kompozisyonlarıdır (Manzi ve ark., 2001).
Mattila ve ark. (2000), C. cibarius diğer yabani mantarların aksine (2,9-5,8 µg/100 µg) yüksek miktarda D2 vitamini içermektedir. Mattila ve ark. (1995), ayrıca
(12,8 µg/100 µg) yetiĢkin bir insanın günlük olarak 5 µg D2 vitamini alması
gerekmektedir (National Research Council. 1989). Bu mantardan günlük olarak 50 g tüketilmesi durumunda, vücudun günlük D2 vitamini gereksinimini karĢılanabilir.
2. GENEL BĠLGĠLER
2.1. Reaktif Oksijen Türleri
Oksijen, insan vücudu metabolizma sürecinde süperoksit, singlet oksijen, hidroksil vb. reaktif oksijen türleri (ROS) oluĢturmaktadır (Sies, 1986; Halliwell ve Aruoma, 1991; Wagner ve ark.,1992). Reaktif oksijen birikimi organizmada bulunan veya gıdalarla alınan antioksidanlarla dengelenmediği durumlarda; oluĢan „oksidatif stres‟ nedeniyle kanser, koroner kalp rahatsızlığı, hücresel yıpranma ve yaĢlanma, mutajenizm, bağıĢıklık sistemi hastalıkları ve lipoprotein (LDL) oksidasyonu ile son bulan, DNA ve hücre membranları gibi duyarlı biyolojik yapıların oksidatif zararını meydana getiren radikalik zincir reaksiyonları oluĢmaktadır (Halliwell ve Aruoma, 1991).
Reaktif oksijen türleri: 1 - Radikaller:
Süperoksit radikal ( O2 -)
Alkoksil radikal ( LO -) Peroksil radikal ( LOO -) 2 - Radikal olmayanlar:
Hidrojen peroksit ( H2O2 )
Lipid hidroperoksit ( LOOH ) Hipoklorik asit ( HOCI) 3 - Singlet oksijen
Ģeklinde sınıflandırılır (Çavdar ve ark., 1997).
McCord (1993), hidrojen peroksit membranlardan kolaylıkla geçip hücreler üzerinde bazı fizyolojik rollere sahip olabilir, fakat çiftlenmemiĢ elektrona sahip
olmadığından radikal olarak adlandırılamaz. Bu nedenle "reaktif oksijen türleri", süperoksit gibi radikaller, ayrıca hidrojen peroksit gibi radikal olmayanlar için ortak olarak kullanılan bir terimdir (Çavdar ve ark. 1997). Halliwell (1991), oksijen molekülü, orbitalinde çiftlenmemiĢ elektron taĢıyorsa süperoksit radikali olarak adlandırılır. Diğer ROS grubunda ise normal oksijenden çok daha hızlı bir biyolojik molekül olan "singlet oksijen" bulunmaktadır. Singlet oksijen molekülü yapısında iki adet çiftlenmemiĢ elektron taĢır. Singlet oksijen hücre membranındaki poliansatüre (çoklu doymamıĢ) yağ asidleriyle doğrudan reaksiyona girerek lipid peroksitlerin oluĢumuna yol açar (Çavdar ve ark., 1997).
Çavdar ve ark. (1997), reaktif oksijen partiküllerinin kaynaklarını Ģu Ģekilde vermiĢlerdir;
I - Normal biyolojik iĢlemler 1 - Oksijenli solunum
2 - Katabolik ve anabolik iĢlemler II - Oksidatif stres yapıcı durumlar
1 - Ġskemi - hemoraji - travma - radyoaktivite - intoksikasyon 2 - Ksenobiotik maddelerin etkisi
a-) Ġnhale edilenler
b-) AlıĢkanlık yapan maddeler c-) Ġlaçlar
3 - Oksidan enzimler a-) Ksantin oksidaz b-) Ġndolamin dioksigenaz c-) Triptofan dioksigenaz d-) Galaktoz oksidaz
e-) Siklooksigenaz f-) Lipooksigenaz g-) Monoamino oksidaz
4 - Stres ile artan katekolaminlerin oksidasyonu
5 - Fagositik inflamasyon hücrelerinden salgılanma (nötrofıl, monosit, makrofaj, eosinofıl, endotelyal hücreler)
6 - Uzun süreli metabolik hastalıklar
7 - Diğer nedenler: Sıcak Ģoku, güneĢ ıĢını, sigara III - YaĢlanma süreci
Kimyasal bileĢikler iki veya daha çok elementin aralarında kimyasal bağ oluĢturması ile meydana gelir. Bu bağlar negatif yüklü elektronlarla sarılmıĢtır ve bu elektronların düzeni bileĢiğe kararlılık sağlar. Serbest radikallerdeki elektronlar kararlı duruma geçmek ister ve kararlı halde bulunan bir bileĢikten elektron alarak, bu bileĢiği yeni bir serbest radikal haline dönüĢtürür. Serbest radikallerin baĢlattığı bu zincirleme reaksiyonlar dizisi, antioksidanlar tarafından durduruluncaya kadar devam eder (Gökpınar ve ark., 2006).
Halliwell ve Guttridge (1991), oksidasyon yaĢayan çoğu organizmanın biyolojik sürecinde enerji üretimi için Ģarttır. Bununla birlikte kontrolsüz oksijen türevli radikallerin üretimi, kanser, eklem romatizması, siroz, damar tıkanıklığının yanı sıra yaĢlanmayla süreciyle ilgili bozulmaları da içeren birçok hastalığın baĢlangıcını tetikler. Ġnsan vücudunda dıĢ kaynaklı kimyasallar ve iç kaynaklı metabolizmik süreç ya da yiyecekler belki de serbest radikalleri özellikle biyomolekülleri okside etme yeteneğine sahip olan ve sonuçta hücreleri öldüren ve böylece dokulara zarar veren ROS‟ ları yüksek miktarda üretmektedir (ElmastaĢ ve ark., 2006). Serbest radikallerin birikimiyle DNA‟da meydana gelen oksidatif bozulmanın ve proteinler ile diğer makromoleküllerin zamanla birikimi, yaĢlanmaya neden olan önemli iç faktörler olarak varsayılmaktadır (Harman, 1981). Halliwell ve Gutteridge (1999), lipid epoksidaz, hidroksiperoksidaz, alkoksil ve peroksil
radikalleri ve lipid peroksidasyonu gibi etmenler mutajenikliği arttırmalarının yanı sıra yiyeceklerin renginin, tadının, yapısının ve besin değerinin bozulmasında da büyük bir rol oynarlar (Gezer ve ark., 2006).
Halliwell ve Gutteridge (2003), Gülçin ve ark., (2002 a,b), yaĢlanmayla beraber antioksidan koruma mekanizmasında dengesizlikler meydan geldiği zaman, belki de fizyolojik fonksiyonlarda bozulmalar meydana gelerek sonuçta hastalıkları ve hızlı yaĢlanmayı tetiklemektedir (ElmastaĢ ve ark.,2007). Bununla birlikte, antioksidan ilaveleri yada antioksidan içeren besinler belki de insan vücudundaki oksidatif zararı azaltmaya yardımcı olmaktadırlar (Yang ve ark.,2002). Ayrıca ROS‟ un neden olduğu hastalıklardan korunmada önemli roller oynarlar (Willcox ve ark., 2004).
2.2. Antioksidanlar
Antioksidanlar serbest radikallerin zararlı etkilerini önemli ölçüde azaltabilen bileĢiklerdir (Halliwell ve Aruoma, 1991).
Halliwell (1991), düzgün çalıĢan bir metabolizmada mitokondriyel sitokrom sistemi, sitozoldaki organelleri oksidanların zararlı etkilerinden korur. Bu sistemin yetersiz kaldığı durumlarda doğal enzimler devreye girer. Enzimlerce etkisiz hale getirilemeyen oksidanlar ilk olarak hücre membranındaki lipidleri etkileyerek “lipid peroksidasyonu”nu baĢlatır. Lipid peroksidasyonunda, membranlarda bulunan çoklu doymamıĢ yağ asitleri (PUFA), serbest oksijen radikalleri tarafından peroksitlenir ki bu olay; PUFA‟nın alkoller, aldehitler gibi çeĢitli ürünlere yıkılması reaksiyonudur ve sonuçta ortaya çıkan biyo-aktif aldehitler hücre hasarına neden olur (Benzer ve Ozan 2003). Lipid peroksidasyonu sırasında yeterli düzeyde E vitamini (tokoferol) ve C vitamini (askorbik asit) gibi antioksidan vitaminlerin bulunması halinde bu tip hücresel hasarların önüne geçilebilir (Gökpınar ve ark., 2006).
2.2.1. Antioksidanların sınıflandırılması
Antioksidanlar, doğal ve yapay antioksidanlar olmak üzere iki sınıfa ayrılırlar.
2.2.1.1. Doğal antioksidanlar
Doğal antioksidanların baĢında tokoferoller, flavonoidleri fenolik asitler, askorbik asit ve karotenoidler gelir.
2.2.1.1.1. Tokoferoller
Shi ve ark. (2001), tokoferoller en iyi bilinen ve en geniĢ kapsamlı kullanılan antioksidanlardır. Tokoferoller ve tokotrienoller olmak üzere iki gruba ayrılırlar ve her iki grup için dört izomer (α-, β-, γ- ve δ-) vardır. Böylelikle toplam sekiz tokoferol izomeri bulunmaktadır. Hemen hemen tüm gıdalarda eser miktarda dahi olsa bulunurlar. Bu gruptaki en önemli antioksidan E vitamininin en aktif formu olan α-tokoferoldür (Can ve ark., 2005). Maslarova (2001), tokoferoller, hidroksil grubunun hidrojenini lipid peroksil radikaline vererek antioksidatif aktivite göstermektedirler. α-Tokoferolün aynı zamanda hidroperoksitlerin dekompozisyonunu yavaĢlattıkları da bilinmektedir. Tokoferoller ısıya karĢı oldukça dayanıklıdırlar. α-Tokoferolün oksidatif stabiliteyi artırmada ve sıcaklık arttıkça oksidasyon hızını azaltmada etkili olduğu bildirilmiĢtir (Can ve ark., 2005). Bir molekül -tokoferol 100 molekül PUFA‟nın peroksidasyonunu engelleyebilir (AkkuĢ 1995).
ġekil 1. - tokoferolün kimyasal formülü
2.2.1.1.2. Flavonoidler
Shi ve ark. (2001), flavonoidler, genellikle bitkilerde bulunan ve günlük diyetle sıklıkla tüketilen difenilpropanlardır. En önemli flavanoid kaynakları sebzeler, meyveler ve bunlara ait içeceklerdir (Can ve ark., 2005). Maslarova (2001), flavonoidler, C6–C3– C6 karbon iskeleti ile karakterize edilmektedirler. Iki aromatik halka, üç karbonlu bir alifatik zincir ile birbirine bağlanmaktadır. Flavon, flavonol, izoflavon, flavonon ve çalkonları içeren flavonoidler tüm bitki dokularında bulunmaktadırlar. (Can ve ark., 2005). Shi ve ark. (2001), flavonoidler, antioksidatif aktivitelerini ksantin oksidaz, lipoksijenaz ve siklooksijenaz gibi oksidatif enzimleri inhibe ederek, metal iyonları ile Ģelat oluĢturarak, diğer antioksidanlar ile etkileĢime girerek ve süperoksit anyonları, lipid peroksil radikalleri, hidroksil radikalleri gibi serbest radikalleri yakalayarak göstermektedirler (Can ve ark., 2005).
ġekil 2. Flavonoidlerin genel kimyasal formülü
2.2.1.1.3. Fenolik asitler
p-Hidroksibenzoik, 3,4-dihidroksibenzoik, vanillik, syringic, p-kumarik, kafeik, ferulik, sinapik, klorojenik ve rosmarinik asit bitkilerde sıklıkla rastlanılan fenolik asitlerdendir. Organik asit esterleri veya glikozitler Ģeklinde bulunmaktadırlar. Pozisyon ve hidroksilasyon dereceleri, antioksidatif aktiviteyi belirlemede öncelik taĢımaktadır (Awad ve Jager, 2003).
ġekil 3. Genel bir fenolün kimyasal formülü
2.2.1.1.4. Askorbik asit
C vitamininin meyvelerde bulunan en baskın formu askorbik asittir. Primer
oksidasyon ürünü olan L-Dehidroksiaskorbik asit (DHA) de biyolojik aktiviteye sahip olduğu için önemlidir. Meyvelerdeki ortalama DHA miktarı, toplam C vitamini içeriğinin %10‟undan azdır. Okside olmuĢ olan form dekompozisyona daha dayanıksız olduğu ve biyolojik aktivite kaybına yol açtığı için, askorbik asit formlarındaki değiĢiklikler hem teknolojik hem de besinsel açıdan önemlidir (Cordenunsi ve ark., 2004).
ġekil 4. Askorbik asidin kimyasal formülü
2.2.1.1.5. Karotenoidler
Langseth (2000), bitkilerde ve hayvansal dokularda bulunan kırmızı-sarı pigmentlerdir. Gıdalarda bulunan karotenoidler, sekiz tane beĢ karbonlu izoprenoid biriminin biraraya gelmesiyle oluĢan 40 C‟lu polienlerdir. Doğada 670‟ten fazla karotenoid bulunmakta ve bunların çoğu antioksidatif aktivite göstermektedir. Gıdalarda bulunan en önemli karotenoidler β-karoten, α-karoten, likopen, lutein ve β- kriptoksantindir. β-Karoten, vücutta A vitaminine dönüĢtürülmektedir. Sarı-turuncu
renkli meyve ve sebzeler, koyu yeĢil renkli sebzeler karotenoid kaynağı gıdalar olarak gösterilmektedir (Can ve ark., 2005).
ġekil 5. - karotenin kimyasal formülü
Niki ve ark. (1994), organizmaların hemen hemen tamamı serbest radikallerin zararlarına karĢı süperoksid dismutaz (SOD) ve katalaz (CAT) gibi oksidatif enzimlerle yada α-tokoferol, askorbik asid, karotenoidler, polifenoller ve glutatyon ile iyi korunmaktadırlar (Mau ve ark., 2002). Simic (1988), hemen hemen tüm organizmalar antioksidan kökenli savunma ve tamir sistemine sahip olmasına rağmen bunların oksidatif zarara karĢı koruyuculukları yaĢlanmayla etkisini yitirerek zarara karĢı koruyuculuğu etkisiz hale gelir (Türkoğlu ve ark.,2006). Sonuçta kanser, kalp-damar hastalıkları, bağıĢıklık sistemi zayıflıkları, beyin fonksiyonları bozuklukları ve katarakt gibi vücudu dejenere eden hastalıklar baĢ gösterir (Ames ve ark., 1993).
Enstrom ve ark. (1992), Rimm ve ark. (1993), Stampfer ve ark. (1993), sebze ve meyvelerin C, E vitamini ve β-karoten gibi antioksidanlar bakımından zengin kaynaklar olduğu antiepidemilojikal çalıĢmalarda antiatherojenik olduğu ileri sürülmüĢtür (Gezer ve ark., 2006). Son zamanlarda besin materyallerindeki fitokimyasallar ve onların insan sağlığına olan etkileri özellikle aktif oksijeni baskılayan çaylar, baharatlar ve bitkiler gibi doğal antioksidanlar kapsamlı olarak çalıĢılmaktadır (Ho ve ark., 1994). Mantarlar da fenolik bileĢikleri, polikedleri, terpenleri ve steroidleri içeren çeĢitli sekonder metabolizma ürünlerini biriktirirler. Fenolik bileĢiklerin LDL oksidasyonunun inhibisyonunda antioksidan aktivite gösterdikleri bulunmuĢtur (Teissdre ve Landrault, 2000). Liu ve ark. (2002), mantarlar genellikle serbest radikalleri süpürme etkisine sahip, polisakkaridler ve polifenoller gibi çok çeĢitli moleküller barındırılar (Cui ve ark., 2005).
2.2.1.2. Sentetik antioksidanlar
Löliger (1991), sentetik antioksidanlar yiyeceklerin bozulmadan uzun süre saklanabilmesinde kullanılmaktadırlar. En yaygın olarak kullanılan sentetik antioksidanlar butillenmiĢ hirokdisi anisol (BHA), butillenmiĢ hirokdisi toluen (BHT) ve üçüncü dereceden butillenmiĢ hidroksikinon (TBHQ)‟ dur (Türkoğlu ve ark., 2006). Son birkaç yıldır doğal ürünlerin içine artan miktarlarda ilave edilen bazı sentetik bileĢiklerin toksik özelliğinden Ģüphelenilmektedir (Stone ve ark., 2003). Halliwell (1997), Halliwell ve Gutteridge (1999), toptan gıda üreticileri, kozmetikçiler ve eczacılar gibi bazı endüstri kuruluĢları, ekstraksiyon ve saflaĢtırma ile doğal ürünlerden biyoaktif bileĢikler hazırlama çabası içerisindedirler. Antioksidan bileĢikleri, üretimi ve muhafazası sürecinde gıda ürünlerinin bozulmasının temel sebeplerinden biri olan lipid peroksidasyonu sürecini geciktirirler ve serbest radikalleri süpürebilirler (Barros ve ark., 2007). Buna göre bilhassa son yıllarda artan, bitkisel orijinli doğal antioksidanlar için araĢtırma yapılması ve doğal güvenilir kaynaklardan alternatif gıda antioksidanları keĢfedilmesi gerekmektedir (Skerget et al., 2005).
2.2.2. Antioksidanların etki mekanizmaları
Gökpınar ve ark. (2006), antioksidanlar baĢlıca dört yolla oksidanları etkisiz hale getirirler;
1. Süpürme etkisi (Scavenging): Oksidanları daha zayıf yeni bir moleküle dönüĢtürerek etkisizleĢtirir. Antioksidan enzimler ve mikromoleküller bu yolla etki eder.
2. Söndürme etkisi (Quenching): Oksidanlara bir hidrojen aktararak inaktive etmesine denir. Vitaminler, flavanoidler, timetazidin ve mannitol bu Ģekide etki eder. 3. Zincir reaksiyonlarını kırma etkisi (Chain Breaking): Hemoglobin, serüloplazmin ve ağır mineraller oksidanları kendilerine bağlar ve inaktive eder.
4. Onarma etkisi (Repair): Oksidatif hasar görmüĢ biyomolekülü onarırlar.
2.3. Antimikrobiyal Aktivite Bakımından Makrofunguslar
Dünya nüfusunun giderek artması, beslenme ve sağlıkla ilgili sorunları da artırmıĢtır. Günümüzde bilim ve teknolojideki büyük ilerlemelere rağmen, doğal kaynakların bilinçsizce tüketimi ve karĢılaĢılan ekonomik güçlükler, doğal kaynakların çok amaçlı kullanılmalarını zorunlu kılmıĢtır. Diğer taraftan enfeksiyöz hastalıklarla mücadelede bugüne kadar geliĢtirilen doğal ve sentetik antibiyotiklerin, mikropların direnç kazanmaları sonucu etkisiz kalmaları ve çeĢitli yan etkilerinin bulunması, tıp ilmini yeni ve değiĢik antimikrobiyal maddeler keĢfetmek için doğaya yöneltmiĢtir. Doğal kaynaklar bakımından oldukça zengin olan ülkemizde sahip olduğumuz en önemli değerlerden birisi de halkımızın tükettiği doğal bir besin durumunda olan makrofunguslardır (Duman ve ark., 2003). Son yıllarda bulaĢıcı hastalıkların tedavisinde kullanılan birbirinden farksız ticari antimikrobiyal ilaçlara ve çok yönlü droglara dirençli insan patojeni mikroorganizmalar geliĢmektedir. Bilim adamaları alıĢılmamıĢ olan çeĢitli antimikrobiyal kemoterapik ajanların kaynaklarından yeni antimikrobiyal maddeler bulmak için çaba sarfetmektedirler (Kararman ve ark., 2003).
Avrupada G. pfeifferi Bres.‟ den üretilen Ganomisin olarak adlandırılan terpenoid methisillin antibiyotiği dirençli Staphylococcus aureus ve diğer bakterilerin geliĢmelerini inhibe etmiĢtir (Mothana ve ark., 2000).
Gao ve ark. (2005), tıbbi bitkilerden elde edilen doğal bileĢiklerin çoğunun antimikrobiyal aktiviteye sahip olduğu bildirilmiĢtir (Harris ve ark., 2001) ve bu bitkilerdeki antimikrobiyal kimyasallar terpenler, steroidler, flavonlar, saponinler, komarinler ve alkoloidler gibi farklı sınıfları içerir (Srivastava ve ark., 2000).
Kaneda ve Tokuda alınan besinin %5‟ i L. edodes mantarı ile desteklendiğinde plazmadaki kolesterolü önemli ölçüde düĢürdüğünü göstermiĢlerdir (Tokita ve ark., 1972).
Aktif iki mantar bileĢiği olan polisakkaridler ve peptidoglukan kimyasal yapısı ve izolasyonu gibi çalıĢmalarla en çok araĢtırılan konu olmaya devem eden farmakolojik olarak aktif iki mantar bileĢiğidir. On yıl önceki araĢtırmalarda L.
edodes‟ in lentinanının, Schizophyllum commune‟ nin Ģizofilanının, Grifola frondosa
(Dickson : Fr.) S.F.Gray‟ nın grifolanının ve Sclerotinia sclerotiorum (Lib.) de Bary‟ un beta-1,3-glukanının önemli ölçüde antitümör aktiviteleri oldğuğu bulunmuĢtur (Fan ve ark., 2006). G. pfeifferi ve diğer Ganoderma türlerinden izole edilen ganodermadiol, lusidadiol ve applanoksidik asid G, influenza virüs tip A‟ ya karĢı antiviral aktivite göstermiĢlerdir. Dahası, ganodermadiol uçuk ve diğer semptonlara neden olan herpes simpleks virüs tip 1‟ e karĢı antiviral aktivite göstermiĢtir (Mothana ve ark., 2003). Trametes versicolor (L.) Lloyd‟ den izole edilen protein bağlı polisakkaridler olan PSK ve PSP‟ nin hücrede HIV‟ e ve sitomegalovirüse karĢı antiviral etki göstermiĢtir (Ichimura ve ark., 1998).
2.4. Yağ Asitleri
Demirci (2005), yağlar, insan beslenmesinde karbonhidrat ve proteinlerle birlikte diyetle alınması zorunlu olan besin öğelerinden olduğunu bildirmiĢtir (TaĢan ve Geçgel, 2007). Kayahan (2000), toplumlarda ortaya çıkabilen sağlık sorunları ile beslenme rejimleri arasındaki iliĢki araĢtırıldığında en fazla sorgulanan gıda bileĢeni yağlar olduğu ve bu nedenle yağ tüketiminde, yağ çeĢidi seçiminden tüketim Ģekline kadar uzanan her aĢamada daha bilinçli ve duyarlı olmak gerektiğine değinmiĢtir. (TaĢan ve Geçgel, 2007).
Katı ve sıvı yağlar, gliserol ve yağ asitlerinden oluĢan trigliseritlerin hakim olduğu bileĢikler grubudur (Karaca ve Aytaç 2007). Baydar (2000), yağı meydana getiren öğelerden gliserolün, bütün yağ bitkilerinde aynı, buna karĢılık yağı oluĢturan diğer unsur olan yağ asitlerinin her bir yağ bitkisinde farklı bir kompozisyonda bulunduğunu bildirmiĢtir (Karaca ve Aytaç 2007). Yağların fiziksel ve kimyasal özelliklerini içerdikleri yağ asitlerinin kompoziyonu belirlemektedir. Bu özelliklerine göre, yemeklik sıvı yağ, sabun, parfümeri ve diğer endüstri kollarında kullanılmasını sağlamaktadır (Karaca ve Aytaç 2007).
Nas ve ark., (2001), Kayahan (2003), yağ asidi, yapısında karboksil grubu (-COOH) taĢıyan düz bir hidrokarbon zinciri olup, yağın en önemli öğesidir. Yağlarda hakim yağ asitleri, çift karbon atomu sayılı ve bir karboksil grubu içeren yağ asitleridir (Karaca ve Aytaç 2007). Baydar (2000), yağ asitleri; hidrokarbon
zincirinde karbon sayısı, karbon atomları arasında çift bağ bulunup bulunmaması, çift bağ varsa yeri ve sayısı gibi özelliklerine göre birbirlerinden ayrılırlar (Karaca ve Aytaç, 2007).
O ||
CH3 – (CH2)x – C-OH
{ Alifatik Zincir }{ Karboksil Grubu } ġekil 6. Bir yağ asidinin genel formülü
2.4.1. Yağ asitlerinin sınıflandırılması
Doğal yağlarda bulunan yağ asitleri genelde düz zincir türevleri olup doymuĢ (saturated fatty acids) ve doymamıĢ (unsaturated fatty acids) yağ asitleri olmak üzere 2 Ģekilde sınıflandırılır.
2.4.1.1. DoymuĢ yağ asitleri
Nas ve ark. (2001), karbon-karbon atomları arasında tek bir kovalent bağdan (-C-C-) oluĢan ve Anon (2004), oda sıcaklığında genelde katı olan yağ asitleri doymuĢ yağ asitleri olarak adlandırılır. Bu yağ asitlerince zengin olan yağlara da doymuĢ yağlar denir (Karaca ve Aytaç 2007), (ġekil. 7).
ġekil 7. DoymuĢ yağ asidi zincirinde C atomları
Kümeli (2006), Laurik asit (C12:0), Miristik asit (C14:0), Palmitik asit (C16:0), Stearik asit (C18:0), Arasidik asit, (C20:0) ve Behenik asit (C22:0) bitkisel yağlarda bulunan en önemli doymuĢ yağ asitleridir. Özellikle palmitik ve stearik asit bitkisel yağlarda bulunan en yaygın doymuĢ yağ asitleridir DoymuĢ yağ asitleri insan vücudunda da sentezlenirler; hiç yağ yenilmese dahi bu tip yağ asitleri karbonhidrat metabolizması ile oluĢan moleküllerden sentez edilebilir (Karaca ve Aytaç, 2007).
2.4.1.2. DoymamıĢ yağ asitleri
Karbon zinciri üzerinde çeĢitli konumlarda, korbon- karbon arasında bir veya daha fazla kovalent çift bağ içeren yağ asitleri doymamıĢ yağ asitleri olarak isimlendirilir (ġekil 8). Bu yağ asitlerince zengin olan yağlara da doymamıĢ yağlar denir (Nas ve ark., 2001).
ġekil 8. DoymamıĢ yağ asidi zincirinde C atomları
Nas ve ark. (2001), yapılarındaki çift bağlar nedeniyle, doymamıĢ yağ asitleri doymuĢ yağ asitlerine göre daha reaktiftir. Bu reaktivite yağ asidi zincirindeki çift bağ sayısına göre artmaktadır (Karaca ve Aytaç, 2007). Kümeli (2006), doymamıĢ yağlar vücudun gereksinim duyduğu zorunlu yağ asitlerindendir. Oda sıcaklığında sıvı haldedirler ve büyük çoğunluğu bitkisel kaynaklıdır (Karaca ve Aytaç, 2007).
2.4.1.2.1. Tekli doymamıĢ yağ asitleri
Kayahan (2003), yapılarında bir çift bağ içeren yağ asitleri tekli doymamıĢ (monoansature) yağ asitleri veya monoenoik yağ asitleri olarak isimlendirilir. Bu grubun en önemli iki üyesi, palmitoleik asit (C16:1) ile oleik asittir (C18:1). Bunlardan palmitoleik asit daha çok deniz hayvanları yağları için karakteristik bir bileĢen olduğu halde, oleik asit bugüne değin bilinen bütün doğal yağların yapısında
yer almıĢtır (Karaca ve Aytaç 2007). Kümeli (2006), zeytin ve kolza yağları, kabuklu yemiĢler (fındık, fıstık, ceviz) kabuklu yemiĢ yağları (yerfıstığı ve badem yağları), avokado tekli doymamıĢ yağ asitlerini yüksek oranda içermektedirler (Karaca ve Aytaç 2007).
2.4.1.2.2. Çoklu doymamıĢ yağ asitleri
Birden fazla çift bağ içeren yağ asitleri ise çoklu doymamıĢ (poliansatüre, PUFA) yağ asitleri veya polienoik yağ asitleri olarak isimlendirilir. Linoleik (C18:2), linolenik (C18:3), araĢhidonik (C20:4), eikosapentaenoik (C22:5) ve dokosahexaenoik (C22:6) asitler çoklu doymamıĢ yağ asitlerinin en önemlileridir. Çoklu doymamıĢ yağ asitleri beslenmede önemli esansiyel yağ asitleridir; F vitamini olarak da adlandırılmaktadırlar. Bunların yağlar ve çeĢitli yağ ürünlerinde belli düzeylerde bulunmaları arzu edilmektedir (Nas ve ark., 2001).
3. KAYNAK ARAġTIRMASI
Tokita (1972), L. edodes‟ den kolesterol düĢürücü madde elde etmiĢtir.
Mattila ve ark. (1995) yenilebilen bazı mantarların fonksiyonel özelliklerini araĢtırmıĢtır.
Wasser ve Weis (1999), Basidiomycetes‟ lerin tıbbi özellikleri hakkında bir reviev yayınlamıĢlardır.
Mattila ve ark. (2000), Ġtalya‟da yaygın olarak tüketilen mantarların fonksiyonel özelliklerini araĢtırmıĢlardır.
Smith ve ark. (2002), mantarların antikanserojenik özellikleri baĢta olmak üzere birçok tıbbi özellikleri hakkında Ġngiltere Kanser AraĢtırma Kurumu adına bir reviev hazırlamıĢlardır.
Liu ve ark. (1997), mantarlardan elde edilen bazı polisakkarid ekstarktlarının serbest radikalleri süpürme kapasitesini belirlemiĢlerdir.
Chao (2001), bazı Auricularia türlerinin antioksidan özelliklerini ve polisakkarid bileĢikleri içeriğini incelemiĢtir.
Yang ve ark. (2002), bazı ticari mantarların antioksidan kapasitelerini tespit etmiĢlerdir.
Mau ve ark. (2002), bazı özel mantarların antioksidan kapasitelerini tespit etmiĢlerdir.
Cheung ve ark. (2003), bazı yenebilen mantarların antioksidan kapasitelerini ve toplam fenolik bileĢik içeriklerini tespit etmiĢlerdir.
Lo ( 2005), A. bisporus, Pleurotus eryngii (DC.) Gillet, P. ferulae (Lanzi) X.L. Mao ve P. ostreatus (Jacq.) P. Kumm.‟ un antioksidan aktivitelerini araĢtırmıĢtır.
Cui ve ark. (2005), Inonotus obliquus (Ach. ex Pers.) Pilát‟ un antioksidan etkilerini incelemiĢlerdir.
Zhan ve ark. (2006), Cordyceps militaris (L.) Link‟ in antioksidan kapasitesini araĢtırmıĢlardır.
ElmastaĢ ve ark. (2007), doğadan toplanıp tüketilen bazı mantarların antioksidan özelliklerini ve içerdikleri antioksidan bileĢikleri belirlemiĢlerdir.
Barros ve ark. (2007), Portekiz‟de doğadan toplanıp tüketilen bazı mantarların antioksidan kapasitelerini ve içerdikleri antioksidan bileĢikleri belirlemiĢlerdir.
Tsai ve ark. (2007), A. blazei, Agrocybe cylindracea (DC.) Gillet ve Boletus
edulis Bull.‟in antioksidan aktivitelerini belirlemiĢlerdir.
Gezer ve ark. (2006), doğadan toplanıp tüketilen bazı mantarların serbest radikalleri süpürme kapasitesini ve antimikrobiyal etkisini araĢtırmıĢlardır.
Türkoğlu ve ark. (2006 a), Morchella conica (Pers.) Boudier’ nın antioksidan ve antimikrobiyal aktivitelerini belirlemiĢlerdir.
Türkoğlu ve ark. (2006 b), Laetiporus sulphureus (Bull.) Murrill’ un antioksidan ve antimikrobiyal aktivitelerini belirlemiĢtir.
Kitzberger ve ark. (2007), Lentinula edodes‟in antioksidan ve antimikrobiyal etkilerini tespit etmiĢlerdir.
Türkoğlu ve ark. (2007), Russula delica Fr.‟ nın antioksidan ve antimikrobiyal etkilerini belirlemiĢlerdir.
Coletto ve ark. (1995), Basidiomycetes‟lerin antibiyotik özelliklerini
incelemiĢlerdir.
Smania ve ark. (1995), G. applanatum (Pers.) Pat‟ dan izole edilen streroid bileĢiklerin antimikrobiyal aktivitesini tespit etmiĢlerdir.
Dülger ve ġen (1997), R. delica makrofungusunun antimikrobiyal aktivitesini belirlemiĢlerdir.
Dülger ve Arslan (1998), Coriolus versicolor (L. ex Fr.) Quèl. makrofungusunun antimikrobiyal aktivitesini tespit etmiĢlerdir
Hirasawa ve ark. (1999), L. edodes‟den üç çeĢit antimikrobiyal maddenin izolasyonunu yapmıĢlardır.
Dülger ve ark. (1999), Tricholoma terreum (Fr.) Kummer mantarının antimikrobiyal etkisini tespit etmiĢlerdir.
Mothana ve ark. (2000), G. pfeifferi Bres‟ nden iki yeni antimikrobiyal madde olan Ganomsin A ve B elde etmiĢlerdir.
Die´z ve Alvarez (2001), Kuzeydoğu Ġspanya‟da tüketilen iki yabani mantarın bileĢimlerini ve besin değerlerini tespit etmiĢlerdir.
Hatvani (2001), L. edodes‟in misellerinin ekstraktlarının antimikrobiyal aktivitesini araĢtırmıĢtır.
Dülger ve ark. (2002), bazı Lactarius türlerinin antimikrobiyal aktivitelerini araĢtırmıĢlardır.
Duman ve ark. (2003), M. conica ve Suillus luteus (L.) S.F.Gray makrofunguslarının antimikrobiyal aktivitelerini tespit etmiĢlerdir.
Jonathan ve Fasidi (2003), Lycoperdon pusillum Hedw. ve Langermannia
gigantea (Batsch.) Rostk‟ un antimikrobiyal aktivitesini belirlemiĢlerdir.
Mothana ve ark. (2003), G. pfeifferi Bres.‟ nden izole edilen triterpenlerin antiviral aktiviteleri belirlemiĢlerdir.
Hur ve ark. (2004), Phellinus linteus (Berk. & M.A. Curtis) Teng mantarının methisillin antibiyotiğine dirençli Staphylococcus aureus bakterisi üzerine etkisini araĢtırmıĢlardır.
Dülger ve ark. (2004), C. cibarius‟ un antimikrobiyal aktivitesini belirlemiĢlerdir.
Gao ve ark. (2005), tıbbi bir mantar olan Ganoderma sp. türlerinin antimikrobiyal etkileri üzerine bir reviv hazırlanmıĢtır.
Yamaç ve Bilgili (2006), bazı mantarlardan elde edilen izolatların antimikrobiyal aktivitesini araĢtırmıĢlardır.
Solak ve ark. (2006), Clitocybe alexandri (Gill.) Konr. ve Rhizopogon roseolus (Corda) T.M mantarlarının antimikrobiyal aktivitesi araĢtırmıĢlardır.
Maga (1981), Mantarlar ın lezzetini sağlayan faktörler üzerine çalıĢma yapmıĢtır.
Brene (1990), birkaç özel mantarın besin değeri ve tıbbi özelliklerini belirlemiĢtir.
Longvah ve Deosthale (1998), Kuzeydoğu Hindistan‟ın tüketilen yabani mantarlarının bileĢimlerini ve besin değerlerini araĢtırmıĢlardır.
Aktümsek ve ark. (1998), A. bisporus‟ un yağ asidi bileĢimini belirlemiĢlerdir.
Yılmaz ve ark. (2006), Orta Karadeniz Bölgesi‟nde yetiĢen bazı yenebilen yabani mantarların yağ asitleri bileĢimlerini tespit etmiĢlerdir.
Barros ve ark. (2007), Portekizin kuzeydoğusundaki tüketilen beĢ yabani mantarın yağ asidi içerikleri, Ģeker bileĢimleri ve besin değerlerini araĢtırmıĢlardır.
4. MATERYAL VE METOT
4.1. Makromantarların Toplanması, TeĢhisi ve Genel Özellikleri
ÇalıĢmalarımızda kullandığımız her iki mantar da, yüksek yapılı Ģapkalı mantarlardan olup yöre halkı tarafından sevilerek tüketilen ve yurt dıĢından da çok rağbet görüp ihraç edilen türlerdir. Mantarlardan C. cibarius ilkbaharda Ordu‟ dan, T.
anatolicum ise sonbaharda Karaman‟dan toplanıp, Selçuk Üniversitesi Mantarcılık
AraĢtırma ve Uygulama Merkezi‟ nde Yard.Doç.Dr. H.Hüseyin DOĞAN tarafından teĢhis edilmiĢlerdir.
Tricholoma anatolicum Doğan & Intini‟ un genel özellikleri;
Regnum : Mycetae Divisio : Basidiomycota Classis: Basidiomycetes Ordo: Agaricales
Familia : Tricholomataceae
Species : Tricholoma anatolicum Doğan & Intini, Tricholoma anatolicum Spec. Nov.: A New Member of The Matsutake Group, Micol. e Veget. Medit., 18, 2: 135-142 (2003).
ġapka; 4-20 cm çapında, önce sapa bitiĢik topuz Ģeklinde, sonra açılarak yarı kubbe Ģeklinden düzgünleĢir. Gençken beyaz-krem, geliĢme ilerleyince sarımsı kreme döner. Yüzeyi ince yünümsü tüylü, kenarında yünümsü velar kalıntılar asılı bulunur (ġekil 9).
Etli kısım; 2-5 cm kalınlığında, beyaz, sıkı yapılı ve dolgun, katran kokusunda ve tadı çok güzeldir.
Lameller; krem beyaz, sapa ince bir girinti yaparak birleĢir.
Sap; 4-10 x 2-5 cm, silindirik ve tabana doğru biraz incelmektedir. Önce beyaz, sonra krem beyazdan krem sarıya döner. Üzerinde ince yünümsü yapıda velar kalıntılar ve annulus bulunur.
Sporlar; 6-7.5 x 4-5 µ, geniĢ eliptik veya subgloboz, renksiz, siyanofiliktir. Spor baskısı krem beyazdır.
YetiĢme yeri özellikleri; Sedir ormanı içinde kumlu yerlerde sedir ağacı ve
Astragalus’ ların dibinde ektomikorhizal yaĢamaktadır.
Diğer özellikleri; Endemik bir türdür. Ġlk kez Doğan (2001) tarafından doktora çalıĢmaları sırasında belirlenmiĢ ve tezde cins seviyesinde verilmiĢtir. Intini ve Ark. (2003) te ise yeni tür olarak bilim dünyasına tanıtmıĢlardır. Amerika‟da bol miktarda yetiĢen Tricholoma magnivelare ve Japonya‟daki Tricholoma matsutake’ye çok benzemektedir. Bu iki türden bazı morfolojik özellikleri, yetiĢme yeri özellikleri ve belirgin kokusuyla ayrılmaktadır. Ayrıca yapılan DNA analiz sonucuna göre belirtilen iki türden kesin hatla ayrıldığı da belirlenmiĢtir.
Yalnızca Akdeniz bölgesinde sedir ağaçlarının bulunduğu yerlerde ve kumlu alanlarda, Ekim ve Kasım aylarında, hava Ģartları iyi olursa Aralık ayında yetiĢir. Yöre halkı mantarı tanımakta ve “Katran Mantarı” ismi verilmektedir. Mantar bol miktarda toplanarak yurt dıĢına özellikle Japonya‟ ya ihraç edilmektedir.
Cantharellus cibarius Fr.‟ un genel özellikleri;
Regnum : Mycetae Divisio : Basidiomycota Classis : Basidiomycetes Ordo: Cantharellales Famillia : Cantharellaceae
Species : Cantharellus cibarius Fr., Syst. mycol. (Lundae) 1: 318 (1821) var. cibarius
ġapka; 3-6 cm çapında, genç mantarlarda yarım küre Ģeklinde, geliĢmiĢlerde ise huni Ģeklini alır. Mantarın rengi sarımsı beyazdan, yumurta sarısı rengine kadar değiĢir. ġapka üstü mumsu bir görünüĢte, ıslandığı zaman mantarın üstü yağımsı görünüĢlü olur (ġekil 10).
Etli kısım; lifli yapılı, az sulu, rengi sarımsı beyaz, genç mantarlarda tadı hoĢ, geliĢmiĢlerde ise acımsı, piĢirilince bu acılık hissedilmez. GeliĢmiĢ mantar uzun zaman toprakta kalırsa kurtlanma görülür.
Lameller; decurrent sap üzerinde 1-1,5 cm kadar devam eder. Eni dar, damar Ģeklinde ve Ģapka kenarına doğru ucu çatallanır ve yanındaki lamellerle birleĢir. Renk Ģapkayla aynı, yumurta sarısıdır.
Sap; 3-5 cm boyunda, 1-2 cm çapında, genellikle silindir Ģekilli, Ģapkaya doğru geniĢler. Sarımsı- beyazdan, yumurta sarısı rengine kadar değiĢir
Sporlar; 8,5 x 5 µ, eliptik ve bir tarafında küçük bir çıkıntısı bulunur. Üzeri halka Ģeklinde süslü ve bunların üzerinde siyah noktacıklar görülür.
YetiĢme yeri özellikleri; Mantar orman içlerinde görülürse de kayın, köknar, ve meĢe ormanlarında yayılıĢ göstermektedir. Memleketimizde ise mantarın, bu ormanlarda haziran ayından kasım ayına kadar toplaması mümkündür.
Diğer özellikleri; Mantar yenen bir tür olup, kendisine benzer aldatıcı bir mantar türü yoktur. Avrupa ülkelerinde her zaman alıcı bulabilmektedir. Karadeniz bölgesinde, yukarıda bahsedilen ormanlardan toplamak mümkündür. Bolu ili çevresinde “cüce kız”, “meĢe mantarı” gibi isimlerle Giresun ve Ordu çevresinde ise “Tavuk bacağı mantarı”, ve “Tirmit” olarak bilinmektedir.
ġekil 9. Tricholoma anatolicum Doğan Intini
ġekil 10. Cantharellus cibarius Fr.
4.2. Mantarların Antioksidan Aktivitelerinin Belirlenmesinde Ġzlenen Metot ve Materyal
4.2.1. Mantar ekstraktlarının hazırlanması
4.2.1.1. Materyal
Petrol Eteri (Merck), MeOH (Merck), soxhlet, evaporatör, liyofilizatör
4.2.1.2. Metot
Uygun koĢullarda kurutulan mantarlar, toz haline getirildi ve herbirinden yaklaĢık 30 g alınarak soxhlet apareyinde 8 saat süreyle 40-60 0C‟ de yağlarından
arındırılmaları amacı ile petrol eterinde ekstre edildi. Kalan numune %70‟ lik MeOH ile sıcak su banyosunda (40 0
C) 1 saat boyunca ekstre edildi ve her 15 dakikada bir süzüldükten sonra, kalan MeOH evaporatörde vakum altında(45 0C) uzaklaĢtırıldı.
Evaporasyondan sonra kalan numunenin suyunun tamamen uzaklaĢtırılabilinmesi ve uzun süreli kullanımı amacıyla liyofilize edildi. Ekstrakt +4 oC‟ de buzdolabında
saklandı.
4.2.2. Ġndirgeme gücü
Mantarların ekstarktlarının bazı bileĢikleri indirgeme kapasitesi ölçüldü.
4.2.2.1. Materyal
Metanol, FeCl3, Fosfat tamponu [(pH: 7)- K2FeCN], Potasyum ferrosiyanid,
Trikloroasetik asit (TCA), Shimadzu U.V. 1700 spektrofotometre, santrifüj, benmari.
4.2.2.2. Metot
Mantarlar ın indirgeme gücü Oyaizu (1986) metodu ile belirlendi. Mantarların metanolik ekstraktarından 5 farklı konsantrasyonda çözeltiler hazırlandı
(0,4-0,04 mg/ml). Hazırlanan her bir çözeltide deney tüplerine 2,5 ml numune alındı. Her birinin üzerine 0,2 M 2,5 ml fosfat tamponu (pH : 6,6) , %1‟ lik Potasyum ferrosiyonad çözeltisinden ilave edildi. Tüpler 50 ˚C‟de 20 dk. boyunca benmaride inkübe edildi. Daha sonra 2,5 ml %10‟luk trikloroasetik asit (TCA) ilave edilip, 10 dk. boyunca 600 rpm‟de santrifüj edildi ve tüplerdeki karıĢımların üst kısmından 5‟er ml alınarak baĢka tüplere aktarıldı. Yeni tüplere aktarılan numunelerin her birinin üzerine 5 ml deiyonize su eklendi. % 0,1‟lik FeCl3‟den 1 mlilave edildikten sonra
oluĢan yeĢil renkli çözeltilerin absorbansları Shimadzu U.V. 1700 spektrofotometrede 700 nm‟de ölçüldü.
4.2.3. DPPH (1,1-Diphenyl-2-picrylhydrazyl) radikallerini süpürme etkisi
4.2.3.1. Materyal
DPPH, metanol(Merck), Shimadzu U.V. 1700 spektrofotometre.
4.2.3.2. Metot
Qian.ve Nihorimbere (2004)‟ e göre Sanchez Moreno metodu esas alınarak yapılmıĢtır. Liyofilize edilmiĢ droglardan yukarıda belirtilen konsantrasyonlarda 5 farklı mantar çözeltisi metanolde hazırlandı. DPPH‟ın kalibrasyon eğrisi çıkarıldı. Hazırlanan çözeltilerden 0,5 ml alınarak üzerine 3 ml DPPH çözeltisi ilave edildi. Kuvvetlice karıĢtırılıp ağzı kapatıldıktan sonra 30 dk. süre ile karanlıkta bekletildi. Bu sürenin sonunda her bir karıĢımın absorbansları spektrofotometrede 515 nm‟de okundu. Bu değerlerden faydalanarak radikalin yarısının süpürüldüğü andaki mantar konsantrasyonu (IC50) değerleri hesaplandı.
4.2.4. Toplam fenolik madde tayini
4.2.4.1. Materyaller
Folin reaktifi, Na2CO3, Metanol (Merck), Gallik asit (GA), Shimadzu U.V.
1700 spektrofotometre.
4.2.4.2. Metot
Toplam fenolik madde tayini Folin-Ciocaltaeu (1927), metoduna göre yapıldı. Standart olarak kullanılan Gallik asit ve mantarlar %70‟lik metanol içerisinde hazırlandı. 0,4 mg/ml konsantrasyonunda 0,5 ml mantarların metanol ekstraktları, %10‟ luk folin reaktifinden 2,5 ml ve %10‟luk NaCO3‟dan 7,5 ml bir
deney tüpünde karıĢtırıldı ve oda sıcaklığında karanlıkta 2 saat bekletildi. Bu süre sonunda 750 nm‟de çözeltilerin absorbansları okundu. Aynı yöntem kullanılarak 0,4 mg/ml konsantrasyonundan baĢlayarak giderek azalan konsantrasyonlarda hazırlanan Gallik asit için kalibrasyon eğrisi çizildi. Çözeltilerin absorbansları çizilen kalibrasyon eğrisinden alınarak eĢ değer Gallik asit (GAE) miktarı mg/ml olarak hesaplandı.
4.2.5. CUPRAC metodu
4.2.5.1. Materyal
CuCl2.2H2O, Etanol (Merck), Amonyum asetat (Merck), saf su, BHT , BHA,
Shimadzu U.V. 1700 spektrofotometre.
4.2.5.2. Metot
Bu yöntem Apak ve ark., 2006‟ na göre yapılmıĢtır. Bir test tüpüne 1‟er ml CuCl2.H2O (10-2M), Neocuprine etanolik çözeltisi (7,5.10-3M) ve Amonyum asetat
tamponu [(0,077 mg/ml) PH:7] çözeltisinden konuldu. Üzerine farklı 29
konsantrasyonlarda hazırlanmıĢ mantarların metanol (%70) ekstraktlarından ve yine %70‟lik metanolde hazırlanmıĢ standartlardan 0,8 ml ve 0,3 ml deiyonize su ilave edildi. 450 nm‟de absorbansları okundu.
4.2.6. β- Karoten- linoleik asit metodu
4.2.6.1. Materyal
Kloroform (CHCI3) (Merck), β- karoten, Linoleik asit, Tween 40, saf su,
evaporatör, Shimadzu 1700 UV spektrofotometre
4.2.6.2. Metot
Bu metot Amin ve Tan, 2002‟ ye göre yapıldı. β- karoten- linoleik asit emülsiyon karıĢımının hazırlanması; 0,2 mg β- karoten, 1 ml kloroformda çözüldü. Üzerine % 60‟lık 0,02 ml linoleik asit çözeltisi ve 200 mg Tween 40 ilave edildi. Vakum altında 40 0C de evaporatörde kloroform tamamen uzaklaĢtırıldıktan sonra
100 ml oksijenle doyurulmuĢ veya deiyonize su eklendi. ġiddetli Ģekilde karıĢtırıldı. Kontrol çözeltisi için aynı iĢlemler β-karoten ilave edilmeden tekrarlandı.
Numunelerin konsantrasyonu 1 mg/ml olacak Ģekilde % 70‟ lik metanolde hazırlandı. Deney tüplerine, hazırlanan bu çözeltilerden 0,2 ml alınarak üzerine 5 ml, hazırlanan emülsiyon çözeltisi ilave edildikten sonra 40 oC‟ de su banyosunda
inkübasyona bırakıldı. Deney tüplerindeki numunelerin ve kontrol çözeltisinin absorbansı 470 nm de okundu (t0). Bu andan itibaren inkübasyondaki çözeltilerin
absorbansı her 15 dakikada bir 2 saat süresince okundu.
4.3. Mantarlar ın Antimikrobiyal Aktivitelerinin Belirlenmesinde Ġzlenen Metot ve Materyal
4.3.1. Materyal
4.3.1.1. Kullanılan kimyasallar ve cihazlar
Metanol, kloroform (Merck), aseton (Merck), hekzan (Merck), 6 mm‟ lik steril boĢ diskler, mukayese antibiyotik diskleri (Kloramfenikol ve Nistatin), Mueller Hinton Agar (OXOID), Malt Extract Broth'da (DIFCO), Brain Heart Infusion Broth'da (OXOID)bitki değirmeni, soxhlet, deney tüpleri, petriler, evaporatör, etüv. 4.3.1.2. Test mikroorganizmaları
ÇalıĢmada kullanılan mikroorganizmaların tamamı Selçuk Üniversitesi Sağlık Meslek Yüksek Okulu‟ndan temin edilmiĢtir. Mantarların antimikrobiyal aktivitesi, altı Gram pozitif bakteri; Staphylococcus aureus ATCC 6538, Streptococcus
salivarius RSHE 606, Streptococcus pneumonia ATCC 10015, Streptococcus mutans
RSHE 676, Bacillus cereus ATCC 11778, Listeria monocytogenesis NCTC 5348; dört Gram negatif bakteri, Klebsiella pneumonia ATCC 5041, Escherichia coli ATCC 25922, Salmonella enteritidis ATCC 13076, Pseudomonas aeruginosa ATCC 27853 ve bir maya; Candida albicans üzerine denendi.
Kullanılan mikroorganizmaların neden olduğu hastalıklar ve rahatsızlıklar;
Bacillus cereus besin zehirlenmelerine,
Pseudomonas aeruginosa özellikle, bağıĢıklık yetersizliği olan hastalarda solunum ve
idrar yollarının, yanıkların ve açık yaraların fırsatçı patojenidir,
Listeria monocytogenesis menenjit ve septisemi,
Staphylococcus aureus toksik Ģok sendromu,
Streptococcus mutans diĢ çürükleri,
Streptococcus pneumonia menenjit,
Streptococcus salivarius endocarditis,
Klebsiella pneumonia zatürre,
Escherichia coli ishal ve idrar yolları enfeksiyonu,
Salmonella enteritidis besin zehirlenmesi,
Candida albicans pamukçuk.
4.3.2. Metot
4.3.2.1. Ekstraktların HazırlanıĢı
Makrofungus örnekleri uygun koĢullarda kurutulduktan sonra aseptik Ģartlara uyularak bir bitki değirmeni yardımı ile toz haline getirildi. Toz halindeki mantardan 25 g tartılarak, 200 ml çözgen içinde Soxhlet cihazına yerleĢtirildi ve 12 saat ekstraksiyona tabi tutuldu. Ekstraksiyon fazı evaporatörde ayrılarak, ekstreler +4°C'de saklandı. Bu iĢlem aynı numune ile sırasıyla non polar çözücüden polar çözücüye doğru; hekzan, aseton, kloroform ve metanol olarak 4 ayrı çözgende yapıldı.
4.3.2.2. Ekstrakt Ġçeren Disklerin ve Mikroorganizma Kültürlerinin Hazırlanması
Antimikrobiyal aktivitenin belirlenmesinde Disk Difuzyon metodu uygulandı. Bu metoda göre 6 mm çapındaki disklere, aseptik Ģartlara uyularak 30 mg/ml konsantrasyonunda hazırlanan ekstrelerden 20 l emdirilmiĢtir. ÇalıĢmada besiyeri olarak bakteri ve mayaların antimikrobiyal aktivitesini belirlemede Mueller Hinton Agar kullanıldı.
Denemede kullanılacak olan bakteri kültürlerini aktifleĢtirmek için Brain Heart Infusion Broth (OXOID), maya kültürieri için Malt Extract Broth (DIFCO) kullanılmıĢtır. Stok kültürden alınan bakteri suĢları ayrı ayrı 4-5 ml Brain Heart Infusion Broth'da (OXOID) süspanse edilerek 35 0C'de 24 saat , maya suĢları da Malt
Extract Broth'da (DIFCO) süspanse edilerek 25 0C'de 48 saat etüvde inkübe