T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Maternal Kan miRNA Ekspresyonu ile
Down Sendromu’nun Noninvaziv Tanısı
Dr. Biray ERTÜRK
Uzmanlık Tezi
Tez Danışmanı
Prof. Dr. M. Özgür ÇOĞULU
Kasım 2014 İzmirii
İÇİNDEKİLER
İÇİNDEKİLER ... ii ŞEKİL DİZİNİ ... iv TABLO DİZİNİ ... v ABSTRACT ... ix 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 3 2.1 MikroRNA ... 3 2.1.1 miRNA’ların Adlandırılması ... 4 2.1.2 miRNA’ların Oluşumu ... 5 2.1.3 miRNA’ların Fonksiyonları ... 6 2.1.4 Dolaşımda miRNA’lar ... 72.1.5 Gebelik Sürecinde miRNA’lar ... 8
2.1.6 21. Kromozomda Yerleşik miRNA’lar ... 10
2.2 Down Sendromu ... 15
2.2.1 Down Sendromunun Klinik Özellikleri ... 16
2.2.2 Down Sendromu’nun Patogenezi ... 19
2.2.3 DS’de Tanı ve Genetik Danışmanlık ... 21
2.2.4 DS’de Prenatal Tanı ... 22
3. GEREÇ ve YÖNTEM ... 37
3.1 Olgu Seçimi ... 37
3.1.1 Çalışmaya Dahil Etme Kriterleri ... 37
3.1.1.2 Kontrol Grubu (Grup 2) ... 37
3.1.2 Çalışmadan dışlama kriterleri ... 39
3.1.3 Etik Kurul, Gönüllü Onam, Maddi Destek ... 39
iii
3.2.1 Kan örneklerinin alınması ve saklanması ... 39
3.2.2 Amniyon ve CVS örneklerinin alınması ve saklanması... 40
3.3 Örneklerden Total RNA İzolasyonu ... 43
3.3.1 Kullanılan Malzemeler ... 43
3.3.2 Trizol ile Faz Ayırma İşlemi ... 44
3.3.3 Yıkama İşlemi ... 44
3.4 miRNA ve cDNA eldesi için RT (Reverse transcriptase) Reaksiyonunun Hazırlanması ... 45
3.5 Real-Time (Gerçek zamanlı) PCR (RT-PCR) Aşaması ... 46
3.6 Real Time PCR Değerlendirmesi ... 48
3.7 Çalışmaya Dahil Edilen miRNA’lar ... 49
3.8 İstatistiksel Analiz ... 49
4. BULGULAR ... 50
4.1 Çalışmaya Dahil Edilen Olguların Özellikleri ... 50
4.2 13-14 Haftalık Gebelerin Bulguları ... 52
4.3 17-18 Haftalık Gebelerin Bulguları ... 54
4.4 20-21 Haftalık Gebelerin Bulguları ... 56
4.5 Gebelik Haftasından Bağımsız Olarak Örneklerin Karşılaştırması ... 57
4.6 Fetal Hücre Kültürü ve Maternal Plazma miRNA Değerlerinin Karşılaştırılması ... 60
5. TARTIŞMA ... 66
6. SONUÇLAR ... 73
iv ŞEKİL DİZİNİ
Şekil 1: Şematik olarak miRNA ve öncülleri [14, 15] ... 4
Şekil 2: miRNA sentez basamakları ... 6
Şekil 3: Ekstrasellüler miRNA'ların plasenta dışında taşınma yolları [54] ... 9
Şekil 4: Çalışmaya dahil edilen miRNA'ların 21.kromozom üzerindeki konumları ... 13
Şekil 5: Önceki çalışmalarda DS’li fetüslerde ekspresyonları anlamlı çıkan miRNA'lar14 Şekil 6: DS'nin şematik karakteristik özellikleri [100] ... 18
Şekil 7: DS tiplerinin karyotip örnekleri: A) 47,XY,+21 / B) 46,XY,t(14;21) / C) 46,XY,t(21q;21q) ... 20
Şekil 8: İnvaziv Prenatal Tanı Teknikleri [154] ... 33
Şekil 9: Çalışma Algoritması ... 38
Şekil 10: RT-PCR “TaqMan probe” yöntemi [158] ... 47
Şekil 11: Hastaların yaş dağılımı ... 50
v TABLO DİZİNİ
Tablo 1: 21. kromozomda bulunan miRNA’lar (www.mirbase.org) ... 11
Tablo 2: Çalışmaya dahil edilen miRNA dizileri (www.mirbase.org) ... 12
Tablo 3: Anne yaşına göre DS görülme sıklığı ... 15
Tablo 4: DS'nin klinik özellikleri ... 17
Tablo 5: DS'nin genetik özellikleri ... 18
Tablo 6: Prenatal biyokimyasal tarama testlerinin güvenilirlikleri ... 27
Tablo 7: RT reaksiyon bileşenleri ... 46
Tablo 8: cDNA eldesi için PCR koşulları ... 46
Tablo 9: RT-PCR reaksiyon bileşenleri ... 47
Tablo 10: Çalışma gruplarının yaş ve endikasyon dağılımı ... 51
Tablo 11: Çalışmaya dahil edilen olguların gebelik haftaları ve örnekleri ... 51
Tablo 12: 13-14 haftalık olguların plazma miRNA ekspresyon değerleri ... 53
Tablo 13: 17-18 hafta fetal hücre kültürleri miRNA ekspresyon değerleri ... 55
Tablo 14: 17-18 haftalık olguların plazma miRNA ekspresyon değerleri ... 56
Tablo 15: Gebelik haftasından bağımsız tüm fetal hücre kültürleri için miRNA ekspresyon değerleri ... 58
Tablo 16: Gebelik haftasından bağımsız tüm plazma miRNA ekspresyon değerleri karşılaştırması ... 59
Tablo 17: Çalışma grubunda 17-18 hafta fetal hücre ve maternal plazma değerleri karşılaştırması ... 61
Tablo 18: Çalışma grubu 20-21. hafta fetal hücre ve maternal plazma miRNA ekspresyon değerleri karşılaştırması ... 62
Tablo 19: Çalışma grubu için gebelik haftasından bağımsız fetal hücre ve maternal plazma miRNA ekspresyon değerleri karşılaştırması ... 63
Tablo 20: Kontrol grubu 17-18. hafta fetal hücre ve maternal plazma miRNA ekspresyon değerleri karşılaştırması ... 64
Tablo 21: Kontrol grubu için gebelik haftasından bağımsız fetal hücre ve maternal plazma kontrol grubu miRNA ekspresyon değerleri karşılaştırması ... 65
vi
KISALTMALAR
AFP : Alfa fetoprotein
Ago : Argonat-RNaz çeşidi
βhCG : İnsan koryonik gonadotropininin beta alt birimi CREB1 : CAMP response element-binding
CVS : Koryon Villus Örneklemesi
DGCR8 : DiGeorge syndrome critical region gene 8
DS : Down Sendromu
DNA : Deoksiribonükleik asit
HLA : İnsan lökosit antijeni (Human leucocyte antigen)
hsa : Homosapiens
KİP : Kendi içinde pasaj
MeCP2 : Methyl CpG binding protein 2 MEF2C : Myocyte enhancer factor 2C
miRNA : Mikro RNA
mRNA : Mesajcı RNA
NGS : Next Generation Sequencing
ORF : Open reading frame
PCR : Polimeraz Zincir Reaksiyonu
pH : Power of Hydrogen (Potansiyel hidrojen)
pri-miRNA : Primer mikroRNA
RISC : RNA-induced silencing complex
RNA : Ribonükleik asit
RNaz : Ribonükleaz
RT-PCR : Gerçek zamanlı polimeraz zincir reaksiyon TRBP : Trans activating response RNA binding protein
USG : Ultrasonografi
vii
ÖNSÖZ
Tez çalışmamda yardımlarını esirgemeyen, başta tez danışmanım Prof. Dr. Özgür ÇOĞULU olmak üzere, Prof. Dr. Cumhur GÜNDÜZ ve Yrd. Doç. Dr. Emin KARACA’ya sonsuz teşekkür ederim. Uzmanlık eğitimim sırasında üzerimde emeği olan hocalarım, Prof. Dr. Cihangir ÖZKINAY, Prof. Dr. Ferda ÖZKINAY, Prof. Dr. Özgür ÇOĞULU, Doç. Dr. Haluk AKIN, Doç. Dr. Hüseyin ONAY, Yrd. Doç. Dr. Emin KARACA, Yrd. Doç. Dr. Asude DURMAZ’ a minnetlerimi sunmayı bir borç bilirim. Bilgi ve deneyimlerini daima benimle paylaşan hekim arkadaşlarıma, çalışma arkadaşlarıma mükemmel kişilikleri ve değerleriyle hayatımın kahramanları olan aileme ve can dostum Dr. Burçin Pehlivanoğlu’na sonsuz şükranlarımı sunarım.
viii
ÖZET
MikroRNA (miRNA)’lar küçük, endojen kodlama yapmayan ~22 nükleotidlik RNA moleküller olup noninvaziv prenatal tanıda kullanılabilirliklerine dair literatürde çok az çalışma bulunmaktadır. Çalışmamızda, 21. kromozoma ait 14 miRNA’nın ekspresyon düzeyinin Down Sendromu (DS)’nun noninvaziv prenatal tanısında kullanılabilirliği araştırılmıştır.
Çalışmaya, 13-21 gebelik haftasında olan, ileri maternal yaş, tarama testinde risk artışı endikasyonu ile invaziv prenatal tanı yapılan, 37’si trizomi 21’li fetüs taşıyan (Grup 1), 40’ı ise kontrol (Grup 2) olmak üzere toplam 77 gebe alınmıştır. Fetal hücre kültürü ve maternal plazmadan elde edilen örneklerde miRNA ekspresyon düzeyleri, iki grup arasında ve grupların kendi içinde olmak üzere, Real-time PCR yöntemi kullanılarak araştırılmıştır.
Gebelik haftası dikkate alınmadan yapılan değerlendirmede fetal kültür örneklerinde 125b-2, 155, 3156; maternal plazmada 3156, hsa-mir-3648, hsa-mir-99a ekspresyon düzeyleri kontrol grubuna göre anlamlı olarak yüksek bulunmuştur (p<0.05). En yüksek sayıda gebenin bulunduğu 17-18. gebelik haftası ayrı olarak değerlendirildiğinde maternal plazmada 3156, 3648 ve hsa-mir-99a’nın kontrole göre anlamlı düzeyde yüksek ekspresyon gösterdiği saptanmıştır.
Sonuç olarak; fetal DS’nin maternal kanda noninvaziv olarak miRNA ekspresyonu değerlendirmesi ile tespitine yönelik daha fazla sayıda gebede yapılacak çalışmalarla umut verici sonuçlar elde edilebilir. Çalışmamızın literatürde belirtilmeyen ancak ekspresyon düzeylerinde farklılık saptanan miRNA’lar başta olmak üzere, miRNA profilinin genişletilerek farklı klinik durumlarda geniş hasta serileri içeren çok merkezli çalışmalarla yapılması, miRNA’ların non invaziv prenatal tanıda kullanılabilirliğinin aydınlatılmasına rehber olacağı düşünülmektedir.
ix
ABSTRACT
MicroRNAs (miRNAs) are small, non-encoding RNA molecules, containing ~22 nucleotides. Few data are available in the literature on their utility in noninvasive prenatal diagnosis. Here, we evaluated the expression levels of 14 miRNAs, located on chromosome 21, in maternal plasma and fetal cell culture samples and their utility for noninvasive prenatal diagnosis of Down Syndrome (DS).
Seventy-seven patients 37 carrying fetuses with DS (Group 1) and 40 control cases carrying fetuses with normal karyotype (Group 2) were included in the study. Gestation weeks of all cases ranged between 13-21. weeks itself in groups and separately miRNA expression levels of maternal plasma and fetal cell culture were measured by using real-time PCR.
In fetal culture samples hsa-mir-125b-2, hsa-mir-155, hsa-mir-3156; in maternal plasma samples hsa-mir-3156, hsa-mir-3648, hsa-mir-99a expression levels were found to be higher in group 1, compared to the control group (p<0.05). When cases who were in 17th-18th gestational weeks were seperately evaluated, significantly increased maternal plasma levels of hsa-mir-3156, hsa-mir-3648 and hsa-mir-99a in this group were found, compared to the control group.
In conclusion, miRNAs may be used in noninvasive prenatal dignosis of chromosomal diseases. However; multicenter studies with large samples should be evaluated to validate our results, particularly with miRNAs which were found to be highly expressed in DS samples.
1
1. GİRİŞ ve AMAÇ
Noninvaziv prenatal tanıya yönelik araştırmalar 2000’li yıllarda başlamıştır. Ancak ülkemizde kromozomal hastalıklardan prenatal tanı endikasyonu en sık olan Down Sendromu’nda (DS) fetal miRNA ekspresyon düzeylerinin maternal dolaşımda anlamlı düzeyde tespitine yönelik bir çalışma henüz mevcut değildir. Bu çalışmanın hipotezi; DS olgularında fazladan bulunan 21 numaralı kromozomdaki kodlayıcı genlerin ekspresyonlarının %50’ye kadar artmış olmasının fenotipik bulguları ortaya çıkarmasına dayalı olarak 21. kromozomdaki genlerin kodladığı miRNA ekspresyonlarının da artmış olabileceği ve bu ekspresyonların maternal kanda tespit edilebileceği düşüncesidir.
Fetal miRNA’lar maternal dolaşıma geçebilecek kadar küçük ve kendini RNaz aktivitesinden koruyabilen stabil moleküllerdir. Bu nedenle; 21. kromozomda kodlanan bazı miRNA’ların ekspresyonlarının maternal kanda artmış olabileceği düşüncesiyle çalışmamızda 21. kromozoma yerleşik 14 miRNA’nın maternal kanda ekspresyon düzeylerinin DS’nin noninvaziv prenatal tanısında kullanılabilir olup olmadığı araştırılmıştır.
Çalışmamızın amacı maternal kanda araştırılan miRNA’ların kontrollere göre aralarındaki farklılıklara bağlı olarak noninvaziv prenatal tanıda kullanılabilirliğini araştırmak ve diğer prenatal tanı ve tarama yöntemlerine alternatif bir yöntem geliştirilmesi adına yapılacak olan çalışmalara ışık tutulmasını sağlamaktır.
miRNA’ların rol oynadığı yolaklar henüz tam olarak aydınlatılamamakla birlikte; miRNA’lar, ileride tüm kalıtsal hastalıklar için prenatal tanıda kullanılabilecek biyobelirteçler haline dönüşme potansiyeline sahip moleküllerdir. Çalışmamızda bundan sonraki çalışmalara ışık tutabilecek noktalar şu şekilde sıralanabilir:
1. DS patogenezinde rol oynayabilecek miRNA’ların belirlenmesi
2. DS’li olgularda ekspresyonu artmış olan miRNA’ların fonksiyonlarını değiştirecek moleküllerin (antagomir) sentezi
3. miRNA’ların fonksiyonlarını etkilediği mesajcı RNA’ların saptanması ve etkilenen proteinlerin DS ile ilişkisinin saptanıp, tedaviye yönelik çalışmaların yapılması
2
5. DS’li ve sağlıklı fetüslerdeki 21. kromozom tarafından kodlanan miRNA’ların tip ve ekspresyon düzeyleri açısından farklılığının ortaya konması.
3
2. GENEL BİLGİLER
2.1 MikroRNA
miRNA’lar küçük, endojen kodlama yapmayan ~22 nükleotidlik RNA molekülleridir (Şekil 1). Hedef genin 3’UTR (untranslated region) bölgesine susturucu kompleks halinde bağlanarak mRNA’nın hedef gene düşük özgüllükte bağlanmasına neden olmak, mRNA yıkımı ve translasyonel inhibisyon gibi farklı mekanizmalarla gen ekspresyonunun düzenlenmesini sağlarlar [1-3]. Hücre farklılaşması, proliferasyonu, morfogenez, metabolizma, apopitozis gibi birçok farklı hücresel süreçte düzenleyici olarak görev alırlar. Sayısız fizyolojik ve patolojik süreçte rol oynamaları nedeniyle miRNA’ların hastalıkların tanı, tedavi ve prognoz sürecinde kullanılabilecek biyobelirteçler olabileceği akla gelmektedir [4]. Çeşitli kanser türleri, karaciğer hastalıkları ve DS gibi durumlarda farklı miRNA’lara ait farklı ekspresyon değişiklikleri tespit edilmiştir [4-6]. Günümüzde insanda yaklaşık olarak 1872 miRNA dizisi tanımlanmıştır [7]. miRNA genlerinin ~%61’i intronik bölgelerde, geri kalanı ise ekzon ve genler arası bölgelerde yerleşmiştir [8, 9]. Yarısından fazlası frajil kromozomal bölgelerde yerleşiktir. Bu durum, kanser gibi patogenezinde anstabil kromozomların ve değişken gen ekspresyonlarının rol oynadığı hastalıklarda miRNA’ların rolünün olduğunun göstergesidir [8, 9]. İlk olarak Caenorhabditis elegans (C.elegans) nematodunun gelişimi sırasında küçük geçici RNA’lar olarak ifade edilen lin-4 ve let-7 keşfedilmiştir [9-11]. İşlevleri hakkındaki temel bilgiler ise meyve sineği,
Drosophila melanogaster (D. Melanogaster) ve insanda let-7’nin keşfi ile ortaya çıkmıştır
[9-11]. let-7’nin ifade modelleri insanlarda evrimsel olarak korunmuştur. Farklı miRNA’ların farklı dokularda ve belli zaman aralıklarındaki gen ifadeleri karşılaştırılarak miRNA genlerinin ifade modelleri belirlenebilmektedir. Fare ve insanda yapılan miRNA profilleme çalışmaları, %50’ye yakın miRNA’nın dokuya özgü gen ifadesini göstermiştir [9, 12]. Bu çalışmalarda hangi miRNA’ların hangi dokularda kendini ifade ederek mRNA’ları inhibe ettiği ortaya konulmak istenmiştir. Bunun kanıtı olarak, dokuya özgü miRNA gen ifadesi arttırıldığı takdirde öncül hücrelere özgün mRNA’ların baskılandığının gözlemlenmesi gösterilmiştir [9, 13]. Yani miRNA’ların dokulara göre ekspresyonları değişmekte, ekspresyonlarının artması durumunda dokuya ait mRNA’lar susturulmaktadır.
4
Şekil 1: Şematik olarak miRNA ve öncülleri [14, 15]
2.1.1 miRNA’ların Adlandırılması
miRNA adlandırmasında ilk 3 harf türü ifade eder. Örneğin; hsa homosapiensi göstermektedir. Bunu matür miRNA olduğunu belirten “mir” terimi takip eder. Bu duruma tek istisna 1993’te ilk keşfedilen miRNA grubu olan let-7 ailesidir. Hsa-let-7 olarak gösterilir. En sondaki rakamlar ise tarif edilen miRNA’yı kodlar. miRNA’lar arasında 1–2 baz farkı varsa rakamlardan sonra “a” veya “b” şeklinde ifade edilirler [16]. “hsa-mir-99a” örneğinde olduğu gibi “hsa”, bahsi geçen miRNA’nın insana ait olduğunu; “mir” dizinin işlenmiş olgun miRNA dizisi olduğunu; “99” miRNA ailesini ve “a” bu miRNA’nın çok
5
yakınında bağlı bulunduğu başka miRNA’ların kodlandığını ifade etmektedir. Öncesinde “miR‐142‐s” (5′ kolu) ve “miR‐142‐as” (3′ kolu) gibi ifade şekilleri transkripsiyona katılan DNA zincirini ifade etmek için kullanılırken günümüzde miR‐142‐5p ve miR‐142‐3p kullanım şekillerinin 5’ ve 3’ kollarının belirtilmesinde daha uygun olduğu fikrine varılmıştır [7].
2.1.2 miRNA’ların Oluşumu
miRNA’lar, birbirini izleyen üç basamağın tamamlanmasıyla oluşur (Şekil 2). Nükluesta başlayan bu basamaklar sitoplazmada tamamlanır. İlk olarak genomik DNA’dan, RNA polimeraz II enzimi ile birincil (primer) transkript (pri-miRNA) oluşumu geçekleşir. Pri-miRNA’lar, 500 ila 3000 baz uzunluğunda olup bir başlık yapısı ile poli-A kuyruğu içermektedir. Nükleusta devam eden ikinci basamakta; pri-miRNA (primer mikroRNA), pre-miRNA (prekürsör mikroRNA) olarak adlandırılan, 70 nükleotidden oluşan, sap-ilmik şekilli yapılara dönüşür. Bu işlemde RNA polimeraz III ailesine mensup bir endonükleaz olan Drosha ve çift zincirli RNA bağlama proteini olan DiGeorge Sendromu kritik bölge geni 8 kofaktörü-Pasha (DGCR8-DiGeorge syndrome critical region gene 8) görev alır [17]. Drosha pri-miRNA’nın her iki ipliğini de keserek pre-miRNA adı öncül molekülü oluşturur. Bu pre-pre-miRNA’lar nükleer transport reseptörü eksportin ve nükleer protein Ran-GTP aracılığıyla nükleustan sitoplazmaya taşınır [9]. Son basamak sitoplazmada gerçekleşir ve bir RNaz III enzimi olan Dicer adlı bir endonükleazın katalizlediği reaksiyonla pre-miRNA fonksiyon görebilen olgun miRNA’ya dönüşür. Bu üç basamak sonucunda oluşan miRNA molekülü 18-20 nükleotid uzunluğundadır. Dicer enzimi aynı zamanda RNA-indüklenmiş susturma kompleksi (RNA-induced silencing complex; RISC) oluşumunu başlatır [18]. Dicer ve bir çift zincir RNA bağlama proteini olan HIV-1 transaktive edici cevap oluşturan RNA bağlanma proteini (TRBP; trans activating response RNA binding protein) pre-miRNA’yı sap-ilmik formunun bittiği bölgelerden kestikten sonra iki tamamlayıcı kısa RNA molekülü meydana gelir, ancak bunlardan sadece biri RISC kompleksine katılır [9]. RISC kompleksinin içinde yer alan bir RNAz olan argonatın (ago) etkisiyle bu ikisinden 5' ucu daha kararlı olanı seçilip komplekse dahil olur. Bu iplikçik kılavuz iplikçik (guide strand) olarak adlandırılır [19]. Diğer iplikçik ise, anti-kılavuz veya yolcu iplikçik olarak adlandırılır, RISC kompleksinin substratı olarak sindirilir [20] (Şekil 2).
6
2.1.3 miRNA’ların Fonksiyonları
Aktif RISC kompleksi ile birleştikten sonra miRNA'lar kendi tamamlayıcı mRNA molekülleri ile baz eşleşmesi yapar ve argonat enzimi ile mRNA’nın yıkımına neden olurlar. miRNA’lar hedef mRNA’lar ile farklı canlı türlerinde miRNA ailelerine özgü olarak yüksek oranda korunmuş ve tohum (seed region) adı verilen 6-8 nükleotidlik bir bölge aracılığı ile etkileşirler [9, 21]. Hedef ile miRNA’nın tohum dizisi arasında eşleniklik (komplementerlik) olmalıdır. Hedef mRNA üzerinde bağlanma bölgeleri genellikle 3’UTR’dedir, ancak 5’UTR’yi Şekil 2: miRNA sentez basamakları
7
ya da açık okuma çerçevesini (ORF-open reading frame) de hedef alarak gen ifadesini baskılayabilirler [9, 22]. Tohum bölge eşlenikliği çok yüksek seviyede ise RISC hedef mRNA’ları degrade eder. Ayrıca bu durumda hedef mRNA’nın yıkımı da gerçekleşebilir. RISC’e yüklenmiş miRNA’lar aracılığı ile mRNA’ların poli-A kuyruklarının ve 5’cap yapılarının yok edilip mRNA degradasyonunun tetiklendiği bilinmektedir. Poli-A kuyruklarının ve 5’cap yapılarının yok olması sonucunda kararlılıkları azalan mRNA’lar hücresel enzimler tarafından parçalanır. Eğer genellikle memelilerde görüldüğü gibi eşleniklik daha az ise, hedef mRNA’dan protein oluşumu baskılanır [9, 23-25]. Hedef genin mRNA seviyesi artarken, protein seviyesinin değişmediği, dolayısıyla da baskılamanın translasyonel seviyede gerçekleştiği belirlenmiştir. Aynı zamanda birçok yayında translasyonel seviyede düzenlemenin, translasyonun başlangıcında gerçekleştiği bildirilmiştir [9, 24]. miRNA-RISC kompleksinin çeşitli transkripsiyon faktörleri ile etkileşerek protein translasyonunun başlangıç ve uzama aşamalarını engelliyor olması muhtemel gözükmektedir [9]. miRNA’ların her birinin birden fazla mRNA’nın ekspresyonunu düzenleyebildiği ve mRNA’ların her birinin de birden fazla miRNA tarafından hedeflenebildiği saptanmıştır [24].
2.1.4 Dolaşımda miRNA’lar
Sağlıklı bireylerde yapılan çalışmalarda dolaşımda bazı ortak miRNA’lar olduğu bildirilmiştir [26]. Bu bilgiye dayanarak, farklı fizyolojik durumlarda ve çeşitli hastalıklarda belirli miRNA tiplerinin dolaşımda arttığı düşünülerek dolaşımdaki miRNA’ların tanısal amaçlı kullanılması bu alanda yeni bir dönemin başlangıcı olmaktadır. miRNA’ların hücre içerisinde işlev göstermekle birlikte serum, plazma, tükürük, idrar ve anne sütü örneklerinde de ekstrasellüler olarak bulunabildikleri gösterilmiştir [26-32]. Normalde serumda yüksek RNAaz aktivitesi mevcut olmasına rağmen miRNA’lar oldukça stabil moleküllerdir. Benzer şekilde, miRNA’ların yüksek ısı, yüksek pH gibi koşullara da dirençli olduğu gösterilmiştir [26]. Yapılan çalışmalarda eksozom, vezikül ve protein-miRNA komplekslerinin, hücreler arasında transfer edilebileceği öne sürülmüştür. Bazı yazarlar, miRNA’ların eksozom ve apoptotik cisimler gibi küçük membranöz veziküller içinde [32-35], bazı yazarlar ise protein-miRNA kompleksleri oluşturarak [36-39] dolaşımda RNAaz aktivitesinden korunduğunu öne sürmektedirler. miRNA’ların bağlandığı başlıca moleküllerin HDL (High density lipoprotein), AGO2 (Argonaute2) ve NPM1 (Nucleophosmin1) olduğu bildirilmiştir.
8
miRNA’ların, bu yapılarla birlikte hücrelerden aktif yolla sekrete edildiği, ekstrasellüler alanda taşınarak hedef mRNA’yı içeren hücreler tarafından alındığı düşünülmektedir [40]. Uzun yıllardır prenatal tanıda üçlü tarama testinde kullanılan, fetal karaciğer ve yolk kesesinde yapılan AFP’nin, idrar yoluyla amniyon sıvısına ve oradan da maternal seruma geçtiği kabul edilmektedir. Fetal miRNA’ların da bahsedilen iki mekanizmadan herhangi biri yoluyla maternal seruma geçtiği söylenebilir. Dolayısıyla, son derece stabil olan ve fetusa ait bu küçük RNA’ların maternal serumda saptanabilmesi ile invaziv tanısal girişimlere gerek kalmadan prenatal tanı mümkün olabilir.
2.1.5 Gebelik Sürecinde miRNA’lar
Anne kanında fetal hücrelerin varlığı ilk defa 1893’te Schmorl’ün eklampsi nedeniyle ölen gebe kadınların kan dolaşımında histolojik olarak trofoblastları gözlemlemesiyle keşfedilmiştir [41]. Bundan sonraki süreç biraz yavaş işlemekle birlikte bu alandaki çalışmalar 1990’lardan sonra hız kazanmıştır. Anne kanında fetal çekirdekli eritrositler incelenerek anöploidilerin prenatal tanısı için önemli sonuçlar elde edilmiştir [41-43]. Hücre bağımsız fetal DNA’nın anne kanında gösterilmesi noninvaziv prenatal tanı için atılmış önemli bir adımdır [44]. Yapılan çalışmalara göre, Trizomi 13 ve 18 gibi çeşitli kromozomal hastalıklarda fetal DNA’nın anne kanında tespiti ve dizi analizi mümkün görünmektedir ancak bu işlemin mevcut koşullarda oldukça pahalı olması önemli bir kısıtlılık yaratmaktadır [45]. Fetusa ait hücrelerin ve fetal DNA-RNA’nın anne kanında çok düşük düzeylerde olduğu kabul edilmektedir. Ancak uygun yöntemle bu moleküllerin saptanması mümkündür. Fetal DNA’nın metilasyon oranı karşılaştırılarak yapılan bir çalışmada, DNA metilasyon oranının, %100 duyarlılık ve özgüllük oranı sağlayarak DS’nin prenatal tanısında kullanılabileceği bildirilmiştir [46].
Fetal-maternal etkileşim tıpta uzun yıllardır ilgi odağıdır. miRNA’ların fizyolojik reaksiyonlardan kanser patogenezine kadar pek çok durumda rol oynadığı keşfedilince bu küçük RNA moleküllerinin, olağan ve patolojik gebelik süreçlerindeki durumu ayrıntılı çalışmalara konu olmuştur. Embriyonun uterusa yerleşme sürecinde miRNA’ların, inflamatuar yanıtı düzenleyen yolaklar üzerinden etkili olduğu düşünülmektedir [47, 48].
Ayrıca gebeliğe özgü ve plasenta kökenli miRNA’ların varlığı da bildirilmiştir. Gebelikle ilişkili miRNA kümeleri başlıca 14. kromozom miRNA kümesi (C14MC), 19. kromozom miRNA kümesi (C19MC) ve miR-371-3 kümesidir [49]. Maternal plazmada
9
C19MC kümesine ait hsa-miR-515-3p, hsa-miR-517a, hsa-miR-517c, hsa-miR-518b ve has-miR-526b düzeylerinin 3. trimesterde anlamlı olarak arttığı tespit edilmiştir [50]. miR– 141, miR–149, miR517a, miR518b miR–516-5p, miR-518b, miR-520a, miR-520h, miR– 525 ve miR-526a plasenta kaynaklı, gebelikte anne kanında anlamlı düzeyde artan ve gebelik sonrasında düzeyleri anlamlı düzeyde azalan miRNA’lardır [51-53]. Yeni bir çalışmada, plasenta spesifik miRNA’ların, maternal plazma düzeyinin plasenta ağırlığına göre değiştiği bildirilmiştir [50]. Yine 2014 yılında yayınlanan bir diğer derlemede ekstrasellüler miRNA’ların plasental trofoblastların ötesine nasıl taşındığı ele alınmış ve farklı yolaklar olduğu belirtilmiştir [54] (Şekil 3). Buna göre; miRNA’lar mikroveziküller, eksozomlar, apoptotik cisimler şeklinde ya da proteinlere bağlanarak taşınmakta ve maternal plazma dahil pek çok hedefe ulaşabilmektedir (Şekil 3).
Şekil 3: Ekstrasellüler miRNA'ların plasenta dışında taşınma yolları [54]
İkiz gebeliklerde miR–451 düzeylerinin, tekil gebeliklere göre, 50 kat fazla olduğu saptanmıştır [55]. miR–16 ve miR-21’in plasentada düşük düzeyde ekspresyonu fetal gelişme geriliği ile ilişkilendirilmiştir [56]. miR–210, miR–1, miR–584 ve miR-34c-5p, preeklampsi gelişen gebelerin plasentalarında aşırı eksprese edilen miRNA’lar olarak bildirilmiştir [57]. Plasental miRNA ekspresyonunun araştırıldığı önceki çalışmalarda preeklampsi ile ilişkilendirilen bir diğer miRNA miR-155’tir [58]. Özellikle aktive immün hücrelerde eksprese edilen miR-155’in plasentada fetal plasental antijen sunucu hücreler
10
olan Hofbauer hücrelerinde eksprese ediliyor olabileceği düşünülmekle birlikte; miR-155’in plasental kaynağı kesin olarak bilinmemektedir [59].
miRNA’ların plasental anjiyogenezdeki rolü de araştırılmaktadır. Mikro RNA-plasental anjiyogenez ilişkisi tam olarak açıklanmamış olmakla birlikte; miRNA’ların, vasküler büyüme faktörleri üzerinden etkili olduğu düşünülmektedir [60]. Önceki çalışmalarda DS’de yüksek düzeyde eksprese olduğu bildirilen miRNA’lardan miR-125b’nin hepatosellüler karsinom hücrelerinde VE-Cadherin’i hedef aldığı ve plasental büyüme faktörü (PIGF) düzeylerini de azalttığı bildirilmiştir [61]. Ancak plasental anjiyogenezin tam olarak aydınlatılabilmesi için ayrıntılı çalışmalar yapılması gerekmektedir.
Bahsedilen tüm bu miRNA’ların birden çok hedef mRNA üzerinde etki göstererek hücre farklılaşması ve embriyonik gelişim gibi süreçlerde rol oynadığı kabul edilmektedir. Bu nedenle; prenatal tanıda olduğu kadar gebelikle ilişkili hastalıkların patogenezinin aydınlatılmasında ve hedefe yönelik tedavilerin geliştirilmesinde de miRNA’larla yapılacak çalışmalar önemli katkı sağlayacaktır.
MikroRNA’lar DNA’dan küçük moleküllerdir ve bu nedenle de miRNA’ların DNA’ya göre fetal-maternal etkileşimde daha kolay yer değiştirebileceği varsayımı yapılabilir. Bu varsayım, bizim bu çalışmayı tasarlamamızda da önemli rol oynamıştır.
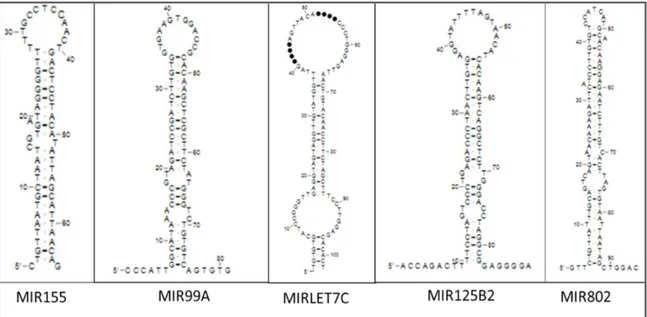
2.1.6 21. Kromozomda Yerleşik miRNA’lar
İnsanda 21. kromozomda 29 miRNA bulunmakta olup bunlar Tablo 1’de listelenmiştir (www.mirbase.org). Bunlar içerisinde önceki çalışmalarda önemi vurgulanan ve çalışmamız başladığı andan itibaren tanımlanmış olan 14 miRNA araştırmamıza da konu olmuştur (Tablo 2). Araştırmamızda yer alan miRNA’ların dizileri Tablo 2’de yer almaktadır.
DS’de fenotipten 21. kromozomun triplikasyonu sorumludur. 21. kromozomda 29 farklı miRNA geni tanımlanmıştır (www.mirbase.org). Önceki çalışmalarda 21. kromozomda yerleşmiş 5 miRNA geninin (99a, let-7c, 125b-2, miR155 ve
miR-802) (Şekil 4-5), DS’li bireylerin beyin ve kalp dokularında aşırı eksprese olduğu
bildirilmiştir [6]. Bunun sonucunda hedef protein olan MeCP2 düzeyi azalmakta; CREB1 ve MEF2C transkripsiyon faktörleri artmakta olup sinaptik matürasyonun bozulduğu ve DS’li hastalarda bilişsel gerilikten bu bulgunun sorumlu olabileceği düşünülmektedir [6].
11
DS’li fetüste, etkilenmemiş monozigot ikiziyle karşılaştırıldığında miR-155’in aşırı eksprese olduğu gösterilmiştir [62]. Bununla birlikte; literatürdeki tüm veriler bu verileri destekler nitelikte değildir. Kotlabova ve arkadaşlarının yaptıkları benzer çalışmada miR-99a, let-7c, miR-125b-2 ve miR-155 plazmada tespit edilebilmiş; miR-miR-99a, miR-125b-2, ve miR-155’in gebelerde gebe olmayan kadınlara göre daha yüksek düzeyde eksprese olduğu ancak bu ekspresyon farkının sağlıklı fetüs taşıyan gebeler ile trizomili fetüs taşıyan gebeler arasında belirgin olmadığı saptanmıştır [63].
Tablo 1: 21. kromozomda bulunan miRNA’lar (www.mirbase.org)
miRNA Başlangıç Bitiş
hsa-mir-8069-1 6859171 6859256 hsa-mir-6724-1 8205315 8205406 hsa-mir-3648-1 8208473 8208652 hsa-mir-3687-1 8208844 8208904 hsa-mir-6724-2 8249505 8249596 hsa-mir-6724-3 8388362 8388453 hsa-mir-6724-4 8432530 8432621 hsa-mir-3648-2 8986999 8987178 hsa-mir-3687-2 8987370 8987430 hsa-mir-3156-3 13406384 13406460 hsa-mir-3118-1 13644775 13644850 hsa-mir-8069-2 13724189 13724274 hsa-mir-99a 16539089 16539169 hsa-let-7c 16539828 16539911 hsa-mir-125b-2 16590237 16590325 hsa-mir-548x 18686090 18686164 hsa-mir-6130 23079284 23079392 hsa-mir-155 25573980 25574044 hsa-mir-4759 26953961 26954043 hsa-mir-4327 30375294 30375378 hsa-mir-6501 33550662 33550728 hsa-mir-802 35720715 35720808 hsa-mir-6508 39447010 39447069 hsa-mir-4760 40212352 40212431 hsa-mir-3197 41167557 41167629 hsa-mir-6814 41746772 41746841 hsa-mir-5692b 42950928 42951014 hsa-mir-6070 43609887 43609989 hsa-mir-6815 45478266 45478326
12
Tablo 2: Çalışmaya dahil edilen miRNA dizileri (www.mirbase.org)
miRNA Lokalizasyon Matür Dizi Stem Loop
hsa-mir-3648 21p11.2 AGCCGCGGGGAUCGCCGAGGG hsa-mir-3648-1
hsa-mir-3648-2
hsa-mir-3687 21p11.2 CCCGGACAGGCGUUCGUGCGACGU hsa-mir-3687-1
hsa-mir-3687-2
hsa-miR-3156 21q21.3 AAAGAUCUGGAAGUGGGAGACA hsa-mir-3156-1
hsa-mir-3156-2 hsa-mir-3156-3
hsa-miR-3118 21q11.2 UGUGACUGCAUUAUGAAAAUUCU hsa-mir-3118-1
hsa-mir-3118-2 hsa-mir-3118-3 hsa-mir-3118-4
hsa-miR-99a-5p 21q21.1 AACCCGUAGAUCCGAUCUUGUG hsa-mir-99a
hsa-let-7c-5p 21q21.1 UGAGGUAGUAGGUUGUAUGGUU hsa-let-7c
hsa-miR-125b-5p 21q21.1 UCCCUGAGACCCUAACUUGUGA hsa-mir-125b-1
hsa-mir-125b-2
hsa-miR-548x-5p 21q21.1 UGCAAAAGUAAUUGCAGUUUUUG hsa-mir-548x
hsa-miR-155-5p 21q21.3 UUAAUGCUAAUCGUGAUAGGGGU hsa-mir-155
hsa-miR-4759 21q21.3 UAGGACUAGAUGUUGGAAUUA hsa-miR-4759
hsa-miR-4327 21q22.11 GGCUUGCAUGGGGGACUGG hsa-miR-4327
hsa-miR-802 21q22.12 CAGUAACAAAGAUUCAUCCUUGU hsa-miR-802
hsa-miR-4760-5p 21q22.2 UUUAGAUUGAACAUGAAGUUAG hsa-miR-4760
13
Şekil 4: Çalışmaya dahil edilen miRNA'ların 21.kromozom üzerindeki konumları
hsa-let-7c; ilk olarak C. Elegans ile yapılan çalışmada keşfedilmiştir. Let-7 ailesi
oldukça geniş bir miRNA ailesini temsil eder ve türler arasında evrimsel olarak korunmuştur ve genomun farklı bölgelerinde farklı alt grupları bulunmaktadır. hsa-let-7c, 21p11.1’de miR-99a/let-7c/miR-125b-2 miRNA kümesinde bulunmakta olup çeşitli kanser tipleriyle ilişkilendirilmiştir [64, 65]. Tümörogenezde önemli rolü olan hücre proliferasyonu, farklılaşması, apopitoz, kök hücre özelliklerinin tekrar kazanılması [66] gibi basamaklarda etkili olduğu düşünülmekte olup bu nedenle, birçok çalışmaya konu olmaktadır. Fetoplasental dokularda da let-7 ailesinin ekspresyonları gösterilmiştir [67, 68]. let-7c ile ilgili 100’ün üstünde makale bulunmaktadır (www.ncbi.nlm.nih.gov/pubmed, Erişim tarihi: 28.06.2014). miR-99a, let-7c, miR-125b-2, miR-155 ve miR-802’nin DS’li fetüslerin hippokampus ve kalp dokularında aşırı eksprese olduğu bildirilmiştir [63]. Xu ve arkadaşları ise, let-7c, miR-125b, miR-155 ve miR-802 ve miR-99a düzeylerinin trizomik lenfositlerde öploid lenfositlere göre daha yüksek düzeyde olduğunu saptamışlardır [69].
hsa-mir-125b-2; 21p11.1’de 99a/let-7c/125b-2 miRNA kümesinde,
miR-125b-1 ise yine 21. kromozomda D11S1345-D11S1316 bölgeleri arasında miR-125b1/let-7a-2/miR-100 kümesinde yer almaktadır. İlk olarak farelerde keşfedilmiştir [70]. Daha sonra insanda B-lenfosit hücrelerinde de gösterilmiştir [71]. hsa-mir-125b-2, 21. kromozom kaynaklı olup DS fenotipine katkısı olabileceği düşünülen önemli miRNA’lar arasındadır. Ayrıca akciğer kanseri [8] ve lenfoid malignitelerle ilişkili olduğu düşünülmektedir [72]. İlginç olarak; 2014’te yayınlanan yeni bir çalışmada, rekürren abortus olgularında genom-wide miRNA ekspresyonu araştırılmış ve kontrol grubuna göre ekspresyonu yüksek saptanan miRNA’lardan biri de hsa-mir-125b-2 olarak bulunmuştur [73].
hsa-mir-155; MIR155HG geni tarafından kodlanmaktadır. DS’li olgularda elde
edilen sonuçlar ile birlikte; hematopoetik dizi farklılaşması, immünite, inflamasyon gibi biyolojik işlevlerin yanı sıra kanser ve kardiyovasküler hastalıklar gibi patolojik süreçlerde rolü olduğu öne sürülmektedir [74]. Bu nedenle de; özellikle hedefe yönelik tedavilerde kullanılabileceği düşünülmektedir.
14
hsa-mir-802; farelerde keşfedilmiştir [75]. DS’li olgularla yapılan çalışmalardaki
bulgulara ek olarak, glikoz metabolizması [76] ve anjiyotensin 2 reseptör aktivitesi ile ilişkisi üzerinde de durulmuştur [77].
hsa-mir-99a; 21. kromozomda bulunan ve DS’li fetüslerde aşırı ekspresyonu
bildirilen bir diğer miRNA’dır [62, 64]. Bunun dışında; özellikle apoptoz üzerindeki etkisi nedeniyle yangısal ve neoplastik hastalıklardaki rolü ilgi odağı olmuştur [78-81].
mir-3118, mir-3197 [83], mir-3156-3 [82, 83] mir-3648 [84], hsa-mir-3687 [85], hsa-mir-4327 [86], hsa-mir-4759, hsa-mir-4760-3p [82] 21. kromozomda
lokalize olup çalışmamızda araştırılan diğer miRNA’lardır, çeşitli çalışmalar sırasında ortaya konmuş olmakla birlikte (Şekil 5) literatürde halen bu miRNA’lar ile ilgili yeterli veri bulunmamaktadır. hsa-mir-3118, hsa-mir-3197 ve hsa-mir-3156-3 melanom olgularında derin sekanslama üzerine yapılan bir çalışmada keşfedilmiştir [83]. Daha sonra 2011 yılında yapılan bir başka çalışmada meme kanserinde ERBB2 geninin rolü araştırılırken hsa-mir-3156-3’ün bu süreçte de etkili olabileceği bulunurken hsa-mir-4759, hsa-mir-4760-3p keşfedilmiştir [83]. hsa-mir-3648 solid tümörlerde miRNA’ların ve diğer küçük RNA moleküllerinin etkisini araştırıldığı [84], hsa-mir-3687 periferik kanda miRNA’ların incelendiği [85] ve hsa-mir-4327 embriyonik kök hücrelerde AGO2 immünopresipitasyonunun araştırıldığı [86] çalışmalar esnasında bulunmuştur. Ancak keşif süreçlerinden sonra bu miRNA’lar ile ilgili çalışma yayınlanmamıştır; dolayısıyla bu miRNA’ların biyolojik rolleri konusunda aydınlatılması gereken pek çok husus söz konusudur.
15
2.2 Down Sendromu
DS, kromozom 21 (Hsa21)’in ekstra kopyası nedeniyle ortaya çıkan birçok genin sorumlu tutulduğu multigenetik kompleks bir tablodur. Yaklaşık 750–1000 canlı doğumda 1 görülmesiyle canlı doğumlarda en sık görülen kromozomal anomali olarak nitelendirilir [87]. Bunun yanı sıra konjenital mental retardasyonun en sık nedenidir. DS’li fetüslerin yarısı ise erken gebelik aylarında düşükle kaybedilir. Maternal yaşın artmasıyla birlikte trizomi 21’li çocuk dünyaya getirme sıklığı artar. Örneğin 30 yaşında bir anne için risk yaklaşık 1/750-1000 iken 40 yaşında bu oran 9/1000’e kadar yükselir (Tablo 3) [88, 89]. Bununla birlikte yapılan çalışmalarda patolojik bulguların penetransının değişkenlik gösterdiği bildirilmiştir [87].
16
2.2.1 Down Sendromunun Klinik Özellikleri
DS’de görülebilecek fenotipik bulgular kromozom 21’deki yaklaşık 310 genden birinin ya da daha fazlasının ekstra kopyasının mevcut olmasına bağlanmaktadır [87]. Klinik spektrum değişken olsa da DS’li bireyler yenidoğan döneminden yaşlılık dönemine kadar pek çok ciddi tıbbi sorunla karşılaşmaktadır. DS’de %30–40 oranında görülen majör konjenital malformasyonların en önemlilerinden biri kardiyak defektlerdir. Morbidite ve mortaliteyi en çok etkileyen kardiyak defektler arasında en sık görülen anomali atrioventriküler septal defekttir (AVSD). Cerrahi girişim yapılmayan olgular en çok kardiyak nedenlerle kaybedilir. Ağır kalp anomalisi olmayan olgular ileri yaşlara kadar yaşayabilirler. Bebeklik yaşlarında kalp anomalisi dışında en önemli ölüm nedeni enfeksiyonlardır. DS’li 158 yenidoğan ile yapılmış olan bir çalışmada olguların %80’inde nötrofili, %66’sında trombositopeni ve %33’ünde polisitemi saptanmıştır. Bu çalışmada DS olgularının hematolojik ve immunolojik desteğe ihtiyaçları olduğu kanısına varılmıştır [90]. Bunun yanında duodenal atrezi, duodenal stenoz, imperfore anüs, Hirschprung hastalığı gibi gastrointestinal trakt anomalileri de majör malformasyonlar arasında yer almaktadır [91-93]. Çoğunlukla cerrahi müdahale gerektiren bu anomaliler olguların yaşam kalitesini azaltmakta ve perforasyon, peritonit ve sepsis gibi ciddi komplikasyonlara neden olabilmektedir. DS’li bireylerde bazı malignitelere yatkınlığın artmış olduğu gösterilmiştir. Lösemi ve lösemi benzeri reaksiyonların görülme sıklığının arttığı çeşitli çalışmalarla kanıtlanmıştır [94-96]. Nörolojik ve endokrinolojik hastalıklar da DS’li bireylerde yaşam kalitesini azaltarak önemli sosyoekonomik sonuçlara yol açabilir. Olguların yaklaşık %90’ında iletim tipi işitme kaybı söz konusudur [97]. Olgularda Alzheimer Hastalığı sıklığının arttığı ve ortaya çıkma yaşının düştüğü görülmüştür [98]. DS’li bireylerde çok farklı fenotipik özellikler ortaya çıkabilmekte (Tablo 4, Şekil 6) ve bu özellikler her bireyde kendine özgü bir seyir izlemektedir. Bu hastaların yönetiminde yukarıda bahsedilen ve vücuttaki tüm sistemleri etkileyen klinik durumlar akılda tutularak pratik ve uygun çözümler sağlanabileceği öngörülebilir.
17 Tablo 4: DS'nin klinik özellikleri [99]
Sistem Organlar Bulgular
Büyüme Boy Boy kısalığı
Baş ve Boyun Baş Brakisefali
Yüz Düz yüz profili
Kulaklar Küçük kulaklar, katlanmış heliks, iletim tipi işitme kaybı Gözler
Yukarı eğimli palpebral fissürler, epikantus, iriste Brushfield lekeleri
Ağız Dışarı çıkma eğiliminde olan dil
Kardiyovasküler
Kalp Konjenital kalp defekti % 30-40, atriyoventriküler kanal (endokardiyal yastık defekti)
Karın Gastrointestinal Duodenal darlık / atrezi, imperfore anüs hirschsprung hastalığı
İskelet Omurga Atlantoaksiyal instabilite
Pelvis Hipoplastik iliak kanatlar, sığ asetabulum
Ekstrenmite Eklem gevşekliği
Eller Kısa, geniş eller, beşinci parmak orta falanks hipoplazisi, tek enine palmar kırışıklık (simian çizgi)
Cilt, Tırnak, Saç Cilt Ense kalınlığı
Nörolojik Merkezi Sinir
Sistemi
Mental retardasyon, Alzheimer hastalığı hipotoni, kötü Moro refleksi
Endokrin - Hipotiroidi
18 Tablo 5: DS'nin genetik özellikleri [99]
Özellik Bulgular
Kalıtım İzole vakalar
Sitogenetik
Tam Trizomi 21, % 94 Mozaik Trizomi 21, % 2.4 Translokasyon 21, % 3.3
Sıklık
Mayoz Kökenli >%95 anne (çoğunlukla mayoz 1) Parental translokasyon ile nüks artar
İnsidans, 650-1000 canlı doğumda 1
Kritik Gen Bölgesi
DSCR1/RCAN1
DSCR2/PSMG1
DSCR3/DSCRA
DSCR4/DSCRB
19
2.2.2 Down Sendromu’nun Patogenezi
Klinik olarak benzer bulgular göstermekle birlikte DS olgularının %95’inin 21. kromozomunun 3 ayrı kopyası vardır (klasik tip), %4’ünün Robertsonian tipte translokasyon, %1 kadarının ise mozaik yapıda olduğu bildirilmiştir [87]. DS bulgularının ortaya çıkması aşağıda belirtilen mekanizmalara bağlı olarak 21 numaralı kromozomun 3 adet bulunması ve gen-dozaj etkisine bağlanmaktadır. Burada 21 numaralı kromozom üzerinde bulunan genler %50 oranında mRNA düzeyinde artmış ekspresyon göstermektedirler [101]. Artmış gen-dozaj etkisine bağlı olarak da fenotipin ortaya çıktığı bildirilmektedir [87]. Toplam kromozom sayısı 47’dir ve üç adet 21 numaralı kromozom vardır [102]. Mayotik nondisjunction (ayrılmama) nedeniyle ya da gamet oluşumu sırasında kromozomların anormal segregasyonu sebebiyle fazladan bir 21. kromozom bulunmaktadır. Klasik trizomi 21’li çocukları olan ailelerin %1,5 kadarında gonadal mozaisizme bağlı olarak birden fazla çocukta trizomi 21 saptandığından risk yüksek olmasa da serbest trizomi 21’li çocuk öyküsü olan tüm ailelere genetik danışma verilmeli, planlı gebelik önerilmeli ve aileye prenatal tanı endikasyonundan söz edilmelidir.
Translokasyon tipindeki DS’de kromozom sayısı 46’dır. Ancak serbest halde bulunan iki adet 21 numaralı kromozoma ek olarak 14, 21 ve nadiren 22. numaralı kromozomlara transloke olmuş üçüncü bir 21. kromozom bulunmaktadır. En sık rastlanan translokasyon 14q ve 21q arasındadır (Şekil 7) [103]. Bu durumda anne ve babanın karyotipi normal olduğunda yineleme riski önemli oranda artmamıştır. Olguların %10’unda ise ebeveynlerden biri transloke kromozomu dengeli olarak taşımaktadır. Yineleme riski önemli oranda artar.
Mozaik tipteki DS olgularında postzigotik bölünme hatası sonucu normal ve trizomik hücre dizileri bir arada bulunur (46, XX/ 47, XX,+21). En önemli risk etkeni ilerlemiş maternal yaştır (İMY). Mayoz-1 evresinin duraklayıp 10–50 yıl sonra devam ettiği, mayoz-2 evresinin ise ovulasyon sırasındaki 3–4 günü kapsadığı ve fertilizasyonla tamamlandığı göz önünde bulundurulursa İMY’nin sadece mayoz-1’i etkilemesi daha olası gibi gözükmektedir. Mayoz-1’deki duraksama sırasında oositte çevresel toksik etkenlerin birikmesi, mayoz düzeneğinde degradasyon meydana gelmesi, hormon sinyalindeki değişimler nedeniyle over işlevlerinin yeniden düzenlenmesi ayrılmama nedenlerindendir. İMY hem mayoz-1, hem de mayoz-2 evrelerinde ayrılmama riskini arttırmaktadır.
20
Maternal ayrılmama ile ilişkisi gösterilmiş olan diğer risk faktörüyse bozulmuş rekombinasyon örgüsüdür [104].
Şekil 7: DS tiplerinin karyotip örnekleri: A) 47,XY,+21 / B) 46,XY,t(14;21) / C) 46,XY,t(21q;21q) (www.sci.ubu.ac.th)
DS trizomik 21. kromozomda yer alan birden çok genin neden olduğu bir patolojidir. Bu kromozomda 225 kadar gen ve 59 psödogen olduğu bilinmektedir [105]. Trizomi 21’in bir gen kusuru değil, gen dozajı kusuru olması genlerin % 50 daha fazla eksprese olması
21
nedeniyledir [106]. DS patogenezinden sorumlu tutulan bir diğer etkense protein kodlamayan işlevsel deoksiribonükleik asit (DNA) öğeleridir [107]. Bunlar protein kodlamasında direkt olarak rol almasalar da birçok düzenleyici mekanizmalardan sorumludur. Protein kodlamayan DNA dizilerinin bir kısmı ribozomal RNA, taşıyıcı RNA, mikroRNA gibi çeşitli işlevsel RNA tiplerini kodlarlar. Promotör ve hızlandırıcılar ise (enhancer) transkripsiyon faktörlerinin bağlandığı özel DNA dizileridir. Diğer DNA dizileri, mRNA'ya yazıldıkları zaman mRNA'nın uygun şekilde işlenmesi (poliadenilasyon, başlık takılması, uç birleştirme gibi) ve protein çevriminin adımları (başlama, sonlanma) için gerekli dizileri içerir. Bir kısım DNA dizileri ise DNA'nın sıkışıp kompakt bir kromatin yapısını almasını sağlar [108]. Bu nedenle DS kliniğinde 21. kromozoma ait kodlama yapmayan dizilerin de sorumlu tutulabileceği düşünülebilir.
HSA21’in uzun kolunda belirli bir bölgenin, DS için karakteristik özelliklerden sorumlu olduğu öne sürülmüştür (Tablo 5) ve bu bölge “Down Sendromu Kritik Bölgesi (Down Syndrome Critical Region; DSCR)” olarak isimlendirilmektedir. DSCR’nin duplikasyonunun DS fenotipi için hem gerekli hem de yeterli olduğunu öne süren araştırmacılar [109] olmakla birlikte; DS’de izlenen fenotipik özelliklerin multifaktöriyel etkileşimler sonucu geliştiğini belirten araştırmacılar [110] da bulunmaktadır. Benzer şekilde; farelerle yapılan çalışmalarda, trizomik farelerin beyin fenotipi için DSCR’nin yeterliliği konusunda da farklı sonuçlar bulunmaktadır [111, 112].
2.2.3 DS’de Tanı ve Genetik Danışmanlık
Her DS’li olgu kliniğinde mutlaka karyotip analizi yapılmalıdır. Sonuca göre her türlü risk aileye bildirilmeli, mozaiklik durumunda daha sonraki gebeliklerde literatürde henüz açıklanamamış genetik bir yatkınlığın söz konusu olabileceği belirtilmeli, hekim prenatal tanı endikasyonunun olduğu, yapılıp yapılmaması durumlarında aileyi nelerin beklediğini bildirmeli ve kararı aileye bırakmalıdır [113]. Genetik hastalıklar ciddi, tedavileri mümkün olmayan ya da çok zor olan hastalıklardır. Günümüzde bu hastalıklardan korunmada en etkili yöntem ciddi genetik hastalıklı çocukları olan ya da olma riski olan ailelere genetik danışma ve mümkün olduğu durumda prenatal tanı hizmeti vermektir [114]. Bir hastalığın genetik temeli hakkında bilgi sahibi olmak yüksek oranda söz konusu genetik hastalığın tipine bağlıdır. Sonuç itibariyle DS, tedavisi olmayan mental retardasyon (IQ: 25–85) [115] başta olmak üzere farklı organlara ait ciddi patolojik bulgularla seyreden bir kromozomal hastalıktır. Sıklığı göz önüne alındığında prenatal tanı
22
endikasyonu olan, kalıtılabilen günümüz koşullarında destek tedavileri dışında kesin tedavi seçeneği olmayan bir hastalıktır.
2.2.4 DS’de Prenatal Tanı
Prenatal tanı, embriyonik ve fetal tanının bütün yönlerini kapsamaktadır. Doğum öncesi tanı genetik durumlar için, bütün gebeliklerin yaklaşık % 8’inde endikedir [116]. Tedavisi olanaksız, yaşam süresi kısıtlı ve ağır fiziksel ve zihinsel özürlere neden olan hastalıklar için yüksek riski olan ailelere sağlıklı bir çocuk için güvence verebilmek prenatal tanının temel amacıdır [117]. Prenatal tanının en sık endikasyonunun DS olduğu bilinmektedir. Bu nedenle daha hızlı, daha az masraflı ve daha az invaziv doğum öncesi tanı yöntemi arayışları bu sendrom açısından oldukça değerlidir [118]. Sitogenetik analiz için yapılan amniyosentez (AS), koryonik villus biyopsisi (CVS) gibi invaziv prenatal tanı işlemleri İMY’li olgularda anöploidi oranlarını azaltırken, günümüzde tespit edilemeyen anöploidili fetusların çok büyük bir oranı (~ %75) genç anne adaylarına aittir. Yirmili, otuzlu yaşlardaki her gebeye invaziv prenatal tanı işlemleri uygulanması durumunda ise gebelik kayıpları, anöploidili gebeliklerin yakalanma oranlarının önüne geçmektedir. Bu durumun önüne geçmeye yönelik 35 yaş altı anne adaylarına uygulanan tarama testleri ve fetal USG (ultrasonografi) ile de bu oranlarda istenen azalma sağlanamamıştır [119]. Bu durum günümüzde rutinde uygulanan tarama testlerinin yetersizliğinden kaynaklanmaktadır. Yanlış pozitiflik ve yanlış negatiflik oranları, testin yapıldığı merkez ve yapıldığı merkezin biyokimyasal istatistik değerlerine, sübjektif USG bulgularına (gebelik haftası, NT: Nuchal Translucency vb.), hasta uyumuna bağlı olarak değişmektedir. Dolayısıyla tarama testlerinin gereksiz invaziv girişim oranlarını azaltmak ve anöploidi yakalama oranlarını arttırmak için üzerlerinde daha çok çalışılma yapılmasına hatta alternatif tarama testlerinin geliştirilmesine ihtiyaç duyulmaktadır.
Prenatal testler materyal elde etme yolları açısından invaziv ve noninvaziv olarak ikiye ayrılmaktadır.
İnvaziv yöntemler; direkt olarak fetusa ait hücrelerin elde edildiği amniyosentez,
koryonik villus biyopsisi, kordosentez gibi girişimsel işlemlerdir. Dolayısıyla hem maternal hem de fetal açıdan mortalite ve morbiditesi yüksek olan uygulamalardır. Elde edilen fetusa ait hücrelerden sitogenetik (karyotip), moleküler sitogenetik (FISH: Floresan İn Situ Hibridizasyon) ve moleküler (QF-PCR: quantitative fluorescence PCR) laboratuvar
23
yöntemleriyle DS tanısı konulabilmektedir. Böylelikle DS ve benzeri genetik hastalıkların tanıları yaklaşık %99 doğrulukta konulabilmektedir.
Noninvaziv yöntemler; dolaylı yollarla fetusa ait biyobelirteçler elde edilmektedir.
Maternal plazmada alfa-fetoprotein ölçümü veya maternal plazmada serbest fetal DNA eldesi noninvaziv yöntemler arasındadır. Bunun gibi girişimsel olmayan yöntemler anne adayından basit bir kan alma işlemi ve elde edilen örnekten istenilen belirteçlerin biyokimyasal, moleküler veya sitogenetik yöntemlerle tespitine dayanmaktadır. Bu yöntemle elde edilen gerek biyokimyasal gerek genetik sonuçlar günümüzde, tanı testleri olarak değil, tarama ve ileri tarama testleri olarak uygulanabilmektedir [120]. Testin DS lehine sonuçlanması durumunda mutlaka invaziv yöntemlerle kesin tanı elde edilmelidir.
2.2.4.1 Non-invaziv Prenatal Tanı Testleri
2.2.4.1.1 Prenatal Biyokimyasal Tarama Testleri
Anöploidiler için prenatal tarama programları 30 yıl önce biyokimyasal testler olarak başlamış, sonraki yıllarda ultrasonografi ve biyokimyasal testlerin birlikte kullanımıyla devam etmiştir [121]. Günümüzde prenatal biyokimyasal tarama testleri artmış DS riskini ortaya koymak için tüm gebelere uygulanmaktadır [122]. Artmış risk tespiti durumunda kesin tanıya yönelik invaziv yöntemlere başvurularak olguya karyotip analizi önerilir. Bu bilgi aileye genetik danışma ile aktarıldıktan sonra terminasyon ya da gebeliğin devamına yönelik karar sonucun pozitif olması durumunda aileye bırakılır. Bu biyokimyasal parametreler gebelik haftalarına göre, ikili tarama testi, üçlü tarama testi, dörtlü tarama testleri şeklinde gebelik haftası ve USG ile kombine olarak uygulanmaktadır.
2.2.4.1.1.1 Maternal Yaşın Değerlendirilmesi
Anne yaşı arttıkça fetüste DS riski artar [123]. Yüksek riskin eşik değeri 1/250 olarak belirlenmiştir. Eşik değerinin 1/250 seçilmesinin sebebi amniyosentez ve koryonik villus biyopsisi gibi invaziv yöntemlerden kaynaklanan mevcut gebeliğin düşük ile sonuçlanma
24
olasılığıdır. Risk 1/250 ya da daha yüksek ise, DS’li fetüs bulunma riski, invaziv girişim sebebiyle olabilecek düşük riskinden daha fazladır, risk 1/250’nin altında ise düşük riski DS’li fetüs bulunma riskinden daha yüksektir [124].
Prenatal tarama testleri %5–10 yanlış pozitiflik, %35–40 yanlış negatiflik oranlarına sahiptir. Dolayısıyla bu tarama testleri kullanılarak DS’li tüm fetüslerin yalnızca %60-65’i tespit edilebilmektedir.[125, 126].
Günümüzde anne yaşı 35’in altında olan tüm gebelere prenatal tarama testleri uygulanmaktadır. Maternal serum tarama testlerinin sonuçları yorumlanırken en önemli nokta ise anne yaşıdır. Test sonucunun anöploidi bakımından yüksek riskliçıkması durumunda genetik danışmayla invaziv prenatal tanı testlerinin uygulanması önerilmektedir [122]. İleri anne yaşına sahip yani 35 yaş ve üzerindeki gebeler ise direkt risk grubunda kabul edilmekteler ve invaziv prenatal tanı yöntemleri için aday grubuna girmektedirler [122] .
2.2.4.1.1.2 İkili Tarama Testi
Gebeliğin, 11–14. haftaları arasında yapılır. PAPP-A ve serbest β-hCG adı verilen iki hormonun anne kanında ölçülmesinden yararlanılarak yapılan risk oranını belirlemeye yarayan istatistiksel bir testtir.
PAPP-A: Pappalysin-1 proteini olarak bilinir ve aynı adlı gen tarafından kodlanır (pregnancy-associated plasma protein A). DS’de hem maternal plazmada hem de plasentada ekspresyonu azalır.
İkili testin avantajları arasında gebeliğin daha erken bir döneminde yapılması ve anormal bir sonuç durumunda daha fazla tanısal test seçeneğinin olması, anomalili bebek durumunda ise gebelik terminasyonunun daha erken gebelik haftalarında yapılabilmesidir. Ayrıca duyarlılığının üçlü teste göre daha yüksek olduğu bildirilmiştir [123, 127].
Sadece ikili test yapılması durumunda DS olan bebeklerin %60’ı saptanabilmektedir. Aslında bu rakam üçlü test ile saptanan DS’li bebek sayısından farklı değildir, ancak ikili testte yalancı pozitiflik oranı daha düşüktür. Ayrıca ikili teste ek olarak ultrasonografide “ense kalınlığı” ölçümü ile bu oran %85-90’lara ulaşmakta ve yalancı pozitiflik oranı % 5’e düşmektedir [127].
25
2.2.4.1.1.3 Üçlü Tarama Testi
Son adet tarihine göre 15–18. gebelik haftasında olan tüm 35 yaş altı gebelere bu tarama testi önerilebilir. Üçlü tarama testi anne kanında Alfa-fetoprotein (AFP), serbest östriol (uE3) ve insan koryonik gonadotropin (hCG) ölçümlerine dayanarak yapılan bir risk belirleme yöntemi olmakla birlikte, anne yaşıyla beraber ele alındığı zaman DS’li bir bebeğe sahip olma riski hesaplanabilir [128].
Alfa-fetoprotein-AFP: Fetal karaciğerde ve yolk kesesinde üretilerek fetal dolaşıma salınan ve fetal böbrekler tarafından idrarla amniyotik sıvıya atılan bir glikoproteindir, bir miktarı anne dolaşımına geçtiğinden, hem anne serumunda (MSAFP), hem de amniyotik sıvıda (AFAFP) düzeyi ölçülebilir. Her iki ölçüm de prenatal tanıda kullanılmaktadır. Trizomi 21’li fetüs taşıyan annenin kanında yolk kesesinin ve fetusun normalden daha küçük olmalarından kaynaklanan azalmış AFP miktarı söz konusudur [129].
Östriol: Fetal karaciğer ve fetal adrenal bezin ürettiği dehidroepiandrosteron sülfat (DHEA-S) ve 16 α- hidroksi DHEA-S’ın androjenlere dönüşümü sonrası aromatizasyon ile plasenta tarafından yapılan bir hormondur. Plasental sülfataz ile sülfat koparılarak fetal adrenalde ankonjuge östriol oluşturulur. Plasental sülfataz aktivitesi düşük veya yetersiz olduğunda maternal serum östriol (MSuE3) düzeyinin düşeceği bildirilmektedir [130]. Östriol DS’li gebede azalmıştır.
İnsan Koryonik Gonadotropin: Beta subuniti DS’li gebeliklerde artmıştır. İlk kez 1912 yılında tanımlanmış, plasental sinsityotrofoblastlar tarafından salınan α ve β subünitlerden oluşan protein yapıda bir moleküldür. Serbest β-hCG, β subünitinin N terminaline oligosakkarit eklenerek sentezlenir. Gebeliğin 11-14. haftasında DS taramasında, anne kanında PAPP-A ile birlikte ikili tarama testinde de kullanılmaktadır [130].
Farklı bileşenlerin doğru analizi gebelik yaşının kesin olarak bilinmesine bağlıdır. Çünkü tetkik edilen biyokimyasal parametreler her biyokimyasal tarama testi için belli gebelik haftalarına ait parametrelerin ortalamaları alınarak değerlendirilir. Bunu saptamanın en iyi yolu USG’dir [131]. Gebeliğin birinci trimestrinde ortalama gebelik kesesi çapı, baş-makat mesafesi (crown-rump length CRL) ölçümleri [132]; ikinci trimestrinde ise biparietal çap (BPD), baş çevresi (HC), femur uzunluğu (FL) ve karın çevresi (AC) ölçümleri standart deviasyonlarla değerlendirilerek gebelik haftası tespit edilmektedir [133].
26
Serum testi sonuçları belirlendikten sonra, laboratuvarın referans değerlerine göre normallerin ortancası "population median" adında bir risk faktörü hesaplanır. Test sonuçları bazen ortancanın çarpanları (Multiples of the Median, MoM) olarak, ortalama değer 1,0 MoM olarak adlandırılır. Trizomi 21’li gebeliklerde AFP ve östriol seviyeleri ortalamanın altında, 1,0 MoM’dan daha düşüktür [134]. AFP seviyesi ortalama 0,8 MoM olup, bu seviyeler anne yaşıyla beraber değerlendirilince 35 yaş altındaki kadınlarda DS’li gebeliklerin yaklaşık %25’i tespit edilebilir [128]. Ortalama uE3 seviyesi ise yaklaşık 0,75 MoM ’dir. Çok düşük düzeyler ise steroid sülfataz eksikliği veya Smith-Lemli-Opitz Sendromu açısından uyarıcı olabilir. DS’li gebeliklerde ortalama β-hCG seviyesi ise yaklaşık 2,5 MoM olup toplum ortalamasından oldukça yüksektir. Bazı çalışmalarda üçlü testte çalışılan hormonlardan β-hCG’nin daha önemli olduğu gösterilmiştir. Üç belirleyicinin tümünün kullanımı ile 35 yaş altındaki kadınlarda DS’li fetusların yaklaşık %60’ı, ultrasonografinin de taramaya ilave edilmesiyle % 85’i saptanabilmektedir (Tablo 6) [120, 128]. Bu üç belirleyicinin hasta yaşına uyarlanmış ortalama seviyeleriyle DS için özgül bir risk elde edilir. Hesaplanmış riskleri 35 yaşında 16 haftalık gebe bir kadının riskinden (1/250) daha yüksek olan kadınların tarama testi pozitif kabul edilir [128].
Üçlü test ile ikili testten farklı olarak nöral tüp defektlerinin riski de belirlenebilmektedir. Ancak testin geç dönemde yapılması ve anormal bir sonuç çıkması durumunda, gebelik sonlandırılması işleminin 20–24. hafta gibi ileri bir gebelik haftasına denk gelmesi hastalar açısından önemli bir dezavantajdır. Ayrıca üçlü testin anomali saptama açısından duyarlılığının yüksek olmaması da ikinci önemli sorunu oluşturmaktadır.
2.2.4.1.1.4 Dörtlü Tarama Testi
Üçlü teste ek olarak kanda inhibin-A düzeylerine de bakılarak dörtlü test yapılabilmektedir. İnhibin-A hipofiz bezi tarafından folikül uyarıcı hormonunun üretimini inhibe eden, overler tarafından salınan bir proteindir. DS’li fetüsü olan annelerin kanlarında düzeyi artmaktadır [134]. Dörtlü tarama ile DS yakalama oranı artarken, invaziv girişim sayısı ~ %35 azalır [124].
27
Tablo 6: Prenatal biyokimyasal tarama testlerinin güvenilirlikleri [122, 124] Trimester Birinci (10–13 hafta) İkinci (14–22 hafta) Birinci- İkinci (10-22 hafta) Parametre İkili Tarama Üçlü Tarama Dörtlü
Tarama Entegre Test
PAPP-A + + NT + + AFP + + + hCG + + + uE3 + + + B- hCG + + inhibin A + + Tespit Oranı % 85 % 69 % 81 % 94
Yanlış Pozitiflik Oranları % 5
2.2.4.1.2 Fetal Görüntüleme
Fetüsün izlemi ve görüntülenmesinde en sık kullanılan yöntem USG’dir. Gerekli görülen durumlarda ekokardiyografi (ECG), manyetik rezonans görüntüleme (MRG) ya da direkt grafiler kullanılabilir. Ultrasonografik incelemelerde tespit edilen artmış ense kalınlığı, hiperekojen barsak, kısa femur, kısa humerus, piyelektazi, ekojenik intrakardiyak odak, koroid pleksus kisti, nazal kemik yokluğu veya hipoplazisi DS tanısına yardımcı bulgulardır [89]. Günümüzde bu bulguların herhangi birinin saptanması durumunda artmış DS riski nedeniyle kesin tanıya yönelik invaziv yöntemler uygulanmakta ve genetik yöntemlerle DS’ye yönelik genetik tanı testleri uygulanmaktadır.
28
2.2.4.1.3 Maternal Kan Örneğinde Fetal Hücre ve Nükleik Asitlerin Analizi
Maternal ve fetal dolaşım plasental membranlarla ayrılmakla birlikte bu membranlar arasında fetal belirteçler açısından bir trafik söz konusudur. Çekirdekli fetal hücrelerin maternal kanda saptanması bu trafiğin ilk kanıtlarından olup bu durum prenatal tanıda girişimsel olmayan yeni yöntemlerin araştırılmasına olanak sağlamıştır [135].
Anne kanındaki fetal hücrelerin rutin doğum öncesi genetik tanıda kullanılabilmesi için aşağıda belirtilen niteliklere sahip olmalıdır:
1. Bu hücreler tüm gebelerin kanında bulunmalı,
2. Genetik incelemenin yapılabilmesi ve gerekirse gebeliğin sonlandırılabilmesi için gebeliğin erken dönemlerinde yeterli miktarda bulunmalı,
3. Sonraki gebeliklerde anne kanında bulunmamalı,
4. Maternal hücrelerden ayrımlarını sağlayabilecek kendilerine özgül işaretleri olmalı [136].
Fetusa ait hücreler ve fetal DNA-RNA anne kanında çok düşük düzeylerde bulunmakla birlikte bunların uygun yöntemle saptanabileceği düşünülmektedir. Anne kanında fetal hücrelerin varlığı ilk defa 1893’te Schmorl’ün eklampsi nedeniyle ölen gebe kadınların kan dolaşımında histolojik olarak trofoblastları gözlemlemesiyle keşfedilmiştir [41]. Mendel ve Matais hem hasta hem de sağlıklı bireylerde plazmadaki nükleik asitlerin varlığını göstermişlerdir [110]. Walknowska ve arkadaşları, 1969’da yayınladıkları çalışmada, anne kanında fetal lenfositlerin varlığını ortaya koymuşlardır [137]. Schroder ve Grossett maternal kanda 46,XY karyotipine sahip fetal lenfositleri ve Y kromatin pozitif hücreleri göstermişlerdir [138, 139]. Sonraki yıllarda maternal kanda fetusa ait 46,XY metafazları da tespit edilmiştir [140]. Yapılan araştırmalar sonucu konvansiyonel sitogenetik yöntemlerin bu araştırma için pratik bir yöntem olmadığı kanısına varılmış, bu da araştırmacıları farklı yaklaşım arayışına yöneltmiştir. Maternal kanda fetal hücrelerin saptanma olasılığını arttırmak amacıyla, kanın zenginleştirilmesi için 1979’da ilk kez akım sitometri kullanılmıştır [141]. Tharapel ve arkadaşları, 1993’te yaptıkları çalışmada, insan lökosit antijenleri (HLA) farkına dayanarak akım sitometri yöntemiyle anne ve fetüsün lenfositlerini ayrıştırıp fetüse ait metafazları incelemişlerdir [142]. Floresanlı hücre ayırıcılar yardımıyla da fetal lenfositlerin arttırılması mümkündür ancak doğumdan sonraki
29
6 senelik sürede bu hücrelerin tespit edilebilir kalmaları önemli bir sorun oluşturmaktadır [143, 144]. Lenfoid prekürsör hücreler ise doğumdan sonraki 27 yıl boyunca maternal kandan izole edilebilmektedir [143, 144].
Son 30 yılda maternal kandan elde edilen fetal hücrelerde prenatal tanı çalışmaları yapılmış ancak klinik uygulamaya geçecek bir başarı sağlanamamıştır. Lo ve arkadaşlarının 1997’de maternal kanda hücre dışı serbest fetal DNA (cffDNA) tespitiyle özellikle 2011-2012 yıllarında cffDNA çalışmaları artmış ve klinik uygulamaya girmeye başlamıştır. Bu alandaki çalışmalar 1990’lardan sonra hız kazanmış, anne kanında fetal çekirdekli eritrositler incelenerek anöploidilerin prenatal tanısı için önemli sonuçlar elde edilmiştir [39-41]. Hücre bağımsız fetal DNA’nın anne kanında gösterilmesi noninvaziv prenatal tanı için atılmış önemli bir adımdır [42]. Fetal hücrelerin azlığı ve maternal dolaşımda çok küçük miktarlarda bulunması maternal kanda hücre bağımsız DNA’yı ön plana çıkarmıştır. Maternal dolaşımda total DNA’nın yalnızca <%1’nin fetal hücre kaynaklı olduğu, total hücre bağımsız fetal DNA oranının ise %3-19 arasında değiştiği bilinmektedir [145, 146]. Yapılan çalışmalarda hücre bağımsız fetal DNA eldesinin 20 kat daha kolay olduğu anlaşılmıştır [143]. Bu serbest DNA kaynağının apoptoza uğrayan sinsityotrofoblastlar olduğu kanıtlanmıştır [44]. Nükleik asitler hücre bütünlüğü bozulsa bile tıbbın birçok alanında kullanılabilecek önemli biyolojik belirteçlerdir.
Yapılan çalışmalara göre, Trizomi 13 ve 18 gibi çeşitli kromozomal hastalıklarda fetal DNA’nın anne kanında tespiti ve dizi analizi mümkün görünmektedir ancak bu işlemin mevcut koşullarda oldukça pahalı olması önemli bir kısıtlılık yaratmaktadır [43].
Günümüzde noninvaziv prenatal tanıya yönelik çalışmalarda %99-100’e varan doğruluklarda trizomi 21 tespit ettiği ileri sürülmekle birlikte bu konuda sağlıklı bir karar vermek için daha fazla sayıda çalışmaya ihtiyaç vardır. Bunlardan biri Methylation DNA Immunoprecipitation (MeDIP) ve real time qPCR’ın bir arada kullanıldığı fetal epigenetik belirteçlerin analiz edildiği yöntemdir. Papageorgiou ve arkadaşları 2011 yılında 34 adet trizomi 21 taşıyan ve 46 adet normal karyotipe sahip fetüs taşıyan gebenin plazmasını kullanarak, DS tanısını %100 özgünlük ve duyarlılıkta tespit ettiklerini bildirmişlerdir [46]. Trizomi 21’in noninvaziv olarak yüksek güvenilirlikte tespit edildiği diğer yöntem ise yeni nesil dizi analiziyle gerçekleştirilebilmektedir. High throughput shotgun sekanslama ve Z skoru analizi ile Palomaki ve arkadaşları 2011’de 1696 olguluk bir seride yaptıkları çalışmada %98,6 duyarlılık ve %99,8 özgünlükte trizomi 21 vakalarını maternal
![Şekil 1: Şematik olarak miRNA ve öncülleri [14, 15]](https://thumb-eu.123doks.com/thumbv2/9libnet/3043040.2858/13.892.132.788.132.712/sekil-sematik-olarak-mirna-onculleri.webp)
![Şekil 3: Ekstrasellüler miRNA'ların plasenta dışında taşınma yolları [54]](https://thumb-eu.123doks.com/thumbv2/9libnet/3043040.2858/18.892.168.718.477.844/sekil-ekstraselluler-mirna-larin-plasenta-disinda-tasinma-yollari.webp)



![Tablo 3: Anne yaşına göre DS görülme sıklığı[89]](https://thumb-eu.123doks.com/thumbv2/9libnet/3043040.2858/24.892.264.668.524.1121/tablo-anne-yasina-gore-ds-gorulme-sikligi.webp)
![Şekil 6: DS'nin şematik karakteristik özellikleri [100]](https://thumb-eu.123doks.com/thumbv2/9libnet/3043040.2858/27.892.154.684.139.1006/sekil-ds-nin-sematik-karakteristik-ozellikleri.webp)

![Tablo 6: Prenatal biyokimyasal tarama testlerinin güvenilirlikleri [122, 124] Trimester Birinci (10–13 hafta) İkinci (14–22 hafta) Birinci- İkinci (10-22 hafta) Parametre İkili Tarama Üçlü Tarama Dörtlü](https://thumb-eu.123doks.com/thumbv2/9libnet/3043040.2858/36.892.118.781.165.654/prenatal-biyokimyasal-testlerinin-guvenilirlikleri-trimester-birinci-parametre-dortlu.webp)