GİRİŞ VE AMAÇ
Ailevi Akdeniz Ateşi (AAA) tekrarlayan ateş ve poliserözit atakları ile karakterize, otozomal resesif geçişli, özellikle Akdeniz havzasındaki topluluklar olan sefardik Yahudiler, Ermeniler, Araplar ve Türkleri etkileyen bir hastalıktır (1,2). İlk olarak 1908 yılında Janeway ve Rosenthal tarafından tanımlanan hastalığın tedavisinde kolşisinin faydaları 1972 yılında Goldfinger tarafından gösterilmiştir (3,4,5). Halen hastalığın tanısı klinik olarak konmaktadır ve bu amaçla Tell-Hashomer kriterleri kullanılmaktadır. 1997 yılında hastalıktan sorumlu genin saptanması ile birlikte gen mutasyonu incelemeleri şüpheli olgularda yardımcı tanı yöntemi olarak gündeme gelmiştir (6).
MEFV (MEditerranean FeVer) geni saptandıktan sonra yapılan
çalışmalarda genetik mutasyonların hastalığın klinik seyri ve komplikasyonları üzerine etkisi araştırılmıştır. Yapılan ilk çalışmalarda M694V homozigot mutasyonunun Ermeni ve Yahudilerde hastalık şiddetini artırdığı, yüksek amiloid riski taşıdığı bildirilmiştir. Türklerde ise benzer ilişki gösterilememiştir. Yalçınkaya ve ark. fenotip-genotip ilişkisini araştıran çalışmalarında Türklerde herhangi bir mutasyonu homozigot yada birleşik heterozigot taşımanın hastalık şiddeti ve amiloid gelişimi üzerine etkisi olmadığını bildirmişlerdir. Benzer sonuçlar İngiltere’den Booth ve ark. (7) tarafındanda yayınlanmıştır.
Bu çalışmayı yapmamızdaki amaç klinik olarak AAA tanısı almış 105 çocuk hastamızdaki genetik mutasyonların araştırılması ve bu mutasyonların hastalığın klinik seyri üzerindeki etkilerini değerlendirmekti.
GENEL BİLGİLER
AİLEVİ AKDENİZ ATEŞİ
Kalıtsal periyodik ateş sendromları belirlenebilen bir neden olmaksızın başlayan ateş, deri döküntüsü, eklem ağrıları, karın ağrısı şeklinde ortaya çıkabilmektedir. Genelde 24-72 saat süren ataklar haricinde hastalar asemtomatiktir. Atakların başlamasına sebep olan neden tam olarak bilinmemektedir. Ruhsal nedenler, ağır egzersiz, yorgunluk gibi etkenlerle atakların başlayabildiği gözlenmiştir (8).
Ailevi Akdeniz Ateşi periyodik ateş sendromları içinde en sık görülenidir (9). Otozomal resesif geçişli olan hastalık; akut faz cevabının eşlik ettiği tekrarlayan ve kendini sınırlayan ateş atakları, genellikle steril bir peritonit, plörit, mono/oligoartrit ve deri döküntüleri ile seyreder. Atak süresi genellikle 12-72 saattir ancak atağa eşlik eden artralji veya artrit bulguları daha uzun sürebilmektedir. Atakların seyri hastalar arasında farklılık gösterebilmektedir. Aynı ailenin bireyleri arasında bile atakların seyri açısından belirgin farklılıklar gözlenebilir (1).
Türk, Ermeni, Yahudi ve Araplar gibi Akdeniz kökenli toplumlarda daha sık gözlenmektedir (2). Hastalığın ilerleyen dönemlerinde amiloidoz ve böbrek yetmezliği geliştiği bildirilmiştir (10,11).
Hastalık ilk olarak 'Unusual paroksismal syndrom' ifadesiyle 1908 yılında Janeway ve Rosenthal tarafından tanımlanmıştır (3,4). 1945’de Siegel tarafından selim paroksismal peritonit şeklinde ifade edilen hastalık 1960’larda Sohar ve ark. (12) tarafından ayrıntılı olarak tanımlanıp familial Mediterranean fever şeklinde isimlendirilmiştir. Türkiye'de ise ilk FMF hastası 'Garip Bir Karın
Ağrısı Sendromu' adı ile 1946 yılında Abrevaya Marmaralı
tarafından bir erişkinde tanımlanmıştır (13). 1970’li yıllara kadar daha çok hastalığın klinik özellikleri ve tanımlanması üzerinde durulurken 1972 de Goldfinger tarafından tedavide kolşisinin faydaları gösterilmiştir (5). 1992 yılında MEFV (MEditerranean FeVer; MEFV) geninin 16. kromozomun kısa kolu üzerinde yeraldığı saptanmıştır (14). İlgili gen 1997 yılında Uluslar arası AAA konsorsiyumu ve Fransız AAA konsorsiyumu tarafından birbirinden bağımsız olarak
GENETİK GEÇİŞ VE EPİDEMİYOLOJİ
Mamau ve Kattan tarafından 1950’li yıllarda hastalığın ailevi olduğu ve otozomal resesif geçiş gösterdiği bildirilmiştir (13). AAA yatay geçişlidir bu durum otozomal resesif kalıtımda görülür ancak bazı toplumlarda taşıyıcı oranının yüksek olması ve akraba evliliklerinin sık olması dikey kalıtım benzeri bir duruma neden olabilmektedir. Bahsedilen bu duruma bağlı olarak otozomal dominant kalıtım benzeri yanıltıcı sonuçlar görülebilmektedir (16).
Fransız AAA Konsorsiyumu kendi çalışma gruplarında taşıyıcı kromozomların %85’inde hastalıkla ilgili 4 mutasyonu göstermiştir (M694V, M680I, M694I, V726A). 1998’de ekson 10’da dört tane daha yeni mutasyon tanımlanmıştır. Bu mutasyonlar; 692’de delesyon, Lys695Arg, Ala744Ser, Arg761His’dir. Bundan sonra ekson 2, 3, 5, 1 ve 9’da 36 mutasyon belirlenmiştir (17).
En son yapılan çalışmalarda MEFV geninin 83 varyantının olduğu ancak bunların yaklaşık yarısının patojenik özelliği olmadığı bildirilmiştir. M694V, M694I, V726A ve M680I (ekzon 10’da) ve E148Q (ekzon 2’de) bölgeleri, AAA’nde en sık mutasyon olan bölgelerdir (18). Günümüzde özellikle ekzon 10 bölgesinde, 150’den fazla mutasyon ve polimorfizm tanımlanmıştır. Diğer
mutasyonlar ise ekzon 1, 2, 3, 5 ve 9’da bulunmuştur (19,20).
Ailevi Akdeniz Ateşi genellikle Doğu Akdeniz kökenli insanlarda, özellikle de Askenazi olmayan Yahudilerde, Ermenilerde, Araplarda ve Türklerde yaygın bir hastalıktır. Askenazi olmayan Yahudilerde (Sefardik Yahudilerde) hastalığın yaygınlığı 1/250 ve 1/500 arasındadır. Hastalığın Türklerdeki yaygınlığı 1/ 1075 ve Orta Anadolu’da ki yaygınlığı ise 1/395 olarak bulunmuştur (21). Bu dört etnik grup kadar olmasa da, giderek artan sayıda diğer Akdeniz ülkelerinden de (Yunanistan, İtalya, İspanya) hastalar bildirilmektedir (22). Taşıyıcı sıklığı Türk, Ermeni ve Yahudi popülasyonlarında 1/3-1/5 gibi yüksek oranlarda saptanmıştır (23,24).
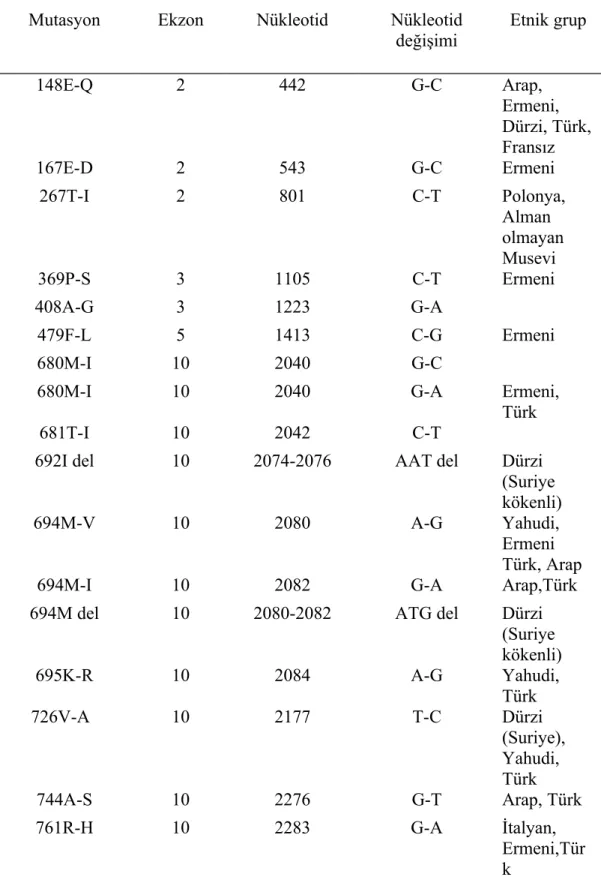
Tablo 1. Etnik kökenlere göre MEFV mutasyonlarının dağılımı
Mutasyon Ekzon Nükleotid Nükleotid
değişimi Etnik grup 148E-Q 2 442 G-C Arap, Ermeni, Dürzi, Türk, Fransız 167E-D 2 543 G-C Ermeni 267T-I 2 801 C-T Polonya, Alman olmayan Musevi 369P-S 3 1105 C-T Ermeni 408A-G 3 1223 G-A 479F-L 5 1413 C-G Ermeni 680M-I 10 2040 G-C
680M-I 10 2040 G-A Ermeni,
Türk
681T-I 10 2042 C-T
692I del 10 2074-2076 AAT del Dürzi
(Suriye kökenli)
694M-V 10 2080 A-G Yahudi,
Ermeni Türk, Arap
694M-I 10 2082 G-A Arap,Türk
694M del 10 2080-2082 ATG del Dürzi
(Suriye kökenli) 695K-R 10 2084 A-G Yahudi, Türk 726V-A 10 2177 T-C Dürzi (Suriye), Yahudi, Türk 744A-S 10 2276 G-T Arap, Türk 761R-H 10 2283 G-A İtalyan, Ermeni,Tür k
PATOGENEZ
16. kromozomun kısa kolunda (16p13.3) yer alan MEFV geni pyrin/marenostrin adı verilen ve 781 aminoasitten oluşan bir proteini kodlar. Çoğunluğu olgun nötrofillerde sentezlenen bu proteininin inflamasyon mediatörlerini baskılayıcı rolü olduğu düşünülmektedir (25,26). Eklemlere olan minör travmalar ve çeşitli sitokinlere bağlı stresin neden olduğu inflamatuar yanıt normal pirin varlığında inhibe edilebilirken FMF’li hastalardaki mutant pirinin varlığında bu cevabın kontrol edilemediği sanılmaktadır (27).
Pirin proteininin sitoplazmada apopitoz ve inflamasyon kontrolünden sorumlu inflamazom kompleksinde görev aldığı gösterilmiştir (28). Bu görevin, amino ucundaki pirin bölgesinin, diğer pirin bölgesi içeren proteinlerle homotipik etkileşimine bağlı olduğu düşünülmektedir. Pirin proteini, amino ucundaki pirin bölümü ile, bir adaptör protein olan ASC proteininin pirin bölgesine bağlanır. Bu sayede, ASC proteininin kriyopirin ve diğer proteinlerle etkileşerek kaspaz-1 (CASP1) enzimini aktive etmesini engeller (29). Kaspaz-1 hem interlökin-1ß (IL-1ß) sitokininin proteolitik aktivasyonundan, hem de apopitoz yolunun uyarılmasından sorumludur (30). Bozulmuş pirin fonksiyonunun IL-1ß üzerinden yürüyen inflamasyon kaskadında ve kaspaz-1 üzerinden yürüyen apopitoz yolunda düzensizliklere yol açtığı ve bu durumun AAA patogenezinde rol aldığı düşünülmektedir (31,32).
Bir diğer hipotez de FMF ataklarının katekolamin metabolizmasında bir bozukluğa bağlı olarak stresle agreve olduğu görüşüdür. Bu hipoteze bağlı olarak Barakat ve ark. (33) sempatomimetik etkili bir ajan olan metaraminol infüzyonunu kullanmışlardır. Burada metaraminole bağlı endojen katekolamin deşarjı ile FMF benzeri semptomlar oluşturulmaya çalışılmıştır. İnfüzyon sonrası ortaya çıkan yakınmalar FMF ataklarına benzemekte ve kolşisin tedavisinden fayda görmektedir.
Günümüzde en çok kabul gören hipotez, atakların inflamatuar yanıtın düzenlenmesindeki bir bozukluktan kaynaklandığıdır. Normalde peritoneal ve sinovyal sıvılar komplemanın C5a fragmanının kemotaktik aktivitesini engelleyen inhibitör bir protein taşırlar. Bu proteinin işlevi, normal koşullarda
çeşitli nedenlerle aktive olan C5a’yı nötralize etmek ve inflamasyonu aşırıya kaçmadan kontrol altında tutmaktır; eksikliğinde seröz zarlarda inflamasyon ortaya çıkar. Yapılan çalışmalarda da hastaların eklem ve peritoneal sıvı örneklerinde C5a inhibitör aktivitesi saptanmamıştır (34).
Bir başka çalışmada ise aynı proteinin proinflamatuar bir sitokin olan IL-8’i de inhibe ettiği gösterilmiştir (35). Bu gende oluşan mutasyonlar, pyrin/marenostrin molekülünde yapısal değişiklikler oluşturup bu proteinin inflamasyondaki baskılayıcı işlevini ortadan kaldırmaktadır. Hastalığın ataklar halinde olmasının sebebinin, mutasyona uğramış bu molekülün normal koşullarda işlevini görmesi, ancak bazı durumlarda (örneğin stres) inflamasyonu engelleyememesinden kaynaklandığı ileri sürülmektedir (36).
KLİNİK
Hastalık 38,5-40 °C arasındaki yüksek ateş ve periton, plevra ya da sinovyum seröz membranlarından birinde oluşan inflamasyonun neden olduğu ciddi karın, göğüs veya alt ekstremitenin geniş eklemlerinden birinin ağrısı ile karakterizedir (27).
Ateş her atak sırasında görülen ve tanı için gerekli kabul edilen bir bulgudur. Ateş atak boyunca devam eder ve ortalama 12-72 saat kadar sürebilir. Genelde ateşe diğer bulgular eşlik eder, fakat nadir de olsa yalnız ateşle seyreden olgularda tarif edilmiştir. Çok nadir olmakla birlikte bazı vakalarda ateş olmayabilir. Kolşisin alan hastalarda da ataklar sırasında ateş görülmeyebilir (25,27,37). Ataklar kısa süreli olup 1-3 gün sürer ve tedavi edilmeden spontan iyileşir. Ancak atağa eşlik edebilen artrit veya artralji daha uzun sürebilmektedir. Ortaya çıkan ateşin yüksekliği ya da tutulan inflamasyon bölgesi bir ataktan diğerine farklılık gösterebilir. Atakların seyri hastalar arasında çeşitlilik gösterebileceği gibi aynı ailenin bireylerinde bile farklı atak seyirleri görülebilmektedir. Ataklar arasında hasta kendini iyi hisseder ve bir sonraki atağa kadar normal fonksiyonlarını yerine
haftada 2 epizodla 2 ayda bir epizod arasında değişir (38). Atak sıklığı yaşla birlikte giderek azalır (2).
Hastalar genellikle atakları başlatan bir etken tarif etmezler ancak AAA ataklarının bazı hastalarda çeşitli stres dönemlerine (menstruasyon, duygusal stres veya ağır fiziksel aktivite gibi) rastladığı görülür. Bazı hastalarda ise titreme benzeri şikayetlerin bulunduğu bir prodrom dönemi görülmektedir (27).
Tekrarlayan ataklar düzensiz aralıklarla ve bilinemeyen zamanlarda ortaya çıkmaktadır. Semptomlar vakaların %50’sinde 6 yaştan önce %80’inde 10 yaşından önce ortaya çıkmaktadır (39).
Tablo 2. FMF hastalığında görülen belirti ve bulgular
Semptom ve işaretler Görülme sıklığı
Ateş %96 1-3 gün süren tedavisiz kendini
sınırlayan 38.5-40 C ateş Steril peritonit %91 Apandisiti taklit eden hassasiyet, defans, distansiyonun eşlik ettiği yaygın karın ağrısı
Plörezi %57 Ağrılı solunum, minimal plevral effüzyon
Artrit, Artralji %45 Sıklıkla efor yada minör travma Sonrası gelişen daha çok alt Ekstremitede ve monoartiküler Erizipel benzeri eritem %22-30 Alt ekstremite cildinde ödemin eşlik ettiği hassas, ısı artışı olan hiperemik keskin sınırlı lezyonlar Başağrısı %90
Proteinüri farklı toplumlarda Sıklıkla tedavi almamış hastalarda değişen sıklıkta tekrarlayan ağır proteinüri
Amiloidoz farklı toplumlarda değişen sıklıkta
Akut skrotum %2 Tunika vaginaliste inflamasyon Myalji %10 Uzamış ateş (6-8 hafta), lökositoz Yüksek sedimentasyon değeri ve Hiperglobulinemi
Splenomegali %3 Perikardit %3
ATEŞ
Hastaların ortalama %90’ında görülür. FMF’de atak süresince ateş genellikle 38 C’den yüksektir. Birkaç saatten 4 güne kadar yüksek kalabilir fakat genellikle 24 saatte düşer.
Ateş her atak sırasında görülen ve tanı için gerekli kabul edilen bir bulgudur. Ateş atak boyunca devam eder ve ortalama 12-72 saat kadar sürebilir. Genelde ateşe diğer bulgular eşlik eder, fakat nadir de olsa yalnız ateşle seyreden olgularda tarif edilmiştir. Çok nadir olmakla birlikte bazı vakalarda ateş olmayabilir. Kolşisin alan hastalarda da ataklar sırasında ateş görülmeyebilir (25,27,37).
KARIN AĞRISI
FMF hastalarının hemen hepsinde (atakların en azından bir kısmında) karın ağrısı görülür. Yaklaşık %50 hastada karın ağrısı ilk belirti olarak bildirilmektedir. Atak sırasında konstipasyon ve ardından hastaların %30’a yakınında diyare gözlenir. Ataklar sıklıkla akut apandisit atakları ile karıştırıldığı için özellikle çocuk yaş gurubundaki hastaların %9’u akut apandisit şüphesiyle takip edilmekte ve bu hastalara apendektomi yada laparotomi yapılabilmektedir. Opere edilen hastalarda peritonda hiperemi ve nötrofilden zengin eksuda vardır. Bu eksuda fibröz yapışıklıklar sonucu mekanik ileusa, kadınlarda ovaryumlarda olaya katılırsa infertiliteye neden olabilir (27).
EKLEM BULGULARI
Eklem bulguları %35 olguda görülür. AAA’nin klasik bulgusu akut monoartrittir, nadiren olgoartriküler olabilir. Genellikle alt ekstremitelerin büyük eklemlerini tutar. Artrit tablosu 3-4 gün sürer, sekel bırakmaz. Nadiren uzun sürer ve destrüksiyona neden olur (25,27,42). Ataklar küçük travmalar ya da uzun süreli egzersizler sonucu tetiklenebilir. Hastalardan alınan sinovyal sıvı örneği bulanık, viskozitesi azalmış ve nötrofillerden zengindir. Gram boyama ve kültür sonuçları negatiftir (40,41).
Tekrarlayan monoartritlerin çeşitli ve çok sayıda nedeni olması sebebiyle kristal artropatiyi ve infeksiyonu ekarte etmek amacıyla eklem aspirasyonu ve elde edilen örneğin kültürünün yapılması gereklidir (41). Şiddetli ve inatçı eklem ağrısında diğer bağ dokusu hastalıkları ayırıcı tanıda değerlendirilmelidir.
Çocuklarda eklem ağrısının görülme sıklığı daha yüksek olduğundan sistemik belirtileri olan juvenil romatoid artrit (JRA) göz önünde tutulmalıdır. Ancak sistemik JRA tipik deri döküntüsü ve lenfadenopati ile FMF’den ayrılır. Uzun süreli JRA genellikle kronik artrite ve radyografik değişikliklere neden olur (25,42,43).
GÖĞÜS AĞRISI
Göğüs ağrısı atakları genellikle tek taraflıdır. Hızlı ve yüzeyel solunuma neden olan şiddetli bir ağrı vardır. Fiziksel bulgular genellikle azdır. Bazen frotman ya da perküsyonla dolgunluk alınabilir. En sık görülen radyografik bulgu kostofrenik sinüste küntleşmedir. Nadiren büyük effüzyon ve hatta atelektazi görülebilir. Göğüs ağrısı geçiren bir hastada tanısal zorluklardan birisi perikardiyal bir atak olup olmadığını teşhis etmektir (41). Plörit hastaların yaklaşık %25-50’sinde görülür. Semptomlar 24-72 saat sürer. Sıklıkla daha uzun süren infeksiyöz plöritten hızlı bir şekilde düzelmesi ile ayırtedilebilir (44). Perikardit ise FMF’in nadir bir özelliği olup tamponatla komplike olmadıkça tanısı zordur (45).
KAS AĞRILARI
FMF’de çeşitli sebeplere bağlı olarak adale tutulumu ortaya çıkabilir. Kısa veya uzamış febril adale atakları, egzersize bağlı baldır ağrısı, fibromiyalji, kolşisin miyopatisi başlıca sebeplerdir (41). İlk kez Langevitz ve ark. (46) 1994 yılında yaptıkları bir çalışmada AAA hastalarında febril miyalji sendromunu tanımlamışlardır. Bu sendrom periton irritasyonu olmaksızın karın ağrısı, artmış ateş, miyalji, yüksek sedimentasyon oranı, lökositoz ve hiperglobülinemi ile kendini gösterir.
Klasik FMF myaljisinde febril myaljiden farklı olarak ağrı, hassasiyet ve fonksiyon kaybı daha az şiddettedir. Hastaların %30’unda egzersize bağlı ağrı oluşur (41). Kolşisinin neden olduğu myopati ve nöropati bildirildiğinden beri uzamış febril myalji ile ilaca bağlı tablonun birbirinden ayrılması önem kazanmıştır (27).
DÖKÜNTÜ
Erizipel benzeri eritem FMF için tipik olan yeğane döküntüdür. Hemen her zaman alt ekstremitelerde dizin alt kısmında lokalize olur. Ayak sırtında ya da ayak bileğinde yer alır. Sıklıkla tek taraflıdır. Genellikle geniş bir sahayı etkileyen keskin sınırlı, kızarık, sıcak ve hassas bir cilt bölgesi olarak ortaya çıkar (41). 24-48 saat içerisinde kendiliğinden kaybolur. Selülit ile karıştırılabilir. Histolojik incelemelerde bu lezyonlarda vaskülitin eşlik etmediği bir ödem görülmüştür (47).
VASKÜLİT
Henoch Schönlein Purpurası (HSP), Poliarteritis Nodosa (PAN) gibi vaskülitlerin FMF’li hastalarda görülme oranının genel populasyona göre daha sık olduğu saptanmıştır. Buradaki vaskülitin patogenezi net olarak bilinmemekle birlikte immun kompleks mekanizmasının rol oynadığı düşünülmektedir (48). Bu hastaların %50’sinde dolaşan immun kompleksler, kompleman tüketimi ve artmış immunglobulin düzeyleri gösterilmiştir (49).
HSP en sık görülen vaskülit olup, sıklığı %5-7 arasında değişir. PAN %1 oranında görülür (27). Hastaların çoğunda FMF tanısı vaskülit geliştikten sonra konulur (50). FMF’li hastalarda PAN daha küçük yaşlarda ortaya çıkmakta ve beraberinde perirenal hematom sık görülmektedir, miyalji ve deri altı nodüllerde daha sık görülür (51).
AKUT SKROTUM
Akut skrotum 20 yaşından sonra nadir görülür. Çocuk ve genç erişkinlerde daha sıktır. Ataklar genellikle tek taraflıdır ve şişlik, kızarıklık, hassasiyet ile kendini belli eder. Tunika vaginalisin inflamasyonundan ileri gelir. Anotomik bir sekel bırakmadan 12-24 saat içinde kendiliğinden geçer. Tek başına yada abdominal atakla birlikte görülebilir (41).
AMİLOİDOZ
Amiloidoz dokularda protein yapıda bir madde olan amiloid’in birikimi ile karakterizedir. Amiloidoz biriken proteinin özelliğine göre iki sınıfa ayrılır. Primer amiloidoz AL (Amiloid Light Chain-hafif zincir amiloid) immunglobulin hafif zincirlerinden oluşur. Sekonder amiloidoz ise AA (Amiloid Associated)
nonimmunglobulin proteinden oluşur (52). Bu protein inflamasyona yanıt olarak karaciğerde sentez edilen Serum Amiloid A’nın terminal parçasıdır. AAA’nde AA tipi amiloidoz görülür (27).
FMF’in en ciddi ve ölümcül komplikasyonu nefropatik AA tip amiloidozistir ve tedavi edilmeyen hastaların çoğunda (%90) 40 yaşına kadar amiloidoz gelişir (53). Hasara uğramış dokularda SAA düzeyi çok fazla arttığı için (100-1000 kat) SAA’nın görevinin tamir mekanizması ile ilgili olabileceği düşünülmektedir. Birbirine bağlı üç SAA geni (SAA1, SAA2, SAA4) kromozom 11 üzerinde yerleşmiştir (54). Dokularda depolanan AA fibrilleri daha çok SAA1’den köken almaktadır (55).
FMF’in nefropatik amiloidozunun son dönem böbrek yetmezliğinden önce preklinik, proteinürik, nefrotik ve üremik olmak üzere 4 evresi mevcuttur (56). Amiloidoz gelişirken erken dönemde idrarda proteinüri görülmektedir. Bu nedenle AAA’li hastalarda tam idrar tetkikinin mutlaka düzenli aralıklarla izlenmesi gerekir. Proteinüri tesbit edilen hastalarda biyopsi ile mutlaka amiloidoz gösterilmelidir. Bu amaçla renal, rektal ya da gingival örnekleme yapılabilir. Bir çalışmada amiloidoz böbrek biyopsisinde %88, rektal biyopside %75 ve gingival örneklemede de %19 oranında gösterilebilmiştir (57).
Amiloidozun ileri evrede görüldüğü olgular fenotip 1, ilk bulgu olarak görüldüğü olgular fenotip 2 olarak adlandırılır (27).
FMF amiloidozunda böbrek dışında adrenal (adrenal yetmezlik), mide-barsak (emilim bozukluğu, ishal), dalak (splenomegali), karaciğer (hepatomegali, KCFT’de bozulma), tiroit (guatr, hipotiroidi), nadiren kalp (restriktif kardiyomiyopati, konjestif kalp yetmezliği), akciğer ve testislerde amiloid birikimi meydana gelebilmektedir (40).
Amiloidoz gelişme riski tedavi edilmeyen Kuzey Afrika Yahudileri’nde %90, Türkler’de %60 olarak bildirilmiştir. Ayrıca Ermenistan’da yaşayan Ermeniler’de amiloid gelişme riski Amerika’da yaşayan Ermeniler’den daha fazla saptanmıştır (40). Bu durum FMF hastalarında amiloidoz gelişimine genetik faktörler, çevresel faktörler ve etnik kökenin birlikte katkı yaptığını ortaya koymaktadır. Çoğu genotip-fenotip ilişkisi çalışması homozigot M694V mutasyonunun amiloidoz
özelliği olan hastalarda da amiloidoz gelişebileceğini göstermişlerdir. Kolşisinin yaygın olarak kullanılmaya başlanmasından sonra FMF’li hastalarda komplikasyon olarak görülen amiloidozun sıklığında azalma görülmüştür. Yapılan bir çalışmada kolşisinle tedavi gören 704 çocuktan sadece 1 tanesinde sekonder tip amiloidoz saptandığı bildirilmiştir (39).
Sonuç olarak kolşisin tedavisinin atakları tamamen önleyemese bile AAA’li hastaların çoğunda amiloidoz gelişimini engellediği kesin olarak kanıtlanmıştır (57).
LABORATUAR BULGULARI
AAA’nde ataklar sırasında artmış akut faz cevabı söz konusudur. Eritrosit sedimentasyon hızı artar, lökositoz oluşur, fibrinojen, CRP, serum amiloid A artar. Ataklar arası dönemde ise sedimentasyon, CRP, lökosit sayısı %50-93 hastada normal bulunmuştur. Buna karşın serum amiloid A ataksız dönemde %5’ten az hastada normal bulunur (61). IL-1, IL-6 ve TNF atak sırasında hastalarda yüksek bulunurken, IL-6’nın ataklar arasındaki dönemde de kontrol grubundan yüksek olduğu ve bunun devam eden subklinik inflamasyonun göstergesi olabileceği düşünülmüştür (62). Buna karşın interferon aktivitesinin azaldığı ayrıca serozal sıvılarda C5a inhibitör aktivitesinde azalma olduğu saptanmıştır (14).
Hastalarda solübl interlökin-2 reseptör ( sIL-2R) düzeyi atak periyodunda, ataklar arası döneme göre daha yüksektir. Ayrıca iki atak arası periyotta interlökin-10 düzeyi düşmektedir. Azalmış IL-interlökin-10 seviyesi iki atak arası periyotta daimi bir subklinik immün aktivasyona yatkınlık meydana getirebilir ( 63).
Ataklar sırasında geçici albuminüri ve mikroskopik hematüri görülebilmektedir (64). Bütün bu bulgulara rağmen AAA için spesifik bir laboratuar testi henüz mevcut değildir.
MUTASYON ANALİZİNİN TANIDAKİ YERİ
Günümüzde çok sayıda mutasyon tanımlanmasına karşın çoğu merkezde bunlardan sık görülen birkaç tanesi çalışılmaktadır.
değerlendirildiğinde %70’i homozigot ya da compound heterozigottur. Geri kalanı heterozigottur ya da tesbit edilebilen bir mutasyon yoktur. Diğer taraftan bazı etkilenmemiş bireylerde her iki allel de de mutasyon vardır (41). Bu nedenle klinik bulguların varlığı ve aile öyküsü tanıda genetik mutasyon analizine göre çok daha değerlidir. Klinik olarak kuvvetle AAA düşünülen hastalarda gen mutasyonu negatif olsa bile tedaviye başlanmalıdır.
Şüpheli klinik bulguların varlığında gen analizinde mutasyon varlığının tesbiti minör yada destekleyici bir kriter olarak değerlendirilmelidir. Klinik tanı kesinse genetik analiz sonucu ne olursa olsun tanı değişmemekte ve tedaviye devam edilmektedir (65).
TANI
Ailevi Akdeniz Ateşi’nin tanısı aile öyküsü, karakteristik klinik özellikler,
kolşisine cevap ve moleküler taramadan oluşur. Atak sırasında sedimentasyon, C-reaktif protein, fibrinojen, haptoglobülin, C3, C4 gibi akut faz reaktanlarının artışı da klinik tablo ile birlikte FMF tanısı koymaya yardımcı unsurlardır (21).
FMF’in tanısı için değişik kriterler geliştirilmiş olup en sık olarak Tell-Hashomer kriterleri kullanılmaktadır.
Tel-Hashomer tanı kriterleri:
Majör kriterler:
1- Tekrarlayıcı poliserözit ve ateşli ataklar
2- Başka bir nedene bağlanamayan AA tipi amiloidoz 3- Sürekli kolşisin tedavisine iyi cevap
Minör kriterler:
1- Yineleyen ateşli ataklar 2- Erizipel benzeri eritem
3- Birinci derece akrabalarda FMF varlığı
Kesin tanı : 2 majör veya 1 majör ve 2 minör kriter Şüpheli tanı: 1 majör ve 1 minör kriter
Tel-Hashomer Ağırlık Skoru Anahtarı:
Hastalığın şiddeti ve klinik özellikleri etnik gruplar ve hastalar arasında belirgin farklılık gösterebildiği için hastalığın başlangıç yaşı, atak sıklığı, deri bulguları, eklem tutulumu, amiloidoz varlığı ve hastalığı kontrol etmek için gerekli kolşisin dozuna göre puanlama esasına dayalı olan Tel-Hashomer hastalık ağırlık skoru kullanılmaya başlanmıştır (66).
1. Hastalık başlangıç yaşı < 5 yaş : 3 puan 5-10 yaş : 2 puan 10-20 yaş : 1 puan > 20 yaş : 0 puan 2. Atak sıklığı
Ayda 2 ataktan fazla : 3 puan Ayda 1-2 atak : 2 puan Ayda 1 ataktan az : 1 puan
3. Atakları kontrol etmek için gerekli kolşisin dozu 2 mg/gün : 3 puan
1.5 mg/gün : 2 puan 1 mg/gün : 1 puan 4.Artrit
Uzamış artrit : 3 puan Akut artrit : 2 puan 5.Erizipel benzeri eritem Varsa : 2 puan 6.Amiloidoz Varsa : 3 puan Fenotip 2 : 4 puan
2-5 puan :Hafif Hastalık 6-10 puan :Orta Hastalık > 10 puan :Ağır Hastalık
Livneh ve ark. (67) gerek hastaların yaklaşık %5’inin kolşisine cevapsız yada zayıf cevaplı olması, gerekse Behçet hastalığı ve Gut hastalığı gibi ayırıcı tanıda yer alan hastalıkların da kolşisin tedavisinden fayda görmeleri nedeniyle kolşisin tedavisine cevabın minör kriter sayıldığı daha geniş kapsamlı tanı kriterleri oluşturmuşlardır.
Livneh ve arkadaşlarının önerdiği yeni kriterler Majör Kriterler:
1- Yaygın peritonit
2- Monoartrit (kalça, diz, ayak bileği) 3- Yalnız ateş
4- Plörit (tek taraflı) veya perikardit 5- Eksik (inkomplet) abdominal ataklar
1, 2, 3 ve 4. kriterler tipik ataklardır. Tipik ataklar her seferinde aynı karakterdedirler, atak süresi 12–72 saattir ve ateş 38 C’den yüksektir. Eksik ataklar ise vücut ısısının 38 C’nin altında olması, atak süresinin tipik atak süresinden daha uzun veya daha kısa olması, abdominal atak boyunca peritoneal bulguların bulunmaması, lokalize abdominal ağrıların bulunması ve spesifik eklemlerden başka eklemleri tutan artrit özelliklerinden biri veya ikisi bakımından tipik ataklardan farklı ataklardır.
Minör Kriterler:
1. İnkomplet göğüs atakları 2. İnkomplet artrit atakları
3. Egzersizle ortaya çıkan bacak ağrısı 4. Kolşisine iyi yanıt
Destekleyici Kriterler:
1. Ailesinde AAA bulunması 2. Etnik köken
3. Atakların 20 yaşından önce başlaması 4. Atağın ciddi yatak istirahati gerektirmesi 5. Atakların kendiliğinden geçmesi
6. Ataklar arası semptom olmaması
7. Geçici enflamasyonu gösteren anormal test cevabı (lökositoz, sedimentasyon, fibrinojen, SAA artışı)
8. Tekrarlayan proteinüri ya da hematüri
9. Gereksiz laparotomi veya apendektomi öyküsü 10. Akraba evliliği
Tablo 3. FMF ataklarının ayırıcı tanısı (41).
Ateşli Karın Ağrısı Atakları Ateşsiz Karın Ağrısı Atakları
İdrar yolu enfeksiyonu Nefrolitiazis Piyelonefrit Kolelitiazis Pelvik inflamatuar hastalık Peptik ulcus
Pankreatitis Ovülasyon , menstrüasyon Behçet hastalığı Hemoliz
İnflamatuar barsak hastalığı Orak hüceli anemi Hiper Ig D sendromu Abdominal epilepsi Ailesel İrlandalı ateşi Sfilitik nöropati Kronik divertikülit/apandisit Porfiria
Febril Ataklar Göğüs ağrısı
HIDS Otoimmün plöröperikarditis Alerjik reaksiyon Rekürren beniğn perikarditis Siklik nötropeni Plöropnomoni
Hodgin ve non hodgin lenfoma Rekürren pulmoner emboli Malarya İnfeksiyöz plöröperikardit Suni ateş Skrotal tutulum Testis torsiyonu Epididimit Orşit Behçet hastalığı
TEDAVİ
FMF hastalarının tedavisi için günlük kolşisin kullanımı ilk kez 1972 yılında
Goldfinger tarafından ortaya atılmıştır. Aynı yıl içinde Özkan ve Ark. (40) da FMF’in tedavisinde kolşisin tedavisini önermişlerdir. 1974 yılında Zemer ve ark. ‘nın (68) çalışmalarıyla bu tedavi günümüze kadar en yaygın kullanılan yöntem olmuştur.
AAA’li hastaların periton ve diğer serozal sıvıları incelendiğinde C5a inhibitörünün azaldığı saptanmıştır. C5a nötrofillerin o bölgeye kemotaksisini sağlar. AAA’deki kontrolsüz olarak artmış olan inflamasyondan C5a inhibitör eksikliğinin sorumlu olduğu düşünülmektedir (34).
Kolşisin polimorf nüveli lökositlerde sitokin üretimini modüle eder. İnflamasyon bölgesine ekstravazasyon ve migrasyonu sağlayan adezyon moleküllerinin (e-selektin, L-selektin) ekspresyonunu azaltır. İnflamasyonun başlangıcındaki C5a salınımını azaltarak lökosit kemotaksisini önler. Hücre içinde mitoz ve motilite için gerekli olan fibriler yapıların oluşumunu önler (37,69,70). Randomize, plasebo kontrollü çalışmalar ile 1-3 mg/gün kolşisin kullanımının FMF ataklarının önlenmesinde etkili olduğu bildirilmiştir (71). Hastaların yakınmalarında belirgin azalma ve çoğunda da atakların tamamen geçtiği gözlenmiştir. Bu tedavinin 16 yaşın altındaki hastalarda da etkili olduğu ve çocukların gelişimi ve fertiliteyi engellemediği saptanmıştır (68). Bazı hastalarda kolşisin dozu 0,5 mg/gün yeterli olmakla birlikte genellikle amiloidozun önlenebilmesi için 1,5-2 mg/gün dozda kullanılması önerilmektedir (57).
Amiloidozu olmayan 960 İsrailli hastanın değerlendirildiği bir çalışmada, düzenli olarak 11 yıl boyunca kolşisin kullanan 906 hastada amiloid gelişimi % 2 bulunurken, 9 yıl boyunca düzensiz aralıklarla kolşisin kullanan 54 hastada % 45 oranında amiloidoz saptanmıştır (72). Proteinürisi olan FMF hastalarına protein kaybını azaltmak için kolşisin tedavisi başlanması önerilmektedir (73). İlacın aralıklı kullanımı akut atakları bazı hastalarda önleyebilmekle beraber amiloidozun önlenebilmesi için kolşisinin sürekli kullanılması şarttır (74).
Kolşisin tedavisine yanıttaki farklılıkların genetik yatkınlık ve çevresel faktörlere bağlı olduğunu bildiren çok sayıda çalışma vardır. Ancak temel olarak kolşisinin etkinliği üç faktöre bağlıdır. Bunlardan ilki tedaviye başlanma anındaki böbrek hastalığının durumudur. İkinci faktör ilaç dozu olup, atakları önlemek için
daha küçük dozlar yeterli olabilmesine karşın amiloidozu önlemek için en az 1 mg/gün kullanılması gerekir. Üçüncü faktör ise tedaviye başlanıldığı andaki histopatolojik bulgulardır (74).
Kolşisinin az sayıda yan etkisi vardır; bunlar arasında gastrointestinal sisteme ait olanlar ön plana çıkmaktadır. Diare, pansitopeni, miyopati ve daha az sıklıkta da döküntü görülebilir. Diare doz azaltılmasıyla kısa sürede düzelir. Laktoz intoleransı normal populasyona göre 3 kat daha sık gözlenmektedir; laktozsuz diyet ve simetikon ile düzelir. Diğer yan etkiler olan azospermi, hafif geçici lökopeni, anjioödem, miyopati ve periferik nöropati son derece nadirdir. 231 tamamlanmış gebeliği kapsayan bir çalışmada hamileliğinden önce ve hamileliği sırasında kolşisin tedavisi almış annelerin bebeklerinde fetal anomali sıklığında artış olmadığı saptanmıştır (75). Laktasyon sırasında süte geçen miktar çok düşük olduğundan emzirme döneminde ilacın kesilmesine gerek yoktur (76).
İntravenöz kolşisin kullanımında daha sık toksik etkiler görülmüştür. Bu yüzden intravenoz kullanım yalnızca ameliyat öncesi ve sonrasında ve oral alamayan hastalarda tercih edilmelidir (14).
MATERYAL VE METOD
Çalışma Mart 2009 ile Ocak 2010 tarihleri arasında Dicle Üniversitesi Tıp Fakültesi Çocuk Nefroloji polikliniğine FMF ön tanısı ile sevkedilen ya da daha önce FMF tanısı almış ve poliklinik kontrollerine gelen 105 hasta ile gerçekleştirildi. Hastaların 50 tanesi kız 55 tanesi erkekti. Tüm hastalarda tanı Tell Hashomer kriterlerine göre kondu.
Hastaların tamamında E148Q, P369S, F479L, M680I (G/C), M680I (G/A), I692del, M694V, M694I, K695R, V726A, A744S, R761H’den oluşan 12 mutasyon strip test tekniği ile çalışıldı.
FMF tanısı alan ya da daha önce tanı alıp kontrole gelen hastaların tamamı aynı klinisyen tarafından muayene edilip, sorgulandı. Her hastaya cinsiyet, yaş, semptomların başlama yaşı, semptomların başlama yaşı ile FMF tanısı arasında geçen süre, ana-baba akrabalığı, hangi akrabalarda FMF ya da benzer semptomların olduğu, ateş, karın ağrısı, artrit, artralji, göğüs agrısı, kas ağrısı, erizipel benzeri eritem varlığı, daha önce aynı şikayetlerle başvurduğu sağlık kuruluşlarında aldığı tanılar, Apendektomi öyküsü ya da apandisit ön tanısı ile izlem, Atak süresi ve atak periyodu bilgilerinden oluşan form dolduruldu. Hastaların ağırlık ve boy persentilleri, MEFV gen mutasyon sonucu, Tam idrar tetkiki, Direkt idrar mikroskobisi, sedimentasyon, CRP ve Fibrinojen değerleri kaydedildi.
Kontrollerde tedaviye uyum, tedaviye yanıt, tedavi yan etkileri, atak dışı CRP, Fibrinojen, Lökosit ve sedimentasyon değerleri ile anne, baba ve kardeşlerde mutasyon analiz sonuçları aynı forma eklendi.
MOLEKÜLER TEKNİKLER Kullanılan cihaz ve kimyasallar:
1. Hibridizasyon cihazı (Profiblot T48, Tecan)
2. Thermal Cycler ( Mastercycler gradient, Eppendorf) 3. Kuru ısı bloğu (CHB-202, Bioer)
4. Santrifüj cihazı (Centrifuge 5415c, Eppendorf)
6. FMF Strip Assay DNA izolasyon kiti (Vienna Lab) 7. FMF Strip Assay PCR ve hibridizasyon kiti (Vienna Lab) 8. Güçkaynağı (Biorad)
9. Taq DNA polimeraz (Fermentas) 10. Ethidium Bromide (EtBr)
11. Otoklav indikatörü
12. Tüp (K3- EDTA, Eppendorf)
13. Eppendorf tüp (1.5, 2 ve 0.2 ml, Eppendorf) 14. Mikropipet uçları (Eppendorf)
15. Yükleme boyası (Fermentas)
DNA İzolasyonu
Tüm hastalarda genomik DNA izolasyonu FMF Strip Assay DNA izolasyon Kiti ile periferik kan dokusundan yapıldı. İzolasyon için kullanılan 20 hastalık kit içeriği aşağıdaki gibidir:
İzolasyon kiti içeriği:
1. Lizis solüsyonu (Lysis Solution) 50 ml
2. DNA bağlama solüsyonu (GENXTRACT Resin) 5 ml 3. Amplifikasyon karışımı (Amplification mix) 500 µl 4. Taq Dilüsyon tamponu (Taq Dilution buffer) 500 µl 5. DNAT Solüsyonu ( DNAT Solution) 1.5 ml
6. Tiplendirme Kabı (Typing Trays) 3 adet 7. Test stripleri ( Teststrips) 20 adet
8. Hibridizasyon Tamponu ( Hybridization buffer) 25 ml 9. Yıkama solüsyonu A (Wash solution A) 80 ml
10. Konjuge solüsyonu ( Conjugate solution) 25 ml 11. Yıkama Solüsyonu B ( wash solution B) 80 ml
Kan dokusundan DNA izolasyon protokolü
1.5 ml’lik mikrotüpe 100 µl kan örneği, 1 ml lizis solüsyonu konuldu ve tüpün kapağı kapatılarak birkaç kez tersyüz edilerek karıştırıldı. 15 dakika oda ısısında bekletildi. Daha sonra 3000 devirde 5 dakika santrifüj edildi. Üstte kalan 1ml’lik kısım atıldı. Tekrar 1ml lizis solusyonu eklenip kapak kapatılarak birkaç kez tersyüz edilerek karıştırılan tüp daha sonra 12000 devirde 5 dakika santrifüj edildi. Yaklaşık 50 µl lik çökelti dışındaki supernatant atıldı. Dipteki çökeltiye 200 µl Genxtract Resin eklendi ve 10 sn süreyle vortekslendi. Daha sonra;
- 56 C de 20 dakika inkübe edildi ve 10 saniye vortekslendi. - 98 C de 10 dakika inkübe edildi ve 10 saniye vortekslendi. - 12000 devirde 5 dakika santrifüj edildi ve buz içinde soğutuldu.
Polimeraz Zincir Reaksiyonu
MEFV geninin ilgili bölgelerinin çoklu amplifikasyonu için Vienna Lab FMF PCR amplifikasyon kiti kullanıldı. Kit, bir amplifikasyon karışımı (12 gen bölgesine ait biyotin işaretli primerler, ve diğer amplifikasyon için gerekli bileşenleri içerir) ve Taq DNA polimeraz tamponundan oluşmaktadır.
PCR için gerekli karışım aşağıdaki gibi hazırlandı; -Amplifikasyon karışımı : 15μl -Taq DNA polimeraz seyreltici tapon: 4,6μl -Taq DNA polimeraz : 0,4μl -Kalıp DNA : 5μl
PCR koşulları aşağıdaki gibi ayarlandı;
94 C’de………2dk (ilk denaturasyon) 94 C’de………15sn (denaturasyon) 58 C’de………30sn (bağlanma)
72 C’de………30sn (uzama) 72 C’de………3dk (son uzama)
35 döngüden sonra elde edilen PCR ürünleri strip test tekniğinde değerlendirilmek üzere +4 C’de saklandı.
Hibridizasyon
Strip test tekniğinide Revers Hibridizasyon 3 temel basamaktan ibarettir; 1) Strip üzerindeki problar ve PCR ürünlerinin bağlanması-hibridizasyon Cihazın örnek yükleme bölgesine (trey) yüklenen 10 μl PCR ürünü ve 10 μl DNAT solüsyonu (% 1.6 NaOH içeren denatürasyon solüsyonu) 5 dakika oda sıcaklığında bekletilerek denatüre edildi. Treye strip yerleştirildi. Denatüre PCR ürünü ve strip, cihazın sallanan platformunda, 45 C sıcaklıkta 1ml hibridizasyon tamponu ile 30 dk inkübe edilerek strip PCR ürünü hibridizasyonu sağlandı. Hibridizasyon solüsyonu aspire edilerek ortamdan uzaklaştırıldı.
2) Yıkama
Hibridizasyon sonrasında ortamda bulunması istenmeyen PCR ürünleri ve non-spesifik bağlanma yapan oligonükleotidler kuvvetli bir yıkayıcı olan yıkama solüsyonu A (1ml) ile 45 C ’de 15 dakikalık iki yıkama periyodu ile ortamdan uzaklaştırıldı.
3) Renk oluşumu
Stripler oda sıcaklığında 1ml konjugat solüsyonu ile 15 dk inkübe edilerek konjugat solüsyonu içinde bulunan streptavidin-alkalan fosfatazın, biyotin işaretli hibrit DNA fragmentlerine bağlanması sağlandı. Konjuğat solüsyonunun artıkları yıkama solüsyonu B ile 10 saniye, 5 dakika ve 5 dakikalık üç periyotta temizlendi.
Strip üzerindeki hibridize olmuş bantların görülür hale gelebilmesi için ortama alkalen fosfatazın subtratı olan nitro blue tetrazolium (NBT) ve 5-bromo-4-kloro-3-indolil fosfatdan (BCIP)
distile su ile yıkandı, kâğıt havlu ile kurutulduktan sonra değerlendirme tablosuna (Collector) yerleştirildi.
Striplerin Değerlendirilmesi
Her stripin üst tarafında kırmızı ve alt tarafında yeşil bir belirteç bulunmaktadır. Ayrıca üst kısımda yer alan kırmızı belirteçin hemen altında bir kontrol bandı bulunmaktadır. Hibridizasyon sonrası striplerin değerlendirmeye alınabilmesi için bu kontrol bantının oluşmuş olması gerekmektedir. Kontrol bantları oluşmamış stripler değerlendirilmeye alınmazlar. Yabanıl tip gen bölgelerine ait 8 prob stripin alt kısmında, mutant gen bölgelerine ait 12 adet prob ise stripin üst kısımında sinyal verecek şekilde dizayn edilmişlerdir. Hibridizasyon sonrası tüm yabanıl tip bantları mevcut olduğu ve mutant gen bölgelerine ait bantların bulunmadığı bir strip profili hastanın mutasyona sahip olmadığını gösterir.
Mutant gen bölgelerine ait bantlardan birinden sinyal alınıyorsa sinyal alınan mutasyonun yabanıl tip kodonuna bakılarak saptanan mutasyonun homozigot ya da heterozigot olma durumuna karar verilir. Mutasyonun yabanıl tip gen bölgesini gösteren bantın mevcut olması durumunda mutasyon heterozigot, mevcut olmaması durumunda ise homozigot olarak değerlendirilir. Normal Homozigot Heterozigot
Mutant Hattı
Yabanıl Tip Hattı
Şekil 1: MEFV gen mutasyonu tayininde striplerin değerlendirilmesi
DİĞER LABORATUAR İNCELEMELERİ
Çalışmaya alınan hastalarımızın laboratuar tetkikleri Dicle Üniversitesi Tıp Fakültesi laboratuarında bulunan cihazlarla yapılmıştır. Tam idrar tetkiki için Urısys 2400, fibrinojen için ACL Top, CRP için Beckman coulter immage, tam kan tetkiki çin Cell dyn 3700, sedimentasyon için greiner 100 markalı cihazlar kullanılmıştır.
İSTATİSTİKSEL ANALİZ
İstatiksel analiz için SPSS vs. 12.0 bilgisayar programı kullanıldı.
Tamamlayıcı istatistikler (ortalama, standart sapma, yüzdeler) yapıldı. Ölçüm ile elde edilen nümerik değerlerle üç grubu karşılaştırmada Kruskal-Wallis varyant analizi, ikili grupları karşılaştırmada Mann-Whitney U testi kullanıldı. Sayımla elde edilen değerlerin gruplar arası karşılaştırmasında Ki-kare testi uygulandı. Nümerik değişkenler arasındaki korelasyonlarda normal dağılıma uyan değişkenler için Pearson korelasyon analizi, normal dağılıma uymayan değişkenler için Speasman korelasyon analizi uygulandı. P 0.05’in altı istatistiksel açıdan anlamlı kabul edildi.
BULGULAR
Çalışma grubumuz Mart 2009 ile Ocak 2010 tarihleri arasında Dicle
Üniversitesi Tıp Fakültesi Çocuk Nefroloji polikliniğine FMF ön tanısı ile sevkedilen ya da daha önce FMF tanısı almış ve poliklinik kontrollerine gelen 105 hastadan oluşturuldu. Hastaların 50 tanesi kız (%47.6) 55 tanesi erkekti (%52.4). Hastalarımızın yaş ortalaması 106.6 ± 37.8 ay (36-192 ay) idi. Hastalarımızın yaşlara göre dağılımı şekil 2’ de verilmiştir.
Yas (ay)
192 180 168 156 144 132 120 108 96 90 84 78 72 60 54 48 36S
A
Y
I
16 14 12 10 8 6 4 2 0Şekil 2: Hastalarımızın yaşlara göre dağılımı
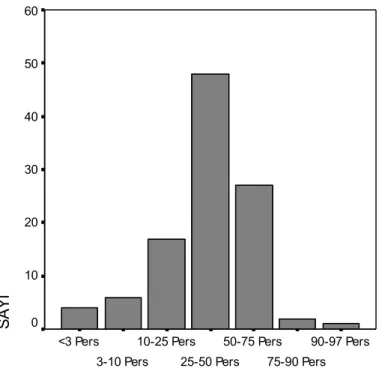
vucut ağırlığına göre 13 hasta (%12.4) boya göre ise dört hasta (%3.8) %3 persentilin altında idi. Vucut ağırlığına göre 88 hasta (%83.8) boya göre ise 75 hasta (%71.4) % 50 persentil ve altında idi. Hastalarımızın vucut ağırlıklarının boya göre geri kalmış olduğu görüldü. Hastalarımızın vucut ağırlığı ve boy persentillerine göre oranları şekil 3 ve şekil 4’de verilmiştir.
VUCUT AGIRLIGI PERSENTILLERI
90-97 Pers 75-90 Pers 50-75 Pers 25-50 Pers 10-25 pers 3-10 Pers <3 Pers S A Y I 40 30 20 10 0
BOY PERSENTILLERI 90-97 Pers 75-90 Pers 50-75 Pers 25-50 Pers 10-25 Pers 3-10 Pers <3 Pers S A Y I 60 50 40 30 20 10 0
Şekil 4: Hastalarımızın boya göre persentil değerleri
Hastalarımız klinik olarak değerlendirildiğinde en sık klinik yakınmaların ateş (%100) ve karın ağrısı (%99) olduğu görüldü. 65 hastada (%61.9) artralji 22 hastada (%21) artrit vardı. 16 hastada (%15.2) erizipel benzeri eritem mevcuttu. 55 erkek hastanın sadece birinde akut skrotum öyküsü mevcuttu. (Tablo 4)
Tablo 4. Hastalarımızın klinik yakınma ve bulguları
Semptomlar Hasta Sayısı (n) % Ateş 105 100 Karın Ağrısı 104 99 Artralji 65 61.9 Artrit 22 21 Göğüs Ağrısı 16 15.2 Erizipel Benzeri Eritem 16 15.2 Myalji 15 14.3 Akut Skrotum 1 0.9
Çalışma grubundaki hastalarımızda semptomların başlama yaşı ortalaması 70.2 ± 38.4 (18-156 ay) , semptomların başlaması ile tanı arasında geçen süre ortalaması ise 27.1 ± 23.5 ( 2-108 ay) idi. (Tablo 5)
Tablo 5. Hastalarımızda semptomların başlama yaşı ve semptomların başlaması ile
tanı arasında geçen süre ortalamaları
Semptomların başlama yaşı ile tanıya kadar geçen süre karşılaştırıldığında bu iki parametre arasında anlamlı negatif korelasyon saptandı. Semptomların başlama yaşı arttıkça tanıya kadar geçen sürenin azaldığı görüldü (r =-0.300, p=0.002).
Cinsiyetlere göre semptomlar değerlendirildiğinde sonuçlar aşağıdaki gibiydi: (Tablo 6)
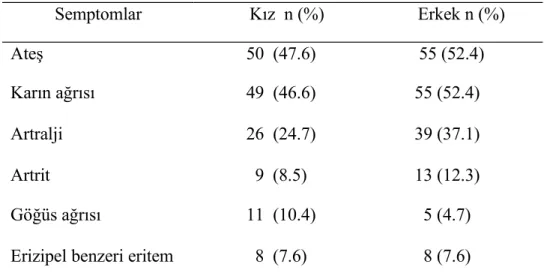
Tablo 6. Cinsiyetlere göre semptomların sıklığı
Semptomlar Kız n (%) Erkek n (%) Ateş 50 (47.6) 55 (52.4) Karın ağrısı 49 (46.6) 55 (52.4) Artralji 26 (24.7) 39 (37.1) Artrit 9 (8.5) 13 (12.3) Göğüs ağrısı 11 (10.4) 5 (4.7)
Ortalama yaş ve süre (ay) Semptomların başlama yaşı 70.2 ± 38.9 Semptomların başlaması ile tanı
arasında geçen süre
Myalji 4 (3.8) 11 (10.4)
Artralji şikayeti erkeklerde kızlara oranla anlamlı derecede yüksek bulundu (p<0.05). Diğer semptomlar açısından cinsiyetler arasında anlamlı fark saptanmadı.
105 hastadan oluşan çalışma grubu atak periyodu açısından gruplandırıldığında atakların düzensiz periyodlarla geldiğini söyleyen grup %26.7 ile en sık oranda görüldü. 2. sıklıkta %21.9 ile ayda 1-2 kez atak geçirdiğini söyleyen grup yeraldı. Ayda 4’den fazla atak geçirdiğini söyleyenlerin oranı %17.1 idi. Hastalarda görülen atakların periyodları tablo 7’de verilmiştir.
Tablo 7. Hastalarımızın atak sıklıkları
Atak Periyodu Hasta sayısı (n) % Düzensiz 28 26.7 Ayda 1 den az 18 17.1 Ayda 1-2 kez 23 21.9 Ayda 3-4 kez 18 17.1 Ayda 4 ten fazla 18 17.1
Atak süresi açısından bakıldığında 105 hastadan 39’u (%37.1) ataklarının 24-48 saat sürdüğünü ifade etti. Atakların 12 saatten az sürdüğünü söyleyenlerin oranı %11.4, 12-24 saat sürdüğünü söyleyenlerin oranı %15.2, 48-72 saat sürdüğünü söyleyenlerin oranı %28.6, 72 saatten fazla sürdüğünü söyleyenlerin oranı %7.6 idi. (Tablo 8)
Cinsiyetler arasında atak süreleri açısından anlamlı fark gözlenmedi (p>0.05).
Atak Süresi Hasta Sayısı (n) % 12 saatten az 12 11.4 12-24 saat 16 15.2 24-48 saat 39 37.1 48-72 saat 30 28.6 72 saatten fazla 8 7.6
Çalışma gurubumuzdaki hastalar daha önce aynı şikayetlerle başvurdukları çeşitli sağlık kuruluşlarında aldıkları tanılar açısından değerlendirildiğinde 56 hastanın (%53,3) idrar yolu enfeksiyonu tanısı aldığı görüldü. Bu oran akut gastroenterit için %20, konstipasyon için %30.5, tonsillit için %28.5, paraziter enfeksiyon için %31.4, gastrit için %21 ve nefrolitiazis için %3.8 şeklindeydi. Akut apandisit tanısı ile altı hasta (%5,7) izlenmişti ve bunlardan dördü (% 3,8) opere edilmişti. (Şekil 5)
Daha önce aynı şikayetlerle alınan tanılara göre kızlar ve erkekler karşılaştırıldığında kızlarda idrar yolu enfeksiyonu, paraziter enfeksiyon ve tonsillit tanısı almış olmanın erkeklere göre anlamlı derecede yüksek olduğu görüldü (p<0.05). Diğer parametreler açısından cinsiyetler arasında anlamlı fark yoktu.
Şekil 5: Hastalarımızın daha önce aynı şikayetlerle başvurdukları sağlık
kuruluşlarında almış oldukları tanılar
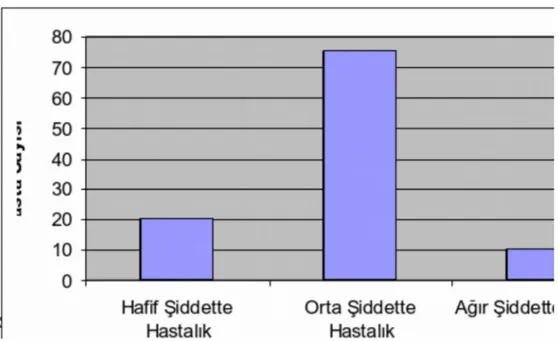
Çalışma grubundaki her bir hasta için hastalık ağırlık skorlaması yapıldı. Hastalık ağırlık skoru ortalaması 6.8 ± 1.9 olarak tesbit edildi. En düşük skor 3 en yüksek skor 11 idi. 2-5 puan hafif hastalık, 6-10 puan orta şiddette hastalık, 10’un üzerindeki puanlar şiddetli hastalık olarak kabul edildi. Buna göre hastalarımızın %71.4’ünün orta şiddette hastalık grubunda yer aldığı görüldü. Hastalarımızın hastalık ağırlık skorlarına göre oranları tablo 9 da verilmiştir.
Tablo 9. Hastalarımızın Hastalık Ağırlık Skorlamasına göre hastalık ağırlık
durumları
Hastalık Şiddeti Hasta Sayısı (n) % Hafif Şiddette Hastalık 20 19.1 Orta Şiddette Hastalık 75 71.4 Ağır Şiddette Hastalık 10 9.5 Toplam 105 100
Şekil 6: Hastalarımızın Hastalık Ağırlık Skorlamasına göre hastalık ağırlık
durumları
Cinsiyetlere göre hastalık ağırlık skorlaması değerlendirildiğinde kızlar için ortalama 6.8 ± 1.7, erkekler için ise 6.9 ± 2.0 şeklindeydi ve cinsiyetler arasında hastalık ağırlık skorlaması açısından anlamlı bir fark saptanmadı.
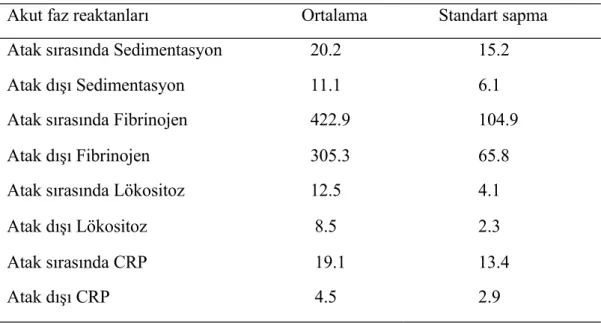
Laboratuar bulguları değerlendirildiğinde atak döneminde hastaların 52’sinde (%49.5) sedimentasyon yüksekliği, 69’unda (%65.7) CRP yüksekliği, 66’sında (%62.9) lökositoz ve fibrinojen yüksekliği mevcuttu. Atak dışı dönemde ise bu oranlar sedimentasyon için 12 (%11.4), CRP için 9 (%8.6), lökositoz için 14 (% 13.3) ve fibrinojen için 9 (%8.6) şeklindeydi. (Tablo 10)
Tablo 10. Hastalarımızın atak anı ve atak dışı laboratuar bulguları
Akut faz reaktanları Ortalama Standart sapma Atak sırasında Sedimentasyon 20.2 15.2 Atak dışı Sedimentasyon 11.1 6.1 Atak sırasında Fibrinojen 422.9 104.9 Atak dışı Fibrinojen 305.3 65.8 Atak sırasında Lökositoz 12.5 4.1 Atak dışı Lökositoz 8.5 2.3 Atak sırasında CRP 19.1 13.4 Atak dışı CRP 4.5 2.9
Atak harici dönem Atak dönemi F ib ri n o je n ( m g /d L ) 700 600 500 400 300 200 100
Şekil 7: Atak sırasında ve atak dışı fibrinojen düzeylerinin karşılaştırılması
Bakılan tam idrar tetkikinde 11 hastada (%10.5) hematüri, 16 hastada (%15.2) hafif proteinüri, beş hastada (%4.8) hafif proteinüri ve hematüri mevcuttu. (Tablo 11) Tedavi sonrası kontrollerde ise oranlar hematüri iki hastada (%1.9), hafif proteinüri sekiz hastada (%7.6) hafif proteinüri ve hematüri ise dört hastada (%3.8) şeklindeydi. (Tablo 12)
Tablo 11. Hastalarımızın tam idrar tetkiki sonuçları
Tam idrar tetkiki Hasta sayısı (n) % Normal 73 69.5 Hematüri 11 10.5 Hafif proteinüri 16 15.2 Proteinüri ve hematüri 5 4.8
Tablo 12. Hastalarımızın kontrollerde değerlendirilen tam idrar tetkiki sonuçları
Tam idrar tetkiki Hasta sayısı (n) % Normal 91 86.7 Hematüri 2 1.9 Hafif proteinüri 8 7.6 Proteinüri ve hematüri 4 3.8
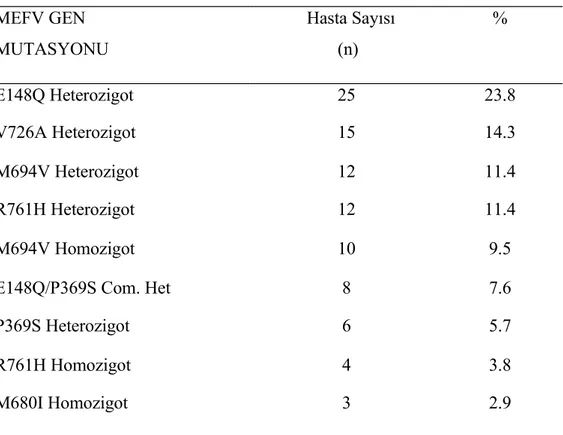
Çalışma grubumuzdaki 105 hasta E148Q, P369S, F479L, M680I (G/C), M680I (G/A), I692del, M694V, M694I, K695R, V726A, A744S, R761H’den oluşan 12 mutasyon açısından tarandı. En sık görülen mutasyon 25 hasta (%23.8) ile E148/N genotipiydi. Sık görülen diğer dört mutasyon ise görülme sıklığına göre sıralandığında 15 hasta (%14.3) V726A/N, 12 hasta (%11.4) M694V/N, 12 hasta (%11.4) R761H/N, 10 hasta (%9.5) M694V/M694V şeklindeydi. Allel frekansına göre değerlendirildiğinde ise E148Q %19, M694V %16, R761H %10, V726A %8, P369S %6, M680I %4 tesbit edildi. Genotip analizine ilişkin sonuçlar Tablo 13 de verilmiştir.
Tablo 13. Hastalarımızın genotip analiz sonuçları
MEFV GEN MUTASYONU Hasta Sayısı (n) % E148Q Heterozigot 25 23.8 V726A Heterozigot 15 14.3 M694V Heterozigot 12 11.4 R761H Heterozigot 12 11.4 M694V Homozigot 10 9.5 E148Q/P369S Com. Het 8 7.6
P369S Heterozigot 6 5.7
M680I Heterozigot 3 2.9
E148Q Homozigot 3 2.9
M694V/V726A Com. Het 1 1 M694V/R761H Com. Het 1 1 M680I/V726A Com. Het 1 1 E148Q/M680I Com. Het 1 1
Toplam 105 100 E148Q/M680I HET %1 M694V/R761H HET %1 E148Q HOM %2.9 M680I/V726A HET %1 M680I HET %2.9 P369S HET %5.7 M680I HOM %2.9 M694V HET %11.4 R761H HET %11.4 M694V/V726A HET %1
R761H HOM %3.8 V726A HET %14.3
E148Q/P369S HET%7.6 M694V HOM %9.5 E148Q HET %23.8
Şekil 8: Hastalarımızın genotip analiz sonuçları
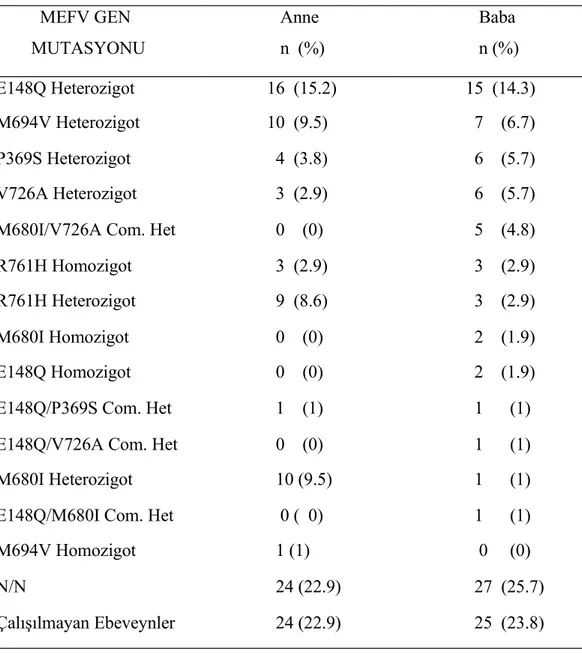
Çalışma grubuna alınan 105 hastanın 28’inde (%26.7) 1. derece, 17’sinde ise (%16.2) 2. derece ana baba akrabalığı mevcuttu. Hastalara yakın akrabalarında FMF tanısı alan ya da benzer şikayetleri olanların varlığı sorulduğunda 38 hasta (%36.2) bir akrabada, 13 hasta (%12.4) iki akrabada, beş hasta (%4.8) üç akrabada, altı hasta ise (%5.7) dört akrabada benzer şikayetlerin olduğunu ya da daha önce FMF tanısı aldığını ifade etti. Hastalarımızın 81’inin (%77.1) annesinde, 80’inin (%76.2) babasında genotip analizi çalışıldı. Bulgular tablo 14’de verilmişdir.
Tablo 14. Hastalarımızın anne ve babalarında genotip analizi MEFV GEN MUTASYONU Anne n (%) Baba n (%) E148Q Heterozigot 16 (15.2) 15 (14.3) M694V Heterozigot 10 (9.5) 7 (6.7) P369S Heterozigot 4 (3.8) 6 (5.7) V726A Heterozigot 3 (2.9) 6 (5.7) M680I/V726A Com. Het 0 (0) 5 (4.8) R761H Homozigot 3 (2.9) 3 (2.9) R761H Heterozigot 9 (8.6) 3 (2.9) M680I Homozigot 0 (0) 2 (1.9) E148Q Homozigot 0 (0) 2 (1.9) E148Q/P369S Com. Het 1 (1) 1 (1) E148Q/V726A Com. Het 0 (0) 1 (1) M680I Heterozigot 10 (9.5) 1 (1) E148Q/M680I Com. Het 0 ( 0) 1 (1) M694V Homozigot 1 (1) 0 (0) N/N 24 (22.9) 27 (25.7) Çalışılmayan Ebeveynler 24 (22.9) 25 (23.8)
Hastalarımızın kolşisin kullanım süreleri ortalaması 11.5 ± 11.9 ay (1 ay- 72 ay) idi. Kolşisin tedavisine cevap değerlendirildiğinde ataklar tamamen düzeldi diyenlerin sayısı 22 (%21), atak sıklığı ve şiddeti belirgin olarak azaldı diyenlerin sayısı 82 (%78.1) idi. Ataklar değişmedi diyen ise bir hastamız (%0.9) mevcuttu. ( Tablo 15 )
Tablo 15. Kolşisin tedavisine cevabın değerlendirlmesi
Kolşisin tedavisine cevap Hasta sayısı (n) % Ataklar tam düzeldi 22 21 Atak sıklığı ve şiddeti
belirgin olarak azaldı
82 78.1
Ataklar değişmedi 1 0.9 Toplam 105 100
Kolşisin tedavisi sonrasında hastaların 99’unda yan etki görülmezken, üç hastada (%2.9) kusma, iki hastada (%1.9) bulantı, bir hastada (%0.9) kusma ve ishal gözlendi. (Tablo 16)
Tablo 16. Kolşisin tedavisinin yan etkileri
Tedavi yan etkisi Hasta sayısı % Yok 99 94.3 Bulantı 2 1.9 Kusma 3 2.9 Kusma ve İshal 1 0.9 Toplam 105 100
GENOTİP FENOTİP İLİŞKİSİ
Mutasyonların hastalığın klinik ve laboratuar bulguları, hastalık ağırlık skorlaması üzerine etkisinin olup olmadığını değerlendirmek amacıyla hastalar üç gruba ayrıldı. Birinci grubu tek bir allelde mutasyon taşıyanlar (heterozigot), ikinci grubu her iki allelde aynı mutasyonu taşıyanlar (homozigot), üçüncü grubu ise her iki allelde farklı mutasyon taşıyanlar (compaund heterozigot) oluşturmaktaydı. Birinci grup 73 hasta (%69.5), ikinci grup 20 hasta (%19), üçüncü grup ise 12 hastadan (%11.4) oluşmaktaydı. (Tablo 17)
Tablo 17. Grupların hasta sayı ve yüzdeleri
Hasta sayısı (n) % Heterozigot grup 73 69.5 Homozigot grup 20 19 Compaund het. grup 12 11.4
Grupların yaş ortalaması değerlendirildiğinde heterozigot grupta 105.8 ± 37.2 ay, homozigot grupta 98.1± 43.2 ay, compaund heterozigot grupta 126.0± 26.3 ay şeklindeydi. Homozigot grubun yaş ortalaması anlamlı derecede düşük bulundu (p<0.05).
Heterozigot grupta semptomların başlama yaşının 73.1±39.0 ay, homozigot grupta 49.2± 23.9 ay, compaund heterozigot grupta ise 88±43.44 ay olduğu görüldü. Homozigot grupta semptomların başlama yaşı diğer gruplara göre anlamlı derecede düşük bulundu (p=0.02).
Tanıda gecikme süresi açısından gruplar arasında anlamlı fark saptanmadı (p>0.05).
Grupların yaş, semptomların başlama yaşı ve tanıda gecikme süresi ortalamaları tablo 18 de verilmiştir.
Tablo 18. Grupların yaş, semptomların başlama yaşı, tanıda gecikme süresi
Heterozigot Grup Homozigot Grup Compaund het. Grup P Yaş (ay) 105.8±37.2 98.1±43.2 126.0±26.3 0.031 Semptom yaşı (ay) 73.1±39.0 49.2±23.9 88.0±43.4 0.015 Tanıda gecikme (ay) 23.7±21.7 37.2±27.9 31.5±22.5 0.652
Ana-baba akrabalığı yönünden gruplar arasında anlamlı fark saptanmadı (p>0.05) (Tablo 19).
Tablo 19. Grupların ana-baba akrabalığı yönünden karşılaştırılması
Ana-baba Akrabalığı Heterozigot Grup (n) Homozigot Grup (n) Compaund het. Grup (n) P Yok 46 9 5 1. derece 15 7 6 0.192 2. derece 12 4 1
Çalışma grubumuzdaki 105 hastanın atak sırasındaki semptom ve bulguları değerlendirildiğinde homozigot grupta erizipel benzeri eritem varlığı diğer iki gruba göre anlamlı derecede yüksek bulundu (p<0.03). Diğer semptom ve bulgular açısından gruplar arasında fark saptanmadı. (Tablo 20)
Tablo 20. Grupların klinik semptom ve bulgular açısından karşılaştırılması Semptomlar Heterozigot Grup n (%) Homozigot Grup n (%) Compaund Het Grup n (%) P Ateş 73 (69.5) 20 (19) 12 (11.4) Karın ağrısı 73 (69.5) 19 (18) 12 (11.4) 0.11 Artralji 44 (41.9) 11 (10) 10 (9.5) 0.24 Artrit 14 (13.3) 5 (4.7) 3 (2.8) 0.79 Göğüs ağrısı 10 (9.5) 4 (3.8) 2 (1.9) 0.77 Eritem 8 (7.6) 7 (6.6) 1 (0.9) 0.023 Myalji 11 (10.4) 3 (2.8) 1 (0.9) 0.82 Akut skrotum 0 1 (0.9) 0 0.11
Atak sıklığı ve süresi açısından gruplar karşılaştırıldığında her iki parametre içinde gruplar arasında anlamlı fark gözlenmedi (p>0.05) (Tablo 21 ve 22).
Tablo 21. Atak sıklığı açısından grupların karşılaştırılması
Atak sıklığı Heterozigot Grup n (%) Homozigot Grup n (%) Compaund Het Grup n (%) P Düzensiz 20 (27.3) 6 (30) 2 (16.6) >0.05 Ayda 1 den az 12 (16.4) 4 (20) 2 (16.6) Ayda 1-2 kez 15 (20.5) 3 (15) 5 (41.6) Ayda 3-4 kez 10 (13.6) 6 (30) 2 (16.6) Ayda 4 den fazla 16 (21.9) 1 (5) 1 (8.3)
Tablo 22. Atak süresi açısından grupların karşılaştırılması
Atak süresi Heterozigot Grup n (%) Homozigot Grup n (%) Compaund Het Grup n (%) P 12 saatten az 10 (13.6) 0 2 (16.6) >0.05 12-24 saat 10 (13.6) 3 (15) 3 (25) 24-48 saat 30 (41) 7 (35) 2 (16.6) 48-72 saat 19 (26) 8 (40) 3 (25) 72 saatten fazla 4 (5.4) 2 (10) 2 (16.6)
Hastalık ağırlık skoru ortalaması heterozigot grupta 6.6±1.8, homozigot grupta 7.6±2.4, compaund heterozigot grupta ise 6.8±0.6 olarak bulundu ve hastalık ağırlık skoru açısından gruplar arasında anlamlı fark saptanmadı (p>0.05). (Tablo 23)
Tablo 23. Hastalık ağırlık skorları açısından grupların karşılaştırılması
Heterozigot Grup Homozigot Grup Compaund Het Grup P Hastalık ağırlık Skoru ortalaması 6.6±1.8 7.6±2.4 6.8±0.6 > 0.05
Laboratuar sonuçları açısından gruplar karşılaştırıldığında hemoglobin, atak anı fibrinojen, atak anı CRP, atak anı sedimentasyon, atak dışı fibrinojen, atak dışı CRP, atak dışı sedimentasyon ve atak dışı lökosit değerleri açısından gruplar arasında anlamlı fark saptanmadı (p>0.05). (Tablo 24)
Atak anı lökosit değerleri homozigot grupta anlamlı derecede yüksek bulundu (p<0.003). (Tablo 24)
Tablo 24. Grupların laboratuar bulguları açısından karşılaştırılması Laboratuar Bulguları Heterozigot Grup Homozigot Grup Compaund Het Grup P Fibrinojen 410.4±109.3 457.8±82.8 440.8±102.5 0.830 Atak dışı fibrinojen 299.1±59.3 324.1±77.0 312.2±82.3 0.613 Sedimentasyon 17.7±11.1 29.1±21.9 20.4±18.8 0.227 Atak dışı sedimentasyon 10.1±4.5 14.5±9.7 11.2±5.7 0.468 CRP 16.1±20.5 23.1±18.9 30.6±39.8 0.586 Atak dışı CRP 4.2±2.4 5.5±3.3 5.0±4.5 0.412 Lökosit sayısı 12581±4090 14231±3643 9500±3496 0.002 Atak dışı lökosit sayısı 8450±2270 9010±2509 8110±2270 0.381 Hemoglobin 13.2±1.1 12.4±1.3 13.0±1.3 0.311
Kolşisin tedavisine cevap açısından gruplar karşılaştırıldı. Gruplar arasında tedaviye cevap açısından anlamlı fark saptanmadı (p>0.05). ( Tablo 25)
Tablo 25. Grupların tedaviye cevap açısından değerlendirilmesi
Tedaviye cevap Heterozigot Grup (n) Homozigot Grup (n) Compaund Het Grup (n) P Ataklar tamamen düzeldi 14 6 2 > 0.05 Atak sıklığı, süresi, Şiddeti azaldı 58 14 10 Ataklar değişmedi 1 0 0
TARTIŞMA
AAA otozomal resesif geçişli bir hastalık olup akut faz cevabının eşlik ettiği tekrarlayan ve kendini sınırlayan ateş atakları, genellikle steril bir peritonit, plörit, mono/oligoartrit ve deri döküntüleri ile seyreder (1). Atakların başlamasına sebep olan neden tam olarak bilinmemektedir. Ruhsal nedenler, ağır egzersiz, yorgunluk gibi etkenlerle atakların başlayabildiği gözlenmiştir (8). Hastalığın ilerleyen dönemlerinde amiloidoz ve böbrek yetmezliği geliştiği bildirilmiştir (10,11). Klinik bulguların varlığı ve aile öyküsü tanıda genetik mutasyon analizine göre çok daha değerlidir. Klinik olarak kuvvetle AAA düşünülen hastalarda gen mutasyonu negatif olsa bile tedaviye başlanmalıdır (65).
Ailevi Akdeniz Ateşi genellikle Doğu Akdeniz kökenli insanlarda, özellikle de Askenazi olmayan Yahudilerde, Ermenilerde, Araplarda ve Türklerde yaygın bir hastalıktır. Askenazi olmayan Yahudilerde (Sefardik Yahudilerde) hastalığın yaygınlığı 1/250 ile 1/500 arasındadır. Hastalığın Türklerdeki yaygınlığı 1/ 1075 ve Orta Anadolu’da ki yaygınlığı ise 1/395 olarak bulunmuştur (21). Taşıyıcı sıklığı Türk, Ermeni ve Yahudi popülasyonlarında 1/3-1/5 gibi yüksek oranlarda saptanmıştır(23,24).
1992 yılında MEFV (MEditerranean FeVer; MEFV) geninin 16. kromozomun kısa kolu üzerinde yeraldığı saptanmıştır (11). MEFV geni 1997 yılında Uluslar arası AAA konsorsiyumu ve Fransız AAA konsorsiyumu tarafından birbirinden bağımsız olarak klonlanmıştır (6,15). M694V, M694I, V726A ve M680I (ekzon 10’da) ve E148Q (ekzon 2’de) bölgeleri, AAA’da en sık mutasyon olan bölgelerdir (18). Gen mutasyonları tanımlandıktan sonra hastalığın farklı etnik gruplar arasında farklı klinik bulgularla seyredebileceği; yine farklı mutasyonları taşıyan bireylerde hastalığın klinik seyrinin farklı olabileceği yönünde pek çok çalışma yapılmıştır (7).
Bizim çalışma grubumuzda Tell hashomer kriterlerine göre tanı alan 105 hasta farklı mutasyonların hastalık ağırlık skorlaması ve fenotipik bulgular üzerine etkili olup olmadığı yönünden araştırıldı. Cinsiyetler açısından değerlendirildiğinde
Yahudiler (32) ve Ermenilerde (77) yapılan çalışmalarda ateş sıklığı %100 olarak bulunmuştur. Türk AAA çalışma grubunun 2005 yılında yaptığı çok merkezli bir çalışmada (78) ise bu oran %92.5 şeklindedir. Biz çalışmamızda ateş sıklığını %100 olarak bulduk. Yine Türk AAA çalışma grubunun yaptığı çalışmada karın ağrısı sıklığı %93.7 iken bizim çalışmamızda bu oran% 99 şeklindeydi.
Çalışma grubumuzdaki hastalarda artrit sıklığı %21 idi bu oran Kone ve ark. (79) çalışmasındaki %34, Yalçınkaya ve ark. (80) çalışmasındaki %46 oranlarına göre düşük idi. Çalışma grubumuzdaki hastalarda ateş ve karın ağrısından sonra 3. sıklıkta görülen semptom %61.9 ile artralji idi. Türk AAA çalışma grubunun yaptığı araştırmada (78) bu oran %51.7, Pras ve ark. (65) yaptığı çalışmada ise %75 şeklindeydi.
Ailevi Akdeniz ateşinde göğüs ağrısı sıklığı %25-80 olarak bildirilmektedir. Türk AAA çalışma grubuna (78) göre bu oran %31.2 iken, bizim hastalarımızda ise %15.2 ile daha düşük oranda saptandı.
Türk AAA çalışma grubunun yaptığı araştırmada (78) apendektomi oranı %19 iken bizim çalışmamızda akut apandisit tanısı ile izlem %5.7, apendektomi oranı ise %3.8 idi.
Hastalarımızda semptomlar cinsiyetlere göre karşılaştırıldığında artralji sıklığı erkeklerde kızlara oranla anlamlı derecede yüksekti. Diğer semptomlar açısından cinsiyetler arasında anlamlı fark saptanmadı.
Semptomların başlama yaşı ile tanıya kadar geçen süre karşılaştırıldığında bu iki parametre arasında anlamlı negatif korelasyon saptandı. Semptomların başlama yaşı arttıkça tanıya kadar geçen sürenin azaldığı görüldü. Bu durumun hastaların yaşı arttıkça şikayetlerini ifade edebilme yeteneklerinin artmasına bağlı olabileceği düşünüldü.
Çalışma grubundaki hastalarımızın AAA tanısı almadan önce aynı şikayetlerle başvurdukları çeşitli saglık kuruluşlarında %53.3’ünün idrar yolu enfeksiyonu, %31.4’ünün paraziter enfeksiyon, %30.5’inin konstipasyon, %28.5’inin tonsillit, %21’inin gastrit, %20’sinin akut gastroenterit %3.8’inin nefrolitiazis tanısı almış olduğu görüldü.
Karın ağrısı ve ateşin ayırıcı tanısında bu hastalıklar yeralmakla birlikte özellikle ülkemiz gibi taşıyıcılığın 1/5 prevalansın 1/1075 gibi yüksek olduğu toplumlarda gerek tıp eğitimi süresince gerekse hekimlik mesleğini uygularken AAA hastalığına daha fazla önem vermemiz gerektiğine inanmaktayız.