T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI
ANABİLİM DALI Prof. Dr. SAVAŞ KANSOY
MATERNAL VE KORDON KANINDA
B12 V
İ
TAM
İ
N
İ
, FOLAT VE HOMOS
İ
STE
İ
N
DÜZEYLER
İ
UZMANLIK TEZ
İ
Dr. SELİME ÖZEN
TEZ YÖNETİCİSİ
Prof. Dr. SADIK AKŞİT
ÖNSÖZ
Çocuk Sağlığı ve Hastalıkları uzmanlık eğitimim süresince bilgi ve deneyimleri ile bizlere ışık tutan ve yol gösteren Çocuk Sağlığı ve Hastalıkları Anabilim Dalı Başkanı Sn. Prof. Dr. Savaş Kansoy’a, bu çalışmam süresince benden yardımlarını, desteğini, sabrını ve bilgisini esirgemeyen ve bu çalışmayı bana vererek kendimi geliştirmemi sağlayan tezimin yöneticisi Sn. Prof. Dr. Sadık Akşit’e, alınan örneklerin temini, saklanması ve çalışılmasında emeği geçen Sn. Doç. Dr. Şükran Köse’ye, Sn. Doç. Dr. Sezin Aşık Akman’a, Sn. Doç. Dr. Esra Arun Özer’e, Sn. Yrd. Doç. Dr. Feyza Umay Koç’a, Sn. Dr. Aslı Aslan’a, Sn. Dr. Oya Halıcıoğlu’na ve tüm Ege Doğum Evi hemşirelerine;
Uzmanlık eğitimim sırasında ilmi yanısıra insani ve ahlaki değerleri ile de örnek aldığım ve yanında çalışmaktan büyük onur duyduğum Sn. Prof. Dr. Mahmut Çoker’e, tecrübelerinden yararlanırken geliştiğimi hissettiğim Sn. Prof. Dr. Bülent Karapınar’a, bizlere çalışmanın gereklerini öğreten Sn. Prof. Dr. Zafer Kurugöl’e, eğitim sürecim boyunca bana bilgi ve tecrübelerini aktaran ve teşekkürlerimi sunmam da kelimelerin yetersiz kalacağı tüm değerli hocalarıma, başarıları, sağlam karakteri ve insan sevgisi ile hayatımda iz bırakan abim Sn. Doç. Dr. Levent Midyat’a, hayatta ve mesleğinde duruşu ile kendime örnek aldığım ablam Sn. Uzm. Dr. Şule Gökçe’ye;
Bu zorlu yol boyunca birlikte yürüdüğüm sevgili arkadaşlarım Sn. Dr. Lale Mamadova, Sn. Dr. Gözde Gözüoğlu, Sn. Dr. Yıldız Ekemen Keleş, Sn. Dr. Özlem Çam Delebe, Sn. Dr. Gonca Gökmen Turgutkaya, Sn. Dr. Seyran Bulut ve tüm asistan, hemşire ve personel arkadaşlarıma;
Onları tanımakla kendimi dünyanın en şanslı insanı saydığım can dostlarım Gizem Özer Mangal ve Betül Özdel Öztürk’e, her emeğime benimle birlikte ter döken, her zaman en büyük destekçim olan ve emeklerini ödemeye gücümün yetemeyeceği annem ve babama, beni benden iyi anlayan ve dünyamı güzelleştiren canım kardeşim Şükran Özen’e sonsuz teşekkürlerimi sunarım.
İÇİNDEKİLER
ŞEKİL DİZİNİ ... V TABLO DİZİNİ ... VI KISALTMALAR ... VII 1. GİRİŞ ... 1 2. GENEL BİLGİLER ... 2 2.1. B12 VİTAMİNİ ... 22.1.1. B12 Vitamini Tanımı ve Tarihçesi ... 2
2.1.2. B12 Vitamini Molekül Yapısı ve Genel Özellikleri ... 2
2.1.3. B12 Vitamini Biyokimyasal Özellikleri ... 4
2.1.4. Homosistein ... 7
2.1.5. Homosistein Metabolizması ... 8
2.1.6. Homosistein Metabolizmasında Bozukluklar ... 10
2.1.7. Hiperhomosisteinemi Nedenleri ... 13
2.1.8. Homosistein ve Gebelik ... 16
2.1.9. Kobalaminlerin Emilimi ... 19
2.1.10. B12 Vitamini Besinsel Kaynakları ... 23
2.1.11. B12 Vitamini Gereksinimi ... 24
2.1.12. Çocuklarda B12 Vitamini Eksikliği Nedenleri ... 25
2.1.13. Yenidoğanlarda ve Süt Çocuklarında B12 Vitamini Eksikliği27 2.1.14. B12 Vitamini Konjenital Bozuklukları ... 28
2.1.15. Annelerde B12 Vitamini Eksikliği ... 32
2.1.16. Gebelikte B12 Vitamini Düzeyleri... 33
2.1.17. B12 Vitamini Eksikliği Bulguları... 34
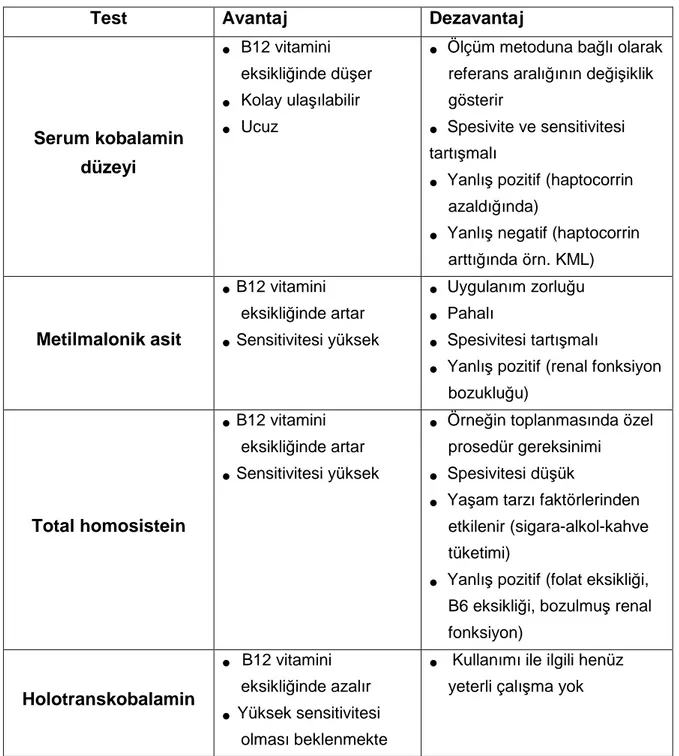
2.1.18. B12 Vitamini Eksikliği Tanısı ... 36
2.1.19. B12 Vitamini Eksikliği Tedavisi ... 42
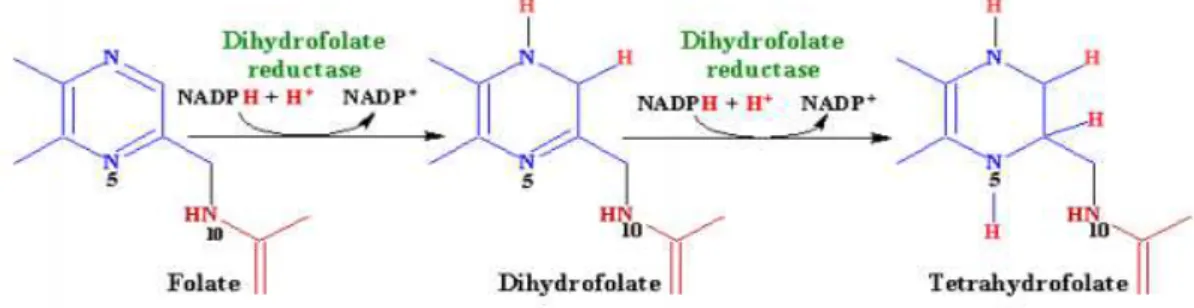
2.2. FOLAT ... 43
2.2.1. Folat Tarihçesi ... 43
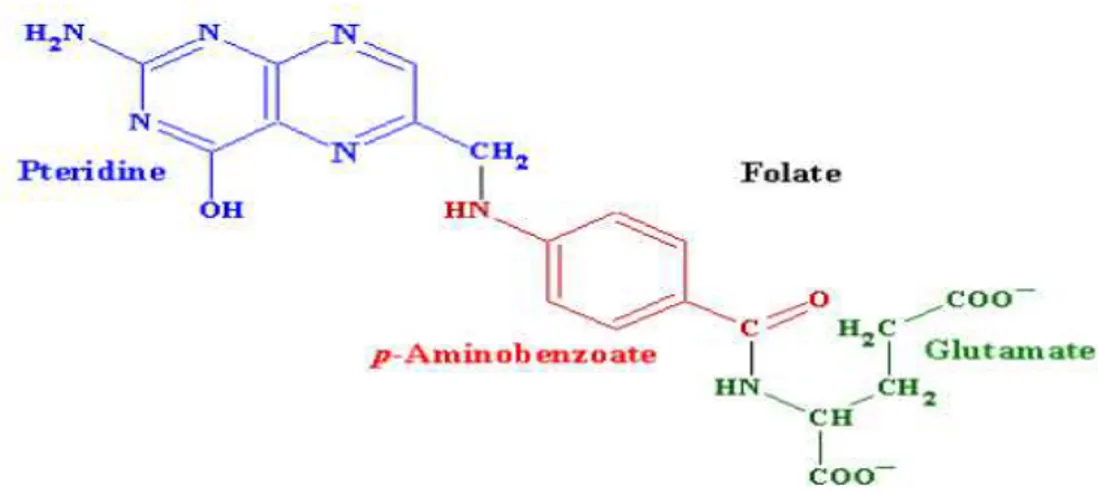
2.2.2. Folat Biyokimyasal Yapısı ... 44
2.2.3. Folat Fizyolojik Rolü ... 45
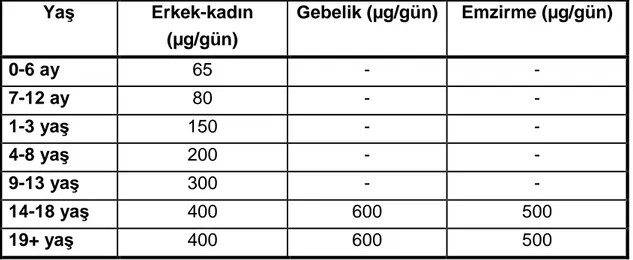
2.2.4. Folat Günlük Gereksinimi ... 45
2.2.7. Folat Düzeyini Etkileyen Faktörler ... 49
2.2.8. Fizyolojik Dönemlerde Folat Düzeyleri ... 50
2.2.9. Gebelikte Folat Düzeyleri ... 51
2.2.10. Patolojik Durumlarda Folat Düzeyleri ... 52
2.2.11. Folat Eksikliğinde Laboratuar Bulgular ... 54
3. GEREÇ VE YÖNTEM ... 57
3.1. Çalışmanın Tasarımı ... 57
3.2. Örneklem Büyüklüğünün hesaplanması ... 57
3.3. Verilerin Toplanması ... 58
3.4. Kan Örneklerinin Toplanması ve Laboratuar Analizi ... 60
3.5. Verilerin Analizi... 60 4. BULGULAR ... 62 5. TARTIŞMA ... 78 6. ÖZET ... 89 7. SUMMARY ... 91 8. KAYNAKLAR ... 93
ŞEKİL DİZİNİ
Şekil 1. B12 vitamini molekül şekli ... 4
Şekil 2. Homosistein metabolizması ... 5
Şekil 3. Kobalamin metabolizması bozuklukları ... 6
Şekil 4. Metiyonin, homosistein ve sistein kimyasal yapısı ... 8
Şekil 5. Homosistein düzeyine göre ayırıcı tanı ... 15
Şekil 6. İntrensek faktör- kobalamin kompleksi... 18
Şekil 7. Kobalaminlerin emilimi ... 20
Şekil 8. Kobalaminlerin dokulara taşınması ... 21
Şekil 9. B12 vitamini ve folat metabolizmasının yolu, metilasyon reaksiyonları ... 22
Şekil 10. Folatın biyokimyasal yapısı ... 44
Şekil 11. Folatın aktif formu olan tetrahidrofolata indirgenmesi ... 47
Şekil 12. Anne serum ve kordon kanı B12 vitamini düzeyi ilişkisi ... 66
Şekil 13a-b. Anne serum ve kordon kanı B12 vitamini düzeyi ilişkisi ... 66
Şekil 14a-b. Anne serum B12 vitamini ile homosistein düzeyi ilişkisi ... 69
Şekil 15. Anne serum folat düzeyi ile homosistein düzeyi ilişkisi ... 70
Şekil 16. Kordon kanı B12 vitamini ile homosistein düzeyi ilişkisi ... 72
Şekil 17. Anne serum ve kordon kanı serum folat düzeyleri arasındaki ilişki 72 Şekil 18. Anne serum ve kordon kanı homosistein düzeyleri arasındaki ilişki73 Şekil 19. Anne serum B12 vitamini düzeyi ile anemi ilişkisi ... 74
TABLO DİZİNİ
Tablo 1. Plazma homosistein düzeyi belirleyicileri ... 14 Tablo 2. Değişik gruplarda açlık serum homosistein üst sınırları için referans
değerleri ... 16
Tablo 3. Bazı yiyeceklerdeki B12 vitamini miktarları ... 23 Tablo 4. B12 vitamini için önerilen günlük alım miktarları ... 24 Tablo 5. B12 vitamini eksikliğinde kullanılan tanı testlerinin avantaj ve
dezavantajları ... 40
Tablo 6. Çocuklar ve erişkinlerde folat için RDA değerleri ... 45
Tablo 7. Bazı yiyeceklerdeki folat miktarları ... 46 Tablo 8. Hematolojik belirleyici olarak megaloblastik anemi kullanıldığında folat
durumu ... 55
Tablo 9. Metabolik belirleyici olarak homosistein kullanıldığında folat durumu
Tablo 10. Olgu rapor formu ... 59 Tablo 11. Anne ve bebeklerin sosyodemografik ve bazı laboratuar özellikleri62 Tablo 12. Gebelerin bazı tanımlayıcı özellikleri ... 63 Tablo 13. Annelerin gebelik süresince beslenme analizi ... 64 Tablo 14. Anne ve bebeklerde B12 vitamini ve folat eksikliği sıklığı ... 65
Tablo 15. Anne B12 vitamini eksikliği ile bebek B12 vitamini eksikliği ilişkisi . 65
Tablo 16. Anne serum ve kordon kanı homosistein düzeyleri ... 67 Tablo 17. Annelerde serum B12 vitamini, folat düzeyleri ve cinsiyet ile serum
homosistein düzeyi ilişkisi ... 68
Tablo 18. Bebeklerde B12 vitamini eksikliği ile kordon kanı homosistein ilişkisi
Tablo 19. Maternal ve kordon kanında B12 vitamini, folat ve homosistein
konsantrasyonları arasındaki ilişki ... 71
Tablo 20. Anne B12 vitamini ve folat eksikliği ile anemi ilişkisi ... 73
Tablo 21. Bazı sosyodemografik özelliklerin gebelerdeki anemi üzerine etkisi75 Tablo 22. Bazı bağımsız değişkenlerin gebelerde anemi gelişimi üzerine etkisinin
lojistik regresyon analizi ile değerlendirilmesi ... 76
KISALTMALAR
IUGR : İntrauterin büyüme geriliği Co : Kobalt IF : İntrensek Faktör CNCbl : Siyanokobalamin CN : Siyanür OHCbl : Hidroksikobalamin OH : Hidroksi TC : Transkobalamin AdoCbl : Adenozil kobalamin MeCbl : Metil kobalamin CH3 : Metil grubu THF : Tetrahidrofolat
SAM : S-Adenozil metiyonin SAH : S-Adenozil homosistein AHcy : Adenozil homosistein MMA : Metilmalonik asit CBS : Sistationin ᵝ sentaz
MTHFR : Metilen tetrahidrofolat redüktaz MS : Metiyonin sentaz
ATP : Adenozin 3-fosfat
MAT : Metiyonin adenozil transferaz SAH : S-Adenozil homosistein Hcy : Homosistein
HPLC : Yüksek performanslı sıvı kromatografi LDL : Düşük dansiteli lipoprotein
GFR : Glomerüler filtrasyon hızı NMDA : N-Metil D-aspartat
NTD : Nöral tüp defekti
MRI : Manyetik rezonans inceleme
CUBAM : Kubilin-Amnionless reseptör kompleksi MGA : Megaloblastik anemi
AMN : Amnionless
EEG : Elektroensefalografi MCV : Ortalama eritrosit hacmi MCH : Ortalama eritrosit hemoglobini
SCDSC : Spinal kordun subakut kombine dejenerasyonu SH : Sülfidril
PGA : Pteroylglutamik asit DRI : Diyetsel referans alımı RDA : Önerilen diyetsel alım AI : Uygun alım
UL : Katlanılabilir üst düzeyler DHF : Dihidrofolat
GTP : Guanizin trifosfat GDP : Guanizin difosfat FBP : Folat bağlayıcı protein BH4 : Tetrahidrobiopterin FIGlu : Formiminoglutamik asit Hb : Hemoglobin
1.
GİRİŞ
Gebelik, hem anne hem fetüs için hızlı bir gelişim süreci olup; gebelikte bazı nutrientlerin gereksinimi artar. Kadınların yaklaşık olarak %20’ sinde B12 vitamini ve folat eksikliği görülür. Doğum ağırlığı, cinsiyet, sigara içimi, parite ve gebelikte vitamin desteği alınıp alınmadığı B12 vitamini ve folat düzeylerini etkileyen ana faktörlerdir. Folat ve B12 vitamini homosistein metabolizmasında önemli kofaktörlerdir. Folat eksikliği ablasyo plasenta, spontan abortus, prematurite, konjenital defektler (başta nöral tüp defektleri) ve perinatal mortalite ile ilişkilidir. B12 vitamini eksikliği ise nörogelişimsel hastalıklar ve megaloblastik anemiye zemin hazırlamaktadır. Bununla birlikte yüksek plazma homosistein düzeyi vasküler endotel hasarı ve oklusiv vasküler sorunlar ile yakın ilişkilendirilmiş olup renal ve kardiyovasküler hastalıklar açısından yüksek risk teşkil etmektedir.
Gebelik sürecinde 2.trimestirde düşmeye başlayan B12 vitamini ve folat düzeyleri, 3. trimestirde en düşük seviyelerine ulaşırken; homosistein düzeyleri ise 1. ve 2. trimestir ile kıyaslandığında 3.trimestirde artış gösterir. Bunun yanında IUGR’lı anne bebeklerinde, homosistein düzeyinin yüksek, folat ve B12 vitamini düzeylerinin düşük olduğunu savunan çalışmalar yanında B12 vitamini düzeyi ile IUGR gelişiminin ilişkisiz olduğunu savunan çalışmalar da mevcuttur. Yapılan pek çok çalışma preeklamptik anne bebeklerinde ve anne serumunda homosistein düzeylerinin yüksek olduğunu göstermektedir.
Bu çalışmanın temel amacı maternal ve kordon kanı B12 vitamini, folat ve homosistein düzeylerinin ölçülerek, B12 vitamini ve folat eksikliği oranlarının belirlenmesidir. Ayrıca gebelerdeki B12 vitamini ve folat düzeyleri ile kordon kanı düzeyleri arasındaki ilişkinin belirlenmesi; bu çalışmanın ikincil amacıdır.
2.
GENEL BİLGİLER
2.1. B12 VİTAMİNİ2.1.1. B12 Vitamini Tanımı ve Tarihçesi
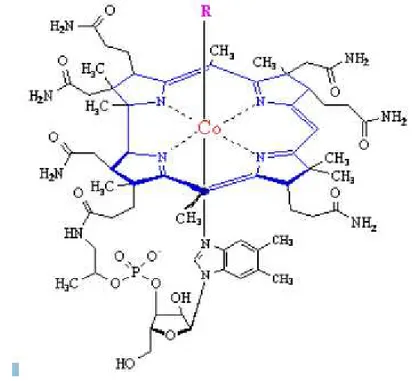
B12 vitamini suda eriyen, 1355,42 dalton molekül ağırlığında olan, başlıca mikroorganizmalar tarafından, farklı yirmi enzimatik basamak sonunda sentezlenebilen, kırmızı renkli ve çeşitli türevleri bulunan bir vitamindir. Yapısında karmaşık korrin halkası ve merkezinde kobalt (Co) iyonu vardır. Tüm vitaminler içerisinde en büyük ve kompleks yapıya sahip olan ve ufak miktarları ile bile güçlü etki yapması yönünden, en güçlü etkinlik gösteren vitamin olarak kabul edilir (1,2).
İlk olarak T.Addison (3), 1855 yılında, pernisiyöz anemiyi tanımlamıştır. Daha sonra, çok ağır anemisi olan kişilerin, karaciğer yemekle tedavi olduğu, 1926 yılında, Minot ve Murphy’nin (4) dikkatini çekmiştir. Daha sonra etin normal mide suyu ile karıştırılarak yedirildiğinde pernisiyöz anemili hastaların kansızlığının düzelebildiği gösterilmiş ve böylece intrinsik faktörün (IF) varlığı ortaya koyulmuştur. Ancak bu maddenin karaciğerden izolasyonu uzun yıllar başarılamamıştır. Nihayet 1948 yılında E.Lester Smith, E.Rickes ve Karlfolkers kobalamini kristal halde elde etmeyi başarmışlar ve bu maddeyi B12 vitamini olarak adlandırmışlardır (4,5).
2.1.2. B12 Vitamini Molekül Yapısı ve Genel Özellikleri
B12 vitamini 3 bölümden oluşur (Şekil 1):
• Korrin Halka Yapısı: Bir adet kobalt (Co) atomu ve onu çevreleyen indirgenmiş 4 adet pirol halkasından oluşan çekirdek kısmıdır. Korrin adı verilen bu yapı, hemoglobinin porfirin halka yapısına benzemektedir. Beşgen halka yapısına sahip olan buradaki pirol halkasından ikisi, hemoglobinden farklı olarak metan köprüsü olmadan direkt olarak birbirine bağlanmıştır. Pirol halkalarının tepe noktasında bulunan 4 azot atomu, 90 derecelik bağlarla ortadaki kobalta bağlanmıştır. Pirol halkaları aynı düzlem üzerindedir. Korrin halkasının merkezindeki kobalt, +1 değerlikli ise koenzim yeşil renkli, kobalt +2 değerlikli ise koenzim portakal renkli ve kobalt +3
değerlikli ise koenzim kırmızı renklidir. Korrin kısmı 5-aminolevulinik asitten, hemoglobindeki porfirin sentezine benzer şekilde sentezlenmektedir. Simetrik ve karmaşık yapısı ile hemoglobini andırır. Hemoglobinde merkezde yer alan demir yerine, B12 vitamininde kobalt vardır (2).
• İkinci kısım, düzlemin altında kalan, hem kobalt atomuna hem de fosfatlı bir zincir aracılığı ile pirol halkalarından birine bağlı olan, nükleotid grubudur. Bu grup tipik bir nükleotid değildir ve α-N-glikozidik bağı ile riboza bağlanmış bazik bir madde olarak 5,6- dimetilbenzimidazol içerir (2).
• Düzlemin üstünde ise koordinasyon tipi bağlarla bağlanmış olan, ufak ek ‘R’ grubu bulunmaktadır. Ancak vitamin etkisi için, bu son grup şart olmamakla beraber, B12 vitamininin isimlendirilmesi bu gruba göre yapılmaktadır. Bu gruptan yoksun olan kısma, kobalaminler adı verilir. Bu sözcük giderek artan bir şekilde B12 vitamini ile eşanlamlı kullanılmaktadır (2).
Bu son ek kısmına göre B12 vitamini dört gruba ayrılır (2).
a) Siyanokobalamin (CNCbI): R grubu olarak siyanür (CN) grubu içerir.
İlk bulunan B12 vitamini türevidir. Vücut sıvılarında ve hücrelerde çok az bulunur. Stabil bir bileşik olduğundan ilaç olarak kullanılır ve B12 vitamininin ticari preparatıdır.
b) Hidroksikobalamin (OHCbI): R grubu olarak hidroksil grubu (OH) içerir. Vücutta en fazla bulunan B12 vitamini türevidir. Fakat ilaç olarak kulanıldığında, transkobalamin-hidroksikobalamin (TC-OHCbI) kompleksine karşı antikor geliştiği gösterilmiştir. Aktif koenzim türlerinin prekürsörüdür.
c) Adenozilkobalamin (AdoCbI): R grubu olarak 5’deoksiadenozil grubu içerir. Hücrelerde aktif koenzim fonksiyonu görür.
d) Metilkobalamin (MeCbI): R grubu olarak metil grubu (CH3) içerir.
İnsan plazmasındaki B12 vitamininin %70‘i MeCbI şeklindedir. AdoCbI gibi vücutta aktif koenzim fonksiyonu görür.
Siyanokobalamin en stabil form olduğundan, ilaç olarak en sık kullanılan kobalamindir. OHCbI ise gıdalarda bulunur. CNCbI ve OHCbI, dokulardaki hücre sitoplazmasında MeCbI‘e ve mitokondrilerde AdoCbI‘ne kolaylıkla dönüştürülür.
Sitoplazmik redüktaz enzimi CbI-Co+3 ün CbI-Co+2’ye ve mitokondriyal kobalamin redüktaz enzimi CbI-Co+2’nin CbI–Co +1’e indirgenmesini sağlar (2, 6, 7).
.
Şekil 1: B12 vitamini molekül şekli
2.1.3. B12 Vitamininin Biyokimyasal Özellikleri
Koenzim olarak fonksiyon gösteren kobalamin bileşiklerinin, hücre içinde sentezi için birkaç enzimatik reaksiyon gereklidir. Plazmadaki kobalamin bileşiklerinde kobalt atomu +3 değerlik durumunda ve stabildir. Kobalaminler aktif koenzim haline gelmeden önce labil olan +1 veya +2 değerlik durumuna indirgenmelidir. Bu intrasellüler değişimin konjenital defektleri homosisteinüri ve metilmalonik asidüri’ye yol açar (7).
B12 vitamini insanlarda 2 reaksiyonda koenzim görevi görür.
Birinci Reaksiyon: Metiyonin sentaz enzimi aracılığıyla, homosisteinden metiyonin aminoasiti sentez edilir. Sitoplazmada gerçekleşen bu reaksiyon için koenzim olarak MeCbI gereklidir. Aynı zamanda folat koenzimi N5-metiltetrahidrofolat (N5-metil-THF) da gereklidir.
Metiyonin sentaz
Homosistein + N5-metil-THF Metiyonin Metilkobalamin
Şekil 2. Homosistein metabolizması
Bu reaksiyon insanlarda metiyoninin tekrar sentezi için ana yoldur. Bu reaksiyon bozulduğu zaman metiyoninin plazma seviyeleri düşer ve buna bağlı olarak gelişme geriliği olur. Hem folat hem de kobalamin eksikliğinde bu reaksiyon kesintiye uğradığından megaloblastik anemi ile sonuçlanabilecek ciddi bozukluklar ortaya çıkar (7-9).
İkinci Reaksiyon: Propiyonat katabolizmasında bir basamaktır. Burada
metilmalonil CoA’nın süksinil CoA’ya dönüşümü gerçekleşir. Bu reaksiyonu metilmalonil CoA mutaz enzimi katalize eder ve 5-deoksi AdoCbI koenzim olarak fonksiyon görür (10,11).
Metil-Malonil CoA mutaz
MetilMalonil CoA Süksinil CoA Adenozilkobalamin
Şekil 3. Kobalamin metabolizması bozuklukları
Kobalamin bağımlı her iki reaksiyon, iki tane toksik materyalin plazma seviyelerini düşürür.
1) Vasküler endotel hasarı ile ilişkili olan homosistein
2) Metabolik asidoza sebep olabilen metilmalonil CoA’dır.
Metiyonin Sentezi ve Kullanımı: Metiyonin diyetle alınır ve emilir.
Plazmadaki metiyonin transport sistemi aracılığı ile hücre içine ve serebrospinal sıvıya geçer. Hücresel metiyonin ATP-L-Metiyonin S-Adenoziltransferaz enzimi aracılığı ile adenozinleşir ve S-Adenozil metiyonin (SAM) meydana gelir (9).
ATP-L-metiyonin S-Adenoziltransferaz
S-Adenozilmetyonin: Birçok reaksiyonda metil grup vericisidir. Fosfotidilkolin, miyelin, melatonin, katekolaminler, DNA ve RNA sentezinde fonksiyon görür. Metil grubu bırakıldıktan sonra S-Adenozilhomosistein (AHcy) oluşur (9).
SAM + R AHcy + CH3-R
Adenozilhomosistein: S-adenozilhomosistein hidrolaz enzimi tarafından
homosistein ve adenozine hidrolize edilir (9).
S-adenozil homosistein hidrolaz
AHcy homosistein+adenozin
Daha sonra homosistein, metiyonin sentaz enzimi tarafından tekrar metiyonine dönüştürülebilir (remetilasyon). Metyonin sentaz enzimi aktivitesi için bir koenzim olarak enzime bağlanan, MeCbI gereklidir (9).
Metil-malonil CoA Mutaz: Bu enzimin rol aldığı reaksiyon mitokondri içinde meydana gelir. Reaksiyonun gerçekleşmesi için AdoCbI sentezlenmelidir.
Koenzim sentetaz
ATP + Kob(I)alamin AdoCbI + Trifosfat
Oluşan AdoCbI daha sonra Metil-malonil CoA mutaza bağlanır ve enzim aktifleşir. Kobalamin eksikliğine bağlı bu yolun hasarlanması ile birlikte, istenmeyen biyokimyasal etkiler oluşur. Plazmada ve idrarda artmış
metilmalonikasit (MMA) seviyeleri görülür. MMA birikimine sekonder yan etkiler oluşur. Bunlar asidoz, hiperglisemi, olasılıkla diğer enzimlerin inhibe edilmesi ve kemikiliğinde kök hücre proliferasyonunun inhibe edilmesidir (12-15).
2.1.4. Homosistein
Homosistein (2-amino-4-merkaptobütirik asit), ilk olarak 1932 yılında Butz ve Du Vigneaud (16) tarafından tanımlanmıştır. Araştırmacılar insülin ile ilgili bir çalışma yaparken konsantre asit ile muamele edilmiş metiyoninden bir ara ürün elde etmişlerdir. Deney sırasında araştırmacıların insülinde bulunan sülfürü hesaba katmaları ve insülinde metiyoninin yokluğunu bilmemeleri homosisteinin
Şekil 4. Metiyonin, homosistein ve sistein kimyasal yapısı
Hastalıklar ve yüksek homosistein seviyeleri arasındaki ilişki, 1962 yılında Carson ve Neil (17) tarafından bulunmuştur. Araştırmacılar, mental geriliği olan çocukların idrarlarında homosistein seviyesinin yüksek olduğunu saptamışlardır (17). Homosisteinüri denilen bu durum, çocukluk çağı dahil olmak üzere hastaların %25’inin damar tıkanıklığı sonucu oluşan kardiyovasküler hastalıklardan ölmesiyle ilişkilendirilmiştir (18). Homosistein metabolizmasındaki bazı enzim eksikliklerinin, yüksek homosistein seviyesine sebep olduğu bulunmuştur (19). Sistation ß sentaz (CBS) enzimindeki genetik eksikliklerin, homosisteinüriye sebep oldugu ve plazma homosistein seviyesini artırdığı 1964’te Mudd ve ark. tarafından (20) tespit edilmiştir. McCully (21) 1969’da homosistein, aterosklerozlu hastaların patogenezinde rol oynayabilecek önemli bir aminoasit olarak ileri sürmüştür. Daha sonraki yıllarda yapılan çalısmalarda homosistein metabolizmasında görev alan metiyonin sentaz (MS) ve metilentetrahidrofolat redüktaz (MTHFR) gibi enzimlerde eksikler saptanmıştır (22,23). Carmel ve ark.(24) 1988 yılında yaptıkları çalışmada kobalaminin, metil kobalamine dönüşmesindeki bozukluk (Cbl G) sonucu MS aktivitesini azaltmakta olduğu ve multiple sklerozisi benzeri bulgular ortaya çıkardığı bildirilmiştir.
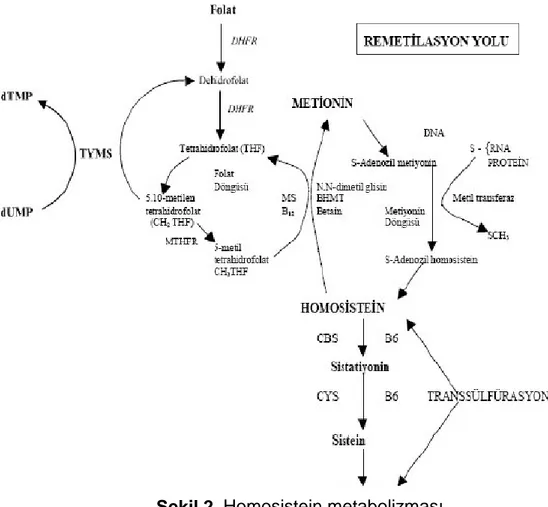
2.1.5. Homosistein Metabolizması
Homosistein, protein yapısında olmayan sülfürlü bir aminoasittir. Bu aminoasit diyetle alınan ve endojen proteinlerden sentezlenen esansiyel bir aminoasit olan metiyoninin metil grubu alınmış bir türevidir. Remetilasyon yoluyla tekrar metiyonine dönüşerek ya da transsülfürasyon yoluyla sistein, metilmalonik ve 2-metilsitrik aside dönüşerek metabolize edilir (25) (Şekil 2). Tüm hücrelerde bulunan metiyonin, hem protein sentezi hem de S-Adonozilmetiyoninin (SAM) oluşmasını sağlayan bir maddedir. Metiyoninin ihtiva ettiği metil grubu, SAM’e
dönüşümü sırasında aktive olur. SAM biçimlenmesi, adenozin 3-fosfat (ATP) ve metiyonin adenozil tranferaz enzimleri (MAT I, II, III) aracılığıyla gerçekleşir. Bu reaksiyonlarla hücre içi SAM miktarı regüle edilir. Metiyoninin kükürt atomuna ATP’den bir adenozil grubunun bağlanmasıyla SAM molekülü meydana gelir. Adenozil grubunun aktarılmasıyla kükürt atomu pozitif yük ile yüklenir. Bu durum sonucunda kükürt oldukça reaktif bir duruma geçerek içerdiği metil grubu akseptör, substratlarca kolayca transfer edilir. Metil grubu fosfatidil etanolamin (sefalin) akseptör olarak iş gördügünde alınır ve S-Adenozil Homosistein (SAH) oluşur. Bu molekül de daha sonra adenozin ve homosisteine hidrolizlenir. SAM organizmalarda başlıca metil grubu vericisidir (26).
Remetilasyon yolunda homosistein kofaktör olarak B12 vitamini’nin, substrat olarak da 5-metiltetrahidrofolatin (5-MTHF) kullanıldıgı ve metiyonin sentaz enziminin görev yaptıgı bir reaksiyonla metillenir ve metiyonine tekrar dönüşür. Bu metabolik yolun substratı olan 5-MTHF termolabil MTHFR enziminin katalizledigi bir reaksiyonla metilentetrahidrofolat (MTHF)’tan sentezlenir (27). Karaciğer ve böbreklerde remetilasyon için metil verici olarak betain de kullanılabilir. Betain/Hcy metiltransferaz enziminin katalizlediği reaksiyonla homosistein remetillenerek de metiyonine dönüştürülebilir (28). Transsülfürasyon yolunda ise homosistein, kofaktör olarak B6 vitaminini (pridoksin) kullanan sistationin beta sentaz (CBS) enzimi aracılığıyla sistationine çevrilir. Sistationin ise vitamin B6'nın kofaktörlüğünde sistationinaz enzimi ile sistein ve α ketobutirata çevrilir, α ketobutirat ise 2-metilsitrik asit ve metilmalonik asite parçalanır. Homosisteinden metiyonin dönüşümünün ve SAM miktarının azalması, metilasyon reaksiyonlarının işleyişini bozabilir. Nitrik oksit (NO) geri dönüşümsüz olarak MS’i metilkobalaminin (aktif koenzim) içerdiği kobaltı okside ederek inaktive eder. Böylece SAM’in biyosentezi engellenir. Hayvan deneylerinde nörolojik fonksiyonları inceleyen araştırmacılar, metilasyon reaksiyonlarında bu enzimin inaktif olmasının yüksek derecedeki etkisini göstermişlerdir (29). Homosistein metabolizması, karışık görünmesine rağmen oldukça düzenli bir feedback mekanizmasına sahiptir. Eğer metiyonin dengesi bozulmuşsa ve SAM düşük konsantrasyonda bulunuyorsa, homosistein öncelikle metiyonin oluşumu için MS’nin görev aldığı remetilasyon yoluna yönelir. Homosistein düzeyi yükseldiğinde S-Adenozil homosistein miktarı artar. Çok sayıda metabolik etkilere sahip olan
SAH, farklı bağlanma bölgelerinde SAM ile rekabet içindedir ve bu özelliği ile metilasyonu engelleyebilir. Bu sebepten araştırıcılar, SAM/SAH oranı metilasyon döngüsünde indikatör olarak görev alabilecegini düşünmüşlerdir (20). MTHFR enziminin katalizlediği bir reaksiyon sonucu oluşan Metilentetrahidrofolat, metiyoninin homosisteine dönüşümünde MS için substrat olması nedeniyle önemli bir işleve sahiptir. Bu yüzden MTHFR’nin, homosistein remetilasyonu üzerinde kuvvetli bir etkisi vardır.
Chen ve ark. (30) MTHFR enziminin eksikliğinin patogenetik mekanizmaları üzerine knockout farelerle yaptıkları çalışmada, toplam homosistein düzeyini normal farelere göre daha yüksek bulmuştur. Tokluk homosistein düzeyleri çok değişken sonuçlar verebildiği için homosistein düzeyi açlık durumunda ölçülmelidir. Direkt ya da indirekt ölçüm metodları mevcuttur (31); ancak en çok kullanılan ölçüm metodu yüksek performanslı sıvı kromatografisidir (HPLC) (32).
Östrojen, total homosistein konsantrasyonunu beslenme ve kas kitlesinden bağımsız olarak düşürdüğü için, erkeklerde homosistein kadınlara göre 1 µmol/L daha yüksek olabilir. Kang ve ark. (33) 16-30 mmol/L hafif, 31-100 mmol/L orta ve 100 mmol/L ise yüksek homosisteinemi düzeyleri olarak sınıflandırmışlardır. Plazma homosistein konsantrasyonu yaş ve cinsiyetle yakın ilişkilidir. Yaşa bağlı olarak plazma homosistein seviyesi hafif artma eğilimi gösterir. Serumda normal homosistein düzeyi 13-18 mmol/L’dir. Altuntaş ve ark nın (34) 2004 yılında pediatrik yaş grubu üzerinde yaptıkları çalışma neticesinde homosisteinin genç çocuk ve adölesanlarda düşük iken yaşla artmakta olduğu görüldü. Ortalama homosistein düzeyleri 1-6 yaş 3.87 ± 1.44 mmol/L, 7-11 yaş 8.7 ± 1.4 mmol/L ve 12-17 yaş 13.54 ± 1.49 mmol/L olarak bulundu. Tüm gruplarda erkek ve kız çocuklar arasında fark saptanmadı (34).
2.1.6. Homosistein Metabolizmasındaki Bozukluklar
Plazma homosistein düzeyinin artmasının tipik iki nedeni vardır. Bunlar homosistein metabolizmasından sorumlu bir enzimin genetik defekti veya vitamin kofaktör eksikliğine yol açan eksikliklerdir. Hiperhomosistenemi formlarının sınıflandırılması üç grupta olur: sistatyon sentazdaki bozukluk, düşük metilentetrahidrofolat ile homosistein metilasyonundaki bozukluk (folat eksikliği,
MTHFR eksikliği), normal veya yüksek metilentetrahidrofolat düzeyleriyle homosistein metilasyonundaki bozukluk (kobalamin eksikliği ve nitrik oksit). Sonraki her iki grup homosistein metilasyonu bozukluğunu gösterirken, MTHFR tarafından olan glisin metiltransferazın regülasyonunu baz alan transsülfülasyon seviyelerinde farklılık gösterebilmektedir (35). SAM konsantrasyonunun yüksek olmasının, transsülfürasyon yolunun tercih edilmesine sebep olduğu gösterilmiştir (36). Hayvan deneylerinde B6 vitamininin azalmasının SAH seviyesinin artmasına ve SAM seviyesinin azalmasının da transsülfürasyon yolunun engellenmesine sebep olduğu tespit edilmiştir (36). Sisteinin indirgenmesiyle oluşan glutatyon, hücredeki temel redoks tamponudur. İnsan hepatoma hücre dizisinde yapılan çalışmalarda, hücre içi glutatyonun kaynağının hemen hemen yarısının homosisteinden sağlandığı saptanmıştır. Glutationin birçok hücresel içeriği oksidatif zarardan ve oluşabilecek hasarlara karşı korur (35). Transsülfürasyon yolu öncelikle karaciğer olmak üzere, böbreklerde, ince bağırsakta ve pankreasta aktiftir. Bu dokular aynı zamanda hızlı glutatyonin dönüşümüne sahiptir. Yüksek homosistein seviyesinin, aterosklorozis, inme, miyokard enfarktüsü, Alzheimer hastalığı, hamile kadınlardaki doğum kusurlarındaki riski artırdığı belirtilmiştir. Ayrıca böbrek yetmezliği görülen hastalarda homosisteinin remetilasyon döngüsünde bozukluk veya sistationin sentaz enziminde bozukluk düzey artışına sebep olarak görülür. Homosistein birikimi ardından her iki yolda geri dönüşümün sağlanmasında SAM etkin bir rol oynar. Remetilasyon döngüsünde görülen aksaklıklar ile sistationin seviyeleri arasında bir ilişki olmadığı saptanmıştır (37).
Esansiyel bir kofaktör olan B12 vitamini ve folat eksikliğinde oldukça yüksek homosistein seviyeleri bildirilmiştir. Herhangi bir hastalıkla ilişkilendirilmemiş sağlıklı insanlarda homosistein seviyesi ile B12 vitamini, folat ve B6 vitamini arasında negatif bir korelasyon saptanmıştır. Selhub ve ark. (38) bir veya daha fazla B vitamini eksikliğinin tüm hiperhomosisteinemi vakalarının en az 2/3’ünde neden olduğunu ileri sürmüşlerdir.
Toplam plazma homosisteinin yaklaşık %80’i disülfit köprüleri ile albümine bağlanır. Bağlı olmayan homosistein türleri ise başlıca homosistein-sistin ve homosistein-homosistein disülfitleri şeklinde bulunur. Dolaşımdaki tüm homosisteinin yalnızca %1’i serbest homosistein şeklinde bulunur. Toplam
homosistein bütün bu serbest ve bağlı biyokimyasal homosistein türlerinin toplamını tanımlar (39). Vücutta homosistein düzeylerindeki artışın önemlerinden biri de erken yaşlarda gelişen ve hayatı tehdit edecek derecede önemli olabilen damar tıkanıklıklarına yol açmasıdır. Vurgulanması gereken önemli bir konu ise, hafif düzeylerdeki artışın bile damarlardaki tıkayıcı mekanizmaları uyarabilmesidir.
İnsan ve hayvanlar üzerinde yapılan çalışmalarda homosisteine bağlı aterosklerozda endotel hasarı olan bölgelerde trombosit yığılımı ve trombositten zengin trombus oluşumu görülmüştür (40).
Homosisteinin damar toksisitesi birbirinden farklı birçok etmenin katılımıyla ortaya çıkar. Bunlar şu şekilde sıralanmaktadır:
1. Homosisteinin homosistin, karışık disülfidler ve homosistein tiyolaktona otooksidasyonu esnasında, hidrojen peroksit, süperoksit ve hidroksil radikali gibi çeşitli sitotoksik reaktif oksijen türlerinin oluşumunu artırır. Bunlar lipid peroksidasyonunu uyararak düşük dansiteli lipoproteinin (LDL) oksitlenmesine, dolayısıyla trombosit aktivasyona ve kümelenmesine yol açar. Endotelden serbestleşen NO, süperoksit radikaliyle birleştiği için tüketilir. Sonuçta NO aracılığıyla gerçekleşen endotel bağımlı vazodilatasyon bozulmuş olur.
2. Hiperhomosisteinemi, endotelin antitrombotik özelligini protrombotik yönde değiştirir.
3. Homosistein damar düz kasındaki hücre büyümesini arttırır. Hücre dışındaki matriks bileşenlerinin birikimini hızlandırır.
4. Damar düz kas hücresindeki kalsiyum salınımı ve damar reaktivitesi sonucu hiperhomosisteinemi artar (41).
Bu etkilerin sonucunda pıhtılaşma ve pıhtı yıkımı arasındaki denge pıhtılaşma yönüne doğru değişir ve sonucunda tromboz ve ateroskleroz artar. Hiperhomosisteinemi tedavisi sebebine göre değişmekle birlikte genellikle vitamin (folat, piridoksin ve B12 vitamini) takviyesi ile düşmektedir. Piridoksin ve folatin en düşük etkili dozu henüz saptanmamıştır. Birçok hastada 1-5 mg folat takviyesi homosisteini hızlı bir şekilde düşürmektedir (42). Homosistein normalizasyonuna genellikle 4 ile 6 haftada ulaşılır.
2.1.7. Hiperhomosisteinemi Nedenleri
• Homosistein Metabolizmasındaki Genetik Bozukluklar (Şekil 3)
Sistatyonin beta-sentaz eksikliği: Bu enzim eksikliğinin homozigot formu konjenital homosistinüri olarak adlandırılan ağır hiperhomosisteineminin en sık karşılaşılan genetik nedenidir. Konjenital homosistinüri; otozomal resesif geçişli bir hastalık olup 1/200000 doğumda görülür. Bu hastalığın homozigot formunda Hcy düzeyi 400 µmol/L’ye kadar çıkabilir. Klinik bulguları ektopik lens, iskelet bozukluğu, mental retardasyon, tromboembolizm ve ağır premature aterosklerozdur. Aterotrombotik komplikasyonlar sıklıkla genç yaşta ortaya çıkar ve ölümcüldür. Heterozigotlar da ise klinik bulgular daha az belirgindir.
N5-N10 metilentetrahidrofolat redüktaz eksikliği: Ağır bir homosisteinemiye neden olur.
• Beslenme Bozuklukları: Hiperhomosisteinemili hastaların 2/3’ünde folat,
B12 vitamini ve B6 vitamininden bir veya daha fazlasının eksik olduğunu öne sürülmüştür.(32, 33, 42)
• Diğer Nedenler:
Kronik böbrek yetersizliği; kreatinin artışının plazma homosistein seviyelerini dört kat yükseltebildiği belirtilmektedir (28).
Hipotiroidi: Birkaç çalışmada hipotiroidisi olan hastalarda HCY konsantrasyonunun arttığı ve bunun vasküler hastalık sıklığı ile ilişkili olduğu savunulmuştur (43, 44).
Kronik gastrit: Helikobakter pilori infeksiyonunda folat eksikliğine bağlı olarak HCY seviyelerinde yükselme bildirilmiştir (45).
Pernisiyöz anemi: Otoimmun atrofik gastrit nedenli gastrik mukozal
hücrelerden intrinsik faktör salınımı bozulmasına bağlı gelişen B12 vitamini eksikliği tablosudur. Bu hastalarda homosistein seviyeleri genellikle yüksek bulunur.
Bazı kanserler: Meme, over ve pankreas kanserlerinde, akut lenfoblastik
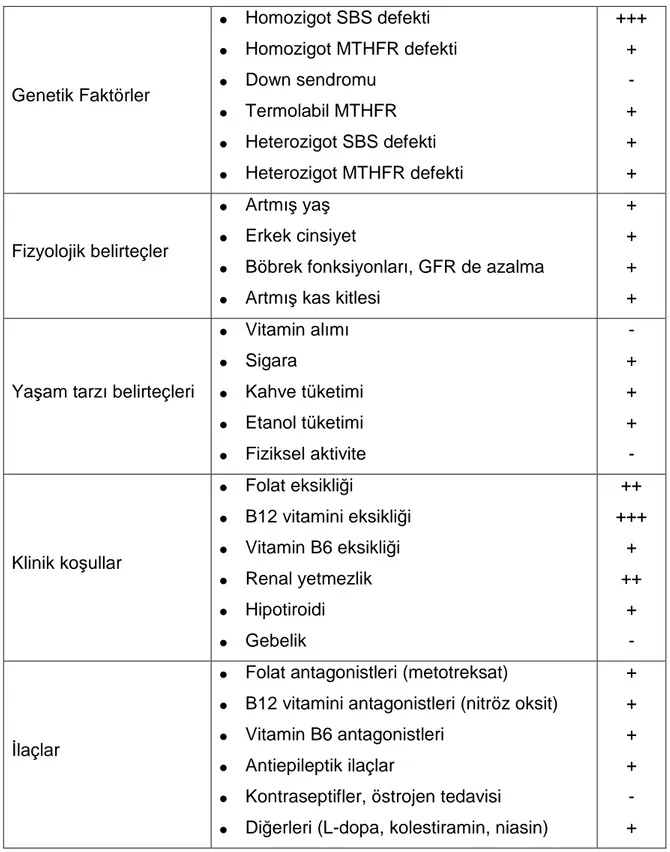
Tablo 1. Plazma Homositein Düzeyi Belirleyicileri Genetik Faktörler • Homozigot SBS defekti • Homozigot MTHFR defekti • Down sendromu • Termolabil MTHFR • Heterozigot SBS defekti • Heterozigot MTHFR defekti +++ + - + + + Fizyolojik belirteçler • Artmış yaş • Erkek cinsiyet
• Böbrek fonksiyonları, GFR de azalma • Artmış kas kitlesi
+ + + + Yaşam tarzı belirteçleri • Vitamin alımı • Sigara • Kahve tüketimi • Etanol tüketimi • Fiziksel aktivite - + + + - Klinik koşullar • Folat eksikliği • B12 vitamini eksikliği • Vitamin B6 eksikliği • Renal yetmezlik • Hipotiroidi • Gebelik ++ +++ + ++ + - İlaçlar
• Folat antagonistleri (metotreksat) • B12 vitamini antagonistleri (nitröz oksit) • Vitamin B6 antagonistleri
• Antiepileptik ilaçlar
• Kontraseptifler, östrojen tedavisi • Diğerleri (L-dopa, kolestiramin, niasin)
+ + + + - +
• Bazı ilaçlar ve toksinler:
Metotreksat, fenitoin, kolestipol ve niasin foat metabolizmasını etkileyerek Hcy seviyelerini arttırır. Blankenhorn ve arkadaşları niasin ve kolestipol alan koroner hastalarında Hcy seviyelerini daha yüksek bulmuşlardır (48).
Teofilin ve sigara: Piridoksal metabolizmasını antagonize ederek Hcy yüksekliğine neden olur.
Nitröz oksit: B12 vitamini metabolizmasını bozarak Hcy seviyesini arttırır. Bu ilaçların aksine tamoksifen ve penisilamin Hcy seviyelerini belirgin
derecede azalttığı gösterilmiştir.
• Diğer hastalıklar
Ağır psöriazis
Sistemik lupus eritematozus Diabetes mellitus
2.1.8. Homosistein ve Gebelik
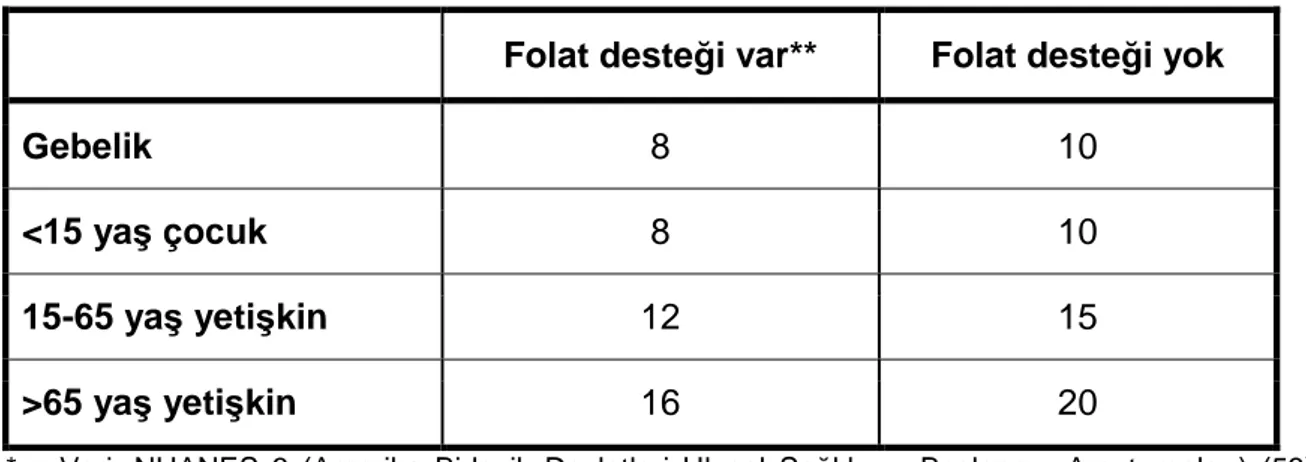
Normal gebeliklerde plasma homosistein düzeyleri düşer. Bu düşmeden sorumlu tutulan mekanizmalar, gebeliğe eşlik eden glomeruler filtrasyon hızında artma, plasma volüm artışıyla birlikte hemodilüsyon ve fetüs tarafından homosistein alımıdır. Homosistein %70-80 oranında albümine bağlandığından, gebelikte serum albümin düzeyinin fizyolojik düşüklüğü de gebelerde daha düşük homosistein düzeyi saptanması ile ilişkilendirilmektedir (49). Gebelik sürecindeki hormonal değişikliklerin de serum homosistein düzeyini etkilediği düşünülmektedir. Postmenapozal kadınlarda homosistein düzeyinin artması ve hormon replasman tedavileri ile düşüş göstermesi özellikle östradiolün bundan sorumlu olduğunu düşündürmektedir.(50) Anderson ve arkadaşlarına (51) göre gebe kadınlardaki serum homosistein konsantrasyonları gebe olmayan kadınlara göre %29-60 oranında daha düşüktür ve en düşük değerine gebeliğin ikinci trimestirinde ulaşır. Gebelikte maternal folik asit replasmanı yapılması da komplikasyonsuz gebeliklerde homosistein düzeylerinin daha düşük olarak bulunması ilşkilendirilmiştir. Homosistein belirleyicileri ile ilgili Refsum ve arkadaşlarının (52) yaptığı bir derlemede, değişik yaş gruplarında folat desteği yapılan ve yapılmayan gruplarda açlık serum homosistein üst düzeyleri ayrı ayrı değerlendirilmiştir. Buna göre folat replasmanı yapılan gebelerde homosistein üst sınırı 8, yapılmayanlarda 10 µmol/L olarak belirlenmiştir (Tablo 2).
Tablo 2. Değişik gruplarda açlık serum homosistein (µmol/L) üst sınırları için referans değerleri (52)*
Folat desteği var** Folat desteği yok
Gebelik 8 10
<15 yaş çocuk 8 10
15-65 yaş yetişkin 12 15
>65 yaş yetişkin 16 20
* Veri; NHANES 3 (Amerika Birleşik Devletleri Ulusal Sağlık ve Beslenme Araştırmaları) (53), Hordaland Homosistein Çalışması (54), Jerusalem Lipit Araştırma Klinik Çalışması (55), Oxford Sağlıklı Yaşlanma Projesi (OHAP)(56), Britanya Doğal Diyet ve Beslenme Araştırması(57), Oslo Çocuk Çalışması (58) gibi geniş populasyon çalışmalarının analizine dayanmaktadır. ** Folik asit katkılı besin ve ya folik asit desteği
Homosistein metabolizmasının gebelik üzerine en iyi tanımlanmış etkisi, nöral tüp defektleri ile ilişkisidir. Folat içeren vitamin suplementasyonu ile nöral tüp defekti gelişim riskinin belirgin ölçüde azaltıldığı bilinen bir gerçektir. Hayvan çalışmalarında nöral tüp defektinin nöral epitel hücrelerindeki metilasyon süreci ile ilişkisi ortaya koyulmuştur. Homositeinin N-methyl D-aspartat (NMDA) reseptör antagonisti gibi davranarak buna yol açtığı düşülmektedir (59). Hiperhomosisteinemi ile ilişkili sık görülen genetik polimorfizmlerin belirlenmesi ile hangi annelerin fetuslarının nöral tüp defekti (NTD) ile doğacağı belirlenmeye çalışıldı. MTHFR genindeki C677T ve A1298C polimorfizminin NTD gelişimi için artmış risk faktörü olduğunu destekleyen çalışmalar mevcuttur (60). Artmış
homosistein düzeyleri direk veya indirek yollarla endotel disfonksiyonu, nörülasyon hasarı, mikrofilamen sentezinde azalma, DNA metilasyonunda inhibisyon, gen ekspresyonunda değişim, S-Adenozilmetionin bağımlı metilasyon reaksiyonlarında azalma gibi etkilere sahiptir. Nöral tüp defektlerine ek olarak artmış plazma homosistein konsatrasyonu erken gebelik kayıplarına yol açabilen preeklampsi ve ablasyo plasenta gibi vasküler plasental trombozla da ilişkilidir (61). Ayrıca hiperhomosisteinemi; tekrarlayan gebelik kayıpları, ölü doğum ve intrauterin büyüme geriliği durumlarında da suçlanmaktadır.
Kobalamin Bağlayıcı Proteinler
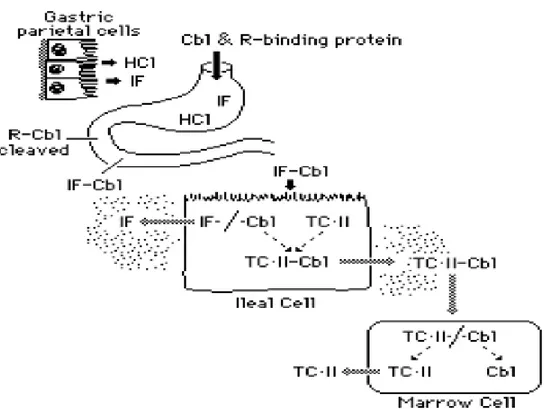
1. İntrensek faktör: İntrensek faktör (İF), insan mide fundus mukozasının parietal hücrelerinde sentez edilen, ısıya dayanıksız ve alkali ortamda stabil olan bir glikoproteindir. Özellikle kobalamine bağlanmadığı zaman asit Ph‘da peptik sindirime hassastır. Kobalamin varlığında monomer formundan dimer formuna geçer ve hızlı bir şekilde kobalamini bağlar. İF’ün her 1 mg’ı yaklaşık 30 mcg kobalamin bağlar. Günlük sekrete edilen miktar 40-80 mcg kobalamin bağlamak için yeterlidir. CbI-IF kompleksi ince bağırsak lümeninden emilir. IF geni 11.kromozom üzerinde lokalizedir (7,9).
Şekil 6. İntrensek faktör-kobalamin kompleksi
2. Transkobalamin II: Transkobalamin II (TCII); ince bağırsak hücrelerinden veya depolardan B12 vitaminini alıp, kullanan dokulara taşımada hizmet eder. TCII; fibroblastlar, makrofajlar, enterositler, hepatositler, dalak, kalp, böbrek hücreleri, mide mukozası ve endotelyum gibi farklı hücrelerde sentez edilen ve glikolize olmamış bir proteindir. TCII, plazmada, serebrospinal ve seminal sıvılarda bulunur. Kobalamine bağlandığı zaman kendi kendine veya diğer proteinler ile polimerize olur. Plazma turnoveri çok hızlıdır. B12 vitamini aktivitesi olmayan korrin analogları için afinitesi çok düşüktür. Plazmada TCII ‘ye hem MeCbI hem de AdCbI bağlanırken, TCI’ye sadece MeCbI bağlanır (8,62-64).
3. Haptokorrinler: Haptokorrinler, TCO, TCI, TCIII, R- bağlayıcı protein ve kabalofilin olarak da adlandırılırlar. Haptokorrinler farklı derecelerde glikozile olmuş, benzer yapılı glikoproteinlerdir. Bunlar miyeloid hücreler ve olası diğer birçok hücre tarafından sentez edilir. En önemli kaynağı granülositlerdir. Haptokorrinler; plazma, safra, tükürük, gözyaşı, anne sütü, amniyon sıvısı, seminal sıvı gibi birçok sekresyonda ve granülositler, trombositler, tükürük bezleri ve hepatoma hücrelerinde mevcutturlar (7,65). Plazma kobalaminlerinin % 70-90’ı haptokorrinlere bağlanır. Haptokorrinler kobalamin bağlayıcı proteinlerin tamamı arasında kobalamine en büyük afiniteyi gösterir. Ek olarak haptokorrinler B12 vitamini aktivitesinden yoksun diğer korrinlere bağlanmak için daha yüksek afiniteye sahiptirler. Gastrik sıvı, tükürük kaynaklı haptokorrinleri ve muhtemelen gastrik pariyetal hücrelerden üretilen haptokorrinleri ihtiva eder (65). TCI çoğunlukla MeCbI olmak üzere kobalaminler ile % 80-90 doygunluk durumundadır. Plazmadaki B12 vitamininin çoğundan kobalamin bağlayan TCI sorumludur (9). Besin ile
alınan aktif kobalaminler ve kobalamin analogları haptokorrinler tarafından sıkıca bağlanır ve en sonunda karaciğere taşınırlar. Bunların bir kısmı safra ile sekrete edilir. Gerçek kobalaminler İF’e bağlanır, bağırsakta tekrar emilir, analogları ise atılır (66). Haptokorrinler aynı zamanda B12 vitamininin üriner atılımını azaltarak depolama ve koruma fonksiyonuna hizmet eder. Ayrıca B12 vitaminini koruyarak ve B12 vitamininin mikroorganizmalar tarafından kullanımını engelleyerek konakçı savunmasında önemli rol oynarlar. Bu fonsiyonlarına rağmen vücutta haptokorrinlerin önemi açık değildir. Konjenital haptokorrin yokluğu olan hastaların bir kısmında B12 vitaminine cevap vermeyen atipik nörolojik bulgular gelişir (7).
2.1.9. Kobalaminlerin Emilimi
Gıdalardaki B12 vitamininin emilimi ve sindirimi oldukça kompleks bir süreç sonunda gerçekleşir. Proteine bağlı olmayan kobalamin, ağızda dilaltında emilebilir. Asıl besin kaynağı olan, hayvansal gıdalarla alındığı zaman B12 vitamini proteine bağlıdır ve dilaltında emilemez. Hayvansal gıdalardaki kobalaminlerin emilimi beş basamakta tamamlanır (7, 9, 67, 68) (Şekil 7).
1) Gıdalardaki proteine bağlı kobalaminler midede gastrik asit, pepsin ve proteazlar aracılığı ile serbestleşir. Bu süreç B12 vitamini emilimi için esastır. Atrofik gastritte vitamin serbestleşemez.
2) Mide ve tükürük sekresyonunda mevcut R-bağlayıcı protein, serbest kobalamin ve analoglarını bağlar. Midede kobalamin-R-bağlayıcı protein kompleksi oluşur.
3) Kobalamin –R-bağlayıcı protein kompleksi duedonuma ulaştığında duedonumun alkali ortamında pankreatik enzimler aracılığı ile R-bağlayıcı protein sindirime uğratılır ve serbestleşen kobalamin (aktif kobalamin), gastrik glikoprotein olan İF ‘e bağlanır. İnaktif kobalamin analogları İF’e bağlanamaz.
4) B12 vitamini-İF kompleksi terminal ileumda, mukozal hücrelerin mikrovillüs membranlarının üzerindeki spesifik İF-B12 reseptörlerine bağlanır. Bu reseptörlere bağlanma sürecinde 6,4-8,4 arasında pH ve divalent katyonlar
5) B12 vitamini –İF kompleksi endositoz ile hücre içine alınır. Kobalamin bazal memrandan portal kan dolaşımına geçer ve B12 vitamini TCII proteinine bağlanır. Kısmen bozulan İF ise salınır. İleal İF-CbI reseptörü dağılımı bireylerde değişiklik gösterir. İnce bağırsakta bir seferde reseptöre bağlanabilen İF-CbI kompleksinin maksimum miktarı, yaklaşık 1,5 mcg’dır. Kobalamin beslenmeden 8-12 saat sonra İF’e bağlanır. Kobalaminlerin fizyolojik emilimi için İF’e bağlanmaları gerekir. İF’e bağlandığı zaman diyetle alınan kobalaminlerin % 70‘i emilir. İF yokluğunda hastalara fazla miktarda kobalamin (100-1000 mcg) ağız yolundan verildiği zaman basit difüzyon gibi olası spesifik olmayan mekanizma aracılığı ile düşük oranda (% 0,1-% 1) ince bağırsaktan emilir (7, 9, 69, 70).
Şekil 7. Kobalaminlerin emilimi Kobalaminlerin Dokuya Taşınması (Şekil 8)
Plazmaya geçen kobalamin, 2 farklı proteine bağlanır. Bu taşıyıcı proteinlerden biri TCII’dır. TCII ince bağırsak hücrelerinden veya vücuttaki depolardan, B12 vitamini gereksinimi olan dokulara, kobalamini taşır. Böylesi fizyolojik önemine rağmen TCII, plazmada total B12 vitamininin yalnızca yaklaşık
% 10-30‘unu bağlar. Geriye kalan kobalaminler, haptokorrinlere özellikle TCI’e bağlıdır. TCII insan plazmasında unsatüre kobalamin bağlayıcı kapasitesinin çoğundan sorumludur. TCII değişik dokulara kobalamin taşınmasını hızlı bir
şekilde sağlar. Bu dokuların hücreleri TCII-CbI kompleksi için reseptör taşır (7).
Şekil 8. Kobalaminlerin dokulara taşınması
Karaciğer TCII-B12 vitamini kompleksi reseptörü, endotelyal hücrelerde bulunurken, hepatosit ve kupffer hücrelerinde bulunmaz. Bu reseptörlere bağlanma geri dönüşümlüdür, doyurulabilirdir ve kalsiyuma bağımlıdır; fakat enerji ve ısıya bağımlı değildir. Reseptöre bağlanmayı, TCII-CbI kompleksinin geri dönüşümsüz olarak endositoz yoluyla hücre içine alınması takip eder. TCII-CbI kompleksi gerekli hücreye ulaştığında lizozomlara alınır, kompleks lizozomal enzimler tarafından parçalanır ve vitamin OHCbI formunda TCII ‘den serbestleşir. OHCbI daha sonra MeCbI ve AdoCbI formlarına dönüşür. Lizozomlarda serbest kalan kobalaminin sitoplazmaya geçişi için spesifik transport sistemi olması gerekir. Bu sistemde bir defektin olması durumunda kobalamin –F (CbI-F) hastalığı meydana gelir (71-73). Kobalamin bağlayan TCI, plazmadaki total B12 vitamininin çoğundan sorumludur. Serumdaki mevcut B12 vitamininin çoğu MeCbI formundadır. Deoksiadenozilkobalamin ise daha küçük miktarlarda bulunur. Aynı zamanda eser miktarda OHCbI mevcut olabilir. TCI hemen hemen yalnızca MeCbI bağlarken TCII hem MeCbI hem de AdoCbI ‘ni bağlar (7).
Şekil 9. B12 vitamini ve folat metabolizmasının yolu, biyokimyasal
metilasyon reaksiyonları.
1 Enterositlerde absorpsiyon, internalizasyon ve transkobalaminII’ye transport.( Buradaki
defekt İmmerslund Grasbeck sendromuna yol açar.) 2
Transkobalamin II yetersizliği. 3
Lizozoma geçiş. (Kobalamin F mutasyonunda, lizozomdan sitoplazmaya geçiş bozulur.) 4
Metilmalonil CoA mutaz reaksiyonu. (Onun kofaktörü adenozilkobalamindir. Ya enzimlerin, ya da kofaktörün eksikliği metilmalonik asidüriye sebep olur.)
5
Metilen tetrahidrofolat redüktaz. 6
Metiyonin sentaz. (Onun kofaktörleri metiltetrahidrofolat ve metilkobalamindir. Enzimin veya kofaktörlerin eksikliği, homosisteinin artmasına ve metiyoninin yetersizliğine yol açar.)
7
Sistatyonin B sentaz. (Homosistein arttığı zaman sistatyoninüri olur; ancak bu enzim eksikliği varsa klasik homosistinüri ortaya çıkar.)
Ortalama total vücut B12 vitamini miktarı 1-4 mg’dır. Total miktarın % 60‘ı karaciğerde, % 30’u kaslarda depolanır. Günlük ortalama 1,4 mcg B12 vitamini safra aracılığı ile ince bağırsağa sekrete edilir ve normal bireylerde safraya sekrete edilenin % 50‘si (0,7 mcg) tekrar emilir. Bu özel dolaşım vejeteryanlarda uzun süre vitamin eksikliğinin oluşmamasını açıklar. B12 vitamininin enterohepatik dolaşımı vitaminin vücutta korunmasında rol oynar ve inaktive analoglarının atılımını sağlar (66).
2.1.10. B12 Vitamini Besinsel Kaynakları
İnsan kalın barsağında, bakteriler tarafından B12 vitamini sentez edilir; fakat kolonik kobalaminler absorbe olamaz. İnsan ince bağırsağında da bakteriler tarafından bir miktar B12 vitamini sentez edilir ve bu emilebilir. Buna rağmen sentez edilen ve emilen miktar, değişen intestinal floraya bağlı olarak ya çok az veya yetersizdir (2, 6, 7).
B12 vitamininin en önemli kaynağı karaciğer, glandüler dokular, kırmızı et, yumurta, peynir ve süt gibi hayvansal gıdalardır (2,7). Gıdalardan B12 vitamini konsantrasyonu en fazla olan karaciğer ve böbrektir. Her birinin 100 gramı, 100 mcg B12 vitamini ihtiva eder (7). Ayrıca deniz ürünlerinde de B12 vitamini bulunmaktadır. Baklagil türleri hariç, bitkisel besinlerde normal olarak B12 vitamini bulunmaz. Baklagil türü besinlerde ise kök kısmında, simbiyotik yaşayan bazı mikroorganizmalar tarafından, B12 vitamini sentez edilir; daha sonra baklagiller tarafından asimile edilerek tanelerin içine alınır. Su içinde bulunan saprofit bakteriler az miktarda B12 vitamini sentez edebilirler. Bu nedenle B12 vitamini bakımından minör bir kaynak sayılabilirler (2).
Gıdaların çoğunda B12 vitamini peptid bağları aracılığı ile proteinlere bağlı olup, nötral ve asidik ortamda ısıya dayanıklıdır ve besinin ısıtılması sonucu fazla kaybolmaz. İlaç olarak kullanılan B12 vitamini ‘Streptomyces griseus’ türü mantar türlerinden izolasyon yoluyla elde edilir (2,74).
Tablo 3. Bazı yiyeceklerdeki B12 vitamini miktarları (75)
Yiyecek Mikrogram (µg) karGünlük gereksimi
şılama yüzdesi*
Karaciğer (85 gr), pişirilmiş 70.7 1.178 Alabalık (85 gr),pişirilmiş, yaban 5.4 90 Süt (1 bardak), az yağlı 1.2 18 Yumurta (1 tane), kaynatılmış 0.6 10 Tavuk (85 gr), göğüs, kızartılmış 0.3 5
* FDA tarafından geliştirilen ve tüketicilerin spesifik bir vitaminin yiyecekte az veya çok miktarda olduğunu belirlemelerine yardım eden referans değerleridir. Eğer bir yiyecek maddesi günlük gereksinimin %20 veya daha fazlasını karşılıyorsa o vitamin için yüksek bir besin kaynağıdır. Ancak düşük yüzdeleri sağlayan yiyecekler de sağlıklı bir diyete katkıda bulunabilmektedir.
Anne serumu ile anne sütündeki B12 vitamini düzeyleri arasında güçlü bir korelasyon vardır. Anne sütünde ortalama 0,2- 1,0 mcg/l B12 vitamini bulunur (76). MeCbI anne serumunda olduğu gibi benzer oranda anne sütünde de en fazla bulunan kobalamindir. İnek sütünde en çok AdoCbI bulunur; fakat kurutulduktan sonra geriye sadece OHCbI kalır (77).
İnsan için gerekli olan B12 vitamininin hepsi, diyetle hayvansal gıdalardan sağlandığından, diyetle yetersiz B12 vitamini alımı, kobalamin eksikliğinin önemli bir sebebidir. Farklı toplumlarda hem diyete bağlı normal kobalamin gereksinimi miktarı hem de diyete bağlı kobalamin eksikliğinin sıklığı çok iyi tespit edilememiştir. Hindistanda serum ve doku B12 vitamini konsantrasyonu hem et tüketmeyen fakat mandıra ürünleri tüketen vejeteryanlarda, hem de hiçbir hayvansal ürünü tüketmeyen katı vejeteryanlarda düşük tespit edilmiştir (78-80).
2.1.11. B12 Vitamini Gereksinimi
B12 vitamini için önerilen günlük alım miktarları yaşa göre Tablo 3’te verilmiştir. Ancak birçok ülkede, yetişkinlerde, ortalama kobalamin alımının 1mcg/günden daha az olduğu tahmin edilmektedir (9). Komplike pernisiyöz anemisi olmayan hastalara, B12 vitamininin 0,1 mcg/gün kadar çok az miktarı bile paranteral verildiğinde, minimal hematopoetik cevap oluşacaktır. Bu miktar eksikliğin bütün bulgu ve semptomlarını önler ve normal sınırlar içinde B12 vitamini serum seviyelerinin devamını sağlar. Fakat 0,1 mcg’ın emilimini garanti altına almak için ağız yoluyla daha fazla B12 vitamini alımı gereklidir (80).
Tablo 4 . B12 vitamini için önerilen günlük alım miktarları (RDA) (75)
Yaş µg/gün 0-6 ay 0,3 7-12 ay 0,5 1-3 yaş 0,7 4-6 yaş 1,0 7-10 yaş 1,4 11-18 yaş 2,0 19-50 yaş 2,4 >50 yaş 2,4 Hamilelerde 2,2 Emzirenlerde 2,6
İnsan vücudundaki kobalaminin toplam miktarı, günlük gereksinimi ile çok yakından ilişkilidir. Vücutta toplam B12 vitamini deposu, bireylerin çoğunda ortalama 1-4 mg’dır (7). Karaciğer tek başına yaklaşık 1600 mcg B12 vitamini ihtiva eder ve daha az oranda diğer dokularda depolanır. Vücuttaki kobalaminin günlük kaybı % 0,1’dir (36).
2.1.12. Çocuklarda B12 Vitamini Eksiklik Nedenleri
Çocuklarda B12 vitamini eksikliğinin sebepleri üç grupta incelenebilir. Bunlar yetersiz alım, emilim defekti ve konjenital transport-metabolizma bozukluklarıdır (1, 9, 68).
• B12 Vitamini Emilim Defekti
A. İntrensek Faktör yokluğu veya fonksiyon bozukluğu
1. Konjenital Pernisiyöz Anemi 2. Mide rezeksiyonu (parsiyel/total) 3. Otoimmün juvenil pernisyöz anemi 4. Kostik madde alımı (koroziv gastrit) 5. Atrofik gastrit
B. Azalmış mide asit: Mide asit salgısını azaltan ilaçların uzun süre kullanımı
C. Pankreas yetmezliği
D. İnce bağırsakta B12 vitamini için kullanım yarışması
1. Bakterilerin aşırı çoğalması
a. İnce bağırsak divertikülü
b. Kör bağırsak sendromu c. Anastomozlar d. Fistüller e. Aklorhidri 2. Parazit enfestasyonları a. Diphillobothrium latum b. Giardiya intestinalis E. İleumdan emilimin bozulması
3. İleumu ilgilendiren cerrahi girişimler veya bypass
4. Anormal ileal reseptörler (İmmerslund-Grasbeck hastalığı)
5. İnfiltratif hastalıklar
a. Whipple sendromu b. Lenfoma
c. Liposarkom 6. İleum tuberkülozu
7. Emilimi azaltan ilaçlar a. Kolşisin
b. PAS c. Neomisin d. Metformin
8. Megaloblastik anemiye sekonder gelişen mukoza hasarı
9. Zollinger Ellison sendromu 10. Helikobakter pylori enfeksiyonu
• B12 Vitamini Transport Defektleri ve Metabolizma Bozuklukları
A. Transport Defektleri 1. TCII eksikliği
2. R-bağlayıcı protein eksikliği
B. Metabolizma Bozuklukları 1. Konjenital
a. AdoCbI eksikliği: CbIA ve CbIB hastalığı
b. MeCbI eksikliği: CbIE ve CbIG hastalığı
c. Kombine AdoCbI ve MeCbI eksikliği: CbIC, CbID ve CbIFhastalığı
d. Metilmalonil Co-Mutaz eksikliği
2. Edinsel
a. Nitrik oksite maruz kalma b. Karaciğer hastalığı
• B12 Vitamininin Yetersiz Alınması
Diyetsel Eksiklik: Katı vejeteryanlık, makrobiyotik diyet, yetersiz beslenme
Annedeki Eksiklik: Bebeklik döneminde B12 vitamini eksikliğinin en önemli nedeni annedeki B12 vitamini eksikliğidir. B12 vitamini eksik anneden doğan bebekte, hem doğum öncesinde plasenta yolu ile hem de doğum sonrası anne sütü ile B12 vitamini alımı yetersiz olduğundan, bebeklerde erken dönemde B12 vitamini eksikliği görülür.
Kötü diyet uygulamaları: İyi yönlendirilmemiş fenilketonüri diyeti, uygun olmayan diyet
2.1.13. Yenidoğanlarda ve Süt Çocuklarında B12 Vitamini Eksikliği
Yetişkinlerde normalde 1-4 mg B12 vitamini deposu vardır. Normal B12 vitamini deposuna sahip annelerin yenidoğan bebeği, sadece 25 mcg B12 vitamini deposuna sahipken, B12 vitamini eksikliği olan annelerin bebeğinde B12 vitamini deposu yaklaşık 3-5 mcg’dır. Kolostrum ve/veya yaşamın ilk hafta sütü, daha sonraki sütlerden çok daha fazla miktarda B12 vitamini ihtiva eder (1,9). Anne sütündeki B12 vitamini miktarı, annedeki B12 vitamini depolarından daha çok B12 vitamininin diyetle alım miktarı ile ilişkilidir. Doğumda yenidoğan bebeğin B12 vitamini deposu eksik olsa da, yaşamın en az birkaç haftası için yeterlidir (81,82).Yeterli B12 vitamini deposu ile doğan sağlıklı süt çocuklarında, serum B12 vitamini seviyeleri 6.aya doğru azalır ve ek gıda almaya başladıktan sonra, serum B12 vitamini seviyeleri tekrar artar. Fakat ek gıda alımı gecikirse veya başlanmaz ise 6. aydan sonra B12 vitamini eksikliği oluşma riski artar (83,84).
Beyin gelişiminin ve myelinizasyonun en hızlı olduğu dönem, doğumdan önceki son 3 ay ve doğumdan sonraki ilk 3-6 aydır. Eğer annede B12 vitamini yetersiz ise bebekte B12 vitamini eksikliği daha erken gelişir (64). Kobalamin eksikliği olan anne bebeğinin, son trimesterdeki miyelinizasyonu yavaş
olacağından, doğumda serebral atrofi ve hipoplazi olabilir. Doğumu takip eden ilk bir yıl, miyelinizasyon oldukça hızlıdır. B12 vitamini deposu eksik olarak doğanlarda, bu miyelinizasyon yavaşlamıştır (85).
B12 vitamini eksikliği erken dönemde teşhis edilip tedavi edilmez ise süt çocuklarında kalıcı nörolojik hasara neden olabilir (85-88). B12 vitamini deposu yetersiz olan çocukların, doğumu takip eden ilk 1 aydaki gelişimleri normaldir. Bunların % 70 ‘inde klinik bulgular 3-6 ay arasında ortaya çıkar. En sık semptomları letarji, hipotoni ve konvülziyondur. Bazen koma tablosu görülebilir. Tedaviyi takip eden ilk 3-4 ayda nörolojik bulgular düzelebilir, devam edebilir veya önceki nörolojik bulgular kötüleşebilir. Hastalarda beyin atrofisi veya hipoplazisi görülebilir. Vakaların birçoğunda miyelinizasyon tedaviden 12-13 ay sonra tamamlanmaktadır; fakat kraniyal MRI ile demiyelinizasyon bulgularının 3 yıla kadar devam edebildiği gösterilmiştir. Erken tanı ve tedavi önemlidir (85,89). Süt çocuklarında bazen anemi ve makrositoz olmayabilir veya değişebilir derecede pansitopeni mevcut olabilir. Kemik iliğinde belirgin megaloblastik değişiklikler görülmeyebilir. Tanı; düşük serum B12 vitamini seviyesi, diğer destekleyici testler, tedaviye cevap, annenin B12 vitamini durumu ve diyetin araştırılması ile konabilir (9).
2.1.14. B12 Vitamini Konjenital Bozuklukları
• B12 Vitamini Emilim ve Transport Bozuklukları
1. İntrensek faktör eksikliği: Çocukların az bir kısmında gastrik İF ‘in yetersiz üretim ve sekresyonu veya immünolojik olarak İF üretimi ve salınışı normal olmasına rağmen fizyolojik olarak inaktif olan anormal İF‘in mevcudiyeti sonucu kongenital pernisiyöz anemi gelişir. Yetişkinlerdeki tipik pernisiyöz anemiden farklıdır. Bunlarda mide asit sekresyonu yeterlidir ve mide mukozası histolojik olarak normaldir. Parietal hücrelere karşı antikor bulunmaz ve endokrin hastalıklar ile birlikte olmaz. B12 vitamini eksikliği bulguları genellikle 1 yaş civarında belirgin bir şekilde ortaya çıkar. Bu 1 yıllık süre, intrauterin dönemde plasenta yolu ile geçen B12 vitamini ile oluşan, B12 vitamini depolarının tüketilmesi ile uygundur. Halsizlik, huzursuzluk, iştahsızlık, güçsüzlük ve şiddetli anemi gelişir. Dil düz, kırmızı ve ağrılıdır. Ataksi, parestezi, hiporefleksi, babinski cevabı ve klonus gibi nörolojik bulgular meydana gelir (9, 65, 90).
2. Enterositler Tarafından B12 Vitamininin Transport Defekti (İmmerslund-Grasbeck sendromu) Finlandiya, Norveç ve Ortadoğu ülkelerinde daha sık olmak üzere tüm dünyada görülür. İlk olarak 1960 yılında Olga Immerslund tarafından
Norveç’li hastalarda ve Ralph Grasbeck ve ark tarafından Finlandiya’lı hastalarda tanımlanmıştır (91). Genellikle 1-5 yaş civarında ortaya çıkar (4 ay-14 yaş). Başlıca klinik bulgular:
– Büyüme-gelişme geriliği
– Tekrarlayan GİS ve solunum yolu enfeksiyonları – Yorgunluk
– Juvenil megaloblastik anemidir.
Nörolojik bulgular rölatif olarak hafiftir. MMA ve homosistein düzeylerinde hafif artış vardır. Hastalar normal IF ve intestinal morfolojiye sahiptirler. IF’e karşı antikor yoktur. IF tedavisi ile düzelmeyen selektif B12 vitamini emilim defekti vardır
İleumdaki kubilin-amnionless reseptör kompleksini (CUBAM= B12-İF kompleksi) kodlayan iki ayrı gendeki mutasyonlarına bağlıdır. Birincisi Fin tipi megaloblastik anemi 1 (MGA), CUBN geni: 10p13; ikincisi ise Norveç tipi MGA2, AMN geni: 14q32.32 de kodlanmaktadır. CUBN(kubilin) geninde en az 33, AMN(amnionless) geninde en az 27 farklı mutasyon bulunmuştur. Kubilin 25-Hidroksi D vitamini bağlayan protein kompleksinin geri emilimini de kolaylaştırır. Bu nedenle immerslund-grasbeck sendromlu hastalarda 25-Hidroksi D vitamini kaybı da artmıştır (92). Hastaların bir kısmında tübüler tipte proteinüri mevcuttur. Anemi sistemik B12 vitamini tedavisi ile düzelir, proteinüri düzelmez (9,91).
3. R-bağlayıcı protein (Haptokorrin, TCI eksikliği): Plazma, tükürük, lökositlerde
R-bağlayıcı protein yetersizliği veya tam yokluğu tespit edilmiştir. Serum kobalamin seviyeleri düşüktür. TCII-B12 vitamini seviyeleri normaldir. Bundan dolayı hastalarda B12 vitamini eksikliğinin klinik bulguları görülmez (9).
4. Transkobalamin II Eksikliği: Fetus ve kord kanında tespit edilen TCII‘nin
tamamı fetal orjinlidir. TCII, B12 vitamini için başlıca hücrelere taşıma aracıdır. Klinik bulgular genellikle yaşamın ilk haftalarında ortaya çıkar. Büyüme geriliği, halsizlik, glossit, kusma ve ishal gibi semptomlar görülür. Belirgin megaloblastik anemi vardır. Ancak hastaların bir kısmında pansitopeni hatta izole eritroid hipoplazi mevcuttur. Aynı şekilde hiposellüler olan kemikiliğinde, immatür olan beyaz hücre öncüllerinin mevcudiyeti ile yanlışlıkla lösemi tanısı konulabilir. Nörolojik bulgular, semptomların başlangıcını takiben ilk 6-30 ay kadar olan zaman aralığında ortaya çıkar. Hücresel ve hümoral bağışıklık defektine bağlı şiddetli immün yetersizlik görülür. Hastaların
bir kısmında metilmalonikasidüri vardır. TCII yetersizlikli hastalarda, genellikle anormal Schilling test sonucu bulunur. Ailede spesifik mutasyon olduğu zaman prenatal tanı olasıdır. Bu hastaların serum B12 vitaminini kullanmaları için serum kobalamin seviyeleri yüksek (100-10.000 pg/ml) tutulmalıdır. Hidroksikobalamin veya siyanokobalaminin haftada 2 kez 500-1000 mcg dozunda oral veya haftada bir veya daha sık olarak 1000 mcg dozunda intramuskuler verilmesi ile B12 vitamini yüksek serum düzeyleri korunur (9, 54, 93).
• B12 Vitamini Kullanım Bozuklukları
Dışarıdan alınan kobalamin, hücre içinde aktif olan AdoCbI ve MeCbI kofaktörlerine dönüşür ve her iki kofaktör farklı iki reaksiyonda koenzim görevi görür. Kobalt molekülünün stabil olduğu +3 değerlikli oksidasyon durumunda, hücre içine giren kobalamin, aktif enzim kofaktörlerine dönüşmek için labil olan +2 veya +1 değerlikli durumuna indirgenmelidir. Herhangi bir basamağın defektinde, B12 vitamini kullanımı bozulur (93).
1. Metilmalonik Asidüri (Mutaz eksikliği): Şiddetli metabolik asidoz ve kanda, idrarda ve serebrospinal sıvıda fazla miktarda MMA‘ın birikmesi ile karakterizedir. Mutaz yetersizliği olan hastalar doğumda çok iyi olmalarına rağmen, proteinli besin ile beslenmeyi takiben, klinik bulguları çok hızlı bir şekilde ortaya çıkar. Genellikle letarji, gelişmede gecikme, kusma, muskuler hipotoni, respiratuar distres, tekrarlayan kusma ve dehidratasyondan dolayı fark edilirler (9, 93).
2. Adenozilkobalamin Eksikliği (CbIA, CbIB hastalığı): Bu iki hastalık
metilmalonik asidüri ve adenozilkobalaminin hücre içinde yetersizliği ile karakterizedir. CbIA hastalığında defekt, muhtemelen kobalamin III’ün kobalamin I’e dönüşümünü sağlayan, mitokondriyal indirgeyici sistemdedir. CbIB hastalığında ise defekt, AdoCbI sentezi için son basamakta bulunan adenoziltransferaz enziminde bulunur. Her iki basamakta semptomlar mutaz yetersizliğinde görülenlere benzerdir (9,93). Semptomların başlama yaşı 1 gün ile 7 ay arasındadır. Adenozil kobalamin eksikliğinde laboratuar bulguları; metilmalonik asidemi, normal serum kobalamin düzeyleri, metabolik asidoz, ketonüri, hiperammonemi, hiperglisinemidir.
Adenozil kobalamin sentez defektlerinin tedavisinde; B12 vitamini (hidroksikobalamin ve siyanokobalamin) haftada bir-iki defa 1 mg. uygulanır. Ağız yolundan antibiyotik (linkomisin ve metranidazol, GİS’de propiyonat oluşumunu azaltmak için) verilir. Diyeter protein kısıtlaması (veya valin, izolösin, metionin ve treoninden kısıtlı formula) önerilir. CblA hastalarının %90’ında cevap alınır. CblB hastalarının %40 kadarında tedaviye cevap alınabilir ve sadece %30 kadarı uzun süre yaşayabilir
3. Adenozilkobalamin ve Metilkobalamin Kombine Eksikliği (CbIC, CbID, CbIF hastalığı): Her 3 hastalıkta, hücre içinde MeCbI ve AdoCbI sentez
yetersizliği vardır. Her 3 bozukluk TCII-CbI kompleksinin endositozu ve takip eden sonraki aşamalarda oluşur. CbIF hastalığında, lizozomdan sitoplazmaya serbest B12 vitamininin taşınmasında defekt vardır. CbI C ve CbI D hastalığında defekt, kobalamin III redüktaz enzimi veya redüktanlardadır. CbI C hastalarının çoğunda yaşamın ilk yılında kötü beslenme, büyüme geriliği ve letarji ortaya çıkar. Çoğunda megaloblastik anemi ve daha geç çocukluk döneminde veya adölesan döneminde başlayan spastisite, deliryum, psikoz ve perimaküler dejenerasyonlu pigmenter retinopati görülür. CbID hastalığında hafif mental retardasyon, davranış
problemleri ve tromboemboliye bağlı serebrovasküler hastalık bildirilmiştir. CbIF hastalığında düşük doğum ağırlığı, kötü beslenme, büyüme geriliği, persistan stomatit olur (9, 93).
4. Metilkobalamin Eksikliği (CbI E,CbI G hastalığı=homosistinüri): Fonksiyonel
metiyonin sentaz enzimi eksikliği, metilmalonikasidüri olmaksızın, homosistinüri ve hipometiyoninemi ile karakterizedir. CblE Tipi Metil Kobalamin Eksikliği; Metionin sentaz redüktaz genindeki (5q15.31) mutasyonun neden olduğu bir bozukluktur. Otozomal resesif geçiş gösterir. Metilkobalamin oluşumunda bozukluk vardır. CblG Tipi Metilkobalamin eksikliğinde ise Metionin sentazı kodlayan gendeki (1q43) mutasyonun neden olduğu bir bozukluktur. Otozomal resesif geçişlidir. En az 13 farklı mutasyon bulunmuştur. Fenotipik olarak CblE’ye benzer. CblE’den komplementasyon analizleri ile ayrılabilir. CblG hücrelerine S-adenozil metionin bağlanmasında defekt vardır. Genelde yaşamın ilk 2 yılında ortaya çıkar. Her iki hastalığın en sık bulguları, megaloblastik anemi, gelişimsel gecikme ve serebral