T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ GÖZ HASTALIKLARI ANABİLİM DALI
ANABİLİM DALI BAŞKANI: PROF. DR. FİLİZ AFRASHİ
ERKEN DÖNEM PARKİNSON HASTALARINDA OPTİK SİNİRİN FONKSİYONEL VE MORFOLOJİK OLARAK DEĞERLENDİRİLMESİ VE
TAKİBİ
UZMANLIK TEZİ DR. SAMİR HASANOV
TEZ DANIŞMANI
PROF. DR. ÖNDER ÜRETMEN
ÖNSÖZ
Tez çalışmamın planlanmasında ve uygulanmasında bana yardımcı olan, asistanlık eğitimim süresince deneyimlerini paylaşan ve desteğini esirgemeyen tez hocam sayın Prof. Dr. Önder Üretmen’e,
Hastalarını bize yönlendiren ve alanları ile ilgili her türlü bilgi ve deneyimlerini bizimle paylaşan Nöroloji Ana Bilim Dalı öğretim üyelerinden sayın Prof. Dr. Zafer Çolakoğlu`na ve Yrd. Doç. Dr. Ahmet Acarer`e
Bilgi ve deneyimleri ile mesleğimin inceliklerini öğreten ve cerrahi becerimin gelişmesinde bana yol gösteren sayın hocalarım; anabilim dalı başkanımız Prof. Dr. Filiz Afrashi’ye, Prof. Dr. Cezmi Akkın`a, Prof. Dr. Jale Menteş’e, Prof. Dr. Ayşe Yağcı’ya, Prof. Dr. Halil Ateş’e, Prof. Dr. Sait Eğrilmez’e ve Doç. Dr. Melis Palamar Onay’a
Asistanlığım süresince hep yanımızda olan, bilimsel katkılarınının yanısıra dostluklarıyla da hatırlayacağım Uzm. Dr. Suzan Güven Yılmaz`a, Uzm. Dr. Elif Demirkılınç Biler`e, Uzm. Dr. Özlem Barut Selver`e, Uzm. Dr. Serhad Nalçacı’ya ve Uzm. Dr. Zafer Öztaş`a
Asistanlık süresince tüm sevinçlerimizi ve kederlerimizi birlikte yaşadığımız, bana hep destek olan tüm asistan arkadaşlarıma,
Tüm asistanlık süresince ve tez yazım aşamasında desteğini ve yardımlarını esirgemeyen Uzm. Dr. Cumali Değirmenci’ye,
Yardımlarıyla hep yanımızda olan ve bize her türlü kolaylığı sağlayan klinik sekreterlerimiz sayın Zuhal Esenkan’a ve Filiz Göy`e,
Asistanlık süresi boyunca hep yanımda olan ve adeta bana annelik yapan sayın Dilek Suakar başta olmakla tüm hemşirelerimize,
Çalışma süresince işlerimizi kolaylaştıran tüm teknisyen ve personelimize, Bu güne gelmemde en büyük role sahip olan babam Yagub Hasanov`a, annem Zoya Hasanova`ya, ablam Sebine Kasımova`ya, ailemizin neşe kaynağı ve benim yaşam sevincim olan canım yeğenlerim İsmayıl Kasımov`a ve Nazım Kasımov`a sonsuz teşekkürlerimi sunarım.
İÇİNDEKİLER
ÖNSÖZ ... II İÇİNDEKİLER ... III ÖZET ... IV İNGİLİZCE ÖZET ... V KISALTMALAR ... VI TABLOLAR LİSTESİ ... VIIIA. GİRİŞ VE AMAÇ ... 1
B. GENEL BİLGİLER ... 2
1. Retinanın Yapısı ... 3
2. Retinal Fizyoloji ... 4
3. Retinada Dopaminerjik Nöronlar ... 5
4. Parkinson Hastalığında Retinal Tutulum ... 7
5. Retinanın Yaşlanması ... 7
6. Parkinson Hastalığında Retinal Dopamin ... 9
7. Parkinson Hastalığında Görsel Disfonksiyon Kanıtları ... 10
7.1. Görme Keskinliği ... 10
7.2. Kontrast Duyarlılık ... 10
7.3. Renkli Görme ... 11
7.4. Motor Algılama ... 12
7.5. Retinanın Yapısal Değişiklikleri ... 12
7.6. VEP ve ERG... 16 7.7. Görme Alanı ... 17 C. GEREÇ VE YÖNTEM ... 19 D. BULGULAR ... 22 E. TARTIŞMA ... 35 F. SONUÇ ... 45 G. KAYNAKLAR ... 46
ÖZET
Amaç: Erken dönem Parkinson hastalarında optik sinirin fonksiyonel ve morfolojik
açıdan prospektif olarak değerlendirilmesi ve takibi.
Gereç ve Yöntem: Erken dönem Parkinson hastalığı tanısıyla takip edilen 19
hastanın ve yaşa göre eşleştirilmiş 19 sağlıklı kontrolün 38’er gözü çalışmaya dahil edildi. Hastalar ve sağlıklı bireyler ilk muayeneden sonra en az 6 ay arayla toplam 3 kez muayene edildi. Muayenelerde tam oftalmolojik muayeneye ilave olarak desen görsel uyarılı potansiyel kaydı (VEP) ve fotopik koşullarda kontrast duyarlılık (KD) ölçümü, İshihara kartları ile renkli görme muayenesi ve tam saha görme alanı değerlendirmesi yapıldı. Optik koherens tomografi cihazı ile peripapiller retina sinir lifi tabakası (RNFL) kalınlığı değerlendirilerek 4 kadranın (üst, alt, nazal, temporal) ayrı ayrı RNFL kalınlığı not edildi. Santral ve ortalama maküler kalınlık ile maküler hacim ölçüldü.
Bulgular: En iyi düzeltilmiş görme keskinliği (EİDGK) hasta grubunda her üç
muayenede de anlamlı düzeyde daha düşük olarak saptandı. Hiç bir olguda rölatif afferent pupil defekti saptanmadı. Renk görme açısından hasta grubundaki bir hastada ılımlı diskromotopsi mevcutken, iki grup arasında anlamlı farklılık bulunmadı. Hasta grubunda KD değerleri tüm uzaysal frekanslarda anlamlı düzeyde daha düşük idi. Hasta grubunda VEP`te P100 dalga latansı anlamlı düzeyde daha uzun ve amplitüdü daha düşük olmakla birlikte takip süresince bu değerlerde anlamlı kötüleşme izlenmedi. Ortalama peripapiller RNFL kalınlığı açısından gruplar arası fark olmamakla birlikte üst kadrandaki RNFL kalınlığı hasta grubunda daha inceydi. Ortalama makula kalınlığı ve toplam makular hacim değerlerinde başlangıçta gruplar arası farklılık yokken izlem süresince hasta grubunda anlamlı azalma saptandı. Görme alanında başlangıçta ve takip süresince hasta grubunda anlamlı kötüleşme izlendi.
Sonuç: Erken dönem Parkinson hastalığında görsel yolların farklı basamaklarında,
elektrofizyolojik ve morfolojik olarak da gösterilebilen yapısal ve işlevsel bozukluklar mevcuttur.
İGİLİZCE ÖZET
Aim: Aim of the study is to evaluate and follow-up of functional and morphological
changes of the optic nerve prospectively in patients with early stage Parkinson’s Disease.
Method: 38 eyes of 19 patients with a diagnosis of early stage Parkinson’s disease
and 38 eyes of 19 age matched healthy controls were included in the study. All participiants were examined 3 time intervals at least 6 month after the first examination. Pattern visually evoked potentials (VEP) and contrast sensitivity measurement at photopic conditions, color vision test with Ishihara cards and full field vision test were performed in addition to a complete ophthalmologic examination. Retinal nerve fiber layer (RNFL) thickness of four quadrants (top, bottom, nasal, temporal) were recorded separately. Central and mean macular thickness and macular volume were measured.
Results: Best corrected visual acuity (BCVA) was observed significantly lower in
patients within all three examinations. Relative afferent pupillary defect was not detected in any case. While one patient in the patient groups in terms of color vision has moderate dyschromatopsia, there was no significant difference between the two groups. Contrast sensitivity values of the patient group was significantly lower in all spatial frequencies. P100 wave latency of VEP was significantly longer and amplitude was lower in patient group, however significant deterioration was not observed during the follow-up. Although average peripapillary of RNFL thickness was not significant between groups, RNFL thickness in the upper quadrant was thinner in the patient group. While there was no difference in terms of mean macular thickness and total macular volume values between the groups initially, a significant decrease occured in the patient group during the follow-up. During the initial and follow-up process, a significant deterioration in visual field was observed in the patient group.
Conclusion: Structural and functional disorders shown as electro-physiologically
and morphologically exist in different stages of visual pathways in early stage Parkinson’s disease.
SİMGELER VE KISALTMALAR
6-OHDA: 6-hidroksidopamin Asb: Apostilb
BDNF: Brain-derived neurotrophic factor cAMP: Cyclic Adenosine Monophosphate DA: Dopamin
DRT: Dış retinal tabakalar
EİDGK: En iyi düzeltilmiş görme keskinliği ERG: Elektroretinogram
ETDRS: Early Treatment Diabetic Retinopathy Study FAZ: Foveal avasküler zon
GABA: Gamma-aminobutrik asit GİB: Göz içi basıncı
HRR: Hardy-Rand-Rittler İFK: İç foveal kalınlık İPK: İç parafoveal kalınlık İRT: İç retinal tabakalar
LGN: Lateral genikulat nukleus
LOCS III: Lens Opacities classification system III MH: Maküler hacim
M-hücre: Magnoselülar hücre
MPTP: 1-methyl-4 phenyl-1,2,3,6-tetrahydropyridine NGF: Nerve growth factor
NMDA: N-metil-D-aspartat OKT: Optik koherens tomografi OMK: Ortalama makula kalınlığı PAAG: Primer açık açılı glokom PERG: Pattern elektroretinogram P-hücre: Parvoselülar hücre
PVEP: Pattern visual evoked potential RAPD: Rölatif afferent pupil defekti RGH: Retinal ganglion hücreleri RNFL: Retinal nerve fiber layer
SMK: Santral makula kalınlığı SOP: Standart otomatize perimetri TH: Tirozin hidroksilaz
UPDRS: Unified Parkinson`s Disease Rating Scale VEP: Visual evoked potential
TABLO LİSTESİ
Tablo 1. Yaşa bağlı göz değişiklikleri ve hastalıkları ... 8
Tablo 2. Parkinson hastalarında peripapiller RNFL kalınlığını araştıran OKT çalışmaları ve sonuçları ... 14
Tablo 3. Parkinson hastalarında makular kalınlığı araştıran OKT çalışmaları ve sonuçları ... 15
Tablo 4. EİDGK değerleri ... 24
Tablo 5. EİDGK açısından grup içi ve gruplar arası karşılaştırma ... 24
Tablo 6. Göz içi basıncı değerleri... 25
Tablo 7. Göz içi basıncı açısından grup içi ve gruplar arası karşılaştırma ... 25
Tablo 8. Farklı uzaysal frekanslardaki kontrast duyarlılık değerleri ... 26
Tablo 9. Farklı uzaysal frekanslardaki kontrast duyarlılık açısından grup içi ve gruplar arası karşılaştırma ... 26
Tablo 10. P100 dalga latansı değerleri ... 27
Tablo 11. P100 dalga latansı açısından grup içi ve gruplar arası karşılaştırma ... 27
Tablo 12. P100 dalga amplitüd değerleri ... 27
Tablo 13. P100 dalga amplitüdü açısından grup içi ve gruplar arası karşılaştırma ... 28
Tablo 14. Ortalama peripapiller RNFL kalınlık değerleri ... 28
Tablo 15. Ortalama peripapiller RNFL kalınlığı açısından grup içi ve gruplar arası karşılaştırma ... 28
Tablo 16. Kadranlar açısından peripapiller RNFL kalınlık değerleri... 29
Tablo 17. Kadranlar açısından peripapiller RNFL kalınlığının grup içi ve gruplar arası karşılaştırması ... 29
Tablo 18. Santral makula kalınlığı değerleri ... 29
Tablo 19. Santral makula kalınlığı açısından grup içi ve gruplar arası karşılaştırma 30 Tablo 20. Ortalama makula kalınlığı değerleri... 30
Tablo 21. Ortalama makula kalınlığı açısından grup içi ve gruplar arası karşılaştırma ... 31
Tablo 22. Toplam maküler hacim değerleri ... 31
Tablo 23. Toplam maküler hacim açısından grup içi ve gruplar arası karşılaştırma 31 Tablo 24. Görme alanında görülmeyen toplam nokta sayısı ... 32
Tablo 25. Görme alanında görülmeyen toplam nokta sayısı açısından grup içi ve gruplar arası karşılaştırma ... 32
Tablo 26. Yarım alanlarda görülmeyen nokta sayısı ... 33 Tablo 27. Yarım alanlarda görülmeyen nokta sayısının grup içi ve gruplar arası
A. GİRİŞ VE AMAÇ
Parkinson hastalığı substantia nigra`da ilerleyici dopaminerjik nöron kaybı ile kendini gösteren yaşa bağlı nörodejeneratif hastalıktır. Parkinson hastalığının klinik fenotipi tam olarak anlaşılmaya başladıktan sonra motor olmayan belirtiler daha hızlı öğrenilmeye başlanmıştır (1). Motor olmayan fenomenler arasında duygudurum bozukluğu, bilişsel gerileme, demans, uyku bozuklukları, hiposmi ve otonom bozukluklar yer almaktadır (2-13). Ayrıca, kuru göz ve okuma zorluğu şikâyetlerinden algısal bozukluklar ve karmaşık görsel halüsinasyonlara kadar geniş yelpazede değişen görsel belirtiler de yaygındır (14-18). Bu gibi görsel belirtiler Parkinson hastalığında önemli morbidite nedenleridir (19). Görsel halüsinasyonlar bilişsel gerilemenin önemli belirleyicesi olmakla beraber, kurumsal bakım ve mortalite nedenidir (20-22). Parkinson hastalığında görsel yolun farklı basamaklarında yapısal ve işlevsel bozuklukların olduğunu gösteren psikofiziksel, elektrofizyolojik ve morfolojik kanıtlar vardır. Ayrıca "yüksek" (kortikal) görsel süreçte de etkilenme söz konusudur. Parkinson hastalığında retinada ve optik sinirde hem yapısal, hem de işlevsel değişiklikler gelişmektedir. Parkinson hastalarında görme keskinliği ve kontrast duyarlılıkta azalma, renk görme bozuklukları, retina sinir lifi tabakasında incelme, makular kalınlıkta azalma, elektrofizyolojik testlerde değişiklikler, görme alanı ve motor algılama bozuklukları bildirilmiştir (1).
Bu çalışmanın amacı erken dönem Parkinson hastalarında optik sinirin fonksiyonel ve morfolojik olarak değerlendirilmesi ve onlardaki değişikliklerin takibidir.
B. GENEL BİLGİLER
Parkinson hastalığı gelişmiş ülkelerde Alzheimer hastalığından sonra ikinci en sık görülen nörodejeneratif hastalıktır. Hastalığın prevalansı %0.3, tahmini insidansı ise yılda 100 000 kişide 8-18`dir (23). Hem insidans, hem de prevalans yaşla birlikte artmaktadır (24, 25).
İlk olarak 1817 yılında İngiliz doktoru James Parkinson tremor, bradikinezi ve rijidite gibi motor bulgulara dayanarak hastalığı "titrek felç" olarak tanımlamıştır (26, 27). Parkinson hastalığı substantia nigra`da ilerleyici dopaminerjik nöron kaybı ile kendini gösteren yaşa bağlı nörodejeneratif hastalıktır. Hastalık yavaş ve sinsi seyreder. On yıl gibi bir süre boyunca sürekli ilerler. Başlangıçta tek taraflı belirtiler görülürken daha sonra bu bütün vücuda yayılır. Belirtilerin şiddeti her hastada farklıdır. Hastalık genelde 40 yaşından sonra görülür ve erkeklerde görülme sıklığı biraz daha fazladır. Sinsi ve yavaş seyreden bir hastalık olduğu için uzun süre farkedilmeyebilir. Genelde ilk belirti elde veya vücudun bir yarısında titremedir. Titreme, bradikinezi ve rijidite hastalığın ana motor semptomlarıdır. Hastalık Birleşmiş Parkinson Hastalığı Derecelendirme Ölçeği (UNIFIED PARKINSON'S DISEASE RATING SCALE-UPDRS) sistemine göre skorlandırılır. Modifiye Hoehn ve Yahr sınıflandırmasına göre hastalığın aşağıdaki evreleri vardır:
Evre 0: Hastalık bulguları yoktur Evre 1: Tek taraflı hastalık
Evre 1.5: Tek taraflı hastalığa ek olarak aksiyal tutulum Evre 2: Denge bozukluğu olmadan çift taraflı hastalık
Evre 2.5: Çekme testinde düzelme ile ılımlı çift taraflı hastalık
Evre 3: Ilımlı orta çift taraflı hastalık; bazı postural dayanıksızlıklar; fiziksel olarak bağımsızlık
Evre 4: Ağır sakatlıklar; yürüyüş ya da yardımsız ayakta kalmak hala mümkün Evre 5: Tekerlekli sandalyeye bağlı veya yatalak
Parkinson hastalığı kendisinde motor ve motor olmayan özellikleri birleştiren multisistem bir hastalıktır. Görsel belirti ve bulgular hastalığın motor olmayan fenomenlerine dahil olup retinanın, optik sinirin ve görme korteksinin yapısal ve işlevsel bozuklukları sonucunda gelişmektedir (1).
1. Retinanın Yapısı
Parkinson hastalığının retina üzerindeki etkisini değerlendirmek için 1892`de Cajal tarafından tarif edilen retinanın temel anatomik özelliklerini hatırlamamız gerekmektedir. İnsan retinası iki tip fotoreseptör hücre içermektedir: rod ve koniler. Rodlar parafoveal ve periferik retinada yerleşerek alacakaranlıkta görmeyi, koniler ise daha çok makulada yerleşerek gündüz ışığında ve renkli görmeyi sağlarlar (28). Retinal sinyaller iki yönde oluşur: yatay ve dikey. Dikey sinyaller fotoreseptörlerden bipolar hücrelere oradan da ganglion hücrelerine aktarılır. Fotoreseptörler dış pleksiform tabakada bipolar hücrelerle, bipolar hücreler ise iç pleksiform tabakada ganglion hücreleri ile sinaps oluşturur. Dikey sistemin ana nörotransmitter`i glutamat`tır. Glutamat genel olarak eksitatör iyonotropik ve inhibitör metabotropik glutamat reseptörleri üzerinde etki eder. Buna ek olarak, dış ve iç pleksiform tabakalarda horizontal sinyal iletimini sağlayan hücreler vardır. Bu hücreler skotopik ve fotopik görmenin zamansal ve mekansal niteliklerinin şekillenmesinde hayati rol oynarlar. Horizontal hücreler dış pleksiform tabakada yer alarak fotoreseptör ve bipolar hücre etkileşimi üzerinden etki ederler. Amakrin hücreler ise iç pleksiform tabakada yer alır ve bipolar hücreler ile ganglion hücreleri arasındaki etkileşim üzerinden etki ederler. Bu horizontal iletişim başlıca olarak GABA ve glisin gibi inhibitör medyatörler aracılığı ile oluşur. Santralde bir ganlion hücresi yalnız bir koni ile bağlantı kurarken perifere doğru gidildikçe bir ganglion hücresi giderek daha fazla hücre ile bağlantı kurar. En periferde bir ganglion hücresinin 200`e kadar rod ile bağlantıda olduğu bilinmektedir. Retinal ganglion hücreleri (RGH) optik sinir başında miyelinize olmağa başlar ve bilgiyi talamus`un lateral geniculat nucleus`una taşır (LGN). Büyük RGH`leri magnoselülar (M-hücre) olarak isimlendirilir ve daha çok periferik retinada yerleşir. Bu hücreler hareket ve kontrastla ilgili bilgileri taşır. Küçük RGH`leri ise parvoselülar (P-hücre) olarak isimlendirilir ve daha çok santral retinada yerleşir. Bu hücreler hassas sinyaller ve renklerle ilgili bilgileri yüksek görme merkezlerine taşırlar (29-33). LGN dışında diğer subkortikal görme merkezlerine superior colliculus, dorzal talamus`un pulvinar kompleksi ve orta beyin tectum`u dahildir. LGN nöronlarının aksonları görsel sinyalleri ilk olarak striat görme korteksine (V1) taşır. Görme sinyalleri buradan ekstra-striat alanlara (V2-V5) iletilir. Görsel sinyaller görme korteksinin striat ve erken ekstra-striat alanlarından "dorsal akım" şeklinde parietal lob`a, "ventral akım" şeklinde ise temporal lob`a
iletilir. Dorsal akım hareket ve mekan, ventral akım ise nesne şeklinin algılanmasından sorumludur (34-37).
2. Retinal Fizyoloji
Fotoreseptörler karanlıkta depolarize durumda bulunurlar ve devamlı glutamat salgılarlar. Işık uyaranı fotoreseptörlerin hiperpolarize duruma geçmesine ve glutamat salgısının azalmasına neden olur. Fotoreseptörler tarafından glutamat salınımının azalması bipolar hücrelerin farklı alt tiplerinde inhibisyon veya aktivasyona neden olur. Aktive olan bipolar hücreler "ON" hücreler olarak isimlendirilir ve onlar da sırasıyla "ON" ganglion hücrelerini aktive ederler (38). Bunun aksine "OFF" bipolar hücreleri "OFF" RGH`ne fotohassas sinyalleri iletirler. Bunun sayesinde ışığın şiddeti ve kontrastına bağlı olarak RGH faaliyet potansiyelini değiştirirler (39-42). Işıkla uyarılmış her retinal ganglion hücresi farklı retina alanı ile ilişkilidir. Bu retina bölgesi ganglion hücrelerinin reseptif alanıdır. Reseptif alanların boyutu ve fotosensitif özellikleri iç ve dış pleksiform tabakalardaki sinaptik bağlantıların ve fotoreseptörlerin bipolar hücre üzerindeki konverjansının derecesine bağlıdır. Bu periferik retinadaki reseptif alanların santral retinaya göre daha büyük olması anlamına gelir. Çünkü, periferik retinada yaklaşık 100`e kadar rod hücresi tek bir bipolar hücre ile ilişkilidir. Ganglion hücrelerinin reseptif alanı 2 önemli özelliğe sahiptir:
1- Retina üzerinde küçük bir noktasal ışık ganglion hücresinin reseptif alanının özelliklerini anlamak için kullanıldığında reseptif alanın düzgün dairesel olduğu kanıtlanır.
2- Ganglion hücrelerinin çoğunun reseptif alanı 2 bölüme ayrılır: merkez olarak isimlendirilen yuvarlak bir alan ve çevre olarak adlandırılan onu saran alan. Ganglion hücresi reseptif alanın çevresinin ya da merkezinin aydınlanmasına göre farklılaşmış yanıtlar oluşturur. Reseptif alanlarının merkezine noktasal ışık uygulanmasına verdikleri yanıtlarına göre ganlion hücreleri iki sınıfa ayrılabilirler (42).
On- center ganlion hücreleri merkeze ışık verilince uyarılırlar. Çevreye ışık verildiğinde ise hücre inhibe olur. En etkili inhibitör uyaran yüzük tarzında olandır. Off-center ganlion hücreleri, reseptif alanın merkezine ışık uygulandığında inhibe olurlar. Buna rağmen onların ateşleme seviyeleri ışık uzaklaştırıldıktan bir süre sonra artar. Bu merkeze uygulanan ışık kapatıldığında hücre uyarılır. Işık çevreye
uygulandığında da uyarılma olur. Her iki tip hücrenin de yanıtı çevreye yüzük gibi bir ışık uygulanması ile ortadan kaldırılır. Bu nedenle yaygın aydınlatma her iki nöron tipinde de çok az yanıt oluşturur. Tüm ganlion hücreleri bu şekilde organize olmamıştır. Örneğin az sayıda ganglion hücresi sadece çok yoğun aydınlanmaya yanıt verirler ve pupil refleksi için önemlidirler. On ve off center ganglion hücreleri kabaca eşit sayılarda bulunurlar ve her fotoreseptör çıktılarını her iki tip nörona da gönderirler. Böylece ganglion hücreleri, görsel bilginin paralel olarak işlemlendiği 2 yol oluştururlar. Ek olarak reseptif alanlarının retina üzerindeki boyutları değişir. Primatların retinasında görmenin en iyi olduğu foveada, reseptif alanlar küçüktür, oysa retinanın periferinde reseptif alanlar büyüktür. Ganglion hücreleri tek tip aydınlatmaya yavaş yanıt verirler. Bunlar çevreye ya da merkeze ayrı olarak yoğun ışık uygulandığında en iyi yanıtı oluştururlar. Bu yüzden diyebiliriz ki bu yapılar yoğun ışıktan çok görüntüdeki kontrastı algılayabilirler (43-47).
3. Retinada Dopaminerjik Nöronlar
İlk defa 1963`de Malmfors gözlemleri sonucunda katekolaminlerin sıçanların retinal fonksiyonlarında rol oynayabileceği fikrini ileri sürmüştür (48). Reserpin kullanılarak katekolaminleri farmakolojik yolla tüketilen sıçanlar pupil çaplarının küçük olmasına rağmen belirgin fotosensitivite göstermişlerdir. Tavşan retinası üzerinde yapılan çalışmalarda dopaminerjik (DA) nöronların olduğu gösterilmiştir (49). Daha sonra benzer hücreler insan retinasının iç nükleer tabakasında da bulunmuştur (50). Retinadaki başlıca dopaminerjik hücre A18 olarak isimlendirilen amakrin hücre alt tipidir (51-53). A18 hücrelerinin yoğunluğu düşüktür. Ancak onlar yaygın dendritik dallanmaları ve uzun ince aksonları sayesinde komşu dopaminerjik hücrelerin yanısıra diğer amakrin ve bipolar hücreler ile de etkileşime girerler (54-57). Dopaminerjik amakrin hücrelere sinyallerin nereden dahil olduğu anatomik olarak tam anlaşılmasa da bu hücrelere uyarıların daha çok rodlarla ilgili bipolar hücrelerden geldiği bilinmektedir (57). Bu hücreler aynı zamanda dev bistratifiye hücreler olarak isimlendirilen konilerle ilgili bipolar hücre tipinden de uyarılar alabilirler (58). Fonksiyonel açıdan bakıldığında hem skotopik, hem de fotopik koşullarda ışığın etkisiyle dopaminerjik hücrelerin depolarize duruma geçtiği bilinmektedir. Bunun için dopaminerjik nöronların depolarize bipolar hücreler tarafından uyarılması gerekmektedir. Dopaminerjik nöronlar diğer 2 amakrin hücre
alt tipi ile de ilişkilidir: AII ve A17 (38). AII amakrin hücreleri sinyalleri rod ve koni bipolar hücrelerinden alarak ON ve OFF ganglion hücrelerine iletir (59, 60). AII hücreleri gap junction ile koni ON bipolar hücreleri ile bağlantıdadır. Bu bağlantı sayesinde rod sinyalleri ON koni yoluna akar (61). Bu hücreler aynı zamanda glisinergik sinapslarla OFF RGH ile bağlantı kurarak skotopik koşullarda onları inhibe eder. AII amakrin hücreleri sadece horizontal sinyal iletiminde değil skotopik koşullarda vertikal sinyal iletiminde de önemli rol oynar. AII hücreleri aynı zamanda gap junction`lar ile diğer AII hücreleri ile ilişkide olup retina boyunca fonksiyonel sinsitium oluştururlar (62). A17 hücreleri çok sayıda rod bipolar hücresinden uyarıları alarak retinanın skotopik eşiğini modüle etmek için bu sinyalleri aynı hücrelere yeniden geri gönderirler (63). AII hücreleri D1-dopamin reseptör subtipini ve gamma aminobutrik asit tip-A (GABAA) reseptörünü üretirler (64-66).
Dopaminerjik nöronlar bipolar hücrelerden eksitatör (glutamaterjik), amakrin hücrelerden ise inhibitör (GABAerjik ve glisinerjik) sinyalleri alır. Bu sinyaller dopaminerjik hücrelerde aksiyon potansiyelini ve dopamin salgısını değiştirirler (67-69). Amakrin ve bipolar hücreler üzerine doğrudan sinaptik etkilerinin yanısıra dopaminin retinal ekstraselülar matriks içerisine difüzyonu sinaptik bileşkelere gerek kalmadan parakrin etkiye neden olur. Bunun sayesinde medyatörün etki alanı genişler (70). AII ve A17 amakrin hücreleri rod odaklı görsel sinyal akımının modüle edilmesinde önemli rol oynarlar.
Dopamin siklik-AMP (cAMP) üretimini düzenleyen G-proteini ile ilgili reseptörler üzerinden etki eder. Dopamin reseptör alt tipleri (D1-D5) iki ana reseptör ailesinde birleşmektedir. D1 reseptör ailesi cAMP düzeyini arttırarak eksitatör etki oluşturur. D2, 3 ve 4 alt tiplerinin dahil olduğu D2 reseptör ailesi ise ters etkiye sahiptir. Fotoreseptörler D2 reseptör ailesinin aktivasyonu ile inhibe olurken, bipolar, horizontal, retinal ganglion hücreleri ve amakrin hücreler D1 reseptörlerinin aracılığı ile aktive olurlar. Kendi dopamin salınımlarını düzenlemek için dopaminerjik nöronlar D2 ailesinin otoreseptörlerine sahiptirler (65,71,72). Dopamin rod ve konilerin horizontal hücreler, AII hücrelerinin AII hücreleri ve koni bipolar hücreleri ile birleştiği seviyelerde gap junction`lar üzerine doğrudan etki ederek onların geçirgenliğini değiştirir (61,73,74). Dopamin`in konsantrasyonu arttıkça gap junction`ların geçirgenliği azalır ve bu reseptif alan çapının küçülmesi ile sonuçlanır (75).
Dopaminin retinal konsantrasyonu tonik diurnal varyasyon gösterir. Gün boyunca yüksek seviyede olan dopamin konsantrasyonu gece azalır. Bu sirkadian ritm retinal melatonin konsantrasyonundaki değişikliğin tam aksidir. Çünkü retinal melatonin konsantrasyonu geceler artar. Dopamin ve melatonin bir birlerinin üretimini baskılayarak retinanın "biyolojik saat"nin oluşmasına neden olurlar (76). Dopamin konsantrasyonundaki fotosensitif değişiklikler bu medyatörün karanlık-ışık adaptasyonunda önemli role sahip olduğunu göstermektedir (75, 77-79). Dopamin amakrin hücreler üzerine etki ederek rod fotoreseptörlerinden gelen sinyallerin azalmasına ve böylece reseptif alanın küçülmesine neden olur (80-84).
Dopamin ışık adaptasyonunun kimyasal habercisidir. Konilerle gelen sinyal akışını arttırırken, rodlar tarafından gelen sinyal akışını azaltır (1).
4. Parkinson Hastalığında Retinal Tutulum
Dopaminin retinal fonksiyonlarda önemli rol oynadığı şüphesizdir. Ancak dopamin yetmezliği olan durumlarda retinanın nasıl etkilendiği tam bilinmemektedir. Parkinson hastalığında retinada hem yapısal, hem de işlevsel değişiklikler gelişmektedir. Bu bir takım soruları ortaya çıkarmaktadır. Parkinson hastalığının prevalansı yaşla birlikte arttığı için retinada gelişen değişiklikler yaşa mı, yoksa dopamin yetmezliğine mi bağlıdır? Eğer hastalığa özgül etki varsa, bu retinadaki mi
yoksa santral görme merkezlerindeki dopamin azlığına mı bağlıdır? Eğer Parkinson hastalarının retinasında lokal dopamin yetmezliği oluşuyorsa, bu sinyal iletimini engelliyerek görsel fonksiyonlarda kısıtlılıklara neden oluyor mu? Son olarak retinal disfonksiyonun halüsinasyon gibi görsel belirtilerin oluşmasına katkısı var mı?(1)
5. Retinanın Yaşlanması
Katarakt, yaşa bağlı makula dejenerasyonu, diyabetik retinopati ve glokom gibi yaşa bağlı hastalıklar nedeniyle yaş arttıkça görsel fonksiyonlarda değişiklikler gelişir (85-89). Hatta bu tür belirgin hastalıklar olmadan bile yaşla birlikte görme fonksiyonu azalır. Lensin kırıcılığının azalması presbiopiye neden olur. Pupil çapı küçülür. Bu "senil miyozis" olarak isimlendirilir. Miyozis gözün odaklama yeteneğini sınırlar ve şiddetli durumlarda retinal aydınlanmayı azaltabilir. Ayrıca retinal dejenerasyon rod, kon hücreleri ve retinal ganglion hücrelerinin sayısının azalmasına neden olur (90-92). Bu değişiklikler yaşlı retinanın nöral fonksiyonlarını
sınırlar. Yaşa bağlı göz hastalıkları görme keskinliği, kontrast duyarlılık, renkli görme, karanlık adaptasyonu ve benzeri fonksiyonlarda kötüleşmeye neden olur. Ayrıca görsel korteks patolojisine bağlı santral disfonksiyon ve eşlik eden bilişsel gerileme yaşlanan nüfusun görme çalışmalarında karışıklığa neden olabilir (Tablo 1).
Tablo 1. Yaşa bağlı göz değişiklikleri ve hastalıkları (1)
Yaşa Bağlı Değişiklikler Fonksiyonel Etki
Yaşa Bağlı Göz Hastalıkları
Katarakt
Yaşa bağlı makula dejenerasyonu
Diyabetik retinopati Glokom
Yaşa Bağlı Göz Değişiklikleri
Presbiopi
Senil miyozis Retinal dejenerasyon
Santral Görsel Bozukluklar
Birincil görme korteksi İkincil kortikal görme alanları
Retinal aydınlanmada azalma Görme keskinliği ve kontrast duyarlılıkta
değişiklikler
Lensin kırma gücünün azalması Görme keskinliğinde azalma Karanlık adaptasyonunda azalma
Görme keskinliğinde azalma Görme alanında daralma Görme keskinliğinde azalma
Renkli görmede azalma
Görme keskinliği ve kontrast duyarlılıkta değişiklikler
Retinal aydınlanmada azalma Retinanın nöral fonksiyonlarında
kısıtlılık
Karanlık adaptasyonunda azalma Statik ve dinamik görme keskinliğinde
azalma
Kontrast duyarlılıkta azalma Renkli görmede azalma Görsel- algısal bozukluk Görme keskinliğinde azalma Kontrast duyarlılıkta azalma
Hareket algı bozukluğu
Snellen eşelleri ile görme keskinliği statik koşullarda ve belli ortamlarda ölçüldüğü için gerçek hayatta olan görme keskinliği ile birebir aynı değildir. Gerçekte ise görsel uyarıcılar retina üzerine çok değişken kontrast ve aydınlanma ile düşmektedir. Aynı zamanda görsel uyarıcılar ve alıcı çoğu zaman hareket halinde
bulunmaktadır. Bu nedenle görsel hayali retinanın optimal alanında tutabilmek için sürekli olarak düzeltici göz hareketlerine gerek duyulmaktadır. Bu bağlamda, hareketli nesnelerin görsel işlenmesi üzerine yaşlanmanın büyük etkisi vardır. Dinamik görme keskinliği ile bağlı yapılan ilk çalışmalar yaşlılığa özgül dinamik bozuklukları ortaya koymuştur. Dinamik görme keskinliği yürüme ve sürüş gibi hareketlerde oldukça önemlidir. Bu bakımdan yaşlılarda sürüş yeteneğinin değerlendirilmesinde statik görme keskinliğinden daha faydalıdır. Dinamik görme keskinliği ölçümü statik görme keskinliği ölçümünden çok zor ve zaman alıcıdır. Aynı zamanda dinamik görme keskinliği ölçümü için rutin klinik pratikte kullanılabilecek standart yöntem yoktur. Yakın zamanda yaşlı bireylerde sinusoidal çizgilerde ve hareket algılamada daha çok bozulma olduğu gösterilmiştir (93-95).
Aynı zamanda yaş arttıkça orta ve yüksek uzaysal frekanslarda kontrast duyarlılık azalır. Kontrast duyarlılıkta azalma lensin bulanıklaşması, senil miyozis gibi optik faktörlerin yanısıra, fotoreseptör ve ganglion hücre dejenerasyonu gibi retinal nöral faktörlerin etkisi ile oluşmaktadır (96-99). Retinanın mekansal ve zamansal niteliklerindeki bu tür değişiklikler yaş açısından eşleştirilmiş kontrol grupları olmadıkça Parkinson hastalığında yapılan görme çalışmalarının sonuçlarını karıştırabilir.
Renkli görme koni hücreleri ile ilişkilidir ve santral retinanın fonksiyonudur. Retina düzeyinde renk bilgisi mavi-sarı ve kırmızı-yeşil yollara ayrılır. Bu renk ayırımı kullanılarak koni ve retinal ganglion hücre alt tipleri belirlenebilir. Yaş arttıkça özellikle mavi-sarı renkleri görmede azalma gelişir. Bu koni disfonksiyonu ve kısa dalga uzunluğuna sahip ışığın bulanık lens tarafından emilimi ile ilişkilidir (100,101). Skotopik görme yaşlanma etkisine daha hassastır ve rod fotoreseptörleri özellikle risk altındadırlar (102-104). Yaşla birlikte rod hücrelerinde olan değişiklikler karanlık adaptasyonunu etkiler.
6. Parkinson Hastalığında Retinal Dopamin
Parkinson hastalığı olan beş hastanın dopaminerjik hücrelerinde tirozin hidroksilaz imunreaktivitesinde azalmanın gösterilmesi insan retinasında dopamin eksikliğinin ilk nörokimyasal kanıtı olmuştur (105). Tirozin hidroksilaz (TH) dopamin sentezinde hız sınırlayıcı bir enzimdir ve dolayısıyla retinada dopamin içeren hücreleri tanımlar. Harnois ve Di Paolo Parkinson hastalarının otopsilerinde
retinal dopamin miktarını incelemişler. Onlar L-DOPA tedavisi almayan hastaların retinasında dopamin miktarının kontrol grubuna veya sonuncu dozunu aldıktan sonra 15 saatten kısa sürede ölen hastalara göre çok daha düşük olduğunu göstermişler (106). Bu tarz insan otopsi çalışmaları çok azdır ve hasta sayıları kısıtlıdır. Bu nedenle bu çalışmaların sonuçlarını çok dikkatli değerlendirmek gerekmektedir. Dopaminerjik hücreleri harap eden 1-metil-4-fenil-1,2,3,6-tetrahidropiridin nörotoksinine maruz kalan maymunların amakrin hücrelerinde doza-bağımlı, ancak geri dönüşümlü tarzda tirozin hidroksilaz imunreaktivitesinin azaldığı gösterilmiştir (107). Bu çalışmalar kısıtlılıklarına rağmen Parkinson hastalarında gelişen elektrofizyolojik ve psiko-fiziksel bozukluklar ile retinal dopamin eksikliği arasında ciddi ilişki olduğunu göstermektedir.
7. Parkinson Hastalığında Görsel Disfonksiyon Kanıtları
7.1 Görme Keskinliği
1990`lı yılların başında yapılan ilk çalışmalarda Parkinson hastalarında görme keskinliğinin azaldığı gösterilmiştir (108). Parkinson hastalarında görme keskinliğinin azalması görsel halüsinasyonların gelişimi için önemli risk faktörüdür (17, 109).
7.2 Kontrast Duyarlılık
Parkinson hastalarında anormal kontrast duyarlılığı gösteren ilk çalışma 1984`de Regan ve Neima tarafından yapılmıştır. Bu çalışmada 10 hasta değerlendirilmiş ve hastaların yarısında normal görme keskinliğine rağmen anormal kontrast duyarlılık saptanmıştır (110). Daha sonra sinusoidal aydınlatmalı dikey çizgilerle yapılan birçok çalışmada farklı uzaysal frekanslardaki kontrast duyarlılıkta azalmanın olduğu gösterilmiştir (111-114). Bodis-Wollner ve Yahr Parkinson hastalarında kontrast duyarlılığın daha çok 4.8 devir/derece uzaysal frekansda azaldığını göstermişler. Normal kontrol grubunda ise bu uzaysal frekansdaki kontrast duyarlılık en yüksek bulunmuştur (115). L-DOPA alan hastaların kontrast duyarlılığında artışın izlenmesi bu değişimin retinal dopamin miktarı ile ilgili olduğunu göstermektedir (116, 117). Motor dalgalanma gösteren Parkinson hastalarının kontrast duyarlılığında da değişim izlenmektedir. Motor olarak aktif
oldukları dönemlerdeki kontrast duyarlılık aynı yaşdaki normal bireylerin kontrast duyarlılığına benzerdir (118).
Kontrast duyarlılık bir dizi günlük etkinlikler için hayati önem taşımaktadır. Kontrast duyarlılıktaki azalma okuma ve sürüş gibi günlük aktiviteleri kısıtlar (96, 119-124). Kontrast duyarlılıktaki bu tarz azalma retina yüksek ışıklanma seviyesinden düşük ışıklanma seviyesine geçtiği zaman da görülür (125). Bu dopaminin retinayı fotopik şartlarda görmeye adapte ettiğini gösterir. Diederich görsel halüsinasyonları olan Parkinson hastalarında kontrast duyarlılığın daha düşük olduğunu göstermiştir (126).
7.3 Renkli Görme
Parkinson hastalığında renk görme bozuklukları bildirilmiştir. Renkli görme ile ilgili bilgiler beyine parvoselüler ve konioselüler yollarla iletilirken, akromatik sinyaller magnoselüler yol üzerinden iletilmektedir. Renk görme bozuklukları farklı klinik, psikofiziksel ve elektrofizyolojik testler ile ortaya konabilir. Farnsworth-Munsell 100 Hue testi (FM) ve Lanthony D-15 (D-15) testi en sık kullanılan klinik testlerdir. FM testinde Parkinson hastalarının kontrol grubuna göre daha çok yalnış yaptıkları gösterilmiştir (127-129). Silva ve ark. kompleks psikofiziksel testler kullanarak Parkinson hastalarında kromatik ve akromatik kontrast duyarlılıktaki değişiklikleri araştırmışlar (130). Bu çalışmada parvoselüler, konioselüler ve magnoselüler yollar ayrı ayrı değerlendirilmiştir. Sonuç olarak bu yolların hepsinde anlamlı tutulum görülmüştür. Kırmızı-yeşil renk bozukluğu ise mavi-sarı renk bozukluğundan daha sık bulunmuştur. Kontrast duyarlılıktaki bu tarz değişim yaşlanma ve retinal hastalıklarda da görülmektedir. Ancak bu durumlarda daha çok mavi renk bozukluğu ön plandadır (131, 132). Bu Parkinson hastalığında retinal tutulumun yaşlanma ve yaşa bağlı göz hastalıklarından farklı olduğunu göstermektedir. Renk görme bozukluklarında retinal komponentin rol oynadığını kromatik ve akromatik PERG çalışmaları ortaya koymaktadır (133). Parkinson hastalarında renk görme bozukluğunun esansiyel tremor hastalarına göre daha ciddi olduğu çalışmalarda gösterilmiştir. Motor semptomların şiddeti renk görme bozukluğu ile ilişkilidir (134).
7.4 Motor Algılama
Parkinson hastalarında görme keskinliği ve kontrast duyarlılıktaki değişikliklerden başka motor algılamada da sorunlar görülmektedir (135, 136). Uc ve ark. yararlı görme alanı testi (useful field of vision-UFOV) ve rasgele nokta sinematogramlar kullanarak Parkinson hastalarında ve kontrol grubunda görsel dikkat ve motor algılmayı öğrenmişlerdir (137). UFOV testi görsel uyaranlar (araba siluetleri) santral ve periferik görme alanında ayrı ayrı ve eş zamanlı sunulduğunda görsel işleme hızını, seçici ve bölünmüş görsel dikkati değerlendirmektedir. Rasgele nokta sinematogramlar ise uzaysal rastgele arka plan gürültüsü arasında hareket sinyali sunmak için kullanılır. Parkinson hastaları kontrol grubuna göre görsel dikkat, uzaysal ve motor tespitte daha kötü performans sergilemişlerdir. Motor algılama üzerine retinal komponentin etkisini öğrenmek için görme keskinliği ve kontrast duyarlılık bakılmış, ancak gruplar arasında anlamlı fark bulunamamıştır. Bu motor algılama üzerine kortikal komponentin daha etkili olduğunu göstermektedir. Görsel algılama ve biliş arasında ilişkinin bulunması Parkinson hastalığında görsel algılamadaki bozukluklarda hem retinal, hem de kortikal komponentlerin birlikte rol oynadığını göstermektedir (1).
Castelo-Branco ve ark. Parkinson hastalarında farklı uyaranlar kullanarak hiyerarşik bir şekilde düşük (magnoselüler), orta ve yüksek (dorsal akım) seviyedeki görsel yolları incelemişler (138). Düşük seviye - magnoselüler yolda etkilenme olmasına rağmen bunun motor algılama ile anlamlı ilişkisi bulunamamıştır. Bu çalışmanın sonucuna göre motor algılama bozukluğu yüksek görsel merkezlerin etkilenmesi sonucunda oluşmaktadır. Motor bozukluğun derecesi ile motor algılama arasında ilişkinin olduğu bu çalışmalarda gösterilmiştir.
7.5 Retinanın Yapısal Değişiklikleri
Görsel fonksiyonlardaki değişimler retinadaki makroskopik ve mikroskopik yapısal değişiklikler ile desteklenmektedir. Görsel fonksiyonlardaki bozukluklarda kortikal ve subkortikal faktörlerin birlikte rol oynadığına dair kanıtlar gittikçe artmaktadır. Bu nedenle ayrıca olarak retinanın değerlendirilmesi için yapısal değişikliklerin öğrenilmesi oldukça kıymetlidir. Lewy cismi bulunan 16 demans hastasını araştıran postmortem otopsi çalışmasında fotoreseptör ve retina ganglion hücrelerinde şişme, aynı zamanda dış pleksiform tabakada soluk hücre içi
inklüzyonlar gösterilmiştir. Bu hastaların hepsinde ölüm öncesinde görsel halüsinasyonlar ve flaş-ERG`de bozukluk tespit edilmişti (139).
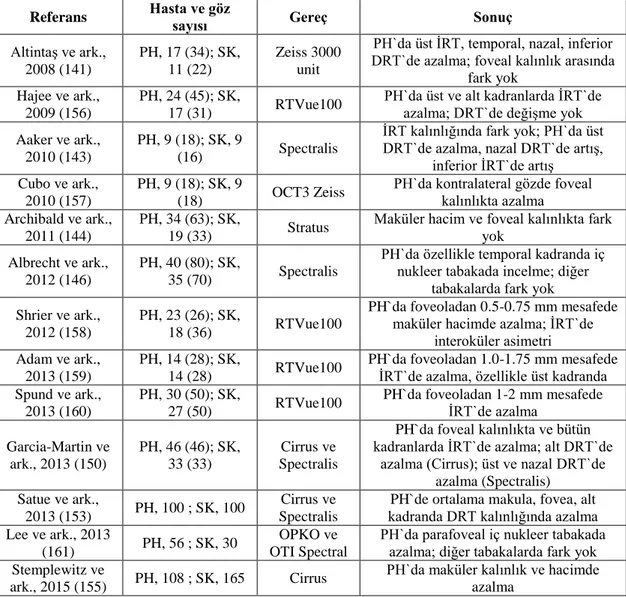
Günümüzde retinanın yapısal değişikliklerini göstermek için girişimsel olmayan yöntemler mevcuttur. Optik koherens tomografi (OKT) bunların en iyi örneğidir. Parkinson hastalığında OKT çalışmaları daha çok peripapiller sinir lifi tabakasının ölçümleri üzerinde yoğunlaşmıştır (Tablo2). Bazı çalışmalarda ise maküler kalınlık ölçümleri araştırılmıştır (Tablo 3). Parkinson hastalarının sinir lifi tabakasında incelme olduğu ilk defa Inzelberg ve ark. tarafından gösterilmiştir (140). Maküler kalınlık ölçümleri RNFL ölçümlerine göre daha yüksek tanısal verimliliğe sahiptir. Bazı çalışmalarda retina dört kadrana ayrılmış ve kadranların tanısal verimliliği ayrı ayrı incelenmiştir. Birçok çalışmanın sonucuna göre Parkinson hastalarında RNFL`de incelme daha çok temporal kadranda görülmektedir. Shrier ve ark. Parkinson hastalarının retinasında iki göz arasında farklılık olduğunu göstermişler (158). Morgia ve ark. sinir lifi tabakasındaki incelmenin etkilenmenin daha çok olduğu vucut tarafindaki gözde değil diğer gözde olduğunu göstermişler (152).
Maküler kalınlık ve hacimdeki azalma daha çok iç retina tabakalarında (İRT) oluşmaktadır (146, 150, 153, 157, 158, 161). Çalışmaların çoğunda dış retinal tabakalarda (DRT) incelmenin olmadığı gösterilmiştir (141, 146, 156, 159-161).
Tablo 2. Parkinson hastalarında peripapiller RNFL kalınlığını araştıran OKT
çalışmaları ve sonuçları (162)
Referans Hasta ve göz sayısı Gereç Sonuç
Inzelberg ve ark., 2004 (140)
PH 10 (10); SK,
10 (10) Bahsedilmemiş
PH`da ortalama RNFL kalınlığında azalma (alt ve temporal kadranda
azalma) Altintaş ve ark., 2008
(141)
PH 17 (34); SK,
11 (22) Zeiss 3000 unit
PH`da ortalama RNFL kalınlığında azalma (üst ve nazal kadranda azalma) Moschos ve ark.,
2010 (142)
PH, 16 (32); SK,
20 (40) Stratus
Ortalama RNFL kalınlığında fark yok, alt ve temporal kadranlarda azalma Aaker ve ark., 2010
(143)
PH, 9 (18); SK, 9
(16) Spectralis RNFL kalınlığında fark yok Archibald ve ark.,
2011 (144)
PH, 34 (66); SK,
18 (35) Stratus RNFL kalınlığında fark yok Tsironi ve ark., 2012
(145)
PH, 24 (24); SK,
24 (24) Stratus RNFL kalınlığında fark yok Albrecht ve ark.,
2012 (146)
PH, 40 (80); SK,
35 (70) Spectralis RNFL kalınlığında fark yok Garcia-Martin ve
ark., 2012 (147) PH, 75 ; SK, 75
Cirrus ve Spectralis
PH`da tüm kadranlarda RNFL kalınlığında azalma; Spectralis daha
sensitif Rohani ve ark., 2012 (148) PH, 27 (54); SK, 27 (50) TOPCON 3D OCT PH`da tüm kadranlarda RNFL kalınlığında azalma (alt ve nazal
kadranda azalma daha çok) Kirbas ve ark., 2013
(149)
PH, 42 (84); SK,
40 (80) Cirrus
PH`da ortalama RNFL kalınlığında azalma (temporal kadranda) Garcia-Martin ve ark., 2013 (150) PH, 46 (46); SK, 33 (33) Cirrus ve Spectralis
PH`da ortalama RNFL kalınlığında azalma (üst, alt, temporal kadranda
azalma) Sen ve ark., 2013
(151) PH, 35 ; SK, 11 Bahsedilmemiş
PH`da ortalama RNFL kalınlığında azalma
La Morgia ve ark., 2013 (152)
PH, 43 (86); SK,
86 (86) Stratus
Ortalama RNFL kalınlığında fark yok, temporal kadranda azalma, kontralateral
göz dominant Satue ve ark., 2013
(153) PH, 100 ; SK, 100
Cirrus ve Spectralis
PH`da ortalama RNFL kalınlığında azalma (alt temporal ve üst temporal
kadranda azalma) Moreno-Ramos ve
ark., 2013 (154) PH, 10 ; SK, 10 Bahsedilmemiş Demansı olan PH`da RNFL`de incelme Stemplewitz ve ark.,
2015 (155) PH, 108 ; SK, 165 Cirrus RNFL kalınlığında fark yok
Tablo 3. Parkinson hastalarında makular kalınlığı araştıran OKT çalışmaları ve
sonuçları (162)
Referans Hasta ve göz sayısı Gereç Sonuç
Altintaş ve ark., 2008 (141) PH, 17 (34); SK, 11 (22) Zeiss 3000 unit
PH`da üst İRT, temporal, nazal, inferior DRT`de azalma; foveal kalınlık arasında
fark yok Hajee ve ark.,
2009 (156)
PH, 24 (45); SK,
17 (31) RTVue100
PH`da üst ve alt kadranlarda İRT`de azalma; DRT`de değişme yok Aaker ve ark.,
2010 (143)
PH, 9 (18); SK, 9
(16) Spectralis
İRT kalınlığında fark yok; PH`da üst DRT`de azalma, nazal DRT`de artış,
inferior İRT`de artış Cubo ve ark.,
2010 (157)
PH, 9 (18); SK, 9
(18) OCT3 Zeiss
PH`da kontralateral gözde foveal kalınlıkta azalma
Archibald ve ark., 2011 (144)
PH, 34 (63); SK,
19 (33) Stratus
Maküler hacim ve foveal kalınlıkta fark yok
Albrecht ve ark., 2012 (146)
PH, 40 (80); SK,
35 (70) Spectralis
PH`da özellikle temporal kadranda iç nukleer tabakada incelme; diğer
tabakalarda fark yok Shrier ve ark.,
2012 (158)
PH, 23 (26); SK,
18 (36) RTVue100
PH`da foveoladan 0.5-0.75 mm mesafede maküler hacimde azalma; İRT`de
interoküler asimetri Adam ve ark.,
2013 (159)
PH, 14 (28); SK,
14 (28) RTVue100
PH`da foveoladan 1.0-1.75 mm mesafede İRT`de azalma, özellikle üst kadranda Spund ve ark.,
2013 (160)
PH, 30 (50); SK,
27 (50) RTVue100
PH`da foveoladan 1-2 mm mesafede İRT`de azalma Garcia-Martin ve ark., 2013 (150) PH, 46 (46); SK, 33 (33) Cirrus ve Spectralis
PH`da foveal kalınlıkta ve bütün kadranlarda İRT`de azalma; alt DRT`de
azalma (Cirrus); üst ve nazal DRT`de azalma (Spectralis)
Satue ve ark.,
2013 (153) PH, 100 ; SK, 100
Cirrus ve Spectralis
PH`de ortalama makula, fovea, alt kadranda DRT kalınlığında azalma Lee ve ark., 2013
(161) PH, 56 ; SK, 30
OPKO ve OTI Spectral
PH`da parafoveal iç nukleer tabakada azalma; diğer tabakalarda fark yok Stemplewitz ve
ark., 2015 (155) PH, 108 ; SK, 165 Cirrus
PH`da maküler kalınlık ve hacimde azalma
PH: Parkinson hastaları, SK: sağlıklı kontrol
Birçok çalışmada RNFL ve makula kalınlığı ile hastalığın şiddeti ve evresi arasında ilişki olduğu gösterilmiştir. RNFL ve makula kalınlığında incelme hastalığın şiddeti ve evresi arttıkça artmaktadır. Diğer taraftan RNFL ve makula kalınlığı azaldıkça kontrast duyarlılık ve renkli görmede azalma, görsel halüsinayonlarda artış izlenmektedir (162).
Sinir lifi tabakası retinal ganglion hücrelerinin aksonlarından oluşur. Dopaminerjik hücreler ve onları birbirine bağlayan pleksus ganglion hücre tabakasından altta yer alır ve onların aksonları direk olarak sinir lifi tabakasına girmez. Bu durumda sinir lifi tabakasındaki incelme retinal dopamin miktarının
sinuklein proteini ile ilişkilidir (163). Bu protein embriyonel dopaminerjik hücre kültürlerinde toksisiteye neden olur. Otopsi çalışmaları Parkinson hastalarında bazı dopaminerjik olmayan hücrelerde de yanlış-katlanmış alfa-sinuklein kümeleri olduğunu göstermiştir. Vagus siniri, olfaktör bulbus ve retina hücreleri bunlara örnek olabilir (164, 165). Retinada alfa-sinuklein iç pleksiform tabakadaki dopaminerjik amakrin hücrelerde ve dopaminerjik olmayan ganglion hücrelerinde bulunmuştur (166).
Parkinson hastalığı foveal remodeling ile sonuçlanmaktadır. İç retinal tabakadaki incelme en çok foveal avasküler zonu (FAZ) çevreleyen parafoveal alanda (0.5-1.5 mm yarıçap) izlenir (167). Bu nedenle Parkinson hastalarında iç parafovel kalınlığın (İPK) iç foveal kalınlığa (İFK) olan oranı (İPK/İFK) azalır. Aynı zamanda FAZ küçülür. Parkinson hastalarında foveal incelme hastalığın süresi ile düz, FAZ alanı ile ise ters orantılıdır. Çünkü, foveal incelme arttıkça parafovel kapillerlerde uzama ve dallanma artışı görülür. Bunun sonucunda ise FAZ alanı küçülür. Foveal kapilerlerdeki uzamanın nedeni tam belli değildir (167, 168). İnsan retinasındaki dopaminerjik nöronlar foveal avasküler zonda yer almaktadır (169). Farmokolojik Parkinson hayvan modellerinde dopaminerjik nöronların çevresindeki kapiler endotel hücrelerinde hasar olduğu gösterilmiştir (170). Foveal dopaminerjik nöronlardaki hasar kapiller yatakta vaskulogenezi indüklemektedir (171). Ganglion hücrelerinin bu etkisi azdır. Bu nedenle primer hasarın retinal ganglion hücrelerinde olduğu glokom hastalığında FAZ`da değişiklik görülmez (172). Ancak sinir lifi tabakasındaki incelme yaş, glokom, Alzheimer hastalığı, multipl skleroz ve diğer durumlarda da görülmektedir. Bu nedenle daha geniş hasta sayılı kohort çalışmalarına gerek duyulmaktadır.
7.6 VEP ve ERG
Retinanın görsel uyaranlara karşı verdiği cevap gözde elektriksel aktivite oluşturmaktadır. Bu elekriksel aktivite görme yolları ile birincil görme korteksine ulaşır. Bu elektriksel cevapların latans ve amplitüdlerinin ölçümü bize görsel yolların fonksiyonel bütünlüğü ile ilgili bilgiler verir. Hem elektroretinogram (ERG), hem de görsel-uyarılmış potansiyel (visual-evoked potential-VEP) ölçümleri Parkinson hastalarında detaylı çalışılmıştır (1). İlk defa Bodis-Wollner ve Yahr Parkinson hastalarında VEP latansında uzama saptamışlar (115). Daha sonra yapılan birçok
başka çalışmaların sonuçları da bunu desteklemiştir (110, 173-176). VEP latansındaki bu değişiklikler L-DOPA tedavisi ile geri döndürülebilir. Aksine olarak haloperidol gibi dopaminerjik blokatörlerin kullanımı Parkinson hastalarında olduğu gibi VEP latansında uzamaya neden olur (177). Görsel uyaranın özelliklerine bağlı olarak aynı hastada hem normal, hem de anormal sonuçlar elde edilebilir (175).
Pattern ERG (PERG) daha çok iç retinal tabakaların, özellikle de retina ganglion hücrelerinin elektriksel aktivitesini değerlendirmek için kullanılır (178). PERG cevapı kullanılan kafesin veya satranç tahtasının uzaysal, zamansal ve kontrast özelliklerine bağlıdır. Yapılan çalışmalarda Parkinson hastalarında PERG latans ve amplitüdünde bozulma olduğunu gösterilmiştir (114, 133, 174, 179-182). Parkinson hastalarında daha çok orta uzaysal frekansdaki uyarılara karşı PERG cevabında bozulma görülmüştür (183). Bu değişiklikler ilerleyici olabilir ve genellikle L-DOPA tedavisine yanıt verirler (176, 184). Normal kontrol grubuna seçici D2 reseptör antagonisti olan sulpirid verilmesi Parkinson hastalarında olduğu gibi orta uzaysal frekansdaki uyarılara karşı PERG cevabında bozulmaya neden olur (185). Hem D1, hem de D2 dopamin reseptörlerine afinite gösteren dopamin reseptör antagonisti haloperidol ise bu etkiye sahip değildir (186). Bu sonuçlar farklı uzaysal frekanslardaki PERG cevabında dopaminin D2 reseptör bağımlı etkisinin önemli rol oynadığını göstermektedir.
Ghilardi ve ark. sistemik MPTP vererek maymunlarda deneysel Parkinson sendromu oluşturmuşlar. Post-mortem maymunların retinal dopamin miktarında azalma olduğunu saptamışlar (187). Aynı zamanda bu maymunların PVEP ve PERG ölçümlerinde amplitüdde azalma ve latansta uzama saptanmıştır. L-DOPA tedavisi ise hem Parkinson bulgularında, hem de PVEP ve PERG ölçümlerinde iyileşmeye neden olmuştur (188). İntraoküler 6-hidroksidopamin (6-OHDA) enjeksiyonu ile lokal dopaminerjik fonksiyon harap edilen maymunlarda da PERG cevabında uzaysal frekans bağımlı kayıp görülmüş, L-DOPA enjeksionu ile ise düzelme saptanmıştır (189, 190).
7.7 Görme Alanı
Glokomatöz optik atrofide olduğu gibi Parkinson hastalığı, Alzheimer hastalığı ve diğer nörodejeneratif hastalıklarda da retinal ganglion hücre apoptozisi görülmektedir (191). Parkinson hastalığında apoptozis sitokin ve glutamat gibi
eksitotoksinlerin miktarının artması ve/veya sinir büyüme faktöru (nerve growth NGF), beyin kaynaklı nörotrofik faktör (brain-derived neurotrophic factor-BDNF) gibi nörotrofinlerin miktarının azalması sonucunda oluşmaktadır (192-194). Eksitotoksisite glokomatöz süreçde ganglion hücre ölümüne neden olan faktörlerden biridir. N-metil-D-aspartat (NMDA) tip glutamat reseptörlerinin aktivitesi aşırı derecede artar ve bu hücrelerde apatozisi indükler. Glokom hastalarının ve deneysel glokom modellerinin vitreusunda eksitatör amino asit olan glutamatın miktarı oldukça yüksektir (195). Deneysel glokom modellerinde Parkinson hastalığının tedavisinde kullanılan NMDA reseptör antagonisti memantinin kullanılması ganglion hücre kaybını anlamlı derecede azaltmaktadır (196).
Glokom hastalığında nörotrofinlerin miktarının azalması sonucunda retrograd aksonal transport bloke olur ve apoptozis indüklenir. Parkinson hastalığında nigrostrial dopamin alanlarında NGF, BDNF gibi nörotrofinlerin miktarı azalır. Beyin-omurilik sıvısında ise glutamat miktarı artar. Yani, Parkinson ve glokom hastalığında apoptozisi indükleyen faktörler benzerdir (192). Bu nedenle Parkinson hastalarında glokom benzeri görme alanı kayıpları görülebilir (197). Bundan başka Bayer ve ark. Parkinson hastalarında gokom insidansının arttığını göstermişler (198). Yeni yapılan çok merkezli kontrollü kohort çalışmasında primer açık açılı glokomu (PAAG) olan hastalarda 8 yıllık takip süresinde Alzheimer ve Parkinson hastalıklarının gelişim insidansını araştırmışlar. Sonuç olarak PAAG`u olan hastalarda Alzheimer hastalığı insidansı daha yüksek saptanmıştır. Parkinson hastalığının insidansı ise normal populasyona benzer bulunmuştur (199).
Parkinson hastalığının tedavisinde kullanılan anti-apoptotik ilaçlar glokom hastalığında da nöron koruyucu etki göstererek hastalığın ilerlemesini durdurabilir (197).
Parkinson hastalığında retinada ve optik sinirde hem yapısal, hem de işlevsel
değişiklikler gelişmektedir. Parkinson hastalarında görme keskinliği ve kontrast duyarlılıkta azalma, renk görme bozuklukları, retina sinir lifi tabakasında incelme, makular kalınlıkta azalma, elektrofizyolojik testlerde değişiklikler, görme alanı ve motor algılama bozuklukları bildirilmiştir (1).C. GEREÇ VE YÖNTEM
Çalışma tek merkezli kontrollü randomize klinik çalışma olarak tasarlandı. Ege Üniversitesi Tıp Fakültesi Nöroloji kliniğinde erken dönem (Hoehn ve Yahr Evre 1 ve Evre 2) Parkinson hastalığı tanısıyla takip edilen hastalar ve yaşa göre eşleştirilmiş sağlıklı bireyler çalışmaya dahil edildi. Çalışma için Ege Üniversitesi Tıp Fakültesi Hastanesi`nin etik kurulu onayı alındı. Hastalara ve sağlıklı bireylere uygulama öncesi ayrıntılı bilgi verilerek, aydınlatılmış onam formu imzalatıldı. Helsinki Deklarasyon prensiplerine uygun olarak hareket edildi.
Erken dönem Parkinson hastalığı (Hoehn ve Yahr Evre 1 ve Evre 2) olan 19 hastanın 38 gözü ve yaşa göre eşleştirilmiş 19 sağlıklı kontrolün 38 gözü çalışmaya dahil edildi. Modifiye Hoehn ve Yahr sınıflandırmasına göre 15 hastada Evre 1, 4 hastada Evre 2 hastalık mevcuttu. Evre 1 hastalığı olan 15 hastanın 5`inde vücudun sağ tarafı, 10`unda ise sol tarafı etkilenmişti. Tüm hastalar başlangıç muayenede ve takip süresi boyunca anti-Parkinson ilaç (L-DOPA, Selegilin, Rasagilin, Pramipexol, Ropinirol) kullanmaktaydı. Yüksek miyopisi (>-6.0 dptr), astigmatı (>3 dptr), glokomu, yoğun kataraktı (LOCS III sınıflandırmasına göre Grade 3 ve üzeri) , konjenital veya edinsel makula veya optik sinir hastalığı olanlar, herhangi bir göz cerrahisi geçirenler, diyabetes mellitus ve hipertansiyonu olan hastalar çalışma dışı bırakıldı.
Tüm olgulara Snellen eşeli ile en iyi düzeltilmiş görme keskinliği (EİDGK), biyomikroskopik ön ve arka segment muayenesi, Goldmann aplanasyon tonometrisi ile GİB ölçümü, pupil ışık reaksiyonu muayenesi yapıldı.
Kontrast duyarlılık ölçümü MetroVision cihazı ile yapıldı. MetroVision (Monopack 3, France) cihazı ile kontrast duyarlılık değerlendirmesi, fotopik koşullarda, 0.4-15 devir/derece arasındaki uzaysal frekanslarda kontrast duyarlılık değerleri belirlenerek yapıldı. Test sonunda her bir uzaysal frekansa karşılık gelen kontrast duyarlılık değeri eğri şeklinde belirlendi (kontrast duyarlılık fonksiyonu). Test edilecek göz açık bırakılarak, hasta cihaz ekranına 2 metre uzakta oturtuldu. Hastadan, yüksek uzaysal frekanslardan başlayarak düşük uzaysal frekanslara doğru değişen her çizgisel uyaran için giderek artan kontrastta sinusidal uyaranların gösterildiği ekrana bakması, ekrandaki çizgileri fark ettiği anda da eline verilen düğmeye basması istenildi. Böylece 0.4-15 devir/derece arasındaki uzaysal frekanslardaki her nokta için kontrast duyarlılık ölçümleri yapıldı ve test sonunda
cihaz ekranında oluşan kontrast duyarlılık eğrisinde normal eğriye göre sapma olup olmadığı değerlendirildi.
Renkli görme İshihara psödoizokromatik kartları (Optitech Eyecare, Allahabad, India) ile test edildi. Test 75 cm mesafeden 300-500 Lux suni aydınlatmada presbiyobik tashih yapılarak her sayfa için 2-5 sn süre verilerek değerlendirildi. Otuzsekiz kartlı İshihara testi kullanıldı. İlk 22 kart ile (transformasyon, sıfırlanma-vanishing ve gizli haneli-hidden digit) kırmızı-yeşil renk görme bozukluğu tespit edilmeyenlerde ayırım (diferensasyon) kartları test edilmedi. İlk 22 kart ile kırmızı-yeşil renk görme bozukluğu tespit edilen bireylerde ise ayırım kartları (22.-27. kartlar) test edilerek renk görme bozukluğunun tipi belirlendi.
Görme alanı ölçümü standart otomatize perimetri (SOP) yardımıyla 31.5 apostilb (asb) aydınlatmalı beyaz fonda III (4 mm2
) boyutlu beyaz uyaran ile 60 derecelik görme alanını değerlendiren iki alan stratejili tüm alan 120 nokta eşik tarama testi kullanılarak yapıldı (Humphrey Field Analyzer II). Görme alanı testi farmakolojik miyozis veya midriyazis oluşturmadan normal çaplı pupil ile gerçekleştirildi. Refraksiyon kusuru olan veya presbiyop olan bireylerde düzeltme camları kullanıldı. Hasta verileri, yaş ve pupil çapı kaydedildi. Büyütülmüş kızılötesi kamara görüntüsü kullanılarak fiksasyon her iki dakikada bir monitörize edildi. Fiksasyon "pencere"sini belirlemek için her test öncesinde sanal imleçler manüel olarak hizalandırıldı. Sanal imleçlerin pupil kenarının dışına çıktığı durumlarda fiksasyon düzelene kadar test durduruldu. Test süresi her göz için yaklaşık 7 dakika idi. Kör noktası belirlenemeyen, fiksasyon kaybı %20`nin üzerinde, yanlış negatif ve yanlış pozitif sonuçları ise %33`ün üzerinde olan görme alanları güvenilir kabul edilmedi ve sonuçları incelenmedi. Tüm görme alanı çıktıları 2 oftalmolog (ÖÜ ve SH) tarafından değerlendirildi. Tüm alan, nazal, temporal, üst ve alt yarım alanlardaki görülmeyen noktalar sayıldı ve istatistiksel olarak incelendi.
Tüm olgulara, standart test koşulları altında desen görsel uyarılı potansiyel (VEP) kaydı yapıldı. Desen VEP kayıtları, hem hasta hem de kontrol grubu için, Metrovision (Monopack 3, France) elektrofizyoloji cihazı ile yapıldı. Kayıt için kullanılan gümüş elektrotlardan aktif olanı eksterna protuberentia occipitalis’ in 2 cm üzerine, referans elektrot vertekse, toprak elektrot ise alına yerleştirildi. Desen uyaran olarak, dönüşümlü dama tahtası deseni kullanıldı ve göze geliş açısı 30 dk olarak ayarlandı. Desen uyaranlar 15 inçlik bir monitör aracılığıyla hastalara gösterildi ve hastalar gözleri ile monitör arası mesafe 100 cm olacak şekilde izole
oda içerisindeki rahat bir koltuğa oturtuldular. Ekran aydınlanması 100 cd/m², beyaz ve siyah kareler arası kontrast %99, desen dönüşüm hızı 2/sn, analiz süresi 300 msn idi. Diğer göz ışık alamayacak şekilde kapatılarak bir gözün kayıtları elde edildi. Her bir olgu için P100 dalgası latans ve amplitüd değerleri kaydedildi.
Optik koherens tomografi için 3D OCT-2000 (Topcon Inc., Japan) kullanıldı. Çekimler iki teknisyen tarafından uygulandı. Bu model tarama için 840 nm dalga boyunda ışınlar kullanmaktadır. A-tarama hızı 27.000 A-tarama/sn, tarama derinliği 2.3 mm, yatay çözünürlüğü 20 μm, uzunlamasına çözünürlüğü ise 5-6 μm`dir. Peripapiller retina sinir lifi tabakası kalınlığı ölçümü için 6.0x6.0 mm, 512x128 (512 A taramalardan oluşan 128 yatay tarama hattı) 3D tarama modu kullanıldı. Toplam peripapiller ve 4 kadranın (inferior, superior, nazal, temporal) ayrı ayrı RNFL kalınlığı not edildi. Maküler kalınlık ölçümü için 6.0x6.0 mm, 512x128 (512 A taramalardan oluşan 128 yatay tarama hattı) 3D tarama modu kullanıldı. Ortalama maküler kalınlık (OMK), maküler hacim (MH), santral makula kalınlığı (SMK) not edildi. Aynı zamanda maküler kalınlık haritası ETDRS (Early Treatment Diabetic Retinopathy Study) ızgarası ile 9 sektörde ayrı ayrı olarak değerlendirildi. ETDRS ızgarası 1, 3, 6 mm çaplı 3 daireden oluşmakta ve 1 mm çaplı santral daire foveal kalınlığı göstermektedir. Üç mm çaplı iç ve 6 mm çaplı dış dairelerin her biri 4 sektöre (inferior, superior, nazal, temporal) ayrılmaktadır.
Hastalar ve sağlıklı bireyler ilk muayeneden sonra en az 6 ay arayla toplam 3 kez muayene edildi.
Tanımlayıcı istatistikler ortalama, standart sapma (SS), minimum ve maksimum değerleri ile verildi. Hasta ve kontrol grubun başlangıç ve kontrol muayene ölçümlerinin normal dağılıma uyup uymadığını test etmek için Shapiro Wilk’s normallik testi kullanıldı. Bu testin sonucuna göre normal dağılıma uyan verilerde grup içi karşılaştırılmalarda bağımlı t-testi, gruplar arası karşılaştırmada bağımsız t-testi kullanıldı. Normal dağılıma uymayan verilerde grup içi karşılaştırılmalarda Wilcoxon testi, gruplar arası karşılaştırmada Mann-Whitney testi kullanıldı. Kategorik verilerin (cinsiyet) karşılaştırılmasında ki- kare testi kullanıldı. Analizlerde 0,05' den küçük p değerleri istatistiksel olarak anlamlı kabul edildi. Analizler SPSS (Statistical Package for Social Science, Worldwide Heaquarters SPSS Inc.) 18.0 paket programı ile gerçekleştirildi.
D. BULGULAR
Çalışmaya Temmuz 2013 ve Ağustos 2015 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Nöroloji kliniğinde erken dönem (Hoehn ve Yahr Evre 1 ve Evre 2) Parkinson hastalığı tanısıyla takip edilen 19 hasta (38 göz) dahil edildi. Hastaların yaşları 44 ile 70 yıl arasında değişmekte olup ortalama 54.39±5.71 yıl idi. Yaşa göre eşleştirilmiş 19 sağlıklı birey (38 göz) kontrol grubunu oluşturdu. Kontrol grubunda yaş 42 ile 65 yıl arasında değişmekte olup ortalama 55.53±6.48 yıl idi. Yaş açısından iki grup arasında istatistiksel olarak anlamlı fark yoktu (t-testi, p=0.422).
Hasta grubunda 5 (%26.3) erkek ve 14 (%73.7) kadın hasta bulunurken, kontrol grubunda 15 (%78.9) erkek ve 4 (%21.1) kadın bulunmakta idi. Cinsiyet açısından gruplar arasında anlamlı fark vardı (ki-kare testi, p<0.001).
Modifiye Hoehn ve Yahr sınıflandırmasına göre 15 (%78.9) hastada Evre 1, 4 (%21.1) hastada Evre 2 hastalık mevcuttu. Evre 1 hastalığı olan 15 hastanın 5 (%33.3)`inde vücudun sağ tarafı, 10 (%66.7)`unda sol tarafı etkilenmişti. Hastalık süresi 3 ile 180 ay arasında değişmekte olup ortalama 47.21±41.15 ay idi. Tüm hastalar başlangıç muayenede ve takip süresi boyunca anti-Parkinson ilaç (L-DOPA, Selegilin, Rasagilin, Pramipexol, Ropinirol) kullanmaktaydı.
Hasta grubunda ortalama takip süresi 19±8.5 ay (6-35 ay arası) idi. İlk muayene ile ikinci muayene arasındaki süre ortalama 9.53±3.8 ay (6-17 ay arası), ikinci muayene ile üçüncü muayene arasıdaki süre ise ortalama 12±4.3 ay (5-18 ay arası) idi. Kontrol grubunda ortalama takip süresi 15.15±2.7 ay (12-20 ay arası) idi. İlk muayene ile ikinci muayene arasındaki süre ortalama 9.26±2.8 ay (6-14 ay arası), ikinci muayene ile üçüncü muayene arasıdaki süre ise ortalama 5.8±0.9 ay (4-8 ay arası) idi. Toplam takip süresi açısından iki grup arasında anlamlı fark izlenmedi (Mann-Whitney U testi, p=0.191).
Hem hasta, hem de kontrol grubunda ilk ve ikinci muayenenin her birinde 19 bireyin 38 gözü muayene edildi. Üçüncü muayenede hasta grubunda 15 hastanın 30 gözü, kontrol grubunda ise 19 hastanın 38 gözü muayene edildi. 4 hastaya ulaşılamadığı için üçüncü muayeneleri yapılamadı.
EİDGK hasta grubunda ilk muayenede ortalama 0.90±0.14 (0.4-1.0 arası), ikinci muayenede 0.86±0.19 (0.4-1.0 arası), üçüncü muayenede 0.85±0.22 (0.4-1.0 arası) idi. Hasta grubunda EİDGK ikinci ve üçüncü muayenede birinci muayeneye göre anlamlı derecede daha düşük idi (Wilcoxon testi, p=0.036; p=0.017). İkinci ve
üçüncü muayeneler arasında istatistiksel olarak anlamlı fark yoktu (Wilcoxon testi, p=0.190). Takiplerde 6 hastanın 8 gözünde 2 sıra ve üzeri EİDGK azalması saptandı. İki hastanın 2 gözünde 2 sıra, 1 hastanın 1 gözünde 3 sıra, 1 hastanın 1 gözünde 4 sıra, 1 hastanın sağ gözünde 4 sıra, sol gözünde 6 sıra, 1 hastanın sağ gözünde 2 sıra, sol gözünde ise 3 sıra azalma vardı. Dört hastanın altı gözündeki EİDGK azalmasının katarakt ilerlemesi nedeni ile olduğu saptandı. Üç hastanın 3 gözüne EİDGK değerinin 0.5 ve altında olması nedeni ile katarakt ameliyatı kararı verildi ve 2 göze katarakt ameliyatı uygulandı. Katarakt ameliyatı uygulanan her iki gözde de ameliyattan sonraki görme keskinliği 1.0 düzeyinde idi. EİDGK kontrol grubunda ilk muayenede ortalama 0.99±0.01 (0.9-1.0 arası), ikinci ve üçüncü muayenede ise 1.0±0.00 idi. Kontrol grubundaki hiçbir olguda takip süresince EİDGK`de azalma saptanmadı ve muayeneler arasında fark izlenmedi (Wilcoxon testi, p=0.324). EİDGK açısından ilk muayenede gruplar arası fark izlenmedi (Mann-Whitney testi, p=985). İkinci ve üçüncü muayenede EİDGK hasta grubunda kontrol grubuna göre anlamlı derecede daha düşük olduğu saptandı (Mann-Whitney testi, p<0.05) (Tablo 4 ve 5).
Tablo 4. EİDGK değerleri
EİDGK (Snellen) Ortalama±SS
Hasta grubu Kontrol grubu
M1 M2 M3 M1 M2 M3
0.90±0.14 0.86±0.19 0.85±0.22 0.99±0.01 1.0±0.00 1.0±0.00
EİDGK: en iyi düzeltilmiş görme keskinliği, M1: ilk muayene, M2: ikinci muayene, M3: üçüncü muayene, SS: standart sapma
Tablo 5. EİDGK açısından grup içi ve gruplar arası karşılaştırma
Grup içi karşılaştırma (P değeri) Gruplar arası karşılaştırma (P değeri) Hasta grubu Kontrol grubu
M1-M2 M1-M3 M2-M3 M1-M2 M1-M3 M2-M3 M1 M2 M3 0.036 0.017 0.190 0.324 0.324 0.324 0.985 0.000 0.033
EİDGK: en iyi düzeltilmiş görme keskinliği, M1: ilk muayene, M2: ikinci muayene, M3: üçüncü muayene
Hasta grubunda ölçülen GİB değerleri, ilk muayenede ortalama 13.4±4.1 mmHg (8-17 mmHg arası), ikinci muayenede 15.0±3.7 mmHg (9-19 mmHg arası), üçüncü muayenede 15.0±2.5 mmHg (10-18 mmHg arası) idi. İkinci ve üçüncü muayenedeki GİB değerleri ilk muayeneye göre anlamlı derecede daha yüksek