T.C
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
SIĞIRLARIN VĐRAL SOLUNUM YOLU
ENFEKSĐYONLARININ
SEROLOJĐK OLARAK ARAŞTIRILMASI
Emel GÜRSES
YÜKSEK LĐSANS TEZĐ
BĐYOLOJĐ ANABĐLĐM DALI
T.C
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
SIĞIRLARIN VĐRAL SOLUNUM YOLU ENFEKSĐYONLARININ SEROLOJĐK
OLARAK ARAŞTIRILMASI
EMEL GÜRSES YÜKSEK LĐSANS TEZĐ BĐYOLOJĐ ANABĐLĐM DALI
Bu tez 10/06/2008 tarihinde aşağıdaki jüri tarafından oybirliği / oyçokluğu ile kabul edilmiştir.
__________________ __________ _________
Yrd. Doç. Dr. Rüstem DUMAN Prof. Dr. Sibel YAVRU Prof. Dr. Atilla ŞĐMŞEK (DANIŞMAN) (ÜYE) (ÜYE)
ÖZET Yüksek Lisans Tezi
SIĞIRLARIN VĐRAL SOLUNUM YOLU ENFEKSĐYONLARININ SEROLOJĐK OLARAK ARAŞTIRILMASI
Emel GÜRSES
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
Danışman : Yrd. Doç. Dr. Rüstem DUMAN 2008, 52 Sayfa
Jüri : Prof. Dr. Sibel YAVRU Prof. Dr. Atilla ŞĐMŞEK
Yrd. Doç. Dr. Rüstem DUMAN
Bu araştırmada, Konya ve çevresindeki geçmişinde solunum sistemi hastalık semptomlarına sahip olduğu bilinen süt sığırlarında Infectious Bovine Rhinotracheitis (IBR), Bovine Viral Diarrhea Virus (BVDV), Bovine Respiratory Syncytial Virus (BRSV), Parainfluenza Virus tip 3 (PIV-3) ve Bovine Adenovirus tip 3 (BAV-3) enfeksiyonlarının seroprevalansı araştırıldı. Bu amaçla, özel çiftliklerde bulunan 1 yaş ve üzeri 180 hayvandan kan örneği alındı. Bu örnekler IBR, BVDV, BRSV, PIV-3 ve BAV-3’ e karşı antikorların varlığı yönünden ticari olarak temin edilen Enzyme Linked Immunosorbent Assay (ELISA) ile test edildi.
ELISA ile yapılan serolojik kontrol neticesinde, 46 hayvanda (% 25.55) IBR’ ye karşı, 173 hayvanda (% 96.11) BVDV’ ye karşı, 172 hayvanda (% 95.55) BRSV’ ye karşı, 164 hayvanda (% 91.11) PIV-3’ e karşı ve 150 hayvanda (% 83.33) BAV-3’ e karşı spesifik antikor varlığı tespit edildi.
Antikorlar yönünden test edilen sığırlarda, serumların % 1.66’ sı sadece bir virus yönünden pozitifti. Serumların % 3.33’ ü 2 virusa, % 17.22’ si 3 virusa, %
54.44’ ü 4 virusa ve % 22.77’ si 5 virusa karşı antikorlara sahipti. Bununla birlikte 180 serumun % 0.55’ inde antikor tespit edilmedi.
Anahtar Kelimeler: süt sığırı, solunum sistemi virusları, seroloji, ELISA. .
ABSTRACT Master Thesis
SEROLOGICAL INVESTIGATION OF VIRAL RESPIRATORY TRACT INFECTIONS IN CATTLE
Emel GÜRSES Selçuk University
Institute of Natural and Applied Sciences Department of Biology
Supervisor : Assis. Prof. Dr. Rüstem DUMAN 2008, 52 Page
Jury : Prof. Dr. Sibel YAVRU Prof. Dr. Atilla ŞĐMŞEK
Assis. Prof. Dr. Rüstem DUMAN
In this research, dairy cattle from Konya and its surrounding, in the past as known as which have respiratory system symptoms for seroprevalence of the infections for Infectious Bovine Rhinotracheitis (IBR), Bovine Viral Diarrhea Virus (BVDV), Bovine Respiratory Syncytial Virus (BRSV), Parainfluenza Virus type 3 (PIV-3) and Bovine Adenovirus type 3 (BAV-3). For that purpose, the blood samples were taken from the one year old and over 180 animals, which were in the private farms. These samples were tested for specific antibodies were detected against IBR, BVDV, BRSV, PIV-3 and BAV-3 by means of a commercially available Enzyme Linked Immunosorbent Assay (ELISA).
At the end of the serological control by ELISA, specific antibody presence was detected against IBR in 46 (25.55%), BVDV in 173 (96.11%), BRSV in 172 (95.55%), PIV-3 in 164 (91.11%) and BAV-3 in 150 (83.33%) animals.
In the cattle tested for antibodies, 1.66% were positive for only one virus, 3.33% of sera had antibodies to two viruses, 17.22% of sera had antibodies to three viruses,
54.44% of sera had antibodies to four viruses and 22.77% of sera had antibodies to five viruses. However antibodies were not detected in 0.55% of the 180 sera.
ÖNSÖZ
Bana bu konuda çalışma olanağı veren Danışman Hocam Sayın Yrd. Doç. Dr. Rüstem DUMAN’a, çalışmamın tüm aşamalarında yardım ve desteklerini gördüğüm aynı zamanda Selçuk Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı’nın tüm olanaklarından faydalanmamı sağlayan Sayın Hocam Prof. Dr. Sibel YAVRU’ya, çalışmam süresince bana yardımcı olan Selçuk Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı’ndaki Araştırma Görevlisi ve Doktora Tezi yapan arkadaşlarıma, bu araştırmayı proje olarak kabul eden ve maddi açıdan destekleyen Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü’ne ve tez çalışmam boyunca benden sabrını ve desteğini esirgemeyen aileme teşekkürü bir borç bilirim.
ĐÇĐNDEKĐLER
ÖZET... iii ABSTRACT... v ÖNSÖZ ... vii ĐÇĐNDEKĐLER ... viii SĐMGELER VE KISALTMALAR... ix 1. GĐRĐŞ ... 1 2. KAYNAK ARAŞTIRMASI ... 2 3. MATERYAL VE METOT ... 15 3.1.Materyal ... 153.1.1. Araştırmada kullanılan şüpheli kan serumları…... 15
3.2. Metot ... 15
3.2.1. Enzyme linked immunosorbent assay (ELISA) ... 15
3.2.1.1. Testin bileşenleri... 16
3.2.1.2. Testin prensibi...17
3.2.1.3. Prosedür ... 18
3.2.1.4. Sonuçların değerlendirilmesi ... 19
4. ARAŞTIRMA SONUÇLARI ... 21
4.1. Şüpheli Serumlarla Yapılan ELISA Testi Sonuçları ... 21
5. TARTIŞMA. ... 31
6. SONUÇ ... 43
SĐMGELER
Kısaltmalar
AGPT : Agar Jel Presipitasyon Testi.
Aubek : Auburn University, Bovine Embriyonic Kidney Cell Line- Sığır Embriyonik Böbrek Hücre Kültürü.
BAV : Bovine Adenovirus- Sığır Adenovirus. BHV-1 : Bovine Herpes Virus-1.
BLV : Bovine Leukemia Virus.
BRSV : Bovine Respiratory Syncytial Virus. BT : Bluetongue-Mavidil.
BVDV : Bovine Viral Diarrhea Virus. CF : Komplement Fiksasyon.
CK : Canine Kidney – Köpek Böbrek Hücresi. CPE : Cytopathologic Effect – Sitopatolojik Efekt. DNA : Dezoksiribonükleik Asit.
ELISA : Enzyme Linked Immunosorbent Assay. EF : Ephemeral Fever.
FAT : Flouresan Antikor Testi.
FBL : Fetal Bovine Lung – Fötal Sığır Akciğer Hücre Kültürü. FDB : Fötal Dana Böbrek Hücre Kültürü.
HI : Hemaglutinasyon Đnhibisyon. IBR : Infectious Bovine Rhinotracheitis. IFT : Immunofloresan Testi.
IP : Immunperoksidaz.
IPV : Infectious Pustular Vulvovaginitis. kb : Kilobase.
MD :Mucosal Disease.
MDBK : Madin Darby Bovine Kidney – Devamlı Dana Böbrek Hücre Kültürü. MDCK : Madin Darby Canine Kidney - Devamlı Köpek Böbrek Hücre Kültürü. ncp : non cytopathogenic – sitopatojen olmayan.
NK : Negatif Kontrol. nm : Nanometre.
PCR : Polimerase Chain Reaction – Polimeraz Zincir Reaksiyonu. PK : Pozitif Kontrol.
PLA : Immunperoksidaz Testi – Peroxidase Linked Antibody Assay. PIV-3 : Parainfluenza Virus-3.
RNA : Ribonükleik Asit.
RPHA : Reverse Passive Hemagglution - Ters Pasif Hemaglutinasyon. SN : Serum Nötralizasyon.
SNT : Serum Nötralizasyon Testi.
1.
GĐRĐŞ
Sığırlarda solunum sisteminde hastalığa neden olan viral enfeksiyonlar tüm dünyada yaygın olarak bulunmakla beraber özellikle gelişmekte olan ve ekonomisinde hayvancılığın önemli yer tuttuğu ülkelerde ekonomik kayıplara neden olmaktadır. Günümüzde insanlığın beslenmesinde hayvansal proteinlerin önemi her geçen gün artmaktadır. Bunun için gerek besi gerekse süt sığırcılığında en ufak bir ihmal bile büyük enfeksiyonların yayılmasına ve telafisi zor kayıplara neden olmaktadır.
Sığırların viral kaynaklı respiratorik sistem hastalıkları oldukça yaygındır ve genellikle ekonomik ve ticari öneme sahiptir. Solunum sistemi enfeksiyonlarına neden olan viral etkenler arasında Parainfluenza Virus-3 (PIV–3), Bovine Respiratory Syncytial Virus (BRSV), Infectious Bovine Rhinotracheitis (IBR), Bovine Adenovirus tip 3 (BAV–3) ve Bovine Viral Diarrhea Virus (BVDV) en önemli yeri tutarlar.
Đç Anadolu bölgesi ekonomisinde evcil hayvan yetiştiriciliği büyük önem taşımaktadır. Konya ve çevresi yerleşik hayvanların yararlanma alanını oluşturduğu gibi aynı zamanda hayvan hareket yollarında önemli bir kavşak durumundadır. Bu durumdan da anlaşılacağı gibi çevre otlakları zaman zaman yoğun hayvan hareketlerine sahne olmakta, bu da yeterli önlemlerin alınmaması sonucu bazı problemleri beraberinde getirebilmektedir.
Bu çalışma, özel hayvancılık işletmelerinde bulunan geçmişinde solunum sistemi hastalık semptomlarına (beden ısısı normalden yüksek, burun ve gözyaşı akıntısı, durgunluk tablosu, vs.) sahip olduğu bilinen bir yaş ve üzeri aşılanmamış 180 adet sütçü sığırdan alınan kan serumunda Parainfluenza Virus-3 (PIV–3), Bovine Respiratory Syncytial Virus (BRSV), Infectious Bovine Rhinotracheitis (IBR) , Bovine Adenovirus tip 3 (BAV- 3) ve Bovine Viral Diarrhea Virus (BVDV) enfeksiyonlarının varlığının serolojik olarak ortaya konması amacıyla yapılmıştır.
2. KAYNAK ARAŞTIRMASI
Sığırlarda viral solunum sistemi enfeksiyonları zaman zaman klinik belirtiler ile ortaya çıkmakla birlikte daha çok subklinik olarak seyretmektedir. Bu hastalıkların en önemlileri; Adenovirus, Parainfluenza Virus-3 (PIV-3), Bovine Respiratory Syncytial Virus (BRSV), Infectious Bovine Rhinotracheitis (IBR) ve Bovine Viral Diarrhea Virus (BVDV) enfeksiyonlarıdır. Bu enfeksiyonlar yetiştiricilik açısından önem taşımakta ve akut enfeksiyon sonrası kondisyon kaybı, süt veriminde azalma, gelişmede gerileme ve pnömoni nedeniyle ekonomik kayıplara yol açarlar. Çeşitli viral ve bakteriyel etkenler ile sinerjik etkileşim, bu enfeksiyonlarla ilgili klinik tablonun gelişmesinde ve ekonomik kayıpların artmasında en önemli nedenlerdendir (Healy ve ark. 1993, Pritchard ve Fishwick 1997).
Sığırlarda solunum sistemi hastalıklarının oluşumunda tek ya da birden fazla virus rol oynayabilmektedir (Pritchard ve Fishwick 1997, Mahin ve ark. 1985).
Sığır adenovirus (BAV) enfeksiyonları bütün dünyada oldukça yaygın olarak gözükmekte ve hayvan yetiştiriciliğinde ekonomik kayıplara yol açmaktadır. Đlk önce çocukların adenoid dokularından izole edildikleri için ADENOVIRIDAE ismini almışlardır (Enders ve ark. 1956).
Adenoviridae familyası izole edildikleri konakçıların türüne göre iki alt gruba ayrılır; mastadenoviruslar, aviadenoviruslar (Kahrs 1986).
Sığır adenovirusları (BAV) Adenoviridae familyasının Adenovirus genusunda yer alır. Adenoviruslar morfolojik, fiziksel ve kimyasal özellikleri ile kesin tanımlanan bir virus grubunu oluştururlar (Bibrack 1971). Basit yapıda olup, protein ve biri argininden oldukça zengin çift iplikçikli DNA içerirler (Norrby ve ark. 1976). Periferinde birbirine benzer protein alt yapılarında (kapsomer) oluşan protein, nükleik asidi çevrelemiştir (Bibrack 1971). Zarsız olan kapsid, ikozahedral simetri gösterir ve ikozahedral yapıların
12 köşesinden uzanan iplikçiklerle karakterize 252 kapsomerden oluşur (Norrby ve ark. 1976).
Elektron mikroskobu ile yapılan ölçümlere göre adenovirus partiküllerinin çapları 60–120 nm, ortalama olarak 80 nm kadardır (Smyth ve ark. 1986).
Adenoviruslar ısıya duyarlıdırlar ve geniş pH spektrumuna sahiptirler (Rozhdestlanskii 1984). Adenoviruslar pH 6,5–7,4 arasında 36 ºC’de en az 7 gün, -25 ºC’de daha uzun zaman hastalık yapma gücü azalmadan kalabilmekte, 56 ºC’de ise 5 dk’da inaktive olmaktadır (Bernard ve ark. 1973).
Adenoviridae familyasındaki bütün adenovirusların ortak bir komplement fikzasyon ve presipitasyon antijeni vardır (Rolle 1978).
BAV’ların doğal konakçıları sığırlardır. Bulaşma direkt temas ile olmaktadır. Virus nasal ve lakrimal akıntı ile saçılır, gaita ile virus saçılımı olmamaktadır. Giriş; ağız veya solunum yoluyla olmaktadır. Aerosol bulaşmada görülebilmektedir. Virus saçılımı iki haftadır (www.bornova.vet.gov.tr/ sigirhast.ppt).
Adenovirus patolojisinde; Pneumoenteritis, peteşiyel hemorajiler, hemorajik fibrinopurulent enteritis görülür. Pneumoniler çoğunlukla pasteurella enfeksiyonları ile birlikte seyreder. Zayıf buzağı doğumlarında; Polyartritis, subkutanoz ödem ve hemoraji görülmektedir. Mide-bağırsak, akciğer, karaciğer, adrenler ve böbreklerde eozinofilik intranükleer inklüzyon cisimcikleri görülür (Eisa 1972).
Solunum sistemindeki makroskobik lezyonlar, nazal bölümde, önce muköz daha sonra mukopurulent bir hale gelen eksudatla başlar. Akciğerlerdeki diffuz konjesyon ve hemoraji, giriş lobüllerinde sertleşmeye neden olur. Solunum sistemine ait lenf nodüllerinde hemoraji ve ödem tespit edilir. Böbrek, adrenal korteks, myokardium ve barsak duvarında peteşiler ve ödem görülebilir. Topallığın görüldüğü salgınlarda kol ve bacak eklemleri çevresinde peteşi ve ödemlere rastlanır (Gough 1984)
BAV ile enfekte olan hayvanlarda klinik belirtilere de rastlanmayabilir. Klinik belirtiler ve lezyonlar bulunsa bile solunum ve sindirim sisteminin diğer bazı hastalıklarıyla karışabilir ve BAV’ların direkt olarak tanısına yarayacak belirgin ipuçları bulunmaz. Adenovirus enfeksiyonlarında solunum sistemine ait belirtiler, sindirim sistemine oranla daha belirgindir. Solunum sistemi ile ilgili belirtiler genellikle hafif bir diyare ile birlikte seyreder. Bu nedenle pnömoenteritis kelimesi, BAV’lardan ileri gelen hastalığı tanımlamak için kullanılabilir (Kahrs 1986).
Adenovirus klinik bulguları; buzağılarda ve yeni doğanlarda yetişkinlerden daha fazla görülmektedir. Tüm yaşlarda ortaya çıkabilir ve yetişkinlerde stres veya diğer faktörler etki etmedikçe nonklinikal olabilir (Alkan 1989).
Klinik olarak BAV enfeksiyonlarının tanısı güçtür, çünkü birçok enfeksiyonda benzer klinik tablo görülür ve mix enfeksiyon şekillenebilir. Adenovirusların inkübasyon periyodu en erken 2–3 günde görülmektedir. Saha olgularında virus alındıktan sonra 2 haftaya kadar uzayan bir periyod görülmektedir (Eisa 1972). Adenoviruslar klinik olarak sağlıklı ve hastalıklı hayvanlardan izole edilmişlerdir (Eisa 1972). Adenovirus enfeksiyonlarının teşhisi direkt ve indirekt yöntemlerle yapılabilir (Eisa 1972).
Adenoviruslar direkt olarak tükrük bezleri, lenf düğümleri, bademcikler, burun ve farenksten alınan swaplar ile dışkıdan izole edilebilirler (Oor 1984). Ayrıca böbrekler adenovirusların izolasyonunda önem taşırlar. Sağlıklı hayvanlardan hazırlanan böbrek hücre kültürleri ile yapılan çalışmalarda inokulasyon yapılmamış bu kültürlerin adenovirus ile enfekte olduğu gözlenmiştir. Bu nedenle, adenovirusların böbreklerde latent olarak var olabilmeleri böbrek hücre kültürleri ile yapılan bütün virolojik çalışmalarda ve aşı üretiminde büyük önem taşımaktadır (Eisa 1972).
Adenovirus enfeksiyonlarının indirekt teşhisinde çeşitli serolojik testler kullanılmaktadır (Cole 1971, Coria ve McClurkin 1978). Yapılan araştırmalar, adenovirus enfeksiyonlarının indirekt teşhislerinde Nötralizasyon Testi (NT), Agar Jel Presipitasyon Testi (AGPT), Komplement Fikzasyon (CF),
Hemaglutinasyon-inhibisyon (HI), Flouresan Antikor Testi (FAT), Enzyme Linked Immunosorbent Assay (ELISA) ve Immunoperoksidaz (IP) testlerinin kolayca uygulanabileceğini ortaya koymaktadır (Inaba ve ark. 1968).
Sığırlarda parainfluenza virus–3 (PIV–3) tarafından meydana getirilen hastalığın varlığı, ülkemizde ve dünyanın çeşitli yerlerinde yapılan serolojik çalışmalar ve virus izolasyonları ile saptanmıştır (Burgu ve ark. 1984). Solunum sistemi enfeksiyonlarına sebep olan viruslar arasında yer alan PI-3 virusu ilk defa sığırlardan izole edilmiştir (McKercher ve ark. 1958).
PIV–3 sığırlarda sık tespit edilen bir virus olup, solunum sistemi enfeksiyonlarının yardımcı faktörü ya da etkeni olarak bildirilmiştir. PIV–3 paramyxoviridae familyasının paramyxovirus grubu içinde yer almaktadır (Fenner ve ark. 1993).
PIV-3 üst solunum sistemi mukoza hücrelerinde, alveolar makrofajlarda, nötrofillerde ve lenfositlerde tahribata sebep olmaktadır. Bu tahribata bağlı olarak makrofajların immunite ve fagasitoz yeteneğini, nötrofillerin bakterisid fonksiyonunu engellenmek suretiyle akciğerlerin doğal savunma mekanizmaları etkisiz hale getirilmektedir. Böyle bir ortamda üst solunum yolları ve tonsillalarda fakültatif patojen olarak bulunan Mannheimia hemolytica ve diğer bakteriler aktif hale geçmekte ve çoğalarak alt solunum sistemine erişmektedir. Oluşan sekonder bakteriyel enfeksiyonların katılımı ile viral pnömoni tedavi edilmediği takdirde ölümle sonuçlanan enzootik pnömoniye dönüşmektedir. Pnömoniler ölüme, vücut ağırlığı kaybına, verimde azalmaya, geç pazarlamaya ve tedavi giderlerine sebep olarak hayvancılıkta önemli ekonomik kayıpların nedeni olarak görülmektedir (Fenner ve ark. 1993).
PIV–3’ ün ısıya karşı hassasiyeti değişik olup, 56ºC de 15 dk’da aktivitesini tamamen kaybetmektedir (Singh ve Baz 1967). PIV-3’ün nükleik asit tipi RNA olup, etere, kloroforma, tripsine ve asit pH derecelerine duyarlıdır (Singh ve Baz 1967). PIV-3’ün virus zarı, hemaglutinasyon, immunite ve nöraminidaz aktivitesi için gerekli iki glikoprotein kapsar (Sağlam ve ark. 1986).
PIV–3, bovine respiratory syncytial virusu (BRSV), infectious bovine rhinotracheitis virusu (IBRV) ve rhinovirus gibi virusların solunum sisteminde sebep oldukları enfeksiyonların hastalığa dönüşmesinde stres faktörleri olarak isimlendirilen iklim, barınak hijyeni, barınak değişimi, yem değişimi, taşınma ve diğer faktörlerin önemli etkilere sahip oldukları uyarısı devamlı yapılmaktadır. Bu nedenle faktörlere bağlı hastalıklar “faktör hastalıkları” olarak isimlendirilmiştir. PIV-3 sığırlarda ve küçükbaş hayvanlarda solunum sisteminde enzootik pnömoni oluşumu için ortam hazırlayıcısı olarak görülmektedir (Blood ve ark. 1990, Bradford 1990).
Türkiye’de sığırlarda PIV–3 enfeksiyonunun varlığını saptamak amacıyla çeşitli araştırıcılar tarafından gerek virus izolasyonları ve gerekse hemaglutinasyon-inhibisyon (HI) testi ve serum nötralizasyon (SN) testi yardımı ile seroepidemiyolojik çalışmalar yapılmıştır (Singh ve Baz 1967).
PIV–3 enfeksiyonu insandan insana hava yolu ile bulaşır. Enfeksiyonun insandan hayvana geçtiğini gösteren kesin bir kanıt yoktur. Hastalık, genellikle ilkbahar ve daha seyrek olarak da sonbaharda görülürse de, virus endemik olarak bütün yıl boyunca bulunur (Lennette 1985).
PIV–3 enfeksiyonunda bulaşma direkt olarak göz, burun akıntısı ve damlacık enfeksiyonu şeklinde, indirekt olarakta yem ve ahır malzemeleri, insanlar ve transport ile olmaktadır (Sağlam ve ark. 1986). Klinik belirti görülen buzağılarda temasta bulunan sağlam buzağılarda da hastalığın 5–10 gün sonra meydana geldiği saptanmıştır (Heddleston ve ark. 1967).
Sığırların PIV–3 hastalığında önemli olan patolojik bulgular; akciğerlerin ventral yarısı hiperemik olmakla beraber, kardial ve apikal lobların daha fazla hiperemik olması, fibröz dokunun bu lobların arasına kadar yayılmış olması, trachea ve bronşlar içinde yapışkan bir mukoprulent eksudat bulunması ve trachea’nın hiperemik oluşu yanında diğer dokuların normal bir görünümde olmasıdır (Woods ve ark. 1964). Histolojik incelemelerde, bronşiolitis, alveolitis, akciğerlerde seröz eksudat, burun ve bronş epitellerinde asidofilik hücre içi inkluzyon cisimcikleri ve alveolar makrofajlar gözlenir (Jolly ve Ditchfield 1965).
Akut seyirli PIV–3 enfeksiyonlarında morbidite oldukça yüksektir. Enfekte hayvanlarda genellikle ateş görülmez, öksürük ve konjuktival akıntı ile birlikte bol seröz burun akıntısı vardır. Klinik bulgular çoğu zaman diğer bazı sığır hastalıkları ile karışabilir (Martin 1983).
PIV–3’ ün direkt teşhisi virusun izolasyon ve identifikasyonu ile olur. Virus izolasyonlarının değişik materyal ve çeşitli doku kültürlerinde yapıldığına dair pek çok kaynak vardır (Burgu ve ark. 1984).
Sığırlarda PIV–3’ ün indirekt teşhisi çeşitli serolojik testlerle ve genellikle nötralizasyon ve HI (Hemaglutinasyon-inhibisyon) testleri ile yapılmaktadır (Burgu ve ark. 1984).
Bovine respiratory syncytial virus (BRSV) enfeksiyonları dünyanın her yerinde yaygın olarak görülen ateş, nasal akıntı, öksürük, salivasyon ve pnömoni ile karakterize akut veya inaparan özellik gösterebilen bir solunum sistemi enfeksiyonudur (www.bornova.vet.gov.tr/ sigirhast.ppt).
BRSV, Paramyxoviridae familyasının Pneumovirus genusunda yer alan RSV’tur. Virus duyarlı hücre kültürlerinde ve enfekte dokularda synctia (multinükleer protoplazmik cisimcik) oluşturmaktadır. Virus pleomorfik RNA virustur ve 80–200 nm büyüklüktedir (www.bornova.vet.gov.tr/ sigirhast.ppt).
BRSV sığırların birincil rezervuarıdır. Koyun ve keçilerde enfeksiyona duyarlıdır ve deneysel olarak enfekte edilebilir. Ancak hastalığın epidemiyolojisindeki rolleri açık değildir. Virus nasal sekresyon ile saçılır, aerosol olarak ve solunum yolu ile organizmaya girer. Hassas populasyonlarda yayılma çok hızlıdır. Ve çok sayıda klinik enfeksiyon ortaya çıkar. BVD, PIV-3, Mannheimia ve Adenoviruslar ile miks enfeksiyonlara sıklıkla rastlanır (www.bornova.vet.gov.tr/ sigirhast.ppt).
BRSV’nin inkübasyon periyodu kısadır ve doğal enfeksiyonlarda aniden ortaya çıkabilir. Deneysel enfeksiyonlarda ise 2–4 gündür. Solunum artışı, oküler ve sulu nasal akıntı, öksürük, depresyon ve süt veriminde azalma görülür. Bu bulgular 3–10 gün sürer. Bazı olgularda salivasyon artışı görülür ve salya köpüklü veya hafif kanlı olabilir. Pnömoni klinik olarak genellikle
saptanır. Ancak sekonder veya kokontaminant enfeksiyonlar her zaman göz önünde bulundurulmalıdır (www.bornova.vet.gov.tr/ sigirhast.ppt).
BRSV patolojisinde akciğerlerde kardiak lopta ve lopların ventral kısımlarında hepatizasyon ve bazen pulmoner amfizem görülür. Enfekte hücrelerde syncytia ve intrasitoplazmik inklüzyon cisimcikleri tipiktir. Klinik olarak şüphe edilebilir. Tanı ancak laboratuvar teşhisi ile konulur. Akut enfekte hayvanlardan alınan nasal swab örnekleri virus izolasyonu için uygundur. Ancak hastalığın erken dönemlerinde virus izole edilemeyebilir. 3 hafta aralıkla alınan çift serum örneğinde serolojik olarak tarama daha çok önerilmektedir. Tüm solunum sistemi hastalıkları göz önünde bulundurulmalıdır. Genellikle Mannheimia ile birlikte bulunur ve hangisinin primer etiyolojik ajan olduğu bilinmemektedir. Ayırıcı tanıda; IBR , Ephemeral Fever (EF) ve BVD mutlaka dikkate alınmalıdır (www.bornova.vet.gov.tr/ sigirhast.ppt).
BRSV’nin tedavisi yoktur. Fakat bakteriyel sekonder enfeksiyonlara karşı antibiyotik uygulaması önerilir. Hızlı yayıldığı için enfekte sürülerin ve bu sürüler ile temas eden insanların hassas populasyonlar ile temas etmemesi gerekir. Profilaktik olarak aşılama önerilir. Ancak BRSV’nin bağışıklık oluşturma özelliği oldukça zayıftır (www.bornova.vet.gov.tr/ sigirhast.ppt).
Türkiye’de IBR hastalığı ile ilgili olarak yapılan farklı çalışmalarda hastalığın yaygın olarak görüldüğü bildirilmektedir (Fenner ve ark. 1987).
IBR hastalığı konakçı sayısı az olmasına karşın tüm dünyada yaygındır, yalnızca Norveç, Đzlanda ve Đsviçre’de hastalığın eradikasyonu gerçekleştirilmiştir (www.bornova.vet.gov.tr/ sigirhast.ppt).
IBR enfeksiyonu Herpesviridae familyasının Alfaherpesvirinae alt familyası içinde yer alan Bovine Herpesvirus–1 (BHV–1) tarafından oluşturulur. BHV–1 yerleştiği dokuya göre üst solunum yolu ve genital kanal enfeksiyonu oluşturur (Fenner ve ark. 1987).
BHV-1 herpesviridae ailesinin bir üyesi olup, yapısında; çift iplikli linear formda DNA, 160–162 kapsomerden oluşmuş ikosahedral yapıda kapsit, kapsidi çevreleyen tegument ve en dısta ise üzerinde glikoproteinleri ihtiva eden viral zarf bulundurmaktadır. Sığırlarda; respiratorik enfeksiyon,
konjunktivitis, vulvovaginitis, abort ve nadiren ensefalitisle seyirli hastalık tablosu oluşturmaktadır. Ayrıca, yasam boyu asemptomatik olarak seyredebilen latent virus enfeksiyonların en önemli etkenlerindendir (Fenner ve ark. 1987).
Virus -60ºC’da en az 9 ay, - 20ºC’da 2 ay süre ile infektif kalmaktadır. Virus, 60ºC’da 15 dakikada inaktive olur (www.bornova.vet.gov.tr/ sigirhast.ppt).
Virus serolojik olarak tek tiptir ve sığırlar virusun doğal konakçılarıdır. Çeşitli araştırmacılar tarafından BHV-1’in Equine Herpes Virus–1 (BHV–1), diğer sığır herpes viruslar (BHV–2, BHV–5) ve domuz virusu (Suis Herpes Virus–1) ile arasında antijenik ilişki olduğu rapor edilmektedir (www.bornova.vet.gov.tr/ sigirhast.ppt).
Enfeksiyon etkenleri içinde yer alan virusların yol açtığı hastalıklar, verim özelliklerinde azalma, sağaltım için medikal girdiler, mortalite vb. nedenlerle önemli ekonomik kayıplara neden olabilmektedir. IBR, BVD, Mavidil, PIV–3, BRSV bu hastalıkların en önemlilerindendir (Fenner ve ark. 1987).
IBR virusunun inkübasyon periyodu virulensi ve giriş yoluna bağlı olarak 2–6 gündür (www.kkgm.gov.tr).
Sığırlarda Infectious Bovine Rhinotracheitis (IBR) olarak bilinen hastalığa neden olan BHV–1, subklinik enfeksiyon ya da akut üst solunum sistemi enfeksiyonu yanısıra vulvovaginitis, endometritis, abortus ve ensefalitis gibi klinik tablolara neden olabilmektedir. BHV–1, diğer herpes viruslarda olduğu gibi latent enfeksiyonlar meydana getirir. Latent enfekte hayvanlarda etken, stres faktörleri ve kortikosteroid uygulamaları ile yeniden aktive olabilmektedir. Dolayısıyla BHV–1 yönünden seropozitif oldukları saptanan hayvanlar sürülerdeki sağlıklı hayvanlar için enfeksiyon kaynağı durumundadırlar (Çabalar ve Akça 1994).
Hastalığın yayılmasında akut ve latent enfekte hayvanlar ile sperma ve embriyo transferi rol oynar. Akut, subklinik veya latent enfekte boğalara ait spermalar likit nitrojende dondurularak saklandığında virus uzun süre stabil
kalabilir ve suni tohumlama yolu ile enfeksiyonun kolayca yayılmasına neden olabilir. Bu bakımdan seropozitif olan boğalar epidemiyolojik açıdan virus taşıyıcı ve saçıcı olarak kabul edilmelidir (Fenner ve ark. 1987).
IBR patolojisinde mukozal yüzeylerde nekroz ve püstül oluşumu görülür. Bu lezyonlara hedef organlarda da rastlanır ve ülserler şekillenebilir. Organların paranşimlerinde fokal nekrozlar görülebilir. Histopatolojik olarak intranükleer inklüzyon cisimcikleri görülür (www.bornova.vet.gov.tr/ sigirhast.ppt). IBR solunum yolu hastalığı olmasına rağmen besi ineklerinde genital bölgede, fetusda, gözde ve beyinde az ciddi enfeksiyonlar görülmekte ve buda ekonomik kayıplara yol açmaktadır (McKercher ve ark. 1958).
IBR enfeksiyonunda klinik tablo, virus suşuna, virus dozuna, enfeksiyon yoluna, hayvanların bağışıklık durumuna ve çevresel faktörlere bağlı olarak değişir. Hastalık %100’e yakın bir morbidite ile %2–20 arasında değişen mortaliteye sahiptir. Enfeksiyona her yaş grubundaki hayvanlar duyarlıdır. IBR enfeksiyonu sığırlarda klinik olarak solunum sistemi enfeksiyonlarına (IBR), genital sistem enfeksiyonlarına (IPV, IPB), enteritis, encephalitis, mastitis, endometritis, abort ve infertiliteye neden olur (www.kkgm.gov.tr).
IBR’nin tanısı respiratorik formda nasal swab, konjuktivitiste konjuktival swab, ensefalitiste beyin, genital formda vaginal swab örnekleri, viremi döneminde kan virus izolasyonu için uygun örneklerdir. Fötusta ise dalak, karaciğer, beyin, lenf yumrusu virus izolasyonu için uygundur. Serolojik olarak çift serum numunesindeki antikor artışı tanıya yardımcı olur (www.bornova.vet.gov.tr/ sigirhast.ppt).
Ayırıcı teşhis; solunum, sindirim ve sinirsel semptomlar ile seyreden hastalıkların yüksek ateş döneminde mukoz membranlardaki konjesyonlar, erezyonlar, nasal akıntılar ve meningoensefalitis klinik olarak IBR’yı akla getirebilir. Klinik olarak IBR’nin solunum formundan şüphe edildiği olaylarda aynı zamanda Bovine Viral Diyare/Mukozal Disease(BVD/MD), Coryza Gangrenosa Bovum (CGB), Sığır Vebası (RP), Mavi dil (BT) her zaman dikkate alınmalıdır. Merkezi sinir sistemi formunda da kuduz ve yalancı kuduz
göz önünde bulundurulmalıdır. Abortlarda ise listeriosis, brusellosis, trikomoniosis ve vibrio abortlar ayırt edilmelidir. Özellikle sığırlarda sığır vebası eradikasyon çalışmalarının klinik izleme dönemlerinde sığırlarda görülen IBR vakalarının sığır vebası olmadığının teyidi zorunludur (www.kkgm.gov.tr).
Doğal enfeksiyon veya aşılamayı takiben humoral ve hücresel immun yanıt gelişir (Ertürk 2004).
Etkenin direkt teşhisinde, laboratuvara steril şartlarda gönderilen örneklerin duyarlı hücre kültürlerine (Primer buzağı böbrek, MDBK) inokulasyonu ile BHV–1 izolasyonu yapılır. Đzole edilen virusun identifikasyonunda çapraz virus nötralizasyon testi (NT) veya biyomoleküler teknikler kullanılmaktadır. Virusun fiziksel ve kimyasal özellikleriyle elektron mikroskobik görünümü direkt teşhis için önemlidir. Đndirekt teşhis, immunoperoksidaz (IP), immunofloresan, enzyme linked immunosorbant assay (ELISA) ters pasif hemaglutinasyon (RPHA) ve hibridizasyon teknikleri kullanılarak yapılmaktadır (www.kkgm.gov.tr).
IBR enfeksiyonunun indirekt teşhisinde klinik semptom göstermeyen latent enfekte hayvanların tespiti, kan serum örneğinin alındığı hayvanın aşılı olup olmadığının bilinmesi zorunludur. Çapraz serum nötralizasyon test ve ELISA bu amaç için kullanılan en yaygın testlerdir (Pritchard ve Fishwick 1997).
Bovine virus diarrhoea/mucosal disease (BVD/MD), tüm dünyada yaygın olarak görülen, sindirim sisteminde (ağız, yemek borusu, mide ve bağırsak) ülser ve ishal ile seyreden bir hastalıktır (Ertürk 2004).
Bovine virus diarrhoea/mucosal disease (BVD/MD) Flaviviridae familyasının pestivirus genusunda yer alır. BVD enfeksiyonunda ateş, lökopeni, süt veriminde ani bir düşme, aralıklı diyare, okulonasal akıntılar ve ağız boşluğu mukozasında erozyon ve ülserler görülür (Fenner ve ark. 1987).
Uzun yıllar Togaviridae familyası içinde sınıflandırılan Pestivirusların moleküler özelliklerini ortaya koyan son gelişmeler ışığında, BVDV’ unun sınıflandırılması tartışmaları yeniden başlamıştır. Pestivirusların Togaviridae
familyasındaki diğer viruslardan farklı olduğunu gösteren ilk moleküler verilerin virusa spesifik RNA'nın özellikleriyle ilgili olduğu bildirilmiştir (Moennig 1990). Enfekte hücrelerde yüksek moleküler ağırlıkta 3' poly A bölümü içermeyen tek bir zincir bulunmuş ve enfeksiyondan sonra herhangi bir subgenomik RNA tespit edilememiştir. Bu özellikler, Pestivirusların Flaviviruslara benzerlik gösterdiğini ortaya koymaktadır (Horzinek 1990). Hatta son zamanlarda yapılan araştırmalarda Pestiviruslar Flaviviridae familyası içinde sınıflandırılmıştır (Collet ve ark. 1992).
Bovine Viral Diarrhea/Mucosal Disease (BVD/MD) sığırlara mahsus, identik bir virus (Bovine Viral Diarrhea Virusu/BVDV) tarafından meydana getirilen, klinik olarak birbirinden farklı iki formu bulunan hastalıktır (Smith ve ark. 1990). Hastalığın her iki formu da hayvanların yaş ve duyarlılığı ile çevresel faktörlerin etkisine bağlı olarak çoğunlukla sporadik ve zaman zaman enzootik olarak ortaya çıkabilir (Rosenberger 1990). Dünyada yaygın görülen hastalığın büyük ekonomik kayıplara neden olduğu bildirilmektedir (Smith 1990).
En küçük RNA virusları arasında yer alan BVDV; lipid zara ve ortalama 40–60 nm çapında ikozahedral simetrili kapside sahip bir etkendir. Etkenin içerdiği RNA; 12,5 kb moleküler ağırlıkta, pozitif polariteye ve tek iplikçikli linear yapıya sahiptir (Moennig 1990).
Bulaşma genellikle BVDV ile persiste ya da geçici olarak enfekte hayvanlarla direkt veya indirekt temas sonucu meydana gelmektedir. Enfekte hayvanlara ait kan, burun akıntısı, tükrük, gözyaşı, sperma, süt, gaita, idrar, uterus akıntıları, amniotik sıvı ve yavru zarları ile virus saçılabilmektedir (Ertürk 2004).
Görünüşte sağlıklı persiste enfekte sığırlar, BVDV’unun epizootiyolojisinde, özellikle hassas sürüler içine enfeksiyonun direkt olarak girişinde çok büyük öneme sahiptirler. Ayrıca enfeksiyon kaynağı olarak, geçici enfekte hayvanlar, enfekte sperma, embriyo transferi, çeşitli enfekte malzemeler, canlı BVDV aşıları, BVDV ile kontamine olmuş aşılar, çeşitli
sinek türleri ve diğer enfekte hayvan türleri sayılabilir (Meyling ve Jensen 1988, Duffel ve Harkness 1985).
Hasta hayvanlar, virusu burun ve göz akıntıları, salya ve dışkıları ile saçarlar. Bu nedenle çoğunlukla içme suları ve yemler enfektedir. Hastalığın bulaşmasında direkt temas önemlidir. Gebe hayvanlar hasta iseler yavrularına hastalığı nakledebilirler. Boğalar çiftleşme yoluyla hastalığı diğer hayvanlara bulaştırırlar (Ertürk 2004).
Hastalık belirtilerinin görüldüğü tip; hastalık, ateş, iştahsızlık, ishal belirtileri ile kendini belli eder. Ayrıca hayvanlarda topallık ve akciğerlerin yeterli çalışmaması ile ilgili solunum problemleri ortaya çıkar (Ertürk 2004).
Hastalık belirtilerinin görülmediği tip; hastalığın belirtisini göstermeyen ancak taşıyıcı olan dişiler çiftleşirlerse yani hastalık yavruya aktarılırsa, gebelik dönemine bağlı olarak yavrunun gelişememesi, yavrunun atılması, ölü doğum ve anormal buzağı doğumları ve hastalığı taşıyan buzağı doğumlarına rastlanır. Hastalığı taşıyan bu buzağılar hayatları boyunca hastalığı diğer hayvanlara bulaştırırlar ve hastalığın yayılmasında büyük rol oynarlar (Ertürk 2004).
Persiste BVDV enfeksiyonlarının kesin teşhisi direkt olarak yapılmakta, bu tür enfeksiyona sahip hayvanların serolojik durumları ise indirekt metodlarla tespit edilmektedir. PI hayvanların identifikasyonu amacıyla genellikle lökosit veya kan serumu örneklerinde virus ya da viral antijenlerin teşhisine yönelik yöntemler kullanılmaktadır (Liess ve ark. 1983).
BVDV ya da antijenlerinin tespiti için yaygın olarak kullanılan testler arasında immunofloresan testi (IFT) (Liess ve ark. 1983) immunperoksidaz testi (Peroxidase Linked Antibody Assay - PLA) (Qvist ve ark. 1991), interferens, monoklonal ELISA, streptoavidin-biotin metodu, hibridizasyon metodu, elektron mikroskopi, sentetik oligonükleotid yöntemi, flow cytometry (Qvist ve ark. 1991) ve polymerase chain reaction (PCR) bulunmaktadır. Ncp biyotip tarafından meydana getirilen ve bulundukları sürüyü BVDV enfeksiyonu yönünden devamlı tehdit eden persiste enfeksiyona sahip hayvanların tespitinde en çok kullanılan testler IFT ve PLA'dır (Qvist ve ark. 1991).
Hastalıktan korunmak için aşılar kullanılmaktadır. Ancak kullanılan bu aşılar hayvanın daha sonra tekrar hastalanması durumunda, hastalığın teşhisini güçleştirmektedir. Hastalık boğa ve gebe hayvanlarda önemli olup bu hayvanlar hastalığı yaydığı için bu tür hayvanların kontrolleri sık olarak yapılmalıdır. Hastalık taşıdığı tespit edilen bu tip hayvanlar sürüden derhal uzaklaştırılmalıdırlar. Bir sürüdeki BVD enfeksiyonunu teşhis edebilmek hastalığın gelecek nesillere taşınmaması bakımından gereklidir. Ayrıca, yeni doğan buzağıların BVD enfeksiyonuna karşı dirençleri artırmak için ağız sütü içirilmesine özen gösterilmelidir (Ertürk 2004).
3.MATERYAL VE METOT
3.1. Materyal:
3.1.1. Araştırmada kullanılan şüpheli kan serumları:
Serum örnekleri, Konya ve çevresindeki özel çiftliklerde bulunan süt sığırlarından geçmişinde solunum sistemi hastalık semptomları gösteren veya vücut ısıları normalin üzerinde, 1 yaş veya daha büyük olan, aşılanmamış 180 adet kan örneği elde edildi. Steril şartlarda kaolinli polystren tüpler içine alınan kan örneklerinden serum ayrılarak 30 dk süre ile 56ºC’lik su banyosunda inaktive edildi ve testte kullanılıncaya kadar 1 ml’lik porsiyonlar halinde -20ºC’de dondurucuda saklandı.
3.2. Metot:
3.2.1. Enzyme linked immunosorbent assay (ELISA):
Toplanan sığır kan serumları indirekt ELISA tekniği ile IBR, BVDV, BRSV, PI-3 ve BAV-3 antikorları yönünden kontrol edildi. Bu amaçla Bio-X Diagnostics’in ticari ELISA kiti [Bio-X Respiratory ELISA KIT PENTAKIT (Bio K 028), Belgium] kullanıldı. Test kit prosedürüne göre uygulandı.
3.2.1.1. Testin bileşenleri
•Mikropleyt: 96 gözlü 2 adet mikro elisa titrasyon pleyti kullanıldı. •Yıkama solusyonu: 1 adet 100 ml’lik 20x sulandırılmış yıkama
solusyonu kullanıldı. Bu solusyon soğuk ortamlarda kristalleşebilir. Bu nedenle kit kullanılmadan önce oda ısısına getirildi ve solusyon iyice karıştırıldı. Solusyon 1:20 oranında distile yada demineralize su ile sulandırıldı. Sulandırılmış solusyon 4ºC’de muhafaza edilebilir. •Dilusyon Buffer: 1 adet kan serumu ve konjugatı sulandırmak için 50
ml’lik 5x konsantre buffer kullanıldı. Bu konsantre solusyon 1:5 oranında distile yada demineralize su ile sulandırıldı. Sulandırılan solusyon 4ºC’de en az üç ay muhafaza edilebilir.
•Konjugat: 1 adet anti-bovine immunoglobulin-peroksidaz konjugat (Horseradish peroksidazla işaretli anti-bovine IgG1 monoklonal antikor) kullanıldı.
•Pozitif Serum: 1 şişe pozitif serum kullanıldı. Pozitif serum 0.5 ml distile veya demineralize su ile sulandırıldı. Bu hazırlanan solusyon -20ºC’de muhafaza edilebilir.
•Kromojen Solusyonu: 1 adet damlalıklı 2-ml’lik kromojen tetrametilbenzidin kullanıldı. 4ºC’ de muhafaza edilebilir.
•Substrat Solusyonu: 1 adet 30 ml’lik hidrojen peroksit substrat solusyonu kullanıldı. 4ºC’ de muhafaza edilebilir.
•Stop Solusyonu: 1 adet 15 ml’lik 1M fosforikasit stop solusyonu kullanıldı.
3.2.1.2. Testin prensibi
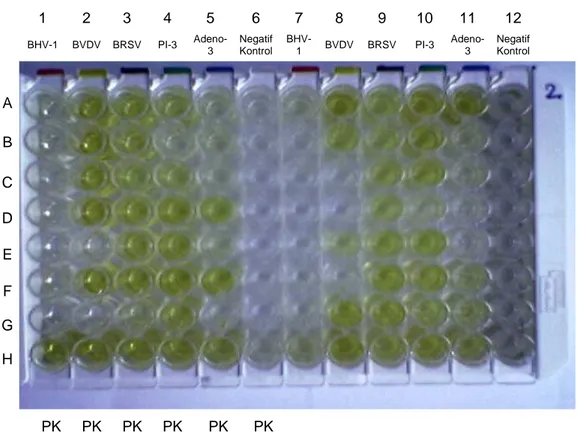
Testte yukarıdaki 5 hastalığa spesifik monoklonal antikorlara karşı hassaslaştırılmış 96 gözlü mikrotitrasyon pleytleri kullanılmaktadır. Bu antikorlar virusların ürediği hücre lizatlarından virusları ayırarak patojenleri yakalamada kullanılırlar. Mikrotitrasyon pleyti üzerinde bu patojenlerin dağılımı aşağıdaki gibidir:
Kolon 1 ve 7: IBR Kolon 2 ve 8: BVDV Kolon 3 ve 9: BRSV Kolon 4 ve 10: PI3
Kolon 5 ve 11: Adenovirus 3
Kolon 6 ve 12: Viruslar için negatif kontrol antijeni
Kolon 6 ve 12 virusların propagasyonunda substrat olarak hidrojen peroksit kullanıldı. Test serumu uygun buffer ile 1/100 oranında dilüte edilir ve pleyt oda sıcaklığında 1 saat inkübasyona bırakılır. Pleyt yıkanır ve gözlere peroksidaz ile işaretlenmiş anti-bovine IgG1 monoklonal antikor olan konjugat ilave edilir ve oda sıcaklığında tekrar inkübe edilir. Bu inkübasyondan sonra pleyt yıkanır ve enzim substrat ve TMB ilave edilir. Bu kromojen diğer peroksidaz kromojenlerine göre daha hassastır ve karsinojenik değildir. Eğer test serumunda spesifik immunoglobulinler varsa konjugat da buna bağlanır ve enzim renksiz kromojenin renkli bir bileşiğe dönüşmesini katalize eder. Sonuçta çıkan mavi rengin yoğunluğu, örnekteki spesifik antikor titresini ortaya koyar. Sonuçlar pozitif gözlerden her birine karşılık gelen negatif gözlerin çıkarılması ile elde edilir. Bilinmeyen bir serumun reaktivitesini 0’dan +++++’ya doğru giden bir skala üzerinden belirlemek mümkündür.
3.2.1.3. Prosedür
1) Tüm kimyasallar kullanılmadan en az 30 dakika önce oda ısısına getirildi.
2) Mikropleyt kılıfından çıkarıldı.
3) 5-10 ml’lik hemoliz tüplerine 1ml/tüp dilusyon buffer aktarıldı ve her tübe 10µ l serum örneği konularak iyice karıştırıldı. Pozitif serum için aynı durum tekrarlandı.
4) Dilute edilmiş numuneler gözlere aşağıdaki gibi aktarıldı: Pozitif referens serum: H1’den H6’ya; Örnek 1: A1’den A6’ya; Örnek 2: B1’den B6’ya…
5) Pleyt oda ısısında 1 saat kadar inkübasyona bırakıldı.
6) Kit bileşenlerindeki tarife göre hazırlanan yıkama solusyonu ile pleyt yıkandı. Daha sonra, mikropleyt yavaşça vurularak boşaltıldı ve temiz bir kurutma kağıdına ters çevrilerek içindeki tüm sıvı boşalana kadar yavaşça vuruldu. Yıkama işlemi 2 kere daha tekrarlandı.
7) Konjugat, dilusyon buffer 1:50 oranında dilue edildi. (örneğin. 1 pleyt için 250µ l konjugat, 12.25ml dilusyon buffer ile sulandırıldı). Dilute edilmiş konjugattan her göze 100µ l konuldu ve oda ısısında 1 saat inkübasyona bırakıldı.
8) Pleyt 6. basamakta anlatıldığı gibi yıkandı.
9) 10 ml indikatör solusyonu aşağıdaki gibi hazırlandı: 12 damla (500µ l) kromojene 9,5 ml substrat solusyonu ilave edilerek karıştırıldı. Hazırlanan solusyondan her göze 100µ l konuldu. Bu solusyon renksiz olmalıdır. Eğer mavi bir renk görülür ise solusyon atılmalı ve temiz malzeme ve ekipman kullanılmalıdır.
10) Oda ısısında 10 dakika inkubasyona bırakıldı. 11) Her göze 50µ l stop solusyonu konuldu.
12) Mikropleyt spektrofotometre ile 450 nm’de okundu. Sonuçlar stop solusyonu ilave edildikten hemen sonra okundu.
Pleytin hazırlanmış ve okuyucuya konmadan önceki son hali Şekil 3.2.1.1.’de görülmektedir. 1 2 3 4 5 6 7 8 9 10 11 12 BHV-1 BVDV BRSV PI-3 Adeno-3 Negatif Kontrol BHV-1 BVDV BRSV PI-3 Adeno-3 Negatif Kontrol A B C D E F G H PK PK PK PK PK PK
Şekil 3.2.1.1. Pleytin hazırlanmış ve okutucuya koymadan önceki son hali.
3.2.1.4. Sonuçların değerlendirilmesi
Pleytin 1,2,3,4,5 sıralarından kaydedilen değerlerden onlara karşılık gelen negatif kontrol değerleri çıkartılır ve aynı sütunda değere karşılık gelen pozitif kontrole bölünür. 2-3 hafta ara ile çift serum numunesi alınarak gerçek teşhise gidilebilir. Her serumun pozitiflik derecesi Kalite Kontrol Prosedürüne bakılarak değerlendirilir. Đlk numune enfeksiyonun akut fazında alınmalıdır. Eğer iki farklı dönemde alınan kan numunesi değerleri arasında bir artış yani
bir serodeğişim varsa enfeksiyon mevcuttur. Numunenin pozitivitesi 1 adet +’dan büyük veya eşitse pozitif olarak kabul edilir.
Örnek Serum – Negatif Kontrol
OD = X 100
4. ARAŞTIRMA SONUÇLARI
4.1. Şüpheli Serumlarla Yapılan ELISA Testi Sonuçları:
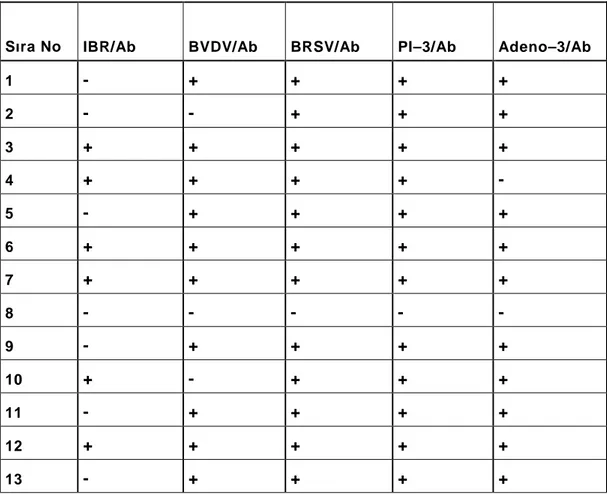
Araştırmada, 180 adet aşılanmamış sığırdan alınan kan serumu numunelerine uygulanan ELISA testi sonucunda; 46 sığır IBR, 173 sığır BVDV, 172 sığır BRSV, 164 sığır PIV-3 ve 150 sığır da BAV-3 yönünden seropozitif bulundu (Tablo 4.1.1.)
Tablo 4.1.1. ELISA testi sonuçları
Sıra No IBR/Ab BVDV/Ab BRSV/Ab PI–3/Ab Adeno–3/Ab
1 - + + + + 2 - - + + + 3 + + + + + 4 + + + + - 5 - + + + + 6 + + + + + 7 + + + + + 8 - - - - - 9 - + + + + 10 + - + + + 11 - + + + + 12 + + + + + 13 - + + + +
14 + + + + + 15 + + + + + 16 + + + + + 17 - + + + + 18 - + + + + 19 - + + + + 20 + + + + + 21 - + + + + 22 + + + + + 23 - + + + + 24 - + + + + 25 - + + + + 26 - + + + + 27 - + + + + 28 - + + + + 29 - + + + + 30 - + + + + 31 - + + + + 32 - + + + + 33 - + + + + 34 - + + + + 35 - + + + + 36 - + + + + 37 - - + - + 38 - + + + + 39 - + + + + 40 - + + + - 41 + + + + + 42 + + + + + 43 + + + + +
44 + + + + + 45 + + + + + 46 + + + + - 47 + + + + + 48 - + + + + 49 + + + + + 50 + + + + + 51 + + + + + 52 - + + + + 53 - + + + + 54 - + - + - 55 + + + + + 56 - + + + + 57 - + + + - 58 + + + + + 59 - + + + + 60 - + + + + 61 - + + + + 62 - + + + + 63 - + + + - 64 - + + + - 65 - + + + + 66 - + + + + 67 - + + + - 68 - + + + + 69 - + + + + 70 + + + + + 71 + + + + + 72 + + + + + 73 - + + + +
74 - + + + + 75 + + + + + 76 + + + + + 77 + + + + + 78 - + + + + 79 - + + + + 80 - + + + + 81 - + + + - 82 - + + + - 83 - + + + + 84 - + + + + 85 - + + + + 86 - + + + - 87 + + + + + 88 - + + + + 89 - + + + + 90 - + + + + 91 - + + + + 92 - + + + + 93 - + + + - 94 + + + + + 95 - + + + + 96 - + + + + 97 - + + + + 98 - + + + + 99 - + + + - 100 - + + + - 101 - + + + + 102 - + + + - 103 - + + + +
104 - + + + + 105 - + + + + 106 - + + + + 107 - + + + + 108 - + + + + 109 - + + + + 110 - + + + + 111 + + + + + 112 - + + + + 113 - + + + + 114 - + + + - 115 - + + + + 116 + + + + + 117 + + + + + 118 + + + + + 119 + + + + + 120 - + + + + 121 - + + + + 122 - + + + + 123 - + + + - 124 - + + + + 125 - + + + + 126 - + + + + 127 - + + + + 128 - + + + + 129 - + + + + 130 - + + + + 131 - + + + + 132 + + + + + 133 - + + + +
134 - + + + + 135 - + + - + 136 - + + + + 137 - + + - + 138 - + + - + 139 - + + - + 140 - + + - + 141 + + + + + 142 - + + - + 143 - + + - + 144 - + + + + 145 - + + - + 146 - + + + + 147 - + + - + 148 - + + - + 149 + + + + + 150 - + + + + 151 - + + - + 152 - + - - + 153 - + - + - 154 - + + + + 155 - + - + - 156 - + + + - 157 - + + + - 158 - + + + - 159 + - - - - 160 - + + + - 161 - + - + - 162 + + + + - 163 - - + - -
164 - + + + + 165 + + + + + 166 - + + + - 167 - + + + + 168 - + + + + 169 - - - + - 170 + + + + + 171 - + + + + 172 - + + + + 173 - + + + + 174 + + + + + 175 - + + + + 176 - + + + + 177 - + + + + 178 + + + + + 179 - + + + + 180 + + + + +
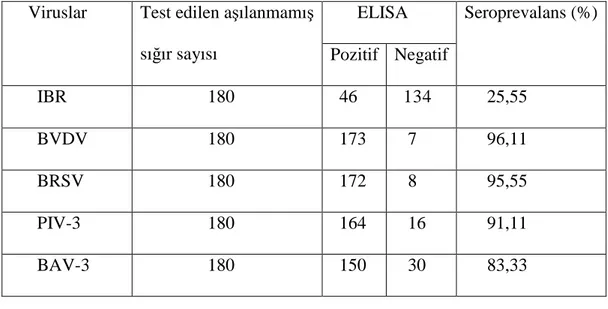
Araştırmada, Konya’ dan örneklenen toplam 180 adet aşılanmamış süt sığırı kan serumu örneğine uygulanan ELISA sonucunda; 46 adedinde (% 25.55) IBR virusuna karşı, 173 adedinde (% 96.11) BVDV’ una karşı, 172 adedinde (% 95.55) BRSV’ una karşı, 164 adedinde (% 91.11) PIV-3’ e karşı ve 150 adedinde de (% 83.33) BAV-3’ e karşı spesifik antikor varlığı belirlendi (Tablo 4.1.2).
Tablo 4.1.2. Konya’ daki 180 aşılanmamış sığırda 5 virusa karşı seropozitivite sonuçları.
ELISA Viruslar Test edilen aşılanmamış
sığır sayısı Pozitif Negatif
Seroprevalans (%) IBR 180 46 134 25,55 BVDV 180 173 7 96,11 BRSV 180 172 8 95,55 PIV-3 180 164 16 91,11 BAV-3 180 150 30 83,33
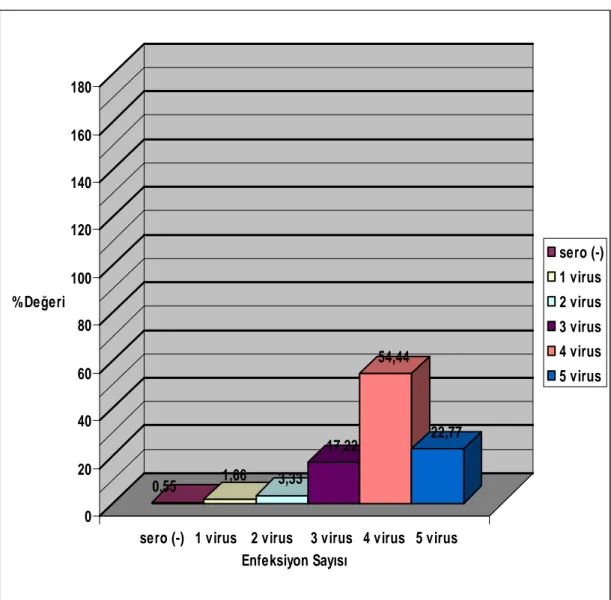
Örneklenen sığırların 3(%1.66)’ünde yalnızca bir virusa, 6(%3.33)’sında iki virusa, 31(%17.22)’inde üç virusa, 98(%54.44)’inde dört virusa ve 41(%22.77)’inde 5 virusa karşı antikor varlığı belirlenirken, 1(%0.55)’inde ise araştırılan viruslardan herhangi birisine karşı antikor varlığı tespit edilememiştir. En yüksek multiple (çoklu) enfeksiyon oranları 3,4 ve 5 virusa karşı belirlenmiştir (Şekil 4.1.1).
Tablo 4.1.3. Kontroledilen hayvanlarda çoklu enfeksiyon oranları. Enfeksiyon Sayısı Viruslar ELISA Pozitif ELISA Pozitif Toplam Test Edilen Aşılanmamış Sığır Sayısı 0 Virus 1 1 180 IBR 1 PIV-3 1 1 Virus BRSV 1 3 180 BRSV + BAV-3 1 BVDV + PIV-3 4 2 Virus BVDV + BAV-3 1 6 180 BRSV + PIV-3 + BAV-3 1 BVDV + BRSV + PIV-3 19 3 Virus BVDV + BRSV + BAV-3 11 31 180 BVDV + BRSV + PIV-3 + BAV-3 94 IBR + BVDV + BRSV + PIV-3 3 4 Virus
IBR + BRSV + PIV-3 + BAV-3 1
98 180
0,55 1,66 3,33 17,22 54,44 22,77 0 20 40 60 80 100 120 140 160 180 % Değeri
sero (-) 1 virus 2 virus 3 virus 4 virus 5 virus Enfeksiyon Sayısı sero (-) 1 virus 2 virus 3 virus 4 virus 5 virus
5. TARTIŞMA
IBR, BVDV, BRSV, P1V-3 ve BAV-3 enfeksiyonları tüm dünyada olduğu gibi Türkiye’de de gözlenmekte ve meydana gelen ekonomik kayıplar nedeniyle özellikle geçimini hayvancılıkla sağlayan bölgelerde önem kazanmaktadır.
Daha önce Türkiye’ nin farklı bölgelerinde IBR, BVDV, BRSV, PIV-3 ve BAV-3 için genellikle serum nötralizasyon testi (SNT) ile yapılan çalışmalarda, sırasıyla, %17.1-70.7, %14.3-100, %43.75-73.0, %11.00-100 ve %14.20-92.3 arasında değişen seropozitiflik oranları bildirilmiştir (Erhan ve ark. 1971, Erhan ve ark. 1973, Öztürk ve ark. 1988, Bolat 1991, Öztürk ve Duman 1992, Alkan ve ark. 1997, Yavru ve ark. 1998, Çabalar ve Karaoğlu 1999, Çabalar ve Can-Şahna 2000, Yıldırım ve Burgu 2005, Yavru ve ark. 2005, Duman ve ark. 2007, Yeşilbağ ve Güngör 2007).
Türkiye’ de IBR enfeksiyonu ile ilgili yapılan çalışmalarda (Öztürk ve ark. 1988, Alkan ve ark. 1997, Yavru ve ark. 1998, Çabalar ve Can-Şahna 2000, Yıldırım ve Burgu 2005, Yavru ve ark. 2005, Duman ve ark. 2007, Okur-Gümüşova ve ark. 2007, Yeşilbağ ve Güngör 2007) enfeksiyonun seroprevalansı % 17.1-70.7 oranları arasında tespit edilmiştir.
Öztürk ve ark. (1988), Konya Hayvancılık Merkez Araştırma Enstitüsü sığırlarından aldıkları 238 kan serumu örneğini mikronötralizasyon testi ile IBR/IPV
virusuna karşı test ederek, serumların %56.3’ ünün pozif olduğunu bildirmişlerdir. Alkan ve ark. (1997) kamu işletmelerinde yaptıkları çalışmada IBR enfeksiyonunun
seroprevalansını %59.70 olarak belirlemişler ve IBR virusunun solunum sistemi enfeksiyonlarında etkin role sahip olduğunu saptamışlardır. Yavru ve ark. (1998) Konya bölgesinde boğalar üzerinde yaptıkları çalışmalarda IBR enfeksiyonunun seroprevalansını %41.60 olarak bulmuşlardır. Çabalar ve Can-Şahna (2000), Doğu ve Güneydoğu Anadolu Bölgesi’ nde bulunan 12 özel ve 5 kamu işletmesine ait süt sığırlarından topladıkları 471 kan serumunu PIV-3, BHV-1 ve BRSV spesifik antikorları yönünden serum nötralizasyon testi ile kontrol ederek, işletmeler genelinde BHV-1 için seropozitiflik oranını % 52.4 olarak saptamışlardır. Yıldırım
ve Burgu (2005), Kuzeydoğu Anadolu bölgesindeki sığırlarda mavidil (BT), IBR, PIV-3, Bovine Leukemia Virus (BLV) enfeksiyonlarının seroprevalanslarını araştırmak amacıyla 8 ildeki özel sektöre ait organize yetiştiricilik yapılan ve aile işletmelerinde bulunan sığırlardan aldıkları toplam 506 kan serumu örneğini mikronötralizasyon testine tabi tutarak, IBR virusuna karşı % 59.48 oranında bir seropozitiflik belirlemişlerdir. Yavru ve ark. (2005), Konya Et ve Balık Kurumu Mezbahası’ ndaki farklı yaş, cinsiyet ve ırktaki sığırlardan aldıkları toplam 254 kan serumu örneğini mikronötralizasyon testi (mNT) ile BAV- 1, 2 ve 3, IBR/IPV,PIV-3, BRSV ve BVDV nötralizasyon antikorları yönünden kontrol ederek, 145 (% 57.08) hayvanda IBR/IPV virusuna karşı nötralizan antikor varlığı tespit etmişlerdir. Duman ve ark. (2007), BHV-1 enfeksiyonlarının varlığını serum nötralizasyon testi ile ortaya koymak için Türkiye’ nin orta (Konya) ve güney (Denizli) bölgelerinden üç yaş ve üzeri, sağlıklı, BHV-1’ e karşı aşılanmamış 3001 besi sığırından kan serum örnekleri almışlardır. Test sonucunda, BHV-1 enfeksiyonunun seroprevalansını, Đç Anadolu’da % 35.08 ve Güney Anadolu’ da % 38.75 olarak tespit ederek, sonuçları Türkiye’ nin orta ve güneyindeki sığır populasyonlarında BHV-1 enfeksiyonunun prevalansında bir azalma olduğu şeklinde yorumlamışlardır. Okur-Gümüşova ve ark. (2007), Türkiye’ nin Samsun ilindeki aşılanmamış, 1-3 yaş arasındaki 188 sığırdan aldıkları kan serumu örneklerini, SNT’ ni kullanarak, sığırlarda solunum sistemi hastalıklarına neden olan 5 virusa (BHV-1, BVDV, PIV-3, BAV-1 ve BAV-3) karşı antikorlar yönünden test ederek, BHV-1’ e karşı % 61.17 oranında bir seropozitiflik tespit etmişlerdir. Yeşilbağ ve Güngör (2007), Marmara bölgesinde bulunan 7 ildeki 39 sığırcılık işletmesinden topladıkları toplam 584 kan serumu örneğini BHV-1, BVDV, BRSV, PIV-3, BAV-1 ve BAV-3’ e spesifik nötralizan antikorlar yönünden inceleyerek, BHV-1’ in seroprevalansını % 17.1 olarak saptamışlardır. Ayrıca, IBR, BVDV ve BRSV’ unun seroprevalansının büyük kapasiteli süt sığırı işletmelerinde küçük kapasiteli işletmelere oranla son derece yüksek olduğunu tespit ederek, sürü kapasitesinin solunum yolu virusları açısından çok önemli bir risk faktörü olduğunu bildirmişlerdir.
Bu çalışmada IBR enfeksiyonunun seroprevalansı örneklenen populasyon için % 25.55 olarak belirlenmiştir (Tablo 4.1.2). Bu sonuç yukarda belirtilen Türkiye’ de yapılan çalışmalarda bildirilen değerler ile karşılaştırıldığında; Yeşilbağ ve
Güngör’ün (2007) bildirdiği değerden (% 17.1) yüksek, diğer araştırmalarda bildirilen değerlerden ise düşüktür. Burada vurgulanması gereken husus, IBR’ nin seroprevalansının Konya bölgesinde azalma eğiliminde olduğudur. Öztürk ve ark. (1988), Yavru ve ark. (2005) ve Duman ve ark. (2007) tarafından Konya bölgesinde önceden yürütülen araştırmalarda, enfeksiyonun seroprevalansı sırasıyla %56.30, %41.60 ve 35.08 olarak belirlenmiştir. IBR enfeksiyonunun seroprevalansının araştırmanın yapıldığı Konya bölgesinde düşük çıkmasının nedeni, özellikle son birkaç yıldır Tarım Bakanlığı Konya Đl Müdürlüğü’ nün IBR’ nin eradikasyonu kapsamında bölgede uyguladığı sıkı kurallardan (hayvan hareketlerinin ve bir sürüye hayvanların girişinin kontrol altına alınması, sığırcılık işletmelerine IBR- seronegatif damızlık boğaların katılması, vs.) kaynaklanmış olabilir. IBR virusu yönünden seropozitif aşılanmamış sığırlar latent virus taşıyıcıları olabileceği için (Obando ve ark. 1999), IBR’ nin Konya’ da seroprevalansındaki bu azalma önemlidir.
Ülkemizde gerek süt sığırcılığı, gerekse besi sığırcılığı yapılan işletmelerde önemli ekonomik kayıplara neden olan IBR enfeksiyonlarının varlığı, dünyanın değişik ülkelerinde de yapılan serolojik çalışmalarla (Durham ve Hassard 1990, Ghirotti ve ark. 1991, Suzan ve ark. 1983) ortaya konulmuştur.
Durham ve Hassard (1990), Kanada’ nın Saskatchewan ve Alberta eyaletlerinde bulunan 295 çiftlikten aldıkları toplam 1745 sağlıklı ineğin kan serum örneklerini IBR/IPV, PIV-3, BRSV ve BVDV’ una karşı spesifik antikorlar yönünden ELISA ile teste tabi tutarak, IBR yönünden % 37.8 oranında bir seropozitiflik değeri saptamışlardır. Ghirotti ve ark. (1991), Zambia’ da sığırlarda IBR/IPV,PIV-3,BAV-3 ve BVD-MD enfeksiyonlarının seroprevalansını belirlemek amacıyla yaptıkları araştırmalarında, IBR/IPV’ nin seroprevalansını % 42.1 olarak tespit etmişlerdir. Suzan ve ark. (1983), Meksika’ nın 19 farklı eyaletinden sütçü inek ve besi sığırlarının kan serumu örneklerini BHV-1, PIV-3, BAV-7 ve BVDV’ u yönünden test etmişler ve IBR/IPV’ nin seroprevalansını % 57 olarak saptamışlardır. Bu sonuçlar elde ettiğimiz bulgularla karşılaştırıldığı zaman; sonuçlar, IBR enfeksiyonlarının Türkiye’ de yapılan araştırmalarla genelde benzer oranlarda bulunduğunu, fakat bu araştırmada bulunan seropozitivite oranından (% 25.55) yüksek olduğunu göstermektedir.
BVDV enfeksiyonları tüm dünyada sığır populasyonlarında yaygındır. Değişik ülkelerde, hatta aynı ülkede değişik sürülerde farklı virulense sahip BVDV’ ları izole edilebilmektedir (Liess 1990). Türkiye’ de BVDV enfeksiyonu ile ilgili yapılan çalışmalarda (Erhan ve ark. 1971, Gelfert 1991, Çabalar ve Karaoğlu 1999, Yavru ve ark. 2005, Yıldırım ve Burgu 2005, Okur-Gümüşova ve ark. 2007, Yeşilbağ ve Güngör 2007) enfeksiyonun seroprevalansı % 14.3-100 oranları arasında tespit edilmiştir.
Erhan ve ark. (1971), Marmara bölgesinde iki çiftlikten alınan sığır serumlarında % 62 oranında BVDV’ una özgü antikor varlığı tespit etmişlerdir. Gelfert (1991), Güney ve Güneydoğu Anadolu bölgesinde bulunan 10 ilden topladığı 476 kan serumunda % 18-100 arasında BVDV seropozitifliği bildirmiştir. Çabalar ve Karaoğlu (1999), Doğu ve Güneydoğu Anadolu bölgesinde kamuya ait işletmelerden ve halk elinde bulunan sığırlardan alınan 471 adet serum örneğinde SNT sonucunda % 14.3-100 arasında BVDV seropozitifliği saptamışlardır. Yavru ve ark. (2005), Konya Et ve Balık Kurumu Mezbahası’ ndaki sığırlardan aldıkları toplam 254 kan serumu örneğini mikronötralizasyon testi (mNT) ile BAV- 1, 2 ve 3, IBR/IPV,PIV-3, BRSV ve BVDV nötralizasyon antikorları yönünden kontrol ederek, BVDV’ una karşı % 44.09 oranında bir seropozitiflik belirlemişlerdir. Yıldırım ve Burgu (2005), Kuzeydoğu Anadolu bölgesindeki sığırlarda mavidil (BT), IBR, PIV-3, Bovine Leukemia Virus (BLV) enfeksiyonlarının seroprevalanslarını araştırmak amacıyla 8 ildeki özel sektöre ait organize yetiştiricilik yapılan ve aile işletmelerinde bulunan sığırlardan aldıkları toplam 506 kan serumu örneğini mikronötralizasyon testine tabi tutarak, BVD virusuna karşı % 81.62 oranında bir seropozitiflik belirlemişlerdir. Okur-Gümüşova ve ark. (2007), Türkiye’ nin Samsun ilindeki aşılanmamış, 1-3 yaş arasındaki 188 sığırdan aldıkları kan serumu örneklerini, SNT’ ni kullanarak, sığırlarda solunum sistemi hastalıklarına neden olan 5 virusa (BHV-1, BVDV,PIV-3, BAV-1 ve BAV-3) karşı antikorlar yönünden test ederek, BVDV’ una karşı % 53.19 oranında bir seropozitiflik tespit etmişlerdir. Yeşilbağ ve Güngör (2007), Marmara bölgesinde bulunan 7 ildeki 39 sığırcılık işletmesinden topladıkları toplam 584 kan serumu örneğini BHV-1, BVDV, BRSV, PIV-3, BAV-1 ve BAV-3’ e spesifik nötralizan antikorlar yönünden inceleyerek, BVDV’ unun seroprevalansını % 41.4 olarak saptamışlardır. Bu çalışmada ise, BVDV enfeksiyonunun seroprevalansı