T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Çocukluk Çağı Tüberküloz Olgularında
IL-12p40, IL-12Rβ1, IFNɣR1, IFNɣR2
Gen Mutasyonlarının Araştırılması
Dr. Merve Saka GÜVENÇ
Uzmanlık Tezi
Tez Danışmanı
Doç. Dr. Hüseyin ONAY
Ocak 2014
ii
İÇİNDEKİLER
İÇİNDEKİLER ... ii TABLO DİZİNİ ... iv ŞEKİL DİZİNİ ... v KISALTMALAR ... vi ÖNSÖZ ... vii 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 4 2.1 Tüberküloz ... 4 2.2 Tarihsel Gelişim ... 6 2.3 Tüberküloz Epidemiyolojisi ... 7 2.3.1 Dünya’da TB ... 8 2.3.2 Türkiye’de TB ... 9 2.4 Tüberküloz Basili ... 11 2.5 Tüberküloz Patogenezi ... 112.6 Klinik Bulgular ve Tanı ... 16
2.7 Korunma ve Tedavi... 17 2.8 Tüberküloz İmmunolojisi ... 18 2.8.1 Doğal İmmünite... 19 2.8.2 Kazanılmış İmmünite ... 20 2.8.2.1 Humoral İmmünite ... 20 2.8.2.2 Hücresel İmmünite ... 21 2.8.2.2.1 Sitokinler ... 22
2.8.3 Geç Tip Aşırı Duyarlılık Reaksiyonu ... 24
2.9 Tüberkulozda Genetik Yatkınlık ... 24
2.9.1 Mikobakteriyel Hastalıklara Mendeliyen Yatkınlık ... 27
2.9.1.1 IFNGR1 eksikliği ... 31
2.9.1.2 IFNGR2 eksikliği ... 32
2.9.1.3 IL12Rβ1 eksikliği ... 34
2.9.1.4 IL12p40 eksikliği ... 35
iii
3.1 Olgu Seçimi ... 37
3.2 Olgularda Moleküler Genetik Çalışma ... 37
3.2.1 Örneklerin Toplanması ve DNA İzolasyonu ... 38
3.2.2 Tüm Genom Amplifikayonu ... 38
3.2.3 Araştırılan DNA Bölgelerinin Çoğaltılması ... 40
3.2.4 Amplifiye Edilen Bölgenin Değerlendirilmesi ... 49
3.2.5 PCR Ürünlerinin Birinci Pürifikasyon İşlemi ... 51
3.2.6 Pürifikasyon Ürünlerinin Cycle Sequencing İşlemi ... 52
3.2.7 Ürünlerin İkinci Pürifikasyon İşlemleri ... 52
3.2.8 Örneklerin Sekans Cihazına Yüklenmesi ... 53
4. BULGULAR ... 54 5. TARTIŞMA ... 64 6. SONUÇLAR ... 79 7. ÖZET ... 80 8. ABSTRACT ... 81 9. KAYNAKLAR ... 82
iv
TABLO DİZİNİ
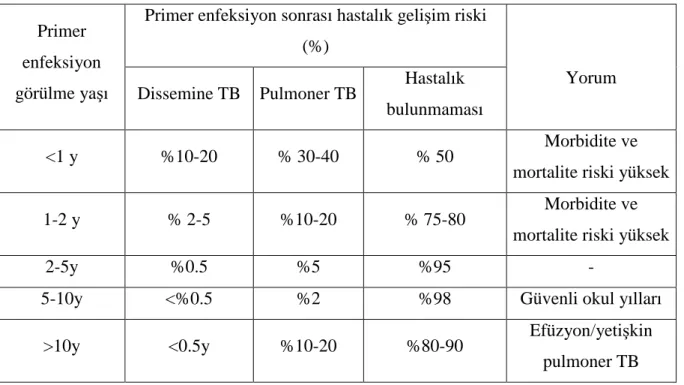
Tablo 1: Yaşlara göre primer TB enfeksiyonu sonrası hastalık gelişimi için spesifik risk oranları
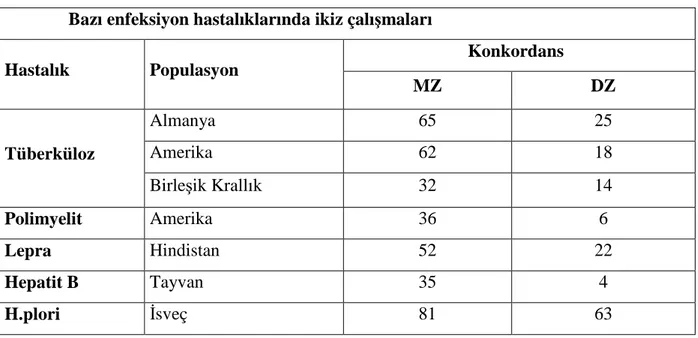
Tablo 2: Enfeksiyon hastalıklarında ikiz çalışmaları
Tablo 3: Tiplere ve yaşlara göre ayrılmış TB hastaları, 2012 Tablo 4: Enfeksiyon hastalıklarına sebep olan genler
Tablo 5: MHMY ve Genetik Heterojenite Tablo 6: IFNGR1 PCR Primerleri
Tablo 7: IFNGR2 PCR Primerleri Tablo 8: IL12B PCR Primerleri Tablo 9: IL12RB1 PCR Primerleri
Tablo 10: IFNGR1 amplifikasyonu için PCR Miksi hazırlanışı Tablo 11: IFNGR2 amplifikasyonu için PCR Miksi hazırlanışı Tablo 12: IL12B amplifikasyonu için PCR Miksi hazırlanışı Tablo 13: IL12RB1 amplifikasyonu için PCR Miksi hazırlanışı Tablo 14: IFNGR1 amplifikasyonu için PCR Koşulları
Tablo 15: IFNGR2 amplifikasyonu için PCR Koşulları Tablo 16: IL12B amplifikasyonu için PCR Koşulları Tablo 17: IL12RB1 amplifikasyonu için PCR Koşulları Tablo 18: Cycle Sequencing için hazırlanan karışım Tablo 19: Cycle Sequencing için PCR koşulları
Tablo 20: Çalışmaya dahil edilen olguların sosyodemografik özellikleri Tablo 21: IFNGR2 Geninde Saptanan Sonuçlar
Tablo 22: IFNGR2 Geninde Saptanan Sonuçlar Tablo 23: IL12B Geninde Saptanan Sonuçlar Tablo 24: IL12RB1 Geninde Saptanan Sonuçlar
Tablo 25: Saptanan polimorfizmlerin olgu grubundaki sıklığının toplum sıklığı ile karşılaştırılması
v
ŞEKİL DİZİNİ
Şekil 1: Dünyada TB insidansıŞekil 2: Türkiye’de TB insidansı
Şekil 3: Mikobakteriler tarafından makrofaj ve T lenfositlerin aktive olması Şekil 4: TH lenfositlerinin farklılaşması
Şekil 5: Tip1 sitokin yolağı ve bu yolağı etkileyen genetik nedenler Şekil 6: TB yatkınlık yapan veya konak rezistansına sebep olan genler Şekil7: MHMY Dünya’da dağılımı
Şekil 8: MHMY’ye sebep olan genler Şekil 9: Tip1 sitokin yolağı
Şekil 10: IFNGR1 geni kromozomal lokalizasyonu Şekil 11: IFNGR1 geninin şematik gösterimi Şekil 12: IFNGR1 geni kromozomal lokalizasyonu Şekil 13: IFNGR2 geninin şematik gösterimi Şekil 14: IL12RB1 geni kromozomal lokalizasyonu Şekil 15: IL12B geninin şematik gösterimi
Şekil 16: IL12B geni kromozomal lokalizasyonu Şekil 17: IL12RB1geninin şematik gösterimi Şekil 18: IFNGR1 geni PCR ürünleri jel görüntüsü Şekil 19: IFNGR2 geni PCR ürünleri jel görüntüsü Şekil 20: IL12B geni PCR ürünleri jel görüntüsü Şekil 21: IL12RB1 geni PCR ürünleri jel görüntüsü
vi
KISALTMALAR
TB = TüberkülozMTB = Mycobacterium Tuberculosis BCG = Bacille Calmette-Guérin
MTC = Mycobacterium Tuberculosis Complex
HIV = Human Immunodeficiency Virus
DZ = Dizigot MZ = Monozigot
NTM = Non-Tüberküloz Mkobakteriler
NRAMP-1 = Natural Rezistance Associated Macrophage Protein-1 MBL = Mannoz Bağlayan Lektin
TNF-α = Tümör nekroz faktörü-alfa
MHMY = Mikobakteriyal Hastalıklara Mendelyan Yatkınlık IFNɣ = İnterferon Gamma
IFNɣR1 = İnterferon Gamma Reseptör 1 IFNɣR2 = İnterferon Gamma Reseptör 2 IL-12B = İnterlökin-12 Beta
IL-12RB1 = IL-12 reseptör β-subünit 1 EZN = Erlich-Ziehl-Neelsen TCT = Tüberkülin Cilt Testi
DGTS = Doğrudan Gözetimli Tedavi Stratejisi DSÖ = Dünya Sağlık Örgütü
CMI = Cell Mediated Immunity DTH = Delayed-Type Hypersensitivity AARB = Asido-alkolo Rezistan Bakteri MHC = Major Histocompatibility Complex MAF = Minör Allel Fekansı
vii
ÖNSÖZ
Uzmanlık eğitimim süresince bilgi ve deneyimlerinden faydalandığım, tezimin her aşamasında desteğini gördüğüm tez danışmanım Doç. Dr. Hüseyin Onay’a, bilgi ve deneyimleriyle eğitimime katkıda bulunan değerli hocalarım Prof. Dr. Cihangir Özkınay’a, Prof. Dr. Ferda Özkınay’a, Prof. Dr. Özgür Çoğulu’ya, Doç.Dr. Haluk AKIN’a, Yrd. Doç. Dr. Asude Durmaz’a ve Yrd. Doç. Dr. Emin Karaca’ya teşekkür ederim.
Her zaman yardımlarını gördüğüm başta Uzm. Dr. Ayça Aykut ve Uzm. Dr. Burak Durmaz’a olmak üzere tüm uzman arkadaşlarıma teşekkür ederim.
Asistanlık sürecinde zor dönemlerimizde birbirimize destek olduğumuz, tezimin çalışmalarında sürekli yardımını ve desteğini gördüğüm Dr. Biray Ertürk’e, beraber çalışmaktan büyük keyif aldığım tüm asistan arkadaşlarıma teşekkür ederim.
Uzmanlık eğitimim boyunca birlikte çalıştığım Tıbbi Genetik Anabilim Dalı’nda birlikte çalıştığım tüm biyolog, teknisyen ve sekreter arkadaşlarıma ayrı ayrı teşekkür ederim.
Her konuda beni destekleyen ve hep yanımda olan aileme çok teşekkür ederim.
1
1. GİRİŞ ve AMAÇ
Tüberküloz (TB) Mycobacterium tuberculosis (MTB) basilinin neden olduğu kronik, nekrotizan bir granülomatöz hastalıktır. Tüberküloz 1921 yılında BCG (Bacille Calmette-Guérin) aşısının geliştirilmesine ve 1950'li yılların ortalarından itibaren etkili bir şekilde tedavi edilebiliyor olmasına rağmen, 2000’li yıllara gelindiğinde halen tüm dünyada, özellikle de gelişmemiş ülkelerde, önemli bir sağlık sorunu olma özelliğini korumaktadır. Tüm dünya nüfusunun yaklaşık üçte biri tüberküloz basili ile enfektedir. Her yıl 8 milyon yeni hasta ortaya çıkmaktadır ve 2 milyon kişi tüberkülozdan ölmektedir (1).
MTB ile enfekte olan bireylerin tamamına yakınında enfeksiyon gelişmekle beraber klinik hastalık tablosu ise sadece enfeksiyonu geçirenlerin %5-10 kadarında ortaya çıkmaktadır (2). MTB enfeksiyonu ile klinik tüberküloz gelişimi arasında enfeksiyon ajanı, çevresel faktörler ve konak kaynaklı kompleks bir ilişki vardır. Klinik hastalık tablosu ortaya çıkan hastaların ancak çok azında diabetes mellitus, ileri yaş, alkol bağımlılığı, HIV enfeksiyonu, kortikosteroid kullanımı gibi altta yatan bir risk faktörü tespit edilebilmektedir (3). İstatistikçi Karl Pearson 1912’de TB’ye duyarlılıktaki ırksal farklılıkları göstermeye çalışırken şu temel soruyu ortaya atmıştır, “Aynı çevresel ortam içerisinde alışılmış şekilde ve pratik anlamda aynı enfeksiyon riski altında yaşayan kişilerin, birikimleri ne olursa olsun tüberküloz hastalığının gelişmesi için aynı şansa sahip olup olmadıklarını araştırmalıyız” (4).
Bir kişinin TB’a yatkınlığını veya direncinin olması bulunduğu etnik kökene göre değişiklik göstermektedir, bu durum klinik tablonun ortaya çıkmasında konağa ait genetik özelliklerin önemli olduğunu göstermektedir (5). Yapılan birçok epidemiyolojik çalışma tüberküloza yol açan genleri ortaya koymuştur.
Endemik bir hastalık tablosu olan ortaya çıkaran TB enfeksiyonunun yayılmasından, uzun yıllar sosyo-ekonomik, epidemiyolojik ve beslenme ile ilişkili faktörler sorumlu tutulurken, özellikle son 10 yılda yapılan aile ve ikiz çalışmaları ile moleküler yöntemlerin devreye girmesi ile çeşitlenerek devam eden çalışmalar, konağa ait genetik faktörlerin de en az çevresel faktörler kadar önemli olduğunu ortaya koymuştur (6). TB hastalarında yapılan ikiz çalışmaları konağa ait genetik özelliklerin önemli olduğunu, dizigot (DZ) ikizlerle karşılaştırıldığında monozigot (MZ) ikizlerdeki yüksek konkordansı göstererek ortaya koymuştur (7). Sonuçta MTB ile enfekte birey sayısının sadece %10’unda klinik hastalık
2
tablosunun ortaya çıkması, etnik kökene göre bu hastalık tablosunun ortaya çıkışının değişiklik göstermesi ve en önemlisi MZ ikizlerde %65 civarında konkordans göstermesi TB yatkınlığında genetiğin önemli bir rolü olduğunu göstermektedir. Genetik nedenlerin ortaya konması sayesinde riskli gruplar belirlenebilir, bunun sonucunda bu bireylere proflaktik antimikrobiyal kullanımı ve aşı uygulamalarında yeni yaklaşımların belirlenmesiyle TB enfeksiyonunun kontrol altına alınması sağlanabilir.
MTB enfeksiyonun klinik enfeksiyona dönüşüp dünüşmeyeceğini belirleyen; basilin üremesi ve öldürülmesi ile doku nekroz, fibroz ve rejenerasyonu arasındaki dengedir. Bu denge üzerindeki en önemli etkiyi; konak duyarlılığı üzerinde etkileri olduğu düşünülen bir takım genetik faktörlerin yaptığı düşünülmektedir. Bunlar arasında HLA , Vitamin D reseptörü, doğal direnç ilişkili makrofaj proteini-1 (NRAMP-1; natural rezistance associated macrophage protein-1), mannoz bağlayan lektin (MBL) ve sitokin (Tümör nekroz faktörü-alfa; TNF-α ve interlökin-1; IL-1) genlerindeki mutasyon ve polimorfizmler sayılabilir (8).
TB oluşumuna yol açan genetik nedenlerin yanı sıra özellikle erken çocukluk döneminde ağır enfeksiyon tablosu görülmesine yol açan Mikobakteriyal Hastalıklara Mendelyan Yatkınlık ‘Mendelian susceptibility to mycobacterial diseases (MHMY)’ nadir görülen konjenital bir durumdur. İmmün yetmezliği olmayan sağlıklı çocuklarda özellikle BCG ve çevresel non-tüberküloz mikobakteriler (NTM) gibi zayıf patojen özelliği olan bakterilerin sebep olduğu şiddetli hastalık tablosu oluşmaktadır. Bu hastalarda, erken çocukluk döneminde düşük virülans özelliği olan mikobakterilerle olan enfeksiyonun yanında MTB enfeksiyonları da daha şiddetli oluşmaktadır (9). Günümüze kadar MHMY tablosundan interferon gamma (IFNɣ) ve interlökin-12 (IL-12) yolağında görevli 6 gen tanımlanmıştır. MHMY tablosuna yol açan mutasyonlar otozomal dominant, otozomal resesif veya X’e bağlı kalıtım göstermektedir. MHMY tablosuna en sık yol açan genetik etyolojik neden IL-12 reseptör β-subünit (IL-12Rβ1) eksikliğidir (10,11).
Mikobakteriler, özellikle gelişmekte olan ülkelerde ciddi morbidite ve mortalite nedeni olan, aerop, sporsuz, hareketsiz bakterilerdir. Günümüzde 70’den fazla mikobakteri türü tanımlanmıştır. Bunların birçoğu mikobakteriyal enfeksiyonlara sebep olurken, insanlarda en sık ve ciddi hastalıklara yol açanlar; M.tuberculosis, M.leprae, M.avium kompleksi, M.kansasii, M.fortuitum, M.cheloniae ve M.abscessus’tur. Mikobakteriyal hastalıklara yatkınlıkta genetik heterojenite yüksek rol oynamaktadır. Mikobakteriyal enfeksiyonlara yanıt
3
tip 1 sitokin yoluyla olmaktadır. Yapılan çalışmalara göre tip 1 sitokin yolağının komponentlerini oluşturan genlerde meydana gelen mutasyonlara sahip bireylerde, düşük virulans özelliği bulunan mikobakteriler bile enfeksiyona neden olabilmektedir. İnterferon gamma (IFNɣ) ve interlökin-12 (IL-12) mikobakteriyal enfeksiyonlara immun yanıtta önemli rol oynamaktadır. IL-12p40, IL-12 reseptör β-subünit (IL-12Rβ1), IFNɣ reseptör 1 (IFNɣR1), IFNɣ reseptör 2 (IFNɣR2) genlerinde meydana gelen mutasyonların öldürücü enfeksiyonlara yol açtığı gösterilmiştir (12). Çocukluk döneminde ortaya çıkan TB enfeksiyonlarının daha şiddetli olduğu bilinmektedir. Bu çalışmada çocukluk çağı tüberküloz olgularında tip 1 sitokin yolağında görevli genlerdeki mutasyonların araştırılması amaçlanmıştır.
Bu amaçla çocukluk çağı tüberküloz olgularına ait DNA’lardan tip 1 sitokin yolunda görevli genlerden olan IL-12B, IL-12Rβ1, IFNɣR1, IFNɣR2 genlerindeki mutasyonların araştırılması planlanmıştır. Çocukluk çağı tüberküloz olgularında IL-12p40, IL-12Rβ1, IFNɣR1, IFNɣR2 mutasyon profilinin belirlenmesi ve böylelikle ölümcül seyreden olgularda rastlanılan gen mutasyonlarının yetişkinlere göre daha şiddetli mikobakteriyal enfeksiyon gelişen çocukluk dönemindeki olgularda hastalığa neden olduğu ortaya konması; çocukluk dönemi tüberkülozlu olgularda tanı ve tedavide yardımcı olacaktır.
4
2.
GENEL BİLGİLER
2.1. Tüberküloz
TB, Mycobacterium tuberculosis complex (MTC) olarak adlandırılan bir grup mikobakteri tarafından oluşturulan, birbirinden değişik klinik görünümlerde olabilen kronik, nekrotizan bir enfeksiyondur. MTC oluşturan patojenler M. tuberculosis, M. africanum, ve M. Bovis’dir. Kompleksin diğer elemanı M.microti ise kemirgenler için patojendir (7). Hastalığın oluşumundan % 97-99 oranında M. Tuberculosis (MTB) sorumludur (6). Hastalığın en kuvvetli patojeni olan M.tuberculosis basili çok sayıda antijene ve değişik virülans faktörlerine sahiptir, bunun sonucunda farklı klinik tablolar gelişmektedir.
Tüberküloz çoğunlukla akciğer tutulumuyla giden, klinik olarak ateş, öksürük, kilo kaybı ve anormal akciğer grafisi ile karakterize olan pulmoner tüberküloz tablosu şeklinde ortaya çıkmaktadır. Aynı zamanda diğer organların tutulumunun olduğu, etkilenen organa bağlı olarak semptomların değişiklik gösterdiği ekstrapulmoner tüberküloz tablosuna da yol açabilmektedir (13).
Çalışmalarda balgam yaymasında basil pozitif ve HIV negatif pulmoner TB olgularının %70’ inde ilk 10 yıl içinde, kültür pozitif ancak balgam yayma negatif olgularının ise %20’sinde ilk 10 yıl içinde ölüm gerçekleşir (14).
TB, çocuklarda ve adölesanlarda morbidite ve mortalitenin önemli bir nedeni olup, erişkin TB olgularında olduğu gibi daha çok gelişmekte olan ülkelerde görülmektedir (15,16). Çocukluk çağı TB olguları toplam TB olgularının %15-40’ını oluşturmaktadır (17). Çocuklarda 2 yaşından önce oluşan primer enfeksiyon sıklıkla ilk 12 ayda içinde belirgin bir bulgu vermeden ciddi hastalığa ilerlerken, 2-10 yaş arasında belirgin bulgu vererek ciddi hastalık oluşturur. 10 yaşından sonra ise primer enfeksiyon yetişkin tip hastalığa ilerlemektedir (Tablo1) (8).
5
Tablo 1: Yaşlara göre primer TB enfeksiyonu sonrası hastalık gelişimi için spesifik risk
oranları (8)
Primer enfeksiyon görülme yaşı
Primer enfeksiyon sonrası hastalık gelişim riski (%)
Yorum Dissemine TB Pulmoner TB Hastalık
bulunmaması
<1 y %10-20 % 30-40 % 50 Morbidite ve
mortalite riski yüksek
1-2 y % 2-5 %10-20 % 75-80 Morbidite ve
mortalite riski yüksek
2-5y %0.5 %5 %95 -
5-10y <%0.5 %2 %98 Güvenli okul yılları
>10y <0.5y %10-20 %80-90 Efüzyon/yetişkin pulmoner TB
Günümüzde ikiz çalışmalarının sonuçlarının da desteklediği gibi, tüberküloz konağa ait genetik faktörlerin de hastalığın ortaya çıkışında ve prognozunda etkili olduğu nekrotizan, kronik bir enfeksiyondur. Almanya-Lübeck’ te uzun yıllar önce çocuklara Calmette-Guérin basili yerine M. Tuberculosis ile immunizasyon yapıldığında TB için değişken yatkınlığın olduğu ortaya çıkmıştır (18). Bu yargı lepra, hepatit, polimyelit ve TB gibi farklı enfeksiyoz hastalıkları içeren birçok geniş ikiz çalışmalarıyla desteklenmiş ve dizigot ikizlerle karşılaştırıldığında monozigotlarda yüksek konkordans olduğu gösterilmiştir (Tablo 2)(19).
6
Tablo 2: Enfeksiyon hastalıklarında yapılan ikiz çalışmalarında gözlenen konkordans oranları
(19)
Bazı enfeksiyon hastalıklarında ikiz çalışmaları
Hastalık Populasyon Konkordans MZ DZ Tüberküloz Almanya 65 25 Amerika 62 18 Birleşik Krallık 32 14 Polimyelit Amerika 36 6 Lepra Hindistan 52 22 Hepatit B Tayvan 35 4 H.plori İsveç 81 63 2.2. Tarihsel Gelişim
TB geniş coğrafik dağılımı olan çok eski bir hastalıktır. Mycobacterium cinsinin 150 milyon yıl öncesinden beri var olduğu düşünülmektedir (20,21). TB’nin Mısır’da 5000, Hindistan’da 3300 ve Çin’de 2300 yıl önce var olduğu belgelendirilmiştir (20).
Mikobakterilerin, lipit bakımından zengin hücre duvarları ve stabilitelerini arttıran DNA’larındaki yüksek G-C oranından dolayı diğer bakterilere göre yıllar boyunca daha iyi korunmuş oldukları düşünülmektedir (22).
Tüberküloz hastalığında yıllar boyunca belirli dalgalanmalar görülmüştür. İngiltere’de 1600 yılından itibaren hastalığın sıklığının giderek arttığı ve 1667 yılında Londra’da ölümlerin %25’ inden tüberkülozun sorumlu olduğu bildirilmiştir. Hastalık 17. ve 18. yüzyılda meydana gelen salgınlar sonucunda İngiltere’den tüm Batı Avrupa ülkelerine, keşifler sayesinde de tüm dünyaya yayılmıştır. 19. yüzyılın başlarında Avrupa nüfusunun %70’ inin tüberkülozlu olduğu tahmin edilmektedir.
7
Robert Koch 24 Mart 1882’de tüberkülozun sebebi olan Mycobacterium basilini hastaların balgam örneklerinde göstermiştir. Bu bilgi TB hastalığının kontrol ve tedavisi için yeni buluşlara öncülük etmiştir.
1897 yılında ise Flügge tarafından hastalığın bulaş yolunun damlacıklar olduğu bildirilmiştir. Aynı yüzyılın sonlarında X ışınının Wilhelm Konrad von Roentgen tarafından bulunmasıyla radyolojinin temeli atılmıştır. Radyoloji yardımıyla hastalığın konaktaki prognozunun takibi sağlanmıştır.
Günümüzde halen kullanılmakta olan Bacille Calmette-Guérin, BCG aşısını ise Calmette ve Guerin 1922 yılından bulmuşlardır. Tüberküloz kemoterapisinde ilk başarılı sonuçlar, 1944 yılında Streptomisin uygulanmasıyla elde edilmiştir. Streptomisinin başta olmak üzere antitüberküloz ilaçların keşfi, M. tuberculosis’in tedavi edilebilecek bir bakteri olduğu gösterilmiştir.
Tüm bu buluşlara rağmen TB, hala dünyada önemli bir sağlık sorunu olarak varlığını devam ettirmektedir. Balgam yayma pozitif TB hastaları konuşma, öksürme ve hapşırma sırasında canlı basil içeren büyük veya küçük damlacıklar çıkartabilirler. Enfektivitenin, çevresel koşullarla ve balgamdaki basil içeriği, kavitasyon varlığı, öksürme sıklığı, larengeal TB varlığı gibi kişisel koşullar ile ilişkili olduğu da bulunmuştur (21).
2.3. Epidemiyoloji
1970’lerden itibaren batı ülkelerinde sosyo-ekonomik gelişmenin sağlanması, tüberküloz hastalarının senatoryumda izolasyonunun yanı sıra BCG aşısı ile tüberküloz ilaçlarının bulunması sayesinde tüberküloz hastalığı giderek azalmıştır. Tüberküloz sorununun bittiğinden ve hastalığın eradikasyonundan bahsedilse de1985’ten itibaren hastalığın görülme sıklığı yeniden artmaya başlamıştır (23). TB basili, konakçı hücrelerde çok uzun süre latent olarak canlılığını sürdürebilmekte ve yıllar sonra ortaya çıkabilmektedir. Bu durum basilin eradikasyonunu zorlaştırmaktadır. TB oluşumunda basil ile birlikte konağa ait sosyal, kültürel, ekonomik ve genetik pek çok etkenin predispozan rol oynadığı bilinmektedir (5).
8
2.3.1. Dünya’da TB
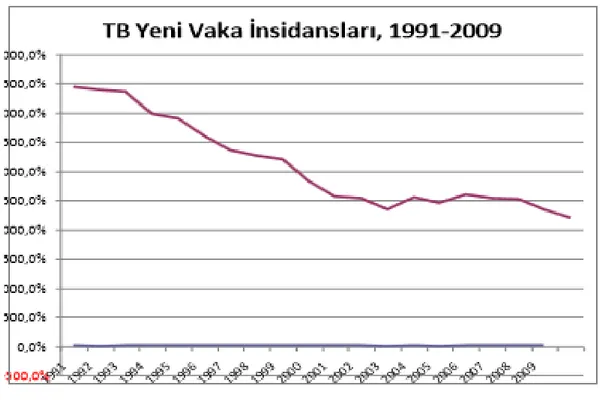
Bugün Dünya nüfusunun %32’si tüberküloz basili ile enfektedir ve her yıl dünya nüfusunun %1’i tüberküloz basili ile enfekte olmaktadır. 2012 yılında yayınlanan son raporlarda 8.6 milyon yeni tanı alan tüberküloz hastasının olduğu ve 1.3 milyon hastada (980000 HIV negatif olgu, 320000 HIV pozitif olgu) ölüm gerçekleştiği tespit edilmiştir. Şekil 1’de 2012 yılında tüm Dünya’da bulunan tahmini TB vaka sayısı gösterilmiştir (24)
Çocuk yaş grubuna bakıldığında Dünya’da 490000 TB hastası çocuk bulunmakta ve çocuk yaş grubunda meydana gelen 64000 ölüm bu hastalığa bağlı olarak görülmektedir. 2012 yılında 15 yaş altı yeni TB tanısı almış çocuk sayısı 349.000 olarak tespit edilmiştir (Tablo 3) (24)
Dünya Sağlık Örgütü, TB kontrolü ile ilgili olarak “Bin Yıl Kalkınma Hedefleri” ve “Stop TB Ortaklığı Hedefleri” yayınlamıştır. Bu bildirgeyle 2015 yılına kadar TB insidansının azaltılması, prevalans ve mortalitenin 1990’ daki seviyelerinin yarısına düşürülmesi, yeni yayma pozitif akciğer TB hastalarının en az %70’ inin kalite kontrollü bakteriyolojik muayene ile tespit edilmesi ve yeni yayma pozitif akciğer TB hastalarının en az %85’ inin başarı ile tedavi edilmesi hedefleri belirlenmiştir (25).
Tablo 3: Tiplere ve yaşlara göre ayrılmış TB hastaları, 2012 (24)
Yayma pozitif Yayma negatif Ekstrapulmoner Toplam bildirimler
Yaşa göre ayrılmış (<15y) Yaşa göre ayrılmamış
2551136 17653 1597530 338441 678953 138509
Yaşa göre ayrım yapılmış
Ülke sayısı 204 184 184
Toplam tahmini çocukluk bildirimleri
349000
Raporlarda elde edilen veriler gelişmekte olan ülkelerde Dünya Sağlık Örgütünün (DSÖ) önerisiyle 1960’larda başlatılan tüberküloz kontrol programlarının 2000’lere gelindiğinde tüberküloz sorununun çözümünde etkili olmadığı göstermektedir. TB sorununun çözümünde etkili olunamaması nedenleri arasında hükümetlerin hastalığı ihmal etmeleri, ilaca
9
dirençli tüberkülozun artışı, HIV’in endemik olduğu yerlerde tüberkülozun patlayıcı artışı ve nüfus artışı bulunmaktadır. Gelişmiş ülkelerde ise göçlerle gelen tüberküloz olguları, o ülkelerde artış nedenlerinden birisini oluşturmaktadır. Tüberkülozlu hasta sayısındaki artış nedeniyle 1990’lı yıllarda Doğrudan Gözetimli Tedavi Stratejisi (DGTS) uygulamaları başlatılmıştır, bu uygulama dünyada hızlı bir şekilde yayılmıştır (1, 23).
Şekil 1: Dünyada 2012 yılında Tahmini TB insidansı
2.3.2.Türkiye’de TB
Bu yüzyılın başında Türkiye’de ciddi bir tüberküloz epidemisi yaşanmıştır. 1950’li yıllara kadar tüberküloz ölümleri, bütün ölüm nedenleri içinde birinci sırada yer almıştır.
Ülkemizde tüberkülozun durumu değerlendirildiğinde, hastalık insidansı açısından başarılı kontrol programı uygulamış ülkeler ile, kötü programlar uygulamış ülkeler arasında bir konumumuzun olduğu görülmektedir (26).
2006 yılından itibaren Türkiye’de de DSÖ’ nün önerdiği DGTS’ nin tüm unsurları ile uygulamasına geçilmiştir. 2009 yılında yayınlanan raporlara göre, Türkiye’de 15.943’ü yeni hasta, 1459’u daha önceden tedavi görmüş hasta olmak üzere toplam 17402 hasta kayıtlara
10
girmiştir. Hastaların 10519’u erkek (% 60.4), 6883’ü (% 39.6) kadındır. Toplam prevalans 24/100000 olarak bulunmuştur. 2009 yılında akciğer tüberkülozu olan hastaların % 88.5’ine bakteriyolojik inceleme yapılmış, mikroskobik pozitiflik oranları % 70, kültür yapma oranı % 63.6 bulunmuştur. Kültür yapılan olgularda % 77.9 pozitiflik saptanmıştır. İlaç duyarlılık testi yapılan 4320 hastanın %19’unda en az bir ilaç direnci saptanmıştır (27).
Şekil 2: Türkiye’de TB insidansı (27)
Şekil 2’de 1991-2009 yılları arasında yeni TB olguları belirtilmiştir (27). Bu oranlar Türkiye’de yeni olgu sayısında düşüş olduğunu göstermektedir.
11
2.4 Tüberküloz Basili (M. tuberculosis)
M. tuberculosis 0.2-0.5 µm eninde, 1-4 µm boyunda bir bakteridir. Aside dirençli uzun ve kısa çomaklar halinde, hareketsiz, sporsuz, aerobik, kapsülsüz bir mikroorganizmadır.
Hidrofob oluşları ve küme halinde üreyişleri sebebiyle dış etkenlere oldukça dayanıklıdır. Aside dayanıklılığı basillerin boyalı preparatlarda kolaylıkla tanınmasını sağlar. MTB hücre duvarındaki yoğun lipid içeriği nedeniyle gram boyasıyla boyanmaz, aromatik metan halkası içeren fuksin veya florokrom boyalar (rodamin, oramin) ile boyanabilir. MTB, Erlich-Ziehl-Neelsen (EZN) yönteminde olduğu gibi alkol ve asit alkol ile yapılan dekolorasyona rağmen boyayı tutar. Bu nedenle asido-alkolo rezistan bakteri (AARB) olarak isimlendirilir. Mikobakteriler, EZN ile mavi zemin üzerinde parlak kırmızı renkte boyanmaktadır (28).
M. tuberculosis için çoğalma zamanı 18-25 saattir. Mera, toprak ve gübrede 2-6 ay canlı kalır. Kurumaya karşı dayanıklıdır. Pastörizasyon ısısında genellikle ölmelerine karşın bazıları 75-80 0C’ ye 5-10 dakika, 100 0C’ye bir dakika, güneş ışığına iki saat dayanır. Alkol (%70-90)’e 5-10 dakika dayanır. Aynı zamanda MTB karanlık ve kuru ortamlarda aylarca canlı kalabilir.
Kimyasal yapısı incelendiğinde MTB protein, polisakkarit ve lipidlerden meydana gelmiştir. Tüberküloz basillerinin hiçbir toksini yoktur. Zorunlu aerob hücre içi bakterilerdir ve bu özellikleri sayesinde akciğerlerin üst loblarına yerleşme eğilimindedirler. Organizmada çoğalmaları sonucunda hastalık meydana getirirler (29).
2.5.Tüberküloz Patogenezi
Tüberküloz hastalığında bulaştırıcılığı yüksek olan hastalar, akciğer, endobronşiyal, larinks tüberkülozlu, balgam yaymasında aside dirençli basil (ARB) pozitif olan, akciğer grafisinde kavitasyon görülen olgulardır. Hastalık etkeni olabilecek damlacık çekirdekleri 1-3 canlı tüberküloz basili içeren ve birkaç saat havada asılı halde kalabilen, çapı 1-5 mikron arasında değişen özelliktedirler.
12
Olgudaki basil sayısı balgam yayması ile değerlendirilebilir. Mililitresinde 10.000 basil bulunan olguların yayması %95 oranında pozitif olarak tesbit edilir. Kültür pozitif hastalarda balgam yayması negatif olanlar, yayması pozitif olanlara oranla daha az bulaştırıcıdırlar (29).
Bulaştırıcı özellikteki tüberkülozlu bir hasta ile karşılaşan, Tüberkülin Cilt Testi (TCT) negatif temaslıların %30’u enfekte olur. Bu olgular, primer enfeksiyon olarak adlandırılan klinik ve radyolojik hiçbir bulgu olmaksızın TCT’leri pozitifleşen olgulardır. Enfekte olan bu kişilerin %5’inde enfeksiyonu izleyen ilk 5 yıl içinde erken hastalık gelişimi ile primer tüberküloz gelişir. Enfekte olup primer tüberküloz gelişmeyen %95’lik popülasyonun ise %5’inde oluşan latent enfeksiyon yaşamlarının herhangi bir döneminde geç reaktivasyon hastalığına yani sekonder tüberküloza dönüşür. Latent enfeksiyonlu grup dünya popülasyonunun yaklaşık 1/3’ünü oluşturur. Basil ile enfekte olan olguların %90’nında hastalık gelişmemektedir (2,27).
Damlacık yolu ile alveole ulaşan basillere karşı ilk savunma, alveolar makrofajlar tarafından sağlanır. Basilin çoğalması, alveolar makrofajlar tarafından fagositoz yoluyla önlenir. Alveolar makrofajlar aynı zamanda sitokin üreterek ve basil antijenlerini T lenfositlere sunarak immun savunmada da rol oynarlar. Basiller makrofaj aracılığıyla hücre yüzeyindeki integrin ailesine ait reseptörlere, mannoz reseptörlerine ve kompleman reseptörlerine (CR1, CR3 ve CR4) bağlanır (30,31).
Farklı mekanizmalar yardımıyla fagozom içine alınan basil yok edilmeye çalışılır. Bu mekanizmalar, fagozom-lizozom birleşmesi, reaktif oksijen ve reaktif nitrojen ara ürünlerinin üretimidir. Bu mekanizmalardan fagozom-lizozom birleşmesi sonrası ortamda bulunan enzimlerin fonksiyonlarını en iyi şekilde gösterebilmeleri için, ATP bağımlı bir proton pompasıyla ortamın asiditesinin (pH ~ 5) sağlanması gerekir (32). Ancak MTB yoğun amonyak üretebilme yeteneği nedeniyle lizozomal enzimlerin etkisini azaltarak ve diğer bir mikobakteriyel ürün olan sülfatidler ile birlikte de fagozom-lizozom birleşmesini inhibe ederek vakuol içindeki toksik çevreden kaçabilir (4). Diğer hücre içi öldürme mekanizmalarından nitrojen ve oksijen ara ürünlerinin üretimi ise basilin protein yapısı ve DNA’sında hasar oluşturarak ölümüne neden olur. Ayrıca enfekte makrofajın apoptozisi, hücre içi canlı basil sayısını azaltarak konakçı savunmasına katkıda bulunmaktadır (32).
13
Tüberküloz, hücresel immun yanıt ile kontrol altına alınan bir enfeksiyondur. Basilin alveole yerleşmesinden 2-3 hafta sonra antijene özgü konakçı immun yanıtı oluşur. Antijene özgü konakçı yanıt, bölgesel lenf bezlerinde, T hücreleri, makrofajlar ve diğer özelleşmiş antijen sunucu hücreler olan dendritik hücreler arasındaki koordineli etkileşim sonucu gelişir. Makrofaj içinde ortadan kaldırılmaya çalışılan basilin antijenik yapılarından bazıları (epitoplar) majör doku uygunluk kompleksine (major histocompatibility complex-MHC) bağlanarak, makrofaj yüzeyine taşınır ve değişik T lenfosit alt gruplarına sunulur. Aktive olan T-helper (Th) lenfositler İnterlökin-2 ile klonal genişleme gösterip, sitokinlerden özellikle İnterferon-gama (IFNɣ), Tümör Nekrozis Faktör-beta (TNF-β) üreterek inaktif makrofajları aktive eder. CD4+ Th lenfositler makrofajları aktive etme işleminin yanı sıra, sitotoksik T lenfosit aktivitesi göstererek basilleri doğrudan yok edebilirler. Tüberkülozda Th lenfositlerin iki alt grubu Th1 ve Th2, makrofaj aktivasyonu konusunda birbirine karşıt etki gösterir. Th1 antijenin olduğu bölgeye makrofajları toplarken, Th2 makrofaj aktivasyonunu baskılayan İnterlökin-4, 5, 6, 10 üretir. Tüberkülozda hücre aracılı immun yanıt (Cell Mediated Immunity-CMI) için makrofajları aktive eden esas hücreler Th1 lenfositlerdir. Konağın CMI yanıtı makrofaj aktivasyonu ile basil çoğalmasını inhibe eden bir süreç olarak tanımlanırken, gecikmiş tip aşırı duyarlılık (Delayed-Type Hypersensitivity-DTH) yanıtı basillerin üremesi için uygun hücre içi ortamı ortadan kaldırıp, basil yüklü aktive olmamış makrofajları ve komşu dokuları hasarlayarak basil çoğalmasını önleyen bir süreçtir. Bu iki sürecin gelişimi tüberküloz patogenezinde belirgin rol oynamaktadır. Bu immun yanıtlar oluşuncaya kadar, basilin kendisi konakçı dokularda herhangi bir hasar yaratmaz (27,33).
Tüberkülozda DTH reaksiyonu, içinde tübeküloz basilleri çoğalan inaktive makrofajları ve bu arada komşu dokuları harap eden bir süreçtir. Konakcının bu yanıtı, hem kazeöz nekroz hem de erime (likefaksiyon) ve kavite oluşumuna neden olur. DTH tarafından yaratılan yerel nekroz, CMI tarafından yerel makrofaj aktivasyonu sağlaması için konakçıya zaman kazandırır. DTH tarafından oluşturulan nekrotik bölge kenarından kaçan basiller yerel makrofajlar tarafından tutulur. Makrofajlar, CMI tarafından aktive edilmiş ise fagosite ettiği basilleri öldürecektir. Eğer makrofajlar aktive edilmemiş ise basiller makrofaj içinde çoğalmaya devam edecektir. Bu çoğalmayı önlemek için DTH yanıtı tekrarlanacak ve böylece kazeöz nekroz alanları genişleyecektir (27,33). Alveoler makrofajlarda ilk enfeksiyondan kavite oluşumuna kadar devam eden olayları açıklayan beş evre tanımlanmıştır (31,33).
14
Evre I: Başlangıç evresi (1. hafta)
İnhale edilen basillerin en sık yerleştiği orta ve alt akciğer zonlarında viseral plevranın hemen altında, kapiller dilatasyon ve kandan gelen polimorf nüveli lökositlerin eksudasyonu sonucu başlangıç evresi başlar. Lezyon bölgesine alveolar makrofajların toplanmaya başlamasıyla özgül olmayan bir inflamatuar yanıt gelişir.
Evre 2: Ortak yaşam, basillerin çoğalma ve yayılma evresi (2-3. hafta)
İkinci evrede tüberküloz basili yaşamak için makrofaj tarafından alınmak zorundadır. Alveoler makrofaj içinde basil çoğalır ve makrofajı parçalar. Makrofajın parçalanmasıyla ortama kemotaktik faktörler salınır, bu faktörler dolaşımdaki inaktif makrofajların lezyon bölgesine gelmesine neden olur. Basillerin etrafında toplanan makrofajlar granülom oluşumunu başlatırlar. İlk oluşan odağın yerleşim yeri hemen daima subplevral bölgedir ve genellikle orta-alt akciğer zonlarında bulunur. Basil yüklü makrofajlar lenfatiklerle bölgesel lenf nodlarına taşınır, eğer makrofajlar kontrol altına alınamazlarsa lenfohematojen yol ile tüm vücuda yayılarak çoğalmaya devam ederler.
Evre 3: Hücre aracılı immun yanıt ve geç tip aşırı duyarlılık gelişimi (3-9. hafta)
Bu evrede CMI ile yok edilemeyecek sayıda lezyonda basil bulunmaktadır. Gelişen DTH yanıtı ile basillerin logaritmik çoğalması engellenir, bu durum granülomların merkezinde kazeöz nekroz odaklarının gelişmesine yol açar. Bu odaklarda basiller canlılıklarını sürdürebilir, fakat anoksik koşullar, düşük pH, toksik yağ asitleri gibi uygun olmayan ortam koşulları nedeniyle çoğalamazlar. Kazeöz dokulardaki basillerin bir kısmı ölür, bir kısmı ise canlılıklarını sürdürürler ancak çoğalamazlar. Doku hasarı bu evrede basilin çoğalmasının önlenmesi ile gerçekleşir. Basilin akciğerlerde ilk yerleştiği orta alt akciğer zonlarındaki primer lezyon (Ghon odağı), hiler ve paratrakeal lenfatiklerle birlikte primer kompleksi oluşturur.
15
Evre 4: CMI ve DTH yanıtları arasındaki karşılıklı etkileşim
Sürecin sürekli durdurulabilmesi için tüberkülün etrafı fibroz bir duvarla çevrilir. Ancak bu durumda bile kazeöz odaktan basil kaçışı olabilir. Kaçan basiller aktive makrofajlar tarafından tutulup yok edilemezse, DTH yanıtı tekrarlanarak makrofajlar öldürülmeye devam edecektir. Sonuç olarak gelişen kazeöz nekroz daha geniş ve şiddetli olacaktır. Bağışıklık sistemi sağlam kişilerde basillerin yok edilmesi ile süreç durdurularak, sadece TCT pozitifliği ile primer enfeksiyon ortaya çıkmaktadır. Bağışıklık sistemi baskılanmış kişilerde ise granülomlardaki kazeöz odaklardan kaçan basiller inaktif ve düşük aktiviteli makrofajlar tarafından tutulur. Bu makrofajlar içinde basil çoğalmasını durdurmak için konakçı doku hasarlayıcı immun yanıtları kullanmaya devam edecektir. Genişleyen kazeöz nekrozlar akciğerde doku hasarına neden olur ve klinik olarak primer tüberküloz gelişir.
Eğer yeterli düzeyde aktive makrofajlar hiç gelişmemişse, doku hasarlayıcı yanıt sürekli tekrarlanır. Bu durumda çok sayıda basil lenfatik ve hematojen yolla akciğerlerden tüm vücuda yayılabilecektir. Kazeöz materyalin doğrudan kan akımına karışması ve pulmoner ven duvarındaki geniş kazeöz odağın (Weigart odağı) açılması ile miliyer ve dissemine tüberküloz formları gelişecektir.
Evre 5: Erime ve kavite oluşumu
Son evrede kaviter lezyonların oluşması izlenmektedir, primer enfeksiyon geliştikten yıllar sonra endojen reaktivasyon ya da reenfeksiyon sonrası gelişen yetişkin tip akciğer tüberkülozunda (sekonder tüberküloz) görülmektedir. primer tüberkülozlu hastaların çok az bir kısmında CMI güçlü olsa bile süreç ilerleyip kazeöz odaklarda erime (likefaksiyon) ve kavite oluşabilir. Hastalığın seyri boyunca basiller ilk kez bu evrede hücre dışında çoğalmaya başlarlar ve sayıları çok fazla çoğalır. Erimiş kazeöz materyale komşu bronş duvarında nekroz gelişir. Bronş rüptürü sonucu bronşial yol ile basiller diğer akciğer bölgelerine yayılır ve öksürük ile dışarıya atılır. Kavite oluşumu hastanın bulaştırıcı özellik kazanmasına sebep olmaktadır (31,33).
16
2.6. Klinik Bulgular ve Tanı
Türkiye gibi tüberkülozun yaygın olduğu ülkelerde tüberküloz basili ile karşılaşmanın yaşamın erken yıllarında olması nedeniyle primer tüberküloz daha çok çocukluk çağında izlenmektedir (27). Sıklıkla küçük çocuklarda görülmeye başlanan tüberkulozun 13 yaşlarına doğru görülme oranı azalsa da sonra tekrar yükselir (34,35).
Primer enfeksiyonu izleyen 5 yıl içinde tüberküloz gelişmesi primer tüberküloz, 5 yıldan sonra gelişen tüberküloz ise sekonder tüberküloz olarak adlandırılmaktadır (27).
Özellikle enfeksiyon kaynağının 4 yaşına kadar alınması durumunda hastalık gelişme riskinin yüksek olduğu bilinmektedir. Bu yaş grubunda miliyer-memenjit tüberküloz kliniği sık görülmektedir. Primer enfeksiyondan sonrası primer tüberküloz gelişme riskinin arttığı diğer iki dönem adelosan ve genç yetişkinlik dönemi ile yaşlılık dönemidir (27). Ekstrapulmoner tüberküloz ise lenfohematojen veya komşuluk sayesinde direkt invazyon sonucu gelişebilir. Ekstrapulmoner tüberküloz da birçok organ tutulumu olabilmektedir ve bu durum özgün olmayan semptomlara neden olmaktadır.
Tüm tüberküloz olgularının %85’ini pulmoner tüberküloz, geri kalan %15’ini tüm ekstrapulmoner tüberküloz olguları oluşturmaktadır. Ekstrapulmoner TB yetişkinlere oranla çocuklarda daha yaygındır (36). Çocuklarda tüberküloz olgularının %25-30’u ekstrapulmoner tüberkülozlu olgulardır (37,38).
Bir yaşın altındaki çocukların %40-50’si, daha büyük çocukların %80-95’i asemptomatiktir. Ateş, öksürük, kilo kaybı ve gece terlemesi hasta çocuklarda en sık karşılaşılan semptomlardır. Aşırı duyarlılık reaksiyonu nedeniyle enfeksiyonun 3-8 haftalarında eritema nodozum veya ilk yıl içinde flikteniler konjonktivit gelişebilir (6).
Tüberküloza ait özgün fizik muayene bulguları bulunmamaktadır ancak TB gelişen hastaların çoğunda solukluk ve kilo kaybı bulunmaktadır. Lezyonun özelliğine göre oskültasyon sonrası raller veya bronşial ses duyulabilir. Yerel büyümüş lenf bezinin bronşa basısı sonucu wheezing duyulur. Yaygın lezyonlar hastalarda obstrüksiyon bozukluğuna yol açar bu durumda çomak parmak gelişimine sebep olabilir. Miliyer tüberkülozlu hastalarda ise yaygın lenfadenopati ve hepatosplenomegali saptanabilir.
17
Ekstrapulmoner TB olgularında bulgular, tutulan organa göre değişir. Böbrek tüberkülozunda idrarda kan, omurga tüberkülozunda sırt ağrısı, plevra tüberkülozunda yan ağrısı ve omuz ağrısı, tüberküloz menenjitte kusma ve baş ağrısı gibi yakınmalar olabilir (27, 37,38).
Uzun süreli öksürük, ateş ve kilo kaybı olan olgular tüberküloz açısından araştırılmalıdır, tüberkülin cilt testi (TCT) ve akciğer grafisi ile olası tanı desteklenir. Hastalık tanısı için önemli kanıtlar ise bulaşıcı bir hasta ile (özellikle aynı evde yaşayan) temas öyküsü, akciğer grafisinde tek taraflı hiler, paratrakeal, lenfadenopati ve/veya akciğer parankim infiltrasyonu varlığı ve TCT pozitifliğidir.
Tüberkülin negatifliği 2-3 ay içinde pozitifleşmezse veya klinik durumda iyileşme varsa tüberküloz tanısından uzaklaşılır (27,39).
Çocukluk yaş grubunda kaviter lezyonların bulunmaması balgam ve mide açlık sıvısında basil saptanmasını zorlaştırır. Klinik bulguları, pozitif TCT, radyolojik olarak tüberküloz ile uyumlu lezyonları olan ve en az bir hafta geniş spektrumlu antibiyotik kullanılmasına rağmen klinik yanıt alınamayan çocuklarda, tekrarlanan balgam ve/veya mide açlık sıvısı örneklerinde aside rezistans bakteri saptanamasa da tüberküloz düşünülmelidir (30,40). Miliyer tüberkülozlu hastaların %30’unda TCT negatiftir. Olguların %33’ünde kültür sonuçları tanıda yardımcıdır. Klinik, radyolojik ve/veya histolojik bulgularla tüberkülozdan şüphelenilen hastalarda kesin tanı sadece klinik örneklerde tüberküloz basilinin gösterilmesi veya üretilmesi ile konabilir (41,42).
2.7. Korunma ve Tedavi
Tüberküloz koruma çalışmalarında, en etkili yaklaşım bulaştırıcı olgulara hızla tanı konulması ve tedavi başlanmasıdır. Bulaşıcılığın en yüksek olduğu dönem tanı öncesi dönemdir. Bulaşıcılığın önlemseninde en etkili yöntem, tedavi başlanmasıdır. Tüberküloz hastası ile teması olan kişide enfeksiyon gelişimini ya da tüberküloz ile enfekte kişide tüberküloz hastalığı gelişimini önlemek için koruyucu ilaç tedavisi uygulanmaktadır. Ancak tüberküloz basili ile enfekte olmuş herkese koruyucu ilaç tedavisi verilmesi çok zordur, bu zorluğun önüne geçmek için tüberküloz hastalığı gelişme riski yüksek olan gruplara ilaç tedavisi önerilmektedir (27,30).
18
Kemoproflaksi için izoniyazid erişkinlerde günde 5 mg/kg (maksimum 300 mg), çocuklarda 10 mg/kg/gün hesabıyla 300 mg’ı geçmeyecek şekilde 6 ay süreyle verilir. HIV pozitiflere, silikozis olanlara, TNF-alfa blokörü ya da diğer bağışıklığı baskılayıcı tedavi alanlara 9 aylık tedavi önerilmektedir.
TB hastalarının tedavi prensiplerine erişkin ve çocuk hastalarda tedavi değişmektedir. Erişkin hastalara uygulanan tedavi şemasına göre; başlangıç döneminde yeni olguya 2 ay süreyle İzoniyazid, Rifampisin, Pirazinamid, Etambutol uygulanırken, nüksle gelen olguya ise 2 ay süreyle İzoniyazid, Rifampisin, Pirazinamid, Etambutol, Streptomisin 1 ay süreyle ise İzoniyazid, Rifampisin, Pirazinamid, Etambutol olmak üzere toplam 3 ay tedavi uygulanır. İdame döneminde ise yeni olgulara 4 ay süreyle İzoniyazid, Rifampisin, nüks olgularına ise 5 ay süreyle İzoniyazid, Rifampisin, Etambutol uygulanmaktadır (43).
Çocuk olgularda ise Akciğer TB, TB lenfadenit ve ağır olmayan akciğer dışı tüberküloz tanılılarda başlangıç döneminde 2 ay süreyle İzoniyazid, Rifampisin, Pirazinamid , idame tedavisinde ise 4 ay süreyle İzoniyazid, Rifampisin uygulanırken, kaviteli-yaygın akciğer TB tanılı çocuklara başlangıç döneminde 2 ay süreyle İzoniyazid, Rifampisin, Pirazinamid, Etambutol ve idame döneminde 4 ay süreyle İzoniyazid, Rifampisin uygulanmaktadır. Eklem-Kemik TB, Miliyer TB, Menenjit TB, Konjenital-Neonatal TB Bağışıklığı baskılanmış TB olgularına 2 ay süreyle İzoniyazid, Rifampisin, Pirazinamid, Etambutol başlangıç döneminde uygulanırken, idame tedavisinde 7-10 ay süreyle İzoniyazid, Rifampisin uygulanmaktadır (43).
2.8. Tüberküloz İmmunolojisi
Basillerin inhalasyon yoluyla organizmaya alınmasıyla pulmoner tüberküloz enfeksiyonu başlamaktadır. Büyük partiküller, lizozim, laktoferrin gibi antibakteriyel sekresyon içeren üst solunum yollarının silyalı epitelyumu tarafından tutulurken, 5 µm’den küçük partiküller alveollere ulaşmakta ve alveolar makrofajlar tarafından fagosite edilmektedir. Tüberküloz basilinin histolitik enzimleri ve toksinleri yoktur, virulans özellikleri sitoplazmik zarın dışında kalan yapılar ve salgıladığı proteinlerce sağlanmaktadır (44,45,46).
Tüberküloza karşı konak yanıtında, hem doğal immünite hem de kazanılmış immünite rol oynamaktadır (47)
19
2.8.1. Doğal İmmünite
Alveollere ulaşan MTB basilleri, doğal savunma yollarıyla yok edilebilir veya çoğalarak klinik görünümlerini oluşturabilirler. Konağın doğal savunmasında; üst solunum yolunun fiziksel engeli, fagositoz, fagositik hücrelerin reaktif nitrojen ve oksijen ürünleri, inflamatuar hücreler ve saldıkları sitokinler, alveoler makrofajların kimyasal yapısını değiştirmesi, apoptoz ve genetik faktörler rol oynar (46).
Doğal immünitede nötrofiller, dendritik hücreler ve doğal öldürücü (naturel killer- NK) hücreler görevli olsada esas sorumlu olan makrofajlar ve salgıladıkları IL-12’dir. Basille karşılaşan dokuda olay yerine ilk gelen hücreler nötrofiller ve NK hücrelerdir.
Nötrofiller, bakterilerin fagositozu, oksijene bağımlı öldürme mekanizmaları veya hücre dışı degranülasyon ürünleri ile konak bağışıklık sistemine katkı sağlarlar. NK hücreler ise doğrudan basilleri öldürür veya basille enfekte hücrelerin apopitozunda rol alırlar. IFNγ salgılayarak makrofajları uyarır ve aktive makrofajların IL-12 salgılamalarını ve doğal immün yanıtın başlamasını sağlarlar (47).
Makrofajların yüzeyinde kompleman reseptörleri (CR1,CR2,CR3,CR4), mannoz reseptörleri (MR) ve IL-10, TNF-α, IFNγ, CD14, Tool Like Reseptörler (TLR1,2,3,4) gibi hücre yüzey reseptörleri, makromoleküllerin yakalanmasını sağlayan reseptörler yer almaktadır. Bu reseptörlerin görevleri, MTB’in makrojaflar tarafından tutulması ve fagosite edilmesidir (47).
Mikobakteri antijenleri tarafından uyarılmış olan makrofajlar şekil 3’de de gösterildiği gibi IL-1, IL-6, IL-12, IL-18, IL-23, IFNγ, TNF-α gibi sitokinleri salgılamaktadır (48). Özellikle de IFNγ ve IL-12 ile uyarılan CD4+ T hücrelerinden salgılanan IFNγ, makrofajların aktivasyonlarını ve yüzeylerindeki MHCII ekspresyonunu daha da arttırır, monositleri ve nötrofilleri ortama çağırır ve granülom oluşumu başlar. Bu şekilde opsonizasyon, kompleman aktivasyonu ve fagositoz kolaylaşmakta, basilin sindirilerek yok edilmesi sağlanmaktadır (34).
20
Şekil 3: Mikobakteriler tarafından makrofaj ve T lenfositlerin aktive olması (48)
2.8.2.Kazanılmış İmmünite
Kazanılmış immünite, doğal immünite elemanlarının uyarılmasıyla tetiklenen, T ve B lenfositlerin işlev gördüğü tek bir antijenik yapıya karşı oluşan ve bellek özelliği bulunan immün yanıttır. Hücresel immün yanıt, T hücre aktivasyonu ve bunların efektör işlevleri ile yürütülürken hümoral immün yanıt ise B lenfosit olgunlaşması ve antikor sentezi ile sağlanmaktadır (49).
2.8.2.1.Hümoral İmmünite
Hümoral immün sistemin TB enfeksiyonu oluşumunda nasıl ve ne derecede etkili olduğu tam netlik kazanmamıştır. Aynı zamanda MTB, hücre içi bakteri olması sebebiyle basilin yok edilmesinde hümoral immün sistemin hücresel immün sistemle birlikte etkili olduğu bilinmektedir. Basilin hücre duvarında bulunan birçok protein, karbonhidrat ve lipid yapıların antikor üretimini stimüle ettiği bilinmektedir. Hümoral immün sistemin, TB’de
21
opsonizasyon, kompleman aktivasyonu, antikor bağımlı toksisite ve makrofajların fagositoz fonksiyonlarında etkili olduğu bilinmektedir (47,49).
Ayrıca hücresel immün sistem yanıtın artmasında, CD4 ve CD8 T lenfositlerin proliferasyonlarının ve IFNγ sekresyonlarının artışının sağlanmasında hümoral immün sistemin etkili olduğu gösterilmiştir (50).
2.8.2.2.Hücresel İmmünite
Makrofajlar, dendritik hücreler, sitokinler ve T lenfositler hücresel immünitede görev almaktadır (49). Hücresel immünite, MHC I/II molekülleri aracılığıyla CD8/CD4 T lenfositlere MTB’ye ait antijenlerin dendritik hücreler ve/veya makrofajlarca sunumuyla başlar (47).
Başta IFNγ başta olmak üzere olmak üzere sitokinlerin salgılanması ve makrofajların aktive edilmesi, CD4 T lenfositlerin primer koruyucu fonksiyonudur. CD4 T lenfositler aynı zamanda, CD95 Fas ligandı yoluyla enfekte hücrelerin apopitozunu da sağlamaktadırlar (47). CD4 TH lenfositlerin proliferasyonu ve CD4 TH1 ve CD4 TH2 şeklinde farklılaşması, aktive makrofajlardan salınan interlökinler ve IFNγ tarafından sağlanmaktadır. TH1 lenfosit farklılaşması daha çok IL-12 ve IL-27 tarafından stimüle edilirken, IL-4 ve IL-10 da TH2 lenfosit farklılaşmasını sağlamaktadır. TH1 lenfositler; IL-2 ve IFNγ yapımını sağlarken TH2 lenfositler ise IL-4, IL-5, IL-9, IL10 ve IL-13 yapımına neden olmaktadır (Şekil4) (51).
22
Şekil 4: Th lenfositlerinin farklılaşması
2.8.2.2.1. Sitokinler
MTB enfeksiyonunun kontrolünde anahtar sitokin rolünü, tip 2 interferon olarak da bilinen IFNγ oynamaktadır. 12q14 kromozomal bölgesinde lokalize IFNG geni tarafından kodlanır ve immun reaksiyonlar sırasında antijen veya mitojenler tarafından uyarılan T lenfositlerince üretilmektedir. CD4 Th lenfositleri özellikle TH1 lenfositleri, nadiren de CD8 Th lenfositleri ve NK hücreleri tarafından salgılanan bir sitokindir (47). IFNγ yapımı, IL-2 aracılığı ile T lenfositlerinin birbirleriyle olan aktivasyonları ve IL-12’nin T lenfositleri ve NK hücrelerini uyarmasıyla düzenlenir (51). IFNγ yapımından ön planda Th1 lenfositlerinin sorumlu olduğu çalışmalarda da gösterilmiştir. Ortamda IL-2 varlığında NK hücreleri de IFNγ salgılayabilmektedir (52).
23
IFNγ, makrofajlardaki 1-alfa hidroksilaz enzimini uyararak aktif D3 vitaminin yapımını da arttırmaktadır. D3 vitamininin basillerin makrofaj içi çoğalmasını önlemede yardımcı olduğu ve bu hücrelerden TNF-α gibi sitokinlerin salınımını arttırdığı bilinmektedir (53).
IL-12, makrofaj ve dendritik hücreler tarafından üretilir. NK, CD4 TH ve CD8 TH lenfositlerinin sitotoksik aktivitesini ve IFNγ üretimini arttırır, TH1 lenfosit proliferasyonunu uyarıcı etkide bulunur. Hücre içi mikroorganizmalara karşı erken immün yanıtta ana mediatör, IL-12’dir. MTB ile karşılaşma sonrasında, IFNγ ile birlikte ilk savunma yanıtında, granülasyon dokusu oluşturularak basilin sınırlandırılmasında ve basilin yayılımının engellenmesinde büyük role sahiptir (54,55). IL-12 salınımının azalması sonucu MTB ile enfekte edilen farelerde tüberküloz hastalığı gelişiminin daha hızlı olduğu ve farelerin yaşam süresinin kısaldığı, IL-12 verilme sonrası da direnç kazanarak yaşam sürelerinin iki katına çıktığı gösterilmiştir. IFNγ ile birlikte IL-12 salınımının bozulması konağın basile immün yanıtının bozulmasına ve tüberküloz hastalığı gelişim riskinin artmasına yol açmaktadır (Şekil 5) (56,57,58).
24
2.8.3. Geç Tip Aşırı Duyarlılık Reaksiyonu
Tüberküloz basilinin yapısında bulunan 10kDa’luk küçük proteinlerin karışımı olan tüberkülin proteinleri, LAM ve kord faktör gibi antijenlere karşı tip IV immün yanıt olarak oluşan reaksiyon, geç tip aşırı duyarlılık (hipersensitivite) reaksiyonu olarak adlandırılmaktadır (59,60).
Tüberkülin cilt testi (TCT), MTB’ne karşı spesifik immünitenin göstergesi olan gecikmiş tip aşırı duyarlılık reaksiyonudur. Enfeksiyon başlangıcından yaklaşık 2-6 hafta sonra pozitifleşmektedir. Konakta doku hasarı yapan bu yanıt, kazeöz nekroz ve kavite oluşumuna yol açmaktadır (61).
Basilin CD4 TH lenfositlere makrofajlar tarafından sunulması ve IL-2 salınımı ile gecikmiş tip hipersensitivite reaksiyonunun başlaması sağlanmaktadır. Antijene spesifik olarak aktive olan CD4 TH1 lenfositlerinin antijenle tekrar karşılaşmaları sonrası IL-12 ve IFNγ, TNF-α salınımı ve NK hücrelerinin uyarımı gerçekleşmektedir. IFNγ, geç tip hipersensitivitenin en potent mediatörüdür (62,63).
2.9. Tüberküloza Genetik Yatkınlık
Dünya popülasyonun 1/3’ünün MTB basili ile enfekte olduğu düşünülmektedir. Enfekte bireylerin yalnızca % 5-10 kadarında klinik bulgular gelişmektedir (64). Halen MTB ile enfekte bireylerin neden sadece %10’unda aktif TB geliştiği netlik kazanmamıştır. Sadece net olan enfeksiyon gelişiminde çevresel faktörler, bakteri ve konak genetiği birlikte rol almaktadır (65). Bu hastaların çok az bir kısmında altta yatan risk faktörleri belirlenebilmiştir ki bunlar sosyoekonomik durum, kalabalık yaşam ve malnütrisyon gibi çevresel faktörlerin yanı sıra genetik faktörlerdir (3). Özellikle 1926 ylında 251 çocuğun bir yanlışlık sonucu virulan TB ile immünizasyonun yapılması ve 46 çocukta klinik hastalık gelişmemişken, 77 çocuğun ölmesi ve 127 tanesinde TB’a ait radyolojik bulguların ortaya çıkması konağın genetik yapısının TB’a yatkınlıkta büyük rol oynadığını vurgulamıştır (66). Aynı zamanda etnik kökene göre TB yatkınlığı değişiklik göstermektedir. Avrupalılarda TB enfeksiyona yatkınlık yerine direnç görünürken, Afrikalı olgularda TB enfeksiyonuna yatkınlık görülmektedir. Yapılan ikiz çalışmalarında MZ ikizlerde konkordans %32 civarındayken, DZ
25
ikizlerde konkordans %14 civarındadır (7). Bütün bu veriler TB enfeksiyonuna yatkınlıkta genetik faktörlerin önemli bir yer tuttuğunu vurgulamaktadır.
Enfeksiyöz hastalıkların ortaya çıkış nedenleri araştırıldığında konaktaki genetik varyasyonların birçok mikroorganizmaların neden olduğu bulaşıcı hastalıkların seyri üzerinde önemli etkileri vardır. Son yıllarda gelişen teknikler insan genetik varyasyonlarının ortaya konmasını kolaylaşmıştır, bu sayede birçok gendeki varyasyonların enfeksiyöz patojenlere karşı yatkınlığı etkilediği gösterilmiştir. Birçok ikiz çalışması tüberküloz, polimyelit, lepra, persistant hepatit B virüs (HBV) enfeksiyonu, helikobakter pylori enfeksiyonu ve malarya hastalıklarında monozigot ikizler dizigot ikizlere oranla daha yüksek konkordans göstermektedir (7,67,68,69). Enfeksiyoz hastalıklarda aile çalışmaları ile linkaj analiz çalışmaları önemli inceleme yöntemlerindendir. Bu yöntemlerle bazı genlerin konaktaki yatkınlığa sebep olduğu ortaya konmaktadır (70).
Tüberküloz genetiğinde en çok üzerinde durulan genetik faktörler; HLA tipleri, vitamin D reseptörleri, mannoz bağlayan lektin (MBL), tümör nekroze faktör alfa (TNF alfa) ve interlökin 1 (IL-1), doğal dirençle ilişkili makrofaj protein 1 geni (NRAMP 1= natural resistance associated macrophage protein gene 1) ve interferon gamma (IFN gamma)’ dır (Tablo 4) (71).
Tablo 4: Enfeksiyon Hastalıklarına Yatkınlıkta Rol Oynadığı Gösterilmiş Genler
Gen Varyant Hastalık Etki
SLC11A1 5’ ve 3’ varyasyonlar Tüberküloz Yatkınlık
Vitamin D reseptör (VDR) 3’ varyasyonlar Tüberküloz Direnç
İnterferon gama İntronik varyasyon Tüberküloz Direnç
HLA-DR HLA-DR2 Lepra Yatkınlık
Mannoz bağlayıcı lektin (MBL) Kodlayıcı Varyant Pnömonokok hastalığı Yatkınlık
PTPN22 Kodon Pnömonokok hastalığı Yatkınlık
26
Tüberküloz patogenezinde ana rolü basilin konak hücre makrofajları ile girdiği ilişki oluşturmaktadır. Basil solunum, sindirim, deri, genitoüriner sistem ve konjuktivalardan girebilir. Genellikle basil solunum yolu ile akciğerlerde alveollere kadar ulaşarak burada makrofajlarca fagosite edilmektedir. Basil makrofajın içerisinde üreyerek onu parçalar ve başka bir makrofajı infekte eder. Bu dönemde basilin yok edilmesinde makrofajların ve makrofaj fonksiyonlarını regüle eden sitokinlerin etkisi büyüktür (2).
Aile linkaj çalışmaları ile nadir görülen enfeksiyoz hastalıklara monogenik yatkınlık gösteren genler belirlenebilmektedir. İnterferonγ (IFNγ) chain 1 geninde, zayıf patojen mikobakterilere yatkınlık gösterilmiştir (72,73). IL-1, IL-6, IL-4, CCL1 ve özellikle IL-10 gibi sitokin genlerinin enfeksiyoz hastalıklara yatkınlıkta rol oynadığını gösteren çalışmalar vardır (Şekil 6) (65).
Şekil 6: TB yatkınlık yapan veya konak rezistansına sebep olan genler (65)
Tüberküloz veya lepra olgularında yapılan geniş pedigri çalışmalarında bu hastalıklara yatkınlık sebebi olan birçok gen ortaya konmuştur (44).
27
2.9.1. Mikobakteriyal Hastalıklara Mendelyan Yatkınlık
Mikobakteriyal Hastalıklara Mendelyan Yatkınlık ‘Mendelian susceptibility to mycobacterial diseases (MHMY)’ , daha az bilinen adıyla Familyal atipik mikobakteriyozis (FAM, OMIM 209950) nadir görülen konjenital bir durumdur, mikobakteriyel enfeksiyona neden olan ailesel kalıtılan immün yetmezlik ile karakterizedir. MHMY ‘ye sebep olan mutasyonların sıklığı çok düşüktür (<1/milyon). MHMY mutasyonlarının belirlenmesi mikobakteriyel enfeksiyonlarda, konak immünitesinin moleküler mekanizmalarının ortaya konmasında önemli rol oynamaktadır (74).
MHMY ilk olarak 1951 yılında tanımlanmıştır, sağlıklı bireylerde çevresel mikobakteriler ve BCG gibi zayıf virulan mikobakterilerin neden olduğu enfeksiyonlarına yatkınlık sağlar (75). MHMY olgularında zayıf mikobakterilere yatkınlık yanı sıra güçlü virulan özelliği olan MTB’ye yatkınlık vardır. BCG ve EM ‘ye normal rezistans gösteren pediatrik tuberküloz olgularında mendeliyan genetik etyoloji olarak ilk tanımlanan neden IFNγR1 eksikliğidir (75). MHMY olgularında en sık görülen genetik etyoloji otozomal resesif IL-12Rβ1 eksikliğidir (76). MHMY’e sebep olan genler IL12-23 / IFNγ yolağında yer alırlar (12).
MHMY herhangi bir etnik gruba veya coğrafik bölgeye sınırlandırılamaz (Şekil7) (10).
28
Enfekte makrofajların IFNγ ve TNF-α ile aktivasyonu TB immünolojisinde anahtar rol oynayan hücresel immünitede en etkili mekanizmadır. IFNγ, Th-1 ve NK hücreleri tarafından üretilir, ve mononükleer fagositlerin üzerinde bulunan bulunan IFNγR1 ve IFNγR2 komplekslerine bağlanır. Bu reseptör sinyallerinin üretiminde, janus kinases (JAK1, JAK2) ve transkripsiyon sinyal üreticileri ve aktivatörleri (STAT1) TNF-α ile birlikte rol almaktadır. Böylece Vitamin D ve lenfositlerle birlikte etki eden fagositlerdeki mikrobisidal mekanizmalar aktive olur. Diğer bir mekanizma ise, granülositleri yok eden perforin ve granulisin sitotoksik T lenfositlerden salınır. IFNγ üretimi özellikle IL12p70 ve diğer sitokinler tarafından regüle edilmektedir (Şekil 8)(78).
Şekil 8: Tip1 sitokin yolağı (78)
1996 yılından beri MHMY’ ye sebep olan 6 gen tanımlanmıştır (12,76). IFNγ reseptör ‘ün 2 zinciri (IFNGR1 and IFNGR2), transkripsiyon faktör 1 aktivatörü ve sinyal düzenleyici (STAT1), interlökin (IL) -12 p40 subüniti (IL12B) ve IL-12 ve IL-23 reseptör β1 zinciri (IL12RB1) genleri otozomal yerleşimlidir, nükleer faktör-κB essansiyel modulatör (NEMO) ise X kromozomu üzerindedir (77). MHMY ‘den 6 gendeki mutasyonlar sorumlu tutulurken, bu mutasyonlarda görülen farklı kalıtım şekillerine ve klinik prezentasyonundaki farklılıklara bağlı olarak 13 farklı klinik durum ortaya çıkmaktadır. Onüç farklı genetik durumun nedeni
29
dominant veya resesif kalıtım olması, komplet veya parsiyel defekt olması ve ekspresyonda azalma veya fonksiyonel olmayan moleküllerin ekspresyonudur (12,79). Tablo 5’de bu durum özetlenmiştir.
Tablo 5: MHMY’de Rol Oynadığı Gösterilmiş Genler
Gen Kromozomal lokalizasyon
Protein etkisi Kalıtım Fonksiyonel bozulma
Protein ekspresyonu IFNGR1 6q23-24 IFNγ reseptör ligand bağlayıcı
zincir OR OR OR OD Komplet Komplet Parsiyel Parsiyel Var Yok Var Var IFNGR2 21q22.1-22.2 IFNγ reseptör sinyal bağlayıcı
zincir OR OR OR Komplet Komplet Parsiyel Var Yok Var IL12B 5q31.1-33.1 IL12 p40 subünit OR Komplet Yok IL12RB1 19p13.1 IL-12 reseptör β subünit OR
OR
Komplet Komplet
Var Yok STAT1 2q32.2-32.3 Transkripsiyon faktör 1
aktivatörü ve sinyal düzenleyici OD OD Parsiyel Parsiyel Var Var NEMO Xq28 Nükleer faktör-κB esansiyel
modulatφr
XR Parsiyel Var
MHMY’de IFNγ Sinyal Yolağı
İnterferonlar, doğal ve kazanılmış immünitede görevli helikal yapıda sitokinlerdir. IFNγ; IFNγ R1 ve IFNγ R2 transmembran proteinlerine bağlanmaktadır. Her iki reseptörde antimikrobial ve antitumoral mekanizmalarda görevlidir. NK ve T lenfositler tarafından üretilen IFNγ, lökositlerin büyüme, maturasyon ve farklı hücrelere differasyasyonunda ve NK hücrelerinin aktivasyonu ve Ig üretimi gibi B-hücre fonksiyonlarının regülasyonunda görev almaktadır (80). IFNγ aynı zamanda kronik granülomatöz hastalık (81), osteopetrosis (82) ve IL12/IL12RB1 eksiklik (10) tedavisinde kullanılmaktadır.
30
IFNγR1 ve IFNγR2 hücre yüzeyinde bulunan kompleks bir yapıdır. Her iki protein N-terminal ucundan ekstrasellüler bölge,transmembran bçlge ve intrasellüler bölge içermektedir. IFNγ’nın her iki reseptöre bağlanmasında sorun olması durumunda, bu reseptörler birbirleriyle etkileşime geçemezler. IFNγR1 ekstrasellüler bölgesi fonksiyonel D1 ve D2 domainleri içermektedir. Bu domainler IFNγ ligandıyla bağlanır ve IFNγR2 reseptörünün ekstrasellüler bölgesiyle etkileşime geçer. IFNγR1 reseptörünün intrasellüler bölgesinde bulunan fonksiyonel birim ise JAK-1 bağlanma bölgesi ve STAT-1 yerleşme bölgesini bulundurmaktadır (83,84).
IFNγR2 reseptörünün ekstrasellüler bölgesinin görevi ise IFNγR1 ekstrasellüler bölgesinin fonksiyonunun ve yapısının devamlılığını korumaktır. IFNγR2 intrasellüler bölgesi ise JAK-2 bağlanma bölgesini içermektedir (85).
IFNγ sinyal genlerindeki MHMY’ye sebep olan mutasyonlar
IFNγ sinyal yolağında görevli her iki geninde kodladıkları protein miktarına bağlı komplet ve parsiyel formları bulunmaktadır. Hastalığın kalıtım modeli de otozomal resesif (OR) veya otozomal dominant (OD) olabilir. IFNγ sinyal yolağında görevli genlerdeki OD kalıtım gösteren mutasyonlar her zaman parsiyel klinik tablo ortaya çıkarmaktadır. Dominant negatif mutasyonlar, IFNγ sinyalizasyonu engelleyen aberran proteinlerin kodlanmasına neden olarak parsiyel eksikliğin ortaya çıkmasını sağlar.
IFNγR eksikliği farklı klinik, genetik ve histopatalojik nedenlere bağlı heterojen bir sendromdur. Komplet IFNγR eksikliği OD veya OR kalıtım şekline göre herhangi bir değişiklik göstermeden IL-12 or IL-12R eksikliğine oranla daha ağır fenotipe sahiptirler, aynı zamanda parsiyel formları da IL-12 or IL-12R eksikliğine oranla daha ılımlı fenotipe sahiptirler (86).
31
2.9.1.1. IFNγR1 Eksikliği (OMIM 107470)
IFNGR1 geni 6q23-24 kromozomal bölgede lokalize 7 ekzonlu, 2139 bç uzunluğunda transkripte sahip bir gendir (79). Aguet ve arkadaşları tarafından IFNGR1 geninin lokalizasyonu 6q kromozomal bölgesine haritalanmıştır (87)
Şekil 9: IFNGR1 geni kromozomal lokalizasyonu
MHMY olgularında IFNGR1 geninin komplet veya parsiyel olmak üzere protein kodlamasını etkileyen eksikliği gösterilmiştir. IFNGR1 geninde MHMY’ye sebep olan değişikliklerin kalıtım modeli otozomal resesif veya otozomal dominant olabilir (88). IFNGR1 genindeki ilk mutasyon 1996 yılında Newport ve arkadaşlarının yaptığı çalışmada tanımlanmıştır. IFNGR1 geninde şimdiye kadar tanımlanmış 37 mutasyon bulunmaktadır. 13 tanesi missense veya nonsense, 3 tane splicing, 15 adet küçük delesyon, 4 adet küçük insersiyon ve 2 adet regülatör bölge mutasyonu tanımlanmıştır.
32
IFNGR1 geni ekstrasellüler, transmembran ve intrasellüler olmak üzere 3 domainden oluşmaktadır (Şekil11) (72). Komplet IFNγR1 eksikliği, herzaman IFNGR1 genindeki resesif mutasyonlar sonucu meydana gelmektedir. Komplet IFNγR1 eksikliğine sebep olan iki moleküler form bulunmaktadır. En yaygın görülen form transmembran kolayıcı bölgesi öncesinde prematür stop kodon oluşumuna yol açan mutasyonlardır. Bir diğer form ise küçük inframe delesyonlar ve misense mutasyonlardır. Parsiyel IFNγR1 eksikliği içinde sebep olan iki moleküler form tarif edilmiştir. Bu formlardan biri IFNγ bağlanmasında azalmaya sebep olan ekstrasellüler bölgede homozigot aminoasid değişiklikleridir. Ancak en yaygın formu tip1 sitokin reseptörlerinde eksikliğe yol açan ekzon 6’da bulunan mutasyon sıcak bölgesindeki heterozigot çerçeve kayma mutasyonudur (58).
Şekil 11: IFNGR1 yapısı (72)
IFNGR1 geninde meydana gelen resesif mutasyonlar genellikle, hücre yüzeyinde IFNR1 ekspresyonunu önleyen değişikliklerdir. Dominant mutasyonlar ise sitoplazmik bölgede fonksiyonel olmayan IFNR1protein birikimine yol açan değişikliklerdir (90).
2.9.1.2 IFNγR2 Eksikliği (OMIM 147569)
IFNGR2 geni 21q22.1-22.2 kromozomal bölgede lokalize 7 ekzonlu 2221 bç uzunluğunda transkripte sahip bir gendir (74,91).
33
Şekil 12: IFNGR2 geni kromozomal lokalizasyonu
IFNGR2 genindeki mutasyonlar IFNGR1 geninde olduğu gibi IFNGR2 geninin komplet veya parsiyel olmak üzere protein kodlamasını etkileyen eksikliği gösterilmiştir. IFNGR2 geninde MHMY’ye sebep olan değişikliklerin kalıtım modeli otozomal resesif veya otozomal dominant olabilir (88). IFNGR2 geninde meydana gelen OR mutasyonların parsiyel veya komplet olmasına bağlı olarak meydana gelen hücresel yanıtın şiddeti değişmektedir (12).
İlk mutasyon Dorman ve arkadaşları tarafından 1998 yılında tanımlanmıştır. Şimdiye kadar IFNGR2 geninde tanımlanmış 12 mutasyon bulunmaktadır.
Şekil13: IFNGR2 geni mutasyonlarının şematik gösterimi (92)
Komplet IFNγR2 eksikliği transmembran kodlama bölgesinden önce stop kodon oluşumuna yol açan homozigot çerçeve kayması mutasyonları sonucu oluşmaktadır. Bu hastalarda şiddetli, genellikle letal seyreden zayıf virulans özellikte mikobakterilere karşı enfeksiyon görülmektedir. Komplet IFNγR2 eksikliği olan hastalarda ömür boyu anti-mikobakterial ilaç tedavisi almaları gerekmektedir.
Parsiyel IFNγR2 eksikliğinde, hücre düzeyinde IFNγR2 düzeyi etkilenmeden IFNγR bağımlı sinyalizasyonun azalmasına sebep olan missense mutasyonlar sorumludur.