1
T.C
Ege Üniversitesi Tıp Fakültesi
Psikiyatri Anabilim Dalı
MAJOR DEPRESİF BOZUKLUK HASTASI ANNELERLE
YÜKSEK RİSKLİ SAĞLIKLI KIZLARININ
DEPRESYONLA İLİŞKİLİ OLARAK HİPOKAMPÜSTE
MEYDANA GELEN YAPISAL DEĞİŞİKLİKLER AÇISINDAN
BİRBİRLERİYLE VE SAĞLIKLI KONTROLLERİYLE
KARŞILAŞTIRILMASI
Tıpta Uzmanlık Tezi
Dr. T. Ece DURMUŞOĞLU
Tez Danışmanı
Prof. Dr. Ali Saffet GÖNÜL
İzmir
Haziran 2014
2
Başta
bilgisinden, deneyiminden ve en önemlisi bilime bakışından
çok şey öğrendiğim
Prof. Dr.Ali Saffet Gönül ‘ e
Öğrenim sürecimde emeği geçen tüm Ege Üniversitesi Hastanesi Psikiyatri A.D
Öğretim üyelerine
Kişisel gelişim serüvenimde büyük katkısı ve emeği olan
Köksal Alptekin’ e
Tez yapım aşamasında emeği geçen
Tüm teknik ekibe
Asistanlık sürecimi eğlenceli ve katlanılır hale getiren,
zorlukları aşmayı kolaylaştıran
Çalışma arkadaşlarıma
Tüm hemşire ve personellerimize
Hayatımın her döneminde benim için tek gerçek olan
Canım Aileme
Sonsuz teşekkürlerimle
Herkes iyi ki var
3
ÖZET
DURMUSOGLU T.E (2014), MAJOR DEPRESİF BOZUKLUK HASTASI ANNELERLE YÜKSEK RİSKLİ SAĞLIKLI KIZLARININ DEPRESYONLA İLİŞKİLİ OLARAK HİPOKAMPÜSTE MEYDANA GELEN YAPISAL DEĞİŞİKLİKLER AÇISINDAN BİRBİRLERİYLE VE SAĞLIKLI KONTROLLERİYLE KARŞILAŞTIRILMASI
Tıpta Uzmanlık Tezi, Ege Üniversitesi Tıp Fakültesi, Psikiyatri Anabilim Dalı, İzmir
AMAÇ: Bu çalışmanın amacı ailevi yineleyici depresyon hastası annelerle yüksek riskli kızlarının hipokampüs yapılarının şekil analizi yöntemiyle birbirleriyle ve kontrolleriyle karşılaştırılarak başta genetik faktörlerin etkisi olmak üzere depresyonla ilişkili olarak hipokampüslerinde meydana gelen yapısal değişikliklerin saptanmasıdır.
YÖNTEM: Bu çalışmaya ‘Ailevi Depresyon Yükü Taşıyan Genç Erişkin Riskli Kadınlarda Negatif
Uyaranın İşlenmesinin Nöral İzdüşümleri: Depresif Anneleri ile Karşılaştırılması ve HPA Ekseninin Nöronal İşlev Üzerine Olan Etkisi’ isimli TUBİTAK projesine katılan hastalar ve ayaktan polikliniklere
başvuran hastalar içerisinden seçilen 27 depresyon hastası anne ve 27 yüksek riskli sağlıklı kızı ile 26 kontrol grubu anne ve 26 sağlıklı kızı dahil edilmiştir. Katılımcıların ayrıntılı psikiyatrik muayenesi yapıldıktan sonra SCID-I (Structured Clinical Interwiew for DSM IV; DSM IV için yapılandırılmış klinik görüşme), HAM-D-17 (Hamilton Depresyon Değerlendirme Ölçeği), Durumluk - Sürekli Anksiyete Envanteri (STAI- State Trait Anxiety Inventory) uygulanmış ve 3 Tesla MR cihazı ile beyin görüntülemeleri tamamlanmıştır. Elde edilen MR görüntüleri hastaların kimliğine kör, deneyimli bir kişi tarafından ITK SNAP programı kullanılarak segmente edilmiş, SPHARM programı ile 3 boyutlu şekil analizi yapılmıştır. Gruplar arası hipokampüs hacim ve morfolojilerinin karşılaştırmasında MANCOVA kullanılmış, yaş ve TBV eş değişken olarak alınmıştır.
BULGULAR: Bu çalışmanın sonucunda gruplar arasında hipokampüs hacmi açısından fark saptanmamıştır. Hastalık süresi, epizod sayısı, anne ya da kız olma ve genetik yük ile hipokampüs hacmi arasında ilişki saptanmazken; yaş ve HDÖ skorunun sağ hipokampüs hacmi üzerine, TBV’ nin ise sağ ve sol hipokampüs hacmi üzerine etkisi olduğu görülmüştür. Yapılan şekil analizinde genetik yükün etkisine bağlı olarak depresyon grubunda sağ hipokampüste CA2 ve CA3’ de; yüksek risk grubunda sol hipokampüste subikulumda büyüme yönünde değişiklikler saptanırken; hem depresyon grubu hem yüksek risk grubunda sağ hipokampüste subikulumda küçülme yönünde ortak genetik etkiye bağlı olduğu düşünülen endofenotipik değişiklikler saptanmıştır. Hastalık süresiyle bilateral hipokampüsün CA2, CA3 alt bölümleri; depresif epzod sayısı ile bilteral hipokampüsün subikulum,
4
CA2 ve CA3 alt bölümleri arasında korelasyon olduğu görülmüştür. Hastalık şiddetini değerlendirmek amacıyla bakılan korelasyon analizinde; HDÖ skoru ile her iki hipokampüsün subikulum ve CA1 alt bölümleri arasında korelasyon saptanmıştır.
TARTIŞMA: Bu çalışmada; ailevi yineleyici depresyon hastası anneler ve yüksek riskli sağlıklı kızlarıyla kontrol grubu karşılaştırıldığında hipokampüs hacmi açısından fark saptanmazken; şekil analizinde subikulum, CA1, CA2, CA3 alt bölümlerinde hacim değişikliğine yol açmayan bölgesel değişikliklere rastlanmıştır. Saptanan değişikliklerin bir kısmının hastalık sürecinden bağımsız genetik etkilerle ilişkili olduğu görülmüştür. Bu alanlardan bazılarının hem depresyon grubu hem yüksek risk grubunda ortak olarak saptanması, bu alanların endofenotipik özellikte alanlar olabileceği yönünde düşündürmektedir. MDB’ de yüksek riskli bireylerde hipokampüs morfolojisinin incelendiği bu çalışmada özellikle genetik yükün hipokampüs yapısı üzerine etkisinin gösterilmiştir. Benzer şekilde yüksek risk gruplarıyla yapılacak hipokampüs şekil analizi izlem çalışmaları; genetik yük, hastalık süreci ve çevresel faktörlerin etkilerinin daha net anlaşılmasına imkan verecektir.
ANAHTAR KELİMELER: Major depresif bozukluk, ailevi depresyon, yüksek risk, hipokampüs, şekil analizi
ABSTRACT
DURMUSOGLU T.E (2014), THE COMPARISON WITH EACH OTHER AND HEALTHY CONTROLS OF STRUCTURAL CHANGES IN THE HIPPOCAMPUS ASSOCIATED WITH DEPPRESSION IN THE MOTHERS WITH MAJOR DEPRESSIVE DISORDER AND THEIR HIGH-RISK HEALTHY GIRLS
Dissertiation, Ege University, Faculty of Medicine, Department of Psychiatry, Izmir, Turkey
OBJECTIVE: The aim of this study are to detection of structural changes with compare of hippocampal structure with shape analysis methods of familial recurrent depression mothers and their high risk daugthers each other and controls including the influence of genetic factors.
METHOD: We were included 27 mothers with depression and 27 their high risk healthy daugthers and control group with 26 mothers and their healthy daugthers selected from patient admitted our policlinics according to the TUBİTAK's project called "The Neural Projections under the processing of negative stimuli in young women whom carrying the burden of familial depression". After detailed
5
examination all participants were applied to SCID-I (Structured Clinical Interwiew for DSM IV), HAM-D-17 (Hamilton Depression Assessment Scale), STAI (State Trait Anxiety Inventory) and 3 Tesla Magnetic resonance imagination (MRI) was performed. All MR images was segmented blind to the identity of the patients using ITK SNAP program by experienced person and performed 3-D shape analysis. In the comparison of the volume and morphology of hippocampus between groups, age and TBV was taken as covariates.
RESULTS: In conclusion of this study no any difference in hippocampal volume changes was detected between all groups. There was no relation between disease period, number of episodes, to became mother or daugther, genetic loading and hippocampus volume change; but age, hippocampus volume and HDI score relations, TBV and right/left hippocampus volume influence was found. Shape analysis results show growing changes in genetically load depression group CA2 and CA3 layers of hippocampus; in subiculum of left hippocampus in high risk group; but there is detected decreasing in subiculum of right hippocampus due to common genetic influence of endophenotypical changes in both depression and high risk groups. There is correlation with disease time and with bilaterally CA2, CA3 inner regions; and also between depression episodes numbers with bilaterally hippocampal subikulum, CA2 and CA3 inner regions. Disease severity assessment with HDI score there are found correlation between bother subiculum of hippocampus and same regions of CA1 inner layer.
DISCUSSION: In this study there was not found any difference after comparison of familial reccurent depression mother patient and their healthy high risk daugthers and control groups with hippocampus volume values; but after shape analysis was found regional changes without lead to change volume. The part of results due to genetic influences was found independent from disease processes. Determining of such regions changes in both depression and high risk groups, suggest that this regions are endophenotypical properties layers. It is the first study that the hippocampal structure reviewed in healthy high risk persons in Major Depression Disorders; especially our study was showing influence of genetically loads on the hippocampus structure. In same way this study allowed to understand the folow-up shape analysis studies; the influence of genetic loads, the disease time, and enviromental factors.
6
İÇİNDEKİLER
1. GİRİŞ 8
1. 1. MAJOR DEPRESİF BOZUKLUK 8
1. 2. DEPRESYONDA ANATOMİK PATOLOJİ VE NÖRAL DEVRELER 9
1. 3. HİPOKAMPAL FORMASYON 10
1. 4. DEPRESYONDA HİPOKAMPÜS 12
1. 5. DEPRESYON VE HPA AKSI 16
1. 6. HİPOTALAMİK PİTUİTER ADRENAL (HPA) STRES AKSI 18
1. 7. DEPRESYONDA CİNSİYET FARKLILIĞI 19
1. 8. DEPRESYONDA AİLESEL RİSK, GENETİK ETKİLER 20 1. 9. DEPRESYONDA ENDOFENOTİP KAVRAMI 22 1. 10. DEPRESYONDA HİPOKAMPÜS HACİM ÇALIŞMALARI 23
2. AMAÇ 31 3. VARSAYIMLAR 31 4. YÖNTEM 32 4. 1. ÖRNEKLEM 32 4. 2. UYGULAMA 33 4. 3. İSTATİSTİKSEL DEĞERLENDİRME 37
7
5. BULGULAR 39
5.1. KATILIMIN DEĞERLENDİRİLMESİ 39
5.2. SOSYODEMOGRAFİK VERİLERİN DEĞERLENDİRİLMESİ 39
5.3. HASTALIK ÖZELLİKLERİNİN DEĞERLENDİRİLMESİ 41
5.4. HİPOKAMPÜS HACİM ANALİZİ SONUÇLARININ DEĞERLENDİRİLMESİ 43 5.5. HİPOKAMPÜS ŞEKİL ANALİZİ SONUÇLARININ DEĞERLENDİRİLMESİ 48
6. TARTIŞMA 57
6.1. ÖRNEKLEMİN ÖZELLİKLERİ 59
6.2. ÖLÇÜM TEKNİĞİNİN DEĞERLENDİRİLMESİ 61
6.3. HİPOKAMPÜS HACİM ANALİZİ SONUÇLARININ DEĞERLENDİRİLMESi 63 6.4. ŞEKİL ANALİZİ SONUÇLARININ DEĞERLENDİRİLMESİ 70
6.5.ÇALIŞMANIN GÜÇLÜ YANLARI 87
6.6.ÇALIŞMANIN KISITLILIKLARI 87
7.VARSAYIMLARIN DEĞERLENDİRİLMESİ 89
8.SONUÇ VE ÖNERİLER 89
9. TABLOLAR, ŞEKİLLER ve EKLER 92
10. KAYNAKLAR 95
8
1. GİRİŞ
1.1. MAJOR DEPRESİF BOZUKLUK
Duygudurum bozuklukları içerisinde ele alınan ‘Major Depresif Bozukluk’ (MDB) %4-24 yaşam boyu prevelansı ile toplumda en yaygın görülen psikiyatrik hastalıklardan biridir (Wong & Licinio, 2001; Rhimer & Isacsson, 2005; Oldehinkel et al. 1999). Depresif mizaç, hayattan zevk alamama, irritabilite, iştah ve uyku problemleri, konsantrasyon kaybı, suçluluk duyguları ve intihar düşüncelerinden oluşan komplike klinik bir tablo ile kendini göstermektedir. Yaşam boyu %10-15 oranında intihar riski ile hayatı tehdit eden bir hastalıktır (Young et al. 1994; Sadock & Sadock, 2005; Doğan, 2011). Depresyon; kişiye ve ailesine verdiği acı yanında yüksek oranda maddi ve sosyal kayıplara neden olmaktadır. Bu nedenle ‘Dünya Sağlık Örgütü’ nün yayınladığı dünya çapında en acil sağlık sorunları listesinde dördüncü sırada yer almaktadır. 2020 yılında en fazla iş gücü kaybına yol açan ikinci hastalığın MDB olacağı öngörülmektedir (Sadock & Sadock, 2005).
Günümüzde MDB’ nin yineleyici bir gidiş gösterdiği kabul edilmektedir. Bazı hastaların yaşamları boyunca çok sayıda depresif nöbet geçirdiği bilinmektedir (Doğan, 2011). Hastaların ¾’ ünde kalıntı depresif belirtilerle tam bir depresif epizot arasında değişen derecelerde yakınmalarla giden tekrarlamalar görülmektedir (Korczak & Goldstein, 2009).
Major depresif bozukluk her yaşta görülebilmekle birlikte ortalama başlangıç yaşı yirmili yaşların sonudur. Yaşla birlikte depresyon riski artmaktadır. Erken erişkinlik döneminden itibaren kadınlarda erkeklere oranla iki kat daha fazla depresyon görülmektedir (Yazıcı et al., 2008). Birinci derece akrabalarında MDB olan kişilerde 1.5 ile 3 kat daha fazla oranda depresyon görülme riski bulunur. Erken başlangıçlı ve yineleme özelliğine sahip depresyon öyküsü varlığında göreceli risk 4-5 kat artmaktadır (Levinson, 2006). Üç nesil takip edilen ailelerde hastalığın alt nesillerde daha erken yaşlarda başladığı ve daha ağır seyrettiği görülmüştür (Myrna M Weissman et al., 2005a). Hangi genlerin hastalığa neden olduğu tam olarak bilinmese de poligenetik bir durum olduğu düşünülmektedir (Caspi et al., 2003; Kaufman et al., 2006). Pek çok kanıt major depresif bozukluğun çeşitli yatkınlık genleri ve stresli yaşam olayları gibi çevresel etkenlerin karmaşık etkileşimi sonucu ortaya çıktığını düşündürmektedir (Kendler et al., 1999). Riskli genleri taşıyan kadınların stres yanıtının erkeklere ve riskli genleri taşımayan kadınlara oranla daha yüksek olması kadın cinsiyeti ve gen etkileşimini göstermesi açısından önemlidir (Jabbi et al., 2008).
9
Toplumda yaygın görülme, kronik seyir, yeti yitimi ve hayatı tehdit eden intihar girişimleri nedeniyle depresif bozukluklarla ilgili olarak çok sayıda araştırma yapılmaktadır. Son 20 yılda hastalığın etiyolojisi, risk faktörleri ve tedavisi yönünde önemli gelişmeler kaydedilmekle birlikte bu kompleks klinik tablonun nasıl oluştuğu ve kesin tedavisi konusunda henüz yeterli bilgi bulunmamaktadır. Hastalığın oluş sürecinin daha iyi anlaşılması; tanı, tedavi ve en önemlisi başlamadan önlenmesi konusunda yol gösterici olacaktır. Depresyonun patofizyolojisini anlayabilmek için, beynin nörokimyası ile emosyonel sistemlerin nöroanotomik yapısı arasındaki etkileşimi dikkate almak gerekmektedir.
1.2. DEPRESYONDA ANATOMİK PATOLOJİ VE NÖRAL DEVRELER
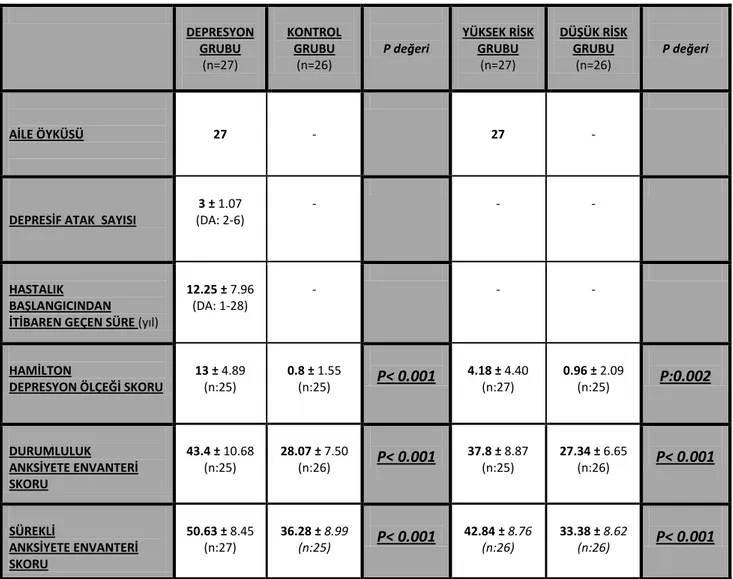
Beyinde kortikal-striatal-pallidal-talamik-limbik devreler emosyonel ve bilişsel dengenin sağlanarak uyaranlara uygun yanıtların verilmesinden sorumludur. Hipokampüs de dahil olmak üzere bu devrelerdeki yapıların kendi içerisinde ve beynin diğer bölgeleriyle çok sayıda, karmaşık yapıda bağlantıları bulunmaktadır (Miller et al., 2010). (Şekil 1)
Şekil 1: Kortikal-striatal-pallidal-talamik-limbik devreler
Nörogörüntüleme, nöropatoloji ve lezyon analiz çalışmalarından edinilen bilgilere göre; olasılıkla PFK, amigdala ve hipokampüsü içerecek şekilde bu devrelerde işlev bozukluğuna yol açan bir seri
Prefrontal korteks Amigdala Hipotalamus Hipokampüs Entorinal korteks (parahipokampal girus) Ventral striatum Ventral pallidum Medial talamus Ant. Hipofiz Adrenal bez Kortizol Orta beyin/Beyin sapı
10
değişikliğin duygudurum bozukluklarının patofizyolojisinde yer aldığı öne sürülmektedir (Sheline, 2003; Ongür et al., 2003; Drevets et al., 2008; Krishnan & Nestler, 2008). Depresyonda nöral devrelerdeki dengenin PFK aktivitesinde azalma yönünde bozulduğu düşünülmektedir. PFK’ de kanlanma ve aktivite azalması unipolar bozukluk ve bipolar bozuklukta kontrol grubuyla karşılaştırıldığında en tutarlı bulgulardandır (Cohen et al., 1989; Drevets & Raichle, 1998; Drevets, 2001; Ketter et al., 2001; Brooks et al., 2009). PFK’ nin limbik sistem üzerindeki inhibitör etkisinin azalması sonucu ortaya çıkan limbik sistem aşırı aktivitesinin depresyonun klinik belirtilerinden ve ilgili otonomik, nöroendokrin ve visseral değişikliklerden sorumlu olduğu öne sürülmektedir (Price & Drevets, 2010).
MDB hastalarında yapılan postmortem ve nörogörüntüleme çalışmalarında; orbitofrontal korteks (OFK), dorsolateral prefrontal korteks (DLPK) ve anterior singulat kortekste (ACC) büyük oranda (Ongur et al., 1998; Cotter et al., 2002; Ballmaier, 2004; Pezawas et al., 2005; Drevets et al., 2008); hipokampüs, putamen ve kaudat nükleusta ise daha az oranda (Harrison, 2002; Sheline, 2003; Drevets et al., 2008; Koolschijn et al., 2009) hacim azalmasının olduğu belirtilmektedir. Bilgisayar destekli üç boyutlu hücre sayım çalışmalarında, glial hücrelerin büyüklük ve sayılarında azalma olduğu, nöron hücrelerinin büyüklüklerinin ise azaldığı ancak sayılarının değişmediği gösterilmiştir (Rajkowska et al., 1999; Rajkowska, 2000). MRG’ de hipokampal atrofi sık görülen bir bulgu olmakla birlikte depresyonun hayvan modellerinde gösterilen hipokampüs hücre sayısında ve nörogenezde görülen azalmanın depresyonda olan bireylerde de görüldüğüne dair daha kesin kanıtlara ihtiyaç duyulmaktadır.
1.3. HİPOKAMPAL FORMASYON
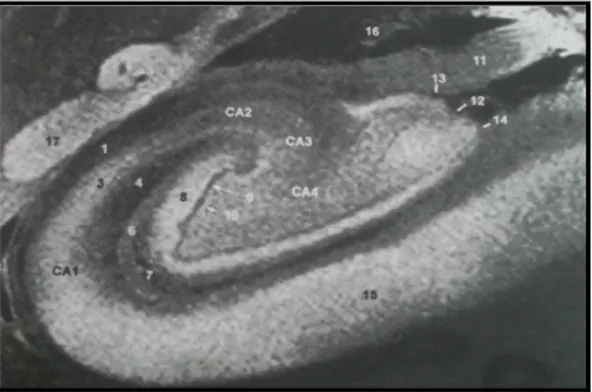
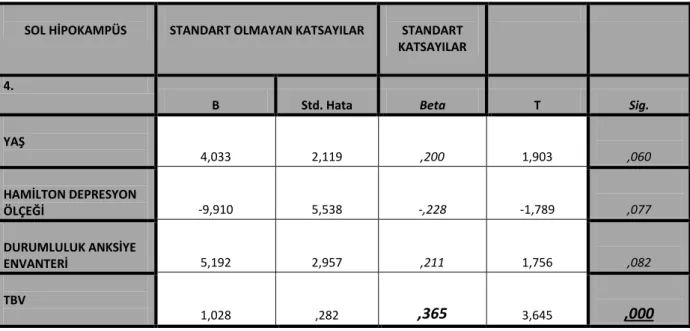
Limbik sistem içerisinde merkezi bir konumda bulunan hipokampal formasyon; parahipokampal sulkus ile lateral ventrikülün temporal boynuzu arasında derinde yer almaktadır. Subikulum, cornu ammonis (hipokampüs proper) ve dentat girus olmak üzere üç bölümden oluşmaktadır. Cornu ammonis; CA1-CA2-CA3-CA4 olmak üzere hücre sütünlarından oluşan dört ana bölüme ayrılır. Piramidal hücreler cornu ammonis boyunca yayılmıştır. Dentat girusda ise granüler hücreler çoğunlukta olup, az miktarda kök hücre de bulunmaktadır. (Şekil 2)
11
Şekil 2: 1-7. Hipokampüs proper (cornu ammonis) (CA1-CA4); 8-10. Dentat girus; 11. Fimbria; 15. Subiculum; 16. Choroid pleksus; 17. Kaudat nukleusun kuyruğu; 18. Lateral ventrikül temporal boynuzu
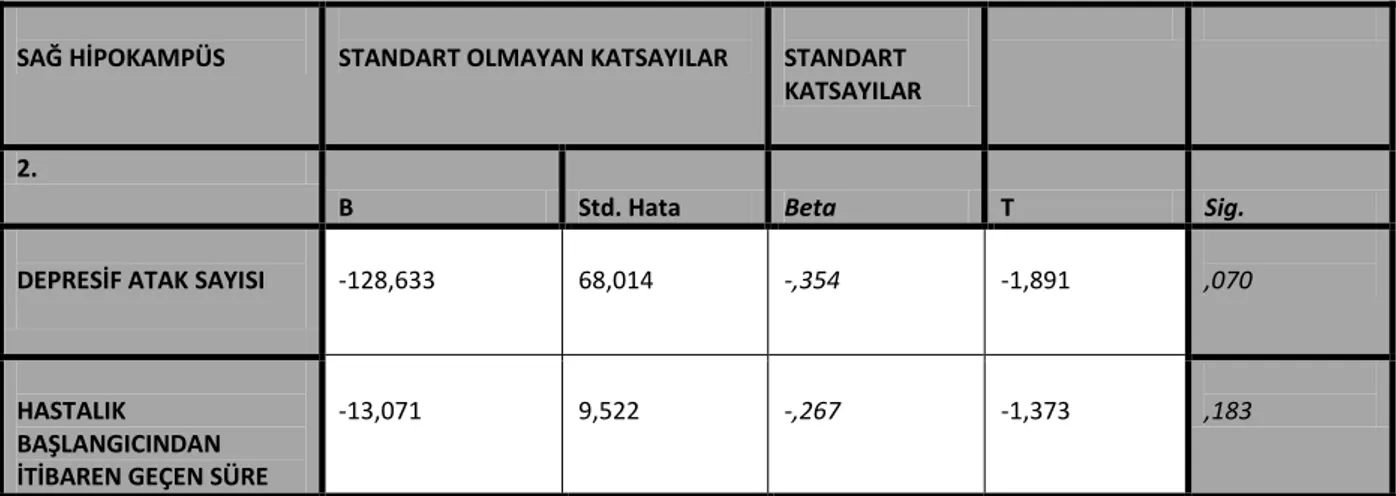
Entorinal korteks hipokampal formasyon için kapı görevi görür; olfaktör bulbus, prepriform alan, amigdala ve frontal lob ile temporal lobun asosiasyon alanlarından gelen kognisyonla ilişkili girdileri alır. Entorinal korteks dışında hipokampüse septal nükleus, hipotalamus, talamus ve beyin sapından da emosyonel ve davranışsal durumlarla ilişkili girdiler gelmektedir. (Şekil 3)
Şekil 3: Hipokampüsün afferent ve efferent bağlantıları
Efferent uyaranlar piramidal hücrelerin aksonları ile hipokampüsü terk ederler. Bu aksonlar bir araya gelerek forniksin fimbriasını oluştururlar. Hipotalamusa uzanan bağlantıları aracılığıyla HPA aksı stres yanıtının düzenlenmesinde önemli rol oynar; normal koşullarda PVN’ ye giden GABAerjik nöronları aktive ederek HPA aksını inhibe eder. Emosyonel davranışın endokrin, otonom ve somatomotor yanlarının ortaya konmasında görev alan hipotalamik-beyin sapı yapılarının modülasyonunda rol alır (Herman & Cullinan, 1997; Pittenger & Duman, 2008). Hipokampüsün amigdala ile de karşılıklı bağlantıları bulunmaktadır.
Hipokampüs beyinde erişkin dönemde de nörogenezin devam ettiği, yüksek nöroplastisite kapasitesine sahip bir bölgedir (Eriksson et al., 1998; Li et al., 2009). Erişkin beyninde yeni nöron
HİPOKAMPÜSÜN AFFERENT BAĞLANTILARI
• Entorinal Korteks • Amigdala • Medial Septum • Klaustrum
• Substantia İnnominata • Meynert' in Bazal Nükleusu • Talamus
• Hipotalamus • Beyin Sapı
HİPOKAMPÜSÜN EFFERENT BAĞLANTILARI
• Talamus • Singulat Girus • Prefrontal Korteks • Nukleus Akkumbens • Amigdala • Entorinal Korteks • Hipotalamus • Beyin Sapı
12
üretimi hipokampüste subgranüler zon (SGZ) ve subventriküler zon (SVZ)’ da gerçekleşmektedir. Progenitör hücrelerden oluşan yeni nöronlar, nöronal devreye katılarak bellek ve öğrenme işlevlerinde rol oynarlar (Kuhn et al., 1996; Gould, 1999). Hipokampüs duygu yüklü olayların içeriği, zamanı ve gerçekleştiği yerle ilgili bellek oluşturulmasında önem teşkil etmektedir. Kognitif bozukluk MDB’ nin temel belirtilerinden biridir (Hasler et al., 2004). MDB hastalarında bilişsel işlevlerle ilgili yapılan değerlendirmelerde en fazla bozulma, büyük ölçüde hipokampüs işlevlerine bağlı olduğu düşünülen öğrenme ve bellek alanlarında saptanmaktadır (Squire, 2004). Zayıf bellek fonksiyonlarının hipokampüste gri madde hacminde gözlenen azalmayla ilişkili olduğu klinik öncesi çalışmalarda gösterilmiştir (Gatt et al., 2009).
Hipokampüs konsantrasyon ve dikkat üzerinde önemli rol oynayan PFK fonksiyonlarında da anahtar rol oynar. Bu nedenle MDB’ de, en az bellek problemleri kadar konsantrasyon bozukluklarına da sık rastlanmaktadır (MacQueen & Frodl, 2010). Hipokampüs DLPFK ve amigdala ile birlikte dekleratif belleğin (explicit memory) düzenlenmesinde görev alır. Dekleratif bellek; günlük olayların, deneyimlerin ya da edinilen bilgilerin depolanmasına dayanan bellek türüdür. Edinilen bellek haftalar aylar boyunca önce hipokampüste depolandıktan sonra kortekste bir yerde pekiştirilerek uzun süreli belleğe dönüştürülür. Septumdan köken alarak hipokampüse ulaşan kolinerjik nöronların oluşturduğu ‘septohipokampal yolak’ da öğrenme ve kısa süreli bellek işlevlerinin düzenlenmesi ve yürütülmesiyle ilişkilidir. Hipokampal afferentler nukleus accumbens ve ventral tegmental alanın da temel düzenleyicilerindendir (Floresco et al., 2001). Hipokampüs fonksiyonlarında bozulmaya bağlı dopaminerjik tonusta azalma sonucu gelişen anhedoni MDB’ nin temel belirtilerindendir (Schmidt & Duman, 2006). Serotonerjik sistem ile HPA aksı arasındaki karşılıklı etkileşimde de hipokampüsün rolü bulunmaktadır. HPA aksı ve serotonerjik sisteminin dentat girustaki granüler hücre proliferasyonu üzerine etkisinin MDB ile ilişkili nörobiyolojik mekanizmalarda önemli rol oynuyor olabileceği düşünülmektedir (Lanfumey et al., 2008).
1.4. DEPRESYONDA HİPOKAMPÜS
Uzun yıllardır MDB patofizyolojisinde odak nokta olan ‘monoamin hipotezi’ ne göre; noradrenalin (NA), dopamin (DA), serotonin (5-HT) gibi monoamin nörotransmitterlerin kimyasal dengelerinin bozulması sonucu tablonun ortaya çıktığı düşünülmektedir (Berton & Nestler, 2006). Yeni antidepresan ilaçlar monoamin düzeylerini akut olarak arttırırlar. Buna rağmen etkilerinin haftalar içerisinde ortaya çıkıyor olması depresyon patofizyolojisinde ‘monoamin hipotezi’ nin yetersiz
13
kaldığını düşündürmektedir. Son dönemde antidepresan etkinliğin transkripsiyon ve protein sentezi aşamaları üzerinden uzun dönem nöroplastik değişiklikler yoluyla ortaya çıktığı ileri sürülmektedir (Pittenger & Duman, 2008). ‘Nörotrofin hipotezi’ ne göre nöron üretimi, nöron farklılaşması, nöron sağ kalımı ve sinaptik aşırım gibi süreçleri etkileyerek erişkin beyninde nöroplastisitenin ve nörogenezin düzenlenmesinde rol alan nörotrofik faktörlerde azalma olduğu düşünülmektedir (Duman & Monteggia, 2006). Depresyonu olan bireylerin postmortem görüntüleme çalışmalarında; limbik sistem, prefrontal korteks ve singulat korteks gibi çeşitli beyin yapılarında saptanan yapısal, metabolik ve boyutsal değişiklikler MDB’ de nöroplastisitenin bozulduğu hipotezine dair ilk kanıtlardır (Rajkowska, 2000). MDB ile ilişkili yapılan bağlantı çalışmaları hipokampüsün de dahil olduğu çok sayıda nöral devrede düzensizlik olduğunu göstermektedir.
Kortikosteroid reseptörlerinden oldukça zengin olan hipokampüs özellikle erken gelişimsel dönemde beynin strese en duyarlı bölgelerinden biridir (Kessler, 1997; Thomas et al., 2007). MDB ise yüksek oranda strese duyarlı bir hastalık olarak bilinmektedir. Fizyolojik ya da psikolojik stresin beyinde yapısal değişikliklere neden olduğu belirtilmektedir (Bremner, 2002; Malberg & Duman, 2003; Pham et al., 2003; Vermetten et al., 2003). Uzamış stresin PFK ve hipokampüs gibi limbik beyin bölgelerinde hacim kaybına yol açtığına dair kanıtlar bulunmaktadır (Czéh & Lucassen, 2007; Frodl et al., 2007; Heuser & Lammers, 2003; Lu & Gottschalk, 2000). Bu alanlarda görülen yapısal değişikliklerin; metabolik etkilere karşı artmış duyarlılık sonucu gelişen nöron hasarı ve ölümüne bağlı atrofiyle ilişkili olduğu ileri sürülmektedir (Ongur et al., 1998; Frodl, 2002). Kronik stres altında HPA aks hiperaktivasyonuna bağlı glukokortikoid düzeylerinde artma, nörotrofik mekanizmalarda bozulma, artmış glutamat düzeylerine bağlı eksitotoksisite, glial hücre değişiklikleri ve nörogenezin baskılanması gibi süreçlerle birlikte bazı genetik etkiler, hipokampüste nöron aktivite ve fonksiyonlarını bozarak hücre ölümüne ve atrofiye neden olmaktadır. Limbik sistemde bulunan mineralokortikoid reseptörleri (MR), glukokortikoid reseptörleri (GR) ve N- metil D-aspartat (NMDA) reseptörlerinin bu mekanizmalarda rol aldığı (Sapolsky, 2000; Shelton, 2000; Heuser & Lammers, 2003; McEwen, 2007; Longone et al., 2008) mitokondriyal membranda bulunan apoptotik ve antiapoptotik proteinler arasındaki kritik dengenin nöron hücre ölümünde tetiği çeken mekanizma olduğu düşünülmektedir (Yuluğ et al., 2009). Hayvan çalışmalarında, stresin beyinde ‘beyinden köken alan nörotrofik faktör’ (BDNF) düzeylerini azalttığı; hipokampüsün CA1 ve CA3 bölgelerinde bulunan nöronların apikal dendritlerinde atrofiye yol açtığı, dentat girusun granüler nöronlarında nörogenezi baskıladığı ve nöroplastisiteyi bozduğu gösterilmiştir (Gould et al., 1997; E. Gould, 1998; Magarinos et al., 1996). Cushing hastalığı gibi hiperkortizolemi tablosuyla giden hastalıklarda hipokampüste gözlenen ve kan kortizol düzeylerinin normale dönmesiyle ortadan kalkan atrofi, stres etkisi altında
14
hipokampüste yapısal değişikliklerin meydana geldiğine dair diğer kanıtlardandır (Magarinos et al., 1996).
Glutamaterjik sistemin ve sinaptik aralıkta BDNF düzeylerinin PFK ve hipokampüste, nöronal plastisite ve hücre sağ kalımı üzerine etkileri bulunmaktadır (Lu et al., 2005; Tashiro et al.,2006; Joëls, 2008; David et al., 2009).Kronik ağır stres etkisiyle artan glutamaterjik aktivite sinaptik plastisite, nöronal büyüme ve sağ kalım üzerine inhibitör etkiye yol açmakta (Pittenger & Duman, 2008), stresle ilişkili nörotoksisiteye katkıda bulunarak hücre hasarı ve ölümüne neden olduğu iddia edilmektedir (R. M. Sapolsky et al., 2000; Sapolsky, 2003). Limbik yapılarda bol miktarda bulunan BDNF’ nin sinir sisteminde hücre sağ kalımıyla ilişkili kaskatların aktivasyonunda (Kermani & Hempstead, 2007; Hallböök et al, 2006) ve uzun dönem potensiyalizasyonda (Thakker-Varia et al., 2007; Schmidt & Duman, 20107) kritik rol oynadığı; hücre sağ kalımı, yeni sinaps oluşumu, sinaps organizasyonu ve nörogenez üzerine önemli etkileri bulunduğu (Lindvall et al., 1994; McAllister et al., 1999) öne sürülmektedir. Beyinde artan glukokortikoid düzeyleri hipokampüste BDNF’ nin düzensiz ve yetersiz salgılanmasına neden olarak eksitotoksik mekanizmalar ve nörogenez inhibisyonu üzerinden hücre hasarına yol açmaktadır (Smith, 1996; Schaaf et al., 2001; Sheline, 2003; Martinowich et al., 2007; MacQueen et al., 2003).
BDNF düzeylerinde görülen düşüşün depresif bozukluğa neden olabileceği ve depresyon riskinin BDNF yoluyla genetik olarak aktarılabileceği düşünülmektedir (Yuluğ et al., 2009). Hayvan çalışmalarında akut ve kronik stresin BDNF düzeylerini düşürerek depresif belirtilere yol açtığı ve BDNF’ nin santral sinir sistemine infüzyonu ile bu etkilerin tersine döndüğü gösterilmiştir (Vaidya & Duman, 2001; Nibuya et al., 1995; Shirayama et al., 2002; Smith et al., 1995) BDNF düzeyleri ve Trk B reseptörleri azaltılarak strese maruz bırakılan transgenik farelerde antidepresan etkinlik elde edilememiştir (Saarelainen et al., 2003). BDNF düzeylerinde ve Trk B reseptörlerinde görülen değişikliklerin hastalık sürecinin gelişiminden önce mi var olduğu yoksa bozukluğun kendisine bağlı bir sonuç olarak mı ortaya çıktığı kesin olarak bilinmemektedir (Tapia-Arancibia et al., 2004). Depresyonu olan intihar sonucu ölen bireylerin postmortem PFK ve hipokampüslerinde hayvan çalışmalarıyla tutarlı şekilde, BDNF mRNA düzeylerinin düşük olduğu saptanmıştır (Dwivedi et al., 2003). Chen ve ark.; antidepresan tedavi alan depresif bireylerin postmortem hipokampüslerinde tedavi almayanlara oranla BDNF ekspresyonunda artış olduğunu belirtmişlerdir (Chen et al., 2001). Gonul ve ark.’ nın yaptığı bir çalışmada MDB hastalarında serum(s) BDNF düzeylerinin depresyon şiddetiyle negatif korelasyon gösterdiği ve başarılı antidepresan tedavi sonunda artarak normale döndüğü gösterilmiştir (Gonul et al., 2005). Benzer şekilde antidepresan tedavi ve EKT ile sBDNF düzeylerinde artışın gösterildiği başka çalışmalar da bulunmaktadır (Karege et al., 2002; Shimizu et al., 2003; Duman & Monteggia, 2006).
15
BDNF gibi serotonerjik sistemin; özellikle dentat girusta bol miktarda bulunan 5HT 1A reseptörlerinin nöron büyümesi, sinaptogenez, hücre sağ kalımı ve beyin gelişimi üzerinde önemli etkileri bulunmaktadır (Yan et al., 1997; Gaspar et al., 2003). Serotonin stimulasyonunun büyüklüğü ve süresi presinaptik uçta bulunan 5 HT taşıyıcısı (5 HTT)’ nın fonksiyonlarına bağlıdır. 5 HTTLPR (5 HT linked promoter region), serotonin nörotransmisyonunu etkileyen fonksiyonel bir polimorfizmdir (Heils et al., 1996; Lesch et al., 1996). 5 HTT’ nin fonksiyonlarını bozarak sinaptik aralıkta serotonin klirensini azaltır. Serotonerjik uyarının uzamasına yol açan bu durum hipokampüste özellikle dentat girusta bol miktarda bulunan postsinaptik 5 HT1A reseptörlerinin desensitizasyonuna neden olur. Serotonin reseptörleri nörogenezde ve nöronal olgunlaşmada, glukokortikoid sekresyonunun geribildirim mekanizmasında ve öğrenilmiş çaresizlik davranışında kritik rollere sahiptir (Martinowich & Lu, 2008; Lucki, 1998; Joca et al., 2003). BDNF’ nin azalması serotonerjik sistemi zayıflatırken; stres glutamat düzeylerini arttırıp BDNF ve 5 HT ekspresyonlarını azaltarak hipokampüste granüler hücre üretiminde azalmaya ve hücre ölümüne yol açmaktadır (E Gould, 1999; Czéh et al., 2002; Rasmusson et al., 2002). BDNF’ nin met alelinin; çocukluk çağı travma öyküsü ya da 5HTTP S alelinin varlığı gibi risk faktörleri bulunan çocuklarda ve erişkinlerde de depresyon riskini arttırdığı düşünülmektedir (Kaufman et al., 2006; Goodyer, 2008; Aguilera et al., 2009).
Sonuç olarak yeni nöron oluşumunda azalma ve glial hücre ölümünde artmaya bağlı olarak hipokampüs hacminde azalma ve hipokampüs fonksiyonlarında bozulma meydana gelmektedir (Magarinos et al., 1996; Ongur et al., 1998; Rajkowska, 2000; T. Frodl et al., 2002; Czéh et al., 2002; Duman, 2004; Dranovsky & Hen, 2006). Hipokampüs HPA aksının düzenlenmesinde önemli role sahip olduğundan hipokampüs hacminde azalma ve fonksiyonlarında bozulma HPA aks regülasyonunda da bozulmaya yol açarak kortizol düzeylerinin daha da artmasına ve hipokampüs fonksiyonlarının daha da bozulmasına neden olmaktadır (Herman et al., 2005). Nöronal olgunlaşmanın erken dönemlerinde karşılaşılan; glukokortikoid reseptör fonksiyonunda körelme ve glukokortikoid fonksiyonlarında artma ile giden olumsuz yaşam olayları da nöronal olgunlaşmada ve hipokampüs nöronlarının entegrasyonunda bozulmaya yol açmaktadır (Cameron & Gould, 1994). Genetik predispozisyon ve çevresel etkenlerin ilişkisi major depresyon yatkınlığını ve belirtilerinin ortaya çıkışını etkiliyor gibi görünmektedir (Eker et al., 2011).
Günümüzde nörotrofin teorisi geçerliliğini korumakla birlikte; BDNF ‘ nin etkileriyle ilgili tutarsız ve olumsuz sonuçların saptandığı bazı çalışmalar bu hipotezinin yeniden gözden geçirilmesi gerektiğini düşündürtmektedir (Berton et al., 2006; Groves, 2007).
16
1.5. DEPRESYON VE HPA AKSI
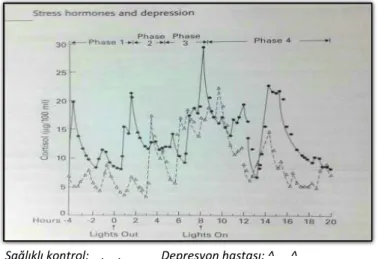
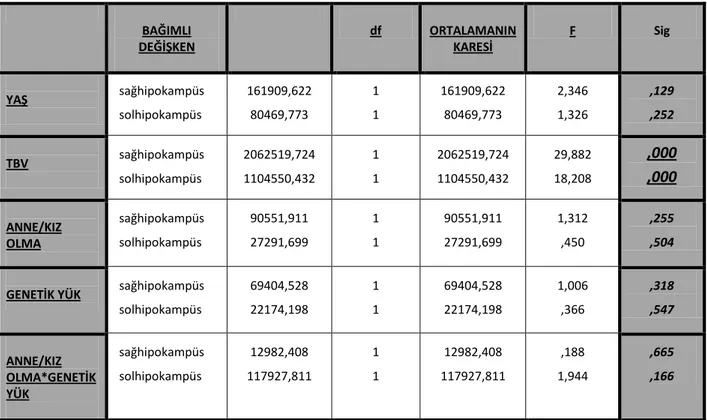
Depresyonda monoamin hipotezinden sonra HPA aksı ilgi gören konulardan biri haline gelmiştir. İlk kez Board ve ark. depresyonda hiperkortizolemiden bahsetmişler; Sachar ve ark. depresyonda gün boyu devam eden plazma kortizol düzeyindeki artışların kortizol sekresyonun değişen sirkadiyen ritmi nedeniyle ortaya çıktığını öne sürmüşlerdir (Board et al., 1956; Sachar, 1970). (Şekil 4)
Şekil 4: Kortizolün gün içerisindeki sirkadiyen ritmi
Sağlıklı kontrol: .__. Depresyon hastası: ^__ ^
Depresyonda HPA aksının hiperaktif olduğunu düşündüren çok sayıda bulguya rastlanmıştır. Hipotalamusta CRH nöron sayısının ve CRH m-RNA miktarının, CRH ve AVP salgılayan hücrelerin her ikisinde görülen artışa bağlı olarak BOS CRH, vazopressin ve oksitosin düzeylerinin, CRH’ ya bağımlı ACTH salınımının, kan ACTH düzeyinin ve üriner kortizol eksekresyonunun arttığı, hipofizde CRH reseptörlerinde gerçekleşen downregülasyona bağlı olarak CRH’ ya ACTH yanıtında küntleşme olduğu saptanan bulgulardandır (Musselman et al., 1998; Arborelius et al., 1999; Holsboer, 2000). Depresif bireylerin %50’ sinde ‘deksametazon supresyon testi’ (DST) bozulur. DST ile CRH/vazopresin artışı karşısında ön hipofizde ACTH/kortizol salınımı üzerinde glukokortikoid reseptörleri (GR)’ nin negatif geribildirim kapasitesi ölçülmektedir. Burada yola çıkarak depresyonda GR’ nin fonksiyonlarının azaldığı ve GR üzerinden gerçekleşen negatif feedback mekanizmanın daha yüksek bir düzeye ayarlandığı söylenebilir (Pariante & Miller, 2001; Young et al., 2003). Son kanıtlar HPA aks aktivitesinde görülen anormalliklerden asıl sorumlunun GR olduğunu göstermektedir. Glukokortikoid feedback mekanizması ancak GR ve mineralokortikoid reseptörlerinin (MR)’ nin birlikte sinerji
17
içerisinde çalışmasıyla dengeli şekilde düzenlenebilmektedir (Atkinson et al., 2008; Karst et al., 2005; Conway-Campbell et al., 2007). Yüksek bazal plazma kortizol düzeylerine sahip depresif bireylerin fizyolojik ve psikolojik stresörler karşısında daha fazla kortizol yanıtı vermeyi sürdürdükleri gözlenmiştir. Stresle tetiklenen kortizol yanıtını sınırlamadaki bu zorluğun bir kısır döngüye yol açarak toplam kortizole maruziyeti arttırdığı düşünülmektedir. Sağlıklı kişilerde uyandıktan sonraki 30 dakika içerisinde görülen kortizol piki 60 dakika içerisinde normal seviyeye inerken, depresif bireylerde bu yükseklik devam etmektedir (Bhagwagar, 2003;Bhagwagar et al., 2005). Ek olarak depresyon hastalarında hipotalamik CRH hücrelerinin remisyonda da aktif olduğu, olası genetik/kazanılmış GR rezistansına bağlı olarak hiperkortizolemiye rağmen CRH sekresyonunda artışın devam ettiği gösterilmiştir. Stresli durumlarda artan CRH ve kortizolün kendisi de anksiyete ve korkuyu arttırıcı etkilere sahiptir. Depresyonda CRH artışı primer fenomen olabileceği gibi azalmış GR fonksiyonuna bağlı kortizol aracılıklı negatif feedback mekanizmasının zayıflaması sonucu da ortaya çıkıyor olabilir (Bhagwagar et al., 2005; Young, 1991). CRH ve kortizolün depresyonda monoaminerjik sisteme etki ederek depresif yakınmalara sebebiyet verebileceği öne sürülmektedir.
Stres verici olumsuz erken yaşam deneyimleri ilerleyen dönemde depresyon için belirgin risk faktörü oluşturmaktadır (Risch et al., 2009). Olumsuz erken yaşam deneyimlerinin epigenetik etki ile sonraki dönemlerde karşılaşılacak stres verici deneyimlere duyarlılığı arttırdığı düşünülmektedir (Cushing & Kramer, 2005; Meaney, 2010). Çocukluk çağı travmaları; nöroendokrin stres yanıtı duyarlılığı, glukokortikoid rezistansı, artmış CRH aktivitesi, immun aktivasyon, azalmış hipokampüs hacmi gibi bir seri fizyolojik değişiklikle ilişkili bulunmuştur. Erken dönemde kronik strese maruz kalan kemirgenlerin hipokampal CA3 nöronlarında yaşam boyu artmış CRH ekspresyonu olduğu gösterilmiştir (Fenoglio et al., 2006). Olumsuz erken yaşam deneyimlerine maruz kalan bireylerde daha küçük hipokampüs hacimlerine rastlanmaktadır (Vythilingam et al., 2002; Woon & Hedges, 2008). Sağlıklı kontroller, post travmatik stres bozukluğu hastaları ve MDB hastalarıyla yapılan çalışmalarda; çocukluk çağı travması ile azalmış hipokampüs hacmi arasında ilişki olduğuna dair güçlü veriler elde edilmiştir. Karşılaşılan stres etkeninin türü, karşılaşıldığı esnada içerisinde bulunulan gelişimsel dönem, kronisite ve stres düzeyinin hipokampal yapı üzerindeki belirleyici etkileri bulunmaktadır (MacQueen & Frodl, 2010).
Depresyonda gün boyu süren artmış HPA aks hiperaktvitesi fark edildiğinden beri bu durumun depresyona ikincil ortaya çıkan ‘epifenomenal’ bir durum yerine predispozan bir risk faktörü olabileceği, genetik yapı ve moleküler programlamayı etkileyen erken yaşam olayları gibi bazı faktörlerin de bir seri nörobiyolojik anormalliğe sebep olabileceği öne sürülmektedir (Pariante & Lightman, 2008; Wong, 2000).
18
1.6. HİPOTALAMİK PİTUİTER ADRENAL (HPA) STRES AKSI
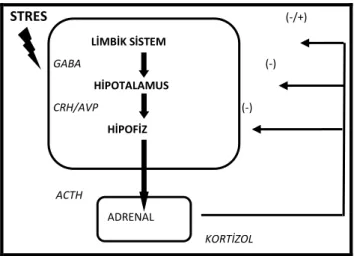
Bozulan homeostazı yeniden sağlamak için organizma tarafından ortaya konan biyolojik ve davranışsal doğadaki adaptif yanıtlara ‘stres yanıtı’ denir. Hipokampüs, amigdala gibi limbik yapılar ve prefrontal korteks çeşitli etkenlerin değerlendirilerek uygun biyolojik ve psikolojik yanıtların verilmesi sürecinde aktif rol oynamaktadır. Stres ve savunma reaksiyonlarının başarısız kontrolü duygudurum bozuklukları ve anksiyete bozukluklarında önemli patolojik mekanizmalardandır (Praag et al., 2004). Nöroendokrin sistemin tetiğini çeken kortkotropin salgılatan hormon (CRH) hipotalamusun paraventriküler nükleusundan (PVN) salgılandıktan sonra hipotalamo-hipofizeal portal sistem ile ön hipofize taşınır; kortikotrop hücrelerdeki CRH 1 reseptörlerine bağlanır. CRH etkisiyle kortikotrop hücrelerden salgılanan adrenokortikotropin hormon (ACTH) sistemik dolaşıma geçerek adrenal korteksten kortizol salınımını başlatır. Sempatik sistem kontrolünde çalışan, bu komplike sistemin dengesi 24 saat içerisinde ortalama 20 ateşleme yapan HPA ekseninin pulsatil aktivitesi tarafından düzenlenir. Pulsasyonların neye göre düzenlendiği tam olarak bilinmemekle birlikte, sıklığı ve amplitüdü sirkadiyen ritme ve stres durumuna göre değişmektedir (Praag et al., 2004). (Şekil 5)
Şekil 5: Stres ve HPA aksı
STRES (-/+) LİMBİK SİSTEM GABA (-) HİPOTALAMUS CRH/AVP (-) HİPOFİZ ACTH ADRENAL KORTİZOL
Salgılanan kortizol etkisini 2 nükleer kortikosteroid reseptörü üzerinden göstermektedir. Yüksek afiniteli MR normal koşullarda CRH sisteminin duyarlılığını ve eşiğini belirler. Yalnızca yüksek kortizol düzeylerinde işgal edilen düşük affiniteli GR ise başlıca hipofizdeki kortikotrop hücreler, PVN ve hipokampüs gibi stres regülasyon merkezleri olmak üzere tüm beyinde yaygın şekilde bulunur; CRH ve ACTH üzerinde negatif geribildirime yol açarak HPA aksının baskılanmasını sağlar. HPA sisteminin dengesinin başlıca, genetik olarak düzenlenen CRH1/MR ve CRH2/GR sistemleri arasındaki dengeye bağlı olduğu düşünülmektedir.
19
Psikojenik uyaranlar beyinde limbik-kortikal devredeki nöronları aktive eder. Bunlar arasında özellikle amigdala, hipokampüs, PFK ile PVN arasındaki devreler en göze çarpanlarıdır. Hipokampüs HPA aksının önemli düzenleyicilerinden biridir. GABAerjik devre hipokampüsten gelen eksitatuar uyarılar aracılığıyla aktive edilirse CRH salınımı azalır; HPA aksı baskılanır. Amigdaladan gelen inhibitör uyarılar ise GABAerjik nöronları inhibe ederek, CRH salınımı arttırır (Herman & Cullinan, 1997). HPA aksına gelen bu afferent projeksiyonlar stresör spesifik bilgiyi HPA aksına taşıyarak stres yanıtının spesifitesini belirler. Limbik-kortikal-beyin sapı yapıları CRH ve kortikosteron reseptörleri eksprese ettiklerinden geri bildirim mekanizması için stres hormonlarının hedef bölgeleridir (Dallman et al., 2002). Stres etkisiyle adrenal korteksten salgılanan kortizol ilk olarak stres yanıtlarının ortaya çıkmasına neden olur. Daha sonra hipotalamustaki CRH nöronlarını çevreleyen GABAerjik devrelerin GR reseptörleri üzerinden aktivasyonu ile HPA aktivitesini baskılar (Cullinan et al., 1995; Munck et al., 1984; Sapolsky et al., 2000).
MDB’ de hipokampüste gelişen uzun süreli fonksiyon bozukluğu HPA aksı üzerindeki inhibitör etkinin ortadan kalkmasına ve glukokortikoid düzeylerinin artmasına yol açar. Bu durum hipokampüste nörotoksik etkiyi arttırarak hipokampüs fonksiyonlarının ve dolayısıyla HPA aks regülasyonunun daha da bozulmasına yol açar.
1.7. DEPRESYONDA CİNSİYET FARKLILIĞI
Çocukluk çağında MDB görülme oranı oldukça düşüktür. Ergenlik ve genç erişkinlik döneminden itibaren bu oran belirgin bir artış göstermektedir (Hankin & Abela, 2005; Kessler et al., 2005). MDB oranlarında görülen bu artışla ilgili olarak çeşitli görüşler öne sürülmektedir. Bir geçiş dönemi olan ergenlikte olumsuz yaşam olaylarıyla karşılaşma sıktır ve bu da stres artışına yol açmaktadır (Caspi & Moffitt, 1991; Hankin et al.,2007). Gelişim ve olgunlaşma sürecindeki beyin bu dönemde strese daha duyarlı haldedir (Perlman et al., 2007). Başka bir mekanizma ise çocukluk döneminden başlayarak şekillenen işlevsel olmayan yatkınlık faktörlerinin ergenlik döneminde stres verici olaylar karşısında devreye girerek depresyon gelişimine zemin hazırlamasıyla ilişkilidir (Abela & Hankin, 2008; Broderick, 1998; David A. Cole et al., 2008; Gibb et al., 2001; Hankin & Abramson, 2001); Genetik risk, emosyonel instabilite, çocukluk çağı travmaları gibi daha önceden var olan duyarlılık faktörleri zaman içerisinde depresyona spesifik bilişsel yatkınlıkların gelişimine katkıda bulunuyor olabilir (Hankin et al., 2009).
20
MDB ergenlik döneminden itibaren kadınlarda erkeklere oranla 2 kat daha fazla görülür (Bouma, Ormel, Verhulst, & Oldehinkel, 2008; Kuehner, 2003; Myrna M Weissman et al., 2005a). Ergenlik dönemindeki kızlar duyarlılık faktörleri, bilişsel yatkınlıklar ve kişilerarası stres verici yaşam olaylarıyla karşılaşma açısından erkeklere oranla daha dezavantajlıdır (Oldehinkel & Bouma, 2011). Ergen kızların stres verici yaşam olaylarının depresyona yol açan etkilerine karşı erkeklere oranla daha duyarlı oldukları görülmüştür. Sosyal stresörler karşısında ortaya konan HPA aks yanıtları cinsiyetler arası farklılık göstermektedir. Sosyal stresörler karşısında ergen kızların erkeklere oranla daha fazla kortizol yanıtı sergiliyor olmaları kızların HPA aks disregülasyonu nedeniyle artmış depresyon riski taşıdıklarını düşündürmektedir (Bouma et al., 2009). Beyindeki reseptörlerle etkileşen gonadal steriodlerin ergenlik dönemiyle birlikte kızlarda ve erkeklerde farklı şekilde işlemeye başlaması stres regülasyon yanıtındaki farklılıklardan sorumlu olabilir (Abela & Hankin, 2008; Angold et al.,1998; Bangasser et al., 2010; Gillies & McArthur, 2010; Levine, 2002). Dişi seks hormonları amigdala ve hipotalamustaki kortikosteroid reseptörlerini direkt olarak etkilemenin yanında; HPA aks fonksiyonlarının kontrolünde rol alan nörotransmitter sistemi de regüle etmektedir (Bigeon & McEwcn, 1982; Goldstein et al., 2010). Östrojenin neonatal dönemde de hipokampüs, amigdala ve PFK gibi bölgelerde yer alan bellek ve öğrenme ile ilişkili devrelerin programlanmasında cinsiyete özgü organizasyonel etkileri bulunduğu (Bowman et al., 2004) ve hayatın ilerleyen dönemlerinde neonatal programlanmanın aktivasyonel etkilerinin ortaya çıktığı öne sürülmektedir (Conrad et al., 2004; Luine et al., 2007; Wood et al., 2001).
1.8. DEPRESYONDA AİLESEL RİSK, GENETİK ETKİLER
İkiz ve aile çalışmaları depresyon risk faktörlerinin %31-42’ sinin genetik faktörler olduğunu göstermektedir (Sullivan et al., 2000). Ailesel risk depresyon için güçlü ve kapsamlı bir belirteçtir. Özellikle annede olmak üzere ebeveynde depresyon öyküsü, gençlerde depresyon gelişimi açısından önemli bir risk faktörü olarak ele alınmaktadır (Beardselee et al., 1998; Bijl et al., 2002; Garber et al., 2009; Goodman, 2007; Gunlicks & Weissman, 2008; Lieb, 2002; Schreier et al., 2006; Weissman et al., 2005a).
Goodman ve Gotlib depresyonun annelerden çocuklara geçişiyle ilgili oluşturdukları modelde; kalıtım, işlevsel olmayan nöroregülatör mekanizmaların varlığı, annenin olumsuz ve uygunsuz kognisyon, davranış ve affektlerine maruziyet ve stres verici yaşam olaylarıyla karşılaşma şeklinde farklı etkilerden bahsetmişlerdir (Goodman & Gotlib, 1999). Antenatal dönemde annenin
21
duygudurumu ve stresinin olasılıkla epigenetik programlama üzerinden bebeğin psikobiyolojik gelişimine etki ettiği; bu nedenle depresif annelerin çocuklarının nöroregülatör disfonksiyonlarla dünyaya geldiği düşünülmektedir (Huizink et al., 2002; Meaney, 2010; O’Connor et al., 2003; Wadhwa et al., 2002). Depresif anneler olumsuz ebeveyn davranışları sergilemekte; kişilerarası ilişkilerde, problem çözme, baş etme alanlarında yetersiz kalmakta ve sosyal öğrenme süreci açısından çocuk için yetersiz örnek teşkil etmektedirler (Hammen et al., 2008; Lovejoy et al., 2000). Ayrıca ebeveyn depresyonunun kendisi de aile içerisinde daha çok anlaşmazlık ve çatışmaya yol açarak stres kaynağı oluşturmaktadır (Hammen, 2002). Ebeveyn depresyonu olumsuz duygulanım, kontrol edilemeyen agresyon, bilişsel yatkınlık faktörleri, kortikal aktivite ve HPA aksı düzensizlikleri gibi diğer risk faktörlerini de etkilemektedir (Goodman, 2007). İkiz çalışmaları özellikle kızlarda, genetik yatkınlığın varlığı durumunda stres verici yaşam olaylarının depresyona yol açtığını öne sürmektedir (Kendler et al., 1995; Kendler et al., 2006; Sullivan et al., 2000).
MDB’de; gen polimorfizmlerinin olasılıkla hipokampüs hacmi üzerinden nörobiyolojik mekanizmalarla ilişki içerisinde olduğu (MacQueen & Frodl, 2010) ve hipokampüs hacminin büyük oranda genetik olarak belirlendiği ileri sürülmektedir (Gilbertson et al., 2002; Lyons et al., 2001). Son dönemde BDNF’ nin val66met polimorfizmi ve 5 HTTLPR polimorfizmi varlığının stres verici yaşam olayları karşısında depresyon riskini arttırdığı belirtilmektedir (Kim et al., 2007). 5 HTTLPR’ nin uzun (L) ve kısa (S) varyantları bulunmaktadır. S alelinin depresyon, anksiyete ve agresif kişilik özellikleriyle ilişkili olduğu, özellikle bu aleli taşıyan kadınların stres karşısında artmış kortizol yanıtı sergiledikleri (Jabbi et al., 2007) ve daha çabuk depresyona girdikleri gösterilmiştir (Bouma et al., 2008; Caspi et al., 2003; Eley et al., 2004; Grabe et al., 2005; Kendler et al., 2005; Mandelli et al., 2007; Sjöberg et al., 2006). Bahsi geçen gen çevre etkileşimini destekler nitelikte çok sayıda çalışma bulunmakla birlikte, herhangi bir ilişki saptamayan çalışmalar da bulunmaktadır. 5 HTTLPR’ nin gelişmekte olan beyni etkileyerek gelecekteki stres yanıtlarının programlanmasında rol oynayabileceği (Brown & Harris, 2008) ya da diğer genlerle bağlantılı olarak etki gösterebileceği öne sürülmektedir (Kaufman et al., 2006). 5HTTLPR’ nin S varyantı azalmış serotonerjik fonksiyonla ilişkili olup; anksiyete bozuklukları ve MDB için yatkınlık faktörü olarak bilinmektedir (Caspi et al., 2003; Serretti et al., 2007). BDNF’ nin val66met tek nükleotit polimorfizminin de depresyon için önemli bir predispozan faktör olabileceği öne sürülmektedir (Bae et al., 2006; Pezawas et al., 2005; Phillips et al., 2003; Steffens et al., 2000). Bu polimorfizmi taşıyan bireylerde sBDNF düzeyleri taşımayanlara oranla daha düşük saptanmaktadır. Val66met polimorfizmi pro-BDNF’ nin hücre içinde taşınma ve paketlenmesinde bozulmaya yol açarak, BDNF’ nin depolarizasyon bağımlı sekresyonunu azaltmaktadır (Chen et al., 2007; Egan et al., 2003). BDNF sekresyonlarında bozulmaya bağlı olarak bu bireylerin stres karşısında adaptasyonlarının yetersiz olduğu; hipokampüslerinde yapısal ve fonksiyonel değişikliklerin ortaya
22
çıktığı belirtilmektedir. BDNF’ nin val66met polimorfizmiyle ilişkili insan çalışmalarının sonuçları tutarsızdır. Ozan ve ark. yaptıkları bir çalışmada sBDNF düzeylerinin kadınlarda erkeklere oranla; depresif hastalarda sağlıklı kontrollere oranla daha yüksek olduğu; val66met polimorfizminin cinsiyetten ve depresyon varlığından bağımsız olarak sBDNF düzeylerini azaltıcı yönde etki gösterdiği görülmüş; ancak Verhagen ve ark.’ nın meta-analizinde depresyonla BDNF’ nin met aleli arasında herhangi bir ilişki bulunmadığı belirtilmiştir (Ozan et al., 2010; Verhagen et al., 2010). Hong ve ark. yaptıkları bir çalışmada BDNF polimorfizmi ile hastalık başlangıç yaşı ve intihar davranışı arasında herhangi bir ilişki saptanmazken; Sarchiapone ve ark. met aleli taşıyan bireylerde artmış intihar riski bulunduğunu, Iga ve ark. ise met aleli taşıyan bireylerde psikotik özelliklerin ve intihar davranışının daha yüksek oranda görüldüğünü belirtmişlerdir (Hong et al., 2003; Iga et al., 2007; Sarchiapone et al., 2008). Met aleli taşıyan depresif bireylerde görülen HAM-D skorlarında yükseklik, psikotik özellikler, intihar eğilimi, anksiyete, DLPFK ve hipokampüste gri madde hacminde azalma ile birlikte giden kognitif disfonksiyonlar met alelinin hastalık ciddiyetiyle ilişkili olabileceğini düşündürmektedir (Ozan et al., 2010). Kortikosteroid reseptörlerinin işlevselliği de gen kodlamasındaki varyasyonlara göre değişiklik göstermektedir. GR Bcl I ve GR 9 beta polimorfizmlerinin stres yanıtı düzenlenmesi üzerine etkileri bulunup, bu etkiler cinsiyete göre farklılık göstermektedir (Bouma et al., 2011; Kumsta et al., 2007). Glikojen sentaz kinaz (GSK) 3 polimorfizmi de hipokampüsü içerecek şekilde temporal bölge gri madde hacimleri ile ilişkili bulunmuştur (Inkster et al., 2009).
1.9. DEPRESYONDA ENDOFENOTİP KAVRAMI
Günümüzde psikiyatrik hastalıklar; etiyoloji ve patofizyolojiye dayanmayan ICD 10, DSM 4 gibi sınıflandırma sistemlerine göre benzer, aynı ya da üst üste binen belirti ve semptomlara dayanarak sınıflandırılmaktadır (Hasler et al., 2004; Hasler & Northoff, 2011; Peterson & Weissman, 2011). Oysa ister genetik ister çevresel, altta yatan aynı nedenler fenotipte farklı semptom ve belirtilere yol açabilmektedir. Hastalık etyolojisi ile fenotipte gözlenen bu kompleks ilişki hastalıklara spesifik nedenlerin saptanmasını güçleştirmektedir (Peterson & Weissman, 2011). Psikiyatrik bozuklukların genetiği son derece karmaşıktır; bu durum epigenetik ve stokastik etkiler, çeşitli gen ve gen-çevre etkileşimleri ile daha da karmaşık hale gelmektedir. Depresyonda ‘depresyon geni’ ya da ‘stresli yaşam olaylarına duyarlılık geni’ gibi bir takım genlerden tek başına söz etmek mümkün değildir. Çok sayıda gen farklı düzeylerde etki ederek, çok sayıda nöronal devrenin aktive olmasına ve farklı davranışsal değişimlerin ortaya çıkmasına neden olmaktadır. Bu durum bir davranış üzerine birden fazla devrenin etkisi olabildiği bilgisiyle daha da karmaşık hale gelmektedir (Gottesman & Gould,
23
2003; Gould & Gottesman, 2006; Meaney, 2010; Oldehinkel & Bouma, 2011; Suomi, 2006). Bu noktada; daha az gen, daha az etkileşim ve sonuç olarak daha az nöronal devrenin aktivasyonunu içerdiği öngörülen; genetik ve epigenetik belirleyiciler ile davranışsal fenotip arasında yer alan ölçülebilir bileşenleri tanımlamak için kullanılan endofenotip kavramından bahsetmek yarar sağlayabilir. Endofenotip kavramı etiyoloji ile ilişkili soruları çözmede yol gösterici olabilir. Bir endofenotiple ilgili olarak ne kadar az oranda nöronal devreden bahsedilirse altta yatan genetik ve nörobiyolojik temelleri tanımlamak o kadar kolay hale gelir.
Endofenotipler hastalığa özgüdür; hasta olanla olmayanı ayırt etmeye yarar. Kalıtılabilirdir; hasta kişilerin sağlıklı birinci derece akrabalarında sağlıklı popülasyona oranla daha sık görülmektedir. Hastalık belirtileri olmadığı dönemlerde süreklilik göstermekte, hastalık öncesi premorbid dönemde de gözlenebilmektedir. Endofenotipler; nörofizyolojik, biyokimyasal, endokrin, kognitif, nöroanatomik ya da nöropsikiyatrik olabilirler, hastalığın genetik etiyolojisiyle ve nörobiyolojik yanıyla ilişkilidirler (Gottesman & Gould, 2003; Gould & Gottesman, 2006). Bozuklukla bağlantılı spesifik bölge ve gen ilişkisini paylaşırlar (Waldman, 2005). Bir endofenotipin hasta kişilerin sağlıklı birinci derece akrabalarında daha sık görüldüğü ve hastalık öncesi dönemde de saptandığı göz önüne alınacak olursa; henüz hastalıktan etkilenmemiş yüksek risk grubundaki bireylerin dahil edilmediği, yalnızca etkilenen bireylerin beyin yapısı ve fonksiyonlarının incelendiği görüntüleme çalışmalarının aday endofenotipleri tanımlamaktan uzak olduğu söylenebilir. Bu nedenle son dönemde beyin tabanlı endofenotipleri araştırmak amacıyla MDB’ den etkilenen bireylerin yanında etkilenmeyen riskli bireylerin de dahil edildiği multijenerasyonel kohort çalışmaları yapılmaktadır.
1. 10. DEPRESYONDA HİPOKAMPÜS HACİM ÇALIŞMALARI
Sağlıklı kontrollerle karşılaştırıldığında MDB hastalarının küçük hipokampüs hacmine sahip olduğu görüşü genel olarak kabul görmekle birlikte (Campbell, 2004; Eker et al., 2011; Saylam et al., 2006; Videbech & Ravnkilde, 2004; Vythilingam et al., 2002); hipokampüs hacim azalması ile ilişkili herhangi bir kanıta rastlanmayan çalışmalar da bulunmaktadır (Eker et al., 2011; Eker et al., 2010; Isikli et al., 2013). Saylam ve ark.’nın yaptığı en az 4 hafta süreyle antidepresan tedavi almamış MDB hastalarının dahil edildiği bir çalışmada (Saylam et al., 2006); önceki çalışmalarla benzer şekilde (Campbell, 2004; Mervaala et al., 2000; Van Der Flier et al., 2004; Vythilingam et al., 2002), depresyon grubunda sol hipokampüs hacminin anlamlı olarak daha küçük olduğu ve hipokampüs hacmindeki azalmanın toplam hastalık süresiyle korelasyon gösterdiği saptanmıştır. Eker ve ark.’ nın
24
yaptığı çalışmalarda ise hastalık grubuyla sağlıklı kontrol grubu arasında hipokampüs hacmi açısından farklılık saptanmamış; hastalık süresi ve hastalık başlangıç yaşı hipokampüs hacmiyle ilişkili bulunmamıştır (Eker et al., 2011; Eker et al., 2010). Yakın zamanda yayınlanan bir derlemede hipokampüs hacminde görülen küçülmenin orta ve ileri yaş hasta grubunda sık rastlanan bir bulguyken; 40 yaş altı hasta grubunda daha az rastlanan bir bulgu olduğu belirtilmektedir (Eker & Gonul, 2010). Yaşlı kadınların (J D Bremner et al., 2000), erken başlangıçlı (Yvette I. Sheline et al., 2003), tedaviye dirençli (Mervaala et al., 2000) ve yineleyici depresyonu olan; çocukluk çağı istismar öyküsü bulunan (MacQueen et al., 2003; Vythilingam et al., 2002) hastaların dahil edildiği çalışmalarda sağlıklı kontrol grubuyla karşılaştırıldığında depresyon grubunda daha küçük hipokampüs hacimleri saptanmıştır. Hafif şiddette depresyonu olan hastaların sağlıklı kontrol grubuyla ve ilk epizod hastalarının tekrarlayan epizod hastaları ile karşılaştırıldığı çalışmalarda hipokampüs hacmi açısından anlamlı fark bulunmamıştır (Frodl et al., 2002; MacQueen et al., 2003). Başka bir derlemede benzer şekilde; hafif şiddette semptomları olan ilk epizod hastaları, kronik ve ağır şiddette depresyonu olan hastalarla karşılaştırıldığında hipokampüs hacimleri arasında fark saptanmadığı belirtilmiştir (Eker & Gonul, 2010). Hipokampüsle ilgili çalışmalarda farklı sonuçların saptanıyor olmasının; ölçüm tekniği, yaş, cinsiyet, genetik yapı, hastalık süresi, antidepresan tedavi, çocukluk çağı istismar öyküsü ve psikoaktif madde bağımlılığı gibi karıştırıcı faktörlerin etkisiyle ilişkili olabileceği düşünülmektedir (Campbell, 2004; Vythilingam et al., 2004).
BDNF’ nin val66met polimorfizmi PFK ve hipokampüs fonksiyonlarını etkileyen önemli genetik faktörlerden biridir. Özellikle hipokampüsün çevresel etkenlere duyarlı olduğu kritik dönemlerde erken yaşam stresörlerine maruz kalan alt gruplarda, BDNF salgılanmasında bozulmaya yol açan met alelinin; depresyon riskini arttırdığı ve hipokampüste gri madde hacminde azalmaya yol açtığı düşünülmektedir. Val66met polimorfizminin depresif bireylerde hipokampüs ve amigdala hacimleri üzerinde görülen olumsuz etkisine ek olarak; bu polimorfizmi taşıyan sağlıklı bireylerin hipokampüs ve amigdala hacimlerinin de taşımayanlara oranla daha küçük olduğu gösterilmiştir (Pezawas et al., 2005). Frodle ve ark.’ nın bir çalışmasında met alelinin hipokampüse etkisinin depresyon tanısından bağımsız olarak; hasta ve sağlıklı bireylerde aynı şekilde olduğu belirtilmektedir (Frodl et al., 2007). Gonul ve ark.’ nın tedavi almayan depresyon hastalarında ve sağlıklı kontrol grubunda BDNF’ nin val66met polimorfizmi ile hipokampüs hacim ilişkisini incelediği çalışmalarında; meta-analizlerle uyumlu şekilde, ilk epizod dahil depresif bireylerin sol hipokampüslerinin kontrollere oranla daha küçük olduğu gösterilmiştir. Hipokampüs hacmi ile yaş, HAM-D skoru, epizod sayısı ve son epizod süresi arasında korelasyon saptanmamış; ancak toplam hastalık süresi ile sağ ve sol hipokampüs hacimleri arasında neredeyse anlamlı bir korelasyon saptanmıştır (Gonul et al., 2010). Genotipler ayrı ayrı değerlendirildiğinde ise met aleli taşıyan MDB hastalarının HAM-D skorlarının homozigot val aleli
25
taşıyanlara oranla belirgin olarak daha yüksek olduğu; ancak Frodle ve ark.’ nın çalışmasının aksine yalnızca homozigot val aleli taşıyan depresif bireylerde hipokampüs hacimlerinin kontrollere oranla daha küçük olduğu saptanmıştır. Bu durum val aleli taşıyan depresif bireylerin hipokampüslerinin kortizol yüksekliği gibi depresyonun patofizyolojisindeki süreçlerin sonuçlarına daha duyarlı olduğunu düşündürmektedir. Bu çalışmada Frodle ve ark’ nın çalışmasından farklı olarak met aleli taşıyan depresif bireylerle kontrol grubu arasında hipokampüs hacim farkı saptanmaması; hastaların erken yaşam travmalarının bulunmayışı, antidepresan tedavi almıyor oluşu, ve düşük hastalık şiddetiyle açıklanmaktadır (Frodl et al., 2007; Gonul et al., 2010)
Yetersiz BDNF sekresyonunun hipokampüs hacminde yol açtığı küçülmenin; hastanın yaşı, hastalığın şiddeti ve süresiyle daha belirgin hale geldiği düşünülecek olursa BDNF düzeylerindeki düşüşün hastalığın erken döneminden önce ortaya çıktığı öne sürülebilir. Bu nedenle Eker ve ark.’ nın orta şiddette semptomları olan ve komorbid hastalığı bulunmayan, ilk epizod, genç depresyon hastalarını dahil ettikleri çalışmalarında; hasta grubunda hipokampüs haciminde küçülme ile ilgili bulguya rastlanmamıştır (Eker et al., 2010). Depresyon grubunda BDNF düzeyleri ile hipokampüs hacmi arasında anlamlı korelasyon saptanırken kontrol grubunda herhangi bir ilişki saptanmamıştır. Sonuçların cinsiyete göre değişiklik göstermediği; MDB grubunda antidepresan tedavi öyküsü, epizod süresi ve HAM-D skorlarının sonuçları etkilemediği görülmüştür. Hastalık süreci boyunca BDNF düzeylerindeki progresif düşüşü ve BDNF düzeyiyle hipokampüs hacmi arasındaki belirgin korelasyonunu görmek amacıyla MDB için yüksek riskli bireylerin ve ilk epizod hastalarının dahil edildiği izlem çalışmalarına ihtiyaç duyulmaktadır.
MDB’ da 5 HTTLPR polimorfizminin hipokampüs hacmi üzerine etkisiyle ilgili çalışmaların sonuçları henüz netlik kazanmamıştır (Eker et al., 2011; Frodl et al., 2004; Frodl et al., 2007; Hickie et al., 2007; Taylor et al., 2005). MDB’ da 5 HTTLPR polimorfizminin küçük hipokampüs hacmiyle ilişkili olduğu öne sürülmekle birlikte; bu polimorfizm ile hipokampüs hacmi arasında ilişki bulunmadığını belirten çalışmalar da bulunmaktadır (Hickie et al., 2007). Frodle ve ark. MDB’ da 5 HTTLPR polimorfizmlerinin hipokampüs hacmi üzerine etkisi ile ilgili olarak L/L genotipinin hipokampüs hacmimde azalma ile ilişkili olduğunu öne sürmüşlerdir (Frodl et al., 2007; Frodl et al., 2004). Taylor ve ark. 5 HTTLPR polimorfizminin hipokampüs hacmi üzerine etkisi bulunmadığını; ancak grup erken başlangıçlı ve geç başlangıçlı olarak ikiye ayrıldığında, geç başlangıçlı hastalarda L/L genotipinin, erken başlangıçlı hastalarda ise S/S genotipinin küçük hipokampüs hacmi ile ilişkili olduğunu saptamışlardır (Taylor et al., 2005). Buradan yola çıkarak hastalık başlangıç yaşının hipokampüs hacmi üzerine etkisi olabileceğini öne sürmüşlerdir. Eker ve ark.’ nın yaptığı çalışmada ise Frodle ve ark.’ nın akisine depresif grupta homozigot S/S varyantı taşıyanların bilateral hipokampüs hacimlerinin sağlıklı kontrollerle karşılaştırıldığında daha küçük olduğu; S/L ve homozigot L/L varyantı taşıyanların
26
hipokampüs hacimlerinde ise herhangi bir farklılık bulunmadığı görülmüştür (Eker et al., 2011; Frodl et al., 2007; Frodl et al., 2004). Aynı çalışmada sağlıklı kontrol grubu ve ilk epizod hastaları ele alındığında; hipokampüs hacimlerinin genotipe göre farklılık göstermediği saptanmış; hipokampüs hacmi ile HAM-D skorları, toplam hastalık süresi, son epizod süresi, başlangıç yaşı ve epizod sayısı gibi klinik değişkenler arasında herhangi bir korelasyon saptanmamıştır. Buradan yola çıkarak; S/S aleli taşıyan depresif hastalarda azalmış serotonerjik tonusun nörogenezde azalmaya, hücresel entegrayonda bozulmaya ve sonuç olarak hipokampüs hacminde azalmaya yol açtığı düşünülmektedir (Eker et al., 2011).
Frodle ve ark.’ nın yaptığı bir başka çalışma; hipokampüs yapısı ile ilşkili olarak gen-çevre etkileşimini göstermesi açısından önemlidir (Frodl et al., 2010). Bu çalışmada sağlıklı grupla tüm hasta grubu arasında hipokampüs hacmi açısından farklılık saptanmazken; 5 HTTLPR’ nin S alelini taşıyan ve çocukluk çağı stresör öyküsü bulunan depresif hastaların, sadece S aleli taşıyan ya da sadece çocukluk çağı stresör öyküsü bulunan hastalara oranla hipokampüs hacimlerinin küçük olduğu görülmüştür. Sağlıklı kontrollerde ise hipokampüs hacmi stres ya da genotipe göre farklılık göstermemiştir. Kaufman ve ark.’ nın çalışmasında istismar edilen çocuklarda BDNF’ nin met alelinin katkısıyla birlikte homozigot S/S aleli varlığının MDB riskini arttırdığı belirtilirken; Risch ve ark.,’ nın meta-analizinde ise 5 HTTLPR’ nin S alelinin kritik yaşam olayları ile birlikteliğinin MDB riskini arttırmadığı belirtilmiştir (Kaufman et al., 2006; Risch et al., 2009). Buradan yola çıkarak genetik predispozisyonla birlikte çevresel etkenlerin major depresyona yatkınlığı ve belirtilerin ortaya çıkışını etkilediğini söylenebilir (Eker et al., 2011).
Mevcut literatür bilgileri doğrultusunda hipokampüs hacminde saptanan küçülmenin hatalı nörogelişimsel bir değişikliğin sonucu olarak hastalık belirtilerinin ortaya çıkışından önce mi var olduğu; yoksa depresyon patofizyolojisiyle ilişkili nörotoksik mekanizmalara bağlı olarak hastalık süresince mi meydana geldiği net olarak bilinmemektedir (Isikli et al., 2013; Sheline, 2011). Erken başlangıç yaşı (J. Keller et al., 2008a); depresyonda geçirilen sürenin uzunluğu (Campbell, 2004; Colla et al., 2007), hastalık şiddeti ve depresif epizod sayısının hipokampüs hacminde küçülmeyle ilişkili olduğunu öne süren çalışmalar; bu küçülmenin depresif belirtilerin ortaya çıkışıyla başlayan ve yıllar içerisinde süregelen kümülatif bir süreçle ilişkili olduğunu (Chen et al., 2010; McKinnon et al., 2009; Sheline et al., 2003); hasta grubunun yaş ortalamasının küçük, HAM-D skorlarının düşük ve epizod sayılarının az olduğu depresif bireylerle yapılan çalışmalar ise saptanan bu küçülmenin hastalığın erken dönemlerinde meydana geliyor olabileceğini düşündürmektedir (Saylam et al., 2006). Bununla birlikte hipokampüs hacminde görülen azalmanın sadece şüpheli genleri taşıyan veya çocukluk çağı travması bulunan bireylerde saptandığı çalışmalar (Eker et al., 2011; Frodl et al., 2010; Gonul et al., 2010; Lupien et al., 2009; Vythilingam et al., 2002); bu küçülmenin hastalık belirtilerinden önce,