Biyokimya ve Klinik Biyokimya
Anabilimdalı
EFOR ÖNCESİ VE SONRASI
SERUM SÜPEROKSİD DİSMUTAZ, KATALAZ,
GLUTATYON PEROKSİDAZ VE
MALONDİALDEHİT
DÜZEYLERİNİN İNCELENMESİ
(Uzmanlık Tezi)
Dr. Gülendam DEGİRMENCİ
Tez Danışmanı
Prof. Dr. Naime CANORUÇ
DİYARBAKIR
2009
ÖNSÖZ
Uzmanlık eğitimim boyunca bilgi ve deneyimlerinden yararlandığım, tezimin danışmanlığını yapan, saygıdeğer hocam Prof. Dr. Naime CANORUÇ’a ve eğitimim boyunca desteğini esirgemeyen tüm bölüm hocalarıma şükranlarımı sunarım.
Tezimin hazırlık aşamalarında emeği geçen asistan arkadaşlarıma ve tüm çalışanlara teşekkür ederim.
Bugünlere gelmemi sağlayan aileme ve tüm sevdiklerime, her konuda desteğini hissetiğim eşim Aydın’a, biricik kızım Rojin ve canım oğlum Deniz’e sonsuz sevgilerimle…
İÇİNDEKİLER
İç Kapak Sayfa
Önsöz I
İçindekiler Dizini II
Şekiller Dizini III
Tablolar Dizini III Simgeler Ve Kısaltmalar Dizini IV
Türkçe Özet V
İngilizce Özet VII
1.Giriş ve Amaç 1
2.Genel Bilgiler 4
2.1. Oksidatif Stres ve Antioksidanlar 4
2.1.1. Serbest Radikaller 4
2.1.1.1. Serbest Radikaller ve Reaktif Oksijen Türleri 5
2.1.1.2. Serbest Radikal oluşumu ve Radikal kaynakları 8
2.1.1.3. Eksojen Ajanlar 11
2.1.1.4. Serbest Radikallerin Hücresel Yapılara Etkileri 13
2.1.2. Antioksidan Savuma Sistemi 17
2.1.2.1.Antioksidanların Sınıflandırılması 19
2.1.2.2. Sellüler Antioksidan Enzimler 24
2.1.2.3. Membran Antioksidanlar 25
2.1.2.4. Ekstrasellüler Antioksidanlar 26
2.1.3. Oksidan-Antioksidan Denge 28
3. Gereç ve Yöntem 30
3.1. Araçlar ve Gereçler 32
3.2. Kan Öreklerinin Alınması 32
3.3. Kimyasal Analizler 33 3.4. İstatistiksel Analizler 35 4. Bulgular 36 5. Tartışma 38 6. Sonuç 44 7. Kaynaklar 45
ŞEKİLLER Sayfa Şekil 2.1. Radikal üretimi, hedef yapılar ve riskler. 8 Şekil 2.2. Çevresel etkilerin araşidonik asit salınımı ile radikal oluşturmaları. 12 Şekil 2.3. Serbest radikallerin zararlı etkileri 13
Şekil 2.4. Reaktif oksijen türleri. 14
Şekil 2.5.Geçiş metallerinin katalizi ile radikal üretimi ve lipit peroksidasyonu. 16 Şekil 3.1. Şematik olarak SOD tayini 34 Şekil 4.1. Efor Öncesi ve Efor Sonrası GPx, SOD, MDA ve CAT değerlerinin
birbirleriyle karşılaştırılması 37
TABLOLAR Sayfa
Tablo 2.1. Sık karşılaşılan radikaller, simgeler ve kimlikleri. 7 Tablo 2.2. Bilinen endojen antioksidanlar ve etkinlikleri. 20 Tablo 2.3. Başlıca eksojen (farmakolojik) antioksidanlar ve özellikleri. 23 Tablo 2.4. İntrasellüler antioksidanlar ve raksiyonları. 25 Tablo 2.5. Membran antioksidanları ve etkileri 26 Tablo 2.6. Ekstrasellüler antioksidanlar ve özellikleri. 28
Tablo 2.7. Serbest radikallerin, radikal olmayanlarla başka radikal oluşturmak üzere girebilecekleri reaksiyonlar. 30
Tablo 4.1. Çalışmaya katılan kadın erkek ve yaşları ortalamaları. 36 Tablo 4.2. Efor öncesi ve efor sonrası GPx, SOD, MDA ve CAT değerlerinin
birbirleriyle karşılaştırılması. 36
SİMGELER VE KISALTMALAR DİZİNİ CAT: Katalaz
SOD: Süperoksit Dismutaz GPx: Glutatyon Peroksidaz MDA: Malondialdehit GR: Glutatyon Redüktaz
NADP: Nikotinamid adenin dinükleotid fosfat GSSG: Okside glutatyon
GSH: Glutatyon
MPO: Myeloperoksidaz
KOAH: Kronik obstrüktif akciğer hastalığı MI: Miyokard infarktüsü
KBY: Kronik böbrek yetmezliği PUFA: Poli unsatüre yağ asiti PMNL: Polimorfonükleer lökositler
TBARS:
Thiobarbituric acid reactive substances EDTA: Etilendiamintetraasetik asit
µl: Mikrolitre μm: Mikrometre μmol/lt: Mikromol/litre mg/dl: Miligram/desilitre rpm: Revolution per minute DNA: Deoksiribonükleik asit
HPLC: High performace liquid chromotoghrapy ATP: Adenozin trifosfat
ÖZET
Egzersiz esnasında insanlarda önemli birçok fizyolojik değişiklikler oluşmaktadır. Egzersiz sırasında üretilen reaktif oksijen türlerine (ROS) karşı ilk savunma hattını Süperoksit Dismutaz (SOD), Katalaz (CAT) ve Glutatyon Peroksidaz (GPx) sağlamaktadır. Bu nedenle egzersizin direkt olarak bu enzimleri etkileyebileceği düşünülmektedir.
Serbest oksijen radikallerinin hücre membranlarına zarar vermesi sonucu bir reaksiyonlar zinciri oluşur. Normalde meydana gelen serbest oksijen radikallerinin oluşturduğu oksidatif stresten vücut, antioksidan sistem sayesinde zarar görmesini engellemektedir. Serbest oksijen radikallerinin düzeyinin direkt olarak ölçülmesi zordur. Bu nedenle serbest oksijen radikallerinin düzeyini ölçebilmek için, lipid peroksidasyonunun son ürünü olan Malondialdehit (MDA)‘nın vücut sıvılarındaki düzeyi indirek olarak serbest oksijen radikallerinin düzeyini göstermektedir.
SOD, substrat olarak serbest oksijen radikallerini kullanan ve süperoksidi hidrojen perokside çeviren bir metalloenzimdir. Bu reaksiyon “oksidatif strese karşı ilk savunma” olarak da adlandırılmaktadır. Çünkü süperoksit zincirleme radikal reaksiyonlarının güçlü bir başlatıcısıdır. Bu sistem sayesinde hücresel kompartımanlardaki süperoksit düzeyleri kontrol altında tutulmaktadır.
Katalaz peroksizomlarda bulunan bir enzimdir. Hidrojen peroksidi su ve oksijene ayrıştırmaktadır. Katalaz hücreyi kendi respiratuar patlamasına karşı koruyucu olarak hizmet etmektedir. Aynı zamanda serbest oksijen radikallerinin mRNA ve protein üzerindeki ekspressiyonunu gösteren SOD ve Katalaz düzeyi de serbest oksijen radikallerinin hücresel hasar düzeyini göstermektedir.
GPx, pek çok hücrede sitozollerde bulunan bir enzimdir. Sitozol ve mitokondrilerde SOD tarafından oluşturulan hidrojen peroksit ve yağ asidi hidroperoksitlerini ortadan kaldırmaktadır. Hidrojen peroksit ve organik peroksitlerin indirgenmesiyle oksitlenen glutatyon, glutatyon redüktaz enzimi ve başlıca pentoz fosfat yolundan sağlanan Nikotinamid adenin dinükleotid fosfat hidrojen (NADPH) yardımıyla indirgenerek reaksiyonların devamını sağlar. GPx fagositik hücrelerde önemli fonksiyonlara sahiptir. Diğer antioksidanlarla birlikte GPx, solunum
patlaması sırasında serbest radikal peroksidasyonu sonucu, fagositik hücrelerin zarar görmesini engeller. Eritrositlerde de GPx oksidan strese karşı en etkili antioksidandır.
Bu çalışma, efordan sonra, oksidatif stresin ortaya çıkıp çıkmadığını göstermeyi amaçlamaktadır.
Bu çalışmada, sistemik hastalığı olmayan, 20–55 yaşlar arasında, cinsiyet farkı gözetmeksizin, dışarıdan antioksidan takviyesi almayan, sağlıklı bireyler dahil edilmiştir. Kan, efor testi öncesinde ve efor testinden 10 dakika sonra olmak üzere 2 kez alınmıştır. Alınan kan örneklerinde serum süperoksit dismutaz (SOD), serum katalaz (CAT), plazma glutatyon proksidaz (GPx), ve serum malondialdehit (MDA) seviyeleri efor öncesi ve sonrası tespit edilerek, eforun oksidatif stres üzerine etkisi araştırılmıştır.
Efor sonrası bireylerin SOD değeri ortalaması 0,219±0,219 U/ml olup efor öncesi ile arasında pozitif ve yüksek bir ilişki olduğu görülmektedir (p<0.05). Yine efor öncesi denek grubunda GPx değerinin 0,650±0,004 nmol/min per ml olduğu ve anlamlı yüksek çıktığı (p<0.05) görülmektedir. CAT değeri ortalamasının efor sonrası 0,152±0,025 U/ml olduğu ve yüksek çıkmasına rağmen istatiksel olarak anlamlı olmadığı görülmüştür. MDA değeri ortalaması efor sonrası 1,988±1,522 nmol/ml olup, düşük çıkmasına rağmen istatiksel olarak anlamlı değildir.
Kısacası, aktif bireylerin metabolizmasının orta şiddette egzersize ve aktif yaşama adapte olduğu söylenebilirken aktif bireylerin MDA düzeylerinin sedanter bireylere göre düşük olması bu deneklerin oksidatif strese adapte oldukları yönünde yorumlanabilir.
Efor sorası MDA’ in istatistiksel anlamda olmasa da düşük olması ve SOD ve CAT aktivitelerinin de efor sonrası yüksek olması, oksidatif stresi antioksidan enzimler ile dengelemeye çalışıyor olmaları ile ilgili olarak yorumlanabilir.
Sonuç olarak egzersizin yüksek oksidatif stres ile artan lipid peroksidasyonun diğer rahatsızlıklara zemin hazırlayabileceği ama artan antioksidan savunmanın egzersizin seviyesine göre vücuda yararlı olduğu öne sürülebilir.
ABSTRACT
While in exercise there have been many physiological changes in human metabolism. Superoxide Dismutase, Catalase, Glutation Peroxydase provide first defence line against to some kinds of reactive oxygen radicals created during exercise.
İn result of many free O2 radicals damages on cell membrans, some reactional chains occurs. Normally Antioxydan system protects body from oxydative stress of O2 radicals. It is hard to estimate directly level of free O2 radicals. For this reason Malondialdehyde, the last product of lipid peroxydation in body fluid give us indirectly level of O2 radicals.
SOD is a metaloenzyme that uses free O2 radicals as a substract for converting superoxyde to hydrogen peroxyde.This reaction called the first defence of oxydative stress. Because superoxyde is a powerful trigger in radical chains reaction so this system keeps down superoxyde in a cell compartment.
Catalase in peroksizomes decomposes hydrogen peroxyde to O2 and H2O . Catalase protects cell against its own respirational explosions. SOD and Catalase level indicates free O2 radical expression on mRNA and protein simultaneously it gives us the level of cell destruction.
GPx is a enzyme commonly located in cell sitozoles. This enzyme GPx, eliminates hydrogen peroxyde and fatty acid hidroperoxydes that products of SOD in sitozole and mitokondria. Hydrogen peroxyde and organic peroxydes reductant makes oxydative impact on glutatyon. Oxydated glutatyon with the help of glutatyon reductant enzyme and NADPH (as a cofactor comes from pentoz phosphate cascade) is reducted for continue reactional chain. GPx has an important function in fagositic cells. Gpx with the other antioxydans protect fagositic cells in respiratuar explosions. Meanwhile, Gpx is the most effective antioxydan against oxydative stress in erythrocytes.
İn this study we are looking for oxydative streess appearing after effort. İn this research we prefer between 20-55 ages with no sexual difference, have no sistemic diseases, using no antioxydan pills and healthy candidates. We took blood samples before the effort test and 10 minutes after. SOD, CAT, GPx, MAD
levels in blood samples before and after effort test are determined so we search effort on oxydative stress.
In this study MDA and GPx levels are found low, SOD levels are statistically and meaningfully high and CAT levels are high but meanless. Shortly, active individuals metabolism can be adapted to mid-level exercise and active lifestyle. Active individuals MDA levels are lower than sedanter individuals so we can say that these active ones have more chance to adapt the oxydative stress rather than sedanter ones.
After body effort MDA levels lowness and activity of SOD and COD levels highness tell us antioxydan enzymes trying to stabilize oxydative stress.
As a result, exercise with high oxydative stress and lipid peroxydation can bring about some uncomfortable results but increasing antioxydan defence with acceptable exercise healthy for humans.
1. GİRİŞ VE AMAÇ
Uygarlığın getirdiği kolaylıklar ve sağladığı olanaklar sayesinde insanlar her geçen gün, daha az hareket eder duruma gelmiştir. İnsan vücudu doğuştan gelen özelliklerinden dolayı sürekli hareket etmek ihtiyacındadır. Diğer tüm canlılarda olduğu gibi insanlar çetin doğa koşulları ile mücadele edecek, kendini savunabilecek, en güç durumlarda dahi ihtiyaçlarını sağlayabilecek bir yapıya sahiptir. İçinde bulunduğumuz yüzyıla gelinceye kadar bu yapının gereği olarak insanlar sürekli hareket halinde olmuş, pek çok işi yerine getirmek için kas gücünü kullanmak zorunda kalmıştır (1).
Organizmada yürüme, koşma, atlama gibi fiziksel hareketler iskelet kaslarının çeşitli kasılmaları sayesinde mümkün olur. Egzersiz; kas kuvveti, reaksiyon zamanı, nöromüsküler koordinasyon, denge, aerobik ve anaerobik kapasiteler gibi fiziksel performansa etkili faktörleri geliştirmek amacıyla yapılan düzenli aktiviteleri içermektedir (2).
Aerobik organizmalar toksisitesi yüksek olan serbest oksijen radikalleri ile sürekli karşı karşıyadırlar. Normal sakin bir yaşamda bile anaerobik metabolizma sırasında düşük düzeylerde sürekli olarak serbest oksijen türevleri üretilir. Metabolik aktivitenin artışıyla oluşan serbest oksijen türevleri miktarı da artar.
Moleküler mekanizmalar düşünüldüğünde, egzersizin iskelet kasını, kalp kasını etkilediği, dolaşımdaki kan hacmini ve çeşitli metabolik değişimler gibi önemli fizyolojik adaptasyonlar ile ilgili olduğu bilinmektedir (3). Örneğin, fiziksel aktivitenin şiddetine bağlı olarak vücudun oksijen kullanımı yükselir. Kasların oksijen kullanımı dinlenme anından yüksek şiddetli egzersizlerde 100–200 kat artar. Hem fiziksel aktivite için hem de organizmanın hayati fonksiyonlarını sürdürebilmesi için gerekli olan oksijen, organizmayı toksik oksijen ürünlerinin zararlı etkileri ile karşı karşıya bırakır. Savunma mekanizmaları, bu tehlikeleri azaltmak için gereklidir. Bu koruyucu mekanizmalar antioksidan savunma sistemi olarak tanımlanır. Bunların görevi, oksijenin tam olmayan indirgenmesi sırasında meydana gelen serbest radikaller ile oluşan oksidatif parçalanmadan hücre bileşenlerini korumaktır (4).
Organizmanın hayati fonksiyonlarını sürdürebilmesi için gerekli olan oksijen, organizmayı toksik oksijen ürünlerinin zararlı etkileri ile karşı karşıya bırakmıştır. Normalde organizmada oluşan serbest oksijen radikalleri ile antioksidan aktivite arasında hassas bir denge vardır. Şiddet ve süresi ile ilişkili olarak egzersiz, metabolik süreçleri ve oksijen tüketimini artırarak daha fazla serbest radikal oluşumuna neden olmaktadır. Serbest radikallerdeki artış antioksidan savunma kapasitesini aşarak lipid peroksidasyon zincir reaksiyonlarını tetikleyebilir (5). Egzersiz ve lipid peroksidasyonuyla ilgili veriler çelişkilidir. Farklılıkların egzersizin türü, şiddeti ve süresine bağlı olabileceği düşünülmektedir (6).
Seçilen fiziksel aktif yaşam tarzı, yani kişinin günlük yaptığı aktivite miktarı ve egzersizle birlikte ortaya çıkan oksidatif stres ve buna karşı antioksidan savunma mekanizmaların harekete geçmesi istenilen bir olaydır. Kısacası, fiziksel aktivite oksidatif stres yaratırken bu da antioksidan savunma elemanlarının artışına neden olmakta ve böylece vücut için yararlı bir mekanizma harekete geçirilmektedir. Kronik olarak oksidan stres ile karşı karşıya kalmanın antioksidan savunmayı güçlendirdiği bildirilmiştir (7,8). Egzersiz de, serbest radikaller oluşturmasına karşın, düzenli olarak yapıldığında antioksidan savunmayı kuvvetlendirmektedir (5).
Serbest radikaller ya moleküldürler ya da dış yörüngelerinde eşleşmemiş elektronlar içeren moleküler bileşenlerdir. Bu bileşenler komşu moleküllerle oksidasyon yaparak elektron yapılandırmayı sağlamlaştırmaya çalışırlar. Serbest radikallerin iletimdeki rollerini göz önünde bulundurduğumuzda, serbest radikaller dönüşümsüz oksidatif stresin bir parçasıdır. Egzersizle olan ilişkisine baktığımızda, serbest radikallerin, kas kasılmasında, enerji üretiminde ve sonuçta fiziksel performansta etkili oldukları tahmin edilebilir (9).
Fiziksel egzersiz sırasında metabolizma hızı kassal aktivitenin şiddetiyle orantılı olarak artmaktadır. Egzersiz şiddet ve süresine göre oksidatif strese neden olabilmektedir. Egzersiz esnasında aktif iskelet kasına yönelen oksijen miktarında bir artış olur. Bu da reaktif oksijen maddeleri (ROS) ve serbest radikallerin üretimini artırır.Buna bağlı olarak egzersiz sırasında serbest oksijen radikallerinin seviyesinde artış hücrelerin savunma kapasitesindeki antioksidanları geçerse lipid peroksidasyonun oluştuğu düşünülmektedir (10). Lipid peroksidasyonu sonucu ortaya çıkan maddelerden biri olan MDA oksidatif stresin bir indikatörü olarak
kullanılmaktadır. Vücutta oluşan hasarın boyutunun sporculara rejenarasyon süresini etkileyebileceği düşünülebilir. Ancak egzersiz belirli şiddette ve düzenli olarak yapıldığında antioksidan savunmayı kuvvetlendirebilmektedir (7). Fiziksel egzersizler sırasında oluşabilecek oksidatif hasarın boyutu sadece serbest radikal üretimi ile değil aynı zamanda antioksidanların savunma kapasitesi tarafından da belirlenmektedir. Egzersiz sırasında üretilen reaktif oksijen türlerine (ROS) karşı ilk savunma hattını SOD, CAT ve GPx sağlamaktadır. Bu nedenle egzersizin direkt olarak bu enzimleri etkileyebileceği düşünülmektedir.
Antioksidanlar, serbest radikallerle tepkimeye girerek bunların başlattığı zincir reaksiyonu durduran ve böylece vücudumuzdaki hayati bileşenlerin zarar görmesini engelleyen moleküllerdir. Damarlarımızın serbest radikaller tarafından bloke edilmesi kalp krizi, beyin kanaması, yüksek kolesterol vb. birçok hayati rahatsızlıklara etken olabilir. Bunların temizlenmesinde etkin rol oynayan ve bizi bu hastalıklardan koruyan antioksidanlardır (7).
Bu çalışmada egzersizlerinin antioksidan savunma sistemi üzerine etkisinin araştırılması amaçlanmıştır. Efor öncesi ve sonrası kan örnekleri alınarak MDA, CAT, GPx ve SOD değerleri arasındaki farkın incelenerek karşılaştırılması planlanmıştır.
2. GENEL BİLGİLER
2.1. OKSİDATİF STRES VE ANTİOKSİDANLAR 2.1.1. Serbest Radikaller
Dış orbitallerinde bir ya da daha fazla eşleşmemiş elektron bulunan serbest radikaller, kısa ömürlü, reaktif atom veya moleküllerdir. Oksijen metabolizması ara ürünleri olan oksijen türleri, halojen atomlar, Na+, K+ gibi alkali metal atomları, bir orbitalinde tek elektron bulunduran NO, NO2 gibi bileşikler, Cl veya Br gibi tek atomlu yapılar radikaller olarak sınıflandırılmaktadır. Dış yörüngelerinde birer elektron taşıyan geçiş metalleri ise serbest radikal kabul edilmezler. Radikaller; pozitif, negatif ya da nötr olabilirler. Serbest radikal kabul edilen atom ve moleküller, elektron konfigürasyonlarının yanında, lokal kinetik reaktiviteleri ve termodinamik yapıları göz önünde bulundurularak da değerlendirilirler (12,13).
Atomlarda elektron dağılımı incelendiğinde elektronların kabuklarda olduğu görülür. Kabuklar alt kabuklardan, alt kabuklarda elektron içeren orbitallerden oluşur. Orbitallerde, her biri diğerinin fizikokimyasal reaksiyonlara girmesini engelleyen, zıt spinlerde (↓↑) hareket eden elektron çiftleri vardır (14).
Bir elektronun bir molekülden diğerine transferi ve homolitik bağ ayrılması gibi mekanizmalar serbest radikal oluşumuna neden olurlar (12, 15).
A∼B→A.+B.
veya A+B→A+.+ B-.
Serbest radikalde bulunan eşlenmemiş elektron, kimyasal bağ içinde bir başka elektronla spin paylaşmadığından, ekstra elektronları başka atomlara lokalize oluncaya ya da elektron alıncaya dek oldukça reaktiftir. Aşırı reaktif bu maddeler, diğer atom ve moleküllerin kimyasal yapılarını birkaç farklı mekanizma yoluyla değiştirerek, onları kararsız formda yapılar haline getirirler (12).
CH 3 . + CH 3 .→ CH3CH3
Radikallerle, diğer nötral atom ya da moleküllerin reaksiyonlarında görülen enyaygın yol, bir atomun alınması ya da eklenmesidir (12,13).
ROO. + RH2→ ROOH + RH. Abstraksiyon HO. + aromatik molekül → HO-aromatik Adezyon
Dış orbitallerinde eşlenmemiş elektron bulunan serbest radikaller, elektron konfigürasyonlarını pozitif yükle dengelemek eğiliminde olduklarından oldukça kararsız yapıdadırlar (12,14,16).
2.1.1.1. Serbest Radikaller ve Reaktif Oksijen Türleri
Aerobik organizmalar yaşamlarını sürdürebilmek için oksijenin toksik metabolik ürünleri ile birlikte yaşamak zorundadır (17).
Aerobik canlılardaki oksidasyon reaksiyonları, besin kaynağı konumundaki maddelerde temel element olması, solunumda rol alması, canlı organizmaları oluşturan moleküllerin yapısına girmesi, oksijeni yapısal ve fonksiyonel açıdan önemli yapmaktadır (17). Serbest radikal reaksiyonlarında, oksijenin moleküler formu, hidrojen peroksit, süperoksit, geçiş metali iyonları, hidroksil radikali önemli yapılardır (12, 16). Bazı literatürlerde “diradikal” veya “dioksijen” şeklinde ifade edilen oksijen atomu eşlenmemiş iki elektron taşımaktadır (12).
Oksijen Orbital Diyagramı Elektronik Sembolü
1s 2s 2p 1s2 2s2 2p4
↓↑ ↓↑ ↓↑ ↑ ↓
Serbest radikal türleri ile kolayca kimyasal tepkime verebilen oksijen atomunun nonradikal yapılarla reaksiyona girmesi oldukça zordur (12). O2 molekülü aerobik metabolizma esnasında, 4 elektron alarak suya indirgenir. Metabolik reaksiyonlarda tam olarak indirgendiğinde son ürün olarak suya dönüşen oksijen, redüksiyonun ara basamaklarında metabolit olarak reaktif oksijen türlerini açığa çıkarır (32,33). O2 molekülünün iki elektronu birden almasını, O2 molekülünün dış yörüngesindeki elektronların paralel spinlerde olması (↑↑) engellemektedir. Oksijenin, kimyasal bağ oluşturabilmesi için, elektronlarının zıt spinlerde olması gerekir. Spin değişimi uzun süre ve oldukça yoğun enerji gerektirdiğinden, oksijen molekülü çift yerine tek elektron almayı benimsemektedir (12).
Oksijen atomunun bir elektron alarak indirgenmesi ile süperoksit radikali (O2.-) açığa çıkar (13,17,18,20). Aerobik canlıların hemen tümünde oluşan süperoksit, solunum zincirinde NADPH’ a bağlı dehidrogenazdan, oksijenin taşınması sırasında hemoglobinden ve mitokondri elektron transport zincirinde elektron sızması şeklinde rutin olarak oluşmaktadır (12).
O2+ e-→ O2
.-Süperoksit anyonu, metal kompleksleri, Cu+2 gibi geçiş metalleri ve serbest radikallerle hızlı bir reaksiyon verir. Süperoksit, hızlı bir şekilde hidrojen perokside ve oksijene dönüşür. Geçiş metali iyonlarını indirgemesi, endotel gevşetici olarak bilinen NO ile peroksinitriti veren reaksiyonda yer alması, H2O2 kaynağı olması gibi nedenler süperoksit radikalini fizyolojik açıdan önemli hale getirmektedir (12,13).
Oksijen molekülüne iki elektron eklenmesi ile oluşan, serbest radikal olmayan hidrojen peroksit, reaktif bir oksijen türü olarak, zararlı oksijen radikallerine dönüşebilmesi nedeniyle önemlidir (12,16).
HO2 + 2e-+ 2H+→ H2O2
Süperoksitle reaksiyona giren hidrojen peroksit, Haber-Weis reaksiyonu adı verilen tepkime ile hücre için oldukça toksik olan hidroksil radikalini oluşturmak üzere parçalanır (13).
H2O2 + O2.- → .OH + OH-+ O2
Reaksiyon katalizörsüz olarak oldukça yavaş ilerlemesine karşın, Fenton tepkimesinde (demirle katalizlendiğinde) ortalama 4000 kat hızlanmaktadır (12).
Fe2+ + H2O2 → Fe 3+ + OH- + .OH H2O2 + e-→ .OH + OH
Bu reaksiyonlar, vücut sıvılarının iyonize edici radyasyonla karşı karşıya kaldığı durumlarda sıkça görülmektedir (13).
Eşlenmemiş elektronu olmayan singlet oksijen reaktif yapısı nedeniyle dikkat çeken bir diğer oksijen türüdür. Singlet oksijen, serbest radikal reaksiyonları esnasında, oksijenin elektronlarından birinin, kendi spinine zıt spinli olarak bir başka orbitale yerleşmesi ile oluşur (12).
Radikal türlerinin reaktivitesi, bu yapıların reaktif karakterinin bilinmesinde ve in vivo radikal ölçüm çalışmalarında önemli bir etkendir. Radikalin yarılanma ömrü ne kadar kısa ise, reaktivitesi o oranda yüksektir, bu da radikalin sabit
konsantrasyonunu düşürür. Reaktif türlere ve atomlara göre farklılık gösteren yarılanma ömrü, radikallerin toksisitesi ile doğru orantılı olduğundan, radikalin potansiyel gücü açısından önemlidir (16). Bilinen başlıca radikal türler Tablo 2.1’de gösterilmiştir (21).
Tablo 2.1. Sık Karşılaşılan Radikaller, Simgeler ve Kimlikleri
Radikal Simge Tanımlama
Hidrojen H• Bilinen en basit radikal
Süperoksit O2•- Oksijen metabolizmasının ilk
ara ürünü
Hidroksil OH• En toksik (reaktif) oksijen
metaboliti
Hidrojen peroksit H2O2 Reaktivitesi çok düşük, moleküler hasar yeteneği zayıf
Singlet oksijen O2- Yarılanma ömrü hızlı, güçlü
oksidatif oksijen formu
Perhidroksi radikal HO2• Lipitlerde hızlı çözünerek lipit peroksidasyonunu
artırır
Peroksil radikal ROO- Perhidroksile oranla daha
zayıf etkili, lipitlere lokalize olur
Triklorometil CCl3 CCl4 metabolizması ürünü
karaciğerde üretilen bir radikal
Tiyonil radikali RS• Sülfürlü ve çiftlenmemiş elektron içeren türlerin genel adı
Alkoksil RO• Organik peroksitlerin yıkımı
ile üretilen oksijen metaboliti
Nitrojen oksit NO L- arjinin aminoasidinden
in- vivo üretilir
Nitrojen dioksit NO2 NO’ in oksijen ile
2.1.1.2. Serbest Radikal Oluşumu ve Radikallerin Kaynakları
Serbest radikaller, aerobik metabolizma sırasında boyaların kuruması, plastik maddelerin işlenmesi ve organik maddelerin çürümesi gibi endüstriyel işlemlerde, oksijenin kısmi redüksiyonu ve oksijen türlerinin reaksiyonları ile oluşabilmektedir (12,13,16). Şekil 2.1. reaktif oksijen türlerinin oluşumuna ilişkin radikal üretimini göstermektedir (12).
Serbest radikaller başlıca, moleküler oksijenin, normal metabolizma basamaklarında indirgenmesi ile açığa çıkmaktadır (16). Bu radikaller kopma ve yapışma reaksiyonları ile yeni radikallerin üretilmesine yol açarlar. Yeni yeni radikallerin açığa çıkarıldığı reaksiyon basamakları, serbest radikal zincir reaksiyonları olarak adlandırılır (12).
Şekil 2.1. Radikal Üretimi, Hedef Yapılar ve Riskler
Normal metabolizma dışında iyonize edici radyasyon, fotokimyasal hava kirleri, iskemi, hipoksi, intoksikasyon, inflamasyon, ısı, yoğun egzersiz, travma gibi durumlar radikal oluşumunu tetikleyen faktörler olarak bildirilmektedir (13).
Oksijeni, klinik uygulamalarda kullanılan birçok kemoterapötik, özellikle antineoplastik maddeler, anestetik maddeler, pestisitler, geçiş metallerine afinitesi bulunan antibiyotikler, çözücü gibi kimyasallar, süperoksit, hidrojen peroksit ve hidroksil radikali gibi türlere dönüştürerek radikal üretimine katkıda bulunurlar. Halojenli hidrokarbon metabolizmasının ürünü olarak oluşan radikal reaksiyonlarının da sürekli olarak süperoksit anyonu oluşumuna neden oldukları gösterilmiştir (12,16).
2.1.1.2.1.Oksidatif Fosforilasyon:
Oksidatif fosforilasyonla mitokondride ATP oluşurken, su moleküler oksijenin tetravalen reaksiyonu ile oluşmaktadır. Oksijenin yaklaşık % 1-5’lik kısmı sitokromla katalizlenen yoldan dışarı sızarak suya indirgenir ve nonkatalitik univalan indirgenmeye uğrar. Ara ürün olarak süperoksit radikali (O2-.), hidrojen peroksit ve hidroksil radikali (OH.) salınır. Bu reaktif oksijen metabolitlerinin, oluşturacağı doku yaralanmasını önlemek için endojen koruyucu mekanizmalarla detoksifiye edilmesi gerekir (22–24).
2.1.1.2.2. Solunum Patlaması:
Nötrofiller, makrofajlar, monositler ve eozinofiller çeşitli uyarılar ile sensitize olarak süperoksit radikali, hidrojen peroksit, hidroksil radikali ve hipoklorik asit (HOCI) salınımına neden olurlar. Nötrofillerin hücre membranındaki NADPH (Nikotinamid adenin dinükleotid fosfat) bağımlı oksidaz sistemi, süperoksit radikali oluşturan önemli bir kaynaktır. Oksidaz enzimi; bakteri, immun kompleksler, mitojen, kompleman, opsonize partiküller, araşidonik asit metabolizma ürünleri, formillenmiş peptitler, lektinler gibi etkenlerle aktive olur ve oksijeni, hidrojen peroksit ve süperoksit radikaline katalizler. Bu fenomene solunum patlaması denir (23–26).
Nötrofillerdeki primer granüllerde bol bulunan myeloperoksidaz (MPO) enzimi ile hidrojen peroksit ve klor iyonlarından hipoklorik asit oluşumu katalizlenir (25,26,27).
MPO H2O2 + Cl- + H+ HOCl + H2O
Hemoprotein olan myeloperoksidaz enzimi, polimorfonükleer lökositlerde (PMNL) bol miktarda bulunur. Enflamatuvar veya toksik uyarım sonucu PMN lökosit gibi fagositik hücrelerden salınır ve doku hasarını arttırır. Birçok araştırmada enflamasyon miktarının tespiti için MPO enzimi düzeyleri kullanılmıştır (26).
Hipokloroz asit ve bu asidin endojen aminlerle oluşan reaksiyon ürünleri kuvvetli oksidan maddeleridir ve nötrofil toksisitesinin çoğundan sorumludur. Bu reaksiyonlar hücre membranında oluşur. Toksik maddeler fagozom içinde salınıp tahrip etme özelliğine sahiptir. Süperoksit radikali, fagositik öldürmenin yanında nötrofil kemotaksisine de yardımcı olur (19,23,26).
2.1.1.2.3. Araşidonik Asit Yolu:
Oksijen radikali kaynağından biri olan araşidonik asit yolunda, ara peroksi bileşikleri ve hidroksi radikalleri meydana gelir. Bu lipit peroksidasyonunun ilk ürünleri olan hidro ve endo peroksitler ve daha sonra yeni zincirleme reaksiyonları başlatabilecek radikal ürünleri meydana getirebilir (22,23).
2.1.1.2.4. Pürinlerin İki Basamaklı Katalizlenmesi:
Hipoksantinden, ksantin yolu ile ürat oluşurken dehidrogenaz enziminin O -formu olan oksidaz kullanıldığında süperoksit radikali oluşur. Oksidaz, iskemi reperfüzyon ve muhtemelen diğer doku yaralanmalarında anahtar rol oynar (22,23,27).
2.1.1.2.5. Demir İle Katalizlenen Reaksiyonlar:
Fenton reaksiyonu veya Haber-Weis reaksiyonu ile çok toksik ve çok reaktif olan hidroksil radikali salınabilir. Haber-Weis reaksiyonunda süperoksit anyonu ile hidrojen peroksit, demirle katalizlenerek direkt reaksiyona girer. Ancak birçok fizyolojik durumda bu reaksiyon çok yavaş olur (22,23,27–29).
Fe
O2-. + H2O2 → O2 + OH- + OH.
Hidrojen peroksitin intrasellüler konsantrasyonu yeterli olduğu zaman Fenton reaksiyonu yoluyla hidroksil radikali meydana gelir.
Ferritine bağlı demir3 (Fe+3), süperoksit radikali varlığında demir2 (Fe+2) olarak salınır. Birçok doku yaralanması modelinde, süperoksit radikali veya hidrojen peroksitten çok hidroksil radikallerinin bu sekonder salınımı sorumlu tutulur (22,23).
2.1.1.3. Ekzojen Ajanlar:
Birçok ekzojen madde biyolojik sistemlerde serbest radikal üretimine yol açabilir. Bazı kimyasal toksinler metabolik olarak aktive edilirler ve bu yolla toksik etkide bulunurlar. Gama ışınları, X ışınları gibi iyonize radyasyona maruz kalan hücrelerde su moleküllerinin direkt homolitik füzyonu ile hidroksil radikali oluşur. Hidroksil radikali, hücre tarafından onarılamayacak şekilde çift zincir kırıklarına yol açabilir (22,23).
2.1.1.3.1. Çevredeki Radikal Türleri
Hava kirliliği, kimyasallara maruz kalma, sigara dumanı ve iyonize edici radyasyon gibi çevresel kimyasal etkilerle karşı karşıya kalma sonucunda hücrelerde radikallerin çoğaldığı bildirilmiştir (Şekil 2.2) (12).
Araşidonik asit metabolizmasının, NO2 ile karşı karşıya kalması durumunda NO2 konsantrasyonuna bağlı olarak değiştiği, düşük konsantrasyondaki NO2’nin araşidonik asit metabolizması artışına yol açtığı ve çift bağlara girerek otooksidasyonu başlatan stabil hidrojen atomlarını ayrıştırdığı gösterilmiştir (12).
Şekil 2.2. Çevresel Etkilerin Araşidonik Asit Salınımı İle Radikal Oluşturmaları Kimyasal maddelerin yanması ile açığa çıkan özel maddelerin, radikallerin olası kaynakları ve taşıyıcıları olduğu ileri sürülmüştür (30,38). Çevresel kimyasal ajanlara maruziyet, hücrelerdeki oksidatif indeksi değiştirerek, oksidatif strese yol açmakta, ayrıca hücrede proteinleri, DNA’yı ve membran lipitlerini etkileyerek hücrenin fonksiyonlarının ve bütünlüğünün bozulmasına neden olmaktadır (31,37).
Çevresel endokrin maddeler içerisinde yer alan bir alkilfenoletoksilat ürünü olan nonilfenol yaygın olarak kullanılmakta ve endokrin sistemi bozucu, östrojenik, karsinojenik ve toksik etkileriyle dikkat çekmektedir. Nonilfenolün sitotoksik etkilerini reaktif oksijen bileşiklerini arttırarak oluşturduğu sanılmaktadır (38).
Akciğerlere alınan başlıca yanmış organik materyal olan sigara dumanının, gaz fazının in vitro PUFA otooksidasyonunu başlattığı gösterilmiştir. Sigara dumanındaki NO2’ nin ilk formu olan azotdioksit, hemoglobinin hem demiri ile oldukça hızlı reaksiyon verir. Bu arada eritrositlerde artan methemoglobin konsantrasyonu, bu kan hücrelerini oksidasyona predispoze hale getirir. Azotdioksit aynı zamanda, süperoksitle reaksiyona girerek peroksinitriti oluşturur (12).
Halojenli hidrokarbonlar, birçok değişik kaynaktan çevreye girerler. Bu tip bileşiklerin en toksik olanı karbontetraklorür (CCl4)’ dür. Karbontetraklorür metabolizması, kloroform ve sitokrom P–450 gibi ilaç metabolize edici enzimlerle CO2 oluşumundan sorumludur (12,16 ).
Ozon, çevresel radikal kaynağı olarak kuvvetli bir oksidan olmasına karşın radikal değildir. Ozonun PUFA ile reaksiyonu ozonoidler denilen polioksijen içeren bileşiklerin bir karışımını verir. Bununla beraber düşük konsantrasyonlarda ozonun, metilinolat film ve emülsiyonlarının peroksidasyonunu başlattığı bildirilmiştir (12,13).
2.1.1.4. Serbest Radikallerin Hücresel Yapılara Etkileri 2.1.1.4.1 Serbest oksijen radikallerinin etkileri
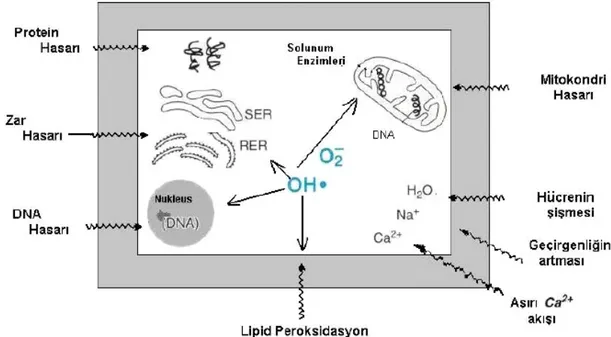
Reaktif oksijen türlerinin oluşumu enflamasyon, radyasyon, yaşlanma, normalden yüksek Parsiyel Oksijen Basıncı (pO2), Ozon (O3) ve NO2·, kimyasal maddeler ve ilaçlar gibi bazı uyarıların etkisiyle artar. Serbest radikaller hücrelerin lipid, protein, DNA, karbonhidrat ve enzim gibi tüm önemli bileşiklerine etki ederler. Süperoksit radikali ve OH· sitoplazma, mitokondri, nükleus ve endoplazmik retikulum membranlarında lipid peroksidasyonunu başlatır. Membranlarda lipid peroksidasyonu meydana gelmesi sonucu membran permeabilitesi artar. Serbest radikallerin etkisiyle proteinlerdeki sistein sülfhidril grupları ve diğer amino asit kalıntıları okside olarak yıkılır, nükleer ve mitokondriyal DNA okside olur(40).
Serbest oksijen radikallerinin tüm bu etkilerinin sonucunda hücre hasarı olur. Hücrede ROS ve serbest radikallerin artışı hücre hasarının önemli bir nedenidir. İskemi sonrasında reperfüzyon da ROS artışına bağlı olarak iskeminin oluşturduğu hücre hasarını artırır.
Şekil 2-4. Reaktif Oksijen Türleri
Serbest oksijen radikallerinin neden olduğu hücre hasarının birçok kronik hastalığın komplikasyonlarına katkıda bulunduğu düşünülmektedir. Aterogenez, amfizem/bronşit, Parkinson hastalığı, Duchenne tipi musküler distrofi, gebelik preeklampsisi, serviks kanseri, alkolik karaciğer hastalığı, hemodiyaliz hastaları, diabetes mellitus, akut renal yetmezlik, Down sendromu, yaşlanma, retrolental fibroplazi, serebrovasküler bozukluklar, iskemi/reperfüzyon injürisi gibi durumlarda serbest oksijen radikallerinin neden olduğu hücre hasarı söz konusudur(40).
2.1.1.4.2 Serbest radikallerin lipidlere etkileri
Lipidler serbest radikallerin etkilerine karşı en hassas olan biyomoleküllerdir. Hücre membranlarındaki kolesterol ve yağ asitlerinin doymamış bağları, serbest radikallerle kolayca reaksiyona girerek peroksidasyon ürünleri oluştururlar.
Poliansatüre yağ asitlerinin oksidatif yıkımı lipid peroksidasyonu olarak bilinir. Lipid peroksidasyonu kendi kendini devam ettiren zincir reaksiyonu şeklinde ilerler ve oldukça zararlıdır. Hücre membranlarında Lipid Serbest Radikalleri (L·) ve Lipid Peroksit Radikallerinin (LOO·) oluşması, ROS neden olduğu hücre hasarının önemli bir özelliği olarak kabul edilir. Serbest radikallerin sebep olduğu lipid peroksidasyonuna "nonenzimatik lipid peroksidasyonu" denir.
Hücre membranlarında lipid peroksidasyonuna uğrayan başlıca yağ asitleri poliansatüre yağ asitleridir. Lipid peroksidasyonu genellikle yağ asitlerindeki konjuge çift bağlardan bir elektron içeren hidrojen atomlarının çıkarılması ve bunun sonucunda yağ asidi zincirinin bir lipid radikali niteliği kazanmasıyla başlar.
Lipid Radikali dayanıksız bir bileşiktir ve bir dizi değişikliğe uğrar. Lipid Radikallerinin, O2’ ye etkileşmesi sonucu LOO· oluşur. Lipid Peroksit radikalleri (LOO·), membran yapısındaki diğer poliansatüre yağ asitlerini etkileyerek yeni lipid radikallerinin oluşumuna yol açarken kendileri de açığa çıkan hidrojen atomlarını alarak Lipid peroksitlerine (LOOH) dönüşürler ve böylece olay kendi kendini katalizleyerek devam eder.
Lipid peroksidasyonu sonucu oluşan LOOH yıkılımı geçiş metalleri iyon katalizini gerektirir. Plazma membranı ve subsellüler organel lipid peroksidasyonu serbest radikal kaynaklarının hepsiyle uyarılabilir ve geçiş metallerinin varlığında artar. Lokal olarak H2O2 Fenton reaksiyonu sonucu OH· oluşması zincir reaksiyonunu başlatabilir.
Membran fosfolipidlerinin peroksidasyonu, permeabilitede ve membran akışkanlığında değişikliklere yol açmaktadır. Permeabilite özelliklerinin değişmesi anormal Ca+2 girişine yol açarak hücre fonksiyonlarının bozulmasına ve oksidasyonla fosforilasyonun ayrılmasına yol açabilmektedir. Peroksi radikali, poliansatüre yağ asidi moleküllerini okside edebilmekte, radikallerin ve aldehitlerin ortaya çıkmasına neden olan hidroperoksitlerin meydana gelmesini sağlayabilmektedir. Aldehitler ise bu maddelerin yıkılması sırasında oluşmakta ve uzun ömürlü olduklarından hücre hasarının yayılmasına neden olabilmektedirler. Bu aldehitler arasında en iyi bilinenleri MDA ve 4 hidroksi alkenaldir. Üç veya daha fazla çift bağ içeren yağ asitlerinin peroksidasyonu MDA oluşumu ile
sonuçlanmaktadır MDA, yağ asidi oksidasyonunun spesifik ya da kantitatif bir indikatörü değildir, ancak lipid peroksidasyonunun derecesi ile korelasyon göstermektedir. Bu nedenle biyolojik materyalde MDA ölçülmesi lipid peroksit seviyelerinin indikatörü olarak kullanılır.
Nonenzimatik lipid peroksidasyonu çok zararlı bir zincir reaksiyonudur. Direkt olarak membran yapısına ve ürettiği reaktif aldehitlerle indirekt olarak diğer hücre bileşenlerine zarar verir. Böylece doku hasarına ve birçok hastalığa neden olur(40).
Şekil 2.5. Geçiş Metallerinin Katalizi ile Radikal Üretimi ve Lipit Peroksidasyonu 2.1.1.4.3 Serbest radikallerin proteinlere etkileri
Proteinler serbest radikallere karşı poliansatüre yağ asitlerinden daha az hassastırlar. Proteinlerin serbest radikal harabiyetinden etkilenme derecesi amino asit kompozisyonlarına bağlıdır. Doymamış bağ ve kükürt içeren triptofan, tirozin, fenilalanin, histidin, metiyonin, sistein gibi amino asitlere sahip proteinler serbest radikallerden kolaylıkla etkilenirler. Bu etki sonucunda özellikle sülfür radikalleri ve karbon merkezli organik radikaller oluşur.
Serbest radikallerin etkileri sonunda, yapılarında fazla sayıda disülfit bağı bulunan İmmünoglobülin G (IgG) ve albümin gibi proteinlerin tersiyer yapıları bozulur, normal fonksiyonlarını yerine getiremezler. Prolin ve lizin ROS üreten reaksiyonlara maruz kaldıklarında nonenzimatik hidroksilasyona uğrayabilirler.
Hemoglobin gibi hem proteinleri de serbest radikallerden önemli oranda zarar görürler. Özellikle oksihemoglobinin O2.- veya H2O2 reaksiyonu methemoglobin oluşumuna neden olur (16).
2.1.1.4.4 Serbest radikallerin nükleik asitler ve DNA’ya etkileri
İyonize edici radyasyonla oluşan serbest radikaller DNA’ yı etkileyerek hücrede mutasyona ve ölüme yol açarlar. Hidroksil radikali deoksiriboz ve bazlarla kolayca reaksiyona girer ve değişikliklere yol açar.
Aktive olmuş nötrofillerden kaynaklanan H2O2 membranlardan kolayca geçerek ve hücre çekirdeğine ulaşarak DNA hasarına, hücre disfonksiyonuna ve hatta hücre ölümüne yol açabilir. Süperokside maruz kalan DNA molekülleri hayvanlara enjekte edildiklerinde daha fazla antijenik özellik gösterirler ki bu oldukça önemli bir etkidir, çünkü otoimmün bir hastalık olan sistemik lupus eritematozusta ve romatoit artritte dolaşımda anti-DNA antikorlar bulunur (16).
2.1.1.4.5 Serbest radikallerin karbonhidratlara etkileri
Serbest radikallerin karbonhidratlara etkisiyle çeşitli ürünler meydana gelir ve bunlar, çeşitli patolojik süreçlerde önemli rol oynarlar.
Diyabet ve diyabet komplikasyonlarının gelişimi, koroner kalp hastalığı, hipertansiyon, psöriyazis, romatoit artrit, Behçet hastalığı, çeşitli deri ve göz hastalıkları, kanser gibi birçok hastalıkta ve yaşlılıkta serbest radikal üretiminin arttığı, antioksidan savunma mekanizmalarının yetersiz olduğu gösterilmiştir.
Ancak bu hallerde serbest radikal artışının sebep mi yoksa sonuç mu olduğu tam olarak bilinmemektedir (28).
2.1.2. Antioksidan savunma sistemi
Hücre ve dokular, radikal ürünleri ve reaksiyonlarını inhibe eden bir sisteme sahiptir. Radikallerle oldukça ivedi reaksiyonlara girerek otooksidasyon / peroksidasyonun ilerlemesini önleyen maddeler antioksidan olarak tanımlanır (39). Bir şekilde oluşturulan herhangi bir ilk radikal ürünün reaktif karakterine bağlı olarak biyomoleküller ve hücresel yapılara saldırmasının önlenmesi antioksidan savunma
sisteminin işidir (33). Zincir kırma reaksiyonlarının her basamağında kesinlikle az da olsa hidroperoksit oluşması, ortamdaki ürünler ve zararın sıfırlanamaması nedeniyle oksidasyon reaksiyonları ve radikaller tamamen yok edilemez (12,41).
Antioksidan maddeler, organizmanın oksidan-antioksidan dengesini korumada rol oynayan beş mekanizmanın en az biri üzerinden etkilidirler. Bu mekanizmalar lipit, protein ve DNA moleküllerinde oluşan hasarın onarılması, oluşan serbest radikallerin etki alanlarından toplanarak temizlenmesi, hücresel kinaz kayıplarının önlenmesi, serbest radikal üreten kimyasal reaksiyonların durdurulması ya da reaksiyon hızının baskılanması, organizmada SOD gibi endojen antioksidan enzimler ile enzimatik olmayan antioksidanların sentezinin arttırılması şeklinde sıralanabilir (41,42-46). Bazı otörler, antioksidan savunmayı, komponentlerin enzimsel olup olmamasına bakarak, katalaz, SOD ve GPx’ ın rol aldığı antioksidan aktiviteleri “enzimatik antioksidan savunma”; glutatyon, ürik asit, glikoz, tokoferol, askorbat gibi maddelerle gerçekleştirilen deoksidasyon işlemlerini “nonenzimatik savunma” olarak tanımlar (33).
Hücresel homeostatik dengenin korunması, organizmanın canlı ve sağlıklı kalabilmesi için gereklidir. Normal fizyolojik şartlarda iç ve dış kaynaklı stresörler hücresel dengeyi sürekli değiştirmektedir. Bu stresörlere karşı korunma, antioksidan savunma olarak adlandırılan kompanentlerle gerçekleştirilmektedir. Bu işlemler, yok edici enzimler ve membran nötralizanı gibi birçok faktörün harekete geçirilmesi ve spesifik savunma kompanentlerinin fonksiyonel integrasyonunu içermekte ve kompanentler hücresel iç karışıklıkları yok edip ya da azaltıp eksternal ve internal stresörlerin etkilerini yok ederek hücrenin uygun formda kalması için çalışmaktadırlar (33,41).
Reaktif oksijen ortamlar ve oksijen metabolizması ürünleri olarak üretilen reaktif türler, sellüler homeostasis için başlıca tehdit olarak sayılabilir. Bu reaktif ürünler hücre için olmazsa olmaz temel fizyolojik ve metabolik işlemlerde üretilmektedir (34). Serbest radikal üretimindeki artış, hücresel kompanentler ve fonksiyonlara toksik etkili görülmektedir. Antioksidan sistemi oluşturan maddelerin görevi bu toksik etkilere karşı organizmayı ve reaktif moleküllerin oksidatif yıpratmasına karşı hücresel homeostasisi korumaktır (13,16). Koruma işlemi; toksik etkili oksidan metabolit üretiminin engellenmesi, sekonder oksidan üreten zincir
reaksiyonlarının durdurulması, ortamdaki radikallerin temizlenmesi, endojen antioksidan kapasitenin artırılması ve inflamatuvar mediatörlerin blokajı gibi yollarla oluşturulmaktadır (34-36).
2.1.2.1. Antioksidanların sınıflandırması
Antioksidanlar çeşitli kriterlere göre sınıflandırılabilir (37). 1. Yapılarına göre:
a. Enzimsel
b. Enzim olmayan proteinler 2. Kaynaklarına göre:
a. Organizmaya ait olanlar (Endojen) (SOD, Katalaz, α tokoferol) b. Dışardan alınanlar (Ekzojen) (Adenozin, Allopurinol, Glutatyon) 3. Çözünürlüklerine göre:
a. Suda çözünenler (Glutatyon, Vit C, Ürik asit, Glikoz, Sistein) b. Lipitlerde çözünenler (Vit E, β-karoten, Bilirubin, Flavonidler) 4. Yerleşimlerine göre:
a. İntrasellüler olanlar (SOD, Katalaz, Glutatyon peroksidaz) b. Ekstrasellüler olanlar (Askorbik asit, Transferin, Albumin)
2.1.2.1.1. Endojen antioksidanlar
Günlük yaşamın rutin ilerleyişi sırasında karşılaşılan oksidatif stres faktörlerinin giderilmesi ve fizyolojik işleyişin devamında endojen olarak bilinen antioksidanlar önemlidir. Hücresel enzimler ve nonenzimatik yapılardan oluşan endojen antioksidanlar ve özellikleri Tablo 2.2' de listelenmiştir (16,30,47).
Tablo 2.2. Bilinen Endojen Antioksidanlar ve Etkinlikleri
Antioksidanlar Yapısı Yerleşimi İşlevi
Stkrm oksdz Tetramerik protein Plazma Süperoksit nötralizanı SOD Cu, Zn, Mn SOD Mitokondri, serum Süperoksiti H202'e
çevirir
Katalaz Hemoprotein Peroksizomlar Peroksit nötralizanı GSH-Px Selenoprotein Sitosol, mitokondri L P ürünlerini indirger GSH-redüktaz Dimerik protein Sitosol, mitokondri Disülfitleri indirger α-tokoferol Yağda çözünen vit. Membranlar,eks.sel.ortam Peroksidasyonu azaltır B-karoten Vit A prekürsörü Hücre membranları Peroksil temizleyicisi Glutatyon, Tripeptid İntraselüler ortam,
alveoller
GSH redoks substratı Askorbik asit Suda çözünen vit. Hücre içi ve dışı sıvıları Vit E’yi rejenere eder Ürik asit Okside pürin bazı Geniş bir dağılım gösterir Hidroksil toplar, vit C
korur
Sistein Amino asit Geniş bir dağılım gösterir Organik bileşikleri indirger
Albumin Protein Plazma, serum Serbest radikalleri giderir
Bilirubin Hemoprotein ürünü Dolaşım kanı, dokular Zincir kırıcı antioksidan Seruloplazmin Protein Dolaşım kanı, dokular Süperoksiti H202'e
çevirir
Transferrin Glikoprotein Plazma Demir iyonlarını bağlar
Laktoferrin Protein Plazma Demir iyonlarını bağlar
Ferritin Glikoprotein Dolaşım kanı, dokular Doku demiri bağlaycısı
2.1.2.1.2. Süperoksit Dismutaz (SOD)
Süperoksit dismutaz O2.- serbest radikalinin, H2O2 ve O2’e dönüşümünü katalizleyen antioksidan enzimdir.
İnsanda süperoksit dismutazın üç izomer tipi bulunmaktadır. Cu-Zn SOD sitozolde bulunur, Cu ve Zn içerir, dimerik yapıdadır, siyanidle inhibe edilir. Mn SOD mitokondride bulunur, Mn içerir, tetramerik yapıdadır, siyanidle inhibe olmaz. Genel olarak hücrede en bol bulunan izomer sitozolik Cu-Zn SOD’dır. Demir içeren FeSOD ve manganez içeren MnSOD esas olarak prokaryot hücrelerin özelliğidir.
SOD’ ın fizyolojik fonksiyonu oksijeni metabolize eden hücreleri süperoksit serbest radikalinin (O2.-) lipid peroksidasyonu gibi zararlı etkilerine karşı korumaktır. SOD, fagosite edilmiş bakterilerin intrasellüler öldürülmesinde de rol oynar.
SOD aktivitesi, yüksek oksijen kullanımı olan dokularda fazladır ve doku pO2 artısıyla artar. SOD’ ın ekstrasellüler aktivitesi çok düşüktür.
Cu-Zn SOD’ ın spesifik aktivitesi Down sendromlu hastaların eritrositlerinde yüksek, prematürelerin ve yaşlıların eritrositlerinde ve psöriyazisli hastaların lökositlerinde düşük bulunmuştur (17).
2.1.2.1.3. Glutatyon Peroksidaz (GPx)
Glutatyon peroksidaz sitozolde bulunur, 4 selenyum atomu içerir, tetramerik yapıdadır. Glutatyon peroksidaz, hidroperoksitlerin indirgenmesinden sorumlu enzimdir. Fosfolipid hidroperoksit glutatyon peroksidaz adı verilen bir enzim monomerik yapıdadır ve esas olarak membran fosfolipid hidroperoksitlerini alkollere indirger. Fosfolipid hidroperoksit glutatyon peroksidaz membrana bağlı en önemli antioksidan olan vitamin E yetersiz olduğunda membranı peroksidasyona karşı korur.
GPx’ ın fagositik hücrelerde de önemli fonksiyonları vardır. Diğer antioksidanlarla birlikte GPx, solunum patlaması sırasında serbest radikal peroksidasyonu sonucu fagositik hücrelerin zarar görmesini önler.
GPx eritrositlerde oksidatif strese karşı en etkili antioksidandır. Eritrosit GPx aktivitesi yaşlılarda ve Down sendromlu hastalarda yüksek, prematürelerde düşük bulunmuştur. Lökosit GPx aktivitesi yaşlılarda ve hipertansiyonlu hastalarda yüksek bulunmuştur.
Öte yandan akut fiziksel aktiviteler ve gebelik gibi fizyolojik durumlar ile pek çok patolojide lokal ve genel antioksidan kapasite aşılabilmekte ve antioksidan savunma sistemi yetersiz kalmaktadır. Bu gelişmeler karşısında antioksidan kapasitenin güçlendirilmesi amacıyla, birçoğu Tablo 2.3' te gösterilen ekzojen antioksidan maddelerin alımı gündeme gelmiştir (16,35).
2.1.2.1.4. Katalaz (CAT)
Katalaz, dört hem grubu içeren bir hemoproteindir. Peroksidaz etkinliğine sahip olmasına ek olarak bir molekül H2O2’i elektron verici substrat ve bir diğer H2O2 molekülünü oksidan veya elektron alıcı olarak kullanabilir.
Katalaz kan, kemikiliği, müköz zarlar, böbrek ve karaciğerde bulunur. Görevi oksidazların etkisiyle oluşan H2O2’i yıkmaktır. Mikro yapılar veya peroksizomlar karaciğer dahil birçok dokuda bulunur. Bunlar oksidazlar ve katalazdan yana zengindir, bu durum H2O2 üreten enzimler ile bunu yıkan ezimler ile bunu yıkan enzimlerin bir grup oluşturması biyolojik bir yarar sağlar. Peroksizomal enzimlere ek olarak mitekondriyal ve mikrozomal elektron taşıyıcı sistemler ve ksantin oksidazı H2O2 kaynağı olarak kabul edilir (99).
Tablo 2.3. Başlıca Ekzojen (Farmakolojik) Antioksidanlar ve Özellikleri
Antioksidan
sınıfı Spesifik tipi İşlevi
Ksantin oksidaz inhibitörleri
Allopurinol Ksantiz oksidaz reaksiyonunda süperoksit üretimini inhibe eder
Oksipurinol Ksantiz oksidaz reaksiyonunda süperoksit üretimini inhibe eder
Pterin aldehit Ksantiz oksidaz reaksiyonunda süperoksit üretimini inhibe eder
Tungsten Ksantiz oksidaz reaksiyonunda süperoksit üretimini inhibe eder
Proteaz inhibitörleri
Soya tripsin inhibitörü Ksantin dehidrogenazdan oksidaz oluşumunu bloke eder Serin proteaı inhibitörleri Ksantin dehidrogenazdan oksidaz oluşumunu bloke eder Fenilmetilsülfonil (PMSF) Ksantin dehidrogenazdan oksidaz oluşumunu bloke eder NADPH
oksidaz inhibitörleri
Adenozin Makrofajlarda NADPH oksidaz ile süperoksit oluşumunu önler
Lokal anestezikler Makrofajlarda NADPH oksidaz ile süperoksit oluşumunu önler
Kalsiyum kanal blokerleri Makrofajlarda NADPH oksidaz ile süperoksit oluşumunu önler
Nonsteroid antünflamatuvarlar
Makrofajlarda NADPH oksidaz ile süperoksit oluşumunu önler
Cetiedil Makrofajlarda NADPH oksidaz ile süperoksit oluşumunu önler
Superoksit dismutaz
Doğal SOD Süperokstten hidrojenperoksit dismutasyonunu katalizler IgA bağımlı SOD Süperokstten hidrojenperoksit dismutasyonunu katalizler Polietilen glikol SOD Süperokstten hidrojenperoksit dismutasyonunu katalizler Ginkgo Biloba (Egb 761) SOD ile benzer fonksiyon
Katalazlar
Doğal katalaz H2O2’nin oksijen ve suya indirgenmesi ve nötralizasyonu
PEG-katalaz H2O2’nin oksijen ve suya indirgenmesi ve nötralizasyonu
Lipzom kapsüllü katalaz H2O2’ni O2 ve H2O’ya çevirir
Nonenzimatik toplayıcılar
Mannitol Hidroksil radikal giderici Albumin Geniş çaplı oksidan toplayıcı Dimetil sulfoksid Fe, süperoksit, hidroksil toplayıcı 17-aminosteroit lazaroidler H2O2 ve hidroksil giderici
Glutatyon Süperoksit giderici
Ürik asit Süperoksit ve hidroksil giderici Spin tuzakları Tüm radikalleri toplar
Bilirubin Peroksidasyon zincirini bozar Demir
redoks zinciri inhibitdrleri
Deferoksamin Serbest Fe3+ atomlarını bağlayarak radikal reaksiyonlarını
önler
Apotransferrin Serbest Fe3+ atomlarını bağlayarak radikal reaksiyonlarını
önler
Seruloplazmin Serbest Fe3+ atomlarını bağlayarak radikal reaksiyonlarını
önler Endojen
savunmayı artıran ajanlar
Antinötrofıl serumu Hücresel glutatyon peroksitaı enzim aktivitesini artırır Monoklnal antibodiler Nötrofillerin endotele adezyonu inhibe eder
Antioksidan maddeler, hücre içi ve dışında antioksidan savunmada rol alan SOD, GPx, Katalaz, ürik asit, Vitamin A, C, E, K, Q, bilirubin, mukus gibi endojen elemanlar ve ksantin oksidaz inhibitörleri, proteaz inhibitörleri, spin tutucular gibi birçok farmakolojik ajandan oluşmaktadır. Antioksidanlara daha spesifik rollerin yüklendiği çalışmalarda, antioksidan savunma; sellüler, membransel ve ekstrasellüler olarak sınıflandırıldığı görülmektedir (31).
2.1.2.2. Sellüler Antioksidan Enzimler
Reaktif oksijen metabolitleri, SOD, GPx, katalaz ve sitokrom oksidaz gibi sellüler antioksidan enzimlerce indirgenir. Hücresel antioksidan enzimler ve nitelikleri Tablo 2.4’te sunulmuştur. Dismutasyon işlemi süperoksidi, SOD katalizörlüğünde H2O2’e ve oksijene dönüştürür (39).
SOD
2O2.-+ 2H+ → H2O2 + O2
Hidrojen peroksit ise GPx ve katalaz katalizörlüğünde aynı reaksiyonlarla indirgenir (27).
GPx Katalaz
O2 + H2O2 → H2O + O2
Aerobik canlılardaki süperoksit ve hidrojen peroksit varlığı, radikallerin yüksek konsantrasyonlarının hücresel yaşam için risk olduğunu göstermesi açısından önemlidir. Diğer sellüler antioksidan enzim sitokrom oksidaz, mitokondriyal elektron transport zincirinde üretilen reaktif oksijen metabolitlerini mitokondri aktif merkezinde bloke ederek salınımını engeller (13). Bunu yaparken demir, bakır gibi oksidan metal iyonlarını oluşturduğu bir havuzcukta toplar. Örneğin, bir antioksidan olarak GPx, paraquat ve diquatın toksik etkisini gidermede etkilidir. Antioksidan enzimlerden GPx aktivitesi selenyum ile SOD aktivitesi ise bakır, çinko ve mangan elementleri ile ilişkilidir (33,39).
Tablo 2.4. Intrasellüler Antioksidanlar ve Reaksiyonları
Antioksidan Reaksiyonu
Süperoksit dismutaz Süperoksidin giderilmesi reaksiyonlarında katalizör
Katalaz H2O2’nin yüksek konsantrasyonlarının giderilmesini katalizler
Glutatyon peroksidaz H2O2’nin düşük konsantrasyonlarının giderilmesinde kullanılır
Sitokrom oksidaz Oksijen indirgenmesi basamaklarında reaktif tür oluşmasını önler
2.1.2.3. Membran Antioksidanları
Membranların hidrofobik lipit yüzünde, intrasellüler ortamdan farklı olarak lipitlerde çözünen ve hücresel enzimlerle yok edilemeyen radikaller üretilir. Başta α-tokoferol (vit E) olmak üzere, ubiquinol bileşikleri, β-karoten ve koenzim Q temel membran antioksidanlarıdır. Düşük dansiteli lipoproteinlerde mikro düzeylerde bulunan ve onların otooksidasyonunu önleyen ubiquinolün kaliteli bir antioksidan olduğu gösterilmiştir. β-karoten oldukça aktif bir radikal toplayıcıdır ve aktivitesi ortam oksijen konsantrasyonuna bağlıdır (41).
Yağda çözünen bir vitamin olan α-tokoferol membranlar dışındaki ortamlarda oldukça zayıf bir antioksidan iken, membran lipid tabakaları arasında oldukça etkilidir (48). α-tokoferol gibi fenolik antioksidanların membranlarda ki etkileri birkaç faktöre bağlıdır (49). Viskoz olmayan nonpolar solüsyonlarda PUFA peroksidasyonunu artıran OH., α-tokoferol ile PUFA’ dan 5×104 kat daha hızlı reaksiyon oluşturabilir ve PUFA oksidasyonunun inhibisyonunda etkilidir (48).
β-karoten, antioksidan aktivitesini oksidasyon ara ürünlerinden singlet oksijen üretiminin engellenmesi üzerinden serbest radikallerin oluşumunu önleyerek ve ortamdaki radikalleri toplayarak gösterir. β-karotenin bu antioksidan aktivitesi, bulunduğu ortamın oksijen konsantrasyonu ile doğru orantılıdır (33,50).
Sadece zarlarda aktif bir antioksidan olan vitamin E (41), lipid peroksidasyonunun erken aşamasında serbest radikal türlerini yok ederek ya da oluşumlarını engelleyerek zar fosfolipitlerindeki poliansature yağ asitlerini oksidanların zararlı etkilerinden koruyarak oksidatif strese karşı ilk savunma hattını oluşturur (12,43).
Vitamin E serbest radikalleri stabile ederek peroksidasyon zincirini kırar ve bu olgu singlet oksijenin çoğunlukla hidroksil radikaline ya da süperoksit radikaline indirgenmesi ile gerçekleştirilir (43). Vitamin E, radikallerin yok edilmesi, zincirin kırılması, baskılama, bozulan yapıların onarılması ve endojen savunma sistemlerinin güçlendirilmesi gibi mekanizmaların tamamını kullanarak antioksidan görevini yerine getirdiğinden antioksidan kapasitesi çok geniştir (12,13,33,42,44). Alveoler zarlar ve eritrosit zarlarında olduğu gibi vitamin E’nin antioksidan rolü, oldukça yüksek moleküler oksijen konsantrasyonlarında bile etkili olabilmektedir (12,13,43,46).
Vitamin E’nin hücre zarında gösterdiği antioksidan etkiyi, hücre içerisinde genelde glutatyon peroksidaz (GPx) üzerine alır. GPx metalloenziminin aktivasyonu için selenyum elementi gereklidir (13,51-53). Bilinen membran antioksidanları ve bazı özellikleri Tablo 2,5’te verilmiştir (55).
Tablo 2.5. Membran Antioksidanları ve Etkileri Antioksidan Etkileri
Vitamin E Membran lipitlerinde çözünerek peroksidasyon zincirini kırar
Koenzim Q Mitokondriyel enerji metabolizmasında bir antioksidan olarak rol alır
β karoten Radikal türleri toplar, ayrıca singlet oksijen oluşumunu inhibe eder
2.1.2.4. Ekstrasellüler Antioksidanlar
Antioksidan enzimler, vücut sıvıları ve organik ürünlerde bulunmaz. Bu nedenle glikozillenmiş serum proteinleri olarak tanımlanan SOD ve GPx’ in ekstraselüler ortam ve organik materyallerde antioksidan olarak önemi yoktur (54). Transferrin, albumin, laktoferrin, ürik asit, haptoglobinler, bilirubin, seruloplazmin, glikoz gibi proteinler temel ekstrasellüler antioksidanlardır (56).
Ekstrasellüler antioksidan savunmanın temel yolu, hücreler arası ortamda üretilen serbest radikal metabolitlerin, demir ve bakır gibi katalizör metal iyonları ile karşılaşmalarını engellemektir (33). Örneğin, demir taşıyıcı protein transferrin bire üç demir bağlayarak plazma serbest demir konsantrasyonunu düşürür. Böylelikle
bağlı demir ve bakır iyonları serbest radikal reaksiyonlarını katalizleyemez ve tepkime sayısı azaltılmış olur (57). Myoglobin, hemoglobin, hemopeksin, laktoferrin, ve albumin hemen hemen aynı işlevselliktedir. Laktoferrinin nötrofillerde radikal oluşumunu önleyen bir ajan olduğu gösterilmiştir (41). Seruloplazmin bakırı bağlarken, glikoz, ürat ve bilirubin ortamdaki radikalleri temizleme uğraşındadır (33). Bilirubinin antioksidan kapasitesi, β-karotene benzer şekilde oksijen konsantrasyonuna bağlı olarak değişmektedir (58). Ekstrasellüler ortamlar ve organik ürünlerin korunmasında, dimetil sülfoksit, mannitol gibi kimyasal antioksidanlardan da yararlanılmaktadır (59). Tablo 2.6 bazı ekstrasellüler antioksidanları göstermektedir (55).
Plazmadaki total antioksidan kapasiteyse, özellikle vitamin C olmak üzere ürik asit ve bazı büyük moleküllü proteinlerin aktivitelerinden oluşmaktadır (61). Su bazlı ortamlarda geniş antioksidan kapasitesi ile vitamin C, lipid ortamların güçlü antioksidanı olan vitamin E’ nin antioksidan etkisini andıran bir rol üstlenerek kan ve diğer vücut sıvılarının primer antioksidan savunmasını gerçekleştirir (62). Vitamin C’ nin singlet oksijen, süperoksit, hidroksil, hidroperoksit, lipid peroksit ve lipid alkoksil radikallerini ortamdan temizleyerek antioksidan etkisini gösterebileceği bildirilmektedir (62-64). Lipid moleküllerinin oksidasyonu ile oluşturduğu lipid peroksitlerinin, sulu ortamlarda çözülmesinin de vitamin C’nin antioksidan etkisiyle oluştuğu ileri sürülmektedir (61).
Bazı biyolojik sistemlerde, lipozomal metil linoat miçellerinin oksidasyonunu baskılayan antioksidan aktivitenin de, vitamin C’den oluştuğu söylenmektedir (65,67).
Ayrıca vitamin C, tokoferol radikali haline gelmiş ve antioksidan özelliğini yitirmiş vitamin E’nin tekrar aktif hale dönüştürülmesinde de rol oynar (68-70). Vitamin C, sayılan bu antioksidan görevlerinin yanı sıra Fe+3’ü, lipid peroksidasyonunu arttıran, Fe+2‘ye dönüştüren oksidan bir davranış da göstermektedir (61).
Tablo 2.6. Ekstrasellüler Antioksidanlar ve Özellikleri
Antioksidan Etkileri
Askorbik asit Hidroksil radikal giderici ve tokoferolü indirgeyici antioksidan vitamin Transferrin Serbest demir iyonlarını bağlayarak fenton reaksiyonunu inhibe eder Laktoferrin Düşük pH’lı ortamlardaki demir iyonlarını bağlar
Haptoglobinler Hemoglobin bağlayarak “hem”in salınmasını önler
Hemopeksin Ortamdaki serbest hem proteinlerini bağlayarak oksidasyonu inhibe eder Albumin HOCL radikalini toplar, hem proteini ve bakır metal iyonlarını bağlar Serüloplazmin Süperoksit radikalini nötralize eder, bakır iyonlarını bağlar
Bilirubin Önemli bir peroksit radikali toplayıcısıdır Mukus Hidroksil radikali toplayıcı olarak işlev yapar
Ürik Asit Genelde metal bağlayıcı olarak çalışırken değişik radikalleri de toplar Glikoz Hidroksil radikali giderici antioksidan moleküldür
2.1.3. Oksidan-Antioksidan Denge
Soluduğumuz havada bulunan oksijen, ilk kez 1770’li yıllarda Priestley, Lavoisier ve Scheele tarafından moleküler oksijen olarak tanımlanmıştır (71). Aerobik yaşamın temel esasını, canlının su ya da havadan alınan oksijen yardımıyla, karbon ve hidrojen içeren besin maddelerinin organizma içinde bol miktarda yakılmasıyla elde edilen, kimyasal ve termal enerji oluşturur (41,47). Yaşam için önemi bulunan bu kimyasal tepkimelerin bazı basamaklarında oksijen indirgenir ve reaktif oksijen türleri olarak tanımlanan ara ürünler oluşur. Reaktif karakterli bu tür metabolitlerin oluşumuna yol açan faktörlerin tamamına “prooksidan veya oksidan madde”, bu maddelerin organizmadaki “pool” leri ise “oksidasyon kapasitesi” olarak tanımlanmaktadır (47,72). Reaktif karakterli ürünler aslında mitokondrial oksidasyon, sitokrom P-450 aktivitesi, prostaglandin sentezi ve akışı ile inflamatuar süreç, oksijenin hemoglobinlerce taşınımı, gibi aerobik yaşamın vazgeçilmez fizyolojik olaylarında, hücresel homeostazisin sağlanmasının doğal bir sonucudur (13,41,47).
Vücut sıvılarında ve hücre membranlarında bulunan ve “antioksidan” olarak isimlendirilen bazı faktörler, reaktif madde miktarındaki artıştan olumsuz etkilenen hücresel homeostazisi önleyebilir. Antioksidanlar reaktif maddeleri ve reaksiyonlarını bir dengede tutabilmek üzere sürekli aktivite gösterirler (33). Sonuç olarak organizma doğuştan kazandığı bir donanım sayesinde, fizyolojik aktivitenin doğal sonucu olan serbest radikal nitelikli biyokimyasal ürünleri, “oksidan antioksidan denge” olarak tanımlanabilecek bir çizgide tutmayı başarır. Tehlikeli
olan durum, radikallerin varlığından daha çok oksidanlar ve antioksidanlar arasındaki bu dengenin herhangi biri lehine bozulmasıdır (47,50).
2.1.3.1. Oksidan-Antioksidan Dengenin Bozulması
Çevresel kimyasal maddelere maruz kalma, hücrelerde radikal oluşumu ve reaksiyonlarını arttırarak oksidatif strese yol açmaktadır (12,31). Hava kirliliği, kimyasallara maruz kalma, organik yanık madde alımı (yanmış gıdalar, sigara dumanı gibi) ve iyonize edici radyasyon başlıca ekzojen radikal kaynaklarıdır (12,31,73,74).
Örneğin, herbisitler, paraquat ve diquatın uygulandığı hayvanlarda, malondialdehit (MDA), etan, pentan gibi peroksidasyon ürünlerinin artması, bu maddelerin redoks devrine girerek süperoksit oluşturduğu ve lipit peroksidasyonunda rol aldığını göstermektedir (75). Oksidanların arttığı veya antioksidanların yetersiz kaldığı durumlarda organizmanın maruz kaldığı “oksidatif stres”, sonuçta bozulan hücresel metabolizma, moleküler yıkımlanma ve doku hasarını getirir (23).
Prooksidanlar ve antioksidanlar arasındaki dengenin bozulmasından endojen faktör olarak mitokondrial oksijen hareketleri sorumludur (13). Organizmaya ani ve aşırı miktarda oksijen girişi; nonilfenol gibi kimyasal çevre kirleticilerinin yoğun olduğu ortamlardan uzun süre etkilenim; yoğun stres, sigara ve alkol kullanımı, laktik asit, laktat dehidrogenaz, diyette doymamış ve kolay peroksitlenebilen yağların fazla miktarda bulunması; kreatin fosfokinaz gibi litik enzim aktivitelerinin yükselmesi; epinefrin ve diğer katekolaminlerin artışı; egzersiz, gebelik, yaşlılık gibi fizyolojik haller; antioksidan savunma sistemi yetmezlikleri veya savunma duvarının aşılması gibi durumlarda hassas olan oksidan-antioksidan denge, oksidanlar lehinde bozulabilir. Bu olgu serbest radikallerin oluşumunun artışından ya da antioksidan aktivitesinin yetersizliğinden ileri gelebilir (47,76).
Yaşadığımız atmosferdeki elektromanyetik alanlar, ozon ve kısmi oksijen basıncı, UV, X ve güneş ışınları gibi faktörlerle de oksidan-antioksidan dengenin radikaller lehine bozulabileceği gösterilmiştir (42,50,77,78). Birçok hastalık ve patolojik olgular da oksidan antioksidan dengeyi olumsuz etkilemektedir (13,72). Ancak tüm araştırıcıların birleştikleri konu herhangi bir nedenle oksidan-antioksidan
dengenin bozulmasıyla oluşan radikallerin öncelikle zar lipitleri olmak üzere proteinler ve DNA gibi tüm biyomoleküller için bir risk faktörü oluşturduğudur (12).
Oksidan-antioksidan dengenin radikaller lehine bozulması bir dizi zincirleme reaksiyonlarla mümkündür. Söz konusu zincirleme reaksiyonları başlatmak, serbest radikallerin radikal olmayan maddelerle yeni radikaller oluşturmak üzere girdikleri reaksiyon tipleri Tablo 2.7’de gösterilmiştir (12,13).
Tablo 2.7. Serbest Radikallerin Radikal Olmayanlarla Başka Radikaller Oluşturmak Üzere Girebilecekleri Reaksiyonlar ve Bazı Örnekler
Reaksiyon Tipi Genel Gösterim Örnek
Eklenme x + y → [ x-y ] DNA guaninine OH-eklenmesiyle
8-hidroksiguanin radikali oluşması İndirgeme
(radikalin elektron vermesi) x + y → y
- + x + Paraquat radikalinin O2’ni süperoksit radikaline indirgemesi
Yükseltgeme
(radikalin elektron alması) x + y → x
-+ y + O2.- + H+ → askorbat + H2O2 askorbik
asitin gösterimindeki gibi yükseltgenmesi
Yükseltgenme
(radikalin H atomu alması) x + y-H → x-H + y Lipit peroksil radikali ile α-tokferolün reaksiyonu αTH + LOO → LOOH + αT
İntersellüler antioksidan enzimlerin artışı, bilirubin, transferrin, glikoz, ürik asit ve albümin gibi ekstrasellüler antioksidan düzeylerinin yükselmesi, hipervitaminozis gibi olgularda oksidan-antioksidan denge antioksidanlar lehine bozulmakta ve gerçekte bir “antioksidatif stres” tablosu oluşmaktadır (12,61).
Vücut çok hassas bir oksidan-antioksidan dengeye sahiptir. Bir antioksidanın düzensiz dozlarda alınımı bu dengeyi bozarak olumsuz etkiler oluşturabilir. Antioksidatif stres kavramı aşırı ve düzensiz antioksidan kullanımında ortaya çıkmaktadır. Tehlikeli olan, bu radikallerin aşırı artışıdır. Bu zararın giderilmesi amacıyla kullanılan antioksidan maddeler sanıldığı kadar saf değildir (79).
Herbert (1993), vitamin C ve β karotenin fizyolojik seviyelerde antioksidan olarak davrandığını fakat farmakolojik seviyelerde de prooksidan etkilerinin arttığını vurgulamıştır (80).
Antioksidan kullanımında önemli olan, bir antioksidanın prooksidan olabileceğini de bilmektir. (57,58)