T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
KALİKS[4]PİROL GRUBU TAŞIYAN vic-DİOKSİM LİGANDININ ve GEÇİŞ METAL
KOMPLEKSLERİNİN SENTEZİ;SPEKTROKİMYASAL ÖZELLİKLERİNİN İNCELENMESİ
SONER BEREKET YÜKSEK LİSANS Kimya Anabilim Dalı
Nisan-2012 KONYA Her Hakkı Saklıdır
iii ÖZET YÜKSEK LĠSANS
KALĠKS[4]PĠROL GRUBU TAġIYAN
vic-DĠOKSĠM LĠGANDININ ve GEÇĠġ METAL KOMPLEKSLERĠNĠN SENTEZĠ; SPEKTROKĠMYASAL ÖZELLĠKLERĠNĠN ĠNCELENMESĠ
Soner BEREKET
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
DanıĢman: Prof. Dr. Emine ÖZCAN Yıl,2012 Sayfa 74
Jüri
Prof. Dr. Emine ÖZCAN Doç. Dr. Ahmet KOÇAK Doç. Dr. Ahmet COġKUN
Bu çalıĢmada, 4-aminofenilkaliks[4]pirol, benziloksikarbonil-p-aminoasetofenon ve benziloksikarbonilkaliks[4]pirol ve metal kompleksleri sentezlenmiĢtir. Sentezlenen bileĢiklerin yapıları IR, 1H-NMR spektroskopisi kullanılarak aydınlatılmıĢtır.
Anahtar Kelimeler: Anyonik sensörler, Kaliks[4]pirol, Kondenzasyon Reaksiyonu, Makrosiklik BileĢikler
iv ABSTRACT
MS THESIS
INVOLVING CALIX[4]PYYROLE OF vic-DIOXIME LIGAND AND METAL COMPLEXES SYNTHESIS;SPECTROSCOPIC STUDIED
Soner BEREKET
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN CHEMISTRY
Advisor: Prof. Dr. Emine ÖZCAN Year,2012 Pages 74
Jury
Prof. Dr. Emine ÖZCAN Doç. Dr. Ahmet KOÇAK Doç. Dr. Ahmet COġKUN
In this study, 4-aminophenylcalix[4]pyrrole, benzyloxycarbonyl-p-aminoacetofenon and benzyloxycarbonilcalix[4]pyrrole and metal complexes were synthesized. Structure of these compounds were identified by using IR, 1H-NMR spectra.
Keywords: Anionic sensors, Calix[4]pyrrole, Condensation Reaction, Macrocyclic Compounds
v ÖNSÖZ
Yüksek lisans çalıĢmalarımda benden desteğini hiç esirgemeyen değerli danıĢman hocam Prof. Dr. Emine ÖZCAN‟a;
Deneysel çalıĢmalarda bana yol gösteren ve manevi desteklerini esirgemeyen sevgili hocalarım Ar.Gör. Bilge TANER ve Ar. Gör. Pervin Deveci‟ye;
Tezimi hazırlarken bana sürekli destekte bulunan ve manevi olarak hep yanımda olan sevgili arkadaĢlarım Asuman UÇAR ve Mükerrem FINDIK‟a
Hayatım boyunca hep yanımda olan, maddi ve manevi olarak desteğini hiç esirgemeyen aileme;
Sonsuz teĢekkürlerimi sunarım.
Soner BEREKET KONYA-2012
vi ĠÇĠNDEKĠLER ÖZET ... İİİ ABSTRACT ... İV ÖNSÖZ ... V SİMGELER VE KISALTMALAR ... Vİİİ 1.GĠRĠġ ... 1 1.1. OKSĠMLER VE ÖZELLĠKLERĠ ... 1
1.1.1. OKSĠMLERĠN ELDE EDĠLĠġ METOTLARI ... 10
1.1.1.1. Aldehit ve ketonların hidroksilaminle reaksiyonundan ... 10
1.1.1.2. Ketiminlerin hidroksilamin ile reaksiyonundan ... 10
1.1.1.3. Primer aminlerin yükseltgenmesinden ... 10
1.1.1.4. Nitrosolama yolu ile ... 10
1.1.1.5. Kloralhidrat ile hidroksilamin reaksiyonundan ... 11
1.1.1.6. Nitriloksit ve disiyandioksit katılmasıyla... 11
1.1.1.7. Alifatik Nitro BileĢiklerinin Ġndirgenmesinden ... 12
1.1.2 OKSĠMLERĠN REAKSĠYONLARI ... 13
1.1.2.1. Asitlerin Etkisi ... 13
1.1.2.2 Isı ve IĢık Etkisi ... 14
1.1.2.3 Oksimlerin Ġndirgenmesi ... 14
1.1.2.4 Oksimlerin Yükseltgenmesi ... 15
1.1.2.5 Beckman çevrimi ... 15
1.1.2.6 Oksimlerin Klorlanması ... 16
1.1.2.7. Oksimlerin Diazonyum Kenetleme Reaksiyonu ... 20
1.1.3 OKSĠMLERĠN SPEKTROSKOPĠK ÖZELLĠKLERĠ ... 20
1.1.3.1 UV-VIS Özellikleri ... 20
1.1.3.2 Infrared (IR) Özellikleri ... 21
1.1.3.3 1H NMR Özellikleri ... 22
1.1.4. OKSĠMLERĠN KOMPLEKSLERĠ ... 22
1.1.5 OKSĠMLERĠN KULLANIM ALANI ... 27
1.2. KALĠKS[4]PĠROLLER ... 28
vii
1.2.2 KALĠKS[4]PĠROLLERĠN SENTEZĠ ... 33
1.2.3 KALĠKS[4]PĠROLLERĠN MODĠFĠKASYONU ... 38
1.2.4 KALĠKS[4]PĠROL VE TÜREVĠ BĠLEġĠKLERĠN UYGULAMA ALANLARI ... 42
1.2.4.1 KALĠKS[4]PĠROL KAPLI OPTĠK SENSÖRLER ... 42
1.2.4.2 KALĠKS[4]PĠROL KAPLI ELEKTROKĠMYASAL SENSÖRLER ... 44
1.2.4.3 KALĠKS[4]PĠROL KAPLI HPLC DESTEKLERĠ ... 44
2.1. ÇalıĢmanın Amacı ... 46
2.2. Literatür Özetleri ... 46
3. MATERYAL VE METOD ... 50
3.1. Kullanılan Kimyasal Maddeler ... 50
3.2. Kullanılan Aletler ... 50
3.3. Yöntem ... 50
3.3.1. 4-aminofenilkaliks[4]pirol Sentez Yöntemi ... 50
4.DENEYSEL KISIM ... 53 4.1.Benziloksikarbonil-p-aminoasetofenon Sentezi... 53 4.2. Benziloksikarbonilkaliks[4]pirol Sentezi ... 53 4.3. 4-aminofenilkaliks[4]pirol Sentezi ... 54 4.4. Klor-amphi-Glioksim Sentezi ... 54 4.5. Anti-klorglioksim Sentezi ... 55
4.6. Ni(II) Kompleksinin Sentezi ... 55
4.7. Cu(II) Kompleksinin Sentezi ... 55
4.8. Co(II) Kompleksinin Sentezi ... 56
5. ARAġTIRMA BULGULARI VE TARTIġMA ... 57
5.1. Spektral Analiz Yorumları ... 57
5.2.1H-NMR spektrumu ile ilgili yorumlar ... 57
6. KAYNAKLAR ... 59
viii
SĠMGELER VE KISALTMALAR
Kısaltmalar g Gram mL Mililitre
NMR Nükleer Manyetik Rezonans IR Infrared Spektroskopi
1 1.GĠRĠġ
Koordinasyon bileĢikleri merkezde bir atom veya iyon içeren (genellikle metal) ve değiĢik molekül gruplarının bu metali çevrelediği bileĢiklerdir. Bu kompleks bileĢikler çözeltide bile yapılarını muhafaza ederler ve yalnızca kısmi bir parçalanma meydana gelir. Kompleks, merkez atomuna ve koordine olan grupların taĢıdıkları yüklere bağlı olarak nötral veya iyonik (katyon veya anyon) Ģeklinde olabilir. Merkez atom genellikle pozitif yüklü geçiĢ metalleridir. Ligantlar ise anyonik veya molekülerdir ve üzerinde bir veya daha çok sayıda ortaklanmamıĢ elektron çifti bulundururlar. Ligantlar içerdikleri donör atom sayılarına göre tek diĢli veya çok diĢli olarak adlandırılırlar. Merkez atomuna bağlı donör atomlarının toplam sayısıda koordinasyon sayısı olarak isimlendirilir.
Ġlk olarak Baeyer (1886) tarafından oktametilkaliks[4]pirol‟ün sentezlenmesiyle baĢlayan kaliks[4]pirol çalıĢmaları 1950‟li yıllara kadar yavaĢ ilerleme göstermiĢ fakat 50‟li yıllardan sonra IR, NMR gibi tekniklerin geliĢmesiyle yapıları aydınlatılmıĢ ve çalıĢmalar ivme kazanmıĢ ve son yıllarda bu konu üzerinde yoğun çalıĢmalar yapılmıĢtır.
1.1. Oksimler ve Özellikleri
(R1R2C=NOH) oksi-imin adının kısaltması ile ortaya çıkan oksimler, zayıf
bazik karakterde azometin (>C=N-) grubu ile zayıf asidik karakterli (-OH ) grubunu ihtiva eden amfoter maddelerdir.
Oksimler, türetildikleri aldehit ve ketonların sonlarına oksim kelimesi eklenerek isimlendirilebildiği gibi(asetaldoksim, asetonoksim, benzofenonoksim v.b.), ana grup keton veya aldehit olmak Ģartıyla "hidroksimino" eki ile de isimlendirilmektedir. Örneğin [CH3-C(N-OH)-COOH] bileĢiği, 2-hidroksimino propiyonik asit olarak isimlendirilir. Ayrıca oksimler nitrozo bileĢiklerinin yapı izomerleri oldukları için ”izonitrozo” terimi de kullanılır (Smith 1966). O-substitüe oksimler için en iyi adlandırma; O-metil aseton oksim örneğinde olduğu gibi O-alkil (veya açil) oksim Ģeklindedir. Basit mono oksimlerin ve dioksimlerin genel formülü aĢağıda verilmiĢtir.
NOH NOH
R CH N OH R C C R (monooksim) (Dioksim)
2
Normal sübstitüe oksimler, nitronlar gibi ileri sınıf olarak bilinirler. Chemical Abstractlar da hipotetik bileĢiklerin türevi olarak adlandırılır ki, bunlara “nitro” denir, bunlar nitro adları altında sıralanır(CH2=NH-O-). Karbondaki sübstitüentler
(-), azottaki sübstitüentler (N-), “,-difenil-N-metil nitron”[(C6H5)2C=N(CH3)-O-]
gibi gösterilir.
Oksimlerde (C=N) bağının varlığında karbon atomuna R veya R‟(R ve R‟, alkil, aril, v.b) gibi farklı iki grup bağlıysa geometrik izomeri mümkündür. Hantzsch ve Werner doktora çalıĢmaları sırasında C=N grubuna sübstitüentlerin ataklarındaki farklılıkların temelinde, oksimlerin izomerlerinin bulunduğunu açıklamıĢlardır.
Basit oksimlerin geometrik izomeri syn- ve anti- örnekleri ile gösterilir. Bu durumda aldoksimlerde syn- formunda H atomu ve OH grubu aynı tarafta bulunurlar. Bu iki grup, ters taraflarda bulunduğunda konfigürasyon anti- formundadır (ġekil 1.1).
Şekil 1.1. Benzaldoksimin geometrik izomerleri C N H OH anti-benzaldoksim syn-benzaldoksim H N C HO
Asimetrik ketonlardan meydana gelen oksimlerde ise referans alınan gruba göre isimlendirme değiĢebilir(Smith 1966)
C N OH CI C N CI OH
syn-fenil p-klorofenil ketoksim anti- fenil p-klorofenil ketoksim veya veya
anti-p-klorofenil fenil ketoksim syn- p-klorofenil fenil ketoksim ġekil 1.2. Ketoksimlerde geometrik izomeri
3
Basit monooksimlerin syn- ve anti- izomerlerinin birbirine dönüĢüm enerjileri aynı çözücüde 0,5-5 kcal/mol arasında değiĢmektedir, bu fark oksimin molekül yapısına ve kullanılan çözücünün dielektrik sabitine bağlı olarak değiĢiklik gösterir(Smith 1966).
Basit monooksimlerde syn- ve anti- izomerlerinin oluĢmasında aldehit veya keton bileĢiğine bağlı olan R- gruplarınında etkisi vardır. Bir fenil ketonundan(C6H5
-CO-R) oksimlerin hazırlanmasında, R bir CH3 grubu ise ketoksim ürünü olarak
syn-metil izomeri fazla miktarda oluĢur. Fakat R bir –CH2CO2H grubu ise ürün olarak
anti-karboksilliasit izomeri fazla miktarda oluĢur.
vic-dioksimlerin izomerleri ise, komĢu C=N grubundaki iki OH'ın birbirine göre pozisyonlarına göre syn-, amphi- ve anti- Ģeklinde kullanılmaktadır (Patai 1970). (ġekil 1.3) C R C N N OH OH R' C R C N N R' OH OH C R C N N R' OH OH
syn- amphi- anti-
ġekil.1.3.vic-dioksimlerde geometrik izomeri
Genellikle vic-dioksim konfigürasyonlarında anti- formu amphi- formuna nazaran daha düĢük enerjili yani daha kararlıdır.Aynı zamanda anti- formlarının erime noktası amphi- ve syn- formlarına nazaran daha yüksektir. Ancak bunun istisnalarıda vardır ve bununla ilgili bir örnek Ģekil 1.4„de görülmektedir.
4 S C N N C C N N OH OH (a) (b)
ġekil.1.4.(a) 1,3-difenil-2-tiookso-4,5-anti-bis(hidroksimino)-imidazolin e.n:180◦C (b)1,3-difenil-2-tiookso-4,5-amphi-bis(hidroksimino)-imidazolin e.n:208◦C
vic-dioksim izomerlerinin birbirine dönüĢüm enerjileri de yapıya bağlı olarak değiĢir ve genellikle düĢüktür. Bu yüzden bunları birbirinden ayırmak güç olmakla beraber, günümüzde geliĢen ayırma teknikleriyle, bir çoğunu ayırmak mümkün olmaktadır. ÇeĢitli makrosiklik halka ihtiva eden çok sayıdaki vic-dioksim bileĢiklerinde, genellikle, en kararlı olan anti-formu izole edilebilmiĢtir. Diğer taraftan ditioferrosenopen grubu ihtiva eden vic-dioksimlerde, azot üzerinde hidrojen köprüsünün oluĢması nedeniyle, altılı bir halka, amphi- formunu daha kararlı kıldığından, büyük oranda bu form ele geçerken ġekil. 1.5., eser miktarda anti- formuna rastlanmıĢtır. Nitekim bu bileĢiğin 1
H-NMR spektrumunda, ferrosen halkalarının karakteristik bandlarının yanı sıra D2O ile kaybolan 13.28 ppm‟
deki(OH) protonu, amphi- izomeri için karakteristiktir.
Fe S S N H O H O N
ġekil.1.5. 1,4-Ditio-2,3-bis(hidroksiimino)[4](1,1)ferrosenopen‟in amphi- formu.
S C N N C C N N OH OH
5
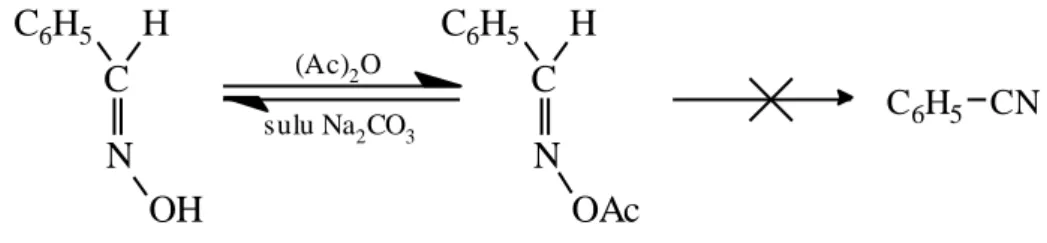
Oksimlerin, syn- veya anti- formunda bulunmaları, fiziksel ve kimyasal özelliklerinde büyük değiĢiklikler meydana getirir. Örneğin syn- ve anti- benzaldoksimin erime noktaları farklı olduğu gibi, kimyasal reaksiyonlara karĢı olan davranıĢları da farklıdır. syn-Benzaldoksimin açillenmesiyle elde edilen açil türevi zayıf baz ile tekrar orijinal oksime dönüĢmesine rağmen ġekil 1.6, anti- izomerinin açil türevi nitril oluĢturur (ġekil 1.7).
OAc sulu Na2CO3 OH C C6H5 H N (Ac)2O N H C6H5 C C6H5 CN
ġekil 1.6. syn-Benzaldoksimin Açilleme Reaksiyonu
sulu Na2CO3 C C6H5 H N AcO (Ac)2O C6H5 CN N HO H C6H5 C
ġekil 1.7. anti-Benzaldoksimin Açilleme Reaksiyonu
Oksimlerin syn- veya anti- formuda bulunması, oluĢacak kompleks formlarınıda etkiler. Mesela; 2-pirolkalbaldehit oksimin bakırasetat ile reaksiyonunda anti- izomer formları 1:1, syn- izomer formları ise 1:2 oranında kompleks oluĢtururlar(Abele,2004).
6 N CHO H N H NHO N H HON HCI Cu(OAc)2 Cu(OAc)2 N N Cu/ NOH Cu N O 2
ġekil.1.8. 2-pirolkarbaldehit oksim sentezi
Oksimler çoğunlukla renksiz, orta derecede eriyen katı maddeler olup, suda çok az çözünürler. Küçük molekül ağırlıklı olanlar dikkate değer derecede uçucudurlar. O-metil gruplu oksimler daha düĢük erime ve kaynama noktasına sahiptirler. Nitronlar ise genellikle daha az uçucu, erime noktaları yüksek ve polar olmayan çözücülerde, oksijenli sübstitüe izomerlerden daha az çözünürler (yüksek dipolmomentli =N-O – bağından dolayı). Tablo 1.1.1 de bazı basit oksim ve türevlerinin erime ve kaynama noktaları verilmiĢtir(Smith,1966).
7 Tablo 1.1.1- Bazı Oksim BileĢiklerinin Özellikleri
Oksim E.N.( oC) K.N.( oC) CH2=N-OH - 84 CH3-CH=NOH 47(13) 115 CH3-CH=N-OCH3 - 47,5 (CH3)2C=N-OH 61 135 (C6H5)2C=N-OH 144 - (C6H5)2C=N-OCH3 61 - (C6H5)2C=N+(CH3 )-O -103 -
Oksimler, azometin (>C=N-) grubundan dolayı zayıf bazik, hidroksil grubundan dolayı da zayıf asidik özellik gösteren, amfoter maddelerdir. Bununla beraber mono ve dioksimler zayıf asidik özellik gösterirler, bu yüzden NaOH'de çözünürler ve CO2 ile çökerler.
Basit oksim adı verilen mono-oksimlerin pKa değerleri 10-12 arasındadır.
Dioksimler ise mono oksimlere göre dikkate değer derecede asidik olup, bunların pKa değerleri 7-10 arasında değiĢir. Bazı dioksimlerin sulu ortamadaki pKa değerleri
Tablo1.1.2 de görülmektedir(Smith1966).
Tablo1.1.2: Bazı Oksimlerin pKa Değerleri
BileĢik pKa
Dihidroksiglioksim 6.81
Difenilglioksim 8.50
Glioksim 8.88
Dimetilglioksim 10.14
Oksimlerin asidik özellikleri, OH grupları üzerindeki oynak protonlardan kaynaklanmaktadır. Buna karĢılık, azot atomu üzerindeki ortaklanmamıĢ elektron çifti nedeniyle oksim bileĢikleri, zayıf bazik özellik gösterir. Bu yüzden, amfoter özelliğe sahip olan bu maddeler, asit ve bazların seyreltik çözeltilerinde kolayca çözünmektedir.
8
Dikloro oksimler dıĢında diğer dioksim bileĢiklerinin organik çözücülerde üç ay gibi uzun bir süre bozunmadan kalabildikleri belirlenmiĢtir. Benzaldehit oksim ve birçok sübstitüe benzaldehit oksimin sulu çözeltilerinde, syn- ve anti-benzaldehit oksimlerin pKa değerlerinin sırası ile 10,68 ve 11,33 olduğu belirlenmiĢtir. Bazı
mono oksimlerin asitlikleri Tablo1.1.3 de verilmiĢtir(Bordwell 1992).
Tablo1.1.3: Bazı Mono Oksimlerin Sulu Ortamda pKa Değerleri
BileĢik pKa
Aseton oksim 12.42
3-Pentanon oksim 12.60
Asetaldehit oksim 12.30
Oksimler yapılarındaki C=N grupları zayıf bazik karakterlidir. Bu çözeltiler seyreltildiği zaman çökerler ve buradan da asite bağlı tuz kristalleri izole edilebilir. Nitronlar ise çok zayıf bazlardır. Hidroklorit tuzu Ģeklindeki oksimlere nazaran oldukça az hidroliz olurlar. Buradan nitronların oksimlere nazaran kuvvetli baz oldukları sonucu çıkarılabilir. O-alkil oksimler sulu çözeltide bazlık göstermezler.
C=N çift bağının uzunluğu 1,29-1,31 Ao (nonkonjüğe halde) bulunmuĢtur. Layton, Kross ve Fassel C=N bağının esneme frekansı ile çekirdekler arası uzaklıkla ilgili lineer bir bağıntı vermiĢlerdir. Azometin grubunun hipotetik bağ momenti olarak Smith 0,9 D değerini vermiĢtir. C=O bağ momenti ise 2,3D kadardır(Smith 1966).
Bazı oksim bileĢiklerinde, X-ıĢınları analiz yöntemi ile belirlenen bağ uzunlukları ve bağ açıları Tablo 1.1.4 de, vic-dioksim komplekslerinin bağ uzunlukları ise Tablo 1.1.5 de verilmiĢtir(Chakravorty 1974).
9
Tablo.1.1.4: Oksimlerde Bağ Uzunluğu ve Bağ Açıları
BileĢik
Bağ Uzunluğu(Ao) Bağ Açısı(o
) C=N N-O <C=N-O Formaldoksim 1.27 1.40 110 Formamidoksim 1.28 1.41 110 Asetonoksim 1.29 1.36 111 Glioksim 1.28 1.39 111 Dimetilglioksim 1.27 1.38 114 Sin-p- Klorobenzaldoksim 1.26 1.40 111
Tablo.1.1.5: vic-dioksim komplekslerinde bağ uzunluğu Bağ uzunluğu(Ao)
BileĢik M-N C=N N-O O-H...
O Ni(Hg)2 1.88 1.29 1.35 2.45 Pd(Hg)2 1.97 1.30 1.34 2.63 Pt(Hg)2 1.99 1.31 1.35 2.66 Ni(Hdmg)2 1.85 1.29 1.36 2.40 Pd(Hdmg)2 1.96 1.31 1.35 2.59 Pt(Hdmg)2 1.94 1.32 1.28 3.03 H2g, glioksim ; H2dmg, dimetilglioksim
Kompleks oluĢumu ile N-O bağ uzunluğunda yaklaĢık 0.4 Ao
kadar bir kısalma yanında, C=N da fazla bir değiĢme olmamıĢtır. CNO açısı serbest ligant durumuna göre yaklaĢık 10o
açılmıĢtır. Komplekslerde O-H...O köprüleri yaklaĢık 175o „lik açıda olĢması O……O bağ uzunluğunun 2.4 Ao ve üzerinde gerçekleĢmesini sağlamıĢtır. DeğiĢik metallerin bu bağ uzunluğuna etkileri, atom yarıçaplarındaki (Ni<Pd<Pt) artıĢla paralellik göstermiĢtir(Chakravorty 1974).
Corttrel, bir molekülün bağ enerjisi molekülün atomlarına bölünmesi için gerekli olan enerji olarak tanımlamıĢtır. Bu araĢtırıcı molekülün parçalanmasıyla ortaya çıkan atomların ideal gaz yasalarına uyduğunu varsayarak 298.16 K standart sıcaklık kabul edip, birçok bileĢiğin oluĢum ısılarını hesaplamıĢtır. Bazı bağ enerjileri Tablo 1.1.6 de Kcal/mol olarak verilmiĢtir (Smith 1966).
10 Tablo 1.1.6: Bazı oksim bileĢiklerinin özellikleri
Tek bağ (Kcal/mol) Çift bağ (Kcal/mol) Üçlü bağ (Kcal/mol) C-C C-O C-N N-N 82.70 85.50 72.80 39 145.80 179 147 101 200 212.40 225.80
1.1.1. Oksimlerin Elde EdiliĢ Metotları
1.1.1.1. Aldehit ve ketonların hidroksilaminle reaksiyonundan
Oksimler aldehit ve ketonların hidroksilamin ile reaksiyonundan elde edilmektedir. Reaksiyon sulu alkollü ortamda, kaynama sıcaklığında ve optimum Ph‟larda gerçekleĢtirilir(Bierlein ve Lingafelter 1951).
RCHO
+
NH2OH.HCl AcONa RCH NOH+
NaCl+
AcOHArCHO
+
NH2OH.HCLAcONa
ArCH NONa ArCH NOH
1.1.1.2. Ketiminlerin hidroksilamin ile reaksiyonundan
Ketiminler hidroksilaminle reaksiyona girerek, kolayca oksimleri verirler (Hauser 1955). Ketonlar ise bu reaksiyonu daha kolay verirler.
(C6H5)2C NH
+
NH2OH (C6H5)2C NOH+
NH31.1.1.3. Primer aminlerin yükseltgenmesinden
Primer aminlerin sodyum tungstat katalizörlüğünde hidrojen peroksit ile yükseltgenmesi ile oksimler elde edilir. (Smith 1966)
H3C CH NOH
Cl2\h
çözücü H3C C
Cl
NOH
1.1.1.4. Nitrosolama yolu ile
Özellikle -ketoksimlerin hazırlanmasında oldukça kullanıĢlı bir yoldur ve aktif metilen gruplu bileĢiklerden yararlanılır (Burakevich ve ark.1971, Uçan ve Mirzaoğlu 1990).
11
-Ketoksimlerin (izonitroso oksimler) karbonil grubunun önceki metodda olduğu gibi, hidroksilamin ile reaksiyonundan 1,2-vic-dioksimler elde edilir (Uçan ve Mirzaoğlu 1990). H C C Ar NH2OH.HCl OH N HO N Ar C O CH3 C4H9ONO CH O C Ar N OH
Ġzonitroso oksimler hidroksilamin ile olduğu gibi hidrazin, amin vb. bileĢikler ile de çeĢitli oksim türevlerini verirler (Chakravorty 1974, Deveci 1994).
C CH NOH + NH2 Z C CH NOH
O N Z
1.1.1.5. Kloralhidrat ile hidroksilamin reaksiyonundan
vic-dioksimlerin önemli bir üyesi olan kloroglioksim, kloralhidrat ile hidroksilaminin reaksiyonundan elde edilir ( Gök 1981).
+ 2NH2OH HCl
.
C NOH C NOH Cl H CCl3 CH (OH)2 NaOH1.1.1.6. Nitriloksit ve disiyandioksit katılmasıyla
Dioksimlerin elde edilmesi için çok kullanıĢlı fakat dikkat isteyen bir metottur. Mono ve dioksim klorürlerinin soğukta ve bazik ortamdaki reaksiyonundan basit nitril oksitler ve disiyandioksitler elde edilir. Bunlar çözelti ortamında kararlıdırlar ve oldukça aktif maddelerdir. Bunların çözeltilerine mono ve diaminlerin katılmasıyla mono ve diamidoksimler elde edilir(Gök 1981, Grundmann ve ark. 1965). R C N OH R C N ONa2CO3 o Cl 0 C + -Nitril oksit
12 o DisiyandioksitC N O + _ _ + Cl C NOH Cl -10 C, CH2Cl2 Na2CO3 C N O C NOH Alkilamidoksim ' + ' NH R R C N O R NH+ - 2 R C N OH
1.1.1.7. Alifatik Nitro BileĢiklerinin Ġndirgenmesinden
Alifatik nitro bileĢiklerinin H2/Pt katalizörü ile etanol ve HCI varlığında
indirgenmesinden oksimler elde edilir.
R2C CH NO2
H2/Pd EtOH.HCl
R2CH CH NOH
13 RCH2CR O NH2OH RCH2CR NOH HNO2 H+ R C C R NOH O CH2 R R RONO C NOH R R RCH=O NH2OH RCH=NOH CI2 RC=NOH CI RMgX RC=NOH R + RCH=CHR NOCI RCH CHR NOH CI + RCH2NH2 (O) RCH=NOH 1.1.2 Oksimlerin Reaksiyonları 1.1.2.1. Asitlerin Etkisi
Oksimler kuvvetli mineral asitlerle, tuzlarına dönüĢürler. Aynı zamanda izomerik dönüĢüm yaparlar. syn- ve amphi- izomerleri HCl ile anti- izomerlerine dönüĢür (Gök 1981).
14 H C6H5 C N HO OH H C C6H5 HCl N Cl C C C C H H N N N OH OH HO OH der. HCl Cl N syn-benzaldoksim anti-benzaldoksim amfi-kloroglioksim anti-kloroglioksim
1.1.2.2 Isı ve IĢık Etkisi
Oksimler oldukça kararlı maddeler olmalarına rağmen, uzun süre ıĢık ve hava oksijenine maruz kaldıklarında bazı bozunmalar olur. Bozunmalar sonucunda genellikle ana karbonil bileĢiği ile bazı azotlu maddeler meydana gelir. Örneğin benzofenon oksim ısı tesiriyle bozunduğunda azot, amonyak, benzofenon ve imine ayrıĢır (Smith 1966).
(C6H5)2C = NOH (C160-185 C 6H5)2C = O (C+ 6H5)2C = NH N+ 2 H+ 2O
o
anti-benzaldoksim ise benzamit ve benzoik asite ayrıĢır.
C ISI 5 6 5 6 5 6 ( . COOH C H + NH O C C H HO N H C H 2
Oksimin yapısında -hidrojenleri varlığında ise bozunma alkol ve nitrile ayrıĢma Ģeklinde olur.
C6H5 CH2 C C6H5 N OH C6H5 CN + C6H5 CH2 OH ısı 1.1.2.3 Oksimlerin Ġndirgenmesi
Oksimler, çeĢitli reaktiflerle imin basamağından geçerek, primer aminlere kadar indirgenebilirler. vic- Dioksimler de kolayca diaminlere indirgenebilirler (Chakravorty 1974).
15 Ar CH NOH Ar CH2 NH2 HCl. SnCl2 / HCl Na / C2H5OH Ar C NOH Ar CH NH2 Ar C NOH Ar CH NH2 1.1.2.4 Oksimlerin Yükseltgenmesi
Aldoksimlerde, C-H bağının oksitlenme kararsızlığından dolayı değiĢik ürünler oluĢur. Aldoksimler -78 °C de oksitlendiğinde nitril oksitleri, vic-dioksimler ise furoksanları verir (Chakravorty 1974).
Pb (Ac)4 R CH NOH R C N O+ -(O) + -O O R C NOH R C N R C NOH R C N 1.1.2.5 Beckman çevrimi
Oksimlerin, katalizlenmiĢ izomerizasyonu ile amide dönüĢümüdür. Özellikle keto oksimler, sülfürik asit, hidroklorik asit, polifosforik asit gibi kuvvetli asitlerle veya fosfor pentaklorür, fosfor pentaoksit varlığında bir çevrilmeye uğrarlar. Alkil veya aril grubu azot atomu üzerine göç ederek, N-sübstitüe amidler meydana gelir. Örneğin asetofenonoksim deriĢik sülfürik asit beraberinde Beckmann çevrilmesine uğrayarak aset anilidi verir (Tüzün 1999).
der. H2SO4 O
OH H3C
CH3 C NH C N
16 1.1.2.6 Oksimlerin Klorlanması
IĢın enerjisi kimyasal bağları daha çok radikaller oluĢturacak Ģekilde koparır. Moleküllerin serbest radikallere ayrıĢtırılmasında, moleküldeki ,kovalent bağın sağlamlığına göre görünen ıĢın, mor ötesi ıĢınları, x-ıĢınları, gama ıĢınları hatta nötron ve α ıĢınları etkindir. Örneğin klor moleküllerini (radikal) klor atomlarına ayıran ıĢın, güneĢ ıĢınlarında bulunan yakın mor ötesi ıĢınlarıdır.
Cl Cl
(yakin mor ötesi) (güneş ışığı )
Cl
+
ClBilindiği gibi radikaller kolay reaksiyon veren etkin gruplardır. Klor molekülerlide güneĢ ıĢığı ile yada yüksek sıcaklıklarda radikallere ayrıĢarak bazı uygun moleküller ile reaksiyona girip klorlu bileĢikleri oluĢtururlar.
H
R
+
Cl Cl R Cl+
HCluv
Oksim klorürleri genellikle oksimlerin uygun bir çözücü (eter, CHCI3, CCI4,
CH3COOH, dioksan, CH2CI2 gibi) içerisinde çözülüp soğukta (-20OC ile +10OC
arasında) güneĢ ıĢığında kuru CI2 gazı geçililmesiyle elde edilir. Örneğin
asetaldoksimin klorlanmasıyla asethidroksamoil klorür elde edilir(Weiland 1907).
H3C CH NOH
Cl2\h
çözücü H3C C
Cl
NOH
Elektrofilik reaktiflerin çoğu oksimlerin O veya N atomlarına etki ettikleri halde, halojenler oksim karbonuna etki ederek halonitrozo bileĢiklerini oluĢtururlar. Bu reaksiyonda ilk etkinin oksijen atomuna mı, yoksa azot atomuna mı olduğu bilinmemektedir. Aldoksimlerin normal klorlanmasından, klor nitrozo bileĢiği üzerinden yürüyen reaksiyon sonunda, hidroksamik asit klorürleri meydana gelir. Eğer, klorlama ileriye gidecek olursa, sararma ile kendini gösteren bir bozunma ürünü olan 1,1-diklor nitrozo bileĢikleri oluĢur (Rheinboldt ve Schmitz-Dumont 1925, KarataĢ ve Tüzün 1989, Uçan ve Mirzaoğlu 1990).
Cl2 eter 0 oC Cl2 H Cl Cl Cl Cl R CH NOH R C NO R C NOH R C NOhv
17
Bazı durumlarda da oksim klorürleri güneĢ ıĢığına ihtiyaç göstermeden sadece Nitrozil klorür (NOCI) kullanılarak elde edilir.
Ġzonitroso ketonların nitrozil klorür ile reaksiyonundan klor izonitroso ketonlar oluĢur.
R-CO-CH=NOH + 2 NOCl → R-CO-CCl=NOH + NO + HCl
Aldoksimlerin nitrozil klorür ile reaksiyonundan ise hidroksamik asit klorürleri elde edilir.
R-CH=NOH + 2 NOCl → R-CCl=NOH + 2 NO + HCl
Nitrozil klorür ile klorlama yapılırken reaksiyon esnasında çözelti , bazı oksimlerde yeĢil ve mavi renk alırken bazılarında ise renksiz olmaktadır. Bunlardan bazıları aĢağıda gösterilmektedir.
Renk verenler Renk vermeyenler Benzaldoksim o-nitrobenzaldoksim o-klorbenzaldoksim m-nitrobenzaldoksim p-tolilaldoksim p-nitrobenzaldoksim Tereftaldialdoksim o-nitropiperonaldoksim Β-naftilmetil eter aldoksim o-ftalaldehitasitoksim
Zimtaldoksim p-ftalaldehitasitoksim
Genellikle oksimler üzerinde elektrofilik reaktifler N yada O atomlarına etkirken, halojenler oksim karbonuna etki etmektedirler. Böylece halonitrozo bileĢikleri oluĢmaktadır. Nitroso bileĢiklerinin mavi renkli olması oksimlerin kalitatif tayinine imkan sağlamaktadır. Aldoksimlerin normal klorlamasından hidroksamik asit klorürleri oluĢur
Hidroksamoil klorürlerin, hidroksamik asitlere hidrolizi zor olmakla beraber, sodyum veya gümüĢ asetat yanında kolay olur.
18
R C NOH + CH3COONa R C NOH
Cl OH
R-hidroksamoil klorür R-hidroksamik asit
Hidroksamoil klorürler çeĢitli nükleofillerle reaksiyona girerek kendi yapılarında bulunan klorun yerine baĢka gruplar geçebilir. Örneğin, amonyak ile amidoksimleri, aminler ile N-sübstitue amidoksimleri, hidroksilamin ile de hidroksilamidoksimleri verirler. NOH NH2 Cl NOH R C + 2 NH3 R C + NH4Cl amidoksim N-Alkil amidoksim R C + 2 R' NH2 R C + R' NH2 HCl NOH Cl NH R' NOH
.
Cl.
N OH NH OH R C NOH + 2 NH2OH R C + NH2OH.HCl N- Hidroksilamidoksimα-kloraldoksimlerin dehidrohalojenasyonu ile nitriller hazırlanabilirler. Bu eliminasyon reaksiyonu genellikle alkali ve tersiyer aminler ile oluĢur
Ar C CI N+ OH ArC N O Baz C N OH Cl R R3N RC N+ O
Aldoksihidroksamoil klorürler, Grignard bileĢikleri ile olan reaksiyonlarıyla ketoksimleri oluĢtururlar.
R' Cl
19
Benzhidroksamil klorür türevlerinin yanmasıyla benzoilhidroksamik klorür türevleri ile izosiyonat yada nitrit türevleri oluĢmaktadır. Benzhidroksamil klorürün 180oC (8 mmHg)‟da yanmasıyla fenil izosiyonat (% 70) ve O-Benzoilbenzhidrosamil klorür (% 21) elde edilmiĢtir.
Aynı Ģekilde nitro yada kloro benzhidroksamik klorür‟ün yanması ile nitro yada kloro benzonitril ile O-benzoillbenzhidroksamik klorür türevleri elde edilmiĢtir
NOH C N NO2 NO2 O CI C O N C NO2 CIC NO2 + NOH C N CI CI O CI C O N C CI CIC CI +
Son yıllarda, vic-dioksim klorürleri ile mono ve diaminler arasındaki reaksiyonlardan bir çok dioksim ve tetra oksim türevi sentezlenmiĢtir(Grundmann ve Grunanger 1971, Chakravorty 1974, Ġrez ve Bekaroğlu 1983, Deveci ve ark. 1991, KarataĢ ve ark.1991). R' NH2 H2N R' NH2 HO N C HN R' NH C NOH HO N C C NOH H (R) (R) H C N OH C N OH (R) H R' NH (R) H C NOH C NOH Cl
20
Yine diklor glioksim ve tereftalohidroksamoil klorür gibi oksimler ile diaminlerin reaksiyonundan organik polimerler elde edilmiĢtir (KarataĢ ve Ġrez 1993, Grundmann ve ark. 1965). n N N HO OH HO OH C C + H2N R NH2 NH R NH C C Cl N N Cl
1.1.2.7. Oksimlerin Diazonyum Kenetleme Reaksiyonu
Diazonyum bileĢikleri bazik karakterde olup, oksimlere karĢı elektrofilik etkide bulunarak azota yönelirler. Bakır bileĢikleri varlığında aldoksim hidrojeni diazo bileĢiğinin aril grubu ile yerdeğiĢtirerek serbest radikal reaksiyonu Ģeklinde cereyan eder(Smith 1966).
Asetaldoksimin diazonyum tuzu ile reaksiyonundan asetofenon oksim oluĢur ve bu maddenin asidik ortamda hidrolizi ile aril metil keton bileĢiği meydana gelir.
C N H3C H OH ArN2Cl C N OH Ar CH 3 H3O C O Ar CH3
1.1.3 Oksimlerin Spektroskopik Özellikleri
Spektroskopik tekniklerin geliĢmesi ile oksimlerin yapısı hakkında daha fazla bilgi sahibi olunmuĢ, izomerlerinin birbirine dönüĢümleri geniĢ ölçüde incelenmiĢtir. X-ıĢını difraksiyon çalıĢmaları ile bir çok oksimin ve metal komplekslerinin yapıları kesin olarak belirlenmiĢtir. X-ıĢını çalıĢmaları yapılmayan oksimlerin yapılarını aydınlatmada UV-VIS, IR ve 1
H-NMR spekturumları da geniĢ ölçüde yardımcı olur. 1.1.3.1 UV-VIS Özellikleri
Alkol, su gibi çözücülerde 230 nm civarında glioksimler tek geniĢ bir band verirler. Bu band çözeltinin pH „sına bağlıdır. Eğer pH 7‟den büyükse 230 nm deki molar absortivite azalır ve 280 nm „de yeni maksimum pik ortaya çıkar. Bu yeni
21
band sulu tampon çözeltilerde glioksim anyonundan ileri gelebilir Ģeklinde yorumlanmaktadır (Ungnade ve ark. 1963).
Oksimlerin UV-VIS spekturumlarında, en önemli ve karakteristik absorpsiyon bandı C=N grubunun n→π* elektronik geçiĢine ait band olup, yaklaĢık
250-300 nm aralığında gözlenir. Bu bileĢiklerin geçiĢ metalleri ile oluĢturdukları komplekslerde n→π*
geçiĢine ait bandlar bir miktar uzun dalga boylarına kaymaktadır. Ancak, özellikle aromatik halka içeren bileĢiklerde bu geçiĢlere ait absorpsiyon bandları, aromatik halkaya ait B bandları ile giriĢim yapabilmektedir.
UV-VIS spekturumları ile kompleks geometrilerinin açıklanmasında yararlı ip uçları veren d-d geçiĢ absorpsiyon Ģiddetlerinin düĢük, organik çözücülerde çözünürlüklerinin de az olması, bu geçiĢlerinin gözlenmesini zorlaĢtırmaktadır. Ayrıca d-d geçiĢlerine ait bandlar, ligantlara ait bandlarla çakıĢabildiklerinden, böyle bir durumda bu bandların ayıredilmeleri oldukça güçleĢmektedir.
1.1.3.2 Infrared (IR) Özellikleri
Literatürde birçok oksim türevi için infrared spektrumları verilmiĢtir. –OH gerilme titreĢimleri 3300-3130 cm-1
civarında, C=N titreĢimleri 1660-1600 cm-1 civarında ve yine oksimler için karakteristik olan N-O titreĢimleri 1000-920 cm-1
civarında gözlenir. Glioksimlerin 1600 cm-1
civarında çıkan zayıf ve tek C=N titreĢimi anti-glioksimlerin s-trans formu olarak yorumlanır. Bazen mono-sübstitüe anti-glioksimlerde bu durum daha iyi gözlenir. amphi-kloroglioksimde bu bölgede orta Ģiddette çıkan çift pik s-cis konformasyonundan ileri gelir. Oksimlerin –OH pikleri çözücüye veya KBr tablette çekilmesine bağlı olarak değiĢik yerlerde çıkabilir. KBr tablette çekildiği zaman asimetrik bileĢiklerde çift pik, simetrik sübstitüe glioksimlerde tek pik olarak gözlenir. Oksimlerde bir çift bağa komĢu (N-O) titreĢimi 1000-920 cm-1 arasında Ģiddetli bir absorpsiyon göstermesi konfigürasyona bağlı olarak önemli bir değiĢiklik göstermez, ancak oksim grubuna bağlı sübstitüentlerin özelliğine göre değiĢir.
Aldonitronlar C=N gerilme absorbsiyonunu 1570-1590 cm-1‟de, keto nitronlar ise 1600-1620 cm-1‟de ve N-O esneme absorbsiyonunu ise 1170-1280 cm
-1‟de azoksi bileĢiklerine benzer Ģekilde verirler. Keto oksimler ve dioksimlerde
molekül içi hidrojen bağlarından (O-H….O) dolayı O-H….H gerilme absorpsiyonunu 1730-1710 cm-1 „de verirler. Keto oksimler ve dioksimlerdeki hidrojen bağları ġekil 1.9 ‟ da gösterilmiĢtir.
22 R C CH=N O O H R C CH=N O H N O H
Keto oksim Keto dioksim ġekil 1.9. Keto oksim ve dioksimlerde hidrojen bağları
1.1.3.3 1H NMR Özellikleri
1H NMR spektrumları oksimlerin hidroksil protonlarına ait kimyasal kaymalar,
oksim grubuna bağlı sübstitüentlere göre karakteristik olan değerler göstermiĢtir. Alifatik ve alisiklik keton ve aldehitlerin oksimleri için tespit edilen OH kimyasal kayma değerleri 11.0-10.0 ppm arasındadır.
Mono oksimlerde –OH protonlarına ait 1H NMR pikleri yaklaĢık 9-13 ppm arasında gözlenir. Dioksimlerde ise, -OH protonlarının çevrelerine bağlı olarak anti-, amphi- ve syn- geometrik izomer durumlarına göre 1H NMR piklerinde farklılık gözlenir. anti-dioksimlerde OH piki geniĢ bir singlet halinde ortaya çıkarken, amphi-dioksimlerde (O-H…N) oluĢumu nedeniyle protonlarından bir tanesi daha zayıf alana kaymakta, diğeri ise normal yerinde çıkmakta ve böylece iki singlet olarak görülmektedir. Ayrıca simetrik olarak sübstitüe olmamıĢ vic-dioksimlerde OH protonları iki ayrı singlet halinde görülmektedir. Bu protonlar D2O ilavesi
durumunda döteryumla yerdeğiĢtirirler ve 1
H NMR pikleri kaybolur. 1.1.4. Oksimlerin Kompleksleri
Oksimler, özellikle de vic-dioksimler geçiĢ metalleriyle çok kolay Ģelat bileĢikleri (kompleks) oluĢtururlar. Bu konudaki çalıĢmalar ilk defa 1905'te Tschugaeff tarafından nikel dimetilglioksim kompleksinin izole edilmesinden sonra baĢlamıĢ ve günümüze kadar artarak sürmüĢtür. Analitik kimyadaki iç komplekslerin kullanıĢını uygulayan Tschugaeff, nikel ile dimetilglioksimin reaksiyona girerek kırmızı renkte çözünmeyen bir bileĢik verdiğini keĢfeden kiĢidir. Yine Tschugaeff tarafından 1907 yılında dimetilglioksimin Co(III) ile vermiĢ olduğu kompleksin izole edilmesi, biyokimyasal mekanizmaların aydınlatılması için bir yaklaĢım modeli olması bakımından, önemli bir olay olmuĢtur. Bu komplekslerin formülleri, aynı araĢtırmacı tarafından CoX(D2H2)B olarak verilmiĢtir (ġekil 1.10). Burada X; bir asit anyonu (Cl, Br, CN v.b.), B; bir organik molekülü (piridin, imidazol, trifenilfosfin v.b.) D ise dimetilglioksimi ifade eder. Bu komplekslerde önceleri açık formül
23
verilmemesine rağmen oktahedral yapıda olduğu tahmin edilmiĢtir.
Komplekslerdeki Co-X bağının reaksiyona yatkın olduğu görülmüĢ ve son zamanlarda yapılan çalıĢmalarla Co atomunun B12(vitamin ve koenzim)
kompleksle-rindeki gibi, beĢ azot atomunun ligand alanında bulunduğu anlaĢılmıĢtır(Bekaroğlu 1974, Sarısaban 1975)(ġekil 1.10). Bu özelliğin anlaĢılmasından sonra biyokimyasal olayların anlaĢılması bakımından bis(dimetilglioksimato)kobalt(III) komplekslerinin önemi artmıĢtır. ġekil 1.10‟da da görüldüğü gibi iki dimetilglioksim molekülü bir kare düzlem oluĢturmakta ve her bir dioksim molekülünün oksim gruplarında bulunan hidrojenler bir hidrojen köprüsü yaparak sağlam bir yapı oluĢturmaktadır. Bu yapı komplekse öyle bir kararlılık verir ki, kompleks bozunmadan kobalt (+1) değerliğine kadar indirgenebilir. Bu özelliğin fark edilmesinden sonra, biyokimyasal reaksiyon mekanizmalarının aydınlatılması açısından, bis(dimetilglioksim)kobalt(III) kompleksi büyük önem kazanmıĢ ve üzerinde geniĢ ölçüde çalıĢmalar yapılmıĢtır(Bekaroğlu 1978). Co(II) kompleksinin suda çözülüp hava ile Co(III)'e yükseltgenmesiyle elde edilen ürün, HCl ile kristallendirildiğinde "Tris(oksamidoksim)Co(III) triklorür" ayrılır. Bu kompleksin yapısının oktahedral olduğu X-ıĢınları ile aydınlatılmıĢtır (Schrauzer ve Windgassen 1966) (ġekil 1.10).
CH3 O H O O H O C C H3C N N Co N N C C CH3 H3C Cl B
ġekil 1.10. Bis(dimetilglioksimato)kobalt(III) kompleksi
Diaminoglioksim ise, ya iki diaminoglioksim ihtiva eden kare düzlem bir kompleks veya üç diaminoglioksime karĢılık üç klor iyonu taĢıyan oktahedral bir kompleks meydana getirmektedir (Bekaroğlu ve ark. 1978). Bu iki Ģelat bileĢiği yalnız yapı bakımından değil, kararlılık bakımından da farklıdır. Bis(dimetilglioksimato)kobalt(III) kompleksindeki kobalt +1 değerliğine kadar indirgenebilmesine rağmen, diaminoglioksimle yapılan çalıĢmalarda indirgeme yapılamamaktadır. Ġndirgeme reaksiyonlarına tabi tutulduğunda kompleksin parçalandığı görülmektedir. Bu durum, dimetilglioksimdeki iki metil grubu yerine amino gruplarının geçmesiyle, oksim gruplarındaki elektron yükünün
24
delokalizasyonu sonucu oksim azotu ile metal arasındaki bağın gevĢemesinden ileri gelmektedir (Bekaroğlu ve ark. 1977).
vic-dioksimlerin Ni(II) ile verdikleri kompleksler, bu yüzyılın baĢından beri ilgi uyandırmıĢtır. Özellikle Ni(II)'nin dimetilglioksimle kantitatif tayini, bu ilginin esas sebebi olmuĢtur. Dimetilglioksimin Ni(II) ile verdiği kompleksin bağ uzunlukları, bağ açıları ve kristal yapısı Godycki ve Rundle(1953) tarafından çalıĢılmıĢ ve ġekil 1.12' deki yapı verilmiĢtir. Pfeiffer(1930) oksimlerin iç kompleks oluĢturduğunu iddia etmiĢlerdir. Dimetilglioksim nikel(II) komplekslerinin suda çözünmeyip, kloroformda bir miktar çözünmesine polar hidrojen köprülerinin sebep olduğu belirtilmiĢtir. Godycki ve Rundle (1953) köprü oluĢturan hidrojenin iki oksijen atomuna uzaklığının eĢit olduğunu öne sürmüĢler ve iki oksijen arasındaki uzaklığın X-ray difraksiyon analizi ile bulmuĢlardır. Ġç kompleks oluĢumu sırasında oksim gruplarından birisi asit, diğeri baz olarak davranır. Dimetilglioksimin M(DH2)Cl2 tipindeki komplekslerinin kararlılıkları karĢılaĢtırılırsa Co> Ni >Cu sırası
ortaya çıkar. Bu nedenle bakır kompleksleri elde edilememektedir. Buna karĢılık diaminoglioksimle Cu(OxH2)2Cl2 tipinde kararlı kompleksler elde etmek mümkündür
(ġekil.1.11). Bu yapının tetra amin bakır tuzuna benzemesi kararlılık sağlar.
C C _ _ _ _ _ _ _ _ _ _ _ _ H2N NH2 HON NOH HON H2N NH2 C C Cl2 NOH Cu
ġekil 1.11. Diaminoglioksimin Bakır(II) Kompleksi
vic- dioksimlerin izomerleri Nikel(II) ile farklı renk ve özellikte kompleksler vermektedirler. Genellikle, vic-dioksimlerin anti- formları Ni(II) ile kiremit kırmızısı (Burakevich ve ark. 1971, Gök 1981, ErtaĢ ve ark. 1987) (ġekil 1.11), amphi- formları yeĢilimsi-sarı kompleksler oluĢtururlar (Smith 1966, Burakevich ve ark. 1971) (ġekil 1.15). Ancak, bu iki kompleks formunun, birbirine dönüĢüm enerjilerinin düĢük olması sebebiyle, birbirine dönüĢebilirler. DüĢük enerjili olan anti- formuna dönüĢüm genellikle hakim ise de bunun istisnaları vardır (Serin ve Bekaroğlu 1983).
25 1 ,9 Ao 1 ,8 7 Ao 1 ,3 7 Ao 1 ,5 1 Ao 1 ,5 3 Ao 1 ,4 6 Ao 1 ,3 8 Ao 1 ,2 Ao 1 ,2 5 Ao 1 2 1 o 1 2 6 o 1 0 0 o 8 0 o 1 2 1 o 1 2 2 o 1 1 7 o 1 1 3 o 1 0 9 o 1 2 4 o 1 2 7 o 1 2 1 o 1 2 1 o 1 1 8 o 9 8 o 1 0 2 o N i O H O O H O H3C H3C C H3 C H3 N N N N C C C C
ġekil 1.12. Dimetilglioksim Ni(II) kompleksinin yapısı
R' R N N OH OH N O O N Ni R' R C C C C
ġekil 1.13. vic-Dioksimlerin amphi-formlarının Ni(II) kompleksi ġelatlar genellikle beĢli ve altılı halkalardan oluĢurlar. BeĢ halkalı Ģelatlar genellikle glikoller, okzalik asit ve bileĢikleri vasıtasıyla oluĢurlar. Genelde Ģelat halkasının ne zaman beĢli ne zaman altılı olabileceği tahmin edilebilir. Genel olarak halka doymuĢ ise, beĢ üyeli Ģelatlar, bir veya daha fazla çift bağ varsa altılı Ģelatlar daha kararlı olurlar. vic-dioksimler bu kuralın dıĢına çıkarlar. vic-dioksimlerin bazı komplekslerinde iki çift bağ bulunmasına rağmen, Ni(II), Cu(II) ve Co(II) gibi geçiĢ metalleri ile beĢ üyeli Ģelat halkası oluĢturarak çok sağlam yapılar meydana getirirler (ġekil 1.14) N C H3 N C H3 O H O N CH3 CH3 N O O H Co R B
ġekil.1.14 Dimetilglioksim Co(II) Kompleksi (R: Alkil,aril vb, B: Piridin, trifenilfosfin vb.)
26
Merkez atom nikel olduğu zaman yapı kare düzlem veya tetrahedral olur. Yapılan çalıĢmalarda magnetik susseptibilite ölçümlerine göre Nikel(II)‟nin mavi kompleksi paramagnetik, sp3 konfigürasyonunda ve tetrahedral yapıda olduğu, portakal rengi komplekslerin diamanyetik, kare düzlem geometride ve dsp2 konfigürasyonunda bulunduğu görülmüĢtür (Sarısaban 1975) (ġekil 1.15). Merkez atom bakır olduğu zaman ise yapı genellikle kare düzlem geometridedir.
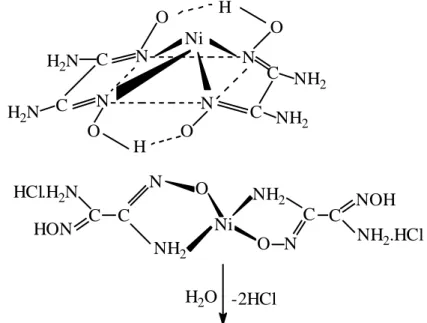
Ni N N N N O O O O H H C C C C NH2 NH2 H2N H2N H2O H2 -2HCl HCl.H2N N Ni N NOH O O HON C NH 2.HCl H2 N C N C C
ġekil 1.15. vic-Diaminoglioksimin Nikel(II) Kompleksinin Tetrahedral ve Karedüzlem Yapıları
vic-dioksimler ve kompleksleri üzerine yapılan çalıĢmalar oldukça fazla olmasına rağmen, literatürde tetraoksim bileĢiği olarak sentezi yapılmıĢ ligand sayısı çok azdır. ġekil 1.16'da görülen [X=O veya X=(CH2)n n = 0,1,2,3] çeĢitli tetra oksimler elde edilmiĢ ve Ni(II), Co(II), Cu(II) ile vermiĢ olduğu polimerik kompleksler incelenmiĢtir(Jones ve ark. 1961).
C C X C C R NOH R HON NOH HON
ġekil 1.16 Tetraoksimlerin genel yapısı
Literatürde basit yapılı tetraoksimler az olmakla beraber özellikle son yıllarda kloroglioksim, klorometilglioksim, klorofenilglioksim v.b. dioksim klorürlerinin diaminler ile olan reaksiyonundan tetraoksim türevleri ve bunların polimerik metal
27
kompleksleri elde edilmiĢtir (Grundmann ve Grunanger 1971, Ġrez ve Bekaroğlu 1983, Deveci ve ark. 1991, KarataĢ ve ark. 1991, Uçan ve KarataĢ 1991, KarataĢ ve ark. 1992, KarataĢ ve Uçan 1998).
n M2+ n HO N C H(R) (R) H C NOH HO N C NH R' NH C NOH n M O O O M H N C HN R' NH C N N C H(R) (R) H C N O H
1.1.5 Oksimlerin Kullanım Alanı
Oksimler; organik, anorganik, endüstriyel ve biyokimyanın birçok alanında değiĢik amaçlarla kullanılmaktadır. Bazı oksim ve onların çeĢitli alkil, oksialkil ve amino türevleri fizyolojik ve biyolojik aktif özelliklere sahip oldukları, ayrıca motor yağlarının, boyalarının, epoksit reçinelerinin, lastiklerin v.s. bazı oksimlerin iyileĢtirilmesi için katkı maddesi olarak kullanıldıkları bilinmektedir (Carlos ve David 1972). Yine sanayide kullanılan birçok polimer madde yüksek sıcaklığa, ıĢığa, darbeye, gerilmeye ve benzeri etkilere dayanıksızdır. Polimerik maddelerin bu eksik özelliklerini iyileĢtirmek için aktif katkı maddeleri olarak kullanılır. Yine doymamıĢ oksimlerin, polimerin ıĢığa karĢı özelliklerini iyileĢtirdiği ve epoksi reçinelerinin yapıĢma özelliğini artırdığı bilinmektedir (Carlos ve David 1972).
Oksim bileĢiklerinin ve türevlerinin tıpta kullanımı son yıllarda giderek artmıĢtır (Abele 2004). Bazı çalıĢmalarda oksimlerin, ağrı kesici etkilerini yanı sıra lokal anestezik etkilerininde bulunduğu görülmüĢtür (ġekil1.17.).
O NMe2
H HON
N
N
28
Oksim bileĢiklerinin aritmi (kalbin düzensiz çalıĢması) gibi bazı kalp hastalıklarında etkili oldukları tesbit edilmiĢtir(ġekil.1.18 ).
N N HON O R (CH2)n N F O ġekil.1.18. R=H, Alk; n=3-5
Bazı tip psikiyatrik hastalıklarda oksimlerden yararlanılmaktadır. Pirol oksimlerin trisiklik türevleri yüksek antidepresif etkiye sahiptir(ġekil.1.19).
R N
S
N O (CH2)n NR'R''
ġekil.1.19. R, R‟, R”= H, Alk; n=2,3
1.2. Kaliks[4]piroller
Kaliks[4]piroller dört pirol halkasının birbirine α pozisyonlarından sp3 hibritleĢmiĢ karbon atomlarıyla bağlandığı tetrasiklik yapılardır.
Ġlk olarak Baeyer (1886) tarafından oktametilkaliks[4]pirol‟ün sentezlenmesiyle baĢlayan kaliks[4]pirol çalıĢmaları 1950‟li yıllara kadar yavaĢ ilerleme göstermiĢ fakat 50‟li yıllardan sonra IR, NMR gibi tekniklerin geliĢmesiyle yapıları aydınlatılmıĢ ve çalıĢmalar ivme kazanmıĢ ve son yıllarda bu konu üzerinde yoğun çalıĢmalar yapılmıĢtır. Kaliks[4]piroller 1990‟lı yıllara kadar porfirinojenler olarak isimlendirilmekteydi. Kalikspiroller, porfirin benzeri bileĢik formlarına okside olmadıkları için porfirinojen isimlendirilmesinden vazgeçilip, kaliks[4]pirol olarak adlandırılırlar.
29
ġekil 1.20. Kaliks[4]pirol ile porfirinojen arasındaki fark
1.2.1 Kaliks[4]pirollerin Molekül Yapısı
Kaliks[4]piroller dört pirol halkasının birbirine α (2 ve 5 pozisyonları) veya diğer bir isimlendirme Ģekli ile mezo-benzeri pozisyonlardan sp3 hibritleĢmiĢ karbon
atomları ile bağlı olduğu makrosiklik bileĢiklerdir. Literatürde uzun süre porfirinojenler olarak isimlendirilmiĢler fakat kaliks[4]arenlere yapısal benzerlikleri dolayısıyla kaliks[4]pirol ismini almıĢlardır. Kaliks[4]pirol bileĢiklerinde dört pirol halkasıda nötraldir ve bileĢikte elektron delokalizasyonu yoktur. Kaliks[4]arenlere zıt olarak kaliks[4]pirollerde pirolik N-H grupları arasında hidrojen bağı zinciri yoktur. Kaliks[4]arenlerde olduğu gibi kaliks[4]pirol bileĢiklerinde de 1,3-alterna, 1,2-alterna, kısmi koni ve koni konformasyonları vardır. Herhangi bir substrat olmadıkça makrosiklik yapının kaliksarenlerde çok yaygın olan koni konformasyonu almaz.
30
ġekil 1.21 Kaliks[4]pirolün ve kaliks[4]arenin yapısı
ġekil 1.22 Kaliks[4]pirolün ve kaliks[4]arenin konformasyonları
Kaliks[4]pirol makrosiklik yapıları için yapılan kristalografik çalıĢmalar; kristal yapının katı halde 1,3-alterne konformasyonda olduğunu göstermektedir. Yani yanyana olan pirol halkaları zıt yönlenmiĢlerdir (ġekil 1.23).
31
Kaliks[4]pirollerin içerdiği dört N-H bağı dizisi bu moleküllerin anyonlarla ve nötral substratlarla hidrojen bağı yapmasına olanak vermektedir. Anyonlarla ve nötral substratlarla yapmıĢ olduğu hidrojen bağı yapının koni konformasyonu almasına sebep olur (ġekil 1.24).
ġekil 1.24. Koni konformasyonu
Sonuç olarak kaliks[4]piroller, bir solvent içerisinde çözündüklerinde veya bir çok durumda katı haldeyken eğer ortamdaki moleküller hidrojen bağı yapmıyorsa 1,3- alterne konformasyonu alırken, eğer ortamda uygun bir anyon veya hidrojen bağı yapabileceği nötral bir bileĢik varsa koni konformasyonunu almaktadır (ġekil 1.25).
1,3-alterne konformasyon Koni konformasyonu ġekil 1.25. Kaliks[4]pirolün konformasyon değiĢimi (chloride; klorit)
Kaliks[4]pirollerin konformasyonel yapısı kompleks yaptığı bileĢiğe göre değiĢebilmektedir. Buna en güzel örnek metanol ve DMF ile yaptığı komplekslerdir. Kaliks[4]pirol bileĢiği metanol ile kompleks yaptığında 1,3-alterne yapıyı tercih ederken DMF ile kompleks yaptığında ise 1,2-alterne yapıyı tercih etmektedir.
32
Tablo.1.2.1.1 Kaliks[4]pirolün metanol ve DMF ile konformasyonları
Metanol ile 1,3-alterne konformasyon DMF ile 1,2-alterne konformasyon
33 1.2.2 Kaliks[4]pirollerin Sentezi
Kaliks[4]pirol bileĢiklerinin sentezinde 3 sentez metodu vardır. Bu metotlar; a) [1+1+1+1] kondenzasyon metodu
b) [2+2] kondenzasyon metodu c) [3+1] kondenzasyon metodu
Bu yöntemlerden en sık kullanılanı [1+1+1+1] kondenzasyon metodudur. 1.2.2.1 [1+1+1+1] Kondenzasyon Metodu
Yaygın olarak kullanılan bu yöntemde; kaliks[4]pirol bileĢiği, ketonun asit katalizli ortamda pirol ile kondenzasyon reaksiyonu ile sentezlenmektedir. Kondenzasyon reaksiyonu sonucu su çıkıĢı olmaktadır. Yaygın olarak kullanılan asit katalizörleri hidroklorik asit, metansülfonik asit, trifloroasetik asit ve borontriflorürdietileter kompleksidir. Pirolün asidik ortamda çabuk polimerleĢmesinden dolayı asit katalitik miktarda çok az kullanılmaktadır. Ayrıca reaksiyonlar azot atmosferinde ve 0OC‟ye
yakın sıcaklıklarda gerçekleĢtirilir. Çözücü olarakta; metanol, etanol, asetonitril ve diklormetan yaygın olarak kullanılır.
Kaliks[4]pirollerin sentezinde ilk olarak ortamda bulunan asit katalizör karbonil grubunun β karbonuna atak ederek karboksilonyum katyonunu oluĢturur.
OluĢan elektrofil pirolün α karbonuna atak eder ve pirolyum katyonu oluĢur. OluĢan sübstitüe pirolyum katyonundan su eliminasyonu olur ve oluĢan yeni elektrofil baĢka bir pirole atak eder ve dipiran yapısı oluĢur.
34
Aynı Ģekilde ortamdaki diğer karboksilonyum katyonu dipiran yapısı üzerindeki pirolün boĢ olan α karbonuna bağlanır ve yeni bir elektrofilin oluĢması ardından suyun eliminasyonu ile yeni bir elektrofil oluĢur ve bu elektrofil diğer bir pirole atak eder. Reaksiyon kararlı tetrasiklik yapının oluĢumuna kadar devam eder ve son olarak kaliks[4]pirol yapısı oluĢmuĢ olur. Reaksiyonun tam mekanizması Ģekil 1.26‟da görülmektedir.
35
ġekil 1.26. Reaksiyon Mekanizması
OluĢan ürünün lineer bir yapıyı değilde, siklik bir yapıyı tercih etmesinin sebebi ise molekül içi kondenzasyonun tercih edilir olması ve oluĢan siklik yapının kararlı olmasıdır.
36
[1+1+1+1] kondenzasyon reaksiyonları homo kondenzasyon ve hetereo kondenzasyon olmak üzere iki gruba ayrılır.
Homo kondenzasyon reaksiyonları simetrik ve asimetrik olmak üzere iki gruba ayrılır. Simetrik homo kondenzasyon reaksiyonlarında; pirol ile simetrik bir ketonun 1:1 oranda reaksiyonu gerçekleĢir. Pirol ile asetonun 1:1 oranında metansülfonikasit katalizörlüğündeki reaksiyonu simetrik homo kondenzasyon reaksiyonuna örnek verilebilir.
Asimetrik homo kondenzasyon reaksiyonunda, pirol ile asimetrik bir ketonun reaksiyonu söz konusudur.
Hetereo kondenzasyon reaksiyonunda, pirol ile bir veya daha fazla ketonun asidik ortamdaki reaksiyonu söz konusudur. Hetereo kondenzasyon reaksiyonunun verimi düĢüktür, bu nedenle reaktant oranı dikkatli bir Ģekilde kontrol edilmelidir. Pirol, siklohekzanon ve metil-4-asetilbütüratın 2:1:1 metansülfonik asit katalizörlündeki reaksiyonu hetereo kondenzasyon reaksiyonuna bir örnektir. OluĢan ürün kolon kromotografisi ile ayrılmıĢtır ( %12, silikajel, diklormetan ).
37 1.2.2.2 [2+2] Kondenzasyon Metodu
[2+2] kondenzasyon reaksiyonunda, asit katalizörlüğünde iki dipirolmetan halkasının reaksiyonuyla gerçekleĢir. [2+2] kondenzasyon reaksiyonları, [1+1+1+1] kondenzasyon reaksiyonu ile kontrol edilmeyen kaliks[4]pirol bileĢiklerinin sentezi için idealdir.
1.2.2.3 [3+1] Kondenzasyon Metodu
[3+1] kondenzasyon reaksiyonu, tripirol veya tripirol türevi bileĢik ile pirol veya pirol türevi bileĢiğin asidik ortamdaki reaksiyonu ile gerçekleĢir. Pek tripiran bileĢiğinin asidik ortamda kararlılığının az olması nedeniyle , bu tür reaksiyonların verimi düĢüktür.
Pseudo kaliks[4]pirol(12) bileĢiği [3+1] kondenzasyon metodu kullanılarak sentezlenmiĢtir. Tripiran bileĢiğinin formaldehit ile reaksiyonundan elde edilen bileĢiğin indirgenmesi iletripirandimethanol oluĢur. Tripirandiolün, asidik ortamda
38
tetrathiafulvaren içeren pirol ile sentezinden %21 verimle mono-TTF kaliks[4]pirol bileĢiği meydana gelir. Bu bileĢiğin, NMR spektroskopik teknikleri ve elektrokimyasal teknikler kullanılarak anyon bağlama özelliği incelenmiĢtir.
1.2.3 Kaliks[4]pirollerin Modifikasyonu
Kaliks[4]pirol bileĢiklerinin modifikasyon metotları Ģunlardır; 1) C-iskeletinin modifikasyonu
2) Meso modifikasyonu
3) N-iskeletinin modifikasyonu 4) Dimerizasyonu
1.2.3.1 C-iskeletinin modifikasyonu
Kaliks[4]pirol bileĢiklerinin β pozisyonundan fonksiyonlandırılması C-iskeletinin fonksiyonlandırılması olarak adlandırılır. En yaygın C-C-iskeletinin fonksiyonlandırılması β-okta ve β- mono fonksiyonlandırılmasıdır. Sesler ve ark.(1997) „de mesooktametilkaliks[4]pirol bileĢiklerinin 4 ekivalent n-bütillityum ile reaksiyonundan polianyon bileĢiği sentezlenmiĢtir. Bu bileĢiğin etilbromo asetat
39
ile muamele edildiğinde geometrik Ģekilleri itibari ile C-iskeleti diyebileceğimiz β pozisyonlarından mono fonksiyonlandırma yapılmıĢlardır.
Oktametilkaliks[4]pirol bileĢiğinin, 8 ekivalent NBS ile 5 saat ısıtılmasıyla %90 verimle β-oktabromokaliks[4]pirol bileĢiği sentezlenmiĢtir.
1.2.3.2 Meso modifikasyonu
Kaliks[4]pirol bileĢiklerinin meso pozisyonlarına aril veya kararlı grupların katılmasıyla kaliks[4]pirol yapısının anyon seçiciliği değiĢebildiği gibi katodik, anodik ve nötral bağlama için seçici ikincil bağlama tarafları oluĢturulur. Kalikspirol bileĢiklerinin meso pozisyonlarından modifikasyonuna en iyi örnek 4. bileĢiğin αααα, αααβ, ααββ ve αβαβ izomerleridir. Bu izomerler kolon kromotografisi metodu kullanılarak birbirinden ayrılmıĢtır.
40 1.2.3.3 N- iskeletinin modifikasyonu
Takata ve ark. (1998) „de yaptıkları çalıĢmalarda kalikspirol bileĢiklerinin N- iskeleti üzerinden modifikasyonu ile ilgili çalıĢmalar yapmıĢlardır. N iskeletinin modifikasyonunda oktaetilkaliks[4]pirolün sodyumhidrür ve metil iyodür ile THF içerisinde 18-crown-6 varlığında reaksiyonundan N metilenmiĢ kalikspiroller verdiği bilinmektedir. DeğiĢen MeI konsantrasyonuna göre oluĢan ürün miktarları tablo.1.2.3.1 da verilmiĢtir.
41
Tablo.1.2.3.1‟de görüldüğü gibi 1 ekivalent MeI kullanıldığında, mono-N metiielnmiĢ türev 16, 2 ekivalent kullanıldığında ana ürün 1,3 dimetillenmiĢ 18 olmakla beraber bis, tris, tetrakis türevleride oluĢamktadır. 18 ürün görüldüğü üzere katı halde 1,3-alterne konformasyonda bulunmaktadır.
42 1.2.3.4 Dimerizasyon
Kaliks[4]piroller, uygun geometrilerde polianyon sübstratların bağlanması ile dimerik bileĢikler oluĢur.
ġekil1.27. Dimer Yapıda Kaliks[4]pirol Sentezi
1.2.4 Kaliks[4]pirol ve Türevi BileĢiklerin Uygulama Alanları 1.2.4.1 Kaliks[4]pirol kaplı optik sensörler
Bulding blocks kaliks[4]pirol bileĢiklerine çeĢitli kromofor veya floresans grup takılarak çok sayıda optik anyon sensörü sentezlenmiĢtir. 35-37 nolu anyon sensörleri, β-monosübstitüe kaliks[4]pirol bileĢiklerinden türetilmiĢtir. 16 nolu bileĢiğin disiklohekzilkarboimidine(DCC) ve hidroksilbenzotriazole(HOBt) kullanılarak 1-aminoantrasen ile bileĢiği ile reaksiyonundan %34 verimle kaliks[4]pirol-antrasen bileĢiği elde edilmiĢtir. 17 nolu bileĢiğin bazik ortamda asidine dönüĢtürüldükten sonra, 1-aminoantrasen ve 9-aminoantrasen bileĢiğini bağlayarak %63 ve %51 verimle bileĢikler sentezlenmiĢtir. Kalik[4]pirol-antrasen konjugasyonlarının farklı anyonlarla titrasyonu yapıldığında, bileĢiklerin yapısındaki amit-alkil bağları aracılıyla antrasen florophere transfer edilmesiyle elektronik değiĢiklik sağlanmıĢtır.
43
Kaliks[4]pirol bileĢiklerine kromofor grubun meso pozisyonundan bağlandığı anyon sensörleride sentezlenmiĢtir. Pirol, 3-pentanon ve Cbz-protected 3-aminoasetofenonun asit katalizörlüğünde reaksiyonundan elde edilen bileĢiğin hidroliz reaksiyonundan 3-aminofenilkalikspirol bileĢiği sentezlenmiĢtir.
44
1.2.4.2 Kaliks[4]pirol kaplı elektrokimyasal sensörler
Son zamanlarda yapılan çalıĢmalarda kaliks[4]pirol bileĢiklerinin β veya meso pozisyonlarından fonksiyonlandırılması ile elektrokimyasal sensör olarak kullanılan bileĢikler sentezlenmiĢtir. 49, 50 ve 51 nolu bileĢikler elektrokimyasal sensör olarak kullanılmaktadır.
51 nolu bileĢik, pirol, siklohekzanon ve asetilferrosenin hetereo kondenzasyon reaksiyonu sonucu sentezlenmiĢtir. Bu bileĢikle yapılan elektrokimyasal çalıĢmalar sonucu aĢırı miktarda dihidrojenfosfatın asetonitril/DMSO(9:1 v/v) „daki çözeltisinin eklenmesiyle 100Mv „a kadar katodik kayma gözlemlendi.
Kaliks[4]piroller, PVC-based membranları kaplayarak iyon seçici elektrot olarak olarakta kullanılmaktadır. Oktametilkaliks[4]pirol bileĢiği içeren bir iyon seçici elektrot ile yapılan potansiyometrik çalıĢmalarda düĢük pH‟larda (3.5-5.5) Br
-, CI- ve H2PO4- güçlü anyonik cevap gösterirken, F- daha az göstermektedir. Bu
çalıĢmalar sonucunda kalik[4]pirol ve türevi bileĢiklerin PVC- based iyon seçici elektrot yapımında önemli rol oynar.
1.2.4.3 Kaliks[4]pirol kaplı HPLC destekleri
Kalks[4]pirol bileĢikleri silikajele modifiye edildiğinde, katı faz HPLC destek olarak davranırlar. Gel B ve Gel M F
-, CI-, Br-, HSO4-, H2PO4- ve Cbz-protected
anyonik aminoasitlerin ayrımı için etkin iken, hemde nükleoidlerin ve oligonükleoidlerin ayrılmasında kullanılır.
46 2. KAYNAK ARAġTIRMASI
2.1. ÇalıĢmanın Amacı
Koordinasyon bileĢiklerinin biyolojik yapılardaki önemi, sanayideki kullanım oranının ve alanının günden güne artması, son zamanlarda kanser araĢtırmalarında antitümör etkilerinin bulunması, kompleksler “özellikle vic-dioksim kompleksleri” üzerindeki araĢtırmaların yoğunlaĢmasına sebep olmuĢtur. Oldukça geniĢ kullanım sahası olan oksimlerin bir kısmı ilaçların imalatında hammadde olarak kullanılır iken bir kısmının da ilaçların yapımında etkinliği artırıcı katkı maddesi olarak kullanılması bu yöndeki çalıĢmaları hızlandırmıĢtır. Özellikle yapılarında pirol grubu ihtiva eden oksimlerin biyokimya, tıp ve ilaç kimyasında yaygın kullanımı söz konusudur. Son zamanlarda pentapirolik makrosiklik bileĢiklerin potansiyel kanser ilaçları olarak aktivite göstermeleri alanındaki çalıĢmalar, bizim yapısında kalikspirol grubu ihtiva eden vic-dioksim ligandı ve komplekslerinin sentezi ile ilgili yeni bir çalıĢma alanı oluĢturmamıza ıĢık tutmuĢtur. Bu çalıĢmalarımız sonucunda uygun pozitif çıktıların alınması durumunda sentezlenen bileĢikler, patent çalıĢmalarına bir zemin teĢkil edecektir. ÇalıĢma sonuçları patent altında korunabildiğinde ülke ekonomisine hem mali hem de saygınlık açısından çok fazla yarar sağlayacaktır. Son zamanlarda kaliks[4]pirol bileĢiğinin meso pozisyonuna kromofor grup bağlanarak ikinci jenerasyon kaliks[4]pirol anyon sensörlerinin sentezlenmesi, bizim yeni çalıĢmamızın yönünü belirleyen önemli faktörlerdendir. Ġleriki çalıĢmalarda, sentezleyeceğimiz yeni vic-dioksim ligandının anyon seçicilik özelliği araĢtırılarak sensör özellikleri incelenebilir. Bu çalıĢmalar da vic-dioksim ligandlarının ve geçiĢ metal komplekslerinin kullanım alanının artmasına önemli katkılar sağlayacaktır.
2.2. Literatür Özetleri
GeçiĢ metalleri ile elektron verici gruplara sahip ligandlardan meydana gelen komplekslerin reaksiyon mekanizmalarının incelenmesi ve yapılarının aydınlatılması biyokimya, ilaç kimyası, boyar maddeler, polimer kimyası ve tarım gibi birçok alanda önem kazanmaktadır (Bekaroğlu 1978). Koordinasyon bileĢiklerinin önemli bir grubunu oluĢturan vic-dioksim komplekslerinin sentezi ile ilgili günümüze kadar pek çok çalıĢma yapılmıĢtır (Özcan ve Mirzaoğlu 1988, KarataĢ ve ark., 1992, Gürsoy ve ark., 2000, Köysal ve ark., 2004). Koordinasyon bileĢiklerinin biyolojik yapılardaki önemi, sanayide kullanım alanının artması özellikle vic-dioksim
47
kompleksleri üzerindeki araĢtırmaların yoğunlaĢmasına sebep olmuĢtur (DurmuĢ ve ark., 2004).
Özcan ve ark. (2002) yaptıkları çalıĢmada, amphi-kloroglioksim, antikloroglioksim ile 4-butilanilin ve 4-fenilazoanilin reaksiyonları sonucu yeni vic Dioksim ligandları sentezleyerek, bu ligandların Co(II), Ni(II), Cu(II), Sentezledikleri ligandlarının Cd(II) metal iyonlarıyla komplekslerini elde etmiĢlerdir. ve komplekslerin yapılarını elementel analiz, IR, 1
H-NMR, kütle spektrumu teknikleriyle aydınlatmıĢlardır. Kurtoğlu ve Serin (2002) yaptıkları çalıĢmada, monokloro-anti-glioksimden çıkarak etoksi grubu içeren yeni bir vic-Dioksim ligandı sentezleyerek bu ligandın Co(II), Cu(II), Ni(II) metal iyonlarıyla komplekslerini elde etmiĢlerdir.Sentezledikleri ligand ve komplekslerin yapılarını elementel analiz, UV-VIS, IR,-1HNMR, teknikleriyle aydınlatmıĢlardır. Aydoğdu ve ark., (2002) yaptıkları çalıĢmada yeni bir glioksim ligandının Ni(II) metal iyonu ile 1:2 oranda metal kompleksini izole etmiĢlerdir. Bu kompleksin elektriksel ve optik özelliklerini inceleyerek anorganik yarı iletken özelliğe sahip olduğunu göstermiĢlerdir. Oksim bileĢiklerinin tıp ve ilaç kimyasında kullanılmasıyla ilgili pek çok çalıĢma yapılmıĢtır. Bu çalıĢmalardan en çok dikkat çekeni pirol grubu ihtiva eden oksim bileĢikleri ile ilgili çalıĢmalardır. 1-metil-2-asetilpirolün oksim bileĢiğinin ağrı kesici etkilerinin yanı sıra lokal anastezik etkilerinin de bulunduğu görülmüĢtür (Abele 2004).
Bu proje kapsamında sentezlenmesi planlanan vic-dioksim ligandı ve komplekslerinin yapısında yer alan kaliks[4]pirol bileĢiği türevleri ile ilgili pek çok çalıĢma yapılmıĢtır. 1886‟ da Baeyer‟in aseton ile pirolün asidik ortamdaki kondenzasyon reaksiyonundan tetrametilkaliks[4]pirol bileĢiğinin sentezlenmesi ile baĢlayan kalikspirol çalıĢması günümüze kadar bir çok yeni kalikspirol bileĢiklerinin sentez çalıĢmalarına öncülük etmiĢtir. Bu araĢtırmaların sonucunda kalikspirol gibi nötral non-aromatik poliprotik makrosikliklerin anyon bağlayıcı özellikleri araĢtırma konusu olmuĢtur. Daha sonraki çalıĢmalarda, kalikspirol bileĢikleri incelenerek bu bileĢiklerin sadece anyon bağlama özelliği olmadığı aynı zamanda kısa zincirli alkollerle, amidlerle ve oksijen içeren nötral bileĢiklerle de kompleks oluĢturdukları anlaĢılmıĢtır.


![ġekil 1.20. Kaliks[4]pirol ile porfirinojen arasındaki fark](https://thumb-eu.123doks.com/thumbv2/9libnet/4658921.87048/38.892.211.620.96.476/ġekil-kaliks-pirol-ile-porfirinojen-arasındaki-fark.webp)
![ġekil 1.21 Kaliks[4]pirolün ve kaliks[4]arenin yapısı](https://thumb-eu.123doks.com/thumbv2/9libnet/4658921.87048/39.892.134.807.75.713/ġekil-kaliks-pirolün-ve-kaliks-arenin-yapısı.webp)

