T. C.
SELÇUK ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
ERKEN GEBELĠKTE EMBRĠYONUN ENDOMETRĠYAL
ANTĠOKSĠDAN YANITA ETKĠLERĠ: KOYUN MODELĠ
Gonca ġEN
YÜKSEK LĠSANS TEZĠ TIBBĠ GENETĠK ANABĠLĠM DALI
DanıĢman
Prof. Dr. Aydın GÜZELOĞLU
EĢ DanıĢman
Prof. Dr. Nuri BAġPINAR
ÖNSÖZ
Bu çalıĢmanın gerçekleĢtirilmesinde bana destek veren, bilimsel düĢünmeyi ve çalıĢmayı öğreten, bilgi ve birikimlerini benimle paylaĢan değerli danıĢmanım Prof. Dr. Aydın GÜZELOĞLU‟na, tez projemin çalıĢmalarına farklı bir yaklaĢım katan, gerek laboratuvar çalıĢmalarında gerek manevi konularda desteğini esirgemeyen değerli eĢ danıĢmanım Prof. Dr. Nuri BAġPINAR‟a, benimle bilgisini ve tecrübesini paylaĢan, yardımlarını esirgemeyen değerli hocam Doç. Dr. Ercan KURAR‟a, ayrıca projenin yapım aĢamasında; özellikle hayvanların bakımı, kesimi ve örneklerin toplanması konusunda özverilerini esirgemeyen sayın hocalarım Yrd. Doç. Dr. Zekeriya KIYMA ve Yrd. Doç. Dr. Mehmet KÖSE‟ye teĢekkürlerimi sunuyorum.
ÇalıĢma süresince beni motive eden, birlikte çalıĢmaktan büyük mutluluk ve onur duyduğum değerli asistan arkadaĢlarım Çağlayan ÖZEL‟e ve Mustafa HĠTĠT‟e gönülden teĢekkür ederim. Hayatımın her aĢamasında bana destek veren sevgili annem ve babama sonsuz teĢekkürü borç bilirim.
BEYAN
Prof. Dr. Aydın GÜZELOĞLU‟nun danıĢmanlığında gerçekleĢtirilen bu tez çalıĢmasının kendi çalıĢmamız olduğunu, tezin planlanmasından yazımına kadar bütün safhalarda etik dıĢı davranıĢımın olmadığını, bu tezdeki bütün bilgileri akademik ve etik kurallar içinde elde ettiğimi, bu tez çalıĢması ile elde edilmeyen bütün bilgi ve yorumlara kaynak gösterdiğimi ve bu kaynakları da kaynaklar listesine aldığımı, yine bu tezin çalıĢılması ve yazımı sırasında patent ve telif haklarını ihlal edici bir davranıĢımın olmadığını beyan ederim.
ĠÇĠNDEKĠLER
SİMGELER ve KISALTMALAR ... ivii
1. GİRİŞ ... 1
1.1. Oksidatif Stres ... 1
1.1.1. Radikaller ... 2
1.1.2. Reaktif Oksijen Türleri ... 4
1.1.3. Radikallerin Zararları ... 5
1.2. Antioksidanlar ... 6
1.2.1. Birincil Antioksidanlar ... 7
1.3. Moleküler Stres Yanıtı ... 9
1.3.1. Nrf2 ve Keap1 Molekülleri ... 10
1.3.2. Nrf2/Keap1 EtkileĢimi ... 11
1.3.3. Nrf2 ile Anlatımı Kontrol Edilen Genler ... 12
1.4. Erken Gebelikte Antioksidan Savunma Sistemi ... 14
2. GEREÇ ve YÖNTEM ... 22
2.1. Deneysel Model ve Dokuların Toplanması ... 22
2.1.1. Hayvan Materyali ... 22
2.1.2. Gruplandırma ... 22
2.1.3. Barındırma ve Beslenme ... 23
2.1.4. Örneklerin Toplanması ... 23
2.2. Moleküler Analizler ... 23
2.2.1. Total RNA Ġzolasyonu ... 23
2.2.2. RNA Kalitesi ve Miktarının Belirlenmesi ... 24
2.2.3. Total RNA‟dan DNaseI Enzimi ile Genomik DNA‟nın UzaklaĢtırılması 25 2.2.4. Revers Transkripsiyon (RT) Reaksiyonu ... 25
2.2.5. Primer Dizaynı ... 26
2.2.6. Primer Sulandırılması ... 27
2.2.8. Primer Dilüsyonları ile Primer Etkinliğinin Belirlenmesi ... 27
2.2.9. Real Time Polimeraz Zincir Reaksiyonu (RT-qPZR) ... 28
2.3. Biyokimyasal Analizler ... 30
2.3.1. Mekanik Homojenizasyon ve Sonikasyon ... 30
2.3.2. Antioksidan Enzim Aktivite Düzeylerinin Ölçümü... 30
2.4. Ġstatistiksel Analizler ... 32
2.5. Etik Kurul ... 32
3. BULGULAR ... 33
3.1. Gen Anlatımı Analizlerinin Sonuçları ... 33
3.1.1. Primer Etkinlikleri ... 33
3.1.2. Housekeeping Gen Seçimi ve Optimizasyonu... 33
3.2. Biyokimyasal Analizlerin Sonuçları ... 40
4. TARTIŞMA ... 43
5. SONUÇ ve ÖNERİLER ... 52
6. KAYNAKLAR ... 54
7. EKLER ... 64
EK A: EĢ DanıĢman Formu ... 64
EK B: Etik Kurul Kararı ... 65
SĠMGELER ve KISALTMALAR
ACTB Beta Aktin
ABTS 2, 2 Azino Bis (3 Ethilbenzothiazolin 6 Sülfonik Asid)
AOP Antioksidan Potansiyeli
ARE Antioksidan Yanıt Elementi
ATP Adenozin Trifosfat
Bç Baz Çifti
CAT Katalaz
cDNA Complementary DNA
CL Korpus Luteum
ClO- Hipoklorit
CO2 Karbondioksit
Cq Cycle Threshold
Cu+2 Bakır
Cu/Zn SOD Bakır Çinko Ġçeren Süperoksit Dismutaz
Cul3 Cullin 3
DEPC-ddH2O Dietilpirokarbonatlı Çift Distile Su
DNA Deoksiribonükleik Asit
EpRE Eletrofil Yanıt Elementi
ERK Hücre DıĢı Sinyal ile Düzenlenen Protein Kinaz
Fe+3/+2 Demir
FSH Folikül Stimülan Hormon
G6PDH Glukoz 6 Fosfat Dehidrogenaz
GAPDH Gliseraldehid Fosfat Dehidrogenaz
GCLC Glutamat Sistein Ligaz Katalitik Subüniti
gDNA Genomik DNA
GnRH Gonadotropin Releasing Hormon
GR Glutatyon Redüktaz GSH Glutatyon GPX Glutatyon Peroksidaz GSSH OksitlenmiĢ Glutatyon GST Glutatyon S Transferaz H2O2 Hidrojen Peroksit
HCOR Aldehid
HKG Housekeeping Gen
HO• Hidroksi Radikali
HO1 Hem Oksijenaz 1
HOCl Hipoklorik Asit
HPRT1 Hipoksantin Guanin Fosforibozil Transferaz 1
IVR Ara Bölge
JNK c-Jun N Terminal Kinaz
Keap1 Kelch benzeri ECH iliĢlili Protein 1
LH Lüteinizan Hormon
LPO Lipid Peroksidasyon
Maf Musculoaponeurotic Fibrosarcoma
MGR Mutlak Gen Regülasyonu
Mn Manganez
Mn SOD Manganez Ġçeren Süperoksit Dismutaz
mRNA Mesajcı Ribonükleik Asit
NAD(P)+/NAD(P)H Nikotinamid Adenin Dinükleotit (Fosfat)
N•O Azot Oksit
NQO1 NAD(P)H Oksidoredüktaz 1
Nrf2 Nüclear E2 ĠliĢkili Factör
O-2 Oksijen/Singlet Oksijen
O•• Oksijen Radikali
O2• Süperoksit
ONOO Peroksinitrit
PGAM5 Fosfogliserat Mutaz 5
PI3K Fosfatidil Ġnozitol 3 Kinaz
PKC Protein Kinaz C
Prx Peroksit
PZR Polimeraz Zincir Reaksiyonu
R• Radikal
RO• Alkoksi Radikali
ROO• Peroksi Radikali
ROOH Hidroperoksit
RPL32 Ribozomal Protein L32
rRNA Ribozomal Ribonükleik Asit
RT Revers Transkriptaz
RT-qPZR Real Time PZR
SDHA Süksinat Dehidrogenaz Subünit A
SOD Süperoksit Dismutaz
SE Standart Hata
T-GSH Total Glutatyon
TXNRD Tioredoksin Redüktaz
YWHAZ Tirozin 3 Monooksijenaz/Triptofan 5 Monooksijenaz
Aktivasyon Protein
ÖZET
T. C.
SELÇUK ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
Erken gebelikte embriyonun endometriyal antioksidan yanıta etkileri: Koyun modeli
Gonca ġEN
Tıbbi Genetik Anabilim Dalı YÜKSEK LĠSANS TEZĠ / KONYA-2015
Reaktif oksijen türleri (ROS) diğer organ ve sistemlerde olduğu gibi reprodüktif sistemdeki birçok fizyolojik ve patalojik süreçte rol oynamaktadırlar. BaĢarılı bir fertilizasyon ve implantasyon ROS‟un konsantrasyonundan etkilenebilmektedir. Ayrıca östrojenin ve progesteronun pro-oksidan ve antioksidan parametrelerini etkilediği ve gebelik gibi fizyolojik süreçlerde antioksidan savunma sisteminde değiĢikliklere yol açabileceği bilinmektedir. Transkripsiyon faktörü Nrf2, güçlü bir trankripsiyonal aktivatör olarak oksidatif ve elektrofilik streste; hücrelerde birçok koruyucu geni indüklemekte, gen anlatımının düzenlenmesinde merkezi bir rol oynamaktadır. Bu çalıĢmadaki amacımız koyunlarda gebeliğin preimplantasyon aĢamasında pro-oksidan ve antioksidan sisteminin hem enzim hem de gen anlatımı düzeyinde araĢtırılması, gebeliğe bağlı antioksidan yanıt yolağındaki farklılıklarının belirlenmesidir.
Gebeliğin ve siklusun 13. günlerinde toplanan endometriyum doku örneklerinden total RNA izolasyonu yapıldı, cDNA üretildi. ÇalıĢmada RT-qPZR yöntemiyle HO1, NQO1, GPX2, GSTP1, GCLC, TXNRD1, G6PDH, CAT, SOD1, Nrf2, Cul3, Keap1, GR genlerinin anlatım düzeyleri belirlendi. Gebe ve gebe olmayan koyunlar istatistiksel olarak karĢılaĢtırıldı. Bulunan verilere göre gebe koyunlarda siklik koyunlara göre GR anlatımında 1,95 kat, HO1 anlatımında 1,39 kat artıĢ gözlendi (p<0,05). Diğer genler numerik olarak %5-20 farklılık göstermesine rağmen istatistiksel olarak anlamlı bulunmadı. Doku örneklerinde biyokimyasal oksidatif stres parametrelerinin göstergesi olan LPO, T-GSH düzeyleri ve total antioksidan aktivitesi spektrofotometrik olarak ölçüldü. Ġstatistiksel değerlendirmede erken gebelikte endometriyumda gebe ve gebe olmayan karĢılaĢtırmasında biyokimyasal parametrelerde anlamlı bir sonuç bulunmadı (p>0,05).
AraĢtırmada koyun endometriyumunda antioksidan yanıt yolağının komponentlerinin gen düzeyinde anlatımları olduğu belirlendi. Elde edilen sonuçlara göre preimplantasyon döneminde gebeliğin uterus üzerinde oksidatif bir stres oluĢturmadığı, ancak GSH üretimi/rejenerasyonu ve demir birikimi ile ilgili yolakların gebeliğe bağlı endometriyumda gen anlatımı farklılıkları oluĢturabileceği kanaatine varıldı. Bu yolakların gebelikteki rollerinin anlaĢılması için yolaklara ait diğer genlerin araĢtırması, erken gebelikte oksidatif stresin rolüyle ilgili bilgi birikimimizi arttıracaktır.
SUMMARY
REPUBLIC of TURKEY SELÇUK UNIVERSITY HEALTH SCIENCES INSTITUTE
Effects of embryo on endometrial antioxidant response in early pregnancy: Ovine model
Gonca ġEN
Department of Medical Genetics MASTER THESIS KONYA-2015
Reactive oxygen species (ROS) involve in several physiologic and pathologic process of reproduction system as well as other organs and systems. Fertilization and implantation could be affected by ROS concentration. Estrogen and progesterone are known to affect pro-oxidant and antioxidant parameters and cause plenty of changes in antioxidant defense system in the physiological processes such as pregnancy. Nrf2, transcription factor, is a robust transcriptional activator. In oxidative and electrophilic stress; Nrf2 induces various protective genes and also plays central role in regulation of gene expression. In this study, the objective was to investigate the levels of both enzyme and gene expression of pro-oxidant and antioxidant system in the peri-implantation period of ewes and besides, reveal the differences pregnancy related antioxidant response.
Total RNA extraction from endometrium tissues, collected on the day 13 th of cylic and pregnancy was performed. The total RNAs was converted to cDNA. In the study, expression levels of HO1, NQO1, GPX2, GSTP1, GCLC, TXNRD1, G6PDH, CAT, SOD1, Nrf2, Cul3, Keap1, GR genes were determined using RT-qPCR. Pregnant and non-pregnant ewes were statically compared. According to the results obtained, GR and HO1 expression was increased respectively 1,95, and 1,39 fold (p<0,05) in pregnant ewes compared to cyclic ewes. Although the genes investigated showed differences at 5-20% levels, they were not statistically significant. Biochemical oxidative stress parameters, LPO, T-GSH and AOP were measured in tissues. There was statistically no significant results between comparsion of pregnant and non-pregnant ewes.
In the study, expression of the components of antioxidant response pathway was determined at gene level. The results, obtained suggests that pregnancy did not put stress on uterus at the period investigated. Production or regeneration of GSH and accumulation of iron may make differences in the expression of pregnancy-related pathway in endometrium. To elucidate the role of these pathways in pregnancy, other genes associated with the pathways should be investigated.
1
1. GĠRĠġ 1.1. Oksidatif Stres
Oksijen, yaĢam için gerekli olmasına karĢın aynı zamanda hasar oluĢturucu etkilere sahiptir. Normal metabolik reaksiyonlarda canlı sistemlere zarar verme potansiyeline sahip moleküller oluĢur (Priestly 1775). Bu sebeple canlı sistemlerde oksijen seviyesinin kontrol edilmesi gerekir (Jaffe 1976). OluĢan bu moleküllere reaktif oksijen türleri (ROS) denir. ROS‟un birçoğu radikaldir, ancak bu formların normal oksijene göre kimyasal reaktiviteleri fazladır (Nawar 1996).
Radikaller, dıĢ orbitallerinde en az bir eĢlenmemiĢ elektron içeren yüksek enerjili, stabil olmayan bileĢiklerdir. Bu elektron radikallere büyük bir reaktiflik kazandırır. Radikallerin protein, lipid, nükleotid, enzim gibi birçok biyolojik moleküllerle reaksiyona girmeleri kolaydır (Diplock 1998). Radikallerin oluĢumunu açıklayan mekanizmalar arasında otooksidasyon, fotooksidasyon ve enzimatik oksidasyon yer almaktadır (Foote 1985, Lavelli ve ark 2000). Oksidasyon reaksiyonlarının yanı sıra geçiĢ metal iyonlarının etkisiyle de radikal oluĢumu gözlenmektedir (Halliwell ve Gutteridge 1990).
Redüktant ve oksidant kavramları kimyasal terimlerdir; biyoloji alanında kullanılırken antioksidan ve pro-oksidant terimleri seçilmelidir (Cao ve Prior 1998, Prior ve Cao 1999). Pro-oksidant, reaktif oksijen türlerini tanımlar ve radikal ve radikal olmayan olmak üzere iki gruba ayrılırlar. Radikal terimi çoğu zaman serbest radikal olarak kullanılmaktadır. Ancak bu terimin kullanımı doğru değildir, çünkü radikaller her zaman serbesttirler (Rice-Evans ve Burdon 1994, Halliwell ve Gutteridge 1999).
Oksidatif stresin zararlarını en aza indirgemek için, canlı sistemlerde farklı savunma sistemleri reaktif; oksijen türlerinin düzeyini kontrol altında tutmaktadır. Bu sistemler farklı yerlerde farklı moleküller üzerinde etkilidir. Bu yüzden savunma sistemleri birbirlerini tamamlayıcı özelliktedirler (Diplock 1998). Radikallerin girebileceği oksidasyon reaksiyonlarını önleyen, reaktif oksijen türlerinin yakalanmasında ve stabilize edilmesinde rol oynayan maddelere “antioksidan” adı verilir (Elliot 1999). Antioksidanlar çalıĢma mekanizmalarına göre birincil ve ikincil antioksidanlar olarak ayrılırlar. Ġlk grup antioksidanlar yani birincil antioksidanlar
2
ortamda bulunan radikallerle reaksiyona girerler. Ġkincil antioksidanlar ise; oksijen radikalini yakalarlar. Böylece radikal zincir reaksiyonlarının devam etmesini durdururlar (Ou ve ark 2002).
Transkripsiyon faktörü Nrf2 (Nüclear E2 iliĢkili factör) güçlü bir trankripsiyonal aktivatördür. Oksidatif ve elektrofilik stres; hücrelerde birçok koruyucu geni indükler, gen anlatımının düzenlenmesinde merkezi bir rol oynar (Itoh ve ark 2003, Motohashi ve Yamamoto 2004). Keap1 (Kelch benzeri ECH iliĢkili protein 1) Nrf2‟nin aktivitesinin düzenlenmesi için gereklidir. Normal Ģartlar altında, Nrf2 genel olarak Keap1‟e bağlı olarak ubikitin-proteazom yolağıyla degrade olur (Sekhar ve ark 2002, McMahon ve ark 2003, Kobayashi ve ark 2004). Elektrofiller veya ROS varlığında, Nrf2 degradasyonu durur, çekirdek içinde stabilize olmuĢ Nrf2 birikir, küçük Maf (musculoaponeurotic fibrosarcoma) proteinleri heterodimerize edilir ve antioksidan yanıt elementi/eletrofil yanıt elementi (ARE/EpRE) aracılığıyla gerekli genler aktif hale getirilir (Itoh ve ark 2004).
DNA (deoksiribonükleik asit)‟nın, proteinlerin ve diğer makromoleküllerin oksidatif hasarı çeĢitli hastalıkların patogenezinden sorumludur (Halliwell 1994). Klinik denemelerinin yanı sıra artan hayvan çalıĢmaları ve epidemiyolojik çalıĢmalar antioksidanların kalp hastalıklarının ve bazı kanser türlerinin önlenmesinde veya yavaĢlatılmasında önemli rol oynayabileceğini öne sürer (Block ve ark 1992, Hennekens ve Gaziano 1993).
1.1.1. Radikaller
Oksidatif stres, oksidatif hasar, radikal ve antioksidan terimleri kimyacılar, fizikçiler ve biyologlar tarafından sıklıkla kullanılmaktadır. BaĢlangıçta inorganik ve organik kimya literatüründe ara bileĢik olarak tarif edilen radikal terimi 20. yüzyılın baĢından beri kullanılmaktadır.
Biyolojik ortamlarda ve hücre içinde bu moleküllerin zararlı süreçlerde önemli roller üstlenebileceği önerilmiĢtir (Gilbert 1981). Daha sonra yapılan bir çalıĢmada bu moleküllerin fizyolojik olaylarda ve özellikle yaĢlanma sürecinde rol oynayabileceği ileri sürülmüĢtür (Harman 1956). Aynı araĢtırıcının radikallerle iliĢkili yaĢlanma teorisinin çok sayıda çalıĢmaya ilham vermesi sonucunda radikaller ile radikal ve radikal olmayan reaktif oksijen türleri hakkında bilgi birikimi artmıĢtır
3
(Harman 1981). Bu metabolitler biyokimyasal reaksiyonlarda ve hücresel yanıtta baĢlıca moleküller olarak kabul görmektedirler (Beckman ve Ames 1998, Davies 1999, Halliwell ve Gutteridge 1999, Allen ve Tresini 2000, Sen 2000).
Bu radikallerin göze çarpan iki önemli özelliği vardır. Bunlardan ilki yarılanma ömürlerinin kısa olmasıdır. Diğeri ise radikal olmayan moleküllerle reaksiyona girerek yeni radikalleri oluĢturmaları ve zincir reaksiyon baĢlatabilmeleridir (Sen 2000).
Çizelge 1.1. Radikaller (Halliwell ve Gutteridge 1999).
Radikaller Kimyasal Gösterimi
Süperoksit O2• Hidrojen peroksit H2O2 Hidroksi radikali HO• Ozon O3- Oksijen O-2 Azot oksit N•O Peroksinitrit ONOO -Hipoklorit ClO -Radikal R•
Peroksil radikali ROO•
Hidroperoksit ROOH
4 1.1.2. Reaktif Oksijen Türleri
Antoine Laurent Lavoisier tarafından 18. yüzyılın baĢlarında oksijenin keĢfinden sonra oksijen seviyesinin kontrol edilmesi gerekliliği farkedilmiĢtir (Jaffe 1976). Bu yüzyılın sonlarında oksijenin organizmaya toksisitesi tarif edilmiĢ ve vücut üzerindeki etkisi karĢılaĢtırılmıĢtır (Priestly 1775). Kimyasal olarak yapısına elektron alabilen her bileĢik oksidant veya oksitleyici ajan olarak; yapısındaki elektronu veren her bileĢik ise redüktant veya indirgeyici ajan olarak tanımlanır (Prior ve Cao 1999). Substratın elektron kazandığı reaksiyonlar indirgenme reaksiyonları olarak tanımlanırken oksidasyon reaksiyonları elektron kaybedildiğinde gerçekleĢir (Schafer ve Buettner 2001). Yani bir redüktant elektron verdiğinde baĢka bir molekülün redüktant olmasını sağlar; oksidant elektron kabul ettiğinde baĢka bir molekülün oksitlenmesini sağlar (Hrbac ve Kohen 2000). Canlı sistemlerde redüktant genellikle bileĢiğe hidrojen vererek veya bileĢikten oksijen çıkararak etki gösterir. Oksidasyon reaksiyonları herzaman indirgeyici reaksiyonlarla eĢ zamanlı gerçekleĢir. EĢlenen indirgeyici reaksiyonlar genellikle oksijen kaybını içerirken oksidasyon reaksiyonları moleküle oksijen eklenmesini içerir (Cao ve Prior 1998, Prior ve Cao 1999, Hrbac ve Kohen 2000, Schafer ve Buettner 2001). Böyle reaksiyonlar redoks reaksiyonları olarak tanımlanır ve bazı biyokimyasal yolaklar ve biyosentez reaksiyonları redoks reaksiyonlarına örnektir (Shapiro 1972).
Redüktant ve oksidant tanımları kimyasal terimlerdir; biyoloji alanında kullanılırken antioksidan ve pro-oksidant terimleri seçilmelidir (Cao ve Prior 1998, Prior ve Cao 1999). Pro-oksidant, reaktif oksijen türlerini tanımlar ve iki gruba ayrılır; radikal ve radikal olmayan. Radikal terimi çoğu zaman serbest radikal olarak kullanılmaktadır. Ancak bu terimin kullanımı doğru değildir, çünkü radikaller her zaman serbesttirler. Radikaller yapısında en az bir tane eĢlenmemiĢ elektron bulundururlar (Rice-Evans ve Burdon 1994, Halliwell ve Gutteridge 1999).
EĢlenmemiĢ elektron varlığı moleküle yüksek reaktiflik kazandırır. Tanımsal olarak bakıldığında oksijen molekülü radikaldir, çünkü yapısında eĢlenmemiĢ iki elektron içerir. Ġki elektronun farklı orbitlerde yer almasından dolayı biradikal olarak tanımlanır (Halliwell ve Gutteridge 1999). Ancak spin kısıtlamasından dolayı oksijen radikali reaktif değildir; yani oksijen radikalinin eĢlenmemiĢ elektronlara ait spin yönünü düzenlemedikçe elektron verebilme veya alabilme kabiliyeti yoktur. Radikal
5
olmayan grup, tanımlamadan dolayı, yüksek reaktif bileĢikleri de içerir. Bu bileĢiklere örnek olarak canlı hücrelerde yüksek konsantrasyonda üretilen hipoklorik asit (HOCl), hidrojen peroksit (H2O2), organik peroksitler, aldehitler ve ozon verilebilir (Kohen ve ark 1996). Radikaller büyük R harfinin üst simge olarak nokta taĢıdığı Ģekilde (R•) literatürde kullanılır. Antioksidanlar pro-oksidasyon sürecini ve biyolojik oksidatif hasarı engelleyen moleküller olarak tanımlanabilir (Rice-Evans ve Burdon 1994, Halliwell ve Gutteridge 1999).
Çizelge 1.2. Oksijen metabolitleri (Hrbac ve Kohen 2000).
Oksijen Radikalleri Radikal Olmayan Oksijen Türevleri
Adı Sembolü Adı Sembolü
Oksijen O•• Hidrojen Peroksit H2O2
Süperoksit O2
• Hipokloröz Asit
HOCl
Hidroksi Radikali HO• Ozon O3
-Peroksi ROO• Aldehid HCOR
Alkoksi RO• Singlet Oksijen O-2
Azot Oksit N•O Peroksinitrit ONOO-
1.1.3. Radikallerin Zararları
Radikaller, dıĢ atomik orbitallerinde bir veya daha fazla çift oluĢturmamıĢ elektron içeren yüksek enerjili, sabit olmayan bileĢiklerdir. Bu çiftlenmemiĢ elektron radikallere reaktiflik kazandırarak protein, lipid, nükleotid gibi birçok biyolojik materyale zarar verme potansiyeline sahiptir. Olası zararın yaĢlanmayı hızlandırabileceği, kalp-damar hastalıkları, çeĢitli kanser türleri, katarakt, bağıĢıklık sisteminde zayıflama, sinir sistemi dejeneratif hastalıkları gibi birçok hastalığa yol açabileceği gözlenmiĢtir (Diplock 1998).
Mitokondriyal hasar
Mitokondrinin iç zarında reaktif oksijen türleri üretilir. Bunun en büyük nedeni oksidatif fosforilasyonun gerçekleĢtiği yer olmasıdır (Alexander ve ark 2011). Mitokondrideki süperoksit, manganez (Mn) içeren süperoksit dismutaz (SOD) ile, hidrojen peroksit ise selenyum içeren glutatyon peroksidaz ile metabolize edilir (Fleury ve ark 2002).
6
Oksijenin suya indirgendiği mitokondri reaktif oksijen türlerinin üretildiği baĢlıca organeldir. Singlet oksijen, süperoksit (O2•), H2O2, HO• (hidroksi radikali) ve azot oksit (NO•) pro-oksidantlar arasında mitokondride üretilen moleküllere örnektir. Fosforilasyon sürecinde oluĢan bu radikaller karĢılaĢtıkları herhangi bir molekülü okside etme potansiyeline sahiptir. Birçoğu çoklu doymamıĢ yağ asitleri ile tepkimeye girerek lipit peroksitleri oluĢturur ve bunlar membran akıĢkanlığının ve elastikiyetinin geri dönüĢümsüz hasarına neden olur (Lippman 1983).
Endoplazmik retikulum hasarı
Endoplazmik retikulum hücredeki proteinlerin katlanması, olgunlaĢması, hücre içinde iĢlev gösterecekleri bölgelere taĢınması ve bu süreçlerde proteinlerin doğru üretildiğinin kontrolünden sorumlu önemli bir organeldir. Bu proteinler genel olarak transmembran proteinler, salgılanan proteinler ve endoplazmik retikuluma yerleĢen proteinler olarak adlandırılabilir (Knight ve ark 2001).
Oksidatif stres proteinlerin doğru katlanmalarını ve organel içindeki iyonlar ile etkileĢimlerini etkiler. Proteinler stres sonucu yapı ve iĢlevlerini kaybedebilirler. Endoplazmik retikulum membranında membrana bağlı sitokromların oksidasyonu yapı ve iĢlevini kaybeden proteinler için önemlidir (Alexander ve ark 2011). ROS‟un etkisiyle proteinlerin katlanamaması ya da hatalı katlanması durumunda endoplazmik retikulum içinde bulunan kontrol sistemi bu proteinlerin yıkımını sağlayarak proteinlerin endoplazmik retikulum içinde birikimini önler (Kincaid ve Cooper 2007).
1.2. Antioksidanlar
Oksidatif stresin zararlarını en aza indirgemek için canlı sistemlerde farklı savunma sistemleri reaktif oksijen türlerinin düzeyini kontrol altında tutmaktadır. Bu sistemler farklı yerlerde farklı moleküller üzerinde etkilidir. Bu yüzden savunma sistemleri birbirlerini tamamlayıcı özelliktedirler (Diplock 1998).
Radikallerin girebileceği oksidasyon reaksiyonlarını önleyen, reaktif oksijen türlerinin yakalanmasında ve stabilize edilmesinde rol oynayan maddelere “antioksidan” adı verilir (Elliot 1999). Antioksidanlar çalıĢma mekanizmalarına göre birincil ve ikincil antioksidanlar olarak ayrılırlar. Ġlk grup antioksidanlar yani birincil
7
antioksidanlar ortamda bulunan radikallerle reaksiyona girerler. Bu reaksiyon sonucunda radikallerin daha zararlı formlara dönüĢmeleri ve yeni radikal oluĢturmaları önlenir. Birincil antioksidanlara örnek olarak SOD, glutatyon peroksidaz (GPX) ve katalaz enzim sistemleri verilebilir. Bu enzimler ayrıca radikallerin hücresel bileĢenlere zarar vermesini engellemek için bir hücresel bölgeden diğerine geçiĢini de engelleyebilirler (Diplock 1998). Diğer bir grup olan ikincil antioksidanlar ise; oksijen radikalini yakalarlar. Böylece radikal zincir reaksiyonlarının devam etmesini durdururlar. Ġkincil antioksidanlara örnek olarak C vitamini, E vitamini, ürik asit, bilurubin ve polifenoller gibi bileĢikler verilebilir (Ou ve ark 2002).
1.2.1. Birincil Antioksidanlar
Katalaz (CAT): Katalaz enzimi redoks reaksiyonunu indüklemeyen bir proteindir (Larson 1988). Ortamda bulunan H2O2 katalaz enziminin aktivitesi ile su ve oksijene dönüĢtürülmektedir (Duthie ve ark 1989).
H2O2 biyolojik sistemlerdeki moleküllerle spesifik olarak reaksiyona girmez. Ancak hidroksi radikali gibi reaktifliği daha yüksek oksijen türlerinin oluĢumunda ön madde olarak kullanılır (Larson 1988). Hidroksi radikallerinin fenton reaksiyonları ile etkisini azaltması katalazın antioksidan rollerinden biridir (Berry ve Kohen 1999, Benhar ve ark 2002). Katalaz ayrıca NAD(P)H (nikotinamid adenin dinükleotit (fosfat)) ile bağlı olarak bulunur; bu bağlantı enzimin inaktivasyonunu engeller ve etkisini arttırır (Henderson ve ark 1998, Helbock ve ark 1999). NAD(P)H molekülünün olgun kırmızı kan hücrelerinde azlığıyla iliĢkili glukoz 6 fosfat dehidrogenaz eksikliğinde hemolizisin nedeni olarak katalazın inhibasyonudur (Henderson ve ark 1998).
Peroksiredoksinler: Peroksiredoksinler hidrojen peroksit ve alkil hidropreoksit gibi pro-oksidantları indirgeyen bir enzimdir (Herrera ve Barbas 2001). Memeli hücrelerinde tioredoksin, tripanosomatidlerde tripanotiyon Salmonella typhimurium‟da alkil hidroperoksit redüktaz sisteminin bir bileĢeni ile okside peroksit (Prx) katalitik döngüsünü oluĢturur (Hrbac ve Kohen 2000). Memeli hücrelerin mitokondri içinde mitokondriyal tiyoredoksin sistemi peroksit indirgeyicidir (Hur ve ark 1999). Peroksiredoksinlerin p53 tarafından baĢlatılmıĢ
8
olan apoptozisi inhibe ettiği gösterilmiĢtir (Iida ve ark 2001). En az 13 memeli ait peroksiredoksin tipi bilinmektedir (Boldyrev 1993, Blau ve ark 1999, Ishikawa ve ark 2001).
Süperoksit Dismutaz (SOD): Süperoksit Dismutaz ROS metabolizması ile ilĢkili ilk keĢfedilen enzimdir (Halliwell 1999). Ökaryotik hücrelerde mitokondri içinde 80kDa tetramerik Mn-SOD ve sitosolik 32kDa dimerik Cu/Zn-SOD (bakır çinko içeren süperoksit dismutaz) enzimi vardır. SOD ile katalize edilen reaksiyon sadece difüzyon ile sınırlıdır ve son derece etkilidir. Mitokondri içinde gerçekleĢen oksidatif fosforilasyon oksijen kullanımını arttırır ve bu fosforilasyon basamaklarından biri olan elektron zinciri oksijenin süperoksit radikaline dönüĢümünü sağlar. Bu sebeple mitokondride yüksek konsantrasyonda süperoksit bulunur.
Hiçbir kalıtsal hastalık Mn-SOD eksikliği ile iliĢkili değildir. Çünkü mitokondriyal Mn-SOD yaĢam için gereklidir (Halliwell 2000). Mn-SOD eksik farelerde doğumdan hemen sonra ölüm gözlenmiĢtir (Halliwell 2001). Sitozolik Cu/Zn-SOD daha az önemli gibi görünür (Blau ve ark 2000). Bu enzimce eksik transgenik hayvanların fenotipi normaldir (Halliwell ve Gutteridge 1992). Ancak peroksidaz aktivitesinin arttığı amyotrofik lateral skleroz sitozolik SOD genindeki mutasyonlardan kaynaklanıdığı düĢünülmektedir (Halliwell ve Kaur 1997, Halliwell ve Gutteridge 1999, Halliwell ve ark 2000). Cu/Zn-SOD sitosolik formundan daha büyük bir formu hücre dıĢında bulunmaktadır (Hammer ve Braun 1988).
Glutatyon Peroksidaz (GPX): Memelilerde en az dört farklı GPX vardır ve hepsi selenosistein içerir (Ishikawa ve ark 2001). GPX1 ve GPX4 çoğu dokuda bulunan sitosolik enzimlerdir (Jaffe 1976, Brown ve Bicknell 2001). GPX4‟ün yakın zamanda sperm hücrelerinde çift iĢleve sahip olduğu bulunmuĢtur; spermatidlerde enzimatik olarak aktiftir ancak çözünmeyen formdadır ve olgun spermlerde yapısal bir protein olarak çalıĢır (Jenner 1993). Alternatif birinci eksonla N-terminalinde farklılık gösteren bir GPX4 varyantı sperm nükleusu için önemlidir; bu enzim spermatid kromatinin yoğunlaĢmasına katılır (Jeronimo ark 2001). GPX4‟ün sperm olgunlaĢması sırasında en az üç farklı iĢlevleri vardır. GPX2‟nin ve GPX3‟ün sırasıyla gastrointestinal sistemde ve böbrekte anlatımı vardır (Brown ve Bicknell ark 2001). GPX3 katalitik olarak TNXRD sistemi tarafından düzenlenebilir (Jiang ve ark
9
2001). Tioredoksin redüktazın GPX3 gibi böbrekte gen anlatımı olmaktadır (Jones ve ark 2000).
Tüm glutatyon peroksidazlar substrat olarak glutatyonu kullanarak H2O2 indirgenmesini katalizleyebilir. GPX ile hidroperoksitlerin azaltılması için önerilen katalitik mekanizma aktif bölgedeki selenolatın selenenik aside oksitlenmesini içerir (Jones ve Vale 2000). Bazı veriler GPX enziminin fizyolojik koĢullar altında yüksek antioksidan önemi olması gerektiğini belirtirken (Kaltschmidt ve ark 1999), diğerleri oksidatif stresin varlığında enzimi önemli olarak kabul eder (Kanner ve Lapidot 2001). GPX1 geni susturulan farelerin normal geliĢim gösterebilmektedirler, hatta hiperoksik oksidatif strese maruz kaldıklarında bile bu stres ile yaĢamlarını sürdürebilmektedirler (Kasprzak 2002). Böylece antioksidan savunmada GPX izoenzimlerin fonksiyonu hala belirsizdir. Ancak kinetik özellikleri ve yaygın görüĢ bu enzimin oksidatif hasara karĢı savunmada katkısının büyük olduğu düĢünülür. 1.3. Moleküler Stres Yanıtı
Transkripsiyon faktörlerinin miktarının kontrol edilmesi aktivesinin düzenlenmesinde önemli rol oynar. Herhangi bir zamandaki protein miktarı proteinin degradasyonu ve sentezlenmesi arasında oluĢan denge ile belirlenir. Protein sentezi gen transkripsiyonu, mRNA (mesajcı ribonükleik asit) translasyonu ve protein posttranslasyonal modifikasyonlarını barındıran evrelerden meydana gelir. Protein degradasyonu otofaji-lizozom, ubikitin-proteazom ve kalpain yollaklarını barındıran evrelerden oluĢur. Proteinin hücredeki düzeyini protein degradasyonundaki değiĢiklikler önemli bir Ģekilde etkileyebilir. Protein degradasyonuna ait fonksiyon bozukluğu, hücre canlılığını da etkileyen kritik genlerin hızlı anlatımını organize eden transkripsiyon faktörlerinin hızlı bir Ģekilde birikmesine sebep olur.
Trankripsiyonal aktivatörlerden transkripsiyon faktörü Nrf2 kuvvetli bir aktivatördür. Oksidatif streste görevli birçok hücre savunucu geni indükler, bu genlerin anlatımının organizasyonunda merkezi bir rol oynar (Itoh ve ark 2003, Motohashi ve Yamamoto 2004). Ksenobiyotik metabolizmada, ilaç taĢınmasında, glutatyon genlerinde ve reaktif oksijen türlerinin ortadan kaldırılmasında Nrf2‟nin hedef genleri görev almaktadır (Okawa ve ark 2006, Yates ve ark 2009).
10 1.3.1. Nrf2 ve Keap1 Molekülleri
Cap‟n‟Collar ailesinin alt üyesi olan Nrf2 transkripsiyon faktörü bir çok türde korunmuĢ bZip bölgesine (LLLLLL) sahiptir (Alam 2006). DNA bağlayan bölgelerinin N-terminal ucunda 43 aminoasitlik bölgesi bu ailenin ortak özelliğidir. Bu ailenin transkripsiyon faktörleri geliĢimsel ve homeostatik yolaklarda görev alırlar, hücresel strese karĢı yanıtta ise önemli rolleri vardır (Alam 2006). Altı transkripsiyon faktörü bu aileye ait olarak tanımlanmıĢtır: p45, Nrf1, Nrf2, Nrf3, Bach1 ve Bach2 (Tkachev ve ark 2011). Bunların dokulara ait farklı iĢlevleri vardır ve farklı dokularda anlatımı yapılır. Bu proteinler aktif dimerler oluĢturabilirler. Bağladıkları faktöre göre ARE ile iliĢkili, genelde düzenleyici yolaklarda gen anlatımını değiĢtirebilirler. Genlerin anlatımını arttıran üyelere örnek olarak p45, Nrf1, Nrf2, Nrf3; genlerin anlatımını azaltan üyelere örnek olarak Bach1 ve Bach2 verilebilir (Alam 2006). Oksidatif strese karĢı hücrenin transkripsiyonel yanıtını yöneten Nrf2 bu ailenin en çok araĢtırılan üyesidir (Sykiotis ve Bohmann 2010).
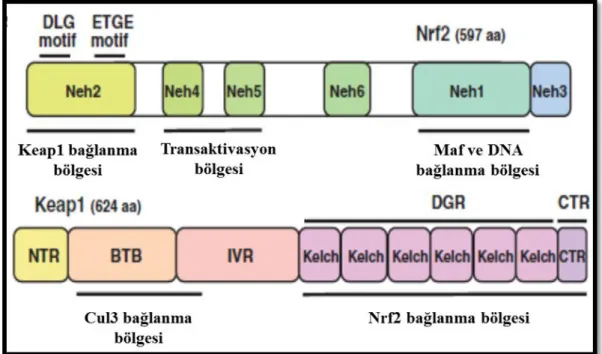
Nrf2‟nin moleküler araĢtırmasında altı adet Neh domaini tarif edilmiĢtir. Nrf2‟nin Keap1‟e-bağımlı degradasyonu için Nrf2‟nin N-terminal bölgesinde bulunan Neh2 domaini gereklidir (McMahon ve ark 2003, 2004, Zhang ve ark 2004). Bu domain DC domain Ģeklinde isimlendirilmiĢtir (Tong ve ark 2006). Tiyol açısından oldukça zengin bir protein olan Keap1 reaktif özellik göstermektedir. Elektrofillerin ilk hedefleri reaktif tiyollerdir ve birçok elekrofilik reaktifin aracı molekül olmadan tiyolleri modifiye ettiği gözlemlenmiĢtir (Holland ve ark 2008; Satoh ve ark 2008; Kobayashi ve ark 2009; Sekhar ve ark 2010) (ġekil 1.1.).
11
ġekil 1.1. Nrf2 ve Keap1 domain yapısı. Nrf2 proteini altı domainli bir yapıya sahiptir. Neh1 Maf protein ve DNA bağlanma noktasıdır. Keap1 ile bağlanmasını Neh2 domaini sağlar ve türler arası korunmuĢtur. Neh4 ve Neh5 CBP‟ye bağlanmakta olan transaktivasyon domainleridir. N-terminal bölge, Cul3 bağlanma bölgesi, IVR (ara bölge), DC domaini (C-terminal bölge ve Altı Kelch-tekrar alanı), Keap1 proteininin yapısında bulunmaktadır. Cul3 ile bağlantılı olduğu için bu domain ve IVR domaini önemli olduğu kabul edilir. Nrf2'nin Neh2 domaini DC domaini ile etkileĢime girmektedir (Taguchi ve ark 2011).
1.3.2. Nrf2/Keap1 EtkileĢimi
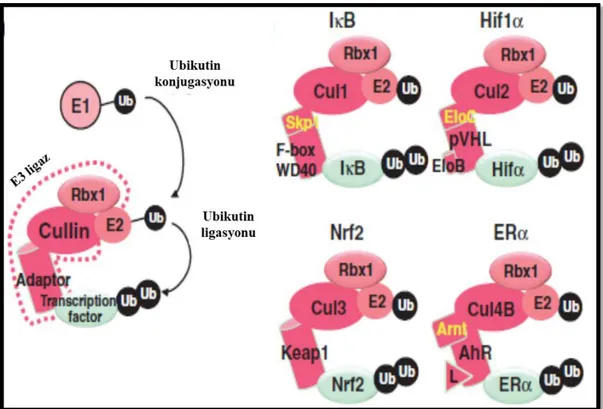
Nrf2‟nin aktivitesinin organize edilmesinde Keap1 (Kelch-like ECH associated protein1) gereklidir. Normal koĢullarda, Nrf2 Keap1‟e bağlı olarak ubikitin-proteazom yolağıyla degrade olmaktadır (Sekhar ve ark 2002, McMahon ve ark 2003, Kobayashi ve ark 2004) (ġekil 1.2.). Oksidatif stress varlığında, Keap-1‟in IVR bölgesindeki S grupları arasında disulfit bağı oluĢur. Keap-1‟de konformasyonel değiĢiklik ortaya çıkar ve Nrf2‟yi tutamaz. Serbest kalan Nrf2 nükleusa transloke olur. Nükleusta Maf ile heterodimer oluĢturarak ARE bölgesine bağlanır. Nrf2‟den ayrılan Keap-1 ubikitin ile birleĢir ve 26S proteazom aracılığı ile yıkılır. Nükleusta biriken Nrf2, küçük Maf proteinlerine bağlanır ve ARE/EpRE aracılığıyla ilgili genleri aktifleĢtirir (Itoh ve ark 2004) (ġekil 1.3.). Nrf2 proteini seviyesi degradasyon süreci tarafından kontrol edilir. Normal Ģartlarda Nrf2‟nin yarılanma süresi 20
12
dakikadır (Katoh ve ark 2005). Bu sayede düĢük konsantrasyonda sitoplazmik Nrf2 devamlı korunur.
ġekil 1.2. Nrf2'nin degradasyonu; Cullin tabanlı ubikitin E3 ligazın ubikitinasyonu. Protein ubikitinasyonu E1 aktifleĢtirici, E2-bağlayıcı ve E3 ligaz enzimlerinin aracılığı ile gerçekleĢen üç basamaklı bir iĢlemdir. Çevresel cevaplarında görev alan transkripsiyon faktörlerinin aktiviteleri protein degradasyon seviyede organize edilir. Keap1 Nrf2 ubikitinasyon için Cul3 bazlı E3 ligaza bir uyarlayıcı olarak görev yapar (Taguchi ve ark 2011).
1.3.3. Nrf2 ile Anlatımı Kontrol Edilen Genler
Oksidatif stres ile bağlantılı Nrf2 sinyal yolağının genlerinin %1-10‟unun anlatımını etkilediğini göstermektedir (Kwak ve ark 2003, Tkachev ve ark 2011). Oksijen hücrede hasara neden olmadığı zaman Nrf2 aktivitesi ortadan kalkmamakta, minumum düzeyde devam etmektedir. Bu sayede Nrf2 hücrenin antioksidan savunma sistemini kontrol etmektedir (McMahon ve ark 2001, Motohashi ve Yamamoto 2004). Nrf2 sinyal yolağı tarafından düzenlenen genlerin görevleri yapılan moleküler çalıĢmalarla belirlenmiĢtir. Antioksidan enzimlerin antalımını, NAD(P)H sentezini, glutatyon sentezini/rejenerasyonunu, detoksifikasyonu uyardığı bilinmektedir (ġekil 1.3.). Nrf2 sinyal yolağı ile anlatımı değiĢen, oksidatif stres ile doğrudan bağlantısı olmayan genler hasarlı proteinlerin hücredeki moleküler
13
mekanizmasında rol oynamaktadır. Ayrıca diğer transkripsiyon faktörlerinin ve reseptörlerin gen anlatımını düzenlediği, sitokin aracılı enflamasyonu inhibe ettiği bilinmektedir (Kensler ve Wakabayashi 2010).
ġekil 1.3. Nrf2 sinyal yolağıyla ilgili genlerin anlatımının kontrolü (Taguchi ve ark 2011).
Nrf2 molekülü kendi mRNA sentezini uyarır (Kwak ve ark 2002). Hücrenin oksidatif strese maruz kalması durumunda sinyal yolağının aktivitesini arttırır.
14
Nrf2/Keap1 kompleksi hücre iskeletine veya fosfogliserat mutaz 5 (PGAM5) ile bağlanarak mitokondrinin dıĢ membranına tutunabilir (Lo ve Hannink 2008). Mitokondri membranına yerleĢen Nrf2 kompleksinin miktarı sitoplazmada bulunun Nrf2 miktarından oldukça düĢük olmasına karĢın mitokondrideki hasarın nukleusa iletilmesinde önemli bir rol oynadığı rol oynadığı düĢünülmektedir. Nrf‟nin aktivasyonunu kontrol eden hücre içi sinyal yolakları vardır. Bunlara örnek olarak PKC (protein kinaz C), PI3K (fosfatidil inozitol 3 kinaz), JNK (c-Jun N terminal kinaz), ERK (hücre dıĢı sinyal ile düzenlenen protein kinaz) yolakları verilebilir (Kensler ve Wakabayashi 2010). PKC‟nin Nrf2‟yi fosforillenmesi Keap1 ile etkileĢimini azaltmaktadır (Huang ve ark 2002). Yapılan in vitro çalıĢmalarda inhibe edilen PI3K, Nrf2‟nin nükleusa translokasyonunu engellemiĢ ve ilgili genlerin anlatımını azaltmıĢtır (Lee ve ark 2001).
Nrf2 sinyal yolağı tarafından uyarılan genlere örnek olarak HO1, NQO1, GSTP, GCLC, GR, TXNRD verilebilir (Cheng ve ark 2011, Tkachev ve ark 2011). Nrf2 transkripsiyon faktörlerinin aktivitesini düzenlemektedir. Ġnhibe ettiği transkripsiyon faktörlerine örnek olarak NF-кB verilebilir. NF-кB‟nin Nrf2 aracılığıyla inhibe edilmesi proinflamatuvar genlerin anlatımını azaltmaktadır. Akut inflamasyonla ilgili genlerin çoğunluğunun NF-кB ile uyarıldığı bulunmuĢtur (Carayol ve ark 2006). Ayrıca karaciğer hücrelerinde Nrf2‟nin aktivasyonu lipit ve kolesterol biyosentezi ve metabolizmasında iĢlevi olan enzimlerin anlatımını azaltmıĢtır (Kwak ve ark 2003).
1.4. Erken Gebelikte Antioksidan Savunma Sistemi
Koyunlar 6-9 aylık dönemde pubertasa, 9-15 aylık yaĢ aralığında yetiĢtirme olgunluğuna eriĢirler, mevsimsel poliöstrik hayvanlardır ve östrus siklusları 16–18 gündür (Horoz ve ark 2003). Östrus coğrafi konum, ırk, yaĢ gibi faktörlere bağlı olarak 20-72 saat sürer. Koyunlar günler kısalmaya ve sıcaklıkların düĢmeye baĢladığı zaman, sonbahar döneminde östrus gösterirler. Türkiye‟de eylül ve ekim ayları tohumlama için en uygun dönemdir. Tropikal bölgelerde yetiĢen merinos gibi koyun ırklarında ise belirli bir çiftlesme mevsimi bulunmamakla birlikte reprodüktif faaliyetler yıl boyu devam etmektedir. Östrus siklusu ortalama 17 gün sürmesine rağmen çevresel Ģartlardan etkilenebilmektedir (Anderson ve ark 1987, Callaghan 1999). Koyunlarda seksüel siklus evreleri proöstrus (2 gün), östrus (2 gün),
15
metöstrus (2 gün) ve diöstrus (11 gün) olarak birbirini takip eden dört evreden oluĢur. Bu evreler çiftleĢme mevsiminde gözlemlenir; çiftleĢme mevsimi dıĢı anöstrus olarak isimlendirilir. Hipotalamus, hipofiz ve ovaryum seksüel siklusu düzenler; proöstrus ve östrus foliküler fazı, metöstrus ve diöstrus luteal fazı oluĢturan evrelerdir (Barrett 2007).
Progesteron foliküler geliĢimi kontrol eden gonadotropin salınımını baskılar. Günlerin kısalmaya baĢlaması ile birlikte gün ıĢığına maruz kalma süresi kısalmaktadır, bu durum melatonin salınımını uyarır (Callaghan 1999). Artan melatonin etkisiyle hipotalamustan gonadotropin releasing hormon (GnRH) salınımını uyarılır (Adashi 1990). GnRH adenohipofizden Folikül Stimülan Hormon (FSH) ve Lüteinizan Hormon (LH) salınımını uyarır. Bu gonadotropinler folikülogenezi uyarırlar (Anderson ve ark 1987). Kandaki GnRH, FSH ve LH hormonu; östrojen, progesteron ve inhibin salınımı için ovaryumu uyarır. Östrojen ve inhibin foliküldeki granüloza hücrelerinden; progesteron korpus luteumda (CL) bulunan luteal hücrelerde üretilmektedir (Ekiz 2005).
Siklusun ilk 12 günlük diliminde östrojen salınımında dalgalanmalar görülse de 13. günde ciddi bir artıĢ gözlenmeye baĢlar. Östrojen yoğunluğunun dolaĢımda artması folikül üzerinde LH reseptörlerini çoğaltır. Östrojen maksimum seviyeye ulaĢtığında (16. gün) ovaryumdan serbest kalan inhibin, adenohipofizde FSH üzerine negatif geri bildirim yapar ve FSH salınımı minumum düzeye düĢer (Barrett 2007). Diğer taraftan östrojen seviyesindeki artıĢa bağlı olarak LH salınımı uyarılmaktadır. LH etkisi ile olgunlaĢmasını tamamlayan folikül preovulatör LH piki etkisinin neticesinde ovule olur. Ovulasyon, östrüsun sonuna doğru, LH‟nın pik düzeydeki salınımdan yaklaĢık 20 saat sonra gerçekleĢir. Ovulasyon sonunda foliküllerde granüloza ve teka hücreleri LH‟nın etkisiyle luteinize olarak CL‟nin oluĢmasını sağlar. Siklusun ilk üç gününden itibaren CL‟den progesteron salgılanması baĢlar, progesteron sekizinci günde en üst seviyeye ulaĢır, bu durum ortalama 12–13. günde değiĢir. DüĢük östrojen ve yüksek progesteron etkisiyle gonadotropinler baskılanarak yeni östrus geliĢimi engellenir (ġekil 1.4.). Uterusta 12-14. günleri kapsayan dönemde gebelik ĢekillenmemiĢse, uterustan Prostaglandin F2 alfa (PGF2α) salgılanır, bu da CL‟nin yıkımlanmasını tetikler (Adashi 1990). Progestatif etkinin
16
ortadan kalkması ile gonadotropin salınımı baĢlar. Bu durum folikül geliĢimini uyarır. Böylece yeni bir siklus geliĢimi baĢlatılmıĢ olur (Anderson ve ark 1987).
Ovulasyon foliküllerinin geliĢimi ve seçimi türlere özgüdür. Yumurtalık fonksiyonunun ve ovülasyondan implantasyona kadar blastosit geliĢimi birçok memeli türünde ortaktır ve ovülasyonu takip eder, korpus luteum menstrüel siklusun veya östrüs siklusunun luteal fazı sırasında yumurtalık folikülünden geliĢir, geliĢmekte olan yumurtalık foliküllerinin tarafından üretilen östradiol embriyo implantasyonu için endometriyumu hazırlamak için CL tarafından üretilen progesteron ile etkileĢime girer, oosit ve sperm buluĢması ve fertilizasyon oviduktun yani yumurta kanalının ampullasında gerçekleĢir, yumurtalık içinde erken embriyo geliĢimi takiben morulla implantasyonun gerçekleĢeceği uterusa göç eder, hücresel farklılaĢma ile birlikte sıvı ile dolu iç boĢluğun (blastocoel) görünüĢü: yüzey hücreleri trofoblast halini alır ve plasenta dahil olmak üzere ekstra embriyonik dokuları oluĢturur; iç hücre kitlesi ise embriyoyu oluĢturur, blastositin endometriyuma yönelmesini, tutunmasını ve yapıĢmasını takiben zona pellusida atımı olur. Blastosit mevcut değilse, CL geriler ve uterus tekrar döngüyü baĢlatır. Implantasyon zamanı gebelik uzunluğundan bağımsız olarak memeli türleri arasında farklılık gösterir. Ġnsanlarda, atlarda, primatlarda ve kemirgenlerde implantasyon blastosit yumurtadan çıktıktan kısa bir süre sonra gerçekleĢmesinin aksine, geviĢ getiren hayvanlarda ve domuzlarda blastosit implantasyondan önce uzar (Al-Gubory ve ark 2010) (ġekil 1.4.).
17
ġekil 1.4. Memeli diĢi üreme organları, erken embriyonik geliĢim ve implantasyon diyagramı.
Hücresel reaktif oksijen türleri (ROS) ve antioksidanlar ile radikallerin kontrolü diĢi üreme fizyolojisinin konuları arasındadır. GeliĢime ve farklılaĢma süreçlerinin baĢlatılmasında rol oynadığı bilinmektedir (Sohal ve ark 1988, Allen ve Balin 1989, Allen ve Venkatraj 1992). Östrüste ovülasyon, fertilizasyon, embriyonun oviduktan uterusa taĢınması ve migrasyonu gebelikte maternal kabulü içine alan süreçte gerçekleĢir. Embriyonik kayıpların önemli bir kısmı bu dönemde görülmektedir (Balı 1993). Bu sebeple gebeliğin önemli safhalarından biri olarak değerlendirilir. Hipoksik ortam oksijen homoestazının geliĢimsel kontrolünde esastır (Iyer ve ark 1998). Koyunlarda peri-implantasyonda anjiyojenez düzenlenmesindeki rolü (Nau ve ark 2002) göz önüne alındığında erken embriyonik plasental geliĢimde ve büyümede gerekli olduğu düĢünülmektedir (Dunwoodie 2009). ROS‟un fizyolojik değerleri folikülogenezde, oosit olgunlaĢmasında, embriyonik implantasyonda, feto-plasental geliĢimde ve benzeri birçok olayda düzenleyici bir rol oynamaktadır (Agarwal ve ark 2008). Yani baĢarılı bir fertilizasyon ve implantasyon ROS‟un konsantrasyonundan etkilenebilmektedir. Ayrıca östrojenin ve progesteronun pro-oksidan ve antipro-oksidan parametrelerini etkilediği ve gebelik gibi fizyolojik süreçlerde antioksidan savunma sisteminde değiĢikliklerin görülebileceği düĢünülmektedir (Sharma ve Agarwal 2004). ROS‟un memeli hücrelerinde ikincil sinyal molekülü
18
olarak (Khan 1995, Remacle ve ark 1995; Finkel 1998, Thannickal ve Fanburg 2000) hücre fonksiyonunu, büyümesini, farklılaĢmasını ve ölümünü düzenlemek için gen anlatımını ve protein posttranslasyonel değiĢimlerini (Palmer ve Paulson 1997, Allen ve Tresini 2000) etkilediği yönünde artan kanıtlar vardır (Dröge 2002, Valko ve ark 2007) (ġekil 1.5.).
ġekil 1.5. ROS‟un üretimi ve anahtar hücresel antioksidan enzim yolakların Ģematik gösterimi. Süperoksit oluĢumu ROS oluĢumunun ve yayılmasının hücre içinde ve dıĢında ilk adımıdır. Radikalin oluĢumu diğer ROS‟ların kademeli olarak oluĢmasına yol açar. Memeli hücreleri ROS üretimini ve ilerlemesini kontrol etmek için antioksidan mekanizmalar vardır. Bu mekanizmanın ana enzimleri; SOD1, SOD2, CAT, GPX, GSR, G6PDH (glukoz 6 fosfat dehidrogenaz) koordineli olarak oksidatif strese bağlı fonksiyonel değiĢiklik gösterir ve doku hasarına karĢı savunma ağını harekete geçirir (Al-Gubory ve ark 2010).
Endometriyumda serbest oksijen türlerinin birkaç potansiyel kaynağı bulunmaktadır. Bunlar, normal metabolizma ürünleri olarak üretilen reaktif oksijen türlerinde stroma hücreleridir. Hücrelerarası reaktif oksijen türleri mitokondrial elektron taĢıma sistemi, endoplazmik retikulum, hücresel zar elektron taĢıma sistemleri ve plazma zarlarını kapsamaktadır (Freeman ve Crapo 1982).
19
Hipoksiya oksijen homeostazının geliĢimsel süreçte kontrolünün temelidir (lyer ve ark 1998). Erken dönemde embriyo ve plasenta geliĢimi için gerekli olduğu düĢünülmektedir (Dunwoodie 2009). Ġnsanlarda (De Marco ve Caniggia 2002), farelerde (Daikoku ve ark 2003) ve koyunlarda (Nau ve ark 2002) peri-implantasyon esnasında anjiyojenezin düzenlenmesini sağlamaktadır. Normal plasental trofoblast apoptozunun hipoksi ve oksidatif stres ile baĢlatılabildiği gösterilmiĢtir (Sharp ve ark 2010). Apoptoz erken embriyonik geliĢim sırasında hücrelerin ortadan kaldırılması sağlamaktadır (Pierce ve ark 1989). Ayrıca endometriyum homeostazının embriyo implantasyonu sırasında korunmasında önemli rol oynamaktadır (von Rango ve ark 1998, Pampfer ve Donnay 1999, Tassell ve ark 2000, Fei ve ark 2001, Zhang ve Paria 2006). Östrüs ve menstrual siklusu sırasında yumurtalık folikülleri, korpus luteum ve uterus erken embriyonik geliĢimi ve gebelik için uygun hormonal ortam sağlamak amacıyla oldukça hızlı hücresel çoğalma, büyüme ve geliĢme göstermektedir. Endometriyum ve ekstra embriyonik zarlar arasında bir iletiĢim olduğu gibi gebelik oluĢumu sırasında konseptustan üretilen biyokimyasal ve moleküler sinyallere uterusun cevap vermesi gerekmektedir. Embriyonik implantasyon öncesi, endometriyum steroid hormonların sıralı etkileriyle geliĢme ve farklılaĢma aĢamalarına hazırlıklı olmalıdır (Schlafke ve Enders 1975, Bazer ve Roberts 1998). GeliĢmekte olan yumurtalık folikülleri tarafından üretilen östrojen ile CL tarafından üretilen progesteron, uterusu embriyo implantasyonuna hazırlamak için etkileĢim göstermektedir. CL fare, sıçan, hamster, tavĢan, köpek, domuz ve keçi de gebelik boyunca esas olmasına karĢın kedi, kobay, koyun, inek, at, makak ve insan gebeliği için daha az önemlidir (Ryan 1969).
Mayoz 2 ilerlemesi antioksidanlar tarafından teĢvik edilmektedir ve bu yumurtalıkta ROS ve antioksidanlar arasında kompleks bir iliĢki olduğunu göstermektedir (Behrman ve ark 1998). Ovaryum follüküllerin geliĢimi sırasında granüloz hücrelerinin hipoksi durumu fizyolojik açıdan normaldir (Tropea ve ark 2006). Oksijenin sınırlandırılmasının follükülerin büyüme ve geliĢim için önemli olan folliküler anjiogenezi stimüle ettiği bilinmektedir. Ovaryum folliküllerde anjiogenezin düĢüĢü folliküler atreziye katkı sağlamaktadır (Greenwald ve Terranova 1988). ROS sinyal dönüĢtürücü (Schroedl ve ark 2002) veya anjiyogenik yanıtta hücre içi haberci olarak (Pearlstein ve ark 2002) rol oynayabilmektedir.
20
BaĢarılı bir implantasyon için stroma hücrelerinin desidualizasyonu gereklidir. ROS ve SOD endometriyal fonksiyonun düzenlenmesinde önemli rol oynamaktadır (Sugino ve ark 1996) (ġekil 1.5.). Menstural siklus boyunca glandular epitelyumda Cu, Zn-SOD ve Mn-SOD varlığı immunohistokimyasal olarak gösterilmiĢtir (Sugino ve ark 1996). Proliferatif faz boyunca stromal hücreler Cu, Zn-SOD ve Mn-Zn-SOD için belirli bir immunohistokimyasal boyanma göstermemesine rağmen, orta-sekretuar fazda morfolojik desidualize değiĢikliklerden sonra stroma hücrelerinde Cu, Zn SOD‟de zayıftan orta dereceye ve Mn-SOD ise orta derece bir immunohistokimyasal boyanma saptanmıĢtır (Sugino ve ark 1996). Ayrıca, östrojen ve progesteron verilen hastaların endometriyumlarında ve erken gebelikte desidualize stroma hücrelerinde Cu, Zn-SOD ve Mn-SOD için yoğun bir immunohistokimyasal boyanma bulunmuĢtur (Sugino ve ark 1996). Üstelik, Cu, Zn-SOD ve Mn-Zn-SOD aktivitesi endometriyumda erken proliferatif fazdan orta-geç proliferatif faza doğru artıĢı ve orta sekretuar fazda artıĢı gözlenmiĢtir (Sugino ve ark 1996). Bu bulgular, desidualizasyondaki endometriyal stroma hücrelerinde Cu, Zn SOD ve Mn-SOD mRNA ve protein anlatımlarının artıĢı ile doğrulanmıĢtır (Kajihara ve ark 2006).
Gebelik ilerledikçe, oksijen basıncı periferik hücrelerin çevresinde azalmakta ve buna bağlı olarak ROS üretiminde de azalma gözlenmektedir. Ortalamadan düĢük oksijen basıncına maruz kalan yeni oluĢmuĢ hücrelerde mitokondri içinde manganez süperoksit dismutaz (MnSOD) gen anlatımını tetiklemek ve oksitleyici özelliği yüksek olan süperoksit nötralizasyonu sağlamak için fizyolojik lipid peroksidasyonu görülmektedir (Aurousseau ve ark 2004). Ayrıca lipid peroksidasyonu sayesinde membran oksidasyonunda azalma, transkripsiyon artıĢı, hücre proliferasyonu, farklılaĢması ve büyümesi gibi ROS aracılı etkilerin zayıflamasına yol açmaktadır (Moreira da Silva ve ark 2010). Koyunlarda gebeliğin 35. ve 55. günleri arasındaki GPx ve GSH artıĢı, ayrıca MnSOD faaliyetlerindeki azalma insanlarda gerçekleĢen olaylara paralellik göstermektedir (Jauniaux ve ark 2000; EriĢir ve ark 2009).
Bu çalıĢmanın amacı endometriyum dokusunun koyun gebeliğinin ve östrus siklusunun 13. gün gibi erken bir süresinde oksidatif stres altında olup olmadığının dolaylı olarak araĢtırılmasıdır. Antioksidan özelliğe sahip moleküllerin hücresel anlatımlarının endometriyumda embriyoya bağlı farklılıklarının belirlenmesi ve total
21
glutatyon düzeyi, lipid peroksidasyon ürünleri, antioksidan potansiyel ölçümü ile gebeliğin preimplantasyon aĢamasında endometriyal oksidatif hasarın biyokimyasal olarak ölçülmesi amaçlandı.
22
2. GEREÇ ve YÖNTEM
2.1. Deneysel Model ve Dokuların Toplanması
2.1.1. Hayvan Materyali
ÇalıĢmada veteriner hekim kontrolünden geçmiĢ, sağlık sorunu olmayan, 2-4 doğum yapmıĢ, kilo ve vücut kondisyon skorları birbirine yakın olan, Tarım ĠĢletmeleri Genel Müdürlüğü‟nden alınmıĢ 24 adet Anadolu Merinosu koyun ve 4 adet koç kullanılmıĢtır.
2.1.2. Gruplandırma
Dört haftalık adaptasyon süresini takiben kızgınlık senkronizasyonuna baĢlandı; birinci (31. gün) ve 10. günde (40. gün) 10 mg PGF2α verilen koyunlar 2. doz uygulamasından sonraki 4 gün boyunca arama koçu yardımıyla kızgınlıkları gözlenerek kaydedildi ve yaklaĢık 17 gün sonra (57. gün) koyunların bir sonraki kızgınlıkları yine arama koçları ile gözlemlenerek her iki gruptan kızgınlık gösteren koyunlar ayrı bir bölmede dölleme kabiliyeti test edilmiĢ koçlara verilerek gebe kalmaları sağlandı. Gebe ve gebe olmayan (östrus siklusu) koyunlar canlı ağırlık ve vücut kondisyon değerlerine göre iki gruba rastgele dağıtıldı ve her bir grup ayrı bir bölmede barındırıldı (ġekil 2.1.).
23 2.1.3. Barındırma ve Beslenme
Koyunlar EĢkiĢehir Osmangazi Üniversitesi Ziraat Fakültesi Ali Numan Kıraç YerleĢkesi içinde bulunan kapalı binalarda bulunan bölmeler modifiye edilerek kontrollü Ģartlarda barındırıldı. Ayrı bölmede barındırılan koyunlardan kızgınlık senkronizasyonu sonucu ikinci kızgınlığı gözlemlenenler gruplarına göre ayrı bir bölmede koça verilerek koçun aĢtığından emin olduktan sonra kesime kadar kendi grubunun olduğu bölmede barındırıldı.
Bütün gruplar TMR (total-mixed ration=toplam karıĢtırılmıĢ rasyon) olarak hesaplanan günlük ihtiyaçlarını karĢılayan rasyonlar ile beslendi. Ġzokalorik ve izonitrojenik olarak hazırlanan rasyonlar sabah ve akĢam olmak üzere günde iki eĢit öğün olacak Ģekilde verildi.
2.1.4. Örneklerin Toplanması
Her iki grupta bulunan koyunlardan, gebe olmayanlar kızgınlık gözlemlendikten 13 gün sonra ve gebelik grubunda olanlar koç aĢımından 13 gün sonra kesime alındı. Kesimden sonra 10 dakika içerisinde endometriyum örnekleri toplanıp sıvı nitrojen içerisinde dondurularak laboratuara getirildi ve -80oC‟de muhafaza edildi. Endometriyum örnekleri kontrol grubu koyunlarda aktif korpus luteuma ipsilateral cornu uteriden, gebe koyunlarda ise embriyonun olduğu kornudan toplandı.
2.2. Moleküler Analizler
2.2.1. Total RNA Ġzolasyonu
Endometriyal biyopsi örneği (~ 50 mg) 0,8 ml Trizol (Fenol/Kloroform, Trigent, ABD) içerisinde homojenize edildi. Homojenizatör ile dokunun tamamen parçalanmasının ardından RNA solüsyonu ependorf tüpe alındı. Ependorf tüpe alınan 800 μl solüsyon üzerine 200 μl kloroform eklenerek vorteksle karıĢtırıldı. Oda ısısında 10 dakika bekletilen örnekler soğutmalı santrifüjde +4°C sıcaklıkta 12000 rpm hızda 15 dakika santrifüj edildi. Süpernatant kısım baĢka bir ependorf tüpe alındı. YaklaĢık 500 μl süpernatant üzerine 500 μl isopropanol ilave edildi. KarıĢım alt üst edilerek 20 kez karıĢtırıldıktan sonra 10 dakika oda ısısında bekletildi. Daha sonra soğutmalı santrifüjde 12000rpm hızda +4°C sıcaklıkta 10 dakika santrifüj
24
edilerek RNA peletinin dipte çöktürülmesi sağlandı. Süpernatant tüpten uzaklaĢtırıldı. Pelet 3 defa (sırası ile %75, %75, %95) soğuk etanol ile +4°C‟de 7500 rpm hızda 5 dakika yıkandı. RNA peleti yeterince kurutulduktan sonra 50 μl steril DEPC-ddH2O (dietilpirokarbonatlı çift distile su) içerisinde çözdürüldü.
2.2.2. RNA Kalitesi ve Miktarının Belirlenmesi
Elde edilen total RNA kalitesi ve miktarının belirlenmesi için Nanodrop kullanıldı. Blank için RNA‟ların içerisinde çözündürüldüğü aperojen enjeksiyonluk ddH2O kullanıldı. Cihaz RNA okunma moduna alındı; 2 μl RNA örneği steril pipet ucu ile aletin okuma yüzeyine konularak ölçümler yapıldı. RNA miktarı ng/μl Ģeklinde belirlendi. Ġzolasyon sırasında oluĢabilecek fenol, protein ve genomik DNA kontaminasyonlarını belirlemek için A260/A280 ve A260/A230 oranları değerlendirildi. Oranları A260/A280 için 2±0,1 ve A260/A230 için 2,0-2,4 arasında olan RNA örnekleri cDNA (complementary DNA) yapımında kullanıldı.
RNA örneklerinin kalitesinin belirlenmesi amacıyla 1 μg/ 10 μl konsantrasyonundaki RNA üzerine 6X yükleme boyasından 2 μl konularak %1‟lik agaroz jelde yürütüldü. Etidium Bromür (EtBr) ile boyanan RNA bantları UV translüminatör üzerinde bant kalitesi gözle ve görüntüleme sisteminden alınan resim ile değerlendirilerek yapıldı. RNA jelinde 28S ve 18S rRNA (ribozomal ribonükleik asit) bantları 28S üzerindeki yüksek moleküler ağırlığa sahip RNA‟lar ve yükleme kuyucuklarında gDNA (genomik DNA) varlığına bakıldı (ġekil 2.2.). RNA kalitesi RNA‟nın smear oluĢturmasına ve 28S bant yoğunluğunun 18S bant yoğunluğundan 2 veya 2,5 katı olmasına bağlı olarak değerlendirildi.
25 2.2.3. Total RNA’dan DNaseI Enzimi ile Genomik DNA’nın UzaklaĢtırılması
Nanodropta ölçümleri yapılan RNA‟ların konsantrasyonları 1 μg/ 5 μl olacak Ģekilde DEPC-ddH2O kullanılarak eĢitlendi. Daha sonra DNaseI (Fermentas, ABD) enzim reaksiyonu üretici firmanın protokolüne göre uygulandı. Bu protokole göre 1 μg/ 10 μl total RNA üzerine 2 μl DNase I reaksiyon karıĢımı ve 2 μl DNase I enzimi konularak su banyosunda +37°C 30 dakika bekletildi. Reaksiyon durdurulması için 2 μl EDTA ilavesi ile +65°C su banyosunda 10 dakika inkübe edildi. ĠĢlem sonrasında gDNA kontaminasyon varlığının kontrol edilmesi için DNaseI ile muamele edilmiĢ RNA örnekleri ACTB (beta aktin) primer çifti ile polimeraz zincir reaksiyonunun (PZR) Touchdown protokolü kullanılara yükseltgendi. Bu iĢlem sonrasında %2‟lik agaroz jelde ACTB sinyali vermeyen RNA örnekleri gDNA‟dan ari kabul edildi.
2.2.4. Revers Transkripsiyon (RT) Reaksiyonu
DNaseI enzimi ile gDNA uzaklaĢtırılmasının ardından 1 μg/ 10 μl total RNA‟dan tek zincir cDNA üretilmesi RevertAid First Strand cDNA Sentez kiti (Fermentas, ABD) kullanılarak gerçekleĢtirdi. Buna göre 1 μl OligodT ve 1 μl Random hekzamer 1 μg/ 10 μl total RNA üzerine ilave edildi. Su banyosunda +70°C‟de 5 dakika bekletildikten sonra 8 μl 5X cDNA reaksiyon karıĢımı, 2 μl RNAse inhibitörü, 4 μl dNTP ilave edilerek +25°C su banyosunda 5 dakika bekletildi. Daha sonra 2 μl revers transkriptaz enzimi ilave edilerek önce +25°C‟de 10 dakika sonra +37°C‟de 60 dakika su banyosunda inkübe edildi. Reaksiyon +70°C su banyosunda 10 dakika bekletilerek durduruldu. Reaksiyon gerçekleĢip gerçekleĢmediği ve kalitesinin belirlenmesi amacıyla elde edilen cDNA kullanılarak ACTB primerleri ile TouchDown protokolü ile PZR‟de çoğaltıldı (ġekil 2.3.).
ġekil 2.3. cDNA‟ların ACTB primerleri ile yapılan PZR ürünlerinin %2‟lik agaroz jel görüntüsü.
26 2.2.5. Primer Dizaynı
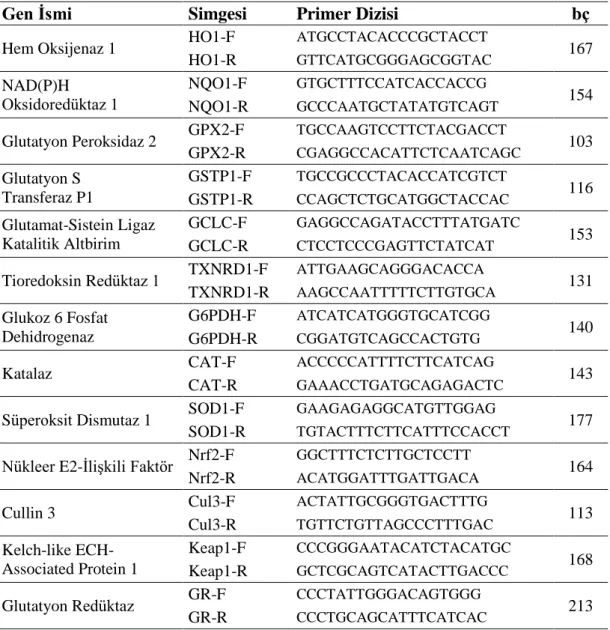
ÇalıĢmada kullanılacak genlerin mRNA ve DNA dizi bilgileri Gen Bankası (http://www. ncbi. nlm. nih. gov) üzerinden elde edildi. Alınan mRNA sekansları internetteki Primer Blast (http://www. ncbi. nlm. nih. gov/tools/) IDT primer dizaynı (http://eu. idtdna. com/home/home. aspx) ve Oligo7 (http://www. oligo. net/) primer dizayn programları ile dizayn edildi (Çizelge 2.1.). Primerlerin self ve/veya hetero dimer oluĢturmamasına dikkat edildi. Bu amaç için Wang ve Seed (2007)‟ın belirttiği kriterler göz önüne alındı. Primerlerin doğruluğu ve çoğaltılacak bölge Gen Bankasındaki BLAST programı ile kontrol edildi. Primerlerin çoğaltılacak olan bölge dıĢında koyun için bilinen farklı bir gen çoğaltmamasına dikkat edildi. Dizayn edilen PZR primerleri Macrogen firmasına sipariĢ edildi.
Çizelge 2.1. Primerlerin gen isimleri, singeleri, dizileri ve ürün boyutları (bç).
Gen Ġsmi Simgesi Primer Dizisi bç
Hem Oksijenaz 1 HO1-F ATGCCTACACCCGCTACCT 167
HO1-R GTTCATGCGGGAGCGGTAC NAD(P)H Oksidoredüktaz 1 NQO1-F GTGCTTTCCATCACCACCG 154 NQO1-R GCCCAATGCTATATGTCAGT
Glutatyon Peroksidaz 2 GPX2-F TGCCAAGTCCTTCTACGACCT 103
GPX2-R CGAGGCCACATTCTCAATCAGC Glutatyon S Transferaz P1 GSTP1-F TGCCGCCCTACACCATCGTCT 116 GSTP1-R CCAGCTCTGCATGGCTACCAC Glutamat-Sistein Ligaz Katalitik Altbirim GCLC-F GAGGCCAGATACCTTTATGATC 153 GCLC-R CTCCTCCCGAGTTCTATCAT
Tioredoksin Redüktaz 1 TXNRD1-F ATTGAAGCAGGGACACCA 131 TXNRD1-R AAGCCAATTTTTCTTGTGCA Glukoz 6 Fosfat Dehidrogenaz G6PDH-F ATCATCATGGGTGCATCGG 140 G6PDH-R CGGATGTCAGCCACTGTG
Katalaz CAT-F ACCCCCATTTTCTTCATCAG 143
CAT-R GAAACCTGATGCAGAGACTC
Süperoksit Dismutaz 1 SOD1-F GAAGAGAGGCATGTTGGAG 177
SOD1-R TGTACTTTCTTCATTTCCACCT
Nükleer E2-ĠliĢkili Faktör Nrf2-F GGCTTTCTCTTGCTCCTT 164
Nrf2-R ACATGGATTTGATTGACA
Cullin 3 Cul3-F ACTATTGCGGGTGACTTTG 113
Cul3-R TGTTCTGTTAGCCCTTTGAC Kelch-like ECH-Associated Protein 1 Keap1-F CCCGGGAATACATCTACATGC 168 Keap1-R GCTCGCAGTCATACTTGACCC
Glutatyon Redüktaz GR-F CCCTATTGGGACAGTGGG 213
27 2.2.6. Primer Sulandırılması
Liyofilize haldeki primerler 100 pMol/ μl konsantrasyonunda olacak Ģekilde DEPC-ddH2O içersinde çözdürüldü. Daha sonra her bir genin forward ve revers primerleri eĢit miktarlarda karıĢtırılarak primer alt stoğu hazırlandı. Ana stokta -20°C‟de muhafaza edildi.
2.2.7. Housekeeping Gen Seçimi
Housekeeping gen (HKG) seçimi için kullanılacak olan primerlerin (GAPDH (gliseraldehid fosfat dehidrogenaz), ACTB, HPRT1 (hipoksantin guanin fosforibozil transferaz 1), RPL32 (ribozomal protein L32), SDHA (süksinat dehidrogenaz subünit A) ve YWHAZ (tirozin 3-monooksijenaz/triptofan 5-monooksijenaz aktivasyon protein)) bilgileri gen bankası üzerinden alındı (Çizelge 2.2.).
Çizelge 2.2. Primer dizileri ve ürün boyutları (bç).
Primer Dizisi bç ACTB-F GGACCTGACGGACTACCTCATG 136 ACTB-R GGCCATCTCCTGCTCGAAGT GAPDH-F TCCATGACCACTTTGGCATCGT 80 GAPDH-R GTCTTCTGGGTGGCAGTGA HPRT1-F AGGTGTTTATTCCTCATGGAGTAATTATG 79 HPRT1-R GGCCTCCCATCTCCTTCATC RPL32-F GGCACCAGTCAGACCGATATG 75 RPL32-R TGCGCACCCTATTGTCAATG SDHA-F CATCCACTACATGACGGAGCA 90 SDHA-R ATCTTGCCATCTTCAGTTCTGCTA YWHAZ-F TGTAGGAGCCCGTAGGTCATCT 102 YWHAZ-R TTCTCTCTGTATTCTCGAGCCATCT
2.2.8. Primer Dilüsyonları ile Primer Etkinliğinin Belirlenmesi
Örneklerden elde edilen cDNA 1/1, 1/2, 1/4, 1/8 ve 1/16 Ģeklinde sulandırıldı. Bu sulandırmalardan her primer için RT-qPZR yapıldı (ġekil 2.5.). Dilüsyonlar değerleri kullanılarak primerlerin etkinliği LightCycler® Nano Software 1.0 ile hesaplandı (ġekil 2.4.).
28
ġekil 2.4. Temsili primer etkinliği grafiği ve denklemi.
ġekil 2.5. Temsili primer dilüsyonu %2‟lik agaroz jel görüntüsü ve Cq (cycle threshold) grafiği.
2.2.9. Real Time Polimeraz Zincir Reaksiyonu (RT-qPZR)
Elde edilen cDNA‟lardan spesifik primerleri kullanılarak araĢtırılacak gen RT-qPZR‟da çoğaltıldı. Genlerin siklik ve gebe dönemlerindeki gen anlatımı farklılıklarının belirlenmesi amaçlandı. Boya olarak çift iplikçikli DNA‟ya
29
bağlanabilen SyberGreen kullanıldı. Reaksiyon SyberGreen içeren 2X olan master miskten (Fermentas, ABD) 1X olacak Ģekilde; 5 μl miks, 500 pMol forward primer, 500 pMol revers primer, 2 μl cDNA ve toplam volümü 10μl olacak Ģekilde steril ddH2O ile tamamlandı. Reaksiyon steril 8‟li PZR tüpleri içinde gerçekleĢtirildi. Reaksiyonun ısı profili +95°C‟de 5 dakika, 40 döngü (95°C‟de 15 saniye, 60°C‟de 30 saniye, 72°C‟de 30 saniye) olacak Ģekilde ayarlandı. Optik ölçümler her siklusun 60°C‟deki bağlanma ısısının hemen bitiminde cihaz tarafından otomatik olarak yapıldı. Daha sonra 60°C„den 95°C‟ye kadar saniyede 0,1°C olacak Ģekilde kademeli olarak ısıtıldı ve bu ısılar içerisindeki her 1°C artıĢta optik ölçümler yapılarak melting curve (erime eğrisi) analizi gerçekleĢtirildi (ġekil 2.6.).
ġekil 2.6. Temsili erime eğrisi grafiği.
RT-qPZR‟de optik analiz sonucu elde edilen veriler Cq olarak kayıt edildi. Negatif kontrol olarak cDNA yerine aynı miktarda ddH2O içeren solüsyon kullanıldı. RT-qPZR‟de elde edilen ürünler %2‟lik agaroz jel de yürütülüp bant büyüklükleri gözlemlenerek doğru ürün olduğu teyit edildi (ġekil 2.7.).
30
ġekil 2.7. Cul3 RT-qPZR ürünlerinin %2‟lik agaroz jeldeki görüntüsü; örnek ID‟leri 3-30. (temsili).
2.3. Biyokimyasal Analizler
Koyun endometriyum dokusunda oksidatif stres parametreleri antioksidan kitleri ile yapıldı. LPO düzeyleri LPO-586TM Oxis research kiti ile, GSH Oxis researh-420TM kiti ile ve antioksidan kapasite ise Sigma-Aldrich Antioksidant assay CS 0790 kiti ile spektrofotometrik olarak ölçüldü.
2.3.1. Mekanik Homojenizasyon ve Sonikasyon
Doku örnekleri (50 mg) 1500 devir/dakika‟da mekanik olarak homojenize edildi, ardından da 5 sn süreli 30 sn soğutmalı 5 tekrar olarak sonike edildi.
2.3.2. Antioksidan Düzeylerinin Ölçümü
GSH düzeylerinin belirlenmesi
GSH düzeyleri GSH-420TM (OxisResearchTM, Bioxytech, CA, 92202, USA) kiti ile spektrofotometrik olarak belirlendi. Kit kromoforik tion oluĢumuna dayalı olarak ölçüm yapmaktadır. 420 nm‟de ölçülen absorbans, GSH konsantrasyonu ile doğru orantılıdır.
Homojenize edilen doku örnekleri 4°C'de 10 dakika 3000 g'de santrifüj edildi. Üst faz toplandı. Ependorfa 200 μl örnek veya kalibratör çözeltisi konuldu. Reaksiyon karıĢımına sırayla 200 μl tampon, 200 μl indirgeme maddesi, 200 μl