ASPİR BİTKİSİNDE EKİM ÖNCESİ HİDROPRİMİNG UYGULAMALARININ FİZYOLOJİK VE
BİYOKİMYASAL ETKİLERİ Burhan KARABAKAN
Yüksek Lisans Tezi Biyoloji Anabilim Dalı
Moleküler Biyoloji ve Genetik Programı Tez Danışmanı: Doç.Dr. Gökhan SADİ Tez Eş Danışmanı: Doç.Dr. Muhammad AASIM
Nisan-2017
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
ASPİR BİTKİSİNDE EKİM ÖNCESİ HİDROPRİMİNG UYGULAMALARININ FİZYOLOJİK VE BİYOKİMYASAL ETKİLERİ
YÜKSEK LİSANS TEZİ Burhan KARABAKAN
Anabilim Dalı: Biyoloji
Programı: Moleküler Biyoloji ve Genetik
Tez Danışmanı: Doç. Dr. Gökhan SADİ Tez Eş Danışmanı: Doç. Dr. Muhammad AASIM
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i
ÖZET
Yüksek Lisans Tezi
ASPİR BİTKİSİNDE EKİM ÖNCESİ HİDROPRİMİNG UYGULAMALARININ FİZYOLOJİK VE BİYOKİMYASAL ETKİLERİ
Burhan KARABAKAN
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyoloji Anabilim Dalı
Danışman: Doç. Dr. Gökhan SADİ
Tez Eş Danışmanı: Doç. Dr. Muhammad AASIM Nisan, 2017, 58 Sayfa
Gerçekleştirilen bu çalışmada farklı LED ışık kaynakları altında gerçekleştirilen hidropriming uygulamalarının Aspir bitkisinin (Carthamus tinctorius L.) tohum çimlenme, büyüme ve gelişmesi üzerine etkileri araştırılmıştır. Ayrıca hidropriming ve farklı ışık kaynaklarının etkileri biyokimyasal olarak incelenmiştir. Aspir tohumlarında oksidan/antioksidan biyobelirteçler (fenolikler, flavonoidler, β -karoten, likopen, toplam antioksidan kapasite (TAK), toplam oksidan kapasite (TOK), indirgeme gücü, DPPH radikal yakalama aktivitesi ve antioksidan enzim aktiviteleri) incelenerek tohumlarda meydana gelen biyokimyasal değişimler ortaya çıkarılmış ve fizyolojik değişimlerle ilişkilendirilmiştir. Çalışma sonuçları, ekim öncesi hidropriming uygulama süresi artıkça Aspirin köklenme ve gelişiminin belirli oranlarda baskılandığını göstermiştir. Karanlık ortamda ve farklı ışık kaynakları altında gerçekleştirilen hidropriming uygulamalarının genel olarak tohum antioksidan madde içeriğini (flavonoid, β-karoten, likopen, TAK, DPPH radikal yakalama aktivitesi, indirgeme gücü) yükselttiği, tohum oksidan kapasitesinde de kısmi bir artışa neden olduğu belirlenmiştir. TOK düzeyinde belirlenen artış, toplam fenolik madde içeriğindeki azalmayla açıklanmıştır. Ayrıca, ana antioksidan enzimlerinin Aspir tohum biyokimyasal içeriklerinin değişimiyle adaptif cevapla düzenlendikleri ortaya çıkarılmıştır. Bulgular, farklı ışık kaynakları altında gerçekleştirilen hidropriming uygulamalarının Aspir tohum antioksidan kapasitesini arttırarak tarımsal verimliliği arttırmada kullanılabilecek yöntemlerin araştırıldığı diğer çalışmalara öncül olabilecek niteliktedir.
ii
ABSTRACT MS Thesis
PHYSIOLOGICAL AND BIOCHEMICAL EFFECTS OF HIDROPRIMING APPLICATIONS IN SAFFLOWER PLANTS
Burhan KARABAKAN
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Biology
Supervisor: Assoc. Prof. Dr. Gökhan SADİ Co-Supervisor: Assoc. Prof. Dr. Muhammad AASIM
April, 2017, 58 Pages
Effects of hydropriming applications under different LED lights on seed germination, growth and development of safflower plants (Carthamus tinctorius L.) were investigated in this study. Moreover, biochemical effects of hydropriming and light sources were also studied. Oxidant and antioxidant biomarkers (phenolics, flavonoids, β-carotene, lycopene, total antioxidant species (TAS), total oxidant species (TOS), reducing power, DPPH radical scavenging activity and antioxidant enzyme activities) were evaluated in safflower in order to reveal the interrelations between physiological and biochemical alterations. The results demonstrated that increasing the time of hydropriming suppreses the root growth and development of safflower plants upto some extent. In general, hydropriming applicaions in dark and under different light sources were found to amplify the seeds’ antioxidant components (flavonoids, β-carotene, lycopene, TAS, DPPH scavenging activity and reducing power) together with an partial increase in seeds total oxidants. The rise in total oxidant status could be associated with a decline in total phenolic compounds. Furthermore, the main antioxidant enzymes were found to be regulated with an adaptive response to biochemical alterations in safflower seeds. The results of this study will direct the further studies concerning agricultural yields of safflower plants, since antioxidant capacity were found to be augmented in response to hydropriming applications carried out under different light sources.
iii
ÖN SÖZ
Yüksek lisans öğrenimim boyunca, tez konusunun planlanması ve değerlendirilmesi aşamasında ilgi ve desteğini esirgemeyen danışmanım Doç. Dr. Gökhan SADİ' ye, tohum örneğinin temininde, teşhisinde ve deneylerde kullanılmasında ve çalışmalarım sırasında bitki fizyolojisi alanındaki bilgilerinden yararlandığım sayın Doç. Dr. Muhammad AASIM' a teşekkürlerimi sunarım.
Tez çalışmalarında kullanılan Aspir tohumlarını temin eden Dr. Sibel DAY’ a teşekkür ederim.
Yüksek lisans eğitimim süresince aynı laboratuvarı paylaştığım çalışma arkadaşlarıma teşekkür ederim.
Hayatım boyunca maddi manevi her türlü konuda yanımda olup desteğini esirgemeyen aileme sonsuz teşekkürlerimi sunuyorum.
Mevcut çalışmaya maddi destek sağlayan Karamanoğlu Mehmetbey Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimine (02-YL-16) teşekkürlerimi sunarım.
Burhan KARABAKAN Nisan, 2017
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÖN SÖZ ... iii İÇİNDEKİLER ... iv ŞEKİLLER DİZİNİ ... vii SİMGELER VE KISALTMALAR DİZİNİ ... ix 1. GİRİŞ ... 1
1.1. Tohum çimlenmesinde etkili ön uygulamalar ... 3
1.1.1. Hidropriming ... 4
1.1.2. Ozmopriming ... 5
1.1.3. Matripriming ... 7
1.2. Antioksidan savunma sistemleri ... 8
1.3. Priming uygulaması ve antioksidatif defans ... 9
1.4. Bitki gelişiminde LED ışık uygulamaları ... 10
2. TEZİN AMACI ... 12
3. MATERYAL ve METOT ... 13
3.1. Kullanılan cihazlar ... 13
3.2. Kullanılan kimyasallar ... 13
3.3. Bitki örnekleri ... 13
3.4. Aspir tohumuna hidropriming uygulaması ve çimlendirilmesi ... 13
3.5. Aspir tohumlarının homojenize edilmesi ... 14
3.6. Biyokimyasal içeriklerin belirlenmesi ... 15
3.6.1. Toplam fenolik içeriğinin belirlenmesi ... 15
3.6.2. Toplam flavonoid içeriğinin belirlenmesi ... 15
3.6.3. β-karoten ve likopen içeriğinin belirlenmesi ... 16
3.7. Antioksidan aktivitesi tayin yöntemleri ... 16
3.7.1. DPPH serbest radikal yakalama aktivitelerinin belirlenmesi ... 16
3.7.2. İndirgeme gücü aktivitesinin belirlenmesi ... 18
v
3.7.4. Toplam oksidan kapasitenin (TOK) belirlenmesi ... 19
3.8. Antioksidan enzim aktivitelerinin belirlenmesi ... 20
3.8.1. Katalaz (CAT) (EC: 1.11.1.6) enzim aktivitesinin belirlenmesi ... 20
3.8.2. Süperoksit Dismutaz (SOD) (EC.1.15.1.1) enzim aktivitesinin belirlenmesi ... 20
3.8.3. Glutatyon Redüktaz (GR): (EC: 1.8.1.7) ... 21
3.8.4. Askorbat peroksidaz (APx) ... 22
3.9. İstatistiksel Analiz ... 22
4. BULGULAR ... 23
4.1. Hidroproming ve farklı ışık kaynaklarının tohum çimlenmesi üzerine fizyolojik etkileri ... 23
4.1.1. Hidropriming ve farklı ışık kaynaklarının köklenme üzerine etkileri ... 24
4.1.2. Hidropriming ve farklı ışık kaynaklarının kök uzunluğu üzerine etkileri ... 25
4. 1.3. Hidropriming ve farklı ışık kaynaklarının gövde uzunluğu üzerine etkileri ... 26
4.2. Hidroproming ve farklı ışık kaynaklarının tohum biyokimyasal içerikleri üzerine fizyolojik etkileri ... 27
4.2.1. Hidroproming ve farklı ışık kaynaklarının tohum toplam fenolik içeriği üzerine etkileri ... 27
4.2.2. Hidroproming ve farklı ışık kaynaklarının tohum toplam flavonoid içeriği üzerine etkileri ... 29
4.2.3. Hidroproming ve farklı ışık kaynaklarının tohum likopen içeriği üzerine etkileri ... 30
4.2.4. Hidroproming ve farklı ışık kaynaklarının tohum β-karoten içeriği üzerine etk ... 31
4.3. Hidroproming ve farklı ışık kaynaklarının tohum oksidan/antioksidan karakterleri üzerine fizyolojik etkileri ... 32
4.3.1. Hidroproming ve farklı ışık kaynaklarının tohum toplam oksidan içerikleri üzerine fizyolojik etkileri ... 32
4.3.2. Hidroproming ve farklı ışık kaynaklarının tohum toplam antioksidan içerikleri üzerine fizyolojik etkileri ... 34
4.3.3. Hidroproming ve farklı ışık kaynaklarının tohum DPPH radikal yakalama etkinlikleri üzerine fizyolojik etkileri ... 35
4.3.4. Hidroproming ve farklı ışık kaynaklarının tohum indirgeme gücü etkinlikleri üzerine fizyolojik etkileri ... 36
4.4. Hidroproming ve farklı ışık kaynaklarının tohum antioksidan enzimleri üzerine fizyolojik etkileri ... 37
vi
4.4.1. Hidroproming ve farklı ışık kaynaklarının tohum toplam SOD aktivitesi
üzerine fizyolojik etkileri ... 38
4.4.2. Hidroproming ve farklı ışık kaynaklarının tohum APx aktivitesi üzerine fizyolojik etkileri ... 39
4.4.3. Hidroproming ve farklı ışık kaynaklarının tohum CAT aktivitesi üzerine fizyolojik etkileri ... 40
4.4.4. Hidroproming ve LED ışık uygulamalarının tohum GR aktivitesi üzerine fizyolojik etkileri ... 42
5. TARTIŞMA VE SONUÇ ... 43
6. KAYNAKÇA ... 48
vii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 1.1. Aspir bitkisi ... 1
Şekil 1.2. Güneydoğu Anadolu Bölgesi’nde safrana alternatif olarak tüketilen kırmızı ve sarı kurutulmuş Aspir çiçekleri. ... 2
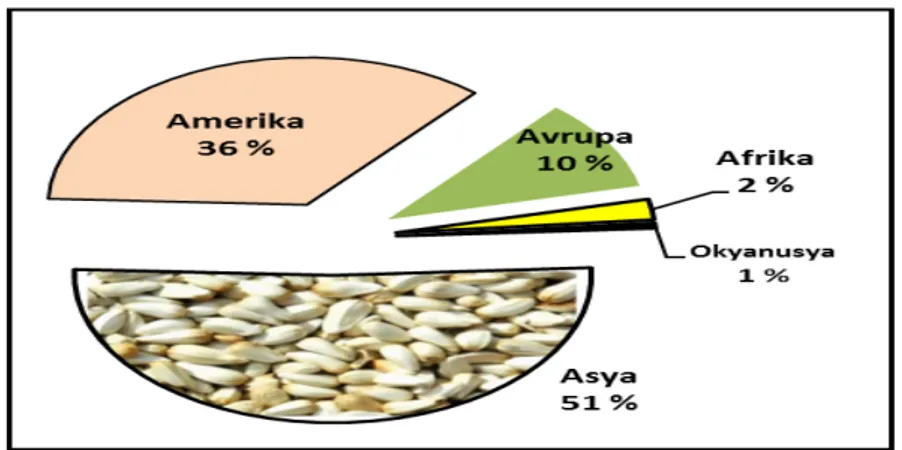
Şekil 1.3. Aspir üretiminin kıtalara göre dağılımı ... 3
Şekil 1.4. Serbest radikallerin oluşumu ve antioksidan enzimlerin serbest radikalleri ortadan kaldırıcı etkileri ... 8
Şekil 1.5. Bitkilerin fotosentez karakteristiği ile bazı yapay ışık kaynaklarının enerji tayfının karşılaştırılması. ... 11
Şekil 3.1. Aspir tohumlarının homojenizasyon işlemi. ... 14
Şekil 3. 2. DPPH radikalinin yapısı. ... 17
Şekil 3. 3. Difenilpikrilhidrazil (DPPH) radikalinin oluşumu. ... 17
Şekil 3.4. SOD aktivite ölçüm yönteminin prensibi. ... 21
Şekil 4.1. Farklı LED ışıkları altında Aspir bitkisinin çimlendirilmesi ... 23
Şekil 4.2. Hidropriming ve LED ışık uygulamalarının Aspir bitkisinin köklenmesi üzerine etkileri. ... 24
Şekil 4.3. Aspir bitkisinin kök uzunluğu ölçümü. ... 25
Şekil 4. 4. Hidropriming ve farklı ışık kaynaklarının Aspir bitkisinin kök uzunluğu üzerine etkileri. ... 25
Şekil 4. 5. Aspir bitkisinin gövde uzunluğunun ölçümü. ... 26
Şekil 4.6. Hidropriming ve farklı ışık kaynaklarının Aspir bitkisinin gövde uzunluğu üzerine etkileri.. ... 27
Şekil 4.7. Hidroproming ve farklı ışık kaynaklarının tohum toplam fenolik içeriği üzerine etkileri.. ... 28
Şekil 4.8. Hidroproming ve farklı ışık kaynaklarının tohum toplam flovanoid içeriği üzerine etkileri. ... 29
Şekil 4.9. Hidroproming ve farklı ışık kaynaklarının tohum likopen içeriği üzerine etkileri.. ... 31
viii
Şekil 4.10. Hidroproming ve farklı ışık kaynaklarının tohum β -karoten içeriği
üzerine etkileri.. ... 32
Şekil 4.11. Hidroproming ve farklı ışık kaynaklarının tohum toplam oksidan
içerikleri üzerine etkileri.. ... 33
Şekil 4.12. Hidroproming ve farklı ışık kaynaklarının tohum toplam
antioksidan kapasite üzerine etkileri.. ... 34
Şekil 4.13. Hidroproming ve farklı ışık kaynaklarının tohum DPPH radikal
yakalama etkinlikleri üzerine etkileri. ... 36
Şekil 4.14. Hidroproming ve farklı ışık kaynaklarının tohum indirgeme gücü
etkinlikleri üzerine fizyolojik etkileri. ... 37
Şekil 4.15. Hidroproming ve farklı ışık kaynaklarının tohum toplam SOD
aktivitesi üzerine fizyolojik etkileri.. ... 39
Şekil 4.16. Hidroproming ve farklı ışık kaynaklarının tohum APx aktivitesi
üzerine fizyolojik etkileri.. ... 40
Şekil 4.17. Hidroproming ve farklı ışık kaynaklarının tohum CAT aktivitesi
üzerine fizyolojik etkileri.. ... 41
Şekil 4.18. Hidroproming ve farklı ışık kaynaklarının tohum GR aktivitesi
ix
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklama
mg Miligram mm Milimetre s Saat nm Nanometre g Gram µ Mikro cm Santimetre dk Dakika ml Mililitre mM Milimolar % Yüzde µl Mikrolitre dH2 β Beta O Distile su OH Hidroksil radikali O2 CO Süperoksit radikali 2
ABTS 2,2-Azinobis(3ethylbenzothiazoline-6-sulfonic acid
Karbondioksit
DPPH 2,2-difenil-1-pikrilhidrazil
TCA Trikloroasetik asit
KFe3(CN)6 Potasyum ferrisiyanür
TAK Toplam antioksidan kapasite
TOK Toplam oksidan kapasite
SEM Standart hata
DNA Deoksiribo nükleik asit
ROS Reaktif oksijen türleri
SOD Süperoksit dismutaz
APx Askorbat peroksidaz
GR Glutatyon redüktaz
NADPH Nikotinamid adenindinükleotid fosfat
CAT Katalaz GSH Glutatyon GSSG Okside glutatyon UV Ultraviyole EC50 Etkin konsantrasyon IC50 İnhibitör konsantrasyon GA Gallik asit pH Hidrojen potansiyeli
1
1. GİRİŞ
Aspir bitkisi (Carthamus tinctorius L.), iki çenekliler (Magnoliopsida) sınıfından olup, Asterales takımının, Asteraceae (papatyagiller) familyasından, Carduoideae alt familyasının Carthamus cinsine ait bir bitki türüdür (Şekil 1.1).
Şekil 1.1. Aspir bitkisi
Yaprak ayası geniş, sarı, kırmızı, turuncu, beyaz ve krem renkli çiçeklere sahip tek yıllık bir bitki olan aspir, dikenli ve dikensiz iki formda bulunur (Özdemir ve Türker, 2014). Aspir bitkisinde çiçeklenme, ana sap tablasında başlayıp iç içe kırılmalar şeklinde 3-4 hafta gibi bir sürede tamamlanır. Aspir tohumunda bulunan yağ oranı %35- 50 arasında, protein oranı % 15- 20 ve geriye kalan kısmı ise %35-40 oranında kabuktan oluşmaktadır (Sirel, 2011). Çiçek tablasının ana tohumlarında yağ içeriği %43,9 iken son çiçeklemenin olduğu zamanda bu yağ oranı ise %14,5’e düşmektedir (Ülger ve ark., 2000).
Aspir, derin kazık kök sistemine sahip olup toprakta 2-3 m derinliğe kadar ulaşabilmektedir. Bu uzun kök sistemi sayesinde toprağın derinlerinde yer alan nemi ve besin elementlerini rahatlıkla kullanabilmektedir. Yer altı sularına sızan nitratı emeçleriyle alarak nitrat miktarının azaltılmasına da yardımcı olmaktadır. Köklerinin sahip olduğu bu özellik sayesinde yüzey nemi az olan yerlerde bile hayat döngüsüne devam edebilir. Ayrıca sahip olduğu kök sistemi ile toprağın derinliklerinde sıkı
2
tabakalarda yer alan suyu absorblayarak bu tabakanın kurumasına ve çatlamasına neden olur. Bu durum, kendisinden sonra ekilecek bitkinin kök gelişiminin daha sağlıklı olmasına zemin hazırlar (Çulha, 2011).
Aspir bitkisi ülkemizde halk arasında yalancı safran, Amerikan safranı ve boya safranı gibi farklı yöresel isimlerle bilinir (Şimşekli, 2010). Yağ bakımından zengin bu bitki günümüzde gerek beslenme, gerekse de biyoyakıt üretiminde kullanılabilmektedir (Culpan, 2015). Linolenik asit (omega-6) içeriği oldukça zengin olan aspir, antioksidan etkisi çok kuvvetli olan tokoferolleri de yüksek düzeyde içermektedir. Bu nedenle kalp damar hastalıklarında uygulanan diyetlerde aspir yağı kullanılmakta, ayrıca yaprağından yapılan çaylar halk arasında kısırlık ve düşük tedavilerinde kullanılmaktadır (Birben, 2015). Çiçekleri, yemeklere verdiği renk ve hafif aromasıyla özellikle Güneydoğu Anadolu Bölgesi’nde çeşni (Şekil 1.2) olarak da kullanılır (Şahin ve ark. 2016).
Şekil 1.2. Güneydoğu Anadolu Bölgesi’nde safrana alternatif olarak tüketilen kırmızı ve sarı kurutulmuş Aspir çiçekleri (Gaziantep) (Şahin ve Taşlıgil, 2016).
Yaz ve kış mevsimlerinde tarımı yapılabilen aspir bitkisinin çiçeklerinde bulunan kartamin maddesi doğal boya, yeşil kısımları ise kuru çiçek olarak kullanılan değerli bir süs bitkisi olarak değerlendirilmektedir (Okçu, 2010; Eryılmaz ve ark., 2014).
Sıcak ve kuru iklimlerde yetişebilen aspir, dünya genelinde altmışın üzerinde ülkede (Şekil 1.3) yetişmekte ve üretiminin yarısından fazlası Hindistan’da gerçekleşmektedir. Bunu takip eden diğer önemli üretici ülkeler Amerika, Meksika, Arjantin, Etiyopya, Avustralya ve Çin’dir (Kırıcı, 1998). Türkiye’de 2014 verilerine göre 439.350 dekarlık alanda 807 tonluk tohum üretimi gerçekleşmiştir (Şahin ve Taşlıgil, 2016).
3
Şekil 1.3. Aspir üretiminin kıtalara göre dağılımı (Şahin ve Taşlıgil, 2016)
Aspir bitkisinin ülkmizde tarımda yer almasının tarihteki yeri cumhuriyetin ilk yıllarına kadar dayanmaktadır. Bu dönemde Bulgaristan’dan ülkemize göç edenlerin getirdikleri aspir tohumları, Balıkesir başta olmak üzere Eskişehir, İstanbul, Konya, Çankırı, Isparta, Kütahya, Afyon, Bolu ve Bursa illerinde tarıma alınmış ve zamanla ülkede tarımı yapılan yağlı tohumlar içerisinde yerini almıştır (Sayılır, 2015).
Kurağa, tuza ve soğuğa karşı dayanıklı olan aspirin yetişme sürecinde yağışın sınırlı olduğu ve sıcaklığın yüksek olduğu bölgelerde verimde azalma olmaktadır. Bu nedenle bitkinin su ihtiyacını karşılayan köklerin ve toprak üstü organların gelişiminin iyileştirilmesi yetiştiricilik açısından büyük önem arz etmektedir (Kaya ve ark., 2004). Aspir üretiminde yetiştiriciliğin ilk basamağını oluşturan tohumdan çim üretimi öncesinde yapılan ön işlemler, tohumun çimlenme hızını artırmakta ve tarımsal verimde artış sağlanmaktadır (Erdoğan, 2008).
1.1. Tohum çimlenmesinde etkili ön uygulamalar (Priming)
Priming; olumsuz çevre şartlarına ya da doğrudan kalite yapısına bağlı olarak tohumdan fide çıkışı esnasında çimlenme sorunlarını en aza indirmek amacıyla yapılan ön işlemlerdir. Kısa sürede üniform fide çıkışı ve gelişimini sağlamak, stres şartlarına karşı dayanıklılığı artırmak amacıyla yapılan yöntemler tohumda farklı fizyolojik etkiler meydana getirmektedir.
Tohumlara çeşitli uygulamaların yapıldığı priming yönteminin temel amacı, tohum neminin çimlenme eşiğine kadar artırılarak bazı biyokimyasal olayların tetiklenmesi ve
4
ekimden sonra çıkışın hızlandırılmasıdır. Bu periyotta çimlenmede hızlanma sağlanırken tohumda yağ asitleri, şekerler ve enzimlerde biyokimyasal değişimler meydana gelmektedir (Kaya ve ark., 2010).
Priming uygulamalarının çimlenmeyi teşvik edici etkilerinin RNA, DNA ve protein sentezini de içeren bir takım biyokimyasal, hücresel ve moleküler olaylarla ilişkili olduğu yapılan çalışmalarda belirtilmiştir (Elkoca, 2007). Priminge tabi tutulmuş olan tohumlar kökçüğün tohum dışına çıkışına izin vermeden gerçekleştirilir. Böylece ekim yapılmadan önce tohumlardaki enzimleri aktive ederek daha hızlı bir şekilde çimlenme sağlayabilmekte ve verim oranında artış meydana gelmektedir (Büyükçılgın, 2007). Ayrıca priming uygulamalarıyla hızlı kök ve sürgün çıkışının gerçekleşmesi daha kuvvetli fide gelişimine fırsat vermekte, bununla birlikte kuraklığa dayanıklılık artmakta ve bitkiler daha kısa sürede çiçeklenerek hasat olgunluğuna gelmektedir (Özdemir, 2012). Örneğin; ekmeklik buğday (Triticum aestivum L.) çeşitlerinden Altay 2000 ve Kıraç 66 yapılan priming denemelerinde kurak koşullarda çıkış oranını yükseltmede, ilk gelişme dönemindeki gelişme zamanını kısaltmada ve stres koşullarına karşı dayanıklılığı artırmada kullanılabilecek alternatif bir yaklaşım olabileceği belirlenmiştir (Özdemir, 2012).
Priming uygulamaları, farklı amaca ya da ihtiyaca göre çeşitli ozmotik ajanlarla yapılmaktadır. Günümüzde çoğunlukla hidropriming, ozmopriming ve matripriming teknikleri kullanılmaktadır (McDonald, 1999). Priming uygulamalarının etkinliği üzerine pek çok faktörün de etkin olduğu bilinmektedir. Bunlardan bazıları; uygun havalandırma koşullarının olması, çözeltinin ozmotik potansiyeli, uygulama süresi, sıcaklığı ve tohum kalitesi gibi faktörlerdir.
1.1.1. Hidropriming
Hidropriming, tohumların ekim öncesi belirli bir süre suda bekletilmesi işlemidir. Yapılan priming uygulamaları içerisinde en basiti olan bu yöntem, çimlenme hızını ve oranını artırmada kullanılan en eski yöntemlerden biridir. Bu uygulamanın amacı tohum içindeki su ile dışarıdaki suyun ya da tohumun içine koyulacağı çözelti arasında osmatik basınç farkı yaratıp çimlenmeyi başlatacak kadar suyun tohum içine girmesini sağlamaktır. Böylece tohumun çimlenmesi uyarılır ve çimlenmede artış sağlanır
5
(Karakurt ve ark., 2010). Uygulama süresince herhangi bir kimyasal madde kullanılmadığı için tohumlarda kimyasal birikiminden veya çevreye zarar verebilecek herhangi bir atıktan söz edilemez (Mc Donald, 2000). Yüksek miktarda tohuma priming uygulamasına imkan sağlayan bu yöntem, hem pratik hem de ucuz bir yöntemdir (Elkoca, 2007).
Hidropriming uygulamalarıyla başta sebze ve çim tohumları gibi küçük tohumlu bitkilerde çimlenme ve çıkışta artış olduğu kanıtlanmıştır (Heydecker ve Coolbaer, 1977; Bradford, 1986). Hidropriming uygulamasının buğday, şeker pancarı, mısır, soya fasulyesi ve ayçiçeği gibi farklı üründe de olumlu etkilerinin olduğunu bildirmiştir ((Parera ve Cantliffe 1994; Singh, 1995; Sadeghian ve Yavari, 2004). Mısır tohumlarında hidropriming uygulamasıyla 0,3 ton/ha ile 1,4 ton/ha arasında değişen tane verimi sağlandığı, yaklaşık olarak %17-76 ortalama seviyesinde verim artışı görüldüğü bildirilmiştir (Arif ve ark., 2008).
Kışlık buğday tohumları üzerine yapılan bir çalışmada tohumların çimlenme ve çıkış performansları üzerine hidropriming uygulamasının olumlu etkisi gösterilmiş (Giri ve ark., 2003), farklı türlerin farklı derecelerde etkilendikleri belirtilmiştir.
Kaya ve ark. (2006), yaptıkları bir çalışmada ayçiçeği (Helianthus anuus L.) üzerine yapılmış hidropriming uygulamasının tuz ve kuraklık stresleri altında çimlenme ve fide büyümesini artırdığını saptamışlardır.
Biber (Capsicum annuum L.) tohumlarında yapılan bir başka çalışmada ise tohumların kontrollü nemlendirilmesi yapılarak, fide gelişimi, düşük ve yüksek sıcaklık ile tuz stresinde, çimlenme, kurutma, depolama, tohumda şeker, yağ, yağ asitleri ve enzim aktivitelerindeki değişimler incelenmiştir. Bu çalışma sonucunda biberde kontrollü nemlendirme uygulamasının çimlenme zamanını kısalttığı, fide gelişimini artırdığı, düşük, yüksek sıcaklık ve tuz stresinde çimlenme, çıkış ve fide gelişimini artırdığı belirlenmiştir (Kaya, 2008).
1.1.2. Ozmopriming
Tohumların belirli bir süre ozmotik bir solusyon içerisinde bekletilerek kontrollü su alımının sağlanması ozmopriming olarak tanımlanır. Kök çıkışının engellendiği bu
6
yöntem, pek çok bitki türünde hızlı ve üniform çimlenmeyi teşvik etmektedir (Heydecker ve Gibbins, 1978). Genellikle polietlien glikol (PEG), mannitol, gliserol ve sükroz gibi ozmotik maddeler ve sodyum, potasyum ve magnezyum gibi elementlerin inorganik tuzları kullanılmaktadır (Al-Karaki, 1998; Parera ve Cantliffe, 1994; Elkoca vd., 2006). Bu maddeler ozmopriming uygulamalarında yaygın olarak kullanılmalarına rağmen, tohum içerisine alınabilme olasılığından dolayı bazen toksik etkiler de gösterebilmektedir (Bradford, 1995).
Soğan tohumlarının çimlenme ve fide çıkış hızını artırmak, çimlenme ve fide çıkışında homojeniteyi sağlamak için yapılan ozmotik tohum uygulamalarında polietilen glikol (PEG) ve değişik potasyum tuzları kullanmışlar. Sonuçlara göre kurutma kâğıtları ile yapılan PEG uygulamalarının çıkış, çimlenme hızı ve homojenliğin arttığı belirlenmiştir (Duman, 2002).
Biber (Capsicum annum.) tohumlarında çimlenmeyi kolaylaştırmak ve hızlandırmak amacıyla PEG-6000 ile –1,0 MPa’da 1, 2 ve 3 gün süreyle ozmopriming uygulamaları yapılmıştır. Ozmotik koşullandırma çimlenme yüzdesini arttırırken, ortalama çimlenme süresini azaltmıştır (Demirkaya, 2006).
Kivi (Actinidia deliciosa) üzerine yapılan bir çalışmada, priming uygulamalarının çimlenme ve çıkış üzerine olan etkilerini araştırılmıştır. Buna göre, farklı dozlarda PEG, KNO3, KH2PO4, Mannitol ve NaCl kullanılan örnekler incelenmiş, en yüksek çimlenme
oranı PEG uygulamasında görülmüştür (Özdemir, 2006).
Nohut bitkisinin çimlenmesi üzerine hidropriming ve ozmopriming uygulamalarının etkisinin araştırıldığı bir çalışmada 4 farklı ozmotik basınca (-0,5 -1,0 1,5 ve -2,0 MPa) sahip PEG çözeltisi ve % 4 mannitol uygulamasına tabi tutulmuştur. Tüm ozmopriming uygulamaları daha hızlı ve üniform çimlenme sağlamış ayrıca çimlenmenin başlanması için gereksinim duyulan sıcaklık isteklerini önemli oranda azalmıştır (Elkoca ve ark., 2007).
Biber tohumlarının fizyolojik olarak iyileştirilmesi için su ve tuz çözeltileri ile yapılan priming ve kurutma uygulamalarının karşılaştırılması yapılmış, canlılık ve güç üzerine etkileri incelenmiştir. Su ve çeşitli tuz çözeltileri ile yapılan tüm priming
7
uygulamalarında biber tohumları çimlenme yüzdeleri ile çimlenme indeksi kontrol tohumlarına kıyasla artış göstermiştir (Şentürk ve ark., 2011).
Fasulye tohumları üzerine yapılan ozmopriming uygulaması sonucunda fide çıkışında stresin azaldığı, tohum veriminin arttığı gözlemlenmiştir (Mazibuko ve Modi., 2004). Bir başka çalışmada ise, ozmopriming uygulamasının pirinç tohum çimlenmesi ve fide büyümesine etkisi bir başka çalışmada araştırılmıştır. Bu çalışmada NaCI, KCI ve CaCl2
kullanılmış olup bütün uygulamalarda kök uzunluğunda ve çimlenme üzerinde pozitif etkilerin olduğu görülmüştür (Islam ve ark., 2012).
1.1.3. Matripriming
Düşük matrik potansiyele sahip, yüksek su tutma kapasiteli ve yüksek yüzey/hacim oranlı, toksik etkisi olmayan ve tohum yüzeyine iyi bir şekilde yapışan katı materyallerin priming ortamı olarak kullandığı uygulamalardır. Bu priming türünde tohumlar genellike -0.4 MPa ile -1.5 MPa arasında matrik potansiyeline sahip katı bir ortamda belirli bir süre bekletilmektedir (McDonald, 2000). Vermikülit en yaygın kullanılan matripriming ortamıdır. Suyu kuvvetli bir şekilde tutarak matrik bir güç oluşturduğu için tohumlar suyu kontrollü bir şekilde yavaş yavaş içerilerine almaktadır (Khan, 1992). Bu uygulamanın küçük ve büyük tohumlu pek çok bitki türünde hızlı ve üniform çimlenme ve kuvvetli bitki gelişimi sağladığı rapor edilmiştir (Hussain ve ark., 2006).
Pill (1995), bitkiler için uygulanacak olan priming şartlarının optimize edilmesi gerektiğini belirtmiş, optimizasyonun sağlanması durumunda organik ve inorganik tuzların da priming ortamı olarak etkili bir şekilde kullanılabileceğini bildirmiştir.
Podlaski ve ark., (2002) mısırda yaptıkları bir çalışmada hidropriming uygulamasıyla matripriming uygulamasını karşılaştırmış, matripriming uygulamasında daha etkili sonuçlar elde etmişlerdir. Katı materyal kullanılarak yapılan matripriming uygulamasından sonra tarla çıkış oranının % 7 daha yüksek olduğu tespit edilmiştir.
8
1.2. Antioksidan savunma sistemleri
Reaktif oksijen türlerinin oluşumu ve bunların meydana getirdiği hasarı önlemek üzere hücrelerde birçok savunma mekanizması bulunur. Bunlara antioksidan savunma sistemleri veya antioksidanlar denir. Bu mekanizmalar; radikallerin ya da başka bir ifade ile oksidanların biyolojik hedeflerle reaksiyona girmesini, radikal zincir reaksiyonları oluşturmalarını veya oksijenin oldukça reaktif ürünlere dönüşmesini engelleyerek oluşacak hasarı en aza indirmeye çalışırlar (Bagchi ve Puri, 1998; Azzi ve ark., 2004).
Doğal antioksidanlar; etki mekanizmalarına göre enzimatik ve enzimatik olmayan (non-enzimatik) antioksidanlar olarak iki gruba ayrılır. Bu antioksidanlardan enzimler ve düşük ağırlıklı moleküller vücutta üretilmektedir. Enzimatik olmayan antioksidanlar ise genellikle vücuda beslenme yoluyla alınmaktadır. Bu moleküllerin başında polifenoller gelmektedir. Ayrıca vitaminler, karotenoidler, organosülfürlü bileşikler ve mineraller de enzimatik olmayan antioksidan sınıfına girmektedir (Cihaner, 2009).
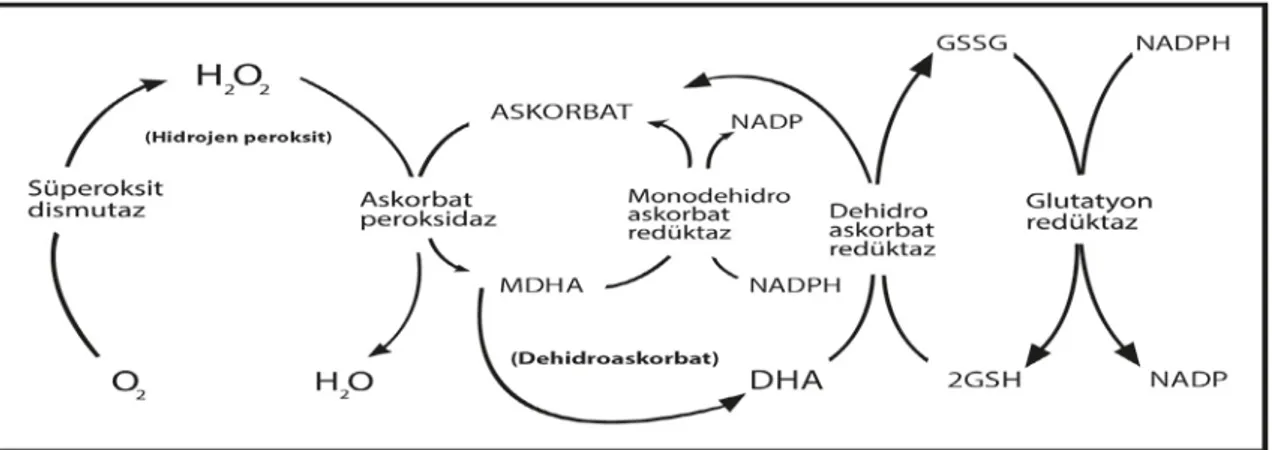
Serbest radikaller ve olası hasarları, antioksidan bileşiklerle beraber antioksidan enzimler tarafından denetlenmektedir. Bitkilerde, serbest radikalleri zararsız hale getirmeye çalışan süperoksit dismutaz (SOD), katalaz (CAT), askorbat peroksidaz (APx) ve glutatyon S-transferaz (GST) gibi enzimler, hücreleri serbest radikallerin toksik etkilerine karşı korumaktadır. Antioksidan enzimlerin radikal süpürücü etkileri Şekil 1.4’te özetlenmiştir.
Şekil 1.4. Serbest radikallerin oluşumu ve antioksidan enzimlerin serbest radikalleri ortadan kaldırıcı etkileri (Özdemir, 2012).
9
SOD enzimi hem sitoplazmada hem de mitokondride süperoksit radikallerini hidrojen peroksite çevirmekte, peroksizomal CAT ve sitoplazmik APx enzimleri ise oluşan hidrojen peroksiti hidroksil radikaline dönüşmeden nötralize etmektedirler. APx enzimi tarafından katalizlenen indirgeme reaksiyonunda NADPH indirgeyici güç olarak kullanılırken, NADPH’ın tekrar üretiminde ise yine antioksidan bir molekül olan indirge glutatyon (GSH) kullanılır. Ayrıca sitoplazmik GST enzimleri de hücrelerde indirge glutatyonu kullanarak oksidan stresi azaltmaya yönelik görev alır. GST’ler aynı zamanda oksidatif olarak modifiye edilmiş molekülleri hücre içerisinde detoksifiye eder ve hücresel peroksitleri de etkisiz hale getirir.
1.3. Priming uygulaması ve antioksidatif defans
Küresel iklim değişiklikleri ve ekolojik çevrede var olan su kaynaklarının giderek azalması bitkisel üretimi büyük ölçüde olumsuz etkilemektedir. Bitkiler üzerinde etkili doğal stres faktörlerinden en önemlisi kuraklıktır. Kuraklığın sebep olduğu verim kayıpları diğer bütün çevresel faktörlerden daha fazladır. Suyun kısıtlı olduğu topraklarda verim oranını artırmak ve verimde stabilite için yapılabilecek en iyi uygulama kuraklığa dayanıklı tohum ve bitki çeşitleri geliştirmektir. Yeni ve hızlı çeşit geliştirmede fizyolojik yaklaşımların çok daha fazla etkili olacağı düşünülmektedir. Yapılan çalışmalarda kuraklık stresi esnasında antioksidatif savunma sistemlerinin modifiye oldukları gösterilmiştir (Özdemir, 2012).
Yüksek ışık, sıcaklık, kuraklık, tuzluluk, aşırı herbisit uygulaması ve mineral eksikliği gibi çevresel stres faktörleri bitkilerde serbest radikal üretimi ve antioksidan savunma sistemlerini etkilemektedir. Yapılan pekçok araştırmada abiyotik stres faktörlerine toleransta enzimatik antioksidantların aktif olarak rol aldığı gösterilmiştir (Keleş ve Öncel, 2002; Parvaiz, 2008). Ayrıca, askorbat, glutatyon, tokoferoller ve karotenoidlerde fotosentetik sistemlerde bulunan önemli antioksidan moleküllerdir (Keleş ve Öncel, 2002).
Priming uygulaması, tohumlarda serbest radikal tutucu enzimlerden SOD, CAT ve APx miktarlarında artış ile daha canlı fide oluşumunu sağlamaktadır (Afzal ve ark., 2006; Chiu ve ark., 1995; Chang ve Sung, 1998). Antioksidant enzimlerin etkinliklerinin
10
artmasıyla bitki hücresinin membran lipitleri, proteinleri, enzimleri, pigmentleri ve nükleik asitleri gibi yaşamsal bileşenlerine zarar veren reaktif oksijen türlerinin edilmesi sağlanır (Maheshwari ve Dubey, 2009).
Yapılan bilimsel çalışmalar priming uygulamalarının tohumların solunum aktivitesini artırarark (Halpin-Ingham ve Sundstrom, 1992) SOD, CAT ve GR gibi antioksidan enzimlerin aktivitesini düzenlediğini göstermiştir (Bailly ve ark., 1997). Ayrıca, priming uygulamaları glutatyon ve askorbat gibi çeşitli antioksidantların seviyesini de arttırdığı belirtilmiştir (Hsu ve Sung, 1997; Bailly ve ark., 1998).
1.4. Bitki gelişiminde LED ışık uygulamaları
Işık, dalgalar halinde hareket eden ve foton taneciği adı verilen birimlerden oluşmuş enerji paketçikleridir. Işığın dalga boyu değiştikçe rengi de değişir. Örneğin, uzun dalga boyları kırmızı ışığı oluştururken, kısa dalga boylu ışınlar mor ötesi ışınları oluşturur. Bitkiler, çeşitli dalga boyundaki ışığa karşı insanlardan farklı duyarlılığa sahiptir. İnsan gözü tarafından görülebilen ışığın sadece bir kısmı, yani 400 ile 700 nm arasında dalga boyuna sahip olan ışıklar fotosenteze ve enerji kaynağı olarak kullanılır.
Bitkiler; yaprak, çiçek, sürgün, dal ve meyve oluşumu için ışık enerjisini kullanarak yaşamsal faaliyetlerini gerçekleştirirler. Fotosentez, klorofil oluşumu, organik ve inorganik maddeleri sentezlemek için ışığa gereksinimleri bulunur. Bitkiler için ihtiyaç duyulan ışık enerjisi ya güneş ışığından ya da yapay ışık kaynaklarından sağlanmaktadır. Bitkisel üretimde yapay ışık kaynaklarının kullanım amacı güneş ışığına destek olmak ve/veya bitkilerde güneş ışığına karşı oluşan cevabı teşvik etmektir.
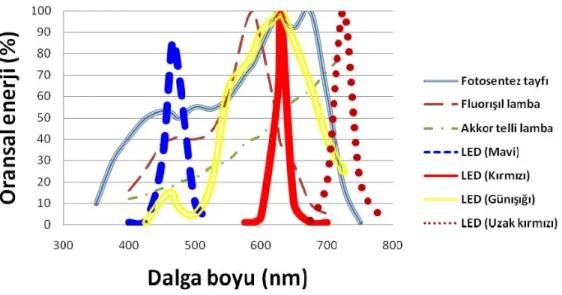
Yapay ışık kaynaklarından en bilineni farklı dalga boylarında maksimum ışık şiddeti sağlayan LED ışıklardır. Oldukça uzun ömürleri ve uzun süreler değişmeyen ışık şiddetleriyle bitki çalışmalarında oldukça yaygın kullanılagelmişlerdir. LED ışıkları ayrıca infrared (IR) ışın oluşturmadıkları için, uygulandıkları nesnelerde ısı artışına da neden olmazlar (Hubbezoğlu ve ark., 2008). Şekil 1.5’te farklı ışık kaynakları kullanılarak yapılan bir deneyde fotosentez hızının ışık kaynağı çeşidi ile nasıl değiştiği gösterilmektedir (McFate, 1989).
11
Şekil 1.5. Bitkilerin fotosentez karakteristiği ile bazı yapay ışık kaynaklarının enerji tayfının karşılaştırılması (McFate 1989‘dan yararlanılmıştır).
Bitkilerin fotosentez hızları farklı dalga boylarında farklı etkinliklerde meydana gelir. Bu nedenle LED ışıklarla yapılan yapay aydınlatma sistemleri, tohum çimlenmesi ve gelişmesinde hızlandırıcı olarak kullanılmaktadır. LED ışıkları altıda yapılan bir çalışmada domates bitkisinin (Lycopersicon esculentum L.) gelişimi incelenmiş, LED ışık kaynaklarıyla ek aydınlatmanın bitki boyu, yaprak sayısı, çiçek sayısı ve ağırlığını etkilediği belirlenmiştir (Köksal ve ark., 2013).
LED ışıkları kallus oluşumu (Budiarto 2010; Chung ve ark. 2010) ve sürgün rejenerasyonu için birçok bitkide başarıyla kullanılmıştır (Wu ve DuToit 2012). Deneme sonuçları farklı LED ışıklarının sürgün rejenerasyonu için etkili olduğunu göstermiştir. Benzer şekilde Lilium bitkisinde eksplant başına en fazla soğancık sayısı kırmızı: mavi LED ışıklarından elde edilmiştir (Lian ve ark., 2002). Chang ve ark., 2003), Zantedeschia albomaculata bitkisinde kırmızı ve mavi LED ışıklarının sürgün uzunluğunda artışa neden olduğunu göstermiştir. Benzer sonuçlar pamuk bitkisinde de rapor edilmiştir (Li ve ark., 2010). Sonuçlara göre sürgün uzunluğu için mavi ışığın çok önemli olduğu belirlenmiştir.
Manivannan ve ark. (2015) son yıllarda yaptıkları bir çalışmada Rehmannia glutinosa bitkisinin in vitro kültür ortamında büyütülmesi sırasında uygulanan farklı ışık kaynaklarının antioksidan potansiyeli ve antioksidan enzim aktiviteleri üzerine etkilerini belirlemişlerdir. MS ortamında bitki büyüme düzenleyicileri verilerek elde edilen
12
sürgün ucu eksplantları beyaz floresan ışık, mavi LED ve kırmızı LED ışık altında dört hafta boyunca büyütülmüştür. Bu sürenin ardından toplam fenol ve toplam flavonoid içeriği, serbest radikal süpürme aktiviteleri ve antioksidan enzim aktiviteleri ile büyüme özellikleri ölçülmüştür. Sonuçlara göre mavi ve kırmızı LED uygulamaları, soğuk beyaz floresan ışık ile karşılaştırıldığında antioksidan kapasitede önemli bir artışa neden olmuştur. Buna ek olarak, LED uygulamaları yaprak ve kökteki toplam fenolik ve flavonoid seviyelerini de arttırmıştır. Bu nedenle Rehmannia glutinosa’nın in vitro yayılması sırasındaki mavi ve kırmızı LED ışık kaynaklarının bitkinin tıbbi değerinin artırmasında faydalı bir yol alabileceği savunulmuştur. Kalanchoe bitkisinin büyümesi ve çicek açması üzerinde LED ışıklarının etkilerinin araştırıldığı bir başka çalışmada ise bitkinin kök ve gövde uzunluğunun kırmızı ve mavi ışık tarafından pozitif bir şekilde etkilendiği gösterilmiştir (Hee Kim ve ark., 2014).
2. TEZİN AMACI
Aspir yağ bakımından zengin tohumlu bir bitkidir. Bu nedenle günümüzde gerek beslenme, gerekse de biyoyakıt üretiminde kullanılabilmektedir. Priming; olumsuz çevre şartlarına ya da doğrudan kalite yapısına bağlı olarak tohumdan fide çıkışı esnasında çimlenme sorunlarını en aza indirmek amacıyla yapılan ön işlemlerdir. Gerçekleştirilen bu çalışmanın amacı gerek çevresel ve genetik faktörlere, gerekse tohum yapısına bağlı olarak çimlenme ve çıkış esnasında yaşanabilecek olumsuzlukları gidermek için kullanılan hidropriming uygulamasının aspir tohumları üzerine etkilerini fizyolojik ve biyokimyasal açıdan incelemektir. Diğer taraftan, priming uygulamalarının başarısı üzerine etki eden LED ışıklarının aspir bitkisinin büyüme ve gelişmesi üzerine etkileri araştırılmıştır. Böylece priming uygulama tekniklerinin ve priming uygulamaları üzerine ışığın etkisinin ortaya konulması, aspir bitkisinde priming uygulamasına yönelik çalışmaların daha sağlıklı bir şekilde planlanıp yürütülmesine katkı sağlayacaktır.
13
3. MATERYAL ve METOT 3.1. Kullanılan cihazlar
Tez çalışmasında; Termo MultiScanGo marka mikro plaka spektrometre, Himac marka santrifüj, SHS inside marka hassas terazi, Thermal marka çeker ocak, Biosan marka TDB-120 kuru blok ısıtıcı, MR HeiTec marka manyetik karıştırıcı, Nüve marka inkübatör, Nüve marka otoklav, Qiagen marka Tissue Ruptor homojezinatör cihazı, Sanyo marka iklimlendirme dolabı ve mavi, kırmızı, beyaz LED ışıkları kullanılmıştır.
3.2. Kullanılan kimyasallar
Deneylerde kullanılan kimyasallar ise şu şekildedir: DPPH (2,2-difenil-1-pikril hidraliz AppChem); TCA (Trichloro acetic acid - Sigma), K3Fe(CN)6 (Potasyum ferrisiyanür),
FeCI (Demir (III) klorür), Sodyum Asetat, Gallik asit, Folin reaktifi (Merck), Sodyum karbonat (Na2CO3), Aseton, Hekzan, Metanol, CuSO45H2O (Bakır sülfat), Na-K
tartarat, Na2CO3 (Sodyum karbonat), NaOH (Sodyum Hidroksit), H2O2 (Hidrojen
peroksit), K2HPO4 (Fosfat tampon), EDTA (Ethylene daimine tetra acetic acid),
Ferrozin, Tris (hydroxymethyl) aminomethane, Pyrogallol, Polyvinlpyrrolidone, KCI (Potasyum klorür), Ascorbat, Trolox
3.3. Bitki örnekleri
(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid), Sodyum asetat, ABTS (2,2-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid, Xylenol orange, NaCI (Sodyum klorür), Glycerol, H2SO4 (Sulfuric acid),
CH3CO2K (Potasyum asetat), Al(NO3)3 (Aluminium nitrate) (Sigma).
Bu çalışmada ülkemizin farklı bölgelerinde yetişen ve doğal yaşam alanlarından toplanan aspir tohumunun sina örneği kullanılmıştır. Kullanılan aspir tohumları Dr. Sibel Day (Tarla Bitkileri Bölümü, Ziraat Fakültesi, Ankara Üniversitesi) tarafından temin edilmiştir.
3.4. Aspir tohumuna hidropriming uygulaması ve çimlendirilmesi
Aspir bitkisinde ekim öncesi hidropriming uygulamalarının fizyolojik ve biyokimyasal etkilerinin incelenmesi amacıyla ilk önce tohumlar herhangi bir hidropriming uygulamaya tabi tutulmadan karanlık ortamda, florsan ışık, kırmızı, mavi, beyaz ve
14
karışık (kırmızı + mavi + beyaz) (1:1:1) LED ışıkları altında çimlenmeye bırakılmış, tohumların ilk 3 günlük çimlenme sayıları kontrol edilmiştir. Çimlenme ve büyüme süreleri üç hafta boyunca takip edilmiştir. Bu süre sonunda çimlenen tohumların fizyolojik ölçümleri yapılmıştır. Fizyolojik ölçümler için her bir ışık altında çimlendirilen bitkilerden rast gele 5 tane fide alınarak bitkilerin kök sayısı, kök uzunlukları, gövde uzunlukları belirlenmiştir. Aynı şekilde 2, 4 ve 8 saat hidropriminge tabi tutulmuş tohumlar da gün ışığı, karanlık ortam, florsan ışık, kırmızı, mavi, beyaz ve karışık LED ışıkları altında büyümeye bırakılmış, ilk 3 gün boyunca tohumların çimlenme sayıları gözlemlenmiştir. Ayrıca tohumlarda gün ışığı, karanlık, florsan, kırmızı, mavi, beyaz ve karışık LED ışıkları altında 2, 4, 8 ve 16 saat hidropriming uygulamaları da yapılmış ve tohumlar toplanarak biyokimyasal içerik analizlerinin yapılacağı güne kadar -80°C’de saklanmıştır.
3.5. Aspir tohumlarının homojenize edilmesi
Hidropriming uygulamalarının ve çeşitli LED ışıklarının aspir tohum antioksidan kapasite ve antioksidan içerik açısından incelenmesi için ilk önce tohumlar homojenizasyon tamponu (50 mM KPi (KH2PO4 veya K2HPO4), 5mM EDTA, %1,15
KCI , %2 PVP) içerisinde homojenize edilmiştir. Bunun için 1 gr tohum havanda sıvı azot kullanılarak toz hale getirildikten sonra Qiagen (ABD) marka tissue ruptor homojenizatör cihazıyla buz içinde iyice parçalanmıştır (Şekil 3.1). 1,5 ml’lik ependorf tüplerine aktarılıp 2 dakika boyunca ultrasonik homojenizasyona tabi tutulan örnekler 9000 g hızda 10 dakika + 4ºC’de santrifüj edilmiştir. Santrifüjden sonra alınan süpernatant deney gününe kadar -85°C saklanmıştır.
15
3.6. Biyokimyasal içeriklerin belirlenmesi 3.6.1. Toplam fenolik içeriğinin belirlenmesi
Bu yöntem; Slinkard ve Singleton tarafından antioksidanların toplam fenol miktarını belirlemek amacıyla geliştirilmiştir. Yöntem suda ve diğer organik çözücülerde çözünmüş olan fenolik bileşiklerin Folin fenol reaktifi ile alkali ortamda renkli kompleks oluşturması temeline dayanır (Slinkard ve Singleton, 1977). Bu yöntemde kullanılan CuSO4 (bakır(II) sülfat), alkali ortamda protein veya antioksidanlarla
kompleks yapar. Folin fenol reaktifi (fosfomolibdik fosfotungstik asit) eklendiğinde ise folin reaktifi proteinlere bağlanır. Protein veya antioksidanla Cu(II)’nin reaksiyonundan açığa çıkan Cu(I), molibdatotungstat ayıracını mavi renge indirger (Dağdelen, 2010). Reaksiyon tamamlanınca 750 nm’de örnek absorbansları ölçülür (Somogyı ve ark., 2007).
Yöntemde standart olarak gallik asit (0,02-0,05-0,1-0,2- 0,5 0,75- 1 mM) çözeltileri kullanılmıştır. Bu çalışmada 10 mg/ml protein içeren tohum homojenatları ve standartlardan 20 µl mikro plaka kuyucuklarına koyulmuştur. Üzerlerine 20 µl Folin reaktifi (2N) eklenmiş ve pipetajlama ile karıştırıldıktan sonra 3 dakika inkübe edilmiştir. Sonra üzerlerine 20 µl %35’lik (w/v) sodyum karbonat ve 140 µl dH2O
eklenerek 10 dakika boyunca karanlıkta bekletilmiştir. 725 nm’de kör tüpüne karşı absorbans değerleri okunmuş, gallik asit ile oluşturulmuş standart kalibrasyon eğrisi kullanılarak her 1 mg protein içeren homojenat içinde bulunan toplam fenolik miktarları hesaplanmıştır.
3.6.2. Toplam flavonoid içeriğinin belirlenmesi
Bitkilerde bulunan flavonoidler bitki sekonder metaboliti olan ve antioksidan kapasiteye katkı sağlayan önemli bileşiklerdendir. Flavonoid tayini bitkisel ekstraktların toplam flavonoid madde içeriğini ortaya çıkarmaktadır. Kullanılan bu yöntem, flavonoid alüminyum kompleksinin oluşumu esasına dayanmaktadır ve bu kompleks 415 nm’de spektrofotometrede maksimum absorbansa sahiptir (Arkan, 2011).
Barros ve arkadaşlarının (2008) yöntemine göre homojenatlarının içerisindeki toplam flavonoid miktarı belirlenmiştir. Bu yönteme göre 50 µl tohum homojenatları (10 mg/ml
16
protein) mikro plaka kuyucuklarına koyulmuştur. Üzerlerine sırasıyla 215 µl % 80’lik (w/v) etanol, 5 µl AlNO3 (% 10 w/v) ve 5 µl potasyum asetat (1M) eklenmiştir. 40
dakika boyunca oda sıcaklığında bekletildikten sonra spektrofotometrede 415 nm’de absorbans değerleri kör tüpüne karşı okunmuş, toplam flavonoid içeriği 1 mg homojenat içerisindeki flavonoid miktarı olarak aşağıdaki formüle göre hesaplanmıştır (Pal ve ark., 2010).
Toplam Flavonoid içeriği (µg/mg protein)= (A415 + 0,01089) / 0,02108
3.6.3. β-karoten ve likopen içeriğinin belirlenmesi
β-karoten-linoleik asit test sistemi, yüksek sıcaklıkta linoleik asit oksidasyonundan kaynaklanan konjuge die hidroperoksitlerin inhibisyonunun ölçülmesine ve β -Karoten molekülünde renk açılması esasına dayanır (Arkan, 2011). Ölçümler sonucunda linoleik asidin oksidasyonunu inhibe etme oranının yüksek olması bu numunenin güçlü bir antioksidan kapasitesi olduğunu göstermektedir (Apak ve ark ., 2007).
Tohum örnekleri içinde bulunan β-karoten ve likopen miktarlarının belirlenmesi için, 500 µl tohum homojenatı, 500 µl hekzan/aseton (4:6) çözeltisiyle karıştırılıp vortekslendikten sonra filtre/şırınga yardımıyla süzülmüştür. Daha sonra ise 453, 505, 663 nm dalga boylarındaki absorbans değerleri kullanılarak β -karoten ve likopen miktarları aşağıda yer alan formüle göre hesaplanmıştır (Pal ve ark., 2010).
β-karoten içeriği (mg/100 mg) = 0,216 A663 – 0,304 A505 + 0,452 A453
Likopen içeriği (mg/100 mg) = -0,0458 A663 + 0,372 A505 – 0,0806 A453
3.7. Antioksidan aktivitesi tayin yöntemleri
Örneklerin antioksidan aktivitesinin belirlenmesi için DPPH radikali yakalama aktivitesi, indirgeme gücü aktivitesi, toplam antioksidan kapasite (TAK) ve toplam oksidan kapasite (TOK) ölçümleri gerçekleştirilmiştir.
3.7.1. DPPH serbest radikal yakalama aktivitelerinin belirlenmesi
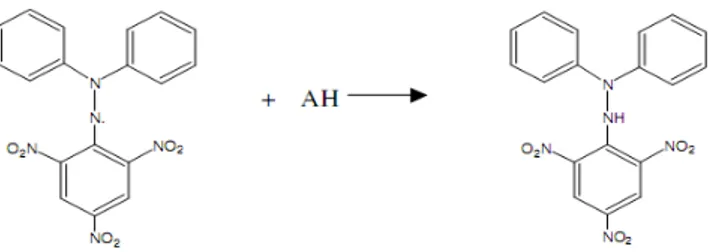
Bu yöntem ilk kez Blois (1958), tarafından 1,1-difenil-2-pikril hidrazil (DPPH) (Şekil 3. 2) radikallerinin antioksidan moleküllerin tayininde kullanılabileceğinin önerilmesi ile
17
ortaya çıkmıştır. Antioksidan aktivite ölçümlerinin çoğaldığı yıllarda Brand-Williams ve arkadaşları yöntemi geliştirmiş ve pek çok araştırıcı tarafından referans olarak kabul edilmiştir (Metin, 2012).
Şekil 3. 2. DPPH radikalinin yapısı.
Yöntemde antioksidan kapasitesi belirlenecek maddelere DPPH çözeltisi ilave edilir. DPPH antioksidan madde ile reaksiyona girdiği zaman indirgenerek koyu menekşe renkli iken sarı renkli ürüne (Şekil 3.3) dönüşmekte ve spektrofotometrede 517 nm’de ölçülebilmektedir (Molyneux, 2004). Sonuçta IC50 adı verilen ve homojenatların DPPH
radikalinin yarısını süpürebildiği konsatrasyon belirlenmiş olur. Bu IC50 değeri
homojenatların serbest olan radikallerin süpürme etkinliğini verir. IC50 değerinin düşük
olması antioksidan kapasitesinin oldukça güçlü olduğun anlamına gelmektedir (Arkan, 2011).
Şekil 3. 3. Difenilpikrilhidrazil (DPPH) radikalinin oluşumu.
Tohum homojenatlarının antioksidan aktivitesi DPPH radikalini yakalama kabiliyetine dayanılarak ölçülmüştür. DPPH serbest radikal giderme Blois metoduna (1958) göre yapılmıştır. Serbest radikal giderme aktivitesinin ölçümünde standart olarak gallik asit çözeltileri (0,01- 0,02- 0,04- 0,06- 0,08- 0,1 mM) ve değişik konsantrasyonlarda tohum homojenatları (0,1- 0,2- 0,25- 0,33- 0,5- 1,0- 2,0- 5,0 mg/ml) kullanılmıştır. Tohum
18
homojenat ve standartlardan; her bir örnek mikro plaka kuyucuğuna 20 µl koyulmuş ve üzerine 180 µl DPPH (metanol içerisinde hazırlanan 0,06 mM) eklenmiştir. Karanlık ortamda 60 dakika bekletildikten sonra 517 nm’de absorbans değerleri ölçülerek DPPH radikalinin indirgenmesi belirlenmiştir. Serbest radikal yakalama aktiviteleri aşağıda bulunan formülle göre hesaplanmıştır. DPPH radikal yakalama aktivitesi her örnek için IC50değerleri hesaplanarak karşılaştırılmıştır (Türkoğlu ve ark., 2007).
3.7.2. İndirgeme gücü aktivitesinin belirlenmesi
Bu yöntemde antioksidan maddenin indirgeme gücüne bağlı olarak antioksidan aktivite belirlenir. Serbest radikalleri yakalama aktivitesi esasına dayanan yöntemlerden biri olan indirgeme potansiyeli metodunda yüksek absorbans, yüksek indirgeme potansiyelini göstermektedir. Potasyum ferrisiyanid [K3Fe(CN)6] içerisindeki Fe(III)
iyonlarının antioksidan reaksiyon sistemi içersinde Fe(II) iyonlarına indirgenmesi ile antioksidan aktivite belirlenir (Mathew ve Abraham, 2006 ).
Örneklerin indirgeme gücü Oyaizu metodu kullanılarak belirlenmiştir (Yen ve Chen, 1995). Tohum homojenatlarının toplam indirgeme gücünün belirlenmesinde standart olarak gallik asit çözeltileri (0,05- 0,1-0,2- 0,4- 0,8- 1,0 mM) kullanılmıştır. Elli mikrolitre gallik asit ve tohum homojenatları mikro plaka kuyucuklarına konulmuştur. Üzerlerine 75 µl fosfat tamponu (0,2 M, pH:6.6) ve 75 µl K3Fe(CN)6 (%1 w/v)
çözeltileri ilave edilmiş ve vortekslenmiştir. Daha sonrasında 20 dakika 50 ºC’de inkübe edilen örneklerin üzerine 75 µl trikloroasetik asit (%10 w/v) çözeltisi eklenmiş ve 10 dakika 1000 g’de santrifüj edilmiştir. Santrifüjlenen karışımdan 75 µl alınıp başka bir mikro plaka içerisine konulmuştur. Üzerine 75 µl dH2O ve 15 µl FeCI3 (%0,1 w/v)
çözeltisi eklenerek pipetajlama yapılmıştır. Ardından spektrofotometrede 700 nm dalga boyunda kör tüpüne karşı absorbansları okunarak indirgeme gücü aktivitesi EC50
değerleri üzerinden hesaplanmıştır (Karamac ve ark., 2002). EC50 değeri absorbans
19
3.7.3. Toplam antioksidan kapasitenin (TAK) belirlenmesi
Antioksidan kapasitesini ölçmek için bu güne kadar birçok yöntem geliştirilmiştir. Bu yöntemlerden birisi de Troloks eşiti antioksidan kapasitenin belirlenmesidir (Albayrak ve ark., 2010). Bu yöntemi ilk kez Miller ve arkadaşları tarafından rapor edilmiş (Miller ve ark., 1993), daha sonrada Re ve arkadaşları tarafından geliştirilmiştir (Re ve ark., 1999). Yöntem; 660, 734 ve 820 nm’de maksimum dalga boylu absorbsiyon spektrumu gösteren ABST (2,2'-azino-bis(3-etilbenztiyoazolin-6-sülfonik asit)) radikalinin absorbans değerlerinin antioksidanlar tarafından baskılanması prensibine dayanmaktadır (Albayrak ve ark., 2010). Buna göre potasyum persülfit ile ABTS’nin oksidasyonu sonucu ABTS•+ radikali oluşturulur. Antioksidanlar varlığında çözelti absorbansında meydana gelen azalma toplam antioksidan kapasite ile doğru orantılıdır. Trolox (6-hidroksi-2, 5, 7, 8-tetrametilkroman- 2-karboksilik asit), E vitaminin suda çözünen analoğu olup, standart referans olarak kullanılır. Analiz geniş bir şekilde bitkilerin antioksidan özelliklerini tespit etmek için kullanılabilmektedir (Ali ve ark., 2008). Toplam antioksidan kapasite (TAK) ABTS metodu kullanılarak belirlenmiştir (Erel, 2004). Tohum homojenatlarının toplam antioksidan kapasitesinin belirlenmesinde standart olarak trolox kullanılmıştır. Kuyucuklara ilk önce 200 µl R1 reaktifi (0,4 M sodyum asetat, pH: 5,8) koyulmuş, üzerine 5 µl değişik konsantrasyonlarda (0,05- 0,1- 0,2- 0,5- 1,0- 2,0- 4,0- 5,0 mM) trolox ve tohum homojenatları konulmuştur. Ardından 20 µl R2 (30 mM sodyum asetat, %35 H2O2, 10 mM ABTS, pH:3,6) koyulduktan
sonra 5 dk bekletilip 660 nm dalga boyunda kör tüpüne karşı absorbansları belirlenmiştir. TAK değerleri µmol Troloks eşleniği/mg protein olarak hesaplanmıştır
3.7.4. Toplam oksidan kapasitenin (TOK) belirlenmesi
Aspir tohumlarında toplam oksidan kapasite (TOK) belirlenmesinde çeşitli oksidanların varlığında ferrous demirin Fe(II) ferrik demire Fe(III) oksidasyonunun ölçülmesi prensibi kullanılmıştır (Erel, 2005). Yönteme göre asitik ortamda Fe(II)’nin Fe(III)’e oksidasyonu oksidan ajanlarla sağlanmakta ve Fe(III) xylenol turuncusunu oksitleyerek renk değişimine sebep olmaktadır. Yöntemde standart olarak hidrojen peroksit (H2O2)
çözeltisi kullanılmakta ve sonuçlar µmol H2O2 eşleniği/mg protein olarak
20
Bitki homojenanatlarında TOK belirlenmesinde kullanılan yöntemde değişik konsantrasyonlarda 1, 2, 4, 10, 20, 50, 200, 100, 150, 200, 400, 500 µM H2O2 ve tohum
homojenatları (10 mg/ml) hazırlanmış ve 35 µl mikro plaka kuyucuklarına koyulmuştur. Üzerine 225 µl R1 reaktifi (25 mM H2SO4 içerisinde hazırlanmış 150 μM xylenol
orange, 140 mM NaCl, 1.35 M glycerol in solution, pH 1.75) eklenmiş ve 530, 560, 800 nm dalga boyunda kör tüpüne karşı absorbans değerleri belirlenmiştir. Ardından üzerine 11 µl R2 (25 mM H2SO4 içerisinde hazırlanmış 5mM ferrous ammonium sülfate, 10
mM o-dianisidine) solüsyonundan koyup 3 dk bekletmiş ve 530, 560, 800 nm dalga boyunda absorbans değrleri okunmuş ve TOK değerleri µmol H2O2 eşleniği/mg protein
olarak hesaplanmıştır.
3.8. Antioksidan enzim aktivitelerinin belirlenmesi
3.8.1. Katalaz (CAT) (EC: 1.11.1.6) enzim aktivitesinin belirlenmesi
Ultra viole (UV) ışık bölgesi olan 240 nm’de absorbans veren hidrojen peroksitin katalaz tarafından suya dönüştürülmesinin spektrofotometrik olarak ölçülmesine dayanan yöntemde (Aebi, 1984) hidrojen peroksitin ekstinksiyon katsayısı 0.00364 L/mmol.mm olarak kullanılmıştır. Aktivite ölçümü için 96’lık UV geçirgen mikroplaka kuyucuklaru içerisine 240 µl fosfat tamponu (50 mM, pH: 7,0) 10 µl örnek (0,5 mg/ml) ve 50 µl H2O2 (50 mM) sırasıyla eklenmiş ve enzimatik reaksiyon başlatılmıştır.
Absorbanstaki azalışın 240 nm’de 2dk boyunca ölçülmesi ile CAT aktivitesi bir dakikada, bir miligram protein içeren homojenatının nötürleştirdiği hidrojen peroksit miktarı olarak hesaplanmıştır.
3.8.2. Süperoksit dismutaz (SOD) (EC.1.15.1.1) enzim aktivitesinin belirlenmesi
SOD substratı olan süperoksit radikali, alkalin pH’da ışık ve atmosferik oksijen ile pyrogallol oto-oksidasyonu sonucu oluşmakta ve oluşan bu radikal, pyrogallolü sarı renkli kromofora çevirmektedir (Şekil 3.4). Oluşan kromoforun 440 nm’de takip edilmesiyle de süperoksit dismutaz aktivitesi ölçülebilmektedir (Marklund and Marklund, 1974).
21
Şekil 3.4. SOD aktivite ölçüm yönteminin prensibi.
Yönteme göre 96’lık mikroplaka içine 250 µl tampon çözeltisi (50 mM Tris, 10 mM EDTA, pH: 8.2), 30 µl Pyrogallol (20 mM) ve değişik miktarlarda (10, 20, 30, 40, 50 µl) örnekler yüklenmiş ve 440 nm’de absorbans değişimi spektrofotometrik olarak ölçülmüştür. Toplam SOD aktivitesi pyrogallolün oto-oksidasyonun 440 nm baskılanması prensibi ile hesaplanmıştır. Buna göre SOD aktivitesi pyrogallol oto-oksidasyonunu %50 engelleyen protein miktarı olarak belirlenmiştir.
3.8.3. Glutatyon redüktaz (GR): (EC: 1.8.1.7)
Glutatyon redüktaz (GR), flavin adenin dinükleotid (FAD) içeren flavoprotein yapıda bir antioksidan enzimdir. GR, okside glutatyonun (GSSG) indirgenmiş glutatyona (GSH) dönüşümünü katalizler ve bu işlemde elektron kaynağı olarak NADPH kullanır (Karabulut ve ark., 2016).
GSSG + NADPH → 2GSH + NADP
Tohum örneklerinde GR aktivite ölçümü Foster ve Hess (1980)‘in geliştirdiği ve labımızda mikroplaka ölçümlerine göre modifiye ettiğimiz yönteme göre yapılmıştır. Buna göre mikroplaka içinde son hacmi 300 µl olan reaksiyon ortamı sırasıyla 225 µl fosfat tamponu (150 mM K2HPO4, 25 mM EDTA, pH: 7,8), 25 µl örnek (5 mg/ml), 25
µl NADPH (2,5 mM) ve 25 µl GSSG (6 mM) ile hazırlanmış ve 340 nm dalga boyunda kör tüpüne karşı absorbans değişimleri spektrofotometrik olarak ölçülmüştür. GR aktivitesi bir dakikada, bir miligram protein içeren homojenatının yükseltgediği NADPH miktarı (ɛ340 = 6.22 mM
+
-1
22
3.8.4. Askorbat peroksidaz (APx)
Bitki hücrelerinde H2O2’in detoksifikasyonunda en önemli indirgen substrat askorbattır.
APx enzimi askorbatı kullanarak hidrojen peroksiti suya parçalamaktadır. Bitki dokularında APx aktivitesi Sairam ve Saxena (2000)’nın yöntemine göre modifiye edilmiş protokol doğrultusunda belirlenmiştir. Yönteme göre mikroplakalar içinde gerçekleştirilen reaksiyon ortamında 50 µl örnek (1 mg/ml), 100 µl fosfat tamponu (100 mM K2HPO4, pH: 6,6 ) ve 10 µl askorbat (1,5 mM) birbirleriyle karıştırılmıştır.
Daha sonra 50 µl H2O2 (5 mM) ile reaksiyon başlatılmış ve 290 nm dalga boyunda
absorbans değişim hızı spektrofotometrik olarak belirlenmiştir.
3.9. İstatistiksel Analiz
Aritmetik ortalamaları, standart sapmaları (SD) ve ortalamanın standart hataları (SEM) hesaplanan veriler ortalama ± SEM şeklinde ifade edilmiştir. Deney grupları arasındaki istatistiksel farklılığı belirlemek için tek yönlü varyans analizi (one-way ANOVA) ve grupların birbirleri ile karşılaştırılması için post hoc testlerden Tukey HSD (Tukey’s Honestly Significant Difference) testi uygulanmıştır. İstatisitiksel analizlerde p<0,05 değeri anlamlılık düzeyi olarak belirlenmiştir. İstatistiksel hesaplamalar ve karşılaştırmalar GRAPHPAD programı kullanılarak gerçekleştirilmiştir.
23
4. BULGULAR
4.1. Hidroproming ve farklı ışık kaynaklarının tohum çimlenmesi üzerine fizyolojik etkileri
Aspir bitkisinin sina çeşidine (Carthamus tinctorius L.) ait tohumların magentalarda çimlendirme çalışmaları her magentada 25 tohum olacak şekilde 3 tekerrürlü (her uygulamada 3 magenta kullanılmıştır) olarak yapılmıştır. Tohum örneklerine 0 (kontrol), 2, 4 ve 8 saat hidropriming uygulaması gerçekleştirilmiştir. Priming uygulamasından sonra bazı tohumlar çimlendirme denemelerine alınmıştır (Şekil 4.1). Çimlendirme çalışmaları magenta kutuları içerisinde bulunan kurutma kağıdı bir miktar su ile ıslatılmış ve aralarına tohumlar yerleştirerek çimlendirilmeye bırakılmıştır. İki günde bir kurutma kağıtları üzerine bir miktar su damlatıp kağıtların sürekli nemli olması sağlanmıştır. Bu magentalar içerisinde gerçekleştirilen çimlenme deneyleri, oda sıcaklığında karanlık ortamda, floresan ışık altında ve beyaz, mavi, kırmızı ve karışık (beyaz + mavi+ kırmız) LED ışıkları altında yapılmıştır. Tüm denemelerde 5-7 gün içinde %100 çimlenme gözlendiği için istatistik analizi yapılmamıştır. 21 gün sonra bitkilerin kök sayıları, kök uzunlukları ve gövde uzunlukları belirlenmiştir.
Şekil 4.1. Farklı LED ışıkları altında Aspir bitkisinin çimlendirilmesi, a) beyaz LED, b) karışık LED, c) kırmızı LED, d) mavi LED.
a b
24
4.1.1. Hidropriming ve farklı ışık kaynaklarının köklenme üzerine etkileri
Hidropriming ve farklı ışık kaynaklarının Aspir bitkisinin köklenmesi üzerine etkileri incelendiğinde (Şekil 4.2), genel olarak hidropriming uygulamalarının köklenme üzerine negatif bir etki gösterdiği görülmektedir. Ancak karanlık ortamda yetiştirilen bitkilerde meydana gelen köklenme oranları ışıklı ortamda yetişenlere oranla farklı davranış göstermiş, karanlık ortamda hidropriming uygulaması köklenmeyi anlamlı ölçüde yükseltmiştir.
Şekil 4.2. Hidropriming ve LED ışık uygulamalarının Aspir bitkisinin köklenmesi üzerine etkileri. Yatay eksen ekim öncesi hidropriming uygulama süresini (saat) göstermektedir.
Hidropriming uygulamasının köklenme üzerine etkileri incelendiğinde karanlık ortamda gerçekleştirilen uygulamanın köklenme üzerine pozitif bir etki oluşturduğu gözlemlenmiştir. Ancak ışıklı ortamlarda hidropriming uygulamasının köklenme üzerine olumsuz etkilerinin olduğu görülmektedir. Hidropriming uygulanmamış bitkiler ele alındığında, ışıklı ortamda köklenmenin karanlık ortama oranla daha yüksek oranlarda gerçekleştiği görülmüştür. Beyaz LED ışık altında köklenme derecesinin karanlık ortama oranla yaklaşık üç kat artış gösterdiği belirlenmiştir. Ayrıca, mavi,
25
kırmızı ve karışık LED ışıkları altında köklenme derecesinin beyaz LED ve floresan ışık altında yetişen bitkilere oranla daha düşük oranlarda gerçekleştiği belirlenmiştir.
4.1.2. Hidropriming ve farklı ışık kaynaklarının kök uzunluğu üzerine etkileri
Hidropriming ve LED ışık uygulamalarının aspir bitkisinin kök uzunluğu uygun cetvel kullanılarak ölçülmüştür (Şekil 4.3).
Şekil 4.3. Aspir bitkisinin kök uzunluğu ölçümü.
Hidropriming ve farklı ışık kaynaklarının aspir bitkisinin kök uzunlukları üzerine etkileri Şekil 4.4’te özetlenmiştir.
Şekil 4.4. Hidropriming ve farklı ışık kaynaklarının Aspir bitkisinin kök uzunluğu üzerine etkileri. Yatay eksen ekim öncesi hidropriming uygulama süresini (saat) göstermektedir.
26
Deney sonuçları ışıklı ortamda köklendirilen aspir tohumlarının, hidropriming uygulamasına tabi tutulduklarında kök uzunluklarında anlamlı bir azalma meydana geldiğini göstermiştir. Ayrıca hidropriming uygulanmamış örneklerde farklı ışık kaynakları altında köklendirilen aspir tohumlarının kök uzunluklarının karanlıkta bekletilen tohumlara oranla daha yüksek kök uzunluğuna sahip oldukları belirlenmiştir. Köklenme sayısına paralel bir şekilde hidropriming yapmadan beyaz, mavi ve kırmızı LED ışıklar altında köklerinin uzunluklarının karanlık ortam, floresan ışık ve karışık LED altında gerçekleşenden daha fazla meydana geldiği sonucuna ulaşılmıştır. Ayrıca, karanlık ortamda hidropriming uygulamasının aspir tohumlarının köklenmesi üzerine olumlu etkileri de çalışma soucunda elde edilen bir diğer önemli bulgudur.
4. 1.3. Hidropriming ve farklı ışık kaynaklarının gövde uzunluğu üzerine etkileri
Yaprak ve üreme organlarını taşıyan, genellikle toprak üstünde bulunan bitki eksenine gövde adı verilir. Aspir bitkisinde hidropriming uygulamasının ve farklı ışık kaynaklarının gövde uzunlukları üzerine fizyolojik etkileri çalışma kapsamında araştırılmıştır. Uygun ölçüm yöntemleriyle ölçülen (Şekil 4.5) bitkilerin gövde uzunluklarına dair sonuçlar Şekil 4.6’da özetlenmektedir.
Şekil 4. 5. Aspir bitkisinin gövde uzunluğunun ölçümü.
Hidropriming ve LED ışık uygulamalarının gövde uzunluğu üzerine etkisi incelendiğinde hidroprimingsiz karanlık ortamdaki gövde uzunluğunun en fazla olduğu görülmüştür. Benzer şekilde, hidropriming ve ışık uygulamalarının gövde uzunluğu üzerine etkileri karanlık ortama ve hidroprimingsiz ortamlara oranla daha düşük düzeylerde gerçekleşmiştir. Beyaz, mavi ve kırmızı LED ışıkları altında çimlenen aspir bitkilerinin gövde uzunlukları birbirlerinden anlamlı ölçüde farklı sonuçlar vermemiştir. En belirgin baskılayıcı etki floresan ışık kaynağında görülmüştür.
27
Şekil 4.6. Hidropriming ve farklı ışık kaynaklarının Aspir bitkisinin gövde uzunluğu üzerine etkileri. Yatay eksen ekim öncesi hidropriming uygulama süresini (saat) göstermektedir.
4.2. Hidroproming ve farklı ışık kaynaklarının tohum biyokimyasal içerikleri üzerine fizyolojik etkileri
4.2.1. Hidroproming ve farklı ışık kaynaklarının tohum toplam fenolik içeriği üzerine etkileri
Fenolik bileşikler bitkilerde yüksek oranda yer alan ve kuvvetli antioksidan özellik gösteren sekonder metabolitlerdir. Benzen halkası içeren bu organik maddeler, kimyasal açıdan flavonoid olmayanlar (hidroksisinnamik, hidroksibenzoik asit ve türevleri, fenolik alkoller) ve flavonoidler (antosiyaninler, flavon-3-ol monomerleri ve polimerleri, flavonoller ve proantosiyanidinler) olmak üzere iki gruba ayrılmaktadır. Bitkilerde toplam fenolik madde miktarını belirlemede en çok kullanılan yöntem folin yöntemidir. Bu metodun sonuçları standart bir fenolik maddeye (gallik asite) eş değer olarak verilmektedir (Arkan, 2011). Çalışmamızda kullanılan tohumların toplam fenolik madde içerikleri gallik asit eş değeri olarak hesaplanmış ve Şekil 4.7’de özetlenmiştir.
28
Şekil 4.7. Hidroproming ve farklı ışık kaynaklarının tohum toplam fenolik içeriği üzerine etkileri. Yatay eksen ekim öncesi hidropriming uygulama süresini (saat)
göstermektedir. Hidropriming uygulamaları farklı ışık kaynaklarının altında
gerçekleştirilmiştir.
Tohumlardafenolik madde içeriği sonuçlarına göre hidropriminge tabi tutulmamış kuru tohumlarda fenolik madde miktarının hidropriming uygulanan diğer bütün tohumlardan daha yoğun olduğu görülmüştür. Bununla birlikte hidroprimig uygulaması tohum yaş ağırlığını yükselttiği için (veriler gösterilmemiştir) kuru tohuma göre daha düşük olarak belirlenmiştir. Gün ışığı altında gerçekleştirilen hidropriming uygulamalarında tohum toplam fenolik miktarının 2, 4, 8 ve 16 saat hidropriming yapılan örneklerde, uygulama süreleriyle ters orantılı olarak azaldığı belirlenmiştir. Ancak buna ters bir şekilde floresan ışık, beyaz ve mavi LED aydınlatmalar altında gerçekleştirilen hidropriming uygulamaları zamanla toplam fenolik içeriğini artış yönünde etkilemiştir. Kırmızı ve karışık LED ışıklarının altında gerçekleşen hidropriming uygulamalarının toplam fenolik madde içeriğinde anlamlı bir değişime neden olmadıkları anlaşılmaktadır. Hidropriming uygulanan tohumlarda en fazla toplam fenolik içeriği karanlık+4s, floresan+16s, beyaz+8s, mavi+8s, kırmızı+4s ve karışık+16s olarak kaydedilmiştir. Ayrıca karanlık ortamdaki örneklerin toplam fenolik miktarlarının genel olarak diğer örneklerden daha fazla olduğu görülmektedir.