T.C
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
KADIN HASTALIKLARI VE DOĞUM ANABİLİM DALI
PREEKLAMPTİK GEBELERDE SERUM VE PLASENTADA
OKSİDATİF STRES PARAMETRELERİNİN
DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. Zeynep TOSUN
TEZ DANIŞMANI
Yrd. Doç. Dr. Muhammet Erdal SAK
DİYARBAKIR
(2012)
TEŞEKKÜR
Uzmanlık eğitimim boyunca; değerli bilgileri ve deneyimlerinden yararlanmamı sağlayan ve iyi bir eğitim almamdaki katkılarından dolayı sayın hocam Prof. Dr. Talip Gül’e tezimin hazırlanmasında bilgi ve deneyimleri ile yardımlarını esirgemeyen Yrd.Doç.Dr. M.Erdal Sak ve Kadın Hastalıklan ve Doğum Anabilim Dalı` nın diğer öğretim üyelerine, Doç.Dr. Ahmet Yalınkaya, Yrd.Doç Dr. M.Sıddık Evsen’e, Yrd.Doç. Dr. H.Ender Soydinç`e, Yrd.Doç.Dr. Ali Özler ´e, Yrd.Doç. Dr. Abdulkadir Turgut´ a, Yrd.Doç.Dr. Neval Yaman Görük´ e birlikte çalıştığım tüm mesai arkadaşlarıma, tezimin hazırlanmasında katkıları olan Bioistatistik Anabilim Dalına ve her zaman yanımda olan ve emeklerini asla ödeyemeyeceğim eşime, biricik kızıma anneme ve babama teşekkür eder, sevgi ve saygılarımı sunarım.
Dr. Zeynep Tosun Diyarbakır 2012
ÖZET
Preeklampsi (PE) gelişmiş ve gelişmekte olan ülkelerin en önemli maternal ve perinatal morbidite ve mortalite nedenlerinden birisidir. Henüz etyopatogenezi tam aydınlatılamamıştır ve tanısında spesifik bir belirteç yoktur. Oksidatif stres genellikle hücresel reaktif oksijen türlerinin (ROT) üretimi ile antioksidan kapasite arasındaki dengesizlikten kaynaklanan bir durum olarak açıklanmaktadır. Normal plasental dokularda ROT üretimi ve biyolojik oksidasyon süreçleri gösterilmiştir. Preeklampside aşırı ROT üretimi için biyokimyasal bazı açıklamalar getirilmiştir. Bu sendromda antioksidan sistemin baskılanarak oksidatif stresin arttığına dair deliller bulunmuştur. Çalışmamızda plasenta ve maternal kanda oksidatif stres, antioksidan savunma sistemi belirteçlerinin preeklampsinin patogenezi ile ilişkisini göstermektir.
Çalışmamız, Nisan 2011 ile Ağustos 2011 tarihleri arasında Dicle Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum Bölümü’ne başvuran 23 preeklamptik, 21 sağlıklı gebe ile yapılmıştır. Çalışmamızda 20-30 yaşında, 36-38 hafta gebeliği olan, ek bir hastalığı olmayan gebelerde doğumdan önce her iki grupta serumda ve doğum sonrası plasentada oksidatif stres parametresi olan Total Oksidan statüs(TOS), Asimetrik dimetil arginin (ADMA), Nitrik oksit (NO), Malonildialdehid(MDA), antioksidan olan Total Antioksidan Statüs(TAS), Paraoksanaz(PANX), katalaz(KAT); TAS ve TOS değerleri ile OSİ(oksidatif stres indexi) parametreleri hesaplandı.
Preeklampsi grubunda sağlıklı gebelere göre plasentada TAS , TOS , ADMA , NO , MDA ,katalaz istatistiki olarak anlamlı fark vardı ve bu parametrelerin arttığı görüldü. Her iki grupta plasentada ve kanda PANX da istatistiki olarak anlamlı fark görülmedi.
Preeklampsi grubunda sağlıklı gebelere göre serumda MDA, TOS, TAS düzeylerinde anlamlı fark vardı. Preeklampsi grubunda MDA, TOS un artığı TAS´ ın azaldığı görüldü.Her iki grupta serumda NO, ADMA, PANX, katalaz da istatistiki olarak anlamlı fark görülmedi.
Preeklampsi ve kontrol grubunda plasentada ve serumda OSİ hesaplandı istatistiki olarak anlamlı fark vardı. OSİ ´nin hem plasental hem de serumda preeklampsi grubunda arttığı saptandı.
Çalışmamızda amaç preeklampsi olan hastalarda serum ve plasentada oksidatif stres, antioksidan mekanizmalardaki değişimi göstererek preeklampsi etyopatogenezini aydınlatmaya çalışmaktır. Preeklampsi etyopatogenezi tam olarak aydınlatılabilirse hastalar daha erken tanı alabilir, önlemeye yönelik tedbirler alınabilir.
Çalışmamızda sonuç olarak preeklampsi grubunda oksidatif stresin arttığı sonucuna vardık. Preeklampsi grubunda artmış oksidatif strese rağmen antioksidan parametrelerde anlamlı bir fark olmaması üzerine antioksidan savunma mekanizmalarının yeterince çalışmadığını sonucuna vardık.
Anahtar kelimeler: Preeklampsi, plasenta, TAS(Total antioksidan statü),
TOS(Total oksidan statü), OSİ(oksidatif stres indeksi), ADMA(asimetrik dimetilarjinin), NO(Nitrikoksit), katalaz, MDA(Malondialdehit), PANX(paraoksanaz)
SUMMARY
Preeclampsia (PE) in developed and developing countries is one of the most important causes of maternal and perinatal morbidity and mortality. Etiopathogenesis has not been elucidated yet, and there is no specific marker in the diagnosis. Oxidative stress is often the cellular reactive oxygen species (ROS) production are described as a condition caused by an imbalance between antioxidant capacity. Rod normal placental tissue shown in the production and biological oxidation processes. Some biochemical explanations for the production of excessive Rod was in preeclampsia. In this syndrome, the evidence of increased oxidative stress, antioxidant system was suppressed. In our study, the placenta and maternal blood oxidative stress markers of antioxidant defense system and show the relationship between the pathogenesis of preeclampsia.
Our study between April 2011 and August 2011 at Dicle University Faculty of Medicine, Department of Women's Diseases and presented on 23 preeclamptic, 21 healthy pregnant women was used. In our study, 20-30 years old, 36-38 weeks of pregnancy, which is a disease in addition to the non-pregnant women the placenta before birth and postpartum serum oxidative stress in both groups, which is a parameter Total oxidant status (TOS), Asymmetric dimethylarginine(ADMA), nitric oxide(NO), malondialdehyde(MDA), antioxidants, total antioxidant status(TAS), paraoxanase(Panxi), catalase(CAT), TAS and TOS and OSI values were measured.
Placenta in preeclampsia group compared to healthy pregnant TAS, TOS, ADMA, NO, MDA, catalase, and these parameters were statistically significant difference in both groups increased in the placenta and blood Panxi görüldü. Her statistically significant difference was observed.
Pre-eclampsia compared to healthy pregnant group, serum MDA, TOS, TAS preeklampsi group, no significant difference in MDA, TAS, TOS levels.MDA,TOS levels increased and TAS levels decrased. The two groups serum NO, ADMA, Panxi, catalase, a statistically significant difference was observed.
Pre-eclampsia and the placenta and serum OSI was calculated in the control group, a statistically significant difference .OSI the preeclampsia group was increased in the serum and placental both.
Purpose of the study in patients with pre-eclampsia serum and placental oxidative stress, antioxidant mechanisms by showing change in the etiopathogenesis of preeclampsia patients.Preeklampsi can etiopathogenesis, prevention measures can
be taken.
In our study, as a result of oxidative stress caused an increase in the preeclampsia group .Preeklampsi group, in spite of increased oxidative stress on the lack of significant difference in antioxidant parameters concluded that the antioxidant defense mechanisms not tried hard enough.
Key words: Preeclampsia, placenta, TAS (total antioxidant status), TOS (Total oxidant status), OSI (oxidative stress index), ADMA(asymmetric dimethyl arginine), NO (nitric oxide), catalase(CAT), MDA (malondialdehyde), PANX(paraoxanase)
İÇİNDEKİLER SAYFA NUMARASI TEŞEKKÜR ...i ÖZET...ii-iii SUMMARY...iv-v İÇİNDEKİLER ...vi
SİMGELER VE KISALTMALAR ...vii-ix TABLOLAR...x ŞEKİLLER...xi 1.GİRİŞ ...1 2.GENEL BİLGİLER...2 2.1.Giriş...2-3 2.2.Terminoloji-Sınıflama...,……..4
2.3.Preeklampside risk faktörleri ...11
2.4.Preeklampside patogenez...,...12
2.5.Preeklampsi oluşumunda etyopatogenez...14
2.6.Preeklampsi öngörüsü ve önlenmesi……….25
2.7. Oksidan/Antioksidan sistem ...26
2.8.Ölçümünü yaptığımız ve karşılaştırdığımız parametreler...31
2.8.1.NO...31 2.8.2.ADMA...32 2.8.3.PANX. ...36 2.8.4.MDA... 38 2.8.5.TAS,TOS,OSI...39 3.MATERYAL METOD... 39 4.BULGULAR...45 5.TARTIŞMA...56 6.SONUÇ...63 7.KAYNAKLAR ...64
SİMGELER VE KISALTMALAR TAS: Total antioksidan kapasite TOS: Total oksidan kapasite OSİ: Oksidatif stres indeksi
ADMA: Asimetrik dimetil metilarjinin PANX,PON-1: Paroksinaz
MDA: Malondialdehit KAT: Katalaz
ACE: Angiotensin Converting Enzyme
ACOG: American Collage of Obstetricians and Gynecology DM: Diabetes Mellitus
EDRF : Endotelyal Kaynaklı Relaksing Faktör EDTA: Etilen Diamin Tetra Asetik Asit
GST: Glutatyon S Transferaz
HELLP: Hemolysis, Elevated Liver, Low Platelet HT: Hipertansiyon
ICAM-I: İntersellüler Adezyon Molekülü-1 IL: İnterlökin
IUGR: İntrauterin Gelişme Geriliği KB: Kan Basıncı
KVH: Kardiyo Vasküler Hastalık MAP : Ortalama Arteryel Basınç NO: Nitrik Oksit
PE: Preeklampsi PGI2: Prostasiklin
PIH : Gebeliğin İndüklediği Hipertansiyon TXA2: Tromboksan A2
VCAM-I: Vasküler Hücre Adezyon Molekülü VKI : Vücut Kitle İndeksi
ALT: Alanin Transferaz AST: Aspartat Transferaz CRP: C-Reaktif Protein
FFA: Serbest yag asidi (Free Fatty Acid)
HDL: Yüksek Dansiteli Lipoprotein (High Density Lipoprotein) IFN: interferon
IUGR: İntrauterin Gelisme Geriligi KVS: Kardiyovasküler Sistem
LDL: Düsük Dansiteli Lipoprotein (Low Density Lipoprotein) LDH: Laktat Dehidrogenaz
MI: Myokard infarktüs
VEGF : Vaskuler endotelyal büyüme faktörü sFlt-1/sVEGFR-1 : Solubl fms benzeri
tirozin kinaz-1
PlGF : Plasenta kökenli büyüme faktörü CTB : Sitotrofoblast
STB : Sinsityotrofoblast
DIC/DIK : Dissemine intravasküler koagülasyon PIH : Gebeliğin neden olduğu hipertansiyon ECM : Ekstraselüler matriks
VSM : Vasküler sitoplazma membranı COX : Siklooksijenaz
RAAS : Renin-anjiyotensin-aldosteron sistemi SGA : Gebelik haftasına göre küçük
HLA-G : insan lökosit antijeni-G
PECAM : Plasental endotelyal hücre adezyon molekülü ET-1: Endotelin-1
PRMT: Protein arjinin metil transferaz DDAH: Arjinin dimetil amino hidrolaz SDMA: Simetrik dimetil arjinin
TABLOLAR
Tablo No Tablo Adı Sayfa
Tablo 1 Uluslar arası hipertansiyon cemiyetinin kabul ettiği sınıflama 4
Tablo 2 Ağır ve hafif preeklampsinin ayrım kriterleri 9
Tablo 3 Preeklampside risk faktörleri 12
Tablo 4 Hasta ve kontrol grubu yaş, gravite, parite, sistolik, diastolik kan basıncı, kilo, boy, BMI karşılaştırılmaı
45
Tablo 5 Hasta ve kontrol grubu tam kan değerleri karşılaştırılmaı 46
Tablo 6 Hasta ve kontrol grubu biyokimya değerleri karşılaştırılmaı 47
Tablo 7 Hasta ve kontrol grubu P ve S ADMA,
P ve S NO, P ve S MDA, P ve S KATALASE, P ve S PANX düzeylerinin karşılaştırılması 48
Tablo 8 Hasta ve kontrol grubu P ve S TAS,
P ve S TOS,
P OSI,S OSI düzeylerinin karşılaştırılması
49
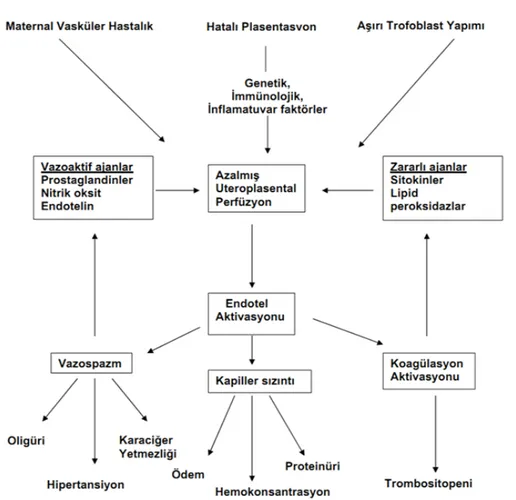
Şekil 1.Preeklampsi patofizyolojisi
Şekil 2.Plasental (erken başlangıçlı) ve maternal (geçBaşlangıçlı) preeklampsi Şekil 3.Preeklampsi gelişiminde preklinik (evre1) ve klinik (evre2) süreç Şekil 4. Trofoblast hücre invazyonu
Şekil 5. İntervillöz aralığın kanlanması
Şekil 6. Endotel disfonksiyonu, aktivasyon etkenleri ve sonuçları Şekil 7. NO sentezi
Şekil 8. Vücutta bulunan başlıca metillenmiş arjinin türevleri Şekil 9.ADMA’nın NOS inhibisyonu
Şekil 10. NO’nun DDAH’ı inhibe etmesi Şekil 11. Paraoksanazın HDL ile etkileşimi Şekil 12: Oksidatif stres indeksi
Obstetrik tanı ve tedavi hizmetlerindeki büyük gelişmelere rağmen preeklampsi gelişmiş ülkelerde maternal ve fetal morbidite ve mortalitenin önde gelen nedenlerinden biridir. Farklı oranlar bildirilmekle beraber tüm gebeliklerin %7-10'unda görülür (1). Preeklampsi; proteinüri, ödem ve sıklıkla diğer organ sistemi bozukluklarının eşlik ettiği gebelikle oluşan bir hipertansiyon sendromudur. Bu durum gebe insana özgüdür ve en çok primigravidalarda görülür (2). Progressif olarak ilerler ve ancak doğumda plasenta ve eklerinin vücuttan ayrılması ile son bulur. Tanım olarak; gebeliğin 20. haftasından sonra, trofoblastik hastalık ve çoğul gebelik varlığında 20. haftadan önce, ortaya çıkan hipertansiyona ödem ve proteinürinin eklenmesine preeklampsi denir (3). Erken tanı ile tedavisi veya buna bağlı komplikasyonların önlenmesi mümkün olabildiğinden, fizyopatolojik mekanizması çözümlendiğinde tedavi alanında önemli bir gelişme kaydedilecektir.
Etyopatogenezinde uterin kan damarlarının anormal trofoblast invazyonu, vasküler endotelyal disfonksiyon, anormal nitrik oksit ve lipid metabolizması, fetoplasental doku ile maternal doku arasında immünolojik intolerans, gebeliğin enflamatuar ve kardiyovasküler değişimlerine uyumsuzluk, genetik anomaliler ve metabolik ve nutrisyonel faktörler bildirilmektedir (4).
Preeklampsinin fizyopatolojisinde vazospazm esas faktördür. Vazospazm muhtemelen vasküler hasarında ortaya çıkışına önderlik etmektedir. Preeklampsi fizyopatolojisinin temelinde rol oynayan endotel hasarı, yaygın vazospazm, azalmış organ perfüzyonuna neden olur. Vazospazm ve bozulmuş organ perfüzyonu tüm anne organlarını etkilemektedir.
2.1. GİRİŞ
Hipertansiyona tüm gebeliklerin % 6-20’sinde rastlanıp, dünyadaki hem maternal hem de perinatal mortalitenin en sık rastlanan dört sebebi arasında yer alır. Preeklampsi, nulliparlarda sık görülen, 20. haftadan sonra ortaya çıkan hipertansiyon petyolojiler kompleksi olarak tanımlanması mümkün olan bir gebelik patolojisidir (5). Progresif olarak ilerler ve ancak doğumda plasenta ve eklerinin vücuttan ayrılması ile son bulur. Bu durum gebe insana özgüdür ve en çok primigravidalarda görülür (2).
Berg ve arkadaşlarının yaptığı çalışmada (6), ABD’de 1991’den 1997’ye kadar olan sürede ortaya çıkan 3201 maternal ölümün %16’sının gebelik ile ilişkili hipertansiyona bağlı olduğu gösterildi. Yine bu çalışmada, preeklampsiye bağlı ölümün siyah ırkta 3 kat fazla olduğu gösterildi (6).
2.2. TERMİNOLOJİ-SINIFLAMA
Son yıllarda gebelikle birlikte bulunan hipertansif hastalıkları tarif etmede kullanılan terminoloji ve sınıflandırma gittikçe karışık ve yanıltıcı olmaktadır. Gebelikten önce de mevcut olan hipertansiyon ile gebeliğin neden olduğu hipertansiyon (PIH = Pregnancy İnduced Hypertension) ayırımı kritiktir. Bu iki klinik antitenin patofizyolojileri ayrı, gerek maternal gerekse fetal prognozları farklı olup, bunlara bağlı olarak tedavileri de farklıdır. Ulusal Yüksek Kan Basıncı Eğitim Programı (NHBPEP) çalışma grubu (7), gebelikte hipertansiyon tanısı konusunda uzun süredir var olan karmaşık terminolojiyi belli bir düzene sokmak için, yeni bir sınıflandırma sistemi önerdi. Bu sınıflandırma sistemine göre, gebelikle ilişkili hipertansif hastalıklar; gestasyonel hipertansiyon, kronik hipertansiyon, kronik hipertansiyon zemininde süperempoze preeklampsi, preeklampsi ve eklampsi olmak üzere 5 formda tanımlandı (Tablo 1). Bu sınıflamadaki temel amaç, gebelikten önce var olan hipertansiyon ile çok kötü prognoza sahip olabilen preeklampsinin ayrımını yapabilmektir. Ancak unutulmaması gereken bir durum da ikisinin bir arada olabileceğidir.
Gebelikte hipertansiyon, gebelik öncesi veya ilk trimestrdeki kan basıncına göre diastolik basıncın 25 mm Hg’dan fazla yükselmesi veya en az 6 saat ara ile iki defa yapılan ölçümlerde kan basıncının 140/90 mm Hg veya üzerinde olması durumudur (8).
1: Uluslararası Hipertansiyon Cemiyeti’nin kabul ettiği sınıflama sistemi:
A-Gestasyonel
Hipertansiyon • Gebelikte ilk kez TA( Tansiyon Arteriyel ) ≥ 140/90 mmHg olması • Proteinüri olmaması
• Postpartum 12. haftaya kadar TA(Tansiyon Arteriyel)’nın normale dönmesi • Preeklampsinin diğer bulguları bulunabilir, epigastrik rahatsızlık veya trombositopeni
B-Preeklampsi Minimum Kriterler
• 20. gebelik haftasından sonra TA(Tansiyon Arteryel) ≥ 140/90 mmHg olması • Proteinürinin ≥ 300 mg/24 saat veya dipstikle ≥ 1+ olması
İleri Kriterler
• TA(Tansiyon Arteryel) ≥ 160/110 mmHg olması • Proteinürinin ≥ 5 g/24 saat veya dipstikle ≥ 2+ olması • Serum kreatininin > 1,2 mg/dl olması
• Trombositlerin < 100.000 /mm3 olması
• Mikroanjiyopatik hemoliz [yükselmiş LDH(Laktik Dehidrogenaz)]
• Yükselmiş ALT(Alanin Aminotransferaz) veya AST(Aspartat Aminotransferaz) • Persistan baş ağrısı veya diğer serebral veya görsel bozukluklar
• Persistan epigastrik ağrı
C-Eklampsi •Preeklamptik bir kadında diğer nedenlere bağlanamayan generalize tonik-klonik nöbetlerin olması D-Süperimpoze Preeklampsi (Kronik Hipertansiyon üzerine eklenmiş)
• 20. gebelik haftasından önce proteinürisi olmayan hipertansif bir kadında yeni başlayan ≥ 300mg/24 sa proteinüri olması
• 20. gebelik haftasından önce proteinürisi olan hipertansif bir kadında proteinüri ve kan basıncında ani yükselme veya trombosit seviyesinin <100.000 /mm3 olması
E-Kronik Hipertansiyon
• Gebelikten önce veya gebeliğin 20. haftasından önce TA(Tansiyon Arteryel) ≥ 140/90 mmHg olması veya
• Hipertansiyonun ilk olarak 20. gebelik haftasından önce tespit edilmesi ve postpartum 12. haftadan sonra devam etmesi
2.2.A. Gestasyonel Hipertansiyon
da daha fazla değere ilk defa gebelik sırasında yükselmiş olmalı, proteinüri eşlik etmemeli ve postpartum 12. haftaya kadar kan basıncı değeri normal değerine dönmelidir. Bu yüzden gestasyonel hipertansiyon tanısı ancak doğumdan sonra mümkün olur (9).
Gestasyonel hipertansiyon tüm doğumların %5-10’unda görülmektedir. Sağlıklı nullipar kadınlarda sıklığı %6-17 sağlıklı multipar kadınlarda ise %2-4’tür (10). Sıklık daha önce preeklampsi geçiren ve çoğul gebeliği olanlarda artmaktadır. Tanı esnasındaki gestasyonel yaşa bağlı olarak gestasyonel hipertansiyon preeklampsiye ilerleyebilmektedir. Otuzuncu gebelik haftası öncesi gestasyonel hipertansiyon gelişen kadınların %50’sinde preeklampsi gelişmektedir (11). Preeklampsinin baş ağrısı, trombositopeni, epigastrik hassasiyet gibi bulguları eşlik edebilir. Bu bulgular eşlik ederse hastada preeklampsi gelişme riski daha yüksektir (9).
2.2.B. Kronik Hipertansiyon
Kronik hipertansiyon tanısı koyabilmek için;
- Gebelikten önce de kan basıncının 140/90 mm Hg üzerinde olması
- 20. gebelik haftasından önce kan basıncının 140/90 mm Hg üzerinde ölçülmesi - Postpartum 12. hafta sonrasında da kan basıncının 140/90 mm Hg üzerinde devam etmesi gerekmektedir (9).
Kronik hipertansiyon genellikle multigravid, obez, 30 yaş üstü, diğer organ patolojileri (diabet, renal hastalık, SLE, v.b.) olan hastalarda sıktır. Etyolojisi multifaktöriyel olmasına karşın büyük bir kısmında hipertansiyon sebebi bilinememektedir (esansiyel hipertansiyon). Hipertansiyonda güçlü bir aile hikâyesi mevcuttur. Hasta gebe olsun veya olmasın kronik hipertansiyon ventriküler hipertrofi ve buna bağlı kardiovasküler yetersizlik, serebrovasküler olay ve böbrek hasarına neden olur ve önemli bir morbidite nedenidir. Gebelikte kronik hipertansiyonu olan kadınlarda süperempoze preeklampsi, dekolman plasenta, fetal gelişme geriliği ve
prematürite riski artmıştır (9).Eğer hasta 20. gebelik haftasına kadar görülmemişse kronik hipertansiyon tanısı koymak zorlaşır.
2.2.C. Kronik Hipertansiyon Zemininde Gelişen Preeklampsi
Kronik hipertansiyon tanısı konmuş bir gebede 20. gebelik haftasından sonra kan basıncının yükselmesi ve buna proteinüri eklenmesidir. Kronik hipertansif bir gebede preeklampsi gelişmesi, gebe için önemli bir tehlikedir. Kronik hipertansif gebelerin %25 ve fazlasında süperempoze preeklampsi görülür (12). Ayrıca bu hastalarda plasenta dekolmanı riski de belirgin olarak artmıştır (12).
Kronik hipertansiyonu olan gebeler tipik olarak 24. gebelik haftasından sonra daha da kötüleşir ve kronik hipertansiyon olmadan preeklampsi gelişen gebelere göre daha ağır seyreder. Ayrıca kronik hipertansiyon zemininde preeklampsi gelişen hastalarda fetal gelişme geriliği insidansı daha fazladır (9).
2.2.D. Preeklampsi
Preeklampsi sadece insan gebeliklerine özgü, endotel disfonksiyonu ve vazospazma sekonder azalmış organ perfüzyonu ile seyreden bir durumdur. Preeklampsi patofizyolojisi Şekil 1’de gösterilmiştir. Ayrıca primatlarda da çok seyrek olarak görülebileceği rapor edilmiştir. Nulliparların bir hastalığı olarak bilinen preeklampsi primigravidalarda %10-14, multiparlarda %5,7-7,3 oranında görülür. Genel populasyonda ortalama insidans %6-7 olarak kabul edilmektedir. Geçirilmiş preeklampsi öyküsü olanlarda insidans %18’dir (13). İkiz gebelerde tek gebeliği olanlara oranla preeklampsinin şiddeti de artmaktadır (14).
Şekil 1: Preeklampsi patofizyolojisi
15 yaş altındaki gebelerde preeklampsi gelişme riski 30-40’lı yaşlara oranla 2,8 kat artış gösterir. Gelişmekte olan ülkelerde preeklampsi ve eklampsi, gebelikte anne ölümlerinin %30’undan sorumlu tutulmaktadır. Preeklampsi, genellikle primigravidalarda 20. gebelik haftasından sonra ortaya çıkan hipertansiyon (sistolik kan basıncı/diastolik kan basıncı 140/90 ya da MAP {ortalama arter basıncı} değerinin>106 olması) ve proteinüri (300mg/24 saat) olarak tarif edilir (MAP=[diastolik kan basıncı x 2 + sistolik kan basıncı]/3). Ancak gestasyonel trofoblastik hastalıklar, çoğul gebelik ve hidrops fetalis gibi durumlarda 20. gebelik haftasından önce de görülebilir. 24 saat idrar toplama imkânı yoksa proteinüri en az 6
saat arayla yapılan iki ölçümde idrarda 300mg/L protein (en az +1, dipstik ile) olarak tanımlanmaktadır.
Normal gebeliklerin %40’ında ödem bulunabileceği gibi, preeklampside ödem bulunmayabilir. Preeklampsinin ödemi patolojiktir ve elleri, yüzü, tüm vücudu içerir. Özellikle sabahları görülür ve en önemli endikatörü yüzüklerin parmaklara dar gelmesidir (15). Proteinüri yokluğunda preeklampsi tanısı, gestasyonel hipertansiyona; baş ağrısı, görme bulanıklığı, bulantı ve kusmaya eşlik eden sağ üst kadran veya epigastrik ağrı, intrauterin gelişme geriliği, trombositopeni ve karaciğer enzim yüksekliği gibi bulguların eşlik etmesiyle konulabilmektedir.
Daha önceleri sistolik kan basıncının 30 mm Hg, diastolik kan basıncının 15 mm Hg ve üzerinde artışı preeklampsi tanısında kullanılan bir kriterdi. Ancak Levine ve ark. (2000) bu değerlerin sonuçlar üzerinde etkili bir prognostik faktör olmadığını göstermişlerdir. Bunun üzerine Working Grup bu değerleri preeklampsi tanı kriterlerinden çıkarmış ancak bu kadınların daha yakın takibini önermiştir (14). Kan basıncındaki günlük değişimler ve ikinci trimesterde kan basıncının düşüp sonradan yükselmesi, kronik hipertansif gebelerin yanlışlıkla preeklamptik olarak değerlendirilmesine yol açabilir (9). Preeklampside hipertansiyon, olguların erken ve kesin bulgusudur.
Proteinüri glomerüler hasarın göstergesidir. Proteinüri dipstik veya sülfosalisilik asit ile ölçülmektedir. 24 saatlik idrarda 300 mg ve üstü protein saptanması, 6 saatlik veya daha fazla ara ile alınan en az 2 idrar örneğinde 1+ veya daha fazla proteinüri olması patolojik proteinüri tanısı için yeterlidir (16).
Yapılan çalışmalarda dipstik ile tespit edilen protein düzeyi ve 24 saatlik idrardaki protein miktarı arasında zayıf bir korelasyon vardır. O yüzden 24 saatlik idrarda protein miktarı proteinüri için ana belirleyici test olmalıdır (14). Preeklampsi zaman zaman renal damarlardaki spazm ile karakterize bir durum olduğu için farklı idrar örneklerinde değişen miktarlarda protein bulunur. İdrardaki protein miktarı kan, bakteri, vaginal sekresyon ve amnion sıvı kontaminasyonuyla değişebilir. Dansitenin 1010 altında ya da 1030 üstünde olması, pH’nın 8 üzerinde olması, egzersiz ve
Preeklampsi ağır ve hafif olarak ikiye ayrılmaktadır (Tablo 2). Bu ayrımın doğru ve kesin olarak yapılması klinik olarak önemli olabilir.
Tablo-2’de ağır ve hafif preeklampside ayrım kriterleri gösterilmiştir.
ACOG (American College of Obstetricians and Gynecologists), aşağıdaki kriterlerden bir veya birden fazlasının bulunuşunu şiddetli preeklampsi olarak tanımlamıştır (17):
-Kan basıncının 160/110 veya MAP değerinin >126 oluşu -Proteinüri 5gr/24saat veya stick testte 3+/4+’lik olması -Oligüri (500m1/24 saat)
-Görmebozukluğu
- Serebral bozukluk, konvülziyon, baş ağrısı - Epigastrik ağn, bulantı, kusma
- Serum kreatininde yükselme - Trombositopeni (<100000)
- Karaciğer fonksiyonlannda veya periferik yaymada bozulma - Pulmoner ödem ve siyanoz
-Anormal umblikal arter doppler bulgularıyla beraber IUGR (intrauterin gelişme geriliği) veya oligohidramnioz
-Şiddetli preeklampsinin bir şekli olan HELLP (hemolysis, elevated liver, low platelet) sendromu multisistemik bir hastalık olup, mikroanjiopatik hemolitik mi, karaciğer enzimlerinde artış ve trombositopeni ile karakterizedir. HELLP sendromu şiddetli preeklampsilerin %4-12’sinde görülür (18). Olguların yalnızca %50’ sinde şiddetli hipertansiyon vardır. %15’inde ise hipertansiyon ve proteinüri görülmez (19).
Renal tutulum ağır olduğu zaman, renal damar vazospazmı ve glomerüler filtrasyondaki azalmaya bağlı olarak plasma kreatinin seviyesi artar. Plasma ürik asit konsantrasyonu, ağır preeklamptik hastalarda daha fazla olmak üzere yükselmiştir (2).Karaciğer enzim artışı ve epigastrik ağrı ise hepatoselüler nekroz, iskemi ve ödemden kaynaklanır. İskemi sonucu infarkt hatta subkapsüler kanama oluşarak şiddetli ağrıya yol açabilir ve nadir de olsa karaciğer rüptürü izlenebilir (1).
Trombositopeni ise endotel aktivasyonu sonrası oluşan vazospazm ve sonucunda trombosit aktivasyonu ve agregasyonu ile seyreden mikroanjiopatik hemoliz nedeniyledir (9). Mikroanjiopatik hemoliz nedeniyle hemoglobinemi, hemoglobinüri ve hiperbilirübinemi oluşması hastalığın ağırlığını gösterir (1). Görme bozukluğu preeklampside izlenebilir. Ancak körlük sık izlenen bir bulgu değildir ve geçicidir. Retinal arter vazospazmı ve retina dekolmanı körlük etyolojisinde sorumlu tutulan iki faktördür (9).
Preeklamptik hastalarda eklampsi gelişiminin nedeni tam olarak bilinmemektedir. Eklampside serebral kan akımında değişiklik olmaktadır. Patofizyolojik olayın serebral vazospazm olduğu düşünülmektedir ( 2).
2.2.E. Eklampsi
Eklampsi, preeklampsi tablosuna tonik-klonik konvülziyonlann eklenmesidir. Nöbetlerin %50’si doğum öncesi, %30’u doğum esnasında, %20’si doğum sonrasında oluşur. İnsidansı gelişmiş ülkelerde 1:2000, gelişmekte olan ülkelerde 1:100–1:1700 oranlarında gözlenmektedir (20). Eklampsi, preeeklamptik hastaların %1’inde ve tüm doğumların %0,1-0,5’inde görülür (19). Eklamptik konvülziyonlar hipertansiyon düzeyleriyle korelasyon göstermez. Patogenezinin; trombosit trombüsüne, lokalize vazokonstriksiyona, hipoksi veya korteksteki lokal hemorajilere bağlı olabileceği belirtilmektedir. Postpartum konvülziyonların %50’si doğumdan sonraki ilk 48 saatte ortaya çıkar, ancak en geç postpartum 6. haftaya kadar oluşabilmektedir (21).
Mattar ve Sibai 2000,399 eklamptik hastayı değerlendirmiş ve major komplikasyonları; %10 dekolman plasenta, %7 nörolojik defekt, %7 aspirasyon pnömonisi, %5 pulmoner ödem, %4 kardiovasküler arrest, %4 akut böbrek yetmezliği, %1 maternal ölüm olarak tespit etmişlerdir (9).
2.3.Preeklampside risk faktörleri:
Gebelik, hipertansiyonu ortaya çıkaran etkenlerin başında gelir. Mevcut hipertansiyonu ise olumsuz etkiler. Olayın oluşması için trofoblastik dokunun varlığı gerekli olup, fetus oluşması şart değildir. Preeklampsi risk faktörleri şunlardır (Tablo 3):
Tablo 3. Preeklampside Risk Faktörleri:
2.4.Preeklampsi Patogenez:
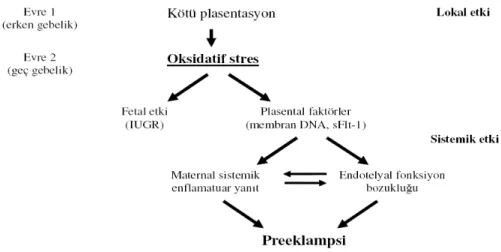
Preeklampsi, plasental ve maternal preeklampsi olarak iki farklı hastalık şeklinde düşünülebilir (22) (Şekil 2). Plasental preeklampside, trofoblast invazyon yetersizliği ve bunun sonucunda gelişen hipoksik mikroçevre, patogenez için başlangıç noktasını oluşturmaktadır. Maternal preklampside ise plasental gelişim normaldir, fakat annede zeminde bir mikrovasküler hastalık vardır. Metabolik bir hastalık varsa, normal bir plasentasyonun getirdiği ek oksidatif stres ve enflamatuar süreç bile klinik tablo oluşturmaya yeter.
Şekil 2 : Plasental (erken baslangıçlı) ve maternal (geç baslangıçlı) preeklampsi
2.4.1. Plasental preeklampsi
Plasental preeklampsi, diğer bir deyimle erken baslangıçlı preeklampsi olarak anılabilir. Preeklampsi iki evreden oluşmaktadır: Preklinik ve klinik evre (Şekil 3).
Şekil 3: Preeklampsi gelişiminde preklinik (evre1) ve klinik (evre 2) süreç
Erken plasentasyon döneminde, adezyon molekülleri ekstravillöz trofoblastlar ile hücre dışı matrikse olan bağlantıda önemli rol oynamaktadır. Trofoblastların spiral arterlerin endotel ve muskularis media tabakalarına invazyonu gebeliğin erken döneminde başlamakta ve süreç progresif olup bu arterlerin myometrial kısımlarına kadar gebeliğin 20. haftasında tamamlanmaktadır. Bu invazyon süresince trofoblast hücreleri bir yüzey hücre adezyon molekülü olan integrin ekspresyonunu değiştirerek, endotel hücresi hüviyeti kazanmakta ve endotel hücresi ve kas hücresini litik etkiye uğratmaktadır. Ayrıca trofoblastik invazyonun ilk döneminde (8–12 hafta) spiral arterlerin desidual kısmına ulaştığı, 13–14. haftadan itibaren ise (ikinci trofoblast dalgası) myometrial segmentlere uzadığı belirtilmektedir. Preeklampsi olgularında bu vasküler şekillenme olmamakta ve ekstravillöz trofoblast invazyonunda sınırlanma olmaktadır. Her zaman yetersiz invazyon preeklampsi ile sonuçlanmamakta, IUGR olan bebeklerde de sığ invazyon görülmektedir (4).
2.4.2. Maternal Preeklampsi
Çogunlukla geç baslangıçlı preeklampsi olarak da tanımlanan bu durumda plasentasyon normaldir. Trofoblast invazyon eksikliği, hipoksik bir plasental mikroçevre söz konusu değildir. Annede önceden var olan bir takım mikrovasküler hastalıklar, insülin direnç artışı ile giden obezite, DM gibi durumlar vardır. Normal bir plasentasyon olsa da plasentadaki fizyolojik enflamasyon ve oksidatif stres
ürünlerindeki artış annede yaygın bir enflamatuar yanıt ve klinik tablo oluşturmaya yeterlidir.
2.5. Preeklampsi Oluşumundaki Etyopatogenez
Preeklampsi etyopatogenezi tam olarak aydınlatılamamıştır, birçok teori mevcuttur. Etyolojisi ve patogenezi ile ilişkili teoriler şunlardır (22) :
- Uterin kan damarlarının anormal trofoblastik invazyonu - Vasküler endotelyal hasar
-Plasental iskemi -Yaygın vazospazm -Oksidatif stres
-Anormal nitrik oksit ve lipid metabolizması -Koagülasyon anomalileri
-Maternal ve fetoplasental doku arasındaki immünolojik intolerans -Gebeliğin kardiyovasküler ve enflamatuar değişimlerine uyumsuzluk -Genetik predispozisyon
-Diyetteki eksiklikler ve fazlalıklar rapor edilmiştir.
2.5.1.Anormal trofoblastik invazyon:
Normal gebelikte, spiral arterlerde çarpıcı morfolojik değişiklikler oluşmaktadır. Prolifere olan trofoblast, desidua ve myometriumun yakın tabakasını iki şekilde invaze eder, bunlar; interstisyel ve intravasküler invazyondur. İnterstisyel invazyonun plasentanın yerinde tutulmasında rolü olabileceği düşünülmektedir. İntravasküler invazyonda endovasküler trofoblastik hücrelerin maternal spiral arterleri invaze etmesi söz konusudur. Bunu gerçekleştirirken endometriumun yerini alıp arter duvarının elastik ve musküler dokusunu harap ederler ve arter duvarında fıbrinoid bir yapının oluşmasına yol açarlar (18).
Bu oluşum desiduamyometrial bileşkeyi kapsayarak 1. trimester sonunda tamamlanır. Sonrasında myometriumun derinliklerindeki radial arterlerden köken alan spiral arterlerin lümeninde, ikinci bir invazyon dönemi başlayıncaya kadar süren dinlenme fazı başlar. Daha sonra 14-16. haftalarda ikinci aşama başlayarak, spiral arterlerin elastik ve musküler tabakasındaki fibrinoid değişiklikler devam eder. Bu durum damar duvannda incelme ve spiral arterlerde kese görünümü meydana gelmesini sağlar (23). Bu değişimler normal gebelikte 20-22. haftaya kadar tamamlanır (24). Uteroplasental yatak düşük rezistanslı, düşük basınçlı ve yüksek akımlı hale gelir (25). Sonuç olarak; bu çarpıcı transformasyon, plasental kan akımını arttırarak fetusun yeterli oranda gelişmesine olanak sağlar. Preeklampside plasenta invazyonunda parsiyel yetersizlik mevcuttur (26). Plasental yataktaki tüm spiral arterler trofoblastik invazyona uğramaz. İnvazyona uğrayan spiral arterlerde ilk faz normal olurken ikinci faz gelişmez ve spiral arterlerin myometrial kısımlarının reaktif muskuloelastik duvarları kaybolmaz. Bununla birlikte preeklampsili hastaların spiral arterlerinin myometrial segmentinde akut ateroz gelişir. Bu lezyon arter duvarının fibrinoid nekrozu, hasarlı duvarda lipid ve lipofaj birikimi, damar çeperinde mononükleer hücre infiltrasyonu ile karakterizedir. Akut ateroz lümeni daraltır ve plasental infarkt alanlarında damar obliterasyonuna dek ilerleyebilir. Spiral arterlerde normalde gebelikte olması gereken değişiklikler olmadığından kan akımı gereksinimi karşılanamaz (27). Tüm bunlar plasental hipoperfüzyonla sonuçlanır. Bu yüzden fetüs erken gebelik döneminde daha az intervillöz kan akımına maruz kalır, bu da intrauterin gelişme geriliği veya düşük doğum ağırlığına neden olur (28) (Şekil 4).
Şekil 4: Trofoblast hücre invazyonu yetersiz olduğunda spiral arterlerin eksik transformasyonu oluşur. Kan akımının bozulması plasental villus dallanmasını bozar bu da fetusun gelişimini bozar.
Spiral arteriollere defektif trofoblastik invazyondan, trofoblastik farklılaşmadaki anormallik sorumlu tutulmaktadır. Bunun da immünolojik ya da
Şekil 5. İntervillöz aralığın kanlanması
Normal farklılaşma sırasında, invaze olan trofoblastlar adezyon moleküleri ekspresyonunda değişiklik yaparak, epitele özgü adezyon molekülleri (integrin alfa6/beta1, alfav/beta5 ve E-cadherin) yerine, endotele özgü adezyon moleküllerini (integrin alfa1/beta1, alfav/beta3, Platelet Endothelial Cell Adhesion Molecule ve VascularEndothelial-Cadherin) eksprese etmeye başlarlar. Bu süreç psödovaskülogenez olarak adlandırılır (29). Preeklamptik kadınlardan elde edilen trofoblastlarda, endotele özgü adezyon molekülü ekspresyonu veya psödovaskülarizasyon gösterilememiştir (30).
2.5.2 Endotel hasarı
Hastalığın patogenezinde rol oynadığı ileri sürülen endotelyal hücreler; vazodilatatör maddelerin sekresyonu, vasküler kompartmanın bütünlüğünün sağlanması ve intravasküler koagülasyonun önlenmesi gibi çeşitli önemli fonksiyonlara sahiptir. Endotelyal hücrelerin disfonksiyonu, preeklampside gözlenen birçok patofizyolojik degişikliğin sebebini izah eder. Endotelyal hücreler prostasiklinin, trombositler ise tromboksanın primer kaynağıdır. Prostasiklin vazodilatatör, tromboksan ise vazokonstrüktör özelliklere sahip olduğundan
vazospazma yol açar. İlaveten endotelyal hücreler aynı zamanda endotelyal kaynaklı genişletici faktör gibi vazodilatatör maddeler ürettiklerinden, disfonksiyonları bu gibi faktörlerin üretimini de azaltır.
Endotel kaynaklı gevşetici faktör [EDRF=NO (Nitrik oksit)] ve endotelin, endotel kaynaklı maddelerdir. EDRF etkili bir vazodilatatör, endotelin ise vazokonstriktördür. PIH gelişen gebelerden elde edilen umblikal kan örneklerinde umblikal kord endotelinden salınan EDRF’de belirgin azalma saptanmıştır(31). Yapılan bir çalışmada plazma endotelin-1 preeklampsili gebelerde normal gebelerden daha yüksek bulunmuştur (32). Vasküler endotelyal hücre disfonksiyonu sonucu normal gebelikte varolan prostasiklin (PGI2)/tromboksan A2 (TxA2)’nin dengesi bozulur. PGI2 güçlü bir vazodilatatör ve platelet agregasyon inhibitörüdür, TxA2 güçlü bir vazokonstriktör ve platelet aktivatörüdür. Hasarlanmış endotelde PGI2 üretimi azalır, TxA2 üretimi artar (33). TxA2/PGI2 oranının artışının, uteroplasental kan akımını azaltacağı, spiral arterlerde tromboz ve plasental infarktlara neden olabileceği düşünülmektedir (34). Preeklampsi; vazospazm, koagulasyon sistem aktivasyonu ve anormal hemostaz ile birliktelik gösterir. Preeklampsideki hemostatik değişikliklere vasküler endotel hasarı neden olmaktadır (4). Endotel hasarı ile birlikte, mikrodolaşımda trombosit aktivasyonu ve aşırı pıhtılaşma olduğu gösterilmiştir. Endotel hücre hasarının morfolojik kalıntılan olan glomerüler endotelyosis, plasental yataktaki ultrastrüktürel değişiklikler ve uterin arterdeki değişiklikler preeklampsinin karakteristik lezyonlandır (35). Yapılan çalışmalarda endotel hasarının sonucu olarak adezyon moleküllerinin arttığı saptanmıştır. Hücreler arası tutunma ve invazyon fonksiyonlarında önemli görevleri olan adezyon molekülleri, gebeliğin ilk trimesterinde sitotrofoblast invazyonunda görev alır. Preeklampsili hastalarda plasental yataktan alınan biyopsilerle yapılan karşılaştırmalı çalışmalarda, preeklampsililerde sitotrofoblast hücrelerinde anormal şekillenen adezyon molekülleri gösterilmiştir ve yetersiz farklılaşma bulunmuştur. Bu alanda çalışmaları yapılan bazı adezyon molekülleri ve integrinler: ct-1 12 ve 13-4 integrinler, matrix metalloproteinaz-9, E-cadherin, VE cadherin, platelet endotel adezyon molekülü 1, vasküler endotel adezyon molekülül, osteopontin, laminin, selektinler, intercellular adhesion molecule (I-CAN’l), vasculer celi adhesion
aktivasyonundan sorumlu olabileceği savunulmuştur. Endotel hasannın ve nötrofil aktivasyonunun işaretleyicisi olan VCAM-1, ICATVI-1 ve P-selektin preeklamptik hastaların serumlarında artmaktadır (37) (Şekil 6).
Şekil 6: Endotel disfonksiyonu, aktivasyon etkenleri ve sonuçları
2.5.3. Oksidatif stres
Gebelik, oksidatif stres durumudur. Oksidatif stres patlamasıyla ilk trimesterde intervillöz sahaya kan akımı sağlanmaktadır. Preeklampside geç gebelik döneminde etkin antioksidan defansın yetersizliği görülmüş ve bunun trofoblast apopitozisi ve plasental vasküler reaktivitede değişikliğe yol açtığı düşünülmüştür. Preeklampsi ve fetal gelişme geriliği gibi durumlarda reaktif oksijen radikallerinin daha fazla üretildiği gösterilmiştir (38). Oksidatif stresin diğer sonuçları arasında;
koagülasyonun aktivasyonu (trombositopeni) ve artmış kapiller permeabilite (ödem ve proteinüri) aterozisin karakteristik bulgusu olan mikrovasküler lipid yüklü makrofajların (köpük hücreleri) üretimi sayılabilir (9).
2.5.4. Çok Düşük Dansiteli Lipoproteinleri
Preeklampside dolaşımdaki serbest yağ asidi seviyeleri (FFA) klinik hastalık ortaya çıkmadan yaklaşık 15–20 hafta önce yükselir. Preeklamptik hastaların serumlarında hem FFA/albumin oranı yüksektir hem de lipolitik aktivite artmıştır. Bunun sonucunda endotel hücrelerinin FFA alımı ve bunların trigliseritlere esterifikasyonu artar. Linoleik ve oleik asitler trombin ile stimüle edilen prostasiklin salınımını azaltırlar. Düşük toksisite engelleyici aktivite/VLDL oranı endotel hücrelerinde sitotoksisiteye ve trigliserit birikimine neden olmaktadır. Gebelik enerji ihtiyacını arttırır. Bu da gebelik boyunca artmış VLDL konsantrasyonları ile kendini gösterir. Düşük albümin konsantrasyonu olan hastalarda ekstra FFA’ları adipoz dokudan karaciğere taşıma işi, toksisite engelleyici aktiviteyi, VLDL toksisitesini ortaya çıkaracak kadar düşürerek endotel hasarına neden olabilir (39).
2.5.5. Renin anjiotensin sisteminde değişiklikler
Normal gebelikte, renin-anjiotensin-aldosteron sisteminin tüm komponentleri artmıştır. Bu durum östrojenin anjiotensinojen sentezini direkt uyarmasına bağlıdır. Normal gebelerde anjiotensinojen II(A-II)’nin pressör etkisine karşı direnç söz konusudur. Preeklamptik kadınların bütün vazokonstrüktörlerin etkilerine normal gebe kadınlardan daha hassas oldukları bilinmekte olup, içlerinde en iyi çalışılanı, anjiyotensin-II’dir. Anjiyotensin-II’ye artmış hassasiyetin vasküler sitoplazma membranındaki (VSM) artmış anjiyotensin-II reseptörlerini yansıttığı düşünülmektedir. Preeklamptik gebelerde ise plazma renin konsantrasyonu, plazma renin aktivitesi ve aldosteron düzeyleri düşük bulunmuştur. Anjiotensin II düzeyi ise gebe olmayan kadınlardaki kadardır. Preeklampside, A-II düzeyleri normal gebelerdekinden düşük olmasına karşın; A-II, renin ve aldosterona karşı artmış vasküler cevap görülmektedir (40).
2.5.6. İmmünolojik etkiler
Preeklampsi gelişmesinde immünolojik olayların rol oynadığı düşünülmektedir. İlk gebeliklerde ve artmış trofoblast kitlesi ile sık görülmesi, eş değiştirdikçe tekrarlanması, aynı kan grubundan evliliklerde, akraba evliliklerinden olan evliliklerde ve kan transfüzyonundan sonra oluşan evliliklerde daha az görülmesi, geniş plasental gebeliklerde daha sık görülmesi, damar içi koagulasyon geçirenlerde ve daha önce düşük yapmış olanlarda daha az görülmesi bunu destekler. Yapılan epidemiyolojik çalışmalar preeklampsinin annenin bebeğe karşı immünolojik bir maladaptasyon olduğunu düşündürmektedir. Kadın genital yolunda biriken sperm bazı allerjik olayları başlatmaktadır.Peter ve ark. (41) uzamış sperm maruziyetinin mukozal alloimmünizasyona neden olduğunu ortaya koymuşlardır. Bu durum sınırlı sperm maruziyeti olan gençlerde neden preeklampsinin fazla görüldüğünü açıklayabilir. Preeklampsi gelişen primigravidalarda gebeliklerinin ikinci yarısında T-helper düzeyleri, normotansif gebelere göre daha düşük tespit edilmiştir (21). Paternal ve fetal antjenlere daha önce maruz kalan gebelerde preeklampsiye karşı koruyuculuk geliştiği ileri sürülmüştür. Preeklampsi insidansı, bariyer yöntemi kullananlarda ve donör spermi ile intrauterin inseminasyon yapılanlarda, eşinin spermi kullanılanlara göre daha yüksektir (42). NK hücreleri ve EVT hücreleri arasındaki etkileşimin plasental implantasyonu kontrol ettiği varsayılmaktadır. Preeklampside maternal ve paternal genler arasındaki uyumsuzluğun, artmış NK aktivitesine neden olarak anormal plasental implantasyonu indüklediğine inanılmaktadır. Maternal NK hücreleri üzerindeki KIR (killer immünglobulin reseptörleri) ve fetal HLA-C halotip polimorfizmleri üzerine yapılan genetik çalışmalarda, KIR-AA genotipli ve fetal HLA-C2 genotipli kadınlarda büyük ölçüde artmış preeklampsi riski görülmüştür (43). Otörler, preeklampsinin immünogenetik tespit çalışmalarında, maternal, paternal ve fetal HLA tipleri arasındaki etkileşimi incelemenin, herhangi bir genotipi tek başına incelemekten daha önemli olduğuna dikkat çekmişlerdir. Preeklamptik kadınlardan alınan plasental yatak biyopsilerinde, preeklamptik desidual dokuda artmış dendritik hücre infiltrasyonu açığa çıkarılmıştır. Dendritik hücreler, makrofajlarla birlikte antijen sunmakla görevli olup, transplantasyon antijenlerine karşı antijen-spesifik T
maternal ve fetal antijenlerin sunumunda değişikliğe neden olabilir, bu da fetal antijenlere karşı anormal maternal immünolojik cevaba ve sonuç olarak anormal implantasyona yol açar (44).
2.5.7. Genetik Etkiler
Preeklampsiye güçlü ailesel yatkınlık gösterilmiştir. Preeklampsiye en iyi uyan kalıtım paterni halen tartışmalıdır. Hala maternal genlerin mi yoksa fetal genlerin mi preeklampsiye yatkınlık yarattığı sorusu cevaplanmamıştır. Yapılan çalışmalarda, ailesel preeklampsi hikâyesi olan (örn; anne veya kızkardesi etkilenmiş) primigravid kadınlarda, aile hikâyesi olmayan primigravidlere göre, preeklampsi riskinin 2-5 kat daha fazla olduğu gösterilmiştir (45). Preeklampsinin gelişimine maternal katkı imprinte olan genlerle kısmen açıklanabilmektedir (46). Preeklampsili anneden doğan erkeklerin eşlerinde preeklampsi gelişme riski, annesinde preeklampsi öyküsü olmayan erkeklerin eşlerine göre yüksek bulunmuştur (47). Bir erkeğin eski eşinde preeklampsi öyküsü varsa, yeni eşinde preeklampsi gelişme riski, daha önceki eşi normotansif olan erkeğin eşine göre, daha yüksek olduğu görülmüştür (48). Bu veriler defektif plasentasyon ve sonrasında preeklampsi gelişiminde, fetal genlere hem maternal hem de paternal katılımın rol oynadığını göstermektedir.
İlk kez 1873 yılında Eliot Lara tarafindan eklampsinin ailesel sıklığı bildirilmiştir. Söz konusu ailede 5. gebeliği sırasında eklampsiden ölen bir kadının dört kızının üçü de daha sonra eklampsiden ölmüştür. Brocklehurst ve Ross (49 ), bir ailenin 4 neslinde 11 eklampsi vakası bildirmişlerdir. Chesley ve ark.(50), 1931-1951 yıllan arasında eklampsi geçiren 122 kadından olan 363 kız çocuğunun %96’sında izleme dayalı detaylı aile çalışmaları yapmışlardır. 187 kız çocuktan olan 426 gebelik, 16 kız torun ve 76 evlilik yoluyla aileye dâhil olan gelinler incelenmiş ve ilk gebeliklerde preeklampsi-eklampsi insidansının kız çocuklarda %26, kız torunlarda %25 ve gelinlerde ise %8 olduğu gözlenmiştir. Bu fetal veya paternal değil maternal genetik etkinin baskın olduğuna işaret eder. Cincotta ve Brennecke’nin (51) , 368 primigravid gebe üzerinde yaptıkları prospektif bir incelemede 34 (%9,2) gebede preeklampsi gelişmiştir. 368 gebenin 18’inde (%4,9); anne [12] , kızkardeş [5] veya
her ikisi [1] olmak üzere preeklampsi aile hikâyesi tespit edilmiştir. Bu 18 gebeden 5’inde (%27,8) ağır preeklampsi gelişmiştir. Aile hikâyesi olmayan 29 (%8,3) gebede preeklampsi saptanmıştır. Preeklampsi ve pozitif aile hikayesi olan gebelerin 4’ünde (%22,2) preeklampsinin ağır seyrettiği gözlenmiştir. Buna karşılık ağır preeklampsi, aile hikâyesi olmayan 18(%5,1) gebede izlenmiştir. Bir primigravidada aile hikâyesinin olması şiddetli preeklampsi geliştirme riskini 4 kat artırmaktadır. Klinik uygulamaya aile hikâyesinin sorgulanmasının mutlaka dâhil edilmesi gerektiği önerilmiştir. Maternal gen modelini araştıran diğer çalışmacılar fetal genlerin de katılımına işaret etmişlerdir.
Tek yumurta ikizlerinde preeklampsi gelişimi açısından uyumsuzluk (52) ve fetal triploidi (53), molar gebelik (54) ve trizomi 13 (53) ile preeklampsi birlikteliği olaya fetal gen katılımını veya fetüsteki genetik farklılıklara maternal maladaptasyonu düşündürür.
2.5.8. Metabolik ve nutrisyonel faktörler
Yapılan birkaç çalışmada protein ve tuz kısıtlanmasının, çinko, magnezyum, balıkyağı, C ve E vitamini takviyesinin, heparin, diüretik ve diğer antihipertansif ilaç kullanımının preeklampsiyi önleyici etkisi incelenmiş, sonuçta bazı çalışmalarda minimum fayda bazılarında hiçbir fayda tespit edilememiştir. Birkaç gözlemsel çalışmada heparinin trombofilili hastalarda rekürren preeklampsi riskini azalttığı belirtilmiştir (55). Obezite, DM, hiperlipidemi, hiperhomosistineminin preeklampside endotelyal disfonksiyona neden olduğu belirtilmektedir. Normal gebelikte plazma lipid konsantrasyonu artar, preeklampside ise trigliseritten zengin lipoproteinler ve nonesterifiye yağ asitleri oldukça fazladır. Homosistein seviyesi, folik asit ve vitamin B12’nin diyetsel eksiklikleriyle artar. Birkaç çalışmada erken gebelikte hiperhomosistineminin preeklampsi insidansı ve IUGR gelişmesinde rolü olduğu saptanmıştır (56).
2.5.9. Maternal inflamatuar cevapta artış
cevabı tetikleyen faktörler (enfeksiyonlar ve romatolojik hastalıklar) preeklampsi gelişme ihtimalini artırır (55). Preeklampside endotel hasarını başlatan spesifik nedenler tam bilinmemekle birlikte, koagulasyon sisteminin, trombositlerin ve nötrofillerin aktivasyonuyla ilişkili olabileceği belirtilmektedir. Normal gebelikte periferik kan lökositleri artar, preeklampside bu artış daha fazladır.
Preeklampside ana sebeplerden biri olan azalmış plasental kan akımı plasentada oksidatif strese neden olur. Bunun sonucunda sinsityotrofoblast debrisi (sflt-1), vasküler endotelyal büyüme faktörü (VEGF) gibi plasental faktörler aşın miktarda dolaşıma salınır, bu maddeler inflamatuar cevap ve endotel disfonksiyonu tetikler. Preeklampsinin tedavisi henüz antienflamatuar ajanları içermese de yeni araştırmalar inflamasyon ve oksidatif stresi azaltmaya odaklanmaktadır (57).
2.6. Preeklampsi Öngörüsü ve Önlenmesi
Bir hastalığın önlenmesi, o hastalığın etyolojisinin ve fizyopatolojisinin çok iyi bilinmesi, bu hastalık için yüksek risk grubunda olan hastaların önceden belirlenmesi ve tanınması için gerekli metotların etkinligi ile sağlanabilir. Preeklampsinin önceden belirlenmesi ve erken yakalanması için sayısız klinik, biyofizik ve biyokimyasal testler önerilmiştir. Ancak yazık ki bu testlerin çoğu düşük sensitivite ve düşük pozitif belirleyicilik değerlerine sahip olduklarından klinikte rutin kullanım için uygun değildirler (58). Preeklampsi için hiçbir tarama testi tek başına güvenilir, uygulanabilir ve mali açıdan etkin bulunmamıstır. Ürik asit en yaygın kullanılan testlerden biridir. Sadece %33 pozitif belirleyicilik değeri vardır ve preeklampsinin önceden belirlenmesinde yararlı olduğu kanıtlanmamıstır (59).Uterin arter Doppler akım hızı düsük preeklampsi riski taşıyan kadınlar için yararlı bir test olarak bildirilmemistir (60).
Preeklampsi gelişmesini önlemek ve insidansını azaltmak için birçok klinik çalışma yapılmıştır. Ancak hastalığın etyolojisinin multifaktöriyel olması ve tam olarak bilinememesi nedeniyle yapılan tedavilerin hiçbiri hastalığı önlemede tam olarak etkili değildir. Diyetin düzenlenmesi, düşük doz aspirin tedavisi ve antioksidanlar preeklampsiyi önlemeye yönelik güncel girişimlerdir.
2. 7. OKSİDAN / ANTİOKSİDAN SİSTEM
2.7.1. OKSİDAN SİSTEM
2.7.1.1. Reaktif Oksijen Türleri (ROS)
Oksidanlar reaktif oksijen türleri (ROS), reaktif nitrojen türleri (RNS), sülfür merkezli radikaller vb. moleküllerden oluşurlar (61). ROS veya RNS fizyolojik ve patolojik şartlarda vücut metabolizmasında üretilirler (61,62). ROS’un hepsi serbest radikal değildir ancak birçok durumda serbest radikal haline dönüşür ve oksidasyon ile biyomoleküler hasara neden olurlar (61).
Oksidanlar çeşitli yollarla oluşurlar; 1-İyonize radyasyonla, 2- Kimyasal reaksiyonlarla, 3- Enzimatik olarak, 4-Serbest geçişli metal iyonlarının veya enzimlere bağlı metal iyonlarının neden olduğu redoks (indirgenme- yükseltgenme) reaksiyonlarıyla (61).ROS’un artmasını sağlayan, oksidatif stresin başlıca hücre içi kaynakları ise şunlardır (61,63):
1- Mitokondri elektron transport zinciriyle, oksijenin tam olmayan (inkomplet) redüksiyonu ROT oluşumuna neden olur. Normal şartlarda mitokondri elektron transport zincirinde ROT’un üretimi mitokondrinin fizyolojik fonksiyonları için gerekli olmasının yanı sıra, fazla üretildiğinde mitokondriyal hasara da neden olur ve mitokondriden salınımı artan Ca+2, apopitozis ve nekrozis süreçlerinin oluşmasında rol alarak hücresel hasara katkıda bulunur (61,63,64).
2- Konakçı defans sistemi yoluyla, pek çok immun hücre yüksek konsantrasyonda serbest radikal üretir. Nötrofillerin plazma membranında NADPH oksidaz enzimi, moleküler oksijenden süperoksit radikali (O2) üretimine ve sonrasında hidrojen peroksit (H2O2) ve hidroksil radikali oluşumuna (OH) yol açar. Son olarak da, miyeloperoksidaz enziminin etkisiyle H2O2’e halojenlerin (Cl¯, Br¯, I¯) eklenmesiyle aşırı oksidan ürünler olan HOCl, HOBr ve HOI oluşur (65).
3a-Ksantin Oksidaz (XO) enzimiyle; Hipoksantin ve Ksantin in vivo şartlarda Ksantin Dehidrogenaz enziminin katalizlemesiyle okside olur.
3b-Nitrik Oksit Sentaz enzimleriyle; L-Arginin’den Nitrik Oksit Sentaz (NOS) enziminin katalizlemesiyle oluşan NO, O2•− ile reaksiyona girerek peroksinitrit (ONOO-) oluşumuna neden olur. Oluşan ONOO- hücresel yapıların hasarına neden olur.
3c-NADH/NADPH Oksidaz, Sitokrom P-450 ve Araşidonik Asit Metabolizması enzimleriyle de serbest radikaller üretilir (66,67).
Serbest radikaller genellikle çok reaktif, kararsız ve biyolojik moleküllere karşı zararlıdırlar (62).
2.7.1.2. Reaktif Oksijen Türlerinin Hücre ve Doku
Düzeyindeki Etkileri
a-Lipid Peroksidasyonu ve MDA: Lipid peroksidasyonu genellikle serbest
radikallerden kaynaklanır. Bir serbest radikal, çoklu doymamış yağ asitlerinden oluşan birden fazla sayıda substrat molekülünün oksidasyonuna neden olabilir (61).
Aralarında malondialdehitin de bulunduğu tiyobarbitürik asit ile tepkimeye girebilen birçok ürün ortaya çıkar bu ürünlere tiyobarbitürik asit reaktanları (TBAR) denir.
Lipid peroksidasyonun en önemli ürünü malondialdehid (MDA) dir. Üç ya da daha fazla çift bağ içeren yağ asitlerinin peroksidasyonunda MDA meydana gelir (68). Oluşan MDA, hücre membranlarından iyon alışverişine etki ederek membrandaki bileşiklerin çapraz bağlanmasına yol açar ve iyon geçirgenliğinin ve enzim aktivitesinin değişimi gibi olumsuz sonuçlara neden olur (69,70).
b- Protein Oksidasyonu:
c- DNA, RNA ve Gen Ekspresyonu: ROS uygun konsantrasyonlarda, insan
patofizyolojisinde bir kısım kinazların, fosfatazların ve redoksa duyarlı transkripsiyon faktörlerinin ve genlerin modulasyonunda rol oynayabilir (71). Bu
hücre sinyali, hücre membranı ile ROS reaksiyonundan kaynaklanan ve diğer biyoaktif moleküllerin katıldığı bir yolla meydana gelir (71).
2.7.2. ANTİOKSİDAN SİSTEM
Organizmada normal metabolizma sırasında veya patolojik olaylar sırasında ortaya çıkan serbest radikaller ve oluşan bu zararlı radikallere karşı koruyucu sistem olan enzimatik ve non enzimatik savunma sistemi arasındaki hassas dengenin serbest radikaller lehine kaymasına “oksidatif stres” denir. Canlı organizma, normal fizyolojik durumlarda üretilen serbest radikalleri, antioksidan savunma sistemleri (defans mekanizması) tarafından dengeler ve organizma lehine, normal fizyolojik durumun devamını sağlar (72). Canlı organizma, serbest radikallerin neden olduğu oksidatif hasara karşı enzimatik ve nonenzimatik savunma sistemini kullanarak hücreleri hasara karşı korur. Serbest radikallerin neden olduğu oksidatif strese bağlı hasara karşı defans mekanizması; (a) önleyici mekanizmalar, (b) tamir edici mekanizmalar, (c) fiziksel savunma ve (d) antioksidan savunma sistemlerinden oluşmaktadır (66).
2.7.2.1. Enzimatik Antioksidan Sistem
Canlı organizmada hücreler, oksidatif hasara karşı enzimatik ve non enzimatik antioksidan defans sistemi ile korunurlar. Enzimatik antioksidan sistemler içerisinde; katalaz (CAT), süperoksit dismutaz (SOD) ve selenyum bağımlı glutatyon peroksidaz (GSH-Px) enzimleri primer antioksidan enzimler olarak sayılabilir. İndirekt olarak, antioksidan defans sistemi içinde yer alan; glutatyon-S-transferaz, G6PD enzimi, glutatyon redüktaz (GR),sülfonil transferaz, GSSH ve konjugat taşıyıcı enzimleri de bu grupta sayabiliriz:
1-Bakır-Çinko Süperoksit Dismutaz (Cu-Zn SOD) 2-Mangan Süperoksit Dismutaz (Mn SOD)
3-Katalaz (CAT)
canlı organizmanın en güçlü radikallerinden birisidir. Çok güçlü toksik etkisi vardır. Katalaz enzimi en fazla eritrosit ve karaciğerde bulunmakla beraber diğer vücut organlarında da bir miktar bulunur. Katalaz enzimi dört alt üniteden oluşur. Bu alt ünitelerin aktif kısımlarında ‘hem’ grubu taşır. Bu alt üniteler hem grubu yanında, enzimin stabilitesinden sorumlu bir molekül NADPH içerir. Katalaz enzimi siyanür, aminotriazol, HOCl ve azid tarafından inhibe edilir (63).
Yang ve arkadaşlarının yaptığı çalışmada preeklampside plasental mitokondride oksidatif hasar seviyeleri, maternal serumda serbest yağ asidi (FFA) konsantrasyonları arasındaki ilişkiyi değerlendirmek için yapılan çalışmada preeklampsi grubunda plasentada katalazın geç başlangıçlı preeklampside azaldığını görmüşler (73).
Miranda ve arkadaşlarının yaptığı çalışmada preeklampsi, gestasyonel hipertansiyon, kronik hipertansiyonu olan gebelerle sağlıklı gebelerde antioksidan enzim düzeyleri çalışılmış olup hipertansif gebelerde katalaz enzim düzeyinin arttığı gösterilmiş (74).
4- Glutatyon Peroksidaz (GSH-Px)
5-Fosfolipit Hidroperoksit Glutatyon Peroksidaz (PLGSH-Px) 6- Sitokrom C Peroksidaz
7-NADH Peroksidaz ve Oksidazlar 8-Glutatyon Redüktaz (GR)
9- Glutatyon S-Transferaz (GST) Non enzimatik antioksidan sistem:
1- Glutatyon (GSH) 7- Deferroksamin (DFO) 2- E Vitamini 8- Albümin
3- C Vitamini (Askorbik Asit) 9- Seruloplasmin 4-A Vitamini (Karotenoidler)
2.7.3.PREEKLAMPSİDE ANTİOKSİDAN SİSTEM
Preeklampside artmış süperoksit üretimi, lipid peroksid artışı, oksitlenmiş proteinler ve DNA söz konusudur (75). Preeklampsideki oksidatif stresi azaltmak amacıyla Vit C ve E efektif antioksidanlardır. Gebelik ve preeklampsideki kullanımları da araştırılmaktadır. Eksojen antioksidanların kullanımı kolay olsa da transport sırasında tükenmeleri, doğru hücresel kompartmanı hedefleyememeleri ve geri dönüşlü olmamaları sınırlayıcı etkenlerdir. Bu nedenle endojen antioksidanlarla desteklenmeleri gerekmektedir (76).
Normal gebelikte plazma SOD aktivitesi gebe olanlarda gebe olmayan kontrollerden yüksektir ve gebelik haftası arttıkça aktiviteleri de artar (77). Ancak bununla ilgili çelişkili sonuçlarda bulunmaktadır. Gebelikteki artmış SOD aktivitesi, plasental ROS’ a karşı koruma sağlamak içindir.
Preeklamptik hastaların plasentalarında ve maternal serumlarında azalmış SOD aktivitesi bulunmuştur. Ayrıca izoformlara özgün farklılıklar da olabilir (76).
2.8.ÇALIŞMAMIZDA ÖLÇÜMÜNÜ YAPTIĞIMIZ VE
KARŞILAŞTIRDIĞIMIZ PARAMETRELER:
Nitrik oksit (NO),
Asimetrik dimetil arginin (ADMA), Paraoksonaz (Panx),
Malonildialdehit (MDA), Total Oksidatif Statu (TOS), Total Antioksidatif Statu (TAS), Oksidatif Stres İndeksi (OSİ).
2.8.1.Nitrik oksit (NO):
Nitrik oksit sentetaz (NOS) tarafından L-arginin den üretilir (Şekil 7). Bu reaksiyon vasküler endotelde gerçekleşir (78).
Şekil 7:NO sentezi
NO, platelet agregasyonu, lokosit migrasyonu, hücresel adezyon ve vasküler düz kas proliferasyonunu inhibe eder. NO’nun fonksiyonu; vasküler homeostazın sağlanmasıdır. Ortamda NO azaldığında, endotel homeostaz vazokonstrüksiyon lehine bozulur ve endotelyal disfonksiyonu başlar (78,79).
Sağlıklı gebelerde endotel bağımlı bradikininin aracılık ettiği NO sentezi artarken, bu artış preeklamptik gebelerde daha düşüktür (80).
2.8.2. Asimetrikdimetilarginin(ADMA):
Endojen Nitrik Oksit Sentaz (NOS) inhibitörüdür. ADMA, NOS aktivitesini inhibe ederek L-Argininin hücre içine alınımını engeller. Bunun sonucunda lokal NO sentezini engelleyerek endotel disfonksiyonuna ve vazospazma yol açar. ADMA düzeyinin artması durumunda NOS aktivitesinin baskılanmasına ve NO düzeyinin düşmesine neden olur (81,82).
2.8.2.1.Genel Bilgiler:
ADMA, nükleoproteinlerde bulunan arjinin rezidülerine, protein arjinin metil transferaz (PRMT) enzimi tarafından metil gruplarının sentez sonrası düzenleme ile eklenmesi ve bu proteinlerin yıkılması sonucunda meydana gelen ve önemi giderek artan bir metillenmiş arjinin türevidir. Vücutta daha farklı metillenmiş arjinin bileşikleri de bulunmaktadır. Bu bileşikler bir ya da 2 metil grubunun arjinine eklenmesi sonucunda meydana gelmektedirler.ADMA ve simetrik dimetil arjinin (SDMA) iki metil grubunun eklenmesiyle ve Nmonometil- L-arjinin (L-NMMA) ise bir metil grubunun eklenmesiyle oluşan türevlerdir (83)(Şekil 8).
Şekil 8: Vücutta bulunan başlıca metillenmiş arjininler (84)
2.8.2.2.ADMA’nın Metabolizması
ADMA ve L-NMMA nitrik oksit sentazı (NOS) inhibe ederken, SDMA’nın böyle bir etkisi bulunmamaktadır. L-NMMA’nın NOS’u inhibe ettiği ADMA’dan daha önce bulunmuştur (85)(Şekil 9).
NO endotel tarafından salgılanmaktadır ve damarlar üzerinde vazodilatasyon, damar direncinde düşme ve kan akımında artış gibi etkileri bulunmaktadır. Böylelikle, ADMA’nın NOS inhibisyonunun hemodinamik değişikliklere yol açması beklenebilir (86).
Şekil 9: ADMA’nın NOS inhibisyonu (87).
2.8.2.3.ADMA ve Oksidatif Stres
Vücutta oksidatif stresin arttığı durumlarda ADMA düzeylerinde artış meydana gelir. ADMA düzeylerindeki bu artış DDAH enzim aktivitesindeki azalmaya bağlı olabilir. Aktivitenin azalmasında DDAH’ın aktif bölgesinde bulunan sisteinin yükseltgenmesi önemlidir. Bu yükseltgenme NO tarafından gerçekleşebilmekte (88) ve böylece aktivitesi geri dönüşümlü olarak
azaltılabilmektedir (89).(Şekil 10) İndüklenebilir NOS (iNOS) aktivitesi inflamasyonda çok artar ve NO çok fazla miktarda üretilir. Üretilen NO süperoksit radikalleriyle birleşip peroksinitrite dönüşür ve NO’nun yarılanma ömrünü azaltır (90). Peroksinitrit oluşumu süperoksit dismutaz’ın (SOD) süperoksit radikallerini yakalamasından daha hızlı gelişmektedir. Peroksinitritte DDAH’ın aktif bölgesine bağlanarak aktivitesini azaltır, böylece ADMA miktarında artışa ve NO düzeylerinde azalmaya yol açar. Oksidatif stres ADMA yapımında rol alan enzimlerin aktivitelerini değiştirerek ADMA miktarlarında değişime yol açmaktadır (89). PRMT aktivitesi reaktif oksijen türleriyle arttırılır ve ADMA düzeyleri artar (91).
Şekil 10: NO’nun DDAH’ı inhibe etmesi (92)
2.8.2.4. ADMA’nın Endotel Hasarıyla İlişkisi
Damar düz kasları tarafından salgılanan faktörler daha çok vazokonstrüksiyona sebep olurken, endotel tabakasının salgıladığı faktörler ise daha çok vazodilatasyonda rol alırlar. Endotel tarafından salgılanan NO’in damar yapısını ve fonksiyonlarını koruyucu etkileri bulunmaktadır. Düz kas proliferasyonunu engellemesi, lökosit adhezyonunu ve trombosit agregasyonunu önlemesi bu etkiler arasında sayılabilir. Endotelde meydana gelen bir harabiyet NO düzeylerinde azalma
eksikliğinde damar düz kaslarında proliferasyon izlenmekte, damar duvarının esnekliği azalmakta ve bunların sonucu olarak akışa-bağımlı vazodilatasyon kaybı ortaya çıkmaktadır (93).
Klinik ve deneysel çalışmalar endotel disfonksiyonunu, artmış oksijen kökenli serbest radikal üretimiyle ilişkilendirmiştir (91). NO’in yarılanma ömrü oksidatif stres altında azalmaktadır. NO süperoksit anyonlarıyla birleşmekte, peroksinitrit meydana gelmekte ve meydana gelen bu ürün lipit peroksidasyonuna yol açmaktadır (94,95). ADMA, NOS aktivitesini inhibe ettiğinden dolayı NO düzeylerinde bir azalmaya yol açmakta, bunun sonucu olarak endotel fonksiyon bozuklukları gelişmektedir.
2.8.2.5. ADMA’ nın Gebelikteki Değişimi
Gebelik sırasında annenin sistemik vasküler fonksiyonları değişir; uterin kan akımı ve kardiyak output artar, periferik rezistansın düşmesi ile kan basıncı düşer. NO sentez artışı, gebelikte, annedeki vasküler adaptasyonun önemli bir kısmından sorumludur (96,97).
Gebelikte ADMA seviyesindeki düşüklük, normotansif gebelerdeki anne vasküler dilatasyonundan ve kan basıncı değişikliklerinden özellikle sorumludur. ADMA konsantrasyonları normal gebelik sırasında düşer ve birinci trimestrin sonunda minimuma ulaşır, sonra gebelik yaşıyla birlikte düzeyleri artar (98). Ancak gebelikte düşük olduğu fakat gebelik haftaları arasında fark olmadığı yönünde yayınlar da vardır (99). ADMA’nın ana eliminasyon yolu DDAH tarafından yıkılmasıdır ancak renal hiperfiltrasyon gebelik sırasındaki düşük ADMA konsantrasyonlarından sorumlu olabilir. Çünkü DDAH enzimi böbrek glomerüllerinde ve tubuluslarında oldukça yüksek düzeylerde bulunur ve bu da renal hiperfiltrasyonla böbreklere gelen ADMA düzeylerinde azalmaya neden olabilir (100).