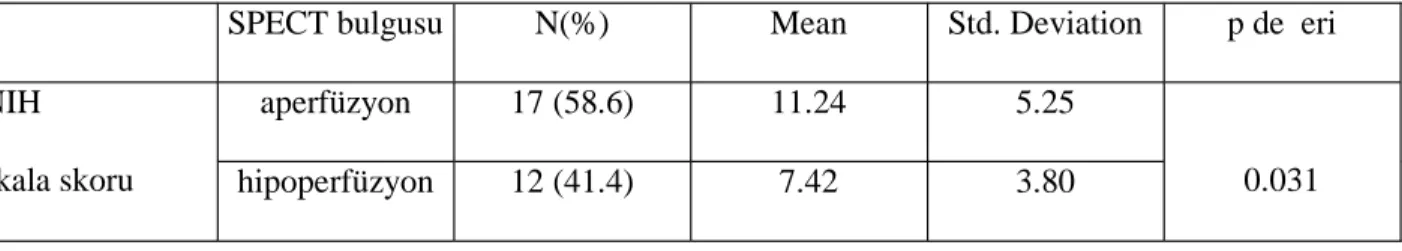
İSKEMİK STROK GEÇİREN OLGULARDA AKUT DÖNEMDE
Tc99m-HMPAO BEYİN SPECT İLE BT BULGULARININ
KARŞILAŞTIRILMASI
Dr. Gülhan KAYA ALTUNCI
(Uzmanlık Tezi)
Tez yöneticisi
Prof. Dr. Halil KAYA
DİYARBAKIR-2009
T.C
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
NÜKLEER TIP AD
Anabilim Dalı Başkanı Prof. Dr. Halil KAYA
ÖNSÖZ
Nükleer Tıp uzmanlığı eğitimim sürecinde tecrübelerinden ve bilgilerinden yararlandığım, çalışmalarıma hoşgörülü, eğitici ve öğretici kişiliğiyle yön veren, tezimin hazırlanmasında desteğini esirgemeyen hocam Anabilim Dalı Başkanımız Sayın Prof. Dr. Halil KAYA’ya,
Dicle Üniversitesinde geçirdiğim süre boyunca, bana göstermiş olduğu yakınlığıyla her zaman yanımda olan hocam Sayın Yrd. Doç.Dr. Ayten GEZİCİ’ye,
Tezimin hazırlanmasında gerekli vakaların temininde yardımlarından dolayı Sayın Yrd. Doç. Dr. Yusuf TAMAM ve nöroloji kliniğindeki asistan arkadaşlarıma,
Asistanlık sürem boyunca en güzel zamanları paylaştığım, hiçbir zaman güler yüzlerini ve yardımlarını benden esirgemeyen Dr. Canan Can ve Dr. Berfin Kızılkan Bellur başta olmak üzere tüm asistan arkadaşlarıma,
Eğitimim süresince birlikte çalışmaktan ve kendilerini tanımaktan mutluluk duyduğum tüm nükleer tıp klinik ve laboratuar çalışanlarına,
Rotasyonlarım süresince bilgi ve tecrübelerini bizlerle paylaşan tüm değerli hocalarıma, diğer asistan arkadaşlarıma,
Bugüne gelene dek benim için en çok emek sarf eden canım annem ve babama,
Her zaman yanımda olan, bana en büyük sabrı gösteren, destek ve sevgilerini daima hissettiğim eşim Yusuf Ali ve canım oğlum Rüzgar’a teşekkür ederim.
Dr. Gülhan KAYA ALTUNCI Diyarbakır-2009
İÇİNDEKİLER ÖNSÖZ 2 İÇİNDEKİLER 3 1. GİRİŞ VE AMAÇ 4 2. GENEL BİLGİLER 6 3. MATERYAL VE METOT 51 4. BULGULAR 53 5. TARTIŞMA ve SONUÇ 66 6. ÖZET 75 7. SUMMARY 77 8. KAYNAKLAR 79
1.GİRİŞ VE AMAÇ
Strok (inme), beynin bir bölgesinin, iskemi veya kanama sonucu kalıcı veya geçici olarak etkilenmesi ve/veya beyni ilgilendiren bir ya da daha fazla kan damarlarının primer patolojisi sonucu olarak ortaya çıkar. Strok gelişmiş ülkelerde hala kalp hastalıkları ve kanserden sonra üçüncü, dünya genelinde ikinci ölüm nedenidir. Erişkin çağda ise en önemli ölüm ve uzun dönem maluliyet kaynağıdır. İskemik stroklar, ölüme neden olmaları dışında aynı zamanda önemli morbidite nedenidirler. Strok insidansını azaltmaya yönelik çalışmalarda, primer korunma yöntemlerindeki iyileştirmeler ne kadar önemli ise de, strok gerçekleştikten sonra uygulanabilecek etkili tedavilerin geliştirilmesi de o derecede önemlidir. İskemik strok semptomlarının başlangıcından sonraki ilk 6 saatte acil tedaviye odaklanılmalıdır. Genellikle bu 6 saatlik periyodun, beyin hasarının sınırlandırılması için medikal müdahelenin başlatılmasında, bir tedavi zaman aralığı sa ğladığına inanılmaktadır (1). Bilgisayarlı Beyin Tomografisi (BT) ve Magnetik Rezonans Görüntüleme (MRI) gibi modern nöroradyolojik görüntüleme teknikleri iskemik ve hemorajik strok yerini ve hacmini belirlemede yardımcı olur. Ancak tekrarlanan nöroradyolojik görüntülemeler pratik değildir. Bu hastalıkların erken dönemde teşhisi, tedavinin yönlendirilmesinde ve has ta prognozunda büyük öneme sahiptir. Bu amaçla kullanılan radyolojik tanı metotları yalnızca lezyonun yapısal özellikleri hakkında fikir vermektedirler. Ancak serebrovasküler hastalıkların (SVH) fonksiyonel özelliklerini tanımlamada ve kantitasyona imkân vermesi ile nükleer tıp metotları, radyolojik tanı yöntemlerine göre daha değerlidir.
Anatomik bulguların ötesinde fonksiyonel bulguları ortaya koyan radyonüklid görüntüleme yöntemleri 1985 yılında Single Photon Emission Computed Tomography (SPECT) tekniğinin ve 1986 yılında Smith ve arkadaşları tarafından bölgesel beyin kan
akımını göstermeye uygun olan Tc99m-Hexamethylpropyleneamineoxime (Tc99m-HMPAO) radyofarmasötiğinin geliştirilmesi ile beyin SPECT çalışmaları büyük bir hız kazanmıştır(2). Çeşitli çalışmalarda farklı metodolojik ve teknik yaklaşımlar, strok prognozunda beyin SPECT’in üstünlüğünü desteklemektedir.(3,4)
Çalışmamızda, Dicle Üniversitesi Acil Servisine başvuran ve nöroloji kliniğine transfer edilen hastalara, akut dönemde uygulanan Tc99m-HMPAO SPECT görüntüleme ile nörolojik bulguların uyumu; akut ve subakut dönemde çekilen BT ya da MRI görüntülerini karşılaştırılarak; Tc99m-HMPAO beyin SPECT’in erken teşhis ve tedaviye başlanması açısından teşhis ve prognozdaki yerinin değerlendirilmesi amaçlanmıştır.
2. GENEL BİLGİLER
2.1. SEREBROVASKÜLER HASTALIK:
Serebrovasküler hastalık (SVH), santral sinir sisteminde iskemi ya da hemorajinin neden olduğu akut nörolojik bir disfonksiyondur (5, 6). Strok, dünya ölüm istatistiklerine göre ölüm sebepleri arasında kalp hastalıkları ve kanserden sonra üçüncü morbidite nedeni olarak yer almaktadır. Nörolojik hastalıklar içinde en sık görülen hastalık grubunu oluşturur ( 7).
Amerikan Nörolojik Bozukluklar ve Strok Ulusal Enstitüsü (National Institute of Neurological Disorders and Stroke (NINDS)) serebrovasküler hastalığı şu şekilde tanımlamıştır; bir beyin bölgesinin, iskemi veya kanama sonucu kalıcı veya geçici olarak etkilenmesi ve /veya beyni ilgilendiren bir ya da daha fazla kan damarının primer patolojisidir(8). Dünya Sağlık Örgütü (World Health Organization (WHO)) kriterlerine göre strokun tanısı şu şekilde yapılmaktadır: Ani gelişen, 24 saatten fazla süren ya da bu süre içerisinde ölümle sonlanan, vasküler nedenden başka bir neden ortaya konulamayan, fokal veya yaygın nörolojik defisitlerdir (9,10). İskemik infarktlar, vasküler lezyonun lokalizasyonu ve tipi ile iskeminin mekanizmaları temel alınarak farklı subgruplarda sın ıflandırılabilir. Nörolojik semptomlar, strok çapı ve lokalizasyonuyla sıklıkla ilgilidir. Klinik semptom ve bulgular, etkilenmiş anatomik bölge ve vasküler alana göre değişiklikler gösterebilir.
2.2. İNSİDANS VE EPİDEMİYOLOJİ:
Strok tüm dünyada önemli mortalite ve morbidite nedenidir. Batı ülkelerinde yapılan epidemiyolojik çalışmalar yılda 2000/milyon kişinin SVH geçirdiği ve 666/milyon kişinin SVH nedeni ile öldüğünü göstermektedir (11,12). Bu ölüm oranı akut koroner kalp hastalığı ve maligniteye bağlı ölüm sonrasında stroku dünyada üçüncü ana ölüm nedeni yapmaktadır.
Strok nedeniyle ölümlerin coğrafi dağılımı da değişiklik göstermektedir.
Bununla birlikte 40–69 yaş arası; erkeklerde SVH’dan ölüm oranı 40-250/100.000 ve kadınlarda 20-160/100.000’dir. Tüm ülkelerde en sık görülen durum, yaş ve erkek cinsiyetiyle ölüm riskinin artmasıdır (5, 6). Yaşlara göre yıllık strok insidansı 55–64 yaş arasında 1.7-3.6/1000, 65-74 yaş arasında 4.9-8.9/1000, 75 yaş üzerinde 13.5-17.9/1000’dir. Erkeklerde strok insidansı kadınlara göre 2-3 kat daha fazla iken yaş ilerledikçe bu fark azalmaktadır. Kış aylarında strokun arttığı görülmektedir (5,11). Strok tüm toplumda üçüncü en sık ölüm nedeni olması yanı sıra erişkinlerde ilk sırada gelen maluliyet nedenidir. İskemik strok tüm çalışmalarda en sık rastlanan tiptir ve %70-85'lik bir orana sahiptir. İntraserebral hemoraji %10-25, subaraknoid kanama %2-5 dolayında saptanırken, %5-10'luk kısmını halen daha nedeni belirlenemeyen stroklu hastalar oluşturur (13-15).
2.3. VASKÜLER ANATOMİ:
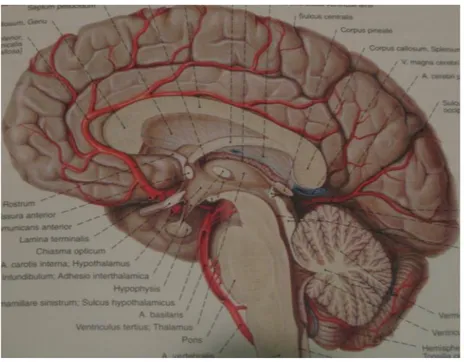
Beyin; iki serebral hemisferden ve derindeki büyük yapıları (bazal ganglion lar ve talamus, kortekse çıkan ve inen beyaz madde yolları ve sıvı ile dolu ventriküler sistem) saran serebral korteksten oluşur. Serebral korteks frontal, pariyetal, temporal ve oksipital loplara ayrılır. Serebrumun orta beyin, pons ve medullayı içeren derin yapıları beyin köküne bağlanır (Şekil1).
Serebral hemisferler kanını internal karotis arterden alırlar. Sağ arteria karotis komminis brakiyosefalik gövdeden köken alır ve sol arteria karotis komminis arkus aortadan köken alır. Her iki arteria karotis komminis boyunda mandibula açısının hemen altında ikiye ayrılır ve beyine giden arteria karotis interna ile yüze giden arteria karotis eksternayı oluşturur.
Anterior koroidal arter dalı orta serebral ve anterior serebral arterlere ayrıldığı yerden hemen önce internal karotis arterden köken alır. Anterior koroidal arter, medial temporal loba kan sağlar. Orta serebral arter frontal, pariyetal ve temporal lopları içeren serebral hemisferlerin lateral yüzeyinin dolaşımını sağlar. Orta serebral arterin horizontal bölümünden gelen küçük dallar -lentikülostriat arterler - bazal ganglionun derindeki yapılarını ve internal kapsüle kan sağlar; bu yapı korteks ve alttaki yapılar arasındaki beyaz maddeden oluşan ana bağlantı yoludur. Anterior serebral arter frontal, pariyetal ve temporal lopları içeren serebral hemisferlerin medial yüzeyine kan sağlar (Şekil 2).
Beyin kökünün kanını iki vertebral arter sağlar (Şekil 3 ); bu arterler her iki tarafta da subklavyen arterlerden köken alır ve birleşerek baziller arteri oluştururlar. Posterior inferior serebellar arter proksimal intrakranyal vertebral arterden köken alarak inferior serebellum ve lateral medullanın kan dolaşımını sağlar. Anterior serebellar arter ve süperior serebellar arter baziller arterden köken alır ve baziller arterden çıkan küçük arterlerle beyin kökü ve serebellumun geri kalan bölümüne kan sağlar. Baziller arterin uç dalları posterior serebral arterleri oluşturur ve bu arterler talamus ile birlikte pariyetal ve temporal lopların posterior bölümlerine ve oksipital loba kan sağlar.
Majör bir damar tıkandığı zaman kollateral anastomozlardan oluşan yoğun bir ağ beyinin primer kan desteğinden yoksun alanlarını besler. Ana kollateral kanal beyinin tabanındaki Willis halkasından oluşur (Şekil 3). İki karotis arter anterior komminis arterler boyunca birbirleri ile bağlantılar oluşturur. Posterior serebral arterle birlikte iki karotis arter posterior komminis arterin de katılımıyla serebral ve vertebrobaziller dolaşımlar arasında kollateral bir yol oluşturur.
2.4. PATOGENEZ:
Nöronal düzeyde hücresel işlev bozukluğunun ortaya çıkmasında ve nekrozun başlangıcında Na-K pompasında yetersizlik, nöronal membranın depolarizasyonu, eksitatör nörotransmitterlerin salınımı ve kalsiyum kanallarının açılımı rol oynamaktadır. Kalsiyum nöron içine girince, çeşitli voltaj duyarlı ve reseptörle ilişkili kanalla r aktive olur. Eksitatör nörotransmitterler (glutamat ve glisin gibi), bu kanallardan kalsiyumun daha fazla hücre içine girmesini sağlar. Bu farklı süreçlerle uzamış nöronal ölüm ortaya çıkabilir.
İskemik penumbra: İnfarkt çevresindeki beyin bölgesinde, nöronal fonksiyonun
bozulduğu fakat potansiyel olarak fonksiyonu kurtarılabilir bir bölge olarak tanımlanmıştır. Devam eden azalmış perfüzyon sonucu iskemik penumbra da bu olaydan etkilenir. Kan akımı yeterli olmayıp kesilirse infarktla sonuçlanır (17).
Distal intrakraniyal dal ya da küçük penetran son arter etkilenip tıkandığı zaman tek bir vasküler alana sınırlı infarkt oluşabilir. Oklüzyon, arteryel ağaçta daha proksimalde olursa iskemi daha yaygın olabilir ve bir vasküler alandan daha fazla veya sınır bö lgesi infarktları görülebilir.
Serebral enfarktın oluşumuna neden olan genel mekanizmalar şunlardır:
A. Trombotik enfarkt: Genellikle aterosklerotik bir plak üzerine trombüs yerleşmesiyle
oluşurlar. Bazen damar duvarına ait bir bozukluk olmaksızın pıhtılaşma bozukluğu nedeniyle trombotik infarkt gelişebilir. Trombotik damar hastalıklarının üç temel nedeni şunlardır:
- Ateroskleroz - Lipohyalinoz
- Çeşitli vaskülopatiler
B. Embolik enfarkt: Trombüs orijininden partiküllerin daha distale gitmesiyle vaskül er
sistemde emboli ve arteryel oklüzyon oluşur. Emboli, çoğunlukla arter bifürkasyonunda ve lümenin daraldığı yerlerde oluşur.
C. Hemodinamik enfarkt: En sık olarak beynin bir bölümünün kanlanmasını sağlayan
proksimal arterin tıkanma ve ağır stenozunda ve küresel serebral perfüzyonun kritik düzeyde azalmasında (örneğin kardiyak çıkışın azalmasında), kollateral kompansatuar kan akımının yetersizliğinde gelişir. Hemodinamik enfarktlar major serebral arterlerin sulama alanları arasında kalan sınır bölgelerinde oluşur (8,17).
2.5. ETİYOLOJİK SINIFLAMA:
İskemik infarkt, bütün SVH’ların yaklaşık %80- 85 gibi önemli bir bölümünü oluşturmaktadır. Günümüzde, iskemik strok etiyolojisinin; prognoz, sonuç ve tedavi yaklaşımını nasıl etkilediğinin gösterilmesi nedeni ile SVH’ların etiyolojilerine göre sınıflandırılması daha önem kazanmıştır (18).Trial of Org 10172 in Acute Stroke Treament (TOAST) bugün için en sık kullanılan, etiyolojiyi temel alan sınıflamadır.
İskemik strokta TOAST sınıflandırması
1. Aterosklerotik infarkt (Büyük damar hastalığı), 2. Kardiyoembolik infarkt
3. Laküner infarkt (Küçük damar hastalığı) 4. Diğer bilinen etiyolojiler
5. Sebebi belirlenemeyenler (Kriptojenik)
1. Aterosklerotik İnfarkt (Büyük Damar Hastalığı)
Tüm iskemik strok hastalarının %14-40 kadarından sorumludur (19,20). NINDS kriterlerine göre major intrakraniyal veya ekstrakraniyal serebral arterleri tutan aterosklerotik lezyonlara bağlı olarak ortaya çıkan serebral infarkt olarak tanımlanır. Geniş damarların birindeki aterosklerotik plak sonucunda progresif stenoz ile geniş arteryel oklüzyon oluşabilir. Aterosklerotik plaklar karotis arter ve vertebrobaziler sistemin herhangi bir noktasında oluşabilir. Fakat ensık ana karotis arter bifurkasyonu ile eksternal ve internal karotis arterlerde görülür. Ayrıca orta ve ön serebral arterlerden ve vertebral arterlerden orjin alabilir (19).
2. Kardiyoembolik Enfarkt
Kardiyak kaynaklı trombüsden köken alan kardiyoembolizm önemli bir strok nedenidir. İskemik serebrovasküler hastalık nedenleri arasında, aterotrombotik mekanizmalardan sonra ikinci sırada yer alır, %15 ile %30 kadarından sorumludur. Trombüsten küçük bir partikül kopup kan dolaşımına geçerek küçük bir artere, genelde distal intrakraniyal dallara gidebilir. Trombüsten embolizasyonun yanı sıra diğer tip partiküller de (neoplazm, yağ, hava ve diğer yabancı madde partikülleri) embolize olabilir.
Kardiyak embolizmin en sık nedenleri; valvüler kalp hastalıkları (mitral stenoz, mitral regurjitasyon, romatizmal kalp hastalıkları), intrakardiyak trombüs (anterior MI sonrası, sol ventrikül duvarını etkileyen trombüs, atriyal fibrilasyonlu (AF) hastalarda sol atriyal apendikste trombüs), ventriküler ya da septal anevrizma ve kardiyomyopatilerdir (19,20).
Kardiyak kan akımının yavaşlaması da intrakardiyak trombüs formasyonu için artmış eğilim yaratır. Diğer serebral embolizm kaynakları; atrial miksoma, marantik endokardit (non
bakteriyel trombotik endokardit) ve şiddetli mitral kapak prolapsusudur. Embolizm, majör serebral arterlerin farklı bölümlerini veya serebral yüzeyel dalları etkileyebilir. Arteriyel lümenin embolik obstrüksiyonu rekanalizasyon ve fibrinolizis ile temizlenmektedir. Bu oluşum sırasında damar lümeni stenotik görülebilir. Son zamanlarda kardiyak ve serebral görüntülemenin daha duyarlı olmasıyla trombüs kaynağının daha iyi tanımlaması yapılmıştır.
3. Laküner İnfarktlar (Küçük Damar Hastalığı)
Tüm strok olgularının %15 ile 30 kadarını oluşturur (19,20). Bu infarktlar tek bir damar alanında tanımlanan küçük iskemik bölgelerde oluşan lezyonlardır. Lakünün patolojik tanmlaması; ortalama 5mm çapta (3-15 mm) ufak serebral infarktlardır. Lakünler talamus, bazal ganglionlar, korona radiata, sentrum semiovale, internal kapsül ve beyin sapında görülebilir. Temel patoloji damar duvarı yıkımı, damarın fokal ekspansiyonu, trombotik tıkanma, hemorajik ekstravazasyon ve fibrinoid depolanmadır (21).
4. Diğer bilinen etyolojiler
Bu nedenler iskemik inmenin etyolojisinin yaklaşık %5’ini oluşturur. Daha az sıklıkla görülmekle birlikte serebral perfüzyonu azaltıp infarkt oluşturan diğer durumlar:
Arteryal disseksiyon
Primer ya da sekonder vaskülit
Hiperkoagulabilite durumları
Vazospazm ve sistemik hipotansiyon
Hiperviskozite (polistemi, disproteinemi ya da trombositozis)
Moya moya hastalığı
Fibromusküler Displazi
Beyin drenajını sağlayan venlerin oklüzyonu.
5. Sebebi belirlenemeyenler (Kriptojenik)
Tanımlanmamış infarktlar iskemik infarktların %40 kadarını oluşturur. Serebral infarkt subtiplerinin ayırt edilmesinde strok oluşumunun klinik özellikleri yardımcı olabilir (19,20).
2.6. RİSK FAKTÖRLERİ:
Tablo1: Strok Risk Faktörlerinin Sınıflandırılması
I.Değiştirilemeyen Risk Faktörleri II. Değiştirilebilen Risk Faktörleri
a) Yaş b) Cinsiyet c) Irk d) Aile Öyküsü a) Kesinleşmiş Faktörler 1. Hipertansiyon 2. Diabetes Mellitus 3. Kalp Hastalıkları 4. Hiperlipidemi 5. Sigara
6.Asemptomatik Karotis Stenozu 7. Orak Hücreli Anemi
b) Kesinleşmemiş Faktörler
1. Alkol kullanımı 2. Obesite
3. Beslenme Alışkanlıkları 4. Fiziksel İnaktivite 5.Hiperhomosisteinemi 6.İlaç kullanımı ve bağımlılığı 7. Hormon Tedavisi
8. Hiperkoagulabilite 9. Fibrinojen
10. İnflamasyon
İnme tedavisindeki önemli gelişmelere karşın, inmeye bağlı ölümler, halen ölüm nedenleri arasında ön sıralarda yer almakta ve buna bağlı sakatlıklar ise büyük ekonomik ka-yıplara yol açmaktadır. Bu durumda, inmenin risk faktörlerinin epidemiyolojik çalışmalarla belirlenmesi ve önlenmesi önem kazanmaktadır. Risk faktörlerinin belirlenmesinde başl ıca veriler, çok sayıda birey ile yapılmış, randomize ve geniş çaplı epidemiyolojik çalışmalardan sağlanmaktadır. Risk faktörlerinin, relatif riskinin hesaplanmasının ya nı sıra, bu faktörlerin toplumdaki prevalanslarının da bilinmesi, özellikle toplum sağlığı ve ülke ekonomisi açısından önemlidir. Bireysel olarak ele alındığında ise risk faktörlerinin başta yaş olmak üzere diğer risk faktörleri ile etkileşimleri, toplum sağlığı açısından da prevalansları gözönüne alınarak değerlendirilmelidir.
2.7. SEREBRAL İSKEMİNİN FİZYOPATOLOJİSİ
Yetişkin beyin ağırlığı 1500 gramın üzerindedir. Kalbin pompaladığı kanın beşte biri beyine gelir (1000ml/dk). Bunun 800 ml’si karotis sistemi, kalanı vertebrobaziller sistemle
sağlanmaktadır. Beyine 100 gram beyin dokusuna dakikada 50 ml kan gelir, buna bölgesel
kan akımı denmektedir.
Her 100 gram beyin dokusu dakikada 3,3 ml oksijen ve 5,5 mg glukoz tüketir. Gelen kan akımı, belirli sınırlar içindeki kan basıncı değişikliklerinde sabit tutulur. Bu mekanizmaya
serebral otoregülasyon denir. Serebral otoregülasyon ortalama arteriyel basınç 70-160
mmHg arasında olduğunda işlevseldir (5).
Birkaç dakikalık işlev bozukluğu sonucunda bile oksijen ve glukoz azalıp kritik seviyelere inebilir. Beyin dokusu bu maddeleri depolayamadığından ve metabolizması çok yüksek olduğundan serebral dolaşımda 6-10 saniyelik kritik düzeyde bir duraklama, geriye dönüşümlü nöronal metabolik bozukluğa ve bilinç kaybına neden olur. Serebral dolaşımda 30 saniyelik bir kesilme beyin metabolizmasında değişikliğe yol açarken, 5 dakika sonra irreversibl beyin dokusu yıkımı ve serebral infarktla sonlanabilecek anoksi başlar (22,23). İskemik penumbrada ise serebral kan akımı 12- 23 ml/100gr/ dakika düzeyindedir. Bu sırada morfolojik değişiklikler meydana gelir; elektriksel nöronal işlev bozulur ancak nöronlar yaşamaya devam eder. Serebral kan akımının 10- 12 ml/100gr/ dakikanın altına düşmesi, süre ile bağımlı olmaksızın infarkta neden olur (5).
İskemiye bağlı nöron ölümü başlıca dört fazda oluşur. Bunlar:
1- Eksitoksisite (dakikalar içinde)
2- Periinfarkt depolarizasyon (dakikalar-saatler içinde) 3- İnflamasyon (saatler-günler içinde)
4- Apopitoz, nekroz (günler içinde)
Bu fazlarda rol alan majör mediatör, intrasellüler sitozolik Ca+2’un kontrol süz yükselişi, serbest radikallerin artışı ve asidozdur.
İnternal karotid arter (İKA): İKA’nın yavaş ve unilateral tıkanması Willis
poligonundan sağlanan yeterli kollateral akım nedeniyle asemptomatik ol abilir ancak bununla birlikte büyük bir kısmında da strok gelişebilir. Tıkanma en sık bifurkasyon bölgesindedir. Vakaların yaklaşık 1/4’ünde strok öncesinde, karotiste geçici iskemik atak (GİA) öyküsü vardır. İKA’nın unilateral tıkanmasında, en sık olarak orta serebral arter kanlanma alanının bir kısmında veya tamamında infarkt gelişir.(24).
Orta serebral arterin beslediği alandaki bir infarkta, aynı bölge ile ilişkili bir GİA öncelik ediyorsa ve servikal bölgede üfürüm saptanırsa strok büyük olasılıkla İKA hastalığına bağlıdır (25). Nörolojik bulgular monopareziden hemipareziye kadar kas güçsüzlüğü, homonim hemianopsi, dizartri veya afazi, agnozinin çeşitli tipleri kısmi veya tam hemihipoestezi olarak saptanır. Geçici monooküler körlük karotid okl üzyonunda nadir bir bulgudur.(22,25,26).
Orta serebral arter (MCA): MCA, verdiği lentikülostriat arterler aracılığıyla
hemisfer derinindeki kapsula interna, kapsula eksterna, nukleus kaudatus, putamen ve klaustrumu besler. MCA ve dalları emboliyle en sık tıkanan dam arlardır. MCA arter sendromunda en sık görülen motor belirti hemiplejidir. Bunun dışında hemihipoestezi, homonim hemianopsi, afazi ve diğer dil bulguları, yürüyüş apraksisi, anozognozi diğer görülen bulgulardır (22,24,25).
Anterior serebral arter (ACA): ACA oklüzyonu ile ilişkili en sık klinik sendrom
kontrlateral alt ekstremite distalinde ve bazen birlikte üst ekstremite proksimal kaslarında kuvvetsizlik oluşmasıdır. Serebral parapleji, hemihipoestezi, idrar inkontinansı, primitif refleksler, frontal rijidite, tremor, akinetik mutizm, amnezi de diğer görülebilen bulgulardır.(24,25).
Vertebro-baziler sistem: Vertebro-baziler sistemi oluşturan damarlar medulla, pons,
serebellum, mezensefalon, talamus, oksipital lob, temporo-oksipital ve pariyeto-oksipital birleşim bölgelerinin kanlanmasını sağlar.(24,25).
Posterior serebral arter (PCA): Baziller arterin terminal dallarından oluşur. Küçük
perforan dalları mezensefalon, koroid pleksus ve posterior talamusu, kortikal dalları ise temporal lobun alt kısmını ve oksipital lobu besler. PCA tıkanıklığı sıklıkla emboli sonucu oluşur. Genellikle homonim hemianopsi saptanır. Talamustaki infarkt sonucu hemisensoriyel defekt gelişir. Her iki PCA tıkanıklığında ise kortikal körlük ve davranı ş bozuklukları sıklıkla izlenir (25).
2.8. TANI
Strok hastasının ilk klinik değerlendirmesi strok tipinin ve hastanın klinik durumunun belirlenmesi açısından kritik önem taşır. Strok, beyin disfonksiyonu semptom ve bulgularına neden olabilen diğer durumlardan (beyin tümörleri, subdural hematom gibi) ayırt edilmelidir. Strok boyutunun belirlenmesinde klinik nörolojik muayene önemlidir ve sıklıkla strokun doğasını belirler. İnmeye neden olabilen koagülasyon bozukluklarının da araştırılması gerekir(27).
Nörolojik muayene:
1- Bilinç durumu: Bilinç düzeyi değerlendirilir.
-Normal: Uyanıktır, sorulara doğru ve tam cevap verir. Zaman, yer ve kişi oryantasyonu tamdır.
-Somnolans: Hasta dalgındır. Israrlı sorulara kısa cümlelerle cevap verir.
-Stupor: Hasta sürekli uyku halindedir. Sözlü uyaranlara cevap vermez. Ağrılı uyaranlarla uyandırılabilir.
-Koma: Sözlü ve ağrılı uyaranlara cevap vermez.
2- Hareket: Aktif hareketlerle, pasif hareketler, ardışık ve düzenli hareketler
değerlendirilir.
-Aktif hareketler: İstemli ve istemsiz hareketler de ğerlendirilir. İstemli hareketlerde hastanın gözlerini açıp kapaması, ellerini açıp kapaması istenir. Bakışları, dil ve dudak hareketleri, ekstremite hareketleri değerlendirilir. Tüm ekstremitelerde tek tek kas gücü 0 ile 5 arasında değerlendirilir (0=kas gücü yok, 5=kas gücü tam). Sağ ve sol taraflar karşılaştırılır. İstemsiz hareketlerde fasikülasyonlar, koreik hareketler, atetoik hareketler, tremor ve konvülzif hareketler değerlendirilir.
- Pasif hareketler: Kol ve bacak eklemleri muayene eden kişi tarafından hareket ettirilerek karşılaşılan direnç değerlendirilir. Kaslarda artmış tonus (hipertoni) ve azalmış tonus (hipotoni) görülebilir.
- Ardışık hareketler: Elleri açıp kapama, el sırtı ve avuçları ard arda dize vurma hareketleri devamlı yaptırılır. Bir veya iki elde yavaşlama (bradidiadokokinezi) veya düzesizlik (disdiadokokinezi) olabilir.
- Düzenli hareketler: Parmak-burun testi, diz-topuk testi yaptırılır. Hareketler sırasında hedefi şaşırır ve duraklarsa dismetri var demektir.
3- Duyu muayenesi: Yüzeyel ve derin duyu değerlendirilir. Yüzeyel duyuda
dokunma, ağrı, sıcak-soğuk algılamaları; derin duyuda ise pasif hareket, pozisyon ve titreşim duyusu değerlendirilir.
4- Refleksler: Kornea ve pupil refleksleri, yumuşak damak ve farinks refleksleri, karın
cildi ve kremaster refleksleri, derin tendon refleksleri, patolojik ve ilkel refleksler değerlendirilir. Patolojik reflekslerden özellikle ayak tabanının dış kenarı sert ve künt uçlu bir cisimle topuk hizasından aşağıdan yukarıya bastırılarak çizilerek babinski refleksi değerlendirilir. Pozitif ya da cevapsız olması patolojiktir.
5- Trofik bozukluklar: Hareket sisteminin ikinci motor nöron hastalığında o nöronun
ulaştığı kaslarda erime görülmesi atrofidir.
6- Denge muayenesi: Denge bozukluğuna ataksi denir.
7- Yürüyüş: Hemiparezi geçiren hastalar parezi gelişen bacaklarını yana doğru açarak
yürürler.
8- Konuşma: Hasta kendine söylenenleri anlar ancak düşüncesini ifade ederken
kelime ve heceleri normal telaffuz edemez. Buna dizartri denir. Wernicke ve Broca afazisinde hasta duyduklarını anlamaz ya da anlasa da konuşamaz.
9- Meningeal belirtiler: Hastanın ense sertliği, Kernig ve Brudzinski belirtileri
değerlendirilir.
Radyolojik İnceleme: İnfarkt alanının yerleşimi, boyutu ve tipinin belirlenmesi için
Bilgisayarlı Beyin Tomografi (BT) veya Magnetik Rezonans Görüntüleme (MRI) kullanılır. Beyni besleyen arterlerdeki akım karotis doppler ve transkranial doppler ultrasonografi ile
değerlendirilebilir ve damarlar Manyetik Rezonans Anjiografi (MRA) veya spiral BT anjiografi ile görüntülenebilir.
Beyin bölgesel kan akımı ve perfüzyonu Tek Photon Emisyon Bilgisayarlı Tomografi (SPECT) ile belirlenebilir. Beynin metabolizmaları ise Pozitron Emisyon Tomografisi (PET) ile belirlenir. Epileptik nöbet aktivitesini tanımlamak ve beyin fonksiyonlarını belirlemek için elektro-ensefalografi (EEG) ile beynin elektriksel aktivitesi değerlendirilir. Hastanın tüm tetkikleri tamamlandıktan sonra, hastanın durumunu iyileştirebilecek ve sonraki inmeleri önleyecek uygun tedavi girişimleri başlatılır (27).
Laboratuar incelemesi: Hastalara uygun tedavinin belirlenebilmesi için temel
hematolojik ve serum biyokimya testlerinin yapılması gereklidir (27). Tam kan sayımı ile serebral doku hipoksisine neden olabilen bir aneminin varlığı, polisitemi, orak hücre anemisi veya tüketim koagülopatisi gibi bir kan hastalığının olup olmadığı belirlenmelidir. Bu nedenle periferik kan yayması incelenmelidir (28). Hiperkoagülobilite, trombotik trombositopenik purpura (29) veya iskemik ve hemorajik inmelere yol açabilen idiyopatik trombotik purpuranın belirlenmesi için trombosit sayımı gereklidir.
Endokardit gibi enfeksiyöz etyolojilerin veya pnömoni gibi ilişkili sekonder enfeksiyonların tanımlanmasına yardımcı olması ve lösemi gibi hemat olojik malignitelerle ilişkili inmenin ekarte edilmesi için lökosit sayımı da önemlidir. Protrobin zamanı (PT) ve parsiyel tromboplastin zamanının (PTT) ölçülmesi gereklidir. Hemoraji kaynağını ekarte etmek ve antikoagülasyon veya trombolitik tedavi ile terapötik girişimler için bir baz sınır elde etmek için bu testlerin ölçümü yapılmalıdır.
Kalp elektrokardiografi (EKG) ve ekokardiyografi (EKO) ile potansiyel emboli kaynakları yönünden değerlendirilir. Stroka neden olabilen veya stroktan kaynaklanan ve
yaşamı tehdit edici bir hal alabilen kardiyak aritmilerin tanımlanması için EKG önemlidir. Atriyal fibrilasyon serebral iskeminin major risk faktörlerinden biridir. Bu nedenle stroklu hastaların yatırılarak, monitörizasyon ile takibi gerekir (30-32).
2.9.SEREBRAL İSKEMİ VE İNFARKTIN GÖRÜNTÜLENMESİ:
Serebral iskeminin görüntüleme bulguları zamanla değişir. Bu nedenle akut, subakut ve kronik infarktlar ayrı olarak incelenmelidir.
AKUT İNFARKTLAR:
Serebral Anjiografi: Anjiografi fibrolitik tedavi uygulanması düşünülmüyorsa veya
atherosklerotik vasküler hastalık yanında inmenin nedeni olabilecek başka sebepler olmadıkça serebral infarktın akut evresi süresince genellikle uygulanmaz. En spesifik bulgu damar oklüzyonudur. Serebral infarkt sonrası ilk birkaç saat içinde uygulanan anjiogramların yaklaşık yarısında görülür. Emboliyle tıkanan arterde sadece persistan kontrast sütunu olarak veya distalde dolma defekti ile birlikte görülebilir.
Akut serebral infarktta izlenen diğer anjiografik anormallikler uzamış sir külasyon zamanı ile birlikteki yavaş antegrad akımı ve tutulan alanda gecikmiş arterial boşalmayı içerir . Akut strokların yaklaşık %15’inde görülür. Retrograd akım ile kollateral dolma veya non-perfüze alanlar, hiperemi veya vasküler blush (luxury perfüzyon), drene eden venlerde kontrast maddenin erken görülmesi ile birlikteki arterio-venöz şant olması ve kitle etkisi bazı vakalarda ayırt edilebilen akut serebral infarktın diğer anjiografik göstergeleridir.
Bilgisayarlı Beyin Tomografisi (BT): Akut infarktta BT’nin iki önemli amacı vardır:
1-İntraserebral hemoraji tanısı koymak veya ekarte etmek. Çünkü primer intrakranial
2-Tümör, vasküler malformasyon veya subdural hematom gibi altta yatan ve klinik
olarak stroku taklit eden lezyonların ayırdedilmesi. Non-vasküler lezyonlar strokun ancak %1-2 nedenidir.
Akut serebral infarktta BT bulguları zamanla belirginleşir. Her ne kadar serebral infarktı takip eden ilk birkaç saat içindeki BT görüntülerinin %50-60 kadarı normal olsa da ilk 4-6 saatte akut inmenin birkaç erken bulgusu tanımlanabilir. Bunlar arterin hiperatenüasyonunu (genellikle MCA - ki bu dens MCA sign olarak adlandırılır), lentiform nükleusun seçilememesi, lateral insula boyunca gri-beyaz interface’in kaybını (insular
ribbon sign) ve korteks boyunca gri-beyaz bileşkenin silinmesini kapsar. Hiperdens
MCA’nın nedeni akut intralüminal trombüstür. Hiperdens MCA sign, akut infarktların %25’inde ve MCA ‘nın beslediği bölgeye yönelik strok semptomları olan hastalarda ise %35-50 oranında rapor edilmektedir (33). Bu bulgu tipik olarak kortikal ve büyük derin MCA infarktları ile ortaya çıkar. Konvansiyonel veya MR anjiografi bu vakalarda oklüze MCA’yı gösterir.
Pıhtılaşmamış intravasküler kan normalde beyine göre bir dereceye kadar hiperdens olduğundan dolayı orta derecede hiperatenüe MCA’yı tromboze damar olarak adlandırmamak için dikkat edilmelidir. Erken BT incelemelerinde lentiform nükleusun açık hipodansitesi açık bir şekilde başlangıçtaki iskemik infarktın sonradan gelişen hemorajik transformasyonu ile birliktedir. Hipertansif intrakraniyal hemoraji ve amiloid anjiopatisi hariç olmak üzere başlangıçtan sonraki ilk 24-48 saat içinde hemorajik stroklar nadirdir. Normotansif hastalarda hemorajik inmelerin çoğu daha önceden iskemik infarkt olan bölgenin reperfüzyonu ile ortaya çıkar. Bu vakalarda hemoraji, embolinin lizisi ile akımın tekrar sağlanmasından sonra hasarlanan kapillerlerde ortaya çıkar.
Hiperakut infarkt (<12 saat) Normal (%50-60), Hiperdens arter (%25-50),
Lentiform nukleusun seçilememesi
Akut (12-24 saat) Bazal ganglionlarda düşük dansite, Gri-beyaz cevher interface’nin
kaybı (insular ribbon sign, kortex-medulla sınırının seçilememesi), sulkal silinme
1-3 Gün Artan kitle etkisi, Gri ve beyaz cevherin her ikisini de tutan wedge şeklinde
düşük dansite, Hemorajik transformasyon olabilir(en sık bazal ganglionlar ve kortekste)
4-7 Gün Gyral kontrastlanma, Kitle etkisi ve ödem persistan kalır
1-8 Hafta Kontrast tutulumunun persistan kalması, Kitle etkisinin çözülmesi,
Transient kalsifikasyon olabilir (pediatrik inmelerde)
Aylar-Yıllar Ensefalomalazik değişiklik, hacim kaybı, nadir kalsifikasyon
Manyetik Rezonans Görüntüleme (MRI): Akut infarktlar BT’ye göre MRI’la daha sıklıkla
saptanıp, daha iyi lokalize edilebilir. %80’i ilk 24 saatte alınan standart spin echo MRI görüntüleri ile görülür. En erken MRI bulguları vasküler akıma bağlı anomalilerdir. Bunlar normal flow-void yokluğu ve intravasküler arteriyel kontrastlanma ile birlikteki yavaş akımdır. Bu bulgular semptomlar başladıktan sonra dakikalar içinde saptanabilir. İntravasküler kontrastlanma akut kortikal infarktların yaklaşık %75’inde görülür. Diğer erken MRI bulguları T1 ağırlıklı imajlardaki morfolojik değişiklikleri (başlıca beyin ödemi) içerir. Bu anatomik değişiklikler proton dansite veya T2 ağırlıklı sekanslardaki artmış sinyal gelişiminden önce ortaya çıkabilir. T2’de hiperintensite meydana gelir ancak, genellikle 8 saatten önce gözlenmez. 1-3 günlük kortikal infarktlara komşu, anormal meningeal kontrastlanma vakaların 1/3’ünde izlenir. Standart MRI sekansları hastaların %10 -20’sinde akut iskemiyi saptamayabilir.
Serebral infarktta MR bulguları
Hemen: Normal akım kaybı, İntravasküler kontrast kuvvetlenmesi, Perfüzyon değişiklikleri,
Düşük diffüzyon kat sayısı
<12 saat T1’ de anatomik değişiklikler, Sulkuslarda silinme, Gyral ödem, Gri-beyaz
görünümün kaybı
12-24 saat T2’ de hiperintensite, İnfarkta yakın bölgede meningeal hızlanma, Kitle etkisi
24-48 saat İntravasküler, meningeal hızlanma azalmaya başlar. Erken parankimal kontrast
hızlanmasında artma.T1, T2’ de sinyal anomalileri, Hemorajik transformasyon belirginleşir.
4-7 gün Belirgin parankimal kontrast hızlanması, Hemoraji %25 belirgin, Kitle etkisi ,ödem
azalmaya başlar., İntravasküler meningeal hızlanma kaybolur.
1-8 hafta Kontrast hızlanması sürer. Kitle etkisi çözülür, T2’ deki anormal sinyalde azalma,
Hemorajik değişiklikler kronikleşir.
Aylar-Yıllar Etkilenmiş vasküler yayılımda ensefalomalazik değişiklikler, Hemorajik rezidü
(Hemosiderin-ferritin)(33).
2.10.SEREBRAL İSKEMİK HASTALIKLARIN ERKEN TANISINDA DİĞER YAKLAŞIMLAR
MR Anjiografi (MRA): MRA büyük damarlardaki oklüzyonu veya ciddi stenozu,
hastaların çoğunda gösterebilir. Spin saturasyonu distal lezyonlar ve küçük damarlar için sensitiviteyi azaltmaktadır.
Diğer Teknikler: Strok ve iskemiye bağlı serebral metabolizma değişikliklerinin çok
erken tanısı yeni morfolojik ve fonksiyonel klinik görüntüleme modaliteleri ile günümüzde mümkün hale gelmiştir. Bunlar: Transkranial doppler US, Proton MR Spektroskop, Diffüzyon görüntüleme ve Perfüzyon incelemeleridir.
Transkranial Doppler US:Akut MCA oklüzyonunda kullanılabilir.Anormal bulgular;
MCA dan sinyal alınamaması veya MCA akım hızının belirgin şekilde azalmasıdır.
Proton MR Spektroskopi: Serebral metabolizmadaki iskemiye bağlı değişiklikleri
izlemede kullanılır. Akut iskemik infarktlar N-asetil aspartat rezonansı düşüşü ve laktat artışı ile karakterizedir. En yüksek laktat seviyeleri komplet MCA bölgesi infarktlarında meydana gelir. İnfarkt alanlarında kreatin ve fosfokreatin de düşmektedir, fakat kolin içeriğinde belirgin değişim rapor edilmemiştir.
Diffüzyon Ağırlıklı Görüntüleme: Diffüzyon ağırlıklı MR görüntüleme su
protonlarının mikroskopik hareketine duyarlıdır. Manyetik alan gradientinin varlığında hareket eden su molekülleri ile taşınan protonların transvers manyetizasyonlarının faz şifti oluşur. Diffüzyon ağırlıklı MR görüntüsünde hızlı difüzyonlu yapılar siyah görülür çünkü en yüksek sinyal attenüasyonu söz konusudur. Yavaş diffüzyonlu yapılar ise parlaktır.
İskeminin başlangıcında sitotoksik ödem dakikalar içinde başlar ve beyin dokusu suyunda %3-5'lik artış oluşturabilir. Diffüzyon ağırlıklı MR kullanarak arteryel oklüzyondan sonra dakikalar içinde sinyal intensite değişiklikleri kaydedilebilir. Akut infarktlar infarkte olmayan beyin dokusuna göre daha düşük apparent diffüzyon katsayısına sahiptir ve bu erken sitotoksik beyin ödeminin oldukça sensitif belirteci olabilir.
Ekoplanar görüntüleme iskemik beyinin diffüzyon katsayılarının ölçülmesine ek olarak fizyolojik parametreleri görüntülemede kullanılabilir. Deoksijene kan effektif hassas
bir kontrast ajan gibi davranır. Gradient eko eko-planar MR görüntüleme kullanılarak beyin oksijenasyonundaki değişiklikler monitorize edilebilir.
Eko-planar görüntüleme ve fast gradient eko teknikleri aynı zamanda serebral perfüzyonu ve serebral kan hacmindeki fonksiyonel değişiklikleri değerlendirmede intravasküler paramanyetik ajanların bolus enjeksiyonuyla birlikte kullanılabilir. Kan-beyin bariyerinin intakt olduğu normal bir beyinde dysprosium DTPA-BMA gibi lanthanide şelatları intravasküler alanda kalırlar. Normal kan akımı olan alanlarda alan gradientleri kapiller alanlarıyla çevre perfüze doku arasında transient fakat substansiyal sinyal azalmasına yolaçarlar. Non-perfüze veya hipoperfüze dokular ise kontrastsız olup sonuç olarak hiperintens görülür(33).
2.11.AKUT İSKEMİK STROKTA NÜKLEER TIP YÖNTEMLERİ
SPECT ve PET radyonüklidlerin beyinde bölgesel dağılımının invivo kuantifikasyonunun yapılabildiği görüntüleme teknikleridir. Bu tekniklerle kan akımı, oksijen ve glikoz tüketimi, nöroreseptörlerin varlığı ve nörotransmitter kullanımı gibi serebral, metabolik aktiviteler ve fonksiyonlar non-invaziv bir şekilde ölçülebilmektedir. Klinikte bu teknikler hastalıkların teşhisi, prognozu ve tedaviye cevabın izlenmesinde kullanılabilir. SPECT ve PET çalışmaları foton veya pozitron yayan radyonüklidlerle işaretli radyofarmasötikler kullanılarak yapılır. Tek foton yayan radyonüklidler çoğunlukla enerjileri 80-360 kilo elektron volt (keV) arasında değişen gamma veya X ışını yayarlar. Yarı ömürleri (T½) birkaç saat ile gün arasında değişen ve biyolojik olmayan elementlerdir.
Pozitron yayan radyonüklidler, pozitif yüklü elektron (pozitron) yayarlar. Radyonüklidlerden çıkan pozitronlar dokuda birkaç milimetre ilerledikten sonra karşılaştıkları
bir negatif elektronla çarpışarak annihilation (yok olma) adı verilen olayla enerjilerini kaybederler. Bu, 180 derece zıt yönlerde yayılan her biri 511 keV enerjili iki foton salınımına neden olur. Bu fotonlar dedektörler aracılığıyla algılanır ve tek foton olarak kaydedilir. Daha sonra bilgisayar yardımıyla üç boyutlu görüntüler elde edilir. Pozitron yayan radyonük lidler çoğunlukla biyolojik elementlerin izotoplarıdır (örn: flour(F18), oksijen(O15), karbon(C11), azot(N13)gibi). Bunlar siklotron ürünleridir ve yarı ömürleri saniyeler ya da dakikalarla ölçülür.
SPECT tekniğinde görüntüleme gamma ışınlarının tespitine dayanır. Tomografik teknikle farklı yönlerden gelen sinyaller toplanarak görüntü oluşturulur. Daha sonra üç boyutlu görüntüler oluşturulmak üzere, elde edilen imajlar bilgisayar ortamında birleştirilir.
Beyin perfüzyon ajanları ile yapılan SPECT çalışmala rında kan akımı ile orantılı olarak kortikal gri cevherdeki aktivite tutulumu, beyaz cevhere oranla daha fazla izlenir. Çünkü gri cevherdeki kan akımı, beyaz cevhere oranla 4 kat fazladır. Beyaz cevherdeki aktivite tutulumu çok az olduğundan ventriküllerle arasındaki sınır belirsizdir. Her iki hemisferde simetrik olarak aktivite tutulumu izlenir. Ayrıca bazal ganglionlarda, talamus ve serebellumda da kortekse oranla çok daha yoğun tutulum izlenir (34).
BEYİN PERFÜZYON AJANLARI:
Kan-beyin bariyerinin (KBB) seçiciliği kandan beyine maddelerin geçişini sınırlamaktadır. Beyin görüntülemesi için kullanılan radyofarmasötikler de bazı kurallara göre hareket etmek zorundadırlar. Beyin perfüzyon ajanları yüksüz nötral lipofilik bileşiklerdir. Sağlam kan-beyin bariyerini kolaylıkla geçerek kortikal nöronlara ulaşırlar. İdeal bir perfüzyon ajanı kan-beyin bariyerini kolayca ve hızla geçebilmeli ve beyin hücrelerinde yüksek oranda tutulmalıdır. Önemli oranda redüstribüsyona uğramamalı ve istenen imajlama
çalışmasına (20-60dk) olanak verecek kadar beyinde kalmalıdır. Kortikal ve subkortikal yapılarda kanlanma ile orantılı olarak bölgesel dağılım göstermeli ve metabolize olmamalıdır.
KBB‘den iki temel geçiş mekanizması vardır: Aktif membran transportu ve pasif difüzyon. Aktif membran transportu yapıya bağımlı olup protein taşıyıcı moleküldeki bağlayıcı bölgenin tanınmasına bağlıdır. Pasif difüzyon, radyofarmasötiğin büyüklüğü, ağırlığı, yükü ve lipitte çözünürlüğü ile ilgili bazı fizikokimyasal özellikler ve KBB’nin bozulması ile ilgilidir (35). Radyofarmasötiğin dağılımı bu parametrelerden birinden etkilenebilir.
Yakın geçmişte beyin fonksiyonlarının ölçümü ve görüntülenmesi için lipofilik ve nötral radyofarmasötikler geliştirilmiştir. Bunlardan günümüzde en sık kullanılan ları Tc 99m-HMPAO ve Tc 99m-ECD’dir. Bu perfüzyon ajanları aynı zamanda bölgesel kan akımı (rCBF) ajanları olarak da adlandırılırlar.
KAN-BEYİN BARİYERİ:
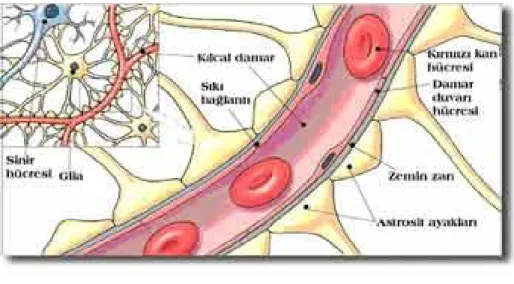
Kan-beyin bariyeri(KBB), serebral kapiller sirkülasyon ve santral sinir sistemi dokusu arasındaki yapıdır (Şekil 4). İlk defa 1857’de Ehrlick tarafından tanımlanmıştır (36). Günümüzde nörolog ve nörofizyologların çoğu, serebral endotelin özel yapısının KBB’yi oluşturduğunu kabul etmişlerdir. Bu özellikler şunlardır:
1-Bazal membran üzerine oturmuş birbirine sıkı bağlantı ile bağlı endotel hücrelerinin varlığı,
2-İyonlara ve hidrofilik yapılara geçirgenliğin çok az olması
4-Bazı organik solitlerin transportu için kolaylaştırılmış transport mekanizmaların varlığı
5-Yüksek elektrik rezistansının varlığı
6-Yüksek ozmolalite değerinde geçirgenliğin artması
7-Endotel membranında yerleşmiş Na-K pompasının varlığı.
Şekil 4: Kan Beyin Bariyeri
Sonuçta, kapiller lümen içindeki kan, aralarında sıkı bağlantı bulunan hücrelerin oluşturduğu efektif bariyer tarafından nöronal dokudan ayrılır. Bu kompleks yapı, solitlerin ve kimyasalların nöronlara geçişini kontrol eder. Sağlam KBB büyük moleküllere geçirgen değildir. Fakat gazlar, su, glikoz, elektrolitler, aminoasitler ve alkol nöronlara ve ekstrasellüler alana az veya çok kolaylıkla geçebilirler. KBB’den geçiş için farklı
mekanizmalar vardır. Su ve gazlar pasif difüzyonla, glikoz ve aminoasitler aktif transportla geçerler.
Travma, inflamatuar olaylar ve/veya serebrovasküler olaylar sıkı endotel yapısını bozarak KBB’nin yıkımına neden olabilirler. Böylelikle suyun, elektrolitlerin ve proteinlerin hücre içi ve dışındaki konsantrasyonu büyük oranda değişebilir. Daha önceleri bu mekanizma kullanılarak görüntüleme yapılıyorken, 1980’lerin başından beri sağlam KBB’ni geçebilen, lipofilik, nötral ajanlar kullanıma girmiştir (36).
BEYİN GÖRÜNTÜLEMEDE KULLANILAN RADYOFARMASÖTİKLER
1-Kan beyin bariyerini geçemeyen radyofarmasötikler:
-NaTc99m O4
--Tc99mDTPA
-Tc99mGH(glukoheptonat)
Bu ajanlar normal koşullarda kan beyin bariyerini geçemezler. İntrakraniyal olaylar (travma, enflamatuar olaylar, tümör) kan beyin bariyerini bozar ve radyofarmasötiğin beyin dokusuna ekstravazasyonuna neden olur. Tc99m’li ajanların transferinde asıl mekanizma tam bilstrokmekle birlikte başlıca difüzyonun sorumlu olduğu söylenmektedir.
Tc99m, molibdenden (Mo99) radyoaktif bozunma sonucu oluşan radyoaktif bir ajandır. Radyonüklid olarak kullanılan Tc-99m, Mo99/Tc99m jeneratöründen sağım yoluyla elde edilir. Bir radyonüklid jeneratörü, bir apareyde bulunan ana-yavru(kız) nüklid çiftinin ayrılmasına ve yavru nüklidin ürün olarak elde edilmesine imkân veren bir sistemdir.
Mo99/Tc99m jeneratör sisteminde ana nüklid olan Mo99’un absorbe edildiği ve karşılıklı iyon değişimine izin veren alüminyum bir sütun bulunur. Sütunun alt ucunda delikli cam bir ızgara, tepesinde ise plastik bir halka vardır. Rölatif olarak daha uzun ömürlü olan ana nüklid radyoaktif bozunma ile sürekli yavru nüklid doğurur. Ana nüklid iyon değiştirici sütun üzerinde kalırken, yavru nüklid çeşitli ayrıştırma yöntemleri ile sütunun alt ucunda birikir. Tek bir sağımla genellikle %87 oranında Tc99m aktivitesi Tc-99m-pertechnetate olarak elde edilebilir. Daha sonra tekrar birikmeye başlar ve en erken maksimum aktivite 24 saat sonra elde edilir. Tc-99m-pertechnetate biyolojik olarak iodine ve perchlorate gibi davranır. Tiroid, tükrük bezleri, koroid pleksus ve mideyi tutar. Bu organların imajlaması ve diğer organların kanlanma durumu (anjiogram) için serbest olarak kullanılabilir. Ayrıca genellikle liyofilize kit olarak sağlanan çeşitli kimyasal bileşiklere bağlanarak hedef organa göre imajlar alınabilir.
Tc-99m-pertechnetate’ın özellikleri; sadece gamma ışını yayar, düşük enerjilidir (140keV), jeneratör ürünüdür, yarı ömrü kısadır(T1/2 6,02saat), hipersensitivite reaksiyonuna neden olmaz, premedikasyon gerektirmez, görüntü kalitesi iyidir, bilinen bir kontrendikasyonu yoktur, advers reaksiyona ilişkin bir rapor bildirilmemiştir..
2-Kan beyin bariyerini geçen radyofarmasötikler:
Genelde kabul edilen beyin perfüzyon ajanlarının sahip olması gereken minimum kriterler şunlar olmalıdır (37):
1.Sağlam KBB’ ni geçebilme 2.İlk geçişte yüksek ekstraksiyon
3.Beyin SPECT imajlama için gerekli uzamış retansiyon 4.Beyinde efektif regional dağılım
5.Metabolize olmama
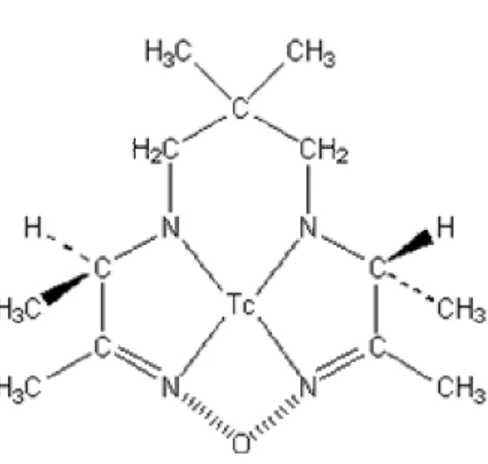
Tc99m-Hexamethylpropyleneamineoxime (Tc99m-HMPAO)
Tc99m ile bağlandığı için uygun enerjisi, kısa yarı ömrü, kolay elde edilebilme ve imaj kalitesi açısından avantajlı bir radyofarmasötiktir. Tc99m-HMPAO günümüzde en sık kullanılan beyin perfüzyon ajanıdır (Şekil 5). HMPAO’nun d, l ve mezo izomerleri vardır. d ve l izomerleri hızla kan beyin bariyerini geçerek beyinde retansiye olurken mezo izomerinin beyinden wash-out’u hızlıdır ve beyinde retansiye olmaz.
Şekil 5: Tc99m-HMPAO
En uygunu ve ticari olarak kullanıma hazır olan d, l-HMPAO kararlı olmakla birlikte Tc99m NaTcO4- ile salin solüsyon içinde bağlandığında stabilitesi azalmaktadır. Neirickx ve
ile KBB’ni geçtiğini ve geriye diffüze olamayan sekonder hidrofilik yapılara dönüştüğünü göstermişlerdir (35,38,39).
Fiksasyon mekanizmasının hücrede çok küçük konsantrasyonda serbest halde bulunan glutatyon ile basit kimyasal reaksiyonla olduğu düşünülmektedir (40). Sekonder kompleks hidrofilik olduğundan KBB’ni geçemez yani redüstribisyona uğramaz. Enjeksiyondan sonra maksimum beyin aktivitesine 1-2 dakikada ulaşır. Tc99m HMPAO uygulaması sonucu bazı organların maruz kaldığı radyasyon dozları tablo 3’te gösterilmiştir. Veril en dozun %3,5-7’si beyne geçer ve ortalama 8 saat beyinde bu oran değişmez (41). Kan beyin bariyerini geçtikten sonra kanlanmayla orantılı olarak beyinde Tc99m HMPAO distribüsyonu izlenir (42). Tc99m HMPAO, moleküler büyüklüğü 500 dalton olup küçük lipofilik ve nötral bir komplekstir. Verilen aktivitenin %80’den fazlası eritrositlere bağlanır.
Enjeksiyondan sonraki birkaç dakika içinde serebral aktivitenin %15’i beyinden ayrılır. Sonraki 24 saat içinde anlamlı bir aktivite kaybı olmaz. 48 saat içinde %50’si hepatobiliyer yolla, %40’ı idrarla atılır (4,34,43). d ve l izomeri daha çok böbreklerle atılırken, mezo izomeri hepatobiliyer yolla atılmaktadır. Yapılan birçok çalışmada Tc99m HMPAO kompleksinin ilk 30 dakikada %82-90’ının d ve l izomerlerinden oluştuğu tespit edilmiştir. Zamana bağlı olarak bu oranlar azalmaktadır (35). Tc99m HMPAO ile serebral kortekste, serebellum ve talamusta sınırları net olarak vizualize edilirken nukleus kaudatus ve putamen birleşik olarak izlenir.
Tablo 3: Tc99m HMPAO uygulaması sonucu değişik organların maruz kaldığı radyasyon dozları (44).
Organlar Radyasyon Dozu(rad/mCi)
Karaciğer 0,042 Böbrek 0,097 Over 0,042 Testis 0,009 İncebarsak 0,068 Tüm vücut 0,016 Xe-133:
İnhalasyon ya da IV yoldan verilen inert bir gazdır. Dokularda serbest olarak difüze olur. Serebral kan akımı ölçümünde yararlı bir yöntem olmasına karşın bazı dezavantajları vardır. Yarı ömrü uzun olduğundan radyasyon etkisi yüksek ve çevre kontaminasyonu fazladır(4,34,43,45,46).
Xe-133, kantitatif rCBF(regional cerebral blood flow)beyin perfüzyon SPECT’inde kullanılarak serebral wash-out’u ölçülerek kesin bir rCBF değeri belirlenir (47). Bu nedenle Xe-133 SPECT rCBF kantifikasyonu için standart olarak kabul edilir. Arteriel kan örnekleri almaksızın ml/100gr/dk olarak serebral kan akımı hakkında fi kir verir. Fakat Xe eliminasyonunun saptanabilmesi için dinamik imajlar alabilen tomografik teknik gerekir.
I-123-İsopropyliodoamphetamine(I123-IMP):
I-123 işaretli aminlerin en sık kullanılanı, I123 isopropyliodoamphetamine (I123 -IMP) dir.I123-IMP intact kan beyin bariyerini geçtikten sonra nöronlardaki amfetamin reseptörlerine bağlanır. Özellikleri, beyin perfüzyon SPECT için oldukça uygundur (48). Enjeksiyondan 2 dakika sonra %45’i beyinde tutulur. Pik beyin aktivitesine enjeksiyondan 20 dakika sonra ulaşması ve zamanla redüstribisyon göstermesine rağmen iyi bir imaj almaya
yeterli düzeyde gri cevher/beyaz cevher oranı ve serebral korteks tarafından kan akımı ile orantılı olmayan bir serebral korteks reuptake’i vardır(48,49). Enjeksiyondan 60 dakika sonra redüstribisyon başlar. Beyindeki uptake ve retansiyon mekanizmasının molekülün yapısındaki aminlerin muhtemelen N-Metil transferaz enzimi yardımıyla demetilasyona uğrayıp metabolize edilerek non-lipofilik metabolitlerinin oluştuğu ve daha sonra lizozomlar, reseptör veya protein bağlayıcılar gibi hücrelerdeki organellerce tutulduğu düşünülmektedir. HMPAO ve ECD’ye oranla yüksek akım durmlarında bölgesel beyin kan akımını(rCBF) daha doğru yansıtır.
Tc99m-Ethyl-cysteinate Dimer(Tc99m-ECD):
Normal beyin dokusunda ECD ve HMPAO’nun kinetik özellikleri benzerdir. Lipofilik yapıları nedeniyle beyin hücrelerine girer ve hidrofilik bileşiklere dönüşerek orada kalırlar.
ECD’nin hidrofilik değişimi için deesterifikasyon gerekirken HMPAO için lipofilik formun instabilitesi ve glutatyon etkileşimi söz konusudur. I123-IMP’ ye göre daha çabuk pik beyin aktivitesine ulaşır(enjeksiyondan sonra 2 dakika içinde) ve redüstribisyona uğramaz.
L ve D izomeri vardır. Serebral perfüzyonun değerlendirilmesinde L formu uygundur. D izomeri beyinde hızla wash-out’a uğrarken, L izomeri beyinde hızla retansiye olur. Mono ester mono asite metabolize olarak beyinde kalır. Kit hazırlandıktan sonra 6 saat stabilitesini korur. Kan klirensi anlamlı derecede yüksektir(4,34). Verilen dozun %6’sı 5. dakikada beyinde tutulur. 24 saatte %74’ü idrarla atılır. Beyinde redistribüsyonu yoktur. Mono ester mono asite metabolize olarak beyinde retansiye olur. Hızlı kan klirensi ve üriner ekskresyona sahiptir. Böbreklerden hızla atılımı dozimetrede avantaj sağlar ve yüksek dozlarda kullanımı mümkündür. Yüksek dozda kullanımla gri/beyaz cevher oranı ve HMPAO ile kıyaslandığında imaj kalitesi yükselir.
Tl201-Dietil-Ditio-Karbamat (DDC):
Lipofilik yapısıyla KBB’ni geçer. Beyin uptake’i 90 saniyede tamamlanır. Beyinde bulunan aktivite büyük oranda sabit kalır. Beyin tutulumu verilen dozun % 4,3’üdür. Tutulum mekanizması bilinmemektedir. Beyinde kan akımı ile orantılı bir şekilde hızla akümüle olur. Akciğer retansiyonu yoktur. Atılımı hepatobiliyer sistem ve böbrekler yoluyla olur. Ancak düşük enerjili fotonları nedeniyle suboptimal imaj kalitesine sahip olması, yüksek doz verilmesi, kafatasını çevreleyen kaslarda tutulum göstermesi dezavantajlarıdır (50).
Pozitron Emisyon Tomografisi (PET):
PET, pozitron yayan radyoaktif maddelerin vücuda verildikten sonra uğradıkları dağılımı görüntülemek yoluyla dokuların ve organların metabolizma ile kan akımı gibi fizyolojik özelliklerini ve bunların çeşitli patofizyolojik koşullarda uğradığı değişimleri değerlendiren bir nükleer tıp yöntemidir. PET, diğer nükleer tıp görüntülerinde olduğu gibi, yapısal (anatomik) detayı göstermekten çok fonksiyonel ve metabolik aktiviteyi göstermeye yöneliktir. Kullanılan radyofarmasötiğin özelliğine göre değişik metabolik ve fonksiyonel parametreler PET yöntemi ile invivo olarak görüntülenir. PET yönteminin görüntü rezolüsyonu radyolojik tomografi yöntemlerine göre daha düşüktür. Ancak henüz yapısal değişikliklerin oluşmadığı erken dönemdeki fonksiyonel ve metabolik değişiklikleri saptayabildiği için erken tanı potansiyeli taşır.
PET yönteminde kullanılan radyonüklidler düşük atom numaralı ve kısa yarı ömürlü elementlerdir. Canlı organizmalar, yapıtaşları hidrojen, oksijen, karbon ve azot atomları olan makro moleküllerden oluşmuşlardır. Bu elementlerin vücut dışından saptanabilen izotopları, sadece pozitron yayan çekirdekleridir.
PET uygulamalarında kullanılan pozitron yayıcı radyonüklidler; F18 (flor), C11 (karbon), N13 (nitrojen) ve O15 (oksijen) dir. Siklotronda yapay olarak elde edilen bu radyonüklidler, kararlı hale geçmek için bozunurken çekirdekten pozitif yüklü bir elektron (pozitron) partikülü fırlatırlar.
Annihilation Reaksiyonu (Yok Olma-Çift Oluşum): Siklotronda üretilen pozitron
yayıcı radyonüklidlerin çekirdeklerinde proton fazlalığı vardır. Kararlı hale geçerken çekirdeklerinden pozitif yüklü bir elektron (e+) partikülü fırlatırlar. Pozitron partikülü ortamda kısa mesafe ilerledikten sonra başka bir atomun negatif yüklü elektronu ile çarpışır. İki kütle yok olur ve enerjiye dönüşerek birbirine zıt olarak hareket eden 511 kiloelektronVolt (keV) sabit enerjide gama ışını oluşur. Bu olaya pozitron yok olması ya da çift oluşum denir.
Kullanılan radyofarmasötiğin özelliğine göre değişik metabolik ve fonksiyonel parametreler PET yöntemi ile in vivo olarak görüntülenir. Örneğin, kan akımı, oksijen kullanımı, glikoz metabolizması, protein metabolizması, nükleik asit metabolizması ve östrojen reseptör dağılımı PET'in en yaygın kullanıldığı parametrelerdir. Glukoz metabolizması rutin klinik uygulamalarda en çok kullanılan parametredir. C11, N13 ve O15 çok kısa yarı ömürleri (2-20dakika) nedeniyle merkezler arasında taşınamazlar. İdeal olarak bu radyonüklidlerin üretildildiği siklotron ünitesinin PET kamerasının yakınında olması gerekmektedir. Ancak 110 dakika yarı ömrü nedeniyle F18 ve bununla işaretlenmiş radyofarmasötikler, belirli mesafelere dağıtılabilir.
Rutin klinik uygulamalarda en çok kabul gören ve kullanılan PET parametresi glikoz metabolizmasının izlenmesidir. Bu amaçla F18 ile işaretli FDG bileşiği kullanılmaktadır. Bütün PET çalışmalarının %80'ini FDG PET çalışmaları oluşturmaktadır. FDG hücre içine glikozun izlediği yollardan girer, heksokinaz enzimi yardımı ile fosforilize edilir, ancak daha öteye metabolize olmaz ve hücre içinde kalır. Böylece belirli bir dokuda FDG'nin birikme hızı
o dokunun glikozu metabolizma etme hızını yansıtır. Glikoz kullanımı ve metabolizması artmış dokular, daha çok FDG tutmaları nedeniyle, elde edilen PET görüntülerinde normal dokulara göre daha yüksek sayım yoğunluğu gösteren (hipermetabolik) odaklar olarak karşımıza çıkarlar. Bunun tersi glikoz kullanımı azalmış dokular, örneğin epileptojenik bölgeler veya skar alanları PET görüntülerinde normal dokulara göre düşük sayım gösteren (hipometabolik) odaklar şeklinde görünürler.
FDG-PET çalışması için glikoz seviyesinin 60-150mg/dl olması gerekir. Glikoz seviyesi daha düşük veya yüksek ise çalışma ertelenir. Hastanın asgari 4 saat aç olması, insülin ve oral antidiabetik ilaçların kesilmesi gerekir. Glukoz seviyesi uygun ise damar yolu açılarak 10 mCi FDG enjekte edilir ve hasta 1 saat sonra çekime alınarak tüm vücut görüntülenir.
Görüntülerin yorumlanmasında fizyolojik olmayan ve vücut background aktivitesine oranla artmış FDG tutulumu gösteren odaklar araştırılır. FDG tutulum yoğunluğu “Standart Uptake Değeri” (SUV) adı verilen semikantitatif bir parametre ile ifade edilir. SUV değerinin 2,5 üzerinde olması lezyonun hipermetabolik (malignite şüphesi) olduğunu gösterir.
Beyinde PET Kullanımı:
Epilepside, serebrovasküler hastalıklarda, nöropsikiyatrik ve psikiyatrik hastalıklarda PET kullanılır. PET epilepsiye neden olan mikroskobik nöronal organizasyon düzensizlikleri ile ilişkili fonksiyonel bozuklukların erken saptanmasında çok duyarlıdır. İnteriktal fazda, FDG ile yapılan PET görüntülemede, MRI görüntüleri normal olan hastaların %60 -%70’inde, epileptik odakta serebral kan akımında ve glukoz kullanımında azalma gösteril ir (51).
Normalde gri kortekste yüksek miktarda glikoz kullanımından dolayı beyin yüksek miktarda FDG tutar. FDG beyinde metabolik hızın ve kan akımının yüksek olduğu yerlerde daha fazla tutulur.
Bölgesel serebral kan akımı ölçümü içi en çok kullanılan PET radyofarmasötiği 015 ile işaretli su (H2O)’dur. Bölgesel kan akımı değerleri, bölgesel glikoz kullanımına paralellik
gösterir ve kortikal nöronların uyarılması ile hızla değişir. Gri cevher için ölçülen normal bölgesel kan akımı 70 ml/100gr/dakika ve beyaz cevher için ise 20 ml/100gr/dakika olarak bildirilmiştir (52).
PET yaygın olarak; Alzheimer hastalığının erken tanısı ve diğer demans tiplerinin ayırıcı tanısında, ayrıca cerrahi tedavi düşünülen medikal tedaviye dirençli epileptik olguların değerlendirilmesinde kullanılır. İktal dönemde yapılan PET çalışmasında epileptik odak hipermetabolik olarak izlenir. Alzheimer hastalığında ise bilateral simetrik olarak pariyeto -oksipital kortekste glukoz metabolizması azalır. PET nörolojik ve psikiyatrik bozuklukları olduğu kadar normal beyin gelişimi ve işlevlerini çalışmak için de kullanılmıştır. Resept örlere özgüllük gösteren radyoaktif madde ile işaretlenmiş bileşiklerle, psikoterapötik ilaçların bu reseptörlere bağlanma özellikleri araştırılmıştır.
Akut İskemik Strokta SPECT’in Önemi:
Strokta SPECT’in en önemli avantajı, strokun erken döneminde BT normal iken henüz anatomik bir bozukluk oluşmadan (ilk 24 saat) perfüzyon defektini gösterebilmesidir (43,53,54). Akut strokta SPECT ile yapılan çalışmalarda izlenen perfüzyon defekti BT ve MRI ile izlenen defektten daha büyüktür (43,55,56). BT’ de izlenen bölge infarktlı doku ve ödemi kapsamaktadır.
- infarktlı doku,
- canlı ama iskemiye bağlı olarak normal fonksiyonlarını kaybeden doku, - deafferansiyon (duyarsız alan)(57).
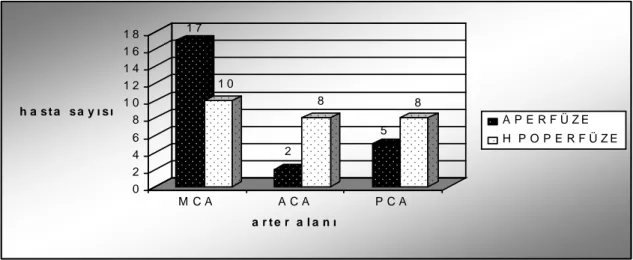
Perfüzyon defektinin büyüklüğü nörolojik bozukluğun belirlenmesinde önemli yere sahiptir. BT’de izlenen anatomik defekt ve SPECT’te izlenen fonksiyonel defektin büyüklükleri arasındaki ilişki hastanın prognozunun tahmininde önem kazanmaktadır. SPECT’te lezyonun büyük izlenmesi, canlı ama non fonksiyone dokunun varlığına bağlı olduğundan ve bu dokunun perfüzyonu normale döndüğünde fonksiyon kazanabileceğinden erken tedavide yol göstericidir (43,55,57,58). SPECT ve BT bilgileri birbirini tamamlayıcıdır. SPECT’in laküner ve beyaz cevher infarktlarında sensitivitesi düşükken, doku hasarı olmadığı halde azalmış perfüzyonun gösterilmesinde beyin SPECT görüntülemede sensitivite daha yüksektir (43,55,59).
Diaşizis iskemik bölgeden uzakta kalan bölgelerde izlenen perfüzyon a zlığıdır. Bu bölgelerde konvansiyonel görüntüleme yöntemleri ile lezyon saptanmaz. Diaşizis, serebral korteks ya da serebellumda izlenebilir. Büyük serebral arter infarktüslerinde(özellikle orta serebral arter) ve subkortikal infarktüslerde karşı taraf serebellumda perfüzyon d efekti izlenebilmektedir. Buna çapraz serebellar diaşizis denir (43,54,60). Kortiko-ponto-serebellar liflerdeki bağlantının kesilmesine bağlı olabileceği düşünülmektedir.
Serebral infarktüsü takiben kan akımı metabolik ihtiyacın üzerindeyse lüks perfüzyon olarak adlandırılır. Akut ve geç fazda oluşur. Erken fazda serebral vasküler yapılarda otoregülasyon kaybına bağlı iken, geç dönemde kapiller hiperplaziye bağlıdır. Lüks perfüzyon PET, Xe-133 eliminasyon ölçümleri ve Tc99m-HMPAO SPECT ile gösterilirken IMP-SPECT ileyapılan çalışmalarda nadiren gözlenmiştir (43,59,60).
2.12. İSKEMİK STROKTA AYIRICI TANI VE KOMPLİKASYONLAR
İskemik strokta ayırıcı tanıda düşünülmesi gereken durumlar ve sonrasında gelişebilecek komplikasyonlar tablo 4 ve tablo 5’te gösterilmiştir.
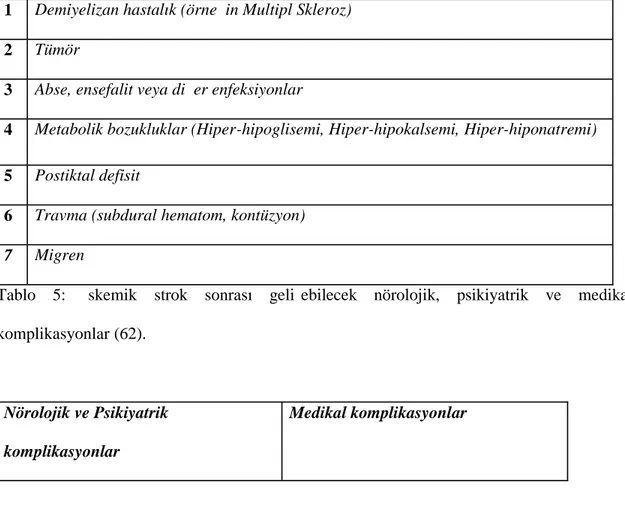
Tablo 4: İskemik strok benzeri bulgu veren nonvasküler sebeplerin ayrıcı tanısı (61)
1 Demiyelizan hastalık (örneğin Multipl Skleroz)
2 Tümör
3 Abse, ensefalit veya diğer enfeksiyonlar
4 Metabolik bozukluklar (Hiper-hipoglisemi, Hiper-hipokalsemi, Hiper-hiponatremi)
5 Postiktal defisit
6 Travma (subdural hematom, kontüzyon)
7 Migren
Tablo 5: İskemik strok sonrası gelişebilecek nörolojik, psikiyatrik ve medikal komplikasyonlar (62).
Nörolojik ve Psikiyatrik komplikasyonlar
* Beyin ödemi ve transtentoriyal herniasyon
* Tekrarlayan strok * Epileptik nöbet * Hidrosefali
* Uygunsuz ADH salınımı * Konfüzyon * Depresyon * Anksiyete bozukluğu * Baş ağrısı *Kardiyo-vasküler komplikasyonlar * Pulmoner komplikasyonlar * Metabolik komplikayonlar * yüksek ateş * Enfeksiyonlar * Gastro-intestinal kanama * Vennöz tromboembolizm * Bası yaraları * Düşmeler * Malnütrisyon * Ağrı * İdrar inkontinansı
*Fekal inkontinans ve konstipasyon * Bulantı-kusma
* Spastisite ve kontraktürler
2.13. TEDAVİ:
İskemik strokun tedavisinde amaç, hasarlı beyin dokusunu en alt düzeye indirmek, oluşabilecek ikincil hasarları engellemektir. Ayrıca akut dönemde oluşabilecek komplikasyonların önüne geçmekte tedavinin diğer amacıdır. Antiagregan, antikoagülan, trombolitik, antiödem ve nöroprotektif tedaviler bu yaklaşımların ana başlıklarını oluşturmaktadır(63).
İskemik strok geçiren hastayı ikinci bir stroktan korumada aterotrombotik strok için antiplatelet tedavi, kardiyoembolik strokta antikoagülan tedavi, ekstrakranyal karotis hastalığında ise cerrahi tedavi, yararı kanıtlanmış tedavi yöntemleridir. Akut serebral iskemisi olan hastada, laküner sendrom varsa ve incelemeler sonucunda sadece küçük damar hastalığı saptanmış ise yapılacak en iyi yaklaşım antiagregan (aspirin, klopidogrel, dipiridamol veya aspirin-dipiridamol) ile tedaviye başlamaktır. Herhangi bir kontrendikasyon yoksa ilk 48 saat içinde aspirin 160-300mg dozunda uygulandığında küçük de olsa anlamlı bir yarar sağlar.
Erken dönemde antikoagülan başlanması tartışmalıdır. İskemik strokta uzun süreli oral antikoagülan kullanımı hastayı yeni bir stroktan koruduğu sadece non-valvüler atriyal fibrilasyona bağlı kardiyoembolik strok geçiren hastalarda gösterilmiştir. Antikoagülanlar fibrin formasyonunu inhibe eder, hipokoagülabilite sağlayarak tromboz eğilimini azaltır.
Antikoagülasyonda kanama riski olacağından dikkatli kullanılması ve endikasyonun yerinde olması gereklidir. Antikoagülasyona ilk günlerde intravenöz heparin ile başlanır, sonra warfarin sodyum ile oral olarak devam edilir. INR (International Normalized Ratio) değeri tedavi süresince 2.0-3.0 arasında tutulması gerekir. Kalbinde yüksek riskli emboli kaynağı (protez kapak, romatizmal mitral stenoz, yeni geçirilmiş myokard infarktüsü, akinetik segment, dilate kardiyomyopati) olan ve kardiyoembolik strok geçiren hastalarda da koruyucu olarak antikoagülan tedavi uygulanır (64).
Son yıllarda beyni besleyen büyük arterlerin (arteria karotis interna, baziler arter, orta serebral arterin dalları) tromboembolik tıkanmalarında, hızla rekanalizasyon sağlanması ve yeniden kan akımının düzenlenmesi için trombolitik ilaçlar gündeme girmiştir. Bu ilaçların temel mekanizması plazminojeni plazmine çevirerek, fibrini parçalamaya yöneliktir. Trombolitik ajanlar arasında, rekombinant doku plazminojen aktivatörü (rt-PA) streptokinaz, ürokinaz, proürokinaz sayılabilir. İskemik strokun ilk 3 saatinde uygulanırsa prognozda