Dr.Seyfullah HALİLOĞ A e
TC.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
BİYOKİMYA (VETERİNER) ANA BİLİM DALI
TEMEL ASKERLİK EĞİTİMİNİN ERBAŞ VE ERLERDE BÜYÜME
HORMONU,TESTOSTERON,KORTİZOL,AÇLIK KAN ŞEKERİ , KOLESTEROL , TRİGLİSERİT VE TOTAL LİPİD DEĞERLERİNE ETKİLERİ
YÜKSEK LİSANS TEZİ
Dr.Şerafettin KILINÇEL
Danışman
Prof.Dr.Behiç SERPEK
KONYA -2006
İÇİNDEKİLER
1.GIRIŞ 6
2.LITERATÜR BILGI 7
2.1.BÜYÜME HORMONU 7
2.1.1. Büyüme hormonunun yapısı 7
2.1.2. Büyüme hormonunun biyosentezi 7
2.1.3. Büyüme hormonunun salınımı 8
Tablo I. Büyüme Hormonu Salınımını Etkileyen faktörle 11
2.1.4. Büyüme hormonunun kanda taşınması 11
2.1.5. Büyüme hormonunun etki mekanizması 12
2.1.6 Büyüme hormonunun metabolik etkileri 13
2.1.7.Büyüme hormonunun biyolojik etkileri 13
2.1.8. Büyüme hormonu yetersizliği 14
2.1.9. Büyüme hormonu fazlalığı 15
2.1.10.Büyüme Hormonu ve stres 15
2.2. TESTOSTERON 15
2.2.2. Testosteronun biyosentezi 18
Şekil 1. Testosteron biyosentezi 19
2.2.3. Testosteronun salınımı 20
2.2.4. Testosteronun kanda taşınması 20
2.2.5. Testosteronun etki mekanizması 21
2.2.6. Testosteronun biyolojik etkileri 21
2.2.7. Testosteron ve stres: 23
2.3.KORTİZOL 24
2.3.1 Kortizolun yapısı 24
2.3.2.Kortizolun biyosentezi 24
2.3.3.Kortizolun salınımı 24
2.3.4.Kortizolun kanda taşınması ve etki mekanizması 24
Şekil 2. Kortizol biyosentezi 25
2.3.6.Kortizolun biyolojik etkileri 26
2.3.7.Kortizol ve stres 26
Şekil 3. Kortizolün biyolojik etkileri 27
2.4. KOLESTEROL –TRİGLİSERİT – TOTAL LİPİD 28
2.5. AÇLIK KAN ŞEKERİ 30
3.1 Plazma Glikoz, kolesterol, total lipid ve trigliserit analizleri 32
3.2 İnsan Plazma testosteron analizi 32
3.2.1 Metodun Prensibi 32
3.2.2 Testosteron-3-CMO-HRP- tracer’ının ve tavşan anti testosteron IgG’si 32
3.2.3 Keçi IgG-anti tavşan IgG 32
3.2.4 Enzimimmunoassay Prosedürü 32
3.2.5 EIA Plaklarının İlk Kaplaması 32
3.2.6 EIA Plaklarının İkinci Kaplaması 32
3.2.7 Plazmadan Testosteron’un Ekstraksiyonu 32
3.2.8 EIA Plaklarının Assay Öncesi Yıkanması 32
3.2.9 Assay Protokolü 33
3.2.10 Substrat Reaksiyonu 33
3.3 İnsan plazma büyüme hormonu analizleri 33
3.3.1Metodun prensibi 33
3.3.2Biotinil hGH tracer’ının hazırlanması 33
3.3.2.1 A çözeltisi 33
3.3.2.2 B Çözeltisi 33
3.3.3. hGH anti serumu 34
3.3.4 Standartların hazırlanması 34
3.3.5 Enzimimmunoassay prosedürü 34
3.3.5.2 Enzimimmunoassay plaklarının ikinci kaplaması 35
3.3.5.3 Enzimimmunoassay plaklarının assay öncesi yıkanması 35
3.3.6 Assay protokolü 35 3.3.7 Substrat reaksiyonu 35 3.4. Kortizol analizleri 35 3.4.1 Metodun Prensibi 36 3.4.2 Assay Protokolü 36 4. BULGULAR 37
Tablo II. Er ve Erbaşlarda Plazma büyüme Hormonu ve Testosteron Düzeyleri 37
Şekil. 4.Er ve erbaşlarda büyüme hormonu ve testosteron düzeyleri 38
Tablo III. Er ve Erbaşlarda Plazma Total Lipid , Kolesterol , Trigliserit , Açlık Kan Şekeri ve Kortizol
Düzeyleri 38
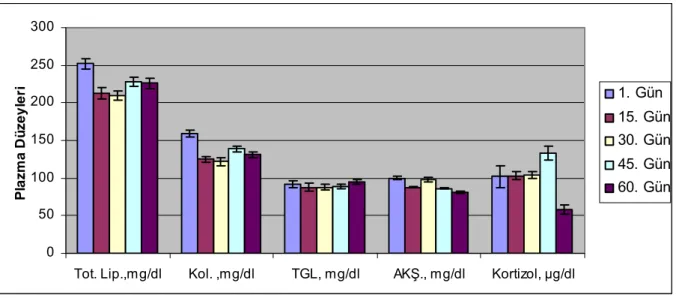
Şekil 5. Er ve erbaşlarda total lipid (Tot. Lip), kolesterol (Kol), trigliserit (TGL), açlık kan şekeri (
AKŞ) ve kortizol düzeyleri 39
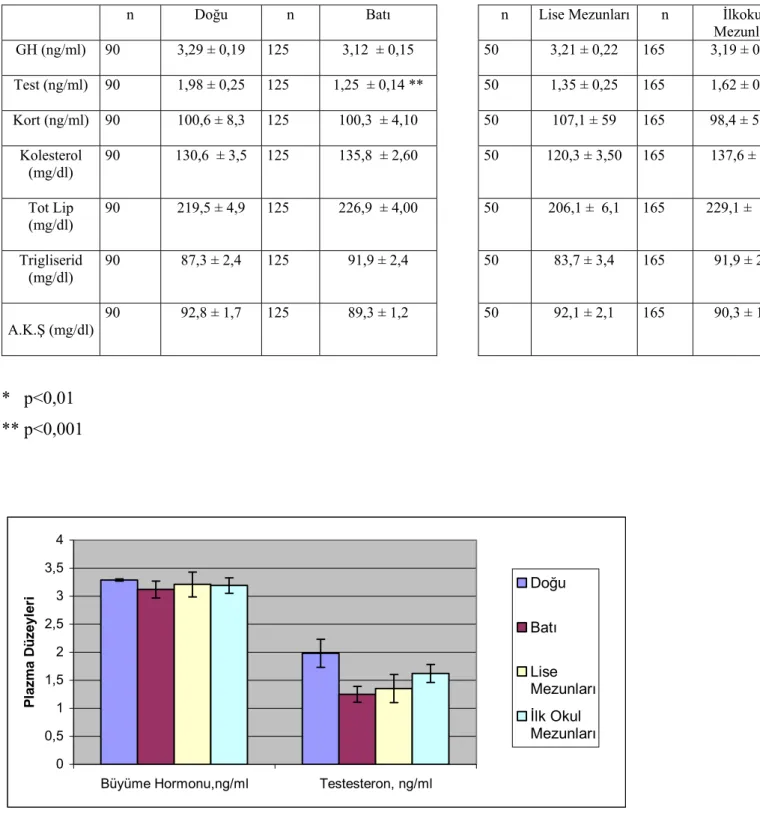
Şekil 6. Er ve erbaşlarda plazma büyüme hormonu ve testosteron düzeylerinin eğitim durumları ve
coğrafi bölgelere göre değişimleri 40
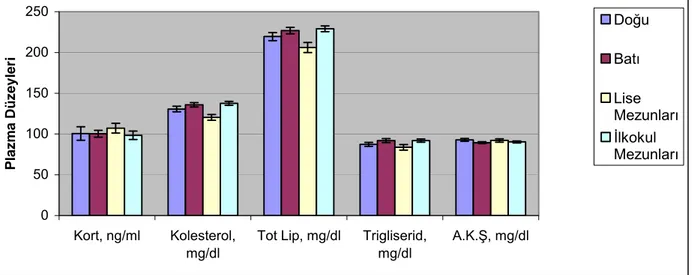
Şekil 7. Er ve erbaşlarda plazma kortizol , kolesterol (Kol), total Lipid (Tot. Lip), trigliserit (TGL)
ve açlık kan şekeri (AKŞ) düzeylerinin eğitim durumları ve coğrafi bölgelere göre değişimler 41
5. TARTIŞMA VE SONUÇ 42 6. ÖZET 46 7.SUMMARY 47 8 .KAYNAKLAR 48 9.ÖZGEÇMİŞ 60 10. TEŞEKKÜR 61
1. GİRİŞ
Egzersiz, stres uyum sorunu gibi metabolizmayı etkileyen faktörlerin hormonlarla etkileşimleri üzerinde çalışmalar bulunmaktadır. Fakat bu çalışmaların bazı spor dalları ve hastalıklar ile sınırlı kaldığıda gözlenmektedir. Özellikle gençlerde değişik nedenlerle gelişen streslerde bir yandan metabolizma etkilenirken, bir yandanda glikokortikoidlerden kortizol başta olmak üzere büyüme hormonu ( Growth Hormon , GH) , kateşolaminler, troid bezi hormonları, seksüel steroidler gibi hormonlar ya da hormonal sistemlerin uyarılmasıyla vucudun dengesi bozulmakta ve çok önemli bozukluklar şekillenebilmeketedir.
Askerlik temel eğitimine başlayan gençlerin karşılaştıkları birliğe uyum sorunu, görevi başaramama kuşkusu, performans kaygısı, toplu bir yerde yaşamanın getirdiği sıkıntı,aileden ayrı kalma , memleket özlemi, gıda değişiklikleri ve alışılmamış düzenli yapılan egzersizlerinde oldukça önemli boyutlarda stres oluşturduğu bilinmektedir. Oluşan bu stresin boyutlarının belirlenmesi, hormonal sistem veya metabolizma üzerindeki etkilerinin tam olarak ortaya konulması, stresin olumsuz etkilerinin giderilebilmesi için alınabilecek önlemlerin şekillendirilmesinde büyük yararlar sağlayacaktır.
Ülkemizin değişik yörelerinden temel askerlik eğitimi almak üzere askeri birliklerde toplanan er ve erbaşlarda aynı ortamı paylaşma, aynı gıdalarla beslenme, aynı egzersizlerin yapılması, katı disiplin kurallarının uygulanması gibi homojen bir yapıda oluşabilecek streslerin kortizol, büyüme hormonu ve testosteron gibi hormonlar ve kan glikozu, total lipid,trigliserit ve kolesterol düzeyleri üzerindeki etkilerinin belirlenmesiyle stresin boyutları hakkında önemli ipucları elde edilebileceği , fiziksel performans, ruh sağlığı , cinsel performans üzerindeki olumsuz etkilerinin engellenebileceği ve morallerinin düzeltilerek askerlik hizmetine daha iyi adaptasyonlarının sağlanabileceği düşünülmüş ve Personel Okulu ve Eğitim Merkezi Komutanlığına (Konya) gelen erbaş ve erlerde teslim olmalarında başlayarak eğitimlerini tamamladıkları zamana kadar belirli aralıklarla alınan kan örneklerinde bazı hormonların ve metabolik parametrelerin incelenmesi amaçlanmıştır.
2. LİTERATÜR BİLGİ
2.1.Büyüme Hormonu
2.1.1. Büyüme hormonunun yapısı
Büyüme hormonu polipeptid yapısında, hipofiz ön lobundan köken alan, ve genelde etkile- rinin büyüme üzeride olduğu gözlenen bir hormondur ve İnsan hipofiz ön lobundaki hücrelerin hemen hemen % 50’sinin büyüme hormonu (GH) sentezleyen somatotrop hücrelerden oluştuğu saptanmıştır (Kreutz ve ark 1972).
Büyüme hormonu (GH), basit bir protein yapısında, protein zinciri içinde yer alan sistein amino asitleri arasıda kurulan iki disülfit köprüsüyle belirli bir üçüncül yapıya kavuşan ve hemen tüm canlı türleri için önemli olan türe spesifik bir hormondur (Serpek ve ark 1995, Kopchick ve ark 2002, Bhogavan 2002).
Somatotropin adıyla da tanımlanan hormonun tüm vucut hücreleri üzerinde etkili olabildiği kabul edilmekle birlikte, bu etki büyümesini tamamlamamış dokularda daha belirgin olarak görülmektedir. Bir başka deyişle büyüme çağındaki bir organizmada tüm vücutta, erginliğe ulaşmış bir canlıdaysa sadece bazı doku ve organlarda etki gösterebilmektedir (Bilge 1975).
GH’un kanda iki ayrı formda bulunduğu saptanmıştır. Bu formlardan birisi hipofizer GH iken, diğeri sadece gebe kadınlarda varlığı saptanan plasental GH’ dır (De Palo ve ark 2001). Büyüme hormonu hipofizer kökenli somatotrop hücrelerden salgılanan, % 75'ini 191 amino asit içeren 22 kDa molekül ağırlığında; % 15’ini ise 176 amino asit içeren 20 kDa molekül ağırlığındaki formu oluştururken, kalan % 10’luk kısmının ise büyüme hormonu dimerleri gibi diğer büyüme hormonu formlarından meydana geldiği, büyüme hormonunun kolaylıkla dimerleştiği ve dimerlerinin yarılanma ömürlerinin daha uzun olduğu bildirilmiştir (Darcan ve Mir 1998, De Palo ve ark 2001).
2.1.2. Büyüme hormonunun biyosentezi
Salgıladığı peptit yapısındaki büyüme hormonu salgılatıcı hormon (growth hormon releasing hormon, GHRH, GRF) etkisiyle büyüme hormonunun biyosentezi ve salınımı hipotalamusun kontrolu altındadır. GHRH’un sinir damar ağı aracılığıyla hipofize ulaşmasıyla adenil siklaz sistemi üzerinden hipofizin somatotrop hücrelerinden büyüme hormonu biyosentezi uyarılırken, GHRH fazını izleyen hipotalamus kökenli somatostatinin (Büyüme hormonu releasing-inhibiting hormon, SRIF) salınımıyla da GH biyosentezi durdurulur (De Palo ve ark 2001, Kopchick ve ark 2002). Büyüme hormonunun biyosentez ve salınımını uyaran GHRH ile durduran SRIF arasında da bir denge bulunur (Bhogavan 2002).
Kadınlarda büyüme hormonu konsantrasyonun erkeklere göre üç kat fazla olduğu (Müller ve ark 1999), erkeklerde günlük büyüme hormonu üretiminin 0,4-1 mg kadarken, kadınlarda üretilen ve depolanan toplam
hormon miktarının 5-10 mg dolayında olduğu bildirilmiştir (Kurdak 1996). İnsanlarda GH’un yarılanma ömrü 20-25 dakikadır (Baumann ve ark 1987). Yaşın ilerlemesiyle azalmaya başlayan büyüme hormonu sentezindeki gerileme (Corpas ve ark 1993) 30’lu yaşlarda % 15 kadarken, 60’lı yaşlarda % 75 düzeylerine ulaşabilmektedir (Janssen ve ark 1998).
Yaşın ilerlemesiyle GH’nun yanı sıra lütenize edici hormon (LH), folükül stimüle edici hormon (FSH), tiroid stimüle edici hormon (TSH) (Perry 1999) ve gonadal steroidlerin (Huang ve ark 2005) serum konsantrasyonları da gerilemektedir. Büyüme hormonunun azalmasına bağlı olarak vücut yağında artma, kas ve kemik kitlesinde azalma meydana gelmektedir. Yaşlılarda büyüme hormonu tedavisi görenlerde kas kitlesinde ve yağsız vücut kitlesinde artış, vücut yağında azalmalar meydana gelmiş ancak büyüme hormonunun tedavi edici özelliği yanı sıra zararlı yan etkilerinin de olabileceği bildirilmiştir (Huang ve ark 2005).
2.1.3. Büyüme hormonunun salınımı
GH ‘ın salınım ve sekresyonu büyüme hormonu salgılatan hormon ( Growth Releasing Factor, GHRH, GRF) ve büyüme hormonu salınımını inhibe edici hormon olmak üzere iki ayrı faktör tarafından kontrol edilmektedir (somatostatin, GIH, SRIF) ( Guyton M.D, Arthur C. F, 1978,Therner ve ark 1992,Görpe 1987). Hipotalamusta üretilen ve depolanan peptit yasındaki GRF merkezi sinir sisteminden ya da doğrudan hipotalamusu uyaran heyecan, stres, travma gibi sinyaller (Bingöl 1983) aracılığıyla hipotamustan uzanan sinir iplikcikleriyle portal dolaşıma ulaşır ve buradan kan yoluyla hipofize gelerek kendisine özgü reseptörlerine bağlanarak adenilsiklaz sistemi üzerinden GH’nın üretimi salınımı uyarılır (Therner ve ark 1992). GH’nın salınımı ise , hipotalamus haricinde pankreasın langerhans adacıklarının D-hücrelerinde ve gastrointestinal mukozada da üretildiği saptanan , peptid yapısındaki somatostatin tarafından engellenir ve somatostatin ile growth releasing factor arasında bir balansın varlığı söz konusudur. Sağlıklı bir büyüme hormonu salınımı için bu iki faktörün hipofizi dönüşümlü olarak etkilemeleri zorunludur (Finding ve ark 1991). Sürekli GHRH etkisinde kalan hipofizden GH salınımı zayıf iken, SRIF etkisinden sonra gelen GHRH uyarımları sonrasında çok daha güçlü bir GH salınımı gözlenmektedir (Müller ve ark 1999).
Hipofiz ön lobunun somatotrop hücrelerinde üretilen büyüme hormonu hücrelerdeki sekret granülalarında depolanır ve salınım için uyarılar hipofiz ön lobuna ulaştığında kan dolaşımına verilir (Le Roith 1997, Kalaycıoğlu ve ark 2000, Bhogavan 2002).
İnsanlarda büyüme hormonu salınımı pulsatildir ve en düşük plazma konsantrasyonu sabahın erken saatlerinde görülmektedir. Yemeklerden 2-4 saat sonra plazma düzeylerinde biraz artışlar meydana gelebilir, ancak salınımın en güçlü olduğu zaman diliminin erken dönem gece uykusunda olduğu bildirilmektedir (Baumann ve ark 1987). İnsanlarda bazal büyüme hormonu düzeyleri 0.5-3 ng/ml kadardır. Hipotalamustan salınan GHRH’un hipofize ulaşması ile gerçekleşen salınım sırasında yükselen kan düzeyleri 3-5 saatlik bir periyot içerisinde tekrar bazal düzeylere geriler (Janssen ve ark 1998).
Karbonhidrat, protein ve yağ gibi besinlerle beslenme GH salınımını etkiler (Farrel ve Barboriak 1981). Yağlı besin tüketilmesi sağlıklı bireylerde GH salınımını düşürür (Farrel ve Barboriak 1981, Alp ve Molvalılar 1987). Büyüme hormonu yağ dokusu hücrelerinde trigliseritlerin yıkılımını artırarak, yağların serbest yağ asitleri halinde kana geçmelerine ve enerji kaynağı olarak kullanılmalarını sağlar. Böylece deri altı yağ dokusu azalırken, kan serbest yağ asiti düzeyleri artar (Samra ve ark 1999, Yılmaz 1999). Fizyolojik GH yükselmeleri yüksek yağ asidi seviyeleri ile baskılanır (Alp ve Molvalılar 1987). Proteinli beslenme veya intravenöz amino asit (örneğin, arginin) infüzyonunun GH salınımında artışa neden olduğu bildirilmektedir (Farrel ve Barboriak 1981). Diğer yandan Gökdemir ve Palaoğlu (2002) proteince zengin besinlerin tüketiminin büyüme hormonu salınımını azaltabileceğini vurgulamışlardır.
GH sekresyonunun önemli bir modülatörlerini oluşturan seksüel steroidlerin günlük GH sekresyonu etkiledikleri ve GH sekresyonu ile testosteron sekresyonu arasında pozitif bir korelasyon bulunurken , GH piklerinin güçlendiği ancak GH frekans sıklığının etkilenmediği saptanmıştır (Müller ve ark 1999). Benzer bir ilişkinin östrojen ile GH arasında da bulunduğu öne sürülmüş (Li ve Zeng 1990) ve östrojen verilmesinin GH düzeyini artırdığı bildirilmiştir (Friend ve ark 1996).
Ayrıca büyüme hormonu salınımı başta stres olmak üzere beslenme şekli, kan büyüme hormonu düzeyleri, kan insülin benzeri büyüme faktörü-1 (IGF-1) düzeyleri gibi bir çok faktör tarafından stimüle ya da inhibe edilebilmektedir (Müller ve ark 1999). Açlık ve strese bağlı olarak büyüme hormonu salınımının artabileceği de öne sürülmüş ve gençlerde iki günlük tam açlık sonrasında büyüme hormonu salınımının 5 kat kadar artabildiği gözlenmiştir (Norrelund 2005).
İlk kez 1999 da Kojima ve arkadaşları tarafından farelerin midesinden izole edilen ghrelin hormonu ile büyüme hormonu arasında yakın bir ilişki varlığı bildirilmektedir. Yiş ve ark. (2005) ‘na göre, 28 amino asit içeren ghrelin büyük ölçüde midenin oksintik mukozasında yer alan endokrin fonksiyonlara sahip X/A hücreleri , daha az ölçülerde de bağırsak, böbrek, hipofiz bezi, plasenta ve hipotalamusta üretilerek kan yoluna verilmektedir. Enerji homeostazisi üzerine etkileri, üretim yerine bağlı olmayan ghrelin etkilerini merkezi sinir sisteminde hipotalamus düzeyinde hipofiz ön lobunu etkileyerek doğrudan ya da GHRH salınımını artırarak dolaylı yoldan GH salınımını uyarmaktadır (Anderson ve ark 2004). Ghrelinin büyüme hormonu salgılatıcı etkileri hem in vitro olarak hem de gönüllüler üzerinde yapılan çalışmalarla gösterilmiş (Wren ve ark 2000, Tolle ve ark 2001) ve sentetik ghrelin verilmesinden 30. dakikada sonra tepe noktasına ulaşan büyüme hormonu düzeylerinin, 180. dakikada da tekrar normal düzeylerine gerilediği bildirilmiştir (Takaya ve ark 2000). Beyinde hipotalamik nukleusta, hipokampusta, substansia nigrada, ventral segmental bölgede, dorsal ve median rafe çekirdeğinde ghrelin reseptörlerinin varlığı gösterilmiş (De Ambrogi 2003, Anderson ve ark 2004, Yiş ve ark 2005) ve ghrelinin büyüme hormunu salınımını uyarabilmesi için GHRH varlığının gerekli olduğu GHRH ve ghrelinin birlikte verilmesininde büyüme hormonunun salınımının uyarırılması, ghrelin yanı sıra GHRH anti serumunun verilmesinde GH düzeylerinin etkilenmemesiyle kanıtlanmıştır (Yiş ve ark 2005). Wren ve ark (2001)’ da yaşları 21-32 arasında değişen dokuz sağlıklı
denekte ghrelin dozuna bağımlı olarak büyüme hormonu salınımının ve enerji alınımının yükseldiği gözlemişler, ancak alınan enerjinin kaynaklarınının dağılımında bir farklılık belirleyememişlerdir.
Ghrelinin, büyüme hormonu ve insülin hattındaki rolü değerlendirildiğinde sadece insülin benzeri büyüme faktörü-1 (IGF-1) ile ghrelin arasında pozitif bir ilişki bulunmuştur (Soriano-Guillen ve ark 2004). Ayrıca ghrelin düzeyleri gibi IGF-1 düzeylerinin de erişkin döneme yaklaştıkça azaldığı, büyüme hormonundan bağımsız olarak beslenme durumdan etkilenebildiği bildirilirken (Baker ve ark 1993, LeRoith 1997 ), yaşın ilerlemesiyle birlikte azalan ghrelin düzeyleriyle vücut kitle indeksi arasında negatif ilişki bulunmuş, ancak ghrelin ile boy uzaması arasında ilişki saptanamamış ve Ghrelin düzeylerinin artışı için en önemli faktörün IGF-1 ve insülin benzeri büyüme faktörü bağlayıcı protein-1 (IGFBP-1) düzeyleri olduğu öne sürülmüştür ( Whatmore ve ark 2003).
Büyüme hormonunun kontrolünü sağlayan bu faktörler merkezi sinir sistemi üzerinden ya da doğrudan hipotalamus üzerinden değişik faktörler tarafından etkilenebilir ve bu etkilerde doğrudan büyüme hormonu biosentezi ve salınımına yansır. Bu etkilerden ilkini yaş ve uyku ile ilişkili olan nöral kontrolün oluşturduğu, en derin uykuya dalışın gerçekleştiği uyuduktan 1 saat sonrasında büyüme hormonu salınımının başladığı ve 1-4 saatleri arasında en yüksek düzeye ulaştığı, gece uykusunda salınan büyüme hormonu miktarının gündüz salınan düzeylerden % 70 daha yüksek olduğu , yaşın ilerlemesiyle. birlikte gerilemeğe başlayan salınım kapasitesinin 30’lu yaşlarda % 25 , 60 yaşlarda % 75.lere varan oranda gerilediği yazılmaktadır ( Finding ve ark 1991).
Büyüme hormonu salınımını etkileyen önemli faktörlerden birisini de alınan gıdaların içeriği nin oluşturduğu bildirilmiş (Finding ve ark 1991), yağdan zengin gıdaların alınmasında görülen büyüme hormonu salınımındaki gerilemenin (Alp ve ark 1977 ,Finding ve ark 1991, Hatemi ve ark 1982), bu gerilemenin kan serbest yağ asitleri düzeylerinin yükselmesinden kaynaklandığı, keza enerjiden zengin karbonhidratların ve lipidlerin özellikle akşam yemeğinde ya da uyku öncesi alınması büyüme hormonu salınımını inhibe ederken, fazla yemek yemeden uykuya yatmanın büyüme hormonu salınımını uyardığı bildirilmektedir (Alp ve ark 1977, Hatemi ve ark 1982). Proteinlerin GH’nın salınımı üzerindeki etkileri konusu tartışmalıdır. Bazı kaynaklara göre büyüme hormonu salınımı uyarırken (Finding ve ark 1991, Hatemi ve ark 1982), bazı kaynaklara göre engelleyebilmektedir (Alp ve ark 1977,Görpe 1987 ) . Ancak kan amino asit düzeylerinin, özellikle kan arjinin düzeylerinin yükselmesinin büyüme hormonu salınımını uyardığı saptanmıştır (Finding ve ark 1991, Hatemi ve ark 1982 ).
Kan GH düzeyleriyle diğer hormonlar arasında da ileri düzeyde ilişkiler vardır. Glikokortikoidlerin büyüme hormonu salınımını engellediği (Finding ve ark 1991), buna karşın östrojen ve glukagon’un GH sekresyonunu artırdığı saptanmıştır (Hatemi ve ark 1982). Büyüme hormonu salınımını az yada çok etkileyen faktörler de Tablo I’de gösterilmiştir .
Tablo I. Büyüme Hormonu Salınımını Etkileyen faktörler (Görpe 1987, Ganong1995). Sekresyonu artıran uyaranlar
Enerji yetmezliği Egzersizler
Açlık Hipoglisemi
Kan serbest yağ asitler düzeyinin artışı Bazı amino asitlerin kan düzeylerinin- artması
Proteinden zengin gıda alımı Glukagon
Arginin ya da bazı diğer amino asitlerin infüzyonu Stres faktörleri Pirojenler Lizin,vazopressin Derinuykuyageçiş L-Dopa Apomorfin Östrojenler Androjenler GHRH
Sekresyonu azaltan uyaranlar
Glukokortikoidler (Kortizol) Somatostatin Hiperglisemi Hiperlipidemi Medroksiprogesteron Rem uyku Büyüme hormonu
2.1.4. Büyüme hormonunun kanda taşınması
Büyüme hormonu kan yoluna verildikten sonra büyüme hormonu bağlayıcı proteine (GHBP) bağlanarak, daha büyük bir moleküler yapıya kavuşur ve bu formda kanda taşınır. Büyüme hormonunun molekül ağırlığı 22.000 dolayında olduğundan kanda serbest halde bulunan GH süratle böbrekler üzerinden kaybedilebilir (De Palo ve ark 1996). Büyüme hormonu bağlayıcı proteinin iki önemli fonksiyonu bulunduğu ve bu fonksiyonlardan ilkini büyüme hormonunun kanda taşınması sırasında aktivite kaybının önlenmesi, ikinci ve daha önemli fonksiyonun ise oluşan büyük moleküler yapı sayesinde böbreklerden büyüme hormonu kaybının önüne geçilmesinin oluşturduğu sanılmaktadır ve GH’ nın insanlardaki bazal plazma düzeylerinin
0,5-3 ng/ ml düzeylerinde olduğu, pulsalit bir nitelik gösteren salınımlar sırasında yükselen kan değerlerinin 3-5 saatlik bir periyot içinde tekrar bazal düzeylere gerilediği, bu nedenle tek bir kez kan örneği alınıp, büyüme hormonu analizlerinin yapılması ve büyüme hormonu düzeyleri hakkında karar verilmesinin hatalı olacağı ileri sürülmektedir (Leung ve ark 1987, De Palo ve ark 1996, Mullis ve ark 1997, Turyn ve ark 1997).
Büyüme hormonu bağlayıcı proteine bağlı iken, inaktif formda bulunan GH, hedef organ ve dokuların hücrelerine ulaştığında GHBP’den ayrılarak aktif formuna kavuşur, kendine özgü reseptörlerine bağlanarak aktivitesini gösterir (Leung ve ark 1987, Mullis ve ark 1997, Turyn ve ark 1997).
2.1.5. Büyüme hormonunun etki mekanizması
Büyüme hormonu reseptörleri, prolaktin reseptörleri, bazı sitokin reseptörleri, GHBP’in çözünür reseptörleri gibi bir süper reseptör familyasının bir üyesidir (De Palo ve ark 2001, Bhogavan 2002)
Büyüme hormonu, 250 amino asitten oluşan ekstrasellüler ve 350 amino asitten oluşan intrasellüler bölgeye sahip olan 638 amino asitten oluşan reseptörüne bağlanıp reseptörün dimerleşmesine yol açarak bilginin hücre içine iletilmesini sağlar (Berg ve ark 2002).
Peptit hormonlarda hormon-reseptör kompleksinin oluşumu, bir seri reaksiyon zincirinin başlamasına yol açar. Hormon-Reseptör kompleksinin şekillenmesini izleyerek intrasellüler haberciler üzerinden birkaç farklı yoldan hormonal etki ortaya çıkar. Bunlardan biri adenil siklazın aktive edilmesi ile gelişen yoldur. Hormon-reseptör kompleksi şekillenmesi üzerinden aktifleştirilen GTP bağlayıcı protein tarafından harekete geçirilen adenilat siklaz ATP'den cAMP oluşumu uyarır. Oluşan cAMP ikisi regülatör ve ikisi de katalitik olmak üzere 4 alt üniteden meydana gelen inaktif protein kinazın aktif protein kinaza dönüşümünü sağlar. Enzimin inaktif formunda katalitik ve regülatör üniteler bir arada bulunurken, cAMP'nin regülatör ünitelere bağlanmasıyla serbest kalan iki katalitik alt üniteye aktif protein kinaz adı verilir. Bir sonraki aşamayı protein kinaz inaktif formdaki fosforilaz kinaz'ı aktif fosforilaz kinaza dönüştürmesidir ve bu aktivasyon defosforile durumdaki inaktif fosforilaz kinazın fosforilasyonu ile gerçekleştirilir. Reaksiyonlar bu aşamada kalmaz ve hormonal etkinin gözleneceği son aşamaya kadar devam eder (Kalaycıoğlu ve ark 2000, Bhogavan 2002).
Normal büyüme koşullarında büyüme hormonu reseptör (GHR) sayıları dolaşım kanındaki GH ya da GHBP düzeyleriyle doğrudan bağlantılıdır ve reseptör düzeyinde ortaya çıkan ani artışlarda reseptörüne bağlanan GH ya da GHBP düzeyleriyle doğrudan ilişkilidir. Ancak normal hormon etkisinin hücre içine iletilmesi için gereken bu yapısal farklılaşmalar bazı patolojik olgularda da gelişebilir (Eliakim ve ark 1996, Mullis ve ark 1997)
2.1.6 Büyüme hormonunun metabolik etkileri
GH hücrenin büyümesi ve çoğalabilmesi için gerekli olan protein biosentezi arttırır ve protein depolarının doldurulması yönünde bir metabolik etki gösterdiğinden protein anabolik bir hormon olarakta tanımlanır (Bilge 1975). Canlı vucudunda bir yandan karbonhidrat kullanımını azaltırken, diğer yandan glikoneojenezin uyarılması üzerinden kan şeker düzeyini artırıcı bir etki gösterdiği (Bingöl 1983), insülinle sinerjik bir etkiye sahip olduğu ve anabolik etkilerinin insülin varlığında gerçekleştiği bildirilmektedir ( Guyton M.D, Arthur C. F, 1978). GH etkisiyle pankreasın langerhans adacıklarının β- hücrelerinden insülin sekresyonu yanı sıra α-hücrelerinden glukagon salınımınında uyarıldığı, stress hallerinde salınan hormonlardan biri olan GH’nın kaslarda glikoz tüketimini azaltırken, karaciğerde de glikoz biosentezini uyardığı saptanmıştır (Unger ve ARK 1992). GH ve adrenal steroidlerin desteğiyle insülin etkisi kuvvetlendirilmekte ve glikozun kas ve yağ hücrelerine girişi hızlanmaktadır (Daughaday 1974). GH arttırdığı gibi kasda anti-insülin etki göstermektedir (Ganong 1995). GH’nın hipoglisemi, açlık, stres sırasında karaciğerden glikoz mobilizasyonunu sağlayarak gerekli enerjiyi sağlayacak maddelerin kan düzeylerini artırdığı (Ganong 1995), yağ dokularından yağların mobilize edilip kana verilmesini (Nelson D.H, Thora ,G1981) ve enerji üretiminde öncelikli olarak kullanılmasını gerçekleştirdiği bildirilmektedir. (Guyton M.D, Arthur C. F, 1978).
2.1.7.Büyüme hormonunun biyolojik etkileri
Büyüme hormonunun etkileri belirli hedef organlar üzerindeki hızlı gelişen ancak kısa süreli direkt etkileri ve karaciğerdeki hedef hücrelerinde IGF-1 salınımının uyarılması üzerinden gerekleştirilen, geç gelişen ancak uzun süren endirekt etkileri olmak üzere ikiye ayrılarak incelenebilir (De Palo ve ark 2001, Bhogavan 2002).
Büyüme hormonunun akut metabolik etkileri insülin etkisine benzerlik gösterir. Bu akut etkiler arasında; öncelikle barsaklardan amino asitlerin emilimi ile karaciğer ve kaslarda protein sentezinde kullanılması, yağ ve kas dokusuna glikoz alımının uyarılması, adipoz doku hücreleri olan adipositlerdeki beta-adrenerjik reseptörlerin uyarılması üzerinden lipolizin stimüle edilmesi, immun fonksiyonların uyarılması, kanda amino asit taşınması, preadipositlerin adipositlere dönüşümü ve yağ depolarının parçalanması sonucu açığa çıkan yağ asitlerinin kaslardaki protein biyosentezinde kullanılması, abdominal bölgede toplanan yağların perifere taşınması, hepatik düşük dansiteli lipoprotein (LDL) reseptörlerinin regülasyonu üzerinden kan kolesterol düzeylerinin düşürülmesi, glikoz atılımı ve metabolizmasının stimülasyonu, gonadal IGF-1 üretiminin uyarılması, gonadotropinler üzerinden lüteal progesteron sentezinin uyarılması ve parathormonla birlikte gerçekleştirdiği kemikler üzerindeki etkileri sayılabilir (Samra ve ark 1999, Norrelund ve ark 2002, Moller ve ark 2003).
İnsanlarda, açlık sonucu hormonal ve metabolik süreçlerde önemli değişiklikler meydana gelir. İki-üç haftalık açlıktan sonra vücut proteinlerinin yıkılımının azalmasını izleyerek idrarla azot atılımı da azalır, alanin düzeyleri düşerken, dallanmış karbon zincirine sahip amino asitlerin düzeyleri yükselir. Açlığın ilk gününde
idrar azot atılımında ya hiç değişiklik görülmez ya da hafif bir artış görülürken, üç günlük açlıktan sonra vücut proteinlerinin yıkılımı hızlanırken, büyüme hormonunun serum konsantrasyonlarının da artışlar görülmektedir (Norrelund ve ark 2001, Norrelund 2005) .
Büyüme hormonunun geç dönemde gelişen etkileri arasında, karaciğerde ve diğer dokulardaki reseptörlerine bağlandıktan sonra hücre içinde IGF-1 ve IGF-1’in kanda taşınmasına hizmet eden IGFBP'lerin biyosentezinin stimülasyonu yer alır. Üretilen ve kan yoluna verilen IGF-1 kan yolunda serbest olarak bulunmaz, bilakis taşıyıcı proteinlerine bağlanarak daha büyük bir moleküler ağırlığa sahip inaktif bir kompleks halinde ve böbreklerden kaybı da önlenerek taşınır. Büyüme hormonunun endirekt etkileriyle karaciğerde uyarılan IGF I’in biosentezi pulsatil değildir ve tüm gün boyunca dengeli bir şekilde sürdürülür. IGF-1 aracılığı ile ortaya çıkan endirekt etkileri arasında da kondrojenez, iskeletin büyümesi, hücreye amino asit alınımı ve hücreye alınan amino asitlerin protein sentezinde kullanılmasının stimülasyonu üzerinden protein kitlesinin artışı, ovaryumlarda androjen üretimi gibi etkiler sayılabilir (Rodrigez-Arnao ve ark 1999 , Ottoson ve ark 2000 , De Palo ve ark 2001, Öğe 2004, Woodhouse ve ark 2006).
2.1.8. Büyüme hormonu yetersizliği
Çocukluk çağlarındaki büyüme hormonu yetersizliğinde organlarının boyları birbirlerine karşı oranları değişmeksizin küçüldüğü ve boyutları ancak 8-10 yaşlarındaki bir çocuğun organlarının boyutlarında kaldığı, genelde diğer vücut fonksiyonları normal , mental ya da seksüel aktivitede bir yetersizliğin görülmediği dwarfizm adı verilen cücelik hali ortaya çıkar (Bingöl 1983, Johnston ve ark 1996, Suman ve ark 2003).
Gençlerde oluşan GH yetersizliklerinde kas kitlesinin azalması, kasların zayıflaması, vücut yağlarının artması (adipozitoz), hiperlipidemi, hiperkolesterinemi, hipertrigliseritemi, insülin tarafından indüklenen hipoglisemi, hipertoni (kan basıncının yükselmesi), vücut veriminin düşmesi, mineral içeriğinin azalmasına bağlı olarak kemiklerin yoğunluğunda azalma (omurgalarda ve radius’ta), osteokalsinin serum düzeylerinin düşmesi, omurga kırıkları, sindirim organlarının küçülmesi, albümin sekresyonunun ve protein sentezinin azalması, sellüler immünitenin düşmesi, renal plazma akımının ve glomerular filtrasyon oranının gerilemesi, sperm kalitesinin düşmesi, uykunun bozulması, uyku derinliği ve sürekliliğinin bozulması, yorgunluk-bitkinlik, yaşam kalitesinde düşme ve kardiovasküler bozukluklara bağlı olarak yaşam süresinin azaldığı görülür, ancak tümör oluşumu sıklığı da azalmaktadır. Ergenlik çağındaki gençlerde görülen tüm bu bulgular GH tedavisi ile geriletilebilir ya da tamamen iyileştirilebilir (Kurdak 1996, De Palo ve ark 2001). Son yıllarda rekombinant teknolojisi ile yeterli miktarda ve ucuz bir şekilde üretilebilen rekombinant insan büyüme hormonunun (rhGH) , insanlarda dwarfizm, kistik fibrozis, lösemi, büyümenin gecikmesi, kronik kalp hastalıkları gibi patalojik ve yaşlılık gibi fiziksel olgularda kullanılmaktadır (Suman ve ark 2003),
2.1.9. Büyüme hormonu fazlalığı
Bir çok organ ve sistemi etkileyen GH karbonhidrat, protein ve lipid metabolizmaları üzerinden büyümeyi etkileyen en önemli hormondur. Genellikle hipofiz tümörlerine bağlı olarak büyüme hormonunun aşırı salınımı sonucu gigantizim veya akromegali meydana gelir (Ayuk ve Sheppard 2006). Tümörler genç yaşlarda gelişirse, sağlıklı bireylere oranla büyüme çok hızlıdır ve tüm vücut organlarındaki büyümeler birbirleriyle uyumludur Boyları 2-2.5 metreye kadar ulaşabilen gençlerin vücutlarında herhangi bir anatomik bozukluk görülmez (Yılmaz 1999, Kalaycıoğlu ve ark 2000).
Hipofiz tümörleri gençlerin aksine, erginlerde ortaya çıkarsa daha çok alın, burun, elmacık kemikleri, eller ve ayaklar gibi organlarda ileri derecede genişleme ve büyümelerle karakterize akromegali ortaya çıkar (Kalaycıoğlu ve ark 2000, Kopchick ve ark 2002, Ayuk ve Sheppard 2006).
2.1.10.Büyüme Hormonu ve stres
Fiziki ya da ruhsal nedenlere bağlı olarak gelişen akut streslerde, stres hormonları arasında sayılan büyüme hormonu düzeylerinin insanlarda (Davis ve ark 1972, Güner 1992, Friesen ve ark 1972, Frantz ve ark 1970, Savers ve ark 1977, Myabo 1977, Görpe 1987, Therner ve ark 1992) ve hayvanlarda yükseldiği bildirilmektedir ( Davis ve ark 1972). şiddetli travmalarda ve cerrahi operasyonlarda veya diğer birçok stres faktörleri karşısında büyüme hormonu düzeylerinin yükselmesi, streslerdeki büyüme hormonunun önemini gösterirken, büyüme hormonunun kan şeker düzeylerinin regülasyonuna da katıldığı bildirilmektedir (Johnston ve ark 1996).
Ancak stres hallerinde GH düzeylerinin değişimi konusundaki çalışmaların sonuçlarında da bir uyum söz konusu değildir. Bazı çalışmaların sonuçlarına göre kan GH düzeylerinin anlamlı bir şekilde yükseldiği bildirilirken, bazı çalışmalarda da anlamlı bir değişimin gözlenmediği söylenmektedir.
Örneğin Karp ve ark(1989) plazma stres hormonlarının (Kortizol- GH – PRL) düzeylerinin gerek sınav stresini izleyen 3. saatte anlamlı bir değişim göstermemesinin stresin belirlenmesinde geç kalınmasından ya da uzun süreli streslerin hipotalamus-hipofiz hattında bir adaptasyona yol açmasından kaynaklanabileceğini öne sürerlerken, Krulich ve arkadaşları (1974) normal erkek sıçanlarda akut stresten en çok etkilenen hormonların prolaktin ve GH olduğunu, akut stres hallerinde prolaktin sekresyonunun artarken GH sekresyonunun engelendiğini, LH ve FSH sekresyonlarınınsa çok az etkilendiğini göstermişlerdir (Kurlich ve ark 1974) . Buna karşın nörotik bireylerde psikolojik kökenli streslerden sonra stresin nöroendokrin sistemi uyarmasına bağlı olarak GH yükseldiğide bildirilmektedir (Miyabo 1977).
2.2. TESTOSTERON
Erkeklerin yapı ve davranışları üzerine etkiyen androjenler isminden erkeklik oluşumunda görev alan tüm hormonlar anlaşılır. Steroid yapıdaki androjenlerden testislerin leydighücrelerinde üretilen testosteronun
yanı sıra androsteron ve dehidroizoandrosteron önemlidir. Testislerin sertoli hücrelerinde üretilen protein yapısındaki inhibin ise steroid yapıda olmayan bir başka androjendir (Litwork ve Schmit 2002, Bagatell ve Bremner 2003). Başlıca üretim yerlerini testislerin oluşturduğu steroid yapıdaki androjenler böbrek üstü bezi kabuğu, ovaryumlar ve plasentada da az miktarda da üretilmektedir Testosteron’un % 95’i testisin leydig (intertisyel) hücrelerinde, % 5’i ise adrenal kortekste sentezlenir. Kadınlarda ise testosteron büyük oranda adrenal kortekste, daha az olmak üzere overlerde ve plasentada sentezlenir. Vücutta testosteron ana kaynağını dolaşımdaki plazma lipoproteinlerinin oluşturduğu (LDL), ancak tüm vücut hücrelerinde de sentezlenebilen kolesterolden sentezlenir (Kraemer ve ark 2001, Zitzmann ve Nieschlag 2001, Sevin ve ark 2005, Gümüşel ve Kandilci 2005).
Testosteronun metabolik etkilerine bakıldığında en önemlisi bireyin sekonder eşey karakterinin gelişmesidir. Ayrıca testosteron vücutta büyüme hormonu ile birlikte protein yapımı ve protein depolarını doldurma yönünde metabolik etki gösterir. Bu metabolik etkideki fonksiyonu vücuttan atılan toplam azotu azaltmasıdır. Azot ise protein yapıtaşı olan amino asitlerin amin grubunda bulunur. Azotun artması protein artışının bir belirtisini teşkil eder. İşte bu nedenle de testosteron “ anabolik steroid hormonlar” arasında yer almaktadır. Testosteronun anabolik etkisinin ikinci ve en önemli sonucu kas gelişimidir. Kasların büyümesi ve vücudun atletik görünümü alması kadınlardan ziyade erkeklerde belirginleşmektedir. (Bilge 1975,Pastoris ve ark 1983)
2.2.1.Testosteronun yapısı
Steroid hormonlar içerisinde yer alan androjenlerden (testosteron ve 5α-dihidrotestosteron) testosteron sistematik ismi 17,β-hidroksi-4-androsten-3-on olarak verilir. Dolaşım kanındaki temel androjen olan testosteron gelişimini tamamlamış testis hacminin yaklaşık % 5’ini oluşturan intertisyel kompartman içinde yerleşik sayıları 500 milyona kadar ulaşan leydig hücrelerinde bir dizi enzimatik reaksiyonla kolesterolden sentezlenir (Sevin ve ark 2005).
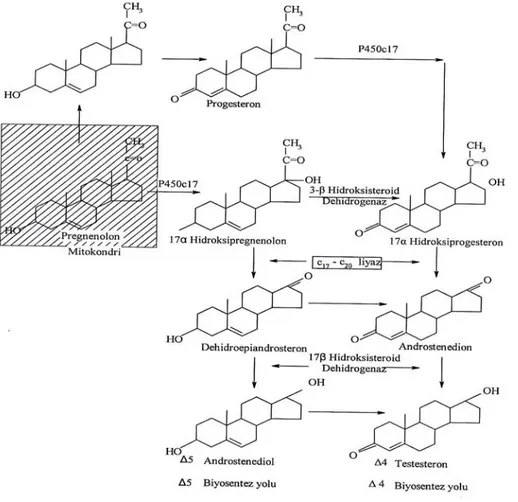
İnsan fetal testisinde gebeliğin altıncı haftasında başlayan erken dönem testosteron biyosentezi ve testosteron biyosentezi için leydig hücrelerinin farklılaşması LH’den bağımsızdır (El-Gehani ve ark 1998, O’Shaughnessy ve ark 1998). Testis gelişimi sırasındaki testosteron üretimi hipofiz tarafından üretilen Luteinize edici hormon (LH)’nin etkisi altına girer. Luteinize edici hormonun sentez ve salınımı gonadotropin salgılatıcı hormon (GnRH) aracılığı ile hipotalamusun kontrolü altındadır ve testosteron tarafından bir negatif geri besleme (feedback) mekanizması ile inhibe edilir. Kolesterolden testosteron biyosentezi, birbirini izleyen birkaç aşamada gerçekleştirilir. Bu aşamaların ilkini kolesterolün steroidojenik akut regülatör protein tarafından dış mitokondrium membranından iç mitokondrium membranına transferi ve P450scc enzimi tarafından gerçekleştirilen kolesteroldeki yan zincirin koparılarak pregnenolon’un sentezlenmesidir. Pregnenolon sentezi ile sonuçlanan bu dönüşüm testosteron biyosentezinde hız belirleyici aşamayı oluşturur.
İzleyen aşamalarda 3 β-hidroksi steroid dehidrogenaz, 17 α-hidroksilaz, C 17,20-liyaz ve 17 β-hidroksi steroid dehidrogenaz gibi bazı enzimler görev yapar. Kadında da esas androjen testosteron olup adrenal korteks ve korpus luteumda benzer yolla sentezlenir. Testosteron’un öncül maddeleri olan androstenedion ve dehidroepiandrosteron zayıf androjenlerdir. Tüm yaşam boyunca erkekte salıverilen testosteron miktarı kadındakinden daha fazladır (Bagatell ve Bremner 2003, Sevin ve ark 2005).
Uterusta gelişmekte olan fetusun testisleri ilk trimesterde (gebeliğin altıncı haftasında) erkeğin cinsel farklılaşmasında esas faktör olan testosteron salınımına başlar. Puberte sırasında, 12-17 yaşları arasında erkekte serum testosteron konsantrasyonları kadına göre çok daha fazla artar. Ergenliğin başlarında erkeklerde 5-7 ng/ml düzeyinde bulunan serum testosteron konsantrasyonları, kadınlarda sadece 0.3-0.5 ng/ml kadardır. Erkekte testosteron konsantrasyonunun yüksek olması pubertede erkeği kadından ayıran bilinen bazı özelliklerin gelişmesini sağlar. Yaş ilerledikçe erkekte serum testosteron konsantrasyonu kademeli olarak azalır. Bu azalma erkekte yaşlanma ile ilgili diğer etkilere katkıda bulunur. Erkekte günde yaklaşık 8 mg testosteron üretilir. Testislerde androjenik etkinliği zayıf androstenedion ve dehidroepiandrosteron’un yanı sıra, güçlü bir androjen olan dihidrotestosteronu da düşük miktarlarda sentezlenirken, biyosentez ara ürünlerinden pregnenolon, progesteron ve bunların hidroksillenmiş türevlerinin küçük miktarları kana ulaşabilir. Testosteron plazma proteinlerine bağlanarak taşındığından, kan konsantrasyonları sudaki çözünürlüğünden daha fazladır. Kana verilen testosteron büyük oranda seks hormonu bağlayıcı globüline (SHBG), diğer adıyla testosteron bağlayıcı globüline (TeBG) bağlanarak taşınır. SHBG bir tek androjen bağlanma yeri olan 95 kD’luk dimerik bir glikoproteindir ve testisteki androjen bağlayıcı proteine özdeştir. Seks hormonu bağlayıcı globülin karaciğer tarafından salgılandığından dolaşımdaki düzeyleri seks steroidleri dahil oral yolla alınan ilaçların karaciğerdeki ilk geçişlerinden etkilenir (Bagatell ve Bremner 1996, Griffin ve Wilson 1998).
Dolaşımdaki TeBG konsantrasyonları ve buna bağlı olarak testosteron konsantrasyonları, oral yolla verilen ve yüksek dozda parenteral uygulanan hormonların yaptığı gibi, karaciğerdeki suprafizyolojik hormon konsantrasyonları tarafından karakteristik olarak azaltılır (androjenler, glukokortikoidler) veya artırılır (estrojenler, tiroksin). Aksine, endojen seks steroidleri veya fizyolojik hormon konsantrasyonunu sürdürmek üzere yapılan parenteral ve diğer uygulamalar (transdermal, depo implantlar) TeBG düzeylerini çok az etkilerler. Dolaşımdaki SHBG düzeylerini etkileyen diğer faktörler arasında TeBG düzeylerini yükselten akut veya kronik karaciğer hastalığı ve androjen eksikliği, düşürücü yönde etki eden obezite, protein kaybı ve genetik TeBG eksikliği sayılabilir. Fizyolojik koşullarda dolaşımdaki testosteron’un % 60-70’i SHBG’ye, kalan büyük bölümü ise düşük afinite ile albümin, α-1-asit glikoprotein ve transkortin taşıyıcı proteinlere bağlanır, Sadece % 1-2’lik bir bölümü serbest halde bulunur. Serbest hormon hipotezi uyarınca, proteine bağlı olmayan serbest testosteron fraksiyonu, biyolojik yararlanımı daha fazla olan gevşek bağlı fraksiyon ile birlikte en yüksek biyolojik aktiviteyi gösterir. Ancak, serbest ve/veya biyolojik yararlanımı yüksek
fraksiyonlar sadece biyoaktiviteyi gösterecekleri yerlere değil, yıkılıma uğrayacakları yerlere daha fazla girerler (Sevin ve ark 2005).
Dolaşımdaki testosteron düzeyleri saatlik veya diurnal (gün içi) değişimler gösterir. Genç erkeklerde gün içi testosteron düzeyi sabahları maksimal düzeye çıkarken, öğleden sonra en düşük düzeye iner. Bu gün içi salgılanma düzeni bazı yaşlı erkeklerde dolaşımdaki TeBG düzeylerinin artması, testosteron salgısının azalması ve/veya nöroendokrin bozukluklar nedeniyle değişikliğe uğrar (Veldhuis 2000).
2.2.2. Testosteronun biyosentezi
Erkeklerin anatomik yapıları ve davranışları üzerinde etkili olan ve androjenler olarak tanımlanan hormonları, testislerin leyding hücrelerinde sentezlenen testosteron, andresteron ve dehidroizoandresteron oluşturur. Ancak içlerinden en önemlisi testosterondur (Vermeulen ve ark 1971, Yılmaz 1999, Yealis 1993 ) . Testosteronun temel karbon iskeletini oluşturan siklopentano perhidro fenantren (steran) halkası A, B, C, ile gösterilen üç benzol halkası ile D ile gösterilen siklopentan halkasına sahiptir. Steran halkalarına keto ve alkil grupları ile H atomu eklenerek ya da çift bağların oluşturulmasıyla çeşitli steroid hormonlar sentezlenebilmektedir (Yılmaz 1999, Yesalis ve ark 2000). Testisin leydig hücrelerindeki testosteron ve diğer androjenlerin biyosentezleri ve salınımları hipotalamustan salınan GnRH’nın kontrolünde adenohipofizde üretilen ve kan yoluna verilen glikoprotein yapısında, iki alt üniteden oluşan , folikül stimüle edici hormon (FSH) ve luteinize edici hormon (LH) tarafından düzenlenir. Hipofizier hormonlardan LH testisini yeldig hücrelerindeki kendilerine özgü rezeptörlere bağlandıktan sonra testosteron biyosentezini sitimüle ederken, FSH testisİn sertoli hücrelerini etkir. Spermatojenez için sadece FSH etkisi yeterli değildir, bilakis LH etkisiyle leydig hücrelerinde sentezlenen testosteronla birlikte tubulus epitellerini etkilerler. FSH spermiojenezi başlatırken, testosteron bir yandan spermiojenezin sürekliliğini sağlarken bir yandan damitotik bölünmenin mayotik bölünmeye geçirilmesiyle spermagonilerin ve spermatositlerin 1. formlarına kavuşmalarını sağlar. FSH ise spermatidlerin spermatozonlara dönüşümlerin gerçekleştirir ( Löffler and Petrides 1988, Yealis ve ark 1993) .
Hipofiz’den salgılanan Luteinize edici hormon (LH) ya da insan koryonik gonadotropini (hCG) leydig hücrelerinin proliferasyonunu, farklılaşmasını ve testosteron üretimini düzenler. Plazma LH düzeyleri de pulsatil bir şekilde gün içi ritim gösterir. Leydig hücrelerinde sentezlenen testosteron, seminifer tubüllerin içine ve dolaşıma salgılanır. Dolaşımdaki testosteron feed-back mekanizması üzerinden hipotalamus’dan gonadotropin salgılatıcı hormon’un (GnRH) salgılanma sıklığını azaltır; bir başka deyişle gonadotropinlerin salınımı engellenir (Litwork ve Schmit 2002, Gümüşel ve Kandilci 2005).
Testisteki leydig hücrelerinin özel zar reseptörlerine LH’nun bağlanması testosteron biyosentezinin stimülasyonuna yol açar. Diğer steroid hormon üreten hücrelerde olduğu gibi, leydig hücreleri de çok büyük miktarda endoplazmik retikulum, sayısız yağ damlacığı ve çok sayıda mitokondrium içerirler. Bir protein
kinaz üzerinden aktarılan bir etki ile kolesterolün pregnenolona dönüşümü ve bunu izleyerek iki yol üzerinden oluşan androjen sentezi stimüle edilir. Pregnolondan androjenlerin üretimi amacıyla bir C17, 20 lize sayesinde yan zincir koparılır. Enzim 17-α-hidroksi pregnenolon üzerinden dehidroepiandrosteron (DHA) ya da 17-α-hidroksi progesteron üzerinden androstendion oluşturur. Androstendionun 17 keto grubunun redüksiyonu ile de testosteron sentezlenir. Dehidroepiandrosteron (DHA) 5 androstendiole dehidre edilir ve bunu izleyen dehidrogenaz-izomeraz kompleksinin etkisiyle testosterona dönüştürülür. Böbrek üstü bezinde de hemen hemen benzer bir enzim donanımı bulunduğundan böbrek üstü bezinde de androjenler sentezlenebilir. Böbrek üstü bezi kabuğunda sentezlenen dehidroepiandrosteron sülfatize edilir, plazmaya verilir ve testislere ulaştıktan sonra burada testosteron ön maddesi olarak kullanılır (Löffler ve Petrides 1988, Serpek 2002, Bhogavan 2002) (Şekil 2.1).
Şekil 1. Testosteron biyosentezi (Löffler ve Petrides 1988).
Aromataz içeren dokularda testosteron östradiole dönüştürülerek doku içinde etkisini gösterir ya da kan yoluyla hedef organ ve hücrelerine ulaşır. Androjenik steroidlerin aksine östrojenin inaktivasyon yeri karaciğer olduğundan karaciğere transfer olana kadar sirkülasyonda dolaşır. Testosteron karaciğer ve böbrekte inaktive olur. Sirkülasyondaki testosteronun yaklaşık % 50’si karaciğere alınarak 17 keto steroidlere (etiocholone, androsteron ve epiandrosteron) dönüştürüldükten sonra glukouronitler şeklinde atılır (Kiersczenbaum 1994).
Testosteronun bir epimeri epitestosteron (17α-hidroksi testosteron) testislerde üretilir, üretilen epitestosteron miktarı idrarla atılan testosteron miktarına eşittir (testosteron: epitestosteron ~ 1:1) dir. Epitestosteron biyolojik olarak inaktiftir. Fakat bir metabolit değildir. Sadece gonadlar tarafından üretildiğine inanılır. Bu yüzden gonadal steroid markeri olarak kullanılır ve bayanlarda testosteron:epitestosteron oranı ile idrar testosteron:epitestosteron birbirine eşit olduğundan sporcularda doping amacıyla testosteron alımlarının saptanmasında kullanılabilir (Wilson 1988, Bagatell ve Bremner 1996)
2.2.3. Testosteronun salınımı
Yetişkin bir erkekte 4-12 mg (ortalama 7 mg) günlük testosteron üretilirken, böbrek üstü bezindeki oluşumu 0.2 mg/gün kadardır. Testosteron salınımı ritmik değil, bilakis düzensiz aralıklarla gerçekleştirilir (Löffler ve Petrides 1988, Serpek 2002).
Erkeklerde puberta ani ve uzun süreli testosteron üretimi ile başlar. Bu olay, henüz tam olarak anlaşılmamış bir dizi hormonal değişikliği başlatırken, hipotalamus ile hipofiz bezinin bu aşamalarda önemli bir rol oynadığı düşünülmektedir. Hipotalamustan salınan GnRH, hipofizer gonadotropinlerden olan FSH ve LH üretimini ve salınımını artırır. Hipofizden kana verilen FSH ve LH testis ve seminifer tüpler üzerine etki ederek, spermatogenez ile testosteron yapımı ve salınımını uyarırlar. Puberta öncesinde günlük 0.25 mg/gün düzeyindeki testosteron üretimi pubertada 11 mg/gün’e kadar yükselir. Belirli bir plazma konsantrasyonuna ulaşıldığında da testosteronun feedback etkisiyle gonadotropinlerin salınımı baskılanır (Yesalis 1993, Griffin ve Wilson 1998).
Serum testosteronun sirkadiyanem ritminin belirlenmesi amacıyla tükürükte yürütülen çalışmalarda testosteronun konsantrasyonun en yüksek sabah, en düşük akşam olduğu gözlenirken (Kraemer ve ark 2001), alınan gıdalarında plazma konsantrasyonlarını etkilediği, fazla yağlı yiyeceklerden sonra total testosteron ve serbest testosteron seviyelerinde önemli düşüşler meydana gelirken (Volek ve ark 2001), bir haftalık bir periyotta yetersiz karbonhidratla beslenmenin düzeyler üzerinde etkili olmadığı saptanmıştır (Volek ve ark 2002).
2.2.4. Testosteronun kanda taşınması
Testosteron plazmada TeBG’e bağlı (% 44), serbest testosteron (% 2) ya da başta albümin olmak üzere plazma proteinlerine bağlı (% 54) olarak bulunur. Yetişkin bir erkekteki testosteron bağlı globülinin düzeyi ~ 25 nM, normal testosteron seviyesi ~22 nM kadardır ve testosteron bağlayıcı globülin düzeylerindeki azalış dokuların kullanabileceği testosteron düzeylerini artırırken, globülin artış dokuların kullanımına sunulan testosteron düzeylerini azaltmaktadır (Griffin ve Wilson 1998, Bagatell ve Bremner 1996).
2.2.5. Testosteronun etki mekanizması
Androjenlerin etkisinin temel mekanizması transkripsiyon üzerindendir ve kan yoluyla hedef hücreye ulaşan androjenler apolar yapılarıyla hücre zarını doğrudan geçerek hedef hücrelerin (testis, iskelet kası, karaciğer gibi) sitoplazmalarındaki steroid reseptörleri süper familyasından, suda çözünen androjen reseptörüne bağlanır ve reseptör-hormon kompleksinde oluşan bir yapısal değişimle bir transkripsiyon faktörü olarak fonksiyon yapması sağlanır. Hormon-reseptör kompleksinin şekillenmesini izleyerek aktive olan reseptör-hormon kopleksi çekirdeğe taşınıp, kromatin üzerindeki belirli bir bölgeye bağlanır. Bağlandığı bölgenin seçimi ve etkinin gösterilmesi, spesifik reseptörü ile ilişkilidir. Hayatın değişik safhalarında bir hormonun farklı etkiler ortaya çıkartabilmesi veya farklı hücrelerde farklı etkilere sahip olabilmesinin, hormon-reseptör kompleksinin farklı programlanabilmesinden kaynaklandığı sanılmaktadır (Kalaycıoğlu ve ark 2000, Bhogavan 2002, Gümüşel ve Kandilci 2005).
2.2.6. Testosteronun biyolojik etkileri
Androjenlerin biyolojik etkileri reprodüktif ve reprodüktif olmayan anabolik etkiler olmak üzere ikiye ayrılabilir (Potteiger ve Stilger 1994). Androjenler plazma TeBG sentezini inhibe ederek testosteronun bağlanmasını önlerler ve serbest formdaki testosteronun dokulara geçişini hızlandırırlar. Ayrıca androjenler, hepatik proteinlerden fibrinojen ve transferin sentezini baskılarken, haptoglobin, α-1 antitripsinin ve hepatik trigliserit lipaz sentezini uyarırlar. Anabolik steroidler etkilerini sitozolik androjen reseptörlerine bağlanarak gösterirler. Anabolik steroidlere yanıt olarak nöro endokrin sistemin LH ve FSH salınımını azaltması sonucu leydig ve sertoli hücrelerinin fonksiyonlarının gerilemesini izleyerek gerileyen endojen testosteron sentezindeki düşme spermatogenezisi de yavaşlatır. Aşırı anabolik steroid uygulamaları, testislerde artrofi ve sperm sayısında azalma ile sonuçlanmaktadır. Oral yolla alınan androjenik steroidlerin çoğu, steroidlerin karaciğerde inaktivasyonunu engelleyen bir 17 α-akil grubu içerirler. Bu tip steroidlerin uzun süreli kullanımı, karaciğer fonksiyon testlerinde bozukluklardan hepatik karsinoma kadar ilerleyebilen bozukluklara yol açar (Muscatelli ve ark 1994, Bagatell ve Bremner 2003).
Hedef dokular 5-α-redüktaz içermiyorsa testosteron doğrudan androjen reseptörlerine bağlanarak testosteron reseptör kompleksini oluşur ve oluşan kompleksin belirli DNA bölgelerine yerleşerek androjene bağımlı genlerin transkripsiyonunu uyarmasıyla androjen yanıtı gelişir. Testosteron karaciğerde modifiye olarak hormonal aktivitede önemli olan 17 β hidroksil grubunun oksidasyonu ile 17 keto türevine, A halkasındaki ∆4 ün doyurulması ile androsteron türevi ve 3 keto grubu indirgenerek 3 α-hidroksilat türevine dönüştürülür. Beş α-redüktaz enzimi içeren hedef dokularda testosteron etkisi testosterondan daha güçlü dihidrotestosterona (DHT) dönüştürülür. DHT’de androjenik bir yanıtı gerçekleştiren androjen reseptörü-androjen yanıt etmeni mekanizması sistemini aktive eder. Androjen görevini tamamladıktan sonra reseptöründen ayrılır, hidroksilat metabolitleri olan 3 α-andrositendiol ya da 3 β androstendiole indirgendikten sonra glukuronik asitle konjuge edilerek renal yoldan atılır (Griffin ve Wilson 1998, Bhogavan 2002).
Testosteronun ve dihidrotestosteronun 17α-hidroksil grubu androjenik aktivite için gereklidir. Testosteron enanthate ve fluoxymsteron’a 17α-hidroksil grubu korunarak A halkasındaki subtutisyon, steroidlerin androjenik gücünü azaltırken anabolik gücünü arttırırlar (Khovidhunkit ve Shoback 1999).
Tüm iskelet kasları, yüksek konsantrasyonda androjen reseptörleri içermelerine karşın, 5-α-redüktaz enzimi içermezler. Androjen reseptör içerikleri yüksek olduğundan insanlarda androjenlere en iyi yanıt verebilen iskelet kasları pektoral ve omuz bölgesindeki kaslardır. Anabolik steroidlerin iskelet kaslarındaki etkinliğini anabolik steroid-reseptör kompleksinin sayısı belirler. Yetişkin erkeklerde, dokuların çoğundaki androjen, reseptörlerine bağlı olduğundan plazma androjen düzeyinin yükseltilmesinin kas gelişimine herhangi bir etkisinin olmadığı bildirilmiştir (Horwîtz 1992, Jameson ve Hollenberg 1993, Bagatell ve Bremner 2003).
Erkeklerin birincil ve ikincil seksüel karakterinin gelişmesini stimüle eden, anabolik etkileri ile karakterize testosteron (Potteiger ve Stilger 1994) ve dihidrotestosteron aynı androjen reseptörleri ile birleşebildiklerinden her ikisi de aynı etkiyi gösterebilmektedirler. Ancak fizyolojik koşullarda dokulardaki 5α-redüktaz enziminin varlığında testosteronun dihidroksitestosterona dönüşebildiğinden, dokularda testosteron aktivitesinin ortaya çıkışı bu enzimce kontrol edilir. Tedavi amacıyla her hangi bir steroid canlı vücuduna verildiğinde anabolik ve androjenik yanıtlarda ortaya çıkacaktır (Wilson 1988, Wilson ve ark 1993, Swain ve ark 1998).
Testosteron, nefronların proksimal tubullerini etkileyerek K+, Na+, Cl-, geri emiliminde, eritropoeziste ve
kan hacminin artışında da rol oynar. Sporcularda sentetik androjen uygulaması sonucu ortaya çıkan ağırlık kazancının kan hacminin artışından ileri geldiği bildirilmiştir. Androjenler eritropoetin sentezini artırır. Hemotokrit düzeyini yükseltir, abdominal bölgede yağ depolanmasını ve vücudun üst kısmında yağlanmayı arttırır (Griffin ve Wilson 1998, Bagatell ve Bremner 2003).
Androjenler büyüme hormonu salınımını etkileyerek dolaylı yoldan iskelet gelişimini ve olgunlaşmasını sağlarlar. Ergenlik döneminde androjen düzeylerinde meydana gelen artış GH salınımını uyararak uzun kemiklerin epifizlerinin gelişimini hızlandırır ve boy uzamasını maksimal düzeye çıkarır. Androjenler aynı zamanda ossifikasyon ve kemik kitlesinin artışını da hızlandırırlar (Yesalis 2000).
Testosteron sentezinin yokluğuna hipoganodizm denir. Bu olay buluğ çağından önce görülecek olursa ikincil cinsiyet karakterleri gelişmez ve olay erişkin dönemde görülecek olursa bu karakterlerin çoğu geriler. Birincil hipogonadizm testisi farklı etkileyen olaylara bağlıdır ve testis yetmezliğine neden olurken ikincil hipoganodizm gonadotropinlerin kusurlu salgılanmasına bağlıdır ve testosteron biyosentezinde karşılaşılan en az 5 ayrı kalıtımsal kusurun varlığı da kanıtlanmıştır (Granner 1998).
Androjenler pubertesi gecikmiş erkek çocuklarda büyümeyi uyarmak amacıyla kullanılırlar. Dikkatli kullanıldıklarında çocukların boyları normal erişkinlerin boylarına ulaşır. Ancak uygulanan tedavide aşırıya
kaçılırsa, büyümenin aşırı hızlanmasına bağlı olarak kemik epifizleri erken kapandığından normal boylara ulaşılamaz (Sevin ve ark 2005).
Yaşın ilerlemesiyle anabolik-androjenik etkili hormonlarda, bir başka deyişle testosteron ve dehidroepiandrosteron sülfat (DHEAS) düzeylerinde ortaya çıkan azalmalar vücut kompozisyonunda, fiziksel fonksiyonlarda ve libidoda düşmelerle karakterize hipogonadizme yol açmaktadır. Hormon konsantrasyonlarının yükseltilmesi ya da eksojen testosteron uygulamaları yaşlılarda bu tür etkileri gidererek yaşam kalitesini yükseltebilmektedir (Vermulen 2000, 2002, Gooren 2003, Bagatell ve Bremner 2003).
2.2.7. Testosteron ve stres:
Fiziksel egzersiz sırasında plazma testosteron düzeyinin yükselmesi genel bir bulgudur (Yezova ve ark 1985, Sutton ve ark 1973). Ancak , atletlerde yoğun, kısa veya uzun süreli egzersizlerin sonunda serum testosteron düzeyi düşmektedir. Birkaç günlük yoğun fiziksel ve mental stres erkeklerde plazma testosteron düzeyini neredeyse bayanlardaki düzeye indirmektedir (Aavqak ve ark 1978). Fiziksel ve mental stres sonucu gelişen testosteron düzeylerindeki düşmelere hipofizin yanıt veremediği bildirilmiş (Zitzmann ve Nieschlag 2001), bu durum ağır dayanıklılık antrenmanlarından sonra bazı sporcularda serum testosteron düzeylerinde düşmeler görülürken, LH ve FSH düzeylerinde herhangi bir değişiklik olmaması ile kanıtlanmıştır (Wheeler ve ark 1991)
Bohus ve ark (1987) psikolojik stres kavramını geliştirmişler ve bu yeni kavramın çevre, davranış ve fizyolojiyi kapsadığını, nöropeptik kavramlarını da içeren nöroendokrin görüşlerle birleştiğini ifade etmişlerdir. Buna bağlı olarak psikolojik stresin endokrin sisteme etkisini inceleyen Johansson ve ark (1988) da 76 tıp fakültesinde okuyan erkek öğrencilerde LH (Luteinizan Hormon) sınav öncesinde daha düşük olduğunu, kız öğrencilerde böyle bir farklılığın bulunmadığını, testosteron düzeylerinin her iki cinste değişmediğini, LH ve testosteron değerleri arasında bir korelasyon bulunmadığını, buna karşın erkeklerde ve kızların çoğunda sınav öncesi testosteron değerleri ile sınav sonrası testosteron değerleri arasında anlamlı bir negatif korelasyon olduğunu, imtihan sonunda LH değerlerinin erkeklerde kontrol değerlerine oranla düşük olmasına karşın, kızlarda böyle bir durumun söz konusu olmadığını, erkeklerde sınav sonrası LH ve testosteron değerleri arasında zayıf bir pozitif korelasyon mevcutken, kızlarda böyle bir durumun söz konusu olmadığını bildirmişler. Bu sonuçlarla psikolojik stresin erkeklerde ve kadınlarda farklı hormonal etkilere neden olduğunu ileri sürmüşlerdir.
Cerrahi streslerde olduğu gibi psikolojik stresler sonucunda da testosteronun baskılandığı Kreutz ve arkadaşlarının yaptığı çalışma ile ortaya konmuştur(Kreutz ve ark 1972). Bazı çalışmalarda hipogonadal erkeklerde Testosteron yerine koyma tedavisinin mizacı yükseltici etki yaptığı ve depresyonu düzelttiği bildirilmiştir(Grimspon ve ark 2006). Testosteronun zindelik verici etkisi, protein anabolizmasının artmasına ayrıca sübjektif düzeyde Libidoyu destekleyecek psişik etkilere de bağlıdır. Protein anabolizmasından kaynaklanan etkilerden biride kemikleştirmeyi kolaylaştırmak ve kıkırdak rejenerasyonunu çabuklaştırmaktır (Bilge 1975,Miyabo.1977..Pastoris ve ark 1983).
Testosteron uzaysal kognisyonu ( hafıza ve dikkat gibi) artırırken, sözel yetenekleri azaltıyor olabilir (Seidman 2003).
2.3.KORTİZOL
2.3.1 Kortizolun yapısı
Adrenal korteksten , en önemli örneklerini kortizolün oluşturduğu glukokortikoidler arasında kortizon ve kortikosteron da sayılabilir. Glukokortikoidlerin toplam metabolik etkilerinin % 95’i kortizolce sağlanır. (Kalaycıoğlu ve ark 2000)
2.3.2.Kortizolun biyosentezi
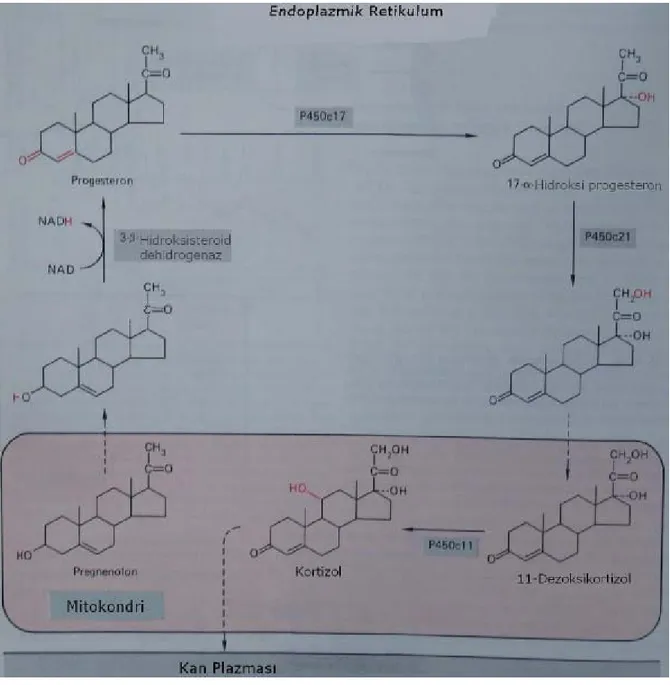
Kortizol böbrek üstü bezinin Zona fasikulata tabakasında hipofiz ön lobundan salınan adrenokortikotrop hormonu (ACTH) kontrolü altında kolesterolden sentezlenir Hipofiz ön lobundan salınan ACTH’ın Böbrek üstü bezinin korteksini uyarmasıyla aktifleşen bir estaraz aracılığı ile kolesterol esterlerinden serbest hale geçen kolesterol mitokondriler içine girer ve burada P450 enzimi tarafından pregnenolona dönüştürülür. Daha sonra NADPH ve moleküler oksijen varlığında hidroksilazlar, dehidrogenazlar, izomerazlar ve liyazların ortaklaşa katalizlediği reaksiyonlar sonucu kortizole dönüştürülür (Şekil 2) ( Löffler and Petrides 1988) .
2.3.3.Kortizolun salınımı
Hipotalamustan salınan Kortikotropin releasing hormonun (CRH) etkisiyle artan miktarlarda adenohipofizden salınan ACTH’ın kan yoluyla böbrek üstü bezlerine ulaşmasıyla ağırlıklı olarak kortizol olmak üzere bazı androjenlerin salınımı da uyarılır (Robert K.ve ark 1993). Kortizol salınımı gece gündüz ritmine sahiptir ve salınım sabah saat 6-8 arasında en yüksek düzeylerine ulaşılır ( Löffler and Petrides 1988 ).
2.3.4.Kortizolun kanda taşınması ve etki mekanizması
Kana verilen kortizol başta transkortin adı verilen protein olmak üzere plazma proteinlerine bağlanır ve bu taşıyıcı protein reseptörlerinin bulunduğu karaciger, kas, böbrek, akciger, lenfoid doku, deri, kemik ve beyin gibi reseptörlerinin bulunduğu dokularda taşıyıcı proteinlerden ayrıldıktan sonra doğrudan hücre zarını geçerek sitoplazmadaki kendine özgü reseptörüne bağlanır. Bu bağlanma sonucu Hormon reseptör kompleksi yapısal bir değişim geçirir ve kompleks çekirdeğe göç ederek DNA üzerindeki kendine özgü bağlanma bölgesine bağlanarak bu bölgelerdeki belirli proteinler için var olan genetik bilginin mRNA’lara transkripsiyonlarını uyarır. mRNA yapısına aktarılan genetik bilgi stoplazmada protein sentezinde kullanılır ve sentezlenen proteinlerde belirli metabolik olayların yönlendirilmesinde görev alırlar (Robert K.ve ark 1993).
Şekil 2. Kortizol biyosentezi( Löffler and Petrides 1988) .
Bugünkü sonuçlara göre kortizol, hemen hemen bütün doku ve hücrelerde metabolik olaylara çok yönlü etkileri olan bir hormondur. Kortizol çeşitli metabolizma olaylarını o şekilde yönlendirir ki, sonuçta vücudun korunma fonksiyonları (antikor yapımı, mikroplara direnç…vb) kolaylaşır. Dokularda rejenerasyon hızlanır. Fiziksel, ruhsal, cerrahi stresler karşısında koruyucu metabolik uyum işlemlerini güçlendirir. Bu metabolik uyumu bir benzetme ile açıklamak istersek; kortizol salgılandığında vücutta, bir savaşın getireceği yıkımları onarma, savaşan hücrelerin ihtiyaçlarını karşılama işlemlerini yürütür. Yüksek miktarda kortizol salgısı ise, organizmada kendi savaş güçlerinin yapacağı tahribatı durdurmak için savaşı durdurur. O halde kortizol hormonu aşağı dozlarda savaşarak korunmayı, yüksek dozlarda ise, savaşı terk ederek, silahsızlanma yolu ile korunmayı planlamaktadır. Bu olaya kortizolün “antienflamatuar” etkisi denir (
Fakat organizma stres etmeni ile karşılaştığı zaman, tetik çeken kimyasal maddeler tam olarak bilinmemektedir. Buna karşın ister fiziksel , ister nörojenik olsun tüm stres tipleri ACTH salgısına sebep olur.(Wolkovitz OM 1994) Hipotalamustan gelen uyarılarla hipofiz ön lobunun uyarılması ve ACHT sekresyonunun artması böbreküstü bezi korteksini uyararak kortizol salınmasına, aynı zamanda otonom sinir sisteminin aşırı aktivasyonu sonucu böbreküstü medullasının uyarılmasına böylece adrenalin ve noradrenalinin kana verilmesine neden olur ( Bilge 1975,Frank ve ark 1974.Williams 1974). Bu salınan hormonlar ve otonom sinir sisteminin aşırı aktivasyonu alarm reaksiyonunu başlatır (Andaç ve ark 1977, Kayaalp 1979 ).
2.3.6.Kortizolun biyolojik etkileri:
Stres hormonu olarakta tanımlanabilen kortizolun etkileri salınan kortizolun düzeylerine bağımlıdır. Düşük konsantrasyonlarda salınan kortizol hemen tüm dokularda vücudun savunma sistemlerini güçlendirirken ( antikor biyosentezi, mikroorganizmalara direnç vb.) dokuların rejenerasyonlarının hızlandığı, fiziksel, ruhsal ve cerrahi stresler karşısında metabolik uyumun sağladığı, bir başka deyişle vücutta mikroorganizmalara karşı savaşta oluşan yıkımların onarımında gerekli düzenlemeleri sağladığı bildirilmektedir ( Bilge 1975, Frank ve ark 1974,Torunoğlu 1972,Williams 1974 ).
Buna karşın kortizolun yüksek miktarlarda salgılanmasında ise tam tersi etkilerle immun sistemin baskılandığı ve vucudun silahtan arındırılması yoluyla antiinflamatuar ve immunosupresif etkinin ortaya çıktığı saptanmıştır (Andaç ve ark 1977, Kayaalp 1979 ).
İnsanlarda ateş psikoz ,uzun süreli ve ağır egzersizler, gebelik ve hipoglisemi gibi uzun süreli stres oluşturan haller yanı sıra enfeksiyon hastalıkları gibi kısa süreli stresler sırasında da salınan kortizolün sığırlarda transport stresine bağlı olarak da salındığı ve bu salınımın sekiz katına kadar yükselebildiği ancak taşınmaya uyumla birlikte düşen düzeylerin tekrarlanan taşınmalar sırasında tekrar yükseldiği de bildirilmiştir (Cengiz 2000).
2.3.7.Kortizol ve stres
Olağandışı olayları tanımlayan ve kontrol dışı gelişen akut streslerin kortizol düzeylerinde önemli derecede artışlara yol açtığı (Herbert 1998,Selye 1978), beyin hücrelerine doğrudan geçebilen kortizolun beyinde yoğunlaşmasının ve beyinden atılımın kan dokusuna göre daha yavaş seyrettiği (Mertensz ve ark 1983) , steroid miktarındaki artışların davranışları etkilediği ve psikolojik stresin anksiyete bozuklukları ve depresyon gibi psikiyatrik hastalıkların başlaması ve seyrinde önemli bir role sahip olduğu yazılmaktadır (Holmes 1967). Stresler sırasında artan kortikosteroid düzeylerinin hipokampal nörodejenerasyona yol açarak depresyona yatkınlığa yol açabildiği , artan steroid salınımının gençlerin yaşamı ve depresyon arasındaki fizyolojik bağlantıyı oluşturduğu sanılmaktadır (Herbert 1998,Kılıç ve ark 2002). Keza kortizol düzeylerindeki hızlı artışların davranış bozukluklarına yol açtığı ve depresif duyguları açığa çıkardığı ileri sürülmüş (Wolkowitz 1994), bu olgu Cushing sendromu ve depresyonlarda antiglukokortikoid tedavilerin antidepresan etkilerinin ortaya konmasıyla kanıtlanmıştır (Wolkowitz 1999).
Şekil 3. Kortizolün biyolojik etkileri. ( Löffler and Petrides 1988) .
A.Engquist ve ark (1972) anestezi ve cerrahi müdaheleler sırasında serum kortizol düzeyindeki
değişimlerin en önemli nedeninin “ stres” olduğunu belirtmişler ve stresin hastanın ameliyattan korkması, anestezi ve cerrahi girişimlerin yarattığı stres olmak üzere üç grup da toplanabileceğini bildirirlerken, pre-operatif evrede hastanın korkmasının ve pre-medikasyonda kullanılan ilaçların serum kortizol düzeyini önemli derecede etkilemediği öne sürülmektedir.( Price ve ark1957, Hammond ve ark 1958, Scrivastava 1969 ). Keza myokard infarktüsünü izleyen ilk günlerde hastane stresine bağlı olarak plazma kortizol düzeyleriyle, idrarla atılan glikokortikoidlerin yıkılım ürünlerinin konsontrasyonlarının yükseldiği bildirilmiştir (Rao 1970) .
Chernow ve ark (1987) post operatif dönemlerde gelişen çok düşük düzeyli streslerin hormonal
saatler arasında plazma kortizol, adrenalin ve noradrenalin düzeylerinde artışl, anjiotensin düzeylerinde azalma gözlenirken, serum total T4 ve serum serbest T4 düzeylerinde anlamlı bir değişim görülmediğini, ancak orta dereceli streslerde serum total T3 ve serbest T3 düzeylerinin anlamlı derecede düştüğünü bildirmektedirler.
Sınavlar sırasında gelişen streslerin hormonal sistem üzerindeki etkileride incelenmiş ve tıp fakültesinde okuyan öğrencilerde sınav stresinin serum prolaktin düzeyinde önemli bir artışa yol açarken, serum kortizol düzeylerinde önemli bir değişiklik göstermediği saptanmıştır (Vassend ve ark 1987) .
Ancak stresin özellikle glikokortikoidler olmak üzere hormonal sistem üzerindeki etkileri konusundaki bulgular arasında da çelişkilerin bulunduğu, araştırıcıların büyük bir bölümünce stresin serum kortizol düzeylerinde artışlara yol açtığının saptanmasına karşın, bir kısım araştırıcıların da psikolojik ve fiziksel streslerden sonra kortizol düzeylerinde anlamsız olmakla birlikte bir miktar düşmelerin görüldünün yazıldığı bildirilmektedir (Dorian ve ark1982 ,Landman ve ark 1984).
2.4. KOLESTEROL –TRİGLİSERİT – TOTAL LİPİD
İnsan ve hayvan metabolizmasında büyük önem taşıyan karmaşık yapılı lipidlerinden olan kolesterol hayvansal kökenli gıdalardan sağlanabilmesi yanı sıra vucudun hemen tüm dokularının hücreleride Asetil CoA lardan kolesterol sentezleyebilme yeteneğine sahiptirler. Bu
dokulardan en yüksek biyosentez oranı karacğerdedir ve toplam kolesterol biyosentezinin %10-20 kadarı karaciğerde yapılırken, geri kalan kısmıysa perifer dokuların hücrelerinde gerçekleştirilir. Gıdalardan alınan ve karaciğerde sentezlenen kolesterol LDL (low density lipoprotein) yapısında kan yoluyla perifer dokulara taşınır ve LDL reseptörleri üzerinden hücrelere alınır. Hücrelerde üretilen ya da, kandan alınan kolesterol hücrelerde D vitamini ve steroid hormonların sentezinde kullanılırken, hücrelerde kullanılmayan kolesterol hücre zarını geçerek hücre üst yüzeyinde kendisini karaciğere taşıyacak HDL (High Density Lipoprotein) moleküllerine bağlanarak karaciğere taşınır, safra asitlerine dönüştürülerek safra üzerinden barsaklara ulaştırılır (Robert K 2000). Bu taşınma sistemlerdeki ya da taşıyıcı moleküllerdeki yetmezliklerde bir yandan kan kolesterol düzeyleri yükselirken bir yandan da kolesterol hücre üst yüzeylerinde birikir ve bu birikimler üzerine Ca oturmasıyla damarların esnekliklerinin kaybolmasını izleyerek damar sertliği ( ateroskleroz) ve koroner kalp hastalıklarının geliştiği öne sürülmektedir (Gökdemir ve ark 2002,Gökçe ve ark 1988).
Kompleks yapılı lipitler arasında sayılan trigliseritler bir trialkol olan gliserolle uzun zincirli yağ asitlerinin esterleridirler. Gıdalarla alınan, karaciğerde ya da yağ dokusunda sentezlenen ve enerji üretiminde kullanılamayan uzun zincirli yağ asitleri gliserolle esterleştirilip, trigiliseritler haline dönüştürüldükten sonra yağ dokusunda depolanırlar. Vucudun enerjiye gereksinim duyduğu hallerde de yağ dokusundan hidrolize edilerek kana verilir ve kanın total lipid içeriği de büyük ölçüde trigliseritlerden oluşur ((Gökdemir ve ark 2002,Gökçe ve ark 1988).