T.C.
SELÇUK ÜNĐVERSĐTESĐ TIP FAKÜLTESĐ
ERDOSTEĐN KULLANIMININ RADYOTERAPĐYE BAĞLI
OLUŞAN BARSAK TOKSĐSĐTESĐ ÜZERĐNE ETKĐSĐNĐN
ARAŞTIRILMASI
Dr. Ahmet BÜYÜKYÖRÜK
TIPTA UZMANLIK TEZĐ
RADYASYON ONKOLOJĐSĐ ANABĐLĐM DALI
Danışman
Yrd. Doç. Dr. Güler YAVAŞ Konya–2014
T. C.
SELÇUK ÜNĐVERSĐTESĐ TIP FAKÜLTESĐ
ERDOSTEĐN KULLANIMININ RADYOTERAPĐYE BAĞLI
OLUŞAN BARSAK TOKSĐSĐTESĐ ÜZERĐNE ETKĐSĐNĐN
ARAŞTIRILMASI
Dr. Ahmet BÜYÜKYÖRÜK
TIPTA UZMANLIK TEZĐ
RADYASYON ONKOLOJĐSĐ ANABĐLĐM DALI
Danışman
Yrd. Doç. Dr. Güler YAVAŞ
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 13102032 proje numarası ile desteklenmiştir.
ONAY SAYFASI
Selçuk Üniversitesi Tıp Fakültesi Dekanlığı’na
Ahmet BÜYÜKYÖRÜK tarafından savunulan bu çalışma, jürimiz tarafından Radyasyon Onkolojisi Anabilim Dalında Uzmanlık tezi olarak oy birliği ile kabul edilmiştir.
Jüri Başkanı: Yrd. Doç. Dr. Güler YAVAŞ Đmza
Selçuk Üniversitesi
Üye: Prof. Dr. Mehmet KOÇ Đmza
Necmettin Erbakan Üniversitesi
Üye: Yrd. Doç.Dr. Meryem AKTAN Đmza
Necmettin Erbakan Üniversitesi
ONAY:
Bu tez, Selçuk Üniversitesi Tıp Fakültesi Mezuniyet Sonrası Eğitim
Yönetmeliği’nin ilgili maddeleri uyarınca; yukarıdaki jüri üyeleri tarafından uygun görülmüş ve Fakülte Yönetim Kurulu 30.04.2014 tarih ve ………..sayılı kararıyla kabul edilmiştir.
Đmza Prof. Dr. Oktay SARI Dekan
ÖNSÖZ ve TEŞEKKÜR
Uzmanlık eğitimim süresince ve bu tezin hazırlanması sırasında, engin tecrübe ve desteğini benden esirgemeyen tez hocam sayın Yrd. Doç. Dr. Güler YAVAŞ’ a en içten teşekkürlerimi sunarım.
Asistanlık eğitimimin bir bölümünde birlikte çalışma şansını bulduğum ve kendisinden çok şey öğrendiğim sayın hocam Prof Dr. Haldun Şükrü ERKAL’ a ve sayın Uzman Dr. Ahmet YOLCU’ ya teşekkür ederim.
Tez çalışmama verdiği katkılardan ötürü Histoloji ve Embriyoloji Anabilim Dalı Öğretim üyesi sayın Prof. Dr. Ender ERDOĞAN’ a, uzun ve zor çalışmalarda yardımcı olan Uzman Dr. Duygu DURSUNOĞLU’na ve araştırma görevlisi arkadaşım Dr. Metin KOCACAN’a teşekkür ederim.
Rotasyona gittiğim bölüm hocalarına ve beraber çalıştığım asistan arkadaşlara teşekkür ederim.
Asistanlık eğitimim boyunca birlikte çalışmaktan mutluluk duyduğum fizik mühendisi Gökçen ĐNAN, Vefa GÜL‘e ve teknisyen arkadaşlara teşekkürlerimi sunarım.
Tez proje kapsamında verdiği mali destek için Selçuk Üniversitesi BAP Koordinatörlüğü’ne teşekkür ederim.
Son olarak, hak ve emekleri asla ödenmeyecek olan aileme, manevi desteği kadar yoğun emeğiyle de tezime katkıda bulunan, her zaman yanımda olup desteğini esirgemeyen sevgili eşim Dr. Cennet BÜYÜKYÖRÜK‘e ve neşe kaynağımız canım oğlum Kayra’ya teşekkürlerimi sunarım.
ĐÇĐNDEKĐLER
Sayfa
SĐMGELER VE KISALTMALAR v
1.GĐRĐŞ 1
1.1 GENEL BĐLGĐLER 2
1.2. Pelvik Radyoterapi Yan Etkileri 2
1.2.1 Gastrointestinal yan etkiler 3
1.2.2 Gastrointestinal yan etkide kullanılan ajanlar 3 1.2.3 Gastrointestinal radyoterapinin yan etkisinden korunma 5 1.3.Radyasyona bağlı intestinal hasarın patogenezi 5
1.3.1 Histopatoloji 5
1.4 Radyoterapide uygulanan radyasyon dozu 7
1.5 Deneysel olarak erken yan etkinin incelenme zamanı 8 1.6 Radyasyon fibrozisi tedavi stratejileri 8
1. 7 Erdostein 12
1.7.1. Erdostein yapısı ve etki mekanizması 12
1.7.2. Erdostein farmakokinetiği 13
1.7.3. Erdostein ile yapılan klinik çalışmalar 13 1.8. Đntestinal Toksisitede Radyoterapi-Erdostein Etkileşimi 14
2.GEREÇ ve YÖNTEM 15
2.1. Radyoterapi Protokolü 15
2.2. Erdostein Tedavi Protokolü 16
2.3. Histopatolojik Đnceleme 17 2.4 Đmmünhistokimyasal Đnceleme 18 2.5 Đstatiksel Analiz 19 3.BULGULAR 20 3.1 Histopatolojik Bulgular 20 3.2 Đmmünhistokimyasal Bulgular 24 3.2.1 TGF-ß1 ekspresyonu 24 3.2.2 8-OHdG ekspresyonu 26 3.2.3 Mitotik Đndeks(PCNA) 28 3.2.4 Apopitotik Đndeks 31 4.TARTIŞMA 35
5.SONUÇ VE ÖNERĐLER 41
KAYNAKLAR 42
ÖZET 47
SUMMARY 49
ÖZGEÇMĐŞ 50
SĐMGELER VE KISALTMALAR
8-OHdG: 8-hidroksi-2'-deoksiguanosin CTGF: Connective Tissue Growth Factor ER: Erdostein
ERRT: Erdostein ve Radyoterapi
G-CSF: Granulocyte-colony stimulating factor MDA: Malondialdehid
PCC: Protein karbonil kontent
PCNA: Proliferating Cell Nuclear Antigen PDGF: Platalete-Derived Growth Factor RT: Radyoterapi
TGF-β: Transforming Growth Factor beta TKI: Tirozin Kinaz Đnhibitörü
TUNEL: Terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nick end labeling
1.GĐRĐŞ
Bu çalışmanın amacı alt batın bölgesine uygulanan ışın tedavisine bağlı barsak dokusunda oluşan erken zamanlı değişiklikler üzerine erdostein tedavisinin erken etkiyi ne ölçüde değiştirdiğini ve etki mekanizmalarını araştırmaktır.
Đnce bağırsaklar, alt batın ışın tedavisi sırasında önemli bir doz sınırlayıcı organ olmaktadır. Tedavi tekniklerindeki ilerlemelere rağmen, bağırsak radyasyon hasarı (radyasyon enteropatisi) kanser tedavileri için önemli bir engel olmaya devam etmektedir ve devam eden şikâyetler, birçok kanser hastasının yaşam kalitesini etkiler. Patolojik olarak, erken ışın tedavisine bağlı ishal ("radyasyon mukoziti") epitelyum bariyerinde hasar ve mukoza iltihabı ile karakterizedir, oysa geç radyasyona bağlı bağırsak dokusu etkilenmesi ise belirgin damarsal sertleşme ve bağırsak duvarında fibrozis sergiler.
Barsak sistemi için ışın tedavisi hasarı iki yol ile en aza indirgenebilir: Ya fiziksel olarak normal bağırsak, idrar kesesi, rektum dokularını ışın tedavi alanından dışarı çıkararak veya biyolojik tedaviler ile iyonlaştırıcı ışın tedavisine maruz kalan normal doku yanıtını düzenleyerek veya direncini arttırarak. Işın tedavisi tedavi alanı düzenlenmesi, modern planlama ve tedavi tekniklerinin kullanılması ile önemli bir gelişme elde edilmiş olmasına rağmen, biyolojik tekniklerin ilavesi ile daha fazla umut vaat edebilir. Farklı biyolojik, kimyasal ve farmakolojik ajanlar, iyonize ışına maruz kalan normal doku hasar şiddetini önlemek veya en aza indirmek için kullanılır olmuştur.
Erdostein (N-(carboxymethylthioacetyl)-homosysteine thiolactone) tiol ajan içeren balgam sökücü ajan olup, karaciğerdeki metabolik süreci takiben salınan iki bloke edilmiş sülfhidril grubu içerir. Bloke edilmiş sülfhidril gruplarının serbest radikal temizleyicisi ve antioksidan aktivitesi vardır. Erdosteinin iltihap önleyici özellikleri ve bakteri yapışmasını azaltıcı özellikleri bulunmaktadır. Erdostein içeren deneysel çalışmalarda böbrek kanlanmasının bozulması ve tekrar kanlanması sonrası böbrek korunmasında, testiste dönmeye bağlı kanlanmada bozulma ve tekrar normale döndürme sonrası ve uzuvlarda kansızlık sonrası tekrar kanlanma sonrasında gelişen akciğer hasarının önlenmesinde, barsak kansızlığı ve tekrar kanlanması sonrası hasarın önlenmesinde, akciğer ışın tedavisi sonrası hasarın önlenmesinde
kullanılmıştır. Fakat hiç alt batın ışın tedavisi sonrası erken dönemde erdosteinin barsak dokusu üzerindeki etkisi üzerine bir çalışma yapılmamıştır.
Bu çalışma ile alt batın ışın tedavisinde erken iltihap aşamasında erdostein kullanılabilirliğini göstermek ve etki mekanizmalarını ortaya koymak mümkün olabilir.
1.1.Genel Bilgiler
Eksternal radyoterapi kanser tedavilerinde geniş yer alan ortak bir tedavi yöntemidir. Radyoterapi tüm kanser tedavilerinde % 25’inde merkezi bir rol oynarken, tüm kanser hastalarının yaklaşık % 70'i, hastalıklarının seyri sırasında radyoterapi alır. (DeVita ve ark 2005, Wang ve ark 2007, Abobakr ve ark 2013) Radyoterapi toplam kanser harcamalarının sadece % 5’ini oluşturur ve maliyet etkin bir tedavi yöntemidir. (Ringborg ve ark 2003). Bu tahmin modern teknolojik yeniliklerin geniş kullanımı ile gelişen simülasyon, organ tanımlama, doz hesaplamaya bağlı ilerleyen radyoterapi teknikleriyle son on yılda artmıştır. (Van de Werf ve ark 2012).
1.2. Pelvik Radyoterapi Yan Etkileri
Radyasyon etkilerine en hassas organ kemik iliği olmakla birlikte GĐS ikinci sırada gelmektedir. Gastrointestinal radyasyon hasarı iki ana nedenden dolayı önemli bir sorundur. Birincisi, morbiditeye bağlı önemli bir ekonomik yük (Sher 2010) ve hastaların yaşam kalitesinde önemli bir azalmaya neden olur. (Bacon CG 2001, Bacon CG 2002). Đkinci olarak radyoterapide normal doku tolerans dozu, kanseri kontrol etmek için kullanılan radyasyon dozunu sınırlar. Gastrointestinal radyasyon hasarının klinik belirtileri akut mukoza yaralanmasına ve inflamasyon nedeniyle radyoterapi sırasında veya hemen sonrasında ya da transmural fibrozis ve vasküler skleroza bağlı kronik süreç nedeniyle radyoterapi sonrası birkaç ay veya yıl içinde zamanla çıkabilir. Radyasyon enteriti terimi radyasyona bağlı kolon ve ince barsaktaki değişiklik hakkında kullanılır. Radyasyon proktiti terimi ise rektumdaki değişiklik için kullanılır. (Theis ve ark 2010)
1.2.1 Gastrointestinal yan etkiler
Karın ve pelvis bölgelerine radyasyon tedavisi alan hastaların yaklaşık %0,5– 5,2’sinde GĐS komplikasyonları gelişmektedir (Poddar ve ark 1982, Fischer ve ark 1989). Dozun miktarı arttıkça, enteropati sıklığı ve şiddeti de artmaktadır (Galland ve ark 1987). Mukozal hasarlanmaya bağlı olarak safra tuzları, vitamin B12, yağ ve laktoz malabsorbsiyonu gelişmekte, ayrıca gastrointestinal içeriğin geçiş süresi de kısalmaktadır (Yeoh E ve ark 1993).
Erken dönemde kolonda ödem, mukozada hiperemi, artmış mukus salgısı ve rektal spazm saptanmaktadır (Jao ve ark 1986). Mukozadaki aşırı hiperemi, ödem ve kırılganlık en üst düzeye radyoterapi sonrasındaki dördüncü haftada ulaşmaktadır. Barsak hücrelerinin hızlı yenilenmesinden dolayı, fraksiyonlar arası yenilenme olur. Bu nedenle erken dönem şikâyetler saatler ile birkaç gün arası sürer ve radyoterapi tedavisinin tamamlanmasından iki ile üç hafta sonra koruyucu tedavi ile hızlıca geçer. (Spyropoulos ve ark 2001). Erken evrede şiddetli reaksiyon gelişen hastalarda geç dönemde de şiddetli reaksiyonların görülme sıklığı artmaktadır (Russell ve ark 1979, Morgenstern ve ark 1985).
Kronik radyasyon enteriti, radyoterapi sonrası üç ay ile altı yıl arasında gelişebilir. Karın veya pelvis radyoterapisi alan hastaların %20- %40’ında geliştiği raporlanmıştır. Nadiren 15 yıl sonra da görülebilir.( Turina ve ark 2008, Theis ve ark 2010)
Hastaların %75’inde bulantı, kusma ve ishal semptomları (koloreik enteropati) görülür. Yüksek doz uygulanan hastalarda rektal kanama ve tenesmus daha sıklıkla görülmektedir. Daha önceden hemoroid rahatsızlığı olan hastalarda bu bulgular diğer hastalara göre daha erken dönemde oluşabilir ve acilen yoğun semptomatik tedavi gerekebilir (Hatcher ve ark 1985, Sher ve ark 1990). Hastaların %40'a yakınında tedavi süresi boyunca kilo kaybı gözlenmektedir (Kawarada ve ark 1974). Radyoterapi altta yatan ülseratif kolit veya divertikülit gibi enflamatuar hastalıkları da alevlendirmektedir (Schofield ve ark 1983).
1.2.2 Gastrointestinal yan etkide kullanılan ajanlar
Diare ve abdominal kramplar oral olarak alınan difenoksilat hidroklorid, atropin sülfat (lomotil), lopermid hidroklorür (imodium), opium preparatları ile ve
pektin, kaolin gibi ilaçlar ile kontrol edilebilir. (Yeoh ve Horowitz 1987). Elemental diyet (yağdan, süt proteininden ve laktozdan fakir diyet uygulaması) gastrik, pankreatik ve safra sekresyonunu azaltarak, radyoterapi sonrasındaki akut evredeki değişikliklere karşı koruyucu rol oynamaktadır (McArdle ve ark 1985, McArdle ve ark 1986). Kolestiramin, safra tuzlarının emilimini azaltarak akut dönem semptomları üzerinde etkili olur ancak bu madde bazı ilaçları bağlayabilmekte ve hastaların %75'inde yağ malabsorbsiyonuna neden olmaktadır. Bu nedenle dikkatli kullanımı önerilmektedir (Heusinkveld ve ark 1978, Zentler-Munro ve ark 1987).
Proktit ve rektal rahatsızlıklarda hidrokorizonlu lavmanlarla (örneğin proctofoam, cortifoam) ve antiinflamatuar içeren suppozituarlarla (örneğin bizmut subsalisilat, benzil benzoat, çinko oksit veya peruvian balzam) tedavi yapılabilir. Bazı suppozituarlar kortizonda içerebilir. Balık ve karaciğer yağı içeren bazı lavmanlar da tedavide etkilidir. Yağsız, baharatsız diyet ve dışkıda lif arttıran metamucil ve fibercon gibi preparatlar kullanılarak gastrointestinal semptomlar azaltılabilir. Akut etkiler görüldüğünde günlük fraksiyonun %10 oranında azaltılması semptomlarda büyük oranda gerilemeye neden olmaktadır (Bloomer ve ark 1975, Heusinkveld ve ark 1978, McArdle ve ark 1985, McArdle ve ark 1986, Yeoh ve Horowitz M 1987, Zentler-Munro ve ark 1987).
Hiperbarik oksijen tedavisi hayvan modellerinde, anjiogenezi arttırarak doku onarımını arttırdığı düşünülmektedir. (Marshall ve ark 2007) 1993 yılında, Nakada ve arkadaşları kronik radyasyona bağlı kanamayı hiperbarik oksijen ile tedavi ettiklerini bildirmiştir. (Nakada ve ark 1993). Gouello ve ark. kronik radyasyon enteritli 36 hastanın 19'unda (% 53) orta derecede şikâyetlerde azalma ve bu hastalarda uzun vadeli(ortalama 52 aylık takip) 24 hastada(% 66) semptomatik iyileşme bildirmiştir. (Gouello ve ark 1999) Daha geniş bir çalışmada (n = 65) ortalama 23 aylık takip sonunda % 73 yanıt oranı bildirilmiştir.(Marshall ve ark 2007) Böylece, hiperbarik oksijen umut verici bir tedavi sağlar, ama pahalı ve tedavisi için uzman merkezlere erişimi gerektirir.
Endoskopi ile argon plazma koagülasyonu ve striktür dilatasyonu sağlanır. Tedavide cerrahi de kullanılmaktadır. ( Theis ve ark 2010)
1.2.3 Gastrointestinal radyoterapinin yan etkisinden korunma
Gastrointestinal sistem için radyoterapi yan etkileri iki strateji ile azaltılabilir: Ya teknik stratejileri kullanarak fiziksel olarak normal dokulardan radyasyon dozunu uzaklaştırarak veya biyolojik stratejiler yoluyla iyonize radyasyonun hücresel ve doku yanıtını modüle ederek. (Shadad ve ark 2013) Özellikle yüzüstü pozisyonunda, karın bölgesine dışarıdan kompresyon uygulandığında ve trendelenburg pozisyonunda, ince barsaklar RT alanına daha az girmektedir (Green ve ark 1975, Caspars ve Hop 1983). RT sırasında mesanenin dolu olması da tedavide hastaya verilecek pozisyonun seçilmesinde çeşitlilik sağlamasına karşın hastalar için konforsuz olmaktadır (Caspars ve Hop 1983, Gunderson ve ark 1985).
1.3.Radyasyona bağlı intestinal hasarın patogenezi:
Radyasyon doğrudan veya dolaylı olarak hücresel DNA’yı etkileyerek, bozulmuş hücre bölünmesi ya da hemen hücre ölümüne yol açan zararlara neden olabilir.(Bismar ve Sinicrope 2002). Doğrudan radyasyon hasarı, lineer enerji transferi sonrası, proton veya nötronlardan çıkan enerji emilimiyle oluşur. Radyasyonun dolaylı hasarı ise genellikle hücresel su ile radyasyon etkileşimi sonucu oluşan serbest radikaller sonucu DNA hasarı oluşur ve hücre döngüsü bozulur. (Hall 2000) Bu süreçlere en hassas hücreler mitozun G2 ve M aşamalarında hızlı çoğalan hücrelerdir. Bu durum da bağırsak mukozasının radyasyona bağlı hasara yatkınlığını açıklar. Bağırsak kripti içindeki kök hücreler özellikle risk altındadır. Çoğalma ve gelişmesi esnasında kök hücrelerin zarar görmesi ve ölümü gelişmiş bağırsak epitel hücrelerinin üretiminde azalma ve bunun sonucu olarak mukoza bütünlüğünün kaybına yol açar (MacNaughton 2000, Bismar ve Sinicrope 2002, McGovern 2005, Theis ve ark 2010). Ayrıca mukozal hasar, mukus hasarına yol açar ve mikroorganizmalar, fiziksel ve kimyasal saldırılara karşı koruyucu bariyer görevi ve sindirim sistemindeki kayganlaştırıcı rolü bozulur.(Akpolat M ve ark 2009)
1.3.1 Histopatoloji:
Akut radyasyon hasarında (radyasyona maruziyeti sonrası 2 hafta içinde meydana gelen) geçici mukozal atrofi, kript hücre kaybı, villus atrofi, mukozal erozyon ve bağırsak bariyerinin bozulması ile epitel atipi ile karakterizedir. Çok sayıda inflamatuar değişiklikler yüzey epiteli, lamina propria ve mukozada
inflamatuar hücre infiltrasyonu gözlenir (Yeoh ve Horowitz 1987, Francois A ve ark 2005). Kök hücre kaybı ve kriptteki mitoz azalmanın bir sonucu olarak, epitel soyulması, kript mikro apse oluşumu ve mukozal ülserasyon oluşur. (Rodier 1995, Pia de la Maza ve ark 2001). Epitel disfonksiyonu, bağırsak patojenlerinin geçişinde artışa neden olarak mukozal iltihabı şiddetlendirebilir ve sonucunda besin ve sıvı kaybına yol açar. (MacNaughton 2000). Bağırsak düz kas hücre çoğalması oranı başlangıçta çok düşüktür, ama radyoterapi sonrası hızlı bir şekilde artar. (Wang J ve ark 2010)
Kronik radyasyon enteritinde besleyici arter tıkanmasına bağlı submukozal fibrozis ve lenfatik dilatasyon sonucunda doku iskemisi ve nekroz oluşur. (Rodier 1995, Wellwood ve Jackson 1973). Tablo 1.1’de akut ve kronik radyasyon hasarındaki histopatolojik değişiklikler özetlenmiştir. Mezenkimal hücre aktivasyonu ve şiddetli transmural fibrozise yol açan kollajen birikimi de oluşabilir. (MacNaughton 2000, Strup-Perrot ve ark 2004). Bu patolojik değişikliklerin altında yatan mekanizma henüz tam olarak tespit edilemese de metalloproteinaz enzimlerindeki bir dengesizliğin kollajen birikiminde rol oynadığı düşünülmektedir. (Şekil–1.1) Đnsan çalışmalarında kronik radyasyon enteritinde, TGF-β1 ile uyarıda yol alan CTGF’nin ve Rho yolağının aktivasyonuna sekonder olarak oluşan fibrotik oluşumun büyük oranda rol aldığı düşünülmektedir.(Bourgier ve ark 2005, Haydont 2005, Nguyen ve ark 2002).
Bu patolojik değişikliklerin toplu etkisi ile vasküler hasar ve telenjiektazik damar oluşumu, mukozal ülser, bağırsak duvar nekrozu ve serozal yapışıklık oluşumuna neden olabilir. Bu değişiklikler kanama, darlık veya fistül oluşumu meydana getirirse bağırsak fonksiyonlarını ciddi bozabilir. (Yeoh ve Horowitz 1987, Oya ve ark 1996).
Tablo–1.1:Radyasyon enteritinde oluşan histopatolojik değişiklikler
Akut Kronik
Đnflamatuar hücre birikimi Besleyici arter tıkanıklığı
Azalmış kript mitozu Submukozal fibrozis
Kript mikro-absesi Lenfatik genişleme
Epitel soyulma ve ülserasyonu Doku iskemi ve nekrozu
Şekil–1.1:Fibrozisde değişik aşamalarda görülen hücreler ve sitokinler. (Wynn TA. 2004).
1.4 Radyoterapide Uygulanan Radyasyon Dozu:
Erken ve geç bağırsak toksisitesinde toplam radyasyon dozu ve radyasyon alan bağırsağın dozu da önemlidir. Toplam radyasyon dozu 50 Gy ve altında olduğu sürece ciddi enterit nadiren görülür. %5 hastada, 5 yıl içinde enterit oluşturacağı tahmin edilen doz (TD 5/5),1/3 bağırsak hacmi için 50 Gy ve tüm bağırsak hacmi için 40 Gy’dir. %50 hastada, 5 yıl içinde enterit oluşturacağı tahmin edilen doz (TD
50/5),1/3 bağırsak hacmi için 60 Gy ve tüm bağırsak hacmi için 55 Gy’dir. Kalın barsak için tolerans dozları daha yüksek olup, TD 5/5 1/3 bağırsak hacmi için 55 Gy ve tüm bağırsak hacmi için 45 Gy’dir. Kalın barsak için TD 50/5 ise,1/3 bağırsak hacmi için 65 Gy ve tüm bağırsak hacmi için 60 Gy’dir.( Emami ve ark 1991)
1.5 Deneysel olarak erken yan etkinin incelenme zamanı
Pelvis radyoterapi sonrası erken etkileri incelemek için en uygun zamanı rektal mukoza incelemesinde ikinci haftada en iyi görülmüştür (Korkut ve ark 2006). Mesane incelemesinde ikinci haftada incelenmiştir (Rocha ve ark 2011) Çoğu çalışmada da 2.haftada yapılmıştır (Uzal ve ark 2012, Yoon ve ark 2012). Đlk iki günde lamina propriada ödem gözlenmiştir. 4. ve 5. günlerde kriptit ve kript abseleri gözlenmiştir. 9. ve 10. günlerde ülserler ve yenilenme bulguları gözlenmiştir.15.günde ise mukoza iyileşmiş ve lamina propriada fibrozis gibi kronik sekel bulguları gözlemlenmiştir. Özellikle 10.günde patolojik bulguların daha belirgin olduğu gözlemlenmiştir. Akut radyasyon toksisitesinde ağırlıklı olarak kriptit ve kript apsesi görülmüştür. (Hovdenak ve ark 2000, Korkut ve ark 2006).
1.6 Radyasyon fibrozisi tedavi stratejileri
Shadad ve arkadaşlarının yaptığı derleme de radyasyonun etkisinden korunmak için hayvanlar üzerinde çalışılan barsak radyoprotektanları özetlenmiştir(Tablo–1.2). Fakat bu tedaviler az sayıda yapılan çalışmalardan çıkan verilerle desteklenir. (Shadad ve ark 2013).
Tablo–1.2: Hayvan çalışmalarında kullanılan barsak radyoprotektanları Hayvan çalışmalarında kullanılan barsak radyoprotektanları
Biyolojik ajan Etki/mekanizması Radyoprotektan
etkisi
Kaynak
Glutamin, arjininden zengin diyet
Gelişmiş mukozal iyileşme Koruyucu etki Ersin S ve ark 2000 Vitamin – E Oksidatif stresin azaltılması Koruyucu etki Empey LR
Tablo–1.2(devamı): Hayvan çalışmalarında kullanılan barsak radyoprotektanları Hayvan çalışmalarında kullanılan barsak radyoprotektanları
Biyolojik ajan Etki/mekanizması Radyoprotektan etkisi Kaynak Kaptopril Proinflamatuar enzim
olan anjiotensin çevirici enzim–1 inhibisyonu
Koruyucu etki Yoon SC ve ark 1994
Rofecoxib Seçici siklooksijenaz – 2 enzim inhibisyonu
Koruyucu etki Keskek M ve ark 2006
Klopidogrel Azaltılmış vasküler skleroz ile trombosit agregasyonu
inhibisyonu
Koruyucu etki Wang J ve ark 2002
Thalidomid Mikrovasküler yatak korunması Endotelyal hücrelerdeki mikrovasküler yatağın azaltılmış hasarı Kim KT ve ark 2008
Simvastatin Endotel hücre hasarı azaltımı Azaltılmış, gecikmiş hasar Wang J ve ark 2007 Glucagon-like peptid-2 (GLP-2)
Mukozal kitle artımı Hasar koruyucu etki Torres S ve ark 2007 Octreotide NFκB aşırı ekspresyonuna bağlı inflamatuar etkilerin modülasyonu Đnflamasyon ve hasarın düzenlenmesi Wang J ve ark 2001, Olgac V ve ark 2006
Prostaglandin E–2 Bağırsak epiteli
üzerinde öncü proliferatif ve anti-apoptotik etkisi Kript yaşamının uzaması Stenson WF 2007
Tablo–1.2(devamı): Hayvan çalışmalarında kullanılan barsak radyoprotektanları Hayvan çalışmalarında kullanılan barsak radyoprotektanları
Biyolojik ajan Etki/mekanizması Radyoprotektan etkisi Kaynak Anti-Transforming
growth factors beta reseptörü Biyolojik ekstrasellüler yenilenmenin inhibisyonu Barsak hasar ve fibrozisin azalması Zheng H ve ark 2000 Salmonella flagellinden elde edilen Toll like reseptör 5 agonisti
NFκB sinyali yolağıyla barsak immün yanıtının aktivasyonu
Koruyucu etki Burdelya LG ve ark 2008
Bağırsak sterilizasyonu
Taşınan bakteri, sepsis ve inflamasyon sayısı azalır
Barsak hücre ölümünün azalması Crawford PA ve Gordon JI 2005 Probiyotik bakteri (Lactobacillus türleri) Bağırsak mikrobiyal florasında dengesizliğin düzenlenmesi
Đntestinal hasar, sepsis
ve ölümlerin
azaltılması
Ciorba MA ve Stenson WF 2009
Delanian ve Lefaix’in yaptığı derlemede fibrozisten korunma tedavileri üçe ayrılarak özetlenmiştir: Bunlar: (1) anti-inflamatuar tedavi, örneğin kortikosteroid; (2) damar tedavisi pentoksifilin veya hiperbarik oksijen ile (3) süperoksit dismutaz yoluyla antioksidan tedavi ya E vitamini (alfa-tokoferol) ile veya pentoksifilin ve E vitamini kombinasyonu olarak özetlenmiştir. (Delanian ve ark 2004, Delanian ve ark 2007).
Çalışmalarda, fibrozisin çözünürlüğünü ölçmek için sonlanım noktalarını tanımlama zorlukları nedeniyle, terapötik faydanın değerlendirilmesi sınırlıdır. Kısıtlı sayıda çift kör çalışma olduğu için veriler yetersiz olarak yorumlanmaktadır (Westbury ve ark 2012). Pro-fibrotik sitokin TGF ß1(Transforming Growth Factor), fibrozis başlamasında önemli rolü olduğunu dikkate alarak, birden çok yolun, kronik radyasyon fibrozisinde yer aldığı düşünülmüştür. Örneğin, CTGF(Connective Tissue Growth Factor) ve TGF ß1 hem fibrotik süreçte rol alır, hem de beraber hareket
edebilir. (Haydont ve ark 2008, Leask ve ark 2004). CTGF yolunda Rho/ROCK yoluna bakılmış ve statinlerle insan hücre kültüründe kollajen gen ekspresyonunu azalttığını ve ratta radyasyon enteropatisini iyileştirdiğini bulmuşlardır. (Haydont ve ark 2007). Fakat bu konuda klinik deneyimin olduğu bir yayın yoktur. (Westbury ve ark 2012). Makrofajların önemli yer tuttuğu inflamatuar süreçte salınan trombosit kökenli büyüme faktörü (PDGF) üzerine tedaviler de denenmiştir. (Abdollahi ve ark 2005, Li ve ark 2009) . Şekil–1.2 ‘de radyasyon fibrozisi ve tedavi hedefleri özet olarak gösterilmiştir.
Şekil–1.2: Radyasyon fibrozisi ve tedavi hedefleri özeti. Endotelyal hücreler fibrotik kemokinlerin ve PDGF ile TGF ß1’in yer aldığı sitokinlerin önemli bir kaynağıdır. Kemik iliği kaynaklı kök hücreler, doku hücrelerinin tamirinde rol alır. Damar hasarına bağlı doku hipoksisi, dolaylı olarak hasara katkıda bulunur. Rho-ROCK yolu, CTGF’ yi arttırır ve fibrotik yolda yer alır. CTGF, TGF ß1’e bağlanınca, TGF ß1 sinyali artar. Sonrasında fibroblast aktivasyonu, kollajen ve ekstrasellüler birikimi artar. TGF ß1 ve PDGF yolağı tirozin kinaz inhibörleriyle(TKI) durdurulabilir. TGF ß1 aktivitesi nötralize edici antikor veya TGF ß1’e de bağlanan, çözünebilen TGF ß2 reseptörü ile durdurulabilir. Rho-ROCK yolu inhibisyonu, örneğin statinlerle, CTGF salınımını azaltır (Westbury ve ark 2012).
Çalışmaların bazı kısıtlandığı noktalar da olmuştur. Örneğin TGF ß1 ayrıca immünolojik aktivasyon ve epitel proliferasyonu rolleri vardır ve TGF ß1 yolağı sonrası mediatörler, tümör bastırıcılar gibi davranabilir. (Denton ve ark 2007). Ancak geç fazda TGF ß1 inhibisyonu bir pro-metastatik ajan gibi davranır; tümör hücreleri seçici olarak TGF ß ‘nın büyüme önleyici etkisinden kaçabilir; metastaz tetiklenir. Bu nedenle, tümörde radyoterapi ile TGF ß inhibitörlerinin kullanımı tartışmalıdır.(Dechant ve ark 1996).
1.7. Erdostein
Erdostein (N-carboxymethylthioacetyl-homosysteine thiolactone) tiol ajan içeren mukolitik ajan olup, anti –inflamatuar özellikleri ve bakteryal adhezyonu azaltıcı özellikleri bulunmaktadır. (Tunc ve ark 2009, Erdogan ve ark 2006, Balli ve ark 2007). Karaciğerdeki metabolik süreci takiben salınan iki bloke edilmiş sülfhidril grupları içerir. Bloke edilmiş sülfhidril gruplarının serbest radikal temizleyici ve antioksidan aktivitesi vardır. (Wang ve ark 2013).
1.7.1. Erdosteinin yapısı ve etki mekanizması:
Erdostein mukomodülatör, antibakteriyel, antioksidan ve anti-inflamatuar etki gösteren bir ön ilaçtır. Bağırsaklardan emilip dolaşıma geçtikten sonra hepatik dolaşımda üç metabolitine dönüşerek aktif hale geçer.
Mukusun bileşiminde yer alan glikoproteinlerdeki disülfit bağlarını kırarak mukolitik etki gösterir. Mukus üretimi ile viskozitesini düzenleyerek ve mukosiliyer transportu artırarak ekspektorasyonu kolaylaştırır.
Erdostein bakteri fimbriyasındaki disülfit bağını kırarak bakterinin mukozaya adezyonunu önler. Böylece antibiyotiklerle birlikte kullanıldığında sinerjik etki oluşturur.
Erdostein iki bloke edilmiş tiyol grubuna sahiptir. Bu tiyol grupları ile ortamda bulunan serbest oksijen radikallerini inhibe eder.
Glutatyon gibi endojen antioksidanların üretimini artırarak güçlü antioksidan etki gösterir. Ayrıca sürfaktan aktivitesini de artırır. Özellikle sigara içenlerde α1 antitripsin inaktivasyonu, lipit peroksidasyonu ve azalan nötrofil kemotaktik yanıtına karşı koruyucu etkisi ile de antioksidan aktivitesi gösterilmiştir.
1.7.2. Erdosteinin farmakokinetiği
Erdostein oral alımdan sonra hızla absorbe olur.
300 mg’lık uygulamadan Tmax=1.18 ± 0.26 saat sonra plazma doruk konsantrasyonuna (Cmax=1.26 ± 0.23 |ig/mL) ulaşır ve ilk geçiş metabolizmasıyla süratle 1. biyolojik aktif metabolitine (M1) dönüşür.
M1 ise uygulamadan Tmax=1.48 saat sonra Cmax=3.46 |ig/mL’ye ulaşır. Gıdalar emilimini etkilemez.
Dağılım:
Plazma proteinlerine bağlanma oranı % 64,5’dur (% 50–86 arası).Hayvan modellerinde başlıca böbreklere, kemiğe, omuriliğe ve karaciğere dağıldığı gösterilmiştir. Bronkoalveoler lavajda erdostein ve M1’in farmakolojik olarak aktif konsantrasyonları bulunmuştur.
Biyotransformasyon:
Emiliminden sonra süratle karaciğerde ilk geçiş metabolizmasına uğrayarak üç aktif metabolitine dönüşür ve başlangıçta sahip olduğu bloke tiyol grupları serbestleşir. Đlk aktif metaboliti (M1) N-thiodiglycolyl-homocysteine’dir.
Üç aktif metabolitin plazma doruk konsantrasyonuna ulaşması sırası ile M1: Tmax= 1.1 – 2.2 saat
M2: Tmax= 2.5 – 4.6 saat M3: Tmax= 2.3 – 4.8 saat sürer.
Eliminasyon:
Eliminasyon yarılanma ömrü; Erdostein: T1/2 = 1.46 ± 0.6 saat M1: T1/2 = 1.62 ± 0.59 saat olarak ölçülmüştür.
Đdrarda sadece M1 ve sülfatlar bulunur, dışkı ile atılımı ihmal edilebilir düzeydedir. Doğrusallık/doğrusal olmayan durum:
Erdosteinin plazma konsantrasyonu doza bağlı biçimde artış gösterir.M1’in de plazma konsantrasyonu dozla birlikte, ancak değişmemiş erdostein ile doğrusal olmayan şekilde yükselir.
1.7.3. Erdosteinin ile ilgili deneysel çalışmalar
Erdostein içeren deneysel çalışmalarda renal iskemi ve reperfüzyon sonrası böbrek korunmasında, testiste torsiyon ve detorsiyon sonrası ve ekstremitede iskemi reperfüzyonu sonrasında gelişen akciğer hasarının önlenmesinde, barsak
iskemi-reperfüzyonu sonrası hasarın önlenmesinde, akciğer radyoterapisi sonrası hasarın önlenmesinde, radyokontrast madde sonrası testis dokusunun korunmasında kullanılmıştır. (Gazzani ve ark 1989, Sogut ve ark 2004, Sahin ve ark 2006, Balli ve ark 2007, Yilmaz ve ark 2008, Uysal ve ark 2009)
1.8. Đntestinal Toksisitede Radyoterapi-Erdostein Etkileşimi
Bildiğimiz kadarıyla, erdostein ile pelvis radyoterapisi sonrası erken radyasyon enteropatisini koruyucu etkileri henüz araştırılmamıştır.
Bu nedenle, bu çalışmanın amacı, pelvis radyoterapisine bağlı enteropati ve barsak dokusundaki değişiklikleri histolojik inceleme ile ve histokimyasal olarak dokuda fibrozis ile ilişkili olduğu bilinen TGF-ß1 ile, DNA sentezi ve tamiriyle ilişkili olan PCNA(Proliferating Cell Nuclear Antigen) ile (Wang J ve ark 2001), oksidatif DNA hasarı belirteci olan 8-OHdG (8-hidroksi-2'-deoksiguanosin) ile (Leonardi ve ark 1992) ve apoptozisi göstermek amacıyla TUNEL (terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nick end labeling) metodu uygulanarak erdosteinin patogenezde olası rolünü araştırmak ve bu etkiler hakkında erdosteinin önleyici bir rolü olup olmadığını ortaya koymaktır.
Bu çalışma ile pelvis radyoterapisinde erken zamanlı gastrointestinal yan etkileri önleme amaçlı erdostein kullanılabilirliğini göstermek ve etki mekanizmalarını ortaya koymak mümkün olabilir.
2.GEREÇ ve YÖNTEM
Bu çalışmada 400–450 gr ağırlığında, 20-24 haftalık, 36 adet Wistar türü albino sıçanlar kullanılmıştır. 17.04.2013 tarihli toplantı ve 2013–071 karar sayısı ile Necmettin Erbakan Üniversitesi Kombassan Deneysel Tıp Araştırma Ve Uygulama Merkezi Deney Hayvanları Etik Kurulu onayı alınmıştır. Çalışma öncesi sıçanlar dört gruba ayrılmıştır:
Grup 1: Kontrol grubu (N: 8) Grup 2: RT grubu (N: 10)
Grup 3: Sadece Erdostein grubu (N: 8) Grup 4: RT+Erdostein grubu (N: 10)
Hayvanlar Necmettin Erbakan Üniversitesi Kombassan Deneysel Tıp Araştırma Ve Uygulama Merkezi Araştırma ve Yetiştirme Ünitesi’nden sağlanmıştır. Sıçanlar hayvan laboratuarında 20°C oda sıcaklığında ve 12 saat aydınlık-12 saat karanlık olacak bir ortamda barındırılmıştır. Deney süresi boyunca hayvanlar kafeslerinde standart koşullarda dörtlü gruplar halinde tutularak istedikleri miktarda yem ve suya ulaşmaları sağlanmıştır. Ratların çalışmaya başlangıç ağırlıkları kontrol grubunun 390-570 gr; ortalama 466,25 gr, sadece radyoterapi grubunun 400-535 gr; ortalama 459,5 gr, erdostein grubunun 310-450 gr; ortalama 368,75 gr, erdostein ve radyoterapi grubunun 400-560 gr; ortalama 461 gr’dır.
2.1. Radyoterapi Protokolü
Grup-2 ve Grup-4’deki sıçanlara tek doz 12,5 Gy intestinal radyoterapi uygulanmıştır. Hayvanlara radyoterapiden onbeş dakika önce 90 mg/kg ketamin ve 10 mg/kg xylazin intraperitoneal yolla verilerek anestezi sağlanmıştır. Anestezi altındaki sıçanlar supin pozisyonda dört ekstremitesi bantlanarak tespit edilmiştir. Simülasyon yapılarak pelvis alanı hayvanların üzerine işaretlenmiştir. Hayvanların pelvisine Varian marka lineer akseleratör kullanılarak SAD tekniği ile radyoterapi uygulanmıştır. Tedavi, 6 MV foton demetleri ile orta hat derinlikleri kullanılarak ön alandan 5 x 5 cm2 tek ön alandan yapılmıştır. Kontur düzgünlüğünü sağlamak için 1 cm elasto-jel bolus kullanılmıştır. (Uzal C ve ark 2012, Yoon WS ve ark 2012). Radyoterapi uygulaması şekil-2.1’de gösterilmiştir.
Şekil–2.1: Radyoterapi uygulaması simülasyon görüntüsü
Grup-1 ve grup-3’deki sıçanlar aynı dozda ketamin ve xylazin ile uyutularak yalancı (sham) radyoterapi uygulanmıştır.
2.2. Erdostein Tedavi Protokolü
Erdostein (10 mg / kg) (Sandoz, Turkey) pelvis radyoterapi öncesi ağızdan tek kullanımlık şırınga yoluyla 1 gün önce uygulanmaya başlanmıştır ve akut etkiler değerlendirmek için 2 hafta boyunca her gün devam edilmiştir. (Gazzani ve ark 1989, Sogut ve ark 2004, Erdogan ve ark 2006, Balli ve ark 2007, Uysal ve ark 2008) 2 haftada tüm gruplar yüksek doz anestezi verilerek sakrifiye edilmiştir, ince barsak dokuları çıkarılmıştır. Bu süre içerisinde sıçanlar klinik olarak enterit açısından 2–3 gün ara ile muayene edilmiştir. Ratların çalışma sonundaki ağırlıkları kontrol grubunun 380-570 gr; ortalama 466,25, sadece radyoterapi grubunun 390-550 gr; ortalama 457 gr, erdostein grubunun 330-430 gr; ortalama 378,75 gr, erdostein ve radyoterapi grubunun 400-540 gr; ortalama 451 gr’dır.
2.3. Histopatolojik Đnceleme
2 hafta sonunda tüm gruplar yüksek doz anestezi altında sakrifiye edilerek ince barsak dokuları çıkarıldı ve histopatolojik ve immünhistokimyasal olarak incelendi. Alınan ince barsak dokuları %10’luk nötral formaldehit solüsyonunda en az 24 saat süreyle tespit edildi. Rutin histolojik takipleri yapılarak parafin bloklara gömüldü. Parafin bloklardan 5 mikrometre kalınlığında kesitler alındı. Alınan kesitler histopatolojik incelemede iki yöntemle boyandı 1) Hematoksilen ve eozin ile doku bütünlüğünü sağlamak ve artefaktları dışlamak amaçlandı. Hücrede hematoksilen boyası nükleer bileşenleri koyu mavi tonunda ve eozin boyası ise sitoplazmik organelleri pembe tonlarında boyamaktadır. 2) Masson trichrome: ekstrasellüler matriks ve kas dokusunun analizi için kullanıldı. Kollajen liflerini, hücre dışı matriks bileşenlerini mavi, çekirdeği siyah ve kas dokusunu ise kırmızı renkte boyamaktadır.
Barsağın 3 farklı bölümünden alınan parçalar parafin bloklara gömüldü. Her bloktan 5 farklı kesit alındı ve her kesitten de rastgele olmak üzere 5 farklı alan seçildi. Kesitler, ışık mikroskobu altında (Olympus- BX51) histopatolojik olarak değerlendirildi ve görüntüleri (Olympus-DP70) kaydedildi. Işık mikroskobu ile ultrastriktürel incelemede tek kişi tarafından körlemesine çalışıldı.
Histopatolojik değerlendirmede, üç mukozal yapı (yüzey epiteli, bez yapısı ve lamina propria stroması) toplam 9 kategoride değerlendirildi ve sonuçlar 0-4 arasında skorlandı; 0: normal yapı, 1: hafif anormal, 2: orta dereceli anormal, 3: ciddi anormal, 4: aşırı anormal (Hovdenak ve ark 2000, Korkut ve ark 2006).(Tablo-2.1)
Tablo-2.1 Histopatolojik değerlendirme parametreleri
Yüzey epiteli Hücresel yükseklik kaybı / düzleşme
Hücresel inflamatuar infiltrasyon
Bez yapısı Goblet hücre kaybı
Bez atrofisi / distorsiyonu
Kriptit(segmental nötrofillerin kript duvarı boyunca göçü)
Eozinofilik kript apseleri
Lamina propria stroması Đnflamasyon
Ödem
2.4.Đmmunohistokimyasal Đnceleme
Đmmunohistokimyasal inceleme için parafin bloklardan lizinli lamlara 5 mikrometre kalınlığında kesitler alındı. Đmmunohistokimyasal boyamada indirekt yöntem uygulandı ve primer antikorlar olarak; fibrozis ile ilişkili olduğu bilinen TGF-ß1, DNA sentezi ve tamiriyle ilişkili olan PCNA (Proliferating Cell Nuclear Antigen) ile ve oksidatif DNA hasarı belirteci olan 8-OHdG (8-hidroksi-2'-deoksiguanosin) kullanıldı. Ayrıca apoptozisi göstermek amacıyla TUNEL (terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nickend labeling) metodu uygulandı. TUNEL, apoptoziste endonükleaz aktivitesine bağlı DNA fragmantasyonuile oluşan 3'-hidroksi gruplarının tespitine dayalı birmetoddur.
TGF-ß1, PCNA ve 8-OHdG için immunohistokimyasal boyamada; kesitler deparafinizasyon sonrası, ısı-aracılı antijen retrieval işleminden geçirildi. Sonrasında, % 3 H2O2 ile endojen peroksit blokajı yapıldı ve ardından serum blok solüsyonunda
bekletildi. Daha sonra, primer antikorlarda oda ısısında bir gece boyunca bekletildi ve ardından, sekonder antikor ve enzim konjugatla muamele edilerek, kromojen ile boyandı. Boyama basamakları arasında kesitler, PBS solüsyonu ile yıkandı. Son olarak, kesitler hematoksilen boyası ile zıt boyamaya tabi tutuldu ve kapatma medyumu ile kapatıldı. Işık mikroskobu altında değerlendirilen kesitlerde apoptotik index belirlendi (Apoptotik index: Apoptotik hücre / Total hücre).
TGF-ß1, PCNA ve 8-OHdG ile boyanmanın sonuçları, ışık mikroskobu altında bağımsız iki gözlemci tarafından değerlendirildi. TGF-ß1 ve 8-OHdG için antikor ekspresyonları boyanmanın yaygınlığına göre 4 gruba ayrılarak skorlandı; Negatif: Hiç boyanma yok, 1+ : Zayıf boyanma var, 2+ : Orta derecede boyanma var, 3+ : Kuvvetli boyanma var. PCNA için mitotik index belirlendi (Mitotik index: PCNA pozitif hücre / Total hücre).
TUNEL metodunda, kesitler protokole uygun olarak boyandı. Zıt boyama hematoksilen ile yapıldı ve kesitler kapatma medyumu ile kapatıldı. Işık mikroskobu altında bağımsız iki gözlemci tarafından değerlendirilen kesitlerde apoptotik index belirlendi (Apoptotik index: Apoptotik hücre / Total hücre).
Ortalama antikor ekspresyonları, apoptotik index ve mitotik index deney grupları arasında istatistiksel olarak karşılaştırıldı.
2.5 Đstatiksel Analiz
Đstatiksel analizde One Way Anova (tek yönlü varyans analizi) testi kullanılmış ve gruplar arasındaki farkı belirleyebilmek için tukey testi kullanılarak anlamlılık p<0.05 alınmıştır. Verilerin değerlendirilmesinde ve hesaplanmış değerlerin bulunmasında SPSS v.16.0 paket programı kullanılmıştır.
3.BULGULAR
Grupların hiçbirinde 14 günlük süre içerisinde ölüme bağlı kayıp gözlenmemiştir. Tüm örnekler aynı mikroskobik prosedürle incelenmiştir. Ratların çalışmaya başlangıç ağırlıkları kontrol grubunun 390-570 gr; ortalama 466,25 gr, sadece radyoterapi grubunun 400-535 gr; ortalama 459,5 gr, erdostein grubunun 310-450 gr; ortalama 368,75 gr, erdostein ve radyoterapi grubunun 400-560 gr; ortalama 461 gr’dır. Ratların çalışma sonunda ağırlıkları kontrol grubunun 380-570 gr; ortalama 466,25, sadece radyoterapi grubunun 390-550 gr; ortalama 457 gr, erdostein grubunun 330-430 gr; ortalama 378,75 gr, erdostein ve radyoterapi grubunun 400-540 gr; ortalama 451 gr’dır. Gruplarda çalışma başlangıcına göre ağırlıklarında anlamlı bir farklılık bulunmamıştır.
3.1. Histopatolojik Bulgular
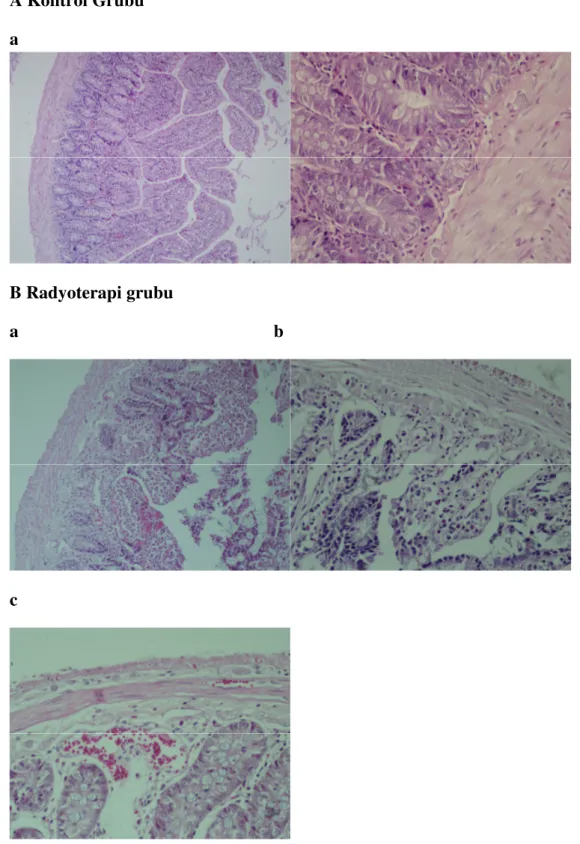
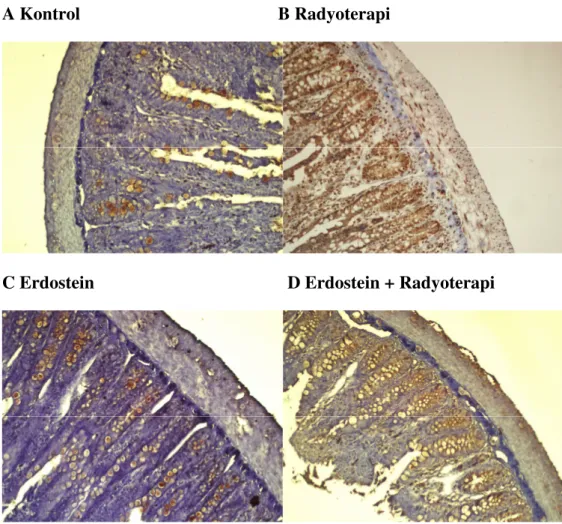
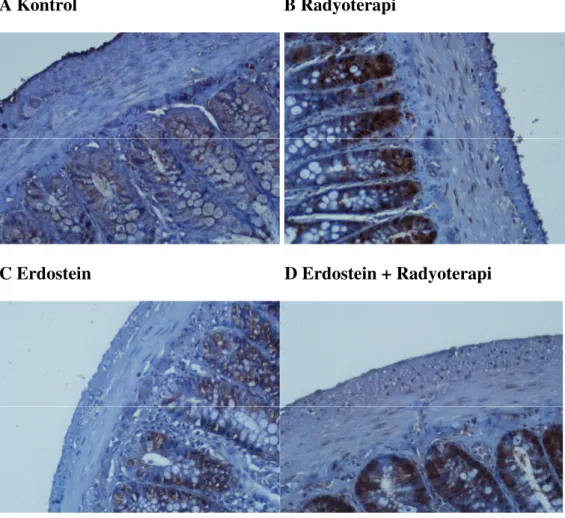
Kontrol grubunda ince barsak dokuları, normal epitel yapısında ve bez yapıları düzenli morfolojide görülmüştür (Şekil 3.1.1 A). Radyoterapi grubunda, kontrol ve erdostein grubuyla karşılaştırıldığında incebarsağın yüzey epiteli ve bez yapılarında önemli ölçüde bozulma olduğu tespit edilmiştir (her ikisi için p<0.001). Radyoterapi grubunda yüzey epitelinde belirgin düzleşme ve deskuamasyon, lökosit infiltrasyonu, kriptlerde belirgin distorsiyon ve atrofi, kript epitelinde lökosit infiltrasyonu (kriptit) ve eozinofilik kript abseleri, goblet hücrelerinin kaybı, lamina propriada belirgin lökosit - özellikle eozinofil infiltrasyonu, ödem ve kan damarlarının konjesyonu dikkati çekmektedir.(Şekil 3.1.1 B) Erdostein + radyoterapi grubunda, epitel ve bez yapılarındaki bu değişiklikler(Şekil 3.1.1 D), radyoterapi grubuna göre önemli ölçüde azalmıştır, histopatolojik skor, istatistiksel olarak anlamlı derecede düşüktür (p<0.001). Erdostein + radyoterapi grubunda skor, kontrol grubuna göre anlamlı derecede yüksektir (p<0.001).
A Kontrol Grubu
a b
B Radyoterapi grubu
a b
c
Şekil 3.1.1: Đncebarsağın histopatolojik bulguları, HE boyası A: Kontrol grubu; normal epitel (a, X200) ve bez yapıları (b, X400) görülmektedir. B: Radyoterapi grubu; yüzey epitelinde belirgin düzleşme, bezlerde belirgin distorsiyon ve atrofi (a, X200), goblet hücre kaybı, lökosit infiltrasyonu ve eozinofilik kript abseleri (b, X400), lamina propriada ödem ve kan damarı konjesyonu (c, X400) izlenmektedir.
C Erdostein D Erdostein + Radyoterapi
Şekil 3.1.1 (devamı): Đncebarsağın histopatolojik bulguları, HE boyası C: Erdostein grubu; normal epitel ve bez yapıları görülmektedir (X200) D: Erdostein + radyoterapi grubu; epitel ve bez yapılarında belirgin düzelme görülmektedir (X200). Tablo 3.1:Barsak histolojik parametre ortalaması
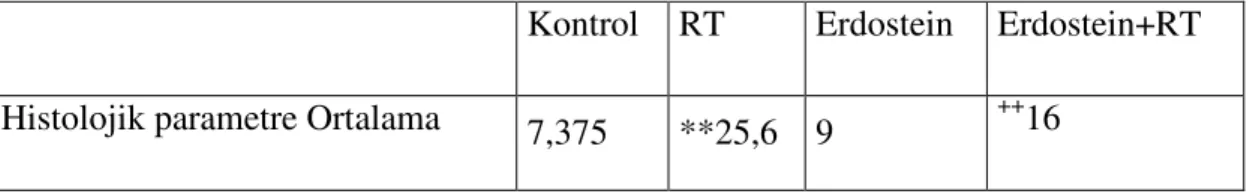
Kontrol RT Erdostein Erdostein+RT Histolojik parametre Ortalama 7,375 **25,6 9 ++16
** p<0.001, sadece RT grubu, kontrol grubu ile karşılaştırıldığında ++ p<0.001, sadece RT grubu ile karşılaştırıldığında. (RT:Radyoterapi)
Grafik 3.1:Barsak histolojik karşılaştırma
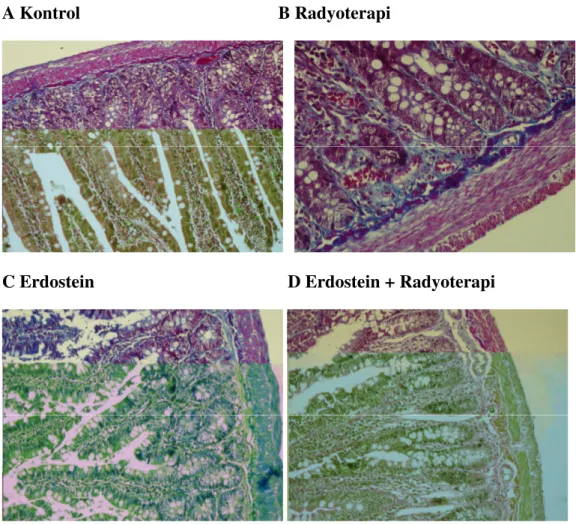
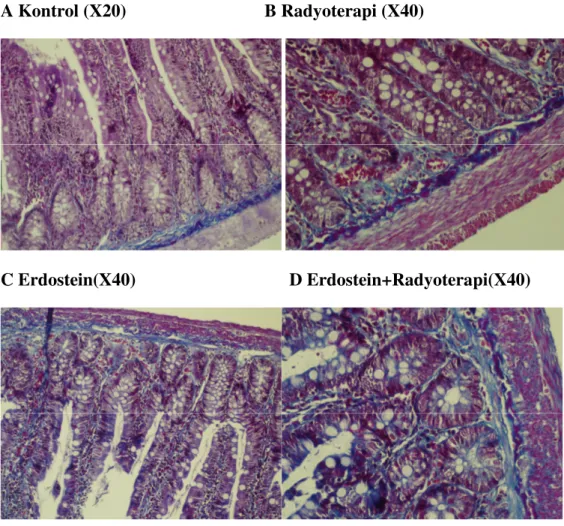
Masson Trichrome boyamada kontrol grubunda ve erdostein grubunda normal kollajen lif dağılımı görüldü. Radyoterapi grubunda; lamina propria ve submukozada kollajen liflerin arttığı izlendi. Erdostein + radyoterapi grubunda ise kollajen liflerin radyoterapi grubuna göre azaldığı görüldü.(şekil 3.1.2) Aynı zamanda erdostein uygulanan radyoterapi grubunda kollajen içeriğinde önemli ölçüde azalma ve ışınlanmamış kontrol grubundan farklı olmadığı görülmüştür.(Şekil 3.1.3)
A Kontrol B Radyoterapi
C Erdostein D Erdostein + Radyoterapi
Şekil 3.1.2: Masson Trichrome boyama; kollajen lifler mavi, kas dokusu kırmızı, çekirdekler ise siyah renkte izlenmektedir. A: Kontrol grubu; normal kollajen lif dağılımı görülmektedir (X200). B: Radyoterapi grubu; lamina propria ve submukozada kollajen liflerin arttığı izlenmektedir (X400). C: Erdostein grubu; normal kollajen lif dağılımı görülmektedir (X200) D: Erdostein + radyoterapi grubu; kollajen liflerin radyoterapi grubuna göre azaldığı dikkati çekmektedir (X200).
A Kontrol (X20) B Radyoterapi (X40)
C Erdostein(X40) D Erdostein+Radyoterapi(X40)
Şekil 3.1.3:Kollajen içeriği.
3.2.Đmmunohistokimyasal Bulgular 3.2.1. TGF-ß1 Ekspresyonu
TGF-ß1 Ekspresyonu antikor ekspresyonları boyanmanın yaygınlığına göre 4 gruba ayrılarak skorlandı; Negatif: Hiç boyanma yok, 1+ : Zayıf boyanma var, 2+ : Orta derecede boyanma var, 3+ : Kuvvetli boyanma var. Đncebarsağın yüzey ve bez epitelinde ve kas tabakasında gruplar arasında TGF-ß1 ekspresyonu açısından anlamlı derecede fark gözlenmedi (p>0.05). (Şekil 3.2.1’de gruplardaki immünhistokimyasal boyama örnekleri gösterilmiştir. Grafik 3.2.1 ve Grafik 3.2.2’de sırasıyla epitel ve kas dokusundaki ekspresyonlar gösterilmiştir. Tablo 3.2.1’de epitel ve kas dokusundaki ortalama değerler verilmiştir)
A Kontrol B Radyoterapi
C Erdostein D Erdostein + Radyoterapi
Şekil 3.2.1: Đmmunohistokimyasal boyama; incebarsakta TGF-ß1 ekspresyonu (X200) A: Kontrol grubu; epitel ve kas dokusunda düşük oranda ekspresyon görülmektedir. B: Radyoterapi grubu; epitel ve kas dokusunda ekspresyonun arttığı izlenmektedir. C: Erdostein grubu; ekspresyon azdır. D: Erdostein + radyoterapi grubu; ekspresyonun radyoterapi grubuna göre azaldığı görülmektedir.
Grafik 3.2.1:Barsak epitelinde TGF-ß1 düzeyleri
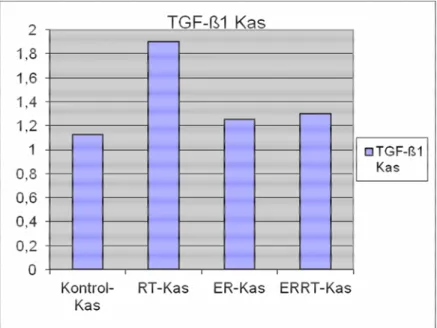
Grafik 3.2.2:Barsak kas tabakasında TGF-ß1 düzeyleri
3.2.2. 8-OHdG Ekspresyonu
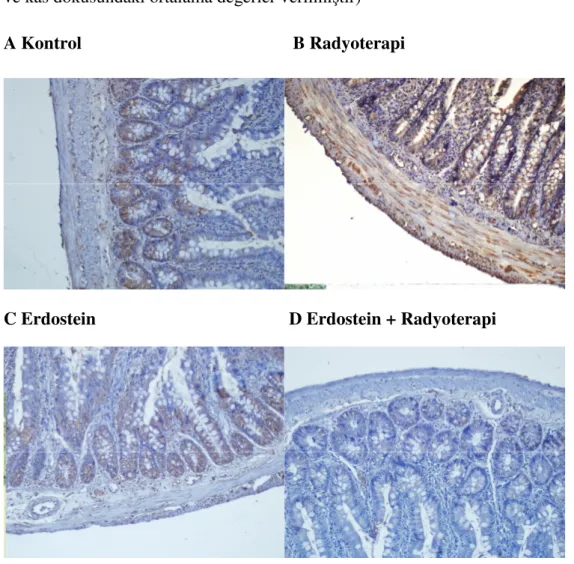
8-OHdG için antikor ekspresyonları boyanmanın yaygınlığına göre 4 gruba ayrılarak skorlandı; Negatif: Hiç boyanma yok, 1+ : Zayıf boyanma var, 2+ : Orta derecede boyanma var, 3+ : Kuvvetli boyanma var. Đncebarsağın yüzey ve bez epitelinde ve kas tabakasında 8-OHdG ekspresyonunun kontrol ve radyoterapi grubu karşılaştırıldığında anlamlı bir fark gözlenmedi.(p>0.05). Erdostein ve erdostein + radyoterapi grubunda, radyoterapi grubuna göre anlamlı derecede azaldığı gözlendi,
(her ikisi için de p<0.001). Erdostein ve erdostein + radyoterapi grubu karşılaştırıldığında anlamlı bir fark gözlenmedi.(p>0.05).(Şekil 3.2.2’de gruplardaki immünhistokimyasal boyama örnekleri gösterilmiştir. Grafik 3.2.3 ve Grafik 3.2.4’de sırasıyla epitel ve kas dokusundaki ekspresyonlar gösterilmiştir. Tablo 3.2.1’de epitel ve kas dokusundaki ortalama değerler verilmiştir)
A Kontrol B Radyoterapi
C Erdostein D Erdostein + Radyoterapi
Şekil 3.2.2: Đmmunohistokimyasal boyama; incebarsakta 8-OHdG ekspresyonu (X200) A: Kontrol grubu; epitel ve kas dokusunda düşük oranda ekspresyon görülmektedir. B: Radyoterapi grubu; epitel ve kas dokusunda ekspresyonun belirgin oranda arttığı görülmektedir. C: Erdostein grubu; ekspresyonun kontrol grubundan daha az olduğu izlenmektedir. D: Erdostein + radyoterapi grubu; ekspresyonun oldukça azaldığı gözlenmektedir.
Grafik 3.2.3:Barsak epitelinde 8-OHdG düzeyleri
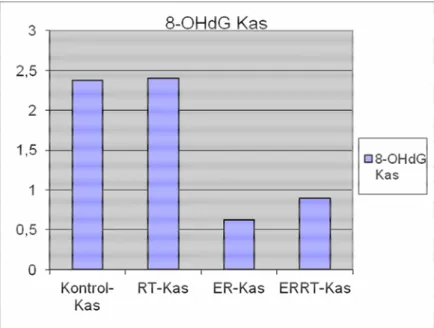
Grafik 3.2.4:Barsak kas tabakasında 8-OHdG düzeyleri
3.2.3. Mitotik Đndeks (PCNA)
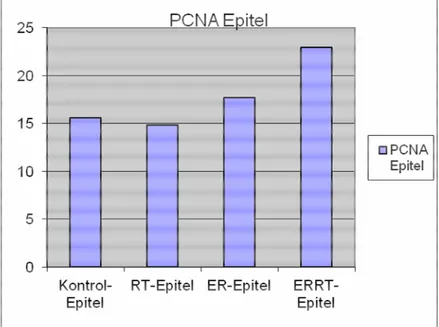
PCNA için mitotik index belirlendi (Mitotik index: PCNA pozitif hücre / Total hücre). Đncebarsağın yüzey ve bez epitelinde kontrol ve radyoterapi grupları arasında mitotik indeks açısından herhangi bir farklılık görülmedi. Erdostein + radyoterapi grubunda ise, radyoterapi grubuna göre artış izlendi (p=0.018). Kas dokusunda ise, radyoterapi grubunda kontrol grubuna göre mitotik indeksin belirgin olarak arttığı tespit edildi (p<0.001). Erdostein + radyoterapi grubunda ise
radyoterapi grubuna göre bir azalma görüldü ancak fark istatistiksel olarak anlamlı değildi (p>0.05)(Şekil 3.2.3’de gruplardaki immünhistokimyasal boyama örnekleri gösterilmiştir. Grafik 3.2.5 ve Grafik 3.2.6’de sırasıyla epitel ve kas dokusundaki ekspresyonlar gösterilmiştir. Tablo 3.2.1’de epitel ve kas dokusundaki ortalama değerler verilmiştir)
A Kontrol B Radyoterapi
C Erdostein D Erdostein + Radyoterapi
Şekil 3.2.3: Đmmunohistokimyasal boyama; incebarsakta PCNA boyama A: Kontrol grubu; az sayıda PCNA-pozitif epitel hücreleri görülmektedir, PCNA-pozitif düz kas hücreleri izlenmemektedir (X400). B: Radyoterapi grubu; epitel ve kas dokusunda PCNA-pozitif hücrelerin belirgin oranda arttığı izlenmektedir (X400). C: Erdostein grubu; epitel ve kas dokusunda artmış PCNA-pozitif hücreler görülmektedir (X400). D: Erdostein + radyoterapi grubu; epitel dokusunda PCNA-pozitif hücrelerin arttığı, kas dokusunda ise PCNA-pozitif hücrelerin radyoterapi grubuna göre azaldığı gözlenmektedir (X400).
Grafik 3.2.5: Barsak epitelinde PCNA düzeyleri (PCNA pozitif hücre / total hücre (%) - Mitotik index)
Grafik 3.2.6: Barsak kas tabakasında PCNA düzeyleri (PCNA pozitif hücre / total hücre (%) - Mitotik index)
3.2.4. Apoptotik Đndeks
Apoptotik indeks, TUNEL metodunda, kesitler protokole uygun olarak boyandı. (Apoptotik indeks: Apoptotik hücre / Total hücre). Apoptotik indeksin, incebarsağın epitel ve kas dokularının her ikisi için de radyoterapi grubunda kontrol grubuna göre belirgin olarak arttığı gözlendi (sırasıyla p<0.001 ve p=0.006). Erdostein + radyoterapi grubunda ise radyoterapi grubuna göre belirgin bir azalma tespit edildi (her iki doku için; p<0,001). Erdostein ve radyoterapi grubunda indeks, kontrol grubuyla benzerdi.(p>0.05) (Şekil 3.2.4’de gruplardaki immünhistokimyasal boyama örnekleri gösterilmiştir. Grafik 3.2.7 ve Grafik 3.2.8’de sırasıyla epitel ve kas dokusundaki ekspresyonlar gösterilmiştir. Tablo 3.2.1’de epitel ve kas dokusundaki ortalama değerler verilmiştir)
Şekil 3.2.4: Đmmunohistokimyasal boyama; incebarsakta TUNEL boyama (X400). A: Kontrol grubu; epitel dokusunda çok az sayıda TUNEL-pozitif hücre görülmektedir (ok), kas dokusunda TUNEL-pozitif hücre izlenmemektedir. B: Radyoterapi grubu; bez epitelinde (a), villus epitelinde (b) ve kas dokusunda (c) TUNEL-pozitif hücrelerin arttığı görülmektedir (oklar). C: Erdostein grubu; az sayıda TUNEL-pozitif hücre görülmektedir (ok). D: Erdostein + radyoterapi grubu; TUNEL-pozitif hücre izlenmemektedir.
Grafik 3.2.7: Barsak epitelinde Apopitozis düzeyleri
Tablo 3.2.1:Barsak epitelinde ve kas tabakasında ortalama TGF-ß1, PCNA, 8-OHdG ve apopitozis düzeyleri
Kontrol RT Erdostein Erdostein+RT
TGF-ß1 Epitel Ortalama 1,63 1,30 1,88 1,80
TGF-ß1 Kas Ortalama 1,13 1,90 1,25 1,30
8-OHdG Epitel Ortalama 1,88 2,60 § 0,88 ++ 0,90 8-OHdG Kas Ortalama 2,38 2,40 §§ 0,63 ++ 0,90 PCNA Epitel Ortalama 15,59 14,85 17,69 + 22,93
PCNA Kas Ortalama 3,70 ** 18,71 6,77 14,06
Apopitozis Epitel Ortalama 1,55 **5,07 1,47 + + 0,68 Apopitozis Kas Ortalama 1,86 *5,22 1,89 ++ 0,57
* p=0.006 sadece RT grubu, kontrol grubu ile karşılaştırıldığında,** p <0.001, sadece RT grubu, kontrol grubu ile karşılaştırıldığında, + p=0.018 sadece RT grubu ile karşılaştırıldığında ++ p <0.001, sadece RT grubu ile karşılaştırıldığında. (RT: Radyoterapi) § p=0.031 kontrol grubuyla karşılaştırıldığında §§ p<0.001 kontrol grubuyla karşılaştırıldığında
4.TARTIŞMA
Eksternal radyoterapi kanser tedavilerinde geniş yer alan ortak bir tedavi yöntemidir. Radyasyon etkilerine en hassas organ kemik iliği olmakla birlikte GĐS ikinci sırada gelmektedir. Gastrointestinal radyasyon hasarı iki ana nedenden dolayı önemli bir sorundur. Birincisi, morbiditeye bağlı önemli bir ekonomik yük (Sher 2010) ve hastaların yaşam kalitesinde önemli bir azalmaya neden olur (Bacon 2001, Bacon 2002). Đkinci olarak radyoterapide gastrointestinal normal doku tolerans dozu, kanseri kontrol etmek için kullanılan radyasyon dozunu sınırlar. Gastrointestinal radyasyon hasarının neden olduğu ishale bağlı akut sıvı ve elektrolit kayıpları giderilmezse hasta yaşamını tehdit edebilir (Slesinger ve Fordtran 1989). Bu geniş ve bazı durumlarda yaşamı tehdit eden veya radyoterapi uygulamasını en azından geciktiren veya mümkün kılmayan yan etkilerin değerlendirilmesi büyük önem taşımaktadır. Bu bağlamda radyoterapiye bağlı toksisite açısından teknik stratejileri kullanarak fiziksel olarak normal dokulardan radyasyon dozunu uzaklaştırmanın yanında, biyolojik stratejiler yoluyla iyonize radyasyonun hücresel ve doku yanıtınının düzenlenmesi büyük önem taşımaktadır.(Shadad ve ark 2013).
Histopatolojik incelemede antioksidan, anti-inflamatuar ve proliferatif etkileri olan erdostein ve radyoterapi verilen grupta; sadece radyoterapi uygulanan gruba göre hasar daha az gözlenmiştir ve istatiksel olarak anlamlıdır(p<0.001). Bu sonuç, erken fazda radyoterapi yan etkilerini azaltmakta kullanılan diğer ajanlarla benzer sonuçlar vermiştir. Erdostein + radyoterapi grubunda skor, kontrol grubuna göre yüksektir (p<0.001). Bu durum radyoterapinin hasar düzeyini azalttığı; fakat normal doku düzeyine getiremediğini göstermektedir.(Akpolat M ve ark 2009, Yoon ve ark 2011, Uzal C ve ark 2012)
Epitel ve kas dokusunda TGF-ß1 ekspresyonu açısından gruplar arasında anlamlı derecede fark görülmemesi erken fazda fibrozis belirteci olan TGF-ß1’in kullandığımız yöntemle gösterilemediğini düşündürmektedir. Martin ve ark.’ının TGF-ß1 ve fibrozis üzerine yaptığı derlemesinde, incelediği deneysel çalışmalarında ratların barsaklarına 5.2 Gy ile 9 fraksiyonda radyoterapi uygulanmıştır. 24.saat, 14.gün ve 26.haftada TGF-ß1’in ekspresyonunun arttığı immünhistokimya ile gösterilmiştir.(Martin M ve ark 2000) Bu derlemeyle beraber değerlendirildiğinde bizim çalışmamızda fark görülmemesi kullandığımız yöntemin yetersiz kaldığına bağlanabilir.
Đncebarsağın yüzey ve bez epitelinde ve kas tabakasında 8-OHdG ekspresyonunun kontrol ve radyoterapi grubu karşılaştırıldığında anlamlı bir fark gözlenmedi.(p>0.05). Erdostein ve erdostein+radyoterapi grubunda, radyoterapi grubuna göre anlamlı derecede azaldığı gözlendi (her ikisi için de p<0.001). Erdostein ve erdostein+radyoterapi grubu karşılaştırıldığında anlamlı bir fark gözlenmedi.(p>0.05).
Bu sonuç Toklu ve ark.’ının yaptığı nar kabuğu ekstresinin enterit ve lökosit apopitozisini engellediğini savunduğu deneysel hayvan çalışmasıyla karşılaştırıldığında kullandığımız metoda bağlı 8-OHdG ekspresyonunu gösteremediğimizi düşündürmektedir. Bu çalışmada ratlara 8 Gy tüm vücut radyoterapisinden 10 gün önce ve 10 gün sonra nar kabuğu ekstresi verilmiştir. Sonrasında da plazma ve ileum dokuları incelenmiştir. Plazmada 8-hidroksi-2'-deoksiguanosin (8-OHdG) (oksidatif DNA hasarı işareti) ELISA yöntemiyle belirlenmiş ve total antioksidan kapasiteye kalorimetrik test sistemiyle bakılmıştır. Radyasyona bağlı glutatyon ve total anti-oksidan kapasitesinin düştüğü, malondialdahid seviyelerinin, myeloperoksidaz aktivitesinin, 8-OHdG kontrol grubuna göre anlamlı derecede (p<0.001) arttığı bulunmuştur. Benzer olarak pro-inflamatur sitokinlerin (TNF-α, IL–1β ve IL–6) arttığı bulunmuştur. Nar kabuğu ekstresinin biyokimyasal değişiklikleri, lökosit apopitozisini ve hücre ölümünü azalttığı görülmüştür. Nar kabuğu ekstresinin barsak dokusundaki bu koruyucu etkileri reaktif oksijen metabolitlerinin azalması ve antioksidan mekanizmaların artışına bağlanmıştır. (Toklu ve ark 2009).Bu çalışmada savunulan oksidatif DNA işaretleyici 8-OHdG azalırsa, total antioksidan kapasite önemli ölçüde artar görüşüne göre; erdostein, 8-OHdG’yi azaltarak anti-oksidan kapasiteyi arttırmaktadır. Erdostein, kontrol ve sadece radyoterapi grubuyla karşılaştırıldığında 8-OHdG düzeyindeki yükselmeyi azaltır ve total antioksidan kapasitedeki azalma engellenmiş olur. Bu sonuç radyoterapinin mukozit yan etkilerinde erdosteinin antioksidan etkisiyle kullanılabilirliğini güçlendirmektedir.
Đncebarsağın yüzey ve bez epitelinde radyoterapi, kontrol grubuna göre anlamlı olmayacak düzeyde mitotik indeksi (PCNA) azaltmıştır. Erdostein + radyoterapi grubunda ise, radyoterapi grubuna göre artış izlendi (p=0.018). Kas dokusunda ise, radyoterapi grubunda kontrol grubuna göre mitotik indeksin belirgin olarak arttığı tespit edildi (p<0.001). Erdostein + radyoterapi grubunda ise radyoterapi grubuna göre bir azalma görüldü ancak fark istatistiksel olarak anlamlı
değildi (p>0.05) Bu sonuç Wang J ve ark.’ının yaptığı çalışmayla beraber değerlendirilirse, bu çalışmada da PCNA açısından anlamlı bir fark bulunamamıştı. Çalışmanın tartışmasında epitelde PCNA azalırsa, barsak dokusunun radyoterapiye bağlı duyarlılığı azalır ve mukozit yan etkisi daha az olur, ama çok azalması hasar iyileşmesini azaltır görüşü savunulmuştur.(Wang J ve ark 2001). Bizim sonuçlarımızda da erdostein yüzey epitelinde villüs proliferasyonunu arttırdığını ve doku sağlamlığını ve hasar iyileşmesini arttırdığı lehine yorumlanabilir
Apoptotik indeksin, incebarsağın epitel ve kas dokularının her ikisi için de radyoterapi grubunda kontrol grubuna göre belirgin olarak arttığı gözlendi (sırasıyla p<0.001 ve p=0.006). Erdostein + radyoterapi grubunda ise radyoterapi grubuna göre belirgin bir azalma tespit edildi (her iki doku için; p<0,001). Erdostein ve radyoterapi grubunda indeks, kontrol grubuyla benzerdi.(p>0.05). Bu sonuç radyoterapinin apoptotik indeksteki artışı, erdosteininin normal doku düzeyine getirerek; radyoterapinin apopitozis etkilerini azalttığını göstermektedir. Bu çalışmada dikkat çeken başka bir husus da radyoterapi grubunda kas tabakasının dış tabakasında apopitozis daha fazla gözlendiğiydi. Bu sonuç Ikeda ve ark.’ının intestinal iskemide apopitozise baktığı çalışmayla karşılaştırıldığında, kas tabakasının dış tabakasında damarlanma yapısı daha az olduğu için apopitozis daha fazla görülmesiyle uyumlu bulunmuştur.(Ikeda H ve ark 1998)
Başka benzer çalışmalara baktığımızda glutamin, radyasyona bağlı normal doku hasarının önlenmesinde birçok çalışmada kullanılmıştır. L- glutamin aminoasidi içerikli beslenme desteğinin radyoterapi uygulanmış ratlarda kolon duvarı mukozasında etkili olduğu görülmüştür (Diestel ve ark 2007). Aynı zamanda akciğer kanserli hastalarda glutamin desteğinin özofajiti koruyabileceği bulunmuştur (Topkan ve ark 2009). Rocha ve ark’ının yaptığı bir çalışmada radyasyona bağlı ratlarda oluşan mesane toksisitesinin engellenmesinde ve kollajen yoğunluğunun düzenlenmesinde glutamin incelenmiştir. Glutamin kullanımında ekstrasellüler matriks yüzdesinin daha düşük oranda azaldığı ama kas yüzdesindeki azalımı engelleyemediği bulunmuştur. (Rocha ve ark 2011).
Wang J ve ark.’ının yaptığı bir çalışmada somatostatin analogu octreotidin barsak radyoterapisi sonrası erken (2.haftada) ve geç fazda (26.haftada) koruyucu etkisine bakılmıştır. Bu çalışmada barsağın 4 cm’lik segmenti skrotal herni içine
yerleştirilmiş ve günlük 4.2 Gy dozla, hafta sonu ara verilmeksizin 16 gün fraksiyone radyoterapi uygulanmıştır. Radyoterapiden 2 gün önce başlanarak toplam 4 hafta boyunca 2 µg/kg/saat ve 10 µg/kg/saat deri altı pompalarla octreotid verilmiştir. Epitel ve düz kas hücresi çoğalması PCNA ile değerlendirilmiş, bağ doku mast hücresi hiperplazisine bakılmış, TGF- β1 ve kollajen düzeyleri değerlendirilmiştir. Oktreotid erken ve geç fazda doz bağımlı olarak doku hasarını engellediği bulunmuştur. Kronik fazda TGF- β, kollajen I ve kollajen III yükselişlerini azaltmıştır. Fakat oktreotidin TGF- β1 mRNA seviyelerini, mast hücre hiperplazisini ve düz kas hücre çoğalması(PCNA) üzerinde anlamlı bir fark bulunamamıştır.
(Wang J ve ark 2001)
Akpolat ve ark curcumin kullandığı hayvan çalışmasında 5 Gy sonrası dördüncü günde ileal hasarı görmüşlerdir. (Akpolat ve ark 2008) Korkut ve ark amifostinin kullanıldığı, histolojik karşılaştırmanın yapıldığı hayvan çalışmasında rektal proktit dozunun eşdeğerini 17,5 Gy olarak ve en iyi ikinci haftada değerlendirmiştir. (Northway ve ark 1988,Kan ve ark 2000, Korkut ve ark 2006). Sitokinler açısından da dokusal sitokinlerden IL–1β, IL–2, IL–6 ve IL–8 ‘in radyasyona bağlı rektal proktitte arttığı bulunmuştur. (Stein ve Hanauer 1999, Korkut ve ark 2006).
Caloğlu ve ark’ının yaptığı amifostin ve L-carnitin karşılaştırmasında 20 Gy pelvis radyoterapi sonrası 5.günde ince barsakta histolojik inceleme yapmışlardır. Çalışmanın sonucunda L-carnitin’in, amifostin kadar radyoterapinin yan etkisini azaltmada etkili olmadığı görülmüştür.(Caloglu ve ark 2012)
Dinçbaş ve ark’ının amifostin (S – 2 – 3 - Aminopropylamino ethylphosphorothioic acid) ve gemsitabin ile yaptığı 5x5 Gy/günlük fraksiyonun verildiği hayvan çalışmasında, idrar kesesi ve barsaklar dördüncü haftada incelenmiştir. Bu çalışmanın tartışmasında daha iyi fibrozis için uygun zamanın 20 -24. haftada görülebileceği önerilmiştir. (Dincbas ve ark 2009)
Granulosit koloni uyarıcı faktör (G-CSF) ün kullanıldığı hayvan çalışmasında 12 Gy yarım tüm vücut radyoterapi sonrası 84.saatte barsak incelemesi yapılmıştır. (Kim ve ark 2012). Bu çalışmanın tartışmasında doza bağlı olarak yaşam süresinin kısaldığı tartışılmıştır. Örneğin bir hayvan çalışmasında 14,7 Gy (10% barsağa bağlı ölüm) ve 12 gün sonra ölüm (ortalama değer), 17.95 Gy (90% barsağa bağlı ölüm) 8 gün sonra ölüm görülmüştür.(Mason ve ark 1988; Rotolo ve ark 2009). Başka bir çalışmada 13,5 Gy ile tüm C3H/ HeN sıçanları mice gastrointestinal nedenle beşinci
günde ölürken, radyasyon etkisini azaltan bir ajan olan FGF-2 ile yaşam süresi %50 artarak 11 gün olmuştur.(Zhang ve ark 2010). Đlerleyen çalışmalarda C3H/HeN sıçanları 12 Gy ile pelvis ışınlaması sonrası 9.günde ölümler başlamış, %50’si 10.günde ölmüş ve 14.günde hepsi ölmüştür. G-CSF ile yapılan çalışmada hiçbir rat 10.günden önce ölmemiş ve %53’ü 14 gün yaşamıştır. (Kim ve ark 2012)
Triphala isimli Hindistan’da alternatif tıpta kullanılan bir ilaçla yapılan hayvan çalışmasında en uygun doz olarak 12.5 Gy doz brakiterapi ile 11.günde rektal mukoza incelenmiştir. (Yoon WS ve ark 2011)
Proteazla aktive olmuş reseptör -1 inhibitörünün kullanıldığı hayvan çalışmasında skrotal herni boşluğuna 4 cm’lik barsak segmenti konulmuş ve 5 Gy/günden 9 fraksiyon radyoterapi uygulanarak, ikinci haftada ince barsak dokusu incelenmiştir. (Wang ve ark 2013)
Erdostein 100 mg/kg dozda oral gavaj yoluyla uygulandığı hayvan çalışmasında geçici iskemi üzerine erdosteinin etkilerine bakılmıştır. Đskemi öncesi
gün başlanarak, deney bitimi olan sonraki 3 gün boyunca uygulandığı çalışmada,
intestinal iskemi ve reperfüzyonu sonucu oluşan malondialdehid (MDA), protein karbonil kontent (PCC) ve NOx seviyelerinin kontrol grubuna göre azalmış olduğu ve antioksidan enzim seviyelerinin, bizim çalışmamızla da uyumlu olarak, arttığı görülmüştür. Histolojik olarak da kontrol grubuna göre daha az hasar görülmüştür. MDA, reaktif nitrojen ve/veya reaktif oksijen sonucu oluşan lipid peroksidasyon son ürünüdür. PCC reaktif nitrojen ve/veya reaktif oksijenin proteinle karşılaşması
sonucu oluşur ve protein oksidasyonunu gösterir. (Tunc T ve ark 2009). Ratta
bacakta iskemi-reperfüzyon sonrası pankreas hasarının incelendiği başka bir çalışmada da 150 mg/kg erdostein 3 gün önceden ağız yoluyla verilmiş ve oksidatif stresin etkilerini ve histolojik hasarı azalttığı bulunmuştur. (Kockar MC ve ark 2012)
Sisplatinin oluşturduğu nefrotoksisite hasarı üzerine erdosteinin 10 mg/kg distile su ve NaHCO3 kullanılarak hazırlandığı, 1 gün öncesinde başlanarak sakrifiye
edilme günü olan 5 gün boyunca şırıngayla ağız yoluyla verildiği bir hayvan çalışmasında akut renal hasara neden olan glukoz metabolizması üzerine koruyucu etkileri olduğu bulunmuştur. (Yilmaz HR ve ark 2004). Benzer bir çalışmada da radyo kontrast maddenin testiste oksidatif stres üzerine, erdosteinin koruyuculuğunun araştırıldığı bir hayvan çalışmasında, erdosteinin 25 mg/kg distile su ve NaHCO3
kullanılarak hazırlanmıştır. 1 gün öncesinde başlanarak sakrifiye edilme günü olan 1. gün boyunca şırıngayla ağız yoluyla verilmiştir. Oksidasyon belirteci olan katalaz
enziminde ve histolojik incelemede sadece radyo kontrast madde enjeksiyonu yapılan grupla anlamlı bir farklılık bulunmamıştır. (Yilmaz HR ve ark 2008).
Radyoterapiye bağlı toksisitede patolojik değişimin erken inflamatuar fazın ardından geç stromal değişim olduğu gözlemlenmiştir. Bu yüzden erken zamanlı çalışmalarda geç oluşan fibrozis yerine, erken oluşan inflamasyon fazına bakılmıştır. (Rocha ve ark 2011).
5.SONUÇ VE ÖNERĐLER
Radyasyona maruziyetten sonra oluşan kronik faz, submukozal damarların inflamasyonu, daralması ve tıkanması sonucunda hasarlanmasıyla ilişkilidir. Bu çalışma kronik yan etkilerin derecesinin, akut bulgularla bağlantılı hipotezi üzerine kurulmuştur. Çünkü dokuların erken zamanlı iyonize radyasyona yanıtı sonraki inflamatuar olaylara dokuları daha duyarlı hale getirir.Bu nedenle, radyasyona bağlı oksidatif hasar düzeltilerek, erken zamanlı radyasyon hasarından bağırsağı korumak büyük önem taşımaktadır.
Radyoterapi abdominopelvik tümörlerin tedavisinde önemli bir tedavi yöntemidir ancak normal hücreler üzerinde, akut ve gecikmiş yan etkiler tedavinin etkisini sınırlayabilir. Bizim bulduğumuz sonuçlar, antioksidan, anti-inflamatuar ve proliferatif etkileri olan erdosteinin, ince bağırsakta radyasyon toksisitesine karşı koruma sağlayabileceğini düşündürmüştür. Bu konuda deneysel olarak daha uzun süreli ve klinik çalışmalara ihtiyaç vardır.