SOĞAN SAK NEMATODU (Ditylenchus dipsaci)’NUN rDNA ITS BÖLGESİNE DAYALI MOLEKÜLER
KARAKTERİZASYONU Nimet GENÇ Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı Doç. Dr. Özlem ATEŞ SÖNMEZOĞLU Dr. Öğr. Ü. Elif YAVUZASLANOĞLU
T.C
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
SOĞAN SAK NEMATODU (Ditylenchus dipsaci)’NUN rDNA ITS BÖLGESİNE DAYALI MOLEKÜLER KARAKTERİZASYONU
YÜKSEK LİSANS TEZİ Nimet GENÇ
Biyomühendislik Anabilim Dalı
Tez Danışmanı: Doç. Dr. Özlem ATEŞ SÖNMEZOĞLU İkinci Danışman: Dr. Öğr. Ü. Elif YAVUZASLANOĞLU
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET Yüksek Lisans
SOĞAN SAK NEMATODU (Ditylenchus dipsaci)’NUN rDNA ITS BÖLGESİNE DAYALI MOLEKÜLER KARAKTERİZASYONU
Nimet GENÇ
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyomühendislik Anabilim Dalı
Danışman: Doç. Dr. Özlem ATEŞ SÖNMEZOĞLU Dr. Öğr. Ü. Elif YAVUZASLANOĞLU
Temmuz, 2018, 73 sayfa
Soğan tüm dünyada ve Türkiye’de insan beslenmesinde önemli bir yere sahip olan bir kültür bitkisidir. Soğanın önemli zararlılarından biri olan soğan sak nematodu (Ditylenchus dipsaci) karantinaya tabi olup soğan üretiminde büyük kayıplara neden olmaktadır. Bu nematod ile etkin bir şekilde mücadele etmenin ilk basamağını oluşturan ırk ve tür tespiti büyük önem taşımaktadır.
Bu tez çalışmasının amacı, Türkiye’de önemli soğan yetiştirme alanlarında bulunan soğan sak nematodu izolatlarının ITS-rDNA dizilerine spesifik moleküler markörler kullanılarak tür teşhislerinin yapılmasıdır. Çalışmada 2016 ve 2017 yıllarında Adana, Aksaray, Amasya, Ankara, Eskişehir, Karaman, Konya, Tokat, Mersin ve Denizli illerinde soğan ekili alanlardan bitki ve toprak örnekleri alınmıştır. Toprak ve bitki örneklerinden izole edilen 101 adet nematod örneğinin türe spesifik 10 adet moleküler markör ile genetik karakterizasyonu sonucunda 50 tanesinin Ditylenchus dipsaci olduğu tespit edilmiştir. Bu tez çalışmasında elde edilen sonuçlarla soğan sak nematodu ile mücadele için yararlı bilgiler sağlanmıştır.
ii ABSTRACT
Ms. Thesis
MOLECULAR CHARACTERIZATION of STEM and BULB NEMATODE (Ditylenchus dipsaci) by rDNA ITS REGION
Nimet GENÇ
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Bioengineering
Supervisor: Assoc. Prof. Dr. Özlem ATEŞ SÖNMEZOĞLU Co-Supervisor: Assist. Prof. Dr. Elif YAVUZASLANOĞLU
July, 2018, 73 pages
Onion is an important culture plant for human nutrition in Turkey and the world. One of the important pests of onion is stem and bulb nematode, Ditylenchus dipsaci which is subjected to quarantine treatments and causes great loss on onion production. The first step of the nematode effective control is determination of the species has great importance.
The aim of this thesis is to identify species of the nematodes isolated from important onion growing areas in Turkey using molecular markers specific to ITS-rDNA sequences. In the study, plant and soil samples were collected from onion cultivated areas in Adana, Aksaray, Amasya, Ankara, Eskişehir, Karaman, Konya, Tokat, Mersin and Denizli in 2016 and 2017. Fifty of the 101 nematode samples isolated from soil and plant samples were found as Ditylenchus dipsaci by genetic characterization using 10 species specific markers. The results of this thesis have provided useful information for struggle with the stem and bulb nematode.
iii ÖN SÖZ
Bu çalışmanın gerçekleştirilmesinde, yüksek lisans eğitimim boyunca bana çalışma olanağı veren, laboratuvar çalışmalarımda ve hayatımın her aşamasında değerli bilgilerini bizlerle paylaşan, kullandığı her kelimenin hayatıma kattığı önemini asla unutmayacağım, her an her ne olursa olsun danışabildiğim ve sorunlarıma çözüm bulduğum, ilerdeki mesleki hayatımın ilkelerini onunla kazandığım tez danışmanım Doç. Dr. Özlem ATEŞ SÖNMEZOĞLU’na sonsuz teşekkür ederim.
Hayatımın her saniyesinde her zaman bana sevginin, vicdanın, saygının, ahlaklı yaşamanın önemini anlatan ve o şekilde yetiştiren maddi manevi her zaman yanımda olan beni hiç bir zaman yalnız bırakmayan annem Fatma GENÇ’e, eğer hayatta olsaydı benim her yaptığım davranışla mutlu olan, onu üzmüş olsam dahi ben üzülmeyeyim diye bana hissettirmeyen beni her daim herşey den çok seven hayatımdan çok erken ayrılan babam merhum Habip GENÇ’e, her daim yanımda olan abim Tarık GENÇ’e sonsuz teşekkür ediyorum.
Lisanüstü eğitim-öğretim zamanım boyunca benim tüm meraklı sorularım karşısında sabırla ve özveriyle sorularıma cevap veren, laboratuvar ve arazi çalışmalarımda bilgileriyle becerilerimi geliştirmeme sebep olan, ikinci tez danışmanım Dr. Öğr. Üyesi Elif YAVUZASLANOĞLU’na teşekkürlerimi sunarım. Lisans eğitimi yıllarında gerek eğitim hakkında gerekse hayatta nasıl yol izlememiz konusunda bizi bilgilendiren, her zaman biz öğrencilerini hiçbir şekilde ayırt etmeden hepimizi en iyi yerlerde görmek istediği belirten genetik dersini onunla sevdiğim değerli hocam Prof. Dr. Ahmet YILDIRIM’a sonsuz teşekkür ederim.
Dostluğun arkadaşlığın en güzel hallerini onunla yaşadığım, bu hayatta üzüntü ve mutluluğumda her zaman yanımda olan, bilgi ve becerilerini her zaman öğretmeye çalışan, gelecek hayatı boyunca o güzel kalbi sayesinde hep iyi yerlere geleceğine inandığım ve hayatı boyunca hiç üzülsün istemediğim hocam Arş. Gör. Begüm TERZİ’ye teşekkürlerimi sunuyorum. Beni her zaman bilgilendiren hocam Yasin UZUN’a minnetlerimi sunuyorum. Çalışmalarım boyunca yardımını esirgemeyen Zeki Mutlu AKAR’a, Sait KARACA’ya, Leyla Nurefşan GÜNDÜZ’e ve Ramazan
iv
ÖZBEY’e teşekkür ediyorum. Beni her sabah güler yüzüyle karşılayan çalışmama mutlu başlamamı sağlayan her zaman yanımda olduğunu hissettiğim arkadaşım Elif YILDIZ’a ve her akşam da benim eve gelmemi sabırsızlıkla bekleyen ve her kapıdan girdiğimde bugün de bunlar oldu diye lafa başlayıp saatleri habersizce yaşadığım ev arkadaşım, destekçim Merve Ezgi ESKİ’ye hayatımda oldukları için teşekkür ediyorum.
Her türlü sıkıntıma katlanan, beni sonsuz seven, koruyan, yaşantım boyunca hep yanımda olmasını istediğim ve her zaman maddi manevi desteğini hissettiğim hayat yoldaşım İsmail BENDER’e hayatımızın kesiştiği için teşekkür ediyorum.
Bu çalışma 215O468 numaralı TÜBİTAK ve 17-YL-16 numaralı yüksek lisans BAP projesi kapsamında yürütülmüştür. Bu tez çalışmasına ve yüksek lisans eğitimime gerek bursiyer gerekse proje kapsamındaki maddi desteklerinden dolayı TÜBİTAK’a teşekkürlerimi sunarım.
Nimet GENÇ Temmuz 2018
v İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÖN SÖZ ... iii ÇİZELGELER DİZİNİ ... vi ŞEKİLLER DİZİNİ ... vii
SİMGELER VE KISALTMALAR……… viii
1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 3
3. MATERYAL VE METOD ... 13
3.1. Soğan ve Toprak Örneklerinin Toplanması ... 13
3.2. Nematodların Bitki ve Toprak Örneklerinden Ayrılması ... 17
3.3. Moleküler Tür Teşhislerinin Yapılması ... 18
3.3.1. DNA İzolasyonu ve Polimeraz Zincir Reaksiyonu ... 18
3.4. Verilerin Değerlendirilmesi ... 25
4. BULGULAR VE TARTIŞMA ... 26
5. SONUÇ ... 52
6. KAYNAKLAR ... 55
vi
ÇİZELGELER DİZİNİ
Çizelge Sayfa
Çizelge 3.1. 2016 yılı yetiştirme sezonunda toplanan örnekler ve lokasyon bilgileri .... 15 Çizelge 3.2. Çalışmada kullanılacak olan SCAR ve SSR markörleri ... 20 Çizelge 3.3. Çalışmada kullanılan primerlere ait PZR koşulları ... 22 Çizelge 3.4. PZR ürünlerinin jele yüklenme sırası ... 24
Çizelge 4.1. Nematod örneklerinin 10 adet primer ile yapılan moleküler taramalarına ait veri tablosu...46
vii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2.1. Nematod genomu...6
Şekil 3.1. Toprak ve bitki örneklerinin toplanması ve paketlenmesi...13
Şekil 3.2. Örnek toplanırken kullanılan malzemeler...14
Şekil 3.3. Nematodların bitki ve toprak örneklerinden ayrılması...18
Şekil 3.4. Nematod örneklerinde DNA kontrolü amacıyla yapılan PZR ürünlerine ait agaroz jel görüntüsü……….20
Şekil 3.5. Çalışmada kullanılan ısı döngüsü cihazı...21
Şekil 3.6. Örneklerin agaroz jel elektroforezi ... 21
Şekil 3.7. Ultraviyole görüntüleme cihazı ... 22
Şekil 3.8. Bantları işaretlenmiş jel fotoğrafı...25
Şekil 4.1. PF1 - PR1 primeri ile yapılan moleküler seleksiyona ait jel örnekleri ... 27
Şekil 4.2. PF2 - PR2 primeri ile yapılan moleküler karakterizasyon ... 29
Şekil 4.3. DitNF1 - rDNA2 primeri ile yapılan moleküler karakterizasyon ... 31
Şekil 4.4. DdpS1 - rDNA2 primeri ile yapılan moleküler taramalara ait jel görüntüsü . 32 Şekil 4.5. DipU F – DipU R primeri ile yapılan moleküler karakterizasyon ... 34
Şekil 4.6. 18S - 26S primeri ile seçilen D. dipsaci örneklerinin agaroz jel görüntüsü ... 37
Şekil 4.7. DIT2 F - DIT2 R primeri ile yapılan moleküler seleksiyona ait jeller………39
Şekil 4.8. DIT5 F - DIT5 R primeri ile seçilen D. dipsaci örneklerinin jel görüntüsü...40
Şekil 4.9. Dip1 R – DipU F primeri ile yapılan moleküler taramalar ... 42
Şekil 4.10. H05 - H06 primeri ile seçilen D. dipsaci örneklerinin jel görüntüsü...44
Şekil 4.11. 2016-2017 yılında soğan tarlalarından alınan 101 adet nematod örneklerinin moleküler taramalarına dayalı olarak oluşturulan dendogram... 49
Şekil 4.12. 2016 yılında soğan tarlalarından alınan nematod örneklerinin H05-H06 primeri ile yapılan taramaları sonucunda elde edilen dendogram...50
viii SİMGELER VE KISALTMALAR Simgeler Açıklama µl Mikrolitre bç Baz çifti cm Santimetre gr Gram ha Hektar km Kilometre M Molar mg Miligram ml Mililitre Kısaltmalar Açıklama dk Dakika
DNA Deoksiribo Nükleik Asit
EtBr Ethidium Bromür
FAO Food and Agriculture Organization of the
United Nations
Birleşmiş Milletler Gıda ve Tarım Örgütü
HCL Hidroklorik Asit
ITS Internal Transcribed Spacer
İç Transkripsiyon Bölgesi
LSU Large Subunit
Büyük Alt Birim
MgCI2 Magnezyum Klorür
NaCl Sodyum Klorür
ix
Kısaltmalar Açıklama
RFLP Restriction Fragment Length Polymorphism
Sınırlandırılmış Parçacık Uzunluğu Polimorfizmi
RNA Ribo Nükleik Asit
SCAR Sequence Characterized Amplified Region
Dizisi Karakterize Edilmiş Çoğaltılan Bölgeler
sn Saniye
SSR Simple Sequence Repeats
Basit Dizi Tekrarları
SSU Small Subunit
Küçük Alt Birim
Taq Thermus aquaticus
TBE Tris/ Borik Asit/ EDTA
UV Ultraviyole
1 1. GİRİŞ
İnsan beslenmesinde olduğu kadar ekonomik olarak da önemli bir yere sahip olan soğan bitkisinin Türkiye’de geniş bir alanda üretimi yapılmaktadır. Soğan yetiştiriciliğinde üretimi kısıtlayan önemli biyotik streslerden biri olan soğan sak nematodu (Ditylenchus dipsaci) karantinaya tabi olup bulunduğu yerlerde soğan üretimini olumsuz yönde etkilemektedir. Bu nedenle soğan yetiştirme alanlarında bölgesel olarak bulunan soğan sak nematodunun dağılım ve populasyon durumunun güncel olarak bilinmesi büyük önem arz etmektedir. Bunun yanında soğan sak nematodunda tür içi çeşitlilik çok fazla olup ırkların konukçuluk durumları çok komplekstir. Bu nedenle soğan bitkisi üzerinde bulunan ırkların moleküler düzeyde tespiti ve o bölgede bulunan ırkların konukçu spektrumlarının bilinmesi gerekmektedir.
Türkiye’de soğan sak nematodunun tespiti çoğunlukla morfolojik karakterlere göre yapılmakta olup, ülke ekonomisi için yüksek önemi olan soğan bitkisinin yetiştirme alanlarında bulunan soğan sak nematodu izolatlarının moleküler farklılık ve benzerliklerinin belirlenmesine ve teşhisine yönelik gerçekleştirilmiş sınırlı sayıda çalışma bulunmaktadır. Ülkemizde soğan yetiştirme alanlarında bulunan soğan sak nematodu ırklarının tespiti, bu nematoda karşı alınabilecek kontrol önlemlerinin daha bilinçli ve etkin bir şekilde yapılmasına yardımcı olacaktır. Dolayısıyla önemli oranda zarar potansiyeli bulunan bu zararlı ile etkin mücadele soğan veriminin artışına ve ekonomik kalkınmaya katkı sağlayacaktır.
Bu tez çalışmasının amacı; Türkiye’nin en fazla soğan üretimi yapılan bölgelerinden elde edilen nematod izolatlarının ITS-rDNA dizilerine spesifik moleküler markörler ile tür teşhislerinin yapılmasıdır. Bu amaçla moleküler taramalarda farklı araştırmacılar tarafından geliştirilen, ITS-rDNA dizilerine spesifik primerler kullanılmıştır. İncelenen nematodların DNA izolasyonu işlemlerinin ardından, moleküler taramalar sonucunda elde edilen verilerin filogenetik analizi ile incelenen nematodların genetik benzerlik ve farklılıkları ortaya konularak tür teşhisleri yapılmıştır. DdpS1 - rDNA2, DipU F – DipU R, DipU F - Dip1 R, DIT2 F - DIT2 R, DIT5 F - DIT5 R, DitNF1 - rDNA2, PF1 - PR1, PF2 - PR2 ve 18S - 26S primerleri ile yapılan moleküler taramalar sonucunda incelenen toplam 101 adet nematod örneğinden 50 tanesinin D. dipsaci olduğu tespit edilmiştir.
2
Ayrıca H05-H06 markörü ile yapılan moleküler taramalar sonucunda D. dipsaci olduğu tespit edilen bu örneklerden 18 tanesi’nin D. dipsaci’nin normal ırkı olduğu da belirlenmiştir. Son yıllarda kullanılmaya başlanan ITS-rDNA dizilerine spesifik markörlere ait bulguların nematod çalışmaları için genetik karakterizasyon araştırmalarına faydalı olacağı düşünülmektedir.
3
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
İnsan beslenmesinde önemli bir yere sahip olan soğanın, insan sağlığı üzerine yararlı etkilerinin belirlenmesiyle, günlük diyette kullanımı artmıştır. Buna bağlı olarak dünyada ve Türkiye’de üretimi giderek artmaktadır. Türkiye 2017 yılında toplam 2.170.506 ton olan soğan üretimi ile dünyada 6. sırada yer almaktadır (TÜİK, 2017). Birleşmiş Milletler Gıda ve Tarım Örgütü verilerine göre, dünyada 85 milyon 795 bin 191 ton soğan üretimi yapıldığı belirtilmiş, Çin’in dünya soğan üretiminde % 26’lık payla ilk sırada yer aldığı, Çin’in ardından sırasıyla % 22,5 ile Hindistan, % 3,7 ile ABD, % 2,8 ile İran, % 2,3 ile Rusya ve % 2,2 ile Türkiye’nin geldiği ve ülkemizin dünya üretiminde 6’ncı sırada yer aldığı belirtilmiştir (FAO, 2017).
Coğrafi ve iklim özellikleri bakımından değerlendirildiğinde Türkiye’nin bütün bölgeleri soğan yetiştiriciliği için uygundur. Birim alandan elde edilen verimi arttırmak için gerçekleştirilen çalışmalar arasında özellikle hastalık ve zararlılarla mücadeleye büyük önem verilmelidir. Soğan üretimi ve verimini olumsuz yönde etkileyen en önemli zararlılardan biri de soğan sak nematodudur.
Mikroskobik yuvarlak solucanları içeren nematoda şubesinde yer alan Ditylenchus Filipjev, 1936 cinsi çoğunluğu fungivor olmakla birlikte başta soğan olmak üzere bitkilerde ciddi zararlara neden olan bitki paraziti türleri içeren bir gruptur. En önemli bitki paraziti türleri; Ditylenchus destructor (Thorne) ve D. dipsaci (Kühn) Filipjev (Jeszke ve ark., 2014)’ dir. Her iki tür de dünyanın her yerine yayılmıştır ve konukçu spektrumları çok geniştir. Bu nedenle bitkisel üretimde önemli zararlılar arasında yer alırlar. Ditylenchus destructor türü çoğunlukla kültürü yapılan bitkilerden patateslerde zarar yapmaktadır ancak soğanda zarara neden olmamaktadır.
Jones ve ark. (2013), çalışmalarında bu patojenlerin bilimsel ve ekonomik önemini göz önünde bulundurarak en önemli 10 parazitin; soğan sak nematodu (Ditylenchus dipsaci spp.), kök-düğüm nematodları (Meloidogyne spp.), kist nematodları (Heterodera ve Globodera spp.), kök lezyonu nematodları (Pratylenchus spp.), gömülü nematod (Radopholus similis), çam soluk nematodu (Bursaphelenchus xylophilus), reniform nematod (Rotylenchulus reniformis), virüs vektör nematodu (Xiphinema), Nacobbus
4
aberrans ve Aphelenchoides besseyi olduğunu bildirmişlerdir. Her nematodun veya nematod grubunun biyolojisini de gözden geçirmişlerdir.
2013 yılında yapılan bir çalışmada buğday bitkisinde ürün kaybına neden olan birçok etmenler arasında biyotik etmenler grubunda yer alan bitki paraziti nematodlar incelenmiştir. Yapılan araştırma sonucunda bitki paraziti nematodların dünya genelinde buğday üretiminde %7-10 oranında ürün kaybına neden oldukları bildirilmiştir. Buğday bitkisinde ürün kaybına neden olan bitki paraziti nematodların; Soğan-sak nematodu (Ditylenchus dipsaci), Tohum gal nematodu (Anguina tritici), Kök-ur nematodları (Meloidoyne spp.), Kök lezyon nematodları (Pratylenchus spp.) ve Tahıl kist nematodları (Heterodera avenea) olduğu ifade edilmiştir (Elekçioğlu ve ark., 2013).
Ditylenchus dipsaci (Kühn) ve Filipjev türü ise 500 bitki türünde gelişebilen 30’dan fazla ırka sahiptir (Sturhan ve Brzeski, 1991). Bu nedenle D. dipsaci tür kompleksi olarak adlandırılmaktadır. En son gerçekleştirilen taksonomik çalışmalarda D. dipsaci türü iki gruba ayrılmıştır. Birinci grup D. dipsaci sensu strico veya normal boyutlu tür olarak adlandırılan diploid özellikte bireyleri içeren gruptur. Diğer grup poliploid özellikte bireyleri içeren 6 alt gruba ayrılmıştır; Vicia faba bitkisinden elde edilen Ditylenchus sp. B, Cirsium setosum bitkisinden elde edilen Ditylenchus sp. C Pilosella cinsi bitkilerle ilişkili olan Ditylenchus sp. D, Crepis praemorsa bitkisinden elde edilen Ditylenchus sp. E, Pilosella ve Leontodon cinsi bitkilerle ilişkili Ditylenchus sp. F ve Plantago maritima bitkisinden elde edilen Ditylenchus sp. G gruplarıdır (Subbotin ve ark., 2005). Bakla (Vicia faba) bitkisinden elde edilen Ditylenchus sp. B grubu daha sonraki araştırmalarda Ditylenchus gigas (Vovlas ve ark., 2011) ve Ditylenchus sp. C grubu ise Ditylenchus weischeri (Chizhov ve ark., 2010) türü olarak ayrılmıştır.
Ditylenchus dipsaci sensu strico grubunda yer alan bireyler filogenetik olarak birbirlerine çok yakın gruplar olarak yer aldığı için alt tür olarak ayrıma gidilememiştir (Subbotin ve ark., 2005). Morfolojik olarak yapılan gözlemlerle sonuçlara ulaşmak oldukça deneyim ve fazla zaman gerektirmekte, ayrıca sonuçlar zaman zaman araştırmacılara göre farlılıklar gösterebilmektedir. Bu nedenle son yıllarda geleneksel yöntemlerin yanı sıra çok sayıda avantaj ve üstünlükleri nedeniyle moleküler yöntemler nematod sistematiğinde sıkça kullanılmaya başlanmıştır (Kılıçoğlu ve Özkoç, 2008).
5
Nematodların konukçu tercihleri ve patojenite özellikleri genetik olarak belirlendiğinden, konukçu reaksiyonlarıyla ırkların tespitinde elde edilen, değerlendirilmesi güç olan çok değişken ve karmaşık sonuçların önüne nematod populasyonlarının moleküler analizleri ile geçildiği görülmektedir. Nematodlarda taksonomi amaçlı kullanılan ilk DNA tekniği genomik DNA’nın restriksiyon enzimleriyle parçacıklara ayrılmasıdır (Curran ve ark., 1985). Ancak bu metot oldukça zaman alıcı olması, fazla miktarda DNA gerektirmesi, hassas bir teknik olmaması ve genomda bulunan genetik varyasyonun çok küçük bir bölümünü göstermesi gibi çok sayıda dezavantaja sahiptir. Polimeraz Zincir Reaksiyonunun (PZR) geliştirilmesiyle çok az miktarda DNA’da bile hassas ayrım yapabilmek mümkün olmuştur. PZR’nin keşfi ile moleküler çalışmalar ivme kazanmıştır.
Günümüzde taksonomik ayrım ve tanı için çok sayıda DNA tabanlı teknik kullanılarak genetik varyasyon saptanabilmektedir (Powers ve Fleming; 1998; Abrantes ve ark., 2004). Genomun özel bölgelerinin çoğaltımı tür içindeki ve tür ile cinsler arasındaki varyasyonların saptanmasında etkili bir metottur. Ribozomal DNA (rDNA) ve mitokondriyal DNA (mtDNA) taksonomik ayrım ve teşhis için kullanılan en yaygın iki tekrar bölgesidir (Abrantes ve ark., 2004). Ditylenchus dipsaci’nin moleküler tür teşhisi ile ilgili son yıllardaki çalışmalar patojenite özelliklerinin kodlandığı gen bölgelerinin analizine yöneliktir (Douda ve ark., 2013; Jeszke ve ark., 2014).
Korunmuş diziler büyük alt birim (LSU) ve küçük alt birim (SSU) genlerinde bulunmaktadır (Şekil 2.1). LSU ve SSU genlerinin nematodlarda taksonomik çalışmalarda kullanımı giderek yaygınlaşmaktadır. Alt birimler arasındaki ara (spacer) bölgeler, trankripsiyonu yapılan ara bölge (Internal Transcribed Spacer-ITS) ve genler arası bölge (Intergenic Spacer-IGS) olarak ikiye ayrılmaktadır. Bu ara bölgelerdeki varyasyon alt birim dizilerinden çok daha fazladır ve çok daha hızlı evrim geçirdiklerinden dolayı türler arasında ya da tür içi populasyonlar arasındaki çalışmalarda sağladığı yüksek farklılıklar nedeniyle yaygın bir şekilde kullanılmaktadır (Dahlman ve ark., 2000).
6
Şekil 2.1. Nematod genomu
Nematod sistematiğinde en çok tercih edilen bölge ribozomal DNA (rDNA) birimi içinde yer alan 18S rDNA, 5.8S rDNA ve 28S rDNA’nın yanısıra ITS bölgeleridir. Kodlanmayan bölge olan ITS daha hızlı evrim geçirdiği için bir cins içindeki nematod türlerinin karşılaştırılması için oldukça kullanışlıdır (Kılıçoğlu ve Özkoç, 2008). ITS bölgesi kodlanmayan iki değişken bölgeden oluşmaktadır. Ayrıca ITS oldukça korunmuş küçük alt birim (SSU) ile 5.8S alt birimi arasında (ITS1 bölgesi) ve büyük alt birim (LSU) rRNA genleri ile 5.8S alt birimi arasındaki (ITS2) iki farklı bölgede yer almaktadır (Şekil 2.1).
ITS bölgesi dört temel özelliği nedeniyle nematodlarda moleküler karakterizasyon çalışmaları için oldukça yararlı ve kullanışlıdır. ITS bölgesi nispeten küçüktür (500-800 bç) ve tek bir primer çifti (rRNA alt birimleri içindeki korunmuş bölgelerin komplementeri) kullanılarak PZR ile kolaylıkla çoğaltılabilir. Morfolojik açıdan farklı türler arasında ITS bölgesi değişken olabildiğinden filogenetik ve sistematik analizler için markörler kullanılabilmektedir. rDNA birimlerinin çok sayıda tekrarları olduğundan, seyreltik ya da oldukça degrade olmuş DNA örneklerinden bile ITS bölgesi kolaylıkla çoğaltılabilir. ITS türe özgü probları ve primerleri, bir kütüphane oluşturmaya gerek kalmaksızın hızlı bir şekilde PZR ile üretilebilir. Ayrıca ITS bölgelerinin tekrarlayan dizelerden oluşması ile türler arasında değişken, tür içinde benzer olma eğiliminde olmasından dolayı, türe özgü probları geliştirmek için ITS bölgesi dizileri tercih edilmektedir (White ve ark., 1990; Bruns ve ark., 1991; Lee ve Taylor, 1992; Kılıçoğlu ve Özkoç, 2008). Son yıllarda nematodlarda yapılan taksonomik çalışmalarda ITS dizilerinin kullanımı giderek artmaktadır.
7
Pethybridge ve ark. (2016) tarafından yapılan çalışmada, 2012-2014 yılları arasında toplanan 345 sarımsak örneğinde yapılan morfolojik testler ve ITS bölgelerine spesifik primerlerin kullanıldığı moleküler taramalar sonucunda yaklaşık 31 Ditylenchus popülasyonun (türünün) birbirine % 99 - % 100 oranında benzerlik gösterdiği görülmüş ve incelenen örneklerde % 14,1 oranında bulaşıklık tespit edilmiştir. Çalışma sonucunda elde edilen bilgilerin gelecek yıllarda sarımsak üretiminin sekteye uğramaması için gerekli önlemlerin alınmasına fayda sağlayacağı ifade edilmiştir.
Yapılan farklı bir çalışmada ise Ditylenchus destructor ile D. mycelıophagus'un ribozomal kistronu ve farklı coğrafi bölgelerden alınan D. dipsaci’nin yedi ana ırkı incelenmiştir. Bu çalışmadaki üç türde; ribozomal kistron, 18S rDNA geni ve ribozomal iç transkripsiyon (ITS) bölgeleri RFLP (Sınırlandırılmış Parçacık Uzunluğu Polimorfizmi) yöntemi ile belirlenmiştir. Bir 7.5 kb ribozomal kistron probu kullanılarak Southern blot analizi yöntemi ile incelenen D. dipsaci'nin beş ana ırkının ayırt edilmesi sağlanmıştır. PZR işlemi sonucunda ITS fragmanlarının türe spesifik bant uzunlukları bilindiğinden geriye kalan türlerin ayrımı sağlanmış ve o bölgedeki bulaşıklık olduğu düşünülen numuneler ribozomal kistron ile araştırılarak D. dipsaci'nin ırkları tespit edilmiştir (Wendt ve ark., 1993).
Vovlas ve ark. (2011), 5 farklı gen dizisini [ITS1-5.8S-ITS2 bölgesi; 28S rDNA geni ve 18S rDNA geninin D2-D3 parçaları; sitokrom c oksidaz I için kısmi mitokondiral geni (mtCOI) ve nüklear kodlanan protein (hsp90 geni)] kullanarak nematod populasyonları arasındaki ilişkileri filogenetik olarak analiz etmiştir. Ditylenchus dipsaci sensu strico grubu ve D. gigas arasında en büyük ayrım, mtCOI ve hsp90 gen dizilerinden elde edilmiştir. Benzer olarak D. weisheri’nin D. dipsaci sensu strico grubundan ayrılması, ITS-rDNA’nın Bsh1236I, HinfI, RsaI ve TaqI enzimleri ile kesilmesiyle oluşan fragment polimorfiziminin yanında hsp90 gen dizisinin analizi ile gerçekleştirilmiştir (Chizhov ve ark., 2010).
Farklı bir çalışmada (Mwaura ve ark., 2015), Ditylenchus cinsindeki birçok türün morfolojik olarak tanımlanması mümkün olmamıştır. Bunun nedeni ise birçok tür ile benzer tanı karakteri taşımasıdır. Tür tanımlamasını yapmak için araştırmacılar Ditylenchus dipsaci ve Ditylenchus destructor nematodlarını kullanmış ve
ITS1-5.8S-8
ITS2 bölgesindeki 3 farklı gen dizisi olan, 28S rDNA geni ve 18S rDNA geninin D2-D3 parçaları ile sitokrom c oksidaz I için kısmi mitokondiral genini (mtCOI) kullanarak nematod popülasyonları arasındaki ilişkileri filogenetik olarak analiz etmişlerdir. Çalışma sonucunda Ditylenchus dipsaci sensu strico grubu ve D. destructor arasındaki en büyük ayrımın mtCOI gen dizilerinden elde edildiği bildirilmiştir (Mwaura ve ark., 2015).
Minnesota’da sarımsakta büyük miktarda ürün kaybına neden olan faktörün araştırıldığı bir çalışmada; TW81 ve AB28 primerlerinin ITS-rDNA amplifikasyonunda, D2A ve D3B primerlerinin ise 28S-rDNA’yı kodlayan genlerin D2-D3 ekspansiyon segmentlerinin nükleotid dizilerinin amplifikasyonunda kullanılarak elde edilen sonuçlar gen bankalarıyla karşılaştırıldığında ürün kayıplarına neden olan faktörün Ditylenchus dipsaci olduğu tespit edilmiştir (Mollov ve ark., 2012). Douda ve ark. (2013), 28S-rDNA’yı kodlayan genlerin D2-D3 ekspansiyon segmentlerinin nükleotid dizilerini D. dipsaci ve D. destructor’un farklı populasyonlarını ayırmak için kullanmışlardır. Farklı bir araştırmada ise 28S-rDNA’yı kodlayan genlerin D2-D3 ekspansiyon segmentlerinin nükleotid dizilerinden geliştirilen primerler kullanılarak, İran’da ilk defa Ditylenchus gigas türü tespit edilmiştir (Mafi ve Taheri, 2013).
2017 yılında yapılan bir çalışmada ise Ditylenchus cinsine ait 5 türün 28S-rDNA’yı kodlayan genlerin D2-D3 ekspansiyon segmentlerinin nükleotid dizilerinden geliştirilen primerler kullanılarak, Ditylenchus cinsinin yeni bir türü olan Ditylenchus persicus n. spp. olduğu belirlenmiştir (Esmaeili ve ark., 2017).
D. dipsaci nematodlarının moleküler karakterizasyonunda ve tanımlanmasında kullanılmak üzere spesifik primerler geliştirmek amacıyla yürütülen bir araştırmada iki SCAR markörü geliştirilmiştir (Zouhar ve ark., 2007). Çalışmada tüm D. dipsaci izolatlarında geliştirilen primerlerden DIT2 primeri 325 bç’lik; DIT5 primeri ise 245 bç’lik bir fragment verdiği saptanmıştır. Ayrıca SCAR primerleri 20 sağlıklı konukçu bitkide test edilmiş ve herhangi bir çoğaltım olmamıştır. Çalışma sonucunda geliştirilen PZR protokolünün ve primerlerin oldukça hassas olduğu ve suni bir şekilde bitki dokularına bulaştırılan D. dipsaci’lerin spesifik bir şekilde tespit edilmesinde kullanışlı
9
bir teknik olduğu bildirilmiştir (Zouhar ve ark., 2007). Diğer bir çalışmada (Marek ve erk., 2010) ise Ditylenchus dipsaci sensu strico, Ditylenchus sp. B ve D. destructor’u içeren karışık örneklerin analizi için spesifik primerlerin kullanıldığı multipleks PZR tekniği geliştirilmiştir. Bu şekilde rutin olarak kontrol yapılan karantina laboratuvarlarında gerçekleştirilen işlem basamakları kısaltılmış ve markör yardımlı seleksiyon çalışmaları için güvenilir bir diyagnostik yöntem geliştirilmiştir (Marek ve ark., 2010).
Madani ve ark. (2015), türe özgü spesifik primerler kullanarak soğan ve köklerde zarar meydana getiren Ditylenchus dipsaci ile Ditylenchus weischeri’yi teşhis etmişler ve aralarındaki moleküler farklılıkları ortaya koymuşlardır. RAPD markörleri kullanılarak yapılan bir çalışmada ise sarımsak bitkisindeki Ditylenchus dipsaci’nin ırksal düzeyde varyasyonu belirlenmiştir (Qiao ve ark., 2013). Bir diğer araştırmada, geliştirilen özel primerler ve PZR tekniği ile Ditylenchus dipsaci’nin normal ve giant ırkları başarılı bir şekilde tespit edilmiştir (Kerkoud ve ark., 2007). Farklı bir çalışmada ise SCAR (Dizisi Karakterize Edilmiş Çoğaltılan Bölgeler) markörleri ve multipleks PZR ile Ditylenchus dipsaci’nin normal ve giant ırklarının farklılıkları belirlenmiştir (Esquibet ve ark., 2003). Bu tez çalışmasında da moleküler karakterizasyonda SCAR markörleri kullanılmıştır.
Sturhan ve Subbotin (2008) de karantinaya tabi nematodlar olan D. dipsaci ve D. destructor için geliştirilmiş olan diyagnostik PZR-RFLP, ITS-rDNA, SCAR-PZR ve spesifik PZR yöntemlerine ait protokollerin başarılı bir şekilde kullanılabileceğini bildirmişlerdir. Bu yöntemlerin yanında daha önceleri Ditylenchus dipsaci’nin ayrımında Zouhar ve ark. (2007) ile Esquibet ve ark. (1998) tarafından Rastgele Çoğaltılmış Polimorfik DNA (RAPD) tekniği de kullanılmıştır. RAPD, DNA sekans bilgisini gerektirmemesi nedeniyle çok sayıda organizmanın karakterizasyonunda kullanılmaktadır (Williams ve ark., 1990). Giant ve normal ırkların RAPD markörleri ile moleküler karakterizasyonunun yapıldığı bir çalışmada, kullanılan primerlerden dördünün D. dipsaci popülasyonları için yüksek derecede polimorfik olduğu saptanmıştır (Esquibet ve ark., 1998). Toplam 30 D. dipsaci türünün karışımının kullanıldığı farklı bir çalışmada rDNA’nın ITS bölgeleri çoğaltılmış ve filogenetik analizleri yapılarak aralarındaki farklılık ve benzerliklerin gösterildiği dendogram
10
oluşturulmuştur (Subbotin ve ark., 2005). Filogenetik analiz metodları kullanılarak yapılan farklı araştırmalarda da farklı konukçu bitkilerden elde edilen Ditylenchus spp. populasyonları sınıflandırılmış ve aralarındaki akrabalık ilişkileri belirlenebilmiştir (Vovlas ve ark., 2011; Jeszke ve ark., 2014).
2003 yılında yapılan bir araştırmada, 22 adet D. dipsaci popülasyonundan D. dipsaci’nin normal ve giant ırklarının ayrımının sağlanması için SCAR markörleri olarak kullanılan türe spesifik iki adet primer seti kullanılmıştır. 1. Primer set; H05-H06, 2. Primer set olarak; D09-D10 kullanılmıştır. Yapılan çalışma sonucunda 19 popülasyonun bant profillerine bakıldığında H05-HO6 primerinin 242 bç, D09-D10 primerinin ise 198 bç bant verdiği görülmüştür. Geriye kalan 3 popülasyonun ise amplifikasyon ürünün bant vermediği gözlemlenmiş olup sonuç gen bankalarındaki verilerle karşılaştırıldığında 19 popülasyonun D. dipsaci normal ırkına ait olduğu belirlenmiştir (Esquibet ve ark., 2003).
Yapılan farklı bir çalışmada ise Ditylenchus dipsaci sensu stricto türü için spesifik primer tasarlama çalışması yapılmış ITS bölgelerindeki bilgiler kullanılarak DitNF1-rDNA2 primeri oluşturulmuştur. Primer tasarlama çalışmasının ardndan PZR yapılmış ve sensu stricto türlerinin 263 bç’de bant verdiği okumalar sonucunda belirlenmiştir (Subbotin ve ark., 2005).
Marek ve ark. (2005) tarafından yapılan bir araştırmada Ditylenchus dipsaci olduğu kesin olarak bilinen üç farklı Avrupa ülkesinden alınan örnekler ve bitki paraziti olarak bilinen Globodera pallida, Bursaphelenchus xylophilus, Rhabditis nematodları, türe spesifik iki primer seti kullanılarak taramalar yapılmıştır. 1. primer seti olarak, PF1-PR1, 2. primer seti olarak, PF2-PR2 kullanılmıştır. Taramalar sonucunda Ditylenchus dipsaci türüne ait örneklerin 1. Primer setinde 327 bç’de bant verdiği, 2 primer seti için de 396 bç’de bant verdiği görülmüştür. Ditylenchus türüne ait olmayan bitki paraziti nemotodların ampflifikasyon ürünlerinin ise bant vermediği tespit edilmiştir.
2007 yılında yapılan bir çalışmada, DdpS1-rDNA2 ve DdpS2-rDNA2 primerleri kullanılarak D. dipsaci ve D. gigas türlerinin moleküler farklılıkları ortaya konulmuştur. DdpS1-rDNA2 primeri, D. dipsaci’nin belirlenmesinde kullanılırken DdpS2- rDNA2
11
primeri ise D. dipsaci ve D. gigas’ın tanımlanmasında kullanılmıştır. Çalışmada 20 popülasyon kullanılmış olup, DdpS1-rDNA2 primerine ait taramalarda 14 popülasyonun, sekiz tanesi D. dipsaci normal ırkı, altı tanesi ise D. dipsaci sensu stricto turune ait olduğu tespit edilmiştir. Amplifikasyon ürünlerinin okumaları yapıldığında ise DdpS1-rDNA2 primeri 517 bç bant verdiği, DdpS2- rDNA2 primeri ise 707 bç’de bant verdiği tespit edilmiştir (Kerkoud ve ark., 2007).
2011 yılında yapılan bir çalışmada, güney İtalya, güney İspanya ve Lübnan'da bulunan bakla fasulyelerinden toplanan çeşitli popülasyonlardan elde edilen morfolojik ve moleküler veriler temel alınarak Ditylenchus dipsaci’nin iki türü olan D. dipsaci sensu stricto ve D. gigas türlerinin morfolojik, karyolojik ve moleküler taramalar yapılmıştır. Moleküler taramalarda türe spesifik üç primer seti kullanılmıştır. 1. primer seti olarak, D2A-D3B, 2. primer seti olarak, TW81-AB28 ve 3. primer seti olarak, 18S -26S kullanılmıştır. Moleküler karakterizasyon çalışmaları sonucunda iki türün ayrımı sağlanmıştır (Vovlas ve ark., 2011).
Marek ve ark (2010) tarafından yapılan bir çalışmada Ditylenchus dipsaci sensu strico, Ditylenchus sp. B ve D. destructor’u içeren karışık örneklerin analizi için spesifik primer (18S ve 26S) kullanılmıştır ve amplifikasyon ürünlerinin okumaları yapıldığında ise 967 bç’lik fragment veren örneklerin D. dipsaci sensu stricto, 966 bç’lik ürünlerin Ditylenchus sp. B ve 1105 bç’lik örneklerin D. destructor olduğu belirlenmiştir.
2017 yılında yapılan bir çalışmada Türkiye‘nin soğan ekiliş alanı bakımından zengin olan bölgelerinden toplanan 51 adet nematod örneğinin morfolojik ve morfometrik taramaları yapıldıktan sonra Ditylenchus dipsaci türüne spesifik beş adet primer çifti ile taramalar yapılmıştır. 1. primer seti olarak PF1-PR1, 2. primer seti olarak, PF2- PR2, 3. primer seti olarak, DdpS1-rDNA2, 4. primer seti olarak, DitNF1-rDNA2 ve 5. Primer set; H05-H06 kullanılmıştır. Taramalar sonucunda Ditylenchus dipsaci türüne ait örneklerin 1. primer setinde 327 bç’de bant verdiği, 2 primer seti için de 396 bç’de bant verdiği 3. primer setinde 517 bç’de bant verdiği, 4. primer seti için 263 bç’de bant verdiği görülmüştür. Ditylenchus türüne ait olmayan bitki paraziti nemotodların ampflifikasyon ürünlerinin ise bant vermediği tespit edilmiştir. İncelenen 51 adet
12
nematod örneğinden ilk dört primer seti için 20 adet nematod örneğinin Ditylenchus dipsaci olduğu tespit edilmiştir (Yavuzaslanoğlu ve ark., 2017).
13 3. MATERYAL VE METOD
3.1. Soğan ve Toprak Örneklerinin Toplanması
Bu tez çalışmasında kullanılmak üzere, 2016 yılı soğan yetiştirme dönemi içinde, bölgelerin iklim özelliklerine bağlı olarak bitki gelişimi durumu göz önünde bulundurularak öncelikle 22-23 Nisan 2016 tarihlerinde Akdeniz Bölgesi’nde Adana ve Hatay illerinden bitki ve toprak örnekleri toplanmıştır.
Daha sonra 29-30 Nisan 2016 tarihlerinde Marmara ve Ege Bölgeleri’nde Tekirdağ, Bursa ve Balıkesir illerinden örnekler alınmıştır. Karadeniz Bölgesi’nde 26-28 Mayıs 2016 tarihleri arasında Tokat, Amasya, Çorum ve Kastamonu illerinden toprak ve bitki örneklemesi gerçekleştirilmiştir. Son olarak 6-15 Mayıs 2016 tarihleri arasında Orta Anadolu Bölgesi’nde Konya, Aksaray, Karaman, Ankara ve Eskişehir illerinden örnekleme yapılmıştır. Çizelge 3.1’de örnekleme yapılan lokasyon bilgileri verilmiştir.
Soğan bitkisi örneklerinin toplanması için tarım il ve ilçe müdürlükleri ile iletişime geçilerek soğan ekilişi gerçekleştirilen köyler öğrenilmiştir. Ekiliş bulunan köyler yönünde gidilerek, örneklenen tarlalar arasında 2-3 km olacak şekilde örnekler alınmıştır (Bora ve Karaca, 1970). Her bir tarla içerisinde 3-4 hat halinde zig zag şeklinde yürünerek 15-20 adımda bir toprak ve bitki örneği alınmıştır (Şekil 3.1). Sarımsak bitkileri ve toprak örnekleri ikişer tekerrür olacak şekilde toplanmıştır.
14
Şekil 3.1. Toprak ve bitki örneklerinin toplanması ve paketlenmesi (devam)
Bitkiler köküyle sökülerek, toprak örnekleri ise 2,5 cm çapında toprak sondası 30 cm derinliğe kadar batırılarak tarlanın 15-20 noktasından yaklaşık 2 kg paçal örnek oluşturulmuştur (Şekil 3.2).
15
Örneklemeler sırasında Akdeniz, Ege, Marmara ve Karadeniz Bölgeleri’nde bitkiler baş bağlama döneminde iken, Orta Anadolu Bölgesi’nde tohumdan ekim yapılan bitkiler 3-4 yapraklı aşamada olduğu tespit edilmiştir. Ancak kıskadan yetiştirilen soğan bitkilerinin baş bağlama döneminde oldukları görülmüştür. 2016 ve 2017 yıllarına ait toplam 101 adet örnekleme çalışması yapılmıştır.
Çizelge 3.1. 2016 ve 2017 yılı yetiştirme sezonunda toplanan örnekler ve lokasyon bilgileri
Örnek No Örnek Toplama Yılı İl İlçe / Köy
1 2016 Adana Kara yusuf
2 2016 Adana Yakapınar
3 2016 Adana Ceyhan
4 2016 Adana Ceyhan, 1 km sonra
5 2016 Adana Sarıçam
6 2016 Hatay Reyhanlı
7 2016 Hatay Reyhanlı Merkez
8 2016 Hatay Reyhanlı, 3 km sonra
9 2016 Hatay Kumlu
10 2016 Hatay Kumlu, 3 km sonra
11 2016 Hatay Kırıkhan
12 2016 Tekirdağ Kırıkhan, 3 km sonra
13 2016 Tekirdağ Merkez
14 2016 Tekirdağ Merkez, 3 km sonra
15 2016 Tekirdağ Merkez, 5 km sonra
16 2016 Tekirdağ Malkara
17 2016 Tekirdağ Ahievran köyü
18 2016 Tekirdağ Yaylagöne
19 2016 Balıkesir Yeşilhisar
20 2016 Bursa Merkez
21 2016 Bursa Merkez, 2 km sonra
22 2016 Bursa Merkez, 3 km sonra
23 2016 Bursa Merkez, 5 km sonra
24 2016 Bursa Evciler
25 2016 Bursa Mesudiye
26 2016 Bursa Yeni şehir çelebi
27 2016 Bursa Kızıl köy
28 2016 Bursa Kızıl köy, 3 km sonra
29 2016 Konya Beyşehir
30 2016 Konya Çiller
31 2016 Aksaray Acıpınar
32 2016 Karaman Morcalı
33 2016 Karaman Morcalı, 3 km sonra
34 2016 Karaman Merkez
35 2016 Karaman Merkez, 2 km sonra
36 2016 Karaman Avgançimeni
37 2016 Karaman Pınarbaşı
16
Çizelge 3.1. 2016 ve 2017 yılı yetiştirme sezonunda toplanan örnekler ve lokasyon bilgileri
(devam)
Örnek No Örnek Toplama Yılı İl İlçe / Köy
39 2016 Ankara Özyurt
40 2016 Ankara İnler
41 2016 Ankara Kabak köy
42 2016 Ankara Kabak köy, 3 km sonra
43 2016 Ankara Yeşilyaka
44 2016 Ankara Doğuray
45 2016 Ankara Çok ören girişi
46 2016 Ankara Çok ören meydan
47 2016 Ankara Çok ören cıkışı
48 2016 Ankara Kuyucak
49 2016 Eskişehir Kızılinler
50 2016 Eskişehir Gerenli
51 2016 Eskişehir Yeniköy
52 2016 Eskişehir Çifteler
53 2016 Tokat Kara Şeyh
54 2016 Tokat Kara Şeyh, 3 km sonra
55 2016 Tokat Kara Şeyh
56 2016 Tokat Çeltek
57 2016 Tokat Çeltek, 3 km sonra
58 2016 Tokat Kuşoturağı
59 2016 Tokat Ataköy
60 2016 Tokat Yakınca
61 2016 Tokat Yakınca, 3 km sonra
62 2016 Tokat Yakınca çıkışı
63 2016 Amasya Dereköy
64 2016 Amasya Deveci
65 2016 Amasya Ortaova
66 2016 Amasya Yeşilören
67 2016 Amasya Keçi köy
68 2016 Amasya Güblüce
69 2016 Amasya Doluca
70 2016 Amasya Doluca, 3 km sonra
71 2016 Çorum İbrahim köy
72 2016 Çorum İbrahim köy, 3 km sonra
73 2016 Çorum Bozboğa
74 2016 Çorum Bozboğa, 3 km sonra
75 2016 Çorum Ömer bey
76 2017 Hatay Reyhanlı’ya giderken
77 2017 Hatay Reyhanlı girişi
78 2017 Hatay Reyhanlı merkez
79 2017 Hatay 3 km sonra
80 2017 Hatay Reyhanlı çıkışı
81 2017 Balıkesir Çepni köyü
82 2017 Bursa Keşlik köyü
83 2017 Amasya Yeşilören köyü
84 2017 Amasya Yalnız köyü girişi
85 2017 Amasya Yalnız köyü çıkış
17
Çizelge 3.1. 2016 ve 2017 yılı yetiştirme sezonunda toplanan örnekler ve lokasyon bilgileri (devam)
3.2. Nematodların Bitki ve Toprak Örneklerinden Ayrılması
Nematodların bitki ve toprak örneklerinden ayrılması için Modifiye Baermann Huni Tekniği ve petri yöntemi (Whitehead ve Hemming, 1965; Hooper, 1986) kullanılmıştır. Nematodların ayrılması için her bir lokasyondan alınan soğan bitkisi örneklerinden 3 adet bitki seçilmiş, her bir bitkinin kök, yumru ve yaprak kısımları ayrılarak bir bitki 3 petri kabında ekstrakte edilmiştir ve petri kabı çeşme suyu ile doldurularak 4 saat bekletilmiştir. Süre sonunda petri kabındaki su 100 ml’lik mezürlere doldurulmuştur. İki saat süre ile nematodların yerçekimi etkisiyle dipte toplanması sağlanmıştır. Üst kısımdaki su sifon yapılarak alınmış ve altta kalan 10 ml’lik nematod süspansiyonu 15 ml’lik santrifüj tüplerine aktarılmıştır. Bitki örneklerinden elde edilen nematod süspansiyonları 1 ml’ye azaltılarak içerisinden alınan 50 µl lam üzerine yerleştirilerek incelenmiştir (Şekil 3.3). Bir ml nematod süspansiyonu içerisindeki nematod sayısını belirlemek için, 50 µl örnekte sayılan her bir cins nematod sayısı 20 ile çarpılmıştır. Whitehead ve Hemming (1965) tarafından geliştirilen petri yöntemine göre toprak örneklerinde nematodların ayrılması için her bir lokasyondan alınan toprak örneklerinden 100 gr. olacak şekilde tartılıp her lokasyon için birer petri kabında ekstrakte edilmiş ve petri kabı çeşme suyu ile doldurularak 1 gün bekletilmiştir. Süre sonunda petri kabındaki su 100 ml’lik mezürlere doldurulmuştur. İki saat süre ile nematodların yerçekimi etkisiyle dipte toplanması için beklenmiştir. Üst kısımdaki su atılmış ve altta kalan 10 ml’lik nematod süspansiyonu 15 ml’lik santrifüj tüplerine
Örnek No Örnek Toplama Yılı İl İlçe/Köy
87 2017 Amasya Deveci köyü
88 2017 Amasya Eraslan köyü
89 2017 Amasya Gözlek köyü
90 2017 Konya Çiller köyü girişi
91 2017 Konya 3 km sonra
92 2017 Aksaray Toprakkaya
93 2017 Mersin Silifke
94 2017 Mersin Kocavilayet mah.
95 2017 Mersin 3 km sonra
96 2017 Mersin Toroslar mah.
97 2017 Mersin Gimem mah.
98 2017 Mersin Osmaniye mah.
99 2017 Mersin Demirtaş mah.
100 2017 Denizli Tavas
18
aktarılmıştır (Şekil 3.3). Elde edilen nematod süspansiyonları 1 ml’ye azaltılarak içerisinden alınan 50 µl lam üzerine yerleştirilerek incelenmiştir (Şahin, 2010).
Şekil 3.3. Nematodların bitki ve toprak örneklerinden ayrılması
3.3. Moleküler Tür Teşhislerinin Yapılması
Bu tez çalışmasında 215O468 numaralı TÜBİTAK projesi kapsamında morfolojik ve morfometrik ayrımlar sonucunda Ditylenchus spp. olduğu düşünülen nematod örnekleri incelenmiştir. 2016 ve 2017 yılları soğan üretim sezonunda alınan soğan bitkisi ve toprak örneklerinden mikroskop altında Ditylenchus spp. olduğu tespit edilen nematodlar, her bir örnekten 0,5 ml lik eppendorf tüplerininin içerisine ortalama 10 birey ayrılmıştır. Daha sonra eppendorf tüplerinin içinde bulunan az miktardaki su 30 °C’de etüvde 2 gece bekletilerek kurutulmuş ve DNA ekstraksiyon işlemine hazır hale getirilmiştir. Moleküler taramalar iki tekerrür olacak şekilde gerçekleştirilmiştir.
3.3.1. DNA İzolasyonu ve Polimeraz Zincir Reaksiyonu
Her bir nematod popülasyonundan elde edilen nematod örneklerinden DNA izolasyonu, Waeyenberge ve ark. (2000) tarafından geliştirilen Holterman ve ark. (2006)’ın modifiye ettiği prosedüre göre gerçekleştirilmiştir. İzolasyonda kullanılan solüsyonların içeriği aşağıda verilmiştir.
19
Bu tez çalışmasında kullanılan çözeltilerin hazırlanması aşağıda verilmiştir. 1 M Sodyum Klorid stok çözeltisi (58,44 Mol. Ağırlık):
5,84 gr NaCl'yi 100 ml dH20 içerisinde eritilir.
1 M Tris HCl, pH 8 stok çözeltisi (121,14 Mol Ağırlık):
12,11 gr Tris HCl çözeltisi 100 ml dH2O içinde eritilir ve pH'sı 8.0’e ayarlanır. Sodyum
Klorid çözeltisi ve Tris tampon çözeltisi otoklav işlemi yaptıktan sonra 4 ºC’de muhafaza edilir.
20 mg / ml Proteinaz K stok solüsyonu
970 μl steril su içerisine 0,02 mg Proteinaz K koyup vorteklesme işlemi yapıldıktan sonra son hacim 1000 μl’ye tamamlanır.
Lizis Tampon Eksi (WLB-)
10-15 ml steril bir plastik tüp içerisine 2 ml 1 M NaCl +2 ml 1 M Tris-HCl (pH8) + 5,5ml steril su eklenerek vortekslenir. 4°C’de 1 ay muhafaza edilebilir.
Lizis Tamponu Artı (WLB +)
1,5-2 ml eppendorf tüpü içerisine, 950 μl WLB- + 10 μl beta-mercaptoethanol + 40 μl 20 mg / ml Proteinaz K ekleyip vortekslenir ve -20 ºC’de 1 ay muhafaza edilebilir.
Solüsyonların hazırlanması tamamlandıktan sonra, 0,2 ml’lik tüplere beş adet nematod koyup üzerlerine; 25 μl steril su ve 25 μl WLB+ eklenerek, 65 °C’de 1,5 saat ardından 99 °C'de 5 dakika inkübasyona bırakılır. Süre tamamlandığında DNA izolasyonu gerçekleştirilmiş olmaktadır. DNA izolasyonu yapılan örnekler +4° C’de muhafaza edilebilir. Nematod DNA’sının çok küçük olması nedeniyle DNA konsantrasyonu düşük olduğundan agaroz jelde doğrudan görüntülenememektedir. Bu nedenle ekstrakte edilen DNA’lar DitNF1 - rDNA2 primeri kullanılarak Polimeraz Zincir Reaksiyonu (PZR) ile çoğaltılıp elde edilen PZR ürünleri 24 ml 5 x TBE, 96 ml ddH2O, 1,2 gr
Agaroz ve 13 µl Etidyum Bromür (10 mg/ml) içeren 120 ml % 1’lik Agaroz jellerde koşulmuş ve görüntülenmiştir (Şekil 3.4).
20
Şekil 3.4. Nematod örneklerinde DNA kontrolü amacıyla yapılan DitNF1-rDNA2 primeri ile yapılan PZR ürünlerine ait agaroz jel görüntüsü
Bu tez çalışmasında moleküler karakterizasyonda kullanılan primerlere ait dizi bilgisi, beklenen bant büyüklükleri ve hedef bölgeler Çizelge 3.2’de verilmiştir.
Çizelge 3.2. Çalışmada kullanılacak olan SCAR ve SSR markörleri
Primer Adı Primer Dizisi (5’--- 3’) D. dipsaci’de Beklenen Büyüklük (bç)
Hedef Bölge Kaynak Makale
DdpS1 rDNA2
5′-TGGCTGCGTTGAAGAGAACT-3′ 517 bç
5.8S rDNA Vrain ve ark., 1992 5′-TTTCACTCGCCGTTACTAAGG-3′ DipU F DipU R 5’-CCCATTTTTGAACTTTTTTACAAG-3’ 333 bç ITS bölgelerini çevreleyen Vovlas ve ark., 2011 5’-CTAGATTAGCAAAGACGTATATC-3’ DipU F Dip1 R 5’-CCCATTTTTGAACTTTTTTACAAG-3’ 256 bç
ITS1-ITS2 Marek ve ark., 2010 5’-GAAAAGCACCCAACCAGTACC-3’ DIT2 F DIT2 R 5′-GCAATGCACAGGTGGATAAAG-3′ 325 bç ITS bölgelerini çevreleyen Zouhar ve ark., 2007 5′-CTGTCTGTGATTTCACGGTAGAC-3′ DIT5 F DIT5 R 5′-GAAAACCAAAGAGGCCGTAAC-3′ 245 bç ITS bölgelerini çevreleyen Zouhar ve ark., 2007 5′-ACCTGATTCTGTACGGTGCAA-3′ DitNF1 rDNA2 5′-TTATGACAAATTCATGGCGG-3′
263 bç 18S ve ITS1 Vrain ve ark., 1992 5′-TTTCACTCGCCGTTCTAAGG-3′ H05 H06 5′- TCAAGGTAATCTTTTTCCCCACT-3′ 242 bç 5.8S rDNA Esquibet ve ark., 2003 5′-CAACTGCTAATGCGTGCTCT-3′ PF1 PR1 5′-AACGGCTCTGTTGGCTTCTAT-3 327 bç ITS bölgelerini çevreleyen Marek ve ark., 2005 5′-ATTTACGACCCTGAGCCAGAT-3′ PF2 PR2 5′-TCGCGAGAATCAATGAGTACC-3′ 396 bç ITS bölgelerini çevreleyen Marek ve ark., 2005 5′-AATAGCCAGTCGATTCCGTCT-3′ 18S 26S 5’-TTGATTAGGTCCCTGCCCTTT-3’
967 bç ITS1-5.8S-ITS2 Marek ve ark., 2010 5’-TTTCACTCGCCGTTACTAAGG-3’
21
Bu primerlere ait kaynak makalelerdeki PZR koşulları ve miktarları optimize edilmiştir PZR işlemi, BIO-RAD C1000 Touch Thermal Cycler kullanılarak gerçekleştirilmiştir (Şekil 3.5).
Şekil 3.5. Çalışmada kullanılan ısı döngüsü cihazı
DNA ve PZR ürünlerinin elektroforezi % 1’lik agaroz jellerde UV ışık altında Sambrook ve ark. (1989) tarafından belirtilen standart yöntemlere göre gerçekleştirilmiştir. PZR ürünlerinin yürütülmesinde Thermo Scientific EC 1000 XL Power Supply Elektroforez Sistemi kullanılmaktadır (Şekil 3.6).
Şekil 3.6. Örneklerin agaroz jel elektroforezi
PZR ürünlerinin yürütüldüğü jellerin görüntülenmesinde ise BIO-RAD ChemiDOC MP Görüntüleme Sistemi kullanılmıştır (Şekil 3.7).
22
Şekil 3.7. Ultraviyole görüntüleme cihazı
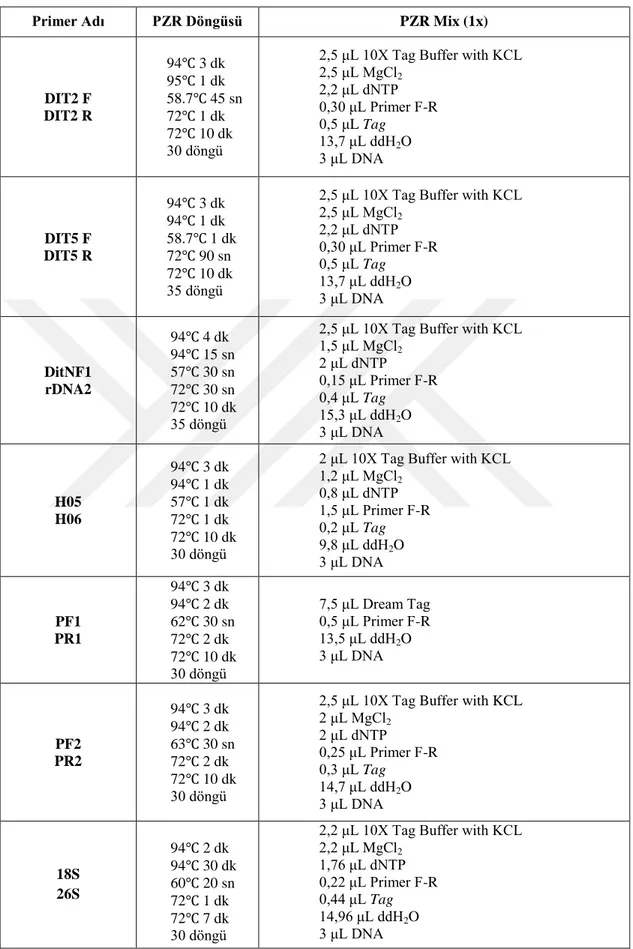
Kullanılan primerlerin PZR master mix oranları ve PZR koşulları Çizelge 3.3’de verilmiştir.
Çizelge 3.3. Çalışmada kullanılan primerlere ait PZR koşulları
Primer Adı PZR Döngüsü PZR Mix (1x)
DdpS1 rDNA2 94℃ 1 dk 94℃ 30 dk 60℃ 30 sn 72℃ 45 sn 72℃ 10 dk 40 döngü
2 μL 10X Tag Buffer with KCL 1,2 μL MgCl2 1,6 μL dNTP 1,5 μL Primer F 0,2 μL Tag 10 μL ddH2O 3 μL DNA DipU F DipU R 95℃ 11 dk 95℃ 45 sn 55℃ 30 sn 72℃ 1 dk 72℃ 5 dk 45 döngü
2,2 μL 10X Tag Buffer with KCL 2,2 μL MgCl2 1,76 μL dNTP 0,22 μL Primer F-R 0,44 μL Tag 14,96 μL ddH2O 3 μL DNA DipU F Dip1 R 95℃ 11 dk 95℃ 45 sn 55℃ 30 sn 72℃ 1 dk 72℃ 5 dk 45 döngü
2,2 μL 10X Tag Buffer with KCL 2,2 μL MgCl2 1,76 μL dNTP 0,22 μL Primer F-R 0,44 μL Tag 14,96 μL ddH2O 3 μL DNA
23
Çizelge 3.3. Çalışmada kullanılan primerlere ait PZR koşulları (devam)
Primer Adı PZR Döngüsü PZR Mix (1x)
DIT2 F DIT2 R 94℃ 3 dk 95℃ 1 dk 58.7℃ 45 sn 72℃ 1 dk 72℃ 10 dk 30 döngü
2,5 μL 10X Tag Buffer with KCL 2,5 μL MgCl2 2,2 μL dNTP 0,30 μL Primer F-R 0,5 μL Tag 13,7 μL ddH2O 3 μL DNA DIT5 F DIT5 R 94℃ 3 dk 94℃ 1 dk 58.7℃ 1 dk 72℃ 90 sn 72℃ 10 dk 35 döngü
2,5 μL 10X Tag Buffer with KCL 2,5 μL MgCl2 2,2 μL dNTP 0,30 μL Primer F-R 0,5 μL Tag 13,7 μL ddH2O 3 μL DNA DitNF1 rDNA2 94℃ 4 dk 94℃ 15 sn 57℃ 30 sn 72℃ 30 sn 72℃ 10 dk 35 döngü
2,5 μL 10X Tag Buffer with KCL 1,5 μL MgCl2 2 μL dNTP 0,15 μL Primer F-R 0,4 μL Tag 15,3 μL ddH2O 3 μL DNA H05 H06 94℃ 3 dk 94℃ 1 dk 57℃ 1 dk 72℃ 1 dk 72℃ 10 dk 30 döngü
2 μL 10X Tag Buffer with KCL 1,2 μL MgCl2 0,8 μL dNTP 1,5 μL Primer F-R 0,2 μL Tag 9,8 μL ddH2O 3 μL DNA PF1 PR1 94℃ 3 dk 94℃ 2 dk 62℃ 30 sn 72℃ 2 dk 72℃ 10 dk 30 döngü 7,5 μL Dream Tag 0,5 μL Primer F-R 13,5 μL ddH2O 3 μL DNA PF2 PR2 94℃ 3 dk 94℃ 2 dk 63℃ 30 sn 72℃ 2 dk 72℃ 10 dk 30 döngü
2,5 μL 10X Tag Buffer with KCL 2 μL MgCl2 2 μL dNTP 0,25 μL Primer F-R 0,3 μL Tag 14,7 μL ddH2O 3 μL DNA 18S 26S 94℃ 2 dk 94℃ 30 dk 60℃ 20 sn 72℃ 1 dk 72℃ 7 dk 30 döngü
2,2 μL 10X Tag Buffer with KCL 2,2 μL MgCl2 1,76 μL dNTP 0,22 μL Primer F-R 0,44 μL Tag 14,96 μL ddH2O 3 μL DNA
24
Araştırmada kullanılan nematod genotiplerine ait PZR ürünlerinin tüm jellerde yürütülme sırası aşağıda verilmiştir. Çalışmada incelenen örneklere ait PZR ürünleri her bir primer için toplam beş jele yüklenmiştir (Çizelge 3.4). Jellerde verilen numaralar Çizelge 3.1’de verilen örnek numaraları ile aynıdır.
Çizelge 3.4. PZR ürünlerinin jele yüklenme sırası
Jel imaj sisteminde görüntülenen jellere ait fotoğraflar Biorad ChemiDoc MP programında açıldıktan sonra kuyucuklar (lane) işaretlenmiş ve baz büyüklüklerine ait okumalar yapılmıştır. Ladder’ın baz çifti (bç) bakımından bant büyüklükleri ve bulunduğu kuyucuk numarası girilmiştir (Şekil 3.8). Çalışmada 100 bç Ladder (Thermo Scientific, SM0321) kullanılmıştır. Filogenetik analizlerde kullanılmak üzere tüm primerlerin bantlarını içeren tablo oluşturulurken, beklenen büyüklükteki bant varsa 1 yoksa 0 yazılarak matriks oluşturulmuştur.
1. Jel Sıra No 2. Jel Sıra No 3. Jel Sıra No 4. Jel Sıra No 5. Jel Sıra No 6. Jel Sıra No 7. Jel Sıra No 100 bç Ladder 100 bç Ladder 100 bç Ladder 100 bç Ladder 100 bç Ladder 100 bç Ladder 100 bç Ladder Pozitif Kontrol Pozitif Kontrol Pozitif Kontrol Pozitif Kontrol Pozitif Kontrol Pozitif Kontrol Pozitif Kontrol Negatif Kontrol Negatif Kontrol Negatif Kontrol Negatif Kontrol Negatif Kontrol Negatif Kontrol Negatif Kontrol 01 18 35 52 64 76 93 02 19 36 53 65 77 94 03 20 37 54 66 78 95 04 21 38 55 67 79 96 05 22 39 56 68 80 97 06 23 40 57 69 81 98 07 24 41 58 70 82 99 08 25 42 59 71 83 100 09 26 43 60 72 84 101 10 27 44 61 73 85 11 28 45 62 74 86 12 29 46 63 75 87 13 30 47 88 14 31 48 89 15 32 49 90 16 33 50 91 17 34 51 92
25
Şekil 3.8. Bantları işaretlenmiş jel fotoğrafı
3.4. Verilerin Değerlendirilmesi
Nematod populasyonlarından elde edilen genotip analizleri DendroUPGMA (D-UPGMA) programında yapılmıştır (Anonim, 2018). Yapılan moleküler taramalar sonucunda her bir primerde D. dipsaci için beklenen büyüklükte bant veren örneklere 1, beklenen büyüklükte bant vermeyenlere 0 yazılmıştır. Bu veriler filogenetik analiz için de kullanılmıştır. Taranan nematod örneklerinin verileri genotip analizleri yapılarak UPGMA dendogramlarının oluşturulmasında DendroUPGMA (D-UPGMA) programı kullanılmıştır (Şekil 4.11- Şekil 4.12).
26 4. BULGULAR VE TARTIŞMA
Bu tez çalışmasında soğan bitkisi ve toprak örneklerinden izole edilen nematodlar ve Ditylenchus dipsaci olduğu bilinen pozitif kontrol tür teşhislerinin yapılması amacıyla SSR ve SCAR markörleri ile taranmıştır. Bu amaçla toplam 10 adet moleküler markör kullanılarak toplanılan 101 adet nematod örneğinin moleküler taramaları yapılmıştır (Şekil 4.1 - 4.10). Jellerde verilen numaralar Çizelge 3.1’de ve Çizelge 4.2’de verilen nematod örneği numaraları ile aynıdır. Toplam 101 adet örnek dördü 20’lik, ikisi 15’lik, biri ise 12’lik kuyucuklardan oluşmak üzere her bir primer seti için toplam 7 jelde yürütülmüştür. Tüm primerler için 2016 yılına ait örneklerde 1. jele 100 bç ladder, pozitif kontrol, negatif kontrol ve sırasıyla 1-17 numaralı örnekler yüklenmiştir. İkinci jele ladder ve kontrol gruplarını takiben sırasıyla 18-34 numaralı örnekler, 3. jelde ise kontrol gruplarını takiben 35-51 arası örnekler, 4. jelde 52-63 numaralı örnekler, 5. jelde ise 64-75 numaralı örnekler, 6. jelde 76-92 arası örnekler ve 7. jelde ise 93-101 arası numaralı örnekler yüklenmiştir.
Elde edilen PZR ürünlerinden 1-17 numaralar arası örnekleri içeren 1. jelde 1, 2, 3, 4 ve 5 numaralı örnekler Adana’dan, 6, 7, 8, 9, 10 ve 11 numaralı örnekler Hatay’dan, 12, 13, 14, 15, 16 ve 17 numaralı örnekler Tekirdağ’dan alınan örnekler bulunmaktadır. İkinci jel de 18 Tekirdağ, 19 Balıkesir, 20, 21, 22, 23, 24, 25, 26, 27 ve 28 numaralı örnekler Bursa’dan, 29 ve 30 numaralı örnekler Konya ilinden, 31 Aksaray, 32, 33 ve 34 numaralı örnekler Karaman ilinden alınan örnekler bulunmaktadır. Üçüncü jelde yürütülen 35-51 numaralı örneklerden 35, 36 ve 37 numaralı örnekler Karaman’dan, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47 ve 48 numaralı örnekler Ankara’dan, 49, 50 ve 51 numaralı örnekler Eskişehir iline ait örneklerdir. Numarası 52-63 arasındaki örnekleri içeren 4. Jelde ise 52 numaralı örnek Eskişehir ilinden, 53, 54, 55, 56, 57, 58, 59, 60, 61 ve 62 numaralı örnekler Tokat ilinden ve 63 numaralı örnek ise Amasya ilinden toplanmıştır. Beşinci jelde ise 64, 65, 66, 67, 68, 69 ve 70 arası örnekler Amasya ilinden ve 71, 72, 73, 74 ve 75 arası örnekler ise Çorum ilindendir. Altıncı jelde 76, 77, 78, 79 ve 80 numaralı örnekler Hatay ilinden, 81 numaralı örnek Balıkesir’den, 82 numaralı örnek Bursa’dan, 83, 84, 85, 86, 87, 88 ve 89 numaralı örnekler Amasya’dan, 90 ve 91 Konya’dan, 92 numaralı örnek ise Aksaray’dan alınan örnekler bulunmaktadır. Yedinci
27
jelde ise 93, 94, 95, 96, 97, 98 ve 99 numaralı örnekler Mersin ilinden ve 100 ve 101 numaralı örnekler Denizli ilinden alınan örneklerdir.
PF1 - PR1 primeri ile yapılan PZR taraması ile elde edilen ürünlerin % 1’lik agaroz jellerde görüntülenmesi sonucunda pozitif kontrol baz alınarak 327 bç’lik beklenen baz çifti büyüklüğünde bant veren Ditylenchus dipsaci türleri tespit edilmiştir (Şekil 4.1). İncelenen toplam 101 örnekten 50’sinde (01, 02, 03, 04, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 30, 31, 35, 40, 50, 51, 53, 57, 59, 61, 64, 66, 67, 71, 73, 75, 77, 79, 82, 83, 84, 87, 93, 94, 95, 96, 97, 98, 99, 100 ve 101) beklenen büyüklükte bant gözlenmiştir. Örnekler kaynak makalede de belirtildiği gibi 327 bç de bant vermiştir (Marek ve ark., 2005). Bu örneklerden 1-4 arası numaralı örnekler Adana, 6-11 arası örnekler Hatay, 12-18 arası örnekler Tekirdağ, 20 ve 23 numaralı örnek Bursa, 30 numaralı örnek Konya, 31 numaralı örnek Aksaray, 35 numaralı örnek Karaman, 40 numaralı örnek Ankara, 50 ve 51 numaralı örnekler Eskişehir, 53, 57, 59 ve 61 numaralı örnekler Tokat, 64, 66 ve 67 numaralı örnekler Amasya, 71,73 ve 75 numaralı örnekler ise Çorum ilinden, 77 ve 79 numaralı örnekler Hatay, 82 numaralı örnek Bursa, 83, 84 ve 87 numaralı örnekler Amasya, 93-99 arası Mersin ve 100 ve 101 numaralı örnekler ise Denizli ilinden toplanan numunelerdir.
Şekil 4.1. PF1 - PR1 primeri ile yapılan moleküler seleksiyona ait agaroz jel örnekleri
28
Şekil 4.1. PF1 - PR1 primeri ile yapılan moleküler seleksiyona ait agaroz jel örnekleri (devam)
(L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
PF2 - PR2 primerleri ile yapılan moleküler taramalar sonucunda çalışmada incelenen örneklerden 01, 02, 03, 04, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 30, 31, 35, 40, 50, 51, 53, 57, 59, 61, 64, 66, 67, 71, 73, 75, 77, 79, 82, 83, 84, 87, 93, 94, 95, 96, 97, 98, 99, 100 ve 101 numaralı örneklerin Ditylenchus dipsaci nematodu
29
olduğu belirlenmiştir (Şekil 4.2). Toplam 101 adet nematod örneğinden 50 tanesinin pozitif kontrol baz alınarak 396 bç’de bant profili verdiği gözlemlenmiştir. Bu örnekler Adana, Hatay, Tekirdağ, Bursa, Konya, Aksaray, Karaman, Ankara, Eskişehir, Tokat, Amasya, Mersin, Denizli ve Çorum illerindir.
Şekil 4.2. PF2 - PR2 primeri ile yapılan moleküler karakterizasyon (L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
30
Şekil 4.2. PF2 - PR2 primeri ile yapılan moleküler karakterizasyon (devam) (L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
Marek ve ark. (2005) yılında yapılan bir araştırmada Ditylenchus dipsaci türüne spesifik bu tez çalışmasında da kullanılan PF1-PR1, 18S-26S ve PF2-PR2 primer çiftleri ile 7 adet nematod örneği taranmıştır. Yapılan taramalarda kullanılan primer çiftleri (PF1-PR1, 18S-26S ve PF2-PR2) ile üç adet nematod örneğinin Ditylenchus dipsaci olduğu tanımlanmıştır. Bu tez çalışmasında da aynı primerler kullanılarak pozitif kontrol baz alınarak 101 adet nematod örneğinden 50 tanesinin D. dipsaci olduğu saptanmıştır.
DitNF1 - rDNA2 primeri ile yapılan moleküler taramalar ile elde edilen PZR ürünlerinin pozitif kontrol baz alınarak % 1’lik agaroz jelde görüntülenmesi sonucunda seçilen örneklerin jel görüntüsü Şekil 4.3’de verilmiştir. Elde edilen PZR ürünlerinden 01, 02, 03, 04, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 30, 31, 35, 40, 50, 51, 53, 57, 59, 61, 64, 66, 67, 71, 73, 75, 77, 79, 82, 83, 84, 87, 93, 94, 95, 96, 97, 98, 99, 100 ve 101 numaralı örneklerin D. dipsaci için 263 bç’lik beklenen baz çifti büyüklüğünde bant verdikleri tespit edilmiştir. Yapılan taramalar sonunda incelenen 101 adet örnekten 50’sinin D. dipsaci olduğu saptanmıştır. D. dipsaci olduğu saptanan iller Adana, Hatay, Tekirdağ, Bursa, Konya, Aksaray, Karaman, Ankara, Eskişehir, Tokat, Amasya, Mersin, Denizli ve Çorum illerindir.
31
Şekil 4.3. DitNF1 - rDNA2 primeri ile yapılan moleküler karakterizasyon
32
Şekil 4.3. DitNF1 - rDNA2 primeri ile yapılan moleküler karakterizasyon (devam)
(L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
Subbotin ve ark. (2005) tarafından yapılan bir çalışmada Ditylenchus dipsaci sensu stricto türü için spesifik primer tasarlama çalışması yapılmış ITS bölgelerindeki bilgiler kullanılarak DitNF1 ve rDNA2 primer seti geliştirilmiştir. Primer tasarlama çalışmasının ardından PZR taramaları yapılmış ve bu primer seti ile sensu stricto türlerinde 263 bç’de bant gözlendiği belirlenmiştir. Bu tez çalışmasında da aynı primer seti kullanılarak pozitif kontrol baz alınarak 101 adet nematod örneğinden 50 tanesinin D. dipsaci olduğu saptanmıştır.
DdpS1 - rDNA2 primeri ile yapılan taramalar sonucunda pozitif kontrol referans alınarak moleküler taraması yapılan örneklerden beklenen baz çifti büyüklüğünde (517 bç) bant veren D. dipsaci olan örnekler tespit edilmiştir (Şekil 4.4). Toplam 101 adet nematod örneğinden 50 tanesinin (01, 02, 03, 04, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 30, 31, 35, 40, 50, 51, 53, 57, 59, 61, 64, 66, 67, 71, 73, 75, 77, 79, 82, 83, 84, 87, 93, 94, 95, 96, 97, 98, 99, 100 ve 101 numaralı örnekler) 517 bç’de bant verdiği gözlemlenmiştir.
Şekil 4.4. DdpS1 - rDNA2 primeri ile yapılan moleküler taramalara ait jel görüntüsü (L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
33
Şekil 4.4. DdpS1 - rDNA2 primeri ile yapılan moleküler taramalara ait jel görüntüsü (devam) (L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)
Kerkoud ve ark. (2007) yaptıkları bir çalışmada, DdpS1-rDNA2 ve DdpS2-rDNA2 primerlerini kullanarak D. dipsaci ve D. gigas türlerinin moleküler farklılıklarını ortaya koymuşlardır. DdPS1-rDNA2 primeri D. dipsaci’nin belirlenmesinde kullanılmıştır. Çalışmada 20 popülasyon kullanılmış olup, DdPS1-rDNA2 primerine ait taramalarda 14 popülasyonun sekiz tanesinin D. dipsaci olduğu tespit edilmiştir (Kerkoud ve ark.,
34
2007). Bu tez çalışmasında da amplifikasyon ürünlerinin okumaları yapıldığında DdPS1-rDNA2 primeri için 517 bç’de 50 adet örneğin bant verdiği gözlemlenmiştir.
Moleküler taramaları yapılan 101 adet nematod örneğinden DipU F – DipU R primer setine göre 50 tanesinin (01, 02, 03, 04, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 30, 31, 35, 40, 50, 51, 53, 57, 59, 61, 64, 66, 67, 71, 73, 75, 77, 79, 82, 83, 84, 87, 93, 94, 95, 96, 97, 98, 99, 100 ve 101) Ditylenchus dipsaci olduğu tespit edilmiştir (Şekil 4.5). DipU F - DipU R primer seti için yaklaşık beklenen baz büyüklüğü 333 bç’dir (Marek ve ark., 2010). Bu örnekler Adana, Hatay, Tekirdağ, Bursa, Konya, Aksaray, Karaman, Ankara, Eskişehir, Tokat, Amasya, Mersin, Denizli ve Çorum illerinden alınmıştır.
Şekil 4.5. DipU F – DipU R primeri ile yapılan moleküler karakterizasyon (L: 100 bç Ladder, NK: Negatif Kontrol, PK: Pozitif Kontrol)