ÖZET
YÜKSEK LĐSANS TEZĐ
KIRMIZI ÇAMURUN GRANÜLLEŞTĐRĐLMESĐ VE SUDAKĐ FLORÜRÜN GĐDERĐMĐNDE KULLANILMASI
Nadide DANAOĞLU
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Çevre Mühendisliği Ana Bilim Dalı
Danışman: Doç. Dr. Ali TOR 2009, 35 Sayfa
Jüri:
Prof.Dr.Yunus ÇENGELOĞLU, Prof.Dr.Mehmet Emin AYDIN, Doç.Dr.Ali TOR
Bu çalışmada kırmızı çamur granül hale getirilmiş ve sudaki florürün giderimi için hem kesikli sistemde hem de kolon sisteminde adsorben olarak kullanılmıştır. Kesikli adsorpsiyon tekniğinde, süre, çözelti pH’ı ve florür konsantrasyonunun giderim üzerine etkisi incelenmiştir. Kırmız çamur ile maksimum florür gideriminin pH 4.7’de olduğu tespit edilmiştir. Gerekli temas süresinin 6 saat olduğu ve adsorpsiyonun 2. dereceden kinetik modele uyduğu belirlenmiştir. Kesikli sistemde granül kırmızı çamur ile florür gideriminde Freundlich izoterm modeli Langmuir modeline kıyasla adsorpsiyon verilerini daha iyi temsil etmektedir. Kolon deneyleri sabit adsorben miktarı ve florür konsantrasyonunda farklı akış hızlarında gerçekleştirilmiştir. Elde edilen sonuçlara göre, akış hızının artmasıyla maksimum kolon kapasitesinin azaldığı belirlenmiştir. Thomas modeli kolon deneylerinden elde edilen sonuçlar için kullanılmış ve model sonuçları ile deneysel sonuçların uyum içinde olduğu belirlenmiştir. Kolonda kullanılan granül kırmızı çamur 0.2 M NaOH ile rejenere edilmiş ve yeniden kullanılabilirliği araştırılmıştır.
ABSTRACT
M.Sc. Thesis
GRANULATION OF THE RED MUD AND ITS USE IN THE REMOVAL OF FLUORIDE FROM WATER
Nadide DANAOĞLU
Selçuk University
Graduate School of Natural and Applied Sciences Department of Environmental Engineering
Supervisor: Assoc. Prof. Dr. Ali TOR 2009, 35 Pages
Jury:
Prof.Dr.Yunus ÇENGELOĞLU, Prof.Dr.Mehmet Emin AYDIN, Assoc. Prof. Dr. Ali TOR
In this study, red mud was granulated and used as an adsorbent for the removal of fluoride from water according to the batch and column systems. For the batch technique, effect of pH, contact time and fluoride concentration on the removal was investigated. Maximum floride removal was obtained at pH 4.7. The contact time to attain the equilibrium was 6 h and adsorption was followed the second-order kinetic model. In comparison to the Langmuir model, Freundlich model better described the adsorption data. Column experiments were carried out under a constant influent concentration and bed depth, and different flow rate. Thomas model was applied to the experimental results. The modelled breakthrough curves were obtained, and they were in agreement with the corresponding experimental data. The regeneration of the column was accomplished by pumping 0.2 M of NaOH and reusability of the column was investigated.
ĐÇĐNDEKĐLER ÖZET ………. i ABSTRACT ……….. ii TABLOLAR LĐSTESĐ ………. iv ŞEKĐLLER LĐSTESĐ ………... v ÖNSÖZ ……….. vi 1. GĐRĐŞ ……… 1 1.1. Çalışmanın amacı ……….. 2 2. KAYNAK ARAŞTIRMASI ……….. 3
2.1. Flor Elementinin Fiziksel ve Kimyasal Özellikleri ………. 3
2.2. Florür’ün Doğadaki Kaynakları ve Sularda Bulunuşu ……….. 4
2.3. Sulardaki Florürün Đnsan Sağlına Etkileri ………. 5
2.4.Florür Đyonunun Su Ortamından Giderimi Đçin Yapılmış Çalışmalar 7 2.4.1. Adsorpsiyon Yöntemi ile Sulardan Florür Giderimi ………… 8
2.4.1.1. Kırmızı çamur ……….. 10
2.4.1.2.Kırmızı çamur ile yapılan diğer adsorpsiyon çalışmaları ……… 11 3. MATERYAL-METOT ……… 13
3.1. Deneylerde Kullanılan Kimyasal Maddeler ………. 13
3.1.2. Granül Kırmızı Çamurun Hazırlanışı ……….. 13
3.2. Kesikli Adsorpsiyon Deneyleri ………. 14
3.3. Kolon Adsorpsiyon Deneyleri ………. 15
3.4. Kolon Rejenerasyon Çalışmaları ……….. 16
3.5. Florür Tayini ……….. 16
4. SONUÇLAR VE TARTIŞMA ……… 18
4.1. Granül kırmızı çamurun karakterizasyonu ……… 18
4.2. Kesikli Adsorpsiyon Deneyleri ………. 19
4.2.1. Çözelti pH’sının Etkisi ………. 19
4.2.2. Temas Süresinin Etkisi ……… 20
4.2.3. Adsorpsiyon Đzoterm Modelleri ……….. 23
4.3. Kolon Deneylerinden Elde Edilen Sonuçlar ……… 26
4.4. Kolon Rejenerasyonu ……… 28
5. GENEL DEĞERLENDĐRME VE ÖNERĐLER ……….. 29
TABLOLAR LĐSTESĐ
Tablo 2.1. Florür iyonu için belirlenen içme suyu standartları………. 6 Tablo 4.1. Granül kırmızı çamurun kimyasal kompozisyonu……….... 18 Tablo 4.2. Granül kırmızı çamur ile florür giderimi üzerine çözelti pH’sının etkisi (florür konsantrasyonu: 15 mg/L, granül kırmızı çamur:5 g/L, temas süresi: 8 saat, karıştırma hızı: 400 rpm ve sıcaklık: 25±1 o
C). 19 Tablo 4.3. Birinci derece kinetik model parametreleri……….. 22 Tablo 4.4. Đkinci derece kinetik model parametreleri……….. 23 Tablo 4.5. Langmuir ve Freundlich izoterm modeli parametreleri………… 24 Table 4.6. Florür gideriminde kullanılan çeşitli adsorbanlar için Freundlich
izoterm parametreleri……….. 25
Tablo 4.7. Kolon deneylerinden ve Thomas modelinden elde edilen
parametreler………. 26
Tablo 4.8. Kolon rejenerasyon parametreleri (florür konsantrasyonu: 5 mg/L, akış hızı: 2 mL/dk, desorpsiyon çözeltisi: 0.2 M NaOH, desorpsiyon
Şekil 2.1. Bayer prosesinin basit akım şeması ……… Şekil 3.1. Granül kırmızı çamurun hazırlama prosedürü ………. 14 Şekil 4.1. Granül kırmızı çamur ile florür giderimine temas süresinin etkisi
(çözelti pH’sı: 4.7, granül kırmızı çamur miktarı: 5 g/L ve karıştırma hızı: 400 rpm, sıcaklık 25±1 o
C)……… 21
Şekil 4.2. Granül kırmızı çamur ile florür giderimi için Langmuir ve Freundlich izoterm modelleri (çözelti pH’sı: 4.7, temas süresi: 6 saat, granül kırmızı çamur miktarı: 5 g/L, karıştırma hızı: 400 rpm, sıcaklık:25±1 o
C)……… 25
Şekil 4.3. Farklı akış hızlarındaki deneysel veriler ve Thomas modelinden elde edilen breakthrough eğrileri………..……… 27
ÖNSÖZ
Tez çalışmam boyunca her açıdan yardımlarını, fikir ve desteğini benden esirgemeyen, en önemlisi bana sabırlı davrandığından dolayı danışman Hocam Sayın Doç. Dr Ali TOR ’a çok teşekkür ederim.
Ayrıca tez çalışmam süresince bana maddi manevi destek olan ve moral veren aileme çok teşekkür ederim.
1. GĐRĐŞ
Florür, içme sularındaki konsantrasyonuna bağlı olarak insan sağlığına yararlı ya da zararlı olabilmektedir. Đçme sularındaki florür iyonunun özellikle çocukların diş gelişimi ve sağlığı açısından 1-1.5 mg/L aralığında olması gerekir. Bu durum, özellikle gelişmekte olan çocuklarda diş çürümelerinin oluşması riskini en aza indirerek sağlıklı bir şekilde dişlerin korunmasını sağlamaktadır. Buna karşılık, 1.5 mg/L konsantrasyonunun aşılması halinde zamanla insanlarda başta dişler olmak üzere, ciğerler, tiroid bezleri ve diğer organlarda zararlı etkiler oluşabilmektedir. Dünya Sağlık Örgütü (WHO) içme sularında bulunması gereken florür konsantrasyonunu maksimum 1.5 mg/L olarak belirlemiştir (WHO, 1993) ve sulardaki fazla miktarlardaki florürün giderilmesi insan sağlığı açısından önem taşımaktadır.
Florür konsantrasyonunu sınır değerin (1.5 mg/L) altına indirebilmek için, geçmişten günümüze çeşitli yöntemler uygulanmıştır. Florürün sulardan giderilmesi için adsorpsiyon (Çengeloğlu ve ark., 2002; Tor, 2006), çöktürme (Singh, 1999), Donnan diyaliz (Durmaz ve ark., 2005; Tor, 2007) ve elektrodiyaliz (Amor ve ark., 1998; Zeni ve ark. 2005) gibi metotlar kullanılmaktadır.
Adsorbsiyon yöntemi, kirleticilerin su ortamından uzaklaştırılmasında etkili bir şekilde kullanılan metottur. Aktif karbon pek çok kirleticiyi gidermede kullanılan en etkili adsorben olmasına rağmen oldukça pahalıdır. Bu sebepten dolayı, son yıllarda düşük maliyetli adsorban maddelerin kalsit (Yang ve ark., 1999), kırmızı çamur (Çengeloğlu ve ark., 2002), montmorillonit (Tor, 2006), su ortamındaki kirleticilerin gideriminde kullanımı yaygınlaşmıştır.
Bu çalışmada, alüminyum üretimi sırasında atık olarak ortaya çıkan kırmızı çamur, granül hale getirilmiş ve hem kesikli hem de kolon sisteminde su ortamındaki florürün gideriminde kullanılması araştırılmıştır.
1.1. Çalışmanın amacı
Dünya Sağlık Örgütü’nün (World Health Organisation) yapmış olduğu araştırmalar sonucunda; 1.5 mg/L’nin altındaki konsantrasyonlarda florür ihtiva eden içme sularının insan sağlığı için faydalı; 1,5 mg/L’nin üstündeki konsantrasyonlarda florür ihtiva eden içme sularının insan sağlığı için tehlike oluşturduğunu tespit etmiştir. Bu nedenle, içme suyu içerinde bulunabilen florür konsantrasyonunun 1.5 mg/L’nin altına düşürülmesi gerekmektedir.
Kırmızı çamur, alüminyum üretimi sonucunda ortaya çıkan bir atıktır. Ancak, kırmızı çamur bünyesi bulunan metal oksitlerinden dolayı oldukça iyi bir adorben madde özelliği de taşımaktadır. Günümüze kadar, pek çok kirleticinin, örneğin; fenol (Tor ve ark. 2006), bor (Çengeloğlu ve ark. 2007), nitrat (Çengeloğlu ve ark. 2006), boyar madde (Tor ve Çengeloğlu, 2006), arsenik (Genç ve ark., 2003), metal (Apak ve ark., 1997) gideriminde kullanılmıştır. Ancak, kırmızı çamur çapı çok küçük (<10
µm) taneciklerden oluştuğu için adsorpsiyon denemelerinde kesikli sistemlerde denenmiştir. Kolon uygulamalarında en çok karşılaşılan problemler ise toz kırmızı çamurun kolondan kaybı veya tıkanma problemleridir (Genç-Fuhrmann ve ark., 2005).
Bu çalışmanın amacı, kırmızı çamuru granül hale getirerek adsorben olarak su ortamındaki florür giderimindeki kullanımını araştırmaktır. Bunun için, granül hale getirilen kırmızı çamur hem kesikli sistemde hem de kolon sisteminde denenmiş ve florür giderim verimi ile giderim mekanizması incelenmiştir.
2. KAYNAK ARAŞTIRMASI
2.1. Flor Elementinin Fiziksel ve Kimyasal Özellikleri
Flor elementi, Henri Moissan tarafından 1886 yılında Fransa’da bulunmuştur. Flor elementi, dünyamız üzerinde 13. çoklukta bulunan bir elementtir. Flor, atmosferde normal şartlar altında, korozif ve mat-yeşilimsi sarı renkte, keskin kokusu olan bir gazdır. Dünyada bilinen elementler arasında en reaktif ve en elektronegatif bir elementtir. Tüm elementlerle florür bileşiklerini oluşturabilen, tüm organik ve inorganik maddelerle reaksiyona girebilen bir elementtir.
Flor elementi, periyodik cetvelde 2. periyod, VIIA grubunda yer almaktadır. Flor elementinin özellikleri aşağıdaki gibidir;
Elementin Simgesi : F Atom Numarası : 9
Bağıl Atom Kütlesi : 18.9984 gram Yoğunluk : 1.696 g/L Kaynama Noktası : -188.05 ºC Erime Noktası : -219.52 ºC Molar Hacmi : 11.20 ml/mol Özgül Isı : 0.824 j/gk Isı Đletkenliği : 0.0277 w/mk Buharlaşma Entalpisi : 3,27 kj mol-1 Atomlaşma Entalpisi : 79 kj mol-1
Flor elementinin de içerisinde bulunduğu halojenler grubunun elementleri, tepkimeye eğilimli ametallerdir. Bu elektronegatif elementler, elektron alma eğilimi en yüksek olan elementlerdir. Doğada saf olarak değil, mineral bileşikleri halinde bulunmaktadırlar. Element halinde iki atomlu moleküllerden oluşmaktadırlar. Zehirli ve tehlikeli elementlerdir.
2.2. Florür’ün Doğadaki Kaynakları ve Sularda Bulunuşu
Florür iyonu doğada serbest halde görülmemektedir. Florür iyonu, kayalık bölgelerde ve iyi çözündükleri için bu bölgelerin yer altı sularında, yüzeysel sularda, atmosferde ve bitkilerde bulunmaktadır.
Yüzeysel sularda florür iyonu konsantrasyonu genelde 0-6.5 mg/L arasında bulunabilmektedir (Benefield ve ark., 1982). Yer altı sularında ise, sıcaklığa; diğer kimyasal elementlere ve bileşiklere; akiferin derinliğine; akiferin fiziksel, kimyasal ve jeolojik karakteristiklerine; toprak ve kayaların porozite ve asiditesine bağlı olarak değişiklik göstermektedir. Yer altı sularında florür iyonunun hiç bulunmadığı sular olduğu gibi; bu iyonun 48 mg/L’ye ulaştığı konsantrasyonlara da rastlanılmıştır. Florür iyonu konsantrasyonunun Hindistan’da 38.5 mg/L, Kenya’da 25 mg/L’ye ulaştığı tespit edilmiştir. Çin’de Shenyang bölgesinde içme sularındaki florür 4-11 mg/L, Tayland’ın Chang Mai bölgesinde içme sularında ise 10-13 mg/L seviyelerinde bulunmaktadır (Frangsrekam ve ark., 1998).
Ülkemizde, içme suyu kaynaklarında, florür konsantrasyonunun etkili olduğu bölgeler; Isparta, Eskişehir ve Denizli’nin Sarayköy ve Çaldıran ilçeleridir. Denizli’nin Sarayköy ve Çaldıran ilçelerinde florür konsantrasyonunun 13.7 mg/L’ye kadar çıktığı tespit edilmiştir. Diğer illerimizden Eskişehir’de 3.9 mg/L; Isparta ilinde ise 4.9 mg/L florür konsantrasyonuna sahip su kaynakları tespit edilmiştir. Geçmiş zamanlarda, Isparta ili içme suyu kaynaklarında bulunan florür ihtivası nedeniyle, bu konuyla ilgili birçok çalışma yapılmıştır. Şehir merkezine 11 km uzaklıktaki Gölcük krater gölü ve çevresinin jeolojik yapısı, içme suyuna karışan florür’ün kaynağıdır. Đçme suyu kaynağının değiştirilmesiyle, Isparta ili içme suyundaki yüksek florür ihtivası problemi giderilmiştir. Fakat şehrin batısındaki bazı yer altı suyu kaynaklarında florür içeriğinin yüksek olması, sorunun halen devam ettiğini göstermektedir. Bu nedenlerle, Isparta ilinde yaşayan insanların dişlerinde kalıcı kahverengi lekelere rastlamak mümkündür (Ergün, 2008).
Suda florür iyonunun bulunmasına sebep olan başıca mineral, kalsiyum florür’dür. Kalsiyum florür (CaF2), genellikle volkanik kayaların bileşiminde bulunur. Bu nedenle derinlerden alınan sularda, özellikle petrol kuyularındaki tuzlu sularda ve son zamanlarda volkanizma geçirmiş arazilerden gelen sularda doğal olarak bulunmaktadır. Kalsiyum florür’ün kaynağı ise fluorit denilen mineraldir. Fluorit, kalsiyum florür bileşiminde (CaF2) olup saf olduğunda %51.1 kalsiyum ve %48.9 flor ihtiva etmektedir. Uluslararası ticari ismi "fuorspar" olan fluoritin esas elementi fluordur. Doğal fluorit; kuvars, barit kalsit, galenit, sfalerit, siderit, sölestit, kalkopirit ve diğer sülfid mineralleri ile birlikte bulunur. Magmatik, metamorfik ve sedimanter kayaçlar içerisinde hidrotermal damar, dolgu ve metasomatik yataklar şeklinde oluşur. Kristal şeklinde olduğu zaman genellikle renksiz bazende mor, sarı, mavi, yeşil, gül rengi, kırmızı, mavimsi ve morumsu siyah ve kahverengi renklerde de görülebilmektedir (Ergün, 2008).
2.3. Sulardaki Florürün Đnsan Sağlına Etkileri
Flor bir iz elementtir. Đz elementlerin miktarları çok küçüktür ancak, sağlık açısından büyük rol oynarlar. Florür iyonu, insan vücudunda değişik dokularda bulunmaktadır. Bu iyonun büyük miktarı, kalsiyum içeriği yüksek olan kemiklerde ve dişlerde bulunmaktadır. Sert dokular dışında kalpte, karaciğerde, böbreklerde, troid bezinde ve damarların yapısında görülmektedir. Bu element, sert dokularda florür ve floroapatit halinde bulunmaktadır. Bu bileşikler insan vücudunda enzimatik olaylarda bulunmakta, mineralizasyon ve kalsifikasyon olaylarını etkilemektedir.
Florür’ün diş sağlığına etkisi olduğunu ve diş içerisinde bulunduğunu ilk defa Morichini bulmuştur. 1902 yılında Amerika Birleşik Devletleri ülkesinde, Colorado Springs şehrinde diş hekimi Frederick Mc Kay, hastaların çoğunda dişlerinde kalıcı, koyu renkli lekeler olduğunu tespit etmiştir. Bu lekelerin bölgesel sebeplerle meydana geldiğini düşünmüş ve bu bulguya “lekeli mine” adını vermiştir (Kartöz, 1992).
Daha sonraki yıllarda yapılan çalışmalar neticesinde, insanlarda diş ve kemik sağlığı açısından içme sularında florür iyonu konsantrasyonunun, önemli etken olduğu kararına varılmıştır. Dünya Sağlık Örgütü’nün yaptığı araştırmalar neticesinde 1.5 mg/L’nin altındaki konsantrasyonlarda florür iyonu içeren suların, diş ve kemik yapısının gelişmesini ve güçlenmesini sağladığı tespit edilmiştir (WHO, 1993). Türk Standartlar Enstitüsü içme sularında florür iyonu için müsaade edilen değerini 1.0 mg/L, maksimum değerini 1.5 mg/L olarak sınırlamışlardır. Florür, diş çürümesinin başlamasına neden olan asitlere karşı diş minesinin öz direncini arttırır ve diş çürümelerini % 40–50 kadar azaltmaktadır. Özellikle 6 ay ile 16 yaş arası olan çocukların gelişimi için içme sularının kabul edilen sınırlar içerisinde florür iyonu içermesi oldukça önemlidir. Đçme sularında florür iyonu konsantrasyonun sınır değerler üzerinde bulunması, özellikle çocuklarda dişlerinde koyu renkli, kalıcı beneklenmelere yol açan ve günümüzde “florisis” olarak adlandırılan hastalığa yol açmaktadır. Bu hastalığın, yetişkin insanları daha az etkilediği gözlenmiştir. Bu hastalığın daha da ilerlemesi halinde kireçlenme sonucu omurga ve eklemlerde haraket ağırlaşması ve yanma hissi belirtileri olan “skeletal florisis” adı verilen hastalığa sebep olmaktadır.
Ülkemizde, içme suyu standartları olarak Türk Standartları Enstitüsünün TS-266 içme suyu standartları uygulanmaktadır. Dünyadaki çeşitli ülkeler, Dünya Sağlık Örgütü’nün araştırmaları sonucunda belirlediği standartları ülkesinde uygulamaktadır. Bu standartlar aşağıda Tablo 2.1’de görülmektedir (Ergün, 2008).
Tablo 2.1. Florür iyonu için belirlenen içme suyu standartları, mg/L.
Türk Standartları Enstitüsü (TS-266) Dünya Sağlık Örgütü
(WHO) Sınır Değer Maksimum Değer
2.4. Florür Đyonunun Su Ortamından Giderimi Đçin Yapılmış Çalışmalar
Florürün sulardan giderilmesi için Donnan diyaliz (Durmaz ve ark., 2005; Tor, 2007), ters ozmoz (Sourirajan ve Matsurra, 1972), nanofiltrasyon (Simons, 1993), ultrafiltrasyon (Guo ve ark., 2001), adsorpsiyon (Cengeloglu ve ark., 2002;Tor, 2006), çöktürme (Singh ve ark., 1999), ve elektrodiyaliz (Amor ve ark., 1998; Zeni ve ark. 2005, Ergun ve ark., 2008) gibi metotlar kullanılmaktadır.
Đyon değiştirici membranların kullanıldığı Donnan diyaliz yöntemi ile sulardan florür giderimi yapılabilmektedir. Bunun için değişik türde iyon değiştirici memranlar kullanılmıştır.
Durmaz ve ark., (2005), Neosepta AHA anyon değiştirici membran kullanarak Donnan diyaliz yöntemi ile sulardan florür giderimi üzerine çalışmışlardır. Bu çalışmada besleme ve alıcı faz konsantrasyonun, membranın, pH’sı ve HCO3-. Cl-, ve SO4-2 anyonlarının florür giderim verimi üzerindeki etkilerini incelemişlerdir. Çalışma sonucunda iyon taşıma verimi açısından en başarılı membranlar ve en çok florür geçişini sağlayan iyonlar sırasıyla şöyledir; Neosepta AFN > Neosepta AHA > polisülfan SB-6407 ve HCO3- > Cl- > SO4-2.
Tor (2007), Donnan diyaliz yöntemiyle, Neosepta-ACM anyon değiştirici membran kullanarak sulardan florür giderimi üzerine çalışmalar yapmıştır. En fazla florür taşınmasının besleme fazı pH’sının 6, alıcı faz pH’sının 1 olduğu durumda elde edildiği tespit edilmiştir. Ayrıca, besleme ve alıcı faz konsantrasyonlarının artması ile florür taşınımının arttığı, florür ile birlikte diğer iyonların bulunmasının taşınımı azalttığı tespit edilmiştir.
Donnan diyaliz yönteminin yavaş bir kinetiğe sahip olması en önemli dezavantajını oluşturmaktadır (Tor ve ark., 2004). Elektrodiyaliz yöntemi ise proses sırasında uygulanan potansiyel dolayısıyla Donnan diyaliz yöntemine göre daha hızlı kinetiğe sahip ancak daha pahalı bir yöntemdir (Amor ve ark., 1998).
Kabay ve ark. (2007), sulu çözeltilerden elektrodiyaliz yöntemiyle florür giderimini araştırmıştır. Çözeltinin florür konsantrasyonu, besleme akış hızı, uygulanan akım yoğunluğu gibi parametrelerin yanı sıra; sülfat ve klorür gibi diğer anyonların giderim verimi üzerine olan etkileri araştırılmıştır. Besleme çözeltisinin florür konsantrasyonu yüksek olduğunda ve uygulanan akım yoğunluğu artırıldığında
giderim veriminin de yüksek olduğu tespit edilmiştir. Florür giderimine klorür iyonlarının sülfat iyonlarına göre daha etkili olduğunu saptamışlardır.
Zeni ve ark., (2005), florür içeriği zengin olan kuyu sularından elektrodiyaliz yöntemi ile florür giderim üzerine çalışmalar yapmışlardır. Çalışmada, farklı anyon değiştirici membranlar kullanılarak uygulanan farklı akım yoğunluklarının florür giderimini nasıl etkilediği araştırılmıştır. Asahi Glass Şirketinin üretimi olan Selenyum AMP® ve fotopolimerik MZATM anyonik membranlarının test edildiği çalışmada, AMP® membranlarının kullanıldığı elektrodiyaliz ünitesine 0,1 A.dm-2 akım uygulandığında %69, 0,7 A.dm-2 akım uygulandığında %97 florür giderim verimi sağlandığı görülmüştür. MZATM membranı için ise bu verimin % 40’da kaldığı rapor edilmiştir.
Florür konsantrasyonundan bağımsız olarak, ters ozmoz ile tek aşamada %90’dan fazla florür giderim verimi elde edilebilmektedir (Sourirajan ve Matsurra, 1972). pH’ın 4.5’ten düşük olduğu durumlarda nanofiltrasyon ile de tatmin edici florür giderimi elde edilebilmektedir (Simons, 1993). Buna karşılık, Guo ve ark., 2001, ultrafiltrasyonu, florür giderim için etkili bir yöntem olarak görmemiştir. Kireç ilavesi ile sulardaki florür çöktürülerek de uzaklaştırılabilmektedir. Ancak, çöktürme sonucu oluşan çamur bertaraf edilmesi gereken başka bir problem olarak karşımıza çıkmaktadır (Singh ve ark., 1999).
2.4.1. Adsorpsiyon Yöntemi ile Sulardan Florür Giderimi
Adsorpsiyon yöntemi kirleticilerin sulardan uzaklaştırılmasında en yaygın kullanılan yöntemlerden biridir. Özellikle aktif karbon en yaygın kullanılan adsorbandır. Ancak, aktif karbonun oldukça pahalı olması ve rejenerasyon işlemlerindeki maliyetlerin yüksek olması sebebiyle (Figueiredo ve ark., 2005) son yıllarda ucuz, genellikle endüstrideki prosesler sonucu atık olarak ortaya çıkan maddelerin kirleticilerin uzaklaştırılmasında adsorban olarak kullanılabilme potansiyeli araştırılmaktadır. Örneğin florürün sulardan adsorpsiyon yöntemi ile giderilmesinde kırmızı çamur (Çengeloğlu ve ark., 2002), kil (Tor, 2006), ağartma toprağı (Mahramanlioğlu ve ark., 2002), alum çamuru (Sujana ve ark.,1998) vb. gibi maddeler kullanılmıştır ve tatmin edici giderim verimleri elde edilmiştir.
Çengeloğlu ve ark., 2002, kırmızı çamur kullanarak kesikli adsorpsiyon tekniği ile sulardan florür giderimini araştırmışlardır. En iyi florür gideriminin pH’ın 5,5 değerinde gerçekleştiğini gözlemlemişlerdir. Florür iyonlarının adsorbsiyon işlemi için yeterli temas süresinin 2 saat olduğunu tespit etmişlerdir. Aktive edilmiş kırmızı çamurun nötralize edilmiş kırmızı çamura kıyasla daha fazla florür adsorpsiyon kapasitesine sahip olduğunu tespit etmişler ve florür giderim mekanizmasını izah etmişlerdir.
Beyhan (2003), atık çamurlar ve doğal malzemeler ile sulardan florür iyonu gideriminin araştırmasını konu alan doktora tezi hazırlamıştır. Bu çalışmasında, sulardan florür iyonu gideriminde alüminyum içeren bazı doğal malzemeler, endüstri tesisi atığı ve içme suyu arıtma tesisi alüminyum çamurlarının etkinliği araştırılmıştır. Karşılaştırma yapabilmek ve giderim mekanizmaları hakkında bilgiler elde edebilmek için alüminyum sülfat, alüminyum hidroksit, alüminyum oksit ve metalik alüminyum tozu gibi saf alüminyum bileşikleri ile de florür iyonu giderim çalışmaları yapılmıştır. Alüminyum çamuru ile elde edilen yüksek verim nedeniyle yüksek konsantrasyonlarda florür iyonu içeren endüstriyel atıksuları arıtmak için araştırma yapılmış ve uygulamaya yönelik yeterli sonuçlar elde edilmiştir.
Tor, 2006, montmorillonit kullanarak su ortamından florür giderimini araştırmıştır. En iyi florür giderim veriminin pH 6’da elde edildiği belirtilmiştir. Montmorillonit ile florür giderim mekanizması, kil bünyesindeki metal oksitleri ile florür arasındaki etkileşim dikkate alınarak izah edilmiştir. Đzoterm modellerinden Langmuir, Freundlich ve Redlich-Peterson modelleri kullanılmış ve adsorpsiyonun Redlich-Peterson ve Freundlich izoterm modellerine uyduğu belirtilmiştir.
Subhashini ve Pant, 2005, aluminayı aktive ederek su ortamından adsorpsiyon yöntemi ile florür gideriminde kullanmışlardır. Maksimum adsorpsiyonun pH 7’de elde edildiği belirtilmiştir. Đzoterm verileri Langmuir izoterm modeline göre izah edilmiştir. Çalışmada kolon denemeleri de gerçekleştirilmiştir.
Jagtap ve ark., 2009, titanyum ile modifiye edilmiş çitosan kullanarak sulardan florür giderimini çalışmışlardır. Çözelti pH’sı, florür konsantrasyonu, adsorban miktarı ve diğer iyonların florür giderimine olan etkisi incelenmiştir. Hazırlanan adsorben ile gerekli temas süresinin 30 dakika olduğu, maksimum florür gideriminin pH 7’de elde edildiği, asidik ve bazik çözelti ortamında adsorpsiyon
veriminin azaldığı, diğer iyonların florür giderimine olumsuz yönde etki ettiği belirtilmiştir.
Viswanathan ve ark., 2009, protonlanmış çitosanı florür gideriminde kullanmışlardır. Ham çitosanın florür giderim kapasitesi 52 mg/kg iken, protonlanmış çitosan için bu değer 1664 mg/kg olarak tespit edilmiştir. Protonlanmış çitosan ile florür gideriminin çözelti pH’sından bağımsız olduğu ve diğer iyonların varlığında florür gideriminin olumsuz yönde etkilendiği belirtilmiştir.
2.4.1.1. Kırmızı çamur
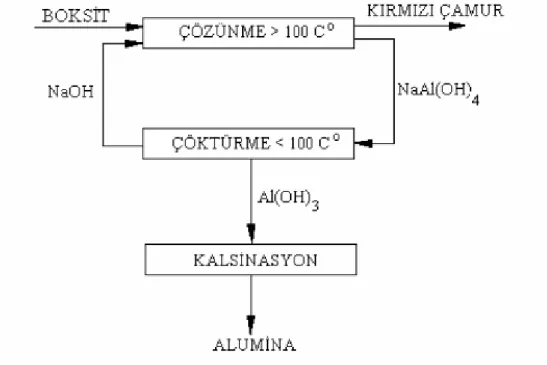
Boksitteki aluminyum, Bayer Prosesinde cevherin otoklavda derişik NaOH ile muamelesiyle NaAl(OH)4 halinde çözeltiye alınır, sonra soğutularak çöktürülür. Çözelti ve çözünmeyen kısmın ayrılmasından sonra çözeltiden pH ayarlaması ile Al(OH)3, Al(OH)3’in kalsinasyonuyla da Al2O3 elde edilir. NaOH ile çözünmeyen kısma “kırmızı çamur” denilmektedir. Bayer prosesinin basit akım şeması Şekil 2.1’de verilmiştir (Kir, 2002).
Alüminyum metali de, aluminanın uygun katkı maddeleri ile karıştırıldıktan sonra eritilerek elektrolizinden elde edilmektedir. Boksitlerin çözünürleştirilmesi sırasında toplam alüminanın % 76-93 kadarı aluminat çözeltisinde sıvı faza geçer. Boksitteki silis ya SiO2 yada sodyum aluminyum silikatlar halinde demir, titan ve az miktarda bulunan Ga, V, P, Ni, Cr, Mg gibi maddeler katı kısımda kalarak kırmızı çamuru oluşturur. Boksit atıklarının diğer iki ana bileşeni sodyum ve kalsiyum genellikle boksitte bulunmayıp atığa teknolojik işlemler sonucu geçerler. Kırmızı çamurun kimyasal kompozisyonu genel olarak; Fe2O3: % 30-60, Al2O3: % 5-20, SiO2: % 1-20, Na2O: % 1-10, CaO: % 2-8, TiO2: eser-% 10 ve % 5-15 kızdırma kaybı oranındadır. Yoğunluğu ise 2.7 - 3.2 ton/m3arasında değişir (Zambo ve ark., 1980).
2.4.1.2. Kırmızı çamur ile yapılan diğer adsorpsiyon çalışmaları
Apak ve ark., 1998, toksik ağır metalleri (Cu(II),Pb(II) ve Cd(II) gibi), kırmızı çamur kullanarak gidermişlerdir. Yapılan çalışmada katı sorbent ve sulu çözelti arasındaki metallerin dağılma oranlarının, metalin dengedeki konsantrasyonuna ve sıcaklığa bağlı olduğu bulunmuştur.
Zhu ve ark., 2007, kırmızı çamuru granul hale getirerek yeni bir adsorben madde elde etmişler ve bu elde edilen adsorbeni sudan kadmiyum uzaklaştırmasında kullanmışlardır. Öncelikle kesikli sistemde adsorpsiyon olayı incelenmiş ve elde edilen veriler Freundlich izotermine göre yorumlanmıştır. Çalışmada ayrıca, adsorpsiyon kinetiği detaylı bir şekilde incelendikten sonra adsorben madde kolon denemelerinde kullanılmıştır. Kolon denemeleri sonucunda, adsorpsiyon olayının tersinir olduğu ve 0.1 M HCl ile desorpsiyon işleminin yapılabileceği belirtilmiştir.
Tor ve Çengeloğlu, 2006, kırmızı çamuru aktive etmişler ve kesikli adsorpsiyon deneyleri ile anyonik boyar madde olan kongo red’in sudan uzaklaştırılmasında kullanmışlardır. Aktive edilmiş kırmızı çamur üzerine adsorpsiyon için etkili olan pH’nın 7 olduğu, dengeye ulaşmak için gerekli sürenin ise 90 dakika olduğu belirtilmiştir. Adsorpsiyon, Langmuir, Freundlich ve üç parametreli Redlich-Peterson isotermleri kullanılarak analiz edilmiştir. Lineer olmayan Ki-kare istatistik testinden elde edilen verilere göre Langmuir isoterminin adsorpsiyon verileri için en uygun model olduğu belirtilmiştir.
Çengeloğlu ve ark., 2007, kesikli adsorpiyon tekniği ile nötralize edilmiş kırmızı çamur kullanılarak sulu çözeltiden borun uzaklaştırılmasını çalışmışlardır. pH, adsorben miktarı, başlangıç bor konsantrasyonu ve temas süresinin adsorpsiyon üzerine etkisi incelenmiştir. Çalışmada, bor gideriminin pH 2-7 aralığında çok az değiştiğini ve adsorpsiyon dengesine ulaşılmasının 20 dakika aldığı belirtilmiştir. Adsorpsiyon verileri Langmuir ve Freundlich izotermlerine göre incelenmiş ve Freundlich isoterminin verileri daha iyi temsil ettiği bulunmuştur.
Tor ve ark., 2006, kesikli adsorpsiyon tekniği ile nötralize edilmiş kırmızı çamur kullanarak fenolün su ortamından uzaklaştırılmasını çalışmışlardır. Çalışmada, temas süresinin, pH’nın, başlangıç fenol konsantrasyonunun, kırmızı çamur miktarının ve tuz ilavesinin giderime olan etkisi incelenmiştir. Maksimum fenol gideriminin geniş bir pH aralığında (1-9) sağlandığı ve dengeye ulaşmak için 10 saat’lik bir süre gerektiği belirtilmiştir. Adsorpsiyon verileri Langmuir ve Freundlich isoterm modellerine göre incelenmiş ve Freundlich isoterm modelinin verileri daha iyi temsil ettiği bulunmuştur. Fenol giderimine tuz ilavesi etkisinin anyonların kırmızı çamur yüzeyine olan relatif ilgisine ve relatif konsantrasyonlarına bağlı olduğu belirtilmiştir.
3. MATERYAL-METOT
3.1. Deneylerde Kullanılan Kimyasal Maddeler
Deneylerde kullanılan kimyasallar aşağıda sıralanmıştır. Söz konusu kimyasallar analitik saflıktadır ve Merck Co. firmasından temin edilmiştir.
• Sodyum florür (NaF)
• Sodyum klorür (NaCl)
• Sodyum hidroksit (NaOH)
• Asetik Asit (CH3COOH)
• Hidroklorik asit (HCl)
• Sodyum silikat (Na2SiO3)
• Sodyum karbonat (Na2CO3)
3.1.2. Granül Kırmızı Çamurun Hazırlanışı
Deneylerde kullanılan kırmızı çamur, Seydişehir Alüminyum Fabrikasından (Konya), uçucu kül ise Konya Çimento Fabrikasından temin edilmiştir.
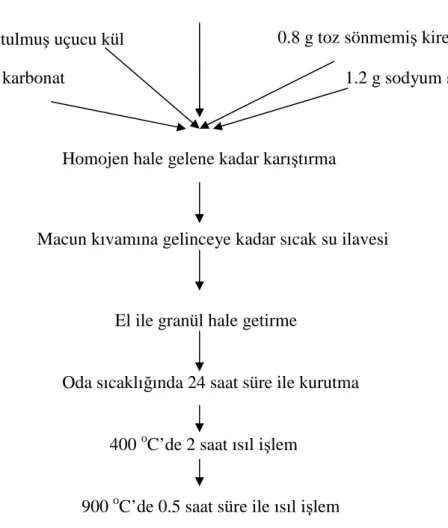
Ham kırmızı çamurun pH’sı çok yüksektir (pH≈12-13). Bu sebepten dolayı kırmızı çamur granülasyondan önce nötralize edilmiştir. Ham kırmızı çamur 2/1 (çamur/su) oranında pH’sı 8-8.5 olana dek saf su ile yıkanmış ve kurutulmuştur. Daha sonra granülleştirme işlemi Şekil 3.1.’de verilen prosedür (Zhu ve ark., 2007) takip edilerek gerçekleştirilmiştir.
15 g nötralize edilmiş kırmızı çamur, 2 g kurutulmuş uçucu kül, 1 g sodyum karbonat, 0.8 g toz haldeki sönmemiş kireç ve 1.2 g sodyum silikat homejenize oluncaya kadar karıştırılmıştır. Bu karışıma sıcak su eklenerek macun kıvamı alması sağlanmıştır. Macun yapısında olan karışım elle granül hale getirilmiştir. Elde edilen granüller oda sıcaklığında 24 saat kurutulmuştur. Kuruyan granül kırmızı çamur, önce 400oC 2 saat, sonra 900 oC yarım saat süre ile fırınlanmıştır. Elde edilen granül kırmızı çamur elenmiş ve 1-1.18 mm boyutundaki granüller adsorpsiyon deneylerinde kullanılmıştır.
15 g nötralize edilmiş kırmızı çamur
Oda sıcaklığında 24 saat süre ile kurutma
400 oC’de 2 saat ısıl işlem
900 oC’de 0.5 saat süre ile ısıl işlem
Şekil 3.1. Granül kırmızı çamurun hazırlama prosedürü (Zhu ve ark., 2007)
3.2. Kesikli Adsorpsiyon Deneyleri
Deneylerde kullanılan florür çözeltileri, 1000 mg/L’lik stok çözeltiden hazırlanmıştır. Bütün deneyler 0.01 M iyonik şiddette gerçekleştirilmiştir. 0.25 g granül kırmızı çamur ve bilinen konsantrasyondaki florür çözeltisi 100 mL’lik erlenmayere alınmış ve deneyler yapılmıştır. Çözeltinin pH’sı, 0.1 M NaOH ve 0.1 M HCl ile ayarlanmıştır. Çözeltinin son hacmi 50 mL’dir. Çözelti, 25µ1 oC’de 400 rpm sabit hızda belirli bir süre karıştırılmış ve 0.45 µm selüloz asetat membran ile filtrelenmiştir.
0.8 g toz sönmemiş kireç 1.2 g sodyum silikat 2 g kurutulmuş uçucu kül
1 g sodyum karbonat
Homojen hale gelene kadar karıştırma
Macun kıvamına gelinceye kadar sıcak su ilavesi
Adsorplanan florür miktarı Eşitlik (1) kullanılarak hesaplanmıştır. m V Ce Co q= ( − ) (1)
Burada, q: adsorbe edilen florür miktarını (mg/g), Co: başlangıç florür konsantrasyonunu (mg/L), Ce: denge anında çözeltideki florür konsantrasyonunu (mg/L), V: çözelti hacmini (L) ve m: granül kırmızı çamur miktarını (g) ifade etmektedir.
Çalışılan deneysel parametreler sırasıyla şöyledir; temas süresi: 15-540 dakika, çözelti pH’sı: 2.5-7.3; başlangıç florür konsantrasyonu: 5-150 mg/L.
3.3. Kolon Adsorpsiyon Deneyleri
10 g granül kırmızı çamur, 0.635 cm2 kesit alanına ve 15 cm yüksekliğe sahip kolona doldurularak kolon deneyleri gerçekleştirilmiştir. Peristaltik pompayla 25±1
o
C’de hazırlanan kolondan saf su geçirilerek kolon şartlandırılmıştır.
5 mg/L’lik florür (pH 4.7) çözeltisi ile, florür giderimi üzerine akış hızının etkisini incelemek amacıyla sırasıyla 2, 3 ve 5 mL/dk’lık akış hızları denenmiştir. Akış hızı, kolondan çıkan çözeltinin belirli bir hacimde toplanması ve bunun için gereken süre tespit edilerek belirlenmiştir. Maksimum kolon kapasitesi (qo, mg/g), Eşitlik (2) kullanılarak hesaplanmıştır.
m dV C C q V o ) ( 0 0 − =
∫
(2)
Burada, qo: maksimum kolon kapasitesini (mg/g), V: maksimum giderimin olduğu ana kadar kolondan geçen çözelti hacmini (L), Co: başlangıç florür konsantrasyonunu (mg/L), C: kolondan çıkan çözeltinin florür konsantrasyonunu (mg/L) ifade etmektedir.
3.4. Kolon Rejenerasyon Çalışmaları
Kolon florür ile doyduğunda yeniden kullanmak için desorpsiyon yapmak gerekir. 2 mL/dk akış hızında çalıştırılan kolon, rejenerasyon deneyleri için seçilmiş
ve rejenerasyon 0.2 M’lık NaOH ile yapılmıştır. Kolonda tutulan florür miktarı, desorbe edilen florür miktarından fazla olana kadar rejenerasyon çalışmaları yapılmıştır. Her rejenerasyondan sonra kolon saf su ile yıkanarak yeniden kullanıma hazır hale getirilmiştir. Kolonda tutulan florürün, desorpsiyonla çıkan miktarı (ED) Eşitlik (3) kullanılarak hesaplanmıştır (Zhu ve ark., 2007).
A o D D M m q M E + = . 100 . (%) (3)
Burada, qo: maksimum kolon kapasitesi (mg/g), m: sorbent miktarını (g), MD: desorplanan florür miktarını (mg), MA: kolonda kalan (desorplanamamış) florür miktarını (mg) ifade etmektedir.
3.5. Florür Tayini
Çözeltilerdeki flor iyonu miktarı iyon seçici elektrot ile tayin edilmiştir. Tayin işleminden önce, diğer iyonların girişim etkisini ortadan kaldırmak ve daha doğru sonuç almak için iyonik şiddet düzenleyici, TISAB çözeltisi kullanılmıştır. TISAB çözeltisi, 58 g sodyum klorür, 57 mL asetik asit ve 150 mL 6 M’lık NaOH
çözeltisinin 1000 mL’ye tamamlanması suretiyle hazırlanmıştır. Florür numuneleri ve florür standart çözeltileri, TISAB çözeltisi ile 1/1 oranında seyreltilerek tayin gerçekleştirilmiştir (Tor, 2007).
4. SONUÇLAR VE TARTIŞMA
4.1. Granül Kırmızı Çamurun Karakterizasyonu
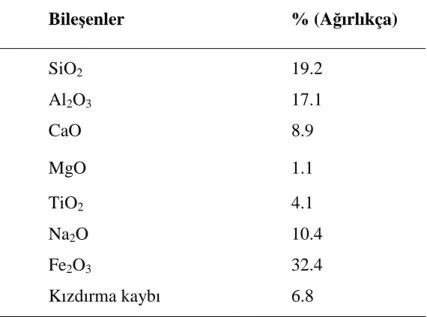
Elde edilen granül kırmızı çamurun SEM fotografı Şekil 4.1.’de gösterilmiştir. Granül kırmızı çamurun kimyasal özelliklerini belirlemek için eritiş yapılmış (Kir, 2002) ve kompozisyonu AES (Varian, vista/AX CCD Simultaneous ICP-AES,Avustralya) kullanılarak belirlenmiştir. Granül kırmızı çamurun kimyasal kompozisyonu Tablo 4.1’de verilmiştir.
Tablo 4.1. Granül kırmızı çamurun kimyasal kompozisyonu.
Bileşenler % (Ağırlıkça) SiO2 19.2 Al2O3 17.1 CaO 8.9 MgO 1.1 TiO2 4.1 Na2O 10.4 Fe2O3 32.4 Kızdırma kaybı 6.8
Granül kırmızı çamurun yüzey alanı Sears (1956)’ın metoduna göre 10.2 m2/g olarak belirlenmiştir. pHzpc değeri (pHzero point charge) ise Balistrieri ve Murray (1981)’ın metodundan yararlanılarak 5.1 olarak tespit edilmiştir. Ayrıca, Zhu ve ark. (2007) granül kırmızı çamurun XRD analizini yapmışlar ve kırmızı çamurun genel olarak kuartz, kalsiyum-titanyum silikatları, sodyum alumino silikatları, demir oksitleri (hematite), ve hidroksitlerinden oluştuğunu belirtmişlerdir.
4.2. Kesikli Adsorpsiyon Deneyleri
4.2.1. Çözelti pH’sının etkisi
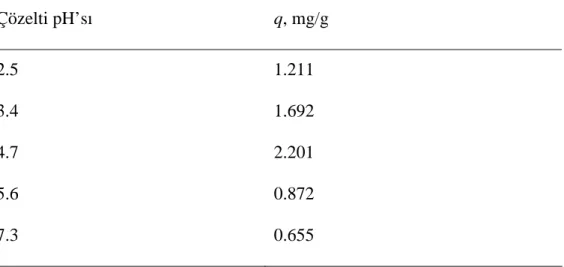
Granül kırmızı çamur ile florür giderimi üzerine çözelti pH’sının etkisi Tablo 4.2’de verilmiştir.
Tablo 4.2. Granül kırmızı çamur ile florür giderimi üzerine çözelti pH’sının etkisi (florür konsantrasyonu: 15 mg/L, granül kırmızı çamur:5 g/L, temas süresi: 8 saat, karıştırma hızı: 400 rpm ve sıcaklık: 25±1 oC).
Çözelti pH’sı q, mg/g 2.5 1.211 3.4 1.692 4.7 2.201 5.6 0.872 7.3 0.655
Maksimum florür giderimi pH 4.7’de elde edilmiştir. pH 4.7’nin altındaki pH değerlerinde florür gideriminin daha düşük verimde gerçekleştiği görülmüştür. Elde edilen bu sonuç, F- ile HF’nin pH’a bağlı olarak çözelti ortamındaki dağılımlarına bağlanabilir. HF’nin asit iyonlaşma sabiti (pKa) değeri 3.16’dır. Bundan dolayı, Eşitlik (4)’e göre, 3.16’dan daha büyük pH değerlerinde F- iyonu çözelti ortamında baskın halde olacaktır.
( )
[
pKa pH]
ions − + =1 1 10 ϕ (4)Ayrıca, Tablo 4.2’den de görüleceği gibi, pH’nın 4.7’den daha büyük değerlerinde florür giderim veriminde azalma tespit edilmiştir. Bu sonuç ise, granül kırmızı çamur için bulunan pHzpc değeri ile açıklanabilir. Granül kırmızı çamurun pHzpc değeri 5.1 olarak tespit edilmiştir. pH<pHzpc değerlerinde yüzey yükü pozitif, pH = pHzpc değerlerinde yüzey yükü nötr, pH>pHzpc değerlerinde ise yüzey yükü negatif hale gelecektir. Negatif hale gelen yüzey ile F- iyonu arasındaki itmeden dolayı, pH= 5.6 ve pH= 7.3 değerlerinde daha düşük giderim tespit edilmiştir.
Granül kırmızı çamurun F- iyonunu tutma mekanizması aşağıdaki model ile açıklanabilir.
≡≡≡≡
MOH + H+ ⇔≡≡≡≡
MOH2+≡≡≡≡
MOH2+ + F- ⇔≡≡≡≡
MF + H2O,Net reaksiyon aşağıdaki gibi yazılabilir;
≡≡≡≡
MOH+ H+ + F- ⇔≡≡≡≡
MF + H2OBurada, M: metal iyonunu (Si, Fe veya Al) temsil etmektedir. Granül kırmızı çamur yüzeyindeki metal oksitler, pH 4.7’de protonlanır. Bu şekilde oluşan
≡≡≡≡
MOH2+ ile F- iyonu arasındaki çekim sayesinde de adsorpsiyonun gerçekleştiği düşünülmektedir (Çengeloğlu ve ark., 2002).4.2.2. Temas Süresinin Etkisi
Temas süresine bağlı olarak, granül kırmızı çamur ile tutulan florür miktarı
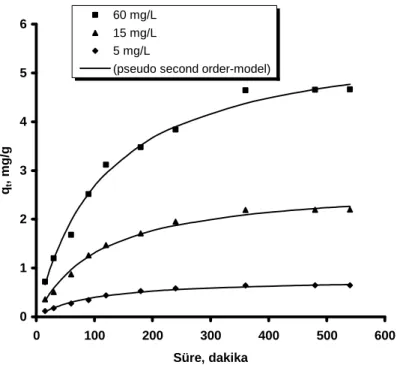
Şekil 4.1’de gösterilmiştir. Şekil 4.1’den de görüleceği gibi temas süresinin artmasıyla birlikte tutulan florür miktarı da artmış ve 6 saat sonunda dengeye ulaşılmıştır. Denenen farklı florür konsantrasyonları (5, 15, 60 mg/L) için gereken temas süresi 6 saat olarak tespit edilmiştir.
0 1 2 3 4 5 6 0 100 200 300 400 500 600 Süre, dakika qt , m g /g 60 mg/L 15 mg/L 5 mg/L
(pseudo second order-model)
Şekil 4.1. Granül kırmızı çamur ile florür giderimine temas süresinin etkisi (çözelti pH’sı: 4.7, granül kırmızı çamur miktarı: 5 g/L ve karıştırma hızı: 400 rpm, sıcaklık 25±1 o
C).
Elde edilen deneysel veriler, birinci ve ikinci dereceden kinetik modellerine göre incelenmiştir. Birinci dereceden kinetik modeli Eşitlik (5)’te verilmiştir (Lagergren ve Svenska, 1898). 303 . 2 . log ) log( k1t q q qe − t = e− (5)
Burada, qe: denge anında adsorbe edilen flor miktarı (mg/g), qt: herhangi bir t anındaki adsorbe edilen flor miktarı (mg/g), k1: birinci dereceden kinetik sabitini (1/dk) ifade etmektedir.
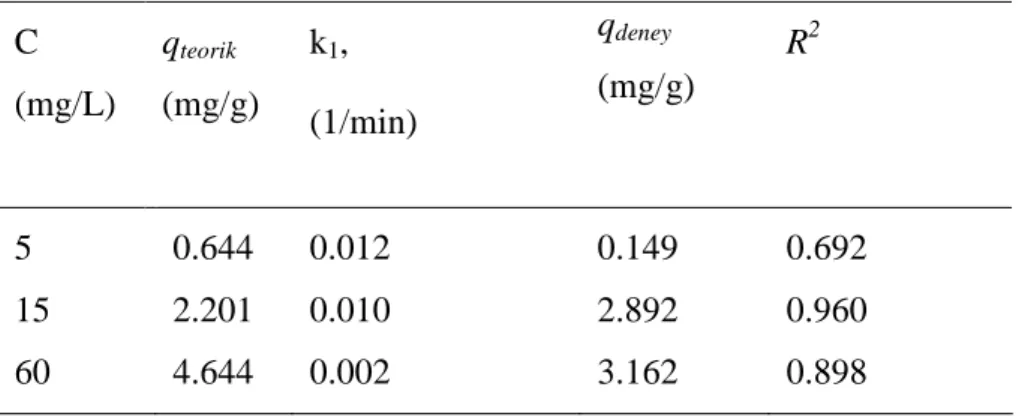
Başlangıç florür konsantrasyonları (5, 15 ve 60 mg/L) için k1 ve teorik denge sorpsiyon kapasiteleri (qteorik) Eşitlik (5) kullanılarak hesaplanmış ve Tablo 4.3’de verilmiştir.
Tablo 4.3. Birinci derece kinetik model parametreleri
C (mg/L) qteorik (mg/g) k1, (1/min) qdeney (mg/g) R2 5 0.644 0.012 0.149 0.692 15 2.201 0.010 2.892 0.960 60 4.644 0.002 3.162 0.898
Tablo 4.3’den de görüleceği gibi, deneysel verilerden hesaplanmış denge sorpsiyon kapasiteleri (qdeney) ile birinci derece kinetik modelinden hesaplanan sorpsiyon kapasiteleri (qteorik) birbiri ile uyumlu değildir. Ayrıca, belirleme katsayıları (R2) 0.692 ile 0.960 arasında bulunmuştur.
Đkinci dereceden kinetik modeli ise Eşitlik (6) kullanılarak deneysel verilere uygulanmıştır (Ho ve McKay, 1999).
t/qt = 1/(k2. qe 2) + t/ qe (6)
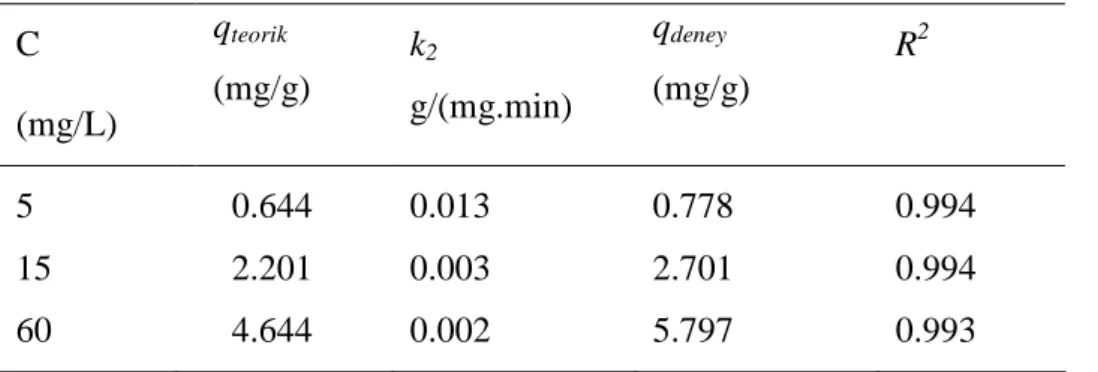
Burada, k2: ikinci dereceden kinetik sabitini (g/(mg.min)) ifade etmektedir. Başlangıç florür konsantrasyonları (5, 15 ve 60 mg/L) için k2 ve teorik denge sorpsiyon kapasiteleri (qteorik) Eşitlik (6) kullanılarak hesaplanmış ve Tablo 4.4’de verilmiştir.
Tablo 4.4. Đkinci derece kinetik model parametreleri C (mg/L) qteorik (mg/g) k2 g/(mg.min) qdeney (mg/g) R2 5 0.644 0.013 0.778 0.994 15 2.201 0.003 2.701 0.994 60 4.644 0.002 5.797 0.993
Birinci dereceden kinetik modeline kıyasla, deneysel verilerden hesaplanmış
denge sorpsiyon kapasiteleri (qdeney) ile ikinci derece kinetik modelinden hesaplanan sorpsiyon kapasiteleri (qteorik) birbiri ile uyumludur (Tablo 4.4). Ayrıca, belirleme katsayıları (R2) ≥ 0.993’tür. Elde edilen bu sonuçlara göre, granül kırmızı çamur ile florür gideriminin ikinci dereceden kinetik modeline uygun olduğu tespit edilmiştir.
4.2.3. Adsorpsiyon Đzoterm Modelleri
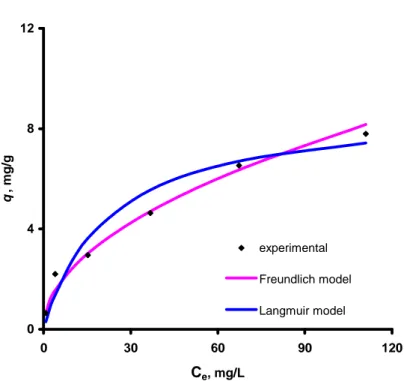
Deneysel adsorpsiyon verileri, Langmuir ve Freundlich izoterm modelleri üzerinde denenmiştir.
Langmuir izoterm modeli, adsorpsiyonun homojen yüzeylerde gerçekleştiği durumları daha iyi ifade eden bir modeldir ve Eşitlik (7) kullanılarak incelenir (Langmuir, 1916). 0 0. ) ( 1 ( Q b C Q q Ce e = + e ) (7)
Burada, Ce: denge anındaki florür konsantrasyonunu (mg/L), Qo: Langmuir adsorpsiyon kapasitesini (mg/g), b ise Langmuir adsorpsiyon katsayısını (L/mg) ifade etmektedir.
Freundlich adsorpsiyon izoterm modeli ise heterojen yüzeyler üzerindeki adsorpsiyon olayını ifade etmede kullanılmaktadır ve Eşitlik (8) ile ifade edilmektedir (Freundlich, 1906). n e kCe q = . 1/ (8)
Burada, Ce: denge anındaki florür konsantrasyonunu (mg/L), k: Freundlich sorpsiyon kapasitesini (mg/g) ve n ise izoterm katsayısını ifade etmektedir.
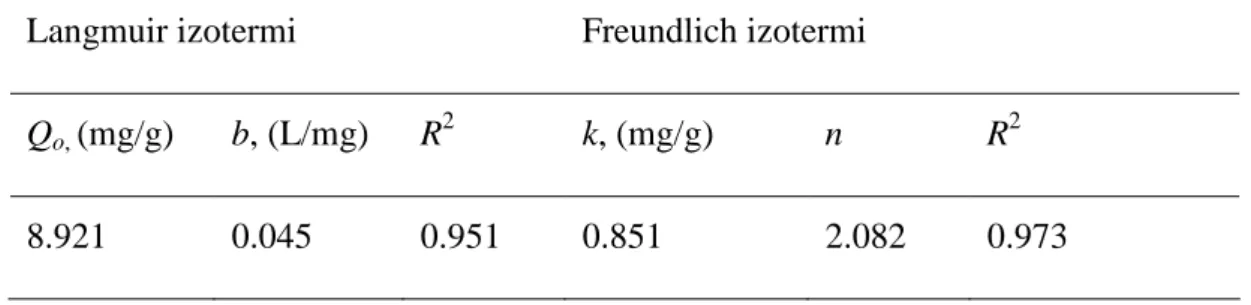
Hem Langmuir hemde Freundlich izoterm parametreleri hesaplanmış ve Tablo 4.5’te verilmiştir. Tablo’dan da görüleceği gibi Freundlich izoterm modeli belirleme katsayıları (R2), Langmuir izoterm modeli R2 değerinden daha büyüktür. Başka bir deyişle, granül kırmızı çamur ile florür adsorpsiyonu Freunclich isoterm modeli ile daha iyi ifade edilmektedir. Elde edilen bu sonuç, Çengeoğlu ve ark. 2002; Çengeloğlu ve ark., 2006 ve Tor ve ark., 2006’nın nötralize edilmiş kırmızı çamur ile florür, bor ve fenol adsorpsiyonu çalışmalarından elde edilen sonuçlar ile de uyumlu bulunmuştur. Ayrıca, deneysel veriler ile Langmuir ve Freundlich izoterm modelleri
Şekil 4.2’de gösterilmiştir.
Tablo 4.5. Langmuir ve Freundlich izoterm modeli parametreleri. Langmuir izotermi Freundlich izotermi
Qo, (mg/g) b, (L/mg) R2 k, (mg/g) n R2
0 4 8 12 0 30 60 90 120 Ce, mg/L q , m g /g experimental Freundlich model Langmuir model
Şekil 4.2. Granül kırmızı çamur ile florür giderimi için Langmuir ve Freundlich isoterm modelleri (çözelti pH’sı: 4.7, temas süresi: 6 saat, granül kırmızı çamur miktarı: 5 g/L, karıştırma hızı: 400 rpm, sıcaklık:25±1 oC).
Granül kırmızı çamur ve florür gideriminde kullanılan diğer adsorban maddeler için literaturden bulunan Freundlich isoterm parametreleri Tablo 4.6.’da verilmiştir.
Tablo 4.6. Florür gideriminde kullanılan çeşitli adsorbanlar için Freundlich isoterm parametreleri.
Adsorban k, mg/g n Kaynak
Kırmızı çamur (toz halde) 1.14 1.29 Çengeloğlu ve ark., 2002
Aktive edilmiş kırmız çamur (toz halde) 5.06 1.97 Çengeloğlu ve ark., 2002
Montmorillonite 0.26 1.77 Tor, 2006
Laterite 0.13 1.70 Sarkar ve ark., 2006
Mangan oksit kaplı alumina 0.42 3.87 Maliyekal ve ark., 2006
4.3. Kolon Deneylerinden Elde Edilen Sonuçlar
Kolon, florür gideremeyinceye kadar farklı akış hızlarında (2, 3 ve 5 mL/dk) çalıştırıldı. Giriş suyunda 0.2’lik bir pH sapması varken çıkış suyunda 0.3’lük bir sapma gözlemlenmiştir.
Kolonda gerçekleşen adsorpsiyon olayını (sürekli akışşartlarında) izah etmek için bazı modeller geliştirilmiştir. Sürekli akışşartlarında kullanılan bu modellerden bir tanesi de Thomas modelidir (Thomas, 1944). Thomas modeli Eşitlik (9)’da verilmiştir.
(
)
[
Co Ce 1]
(
kT.qT.mθ
) (
kT.Co.Vθ
)
ln − = − (9)
Burada; Ce: çıkış suyundaki florür konsantrasyonunu (mg/L), Co: giriş suyundaki florür konsantrasyonunu (mg/L), kT: Thomas modeli sabitini (L/mg.saat),
θ
:akış hızını (L/saat), qT kolonun toplam sorpsiyon kapasitesini (mg/g), V: kolondan geçen çözelti hacmini (L), ve m: kolonda kullanılan granül kırmızı çamur miktarını(g) ifade etmektedir.
Teorik (qT) ve deneysel olarak tespit edilen (qdeneysel) kolon sorpsiyon kapasiteleri ve Thomas modelinden hesap edilen parametreler Tablo 4.7.’de verilmiştir.
Tablo 4.7. Kolon deneylerinden ve Thomas modelinden elde edilen parametreler.
Thomas Modeli Akış hızı (mL/dk) qdeneysel (mg/g) kT (L/mg.saat) qT (mg/g) 2 2.051 0.067 1.801 3 1.909 0.079 1.502 5 1.490 0.192 1.216
Tablo 4.7’den de görüleceği gibi akış hızının artmasıyla birlikte kolon sorpsiyon kapasitesi azalmıştır. Bu sonuç, akış hızının artmasıyla birlikte, çözelti ile adsorban madde arasındaki temas süresinin azalmasına bağlanabilir. Thomas modelinin deneysel verilere uygulanması suretiyle farklı akış hızlarında elde edilen breakthrough eğrileri Şekil 4.3.’te verilmiştir. Şekil 4.3.’ten görüleceği gibi, akış hızı arttıkça breakthrough zamanı azalmaktadır.
0 0.2 0.4 0.6 0.8 1 1.2 0 10 20 30 40 50 60 Süre, saat Ce /C o 2 mL/min 3 mL/min 5 mL/min
Şekil 4.3. Farklı akış hızlarındaki deneysel veriler ve Thomas modelinden elde edilen breakthrough eğrileri. ( Thomas modelini ifade etmektedir).
Ayrıca, aynı florür konsantrasyonu (5 mg/L) için, kesikli sistem ve kolon sisteminden elde edilen sorpsiyon kapasitelerini karşılaştırdığımızda, kolon sistemi ile elde edilen sorpsiyon kapasitesinin kesikli sistem ile elde edilenden (qe = 0.644 mg/g) daha büyük olduğu görülmüştür. Benzer sonuç, Genç-Fuhrmann ve ark. 2005 tarafından da belirtilmiştir.
4.4. Kolon Rejenerasyonu
Kolonlar florür ile doyduğunda yeniden kullanmak için desorpsiyon yapmak gerekir. 2 mL/dk akış hızında çalıştırılan kolon, rejenerasyon deneyleri için seçilmiş
ve rejenerasyon 100 mL 0.2 M’lık NaOH çözeltisi ile yapılmıştır. Desorpsiyon çalışmasından elde edilen sonuçlar Tablo 4.8.’de verilmiştir.
Tablo 4.8. Kolon rejenerasyon parametreleri (giriş florür konsantrasyonu: 5 mg/L, akış hızı: 2 mL/dk, desorpsiyon çözeltisi: 0.2 M NaOH, desorpsiyon çözeltisi akış
hızı: 1 mL/dk). qo ED Rejenerasyon sayısı mg/g % 1 2.051 87 2 1.730 76 3 1.311 58 4 0.824 46
Tablo 4.8’den de görüleceği gibi, 4. rejenerasyondan sonra kolondan desorbe edilen florür miktarının (ED), desorbe edilemeyen florürden daha az olduğu tespit edilmiş ve daha fazla rejenerasyon işlemi yapılmamıştır. Ayrıca, rejenerasyon sayısı arttıkça kolon adsorplama kapasitesinin de azaldığı görülmüştür.
5. GENEL DEĞERLENDĐRME VE ÖNERĐLER
Bu çalışmada, alüminyum üretimi sonucunda atık olarak ortaya çıkan kırmızı çamur granül hale getirilerek hem kesikli sistemde hem de kolon sisteminde florür gideriminde denenmiştir. Toz halindeki kırmızı çamur doğrudan kolon sisteminde kullanıldığında, kırmızı çamurun kolondan kaybı veya tıkanma problemleri ile karşılaşılmaktadır. Bu sebeplerden dolayı, toz halindeki kırmızı çamur granül hale getirilmiş ve florür gideriminde denenmiştir. Elde edilen sonuçlar, aşağıdaki gibi özetlenebilir.
i. Kesikli adsorpsiyon denemeleri sonucunda granül kırmızı çamur ile maksimum florür gideriminin pH 4.7’de olduğu görülmüştür.
ii. Kesikli denemelerde gerekli temas süresinin 6 saat olduğu ve adsorpsiyonun ikinci dereceden kinetik modele uyduğu tespit edilmiştir.
iii. Kesikli sistemde adsorpsiyonun Freundlich izoterm modeli ile daha iyi izah edildiği bulunmuştur. Freundlich adsorpsiyon kapasitesi k 0.851 mg/g olarak
tespit edilmiştir.
iv. Granül kırmızı çamurun kolon sisteminde denenmesi halinde kesikli sisteme göre daha yüksek sorpsiyon kapasitesi elde edilmiştir.
v. Kolon adsorpsiyon denemelerinde akış hızı arttıkça, kolon sorpsiyon kapasitesinin ve breakthrough zamanının azaldığı tespit edilmiştir.
vi. Kolon denemelerinden elde edilen veriler Thomas modeli ile uyum bir
şekilde izah edilmiştir.
vii. 0.2 M NaOH çözeltisi ile rejenerasyon çalışmaları sonucunda, 5 mg/L florür çözeltisi ile yüklenen kolonun rejenerasyon sayısı arttıkça sorpsiyon kapasitesinin azaldığı ve en fazla 4 kez rejenere edilebileceği tespit edilmiştir.
Sonuç olarak, toz halindeki kırmızı çamurun granül hale getirilebildiği ve hem kesikli hem de kolon sistemlerinde sulardaki florürün gideriminde başarılı bir
şekilde kullanılabildiği tespit edilmiştir. Bundan dolayı, kolon sistemlerinde granül kırmızı çamurun su ortamındaki diğer kirleticilerin giderimi için de denenmesi önerilmektedir.
6. KAYNAKLAR
Amor, Z., Malki, S., Taky, M., Bariou, B., Mameri, N., Elmidaoui, A., 1998, “Optimization of fluoride removal from brackish water by electrodialysis”, Desalination, 120, 263-271.
Apak, R., Tütem, E., Hügül, M., Hizal, J., 1997, “Heavy metal cation retention by unconventional sorbents (red muds and fly ashes)”, Water Res., 32, 430–440.
Balistrieri, L.S., Murray, J.W., 1981, “The surface chemistry of goethite (alpha FeOOH) in major ion seawater”, J. Am. Sci., 281, 788–806.
Benefield, L. D., Judkins, J. F., Weand, B. L., 1982, “Process Chemistry for Water and Wastewater Treatment”, Prentice-Hall, Inc, Englewood Cliffs, New Jersey.
Beyhan, M., 2003, Doktora Tezi, “Atık çamurlar ve doğal malzemeler ile sulardan florür iyonu gideriminin araştırılması”, Yıldız Teknik Üniversitesi Fen Bilimleri Enstitüsü, Đstanbul.
Çengeloğlu, Y., Kır, E., Ersöz, M., 2002, “Removal of fluoride from aqueous solution by using red mud”, Sep. Purif. Technol., 28, 81-86.
Çengeloğlu, Y., Tor, A., Arslan, G., Ersöz, M., Gezgin, S., 2007, “Removal of boron from aqueous solution by using neutralized red mud”, J. Hazard. Mater., 142, 412-417.
Çengeloğlu, Y., Tor, A., Ersoz, M., Arslan, G., 2006, “Removal of nitrate from aqueous solution by using red mud”, Sep. Purif. Technol. 51, 374–378.
Durmaz, F., Kara, H., Çengeloğlu Y., Ersöz, M., 2005, “Fluoride removal by Donnan dialysis with anion exchange membranes”, Desalination, 177, 51-57.
Ergün, E., 2008, Yüksek Lisans Tezi, “Elektrodiyaliz yöntemiyle sulardan florür’ün giderilmesi, Selçuk Üniversitesi”, Fen Bilimleri Enstitüsü, Konya.
Ergun, E., Tor, A., Cengeloglu, Y., Kocak, I., 2008, “Electrodialytic removal of fluoride from water: Effects of process parameters and accompanying anions”, Sep. Purif. Technol., 64, 147-153.
Fangsrekam, N., Watanesk, S., Watanesk, R., 1998, “Adsorption study for defluoridation by bone char”, Department of chemistry, Faculty of Science, Chiang Mai University.
Figueiredo, S.A., Loureiro, J.M. and Boaventura, R.A., 2005, “Natural waste materials containing chitin as adsorbents for textile dyestuffs: Batch and continuous studies”, Water Res., 39, 4142-4152.
Freundlich, H.M.F., 1906, “Über die adsorption in losungen”, Z. Phys. Chem. 57A, 385–470.
Genç, H., Tjell, J.C., McConchie, D., Schuiling, R.D. (2003), “Adsorption of arsenate from water using neutralized red mud”, J. Coll. Interface Sci., 264, 327–334.
Genç-Fuhrman, H., Bregnhøj, H., McConchie, D., 2005, “Arsenate removal from water using sand–red mud columns”, Water Res., 39, 2944-2954.
Guo, L., Hunt, B.J., Santsci, P.H., 2001, “Ultrafiltration behavior of major ions (Na, Ca, Mg, F, Cl, and SO4) in natural waters”, Water Res., 35, 1500-1508.
Jagtap, S., Thakre, D., Wanjari, S., Kamble, S., Labhsetwar, N., Rayalu, S., 2009, “New modified chitosan-based adsorbent for defluoridation of water”, J. Colloid Interface Sci. doi:10.1016/j.jcis.2008.11.080.
Kabay, N., Arar, Ö., Samatya, S., Yüksel, Ü., Yüksel, M., 2007, “Separation of fluoride from aqueous solution by electrodialysis: Effect of process parameters and other ionic species”, J. Hazard. Mater., 153, 107-113.
Kartöz, H., 1992, “Isparta’nın içme suları ve diş sağlığımız”, 1. Isparta’nın Dünü Bugünü ve Yarını Sempozyumu, 239-252, Isparta.
Kir, E., 2002, Doktora Tezi, “Kırmızı çamurdan metallerin geri kazanılması ve değerlendirilme yollarının araştırılması”, Selçuk Üniversitesi, Fen Bilimleri Enstitüsü, Konya.
Lagergren, S., Svenska, K., 1898, “About the theory of so called adsorption of soluble substances”, K. Sven. Vetenskapsad. Handl., 24, 1–39.
Langmuir, I., 1916, “The constitution and fundamental properties of solids and liquids”, J. Am. Chem. Soc., 38, 2221–2295.
Mahramanlioglu, M., Kizilcikli, I., Bicer, I.O., 2002, “Adsorption of fluoride from aqueous solution by acid treated spent bleaching earth”, J. Flourine Chem. 115, 41.
Maliyekkal, S.M., Sharma, A.K., Philip, L., 2006, “Manganese-oxide-coated alumina: a promising sorbent for defluoridation ofwater”, Water Res., 40, 3497–3506.
Sarkar, M., Banerjee, A., Pramanick, P.P., Sarkar, A.R., 2006, “Use of laterite for the removal of fluoride from contaminated drinking water”, J. Colloid Interface Sci., 302, 432–441.
Sears, G., 1956, “Determination of specific surface area of colloidal silica by titration with sodium hydroxide”, Anal. Chem. 28, 1981–1983.
Simons, R., 1993, “Trace element removal from ash dam waters by nanofiltration and diffusion dialysis”, Desalination, 89, 325-341.
Singh, G., Kumar, B., Sen, P.K., Majumdar, J., 1999, “Removal of fluoride from spent pot liner leachate using ion exchange”, Water Environ. Res., 71, 36-42.
Sourirajan, S., Matsurra, T., 1972, “Studies on reverse osmosis for water pollution control”, Water Res., 6 1073-1086.
Subhashini G. Pan, K.K., 2005, “Equilibrium, kinetics and breakthrough studies for adsorption of fluoride on activated alumina”, Sep. Purif. Technol. 42, 265–271.
Sujana, M.G., Thakur, R.S., Rao, R.B., 1998, “Removal of fluoride from aqueous solution by using alum sludge”, J. Colloid Interface Sci. 206, 94–101.
Thomas, H.C., 1944, “Heterogeneous ion exchange in a flowing system, J. Am. Chem.66, 1664–1666.
Tor, A., 2006, “Removal of fluoride from an aqueous solution by using montmorillonite”, Desalination, 201, 267-276.
Tor, A., Cengeloglu, Y., Aydin, M.E., Ersoz, M., 2006,“Removal of phenol from aqueous phase by using neutralized red mud”, J. Colloid Interface Sci., 300, 498-503.
Tor, A., 2007, “Removal of fluoride from water using anion-exchange membrane under Donnan dialysis condition”, J. Hazard. Mater., 141, 814-818.
Tor, A., Buyukerkek, T., Cengeloglu, Y., Ersoz, M., 2004, “Simultaneous recovery of Cr(III) and Cr(VI) from the aqueous phase with ion-exchange membranes”, Desalination, 171, 233-241.
Tor, A., Çengeloğlu, Y., 2006, “Removal of congo red from aqueous solution by adsorption onto acid activated red mud”, J. Hazard. Mater. B138, 409-415.
Viswanathan, C., Sundaram, S., Meenaksh, S., 2009, “Removal of fluoride from aqueous solution using protonated chitosan beads”, J. Hazard. Mater. 161, 423-430.
Y.S. Ho, G. McKay, 1999, “Pseudo-second order model for sorption processes”, Process Biochem., 34, 451–465.
WHO (World Health Organization), Guidelines for Drinking Water Quality, World Health Organization, Geneva, 1993.
Zambo, J., Orban, F., Sigmond , G., Csak, J., 1980, “Study on the disposal and utilization of bauxite residues” Final Report, Budapest.
Zeni, M., Riveros, R., Melo K., Primieri, R., Lorenzini, S., 2005, “Study on fluoride reduction in artesian well—water from electrodialysis process”, Desalination, 185, 241-244.
Zhu, C., Luan, Z., Wang, Y. Shan, X., 2007, “Removal of cadmium from aqueous solutions by adsorption on granular red mud (GRM)”, Sep. Purif. Technol. 57, 161-169.