TC
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI
ANABİLİM DALI
DİALİZ HASTALARINDA
ANJİOTENSİN KONVERTİNG ENZİM
(ACE) GEN POLİMORFİZMİ
TEZ YÖNETİCİSİ
Prof. Dr. M. Emin YILMAZ
UZMANLIK TEZİ
Dr. Avşar ZERMAN
TEŞEKKÜR
İç Hastalıkları uzmanlığı eğitimim süresince yetişmemde büyük emekleri olan saygıdeğer hocalarım; Rektörümüz Sayın Prof. Dr. Fikri CANORUÇ’a, İç Hastalıkları Ana Bilim Dalı Başkanımız Sayın Prof. Dr. O. Ekrem MÜFTÜOĞLU’na, Tez hocam Sayın Prof. Dr. M. Emin YILMAZ’a, emekli hocalarımız Sayın Prof. Dr. Bünyamin IŞIKOĞLU’na ve Sayın Prof. Dr. Halil DEĞERTEKİN’e, diğer hocalarımız Sayın Prof. Dr. Vedat GÖRAL’a, Sayın Prof. Dr. Orhan YAZANEL’e, Sayın Prof. Dr. M. Orhan AYYILDIZ’a, Sayın Prof. Dr. Mithat Bahçeci’ye, Sayın Doç. Dr. Abdurrahman IŞIKDOĞAN’a, Sayın Doç. Dr. Mehmet DURSUN’a, Sayın Doç. Dr. Kendal YALÇIN’a, Sayın Doç. Dr. Alparslan K. TUZCU’ya, Sayın Yrd. Doç. Dr. Dede ŞİT’e, Sayın Yrd. Doç. Dr. Şerif Yılmaz’a, Sayın Yrd. Doç. Dr. Abdullah ALTINTAŞ’a, Sayın Yrd. Doç. Dr. Ramazan DANIŞ’a, Sayın Yrd. Doç. Dr. Şenay ARIKAN’a, Sayın Yrd. Doç. Dr. Kadim BAYAN’a, Sayın Yrd. Doç.Dr Şehmuz ÖZMEN’e teşekkür ederim.
Rotasyon eğitimim sırasında bilgilerinden yararlandığım Sayın Prof. Dr Nizamettin TOPRAK’a, Sayın Doç. Dr. Aziz KARADEDE’ye, Sayın Doç. Dr. Sait ALAN’a, Sayın Yrd. Doç. Dr. Aziz KARABULUT’a, Sayın Yrd. Doç. Dr. Kenan İLTİMUR’a, Sayın Prof. Dr. Naime CANORUÇ’a Sayın Prof. Dr. Füsun TOPÇU’ya, Sayın Prof. Dr. Mehmet COŞKUNSEL’e, Sayın Prof. Dr. Abdurrahman ŞENYİĞİT’e, Sayın Prof. Dr. Celal AYAZ’a, Sayın Yrd. Doç. Dr Mustafa Çelen’e ve diğer öğretim üyelerimize teşekkür ederim.
Tezimin bütün aşamalarına katkıda bulunan ve yardımlarını esirgemeyen Yrd. Doç. Dr. Dede ŞİT’e ve Uzman Dr. A. Kemal KADİROĞLU’na teşekkür ederim.
Tezime ait örneklerin laboratuarda çalışılmasında katkıda bulunan Trakya Üniversitesi Biofizik Anabilim Dalı’nda araştırma görevlisi Sayın Metin BUDAK’a teşekkür ederim.
Birlikte çalıştığım tüm asistan arkadaşlarıma, İç Hastalıkları A.B.D. çalışanlarına ve desteğini esirgemeyen aileme, sevgili eşim Nermin ZERMAN’a teşekkür ederim.
İÇİNDEKİLER
TEŞEKKÜR 2 İÇİNDEKİLER 4 KISALTMALAR 6 TABLOLAR LİSTESİ 7 ŞEKİLLER LİSTESİ 8 ÖZET 9 SUMMARY 11 1.GİRİŞ VE AMAÇ 13 2.GENEL BİLGİLER 162.1.RENİN ANJİOTENSİN ALDOSTERON SİSTEMİNİ
OLUŞTURAN FAKTÖRLER 16
2.1.1.RENİN 16
2.1.2.ANJİOTENSİNOJEN 17
2.1.3.RENİN SALINIMINI ETKİLEYEN FAKTÖRLER 17 2.1.4.ANJİOTENSİN KONVERTİNG ENZİM (ACE) 18
2.1.5.ANJİOTENSİNLER 19
2.1.6.ANJİOTENSİN RESEPTÖRLERİ 20
2.1.7.ALDOSTERON 21
2.1.8. A II’NİN BÖBREKTEKİ ETKİLERİ 22 2.1.9. RAAS’NİN RENAL FİBROZİSTEKİ ROLÜ 23
2.2. ACE GENİ VE POLİMORFİZMİ 29
2.2.1.ACE GEN POLİMORFİZMİ 29 2.2.2.ACE GEN POLİMORFİZMİ VE HİPERTANSİYON 31 2.2.3. ACE GEN POLİMORFİZMİ VE ATEROSKLEROZ 34 2.2.4. ACE GEN POLİMORFİZMİ VE KORENER
ARTER HASTALIĞI 35
2.2.5. ACE GEN POLİMORFİZMİ VE İNME 37 2.2.6. ACE GEN POLİMORFİZMİ VE DİLATE
KARDİYOMYOPATİ 38
2.2.8. ACE GEN POLİMORFİZMİ VE VENÖZ
TROMBOEMBOLİ 41
2.2.9. ACE GEN POLİMORFİZMİ VE NEFROPATİ 41
3.GEREÇ VE YÖNTEM 44
3.1. BİOKİMYA, HEMOGRAM ANALİZLERİ 44
3.2.ANJİOTENSİN KONVERTİNG ENZİM GEN
POLİMORFİZMİNİN BELİRLENMESİ 45
3.3.İSTATİSTİKSEL DEĞERLENDİRME 45
4.BULGULAR 46
5.TARTIŞMA 49
KISALTMALAR
RAAS: Renin Anjiotensin Aldosteron Sistemi ACE: Anjiotensin converting enzim
I/I:İnsersiyon/İnsersiyon I/D:İnsersiyon/Delesyon D/D:Delesyon/Delesyon
PCR:Polimeraz zincir reaksiyonu A II: Anjiotensin II
SDBY: Son dönem böbrek yetmezliği DM: Diabetes mellitus
HT: Hipertansiyon
KGN: Kronik Glomerulonefrit PKBH: Polikistik böbrek hastalığı NO: Nitrik oksit
KB: Kan basıncı
DNA: Deoksiribonükleik asit
RANTES: Normal eksprese edilen ve salınan T hücrelerinin aktivasyonu ile düzenlenen
MCP-1: Monosit kemoatraktif protein-1
TGF β 1: Dönüştürücü Büyüme Faktörü –beta 1 PAF: Trombosit aktive edici faktör
FGF: Fibroblast büyüme faktörü
PDGF: Trombosit kökenli büyüme faktörü IL-1: İnterlökin-1
TABLOLAR LİSTESİ
Tablo 1:Renin-anjiotensin aldosteron fonksiyonları 27 Tablo 2: Anjiotensin II , AT1 ve AT2 reseptör etkileri 28
Tablo 3: Grupların ACE Gen polimorfizm dağılımının
karşılaştırılması 47 Tablo 4: Hasta grubunda etyolojiye göre ACE GEN
ALEL ( Del / Ins ) dağılımı 47 Tablo 5. Grupların cins, yaş, VKİ ve kan basınçlarının
ŞEKİLLER LİSTESİ
Şekil 1: RAAS Aktivasyonu 24 Şekil 2: AII’nin büyüme faktörleri üzerine etkileri 25 Şekil 3: AII’nin hemodinamik olmayan etkileri 25 Şekil 4: Artık böbrek modelinde RAAS’nin hasarın
progresyonuna etkisi. 26 Sekil 5: AII’nin renal fibrozisteki rolü 26 Şekil 6: ACE I/D polimorfizminin PCR Amplifikasyon
Bantları 48 Şekil 7: Hasta grubunun etyolojik dağılımı 48
ÖZET
Amaç: Kronik böbrek hastalığı (KBH) ile ACE I/D gen polimorfizmi ilişkisi ve bu
ilişkinin bu hasta populasyonunda hastalığın progresyonu üzerine etkisi son yıllarda üzerinde yoğun çalışmaların olduğu bir konudur. Merkezimizde diyaliz tedavisi gören hasta populasyonunda bu ilişkiyi araştırmayı amaçladık.
Gereç ve Yöntem: Çalışmaya 87 hasta, 38 sağlıklı kontrol grubu alındı.
Çalışmaya alınan kişilerin kan basınçları, vücut kitle indeksleri (VKI) ve biokimyasal paremetrelerine bakıldı. Kan basınçları JCN 7 (Ulusal Birleşik Komite) raporunda belirtildiği gibi ölçüldü ve sistolik kan basıncının 140 mmHg ve/veya diastolik kan basıncının 90 mmHg üzerinde olması hipertansiyon olarak kabul edildi. Genotiplemede polimeraz zincir reaksiyonu yöntemi kullanılarak ACE I/D gen polimorfizmi çalışıldı.
Bulgular: Olguların 49’u HD (% 56.3), 38’i SAPD (%43.7) programında idi. 38
sağlıklı kişi kontrol grubu olarak alındı. Kontrol grubunda gerek kendilerinde gerekse birinci dereceden akrabalarında Diabetes Mellitus, Kronik Böbrek Hastalığı, Hipertansiyon ve İskemik Kalp Hastalığı bulunmaması şartı arandı. Hasta grubu kontrol grubu ile yaş, cins, VKI, sistolik kan basıncı ve diastolik kan basıncı açısından karşılaştırıldı. Hasta grubunun yaş ortalaması 41.1±13.6 yıl, kontrol grubunun 38.0±1.41 yıl tespit edildi (p=0.162). Hasta grubunun Kadın/Erkek oranı 39/48, kontrol grubunda ise 24/14 olarak tespit edildi (p=0.059). Hasta grubunun VKİ 22.1±4.2 kg/m², kontrol grubunun 23.4±2.4 kg/m² id (p=0.065). Sistolik kan basıncı hasta grubunda 136.5±18.4 mmHg, kontrol grubunda 116.3±14.4 mmHg olarak ölçüldü. Diastolik kan basıncı hasta grubunda 81.3±8.6 mmHg, kontrol grubunda 69.2±10.2 mmHg olarak ölçüldü. Sistolik kan basıncı (p=0.001) ve diastolik kan basıncı (p=0.001) hasta grubunda, kontrol grubuna göre anlamlı derecede daha yüksek bulundu (p= 0,001).
Çalışma grubunda ki hastaların SDBY etyolojik nedenleri 24 (%28) DM, 21 (% 24) HT, 19 (% 23) kronik glomerulonefrit, 8 (% 9) postrenal böbrek hastalığı, 4 (%5) polikistik böbrek hastalığı, 11 (% 11) nedeni bilinmeyen böbrek yetmezliği olduğu görüldü.
ACE gen (I/D) polimorfizmi prevalansı hasta grubunda, I/I 8 (% 0.9), I/D 39 (% 44.8), D/D 40 (%45.9), kontrol grubunda I/I 12 (% 31.5), I/D 15 (% 39.4), D/D 11 (% 28.9) bulundu ve istatistiksel farklılık tespit edildi ( p= 0.006). Hasta grubu ve kontrol grubu ACE D alel dağılımları açısından karşılaştırıldı. Hasta grubunda % 68.4, kontrol grubunda %48.7 olarak bulundu (p= 0,001). D alel baskınlığı görüldü. Hasta grubu etyolojiye göre ACE gen alel dağılımı açısından karşılaştırıldı. Diabetes mellitus, Hipertansiyon, Kronik glomerülonefrit ve postrenal böbrek hastalığında D alel baskınlığı görüldü.
Sonuç olarak; Hasta grubunda ACE gen polimorfizmi için D alel frekansında ve
genotip dağılımında D/D baskınlığı görüldü. D alel dağılımı, diabetes mellitus, hipertansiyon, kronik glomerulonefrit ve postrenal böbrek hastalığında anlamlı derecede baskın bulundu. Bu verilere göre kronik böbrek hastalığının ACE I/D gen polimorfizim ile ilişkili olduğu ve bu ilişkinin renal hastalık progresyonuna etkili olabileceği düşünüldü.
Anahtar kelimeler: Anjiotensin converting enzim, ACE I/D polimorfizmi, SDBY
SUMMARY
Objective: Relation of chronic kidney disease (CKD) and ACE I/D gene
polymorphism and the effect of that relation in patient population is a subject which has plenty of studies on it last years. We aim to study on that relation with the patients are treated with dialysis in our dialysis center.
Material and methods: 87 patients and 38 normal people were studied. Blood pressure, body mass index (BMI) and biochemical parameters were checked in these people. Blood pressure were measured as determined in JCN 7 report and over 140 mmHg systolic blood pressure and/or over 90 mmHg diastolic blood pressure accepted as hypertension. In genotyping ACE I/D polymorphism was studied by using polymerase chain reaction.
Results: 49 (%56.3) people were in HD and 38 (%43.7) people were in SAPD
program. 38 people were in control group. In the control group we chose people and their first degree relatives who don’t have Diabetes Mellitus, chronic kidney disease, hypertension and ischemic heart disease.
Age, sex, BMI, systolic and diastolic blood pressures of patients and the control group were compared. The patient group’s average age was 41.1±13.6 years, and the control group’s average age was 38.0±1.41 years (p= 0.162). The ratio of female/male in the patient group was 39/48, in the control group was 24/14 (p=0.059). The patient group’s BMI was 22.1±4.2 kg/m2, and the control group’s BMI was 23.4±2.4 kg/ m2 (p=0.065). In the patient group systolic blood pressure was measured 136.5±18.4 mmHg, and in the control group was measured 116.3±14.4 mmHg. In the patient group diastolic blood pressure was measured 81.3±8.6 mmHg and in control group was measured 69.2±10.2 mmHg. The patient group’s systolic blood pressure (p=0.001) and diastolic blood pressure (p=0.001) was significantly higher than control group (p=0.001). The etiological reasons of ESRD in patient group were 24 (%28) DM , 21 (%24) HT, 19 (%23) chronic glomerulonephritis, 8 (%9) postrenal kidney disease, 4 (%5) polycystic kidney disease, 11 (%11) with unknown etiology kidney insufficiency .
In the patient group ACE gene (I/D) polymorphism prevalence was found I/I 8 (%0.9), I/D 39 (44.8), D/D 40 (%45.9) and in the control group was found I/I
12(%31.5) , I/D 15 (39.4), D/D 11 (%28.9) and statically differences were seen (p=0.006). The distribution of ACE D alleles were compared in the patient and control groups. In the patient group was %68.4 and in the control group was %48.7 (p=0,001). D allele was dominant. Patient group was compared for the distribution of ACE gene allele etiologically. In diabetes mellitus, hypertension, chronic glomerulonephritis and postrenal kidney disease D allele was dominant.
Conclusion: In the patient group for the ACE gene polymorphism, on the D
allele frequency and genotype distribution, D/D dominancy was seen. D allele distribution was significantly dominant in diabetes mellitus, hypertension, chronic glomerulonephritis and postrenal kidney disease. The present data indicate that chronic kidney disease may associate with ACE I/D gene polymorphism and that association may effect the renal disease progression.
1.GİRİŞ VE AMAÇ
Son dönem böbrek yetmezliği (SDBY) çevresel ve genetik faktörlerden kaynaklanan farklı böbrek hastalıklarının etyolojide rol oynadığı kompleks bir durumdur. SDBY’nin gelişim ve progresyon hızını etkileyen sorumlu genler yeni yeni tanımlanmaktadır. Renin anjiyotensin aldosteron sistemi (RAAS) ve gen polimorfizmleri daha önce geniş çapta araştırılmıştır ve bunların SDBY popülasyonunda olduğu kadar, genel popülasyonda da, sol ventrikül hipertrofisi, hipertansiyon ve renal fonksiyonların hızlı bozulması gibi sağ kalımı etkileyebilecek bazı etkenlerle ilişkili olduğu gösterilmiştir (1-5). Daha önce yapılan araştırmalarda anjiyotensinojen (AGT)-TT, anjiyotensin converting enzim (ACE)-D/D ve anjiyotensin II tip-1 ve -2 (ATR1 ve ATR2) reseptör- A/A genotiplerinde RAAS aktivitesinin anlamlı olarak daha yüksek olduğu gösterilmiştir (6-14).
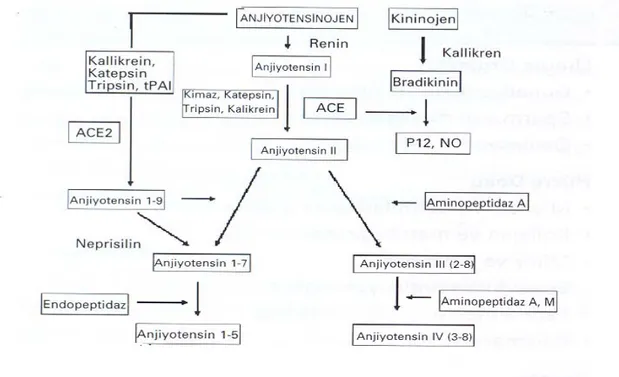
RAAS vücutta homeostatik pek çok olayda rol oynayan bir endokrin sistemdir. Bu sistemin en önemli hormonu, ACE’nin aracılık ettiği bir enzimatik reaksiyonla oluşan anjiyotensin II’dir. Karaciğerden salgılanan anjiyotensinojen, böbreğin jukstaglomerüler hücrelerinden salgılanan renin enziminin etkisi ile, karaciğerde anjiyotensin I’e dönüşür. Bir dekapeptit olan anjiyotensin I, akciğer kapillerinin endotel yüzeyinde bulunan ACE ile anjiyotensin II’ye çevrilir (15). Anjiyotensin II daha sonra dolaşıma karışarak hedef organlara ulaşır. Bu kaskat sistemik RAAS olarak bilinir. Buna ek olarak, vücudun hemen hemen tüm dokularında RAAS’ın tüm unsurlarının bulunduğu, depo edildiği ve salgılandığı saptanmıştır. Bu sisteme lokal doku RAAS’ı denilmektedir (15,16). Her iki sistem sonucunda oluşan anjiyotensin II hemen hemen tüm organlarda önemli fonksiyonlara katılır.
Anjiotensin II (AII), kronik böbrek hastalığına ilişkin hemodinamik ve non-hemodinamik mekanizmalarda merkezi rol oynamakta olup kronik nefropatilerin oluşumunu ve son dönem böbrek hastalığına doğru aşamalı ilerlemesini engellemeyi amaçlayan müdahalelerin ana hedefini oluşturmaktadır (17). İnvivo ortamda AII, afferent ve efferent glomeruler arteriollerin vasküler tonusunu artırarak intraglomeruler kapiller basıncı ve glomeruler filtrasyon hızını
ayarlamaktadır. AII vazokonstriktör etkisini baskın olarak postglomeruler arteriollerde göstermekte ve bu yolla glomeruler hidrolik basıncı ve glomeruler hiperfiltrasyonu artırmaktadır. Yüksek glomeruler kapiller basınç, glomeruler membranda yer alan porların yarıçaplarını artırarak membranın plazma makromoleküllerine gösterdiği boyut seçici işlevi bozmakta ve proteinüri ile sonuçlanmaktadır. Glomeruler geçirgenlik artışı, glomeruler kapiller boyunca anormal protein geçişi ile sonuçlanmakta olup, bu durum ilerleyici glomeruler ve tubulointertisyel hasara katkı sağlamakta, sonuç olarak böbrek işlev kaybı ve skarlaşmaya neden olmaktadır (18).
ACE vasküler endotelyal hücreler tarafından sentezlenir ve klas 1 integral ektoenzim olarak plazma membranına eksprese edilir (19). ACE gen ekspresyonu hala büyük ölçüde bilinmemekle birlikte doku spesifik olabileceği düşünülmektedir (20). ACE geni 17. kromozomun uzun kolu üzerinde (17q23) lokalizedir. Bu genin 16. intronunda 287 baz çiftlik bir alu tekrar bölgesinin varlığı veya yokluğuna göre insersiyon/delesyon (I/D) polimorfizmi meydana gelmektedir (20,21,22). Bu polimorfizim, sonuçta üç genotipe neden olmaktadır. Bu genotipler homozigot D/D veya I/I genotipi ve heterezigot I/D genotipidir (23).
ACE genindeki ‘insersiyon’ ACE ekspresyonunu azaltır, böylece I/I homozigotlara göre D/D homozigotlar %65, I/D heterozigotlar ise %31 daha fazla ACE’ye sahiptir (21). ACE D alelli kişilerde plazma ACE aktivitesinin, ACE I alelli kişilere göre daha yüksek olduğu yapılan araştırmalarla bildirilmiştir (24,25). I alellilerde gözlenen düşük ACE aktivitesi, bradikininin yarı ömrünün artması ve anjiotensin II üretimindeki azalma, endotele bağlı artmış vazodilatasyon sebebiyle ACE genotipinin fizyolojik önemini vurgulamaktadır (26).
Türk toplumunda yapılan bir araştırmada pozitif aile hikayesi olan ciddi hipertansiyonlu hastalarda D/D genotipinin predispozan bir faktör olduğu ve ACE I/D polimorfizminin hipertansiyon üzerine bağımsız faktörlerden biri olarak etki edebileceği ortaya konulmuştur (27). Erkeklerde ACE genotipi ile diastolik kan basıncı arasında bir ilişki bulunduğunu bildiren çalışmaların (28) yanında, ACE genotipi ile kan basıcı arasında bir ilişki bulunmadığını bildiren araştırmalarda bulunmaktadır (29). Ancak toplumumuzda yapılan başka bir
araştırmada ise Tip 2 diyabetik hastalarda hipertansiyon ile ACE I/D polimorfizmi arasında bir ilişki saptanmamıştır (30). Ayrıca ACE D/D genotipli hemodiyaliz hastalarının hemodiyaliz için yüksek risk taşıdığı da başka bir çalışmanın sonucu olarak bildirilmektedir (31).
Bu çalışmada merkezimizde diyaliz tedavisi görmekte olan hastalarda ACE gen polimorfizm frekanslarının dağılımını araştırmayı planladık.
2.GENEL BİLGİLER
Renin Anjiyotensin Aldosteron Sistemi (RAAS) vücutta birçok sistemi ilgilendiren kompleks bir endokrin sistemdir. Temel olarak su elektrolit dengesi ile birlikte kan volümü ve basıncının düzenlenmesinde görev almasına karşın, yakın zamanda proliferatif, proinflamatuar, apoptoz ve ateroskleroz gelişimi üzerine olan etkileri ön plana çıkmaya başlamıştır. Önceleri dolaşımdaki komponentleriyle sadece sistemik etkisi olduğu düşünülen RAAS’ın çeşitli dokularda farklı bileşenlerin üretilmesiyle parakrin, otokrin ve intrakrin etkilerinin olduğu anlaşılmıştır. Daha da önemlisi lokal etkili RAAS’ın vücutta önemli patolojik olaylarda çoğu zaman sistemik RAAS’dan daha etkili olduğu ve bu sistemin blokajı ile patolojik durumların gerilediği saptanmıştır. Lokal etkili doku RAAS’ın hücre proliferasyonu, proinflamasyon, ateroskleroz gelişimi, plak instabilitesi, endotel disfonksiyonu, vasküler yeniden şekillenme (remodeling), apoptoz ve fibrinolitik sistem üzerine etkileri vardır. RAAS’ın fizyolojik etkilerinden sorumlu, temel hormonu anjiyotensin II’dir. Anjiyotensin dönüştürücü enzim (angiotensin converting enzyme=ACE), anjiyotensin I’in anjiyotensin II’ye dönüşümünü sağlayan enzimdir. Çeşitli fizyolojik uyarılara cevap olarak aktive olan RAAS’ın kompanzatuar etkileri bazı patolojik durumlarda yararlı etkilerinden çok zararlı etkileri olan bir kısır döngü haline gelebilir. Bu kısır döngü sürecinde yer alanlar daha çok anjiyotensinler ve özellikle anjiyotensin II (AngII ) iken aldosteronun fizyolojik olaylardaki önemi daha önde gelir. Hipertansiyon, kalp yetersizliği, ateroskleroz ve koroner arter hastalığı gibi önemli hastalıkların patofizyolojisinde rol aldığı için RAAS’ın öncelikle fizyolojisinin iyi anlaşılması gerekmektedir.
2.1. Renin-Anjiotensin-Aldosteron Sistemini Oluşturan Faktörler 2.1.1.Renin
Aspartil proteaz enzim olan renin 40 kD ağırlığındadır ve gen
lokalizasyonu I.kromozomdadır (32). Karaciğerde yapılan anjiyotensinojenin, dekapeptid olan AI'e dönüşümünü sağlayan renin (33), esas olarak afferent arteriyol junkstaglomerüler hücrelerinde ve daha az olarak da düz kas
hücrelerinde sentezlenir (34). Proksimal tübüler ve mezanjiyal hücrelerde de mRNA saptanmıştır (35). Beyin, adrenal bezler, testisler, karaciğer ve damar duvarında mRNA bulunması reninin böbrek dışında da sentezlendiğini düşündürmektedir (36). Renin, pre-proreninden kaynaklanan proreninden oluşur. Prorenin, Golgi aygıtındaki hücrelerin lizozomal granüllerinde depolanır ve katepsin B enzim etkisi ile renine dönüşür ya da membrana bağlı veziküllerden doğrudan salgılanır. Akut stimülasyonlarla (cAMP) sekretuar gra-nüllerden renin hızla salınır (37). Aktif renin, tek zincirli olarak afferent arteriyolde, çift zincirli olarak maküladensa da bulunmaktadır. Reninin RAAS sistemindeki rolü, anjiyotensinojeni 10.-11. lösin amino asit zincirinden ayırarak AI'e çevirmektir. Nguyen ve arkadaşlarının (38) renin/prorenin reseptörlerini saptamaları, reninin başka etkileri olabileceğini, presör hormondan çok büyüme faktörü olarak rol aldığını düşündürmektedir (39).
2.1.2.Anjiotensinojen
Bir alfa2-globulin olan 50-100 kD molekül ağırlığın daki
anjiyotensinin plazma yarı ömrü 4-16 saattir. Öncelikle karaciğerde ve daha az oranda da böbrekler, adrenal glandlar, akciğer, kalp, vasküler dokular, testisler, gastrointestinal traktusta sentezlenir. Plazmadaki konsantrasyonu glukokortikoidler, östrojen, oral kontraseptifler ve kortikosteroidlerle artar. Organizmadaki etkinliği net olarak bilinmemektedir. Ancak, hipertansiflilerde (HT) ve normotensif olan çocuklarında, kan basıncı (KB) ve plazma renin düzeyiyle pozitif korelasyonlu olarak (0.39) dolaşımdaki anjiyotensinojen düzeyinde %24-30'a varan bir artış olmaktadır (40). Bazı çalışmalarda, anjiyotensinojen gen polimorfizminin (T235) HT'lilerdeki KB ile pozitif ilişki göstermesi, anjiyotensinojenin, HT gelişiminde rol aldığını düşün dürmektedir (41).
2.1.3.Renin salınımını etkileyen faktörler
Afferent arteriyolde baroreseptör artışı, renal perfüzyon azalması, kan
volumü ve sodyum (Na+) konsantrasyonu ile distal tübüldeki makula densaya sodyum klorür (NaCl) ve sıvı ulaşımının azalması, beta ve alfa adrenerjik
nöronal uyarım ve aldosteron salınımının azalmasıyla renin salınımı artar. Lokal olarak oluşan prostaglandin E2 ve protasiklin (PGE2, PGI2), atriyel natriüretik peptit (ANP), tümör nekrozis faktör (TNF), interlökin-1 (IL-I) artışı da renin salınımını uyarır. All artışı, mineralo kortikoidler, beta adrenerjik blokaj, tuz alım artışı, vazopresin (ADH), tromboksan A2 (TXA2), endotelyal büyüme faktörü (EGF) ile renin salınımı baskılanır (42).
2.1.4.Anjiotensin Konverting Enzim (ACE)
Endotel hücrelerinin plazma membranı üzerinde bulunan ve çinko
metalopeptidaz enzimi olan ACE, AI'in AII'ye dönüşümünde ve bradikinin yıkımında da rol aldığı için, RAAS ve kallikrein-kinin sisteminde kilit görev yapar. 17. kromozomda gen lokalizasyonu olan ACE'nin, iki ayrı mRNA ile kodlanan iki formu vardır. Yüksek molekül ağırlıklı (170 kD) ACE, endotel, epitel, nöronal hücrelerde, düşük moleküler ağırlıklı (90 kD) formu ise germinal hücrelerde bulunur. Membran ektoenzim olan ACE'nin %10'u plazmada serbest halde, %90'ı dokularda hücre membranına bağlı şekilde bulunur. Organizmadaki dağılımı yaygın olan ACE, plazma kalp ve adrenal bezlerde yüksek konsantrasyondadır (43). Fizyolojik koşullarda en yüksek ACE etkinliği akciğer endotelinde, daha az olarak da sağ atriyumda bulunur. Bu nedenle, dolaşımdaki AI'in %90'ı akciğerlerde AII'ye dönüşür. Genetik olarak dokudaki ACE aktivitesinin kaybedilmesiyle hipotansiyon gelişmesi, dokudaki ACE etkisinin plazma dakine oranla daha güçlü olduğunu göstermektedir (43). Ayrıca, plazma ve dokudaki ACE' nin farklı fonksiyonları olduğu, plazmadaki ACE'nin akut etkilerden, dokudaki ACE'nin kronik etkilerden sorumlu olduğu düşünülmektedir. Dokudaki ACE, vasküler dilatasyon/konstriksiyon, proliferasyonun uyarılması/önlenmesi, pro/antiinflamatuar ve hemostaz olaylarında, oksidatif stres oluşumunda rol almaktadır. Bazı çalışmalarda, HT’lilerde ACE gen polimorfiziminin (insersiyon/delesyon) oluştuğu, ACE aktivasyonunun D allel homozigotlarda en yüksek, I allel homozigotlularda en düşük, I/D heterezigotlarda orta düzeylerde olduğu gözlenmiştir (44).
İnsanlarda ilk gösterilen ACE homologu ACE 2'dir. Gen lokalizasyonu X krozomomu üzerindedir. Koroner ve intrarenal damar endotelinde, renal tübüler epital hücrelerinde ve testislerde bulunur. ACE, AI'den iki a.a. ayırarak AII'yi (anjiyotensin 1-8) oluştururken ACE 2, yalnızca lösin a.a.'yı ayırarak AII (Anjiyotensin 1-9) oluşturur. A I-9 da ACE ve diğer peptitazlarlarla anjiyotensin 1-7’ye dönüşür. A 1-7, RAAS üyesi olmasına karşın ACE'yi inhibe ederek bradikinini ve nitrik oksit (NO), PGI2 yapımını artırır, A II'nin hipertansif ve proliferatif etkilerini azaltır. RAAS'ın vazodilatatör, antiproliferatif etkili olan bu farklı üyesi ACE tarafından inaktive edilir. Ayrıca ACE inhibitörleriyle ACE2'nin baskılanmaması da, iki formun etkilerinin farklı olduğunu göstermektedir. Genetik olarak ACE 2'nin azaltılmasıyla miyokard kontraktilitesinde defekt ve AII'de artış olması, ACE 2'nin kardiyak fonksiyonlarda önemli rol oynadığını göstermektedir (43). Ay-rıca, ACE dışı enzimlerlede anjiyotensi nojenden direkt olarak ve AI'den AII oluşturulmaktadır (Şekil1).
2.1.5.Anjiotensinler
AII'ye benzer şekilde renal kortikal kan akımını (45) ve medüller
katekolamin salınımını (46) artırdığı bildirilmiştir. Bilinen belirgin bir etkisi tanımlanmayan AI, yaklaşık bir dakikada AII'ye dönüşür. Kan dolaşımında 30-120 saniye kalarak etkisini reseptörler düzeyinde gösteren AII, biyoaktif olan anjiyotensin III (AlIl),anjiyotensin IV (AIV) ve inaktif metabolitlerine dönüşür. Birçok organdaki anjiyotensinlerin sentez ve etkileri tam olarak bilinmemektedir. RAAS'ın fizyolojik etkileri en iyi bilinen ve KB artışında en etkili olan üyesi AII' dir. Klinik açıdan yaşamsal olan sınırlı sayıdaki fizyolojik etkilerinin yanında fizyolojik olmayan önemli etkileri vardır (47). Uzun süreden beri fizyolojik koşullardaki bilinen en önemli etkisi KB regülasyonundaki görevidir. Bu işlevi, damar duvarı ve kalp kasında konstriksiyon, merkezi ve periferik sempatik sistemde uyarıyı hızlandırma, beyinde susama merkezini ve vazopressin salınımını uyarma, adrenal medulladan adrenalin salınımı ile vasküler tonusu ve adrenal korteksten aldosteron salınımı ile böbreklerden Na+ ve su tutulumunu hızlandırarak kan volümünü düzenlemesiyle gerçekleştirmektedir (48). Aynı
zamanda NO (Nitrik oksit) ve PGI2 yapımını uyararak KB'nin fazla yükselmesini önler. Güçlü bir vazokonstriktör olmasına karşın, selektif damarlarda kan akımını sağlar. KB'yi düşüren hemoraji, dehidratasyon ve postural hipotansiyon gibi olaylarda devreye girerek saniyeler ve dakikalar içinde vazokonstriksiyon ve aldosteron salınımını gerçekleştirir. Böbreklerde All ve aldosteronun etkisi ile proksimal ve distal tübüllerden Na + -su emilimi artar. Efferent arteriyol konstriksiyonu ile glomerül basıncının devamlılığı ve prostaglandin sentezi ile de afferent arteriyol dilatasyonu ve renal kanlanma sağlanır (tablo1). Bu etkilerinden ötürü çok küçük düzeylerdeki AII artışının devam etmesi, HT gelişmesine yol açmaktadır. AII, HT'ye yol açan etkilerini efektör organlardaki reseptörler aracılığıyla gerçekleştirir (49).
2.1.6.Anjiotensin reseptörleri
AII reseptörleri, değişik dokulardaki hücrelerin plazma membranlarına yerleşmiş özgün reseptörlerdir. AII'nin bugün için klonlanmış reseptörleri AT1 ve AT2 reseptörleridir. AII peptidinin amino asit diziliminin bu reseptörlerce tanınması, bağlanarak etki yapmasında önemlidir. AII'nin A Tl reseptör etkisi AT2'ninkinden daha güçlüdür. Yaklaşık 350 amino asitten oluşan ATl 40.9 kD molekül ağırlığında, transmembran grup reseptörlerindendir (50). Kromozom 3'te lokalize olan AT1, G proteinine bağlanarak etki gösterir. AII'nin her iki reseptöre etkisi eşit, AT1'e etkisi AIII'ünkinden daha güçlü, AT2'ye etkileri ise benzer bulunmuştur. Radyonükleidle işaretlenmiş AII ile yapılan otoradyografi veya in situ hibridizasyon incelemelerde, AII'nin fizyolojik etkilerinin görüldüğü tüm organlarda ATl reseptörlerinin bulunduğu gözlenmiştir. Böbrekler, adrenal bezler, kalp ve aortada AT1 ve AT2 eşit düzeyde bulunurken akciğer, karaciğer ve plasentada yalnızca AT1 reseptörleri bulunmaktadır. AT2 ise overler, adrenal medulla ve pankreasta ağırlıklı olarak bulunmaktadır (50,5152). Değişik faktörlerle etkilenen reseptör ekspresyonu, mRNA ile oluşmaktadır. AII hücrelerdeki hipertrofi ve hiperplazi, ekstraselüler matriks protein yapımı ve yıkımına yol açan etkileri ATl reseptörleri ile oluşur. AII'nin, AT2 blokerleriyle önlenemeyen proliferatif
ve dejeneratif etkilerinin, ATl blokerleriyle azalması bu görüşü desteklemektedir (54). AII'nin AT1'e bağlanması ile hücresel Ca++ ile ilişkili mekanizma harekete geçer. ATl 'in uyarılması, G protein ve fosfolipaz C'yi aktive eder. Hücre içi diasil gliserol (DAG) ve trifosfat (iP3) artar. iP3'ün etkisiyle hücre içindeki Ca++ sitozole taşınır, yavaş çalışan kalsiyum kanallarının açılmasıyla hücre içi kalsiyum konsantrasyonu artar. Hücre içi kalsiyum artışı ile kontraktil elementlerin kasılmasına bağlı olarak hücrelerde proliferasyon ve hiperplazi gelişir. AII’nin T1 reseptörüne bağlanması ile resistans arteriollerinde ve vasküler düz kas hücrelerinde kasılma oluşur. AII protoonkogenik uyarıyla kemotaksis ve migrasyonu hızlandırır, damar hücrelerinde proliferasyon ve hipertrofi ile intimal hiperplazi ve anjiogenezise yol açar. Myokardda, kontraktilite, hipertrofi, kollajen sentezi ve fibrozisi artırıcı etki yapar. Özetle AII hem kalp debisi hem de periferik direnç üzerindeki dört birincil uyarı türünde rol almaktadır (55). Böbrekte, renal dokuda yüksek konsantrasyonda olan anjiotensin I ve özellikle II efferent arterioler resistansla intraglomeruler basınç ve filtrasyonu, sempatik aktivasyonla tuz emilimini artırır. Adrenal glandda, aldosteron ve katekolamin salınımını uyarır. Beyin ve pitüter glandda ADH salınımını ve su içmeyi uyarıcı etki yapar. AT2 reseptör etkileri genellikle AT1’e karşı koruyucu özelliktedir (56,57,58) (tablo 2).
2.1.7.Aldosteron
Başlıca AII ve potasyum (K+) etkisiyle adrenal korteks zona glomerulozada sentezlenen steroid hormondur. Doku ACE aktivitesiyle oluşan AII’de damar endoteli ve düz kas hücrelerinde lokal aldosteron sentezine yol açar. Aldosteron, renal tubuler epitel ve distal kolondan Na+ emilimini ve K+ salınımını uyarır. Distal ve kolektör tubullerin epitel hücrelerinin apikal membranlarında Na geçiren kanalların sayısını artırarak ve olası metilasyonuyla kanalın açık kalmasını sağlayarak Na’un pasif difüzyonunu sağlar. Ayrıca epitelyum hücrelerinin bazolateral membranında Na/K-ATP’ase sentezini uyararak Na+’un aktif emilimini sağlar, K+ ve Mg++’un atılımını artırıcı etkileri de kan basıncı artışını kolaylaştırır. AII’ye benzer şekilde,dokuda kollajen birikimini artırarak myokardda fibrozis oluşmasını tetikler.
2.1.8. A II’nin Böbrekteki Etkileri
AII biyolojik etkilerini başlıca iki tip reseptör üzerinden göstermektedir. Normal fizyolojik koşullarda erişkin dokularda en fazla sunulan reseptör AT1 subtipidir. Bu reseptörlere bağlanarak AII, vazokonstriksiyon aldosteron sekresyonu, sodyum reabsorbsiyonu, su iştahının artışı, ADH (Anti Diüretik Hormon) sekresyonu ve hücre büyümesinin uyarılması gibi etkilerini gerçekleştirir. AII, AT1 reseptörlere göre daha az sunulan AT2 reseptörlere bağlanarak farklı işlevler gerçekleştirir. Bazı hastalık durumlarında ya da kronik AT1 reseptör blokajı uygulandığında AT2 reseptör sunusu artarak vazodilatasyon, hücre büyümesinin ve fibrozisin bakılanması gibi işlevler ön plana geçmektedir.
AII bilinen klasik hemodinamik etkilerine ek olarak, doğrudan ya da diğer büyüme faktörleri aracılığı ile (şekil 2) dolaylı olarak, birçok hemodinamik olmayan etkilere sahiptir (şekil 3). Böbrek hastalıklarının fizyopatolojisindeki rolünde bu iki tip etkininde önemli payı bulunmaktadır.
Böbrekteki AII düzeyleri dolaşımdaki konsantrasyonun 1000 katı kadardır. A II ‘ nin normal fizyolojik koşullarda glomerüler filtrasyon hızının ayarlanmasında kritik bir görevi olmakla birlikte, glomerüler kapiller basıncı arttırarak glomerüloskleroz gelişiminde de rol oynar. Hemodinamik etkilerine ek olarak, mesenjial hücreler üzerine önemli doğrudan etkileri vardır. A II, kültüre mesenjial hücrelerde AT I reseptörler üzerinden hipertrofi ve proliferasyonu uyarır, süperoksit anyon oluşumunu doz bağımlı olarak arttırır (59). Glomerülosklerozun progresyonunda transforming growth factor-β1 (TGF-β1) mesenjial hücre hipertrofisi ve ekstrasellüler matriks artışı ile anahtar bir rol oynar. A II’ye bağlı glomerülosklerozun, TGF-β1 ile ilişkili olduğu düşünülmektedir (59). Sıçan mesenjial hücrelerinde A II, TGF-β1, m-RNA ve protein düzeylerine ve biglikan, fibronektin, tip 1 kollajen gibi ekstra sellüler matriks komponentlerini arttırır. A II, aynı hücrelerden TGF- β1 aracılığı ile plasminojen aktivatör inhibitör-1 (PAI-1) oluşumunu arttırır.
Sıçanların glomerüler endotelyal hücrelerinde hem AT 1 hem de AT 2 reseptörler bulunur. Bu hücrelerden A II AT 2 reseptörler aracılığı ile RANTES (Normal eksprese edilen ve salınan T hücrelerinin aktivasyonu ile düzenlenen)
m-RNA ve protein sentezini arttırarak, glomerüler enflamasyonda rol oynar. Glomerüler epitelyal hücrelerde de AT 1 ve AT 2 reseptörler bulunur. A II bu hücrelerde AT 1 reseptörler üzerinden c-AMP’yi arttırır, ancak bu durumun fizyolojik önemi bilinmemektedir. Sıçanların A II infüzyonu glomerüler kapiller basınç artışı, proteinürü ve glomerüloskleroza yol açar. Sıçanlarda glomerüler hastalık geliştiğinde hücrelerde ortaya çıkan fenotipik değişiklikler A II tarafından uyarılır. A II infüzyonu glomerüler TGF- β1 ve kollajen tip 1 m-RNA artışına yol açar. Sıçanlara intraperitoneal A II verilmesiyle glomerüler RANTES protein ve m-RNA uyarılır ve glomerüllere monosit-makrofaj gelişi artar (59). Çeşitli deneysel glomerüler hastalık modellerinde ACE inhibitörleri yada AT 1 resptör antagonistlerinin glomerüler hücrelerde fenotipik değişiklikler oluşumu TGF- β1 aktivasyonu ve ekstrasellüler matriks komponenetlerindeki artışı önlediği ve glomerülosklerozu hafiflettiği gösterilmiştir.
2.1.9. RAAS’nin Renal Fibrozisteki Rolü
Böbrek hastalıklarının fizyopatolojisi ve böbrek hasarının progresyonunda RAAS’nin anahtar rol oynadığı, ilk kez 1980’lerde Brenner ve grubunun sıçanlarda oluşturduğu ‘artık böbrek’ modeli çalışmalarıyla ortaya konmuştur. Bu modelde 5/6 nefrektomi uygulanan sıçanlarda glomerüler hiperfiltrasyon geliştiği, intraglomerüler kapiller basınç artışı, proteinüri ve sonuçta fokal glomeruloskleroz ortaya çıktığı, bu durumun tek tek nefronlarda hiperfiltrasyonu arttırarak kısır döngüye yol açtığı ve hasarın progresyon gösterdiği saptanmıştır. Artık böbrek modelinde protein kısıtlaması ve ACE inhibitörleri ile progresyonun yavaşlaması, bulguların artmış RAAS aktivasyonuna bağlı olduğunu düşündürmüştür (şekil 4). Son zamanlarda AII’nin hemodinamik olmayan etkileri ve diğer büyüme faktörleri ile ilişkilerinin saptanması ile, RAAS komponenetlerinin renal fibrozisteki rolü daha iyi bir şekilde anlaşılmıştır. Hem A II (şekil 5) hem de AIII renal ve enflamatuar hücreler üzerine olan proenflamatuar ve protrombotik etkileri ile renal hasarın oluşum ve progresyonunda anahtar rol oynamaktadır (60,61).
Son zamanlarda yapılan çalışmalar, anjiyotensinlere ek olarak, aldosteronun da hemodinamik ve hemodinamik olmayan etkileri ile, böbrek
hastalıklarının oluşum ve progresyonunda önemli bir rol oynadığını ortaya çıkarmıştır. Aldosteron, in vitro mesenjial hücrelerde tip IV kollajen sentezinde artış, vasküler düz adele hücrelerinde plazminojen aktivatör inhibitör-1 (PAI-1) sunusunda artışa yol açar. İn vivo normal sıçanlarda aldosteron infüzyonu ile idrar TGF-β atılımında artış olduğu saptanmıştır.
Renin anjiotensin aldosteron sistemi, böbrek hastalığı oluşum ve progresyonunda anahtar rol oynamaktadır. Bu sistemin mediyatörleri ve bunların etkileri hakkındaki bilgilerimiz her geçen gün artmaktadır.
Şekil 2:AII’nin büyüme faktörleri üzerine etkileri.(NF-κB: nükleer faktör kapa B; TGF-β1:dönüştürücü büyüme faktörü-beta 1; PAF:trombosit aktive edici faktör; FGF:fibroblast büyüme faktörü; PDGF: trombosit kökenli büyüme faktörü;IL-1: intörlökin 1).
Şekil 4:Artık böbrek modelinde RAAS’nin hasarın progresyonuna etkisi.
(FGS: fokal glomeruloskleroz; HT: hipertansiyon; ACEİ: ACE inhibitörü; SNGFR: tek nefron glomerulofiltrasyon hızı; Pgc: glomerulor kapiller basınç)
Tablo 1:Renin-anjiotensin aldosteron fonksiyonları Kardiovasküler Sistem
- Sistemil arteryel basınç yükselmesi
- Lokal selektif arteriol kan akımı düzenlenmesi - Kalp ve damar düz kas hücre hipertrofisi - Damar düz kas hücrelerinin migrasyonu - Hiperplazi-hipertrofi
- Doğrudan anjiotensin II aktivasyonu, - Büyüme faktörleri (FGF, PDGF) - Protoonkogenlerin uyarımı - Endotelden NO, PGI2 uyarımı - Pozitif kalp inotrop/kronotrop - İnflamasyon mediatörleri
Endokrin Sistem
- Aldosteron sentez salınımı - Katekolamin salınımı - ADH salınımı
Sinir Sistemi
- Merkezi ve periferik sempatik uyarı - Susama,su içme
- Öğrenme ve hafıza düzenlenmesi
Üreme Organları
- Gonadotropin-östrojen yapımı - Sperm yapımı-olgunlaşması - Ovulsyon regulasyonu
Hücre Doku
- Myozit ve fibroblastlarda protein sentezi - Kollajen ve matriks protein sentezi - Mitoz ve hiperplazi
- Peptid metabolizma bozukluğu - İnflamasyon kontrolü-doku onarımı
Böbrek
- Su-Na emilimi,K-Mg atılımı
- Efferent arteryel basınç ve GFR artışı - Renin salınım kontrolü
- Renal kan akım dağılımının düzenlenmesi
Diğerleri
- Süperoksit artışıyla NO fonksiyon bozukluğu - İnsülin direnci
- Glukoz intoleransı - Lipid oksidasyonu - Koagülasyon bozukluğu
Tablo 2: Anjiotensin II, AT1 ve AT2 reseptör etkileri
AT1 Resaptör AT2 Reseptör - Vazokontriksiyon - Vazodilatasyon
- Kardiak kontraktilite - Bradikinin yapımı - Kardiyak hipertrofi - NO yapımı
- Sempatik aktivasyon - Prostaglandin yapım artışı - Aldosteron salınımı - cGMP,tPA yapımı
- Vazopresin salınımı - Fetal doku gelişimi - Santral osmo kontrol - Apopitozis
- Renin baskılanması - Doku rejenerasyonu
- Metaloproteinaz yapımı -Kollajen doku baskılanması - Endotel NO disfonksiyonu - Anjiyogenezis baskılanması - Endotelin PAI-I,fibrinojen artışı -Hücre büyüme baskılanması - İntraselüler asidoz
- Hücre büyüme ve proliferasyonu - Büyüme faktörleri,matriks artışı - Renal tuz tutulumu,tuz iştah artışı
2.2. ACE GENİ VE POLİMORFİZMİ
Canlılarda bulunan genetik maddenin iki tane görevi vardır; kendisine benzer ya da kopya olan yeni maddeleri oluşturmak ve metabolizma için gerekli makromoleküllerin sentezi için bilgi aktarımını sağlamaktır. Bir birey veya hücrenin genetik materyalinin tamamı genom olarak adlandırılır. İnsan genomu 23 çift kromozom içinde saklanmaktadır. İnsanda 1 çift cinsiyet kromozomu (x ve y) ve 22 çift otozomal kromozom bulunmaktadır. Kromozomlar nükleik asitler ve histon gibi proteinlerin bileşiminden oluşur. Canlılarda kalıtsal bilgiyi kromozomlarda bulunan deoksiribonükleik asit (deoxyribonucleıc acid = DNA) taşır. Oldukça uzun bir molekül olan DNA, karşılıklı nükleotidlerin dizildiği çift sarmal halinde bulunur. Pürin ya da Pirimidin bazlarının birinin deoksiribozla birleşmesine nükleozid denir. Nükleozide fosfat ilavesi ile nükleotid meydana gelir. DNA molekülünde 1000 baz çifti uzunluğu için 1 kilobaz (kilobase=kb) ölçü birimi kullanılır.
Spesifik bir polipeptidi kodlayan ayrı bir DNA birimine gen denir. Her gen kromozom üzerinde özel bir yere sahiptir. Buraya gen loküsü ya da loküs denir. İnsan DNA’sında kodlanmış olan yapısal genlerin 100.000 dolayında olduğu tahmin edilmektedir. Protein kodlayan bir genin anatomisini intronlar ve eksonlar oluşturur. Eksonlar esas genetik şifreyi taşırlar. İntronlar protein kodlaması yapmazlar. İntronlar DNA yapı ve bütülüğünün korunması, genin ne zaman ve nasıl m RNA oluşturacağını kontrol ederler. Protein sentezi esnasında, intron ve eksonlardan oluşan bir gen tarafından önce pro – mRNA transkripsiyonu yapılır . Pro-mRNA nükleustan çıkmadan spesifik enzimler tarafından parçalanır. İntronlara ait kısımlar çıkarılır ve eksonlara ait parçalar birleştirilerek olgun mRNA meydana getirilir.
2.2.1. ACE GEN POLİMORFİZMİ
RAAS genlerinde çeşitli polimorfizmler olduğu bildirilmiştir ve bu polimorfizmler hem dolaşımdaki hem de dokudaki RAAS’ı etkileyen genetik faktörleri temsil etmektedir. Bunlar anjiyotensinojen, ACE ve ATII tip 1 reseptör
genlerindeki polimorfizmiiçermektedir. ACE’yi kodlayan gen 17. kromozo mun q23 loküsünde bulunmaktadır. Gen 21
kb ağırlığında olup 26 ekson ve 25 intron içermektedir (62). Endotel tipi ve testiküler tip olmak üzere 2 tip ACE mRNA saptanmıştır. Transkripsiyon, endotel tipi mRNA ‘da 13. hariç 1.-26. eksonları, testiküler tipte ise 13.-26. eksoları kapsar. Ekson 13 testiküler mRNA’ya spesifiktir. Endotel tipi ACE mRNA sadece endotel hücrelerinde değil epitelyum hücrelerinde de gösterilmiştir (63,64).
Renin geni, 1. kromozomun q32 loküsünde, 12 kb ağırlığında olup, 10 ekson ve 9 intron içerir (65). Anjiyotensinojen geni, yine 1. kromozomda q42-43 lokuslarında, 13kb ağırlığında 5 ekson ve 4 introndan oluşur (66). Anjiyotensin II tip 1 reseptör geni 3. kromo zomda ve anjiyotensin II tip 2 reseptör geni X kromozomundadır (63,64 ).
Kromozomların otozomal çiftlerinin her biri, biri anneden biri babadan gelen aynı gen dizisinden oluşur. Homolog olmaları ve aynı potansiyel fonksiyonlara sahip olmalarına karşın, bazı genler biraz farklı gen dizisine sahip olabilir. Bir genin, bir parçasının ya da bir çiftinin, kaybolması veya olmamasına delesyon (deletıon=D) denir. Bir ya da birden çok nükleotidin gen yapısına sokulması veya ek olarak var olması insersiyon (insertion=I) olarak tanımlanır. ACE geninin 16.intronundaki 287.DNA baz çiftinin olup olmamasına göre insersiyon/delesyon ( I/D ) polimorfizmi oluşmaktadır. DNA çift sarmal olduğuna göre D/D, I/D, I/I olmak üzere 3 genotip vardır (67). Bir genin belirli bir bölgesinde bulunan alternatif formların her birine alel denmektedir. Buna göre, ACE gen polimorfizminde D ve I aleli söz konusu olmaktadır. İnsanlarda ACE I/D gen polimorfizmi, standart polimeraz zincir reaksiyonu ( polymerase chain reaction = PCR ) ile periferik kandan, lökosit genomik DNA kullanılarak kolayca tespit edilebilmektedir. Çalışmalarda hasta ve kontrol gruplarının genotipik frekansları Hardy-Weinberg eşitliği kullanılarak hesaplanmaktadır. Örneğin bir toplum 0.24 DD, 0.50 ID, 0.26 II genotipine sahip olduğunda, 0.49 D alel ve 0.51 I alel sıklığı saptanmaktadır. Yapılan çok sayıda çalışma ve metaanalizlerde serum ACE seviyesi DD genotiplerde en yüksek, II genotiplerde en düşük düzeyde bulunmuştur (67-70). Alelik varyasyon, plazma ACE aktivitesini % 47 oranında etkilemektedir (71). ACE genotip frekansı
normal, toplumdan farklı olmayan bir popülasyonda yapılan bir çalışmada DD genotiplilerde kardiyak ACE aktivitesi yüksek bulunmuştur (72).
ACE gen polimorfizmi büyük etnik farklılıklar içermektedir. Ayrıca etnik grup içinde de heterojenite göstermektedir. Afrika kökenli Amerikalılarda D aleli sıklığı 0.48 ile 0.64, I aleli sıklığı ise 0.36 ile 0.52 arasında değişmektedir. Avrupalılarda ve Amerikalı beyazlarda daha az varyasyonlar görülmektedir. Bu gruplarda D aleli sıklığı 0.50 – 0.57, I aleli sıklığı 0.43 – 0.50 arasında bulunmuştur(73,74). Avrupa ile karşılaştırıldığında, Amerikada yaşayan siyahlarda D aleli yüksek, Japonlarda ise D aleli daha düşük (0.33) saptanmıştır (75). Genel olarak beyazlarda D aleli sıklığı 0.55, I aleli sıklığı 0.45 olarak bulunmuştur (76,77).
ACE gen polimorfizmi ile çok sayıda kardiyak ve nonkardiyak hastalık arasındaki ilişki incelenmiştir. RAAS’da sadece ACE geninde değil, anjiyotensinojen ve anjiyotensin tip1 reseptör genlerinde de polimorfizm tanımlanmıştır. Bu polimorfizmlerinde bazı hastalıklarla birlikteliği gösterilmiştir.
2.2.2. ACE Gen Polimorfizmi ve Hipertansiyon
Esansiyel hipertasiyon (HT) toplumdaki kan basıncı yüksekliğinin % 95’inden sorumludur ve nedeni tam olarak ortaya konamamış karmaşık bir klinik durumdur. Genetik yapı, fetal yaşamdaki faktörler, böbrekler ve sodyum mekanizması, RAAS, sempatik sinir sistemi, vasküler yapı, endotel hücre disfonksiyonu ve insülin direnci primer hipertansiyon patofizyolojisinde rol oynayan temel faktörlerdir. RAAS ve genetik yapı HT patogenezinde suçlanmaktadır.
HT‘da genetik yatkınlık % 30-60 oranındadır. İki farklı genetik mekanizma hipertansiyona yol açar; monogenik ve poligenik sendromlar. Primer hipertansiyonun büyük çoğunluğu birden fazla gen noktasında mutasyona bağlıdır yani poligeniktir. Anjiyotensinojen, ACE ve anjiyotensin II tip 1 reseptörlerini düzenleyen genlerde görülen polimorfizmler bu tipe örnektir. Kan basıncını oluşturan faktörler kalp debisi ve vasküler dirençtir. Anjiyotensin II vazokonstrüksiyon, yapısal hipertrofi, kontraktilite ve ön yük artışına neden olarak kan basıncı regülasyonunda ve dolayısıyla HT
patogenezinde önemli bir role sahiptir. Normalde yüksek kan basıncı ile primer HT ‘da düşük plazma renin aktivitesi beklenir. Ancak HT hastalarını % 30’u düşük ,% 20’si yüksek plazma renin aktivitesine sahiptir. D alele sahip kişilerde artmış serum ACE düzeyi ve dolayısıyla yüksek anjiyotensin II seviyesi kan basıncında artış meydana getirebilir. Böylece genetik yapı farklılığı ve değişen RAAS aktivitesi nedeniyle, ACE gen polimorfizmi ve HT ilişkisi çok sayıda çalışmada araştırılmıştır.
Bloem ve ark (77) sağlıklı kişilerde yaptıkları incelemede, D aleli olan kişilerde ACE aktivitesini belirgin olarak yüksek saptamışlardır. Ayrıca serum ACE düzeyi ile ortalama diyastolik kan basıncı arasında pozitif korelasyon bildirmişlerdir. Amerikada yapılan bir çalışmada, etnik ve sosyoekonomik olarak benzer 209 HT ve 100 kontrol olgusu karşılaştırıldığında HT grubunda DD genotipi önemli derecede yüksek bulunmuştur (78). ”Framingam Heart Study “e alınan 3095 hasta ile yapılan çalışmada sadece D aleline sahip erkeklerde ortalama diastolik kan basıncı yüksek saptanmıştır. Kadınlarda fark tespit edilememiştir. Orta – Yüksek HT olanlarda da genotip farkı bulunamamıştır. ACE gen polimorfizmi ve HT ilişkisini araştıran “Ohasama study”e 2000’den fazla olgu dahil edilmiştir. Avrupa ve Amerikalı beyazlara oranla Japonya’da D alelinin daha az görüldüğü saptanmıştır. Genotipler arasıda HT prevalansı ve kan basıncı düzeyleri arasında ilişki bulunmuştur (75). ”Copenhagen City Heart Study” de 9203 hastanın değerlendirildiğinde D alel varlığı ile HT prevalansı, sistolik ve diastolik kan basınçları arasında ilişki gösterilememiştir. Bu çalışma diğerlerine oranla çok daha homojen ve büyük bir grupta yapılmıştır (79). Yine 19 çalışma ve toplamda yaklaşık 16000 kişinin değerlendirildiği bir metaanalizde, ACE genotipleri arasında sistolik ve diastolik kan basıncı açısından fark görülmemiştir (80).
Sol ventrilül hipertrofisinin ( SVH ) en sık nedeni HT dir. SVH total ve kardiyak mortalite artışı ile beraberdir. SVH kan basıncından bağımsız olarak, ani ölüm, koroner kalp hastalığı, akut miyokard infarktüsü, konjestif kalp yetersizliği ve inme için risk belirleyicisidir. Anjiyotensin II’nin sol vetrikül kitlesi üzerine önemli etkilerinin olması dolayısıyla ACE gen polimorfizmi ve SVH arasındaki ilişki incelendiğinde 200 HT hastası arasında D/D genotipine sahip
olgularda, I/D ve I/I genotipine oranla sol ventrikül kitle indeksi ve ekzantrik hipertrofi sıklığı daha yüksek bulunmuştur (81). Buna karşın İtalya’da yapılan ve 225 hastanın alındığı bir başka çalışmada, sol ventrikül kitlesi ve ACE genotipleri arasında fark bulunamamıştır (82). Ancak HT dışında risk faktörü bulunmayan subgrupta, D/D genotipine sahip kişilerde sol vetnrikül kitle indeksi yüksek tespit edilmiştir. Bu grupta SVH, D/D olmayanlara göre 3.8 kat daha fazla görülmüştür (82). Kuznetsova ve ark (83) tarafından yapılan metaanalizde, 28 çalışma ve 6638 hasta değerlendirilmiştir. Toplamda D aleli ile SVH arasında istatistiksel anlamlı ilişki saptanamamıştır. Ancak tedavi edilmeyen HT hastaları incelendiğinde, D/D genotip varlığı ile SVH arasında kuvvetli bir birliktelik gösterilmiştir. Pontremoli ve ark (84) tarafından yapılan çalışmada, ACE genotipleri arasında demografik özellikleri benzer 106 HT hastası, nefropati, retinopati ve SVH açısından incelenmiştir. D/D genotipinde, II ile karşılaştırılınca mikroalbuminüri, retinopati, SVH ve sol ventrikül kitle indeksi daha fazla tespit edilmiştir. Sonuçta D aleli varlığı HT’da hedef organ hasarı için bağımsız risk faktörü olarak değerlendirilmiştir.
Diyetle alınan tuz ile kan basıncı arasında pozitif bir ilişki gösterilmiştir ve alınan sodyumun azaltılmasıyla kan basıncı düşmektedir. Esansiyel HT’da tuza duyarlılık yaklaşık % 50 düzeyindedir. Bu konu ile ilgili yapılan çalışmalarda, ACE II genotipine sahip HT hastalarında tuza karşı duyarlılığın belirgin yüksek, homozigot D aleline sahip hastalarda ise tuza duyarlılık prevalansı rölatif olarak düşük saptanmıştır (85,86).
Malign ve nonmalign HT’u olan hastalar arasında yapılan bir karşılaştırmada, D/D genotipi, malign HT’u olanlarda belirgin yüksek saptanmıştır. D/D genotipinin malign HT gelişimi için risk olabileceği bildirilmiştir (87). Preeklampsi ve ACE gen polimorfizmi ilişkisini araştıran iki çalışmada, ACE genotipleri ile preeklampsi gelişimi arasında ilişki kurulamamıştır. Ancak D/D genotipine sahip preeklamptik hastaların uteroplasental ve umblikal akımlarının azaldığı, rekürran preeklampsi ve problemli gebelik risklerinin yüksek olduğu gösterilmiştir (88,89).
Sonuç olarak ACE gen polimorfizmi ile primer HT arasında güçlü bir ilişki gösterilememiştir. Ancak D aleline sahip kişilerde hedef organ hasarının daha fazla olduğu söylenebilir.
2.2.3. ACE Gen Polimorfizmi ve Ateroskleroz
Yaş, cinsiyet, sigara, hipertansiyon, diyabet, yüksek LDL-K, sedanter yaşam, şişmanlık, aile hikayesi olması aterosklerotik süreç için kanıtlanmış kuvvetli risk faktörleridir. Anjiyotensin II ateroskleroz gelişiminde önemli yeri olan; makrofaj lipid peroksidasyonunu uyararak LDL-K oksidasyon artışına, endotel disfonksiyonuna, matriks glikoproteinlerinin ve metalloproteinazların sentezini ve salınımını uyararak ekstraselüler matriks artışına, düz kas hücrelerinin migrasyon ve proliferasyonuna, fibroblast hiperplazisine neden olur. Bu nedenle endokrin RAAS ve doku RAAS aktivitesi ateroskleroz sürecinde önemli bir yere sahiptir. ACE gen polimorfizminin de ateroskleroz da belirleyici olabileceği düşünülmektedir.
Yapılan bir çalışmada D/D genotipine sahip hastalarda serum ACE seviyesi yüksek ve bu hastalarda asetilkolin cevabı azalmıştır. Ateroskleroz için çok önemli olan endotel disfonksiyonu D/D genotipinde daha fazla olabileceği kanaatine varılmıştır (90). Yine artmış serum ACE seviyesi ile arteriyel duvar yapısal değişiklikleri ve karotis arter intima/media kalınlığı korele saptanmıştır(91). ACE gen polimorfizmi ve karotis arter intima/media kalınlığını inceleyen bir metaanalizde 23 çalışma ve 9833 hasta değerlendirilmiştir. D/D genotipi ile intima/media kalınlığı arasında pozitif ilişki saptanmıştır. Bu korelasyonun, yüksek riskli hastalarda daha belirgin olduğu gösterilmiştir (92). Olivieri ve ark (93) tarafından yapılan bir çalışmaya, anjiyografi ile renal arter darlığı tespit edilen 58 hasta ile 102 normotansif ve ateroskleroz lehine bulgusu olmayan kontrol hastası alınmıştır. Renal arter darlığı olan grupta D aleli ve D/D genotipi oldukça yüksek saptanmıştır. Koroner arter hastalığı ve renal arter hastalığı olan 942 hastanın dahil edildiği başka bir çalışmada ise koroner arter hastalığı olanlar ile olmayanlar arasında D/D genotipi farkı saptanmamıştır. Ancak renal arter hastalığı olanlarda olmayanlara
oranla D/D genotipi daha fazla tespit edilmiştir. Renal arter darlığı açısından D/D genotipine sahip olanların 2.25 kat riske sahip olduğu hesaplanmıştır (94). Çok sayıda çalışmada karotis arter intima/media kalınlığı ve renal arter darlığı ile ACE D/D genotipi arasında ilişki gösterilmiştir.
2.2.4. ACE Gen Polimorfizmi ve Koroner Arter Hastalığı
Anjiyotensin II’nin ateroskleroz patogenezindeki rolü bilinmektedir. Akut koroner sendromlarında en önemli olay; hassas plağın yırtılması ve ardından trombüsün oluşumudur. Son yıllarda yüksek riskli hastalarda ACE inhibitörü (ACE-İ) tedavisi ile fatal ya da nonfatal MI gibi akut koroner olayların azaldığı gösterilmiştir. Dolayısıyla RAAS sadece plak stabilizasyonunda değil, muhtemelen akut olaylarda da rol oynamaktadır. Doku faktörü arteriyel trombojenite için çok önemlidir. Anjiyotensin II, monosit/makrofajlardan doku faktörü sentez ve salınımında önemli rol oynamaktadır. Ayrıca endotelden plazminojen aktivatör inhibitör-1 (PAI-1) salınımına neden olarak fibrinolitik sistem üzerinede etkilidir. Anjiyotensin II damarda vazospazm, makrofaj ve düz kaslardan IL-6 salınımı, monositlerde ve damar düz kas hücrelerinde monosit kemotaktik protein-1 mRNA ekspresyonuna neden olmaktadır. Ayrıca aterosklerotik plağın yırtılmaya hassas omuz bölgesinde, doku ACE ve anjiyotensin II’nin belirgin olarak birikmiş olması, akut iskemik komplikasyonlarda etkili olduğunu göstermektedir. Anjiyotensin II yapımı ACE’ye bağlı olduğu için, D/D genotipi olan kişilerde, akut koroner olay insidansının daha fazla olacağı hipotezi ileri sürülmüştür.
Miyokard infarktüsü (MI) ile ACE gen polimorfizmini araştıran ve 1300 hastanın alındığı çok merkezli çalışmada, MI geçirmiş kişilerde D/D genotipinin kontrollerden daha yüksek olduğu bulunmuştur. D/D grubunda serum ACE düzeyleri yüksek olarak saptanmıştır. MI ve D/D genotipi arasındaki ilişkinin düşük riskli hastalarda daha yüksek olduğu gözlenmiştir. Sonuçta ACE gen polimorfizminin MI için bağımsız risk faktörü olabileceğini bildirmişlerdir (95,96). Koroner anjiyografi yapılan 697 hastanın alındığı bir başka çalışmada, D alel varlığı ile, MI arasında diğer risk faktörlerinden bağımsız olarak kuvvetli
ilişki bulunmuştur (97). Bu çalışmaların dışında irili ufaklı birçok çalışmada D/D genotipi ile MI arasında ilişki gösterilmiştir (69,98).
Kopenhag’da yapılan 672 MI, 947 iskemik kalp hastalığına sahip olgunun alındığı çalışmada, 3 ACE genotipi arasında MI ve iskemik kalp hastalığı açısından fark bulunamamıştır (79). Internatıonal Studies of Infarct Survival (ISIS) çalışması olgularında MI ve ACE gen polimorfizmi ilişkisi incelenmiştir. 4629 MI ve 5954 kontrol hastası arasında ACE genotip farkı gösterilememiştir. Ayrıca düşük risk grubunda da fark saptanamamıştır. D/D genotipine sahip hastalarda MI için risk oranı 1:1.1 düzeyinde bulunmuştur (99).
Diyabetik hastalarda da sonuçlar çelişkili elde edilmiştir. TipII DM’lu olan173 yeni MI hastası ile yapılan bir çalışmada, ACE genotipleri arasında fark saptanamamıştır (100). Bir başka çalışmada, tip II DM’u olan ve MI geçiren geçiren hastalar incelendiğinde, D/D genotipi olanlarda MI risk artışı 2.22 kat yüksek bulunmuştur (101).
Koroner arter hastalığı ve ACE gen polimorfizmi ilişkisi hakkında çelişkili sonuçların bildirilmesinin ardından konu ile ilgili iki metaanaliz yayımlanmıştır. Samani ve ark (102) tarafından yapılan 15 çalışma ve 8073 olgunun dahil edildiği metaanalizde, D/D genotipi ile I/D ve I/I genotipleri arasında MI riskleri açısından belirgin fark saptanmıştır. Daha yeni yapılan bir metaanalizde 46 çalışma ve 32715 hasta alınmıştır. D/D aleli içerenlerde kuvvetli olmasa da MI ve iskemik kalp hastalığı riski yüksek saptanmıştır (102). Küçük çalışmalarda MI ile D alel varlığı arasında kuvvetli ilişki çıkarken, büyük çalışmalarda ACE genotipleri arasında fark tespit edilememiştir. Burada çalışmalara alınan grupların ve kontrol gruplarının etnik/genetik yapısı ve heterojiniteleri sonuçları etkilediği düşünülmektedir. Tüm çalışmalar göz önüne alındığında D/D genotipine sahip olmanın iskemik kalp hastalığı riskini % 20 artırdığı hesaplanmıştır (80).
Bazı çalışmalarda, ACE gen polimorfizmi ile MI sonrası hastalarda reperfüzyon aritmileri ve QT uzaması incelenmiştir. Sonuçta D/D genotipine sahip hastalarda, kontrol gruplarına ve diğer genotiplere (I/D ve D/D)oranla, daha fazla QT uzaması ve reperfüzyon aritmisi oluğu gösterilmiştir. D alel
varlığının akut MI ve sonrasında, ani kardiyak ölüm için başlıca rol oynayabileceği sonucuna varılmıştır (103,104). Koroner arter by-pass greft operasyonu geçiren 249 kişinin 2 yıl takip edildiği bir çalışmada, D/D genotipi yaş, ejeksiyon fraksiyonu ve DM gibi faktörlerden bağımsız olarak artmış mortalite ile ilişkili saptanmıştır. Ayrıca tekrar revaskülarizasyon gereksinimi, kalp yetersizliği, MI gibi sekonder sonlanımnoktaları da D/D genotipinde oldukça fazla bulunmuştur (105).
Aksini destekleyen çalışmalar olsa da, ACE gen polimorfizmi ve D aleline sahip olma, akut koroner olayların gelişimi ve prognozu için bağımsız bir risk faktörü olabilir.
2.2.5. ACE Gen Polimorfizmi ve İnme
ACE gen polimorfizmi, diğer risk faktörlerinden bağımsız olarak ateroskleroz, iskemik kalp hastalığı ve MI gibi hastalıklarla ilişkili bulunmuştur. Elde edilen bu verilerden sonra ACE gen polimorfizminin iskemik inme için risk faktörü olup olmadığı araştırılmıştır.
Margoglione ve ark (106) 101 iskemik inme öyküsü olan hastada kontrol grubu ile karşılaştılınca D/D genotipinin daha yüksek olduğunu tespit etmişlerdir. Ailesinde inme öyküsü olanlarda, D/D genotipe sahip olmanın serebral iskeminin bağımsız belirleyicisi olduğu sonucuna varmışlardır. Benzer şekilde iskemik inme öyküsü olan hastaların incelendiği bir başka çalışmada, D/D genotipi serebral infarktlı hastalarda yüksek çıkmıştır (107). Bu çalışmaların aksine Pfohl ve ark(108) yaptığı ve 388 hastanın alındığı çalışmada, ACE gen polimorfizmi ile inme öyküsü arasında ilişki bulunamamıştır. Ayrıca, “Physicians Health Study” olguları arasında yapılan çalışmada, 338 inme öyküsü olan hasta, inme dışında benzer özelliklere sahip 338 kontrol hastası ile karşılaştırılmıştır. Bu prospektif çalışmanın sonucunda iskemik inme ile ACE gen polimorfizmi arasında ilişki gösterilememiştir (109).
Sharma (110), inme ile ACE gen polimorfizmi ilişkisini araştıran 7 çalışmanın metaanalizini yapmış, bu çalışmaların üçünde ilişki saptarken, dördünde ise ilişki bulunmamıştır. Metaanalizin sonucunda, ACE gen polimorfizminin iskemik inme için çok güçlü olmayan bağımsız risk faktörü
olduğu kanaatine varılmıştır. Daha sonra yapılan bir başka metaanalizde de, iskemik serebrovasküler hastalık ile ACE gen polimorfizmi arasında zayıf ilişki saptanmıştır (110).
Parkinson hastalığında, bazal ganglionlardaki ve substantia nigradaki nöronlarda substans P azalmaktadır. Yapılan bazı çalışmalarda bazal ganglionlardaki ve substantia nigradaki nöronlarda nöropeptid substans P düzeyleri ile D aleli varlığı ilişkilendirilmiştir. Mellick ve ark (111) çalışmasında D aleli ile Parkinson hastalığı arasında bir ilişki kurulamazken, Linn ve ark (112) yaptığı çalışmada ise, kontrol hastalarına oranla Parkinsonlu hastalarda D/D genotipi daha sık tespit edilmiştir.
Bazı çalışmalarda ilişkili olduğu bildirilsede, ACE gen polimorfizminin inme risk faktörü olarak ileri sürülmesi için mevcut bilgiler henüz yeterli değildi.
2.2.6. ACE Gen Polimorfizmi ve Dilate Kardiyomiyopati
RAAS sol kalp yetersizliği fizyopatolojisinde çok önemli rol oynamaktadır. Sol ventrikül disfonksiyonunda ve AMI’de endokrin ve/veya doku RAS’ının aktive olduğu bilinmetedir. Endokrin ve doku RAS aktivasyonu, miyokardın remodelingine neden olan değişiklikleri başlatır. Anjiyotensin II, miyosit hipertrofisi, fibroblast proliferasyon stimü lasyonu ve matriks artışı, ventriküler dilatasyon ve remodeling, endotelyal disfonksiyon, sistemik vazokonstrüksiyon ve sol ventrikül ön yükünde artış, diyastolik relaksasyonda bozulma ve sempatik sinir sistemi aktivasyonuna yol açarak kalp yetersizliği patogenezinde yer almaktadır. ACE-İ kullanımı ile sol kalp yetersizliği mortalite ve morbiditesi belirgin azalmıştır. ACE genotipleri arasında, serum ve doku ACE seviyelerinin farklı olmasından dolayı, D/D genotipine sahip hastalarda daha fazla remodeling ve prognozda kötüleşme oluşabileceği düşünülmektedir. Raynolds ve ark (113) tarafından 102 iskemik ve 112 idiyopatik dilate kardiyomiyopatili hastada yapılan çalışmada, kontrol vakalarına oranla her iki gruptada D/D genotipinin daha yüksek olduğunu saptamışlardır. Bir başka çalışmada, 77 kontrol ve sol kalp yetersizliğine sahip 193 hasta 5 yıl süreyle takip edilmiştir. D/D genotipine sahip olanlarda mortalite 1.7 kat daha yüksek tespit edilmiştir (114).
2.2.7. ACE Gen Polimorfizmi ve Restenoz
Günümüzde dünyada yılda bir buçuk milyonun üzerinde perkütan koroner revaskülarizasyon yapılmaktadır. Bu koroner girişimlerin yaklaşık ¾’ünde intrakoroner stent kullanılmaktadır. Stent implantasyonu sonrası en önemli problem, girişim yapıla damar lümeninde geç dönemde gelişen daralmadır (restenoz). Restenozdan elastik rekoil, trombüsün reorganizasyonu, neointimal proliferasyon, remodeling ve inflamasyonun rezolusyonu sorumlu tutulmaktadır. Restenoz gelişimini, unstabil anjina, diyabet ve hipertansiyon varlığı, ileri yaş, anormal trombosit aktivasyonu, total oklüzyonlar, proksimal ve bifurkasyon lezyonları, uzun ekzantrik ve trombüslü lezyonlar, genetik yapı ve işlem ile ilişkili birçok faktör etkileyebilir.
Koroner artere yapılan balon anjiyoplasti gibi girişimlerle endotel hasarlanır. Vasküler hasar, doku RAAS’ın aktive olmasına ve doku anjiyotensin II artışına neden olur. Anjiyotensin bazı sitokinlerin salınlmını uyararak ekstraselüler matriks artışına, düz kas hücresinin migrasyon ve proliferasyonuna yol açar. Neointimal kalınlaşmada önemli nokta, düz kas hücre proliferasyonu ve aşırı matriks oluşumudur. Bu mantıktan yola çıkarak ACE gen polimorfizminin restenoz ile ilişkisi çok sayıda çalışmada araştırılmıştır.
Amant ve ark intrakoroner stent yerleştirilen 146 hastayı işlemden 6 ay sonra koroner anjiyografi ile tekrar değerlendirmişler ve diğer risk faktörlerinden farklı olarak D alel sayısı ile restenoz arasında pozitif ilişki saptamışlardır. Homozigot D/D genotipine sahip kişilerde intrakoroner neointimal kalınlaşmanın yüksek derecede olduğunu bildirmişlerdir (115). Benzer şekilde 176 stent implante edilen hastanın dahil edildiği bir başka çalışmada, ACE gen polimorfizmi ile stent restenozu arasında ilişki araştırılmıştır. D/D genotip olan hastalarda, I/I ve I/D genotipleriyle karşılaştırıldığında, restenozun belirgin olarak fazla olduğu tespit edilmiştir. Ayrıca bu hastalar daha fazla difüz neointimal hiperplaziye sahiptirler. Bu çalışmada sonuç olarak, stent restenozunda D/D ACE genotipinin artmış difüz restenoz ve uzun dönemde kötü prognoz ile beraber olduğu gösterilmiştir (116). D aleli ile restenoz arasında pozitif bir ilişki olduğunu gösteren çok sayıda küçük çalışmadan sonra daha fazla vakanın alındığı büyük çalışmalar
yapılmıştır. Toplam 1850 olgunun alındığı bir çalışmada, 6 ay ve 1 yılın sonunda hastalar restenoz açısından değerlen dirilmiştir. Sonuçta D alel varlığı ya da D/D genotipi ile restenoz, tekrar revaskülarizasyon ihtiyacı ve MI arasında bir ilişki bulunamamıştır (117). Zee ve ark (118) tarafından daha sonra yayımlanan ve 779 hastanın dahil edidiği bir başka çalışmada da, restenoz ve ACE gen polimorfizmi arasındaki ilişki tespit edilememiştir. Bu iki çalışma sonucunda ACE gen polimorfizminin stent restenozu tayini için bir marker olamayacağı kanaatine varılmıştır.
ACE gen polimorfizmi ile restenoz ilişkisinin gösterilmesi ve hayvan modellerinde ACE inhibitörlerinin neointimal kalınlaşmayı engelleyebileceğinin saptanmasından sonra ACE inhibitörlerinin restenoza etkisi araştırılmıştır (119). Meurice ve ark(120) yaptığı çalışmada, koroner stent yerleştirilen ve D/D genotipine sahip 91 hasta, çift kör, plasebo (n=45) ve 40 mg/gün quinapril (n=46) tedavilerine randomize edilmişlerdir. 6 aylık izlem sonunda ACE inhibitörü tedavisinin D/D genotipli hastalarda restenozu azaltmadığı sonucuna varmışlardır. Yakında yayımlanan bir başka çalışmada, 897 hastaya ait 998 lezyonun restenoz açısından değerlendirilmesi sonucunda, beklenenin aksine tüm ACE genotiplerinde, ACE-İ tedavisi alanlarda restenoz daha yüksek saptanmıştır. MI öyküsü ve HT varlığına göre yapılan subgrup analizlerinde de ACE-İ tedavisi alanlarda restenoz daha yüksek tespit edilmiştir (121).
Daha önce yapılmış 12 çalışmanın metaanalizinde sonuç olarak D/D genotipindeki hastaların I/I genotipine göre çok daha fazla restenoz riskine sahip olduğu bildirilmiştir (122). Bonnici ve ark (68) tarafından yapılan bir başka metaanalizde, 16 çalışmaya ait 4331 hasta incelenmiştir. Olgu sayısı 200 hastanın üzerindeki çalışmalarda D/D genotipi ile restenoz arasında ilişki saptanmazken, 200 kişinin altındaki çalışmalarda D/D genotipi ile kuvvetli ilişki olduğu bulunmuştur.
Bazı çalışmalar olumsuz sonuçlansa da, D/D ACE genotipi ile restenoz arasında bir ilişki olduğu görüşü hakimdir.
2.2.8. ACE Gen Polimorfizmi ve Venöz Tromboemboli
Venöz tromboemboli, AMI ve unstabil anjina gibi durumlarda PAI-1 artışı olduğu bilinmektedir. Anjiyotensin II, endotel hücrelerin PAI-1 salınımını uyarmaktadır. Böylece fibrinolitik aktivite azalmakta ve trombotik bir ortam gelişmektedir (123). RAS’ın fibrinolitik sistem üzerine olan etkileri araştırmacıları ACE gen polimorfizmi ve venöz tromboembolilerin ilişkisine yöneltmiştir.
Philipp ve ark (124), total kalça protezi operasyonu geçiren ve venöz tromboemboli saptanan 85 hastada yaptıkları çalışmada, D/D genotipine sahip hastaların I/I genotipine oranla 11 kat fazla venöz tromboemboli riskine sahip olduklarını göstermiştir. Çalışmalarda yüksek PAI-1 seviyeleriile ACE D/D genotipi de ilişkili bulunmuştur. Yakında yayınlanan bir başka çalışmada 336 venöz tromboemboli ve 378 kontrol hastası alınmıştır. Tromboemboli ile D/D genotipi arasında kuvvetli bir ilişki tespit edilmiştir. Venöz tromboemboli için D/D genotipine sahip olmanın, faktör V leiden, faktör II, homosistein, protein C ve S gibi homeostatik faktörlerden bağımsız risk fektörü olduğu gösterilmiştir (125). RAAS’ın fibrinolitik sistem üzerine etkileri nedeniyle, ACE D/D genotipine sahip kişilerde venöz tromboemboli daha yüksek görülmektedir.
2.2.9. ACE Gen Polimorfizmi ve Nefropati
RAAS kan basıncı, kan hacmi ve elektrolit dengesini düzenleyen nörohumoral mekanizmalarda önemli bir rolü vardır. RAAS ile, sempatik aktivasyon, sistemik arterler /ven lerde ve renal eferent arteriyollerde vazokonstrüksiyon, direkt tübüler etki ve aldosteron/ADH salınımı ile sodyum/su retansiyonu meydana gelmektedir. Bu etkilerde böbrekler çok önemli bir role sahiptir ve renin böbrek glomerullerinin aferent arteriyollerindeki jukstaglomeruler aparatustan salgılanır. Anjiyotensin II, matriks glikoproteinlerinin ve metalloproteinazların sentezini ve salınımını uyararak matriks artışına, hücre büyümesine ve fibroblast hiperplazisine neden olur. Anjiyotensin II ‘nin glomeruloskleroz gelişiminde önemli bir role sahip olduğu bildirilmiştir (126).
Yapılan çok sayıda çalışmada ACE gen polimorfizmiyle renal hastalıkların gelişmesi ve progresyonu ilişkilendirilmiştir. Çeşitli primer böbrek