T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
KAĞIT ENDÜSTRĠSĠ ATIKSULARININ ELEKTRO-FENTON PROSESĠ ĠLE
ARITILMASI
Elif DELĠKTAġ
YÜKSEK LĠSANS TEZĠ
Çevre Mühendisliği Anabilim Dalı
Eylül-2011 KONYA Her Hakkı Saklıdır
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Elif DELİKTAŞ Tarih: 30.09.2011
iv ÖZET
YÜKSEK LĠSANS TEZĠ
KAĞIT ENDÜSTRĠSĠ ATIKSULARININ ELEKTRO-FENTON PROSESĠ ĠLE ARITILMASI
Elif DELĠKTAġ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Çevre Mühendisliği Anabilim Dalı DanıĢman: Prof. Dr. Mehmet Faik SEVĠMLĠ
2011, 69 Sayfa Jüri
DanıĢman Prof.Dr. Mehmet Faik SEVĠMLĠ Prof.Dr. Ali BERKTAY
Yrd.Doç.Dr. Mustafa ONÜÇYILDIZ
Kağıt endüstrisi atıksuları, sucul ortamlarda oldukça tehlikeli etkiler yaratmaktadır. Bununla birlikte, ülkemizde kurulu olan kağıt üretim fabrikaları sürekli olarak farklı özellikte ve miktardaki atıksularını farklı alıcı ortamlara deşarj etmektedirler. Bu fabrikaların bir çoğunda atıksu arıtma tesisleri bulunsa da, tesisler yeterli verimde çalışmamakta ve çoğu durumda atıl şekilde kalabilmektedir.
Son zamanlardaki bilimsel araştırmalar, bu tür atıksuların fizikokimyasal süreçlerle (özellikle ileri oksidasyon yöntemleri ile) arıtılabilirliği üzerine yoğunlaşmıştır. Elektro-Fenton (EF) yöntemi de, yüksek arıtım verimleri ile ileri oksidasyon sistemleri içerisinde oldukça kuvvetli bir alternatif olarak durmaktadır.
Bu çalışma kapsamında, kağıt üretiminden kaynaklanan atıksuların KOİ ve bulanıklık parametrelerinin EF yöntemiyle giderimi araştırılmıştır. Deneysel çalışmalarda yöntem veriminde etkin rol oynayan faktörlerin (başlangıç pH değeri, başlangıç H2O2 derişimi ve uygulanan doğru akımın
büyüklüğü) arıtma verimine etkileri belirlenmiş ve optimum işletme koşulları ortaya konmuştur. Uygun işletme koşullarında çalışıldığı takdirde elektro-Fenton yönteminin kağıt endüstrisi atıksuyu arıtımında etkin olarak uygulanabileceği görülmüştür. Bu çalışmada sabit DC akımının 1.0 Amper (A), H2O2
konsantrasyonunun 1500 mg/L ve başlangıç pH‟ının 3.0 olduğu koşullarda, KOİ giderim verimi % 55 değeriyle en iyi verime ulaşmıştır. Aynı zamanda Fenton oksidasyonu kullanılarak da bir deneysel çalışma yapılmış ve elektro-Fenton oksidasyonu ile kıyaslaması yapılmıştır. Yapılan karşılaştırma sonuçlarına göre elektro-Fenton prosesinin atıksu arıtma maliyeti hem de oluşan atık çamur miktarı göz önüne alındığında Fenton prosesine oranla daha üstün olduğu belirlenmiştir.
v ABSTRACT MSc THESIS
TREATMENT OF PAPER INDUSTRY WASTEWATER BY USING ELECTRO-FENTON PROCESS
Elif DELĠKTAġ
SELÇUK UNIVERSITY GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCES DEPARTMENT OF ENVIRONMENT ENGINEERING
Advisor: Prof. Dr. Mehmet Faik SEVĠMLĠ 2011, 69 Pages
Jury
Advisor Prof.Dr. Mehmet Faik SEVĠMLĠ Prof.Dr. Ali BERKTAY
Asst.Prof.Dr. Mustafa ONÜÇYILDIZ
Wastewaters of paper industry causes dangerous effects under hydrous conditions. Therefore, the paper production factories in our country constantly dischange their wastewaters which have different features and various amounts in to different environments.
Although most of these factories have waste treatment facilities, they do not work efficienciently and they may mostly be inactive. The recent researches have focused on the issue that such kind of wastewaters can be treated as physical-chemistry processes (especially by advanced oxidation methods). Electro-Fenton (EF) method is also a very strong alternative in advanced oxidation methods with its high treatment efficiency.
In this research, COD and turbidity parameters of wastewaters which are caused by paper production, removed by EF method is examined. The effects of the operation parameters (the initial pH, the initial H2O2 concentration and the electricity current) on the treatment efficiency have been also
determined and optimum process conditions are established. It has been proved that electro-Fenton method may effectively be applied for the refining of paper industry wastewater on condition that correct processing methods are used. In this study when constant DC current is 1.0 (A), the concentration of H2O2 is 1500 mg/L and the initial pH is 3.0, COD removal efficiency has reached the highest efficiency
with its value of % 55. Fenton oxidation is also made by using an experimental study and comparison is made with electro-Fenton oxidation. According to the results of the comparison of the electro-Fenton process, in terms of both cost and efficiency of COD of the waste sludge characteristics, amount and disposal costs are taken into account in every way than the Fenton process was a step in the future.
vi ÖNSÖZ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Çevre Mühendisliği Anabilim Dalı‟nda gerçekleştirilen yüksek lisans tez çalışmam sırasında desteğini esirgemeyen, bilgi ve deneyimi ile çalışmamı yönlendiren danışman hocam Prof.Dr. Mehmet Faik SEVİMLİ‟ye, ayrıca bilgi ve tecrübesinden faydalandığım Yrd. Doç. Dr. Dünyamin GÜÇLÜ hocama teşekkür ederim. Laboratuvar çalışmaları sırasında bana her konuda yardımcı olan ve destek veren, çalışmalarım sırasında yardımları ile bana yol gösteren Arş. Gör. Dr. Serkan ŞAHİNKAYA‟ya desteklerinden dolayı çok teşekkür ederim.
Bugünlere gelmemi sağlayan, eğitimim boyunca her zaman maddi ve manevi bana destek olan anneme, babama ve kardeşime sonsuz teşekkürlerimi sunarım.
Elif DELİKTAŞ KONYA-2011
vii ĠÇĠNDEKĠLER ÖZET ... iv ABSTRACT ... iv ÖNSÖZ ... vi ĠÇĠNDEKĠLER ... vii SĠMGELER VE KISALTMALAR ... ix 1. GĠRĠġ ... 1 1.1. Problemin Tanımı ... 1 1.2. Çalışmanın Önemi ... 2
1.3. Çalışmanın Amacı ve Kapsamı ... 4
2. KAYNAK ARAġTIRMASI ... 5
2.1. Elektrokimyasal Arıtma ... 5
2.1.1. Elektrokimya ... 5
2.1.1.1. Faraday yasası ... 5
2.1.1.2. Elektrokimyasal hücre potansiyeli ... 6
2.1.2. Elektrokimyasal atıksu arıtımı ... 7
2.1.3. Elektrokimyasal oksidasyon ... 7
2.1.3.1. Direkt oksidasyon ... 8
2.1.3.2. İndirekt oksidasyon ... 8
2.1.4. Elektro-Fenton oksidasyonu ... 9
2.1.4.1. Elektro-Fenton reaksiyonlarının avantaj ve dezavantajları... 12
2.1.4.2. Sıcaklığın etkisi ... 13
2.1.4.3. Başlangıç pH‟ının etkisi ... 13
2.1.4.4. Başlangıç H2O2 dozunun etkisi ... 13
2.1.4.5. Akım büyüklüğünün etkisi ... 14
2.1.4.6. Oluşan atık çamurun çökelebilirliği ... 14
2.1.4.7. Demir iyonu konsantrasyonunun etkisi ... 15
2.1.5. Klasik Fenton oksidasyonu (H2O2/Fe2+) ... 15
2.1.5.1. Klasik Fenton prosesinin avantajları ... 16
2.1.5.2. Klasik Fenton oksidasyonuna etki eden faktörler ... 17
2.2. Kağıt ve Kağıt Hamuru Endüstrisi ... 17
2.2.1. Endüstrinin tanımı ... 17
2.2.2. Kağıt ve kağıt ürünleri üretimi ... 18
2.2.3. Kağıt endüstrisi atıksularının özellikleri ... 21
2.2.4. Kağıt endüstrisi atıksuları ve kaynakları ... 21
2.2.5. Kağıt endüstrisi atıksularının taşıdığı riskler ve arıtımının önemi ... 22
viii
3. MATERYAL VE YÖNTEM ... 27
3.1. Atıksu ve Karakterizasyonu ... 27
3.2. Deneysel Kurulum ... 27
3.2.1. Klasik Fenton prosesi ile yapılan deneysel çalışma ... 28
3.2.2. Elektro-Fenton prosesi ile yapılan deneysel çalışma ... 29
3.3. Analizler ... 32
3.4. Kinetik Çalışma ... 33
3.4.1. Reaksiyon kinetiği ... 33
3.4.2. İki aşamalı kinetik matematiksel model ... 36
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 37
4.1. Klasik Fenton Oksidasyonu İle Yapılan Deneysel Çalışma Sonuçları ... 37
4.1.1. Reaksiyon süresinin etkisi ... 37
4.1.2. Başlangıç pH‟ının etkisi ... 37
4.1.3. Başlangıç H2O2 dozunun etkisi ... 39
4.1.4. Başlangıç Fe2+ dozunun etkisi ... 41
4.1.5. Kinetik çalışma ... 42
4.2. Elektro-Fenton Prosesi İle Yapılan Deneysel Çalışma Sonuçları ... 43
4.2.1. Reaksiyon süresinin etkisi ... 44
4.2.2. Başlangıç pH‟ının etkisi ... 46
4.2.3. Başlangıç H2O2 dozunun etkisi ... 48
4.2.4. Akım büyüklüğünün etkisi... 51
4.2.5. Kinetik çalışma ... 53
4.3. Elektro-Fenton Oksidasyonu ve Klasik Fenton Oksidasyonu Kıyaslaması ... 54
4.4. Maliyet Analizi ... 55
4.4.1. Klasik Fenton prosesi için maliyet analizi ... 55
4.4.2. Elektro-Fenton prosesi için maliyet analizi ... 57
4.5. Oluşan Atık Çamur Miktarı Açısından Kıyaslama ... 59
5. SONUÇLAR VE ÖNERĠLER ... 61
6. KAYNAKLAR ... 63
ix
SĠMGELER VE KISALTMALAR Simgeler
(€) : Avro A : Amper FeSO4 : Demir Sülfat
H2O2 : Hidrojen Peroksit
I : Akım
MnO2 : Mangan Di Oksit
O3 : Ozon
OH : Hidroksil Radikali P : Güç
U : Gerilim Kısaltmalar
AKM : Askıda Katı Madde BOİ : Biyolojik Oksijen İhtiyacı C : Coulomb
EAH : Elektrot Aşınma Hızı EF : Elektro-Fenton
EMK : Elektro Motor Kuvveti EO : Elektro Oksidasyon FO : Fenton Oksidasyonu KOİ : Kimyasal Oksijen İhtiyacı ÇÇO : Çökelmiş Çamur Oranı ÇHİ : Çamur Hacim İndeksi UV : Ultraviyole
1. GĠRĠġ
1.1. Problemin Tanımı
Nüfustaki hızlı artış, insanlığın ihtiyaçlarını karşılamak için kurulan endüstriyel işletmelerin artmasına neden olmuştur. Bu durum, kara, su ve hava gibi çevresel ortamların kirlenmesini de beraberinde getirmiştir. Kağıt endüstrisi de sözü geçen endüstrilerden bir tanesidir. Kağıt üretimi sırasında kullanılan su miktarının çok yüksek olması ve bünyesinde biyolojik olarak ayrışması güç organik ve inorganik kirleticileri içermesi, bu endüstrileri çevresel açıdan daha özen gösterilmesi gereken kurumlar haline dönüştürmüştür. Örneğin, Nemerov ve Dasgupta (1991), farklı üretim teknolojileri için, üretilen birim ton kağıt başına 75.7 m3
ile 227.1 m3 arasında su tüketilebileceğini ifade etmişlerdir. Bu değerler, günümüzde kullanılan kağıt miktarı düşünüldüğünde, kağıt endüstrisi ile kullanılabilir su kaynaklarının tüketimi arasındaki ilişkiyi daha net ortaya koymaktadır. Buna ek olarak, bu endüstrinin ana ham maddesi olan odunun hamur haline getirilmesi sırasında, susuzlaştırma, eleme ve yıkama işlemleriyle lignin, karbonhidrat ve çeşitli tipte ayrıştırıcılar da atıksuya geçmektedir. Bu bileşikler ise genellikle biyolojik ayrışabilirliği oldukça düşük bileşikler olarak nitelendirilmektedir. Ayrıca, uygulanan prosesin türüne göre atıksuya, reçineler, doymamış yağ asitleri, organo-halojenler, inorganik klorlu bileşikler, uçucu organikler (alkoller, fenoller, aseton, kloroform vb.) ve sülfür gibi bir çok toksik bileşik de su ortamlarına verilmektedir (Pokhrel ve Viraraghavan, 2004). Özetle, bu tür endüstrilerden çıkan atıksuların özellikleri, miktar ve içerik açısından kuruluştan kuruluşa değişse de, özellikle alıcı ortamlarda önemli kirlilik problemlerine neden olmaktadır.
Kağıt endüstrisi atıksularının arıtımı için literatürde yapılan çalışmalar daha çok biyolojik arıtma sistemleri üzerine yoğunlaşmıştır. Ancak, kağıt endüstrisi atıksularının biyolojik parçalanabilirliği düşük ve toksik özellikteki kirleticiler içermesi nedeniyle, biyolojik prosesler toplam organik karbon ve KOİ giderimi konusunda yetersiz kalmıştır. Bununla birlikte söz konusu proseslerin büyük ölçekli uygulamalarında da işletme güçlüklerinin bulunduğu bilinen bir vakadır. Bu nedenle son zamanlardaki bilimsel çalışmalar, bu atıksuların fizikokimyasal süreçlerle (özellikle ileri oksidasyon yöntemleri ile) arıtılabilirliği üzerine yoğunlaşmıştır.
Son yıllarda, biyolojik parçalanabilirliği düşük ve toksik yapıdaki organik maddelerin arıtımı için elektrokimyasal yöntemlerin etkin bir şekilde uygulanabildiği görülmüştür. Özellikle, elektro-koagülasyon, elektro-oksidasyon, elektro-foto-oksidasyon gibi elektrokimyasal yöntemler tekstil, deri, petrokimya ve yağ endüstrilerinden gelen atıksuların arıtımında sıkça kullanılmıştır (Naumczyk ve ark., 1996; Rao ve ark., 2001; Rajkumar ve Palanivelu, 2004; Israilides ve ark., 1997; Vlyssides ve ark., 2003). Elektrokimyasal yöntemlerin verimliliğinin arttırılabilmesi için farklı oksidasyon proseslerinin (Fenton oksidasyonu, foto-oksidasyon, elektro-oksidasyon gibi) aynı elektrokimyasal hücre içerisinde eş zamanlı olarak yürütüldüğü hibrit sistemler sıkça kullanılmaktadır. Özellikle oksidasyon (EO) ve elektro-koagülasyonun (EC) bir arada gerçekleştiği bir sistem olarak bilinen elektro-Fenton (EF), kirlilik yükü yüksek atıksuların arıtımında oldukça iyi sonuçlar vermektedir (Brillas ve Casada, 2002; Chang ve ark., 2004; Tauchert ve ark., 2005). Bu çalışmada, kağıt üretiminden kaynaklanan atıksuların elektro-Fenton (EF) yöntemiyle arıtılabilirliği incelenmiştir. Bu kapsamda, farklı işletme parametrelerinin (arıtım süresi, akım, pH, H2O2 derişimi, gibi) yöntemin arıtma verimine etkileri belirlenmiştir. Ayrıca yöntemde
olası büyük ölçekli uygulamalara temel oluşturacak optimum işletme koşullarının belirlenmesine çalışılmıştır. Kağıt endüstrisi atıksularının biyolojik metotlarla arıtılmasına yönelik çok sayıda çalışma mevcut olmasına karşın, ham atıksuyun arıtımı için Fenton ve elektro-Fenton yöntemlerinin kullanıldığı kıyaslayıcı çalışmalara ise çok az rastlanılmaktadır.
1.2. ÇalıĢmanın Önemi
Kâğıt endüstrisi atıksuları içerdikleri bir çok toksik bileşik (dioksinler, merkaptanlar vb.) nedeniyle alıcı ortamda olumsuz çevresel etkilere neden olmaktadır. Proseste çok fazla su kullanımı ise bu etkiyi daha da artırıcı bir etken olarak ön plana çıkmaktadır. Gün geçtikçe artan sıkı deşarj limitleri, kağıt endüstrisi atıksuları için kullanılan klasik arıtma sistemlerinin modifikasyonunu ve geliştirilmesini zorunlu kılmaktadır.
Bazı atıksu bileşenleri ve organik maddelerin tümü biyolojik arıtma sistemleri ile yeteri kadar arıtılamamaktadır. Bu bileşenleri zararsız bir forma dönüştürme kabiliyetine sahip ileri oksidasyon prosesleri, bu tip atıksuların arıtımında potansiyel güçlü bir metot olarak kullanılmaktadır. Oksidasyon ve koagülasyon–flokülasyon
basamaklarından oluşan elektro-Fenton prosesi de bu metotlardan bir tanesidir. Literatürde, çok geniş yelpazede farklı atıksuların arıtılabilirliğinde uygulama alanı bulmasına karşın kâğıt endüstrisi atıksuları için kısıtlı sayıda araştırma bulunmaktadır. Bu açıdan bu alanda geniş bir araştırma ihtiyacı bulunmaktadır. Bu proje kapsamında, elektro-Fenton reaktör uygulaması ile yürütülecek çalışmalar, mevcut boşluğun kapatılmasına katkı sağlayacak olması bakımından önemlidir.
Son yıllarda endüstrileşmenin zamanla artış göstermesiyle birlikte artan üretimin çevre üzerindeki olumsuz baskıları temiz bir çevreyi tehdit eder duruma gelmiştir. Bunun yanı sıra günümüzde kuraklığın ortaya çıkardığı su sıkıntısının yaşandığı ülkemizde, temiz su kaynaklarının en optimum şekilde kullanılması gerekliliği, endüstrilerde alternatif su kullanım yollarının aranmasına neden olmuştur. Bu nedenle endüstriyel üretim sonucunda oluşan atıksuların çevreye zararsız hale getirilecek düzeyde arıtılması ve geri kazanılarak endüstride tekrar kullanılması konuları araştırmaların ana konusu olmuştur. Endüstriyel üretim sonucunda açığa çıkan atıksuların deşarj edildiği kanalizasyon sisteminde ya da alıcı ortamda çevresel problemleri oluşturmaması açısından, Su Kirliliği Kontrol Yönetmeliği‟nde verilen deşarj kriterlerini sağlayacak düzeyde arıtılmaları gerekmektedir. Atıksuların içeriğindeki organik madde, askıda katı madde, nutrient madde ve toksik maddelerin çeşitli arıtma yöntemleriyle istenen düzeye indirgenme gerekliliği son derece önemlidir.
Günümüzde kuraklıkla bağlantılı olarak ortaya çıkan su sıkıntısının yaşandığı ülkemizde, atıksuların deşarj kriterlerini sağlayacak düzeyde arıtıldıktan sonra geri kazanılması ve endüstrilerde tekrar kullanımının sağlanması, gerek işletmelere gerekse ülkemize büyük yararlar sağlayacaktır. Endüstriyel atıksuyun geri dönüşümü ile elde edilen geri kazanılmış suyun endüstride tekrar kullanımı endüstriye, ilave ve güvenilir su kaynaklarının temin edilmesi veya var olan temiz su kaynaklarının çoğaltılması, net su tüketimi ile atıksu oluşumunun ve atıksu arıtma maliyetlerinin azaltılması açısından önemli faydalar sağlamaktadır. Dünya çapında geri kazanılan atıksuyun yaklaşık % 25‟i endüstride tekrar kullanılmaktadır (Metcalf ve Eddy, 1991; Lens ve ark., 2002).
Son yıllarda geleneksel arıtma yöntemlerinin atıksulardaki kirlilikleri deşarj limitlerine ulaştırmada yetersiz kalması ve nitelikli suyun temini, endüstriyel atıksuyun uzaklaştırılması ile artan maliyetler, endüstrileri daha etkin su yönetimi yaklaşımlarına ulaşma konusunda araştırmalara yöneltmiştir. Bu araştırmalar atıksuyun arıtılarak geri kazanımı ve endüstride tekrar kullanımının sağlanması için ileri arıtma teknolojilerine ihtiyaç duyulduğunu göstermektedir. Buna ek olarak ileri arıtma yöntemleri arasında,
daha az işletme problemlerine sahip ve diğer ileri arıtma yöntemlerine nazaran daha yüksek arıtma verimini sağlayan ileri oksidasyon prosesleri, son yıllarda endüstriyel atıksuların arıtımında kullanılan yöntemler arasında ön plana çıkmıştır (Gogate ve Pandit, 2004).
Endüstriyel atıksuların arıtımında kullanılan ileri oksidasyon proseslerinden, yüksek pH‟ta ozonlama, ozon/hidrojen peroksit, ozon/UV, hidrojen peroksit/UV, O3/H2O2/UV ve vakum ultraviyole (VUV) prosesleri, bu proseslerle çeşitli endüstriyel
atıksuların arıtılabilirliği üzerine yapılmış olan çalışmalar vardır. İleri bir oksidasyon prosesi olan elektro-Fenton yöntemi öne çıkmış ve endüstriyel atıksuların arıtımı için uygulanabilirliği gündeme gelmiş, bu konuda yapılan çalışmalarla uygun bir arıtma yöntemi olduğu verilerle ispatlanmıştır.
1.3. ÇalıĢmanın Amacı ve Kapsamı
Laboratuar ölçekli küçük hacimli reaktörlerde gerçekleştirilen bu çalışma kapsamında ülkemiz açısından önemli sanayi kollarından olan kâğıt endüstrisi atıksularının düşük maliyetli demir elektrotlarını kullanan elektro-Fenton prosesi ile arıtılabilirliği, bu atıksulara pratikte uygulanabilirliğinin gösterilmesi ve Fenton oksidasyon sistemi kullanılarak yapılan deneysel çalışma ile kıyaslanması gerçekleştirilmiştir.
Çalışmanın amacı ise aşağıda maddeler halinde sunulmuştur. Fenton oksidasyonu verimini etkileyen pH, Fe2+
dozu, hidrojen peroksit dozu, arıtma süresi optimizasyonları ve optimum şartlarda kinetik çalışma gerçekleştirilmiştir.
Elektro-Fenton prosesinin verimini etkileyen pH, elektrotlar arası mesafe, akım büyüklüğü, hidrojen peroksit dozu, arıtma süresi optimizasyonları, farklı reaktör konfigürasyonları ile çalışılarak reaktör optimizasyonu ve kinetik çalışma gerçekleştirilmiştir.
Elektro-Fenton prosesi ile klasik Fenton oksidasyonunun verim, maliyet ve oluşan atık çamur hacim miktarı bakımından kıyaslaması yapılmıştır.
2. KAYNAK ARAġTIRMASI
2.1. Elektrokimyasal Arıtma
2.1.1. Elektrokimya
Elektrokimya pratikte büyük öneme sahip bir bilimdir. Genel anlamda, elektrokimya elektrik enerjisi üreten veya elektrik enerjisiyle yürüyen yükseltgenme, indirgenme reaksiyonlarının tümünü içine alan bilim dalıdır. Bir anlamda elektrik akımının kimyasal reaksiyonlarla ilişkisini açıklamaktadır. Bir elektrokimyasal olay muhakkak bir redoks reaksiyonudur ve elektrik üretir veya elektrik akımı yardımıyla reaksiyon gerçekleşir. Her redoks reaksiyonu da indirgenme yarı reaksiyonu ve yükseltgenme yarı reaksiyonu olmak üzere iki yarı reaksiyondan ibarettir. Elektrik akımı ise bir metalik iletken ve bir elektrolit iletken yardımıyla ortaya çıkarılır (Baker, 1991). Elektrik akımı üreten veya elektrik akımı yardımıyla kimyasal bir olayın gerçekleştiği sisteme veya cihaza elektrokimyasal pil adı verilir. Bir pilde iyon akımının geçirildiği çözeltiye elektrolit, bu çözeltiye batırılmış olan ve elektron akımının sağlandığı metal veya grafit çubuklara elektrot adı verilir. Her türlü elektrokimyasal pilde yükseltgenme yarı reaksiyonunun olduğu elektrota anot, indirgenme yarı reaksiyonunun olduğu elektrota da katot adı verilir. Eğer inert elektrotlar kullanılmamışsa anot metali çözünür, katot metali üzerinde birikme olur (Baker, 1991). İstemli redoks reaksiyonlarında, reaksiyonlar yazıldığı şekilde ürünler vermek üzere yürümektedir. Eğer bu istemli redoks reaksiyonlarının elektrokimyasal hücre olarak nitelendirdiğimiz uygun düzeneklerde yürümeleri sağlanırsa, sahip oldukları kimyasal enerjinin bir kısmı elektrik enerjisine dönüşür. İstemsiz bir redoks reaksiyonunun bir elektrokimyasal hücrede yazıldığı şekilde yürümesi, ancak reaksiyona bir dış kaynaktan elektrik enerjisi verilerek mümkün olmaktadır. İstemsiz redoks reaksiyonlarının dışarıdan elektrik enerjisi verilerek yürütülmesi olayına "elektroliz" denir (Türk, 2007).
2.1.1.1. Faraday yasası
Elektrokimyasal reaksiyonlarda, hücreden geçen elektrik miktarıyla kimyasal değişme arasında nicel bir ilişkinin olduğu 1833'de M.Faraday tarafından bulunmuştur. Bu ilişkiye göre, elektrotlarda açığa çıkan maddelerin kütleleri, devreden geçen yük
miktarı ile doğru orantılıdır ve devreden geçen aynı miktarda elektrik yüküne karşı farklı maddelerin aynı eşdeğer kütlesi açığa çıkar. Bu nedenle bir elektrokimyasal hücrede elektrik yükünü taşıyan elektronları bir reaksiyondaki reaktant veya ürün gibi düşünüp hesaplamalar yapılabilir (Baker, 1991).
Elektrik yükü miktarının birimi Coulomb (C) olup, „„1.0 C, 1.0 amperlik (A) bir akımın saniyede taşıdığı elektrik yükü‟‟ olarak tanımlanır. Elektrik katılarda elektronlar tarafından iletildiğinden 1.0 mol elektronun taşıdığı yük 96485 C‟dur ve bu miktar elektrik yükü „„1.0 Faraday (F)‟‟ olarak bilinmektedir (Baker, 1991).
2.1.1.2. Elektrokimyasal hücre potansiyeli
Bir elektrokimyasal reaksiyonda, elektronların bir dış iletken aracılığıyla anottan katota doğru akması iki elektrot arasındaki gerilim farkından kaynaklanmaktadır. Anot, katota göre daha yüksek negatif gerilime sahip olduğundan elektron akışı anottan katota doğru olmaktadır (Türk, 2007).
Bir elektrokimyasal hücreyi oluşturan iki yarı hücrenin gerilim farkı „„elektro motor kuvveti (EMK)‟‟ veya „„elektrokimyasal hücre potansiyeli‟‟ veya „„pil gerilimi‟‟ olarak bilinir ve değeri, reaksiyonun bileşenlerine, sıcaklığa ve derişime bağlıdır. Elektro motor kuvvetinin birimi volt olup, değeri elektrolit hacmine ve elektrotların boyutlarına bağlı olarak değişmez (Türk, 2007). Redoks reaksiyonlarının standart elektro motor kuvvetleri, elektrokimyasal hücreyi oluşturan yarı-reaksiyonların elektrot gerilimleri kullanılarak hesaplanabilir. İstemli bir redoks reaksiyonun standart elektro motor kuvveti daima artıdır (E°>0). Bir reaksiyonun standart elektro motor kuvvetinin eksi (E°<0) olması ise reaksiyonun bu koşullarda istemsiz olduğunu göstermektedir. Standart elektro motor kuvvetleri standart elektrot gerilimlerinden hesaplandığından sadece standart basınç, derişimler ve sıcaklık için geçerlidir. Bir elektrokimyasal hücrenin standart olmayan koşullardaki elektro motor kuvveti Nernst eşitliği olarak bilinen eşitlik kullanılarak hesaplanabilir (Türk, 2007).
(2.1)
Burada;
R : Gaz sabiti, T : Mutlak sıcaklık, F : Faraday sabiti,
n : Reaksiyon sırasında alınan verilen elektron sayısı, Q : Kütlelerin etkisi ifadesidir.
2.1.2. Elektrokimyasal atıksu arıtımı
Klasik arıtma teknikleri diye nitelendirebileceğimiz yöntemlerinin dışında daha etkin yöntemlerin geliştirilmesi zorunluluğu doğmuştur. Elektrokimyasal yöntemler üzerine kurulan arıtma yöntemleri teknolojinin gelişimine paralel olarak hem geliştirilebilir olması ve yüksek arıtma verimleri dolayısıyla ümit verici yapıdadır (Panizza ve ark., 1999). Bu yöntemlerin önemli avantajları, kirliliğin kısa sürede ve maksimum düzeyde azaltılması, kolay ve düşük maliyetli teçhizatların kullanılması ve işletmesinin kolay olması olarak sıralanabilir (Mollah, 2001).
Bu yöntemler geleneksel arıtma yöntemlerinin dezavantajlarının bir çoğunu ortadan kaldırmaktadır. Elektrokimyasal atıksu arıtma yöntemleri genellikle yüksek derişime sahip organik ve inorganik kirleticilerin arıtılmasında, metal iyonların uzaklaştırılması veya geri kazanılmasında kullanılmaktadır (Panizza ve ark., 1999).
2.1.3. Elektrokimyasal oksidasyon
Bu yöntem 1990‟ların ortalarında geliştirilen yeni bir yöntemdir. Elektrokimyasal bir reaksiyonda yük, elektrot ile iletken sıvı içindeki reaktif türler arasındaki ara yüzeyde transfer olur. Elektrokimyasal bir reaktör bir anot, bir katot, bir iletken elektrolit ve güç kaynağından oluşmaktadır. Katotta yük reaksiyona giren türlere geçerek oksidasyonda azalmaya neden olur. Anotta ise yük reaktif türlerden elektroda geçerek oksidasyon durumunu arttırır. Oksidasyon durumundaki değişmeler türlerin kimyasal özelliklerinin ve formlarının değişmesine yol açar. Bu yöntem özellikle endüstriyel atıksularda organik ve inorganik yapılı kirliliklerin giderilmesi amacıyla kullanılmaya başlanmıştır. KOİ, BOİ, AKM ve renk parametrelerinin değerlerinin düşürülebileceği görülerek geliştirilmiştir (Chen, 2004). Sigara endüstrisi (Bejankiwar, 2002), tekstil endüstrisi (Vlyssides ve ark., 2000), deri endüstrisi (Szpyrkowicz ve ark., 2001) atıksu arıtımında, elektrokimyasal oksidasyon yöntemi ile giderim veriminde
olumlu sonuçların elde edildiği görülmüştür. Elektrokimyasal oksidasyon yönteminin mevcut tesislerde zor olmayan değişikliklerle ve fazla yatırım gerektirmeden uygulanabilir olması ve işletme maliyetinin yüksek olmaması başlıca tercih sebepleridir. Bu yöntemde çeşitli oksidasyon reaksiyonları ile kirliliklerin giderimi sağlanmaktadır. Bu reaksiyonlar direkt ve indirekt oksidasyon olarak ikiye ayrılabilir (Chen, 2004).
2.1.3.1. Direkt oksidasyon
Sistemde kullanılan elektrotların (anot-katot) yüzeyinde gerçekleşmektedir. Organik yapılı kirleticilerin, oksidasyon reaksiyonları ile giderimi sağlanmaktadır. Direkt oksidasyon prosesinde önemli kısım anottur. Anot materyali olarak Fe, Al, Pt, Ti, Ti/IrO2, Pb/PbO2, IrO2, TiO2, cam karbon, poroz karbon, fiber karbon gibi materyaller
kullanılır. Katot materyali olarak ise genellikle çelik, Pt, Ti kullanılır (Comninellis, 1994). Direkt oksidasyonda katalitik aktivitesi yüksek anotlar yardımıyla suyun hidrolizi sağlanır ve aşağıda verilen reaksiyon gereği OH
˙
radikalleri oluşturulur. Organik kirleticilerin bu radikalleri adsorplamasıyla, organik kirleticilerin bozunması sağlanır (Panizza ve ark., 1999).2H2O → 2 OH
˙
+ 2H+ -2eˉ (2.2)Bunun yanı sıra bir diğer oksidasyon mekanizması yüksek klorür konsantrasyonlarında gözlenir. Klorür reaksiyonları anotta yüksek elektrokatalitik aktivite ile gerçekleşir. Anot yüzeyinde serbest klorun su ile reaksiyonunda hipokloröz asit (ClOH) ile H+ iyonları meydana gelir. Bu sayede hipokloröz asit organik maddelerin parçalanmasında etkin rol almaktadır (Israilides, 1997). Direkt oksidasyon oranı, organik kirliliğin türüne, katalitik aktiviteye, akım yoğunluğuna ve difüzyon oranına bağlıdır.
2.1.3.2. Ġndirekt oksidasyon
İndirekt oksidasyon işlemi elektrot yüzeyinde veya yakınında değil, elektrotlar arasındaki su ortamında meydana gelmektedir (Rajkumar ve Palanivelu, 2004). Burada organik maddelerin daha küçük bileşenlere parçalanması, direkt oksidasyonda meydana
gelen radikallarin bozunması sonucunda oluşmuş birincil (Cl2, O2 gibi) ve ikincil (ClO2,
O3 ve H2O2 gibi) oksidantların sözü geçen su ortamına difüze olması ile gerçekleşir.
İndirekt oksidasyonun gücü difüzyon oranına, sıcaklığa ve pH‟ına bağlıdır (Israilides ve ark., 1997).
2.1.4. Elektro-Fenton oksidasyonu
Endüstriyel atıksuların arıtımında biyolojik prosesler geniş uygulama imkanı bulmasına karşın, kalıcı organik ve inorganik maddelerin hızlı gideriminin beklendiği sistemler için ileri oksidasyon prosesleri daha uygun hale gelmektedir. Fenton oksidasyonu (FO)‟da biyolojik ve kalıcı organik kirleticilerin gideriminin sağlandığı ileri oksidasyon prosesi olarak kullanılabilmektedir (Bidga, 1995; Teel ve ark., 2001). Günümüzde, elektrokimyasal yöntemlerin verimliliğinin arttırılabilmesi için farklı oksidasyon proseslerinin aynı elektrokimyasal hücre içerisinde eş zamanlı olarak yürütüldüğü hibrit sistemler sıkça kullanılmaktadır. Özellikle elektro-oksidasyon (EO) ve koagülasyonun (EC) bir arada gerçekleştiği bir sistem olarak bilinen elektro-Fenton (EF), kirlilik yükü yüksek atıksuların arıtımında oldukça iyi sonuçlar vermektedir (Brillas ve Casada, 2002; Chang ve ark., 2004; Tauchert ve ark., 2005). Bu yöntemde, H2O2‟nin Fe2+ iyonlarıyla katalizlenmesi yolu ile OH
˙
radikallerininoluşturulması amaçlanır. OH
˙
radikalleri oldukça iyi bir oksidant olup, organik maddeleri kolayca parçalayabilir. Hidroksil radikalleri (OH˙
) ile organik maddelerin oksidasyonu genel olarak aşağıda verilen zincir reaksiyonlar sayesinde gerçekleşir (Diaz ve ark., 2002).Fe2+ + H2O2→Fe3+ + OHˉ+ OH
˙
(2.3)Fe2++ OH
˙
→Fe3++ OHˉ (2.4)RH + OH
˙
→H2O + R·
(2.5)R
·
+ Fe3+→R+ + Fe2+ (2.6)EF prosesinde görev alan OH
˙
radikallerinin tek kaynağı FO değildir. Bu yöntemde, OH˙
radikalleri aşağıda verilen reaksiyon gereği anot yüzeyinde meydanagelen suyun hidrolizi ile de oluşabilmektedir. Ancak sistemde anotta çözünebilir elektrot kullanılması durumunda EO verimi oldukça sınırlıdır (Boye ve ark., 2003).
H2O → OH
˙
+ H+ + eˉ (2.7)Sonuçta, reaktördeki OH
˙
radikallerinin miktarı FO sistemine göre daha yüksek olacaktır. Bu olay, EF yönteminin verimliliğini arttıran en önemli unsurlardan birisidir. Sistemde, Fenton reaksiyonları sonucu oluşan Fe3+ iyonlarının (2.6) nolu reaksiyon gereği katot yüzeyinde Fe2+‟ya indirgenmesi mümkündür. Bu durum, Fenton zincirreaksiyonlarını teşvik edeceği için, EF sistemlerinde klasik FO metoduna kıyasla daha yüksek arıtma verimlerine ulaşılmasını sağlamaktadır (Fockedey ve Lierde, 2002).
Fe3+ + eˉ →Fe2+ (2.8)
Ayrıca, hidroliz sırasında anotta oluşan aktif oksijen türleri, kimyasal ve fiziksel olarak anot yüzeyine tutunarak organik maddeleri oksitleyebilmektedir (eşitlik (2.9) ve (2.10)). Bu olay, literatür de direkt oksidasyon olarak isimlendirilmektedir (Israilides ve ark., 1997).
R + MOx+1 → RO + MOx (2.9)
R+ MOx (OH
˙
)2→CO2 + zH+ + zeˉ + MOx (2.10)Yukarıda verilen reaksiyonlara ek olarak, anot yüzeyinde ikincil reaksiyonlar yardımıyla meydana gelen Cl2/OClˉ, H2O2, O3 gibi oksidantlar da reaktör içerisindeki
organik kirleticileri oksitlemeyebilmektedir (indirekt oksidasyon olarak isimlendirilir) (Deng ve Englehardt, 2006). Aslında, bir elektrokimyasal hücrede direkt ve indirekt oksidasyonun oluşum mekanizmaları tam olarak bilinmemektedir. Buna karşın, Israilides ve ark., (1997) tarafından yapılan çalışmada, muhtemel reaksiyonlar detaylı olarak tanımlanmaya çalışılmıştır.
EF yönteminde gözlenen bir diğer arıtma mekanizması ise elektro-koagülasyondur (EC). EC‟de, anodik olarak üretilen Fe2+
ve Fe3+ bileşenleri ortam pH‟ına bağlı olarak Fe(OH)n türündeki yapılara dönüşür ve bu yapılar flokların polaritesine bağlı olarak elektrostatik ilgi veya kompleksleşme reaksiyonlarıyla,
kirleticilerin (organik, kolloidal, bir kısım iyonik vb. türde) giderimi sağlanmaktadır (Mollah ve ark., 2001).
4Fe(s) + 10H2O + O2 → 4Fe(OH)3 + 4H2(g) (2.11)
Fe(s) + 2H2O →Fe(OH)2 + H2 (2.12)
EF yöntemi, yukarıda verilen bir çok arıtma mekanizmalarının birlikte çalıştığı bir sistem gibi görünse de, elektrokimyasal hücrede yöntemin verimini sınırlandıran parazit reaksiyonların meydana gelmesi de mümkündür. Özellikle, sistemde üretilen OH
˙
radikalleri ve dışarıdan eklenen H2O2, bu parazite reaksiyonlar iletüketilebilmektedir (Diaz ve ark., 2002).
H2O2 + Fe3+ →Fe2++ HO2
·
+ H+ (2.13)H2O2 + OH
˙
→HO2·
+ H2O (2.14)Fe3+ + HO2
·
→Fe2+ + H+ + O2 (2.15)Fe2+ + HO2
·
→Fe3+ + HO2ˉ (2.16)Bu reaksiyonlar, genellikle reaktörde sağlanacak uygun Fe(II)/H2O2 ve
Fe(III)/H2O2 molar oranları ve pH ile azaltılabilmektedir. Parazit reaksiyonlara ek
olarak, yüksek akım uygulamalarında, aşağıda verilen rekabetçi elektrot reaksiyonlarının reaksiyon (2.7) ve (2.8)‟i engellemesi mümkündür. Bu durum, EF reaktöründeki organik madde giderimini azaltan bir diğer önemli faktör olarak kabul edilmektedir (Zhang ve ark., 2005).
2H2O2 → 4H+ + O2 + 4eˉ (2.17)
2H+ + 2eˉ→ H2 (2.18)
Yukarıda da ifade edildiği gibi, EF yönteminde gerçekleşen kimyasal reaksiyonlar oldukça karmaşık ve kontrolü oldukça güçtür. Bu nedenle, optimum işletme koşullarının belirlenmesinin EF yönteminin verimliliğinin arttırılmasında büyük önemi vardır.
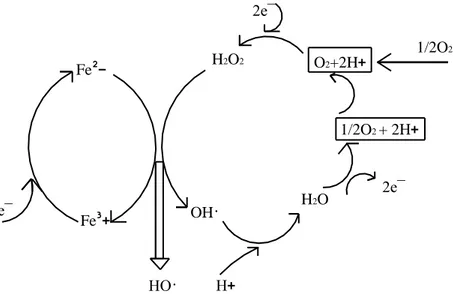
Fe² Fe³ e¯ H2O2 H2O OH· 2e¯ 2e¯ 1/2O2 + 2H O2+2H 1/2O2
ġekil 2.1. Elektro-Fenton yöntemiyle OH˙radikallerinin üretim şeması (Oturan, M.A., 1992). Şekil 2.1‟de elektro-Fenton yöntemiyle OH
˙
radikallerinin üretim şeması verilmiştir. Elektro-Fenton yönteminde çözeltiye katalitik miktarda Fe2+ iyonları eklenir.Uygulanan elektriksel potansiyelle bir taraftan oksijenin indirgenmesi ile H2O2
oluşurken diğer taraftan Fe3+
tekrar Fe2+‟ya indirgenerek olayın katalitik bir şekilde yürümesi sağlanır (Tomat, 1977; Oturan, 1992; Matsue, 1981; Fleszar, 1983; Clifton, 1986).
2.1.4.1. Elektro-Fenton reaksiyonlarının avantaj ve dezavantajları
Elektro-Fenton prosesi oksidasyon ve koagülasyon proseslerinin avantajlarına sahip olmakla beraber sudaki oksijen miktarını da arttırmaktadır.
Çizelge 2.1. Elektro-Fenton prosesinin avantaj ve dezavantajları.
Avantajları Dezavantajları
H2O2 ihtiyaç duyuldukça yerinde ve sürekli
üretilebilir. Bu nakliye ve depolamayı ortadan kaldırır.
H2O2katot ara yüzeyinde birikebilir ve kısmen
bozunabilir.
Seyreltik H2O2 çözeltisi işlem sırasında
güvenliği arttırır. Yüksek derişimlerde protonlar elektronlar ile yarışır ve hidrojen gazı açığa çıkar. Üretim prosesi normal sıcaklık ve basınçta
basitçe gerçekleştirilir.
İlk iki dezavantaj H2O2 üretiminde akım verimini
azaltır.
Fe²+ katotta tekrar üretilebilir. Normal kimyasal reaksiyonlar devam eder. Reaksiyon hemen başlatılabilir. Potansiyel korozyon problemleri vardır. Çamurların çökme karakteristikleri
oldukça iyidir
Anot ve katotta meydana gelen gaz kabarcıkları oluşan çamurun çökme zamanını arttırır Oksijen veya hava gönderilmesi tepkime
çözeltisinin karışımını arttırır. Köpük oluşumu söz konusu olabilir. Hidroksil radikallerinin kontrollü üretimi söz
2.1.4.2. Sıcaklığın etkisi
Yüksek sıcaklıkta kirlilik giderme düşük sıcaklıktakinden daha iyi gerçekleşmektedir. Sıcaklık hidrojen peroksitin dönüşüm süresinde etkilidir. Reaksiyonda sıcaklık arttıkça reaksiyon süresi azalır. Fakat sıcaklık 40-50 °C nin üzerine çıktığında H2O2‟den randımanlı bir şekilde yararlanma oranı azalmaktadır. Bu
durum pratik uygulamada sorun yaratır. Bu sorun H2O2‟nin H2O ve O2‟ye ayrışmasının
hızlanmasından kaynaklanmaktadır. Bu yüzden bir çok ticari uygulamada Fenton reaksiyonları 20-40°C sıcaklık aralığında gerçekleştirilebilmektedir. Fenton prosesinde 20˚C veya 40˚C iyi bir sıcaklık seçimidir. Fenton reaksiyonu uygulamalarında, yüksek dayanıklılığa sahip atıkların kullanıma uygun hale getirilebilmesi için reaksiyonun gerçekleşeceği sıcaklığa hızla değil kademeli bir artışla ulaşmak daha yararlı olacaktır. Bu da H2O2‟nin ortama kontrollü eklenmesiyle mümkün olabilmektedir. Sıcaklıktaki bu
kademeli artış sadece ekonomik yönden değil aynı zamanda güvenlik nedeniyle de istenmektedir (Walling, 1975; Bishop ve ark., 1968).
2.1.4.3. BaĢlangıç pH’ının etkisi
Farklı endüstri dallarında yapılan çalışmalarda Fenton reaksiyonlarının diğer oksidasyon proseslerine göre düşük pH‟larda gerçekleştiği bilinmektedir. Fenton oksidasyonu için en uygun pH aralığının 2.0–4.0 olduğu anlaşılmıştır. Literatürde Fenton prosesi sırasında oluşan Fe3+ iyonlarının koagülasyon yardımıyla KOİ gideriminin sağlandığı belirtilmektedir. Bu nedenle KOİ gideriminin önemli olduğu durumlarda elektro-Fenton reaksiyonu sırasında oluşan Fe3+ iyonlarının reaksiyon sisteminde tekrar Fe2+ iyonlarına dönüşümünün engellenmesi gerekmektedir. pH değeri yöntemin arıtma verimini etkileyen parametrelerden biri olarak kabul edildiğinden bu nedenle öncelikle elektro-Fenton yönteminde optimum KOİ giderimini sağlayan, optimum pH değeri önemlidir ve araştırılmalıdır.
2.1.4.4. BaĢlangıç H2O2 dozunun etkisi
Elektro-Fenton oksidasyonunda sistemde üretilecek OH
˙
radikallerinin ana kaynağı H2O2‟dir. Fenton reaksiyonlarında H2O2 tüketilmesi, yöntemin veriminiH2O2 konsantrasyonunun optimum değerinin belirlenmesi bu yüzden önemlidir. Eğer
ortamda yeterince H2O2 bulunmuyorsa proses esnasında istenmeyen ara ürünler
meydana gelebilir. Fazladan H2O2 ilavesiyle reaksiyonlar seri olarak devam ettirilebilir.
Bu toksisite giderme maksatlı atıksu arıtımında sık sık gözlenebilir.
H2O2 optimum dozuna ulaşıldığında KOİ giderimi ve toksisite indirgenmesinde
ani artan verimlilikler meydana gelmektedir. Optimum dozun üzerindeki H2O2 ilavesi
ise verimi arttırmadığı gibi, verimlilik kontrolü için yapılacak olan KOİ, BOİ gibi deneysel çalışmalarda girişime neden olması açısından sıkıntı doğurur.
2.1.4.5. Akım büyüklüğünün etkisi
Elektro-Fenton yönteminde bir diğer etkili işletme parametresi, sistem içerisinde elektrotlara uygulanan akımın büyüklüğüdür. Elektrotlara verilen akım değeri arttıkça, elektrokoagülasyon verimi artma gösterirken aynı zamanda da Fenton oksidasyonu için gerekli olan Fe2+‟nın reaktöre girişi hızlanmaktadır. Ancak yüksek akım koşullarında, yöntemin enerji tüketimi artarken, elde edilen verim belli bir noktadan sonra çok fazla değişim göstermemektedir. Enerjiden kaynaklanan maliyetin artmaması için sistemde kullanılacak akım değerinin iyi tespit edilmesi gerekmektedir.
2.1.4.6. OluĢan atık çamurun çökelebilirliği
Elektrokimyasal yöntemlerin en önemli avantajlarından birisi de, arıtma sonucunda diğer arıtma yöntemlerine göre miktar bakımından daha az çamur oluşturmasıdır. Ünitede oluşan flokların büyük olması nedeniyle, bu tür çamurların çökme karakteristikleri oldukça iyidir. Ancak anot ve katotta meydana gelen gaz kabarcıkları çökme zamanını arttırabilmektedir. Genel olarak, oluşan çamurların çökme karakteristikleri çamur hacim indeksi (ÇHİ) ile belirlenir. ÇHİ değeri 100‟den küçük olan çamurlar, çökme karakteristikleri iyi olarak nitelendirilir. Bununla birlikte, başlangıç pH‟ının 2.0-3.0 aralığında ÇHİ değerinin düştüğü görülmüştür. Bu olay Fe(OH)n komplekslerinin hafif asidik koşullarda daha büyük ve stabil floklar meydana getirmesinden kaynaklanmaktadır. Buna karşın çok yüksek H2O2 konsantrasyonlarında
(>2000 mg/L) ÇHİ değerlerinde artış görülürken, düşük H2O2 konsantrasyonların da
(<1000 mg/L) ÇHİ değerlerinde azalma görülmektedir. Yüksek H2O2
reaksiyonlarda H2 ve O2‟nin flok yapısını bozması ve çamurun çökme kabiliyetini
azaltması olarak değerlendirilmektedir. Düşük H2O2 derişimlerinde ise bu olayın flok
yapısı daha iyi olan Fe (III) konsantrasyonun Fe (II)‟ye göre daha az olmasından kaynaklandığı düşünülmektedir.
2.1.4.7. Demir iyonu konsantrasyonunun etkisi
Demir iyonu yokluğunda ortamda hidroksil radikali oluşmadığından Fenton reaksiyonu gerçekleşmez. Ortamdaki demir konsantrasyonu arttıkça reaksiyonun hızı artar. Ancak öyle bir konsantrasyona ulaşılır ki bundan sonra ilave edilen demir iyonu, verimi arttırıcı etkide bulunamaz. Ortamda reaksiyon için yeteri kadar organik madde ve H2O2 bulunması durumunda katalitik dönüşüm zinciri derhal başlar. Klorür veya
sülfat tuzlarının ortamda bulunması, yüksek hızlı uygulamalarında Cl2 oluşumu dışında
başka bir olumsuzluğa yol açmaz.
OH
˙
+ CI → OHˉ + ´ Cl2 (2.19)Bu tez çalışmasında ayrıca klasik Fenton çalışması da yapılmıştır. Klasik Fenton prosesi ile ilgili olarak literatür bilgileri de aşağıda verilmiştir.
2.1.5. Klasik Fenton oksidasyonu (H2O2/Fe2+)
Bazı metal katyonlarının H2O2 ile birlikte olduğu sulu sistemler etkili oksidant
özellik gösterirler. Özellikle Fe2+‟nın kullanımı oldukça etkin OH
˙
radikali oluşumu sağlamaktadır.
H2O2 + Fe2+ ↔ Fe3+ + OH
˙
+ OHˉ k= 51 Mˉ¹sˉ¹ (2.20)Bu sistemin etkinliği ilk kez 1894 yılında Fenton tarafından gözlenmiştir. Ancak 1930‟lu yıllara kadar sistemin mekanizması açığa çıkarılamamıştır. 1876 yılında Fenton maleik asidi H2O2 ve düşük derişimde Fe2+ tuzunun karışımı ile reaksiyona sokmuş ve
oksidasyonunun Fe2+ iyonları tarafından katalizlendiği ve oluşan renkli ürünün dihidroksimaleik asit olduğu belirlenmiştir (Fenton, 1894). Daha sonra H2O2/Metal
iyonu kombinasyonları bir çok maddenin oksidantı olarak kullanılmış ve “Fenton reaktifi” olarak adlandırılmıştır. ESR spektroskopi tekniği dahil olmak üzere bir çok teknikle kanıtlanmış bir hipotezle (Dixon, 1964), Fenton reaktiflerinin bulunduğu bir sistemde, esas oksidantın Fe2+ ve H2O2 arasında gerçekleşen tepkimeler sonrasında açığa
çıkan OH
˙
radikalleri olduğu 1934 yılında Haber ve Weiss tarafından açıklanmıştır. Günümüzde Fenton reaktifi toksik organik bileşikleri (fenol, formaldehit, boya atık suları, plastik katkı maddeleri, kauçuk kimyasalları vb.) içeren endüstriyel atıksuların işlenmesinde kullanılmaktadır. Yöntem atıksularla kirletilmiş topraklara ve çamur kalıntılarına da; organik kirleticilerin parçalanması, toksisitenin azaltılması, biyoparçalanabilirliğin arttırılabilmesi, koku ve rengin giderilmesi amaçları için uygulanabilmektedir.2.1.5.1. Klasik Fenton prosesinin avantajları
Zararlı atıkların arıtılmasında Fenton reaktiflerinin kullanımı önemli avantajlara sahiptir. Bu avantajları şöyle sıralayabiliriz:
Demirin sadece katalitik miktarı kullanılır.
Kullanılmayan Fe2+ çözeltiden kolaylıkla uzaklaştırılabilir.
Fe2+
tuzları ve H2O2 toksik maddeler değildirler.
H2O2 yine kendisi gibi toksik olmayan H2O ve O2 gibi maddelere bozunur.
Fenton reaksiyonu sonucu meydana gelen hidroksil radikallerinin sudaki mevcut kirleticileri mineralize etme yeteneği çok yüksektir.
H2O2 ve Fe2+ tuzlarının ucuz ve kolay bulunabilir olmasından dolayı sistem
ekonomiktir.
Klorlama ve ozonlama işlemlerindeki gibi oksidasyon prosesi sırasında klorlu organik bileşikler oluşmaz.
İstenirse organik kirleticiler tamamen H2O ve CO2‟ye dönüştürülebilir.
Mevcut fiziko-kimyasal arıtma tesislerine çok az bir ek masrafla uygulanabilir. Bu kadar çok avantajının yanında, toksik çamur oluşma riski gibi dezavantajları
2.1.5.2. Klasik Fenton oksidasyonuna etki eden faktörler
Sıcaklık, pH, demir sülfat ve hidrojen peroksit miktarlarındaki değişiklikler Fenton prosesinin arıtma verimliliğini etkileyen parametrelerdir (Aydın 2002; Walling 1975; Bishop ve ark., 1968).
Sıcaklığın etkisi: Yüksek sıcaklıkta kirlilik giderme düşük sıcaklıktakinden daha iyi gerçekleşmektedir. Sıcaklık hidrojen peroksitin dönüşüm süresinde etkilidir. Reaksiyonda sıcaklık arttıkça reaksiyon süresi azalır. Fenton prosesinde 30°C veya 40°C sıcaklık iyi bir seçimdir.
pH’nın etkisi: Asidik koşullarda redoks sistemi daha iyi gerçekleşmektedir. pH değeri 3.5‟den düşük olduğu zaman H2O2 ve Fe2+ daha kararlıdır. Fe2+ iyonları
pH 4.0‟ten yüksek olduğunda kararsızdır ve kolayca demir hidrokso kompleksleri üretmeye meyilli demir iyonları oluştururlar. Yüksek pH‟ta H2O2
oksitleme yeteneği azaldığından kararsızdır. Fe2+ iyonları ve H
2O2 kararsızlığı
redoks sistemini ve sistemin verimini etkilemektedir. Fe2+
iyonu dozunun etkisi: Fe2+ iyonu dozunun artması veya azalması sistem verimi üzerinde etkilidir. Yeterli H2O2‟in bulunduğu ortamlarda daha yüksek
dozaj daha iyi etki demektir. Fe2+ iyonu dozunun artması, redoks reaksiyonunun tamamlanmasına ve koagülasyona sebep olur.
H2O2 dozunun etkisi: Yeterli Fe2+‟nın bulunması hali için hidrojen peroksit
fazla miktarda kullanıldığında kirlilik giderme verimi yüksek, az miktarda kullanıldığında ise düşüktür. Arıtılmış suda H2O2 kalması girişim yaparak KOİ
değerinin artmasına neden olmaktadır.
2.2. Kağıt ve Kağıt Hamuru Endüstrisi
2.2.1. Endüstrinin tanımı
Kağıt endüstrisi ağaç, jüt, kenevir gibi bitkilerden selüloz ve kağıt, karton gibi kağıt ürünleri üreten endüstridir. Son yıllarda atık kağıtlardan geri dönüşüm ile kağıt ürünleri üretimi de büyük önem kazanmıştır. Endüstri, hammaddenin hazırlanması, selüloza dönüştürülmesi, ağartma ve kağıt ürünlerine dönüştürme işlemlerini kapsar (Anonim, 2007) Kağıt endüstrisi Türkiye‟ de 1936‟ya kadar küçük işletmelerde çok
sınırlı ölçülerde üretim yapmış, 1936‟dan sonra büyük işletmeler devreye girmiş ve kağıt endüstrisi büyük gelişme göstermiştir.
2.2.2. Kağıt ve kağıt ürünleri üretimi
Odun sahasına gelen tomruklardan kabuklu olanlar kabuğu soyulduktan sonra, kabuksuzlar ise direkt olarak yongalama ünitesine alınmaktadır. Tomruklar, yongalama makinesinde küçük parçalara ayrılarak yongalar üretilmektedir ve yonga sahasında depolanmaktadır. Sahadan alınan yongalar Şekil 2.2‟de görüldüğü gibi pişirme kazanlarına doldurulmaktadır. Kazana beyaz ve siyah mahlul ilave edilerek, basınç altında belli bir sıcaklıkta pişirme işlemi yapılarak yongalar hamur haline getirilmektedir. Selüloz hamuru, kurutucu ve metal tutuculardan geçirildikten sonra rifayner makinesinde ögütülmektedir. Öğütülmüş selüloz hamuru yıkama eleklerinden geçirilerek, su ile yıkanmaktadır. Kağıt hamuru beyazlatılıp öğütüldükten sonra su eklenerek seyreltik hale getirilmektedir, gerekirse kalsiyum karbonat, kaolin gibi dolgu maddeleri eklenmektedir. Bu karışım % 99‟u su, % 1‟i elyaf ve diğer katkı maddeleri olacak şekilde kağıt makinasına pompa ile iletilmektedir (Anonim, 2007). Yıkama işlemi sonucunda yıkanmış selüloz hamuru ve atık kağıt ünitesinden gelen selüloz hamuru stok kulelerine, hamurdan ayrılan siyah likör ise geri kazanma tesisine gönderilmektedir. Stok kulelerindeki hamur, kağıt işletmesinde rifayner makinelerinden geçirilerek ögütülmektedir ve karışım bütesine alınmaktadır. Burada, hamura nişasta (istenirse), sap ve köpük kesici ilavesi yapılmaktadır. Karışım bütesinden çıkan hamur, siklon kademelerinden geçirilerek içindeki budak, kum, açılmamış lif vs. temizlenmektedir. Temizlenmiş hamur, kağıt makinesinin elek adı verilen çok ince gözenekli, süzgeç üzerine hamur, çok dar bir yarıktan akıtılmaktadır. Elek, sürekli dönmektedir ve su-elyaf karışımındaki katı maddeler, elek üzerinde kalmaktadır, su elek yardımı ile süzülmektedir. İlk kısımda serbest drenaj ile daha sonra ise vakum yardımı ile % 20-25 kuruluğa kadar suyundan ayrılması sağlanmaktadır. Eleğin üzerinde böylece yaklaşık % 20‟si elyaf, % 80‟i su olan yaş bir kağıt tabakası oluşmuş olmaktadır. Elekten çıkan kağıt, önce preslerden sonrada kurutma silindirlerinden geçirilerek % 93 kurulukta kağıt, sarıcıya sarılarak tampon olarak kağıt üretimi tamamlanmaktadır.
Geri kazanma tesisinde; yıkama işlemi sonucunda selüloz hamurundan ayrılan siyah likör buharlaştırma ünitesinde evaparatörlerden geçirilerek kuru madde miktarı arttırılmaktadır. Buradan çıkan siyah likör soda kazanında yakılarak, oluşan inorganik maddeler, tankta zayıf likör içinde çözündürülerek yeşil likör elde edilmektedir. Yeşil likör durultma tankında çamurundan ayrıldıktan sonra, döner kireç fırınında elde edilen kireç CaO ile reaksiyona girerek beyaz likör elde edilmekte ve pişirme işlemi için selüloz işletmesine sevk edilmektedir.
Kurutulmuş kâğıt hamuru metrik tonu basına 20–250 m3
atıksu oluşur. Kimyasal mekanik hamur işleminden oluşan atıksuyun BOİ değeri, mekanik hamur üretiminde oluşan atıksuyun BOİ değerinden 3 ila 10 kat daha yüksektir.
2.2.3. Kağıt endüstrisi atıksularının özellikleri
Kağıt hamuru hazırlama atıksuları “siyah su”, kağıt yapma kısmı atıksuları ise „„beyaz su” olarak adlandırılır. Kağıt hamuru atıksuları pişirme, yıkama, ağartma, kalınlaştırma, elyaflarına ayırma işlemlerinden gelir. Bu atıklar sülfit sıvısı, ince hamur, ağartma için kullanılan kimyasal maddeler, merkaptanlar, sodyum sülfit, karbonat, hidroksiller, kağıt, kazein, kil, boyalar, yağ-gres ve elyaflar içermektedir. Kağıt yapımında meydana gelen kirliliğin büyük kısmı kağıt hamuru hazırlama proseslerinden oluşur (Şengül, 1991). Kağıt makinesi atıkları ise eleklerden, duşlardan, kağıt makinesinden karıştırma tanklarından geçen sulardan oluşur. Kağıt yapımında çeşitli dolgu maddeleri kullanıldığından bunlar da atıksulara karışmaktadır. Kağıt makinesi atıksularına beyaz su denir (Şengül, 1991).
2.2.4. Kağıt endüstrisi atıksuları ve kaynakları
Kağıt hamuru yapan tesislerde çözünmüş, biyokimyasal oksijen ihtiyacı ve askıda katı madde içeriği yüksek atıksular oluşur. Kağıt üretiminde yaklaşık 400-600 m3
su/ton kağıt kullanılır. En iyi cins kağıt üretiminde 1000 m3
atıksu/ton ürün oluşur. Alıcı su ortamlarında kirlenmenin önlenebilmesi için yapılacak uygulamalarda Su Kirliliği Kontrolü Yönetmeliği Suda Tehlikeli ve Zararlı Maddeler Tebliği‟nde yer alan maddelerin atıksularda bulunması ve alıcı ortamlara deşarjları için, bu tebliğde öngörülen şartlar ve sınır değerleri geçerlidir. Endüstriler üretim tiplerine göre gruplandırılmış ve on altı tane sektör oluşturulmuştur. Bu sektörler ve sektörlerin içerdiği endüstri tiplerinden biri olan; selüloz, kâğıt, karton sanayi sektörü; yarı selüloz üretimi, ağartılmamış selüloz üretimi, ağartılmış selüloz üretimi, saf selüloz üretimi, nişasta katkısız kağıt üretimi, nişasta katkılı kağıt üretimi, saf selülozdan elde edilen çok ince dokulu kağıt üretimi, yüzey kaplamalı-dolgulu kağıt üretimi, kırpıntı kağıt yüzdesi yüksek olmayan kağıt üretimi, kırpıntı kağıttan kağıt üretimi, parşömen kağıdı üretimi ve benzerleri aşağıda verilmiştir. Kağıt endüstrisi atıksu kaynakları için belirlenen atık
su deşarj standartları, atıksular için Su Kirliliği Kontrolü Yönetmeliği deşarj standartları ve her tür üretim için atık yükleri Çizelge 2.2 ve 2.3‟de sunulmuştur.
Çizelge 2.2. Kraft kağıt endüstrisi atıksuları için su kirliliği kontrolü yönetmeliği deşarj standartları (Sektör: selüloz, kağıt, karton ve benzeri sanayi (saf selüloz üretimi).
Parametre Birim Anlık Numune Kompozit Numune 24 SAATLĠK
Debi (m3/ton) - 230
Kimyasal Oksijen İhtiyacı (KOİ) (mg/L) - 1500
Askıda Katı Madde (AKM) (mg/L) - 50
Çökebilir Katı Madde (mg/L) 7 -
Balık Biyodeneyi (ZSF) - - 8
Çizelge 2.3. Kağıt endüstrisi atıksuları için su kirliliği kontrolü yönetmeliği deşarj standartları ve her tür üretim için atık yükleri (Sektör: selüloz, kağıt, karton ve benzeri sanayi).
Üretim Türü BOĠ KOĠ AKM
Çökelebilir
Katı Madde BĠOdeneyi ZSF Balık Debi pH mg/L kg/ton mg/L kg/ton mg/L kg/ton mL/L m 3/ton Yarı selüloz 300 30 800 80 50 5 3 8 100 - Ağartılmış selüloz 350 70 1000 220 50 10 6 8 200 - Saf selüloz 500 120 1500 350 11.5 50 7 8 230 -
Nişasta katkısız kağıt 40 3
100
6 - -- 0.5 - - -
Nişasta katkılı kağıt 40 3 100 8 - -- 0.5 - - -
Yüzey kaplamalı dolgulu kağıt 35 0.7 75 2(*) - 0.5 - - - Su ürünleri sirkülerine
göre atık su değerleri 50 70 200 - - - 5-9
2.2.5. Kağıt endüstrisi atıksularının taĢıdığı riskler ve arıtımının önemi
Kağıt sanayi atıklarının üretim işlemlerinin bir sonucu olarak organik içerikli olmaları nedeniyle BOİ, KOİ, AKM, N ve P gibi parametreler temel kontrol parametreleri olarak kullanılmaktadır. Kâğıt fabrikalarında parlak beyaz kâğıt üretimi için klor dioksit gibi beyazlatıcı maddeler kullanılmaktadır. Bu işlem dioksinler ve diğer
yüksek toksisiteli maddeler dâhil bir çok zehirli maddeden oluşan bir kokteyl üretmektedir. Bu yan ürünlerin binlerce tonu her yıl su kaynaklarına ve havaya karışmaktadır. Balıklara ve kuşlara olan zararının yanı sıra insanlar da bundan oldukça fazla etkilenmektedir. Kısıtlamalar sonucu bu atıklar azaltılsa da, çok az bir miktarı bile çok zararlıdır. Klor yerine kullanabilecek en iyi alternatifler hidrojen peroksit, ozon ve oksijen gibi oksijen bazlı beyazlatıcılardır. Ayrıca bir kâğıt endüstrisinde 1 ton kağıt üretmek için eski teknolojilerde 400 ton su kullanmak gerekirken modern tesislerde 20 ile 50 ton su kullanmak yeterli olmaktadır. Bunun yanı sıra kullanılmış kağıttan, kağıt üreten tesislerde bir ton kağıt üretimi için sadece 5 ton su kullanmak yeterli olmaktadır.
Çizelge 2.4. Kağıt hamuru ve kağıt endüstrisi atıksu miktarları ve atık yükleri. Alt Kategori BOĠ5 (kg/ton ürün) AKM (kg/ton ürün)
Ağartılmamış kraft 15-30 12-30
Ağartılmış kraft 12-50 20-30
Sülfit kâğıt hamuru 100-200 10-100
Atık kâğıttan kâğıt üretimi 4-20 3-80
Mekanik kâğıt hamuru ve bu
hamurdan kağıt, karton üretimi 5-50 5-80
2.3. Elektro-Fenton Prosesi Ġle Yapılan ÇalıĢmalardan Örnekler
Tambosi ve arkadaşları (2005), (+2) değerlikli demir ve (+3) değerlikli demir ile Fenton ve Fenton-like proseslerini kullanarak kağıt fabrikası atıksularının ön arıtımı üzerine çalışmışlardır. pH, demir, peroksit dozları ve son aşamada koagülasyon için optimizasyon yapmışlardır. pH‟nın proses verimi üzerine ciddi bir etkisi olduğu tespit edilmiştir. Oksidasyon aşaması için optimum pH 2.5 ve koagülasyon için de pH 4.5–6.0 aralığı optimum olarak belirlenmiştir. Sonuç olarak, renk gideriminde % 95 verim, KOİ giderimin de ise % 50 verime ulaşmışlardır.
Zahrim ve arkadaşları (2007), kâğıt fabrikasının atıksularının arıtımı üzerine yaptıkları çalışmada, foto-Fenton prosesinin arıtma verimini değerlendirmişlerdir. Yaptıkları çalışmada, optimum pH, demir (+2) ve peroksit dozu üzerine çalışmışlardır. Sonuçta optimum değerler olarak, pH 5.0, Fe2+
400 mg/L ve H2O2 500 mg/L
konsantrasyonlarını belirlemişlerdir. Bu optimize edilmiş şartlarda, biyokimyasal oksijen ihtiyacı (BOİ5) ve katı madde giderim verimleri sırasıyla % 87.5 ve % 87 olarak
Ting ve arkadaşları (2008), farklı reaktör tipleri ile benzen sülfonik asit (BSA) giderimi üzerinde çalışmışlardır. Çalışmada, klasik Fenton, elektro-Fenton ve foto+elektro-Fenton proseslerini kullanmışlardır. Ayrıca elektro-Fenton prosesini 3 farklı reaktör modeli uygulayarak verimleri kıyaslanmıştır. Sonuç olarak, KOİ giderimi esas alınarak, foto+elektro-Fenton prosesinin elektro-Fenton prosesinden % 14 daha verimli olduğu, elektro-Fenton prosesinin ise Fenton prosesinden % 17 daha verimli olduğu belirlenmiştir. Ayrıca farklı elektro-Fenton reaktör modelleri için yapılan çalışmalarda, çoklu elektrot kullanan reaktörlerde, tek katot ve anotlu reaktörlerden daha yüksek verim elde edilmiştir.
Atmaca ve ark. (2009), katı atık deponi sızıntı sularının elektro-Fenton prosesi ile arıtımını çalışmışlardır. 45 dakikalık oksidasyon süresi sonunda, pH 2.0–4.0 aralığında yaptıkları çalışmada, optimum pH‟nın 3.0 olduğunu ve daha düşük ve daha yüksek pH‟larda verimin azaldığını bulmuşlardır. 1.0–3.0 A akım şiddetlerinde yaptıkları deneylerde ise, optimum akım şiddetinin 2.0 A olduğunu ve daha şiddetli akımlarda verimde ciddi bir artış olmadığını tespit etmişlerdir. Başlangıç H2O2
konsantrasyonları için 250–2500 mg/L aralığında yaptıkları çalışmada ise, optimum konsantrasyon olarak 2000 mg/L olduğunu ve artan H2O2 konsantrasyonunda ciddi bir
verim artışı olmadığını belirlemişlerdir. Elektrotlar arası mesafe için 1.0–4.0 cm aralığında yaptıkları çalışmada ise, en yüksek verimin 3.0 cm‟lik mesafede elde edildiğini bulmuşlardır.
Hassan ve Hawkyard (2002) Fenton ve ozon oksidasyonuyla % 100‟e varan renk giderimleri elde etmiştir. Yine Torrades ve ark., (2001) tarafından yapılan fotokataliz ve ozon oksidasyonun birlikte uygulandığı kombine sistemde, % 88 toplam organik karbon ve % 100 renk giderimine ulaşılmıştır.
Munoz ve ark., (2006) tarafından yapılan bir karşılaştırmalı çalışmada Fenton, foto-Fenton, ozon ve O3/UV oksidasyon teknikleri kraft kağıt üretim atıksularında
denenmiş ve bu yöntemlerden özellikle O3/UV ve foto-Fenton tekniklerinin verimli bir
şekilde uygulanabileceğini (% 70 ile % 80 oranında KOİ giderimi) göstermiştir.
Sheng ve Chih (2000) sızıntı suyu ile yaptıkları kimyasal koagülasyon sonrası elektro-Fenton çalışmasında 23 dakika gibi kısa bir sürede, teorik H2O2 dozunun %
37‟sini kullanarak % 68 oranında KOİ giderme verimine ulaşmışlardır. Bu arıtılmış suyun % 30‟luk kısmını da BOİ temsil etmektedir.
Panizza ve Cerisola (2004), farklı deneysel şartlar altında BDD (Boron Doped Diamond) ,Ti- Ru-SnO2 anodlarla birlikte elektroliz yaparak naftalinsülfonikasit içeren
endüstriyel atıksuların elektrokimyasal oksidasyonu sağlamıştır. Her iki elektrod kullanımında da yüksek KOİ giderim verimi elde edilmiştir. BDD anodların düşük akım yoğunluğunda yüksek oksidasyon hızına sahip olduğu belirlenmiştir. Naftalin sülfonik asit ile etkin hidroksil radikalleri elektrolitik olarak üretildikten sonra özellikle KOİ gideriminin % 100‟leri bulduğu gözlemlenmiştir. Hidroksil radikalleri vasıtasıyla iyi giderim sonuçları gözlenmiştir. Lin ve Chang (2000) sızıntı sularının kimyasal ve biyolojik arıtım metodlarıyla birlikte arıtılmasını çalışmışlardır. Kimyasal koagülasyon için elektro-Fenton metodunu deneyerek sızıntı sularında bulunan dayanıklı organik ve inorganik bileşiklerin yüksek bir verimde etkin bir şekilde giderilmesi amaçlanmıştır. Daha sonra da SBR‟de arıtılarak deşarj edilebilecek bir standarda ulaşılmıştır. Optimum işletme şartları her bir arıtma ünitesi için belirlenerek iyi bir verim elde edilmesi amaçlanmıştır. Deneysel Kurulum: Sızıntı suyu tankı–kimyasal koagülasyon–elektro-Fenton–SBR şeklinde olmuştur. Elektro-Fenton oksidasyonunda KOİ gideriminde yüksek verim elde edilebilmiştir. Bu aşama için optimum pH 4.0 olarak belirlenmiştir. Yine bu aşamada rengin % 100‟ü giderilebilmiştir. Bu amaçla uygulanan H2O2 dozu ise
750 mg/L‟dir.
Aaron ve Oturan (2001), doğal sularda bulunan yüksek kirletici konsantrasyona sahip aromatik pestisitlerin gelişen elektrokimyasal ve fotokimyasal metodlarla kirliliğin önlenmesi üzerine çalışmışlardır. Sulu çözeltilerde aromatik pestisitlerin degredasyonu için foto-Fenton reaksiyonlarının, elektro-Fentona oranla daha hızlı gerçekleştiği belirlenmiştir. Her iki proseste de sulardan kirlilik giderimi sağlandığı görülmüştür. Son olarak kısa zamanda yüksek minerilizasyon değerleri elde edildiğinden dolayı foto-Fenton ve elektro-Fenton metodları verimli teknikler olarak kabul edilebilir sonucu ortaya çıkmıştır.
De Francesco ve Costamagna (2004), elektrokimyasal yöntemler ve elektro-Fentonla ilgili çalışmaların kullanılabirliğinden bahsederek, bunları endüstriyel ölçekte kullanılması için reaktörlerin tasarımı ve fizibilite çalışması üzerinde durmuşlardır. Endüstriyel ölçekteki reaktörlerin tasarımı için en önemli parametreler; akım yoğunluğu, voltaj, reaksiyon kinetiği ve verim olarak sıralanmıştır. Bununla birlikte fizibilite için denge potansiyeli, akım ve deneysel kinetik verilerin önemi de belirtilmiştir. 60 ppm‟lik bir kirliliği ortamdan elimine edebilmek için 300 GJ/m enerji gereklidir. Atıksulardaki belirli düzeydeki kirletici konsantrasyonunun belirli debide arıtılabilmesi için elektrot yüzeyi bakımından çeşitli elektrokimyasal prosesler arasında dikkati çeken bir farklılık göstermektedir.
Doran Moreno ve ark. (2004), klasik Fenton prosesine daha ekonomik bir alternatif olarak, evsel atıksu ve laboratuar atıksuyu karışımından oluşan atıksu kombinasyonu üzerinde elektro-Fenton prosesinin arıtma performansını kesikli ve sürekli sistemlerde test etmişlerdir. Her iki çalışmada pH 3.0‟te gerçekleştirilmiş olup, kesikli sistem için 2.0 litre hacimli elektrokimyasal hücre ile paslanmaz çelikten anot ve grafit katot elektrotlar kullanılmıştır. Sürekli sistem olarak aynı elektroliz hücresine iki adet berraklaştırma tankı ve bir kum filtresi eklenerek elde edilen pilot tesis kullanılmıştır. Reaksiyon süreleri, 0-60 dakika ile, akım şiddeti, 0.2-1.0 A aralığında kalacak şekilde yapılan testlerde, filtrasyonsuz elde edilen en iyi sonuçlara 1.0 A ve 60 dakika şartlarında ulaşılmıştır. Aynı şartlarda, kesikli ve sürekli sistemlerden filtrasyon çıkışında elde edilen giderim verimleri sırasıyla, KOİ: % 65-74.8, Bulanıklık: % 77-92 ve Renk: % 80-100 şeklinde olmuştur. Pilot tesis olarak dizayn edilen sürekli sistem çıkışında, fekal ve toplam koliform bakterilere rastlanmamıştır. Bu çalışmada atıksuyun sistemdeki ortalama hidrolik bekleme süresi 4.0 saat olmuş ve Fenton reaktiflerinin elektriksel ortamda üretilmesi ile maliyetin, ileri ön arıtma maliyet rakamlarının beşte biri kadarına gerilediği ayrıca rapor edilmiştir.
Yıldırım (2007), kağıt endüstrisi atıksuyunda, başlangıç pH‟ı 2.5, akım değeri 1.0 A ve H2O2 dozu 1000 mg/L olan deney şartlarında uyguladığı elektro-Fenton
oksidasyonu ile % 95 KOİ verimi elde etmiştir.
Proje kapsamında önerilen elektro-Fenton prosesi, elektro-oksidasyon ve elektro-koagülasyon süreçlerini kapsayan ve üzerinde araştırmacıların halen çalıştığı yeni bir arıtma prosesidir. Önerilen çalışma ile, geliştirilen tam karışımlı ve kesikli iki farklı reaktör konfigürasyonu kullanan elektro-Fenton prosesi ile gerçek kağıt fabrikası atıksularının arıtımı çalışılacak olması çalışmanın özgün yanını oluşturmaktadır.
3. MATERYAL VE YÖNTEM
3.1. Atıksu ve Karakterizasyonu
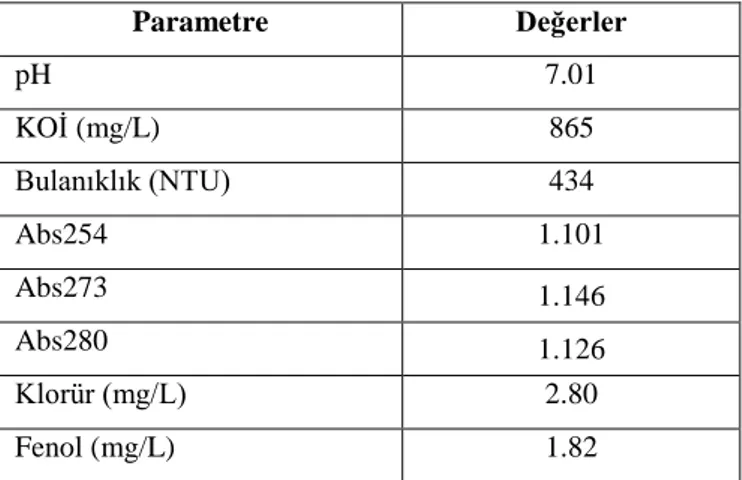
Çalışmada kullanılan atıksu Kombassan Kağıt Fabrikası‟nın arıtma tesisinde kullanılan kimyasal arıtmanın çıkışından alınmıştır. Deneylerde bu atıksu herhangi bir ön işleme maruz bırakılmadan kullanılmıştır. Atıksu numuneleri +4°C de saklanmış ve 1 hafta içinde kullanılmıştır. Bu süre içerisinde atıksuda herhangi bir bozunma gözlemlenmemiştir. Çalışmalarda kullanılan atıksuyun özellikleri Çizelge 3.1.‟de verilmiştir.
Çizelge 3.1. Çalışmada kullanılan atıksuyun özellikleri. Parametre Değerler pH 7.01 KOİ (mg/L) 865 Bulanıklık (NTU) 434 Abs254 1.101 Abs273 1.146 Abs280 1.126 Klorür (mg/L) 2.80 Fenol (mg/L) 1.82 3.2. Deneysel Kurulum
Özellikleri belirlenen kağıt atıksularına yapılacak olan elektro-Fenton uygulaması iki aşamada gerçekleştirilmiştir.
Optimizasyon çalışması Kinetik çalışma
Çalışma kapsamında incelenen deney şartları aşağıda verilmiştir. Fenton prosesi için incelenen deney şartları;
1. Optimum pH‟nın tespiti,
2. Optimum Fe2+ dozunun belirlenmesi, 3. Optimum H2O2 dozunun belirlenmesi,