İÇ HASTALIKLARI ANA BİLİM DALI PROF. DR. FEHMİ AKÇİÇEK
İç Hastalıkları Yoğun Bakım Ünitesinde
Terapötik Plazmaferez Deneyimimiz
DR. Tariyel MAMMADOV
İÇ HASTALIKLARI ANA BİLİM DALI TIPTA UZMANLIK TEZİ
TEZ DANIŞMANI Doç. Dr. Devrim BOZKURT
TEŞEKKÜR
Sürdürdüğüm uzmanlık eğitimim süresince bizlerin kaliteli eğitim almasında, karşılaşdığımız sorunların giderilmesinde desteğini, hoşgörüsünü esirgemeyen Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi Akçiçek’e,
Tezimin her aşamasında bana yol gösteren, her türlü desteği veren, tezimin şekillenmesi ve hazırlanması husunda yardımlarını biran bile esirgemeyen ve uzmanlık eğitimim boyunca sahip olduğu bilgi birikim ve görüşleriyle beni yönlendiren değerli tez danışmanım Sayın Doç. Dr. Devrim Bozkurt’ a,
Verdikleri destekten dolayı Hematoloji Bilim Dalı Aferez Ünitesi sorumlu öğretim üyelerine ve aferez çalışanlarına,
İç Hastalıkları eğitimim boyunca verdikleri destek ve eğitimime sağladıkları katkılar nedeniyle bütün İç Hastalıkları öğretim üyelerine, uzmanlarına, birlikte çalıştığım tüm asistan arkadaşlarıma, İç Hastalıkları AD bünyesinde çalışan tüm hemşire ve personellere,
Tüm hayatım ve tıp eğitimim boyunca beni sabırla destekleyen ve yanımda olan, bugünlere onlarsız gelmem mümkün olmayan aileme, eşime ve ailesine ve asistanlık eğitim süresinde dünyaya göz açarak hayatımıza renk katan sevgili çocuklarıma sonsuz teşekkür ederim.
İÇİNDEKİLER TEŞEKKÜR ... i İÇİNDEKİLER ... ii KISALTMALAR ... iii TABLOLAR DİZİNİ VE ŞEKİLLER ... v 1.GİRİŞ VE AMAÇ ... 1 2.GENEL BİLGİLER ... 2
2.1. Aferez tanımı ve tarihçesi ... 2
2.2. Aferez sınıflaması ... 2
2.3. Aferez cihazları çalışma yöntemleri ... 6
2.4. Terapötik Aferezin Amaçları ve Etki Mekanizmaları ... 8
2.5. Plazma değişimi işleminde hedef ve süreler ... 10
2.6. Plazma değişim işlemi sonrası kan bileşenlerindeki değişiklikler ... 12
2.7. Plazma değişiminde kullanılan replasman sıvıları ... 14
2.8. Plazma değişim endikasyonları ... 16
2.9. Plazma değişimi komplikasyonları ... 28
3.MATERYAL METOD ... 30 4.BULGULAR ... 32 5.TARTIŞMA ... 39 6.SONUÇ ... 46 7.ÖZET ... 47 8.KAYNAKLAR ... 48
KISALTMALAR
AA: Aplastik Anemi
ALL: Akut Lenfoblastik Lösemi AML: Akut Miyeloblastik Lösemi
Anti-GBM: Anti-Glomeruler Bazal Membran ANCA: Anti-nötrofilik sitoplazmik antikor
ASFA: American Society for Apheresis (Amerikan Aferez Derneği) EKF: Ekstrakorporeal Fotoferez
FSGS: Fokal Segmental Glomerülosklerozlu GBS: Gullian Barre Sendromu
HLA: İnsan lökosit antijeni; HÜS: Hemolitik üremik sendrom İA: İmmunadsorbsiyon;
İVİG: İntravenöz İmmunglobülin KF: Kaskad Filtrasyonu
KML: Kronik Miyeloid Lösemi
KMML: Kronik Miyelomonositik Lösemi KT: Kemoterapi
KTHL: Kutanöz T Hücreli Lenfomadır
LDL: Low Density Lipoprotein (Düşük dansiteli lipoprotein) MG: Myastenia Graves
MM: Multipl Miyelom
OİHA: Otoimmün hemolitik anemi RPGN: Rapidli Progresif Glomerulonefrit SESA: Saf Eritroid Seri Aplazisi
SS: Sezary Sendromu
SLE: Sistemik Lupus Eritematoz
STEC: Shiga Toksini (verositotoksin) üreten Escherichia Coli TA: Terapötik aferez
TPD: Terapötik Plazma Değişimi
TPD –YH: Terapötik plazma değişimi -yüksek hacimli TMA: Trombotik Mikroanjiopati
TTP: Trombotik Trombositopenik Purpura vWF: von Willebrand Faktör
TABLOLAR DİZİNİ
Tablo 2.1. Terapötik aferez ile plazmadan uzaklaştırılan patolojik maddeler ... 9
Tablo 2.2. Plazma değişimi işlemlerinde hedef ve süreler ... 10
Tablo 2.3. 70 sabit rakamı yerine Toplam Kan Hacmi (TKH) hesabında Glicher’in 5’ler kuralı (ml/kg) kullanılır ... 11
Tablo 2.4. Plazma değişimi işlemlerinde teorik etkinlik ... 12
Tablo 2.5. Bir plazma değişim işlemi sonrası kan bileşenlerindeki değişiklikler ... 12
Tablo 2.6. Bazı plazma proteinlerinin dağılım ve metabolik özellikleri ... 14
Tablo 2.7. Replasman sıvılarının karşılaştırılması ... 14
Tablo 2.8. Taze Donmuş Plazmanın Koagülasyon Parametreleri ... 15
Tablo 2.9. Terapötik aferez prosedürleri 2016 ASFA (American Society for Apheresis) Endikasyonları ... 17
Tablo 2.10. Renal, Romatizmal Hastalıklar İçin Terapötik Aferez... 26
Tablo 2.11. Plazma değişimi komplikasyonları ... 29
Tablo 4.1. Malignite ve/veya KT öyküsü olmayan TPD uygulanan hastalar ... 32
Tablo 4.2. TPD uygulanma endikasyonları, hasta sayısı, ASFA kategorisi, mortalitesi ... 33
Tablo 4.3. TPD hastalarında mortalite prediktörleri Univarite Analizi ... 34
Tablo 4.4. TPD hastalarında mortalite prediktörleri Multivarite Analizi... 35
ŞEKİLLER Şekil 1. Santrifüj yaparak hücre ayırma yöntemi ... 7
Şekil 2. Plazma filtreleriyle yapılan plazmaferez yöntemi ... 8
Şekil 3. Çoklu Değişkenli Logistic Regresyon analizinde Delta-NLR- Mortalite ilişkisi ... 36
Şekil 4. Çoklu Değişkenli Logistic Regresyon analizinde Delta-MPV-Mortalite ilişkisi ... 37
1. GİRİŞ VE AMAÇ
Aferez; kanın bir komponentinin alınıp, geri kalanının hastaya veya donöre geri verilmesi işlemi olarak tanımlanmaktadır. Hemaferezis, aferezis ile eş anlamlı olarak kullanılmaktadır. Hemaferez; bir kan komponentinin uzaklaştırılması ve kalanının donöre veya hastaya geri verilmesi işlemi, ilk kez 1666’da Dr. Richard Lower tarafından deneysel olarak köpeklerde uygulanmıştır. Sitaferez kanın hücresel elemanlarının ayrılıp, geri kalanının hastaya veya donöre verilmesi işlemidir. Plazmaferez; plazmanın otomatik, seçici olarak çıkarılmasını ifade etmek için kullanılan genel bir terimdir. Plazmaferez, çoğunlukla, transfüzyon için sağlıklı kan vericilerinden plazma toplamak için kullanılır. İlk kez 1902’de Fransa ve 1914’de Rusya’da uygulanmıştır. Terapötik plazma değişimi (TPD), aferez cihazı kullanımı ile büyük hacimlerde hasta plazması alınması ve bunun yerine uygun replasman sıvılarının konması işlemidir. TPD‘nin başlangıcı olarak 1960’da Hiperviskozite Sendromu’nun tedavisinde Solomon ve Fahey’in TPD’ni kullanması kabul edilebilir. TPD’nin esas olarak amacı; çeşitli hastalıkların patogenezinde etkin olan plazma bileşenlerinin azaltılarak patolojik sürecin organizmaya verdiği zararın azaltılması veya bu zararın bir ölçüye kadar geri döndürülmesidir. Plazmada bulunan ve hastalık patogenezinden sorumlu olan çeşitli maddelere örnek olarak monoklonal proteinler, kriyoglobulinler, immünkompleksler, lipoproteinler, oto/allo antikorlar ve toksinler verilebilir.
Yoğun Bakım hastalarında immun aktive durumlar, sepsis, makrofaj aktivasyon sendromu, trombotik mikroanjiopati ve dissemine intravasküler koagulopati gibi hayatı tehtit eden patolojilerde plazmaferez hayat kurtarıcı tedavi seçeneğidir. Bu hastalarda spesifik olmayan klinik belirti ve laboratuvar bulguların varlığı bir çok hastada geç tanı konulmasına ve hastanın kaybedilmesine neden olmaktadır. İmmun aktivasyon durumlarında plazmaferez hem aktif inflamasyonu azaltan, hem de tanıya gidişe ve spesifik tedavi verebilmeye olanak sağlayan önemli bir tedavi yöntemidir.
Bu çalışmada, İç Hastalıkları Yoğun Bakım Ünitesi’nde, 2010-2017 yılları arasında hematolojik ve/ve ya onkolojik maligniteler dışında, immun aktivasyon durumları nedeniyle yatırılarak, TPD uygulanan hastaların demografik verilerini, başlangıç ve sonlanım laboratuvar verilerini incelemeyi ve hasta sağkalımını etkileyen faktörleri saptamayı amaçladık.
2. GENEL BİLGİLER 2.1. Aferez Tanımı ve Tarihçesi
Aferez; kanın bir komponentinin alınıp, geri kalanının hastaya veya donöre geri verilmesi işlemi olarak tanımlanmaktadır. Hemaferezis, aferezis ile eş anlamlı olarak kullanılmaktadır. İlk kez 1666’da Dr. Richard Lower tarafından deneysel olarak köpeklerde uygulanmıştır (1).Sitaferez kanın hücresel elemanlarının ayrılıp, geri kalanının hastaya veya donöre verilmesi işlemidir. (1).Plazmaferez; plazmanın otomatik, seçici olarak çıkarılmasını ifade etmek için kullanılan genel bir terimdir. Plazmaferez, çoğunlukla, transfüzyon için sağlıklı kan vericilerinden plazma toplamak için kullanılır.İlk kez 1902’de Fransa ve 1914’de Rusya’da uygulanmıştır. Terapötik plazma değişimi (TPD), aferez cihazı kullanımı ile büyük hacimlerde hasta plazması alınması ve bunun yerine uygun replasman sıvılarının konması işlemidir. TPD‘nin başlangıcı olarak, 1960’da Hiperviskozite Sendromu’nun tedavisinde Solomon ve Fahey’in TPD’ni kullanması kabul edilebilir (1-3).
2.2. Aferez Sınıflaması 2.2.1. Uygulanan kişiye göre:
A - Terapötik Aferez ( Hastaya tedavi amaçlı işlem yapılması )
Sitaferez (sitoredüktif lökoferez, trombositaferez vb.)
Komponent değişimi (terapötik plazma değişimi ve eritrosit değişimi)
Plazma immünomodulatuar tedavi (lipid aferezi, ekstrakorporeal fotoimmünoterapi)
B - Donör Aferezi (Sağlıklı vericiden kan komponenti toplanması)
Plazmaferez, trombositaferez, granülositaferez, kök hücre aferezi gibi (3, 4)
2.2.2. Aferez sırasında uzaklaştırılan komponente, yapılan işleme göre (5-7) A - Sitaferezis :
Sitaferez dolaşımda bulunan hücresel elemanların uzaklaştırılması veya toplanması amacıyla uygulanan işlemin genel adıdır.
1- Lökoferez: Lökoferez donör veya hastalarda lökosit toplanması ve uzaklaştırılması için yapılan aferez işlemlerine verilen genel addır.
a) Terapötik lökoferez: Lökosit sayısının >50.000-100.000/ mm3‟ün üstündeki değerler
hiperlökositoz olarak tanımlanır. Aşırı yüksek lökosit sayısı ile birlikte klinik bulguların (dispne, hipoksi, taşikardi ve merkezi sinir sistemi bulguları gibi) varlığına ise lökostaz sendromu denir. Çoğalma indeksi yüksek hematolojik habis hastalıklarda görülebilmektedir. Lökostaz riskleri en çok akut miyeloblastik lösemi (AML), akut monositik lösemi, kronik miyelomonositik lösemi (KMML) ve kronik miyeloid löseminin (KML) blastik krizi veya akselere fazında izlenmektedir. Terapötik lökoferezin yararı, lökostaza neden olan malign lökositlerin uzaklaştırılmasıdır (8). Akut ve kronik lösemilerde, lenfomanın lösemik fazında önerilir. Lökostaz tablosunun varlığında lösemik hücreleri hızlı bir şekilde azaltmak için acil lökoferez endikasyonu vardır (8). Lökosit sayısı >100.000/ mm3olan AML‟li hastalarda erken dönemde lökostazı izleyerek gelişen intraserebral kanama ve/veya pulmoner lökostazla ilişkili solunum yetmezliğine bağlı olarak, yüksek ölüm oranı söz konusudur. Bu hastalarda tek bir lökoferez işlemi ile lökosit sayısında %20-60 azalma sağlanabilir. Lökostaz bulguları olmayan ancak, lökosit sayısı >100.000/ mm3 olan AML‟li hastalarda terapötik lökoferez uygulanması erken ölümleri belirgin oranda azaltabilir. Blastların büyüklük farkı nedeniyle hiperlökositozlu akut lenfoblastik lösemili (ALL) hastalarda lökostaz ve erken ölüm sıklığı AML‟ye göre belirgin olarak daha azdır. Kronik myelositer lösemide 1960-70‟li yıllarda aralıklı, uzun süreli lökoferez tedavi amacıyla uygulanmıştır. Splenomegali gerileyebilir, konstitüsyonel semptomlar düzelebilir. Fakat kronik lökoferez yaşam süresini uzatmayacağı gibi, blastik transformasyonun başlangıcınıda geciktirmez. Günümüzde çok daha etkin tedavi yöntemleri nedeniyle KML‟de bu tedavi yaklaşımı geçerli olmasa da özellikle KML‟nin akselere veya kronik fazındaki hiperlökositozlu veya KMML‟li lökostaz açısında yüksek riskli olan bu hastalarda lökoferez uygulanabilir. Gebelikte KML tanısı alan hastalarda, gebelik boyunca uygulanan lökoferez ile hastalığa ait bulgular, belirgin bir yan etki olmaksızın kontrol altında tutulabilir. Kronik lenfositer lösemili (KLL) hastalarda lökosit sayısı >400.000/ mm3 olmadıkça lökostaza ait klinik tabloların gelişimi nadirdir. Tekrarlanan lökoferez işlemleri ile çevresel kandaki lökosit sayısındaki azalmaya paralel olarak lenfositlerdeki azalmaya genellikle lenf bezi, dalak boyutlarında ve kemik iliği infiltrasyonunda azalmada eşlik edebilir; anemi ve trombositopenide düzelme gözlenebilir (9).
b) Granülosit Aferezi: Uzayan nötropenilerde fatal enfeksiyonların tedavisi amacı ile sağlıklı
dönerlerden granülosit toplanması işlemine denir. Sık kullanılan bir yöntem değildir.
c) Periferik Kök Hücre Aferezi: Solid organ tümörleri, akut ve kronik lösemilerde otolog ve
d) Lenfosit Aferezi: Allojenik hematopoietik hücre nakli sonrası donör lenfosit infüzyonu
amaçlı veya koruyucu bağışık yanıtın cevap vermediği ana dokunun tahribatı ile sonuçlanan hastalıkların tedavisinde lenfositleri uzaklaştırılmasıdır. Kök hücre nakilleri dışında romatoid artrit ve multipl sklerozda kullanılmaktadır (5-7,10).
2- Eritrosit Aferezi: Hastanın ya da gönüllü vericinin kanını tıbbi bir cihazdan geçirmek
sureti ile kırmızı kan hücrelerini kanın diğer bileşenlerinden ayıran, uzaklaştıran bir işlemdir (6,7,10). Bu yöntem daha çok polistemili hastalarda Htc düzeyini hızlı bir şekilde düşürmek gerektiğinde kullanılır (9).
3- Trombosit Aferezi:
a) Terapötik Trombosit Aferezi: Hastanın kanından, kanının tıbbi bir cihazdan geçirilmek
sureti ile trombositlerinin ayrılarak toplandığı ve hastanın kalan kanının kolloid ve/veya kristaloid solüsyon gibi replasman sıvısı eklenerek ya da eklenmeden tekrar geri verildiği tedavi amaçlı bir işlemdir.
b) Donör Trombosit Aferezi: Özellikle trombositopeni nedeni ile kanama riski yüksek
lösemi hastalarında transfüzyon amacıyla sağlıklı donörlerden konsantre trombosit hazırlanmasıdır (5-7,10).
B-Komponent Değişimi :
1-Terapötik Plazma Değisimi: Terapötik plazma değişimi (TPD), aferez cihazı kullanımı ile
büyük hacimlerde hasta plazması alınması ve bunun yerine uygun replasman sıvılarının konması işlemidir. TPD tipik olarak, monoklonal immunglobulinler (paraproteinler), otoantikorlar, immunkompleksler, lipidler ve toksinler gibi bir hastalıkla ilişkili olan zararlı maddeleri içerebilen plazmayı uzaklaştırmada kullanılır (8,11). Plazma değişimi ile immünkomplekslerin plazmadan uzaklaştırılmasının, diğer tedavi yaklaşımlarının yetersiz kaldığı durumlarda ek tedavi olarak yararlı olduğu kabul edilmektedir. Monoklonal immünglobulinler plazma viskozitesini arttırarak kardiyovasküler sisteme, solunum sistemine ve merkezi sinir sistemine ait bulgularına, böbrek yetmezliğine, ağır vakalarda akut tubuler nekroza ve kanama problemlerine neden olabilirler. Hiperviskoziteye bağlı olarak gelişen bütün bu yaşamı tehlikeye sokan organ yetmezliklerinin kısa sürede düzeltilmesi TPD ile mümkündür. Çeşitli zehirler, ilaçlar ve toksinler plazma değişimi ile hastanın plazmasından uzaklaştırılabilir(11).
2-Terapötik Eritrosit Değişimi: Terapötik eritrosit değişiminde hasta olan eritrositler
sağlıklı verici eritrositleri ile değiştirilir. Terapötik eritrosit değişimi orak hücreli aneminin tedavisinde yaygın olarak kullanılmaktadır (9). Yaşamsal risk yaratan vazo-oklüziv krizler sırasında, patolojik HbS konsantrasyonunu düşürüp HbA düzeyini arttırarak oraklaşma olayını sona erdirmek için “exchange” transfüzyon yapılır. Geniş volüm “exchange” transfüzyon zor ve zaman isteyen bir tekniktir. Aferez sonrası Htc, geçici hiperviskoziteden sakınmak için %30‟un üzerinde olmamalıdır. Bu olgularda hemorajik enfarkt gelişebildiğinden pıhtılaşma faktörlerinde azalmadan sakınmak için işlem, TDP ile desteklenmelidir. Uzun süreli transfüzyon ihtiyacı olan hastalarda eritrositaferezis demir birikimini önlemesi ile de önemli bir avantaj sağlar. Eritrositaferez, parazit yükü yüksek ve serebral, renal, pulmoner komplikasyonları olan malaryalı hastalarda başarıyla uygulanmıştır (9).
C-İmmunoterapi / Plazmamodulator Tedavi:
1- İmmunadsorbsiyon: Hastanın kanından ayrılmış plazmasını, immunoglobulinlerini
uzaklaştırmak için tıbbi bir cihazdan geçirmek sureti ile aktif bileşenine (örn. stafilokok protein A, poliklonal antikorlar, triptofan fenilalenin immobilize polivinilalkol jel) spesifik olarak bağlayarak uzaklaştırma kapasitesi olan bir işlemdir (5).
2- LDL Aferezi: Kandaki düşük yoğunluklu lipoproteinlerin seçilerek uzaklaştırılması ve
kalan bileşenlerin tekrar geri verilmesidir. LDL kolesterolünü uzaklaştırabilen yüke bağlı dekstran sülfat-selüloz adsorbsiyonu, boyut bağımlı double membran filtrasyonu (DFPP), lipoproteinlerin tam kandan direk adsorbsiyonu (DALI), düşük pH-da çökelti oluşumu heparin bağımlı ekstrakorporeal LDL presipitasyonu (HELP) veya anti-Apo B-100 antikorlarıyla immuno-adsorpsiyon gibi çeşitli yöntemler çalışan araçlar mevcuttur (12).
3- Kaskad Filtrasyon/ Duble filtrasyon plazmaferez-DFPP: Temelinde‗‘Filtrasyon
Selektif Ayırma‘‘ işlemlerinden olan KF ve DFPP, birer terapötik plazmaferez işlemi olup, birbirinden işleme tabi tutulacak plazmanın filtre veya santrifüj ile ayrılmasına göre farklılık gösterir. Plazma filtre ile ayrılırsa işlem DFPP, santrifüj ile ayrılırsa KF olarak adlandırılır. Etki olarak birbirlerine yakın olmakla beraber hasta ihtiyacına ve/veya endikasyona ve/veya teknik ve aferez merkezi cihaz altyapısına göre uygun olan metot kullanılabilir (5).
4-Reoforez: Hastanın kanından ayrılmış plazmasını, kan reolojisini olumsuz etkilediği
gibi) uzaklaştırmak/arındırmak için tıbbi bir cihazdan geçirmek sureti ile tekrar dolaşıma döndürüldüğü terapötik bir işlemdir.
5-Ekstrakorporeal fotoferez: Hastanın kanından buffy-coat’un ayrıldığı; fotoreaktif bir
bileşenle ultraviyole A ışığına maruz bırakılarak (örn. fisoralen) ekstrakorporeal olarak tedavi edildiği ve ardından aynı işlem esnasında geri verildiği terapötik bir işlemdir. Fisoralen ve UVA birlikte hücre mitoz inhibisyonu, T hücrelerinde antijenik değişim, monositlerden TNF alfa salınımı ve dentritik hücre modifikasyonu yaparak terapötik etkinlik sağlar. Kullanımı ilk kez derinin T hücreli lenfomasında gündeme gelmiş, giderek otoimmun hastalıklar, transplantasyonda rejeksiyon ve graft-versus-host hastalığı ve tedavinin problem oldugu daha birçok klinik durumda kullanılmaya başlanmıştır (13).
2.3. Aferez Cihazları Çalışma Yöntemleri A. Santrifüj Tekniği
Bu yöntemde kanın komponentlerine ayrılması, santrifuj sırasında oluşan merkez kaç kuvvetinin etkisi ile özgül ağırlıkları birbirinden farklı olan kan hücreleri ve plazmanın ayrılması prensibine dayanır. Bir tüp içinde kan santrifuj edilecek olursa özgül ağırlıklarına göre hafiften ağıra doğru plazma, trombosit, mononükleer hücre, granülosit ve eritrosit olarak sıralanır (Şekil 1).
Alınan kan, komponent ayrımının gerçekleştirileceği santrifüj bölgesine gönderilir. Üretici firmaların kendi cihazları için geliştirdikleri değişik şekillerde dizayn edilmiş santrifuj bölümleri bulunmaktadır ve cihazlara göre çanak (bowl), ayırım odacığı (seperation chamber), tübüler kasnak gibi farklı isimler ile betimlenmektedirler. Santrifüj yönteminde iki farklı teknik vardır: aralıklı akım tekniği (intermittan akım), sürekli akım tekniği. Devamlı akım yöntemi kullanan cihazlarda donörden ve hastadan alınan kan alma işlemi süreklilik göstermektedir. Aralıklı akım yöntemi ile çalışan cihazlarda ise yüksek hacimlerde ve aralıklarla alınan kan santrifüj edilerek komponentlerine ayrılmaktadır.
Bu yöntemde uzaklaştırılan proteinlerin molekül ağırlıklarının bir üst sınırı yoktur. Kan akım hızı dakikada 90-150 ml civarındadır ve plazma filtreleri ile yapılan plazmafereze göre düşüktür. Bu yöntemle yapılan plazmaferezin önemli bir dezavantajı ise trombositlerin % 50 kadar azalabilmesidir (3,4,14,15).
Şekil 1. Santrifüj yaparak hücre ayırma yöntemi.
B. Filtrasyon tekniği
Plazma filtreleriyle yapılan plazmaferezde ise Porları 0,2-0,5 μm olan filtreler kullanılır (Şekil 2) (15). Bu yöntemde plazma membrandan geçerken hücreler eş zamanlı olarak hastaya döner. Tüm immünglobulinler membranı geçerken bazı büyük immün kompleksler ve kriyoglobülinler yeterince temizlenmez (16). Önemli bir avantajı ise bu yöntemde trombosit kaybının olmamasıdır (17). Kan akımı 90-200 ml/dk’dır ve daha yüksek kan akımlarında plazma süzülme hızında artış olmazken hemoliz riskinde artış ortaya çıkar (16).
Şekil 2. Plazma filtreleriyle yapılan plazmaferez yöntemi.
C. Adsorbsiyon İle Ayırma;
Tam kan ya da plazmadaki hastalığa yol açan patolojik yapıların uzaklaştırılmasıdır. Santrifüj ve filtrasyon yöntemlerine affinite kromotografi prensibi eklenerek spesifik zararlı yapılar vücut dışına alınır. Bu sistemde bir matriks içinde bulunan antijen, antikor, dextran sülfat ya da heparin gibi maddeler kandaki spesifik yapıları bağlayarak uzaklaştırır (18).
2.4. Terapötik Aferezin Amaçları ve Etki Mekanizmaları
Terapötik aferezde amaç, plazmada bulunan zararlı maddelerin (monoklonal immünglobülinler, otoantikorlar, immün kompleksler, inflamasyon mediatörleri vb.) ve sayıca artan kan şekilli elemanlarının azaltılması, volüm yükü yaratmadan büyük miktarda plazma replasmanı yapılması (trombotik trombositopenik purpura, sepsis vb.), kan şekilli elemanlarının değiştirilmesidir (eritrosit değişimi ) (19). Lökaferez, trombositaferez, plazma değişimi sitotoksik ya da immünsüpresif tedavinin hızla etkili olamadığı bazı hastalıkların hayatî tehlike yaratan kriz durumlarında, alevlenmeyi bastırmak açısından etkin ve dolayısıyla da vakit kazandırıcı tedavi yöntemleridir (19). Terapötik plazma değişimi işlemindeki amaç ise çeşitli hastalıkların patogenezinde etkin olan plazma bileşenlerinin azaltılarak patolojik sürecin organizmaya verdiği zararın azaltılması ve ya bu zararın bir ölçüye kadar geri döndürülmesi ve eksiklerinde çeşitli patolojik durumlara, hastalıklara neden olan plazma faktörlerinin yerine konulmasıdır. Plazmada bulunan ve hastalık patogenezinden sorumlu olan çeşitli maddelere örnek olarak monoklonal proteinler, kriyoglobulinler, immünkompleksler, lipoproteinler, oto/allo antikorlar ve toksinler verilebilir (4,19)(Tablo 2.1).
Tablo2.1. Terapötik aferez ile plazmadan uzaklaştırılan patolojik maddeler (20)
Patolojik maddeler Hastalıklar
İmmünglobulinler Hiperviskozite Sendromu
Waldenström Makroglobulinemisi Multple Myelom
Otoantikorlar Myastenia Gravis
Anti-GBM Hastalığı
Sistemik Lupus Eritematozus Sistemik vaskülitler
Faktör VIII inhibitörleri
Trombotik Trombositopenik Purpura
Lipoproteinler Hiperkolesterolemi
Lökositler Hiperlökositozlu Lökostaz
Trombositler Ciddi Trombositoz
Anormal kırmızı hücreler Orak hücre anemi
Dolaşan immünkompleksler İmmünkompleks Glomerülonefritleri Sistemik Lupus Eritematozus Sistemik vaskülitler
Poteine bağlı maddeler ve toksinler Tiroid fırtınası
Amanita phalloides toksinleri
Hiperparazitemi Sıtma, Babesiozis
Terapötik aferezin etki mekanizması kimi hastalıklar için çok açıkken, bazı hastalıklarda halen bilinmemektedir. Goodpasture ve Guillian-Barré sendromları, otoimmün anemi gibi hastalıklarda otoantikorların uzaklaştırılması, sepsis (inflamatuvar mediatörlerin ortamdan uzaklaştırılması) ve dissemine intravasküler koagülasyonda (eksik olan plazma faktörlerinin yerine konulması) ise büyük miktarda plazma replasmanı yoluyla etki gösterirken, Reye sendromu, parakuat zehirlenmesi gibi bazı durumlarda etki mekanizması belirlenememiştir (19). Terapötik aferezin, retiküloendotelyal sistem aktivasyonu ile immün komplekslerin plazmadan daha hızlı temizlenmesini sağladığı, sitokinleri de plazmadan uzaklaştırarak immün regülasyonu değiştirdiği ve bu şekilde çeşitli hastalıklar üzerinde tedavi edici etki gösterdiği düşünülmektedir (21,22). Steroid bağlayıcı proteinleri azaltarak steroidlerin etkinliğinin artması da, terapötik aferezin etki mekanizmalarından bir diğeridir (23). Terapötik aferez ile LDL’nin plazmadan uzaklaştırılabilmesi yanında, oksidasyonunun da azaldığı gösterilmiştir (24).
2.5. Plazma değişimi işlemlerinde hedef ve süreler
Toplam plazma değişimi sayısı ve sıklığından çesitli klinik durumlardaki hastaların ne kadar yarar göreceği açık olarak hesaplanmamıştır. Her hasta için bu karar, hastanın klinik durumuna ve laboratuvar verilerine göre verilir. Genel olarak, dolaşan immün kompleksler, myelom proteinleri, Ig G ve Ig M tipi antikorlar uzaklaştırılmak istendiğinde birkaç hafta süreli, haftada 3 kez plazma değişimi gerekebilir. Plazma değişimi süresi, laboratuvar verileri ve klinik durum gözönüne alınarak, kademeli olarak azaltılarak kesilir. Trombotik trombositopenik purpura (TTP) ve Guillain-Barre sendromu (GBS) gibi akut durumlarda günlük plazma değişimi, hastanın kliniği düzelene ve hastalığın akut fazı geçene kadar yapılmalıdır (Tablo 2.2). Plazma değişimi sıklığı ve değiştirilecek olan plazma volümü, doktorun vereceği karara bağlıdır ve hastadan hastaya değişebilir (25,26).
Tablo 2.2 Plazma değişimi işlemlerinde uygulama sıklığı, hedef ve süreler
Aferez işlemi öncesi bazı hesaplamaların yapılması gereklidir. Bu hesaplamaları çoğu aferez cihazı otomatik olarak yapmakla birlikte teorik olarak bilinmesinde de fayda vardır. Toplam plazma hacmi, değiştirilecek olan plazma hacmini hesaplamada kullanılır. Plazma volümü aşağıdaki formül kullanılarak hesaplanabilir (27).
Plazma volumü (mL) = 70 x VA (kg) x (1 - hematokrit)
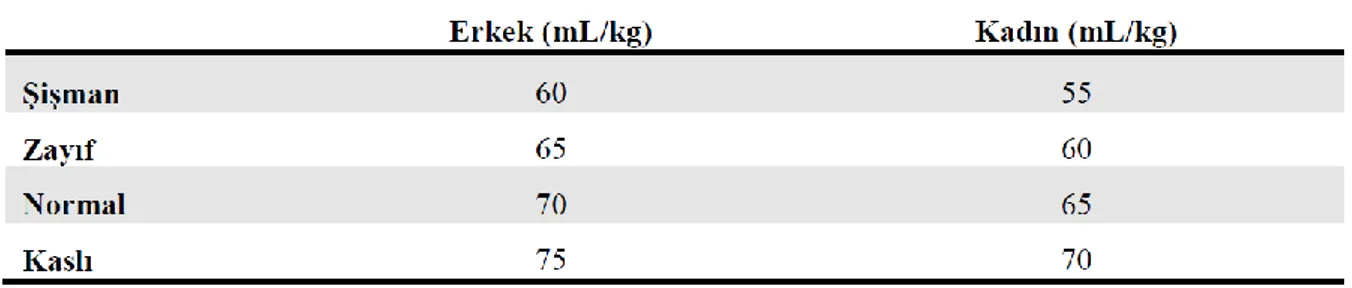
Örnek olarak VA 70 kg, Htc:%40 olan bir kişide plazma volümü=70x70x(1-0,40)=2940 millilitredir. Albümin düzeyini 3,5 gr/dL yapmayı planlarsak 29,4(dL)x3,5=102,9 gr albümin ihtiyacı vardır.Yani %20 lik 100cc human albümin flakondan 5 adet bir plazma değişimi için gerekli olan albümin miktarıdır. TDP kullanılacaksa 1 ünite TDP 250 cc olduğundan 2940/250=11,76 yani 12 ünite TDP’ye ihtiyaç vardır. 70 sabit rakamı yerine Toplam Kan Hacmi (TKH) hesabında Glicher’in 5’ler kuralı (ml/kg) da kullanılır (Tablo 2.3).
Tablo 2.3. Toplam Kan Hacmi (TKH) hesabında Glicher’in 5’ler kuralı (ml/kg)
Standart protokollerde genellikle hesaplanan plazma hacminin 1,0-1,5 katı kullanılır. Bu uygulama ile tek seansta plazmadan arındırılmak istenen patolojik proteinlerin %60 (50-80)’ı uzaklaştırılmış olur. Çeşitli durumlarda, hesaplanan volümün 2-3 katına çıkılır. Ekstrakorporeal dolaşımda bulunan hacim işlem sırasında hiçbir zaman %15’i geçmemelidir. İşlem sırasındaki hematokrit en az %25 olmalıdır (8).
Aferez işlemleri, her biri kullanılacak olan cihaz için özel olarak üretilmiş, tümü steril, tek kullanımlık setler ile yapılmaktadır. Başarılı bir TPD işlemi öncelikle uygun bir damar yolu gerektirir. Bu nedenle TPD uygulanacak olan hastanın yeterince büyük periferik venlere sahip olması yoksa hastaya çift lümenli bir santral venöz yol yerleştirilmesi gerekir. Bu işlemler sırasında hasta veya donörün geniş çaplı bir toplar damarına girilerek kan, hızı ayarlanabilen bir pompa aracılığı ile alınmakta ve bu sırada antikoagulan bir solüsyon (genellikle; asit-sitrat-dekstroz: ACD-A) ile sabit bir oranda karıştırılarak sistemde kanın pıhtılaşması önlenmektedir. TPD işlemi sırasında antikoagülan olarak sitrat kullanıldığında, sinoatrial noda direkt infüzyonu kardiyak aritmilere yol açabileceğinden kateter yerleşiminde radyografik komfirmasyon kritik öneme sahiptir (28).
Aferez işlemi sadece intravasküler kompartmanda yapılır ve tedavinin etkinliği sıralanan parametrelere bağlıdır: 1. İşlenen kan hacmine, 2.Her işlemde değiştirilen plazmanın hacmine, 3. Yapılan işlemlerin toplam sayısına ve değişim sıklığına, 4. Hücreler veya plazma bileşenlerinin mobilize olabilme, dengelenme ve tekrar sentezlenme hızlarına (29).
Laboratuvar değerlendirmesi, ulaşılmak istenen değerlerin ve işlem sayısının belirlenmesi için çok önemlidir. Her terapotik plazma değişimi işlemi öncesinde bazal tam kan sayımı, serum protein elektroforezi, koagülasyon ve serum elektrolit değerlerinin tespit edilmesi gereklidir. Ancak bu şekilde tedaviye olan yanıtın yeterliliği değerlendirilebilir (29).
2.6. Plazma değişim işlemi sonrası kan bileşenlerindeki değişiklikler
Bir maddenin intravasküler kompartmandaki miktarı; o maddenin plazma konsantrasyonu ve plazma volümü yardımı ile bulunabilir. Plazmadan uzaklaştırılmak istenen faktörler biliniyorsa; “ plazma değişim miktarı: plazma volümü x konsantrasyonu” formülü ile hesaplanabilir (4,25,30).
Tablo 2.4. Plazma değişimi işlemlerinde teorik etkinlik (4);
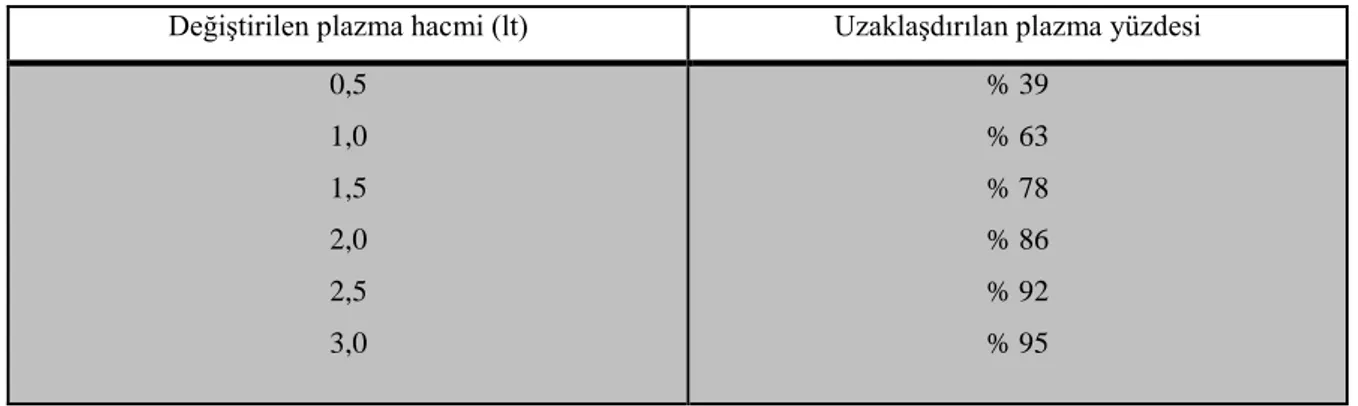
Değiştirilen plazma hacmi (lt) Uzaklaşdırılan plazma yüzdesi 0,5 1,0 1,5 2,0 2,5 3,0 % 39 % 63 % 78 % 86 % 92 % 95
Eğer sözkonusu olan madde ağırlıklı olarak intravasküler kompartmanda bulunuyorsa, TPD ile ortamdan temizlenme hızı, birim zamanda değiştirilen plazma hacmine bağlıdır. Plazma değişimi öncesi ve sonrası alınan örnekler plazma faktörlerindeki düşüşün yüzdesi hakkında bilgi verirler (Tablo 2.5).
Ekstravasküler alanın büyüklüğü, ekstravasküler kompartmandaki faktörlerin miktarı bilinmemektedir. Ekstravasküler alanın intravasküler kompartmandan üç kat veya daha fazla olabileceği belirtilmekte ayrıca plazma faktörlerinin de kapiller membrandan geçiş hızları bilinmemektedir.
Plazmadan uzaklaştırılması istenen maddenin intravasküler (örn. Ig M, Fibrinojen, α-2- makroglobulin) veya ekstravasküler (örn. albumin ve Ig G) kompartmanda yoğunlaşması önemlidir. Bu nedenle plazma proteinleri gibi yeni sentezlenen çözünebilir maddelerin büyük oranda intravasküler boşluğa geçtiği bilinmektedir. Çözünebilir bir madde vücuda intravasküler kompartman yoluyla sentez hızında girerken, aynı madde intravasküler kompartmandan katabolizma hızı ile uzaklaştırılır. İntravasküler kompartmandan ekstravasküler kompartmana doğru olan hareket esas olarak diffüzyon yoluyla olurken, çok küçük molekül ağırlıklı maddeler ise transmembran akımı kullanır. Çözünebilen maddeler ekstravasküler kompartmandan intravasküler kompartmana ise esas olarak lenfatik sistem aracılığı ile geri dönerler (30-32). Plazma değişimi, çözünebilen maddeleri direkt olarak intravasküler kompartmandan uzaklaştırır. Sentez ve katabolizma hızı belirli bir denge halindedir ve kompartmanlar arasındaki hareket çok yavas olmaktadır. Bu yüzden intravasküler kompartman, çözünebilir içeriği replasman sıvıları ile değiştirilebilen izole bir sistem olarak kabul edilir. Bazı plazma proteinlerinin dağılım ve metabolik özellikleri Tablo 2.6’da sıralanmıştır. Bu tablodan yola çıkarak, tek bir plazma değişimi işlemi ile ağırlıklı olarak intravasküler kompartmanda yer alan Ig M, fibrinojen ve α–2 makroglobulin’in, ağırlıklı olarak ekstravasküler kompartmanda yer alan albumin ve Ig G’ye göre daha büyük oranda uzaklaştırılması mümkün olmaktadır (30-33).
Tablo 2.6. Bazı plazma proteinlerinin dağılım ve metabolik özellikleri (33)
2.7. Plazma değişiminde kullanılan replasman sıvıları
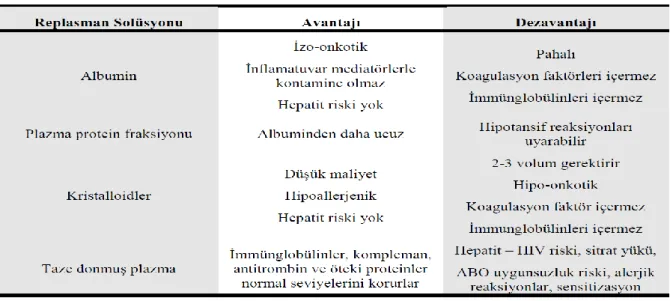
Plazma değişimi işlemi ile vücuttan uzaklaştırılan sıvının, volüm eksikliğini önlemek amacıyla, yerine konulması gereklidir. Replasman amacıyla kullanılan sıvıların her birinin avantajları ve dezavantajları vardır (Tablo 2.7) (26,30). Başlıca üç çeşit replasman sıvısı kullanılmaktadır; Albumin (%5 albumin ve %0.9 serum fizyolojik karışımı), taze donmuş plazma, hidroksietilstarch (HES). Plazma değişimi işlemlerinde kullanılan replasman sıvılarının avantaj ve dezavantajları Tablo 2.7’de sunulmuştur.
Tablo 2.7. Replasman sıvılarının karşılaştırılması
Albumin (%5 albumin ve %0,9 serum fizyolojik karışımı): Günümüzde çoğu merkezde kullanılmakta olan standart replasman sıvısıdır. Viral bulaşım riskinin olmaması ve
anafilaksi riskinin minimal olması en önemli avantajlarıdır. Bununla beraber hiperonkotik olması nedeniyle görece dilüsyonel bir anemiye neden olması, prekallikrein aktive edici faktör varlığına bağlı hipotansif ataklar oluşması, koagülasyon faktörlerinin azalmasına bağlı olarak işlem sonrası koagülopati oluşturabilmesi, nadiren pirojenik reaksiyonlar meydana gelmesi ve pahalı bir ürün olması ise dezavantajlarıdır (Tablo 2.7).
Taze donmuş plazma (TDP): Trombosit agregasyonunu inhibe eden bir protein sağladığı için özellikle TTP ve HÜS’da tercih edilen taze donmuş plazma kullanımı ile vücut dışına alınan plazma proteinlerinin replasmanı sağlanmış olur. Ucuz ve idamesinin kolay olması ise en önemli avantajlarıdır. Bununla beraber komplikasyon sıklığı albuminden daha fazladır. Komplikasyonlara örnek olarak rölatif olarak yüksek enfeksiyon bulaşma riski, sitrata bağlı parestezi oluşması (sitratın serbest kalsiyumu bağlaması nedeniyle), kas krampları, ürtiker, ender olarak anaflaktoid reaksiyon riski sayılabilir (Tablo 2.7). Ayrıca plazma bileşenlerine karşı antikor geliştiği için bazı hastalarda uzun süreli kullanımı sakıncalıdır. Fibrinojen, Faktör V, Faktör VII, Faktör VIII, Protein C ve Protein S taze donmuş plazmanın içerdiği bazı koagulasyon parametreleridir(Tablo 2.8).
Tablo 2.8. Taze Donmuş Plazmanın Koagülasyon Parametreleri
Kriyopresipitat: TDP’nin +4ºC’de eritilerek süpernatanın ayrılması ile elde edilir ve – 20ºC’de 1 yıl saklanabilir. FVIII, FXIII, fibrinojen ve fibronektin içerir. FVIII eksikliği, von Willebrand hastalığı, hipofibrinojenemi tedavisinde kullanılır. Bir ünite kriyopresipitat en az
80 Ü FVIII, 150 mg fibrinojen ve yaklaşık 15 mL plazma içermelidir. Kriyosüpernatan plazma ise TDP’nin +4ºC’de eritilerek kriyopresipitattan ayrılması ile elde edilir. Özellikle refrakter TTP vakalarında oldukça faydalıdır.
Hidroksietilstarch (HES): 450,000 kD ağırlığında bir molekül olan hetastarch, albumine ek olarak kullanılabildiği gibi son yıllarda tek başına da kullanılabileceği gösterilmiştir. Albumine göre en önemli avantajı fiyatı olup ürtikeryal ve pruritik ataklar daha fazla gözlenir. Eğer 24 saat içinde 200 mL/kg’dan daha fazla kullanılırsa Faktör VIII ile etkileşerek koagülopatiye sebep olabilir. Ender olarak baş ve sırt ağrılarına rastlanır ve eliminasyon yarı ömrü çok uzundur (26,30).
2.8. Plazma değişim endikasyonları
Plazma değişimi işlemi birçok nörolojik, hematolojik, immunolojik hastalıklarda, böbrek hastalıklarında, hiperlipidemiler (seçilmiş vakalarda), ilaç intoksikasyonları vb. durumlarda yaygın olarak kullanılmaktadır. American Society for Apheresis (ASFA) göre, terapötik aferezin endike olduğu hastalıklar 4 kategori altında toplanmıştır (34).
Kategori I: Terapötik aferezin ya tek başına veya diğer tedavi modelleriyle birlikte ilk sıra
tedavi olarak kabul edildiği hastalıklardır.
Kategori II: Terapötik aferezin ya tek başına veya diğer tedavi modelleriyle birlikte ikinci
sıra tedavi olarak kabul edildiği hastalıklardır.
Kategori III: Terapötik aferezin, optimum rolünün belirlenemediği hastalıklardır. Bu
kategorideki uygulamalar olguya özgünleştirilmelidir.
Kategori IV: Yayımlanmış kanıtlara göre aferezin etkisiz veya zararlı olduğunun gösterildiği
veya öne sürüldüğü hastalıklar. Bu durumdaki aferez tedavi uygulamaları sadece onaylı araştırma protokolleri altında yapılmalıdır.
Kanıt
Kanıt derecesi 1: Güçlü öneri.
Kanıt derecesi 2: Zayıf öneri
Kanıt kalitesi A: Yüksek kaliteli kanıt.
Kanıt kalitesi B: Orta kalite kanıt.
Tablo 2.9. Terapötik aferez (TA) prosedürleri
2016 ASFA (American Society for Apheresis) endikasyonları (34)
Endikasyon Modaliteler Kategori Kanıt
Renal, Romatizmal hastalıklarda TA ANCA ilişkili RPGN
Diyaliz bağımlı TPD I 1A
Diyaliz bağımsız TPD III 2C
Diffüz alveolar hemoraji TPD I 1C
Anti-GBM Hastalığı
Diyaliz bağımlı ve diffüz alveoler hemoraji yok
TPD III 2B
Diyaliz bağımsız TPD I 1B
Diffüz alveolar hemoraji TPD I 1C
Sistemik lupus eritematozus
Nefrit TPD IV 1B
Şiddetli (örneğin serebrit, diffüz alveoler hemoraji)
TPD II 2C
Henoch-Schönlein purpurası: Kresentik veya şiddetli ekstrarenal hastalık
TPD III 2C Kriyoglubolinemi şiddetli/semptomatik TPD İA II II 2A 2B Vaskülitler
Behçet hastalığı Adsorpsiyon granülositaferez TPD
II III
1C 2C Eozinofilik granülomatoz polianjitis
(EGPA)
TPD III 1B
Hepatit B virüsü ile ilişkili poliarteritis nodoz (HBV-PAN)
TPD II 2C
İdyopatik poliarteritis nodoza (PAN) TPD IV 1B
İg A nefropatisi
Kronik progresif TPD III 2C
Kresentik TPD III 2B
Fokal segmental glomeruloskleroz
Transplant böbrekde rekürrens TPD I 1B
Nativ böbrekte steroid dirençli LDL aferezi III 2C
Nefrojenik sistemik fibrozis TPD
EKF
III III
2C 2C Böbrek transplantasyonu, ABO uyumlu
Antikor aracılı ret veya duyarsızlaştırma, canlı donor TPD İA I I 1B 1B Kadavra, duyarsızlaştırma TPD İA III III 2C 2C Böbrek transplantasyonu, ABO uyumsuz
Antikor aracılı ret TPD
İA
II II
1B 1B Canlı donör, duyarsızlaştırma TPD
İA
I I
1B 1B Skleroderma (sistemik skleroz) TPD
EKF III III 2C 2A Dermatomiyozit/polimiyozit TPD EKF IV IV 2B 2C Endokrin, Hepatobiliyer ve diğer patolojik durumlarda TA
Akut karaciğer yetmezliği TPD
TPD-YH
III I
2B 1A
İlaç aşırı dozu veya zehirlenme TPD III 2C
Familial hiperkolesterolemi
Heterozigot LDL aferezi II 1A
Homozigot LDL aferezi I 1A
Homozigot küçük kan hacimi ile TPD II 1C
Hashimoto ensefalopati: otoimmün tiroiditle ilişkili steroid yanıtlı ensefalopati
TPD II 2C
Hipertrigiseridemik pankreatit TPD III 2C
Mantar zehirlenmesi TPD II 2C
Sıtma, şiddetli Eritrosit değişimi III 2B
Babesiosis, şiddetli Eritrosit değişimi II 2C
Periferik vasküler hastalık LDL aferezi II 1B
Hepatobiliyer hastalık ilişkili pruritus, tedaviye dirençli
TPD III 1C
Çoklu organ yetmezliği ile sepsis TPD III 2B
Tiroid fırtınası TPD III 2C
Toksik epidermal nekrolizis, refrakter TPD III 2B
Wilson hastalığı, fulminan TPD I 1C
Hematolojik hastalıklarda TA
Hemoliz, karaciğer enzim yükseliği ve düşük trombosit (HELLP) sendromu
Antepartum TPD IV 2C
Postpartum TPD III 2C
Herediter hemokromatoz Eritrositaferez I 1B Hiperlökositoz
Semptomatik Lökositaferez II 1B
Profilaktik Lökositaferez III 2C
Hematopoietik hücre nakli, HLA duyarsızlaştırma TPD III 2C
Hematopoietik hücre nakli, majör ABO uyumsuzluğu (alıcı anti-A veya anti-B antikorlarına sahiptir)
Kemik iliğindeki kök hücreler TPD II 1B
Periferik kandaki kök hücreler TPD II 2B
Hematopoietik hücre nakli, minör ABO
uyuşmazlığı (verici anti-A veya anti-B antikorlarına sahiptir), periferik kan kök hücreleri
Eritrosit değişimi III 2C
İmmun trombositopeni (İTP): Refrakter TPD İA
III III
2C 2C
Monoklonal gamopati hiperviskozite ile TPD I 1B
Myelom cast nefropatisi TPD II 2B
Polisitemiya vera Eritsositaferez I 1B
Saf kırmızı hücre aplazisi TPD III 2C
Orak hücreli anemi
Transfüzyonel aşırı demir yüklenmesini önleme ve ya inme profilaksisi
Eritrosit değişimi I 1A
Akut göğüs sendromu, şiddetli Eritrosit değişimi II 1C
Akut inme Eritrosit değişimi I 1C
Multi-organ yetmezliği, gebelik, priapizm, tekrarlayan vazookluziv ağrı atakları, dalak veya hepatik sekestrasyon
Eritrosit değişimi III 2C
Preoperativ Eritrosit değişimi III 2A
Trombositoz
İkincil veya profilaksi Trombositaferez III 2C
Semptomatik Trombositaferez II 2C
Trombotik trombositopenik purpura (TTP): Edinilmiş, otoimmün TPD I 1A Trombotik mikroanjiopati Koagülasyon aracılı: THBD (trombomodulin) mutasyonu TPD III 2C
Kompleman aracılı: Kompleman faktör gen mutasyonları
TPD III 2C
Kompleman aracılı: Faktör H otoantikorları
Kompleman aracılı: Membran kofaktör proteini (MCP) mutasyonları
TPD III 1C
İlaç-ilişkili: Kalsinörin inhibitörleri TPD III 2C
İlaç-ilişkili: Klopedogril TPD III 2B
İlaç-ilişkili: Gemsitabin ve ya kinin TPD IV 2C
İlaç-ilişkili: Tiklopidin* TPD I 2B
Hematopoietik kök hücre nakli ile ilişkili TPD III 2C
Shiga toksini aracılı, Streptococcus pneumonia
TPD III 2C
Shiga toksini aracılığı ağır nörolojik semptomlarla birlikte TPD İA III III 2C 2C Şiga toksini aracılığı şiddetli nörolojik
semptomların olmadan
TPD IV 1C
Paraproteinemik demiyelinizan nöropatlar / kronik olarak edinilen demiyelinizan polinöropatiler
Anti-MAG nöropati TPD III 1C
IgA, IgG TPD I 1B
IgM TPD I 1C
Multifokal motor nöropati TPD IV 1C
Multiple myelom TPD III 2C
Amiloyidozis, sistemik Beta-2 mikroglobulin kolonu TPD
II IV
2B 2C
Aplastik anemi TPD III 2C
OİHA
Şiddetli soğuk aglutinin hastalığı TPD II 2C
Şiddetli sıcak OİHA TPD III 2C
Kutanöz T hücreli lenfoma; mukozis fungoides ; Sezary sendronu
Eritrodermik EKF I 1B
Non-eritrodermik EKF III 2C
Koagülasyon faktör inhibitörleri
Alloantikor TPD İA IV III 2C 2B Otoantikor TPD İA III III 2C 1C Graft-versus-host hastalığı akut EKF II 1C kronik EKF II 1B
Hematolojik Hastalıklarda Terapötik Aferez
Hematolojik hastalıklar terapötik aferez tekniklerinin kullanıldığı hastalıkların başında gelmektedir. Bu endikasyonların başında, TTP gelmektedir. TTP, mikroanjiopatik hemolitik anemi, trombositopeni ile ateş, nörolojik bulgular ve böbrek yetmezliğinin eşlik ettiği nadir ve fatal seyreden bir hastalıktır. Tüm olguların ancak % 40'ında bu pentad görülebilir. % 80‟ni triad şeklinde ortaya çıkar. ADAMTS13‟teki moleküler defektler, ADAMTS13‟ün antikor aracılı yetmezliği ve von Willebrand Faktör (vWF) multimerlerinin parçalanamaması bu hastalığın santral patofizyolojik temelini oluşturmaktadır. ASFA, TTP‟de, TPD‟yi kategori I endikasyon olarak önermektedir (9). Plazmaferez TTP‟de en önemli tedavidir ve standart olarak kabul edilmektedir. Bununla birlikte, tedaviye hemen başlamak önemlidir. Amaç; zararlı olan büyük multimerlerin ve inhibitörlerin kaldırılması, eksik olan bileşenlerin yerine konulmasıdır. Günlük 40 ml/kg plazma değişimi (plazma hacminin 1-1,5 katı) hasta yanıt verinceye kadar devam edilir. Yanıt olarak, böbrek yetmezliğinin ve nörolojik bozuklukların düzelmesi, Laktat dehidrojenaz (LDH) seviyesinin normal veya normale yakın olması ve trombosit sayısının yükselmesi kabul edilmektedir. Klinik yanıt ortalama 1 haftada görülürken, tam iyileşme 3 haftada tamamlanmaktadır. Birinci haftada düzelme olmazsa, plazmaferez günlük 2 defa yapılabilir ya da plazma hacminin 1,5 katı olacak şekilde devam edilir. Yanıt elde edildikten sonra nüksleri önlemek için, plazmafereze trombosit sayısının 150.000/ mm3 geçmesini takiben 2 gün daha devam edilmelidir. Böbrek bozuklukları hematolojik ve nörolojik bozukluklara göre daha yavaş düzelmektedir. Trombotik mikroanjiopati kemik iliği transplantasyonu, solunum yolu enfeksiyonu, gebelik, otoimmün hastalıklar ve siklosporin, kinin, mitomisin-c gibi bazı ilaçların kullanımına bağlı olarak görülebilir. ASFA, Trombotik mikroanjiopatiyi esas olarak kategori III endikasyon olarak betimlemekte ve TPD önermektedir (9). Shiga toksini (verositotoksin) üreten Escherichia coli (STEC) ilişkili hemolitik üremik sendrom (HÜS) çocuklarda ortaya çıkan, akut başlangıçlı mikroanjiopatik hemolitik anemi, böbrek yetersizliği ve trombositopeni ile tanımlanan bir trombotik mikroanjiopati nedenidir. STEC-HÜS‟de diare sık görülmekte (9).ASFA, TPD’’yi nörolojik semptomları olmayan STEC-HÜS’’de kategori IV olarak betimlemekte ve önermemektedir, kompleman ilişkili gen mutasyonuna bağlı apitik HÜS’’de kategori III olarak, Faktör H’’a karşı gelişen otoantikorlara bağlı HÜS’’de ise kategori I olarak betimlemekte ve önermektedir (34). Multipl miyelom (MM) plazma hücrelerinden köken alan klonal bir hastalıktır. MM hastalarının %15-20‟sinde akut böbrek yetersizliği görülür. Böbrek yetersizliğinin en önemli nedeni hafif zincirlerin renal distal tübüllerde birikmesidir.
Diğer nedenler ise amiloidoz, hiperkalsemi, hiperürisemi, yineleyen üriner enfeksiyonlardır (9). ASFA, MM‟ye bağlı gelişen cast nefropatisi tedavisinde TPD‟yi kategori II endikasyon olarak önermektedir (34). Genel olarak önerilen plazmaferez rejimi 7-10 gün içerisinde 5-7 değişimi içeren yaklaşımdır. Plazmaferez süresi serum serbest hafif zincir seviyesi rehberliğinde belirlenmelidir. Ayrıca plazmaferez tedavisine serbest hafif zincir üretimini baskılayan deksametasone içeren kemoterapi (KT) rejimleri eklenmelidir.Serbest hafif zincir ölçümünün başlangıç plazmaferez rejimi tamamlandıktan 1-2 gün sonra yapılması uygun olacaktır. KT yeni zincir oluşumunu engellemişse genellikle 5-7 kez yapılan plazmaferez yeterli olmaktadır. (35). Hiperviskozite sendromu, WM‟li hastaların %50-70‟inde ve MM‟li hastaların %5‟inde monoklonal immünglobulinlerin endoteli zedeleyerek, kapiller kan akımını engellemesi ile gelişen iskemi ve organ işlev kusurudur. IgM‟nin molekül ağırlığı daha fazla olduğu için WM‟li hastalarda hiperviskozite sendromuna daha sık rastlanır. Hiperviskozite sendromu klinik baş ağrısı, baş dönmesi, nistagmus, işitme ve görme kaybı, somnolans, koma ve nöbetler gibi nörolojik semptomlar, mukozal kanamalar ve retinopati, nadiren kalp yetersizliği, halsizlik, iştahsızlık ve periferik nöropatiyi kapsar. ASFA, monoklonal gamopatiye bağlı hiperviskozite sendromu tedavisinde TPD‟yi kategori I endikasyon olarak önermektedir.Yerine koyma sıvısı olarak albumin ile her gün 1-1,5 plazma hacmi TPD plazma viskositesini hızla azaltarak hiperviskozite semptomlarında hızlı bir düzelme sağlar. (9). Stupor, koma gibi ağır nörolojik hastalığı olan hastalarda plazmaferez acil olarak yapılmalıdır (36). Bir plazma volümü değişimi günlük olarak semptomlar kayboluncaya veya serum viskozitesi normale gelinceye kadar devam edilmelidir. IgA veya IgG ilişkili sendromlarda bu Ig’ler ekstravasküler alanda da yer aldığından daha yüksek volümlü ve tekrarlayan plazmafereze gereksinim olabilir (37). Plazmaferez hastalığın ilerleyişini etkilemez, diğer tedaviler verilmeden sadece plazmaferez yapılırsa semptomlar 2-3 hafta içinde tekrarlar. Dolayısıyla primer hastalığın tedavisi için gerekli yaklaşımlar (Kemoterapi vb.) yapılmalıdır (38.). POEMS (polinöropati, organomegali, endokrinopati, monoklonal protein, deri bulguları) sendromunda ve önemi bilinmeyen monoklonal gamopatide polinöropati sıktır. MAG (Myelinassociated glycoprotein) ve GM-1 (Ganglioside M1) gibi periferik sinir antijenlerine karşı oluşan antikorlar periferik nöropatiden sorumlu tutulmaktadır. ASFA, TPD‟yi IgG/A demiyelinizan polinöropatide kategori I, IgM polinöropatisinde (± WM) kategori I, MM‟ye bağlı polinöropatide kategori III (34) olarak önerirken POEMS‟de kategori IV olarak görmektedir (9). Otoimmün hemolitik anemide (OİHA) eritrositlere karşı gelişen otoantikorlar nedeni ile hemoliz gelişir. Halsizlik ve sarılık temel bulgulardır. Eritrosit I/i antijenlerine karşı oluşan IgM yapısındaki antikorların neden
olduğu soğuk aglütinin hastalığı düşük derecelerde (4- 18°C) aglutinasyona yol açar. Çoğunlukla enfeksiyonlar ve lenfoproliferatif hastalıkların seyrinde izlenir. Eritrositlerin Rh antijenlerine karşı oluşan IgG yapısındaki sıcak antikorların oluşturduğu hemolizde ise, reaksiyon 37 °C‟de ortaya çıkar. %30‟u idiopatik olup lenfoproliferatif, otoimmün hastalıklar seyrine ya da ilaçlara bağlı görülür. OİHA tedavisinde hemolizin durdurulması amacıyla kortikosteroidler ve diğer immünsüpresifler, vinka alkaloidleri, danazol, IVIG, rituksimab ve splenektomi kullanılır. Plazmaferez, otoantikorları uzaklaştırrarak semptomatik düzelme sağlar. ASFA, sıcak OİHA tedavisinde TPD‟yi kategori III endikasyon olarak önermektedir (9). Aplastik anemi (AA) ve saf eritroid seri aplazisi (SESA) hematopoetik kök hücre hastalıkları olup ve çoğu idiopatik ve edinseldir. AA‟da çoğunlukla üç seri de tutulur. Pansitopeni ve kemik iliğinde hipo/asellülerite saptanır. SESA‟da yalnız eritroid seri etkilenir ve normositer-normokrom anemi, retikülositopeni, kemik iliğinde eritroid seri öncü hücrelerinde ileri derecede azalma saptanır. Her iki hastalığın temel tedavisinde immünsupresif ilaçlar kullanılmaktadır. ASFA, AA ve SESA tedavisinde TPD‟yi kategori III endikasyon olarak önermektedir (9). İdiyopatik/immün trombositopenik purpurada (İTP), sıklıkla GPIIb/IIIa ve daha az olarak GPIb/IX, GPIa/IIa ve GPIV gibi trombosit antijenlerine karşı oluşan otoantikorların bu antijenlere bağlanarak trombosit yıkımına yol açması ile kanamaya yatkınlık ortaya çıkar. Kanama semptomları olan ve trombosit sayısı <20-30.000/ mm3 hastalarda başta steroid ilk basamak tedavisidir. Acil durumlarda IVIG kullanılabilir (9). ASFA, refrakter ITP‟de TPD‟yi kategori III olarak görmektedir (34). Eritrosit içi parazitler (malarya, babesiozis) eritrosit değişiminden yararlanan hasta grubundandır. Ağır babesioziste ASFA eritrosit değişimini kategori II, ağır malaryada ise kategori III endikasyon olarak sınıflandırmaktadır (34). Eritrosit değişimi keza orak hücre hastalığında akut inme tedavisinde de ASFA‟ya göre kategori I endikasyondur (9). Hematolojik hastalıklarda aferez yöntemlerinin yeri Tablo 2.9‟de toplu olarak verilmiştir (9). Mycosis fungoides (MF) ve onun lösemik formu olan Sezary sendromu (SS) en sık görülen kutanöz T hücreli lenfomadır (KTHL). Eritrodermik KTHL‟lı ve özellikle periferik T hücre klonu veya Sezary hücreleri, lenfositlerin %10‟undan fazla olan ve/veya CD4/CD8 oranı >10 olan tüm hastalar günümüzde EKF adayıdır. Erken evre hastalarda tek başına EKF etkinliği %33-88 olarak bildirilmiştir (Kategori I). Non-eritrodermik KTHL olgularında EKF kategori III düzeyinde endikedir (9).
Renal, Romatizmal, Otoimmun ve Metabolik Hastalıklar İçin Terapötik Aferez Goodpasture Hastalığı
Goodpasture hastalığında temel tedavi plazmaferez ile birlikte yapılan immünosüpresif tedavidir (39-41). ASFA tarafından plazmaferez bu hastalıkta kategori-I olarak önerilmektedir (42). İmmünosüpressif tedavi yeni antikor oluşumunu baskılarken, plazmaferez dolaşımdaki antikorları ve kompleman gibi diğer inflamasyon mediatörlerini uzaklaştırır. Bir çalışmada, Goodpasture sendromlu 9 hastaya sadece immünosupresyon, 8 hastaya ise immünosupresyon ile birlikte plazmaferez tedavisi uygulanmıştır (43). Çalışmada plazmaferez grubunda hem anti GBM antikoru titreleri hem de serum kreatinini sadece immünosupressif alan gruba göre daha hızlı regrese olmuştur. Ancak başlangıçtaki renal biyopsideki kresent oranı ve bazal serum kreatinin düzeyi sonuçlarla tedavi modalitelerinden daha iyi korelasyon göstermiştir. Sonuç olarak; %30’dan daha düşük kresenti olanlar daha yüksek oranda kresenti olanlara göre, renal fonksiyonları daha iyi korumuşlardır. (43) Bir kısmı Goodpasture sendromlu hastalar iken diğerleri GN’li 71 hastayı içeren çalışmanın sonucunda; prednisolon, sitotoksik ilaçlar, plazmaferez diyalize girmeyen ve hemoptizisi olan hastaların durumunu iyileştirdiği saptanmıştır (39). Goodpasture Hastalığı tedavisiz bırakılırsa genellikle hızlıca son dönem böbrek yetersizliğine ilerler (44). Tedaviden en iyi yanıtı almak için erken teşhis önemlidir. Çünkü başlangıçtaki kresent oranı ve bazal kreatinin değeri sonuçlarla korelasyon gösterir. Tedavi başlangıcında diyaliz gereksinimi ortaya çıkmışsa böbrek iyileşmesi %10’nun altındadır. Böbrek hastalığından bağımsız olarak pulmoner hemorajili tüm hastalara, renal replasman tedavisi gerektirmeyen ancak böbrek tutulumu olan tüm hastalara ve hemoptizisi olmayan diyalize giren seçilmiş hastalara plazmaferez tedavisi önerilmektedir (Tablo 2.10) (34). Hemoptizi yokluğunda yüksek kresent oranlı diyalize giren hastalarda plazmaferez veya immünosüpresyonun riskleri, faydalarından fazla olabilir (44). Fakat yinede akut teşhis edilen hastalarda 2-3 haftalık kısa süreli deneme tedavisi düşünülebilir. Fakat bu hastalarda renal iyileşme ihtimalinin % 10’nun altında olduğu akıldan çıkarılmamalıdır (44). Uygulanacak plazmaferez rejimi olarak; günlük veya günaşırı dört litrelik plazma değişimi ve 2-3 hafta süre ile, replasman sıvısı olarak human albümin kullanılarak ancak yeni biyopsi yapılmış veya pulmoner hemorajisi olan hastalarda TDP ile plazmaferez yapılması önerilmektedir (39). Klinik durum ve anti-GBM antikoru titreleri seri olarak ölçülerek tedavi devamına karar verilir. Üç haftanın sonunda hastada hala hemoptizi varsa veya anti-GBM antikorları titresi yüksekse hemoptizi kayboluncaya veya titre anlamlı olarak düşünceye veya negatifleşinceye kadarplazmafereze devam edilir (44). Plazmaferez tedavisi sırasında enfeksiyon gelişen
hastalara intravenöz immünoglobulin (IVIG) (100-400 mg/kg) infüzyonun antibiyoterapiye ek olarak verilmesi uygun olacaktır (44).
Esansiyel Mikst Krioglobulinemi
İdiopatik mikst krioglobulinemide plazmaferez kategori I olarak önerilmektedir (Tablo 2.10) (42). Agressif tedavi primer olarak progressif böbrek yetersizliği, amputasyon gerektiren distal nekroz veya ileri nöropatisi olan ağır hastalara saklanmalıdır (45). Klinikle krioglobulin düzeyi korele değildir. Dolayısı ile tedavi kararı hastanın klinik tablosuna göre verilmelidir (46). Kontrolü çalışmalar olmamasına rağmen kontrolsüz gözlemsel çalışmalar bu tedavilerin plazma kreatinin düzeyini hastaların %55-87’sinde azalttığını göstermiştir (47,48). Haftada 3 gün bir plazma volümü değişimi ile plazmafereze 2-3 hafta devam edilmesi önerilmektedir (49). Replasman sıvısı olarak presipitasyonu önlemek için ısıtılmış %5 albümin kullanılır (50). Plazmaferez sonrası krioglobulin değişim yüzdesi ile klinik aktivite korelasyon göstermez (45). Başarılı plazmaferez purpurik lezyonlarda rezolüsyonu ve eğer plazma kreatinin düzeyi yüksek ise bazale inmesini sağlar (45). Ancak nöropati belirtileri kısa dönem tedaviye yanıt vermemektedir (45).
Kresentik Glomerülonefrit
Kresentik glomerülonefritin Tip 1 (Anti GBM antikor hastalığı), Tip 2 (immün kompleks RPGN’’ler Ig A nefropatisi, poststreptokoksik GN, lupus nefriti, esansiyel mikst krioglobülinemiyi içerir), Tip 3 (pauci-immun) ve Tip 4 (çift antikor pozitif) olmak üzere 4 tipi vardır (41). Pauci-immün RPGN’de plazmaferez kategori I olarak önerilmektedir (Tablo 2.10) (42). Pauci-immun RPGN’li hastalardan özellikle ağır böbrek yetersizliği olan veya ağır pulmoner hemoraji olan hastalara plazmaferez yapılması önerilmektedir (15). Mümkünse günlük, veya günaşırı dört litrelik plazma değişimi replasman sıvısı olarak albümin kullanılarak önerilir. Yeni biyopsi yapılmış veya pulmoner hemorajisi olan hastalarda TDP ile plazmaferez önerilir. Başlangıç plazmaferez tedavisi genellikle 2-3 hafta önerilmektedir. Klinik duruma göre tedavi devamına karar verilir.
Tablo 2.10. Renal, Romatizmal Hastalıklar İçin Terapötik Aferez
Hastalık Kategori Tedavi Önerilen Hastalar Plazmaferez Reçetelenmesi Replasman Sıvıları Plazmaferez Süresi Ek Tedaviler Goodpasture Hastalığı I Alveoler hemoraji, Diyaliz ihtiyacı olmayan hastalar Günlük veya günaşırı 4litre ile
Albumin, TDP 2-3 hafta İmmünsupressif (KS+SF) İVİG Kriyoglobulinemi I Ve ya II RPGN, distal nekroz ampütasyon ihtiyacı veya ileri nöropati
Haftada 3 gün 1 plazma hacmi Isıtılmış %5 human albumin 2-3 hafta İmmünsupressif (KS+SF) HCV’ye dikkat Pulmonorenal Sendrom I RPGN veya alveoler hemoraji Günlük veya günaşırı, 4litre
Albumin, TDP 2-3 hafta İmmünsupressif (KS+SF) Myelom
Böbreği
II Cast nefropatisi yeya monoklonal hafif zincir
yüksekliği
7-10gün içerisinde 5-7
seans
Albumin, TDP Hafif zincir düzeyine göre
Deksametazon İçeren KT protokolleri SLE II Ağır avleolar hemoraji
veya nörolojik tutulum
Albumin, TDP ?? İmmünsupressif (KS+SF) HÜS I Ve ya III HÜS şübhesi veya tanılı tüm hastalar Günlük 1 plazma hacmi TDP En az 7-10 seans, (trombosit ve hemoliz) Vasküler Rejeksiyon I Albumin, TDP En az 4, serum kreatinin %20-30 düşme İmmünsupressif rejimi değiştirilmesi, puls KS vb Yenilenen FSGS I Albumin, TDP Günlük en az 10 seans
KS: Kortikosteroid, SF: siklofosfamid, İVİG: İntravenöz İmmunglobulin, TDP: Taze Donmuş Plazma, FSGS: Fokal Segmental Glomerüloskleroz, HCV: Hepatit C Virüsü
Sistemik Lupus Eritematoz (SLE )
Şiddetli (örneğin serebrit, diffüz alveoler hemoraji) SLE’de plazmaferez kategori-II olarak önerilmektedir (Tablo 2.10). Bazı gözlemsel çalışmalarda (51) faydası desteklenmesine rağmen plazmaferezin lupus nefritinde immunosüpressif tedaviye ek katkı sağlamadığı randomize kontrollü çalışmalarda gösterilmiştir (52,53). Bununla beraber bu randomize çalışmalarda kresentik lupus nefritli hastalar ve ciddi böbrek bozukluğu olanlar (diyalize bağımlılık) dışlanmıştır. Plazmaferez ile sitotoksik tedavi ve sadece sitotoksik tedaviyi karşılaştıran çalışmalarda plazmaferez ile sitotoksik tedavide enfeksiyon ve ölüm gibi yan etkilerin daha fazla olduğu gösterilmiştir (54). Sistemik Lupuslu tüm hastalara rutin önerilmemekle birlikte diyaliz gerektiren ağır kresentik lupus nefriti, nörolojik tutulumu veya proliferatif lupus nefriti ile birlikte TTP veya antifosfolipid antikorları mevcut olan hastalara plazmaferez denenebilir (55). Hemolitik Üremik Sendrom (HÜS) Erişkin HÜS’ünde
plazmaferez veya plazma infüzyonu konusunda herhangi bir kontrollü çalışma yapılmamıştır. Fakat kontrolsüz seriler plazmaferezin yararını düşündürmektedir (56). Plazma değişimine günlük olarak trombosit sayısı normale gelinceye ve hemoliz kayboluncaya kadar (serum LDH normale gelinceye kadar) devam edilmesi önerilir (57,58). Genellikle remisyon için 7’den 16’ya kadar plazma değişimi gerekir (Tablo 2.10). Önerilen plazma değişim volümü bir plazma hacmidir (59). Başlangıçta diyaliz ihtiyacı olan hastaların çoğunda diyaliz ihtiyacı ortadan kalkmasına rağmen hastaların çoğunda renal fonksiyonlarda rezidü yetmezlik ve/veya dirençli hipertansiyon sebat eder (59,60). Trombositopeni ve hemoliz düzeldikten sonra plazmafereze devam etmenin rezidü renal yetmezlik üzerine etkileri bilinmemektedir. Trombosit sayısı normale geldiğinde plazmaferez kesilir veya aralıkları açılır. Ancak plazma değişimini aniden kesmenin veya kademeli olarak kesmenin etkileri tam olarak bilinmemektedir (61).
Plazmaferezin Renal Transplantta Kullanımı
Plazmaferez böbrek naklinde genellikle nakil öncesi Anti- HLA antikor Yüksekliği ve yüksek riskli fokal segmental glomerülosklerozlu (FSGS) hastalarda, transplantasyon sonrası ise vasküler rejeksiyon, tekrarlayan FSGS veya trombotik mikroanjiopati (TMA) durumlarında kullanılmaktadır (Tablo 10). Plazmaferezin bu hastalarda nasıl veya ne kadar süre kullanılacağına dair oluşmuş bir fikir birliği yoktur. Genellikle merkezler kendi deneyimlerine göre plazmaferez tedavisini uygulamaktadır. Bu konuda, daha önce yayınlanan bir derlemede plazmaferez tedavisinin böbrek nakli hastalarında ABO uyuşmazlığı durumunda, yüksek sensitize hastalarda transplant öncesi dönemde, akut humoral rejeksiyonlarda, tekrarlayan FSGS ve TMA olgularında diğer tedavilere ek olarak başarılı bir şekilde uygulanabileceği, ancak kronik humoral rejeksiyonlarda ise henüz etkinliği gösterilemediği vurgulanmıştır (62). Renal transplant hastalarında uygulanan diğer aferez çeşidi Ekstrakorporeal Fotoferezdir (EKF). Kortikosteroid ve antilenfosit globülin tedavisine rağmen, tekrarlayan biyopsilerle hücresel ve vasküler rejeksiyon gösterilmiş olgularda multipl EKF seanslarından sonra rejeksiyonun önlendiği gösterilmiştir (9).
Ailesel hiperkolesterolemide Terapötik Aferez
Ailesel hiperkolesterolemi; karaciğer apoliporotein gen mutasyonuyla tanımlanan otozomal dominant bir hastalıktır. Homozigotlarda 20 yaşından önce kardiyak nedenli ölüm sıktır. Heterozigotlarda erken ateroskleroz görülür. Bir seans LDL aferezi kolesterol düzeyini %50-60 düşürür ve aralıklı LDL aferez işlemleri koroner riski azaltır. ASFA kılavuzunda LDL aferezi homozigot olgularda Kategori I, heterozigot olgularda Kategori II güzeyinde önerilmektedir (9).
Nörolojik Hastalıklarda Terapötik Aferez
Miyastenia gravis (MG), TPD ile başarılı bir şekilde tedavi edilen ilk hastalıklardan biriydi. MG, genellikle klinik olarak kas güçsüzlüğü ve kas yorgunluğu ile karakterizedir. Okuler tutulum olduğu zaman diplopi ve pitozis ile sınırlı olabilir. MG motor son plaktaki asetilkolin reseptörlerinin alfa alt ünitesine karşı gelişen IgG antikorları tarafından oluşturulduğu saptanmıştır. MG‟de tekrarlayan TDP‟lerden sonra, plazma asetilkolin reseptörlerinin alfa alt ünitesine karşı gelişen antikor seviyelerinin azalmasıyla klinik iyileşme görülmektedir. ASFA tarafından Kategori I endikasyon sınıfına koyulmuştur. GBS, periferik siniri sistemini etkileyen akut, ilerleyici bir hastalıktır. Ayaklarda simetrik güçsüzlükle ve distal pareztezi ile başlar giderek kötüleşir, kollar ve yüzde de benzer şekilde tutulumlar takip eder. Genellikle akut üst solunum yolu ya da gastrointestinal sistem hastalığı ile ilişkilidir. GBS tedavisinde TPD‟nin yararı kontrollü çalışmalarda gösterilmiştir (63-65). TDP daha fazla yan etkiye neden olduğundan replasman sıvısı olarak albümin tercih edilir. Buna rağmen TDP ile değişim yapılanlarda, albumin ile değişim yapılanlara göre daha iyi cevap alındığını gösteren yayınlarda mevcuttur (66). GBS ASFA tarafından Kategori I endikasyon sınıfına sokulmuştur. Teknik ilerledikçe ve nörolojik hastalıkların immün etiyolojileri daha iyi anlaşıldıkça TPD yapılan hastaların sayısı artmıştır. Kronik inflamatuar demiyelizan polinöropati (CIDP), Lambert-Eaton miyastenik sendromu (LEMS), multipl skleroz (MS), nöromiyelitis optica (NMO), refsum hastalığı, rasmussen ensefaliti ve sydenham koresi ASFA tarafından TDP için kategorize edilmiştir (34).
2.9. Plazma değişimi komplikasyonları
Komplikasyon oranı TDP kullanılan hastalarda human albümin kullanılan hastalara göre daha yüksek (%20 e karşı %1,4) bulunmuştur (67). Bu komplikasyonlar arasında; hipotansiyon, dispne, allerjik reaksiyonlar, sitrat ilişkili hipokalsemi, özellikle böbrek yetersizliğinde sitrat ilişkili metabolik alkaloz, özellikle albümin kullanılan plazmaferezlerde
koagülasyon anormallikleri, Ig’lerin azalmasına bağlı enfeksiyon gelişimi,viral enfeksiyonların bulaş riski, ilaçların uzaklaştırılması ve kateterle ilgili komplikasyonlar sayılabilir (68,69). Anjiotensin konverting enzim inhibitörü (ACE) kullanan hastalarda özellikle albümin ile yapılan plazmaferezlerde flushing, hipotansiyon, abdominal kramp benzeri semptomlar saptanmıştır. Bu semptomların tam olarak sebebi bilinmemesine rağmen olasılıkla ACE inhibitörleri ile kinin artışı sorumlu gibi gözükmektedir. Bu durumdan kaçınmak için plazmaferezden 24 saat önce ACE inhibitörleri kesilmelidir (70). Mortalite 10,000’de 3 ila 5 civarındadır (68,69). Ölümler çoğunlukla solunum sistemi ve kardiyak sebeplere bağlıdır (71). Özellikle TDP kullananlarda aritmiye bağlı kardiyak ölümler sık gözlenmiştir. Ancak sebep sonuç ilişkisi kanıtlanamamıştır (72). Solunumsal sebeplerden nonkardiyojenik pulmoner ödem ölümden hemen önce gözlemlenmiştir. Tablo 2.10’da komplikasyonlar sunulmuştur (71).