T.C.
SELÇUK ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
NĠFEDĠPĠNE BAĞLI DĠġETĠ BÜYÜMESĠ OLUġTURULAN
RATLARIN PERĠODONTAL DOKULARINDA APOPTOZĠSĠN
ĠN SĠTU OLARAK ĠNCELENMESĠ
Cem MANGIROĞLU
DOKTORA TEZĠ
PERĠODONTOLOJĠ ANABĠLĠM DALI
DanıĢman
Prof. Dr. Mihtikar GÜRSEL
T.C.
SELÇUK ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
NĠFEDĠPĠNE BAĞLI DĠġETĠ BÜYÜMESĠ OLUġTURULAN
RATLARIN PERĠODONTAL DOKULARINDA APOPTOZĠSĠN
ĠN SĠTU OLARAK ĠNCELENMESĠ
Cem MANGIROĞLU
DOKTORA TEZĠ
PERĠODONTOLOJĠ ANABĠLĠM DALI
DanıĢman
Prof. Dr. Mihtikar GÜRSEL
Bu araĢtırma Selçuk Üniversitesi Bilimsel AraĢtırma Projeleri Koordinatörlüğü tarafından 09202060 proje numarası ile desteklenmiĢtir.
i
ii. ÖNSÖZ
Projemizi desteklediği için Selçuk Üniversitesi Bilimsel AraĢtırma Projeleri Kordinatörlüğü‟ne,
ÇalıĢmamız boyunca bilgi ve desteğini hiçbir zaman esirgemeyen değerli hocam S.Ü. Veterinerlik Fakültesi Histoloji Anabilim Dalı Öğretim Üyesi Prof. Dr. Ġlhami Çelik‟ e,
Doktora eğitimim boyunca hoĢgörü ile rehberlik eden danıĢman hocam Sayın Prof. Dr. Mihtikar Gürsel‟e,
Doktora eğitimim süresince bilgi ve deneyimlerini paylaĢtıkları için Prof. Dr. Tamer Ataoğlu, Prof. Dr. Nilgün Özlem Alptekin, Prof. Dr. Ġsmail Marakoğlu, Prof. Dr. Ġsmet Duran ve Prof. Dr. Sema Hakkı‟ya, baĢta Ahmet AfĢin Erbeyoğlu olmak üzere, tüm bölüm arkadaĢlarıma,
Canım anneme, babama ve abime,
Cesaret veren, destek olan, bugünlere beraber geldiğimiz eĢime sevgiyle
ii
iii. ĠÇĠNDEKĠLER Sayfa
SĠMGELER ve KISALTMALAR v
1.GĠRĠġ 1
1.1. Ġlaca Bağlı DiĢeti Büyümeleri 3
1.1.1. Ġlaca Bağlı DiĢeti Büyümelerinin Prevalansı 3 1.1.2. Ġlaca Bağlı DiĢeti Büyümelerinde Risk Faktörleri 4
YaĢ 5
Cinsiyet 6
Ġlaç DeğiĢkenleri 7
Kombine Kullanılan Ġlaçlar 7
Periodontal DeğiĢkenler 8
Genetik Faktörler 9
1.1.3. Ġlaca Bağlı DiĢeti Büyümesinin Patogenezi 10
1.1.4. DiĢeti Bağ Dokusu Homeostazisinde 11
Meydana Gelen Ġlaca Bağlı DeğiĢimler
1.1.5. Ġlaca Bağlı DiĢeti Büyümesinin Klinik Karakteristik Özellikleri 14 1.1.6. DiĢeti Büyümesi Yapan Ġlaçlar 14
1.2. Kalsiyum Kanal Blokörleri 15
1.2.1. Kalsiyum Kanal Blokörlerinin Farmakolojik Etkileri 16
1.2.2. Kalsiyum Haberci Sistemi 17
1.2.3. Kalsiyum Kanal Blokörlerinin Yan Etkileri 17
1.3. Nifedipin 17
iii
1.3.2. Endikasyonları 18
1.3.3. Kontraendikasyonları 18
1.3.4. Yan Etkileri 19
1.3.5. Nifedipine Bağlı DiĢeti Büyümesi 19
1.4. Apoptozis 21
1.4.1. Apoptozisin Fizyolojik Olaylar ve Hastalıklarla ĠliĢkisi 21
1.4.2. Apoptozis ve Nekrozis Morfolojisi 22
1.4.3. Apoptozisin Düzenlenmesi 24 Kalsiyum iyonu 25 p53 25 Bcl-2 gen ailesi 25 Kaspazlar 26 Mitokondrion 27 Perforin ve granzim 27 Fas-Fas Ligandı 27 1.4.4. Apoptozisin Tetiklenmesi 28
Ġçsel Sinyallerle Tetiklenen Apoptozis Mekanizması 28 DıĢsal Sinyallerle Tetiklenen Apoptozis Mekanizması 29
2. GEREÇ VE YÖNTEM 31
2.1. Deney Hayvanları 31
2.2. Deney Grupları 31
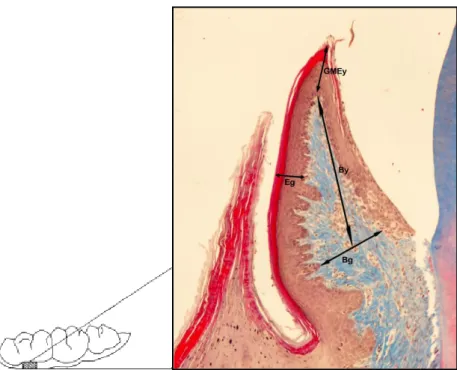
2.3. Doku Örneklerinin Alınması, Histololojik Takip, Bloklama 32 ve Kesit Alma ĠĢlemleri
iv
2.4. Histolojik Boyama ĠĢlemleri 32
2.4.1. TdT-Frag EL DNA Fragmentasyon Kiti ile 33
Apoptotik Hücrelerin Boyanması
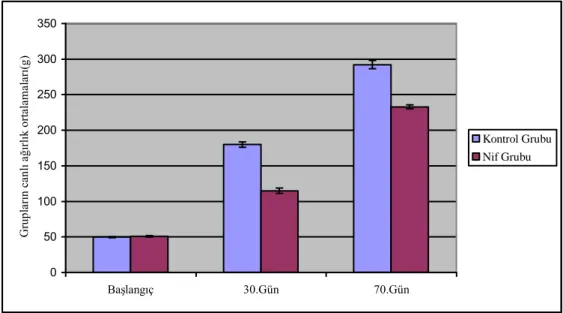
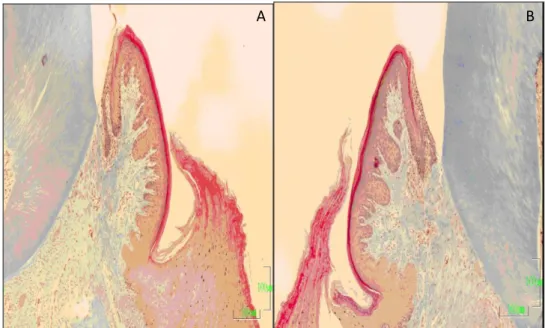
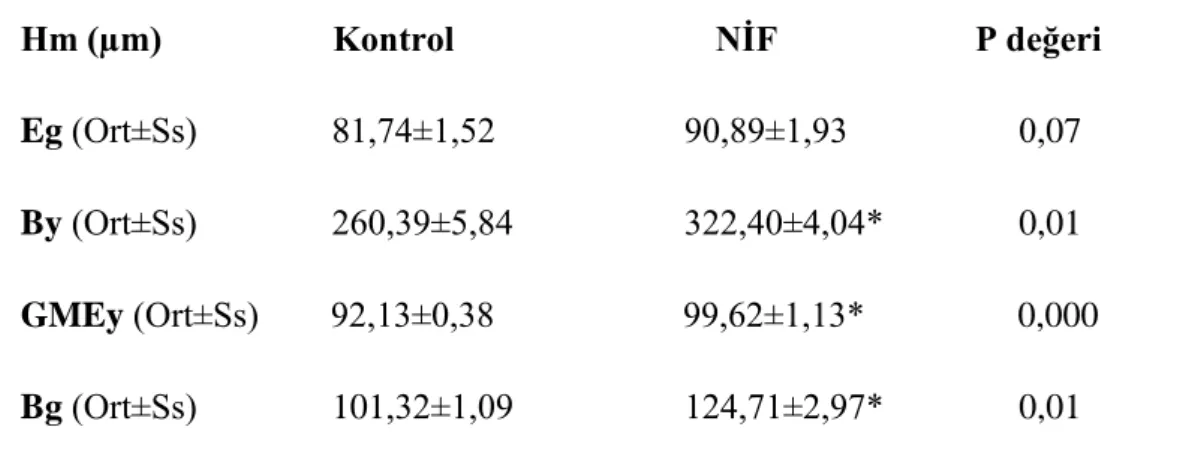
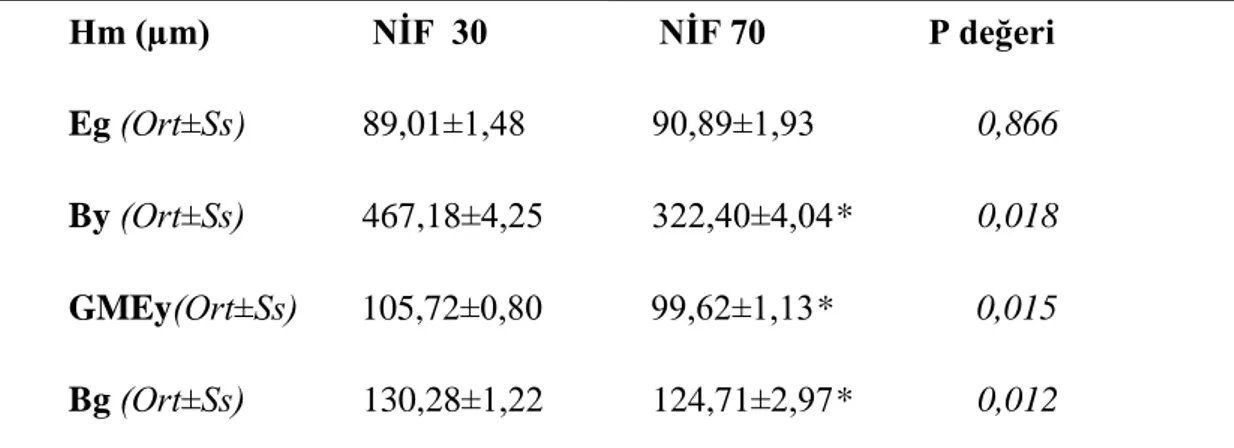
2.5. Histomorfometrik Analizler 34 2.6. Ġstatistiksel Analizler 35 3. BULGULAR 36 3.1. Klinik Bulgular 36 3.2. Histolojik Bulgular 37 3.3. Histomorfometrik Bulgular 39
3.4. Apoptotik Hücre Oranları 42
4. TARTIġMA 45 5. SONUÇ VE ÖNERĠLER 54 6. ÖZET 56 7. SUMMARY 57 8. KAYNAKLAR 58 9. EKLER 63
9.1. EK-A: Etik Kurul Kararı 63
v
iv. SĠMGELER ve KISALTMALAR
CsA: Siklosporin A DOS: DiĢeti oluğu sıvısı HLA: Ġnsan lökosit antijeni IL 6: Ġnterlökin 6
IL-1β: Ġnterlökin 1 beta
PDGF-B: Platelet-derived growth factor-B FGF-2 :Fibroblast growth factor-2
TGF-β :Transforming growth factor-β CTGF :Connective tissue growth factor TIMP: Tissue inhibitor of metalloproteinase MMP: Matriks metalloproteaz
Ca+2 : Kalsiyum iyonu CYP 450: Sitokrom P450
KTZ : Ketokonazol
TNF : Tümör nekrozan faktör AIF : Apoptosis Inducing Factor
APAF-1 : Apoptosis protease-activating factor 1 CTL: Sitotoksik T-lenfositler
NK: Naturel Killer (Doğal katil) hücreler RIP : Receptor interacting protein TBS : Tris tampon solüsyonu
4-HPPH: 5-(4-hydroxylphenyl)-5-phenylhydantoin KGF: Keratinosit büyüme faktörü
1
1.GĠRĠġ
Periodontal dokular (periodonsiyum), diĢeti, alveoler kemik, sement ve periodontal ligamentten oluĢur (Listgarten 1986, Albandar 2005). Periodontitis, bağ dokusu ataĢmanı ve alveoler kemik kaybıyla birlikte, bağlantı epitelinin apikale migrasyonu ile karakterize periodonsiyum enflamasyonudur (Ranney 1993). Klinik olarak; ataĢman kaybı, alveoler kemik kaybı, diĢeti ödemi, kanama, iltihabi eksuda gibi bulgularla teĢhis edilir. Bu destek doku yıkımı, spesifik anaerob gram(-) bakterilerle, immün yanıtı oluĢturan hücreler arasındaki etkileĢim sonucu gerçekleĢir (Genco 1992, Offenbacher 1996). Gingivitis ise diĢeti enflamasyonudur. DiĢeti kenarında kızarıklık, ĢiĢlik ve sondlamada kanama Ģeklinde enflamasyonun klinik bulgularının gözlendiği, ataĢman kaybına neden olmayan ve diĢeti ile sınırlı periodontal hastalıktır (American Academy of Periodontology 1989).
Gingival hastalıklar sınıflandırılması, hastalığın doğru teĢhisi ve doğru tedavi planı açısından önemlidir. Amerikan Periodontoloji Akademisinin 1989 yılında yapmıĢ olduğu sınıflandırmada bazı periodontal hastalıkların sınıflandırılmasında yaĢanılan sorunlar sonucunda periodontal hastalıkların sınıflandırılması uluslararası düzeyde tekrar değerlendirilmiĢtir.
1999 yılında “The International Workshop for a Classification of Periodontal Diseases and Conditions” baĢlığı altında Armitage tarafından periodontal hastalıkların günümüzde kullanılan sınıflandırılması yayınlanmıĢtır (Armitage 1999, Armitage 2002). Bu yeni sınıflandırmada “Gingival hastalıklar” baĢlığı altında yeni eklenen bölümün alt sınıfları aĢağıdaki Ģekilde yapılmıĢtır:
I. Gingival hastalılar
A. Dental plağa bağlı oluĢan gingival hastalıklar 1. Sadece dental plakla iliĢkili gingivitis
2. Sistemik faktörler tarafından modifiye edilenler 3. Ġlaçlar tarafından modifiye edilenler
a) Ġlaca bağlı gingival hastalıklar i. Ġlaca bağlı diĢeti büyümeleri ii. Ġlaca bağlı gingivitisler
2 B. Plağa bağlı olmayan gingival lezyonlar
II. Kronik periodontitis III. Agresif periodontitis
IV. Sistemik hastalıklarla iliĢkili periodontitis V. Nekrotizan periodontal hastalıklar
VI. Periodonsiyumun abseleri
VII. Endodontik lezyonlarla iliĢkili periodontitis
VIII. GeliĢimsel veya kazanılmıĢ deformiteler ve durumlar
Bu sınıflandırmada, ilaca bağlı diĢeti büyümeleri dental plağa bağlı oluĢan gingival hastalıklar kategorisinin içinde, ilaçlara bağlı gingival hastalıklar alt grubunda yer almaktadır.
Diğer bir sınıflamada diĢeti büyümeleri aĢağıdaki gibi gruplandırılmıĢtır (Carranza ve Hogan 2006 ) :
I. Ġtihabi diĢeti büyümeleri A. Akut
B. Kronik
II. Ġlaca bağlı diĢeti büyümeleri
III. Sistemik hastalıklarla iliĢkili diĢeti büyümeleri A. Durumsal Büyümeler
1. Hamilelik 2. Puberte
3. Vitamin C eksikliği 4. Plazma hücreli gingivitis
5. Spesifik olmayan durumsal büyümeler (Piyojenik granuloma) B. DiĢeti büyümesine neden olan sistemik hastalıklar
1. Lösemi
2. Granülamatöz hastalıklar (Wegener granulomatosis, Sarcoidosis)
IV. Neoplastik diĢeti büyümeleri A. Benign tümörler B. Malign tümörler V. Yalancı büyümeler
3
1.1.Ġlaca Bağlı DiĢeti Büyümeleri
Konak ve çevre arasındaki çeĢitli etkileĢimlere cevap olarak, diĢeti ve periodonsiyumla iliĢkili yumuĢak dokularda büyümeler gözlenebilir. Genellikle bu büyümeler bakteriyel dental plağa karĢı enflamatuvar yanıt sonucu oluĢmaktadır. Bununla birlikte lösemi, vitamin C eksikliği, puberte, hamilelik, herediter gingival fibromatozis ve çeĢitli ilaçların yan etkileri sonucu da diĢeti büyümeleri gözlenmektedir (Hallmon ve Rossmann 1999).
Ġlaca bağlı diĢeti büyümeleri, değiĢik farmakolojik etkileri olan ve farklı hedef dokulara etki gösteren üç ana grup ilacın yan etkisi sonucu oluĢur (Marshall ve Bartold 1998). DiĢeti büyümesine neden olduğu bilinen bu ilaçlar; antikonvülsanlar, immünsupresanlar ve kalsiyum kanal blokörleridir (Çizelge 1.1), (Academy Report 2004).
1.1.1.Ġlaca Bağlı DiĢeti Büyümelerinin Prevalansı
Her ilaç grubu için doğru prevalans yüzdelerini belirtmek, rapor edilen prevalans farklılıklarından dolayı oldukça zordur. Bu farklılıklar çeĢitli faktörlerden kaynaklanabilir. DiĢeti büyümesi değerlendirmesinin tıp hekimleri ya da diĢ hekimleri tarafından yapılması ve farklı diĢeti büyümesi değerlendirme metotları kullanılması, hastaların yaĢı, mevcut ilaçla eĢzamanlı kullanılan ilaçların etkileri (kombine kullanılan ilaçlar), ayakta tedavi gören ya da yatarak tedavi gören hasta gruplarına odaklanma, tedavi edilen sistemik hastalık tipi, mevcut periodontal sağlığın yeterince değerlendirilememesi ve diğer faktörler prevalans farklılıklarını oluĢturur.
Antikonvülsan ilaçlardan fenitoine bağlı diĢeti büyümesi, ilacı kullanan bireylerin yaklaĢık %50'sinde görülmektedir. Valproik asit ile tedavi edilen yetiĢkin hastalarda diĢeti büyümesi nadiren gözlenmektedir. Kalsiyum kanal blokörlerinden nifedipin kullanan bireylerde bu değer %20 (%6-15)'dir. Verapamil, diltiazem, felodipin ve amlodipin kullanımı sonucu oluĢan diĢeti büyümesi prevalansı, nifedipine bağlı oluĢandan daha düĢüktür. Siklosporin A (CsA) için rapor edilen değerler oldukça farklıdır, yaklaĢık olarak %25-30 (%12.5-84.6) civarındadır.
4 Pediatrik kalp transplant hastaları CsA'ya bağlı diĢeti büyümesine daha yatkındır, bu hastalarda farklı derecelerde diĢeti büyümesi saptanmıĢtır (Academy Report 2004).
Çizelge 1.1 DiĢeti büyümesi yapan çeĢitli farmakolojik ajanlar ve büyüme prevalansları (Academy
Report 2004).
Kategori Farmakolojik Ajan Ticari Ġsim Prevalans
Antikonvülsan Fenitoin Dilantin %50
Valproik asit Depakene, Depacon, Epilin, Valpro
Nadiren
Fenobarbiton Fenobarbital, Donnatal <%5
Vigabatrin Sabril Nadiren
Karbamezapin Tegretol Rapor edilmemiĢtir
Ġmmünsüpresan Siklosporin Neoral, Sandimmune YetiĢkin %25-30, Çocuk >%70 Kalsiyum Kanal
Blokörleri
Nifedipin Adalat, Nifecart, Procardia, Tenif
%6-15
Ġsradipin DynaCirc Rapor edilmemiĢtir
Felodipin Agon, Felodur, Lexxel, Plendil
Nadiren
Amilodipin Lotrel, Norvasc Nadiren
Verapamil Calan, Covera, Ġsoptin, Tarka, Verelan
<%5
Diltiazem Cardizem, Dilacor, Diltiamax, Tiazac
%5-20
1.1.2.Ġlaca Bağlı DiĢeti Büyümelerinde Risk Faktörleri
Ġlaca bağlı diĢeti büyümelerinin patogenezi henüz tam olarak açıklanamamıĢtır. DiĢetini oluĢturan bileĢenlerle ilaçlar arasındaki iliĢkiyi etkileyen faktörler; yaĢ, cinsiyet, genetik, ilaç değiĢkenleri, kombine kullanılan ilaçlar, periodontal değiĢkenler olarak sıralanabilir. (ġekil 1.1.) (Seymour ve ark 2000).
5
ġekil 1.1. Ġlaca bağlı diĢeti büyümelerinde risk faktörleri (Seymour ve ark 2000).
YaĢ:
Çocukların ve ergenlik dönemindeki gençlerin, ilaca bağlı diĢeti büyümesine karĢı yetiĢkinlerden daha duyarlı olduğu klinik çalıĢmalarla desteklenmektedir. Fenitoine bağlı diĢeti büyümeleriyle ilgili yapılan çalıĢmalar, ilaca bağlı oluĢan yan etkinin daha çok gençleri etkilediğini göstermiĢtir (Seymour ve ark 2000). CsA'ya bağlı diĢeti büyümeleri için yaĢın bir risk faktörü olduğu belirtilmiĢtir (Somacarrera
ĠLACA BAĞLI DĠġETĠ BÜYÜMESĠ
YaĢ
Periodontal değiĢkenler•
Gingival enflamasyon•
Plak•
Transplant öncesi mevcut büyüme
Kombine Kullanılan Ġlaçlar•
CsA & Kalsiyum kanal blakörü•
CsA & Prednizolon•
CsA & Azatioprin•
Fenitoin & Hepatik enzim indükleyiciler
Cinsiyet
Ġlaç değiĢkenleri•
Doz•
Serum/Plazma konsantrasyonu•
Doku konsantrasyonu•
Tükürük konsantrasyonu
Genetik•
Sitokrom P450•
CsA HLA-DR1•
CsA HLA-DR2•
CsA HLA-B376 ve ark 1994, Karpinia ve ark 1996). Bu gözlemler hayvan çalıĢmalarıyla desteklenmiĢtir (Morisaki ve ark 1993).
Farklı yaĢ grupları ile yapılan çalıĢmalar daha çok fenitoin ve CsA grubu ilaçlar için yapılmaktadır. Çünkü kalsiyum kanal blokörlerinin çocuklarda ve ergenlik dönemindeki gençlerde kullanımı diğer ilaçlara göre oldukça sınırlıdır (Seymour ve ark 1996).
Bununla birlikte, hayvanlarda yapılan bir çalıĢmada farklı yaĢ gruplarından ratlara, nifedipinin düzenli olarak verilmesi sonucunda maksimum diĢeti büyümesinin genç ratlarda gözlendiği belirtilmiĢtir (Ishida ve ark 1995). CsA ve kalsiyum kanal blokörünü kombine kullanan hastalarda yaĢ, risk faktörü olarak tanımlanmıĢtır (Thomason ve ark 1997). Benzer sonuçları Nishikawa ve ark (1996) CsA, fenitoin ve nifedipin için elde etmiĢler ve ilaca bağlı diĢeti büyümesi miktarının yaĢ ile iliĢkili olduğunu belirtmiĢlerdir.
Cinsiyet:
Cinsiyetin ilaca bağlı diĢeti büyümelerinde risk faktörü olup olmadığını araĢtıran çok az çalıĢma vardır. Fenitoine bağlı diĢeti büyümesi oluĢan hastalarda cinsiyet; risk faktörü olarak gözükmemektedir. Ancak CsA ve nifedipin kullanan hastalarda ilaca bağlı diĢeti büyümelerinde de cinsiyet risk faktörü olarak değerlendirilmektedir (Seymour 2006).
Kalsiyum kanal blokörü kullanan bireylerde yapılan bir çalıĢmada, erkeklerde kadınlardan 3 kat daha fazla diĢeti büyümesi gözlenmiĢtir (Ellis ve ark 1999). Özellikle CsA ve kalsiyum kanal blokörü kullanan erkek bireylerin kadınlara göre diĢeti büyümesi oluĢmasına daha yatkın olduğu ve diĢetindeki değiĢikliklerin daha Ģiddetli görüldüğü bildirilmektedir (Seymour ve ark 2000). Yapılan hayvan çalıĢmalarında da benzer sonuçlar bulunmuĢtur. Erkek ratların diĢeti büyümesine diĢi ratlardan daha yatkın olduğu bildirilmiĢtir. DiĢeti büyümesinin oluĢması için bir serum eĢik değeri olduğu ve erkeklerde bu düzeyin daha düĢük olduğu üzerinde durulmuĢtur (Ishida ve ark 1995).
7
Ġlaç değiĢkenleri:
DiĢeti büyümesinin Ģiddeti ve yaygınlığı ile ilaç değiĢkenleri (ilacın kullanım süresi, dozu, serum ve salya konsantrasyonları) arasındaki iliĢkiyi saptamaya yönelik çalıĢmaların sonuçları farklılıklar göstermektedir. Sonuçlardaki farklılıkların çoğu, diĢeti büyümesini değerlendirme yöntemi, kan örneğinin alınma zamanı, çalıĢmaya katılan hasta sayısındaki değiĢiklikler ve ilacın farmakokinetik profilini etkileyebilecek diğer faktörlere bağlanabilir (Thomason 1995, Seymour 2000).
DiĢeti büyümesi yapan ilaçların salya ve diĢeti oluğu sıvısındaki (DOS) konsantrasyonlarına bakılan çalıĢmalarda, DOS'ta fenitoin, nifedipin ve amlodipin varlığı tespit edilmiĢtir (Seymour 1994). Ancak DOS'taki fenitoin konsantrasyonuyla diĢeti büyümesinin Ģiddeti arasında bir iliĢki bulunamamıĢtır. Nifedipin de DOS'da yüksek konsantrasyonlarda tespit edilmiĢ, ancak diĢeti büyümesi ile aynı Ģekilde bir korelasyon saptanamamıĢtır. Buna karĢın ilacın plazma konsantrasyonu ile diĢeti büyümesinin Ģiddeti arasında bir iliĢki olduğu gözlenmiĢtir (Seymour 2000). Güncü ve ark (2007) yapmıĢ oldukları çalıĢmada, DOS‟taki nifedipin konsantrasyonuyla diĢeti büyümesi Ģiddeti arasında belirgin bir iliĢki olmadığını ve hem plazma hem de DOS‟taki nifedipin konsantrasyonunun diĢeti büyümesi için risk faktörü olmadığını belirtmiĢlerdir.
DiĢetindeki değiĢikliklerin baĢlaması için ilacın dokularda belli bir eĢik değere ulaĢması gerektiği ve bu eĢik değerin bireyden bireye farklılık gösterdiği düĢünülmektedir. Bu sebeple diĢeti büyümelerinde, hastanın vücut ağırlığıyla ilaç dozunu iliĢkilendirmek daha uygundur (Seymour 2000).
Kombine kullanılan ilaçlar:
Organ transplantasyonu yapılan hastaların birçoğu, siklosporinle beraber, siklosporine bağlı olarak oluĢan nefrotoksisiteyi ve hipertansiyonu tedavi etmek için nifedipin kullanmaktadırlar. Ġki ilaç kombine olarak kullanıldığında diĢeti büyüme insidansında artıĢ gözlenmiĢtir (Seymour 2000, Seymour 2006). Yapılan bir çalıĢmada, 55 organ transplantasyon hastasında nifedipin ve siklosporinin kombine verildiği grupta, sadece siklosporin verilen gruba kıyasla diĢeti büyümeleri daha fazla bulunmuĢtur (Thomason ve ark 1993).
8 Fenitoin, karaciğerde sitokrom P450 (CYP 450) enzimi tarafından
5-(4-hydroxylphenyl)-5-phenylhydantoin (4-HPPH)'e metabolize edilir. Bu metabolit de diĢeti büyümesini indüklemektedir. Fenobarbiton, primidon ve karbamazepin gibi antikonvülzanlar, fenitoinle beraber kullanıldıklarında karaciğerdeki CYP 450 enzimini etkileyerek, 4-HPPH metabolitini artırırlar. Bu da birden çok antikonvülzan ilacın beraber kullanılmasının diĢeti büyümesi prevalansını arttırmasını açıklamaktadır (Seymour 2000).
Ketokonazol (KTZ) antifungal bir ilaçtır ve karaciğerdeki CYP3A4 enziminin inhibitörü olarak etki gösterir. Nifedipin de karaciğerde CYP3A4 enzimi tarafından metabolize edilir. Kato ve ark (2005) yapmıĢ oldukları hayvan çalıĢmasında KTZ ile nifedipini ratlara kombine olarak uygulamıĢlardır. Kombine ilaç kullanılan gruptaki ratların nifedipin serum konsantrasyonlarını ve diĢeti büyümelerini sadece nifedipin verilen gruba kıyasla daha yüksek bulmuĢlardır.
Periodontal değiĢkenler:
Ġlaca bağlı diĢeti büyümeleri, en son kabul edilen periodontal hastalık sınıflandırmasında, dental plağa bağlı oluĢan gingival hastalıklar kategorisinin içinde yer almaktadır (Armitage 2002). Plağın; diĢeti büyümesine katkısı olan bir faktör mü olduğu yoksa diĢeti değiĢiklikleri sonucunda mı oluĢtuğu tam olarak açıklığa kavuĢmamıĢtır (Seymour 2000). Her ne kadar ilaca bağlı diĢeti büyümesinde diĢeti enflamasyonu ve dental plağın rolü tartıĢma konusu olsa da, hastaların oral hijyen uygulamalarını geliĢtirmelerinin, ilaca bağlı istenmeyen bu yan etkiyi azalttığı bildirilmiĢtir (Seymour 2006).
Seymour ve Smith (1991) yaptıkları bir çalıĢmada oral hijyen programının diĢeti büyümesi üzerine etkisini incelemiĢlerdir. Gingival irritanların uzaklaĢtırılmasının ve plak kontrolünün CsA'ya bağlı diĢeti büyümesini inhibe edemediğini gözlemlemiĢlerdir.
Güncü ve ark (2007) fenitoin ve nifedipin kullanan hastalarda, diĢeti büyümesi olanlar ve olmayanlar arasında plak indeksi, gingival indeks ve kanama zamanı indeksi açısından istatistiksel olarak anlamlı bir fark gözlememiĢlerdir.
Yapılan bir çalıĢmada 100 organ transplantasyon hastasında, oral hijyen motivasyonuyla periodontal durumda iyileĢme sağlanmasına rağmen, hastaların
9 %43'ünde diĢeti büyümesi kaydedilmiĢtir (Somacarrera ve ark 1994). Tüm bu bulgular göz önüne alındığında, iyi oral hijyenin CsA'ya bağlı diĢeti büyümesinin Ģiddetini, lezyonun enflamatuar komponentini elimine ederek azaltabileceği ancak iyi oral hijyenin sağlanmasının tek baĢına diĢeti büyümesini engelleyemeyeceği sonucuna varılmıĢtır (Seymour ve ark 2000).
Miranda ve ark (2001) yapmıĢ oldukları çalıĢmada nifedipin kullanan bireylerde gingival indeks ve plak indeksi skorlarını, ilaç kullanmayan kontrol grubuna kıyasla daha yüksek bulmuĢlardır. Yapılan bir hayvan çalıĢmasında, ligatür bağlanıp nifedipin verilen gruptaki diĢeti büyümeleri ve diĢeti bağ dokusundaki enflamasyon, sadece ligatür bağlanan gruba göre fazla bulunmuĢtur ancak kemik kaybı açısından gruplar arasında belirgin farklar gözlenmemiĢtir (Fernandes ve ark 2010). Kalsiyum kanal blokörleriyle ilgili yapılan birçok çalıĢmada, plak ve diĢeti enflamasyonunun ilaca bağlı diĢeti büyümesi için önemli birer risk faktörü oldukları gösterilmiĢtir. Benzer Ģekilde birçok çalıĢmada da nifedipine bağlı diĢeti büyümesi ve plak arasında iliĢki saptanmıĢtır (Seymour 2000).
Genetik Faktörler:
Ġlaç kullanımı sonrasında hastalarda görülen farklı diĢeti cevabı, fibroblastların heterojenitesiyle açıklanmaya çalıĢılmıĢtır (Seymour 2006). Gingival doku fibroblastlarının değiĢik subpopulasyonlarının olduğu ve de bu subpopulasyonlardan bir kısmının yüksek kapasitede protein ve kollajen sentezleyebildiği öne sürülmüĢtür. Ġki ayrı diĢeti fibroblast subpopulasyonu varlığından bahsedilmektedir. Bunlar diĢetinin ilaca gösterdiği cevaba göre, yüksek aktiviteli ve düĢük aktiviteli fibroblastlar olarak isimlendirilmektedir (Daley ve ark 1986). Bu fibroblastların dokudaki oranları genetik olarak belirlenmektedir (Thomason 1995).
Ġlaçları metabolize eden enzimler ile diĢeti büyümesi iliĢkisi üzerinde de durulmuĢtur. Fenitoin, siklosporin ve nifedipinin her üçü de karaciğerdeki CYP450 enzimi tarafından metabolize edildikleri için bireylerdeki genetik farklılıklar, bu ilaçların metabolizmalarını etkileyebilir (Thomason 1995, Seymour ve ark 2000). CYP gen ailesi, bireyler arası enzim varyasyonlarına neden olacak Ģekilde polimorfizmler göstermektedir. Bu enzim varyasyonları da, ilaçların serum ve doku konsantrasyonlarını etkileyerek, gingival cevabı değiĢtirebilir. Yapılan bir çalıĢmada,
10 CYP 2C polimorfizmiyle diĢeti büyümesinin Ģiddeti arasında herhangi bir korelasyon tespit edilmemiĢtir (Seymour 2006). DiĢeti büyümesi için diğer bir genetik marker da insan lökosit antijeni (HLA) ekspresyonudur. Genellikle organ transplant hastalarında HLA incelenmektedir. Böylece HLA fenotipi organ transplantasyonu öncesinde tanımlanmaktadır. Yapılan çalıĢmalarda HLA-DR1 pozitif olan hastalarda diĢeti büyümesine karĢı belli bir koruyuculuk saptanırken, HLA-DR2 pozitif olanların bu yan etkiye daha yatkın olabileceği belirtilmiĢtir. HLA-A19 ekspresyonunun ilaca bağlı diĢeti büyümesine yatkınlığı artırdığı ve HLA-B37 ekspresyonunun anlamlı bir risk faktörü olduğunu gösteren çalıĢmalar vardır (Seymour ve ark 2000).
1.1.3.Ġlaca Bağlı DiĢeti Büyümesinin Patogenezi:
Ġlaca bağlı diĢeti büyümesinin multifaktöriyel özellikte olması sebebiyle patolojisinin açıklanması güçtür. Bu tip diĢeti büyümelerinin klinik ve histolojik görüntüsü; enflamasyonun Ģiddeti, ilacın kulanım süresi, dozu, tipi, hastanın oral hijyen düzeyi, çevresel etkiler ve genetik faktörlerce Ģekillenen bireysel yatkınlığa bağlıdır (ġekil 1.2). Bütün veriler dikkate alındığında üç önemli faktörün diĢetinde meydana gelen değiĢikliklerden sorumlu olduğu düĢünülmektedir. Bunlar, ilaç değiĢkenleri, gingival dokularda plak tarafından indüklenen iltihabi değiĢiklikler ve genetik faktörlerdir.
Genetik faktörler ilaç metabolizmasını etkileyebilir. Gingival fibroblastlardaki heterojenite sonucu ilaca verilen yanıt değiĢmektedir. DiĢeti büyümesi, bu yan etkiye yol açtığı bildirilen ilaçları alan hastaların sadece bir kısmında meydana gelmektedir (Daley ve ark 1986).
Gingival dokulardaki iltihabi değiĢiklikler, ilaç ve fibroblast arasındaki etkileĢimler ve bu hücrelerin daha sonraki aktivitelerinin düzenlenmesinde etkin rol oynar. Ayrıca bu ilaçlar direkt olarak iltihabi cevabı etkileyerek gerek hücresel yanıtı ve gerekse de sitokin, prostaglandin ve büyüme faktörlerinin salınımına etki ederler.
BaĢta ilaca bağlı değiĢkenler olmak üzere, genetik faktörler ve plağa bağlı iltihabi değiĢiklikler kollajen matriks mekanizmasının kontrol edilmesinde etkilidirler. Bu üç faktörün hepsi, matriks metalloproteinazların ve
11 metalloproteinazların doku inhibitörlerinin sentezlenmesi ile salgılanmasına etki ederek kollajen matriksin kontrolünü sağlarlar.
ÇeĢitli büyüme hormonları ve enflamatuar sitokinlerin gingival fibroblastlara etkisi üzerinde de birçok çalıĢma yapılmıĢtır. Sitokin mekanizmasındaki düzensizliklerin diĢeti büyümelerinin oluĢmasında daha etkin olduğu düĢünülmektedir. Gingival fibroblastlarla yapılan çeĢitli hücre kültürü çalıĢmalarında fenitoin, nifedipin ve CsA uygulamasının sitokinleri ve prostoglandin E2 ‟yi
arttırdığını göstermiĢtir. Son zamanlarda yapılan çalıĢmalarda diĢeti büyümesi gözlenen dokularda spesifik sitokinlerin yüksek seviyede gözlendiği tespit edilmiĢtir. IL-6, IL-1β, PDGF-B (platelet-derived growth factor-B), FGF-2 (fibroblast growth factor-2), TGF-β (transforming growth factor-β ) ve CTGF (connective tissue growth factor) ilaca bağlı diĢeti büyümelerinde artmıĢ seviyelerde gözlenen sitokin ve büyüme faktörleridir ( Trackman ve Kantarcı 2004).
DiĢeti büyümesi yapan ilaçların enflamatuar hücrelere (çoğunlukla lenfosit ve makrofajlar) etkisi sonucu bu hücreler tarafından üretilen sitokinlerin ve enflamatuvar mediatörlerin üretim mekanizmaları ve birbirleriyle olan dengeleri değiĢir. Bunun sonucunda da bakterilerin patojenik etkilerine ve doku yaralanmalarına verilen cevap bozulur. Sitokinler, gingival fibroblastların ekstraselüler matriks metabolizmasını ve proliferasyonunu etkiler. Örneğin fenitoine bağlı diĢeti büyümesinde TGF-β1‟in fazla salgılanması sonucu gingival fibroblastlar CTGF üretirler. CTGF de ekstraselüler matriks akümülasyonunu düzenler. Fenitoin ve nifedipine bağlı diĢeti büyümesi gözlenen dokularda artmıĢ seviyede CTGF gözlenir ayrıca CTFG‟nin yüksek seviyede bulunduğu dokular daha fibrotik karakterdedir ( Trackman ve Kantarcı 2004).
1.1.4.DiĢeti Bağ Dokusu Homeostazisinde Meydana Gelen Ġlaca Bağlı DeğiĢimler
Ġlaca bağlı diĢeti büyümesinin klinik ve histolojik özellikleri incelendiğinde bağlantı epitelinde hiperplazi, keratinize epitelde hipertrofi ve bağ dokusunun ekstraselüler matriksinde ve özellikle kollajen komponentinde aĢırı birikim gözlenmektedir.
12 Ġlaca bağlı diĢeti büyümelerinin tümünün ortak histopatolojik bulgusu bağ dokusu matriksindeki artıĢtır, bu nedenle bağ dokusu homeostazisi üzerinde birçok çalıĢma yapılmıĢtır.
ġekil 1.2. Ġlaca bağlı diĢeti büyümesinin multifaktöriyel patogenezi (Seymour ve ark 1996).
DiĢeti fibroblastları tarafından kollajen üretimi, kollajeni düzenleyen mekanizmalarca ayarlanır. Hücre içi parçalanma mekanizması, metalloproteinaz sentezi ve inhibitörleri ile ayrıca metalloproteinazın doku inhibitörleri (TIMPs) tarafından düzenlenmektedir (Seymour ve ark. 1996).
Memelilerde en çok bulunan protein olan kollajenin metabolizması, kollajen sentezi ve yıkımı arasındaki denge ile sağlanmaktadır. Kollajen fibrillerin (özellikle tip I kollajen) sentez ve degredasyonunun homeostazisinin kaybolması sonucunda kollajen fibrillerin birikimi ve bunun sonucunda fibrozis gerçekleĢir. Ġlaca bağlı diĢeti büyümesi, tip I kollajen sentezinin artmasından ziyade fibroblastların kollajeni
13 fagosite etmelerinin azalması sonucu diĢeti bağ dokusundaki tip I kollajen degredasyonunun azalmasıyla iliĢkilidir (Kataoka ve ark 2005).
Fibroblastların kollajeni fagositozunda, kollajen ve fibroblastın birbirine adezyonunda α2 integrin kritik bir rol oynar. Ġntegrinler ekstraselüler matriks molekülleri için heterodimerik transmembran reseptörleridir. Hücreler ve ekstrasellular matriks arasındaki moleküler diyaloğu sağlayan temel mediatörlerdir. Hayvan çalıĢmalarında, diĢeti büyümesi yapan ilaçların α2 integrinin ekspresyonunu baskıladığı veya gingival fibroblastlara α2 integrinin bağlanma aktivitesini azaltması sonucu kollajen fagositozunda inhibisyon gözlendiği düĢünülebilir (Kataoka ve ark 2005).
DiĢeti büyümesi yapan ilaçların hepsinin farklı farmakolojik özellikleri bulunmakla birlikte hepsi de hücre içine Ca+2/Na+2 akıĢına etki eder. Hücre içine kalsiyum akıĢının bozulması sonucu fibroblastların kollajen fagositoz mekanizmaları bozulur (Seymour ve ark 1996, Kataoka ve ark 2005).
Gingival fibroblastlarla yapılan hücre kültürü çalıĢmaları sonucunda fenitoin, nifedipin ve CsA‟nın kollajen ve non-kollajen ekstraselüler matriks metabolizmasına direkt olarak etkilerinin incelendiği çalıĢmalarda farklı sonuçlar elde edilmiĢtir. In vitro yapılan bu çalıĢmalarda CsA, fibroblastların glikozaminoglikan sekresyonlarını arttırırken fenitoin ve nifedipin, fibroblastların heparin seviyesini arttırmıĢtır. Bu ilaçların gingival fibroblastların ekstrasellular matriks üretimini ve/veya hücre proliferasyonunu inhibe ettiğini gösteren çeĢitli in vitro çalıĢmalar da mevcuttur. Ayrıca ilaca bağlı diĢeti büyümelerinin in vivo olarak incelendiği çalıĢmalarla in vitro çalıĢmaların sonuçlarındaki tutarsızlık, bu ilaçların ekstraselüler matriks mekanizmasına veya gingival fibroblast proliferasyonuna direkt etkisinin, diĢeti büyümesinden sorumlu primer mekanizma olamayacağını düĢündürmektedir (Trackman ve Kantarcı 2004).
Hücre kültürü çalıĢmaları sonucunda fenitoine bağlı diĢeti büyümelerinden üretilen fibroblastların oluĢturdukları ekstrasellüler matriksin fibroblast yayılımını kolaylaĢtırdığı gösterilmiĢtir. Fibroblast yayılımının diĢeti büyümesi için ön koĢul olduğu belirtilmiĢtir. Hücre kültürü çalıĢmalarından, hem fenitoin hem de nifedipinin kollajen gen ekspresyonu üzerine etkilerinin araĢtırılması için de yararlanılmıĢtır. Bu
14 çalıĢmaların sonuçlarına göre hem fenitoin hem de nifedipin, tip I ve tip IV kollajen genlerinin ekspresyonunu etkileyebilmektedir (Seymour ve ark 1996).
1.1.5.Ġlaca Bağlı DiĢeti Büyümesinin Klinik Karakteristik Özellikleri:
Ġlaca bağlı diĢeti büyümelerinin genel özellikleri aĢağıdaki gibi sıralanır (Mariotti 1999):
1. Hastalar arasında ve aynı hastanın ağız içinin farklı bölgelerinde değiĢen oranlarda diĢeti büyümesi gözlenebilir.
2. DiĢeti büyümesi, sıklıkla anterior bölgede oluĢma eğilimindedir. 3. Çocuklarda görülme prevalansı daha yüksektir.
4. Ġlaç kullanılmaya baĢlandıktan sonra ilk üç ayda büyüme gözlenir. 5. DiĢeti büyümesi miktarına bağlı olarak diĢeti konturu değiĢir. 6. DiĢeti büyümesi ilk olarak interdental papilde gözlenir. 7. DiĢeti renginde değiĢiklik gözlenir.
8. Gingival eksudada artıĢ gözlenir. 9. Sondlamada kanama artar.
10. DiĢeti büyümesi, kemik kaybı olan veya olmayan diĢetinde de gözlenebilir, ama ataçman kaybı ile iliĢkili değildir.
11. Plak varlığına bağlı olarak artmıĢ enflamatuar yanıt görülür. 12. Dental plağın eliminasyonu, lezyonların Ģiddetini sınırlayabilir.
DiĢeti büyümeleri, lokal faktörlerin neden olduğu enflamasyonun derecesine bağlı olarak ödemli veya fibrotik olabilir. Fibrotik büyüme normalde yapıĢık diĢetiyle sınırlıdır. Ancak çiğnemeyi, konuĢmayı ve estetiği etkileyecek Ģekilde koronale doğru uzanabilir. Bunun sonucunda beslenme ve ağız hijyeni bozulur, oral enfeksiyona yatkınlık, çürük ve periodontal hastalık geliĢebilir (Academy Report 2004).
1.1.6.DiĢeti Büyümesi Yapan Ġlaçlar:
Antikonvülsanlar Ġmmünsupresanlar
15
1.2.Kalsiyum kanal blokörleri:
Kalsiyum kanal blokerleri 1950/1960‟larda bulunmasına rağmen tedavi amaçlı olarak yaygın Ģekilde kullanılmaları 1980‟lerde baĢlamıĢtır. Kalsiyum antagonistleri terimi ilk defa Fleckenstein tarafından kullanılmıĢtır. Fleckenstein; kalp ve düz kaslarda kalsiyum akımına karĢı özel etkinliği olan bir grup madde (verapamil, nifedipin, gallopamil ve diltiazemdir) tanımlamıĢtır. Bunlar farklı kimyasal yapıları ve etkinlikleri olan ilaçlardır fakat hepsi de L tipi kalsiyum kanallarına etki ederek, kalsiyumun hücre içine akıĢını bloke ederler (Marshall 1998).
Çizelge 1.2. Kalsiyum kanal blokörlerinin kimyasal yapılarına göre sınıflandırılması (Nayler ve
Dillon 1986).
Fenilalkinamin Türevleri Dihidropiridin Türevleri Benzotiazepin Türevleri
Verapamil Nifedipin Diltiazem
Gallopamil Nimodipin Tiapamil Niludipin Anipamil Nitrendipin Ronipamil Nizoldipin Nikardipin Felodipin Amlodipin
Kalsiyum kanal blokörleri farmakolojik özelliklerine göre de sınıflandırılırlar. Sınıf I ilaçlar (örneğin verapamil) özellikle kalbi etkiler. Güçlü negatif inotropik (kalbin kontraksiyon gücünü azaltırlar) ve negatif kronotropik (kalp atım sayısını azaltırlar) etki gösterirler. Sınıf II ilaçlar (örneğin dihidropridinler) en büyük etkilerini kan damarları üzerine gösterirler, periferal ve koroner vazodilatasyon sağlarlar. Sınıf III ilaçlar (örneğin diltiazem) koroner arterler üzerine hafif veya minimum düzeyde inotropik etki gösterirler.
Kalsiyum kanal blokörleri, hipertansiyon, vazospastik anjina, supraventriküler aritmi, stabil anjina, akut miyokardiyal infarktüsün bazı formları gibi kardiyovasküler hastalıkların tedavilerinde kullanılmaktadırlar (Hagiwara ve ark 1988, Marshall 1998).
16
1.2.1.Kalsiyum kanal blokörlerinin farmakolojik etkileri:
Kalsiyum kanal blokörleri; hücre membranındaki kalsiyum kanalları içinden kalsiyum iyonlarının (Ca+2) geçiĢini azaltarak etki gösterirler. Sodyum ve potasyum kanallarından geçen Na+
ve K+ iyonlarının fonksiyonu depolarizasyon ve repolarizasyon iken, kalsiyum kanalları içinden geçen Ca+2
kimyasal haberci gibi etki gösterirler. Kalsiyum iyonu, hücrede çok çeĢitli fonksiyonlara katılan bir hücre içi habercisidir. Bu iyonun çok çeĢitli olan aktivitelerine aracılık eden reseptörü kalmodulin adlı proteindir. Bu protein kalsiyumun aktivitelerini değiĢtirir ve düzenler. Bu nedenle kalmodulin adı verilmiĢtir. Kalsiyumun fizyolojik aktivitelerine katılan formu iyon (Ca+2
) formudur. Kalsiyum atomu, sıvı ortamda iki elektron verir ve iki değerli bir katyon haline gelir.
Kas kasılmasını baĢlatan kalsiyum, endositozis ve ekzositozis olaylarında da rol alır. Ayrıca hücre ve kromozom hareketlerinde ve glikojen metabolizmasında önemli role sahiptir. Nörotransmitter sentezi ve salınmasında, siklik adenozin monofosfat (cAMP) düzeyinin ayarlanmasında, hücre organel membranlarındaki kalsiyum ATP-az enziminin aktive edilmesinde, insulin salgılanmasında da kalsiyumun rolü vardır (Noyan 1983).
L, T ve N olmak üzere üç çeĢit kalsiyum kanalı vardır. Bazı dokular üç tip kalsiyum kanalını ihtiva ederler. Bunun örneği dorsal kök ganglionlarının duyusal nöronlarıdır. Kalp kası hücreleri ve uyarı merkezi (pacemaker) hücreleri L ve T tipi kalsiyum kanallarını içerir. N tipi kalsiyum kanalları ise sinir uçlarında bulunur (Hagiwara ve ark 1988, Wnifred 1989).
Kalsiyum kanal blokörlerinin halen kardiyovasküler hastalıkların tedavisinde kullanılanları, yapısal olarak farklı üç gruba ayrılırlar:
(i) 1,4 dihidropiridin (DHP) türevleri (nifedipin, amlodipin ve diğer ilaçlar gibi),
(ii) fenilalkilamin türevleri (verapamil ve gallopamil gibi), (iii) benzotiazepin türevleri (diltiazem gibi). (Çizelge 1.2)
17 Bu ilaçlar kalsiyum kanallarının L tipine yüksek affinite gösterirler ve L tipi kanalın, kanalı içeren ana alt-biriminde (alfa-1 alt birimi ) yapıca farklı üç grup ilaç için ayrı bağlanma yerleri bulunur (Kayaalp 2002, Domenic ve Sica 2006).
1.2.2.Kalsiyum haberci sistemi:
Kalsiyum haberci sisteminde bilginin, hücre yüzeyinden hücre içine akıĢı birbirinden farklı iki yoldan birisini izleyebilir. Bu yollar;
i. Kalmodulin yolu: Hücre sitoplazmasında kalsiyum iyonlarının geçici olarak artması, kalsiyum bağlayıcı bir protein olan kalmodulini aktive eder. Kalmodulin de çeĢitli enzimleri veya proteinleri aktive ederek gerekli fizyolojik fonksiyonların yapılmasını sağlar. Kalmodulin yolu hücrenin uyarıya vereceği yanıtın baĢlangıç ve geçici evresinde görülür.
ii. C-Kinaz yolu: Kinaz enzimleri çeĢitli bileĢikleri, özellikle proteinleri fosforile eden enzimlerdir. C-kinazlar ise, aktiviteleri için kalsiyuma ihtiyaç duyarlar. C-kinaz yolu, hücre içi kalsiyum miktarının artması ve plazma membranında diasilgliserol miktarının artması ile aktive edilir. Aslında bu yol polifosfoinozitid haberci sistemi yoludur ve hücrenin uyarıya vereceği yanıtın uzunca süren evresinde görevlidir. Kalmodulin yolu hücrenin vereceği tepkimenin baĢlangıç ve kısa süren evresinde rol alır. Bundan sonraki daha uzun süren tepkime C-kinaz yolu ile olur (Noyan 1989).
1.2.3.Kalsiyum kanal blokörlerinin yan etkileri:
Kalsiyum kanal blokörlerine bağlı sıkça rastlanan yan etkiler artan periferal vazodilatasyon sonucu oluĢmaktadır. Bunlar; baĢ ağrısı, baĢ dönmesi, yüz kızarıklığı ve ödemdir. Kabızlık, mide bulantısı ve halsizlik ilacın düz kaslara etkisi sonucu gözlenen yan etkilerdir. Nifedipine bağlı diĢeti büyümesi ilk defa 1984 yılında Lederman ve ark tarafından yan etki olarak tanımlanmıĢtır (Marshall 1998).
1.3.Nifedipin
Dihidropiridin türevi ilaçların klinik kullanıma ilk gireni ve en fazla denenmiĢ olanıdır. Nifedipin bu grup ilaçların prototipi olarak kabul edilir. Nifedipin,
18 kalsiyumun L-tipi veya diğer adıyla “yavaĢ kalsiyum kanallarından” geçiĢini inhibe eder. Nifedipinin kalsiyum kanallarını bloke etmesinin karakteristik özelliği, ilacın etkisinin reversibl olması ve ilaç bırakılınca etkisinin sona ermesidir. Kan basıncını düĢüren kısa etkili bir ilaçtır. Bu özelliği nedeni ile yinelenen dozlarda verildiğinde kan basıncında belirgin flüktuasyonlar ve buna bağlı refleks kalp stimülasyonu yapar. Bu nedenle nifedipin ve kısa etki süreli birinci kuĢak kalsiyum kanal blokörlerinin hemen-salınım yapan Ģekilleri hipertansiyon tedavisinde tercih edilmez. (Wnifred ve Nayler 1989, Eliott ve ark 2001).
1.3.1.Farmakokinetik Özellikleri:
Nifedipin, oral yoldan alındıktan sonra mide-barsak kanalından çabuk ve tama yakın bir derecede absorbe edilir. Sublingual olarak alındıktan sonra daha hızlı absorbe edildiği ileri sürülmüĢse de ağız boĢluğundan hızlı absorbe edilmediği saptanmıĢtır. Mide-barsak kanalından absorpsiyondan sonra karaciğerden ilk geçiĢteki eliminasyonu, verapamilin aksine, fazla olmaz ve sistemik biyoyararlanım yaklaĢık % 65'tir. Esas olarak, karaciğerde polar metabolitlere dönüĢtürülerek inaktive edilir. Eliminasyon yarılanma ömrü yaklaĢık 5 saattir. Kontrollü salınım yapan tablet formları hipertansiyon tedavisinde daha etkilidir (Eliott ve ark 2001).
1.3.2.Endikasyonları:
i. Prinzmetal variant tip anjina pektoris ii. Stabil anjina pektoris
iii. Stabil olmayan anjina pektoris iv. Periferal damar hastalığı
v. Hipertansiyon
vi. Konjestif kalp yetmezliği vii. Raynoud fenomeni viii. Pulmoner hipertansiyon
1.3.3.Kontrendikasyonları:
i. Zayıf sol ventrikül kontraksiyonu bulunan kalp yetersizliği olan hastalar
ii. Aort stenozu iii. Bradikardi
19
1.3.4.Yan etkileri:
Nifedipinin sık görülen yan etkileri, baĢ ağrısı, palpitasyon, yüz kızarması ve ayak bileği ödemidir. Ayrıca hafif hiperkalemi yapabilir. Daha seyrek olarak baĢ dönmesi, ağız kuruluğu, bacak krampı, bulantı ve sporadik ventriküler prematür atıĢ yapabilir. Ciltte vazodilatasyona bağlı yan etkiler ve baĢ dönmesi nifedipinin kontrollü salınım yapan formlarında daha az gözlenir. Bu durum, vazodilatasyon ve kan basıncı düĢmesinin bu durumda daha yavaĢ geliĢmesine bağlıdır (Eliott ve ark 2001). Nifedipine bağlı diĢeti büyümesi ilk defa 1984 yılında Lederman ve ark tarafından yan etki olarak tanımlanmıĢtır (Marshall 1998).
1.3.5.Nifedipine Bağlı DiĢeti Büyümesi:
Nifedipine bağlı diĢeti büyümesi ilk defa 1984 yılında Lederman ve ark tarafından tanımlandıktan sonra birçok yazar tarafından diĢeti büyümesi prevelansını %14,7 ile %83 arasında değiĢen değerlerle yayınlanmıĢtır. Literatürde yayınlanan çalıĢmaların büyük çoğunluğunun vaka raporu olması nedeni ile ilaca bağlı diĢeti büyümelerinin gerçek prevelansı kesin olarak bilinmemektedir. Ġlacın bütün dünya piyasasında geniĢ Ģekilde reçete edilmesi ve kullanılması sonucu, ilaca bağlı diĢeti büyümelerinin gerçek prevelansının yayınlanan değerlerin çok daha altında olduğunu düĢündürmektedir (Marshall 1999). Nifedipine bağlı diĢeti büyümesinin insidansını araĢtıran bir çalıĢmada, kardiyovasküler problemleri bulunan 47 hastadan 19‟una tedavi amaçlı nifedipin verilmiĢtir. Bu hastalardan 4‟ünde yani yaklaĢık olarak %20‟sinde diĢeti büyümesi gözlenmiĢtir. ÇalıĢmacılara göre bu oran beklenenin üzerindedir (Barclay ve ark 1992). ÇalıĢma sonuçlarının tartıĢılır olma nedenleri; hastaların genellikle Ģikayetleri sebebiyle hastaneye baĢvurmuĢ olan hastalardan seçilmiĢ olması, çalıĢmaya katılan hasta sayısının düĢük olması ve uygun kontrol gruplarının oluĢturulamaması olarak sıralanabilir. Ġlaca bağlı diĢeti büyümesi üzerine, doz, ilacın kullanım süresi, yaĢ gibi değiĢkenlerin etkilerinin incelendiği bir çalıĢmada ilacın kullanım dozu ile diĢeti büyümesi arasında bir iliĢki saptanamamıĢtır (Nervy ve ark 1995). Bununla birlikte daha önce yapılan bir çalıĢmada, diĢeti büyümesi ile yüksek doz nifedipin kullanımı arasında bir iliĢki olduğu belirtilmiĢtir (Barak ve ark 1987).
Ellis ve ark yapmıĢ oldukları bir çalıĢmada, nifedipinin DOS‟taki konsantrasyonunun plazma konsantrasyonundan 316 kat daha fazla olduğunu
20 saptamıĢlardır; ancak bunu diĢeti büyümesi ile iliĢkilendirememiĢlerdir. (Ellis ve ark 1992).
Organ transplantasyonu yapılan hastalarda nifedipine bağlı değiĢkenlerin (doz, plazma konsantrasyonu, DOS konsantrasyonu) diĢeti büyümesi için risk faktörü olup olmadığının araĢtırıldığı bir çalıĢmada, DOS‟da yüksek konsantrasyonda nifedipin bulunmasına rağmen sadece nifedipinin plazma konsantrasyonunun hastalardaki ciddi diĢeti büyümelerinde risk faktörü olabileceği tanımlanmıĢtır (Thomason ve ark 1997).
Klinik ve farmakolojik değiĢkenlerin nifedipine bağlı diĢeti büyümesinde risk faktörü olup olmadığının araĢtırıldığı bir baĢka çalıĢmada, plak indeksi, gingival indeks ve kanama zamanı indeksinin ilaç kullanımı sonucu diĢeti büyümesi gözlenen ve gözlenmeyen hastalar arasında önemli bir farklılık oluĢmadığı gözlenmiĢtir. Nifedipinin ortalama DOS konsantrasyonu, plazma konsantrasyonuna göre önemli miktarda fazla bulunmuĢtur. Bununla birlikte, ilaç kullanımı sonucu diĢeti büyümesi gözlenen ve gözlenmeyen hastalar arasında DOS ve plazma konsantrasyonları arasında önemli bir fark gözlenmemiĢtir. Bu çalıĢma sonucunda DOS ve plazma nifedipin seviyelerinin, ilaca bağlı diĢeti büyümesinde risk faktörü olmadıkları gösterilmiĢtir (Güncü ve ark 2007).
Son zamanlarda yapılan hayvan çalıĢmalarında nifedipine bağlı diĢeti büyümesinin ilacın doz ve serum konsantrasyonları ile iliĢkili olduğu gözlenmiĢtir. Ayrıca erkek ve genç ratlarda ilaca bağlı diĢeti büyümesi oluĢması için daha düĢük ilaç eĢik değerlerinin yeterli olduğu gösterilmiĢtir (Ishida ve ark 1995).
Ratlarda yapılan baĢka bir çalıĢmada farklı dozlarda (0, 30 mg/kg, 50 mg/kg) nifedipin uygulaması sonucunda ratlarda diĢeti büyümesinin doza bağımlı olduğu gösterilmiĢtir (Fu ve ark 1998).
DiĢeti büyümesinin prevelansının incelendiği bir çalıĢmada, nifedipin kullanan hastaların % 6,3‟ünde diĢeti büyümesi gözlenmiĢtir. DiĢeti büyümesi erkek bireylerde diĢi bireylere oranla 3 kat fazla gözlenmiĢtir. Ayrıca diĢeti iltihabının diĢeti büyümesi üzerine önemli kofaktör etkisi olduğu belirtilmektedir (Ellis ve ark 1999).
21 Nifedipin kullanan 65 hasta ve bu ilacı hiç kullanmamıĢ 147 kontrol grubunda yapılan cross-sectional bir çalıĢmada nifedipin kullanan hastalarda kontrol grubuna oranla diĢeti büyümesi prevelansı önemli derecede yüksek bulunmuĢtur. Ayrıca gingival indeks ve plak indeksi nifedipin kullanan hastalarda daha yüksek saptanırken, sadece gingival indeksin diĢeti büyümesi için risk faktörü olduğu ve diĢeti büyümesi ile iliĢkilendirilebileceği gösterilmiĢtir. Sonuç olarak, nifedipin kullanan hastalarda diĢeti büyümesi riskinin yüksek olduğu ve diĢeti iltihabının, diĢeti büyümesi için predispozan bir faktör olduğu belirtilmiĢtir (Miranda ve ark 2001).
1.4.Apoptozis:
Her hücre doğar, çoğalır, farklılaĢır ve ölür. Organizmadaki bu olaylar doğal bir denge halinde sürer. Doku homeostazı, yani hücrelerin yeniden yapım ve yıkımının bir düzen içinde oluĢu, bu dengenin sağlıklı bir Ģekilde sürdürülmesine bağlıdır (Israels ve Israels 1999, AkĢit 2008).
Hücre ölümü ile ilgili ilk bilgiler 1920 yılında ıĢık mikroskopunun ve yeni boya yöntemlerinin keĢfedilmesi ve ilk olarak nekrozun tanımlanmasıyla baĢlamıĢtır. Morfolojik olarak ayrı bir hücre ölüm biçimini tanımlamak için, 1972 yılında ilk defa Kerr, Wyllie ve Currie tarafından 'apoptozis' terimi kullanılmıĢtır (Kerr ve ark 1972, Kerr 2002). Apoptozis, "sonbaharda yaprakların ağaçtan tek tek dökülmesi" anlamına gelen, "programlanmıĢ hücre ölümü veya fizyolojik hücre ölümü" için kullanılan, Yunanca kökenli bir kelimedir (Nagata 1999, Tomatır 2003).
Apoptozis; morfolojik olarak özgün, enerji gereksinimi olan birçok patolojik ve fizyolojik süreçte rol alan, genlerle yönetilen bir mekanizmadır (Formigli ve ark 2000). Organizmanın ihtiyaç duymadığı biyolojik görevini tamamlamıĢ veya hasarlı hücrelerin, zararsız bir biçimde ortadan kaldırılmasını sağlayan ve genetik olarak kontrol edilen programlı hücre ölümüdür (Öztürk 2002).
1.4.1.Apoptozisin fizyolojik olaylar ve hastalıklarla iliĢkisi
Apoptozis birçok fizyolojik ve patolojik olayda etkin rol oynamaktadır. Fizyolojik olayların baĢında hücre yapım-yıkım dengesi gelir. Deri, barsak epiteli,
22 kan hücreleri gibi hücre yapım-yıkımının hızlı olduğu dokularda yaĢlanan hücreler apoptozis ile ortadan kaldırılarak yeni hücrelere yer açılır (Tomatır 2003). Fetusun implantasyonundan organogenezise kadar embriyolojik dönemden baĢlayarak; tüm yaĢam boyunca birçok geliĢim basamağında önemli rol oynar. Ġnsanın embriyolojik geliĢiminde parmaklar arasındaki perdelerin ortadan kalkması ve sinir sisteminin geliĢimi sırasında üretilen nöronların %50‟sinden fazlasının ölümü apoptozisle gerçekleĢir (Erdoğan ve Uzaslan 2003). Normal homeostazis mekanizması olarak menstruasyonda endometriyumun dökülmesi, laktasyonun kesilmesinden sonra meme bezlerinin küçülmesi gibi hormona bağlı değiĢikliklerde; immün sistemin geliĢimi ve uygun Ģekilde çalıĢmasında olduğu gibi birçok fizyolojik olayda da etkin rol almaktadır. Buna ek olarak; hipertermi, radyasyon, sitotoksik kemoterapi, hipoksi gibi nekroz oluĢturan zararlı ajanların yaptığı hücre hasarları; HIV-1, HCV gibi bazı viral hastalıklar veya immun reaksiyonlara yanıt olarak oluĢan sitotoksik T lenfositleri ile oluĢturulan hücre ölümü gibi patolojik süreçlerde de apoptozis oluĢmaktadır (Norbury ve Hickson 2001).
Bir dokuda hızlanmıĢ ya da tam tersine yavaĢlamıĢ apoptozis nedeni ile, HIV ve HCV enfeksiyonu gibi viral enfeksiyonlar, Parkinson hastalığı, Alzheimer hastalığı gibi nörodejeneratif hastalıklar, ateroskleroz ve iskemik hasar, otoimmun hastalıklar ve kanser meydana gelebilmektedir (Elmore 2007). Genellikle tümör dokularında proliferasyonun artmasına bağlı olarak apoptoziste artıĢ izlenirken, B hücreli lenfomada olduğu gibi bazı tümörlerde apoptozis azalması tümör geliĢimine neden olabilmektedir (Soini ve ark 1998).
1.4.2.Apoptozis ve nekrozis morfolojisi:
Hücre ölümü; nekrozis veya apoptozis yollarından biriyle gerçekleĢir. Nekrozis, hücrenin patolojik bir ölüm Ģekli olmasına rağmen apoptozis hem fizyolojik hem de patolojik Ģartlar altında meydana gelebilir (ÇalıĢkan 1999). Nekrozis, hücrenin ani ve aĢırı derecede travma yada hasara maruz kalması ile gerçekleĢen akut hücre ölümüdür. Bu olay hücrenin sitoplazmasına iyon giriĢ çıkıĢ kontrolünü hızla kaybettiği pasif ve yıkıcı bir süreçtir. Bu durumda hücreye giren fazla miktardaki su, hücre ve organellerin aĢırı ĢiĢmesine neden olur. Bu süreç sitolizle sonuçlanır ve enerji gerektirmez. Apoptozis ise, hücrenin kendi ölümünü gerçekleĢtirmek için sistemik olarak inaktive olduğu, yapısal ve fonksiyonel
23 komponentlerini veziküllere ayırdığı doğal bir süreçtir. Nekrozisde kromatin patterni normal hücredeki görüntüye benzerdir. Apototik hücrenin kromatini nükleus membranının çevresinde toplanır ve kondanse olur. Nekrotik hücrenin plazma membranı bütünlüğünü kaybeder ve hücre içinden dıĢına hücre içi materyallerinin çıkıĢı gerçekleĢir ve lizise uğrar. Apoptotik hücre plazma membranında tomurcuklanmalar oluĢur ve hücre, sitoplazma ile çevrilmiĢ kromatin parçalarından oluĢan apoptotik cisimciklere parçalanır. Hücre henüz yaĢamaya devam etmektedir. Apoptotik hücreler komĢu hücreler ve makrofajlar tarafından tanınır ve fagosite edilir. Apoptotik hücrelerin tanınması, plazma membranındaki değiĢikliklerle olur. Normalde hücre membranının iç tabakasında olan fosfatidil serin, aminofosfolipid transferaz enzimiyle membranın dıĢ yaprağına göç eder. Fagositik hücrelerin vitronektin, lektin özelliğindeki reseptörleri fosfatidil serin ile bağlanır ve fagositozu uyarır. Nekrozisde plazma membranının bütünlüğünün bozularak hasarlanması nedeniyle hücre içeriğinin dıĢ ortama salıverilmesi sonucu inflamasyon uyarılır. Apoptozisde apoptotik cisimcikler plazma membranları hasarlanmadan komĢu hücreler veya makrofajlar tarafından fagosite edildiklerinden inflamasyon oluĢmaz (Wyllie ve Duvall 1992, Öktem ve ark 2001, Ulukaya 2003). Apoptozisin en özgün yönü, hücre DNA‟sının internükleozomal bölgelerden yaklaĢık 180-200 kilobaz çifti (kbp) veya bunların katları boyutunda DNA parçaları oluĢturacak Ģekilde parçalanmasıdır. Bu durum agaroz jel elektroforezinde merdiven görüntüsünün (DNA laddering, ladder pattern) ortaya çıkmasına neden olur. Ama bu görünüm hücre tipine bağlı olarak değiĢebilir yada sadece 50 kbp uzunluğunda bir DNA fragmantasyonu da görülebilir. DNA‟nın internükleozomal bölgelerinde oluĢan kırılmalar sonucu fragmanlara ayrılması apoptozis için karakteristik olmasına rağmen, bütün hücre tiplerinde görülmez. DNA parçalanması nekrozun geç safhalarında da belirlenebilir ancak oluĢan parçalar geliĢigüzel boyutlardadır ve jel elektroforezinde merdiven görüntüsüne yol açmazlar (Ulukaya 2003).
Apoptozis sürecinde, hücre zarının hasarlanıp içeriğini çevre dokuya salgılamaması, makrofajlar ya da komĢu hücreler tarafından hemen fagositozun gerçekleĢtirilmesi, ortadan kaldırılan hücrelerden anti-inflamatuar sitokinlerin üretilmemesi nedeniyle inflamasyon yanıtı geliĢmemektedir (Kurosaka ve ark 2003).
Nekroz ise, apoptozisden farklı olarak; genelde geniĢ alanları ve hücreleri etkileyen, enerji depolarında ani azalma ve hücre zarı geçirgenliğinin bozulmasını
24 takiben hücre ve organellerde ĢiĢme sonucunda organel membranı ve hücre zarı bütünlüğünün bozulması ve rüptüre olmaları ile karakterize kontrolsüz ve pasif bir süreçtir (Elmore 2007). Hücre membran bütünlüğünün bozulması sitoplazmik içeriğin çevre dokulara yayılmasına ve kemotaktik sinyaller göndererek inflamasyonun uyarılmasına neden olur (Kurosaka ve ark 2003).
Çizelge 1.3. Apoptozis ile nekroz arasındaki farklar (Wyllie ve Duvall 1992, Öktem ve ark 2001,
Tomatır 2003).
Histolojik Bulgular
Apoptozis Nekrozis
Hücre
Hücre küçülür, tek tek hücre
ölümleri gerçekleĢir. Hücre ĢiĢmesi, toplu hücre ölümü gerçekleĢir.
Organeller Sağlamdır. Hasarlıdır.
Enerji gereksinimi ATP‟ye bağlıdır. Enerji gereksinimi yoktur.
Hücre zarı Hücre zarı sağlamdır. Bütünlüğünü kaybeder, seçici
geçirgenlik özelliği bozulur. Nükleus Kromatin parçalanmıĢ birimler
halinde yada Ģapka biçiminde yoğunlaĢmıĢ, nükleolus dağılmıĢtır.
Nekrozda kromatin, normal dağılımını kaybetmiĢtir ve kalın kromatin iplikleri halinde olup; nekrozun piknoz, karyoreksiz, karyoliz aĢamalarından biri görülür. Yol açan nedenler ATP noksanlığına yol açmayan
fizyolojik ve patolojik durumlardır.
Toksinler, ciddi hipoksi, açlık, fiziksel ve kimyasal travmalardır. Doku reaksiyonu Ġnflamasyon yoktur. OluĢan
veziküler yapılar komĢu hücreler ve makrofajlar tarafından fagosite edilir.
Ġnflamasyon vardır, ortamda dejenere hücre kalıntıları bulunur ve bunlar fagositler tarafından alınır.
1.4.3.Apoptozisin düzenlenmesi:
Apoptozisin genetik mekanizması ilk kez Caenorhabditis elegans isimli nematodun embriyo geliĢim sürecinde 1090 somatik hücreden 131 hücrenin apoptozisle ölmesini düzenleyen genlerin tanımlanması ile ortaya konmuĢtur (Güçer ve ark 2001).
Apoptozisi baĢlatan faktörler, büyüme faktörlerinin eksikliği, sitokinler, hücre içi kalsiyum miktarında artıĢ, tümör nekrozan faktör (TNF), TGF- , Fas/FasL sisteminin, p53' ün aktive olması, viral veya bakteriyel enfeksiyonlar ve glukokortikoidler Ģeklinde sıralanabilir. Ayrıca hipertermi, radyasyon, sitotoksik antikanser ilaçları ve hipoksi gibi çeĢitli zararlı uyaranlar, yüksek dozlarda nekroz oluĢtururken, düĢük dozlarda apoptozis meydana getirebilirler (Elmore 2007).
25
Kalsiyum iyonu:
Kalsiyum iyonları endonükleaz, proteaz ve doku transglutaminazlarının aktivasyonunda, gen regülasyonunda ve hücre iskeleti organizasyonunda rol oynarlar (Ulukaya 2003). Hücreler arası sinyal iletimi kesildiği zaman hücrede apoptozis gözlenir. Sinyal iletim mekanizmasının önemli bir parçası olan Ca+2
iyonunun bazı hücrelerde apoptozisi aktive ettiği ve ortamdaki Ca+2 iyonunu bloke edildiğinde apoptozis oluĢmadığı görülmüĢtür. Bunun mekanizması tam olarak bilinmemekle birlikte Ca+2/Mg +2 bağlantılı çalıĢan ve DNA‟yı parçalayan endonükleaz enziminin rol aldığı ileri sürülmüĢtür. Bcl-2 gen ürünü olan proteinin mitokondriyon membranında lokalize olması onun hücredeki Ca+2 oranını kontrol edebileceğini
göstermiĢtir, çünkü mitokondriyonlar hücredeki Ca+2
depo yeridir(ÇalıĢkan 2000).
p53:
Ġnsanda apoptozisin düzenlenmesi, p53 ile baĢlayan ve kaspazlara kadar devam eden bir süreçtir. Bir tümör süpresör geni olarak çalıĢan p53‟ün mutasyona uğradığı veya bulunmadığı zaman hücre yaĢamı uzar (Tomatır 2003). p53, genotoksik olaylarla oluĢan hücre hasarı ile aktive olur. Büyüme faktörü eksikliği, DNA hasarı veya hücresel stresler p53 proteininin stabilizasyonunu bozarak aktivasyonuna yol açarlar. Bu olay, hücrenin durumuna bağlı olarak iki Ģekilde sonuçlanır. p53 protein ürünü, DNA zarar gördüğünde, doğrudan DNA'ya bağlanarak hasarı tanıdıktan sonra, DNA tamir proteinlerini harekete geçirir. G1'de hücre siklusunun durmasını indükleyerek tamir için gerekli zamanı kazanır veya DNA tamir edilemeyecek kadar zarar gördüğünde apoptozisi baĢlatır. Bu iki hücresel yanıt arasında seçim, hücre ve stresin tipi, p53 kofaktörlerinin etkisi gibi birçok faktör tarafından etkilenir (Schuler 2001). p53‟ün apoptozisi indüklemesi, Bax‟ın ekspresyonunu arttırması ve böylece Bcl-2/Bax oranını değiĢtirmesi yoluyla gerçekleĢtirir (Ulukaya 2003).
Bcl-2 gen ailesi:
Bcl-2 gen ailesinin 20' den fazla üyesi tanımlanmıĢ, yapısal ve fonksiyonel özelliklerine göre antiapoptotik ve proapoptotik olmak üzere 2 alt gruba bölünmüĢtür. Bcl-2, Bcl-x, Bcl-XL, Bcl-XS, Bcl-w, BAG gibi bazıları apoptozis inhibitörüdür (antiapoptotik). Bcl-10, Bax (Bcl-2-associated X protein), Bak, Bid,
26 Bad, Bim, Bik ve Blk ise apoptozisi uyarır ve pro-apoptotik genler olarak tanımlanır (Renehan ve ark 2001, Kirkin ve ark 2004).
Bcl-2 iliĢkili proteinler, hücreyi öldürücü ya da koruyucu gibi hareket ederek, apoptozisi negatif veya pozitif olarak kontrol edebilir.
Bcl-2 ve alt gruplarının fonksiyonları, apoptozisi nasıl kontrol ve koordine ettikleri henüz tam olarak bilinmese de, mitokondriyon membranını hedeflemesi nedeni ile apoptotik hücrede mitokondri fonksiyonlarının kontrolü açısından önemli bir rol oynadığı düĢünülmektedir (Kirkin ve ark 2004).
Apoptotik sinyalin alınmasından sonra sitoplazmada bulunan proapoptotik bcl-2 proteinleri (özellikle Bax proteinleri), mitokondri membranının seçici iyon geçirgenliğini azaltabilir. Membrandaki bu değiĢiklikler nedeniyle, sitokrom c ve Apoptosis Inducing Factor (AIF) gibi faktörler sitoplazmaya geçerler.
AIF, doğrudan kromatin kondansasyonu ve nükleer fragmentasyona neden olur. Sitokrom c, ATP varlığında Apoptosis protease-activating factor 1'e (APAF-1) bağlanarak APAF-1' de oligomerizasyona neden olur. Bu kompleksin prokaspaz-9'a bağlanması ile 'apoptozom' oluĢur. Prokaspaz-9' un aktivasyonu ile kaspaz kaskadı (cascade) aktivasyonu baĢlatılır (Hill ve ark 2004).
Kaspazlar:
Memeli hücrelerinin çoğunda sitoplazmada inaktif proenzim formunda bulunan kaspazlar, bir kez aktive olunca proteolitik olarak birbirlerini aktifleĢtirerek proteaz kaskadının (Ģelale tarzı reaksiyon dizisi) baĢlamasını sağlarlar (Elmore 2007). Sistein proteaz ailesinden olan kaspazlar, proteinleri aspartik asit bulunan bölgelerden keserler, bu nedenle c-asp-ases adını almıĢlardır. Böylece kaspazların kısıtlı proteolizisi nedeniyle, hücrede lizis olmadan apoptotik cisimcikler meydana gelir ve apoptotik morfolojinin oluĢumunda rol alırlar (Tomatır 2003). Bugüne kadar memeli hücrelerinde, çoğu apoptoziste rol alan 14 tane kaspaz tanımlanmıĢtır. Ġnflamasyonu uyaran ve ilk kez bir proteaz olarak tanımlanan IL-1β dönüĢtürücü enzim (interleukin-1β converting enzyme, ICE) prokaspaz-1 olarak isimlendirilmiĢtir.
27 TanımlanmıĢ 14 major kaspaz, amino asit dizilimlerindeki benzerliğe dayandırılarak üç alt grupta sınıflandırılırlar. BaĢlatıcılar 'initiators' (caspase 2,-8,-9,-10), infazcı 'executioner' (caspase 3,-6,-7) ve inflamatuar kaspazlar (caspase 1,-4,-5,-11,-12,-13,-14) olarak kategorize edilirler. Kaspaz aktivasyonu, hücre yüzey ölüm reseptörlerinin aktivasyonu veya mitokondriyondan salıverilen sitokrom c'nin APAF-1'i indüklenmesi ve prokaspaz 9'a bağlanması ile gerçekleĢir (Rai ve ark 2005).
Mitokondriyon:
Bazı kaspazlar mitokondriyonda inhibe edilir. Bcl-2 ve Bax, mitokondriyon dıĢ zar geçirgenliğini ayarlar. Apoptotik uyarıda mitokondriyon iç membranında bulunan elektron transport zincirinde yer alan bir protein olan sitokrom-C, APAF-1‟i aktive eder ve APAF-1‟i kaspazların aktive edildiği yer olan sitoplazmaya salar. Sitokrom-C‟nin mitokondriyondan sitoplazmaya sızması, apoptozis yoluna giren bir hücrenin geri dönüĢümsüz bir döneme girdiğini iĢaret eder (Altunkaynak ve ark 2008).
Perforin ve granzim:
Bu salgısal apoptotik yol, patojenle infekte edilmiĢ hücrelerin veya tümör hücrelerinin ortadan kaldırılmasında etkin rol alır. Perforinler ve granzimler, sitotoksik T-lenfositler (CTL) ve naturel killer (doğal katil), (NK) hücrelerin sitoplazmik salgı granülleri içinde bulunan proteinlerdir. CTL reseptörü hedef hücreye bağlandığında, perforinler salgılanır ve salgılanan perforinler hedef hücre üzerinde dairesel bir por oluĢtururlar. Bu perforin poru, hücre içi kalsiyumda hızlı bir artıĢa neden olur. Beraberinde salgılanan bir serin proteaz olan granzimin de bu porlar aracılığıyla hücreye girmesiyle hücre içinde prokaspaz 8‟in aktivasyonu, dolayısıyla kaspaz kaskadı (Ģelalesi) baĢlatılır. Bu da infekte hücreyi veya tümör hücrelerini apoptozise götürür (Tomatır 2003, Ulukaya 2003).
Fas–Fas ligandı:
Apoptozisin salgıdan bağımsız mekanizması, hücre zarı üzerinde bulunan “ölüm reseptörlerinin” aktivasyonu ile ilgilidir. Fas (CD95), hücre yüzey reseptörüdür ve tümör nekroz faktörü ailesinin bir üyesidir. APO-1 veya CD95 olarak da bilinen 48kD‟luk tip 1 membran proteinidir. Enflamasyon, proliferasyon, antiviral aktivite ve hücre ölümü gibi birçok biyolojik cevaptan sorumlu olan TNF
28 reseptör ailesi yaklaĢık 20 üyeden oluĢur. Apoptotik iĢaretin uyarıcısı olan Fas, birçok hücre tipinde sergilenir. Özellikle aktif lenfositlerde yüksek miktarda eksprese edilir, ayrıca lenfoid hücrelerde, neoplastik dokularda ve tümör hücrelerinde de eksprese edilmektedir (Bruce 2001). Fas ligandı (Fas L, CD95L), TNF ailesinin bir üyesidir. Hedef hücredeki reseptörlerine bağlanarak hücresel proliferasyon ve diferansiyasyonu düzenleyen 40 kD‟luk bir sitokindir. Özellikle sitotoksik T hücreleri üzerinde bulunur. Dinlenme halindeki T hücrelerinde FasL ekspresyonu olmazken, aktif hale geldiklerinde yüksek düzeyde FasL eksprese etmeye baĢlarlar. Fas L‟nin Fas reseptörüne bağlanması ile apoptotik iĢlem baĢlar. Bu mekanizma, bir immün tepki sonunda aktive olmuĢ T hücrelerinin uzaklaĢtırılması, virüs ile infekte hedef hücrelerin ortadan kaldırılması, tümör hücrelerinin öldürülmesi ve birçok patolojik durumdaki hücrelerin uzaklaĢtırılmasında önemli rol oynar. TNF‟nin tümör nekroz faktör reseptörü-1 (TNFR-1)‟e bağlanması ile de benzer olaylar Ģekillenir. Fas ve TNFR-1‟in sitoplazmik uzantısı, bir ölüm bölgesi (death domain, DD) ve RIP (receptor interacting protein) ile etkileĢimdedir. Ölüm bölgelerin içeren bu TRADD (TNFR-1 associated death domain) ve RIP proteinleri, prokaspaz-8‟in aktivasyonu ile apoptozisi doğrudan uyarırlar. Aktive olan kaspaz-8 daha sonra diğer uygulayıcı kaspazları aktive eder (Tomatr 2003, Ulukaya 2003).
1.4.4.Apoptozisin Tetiklenmesi
Bu olay hücre içi ve dıĢından gelen sinyallerle gerçekleĢir.
Ġçsel sinyallerle tetiklenen apoptozis mekanizması:
Ġçsel sinyallerle tetiklenen apoptozis mekanizması, mitokondriyal baĢlangıçlı, reseptörden bağımsız, doğrudan hücre içi hedeflere etki eden sinyaller üreterek apoptozisi baĢlatır. Mitokondriyon bağımlı bu yol daha çok hücresel stresle (sitotoksik ilaç, hipoksi, hipertermi, viral infeksiyonlar, mor ötesi ıĢınlar, radyasyon, büyüme faktörleri ve hormonların eksikliği vb) aktive olur. Tüm bu uyarılar, çift zarlı organeller olan mitokondriyonlarda transmembran potansiyel kaybına ve iç membranının geçirgenliğinde bir değiĢime yol açar ve sitokrom-C sitosole salınır (Garrido ve ark 2006). Mitokondriyonun aktivasyonuna yol açan en önemli faktör Bcl-2 ailesidir. Hem pro-apoptotik hem de anti-apoptotik üyeleri olan bu ailenin üyelerinin mitokondriyon üzerindeki etkileriyle ya sitokrom-C‟nin sitoplazmaya salıverilmesi gerçekleĢir (apoptozisin baĢlaması), yada sitokrom-C‟nin sitoplazmaya
29 salıverilmesi baskılanır (apoptozisin inhibisyonu). Anti-apoptotik bcl-2 ailesi üyelerinin en iyi bilinenleri; bcl-2, bcl-Xl, Mcl-1 iken, pro-apoptotik olanlar ise; Bax, Bid, bcl-Xs, Bak‟dır. Bax, Bid, bcl-Xs, Bak gibi pro-apoptotik bcl-2 ailesi üyeleri normalde hücrelerde latent formda bulunurlar. Bu proapoptotik üyeler aktive edildiklerinde sitokrom-c‟nin sitoplazmaya salınıverilmesini sağlarlar. Bid‟in kırılmasına dolayısıyla aktifleĢmesine yol açan etken kaspaz -8‟in aktivasyonudur. Bid‟in aktive olduktan sonra diğer proapoptotik bcl-2 ailesi üyeleriyle reaksiyona girerek onların normalde bulundukları sitoplazmadan mitokondriyonlara göç etmelerine neden olur. Bu aktivasyon sonucu sitokrom-C sitosole salınır. Sitokrom-C, sitoplazmik bir protein olan APAF-1‟e bağlanarak onu aktive eder, ardından ATP‟nin de yapıya katılmasıyla apoptozom adı verilen bir kompleks oluĢur. Bu kompleks, inaktif olan prokaspaz-9‟un aktif kaspaz-9‟a dönüĢmesini sağlar. Aktif kaspaz-9 ise prokaspaz-3‟ü aktive eder (Susin ve ark 2000, Ulukaya 2003, Schimmer 2004). Aktive olan kaspaz-3, kaspaz kaskadını tetikler ve bunun sonucunda apoptozis gerçekleĢir.
ġekil 1.3. Apoptozis mekanizması (http://pics.34000.org/).
DıĢsal sinyallerle tetiklenen apoptozis mekanizması:
DıĢsal sinyallerle tetiklenen apoptozis mekanizması, hücre ölüm reseptörleri olarak bilinen Fas (APO-1, CD95) ve TNFR-1‟in ilgili ligandları ile etkileĢime