T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
BETA TALASEMİ MAJORLÜ HASTALARDA
KARDİAK DEMİR BİRİKİMİNİN T2* MRG İLE
DEĞERLENDİRİLMESİ VE SERUM FERRİTİN
DÜZEYİ İLE KORELASYONU
Dr. SELDA ERDİNÇ TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
BETA TALASEMİ MAJORLÜ HASTALARDA
KARDİAK DEMİR BİRİKİMİNİN T2* MRG İLE
DEĞERLENDİRİLMESİ VE SERUM FERRİTİN
DÜZEYİ İLE KORELASYONU
Dr. SELDA ERDİNÇ TIPTA UZMANLIK TEZİ
TEZ DANIŞMANI Prof. Dr. MURAT SÖKER
ÖNSÖZ
Tezimin tüm basamaklarında bilgi ve tecrübelerini benimle paylaşan, uzmanlık eğitimim boyunca bilgi, tecrübe ve etik değerlerle hekimlik sanatını öğrenmemde büyük katkıları olan tez danışmanım Prof. Dr. Murat Söker’e, Uzmanlık eğitimim süresince bilgi ve tecrübelerinden yararlandığım değerli hocalarım Prof. Dr. M.Celal Devecioğlu, Prof. Dr. Mehmet Ali Taş, Prof. Dr.Kenan Haspolat, Prof. Dr. Mehmet Fuat Gürkan, Prof. Dr. Aydın Ece, Prof. Dr. Ahmet Yaramış, Prof. Dr. Gökhan Baysoy, Doç. Dr. Ayfer Gözü Pirinççioğlu, Doç. Dr. Mustafa Taşkesen, Doç. Dr.Meki Bilici, Doç. Dr. Alper Akın, Doç. Dr. Fikri Demir, Doç. Dr. İlyas Yolbaş, Doç. Dr. Selvi Kelekçi, Doç. Dr. Müsemma Karabel, Doç. Dr. Velat Şen, Yrd. Doç. Dr. Ünal Uluca, Yrd. Doç. Dr. İlhan Tan, Yrd. Doç. Dr. Ali Güneş, Yrd. Doç. Dr. Fesih Aktar, Yrd. Doç. Dr. Sabahattin Ertuğrul, Yrd. Doç. Dr. Servet Yel, Uzm. Dr. Ruken Yıldırım, Uzm. Dr. Veysiye Hülya Üzel, Uzm. Dr. Edip Unal, Uzm. Dr. Hasan Balık, Uzm. Dr. Kahraman Öncel ve Uzm. Dr. Mehmet Türe’ye,
Hastalarımızın radyolojik değerlendirmesini yapan Yrd. Doç. Dr. Mehmet Güli Çetinçakmak ve istatiksel analizlerimizi yapan Yrd. Doç. Dr. İsmail Yıldız‘a,
Tezimin yazıya döküm aşamasında bana en büyük yardımı sunan canım kardeşim Yekzan Erdinç'e,
Yorucu, stresli hastane şartlarında hayatımı renklendiren, çalışmayı mutlu ve zevkli kılan, beraber mesleğimi öğrendiğim başta eş kıdemlerim olmak üzere değerli asistan arkadaşlarıma,
Çalışma ortamını paylaşmaktan mutluluk duyduğum hastane çalışanlarına yürekten teşekkür ederim.
Bu tezi; bitmeyen öğrencilik hayatım boyunca hep yanımda olan, bana her daim en büyük desteği veren, bugünlere gelmemi sağlayan başta canım annem -babam Seher-Yahya Erdinç, kardeşlerim Seval, Şevda ve Yekzan Erdinç ‘e,
Sevgisi ve desteğiyle hep yanımda olan yol arkadaşım nişanlım Ferhat Karakoç’a adıyorum.
Dr. Selda ERDİNÇ Ekim-2016
ÖZET
Amaç: Beta talasemi majorlü hastalarda demir birikimine bağlı olarak gelişen kardiyak komplikasyonlar başlıca ölüm nedenidir. Çalışmamızda beta talasemi major tanılı çocuklarda demir birikimine bağlı erken kardiyak etkilenmeyi gösteren noninvaziv bir yöntem olan kardiak MRG ile demir birikimi takibinde sık kullanılan serum ferritin düzeyi arasındaki ilişkiyi göstermeyi amaçladık.
Gereç ve Yöntem: Bu çalışma 2004-2016 yılları arasında Dicle Üniversitesi Tıp Fakültesi Çocuk Hematolojisi ve Onkolojisi Bilim Dalı ‘nda yapıldı. Çalışmaya aldığımız hastalar düzenli transfüzyon programında olan, dokuz yaş ve üstü olan hastalardan seçildi. Hastaların dosya kayıtlarından, hastane veri sisteminden hasta bilgilerine ulaşıldı. Hastaların kardiak T2* MRG, karaciğer T2* MRG, serum ferritin düzeyleri, yaş, cinsiyet, kullandıkları şelatör ilaç tipleri, transfüzyon öncesi hemoglobin değerleri ve transfüzyon sıklığı parametreleri istatiksel olarak karşılaştırıldı.
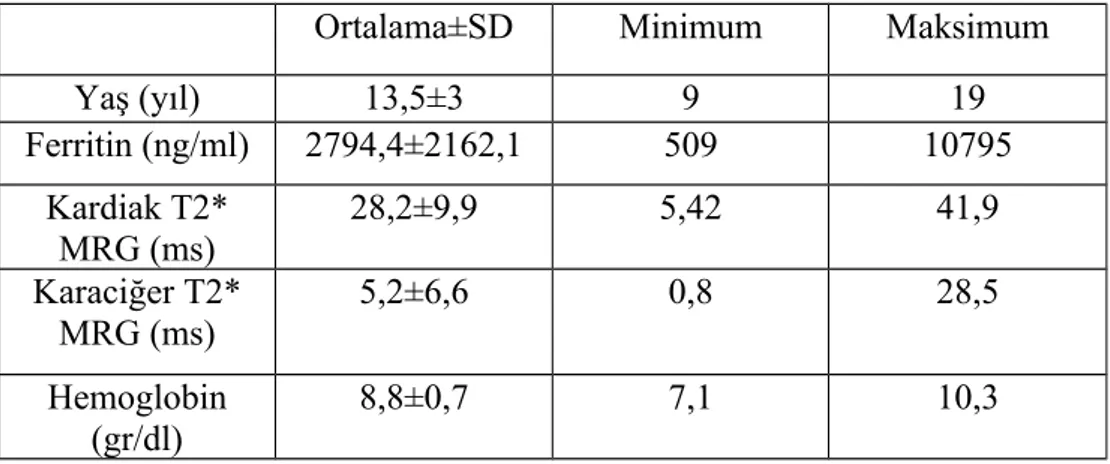
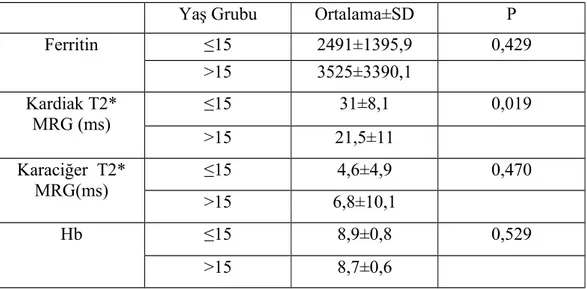
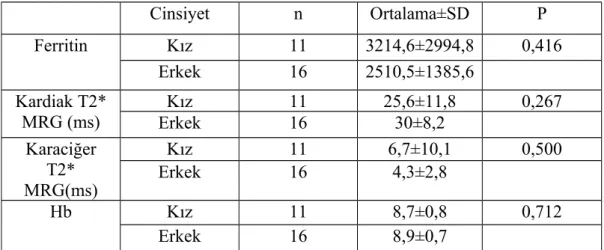
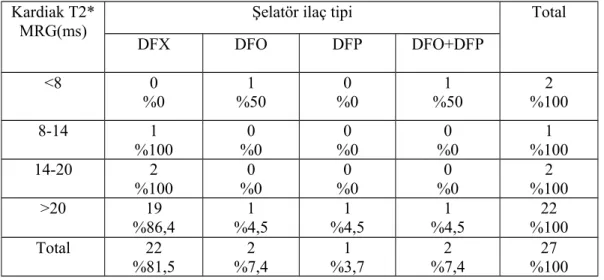
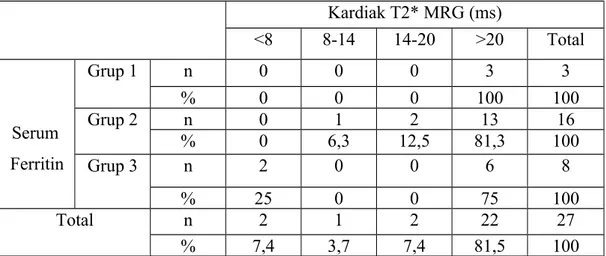
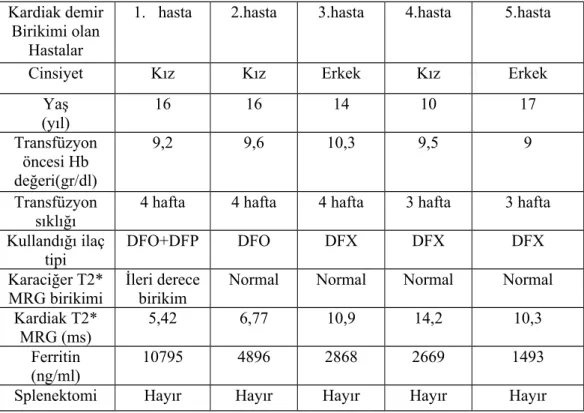
Bulgular: Çalışmamız 27 hasta ile yapılmıştır. Hastalarımızın yaşları 9-19 arasında olup; yaş ortalaması 13,5±3 yıl idi. Hastaların 11’i (%40,7) kız, 16’sı (%59,3) erkek idi. Çalışmaya dahil edilen hastaların tümü şelatör tedavi almakta idi. Deferasiroks kullanan 22 (%81,5), desferoksamin kullanan iki (%7,4), deferipron kullanan bir (%3,7) ,desferoksamin+deferipron kombine tedavi alan iki (%7,4) hasta idi. Hastalarımızdan sadece bir tanesinde splenektomili olguya rastlandı. Transfüzyon sıklığı dört haftada bir olan 23 (%85,2), üç haftada bir olan dört (%14,8) hasta idi. Ferritin ortalama değeri 2794,4±2162,1 ng/ml, minimum ferritin 509 ng/ml maksimum ferritin 10795 ng/ml idi. Kardiak T2* MRG ortalama T2 değeri 28,2±9,9 ms, T2 ölçümü minimum 5,42 ms maksimum 41,9 ms idi. Karaciğer T2* MRG ortalama T2 değeri 5,2±6,6 ms, transfüzyon öncesi bakılan hemoglobin ortalama değeri 8,8±0,7 gr/dl saptandı. Yapılan istatiksel değerlendirmede kardiak T2 değeri ile yaş arasında anlamlı ilişki saptandı (p=0,019). Kardiak demir birikimi saptanan beş hastanın görece ferritin değerlerinin de yüksek olduğu görüldü ancak serum ferritin düzeyi ile kardiak T2 değeri arasında anlamlı ilişki saptanmadı.
Sonuç: Beta talasemi major hastalarında kardiak demir birikiminin değerlendirildiği çalışmamızda; hastaların kardiak demir birikiminin yaşla ilişkili olduğu görüldü. Serum ferritin düzeyinin kardiak demir birikimini göstermede yeterince yararlı olmadığı görüldü.
ABSTRACT
Objective: Cardiac complications resulting from iron accumulation in patients with major beta-thalassemia are the main causes of death. In our study we aimed to show the relation betweena noninvasive method of cardiac MRI showing early cardiac affection caused by iron accumulationin children diagnosed with major beta-thalassemia and serum ferritin level that is frequently used to follow up iron accumulation.
Materials and Methods:This study was conducted at Dicle University Faculty of Medicine, Department of PediatricHematology and Oncology between the years of 2004-2016. Patients, that were included in the study, selected from the ones whowere on regular transfusion programme, nine years old and older. Patient data was obtained from patient file records and hospital data system. Cardiac T2*MRI, liver T2*MRI, serum ferritin levels, age, gender, used chelator drug types, pre-transfusion hemoglobin values and frequency of pre-transfusion parameters of patients were statistically compared.
Results: Our study was conducted with 27 patients. The patients were between the ages of 9-19 years with an average age of 13.5 + 3 years. 11 (40.7 %) of the patients were female, 16 (59.3 %) of them were male. All the patients included in the study were being treated with chelator. Deferasirox were used by 22 (81.5%) patients, desferrioxamine were used by two (7.4 %), deferiprone was used by one (3.7 %), combined treatment of desferrioxamine+deferiprone were taken by two (7.4 %) patients. Only in one of our patients splenectomy case was encountered. Transfusion frequencies of 23 (85.2 %) patients wereonce in four weeks, four (14.8 %) patients were once in three weeks. Average ferritin value was 2794.4+2162.1 ng/ml, minimum ferritin was 509 ng/ml and maximum ferritin value was 10795 ng/ml. Cardiac T2*MRI average T2 value was 28.2+9.9ms, measured T2 minimum value was 5.42 ms and maximum value was 41.9 ms. Liver T2*MRI average T2 value was 5.2+6.6 ms, pre-transfusion average hemoglobinvalue was detected as 8.8+0.7 gr/dl. According to the applied statistical analyses a significant relation
between cardiac T2 value and age was found (p=0.019).Five of the patients diagnosed with cardiac iron accumulationhad also elevated relative ferritin valuesbut a significant relation between serum ferritin levels and cardiac T2 was not found.
Conclusion:In our study cardiac iron accumulation was evaluatedin patients with major beta-thalassemia; it was observed that cardiac iron accumulation of patients was related to age.Serum ferritin level was not that helpful in showing cardiac iron accumulation.
İÇİNDEKİLER ÖNSÖZ ... ÖZET ... ABSTRACT ... İÇİNDEKİLER ... TABLO LİSTESİ ... KISALTMALAR LİSTESİ ... 1. GİRİŞ VE AMAÇ ... 2.GENEL BİLGİLER ... 2.1 Talasemi Tanımı ve Epidemiyolojisi ... 2.2. Talasemilerde Klinik ... 2.2.1. Alfa Talasemi ... 2.2.2. Beta Talasemi ... 2.2.2.1. Sessiz Beta Talasemi Taşıyıcılığı ... 2.2.2.2. β Talasemi Taşıyıcılığı ... 2.2.2.3. Talasemi İntermedia... 2.2.2.4. Beta Talasemi Major ... 3. GEREÇ VE YÖNTEM ... 4. BULGULAR ... 5. TARTIŞMA ... 6. SONUÇLAR ... 7. KAYNAKLAR ... i ii iv vi vii viii 1 3 3 3 3 4 4 5 5 6 27 30 39 45 47
TABLO LİSTESİ
Tablo 1. Demir şelatör ilaçların özellikleri ... Tablo 2. MRG çekim parametreleri ... Tablo 3. Hastaların cinsiyet, transfüzyon sıklığı, Hb değeri, yaş grubu
parametrelerine ait temel istatistik değerlendirmesi ...
Tablo 4. Değişkenlere ait temel istatistiklerin değerlendirilmesi ...
Tablo 5. Cinsiyete göre ferritin dağılımı ...
Tablo 6. Yaş gruplarının ferritin, Karaciğer T2* MRG, Kardiak T2* MRG, Hb değeri ile ilişkisi ...
Tablo 7. Cinsiyetin ferritin, Karaciğer T2* MRG, Kardiak T2* MRG, Hb
değeri ile ilişkisi ...
Tablo 8. Cinsiyete göre şelatör ilaç tiplerinin dağılımı ...
Tablo 9. Şelatör ilaç tipleriyle Kardiak T2*MRG T2 ölçümü arasındaki ilişkinin değerlendirilmesi ...
Tablo 10. Karaciğer T2* MRG ile kardiak T2* MRG arasındaki ilişkinin
değerlendirilmesi ...
Tablo 11. Serum ferritin düzeylerinin gruplandırılması ve cinsiyete göre dağılımı... Tablo 12. Serum ferritin düzeyi ile şelatör ilaç tipleri arasındaki ilişkinin
değerlendirilmesi ...
Tablo 13. Serum ferritin düzeyleri ile Kardiak T2* MRG T2 ölçümleri
arasındaki ilişkinin değerlendirilmesi ...
Tablo 14. Kardiak T2* MRG’de birikim saptanan olguların değerlendirilmesi ... 16 28 30 31 31 32 33 33 34 35 35 36 36 37
KISALTMALAR LİSTESİ
AAS : Atomik absorbsiyon spektrometrisi AES : Atomik emisyon spektrometrisi ALP : Alkalen fosfataz
ALT : Alanin transferaz AST : Aspartat transferaz
BLS : Biomagnetic Liver Susceptometry DFO : Desferoksamin
DFP : Deferipon DFX : Deferasiroks DM : Diabetes Mellitus
DEXA : Dual x-ray aborbsiyometri EF : Ejeksiyon-fraksiyon EMA : Avrupa İlaç Ajansı Fe+3 : Ferrik demir
FDA : Food and drug administration GDF15 : Growth and diferantiation factor GGT : Gama glutamil transferaz GİS :Gastrointestinal sistem GvHD : Greft versus host hastalığı Hb : Hemoglobin
HbF : Fötal hemoglobin HBV : Hepatit B virus HCV : Hepatit C virus
HLA : Human Lökosit Antijeni
HPLC : High pressure liquid chromatography IGF-1 : İnsülin benzeri büyüme faktörü
IGFBP3 : İnsülin benzeri büyüme benzeri bağlayıcı protein KMD : Kemik mineral dansitometrisi
LIC : Karaciğer demir konsantrasyonu MCH : Ortalama eritrosit hemoglobini MCV : Ortalama eritrosit hacmi
MRG : Manyetik rezonans görüntüleme MS : Milisaniye
NTBI : Plazma transferine bağlı olmayan demir OGTT : Oral glukoz tolerans testi
RDW : Kırmızı küre dağılım genişliği RES : Retiküloendotelyal sistem RNA : Ribonükleik asit
SD : Standart sapma sT3 : Serbest T3 sT4 : Serbest T4
SQUID : Super-conducting Quantum Interference Device TGF-β : Doku büyüme faktörü β
TSH : Tiroid stimüle edici hormon TWSG-1 : Twisted gastrulation protein-1 VKİ : Vücut kitle indeksi
1. GİRİŞ VE AMAÇ
Talasemiler en sık görülen tek gen hastalığıdır. Beta talasemi major hastalarında β globin zincirinin, homozigot ya da çift heterozigot mutasyonlarına bağlı olarak yokluğu (β0) veya azlığı, eritrositlerde α globin zincir fazlalığına ve zincir oranlarında dengesizliğe yol açarak ağır bir klinik tabloya neden olmaktadır . Eritrositlerde α globin zincir fazlalığına bağlı olarak, eritrosit membranında hasarlanma, hemoliz, kemik iliğinde inefektif eritropoez ve bunların sonucu olarak anemi görülmektedir. Anemi eritropoetin üretimini artırarak ekstramedüller hematopoeze yol açmakta, hastalarda burun kökünde basıklık, mongoloid yüz görünümü gibi iskelet-yüz değişiklikleri ve hepatosplenomegali gelişmektedir (1,2). Yapılan kan transfüzyonları ve artmış gastrointestinal demir absorbsiyonu nedeniyle sekonder hemokromatozis gelişmekte ve demir başlıca kalp, karaciğer, dalak, endokrin organlar başta olmak üzere tüm dokularda birikerek ilerleyici toksisite geliştirebilmektedir. Kan transfüzyonu ve demir şelasyonu homozigot talasemi tedavisinin temelidir . Düzenli kan transfüzyonları ile hastaların normal büyüme, gelişme ve aktiviteleri sağlanmış olur. Ayrıca düzenli demir şelasyon tedavisi alan hastalarda kardiak, hepatik ve endokrin başta olmak üzere demir birikimine bağlı organ yetmezlikleri önlenebilir (2).
Dokularda demir birikiminin invazif olmayan metodlarla belirlenmesi hastaların bu komplikasyonlar yönünden yeterli takibine olanak verir. Bu amaçla kardiak T2* manyetik rezonans görüntüleme (MRG) altın standard olarak kullanılmaktadır . Yine karaciğerdeki demirin tayininde hepatik T2* ya da R2* MRG ile yapılan ölçümlerin karaciğer biyopsisi ile yapılan karaciğer demir konsantrasyonu (liver iron concentration, LIC) ölçümleri ile korele olduğuna dair yeterli veri bulunmaktadır (2).
Talasemi majorlü (TM) hastalarda en önemli mortalite ve morbidite nedeni kardiyak komplikasyonlardır. Kardiyak fonksiyon bozukluğunun nedenleri, kronik hemolitik anemiye bağlı ventriküler kontraktilite artışı, ventriküllerde genişleme ve demir birikimidir. Çalışmamızda kardiak demir birikiminin kalp yetmezliği gelişmeden erken dönemde farkedilmesi için kullanılan, noninvaziv bir yöntem olan
kardiak T2* MRG ile serum ferritin düzeyi arasındaki ilişkiyi ortaya koymayı amaçladık.
2.GENEL BİLGİLER
2.1 Talasemi Tanımı ve Epidemijolojisi
Talasemiler, otozomal resesif geçiş gösteren, hemoglobin (Hb) zincirlerinden birinin veya birkaçının hasarlı senteziyle gelişen, hipokrom mikrositer anemi ile karakterize bir grup hastalıktır. Talasemi, α, β, γ, δ olarak tanımlanan Hb zincirinin veya zincirlerinin az sayıda veya hiç yapılamaması ile oluşmaktadır. Bu tanımlamaya göre, alfa zincir yapım azlığı alfa talasemiye, beta zincir yapım azlığı beta talasemiye neden olmaktadır. Beta zincir yapımı hiç yoksa β0, beta zincir yapımı az da olsa yapılıyorsa β+ talasemi adı verilir (1-7).
Talasemi; ‘‘talas’’ deniz ve ‘‘anemia’’ kansızlık kelimelerinin birleşmesiyle oluşmuş; ‘‘Deniz Anemisi’’ anlamına gelen Yunan asıllı bir kelimedir (1). Dünya genelinde talasemi taşıyıcılığı sıklığı %1,5 iken, bazı bölgelerde bu sıklık %2,5-25 arasında değişmektedir (7). Ülkemizin içinde bulunduğu Akdeniz Havzasında β-talasemi daha sık görülmektedir. Türkiye'nin genelinde taşıyıcılık oranı %2,1 görülmekle beraber, bazı bölgelerimizde %10’un üzerine çıkmaktadır (8).
2.2. Talasemilerde Klinik 2.2.1. Alfa Talasemi
Alfa globülin geni 16. kromozomun kısa kolunda yer alıp, çift kopyadır ve diploid hücrelerde 4 adet bulunur. Alfa globülin genini etkileyen 30’dan fazla mutasyon bildirilmiştir ve mutasyonlar sıklıkla delesyonlar şeklindedir. Bazı mutasyonlar α globin gen ekspresyonunu ortadan kaldırırken (α0), bazıları ise değişik derecelerde gen ekspresyonunu azaltır (α+). Etkilenen gen sayısıyla ilişkili olarak klinik vermektedir (1,2).
1.Sessiz α taşıyıcısı (-α/αα): Alfa geninin sadece birinde mutasyon vardır. Yenidoğan döneminde kordon kanında %2-5 oranında Hb Bart’s (γ4) tespit edilir. Bu hastalar klinik ve hematolojik olarak tamamen normaldirler. Tam kan sayımında ortalama eritrosit hacmi (MCV) ve ortalama eritrosit hemoglobini (MCH) değerleri normal aralıklarda seyretmektedir. Yenidoğan devresi dışında bu bireylerin tesbiti ancak in- vitro Hb zincir sentezi yada DNA çalışmalarıyla mümkün olabilir (2).
2. α talasemi taşıyıcısı (--/αα) ya da (-α/-α): İki alfa geninde mutasyon olup,hipokrom mikrositer eritrositler görülmektedir. Yenidoğan döneminde Hb Bart’s %3-8 arasındadır ve 6 aydan sonra kaybolur. Tam kan sayımında MCV ve MCH değerleri düşüktür. Periferik kan yaymasında, hipokromi, mikrositoz, anizositoz, polikromazi görülebilir. Tanı demir eksikliği ve β talasemi taşıyıcılığı dışlanan hastalarda genetik çalışma yapılması ile konulabilir (9).
3. HbH hastalığı (--/-α): Üç alfa geninde delesyon mevcut olup,hemoglobin elektroforezinde %20-40 oranında Hb Bart’s tespit edilir. Daha sonra Hb Bart’s yerini %5-30 oranında Hb H’e (β4) bırakır. Hemoglobin değerleri 7-11 g/dl civarındadır. Klinik bulgular talasemi intermedia veya ondan daha hafif bir tabloya yol açabilir. Hipokromi ile mikrositoz görülür. İndirekt hiperbilirubinemi, kolelitiazis, talasemik yüz görünümü, hepatosplenomegali, bacak ülserleri görülebilir (10).
4. Alfa talasemi majör (--/--): Dört alfa geninde kısmi veya tam delesyon veya fonksiyon kaybı sonucu oluşur. Doğumda majör hemoglobin, Hb Bart’s olup az miktarda HbH ve Hb Portland olabilir. Bu bebekler hidrops fetalis nedeniyle sıklıkla intarauterin hayatta kaybedilirler (2).
2.2.2. Beta Talasemi
Beta globülin geni ise 11. kromozomun kısa kolunda yer alır. En sık görülen mutasyonlar nokta mutasyonları olup, türk toplumunda otuzu aşkın mutasyon tanımlanmıştır. Türkiye’de en sık görülen mutasyonlar: I-110 (%40), bunu IVS-I-6, IVS-I-1, FSC-8, IVS-I-1, IVS-II-745, IVS-II-1, Cd39 ve FSC-5 mutasyonları izlemektedir (11,12). Eğer moleküler defekt β-globin zincir sentezine izin vermiyor ise; βº-talasemi %5-30 civarında, β-globin zincir sentezi sağlanabiliyorsa β+-talasemiden söz edilir (4).
2.2.2.1. Sessiz Beta Talasemi Taşıyıcılıği
Sağlıklı fenotipik özellikte olup, HbA2 seviyesi normal sınırlardadır. Hafif bir mikrositozları olabilir. Bir kısmında periferik kan yaymasında eritrosit morfolojisine
ait tipik talasemik özellikler görülürken, bir kısmının kan yayması normaldir (2). İtalyan, Bulgar ve Türklerde bu tip fenotipe yol açan en sık mutasyon promotor bölgedeki nokta mutasyonu; -101 pozisyondaki sitozin yerine timinin gelmesi ile olmaktadır (10-13).
2.2.2.2. β Talasemi Taşıyıcılığı
Bu bireylerde β globin genlerinden sadece birinde mutasyon mevcuttur. Tipik olarak hemoglobin elektroforezi incelemesinde HbA2 düzeyi artmıştır (%3.5-8) (14). Eşlik eden demir eksikliği HbA2 sentezini azaltacağı için, hemoglobin elektroforezinde HbA2 normal saptanabilir. Bu sebeple, öncelikle demir eksikliği düzeltilip daha sonra hemoglobin elektroforezi ile hastanın değerlendirilmesi gerekir (15). Ayrıca, folik asit ya da vitamin B12 eksikliğinin yol açtığı megaloblastik anemilerde HbA2 yüksek bulunabilir (2). Beta talasemi taşıyıcılarında tam kan sayımında hafif anemi, hafif eritrositoz (>5 milyon/mm3), MCV <80fl, RDW normal beklenir. Periferik kan yaymalarında mikrositoz, hipokromi, bazofilik noktalanma, “target” hücreleri görülebilir. β talasemi taşıyıcılığı ve demir eksikliği birbirinden ayırt edilmelidir. β talasemi taşıyıcılarında mikrositoz daha derindir. β talasemi taşıyıcılarında hafif eritrositoz varken, demir eksikliği anemisi bir yapım eksikliği anemisi olduğundan kırmızı küre düşüktür . Kırmızı küre dağılım genişliği (RDW) ise sıklıkla talasemi taşıyıcılarında normal, demir eksikliğinde artmış olmakla birlikte; talasemi taşıyıcılığında da artabileceğinden güvenilir bir ayırıcı değildir (16). Tam kan sayımından yararlanılarak, MCV değerinin eritrosit kitlesine bölünerek hesaplandığı ‘‘Mentzer İndeksi’’, yine demir eksikliği-talasemi taşıyıcılığı ayrımında kullanılmaktadır. Mentzer indeksinin; 13’den küçük olması talasemi taşıyıcılığı, büyük olması demir eksikliği lehinedir (5).
2.2.2.3. Talasemi İntermedia
Altta yatan moleküler defekt β+ veya sessiz beta talasemi mutasyonlarının homozigot veya bileşik heterozigot beraberliğidir (2). Talasemi taşıyıcılığı ile transfüzyon bağımlı talasemi major arasında yer alan bu klinik formda hastalar transfüzyonsuz hemoglobin değerlerini >7g/dl seviyesinde tutabilmektedirler. Hematokrit, MCV, MCH değerlerinde azalma, RDW’de artış mevcuttur.
Hemoglobin elektroforezinde: HbA düşük (%10-20), HbF yüksek (%70-80) saptanmaktadır (16). Orta derecede hemolitik anemi, hiperbiluribinemi ve hepatosplenomegali görülür. Klinik olarak hastalar talasemi majordan daha geç tanı alırlar. Araya giren enfeksiyonların sebep olduğu hemolitik veya aplastik krizler, gebelik, folik asit eksikliği ya da hipersplenizme bağlı olarak derin anemi oluşabilir ve transfüzyon ihtiyacı gelişebilir (17-19). Bu hastalar genellikle iyi bir büyüme ve seksüel gelişim gösterirler. Bazı talasemi intermedia hastalarında ise; hemoglobin seviyesi > 7g/dl olmakla birlikte gelişme geriliği ve kemik deformiteleri oluşabilir, fakat erken ve düzenli transfüzyonla bu bulgular düzeltilebilmektedir (1,2). Bazı hastalarda masif splenomegali gelişmekte ve buna bağlı pansitopeni tablosu oluşmakta ve splenektomi gerekebilmektedir. Hastalarda ilerleyen yaşlarda kronik anemiye bağlı pulmoner hipertansiyon, artmış demir emilimine bağlı sekonder hemosiderozis ile ilişkili kalp ve karaciğer hasarı görülebilmektedir (18). Takibinde büyüme gelişme, kemik değişiklikleri ve splenomegali yönünden izlem, gerektiğinde kan transfüzyonu, splenektomi ve demir şelatörleri uygulanır. Talasemi intermedialı hastalarda kan transfüzyonu almasalar bile, artmış intestinal demir emilimine bağlı demir birikimi görülebilmektedir. Bu sebeple bu hastaların demir birikimi yönünden serum ferritin ve karaciğer demir birikimlerinin karaciğer biyopsisi ya da T2*/R2* MRG ile izlemi ve birikimin bu hastalar için belirlenen eşik değerlerin üzerine çıkması durumunda demir şelasyon tedavisinin başlanması yönünde literatürde veriler mevcuttur (20).
Talasemi intermedia hastalarında; büyüme ve gelişmede duraksama, yüz kemiklerinde değişiklik olması, hipersplenizm gelişmesi, ekstramedüler hematopoez oluşması, bacak ülserleri ve patolojik kırık görülmesi, kardiyak komplikasyonların gelişmesi, enfeksiyon ve gebelik dönemleri, egzersiz kapasitesinde azalma olması kan transfüzyonu yapılmasını gerektiren endikasyonlardır (21).
2.2.2.4. Beta Talasemi Major
Her iki genin de defektif olduğu beta-talasemi sendromudur. Hastalar ya homozigot ya da bileşik-çift (compaund) heterozigot olarak talasemi mutasyonunu taşırlar (1,2). Nadiren otozomal dominant kalıtılan talasemi majorlu hastalar da olabilir (22). Kişinin taşıdığı moleküler defektin şiddeti, hastalığın klinik şiddetinin
belirleyicisi olmaktadır. Β-globin genindeki bazı mutasyonlarda, ɣ-globin gen ekspresyonunu etkilenmektedir. Bireyin ɣ-globülin sentez etme kapasitesi hastanın HbF (α2ɣ2) düzeyini arttırarak anemiyi hafifletmekte, yine eşlik eden α-talasemi mutasyonu, α ve β zincirleri arasındaki dengesizliği azaltarak hastalığın kliniğini hafifletebilmektedir (23,24).
a. Beta talasemi majorun patofizyolojisi
Beta globülinin sentezinin azalması veya hiç olmaması sonucu, eritrosit öncüllerinde göreceli olarak beta globülin ile eşleşemeyen alfa globülin tetramerleri birikip çökmeye başlar. Hücre çekirdeğinde biriken tetramerler, eritrosit öncüllerinde bölünmeyi engeller. Tetramerlerin sitoplazmada birikimi; hem mekanik hem de oksidatif stres sonucu hücre zarında ve hücre içi iskeletinde hasara sebep olmaktadır. Mitokondriyal fonksiyonları bozarak artmış kalsiyum girişine ve hücrenin ölümüne neden olurlar. Ayrıca bu tetramerler eritrositlerin şekil değiştirebilme yeteneğini de bozdukları için, bu eritrositler hem kemik iliği hem de dalakta sinüzoidlerde takılıp parçalanmaktadırlar. Hastalarda anemiyi kompanse etmek için artmış eritropoetik aktiviteye rağmen, eritropoetik öncüllerdeki kayıp sonucu hemoglobin sentezi ileri derecede azalmıştır, yani ‘‘inefektif bir eritropoez’’ vardır. Artmış medüller eritropoez kemiklerde şekil bozuklukları ve kortikal kemikte incelmelere neden olur. Ağır inefektif eritropoeze bağlı olarak ‘‘eksramedüller’’ alanlarda (karaciğer, dalak, lenf nodu vb. ) sekonder eritropoez odakları oluşur ve buna bağlı olarak dokularda genişleme olur (1,2,25) .
b- β talasemi majorde klinik
β talasemi major hastası bebeklerde doğumda talasemi ile ilgili klinik bulgu yoktur. Hasta bebekler doğumda HbF yüksekliği nedeniyle asemptomatiktirler. γ globin zincir yapımı yaşamın ilk 4-6 ayı içinde hızlı bir şekilde azalır (HbF, HbA ya dönüşür) ve hastalarda anemi gelişir. Yaşamın 4-6. aylarında anemi ve buna bağlı semptomlar ortaya çıkar. Halsizlik, iştahsızlık, solukluk, kilo almada yetersizlik, büyüme ve gelişmede gerilik, hepatosplenomegaliye bağlı karın şişliği, sık enfeksiyon gibi bulgular ile hastanelere başvururlar. Bu hastalara kan transfüzyonu
yapılmaz ise anemi derinleşir, kalp yetmezliği bulguları gelişir ve hastalar kalp yetmezliğinden kaybedilebilirler (2,17).
Hastalar büyüdükçe büyüme gelişme geriliği, maksiller bölge kemiklerinde belirginlik, frontal kemiklerde çıkıntı ile karakterize “talasemik yüz” denilen tipik yüz görünümü oluşur. Humerus ve femur gibi uzun kemiklerin epifizindeki çizgilerin erken birleşmesi sonucu kemikler kısalır. Kafa kemiklerinde belirgin olan değişiklikler, artan hematopoetik doku aktivitesi nedeniyle medullanın kemik aleyhine gelişmesinden ileri gelir (26).
c- β talasemi majorde tanı
Hastaların ağır anemiye eşlik eden düşük MCV (50-70 fl) ve MCH (12-18 pg) değerleri vardır (1,28). Hipersplenizme bağlı lökopeni ve trombositopeni gelişebilir (14). Periferik yaymada santral solukluğu artmış eritrositler (hipokromi), küçük eritrositler (mikrositoz), çeşitli şekil değişiklikleri (poikilositoz), eritrositler arasında çap farklılıkları (anizositoz), target hücreler, bazofilik noktalanmalar ve normoblastlar görülür. Kemik iliğinde eritroid seride hiperplazi, normoblastlarda demir granüllerinde artış olur.Hastaların kemik iliğinde aşırı artmış bir eritropoez vardır.
Serum demiri yüksektir, demir bağlama kapasitesi azalmıştır. Transferrin saturasyonu %80 ve üzerindedir. Ferritin yaşa göre artmıştır. Hemoliz nedeniyle indirekt bilirubin ve laktat dehidrogenaz yüksektir. β-talasemi major ve taşıyıcılarının belirlenmesinde hemogram ve hemoglobin elektroforezi kullanılmaktadır. Hemoglobin elektroforezinde β0 talasemi homozigot hastalarda HbA görülmezken, HbF düzeyi % 92-95 ‘tir.
Yapılan moleküler tanı çalışmalarında; β-talasemilerin büyük çoğunluğu nokta mutasyonları sonucu oluştuğu görülmüş olup, 200’den fazla mutasyon tanımlanmıştır. Ülkemizde birinci sıklıkta görülen IVS-I-110 mutasyonudur. (27).
d. Beta talasemi majorde tedavi
1. Transfüzyon tedavisi: Beta-talasemi hastalarının tedavisinde kan transfüzyonu en büyük destektir. Transfüzyon ile hemoglobin düzeyi yükselir, böylece kanın oksijen taşıma kapasitesi artar ve doku hipoksisi azalır. Doku
oksijenizasyonunun düzelmesi normal büyüme ve gelişmenin sağlanmasına yardımcı olur. Eritropoezin baskılanması ile birlikte intestinal demir emilimi azalır (14,25). Hayatın ilk 10 yılında büyümenin normal olarak devam etmesi transfüzyon rejiminin yeterli olduğuna işaret eder (2). Buna göre hastalara pretransfuzyon hemoglobin düzeyi en az 9.5 g/dl’nin üzerinde olmasını sağlayacak transfuzyon aralığı ile (3-5 hafta) hastalara 10-20 cc/kg eritrosit suspansiyonu verilir. Hastaların transfuzyon sonrası hemoglobin değeri 15 g/dl’nin üzerine çıkartılmamalıdır. Mümkün olduğunca taze eritrosit süspansiyonu verilmelidir. Transfüze edilecek eritrosit süspansiyonunun raf ömrünün bir haftayı geçmiş olması ‘‘2,3 difosfogliserad’’ düzeyi düşük olacağı için önerilmez. İlk transfüzyondan önce; mutlaka hastaların ABO ve Rh alt gruplarının tayin edilmesi, daha sonra karşılaşılacak alloimmünüzasyon için önemlidir.
Tanı aldıktan sonra hastaların transfüzyon gereksiniminin olup olmadığının değerlendirilmesi: Hastaların hemoglobin değeri 7 g/dl altına düşürüyorsa veya talasemi intermedia olup; hastanın büyüme geriliği, ekstramedüller hematopoez bulguları ve kemik değişiklikleri varsa, hemoglobin düzeyi 8-9 g/dl olsa da düzenli transfüzyona başlanması gereklidir (1,2,16). İlk dekadda yeterli transfüzyon rejimi ile normal büyüme sağlanır. Daha büyük yaşlarda (13-19 yaş), büyüme geriliği yetersiz transfüzyondan daha çok endokrin disfonksiyonla ilişkilidir. Epifizler kapanıp büyüme tamamlandıktan sonra hemoglobin düzeyinin 8-9 g/dl tutulması iyi tolere edilebilir (2).
Transfüzyon ilişkili komplikasyonlar şunlardır:
En önemli ve kronik komplikasyonu “hemosiderozistir” ve ayrı bir bölümde tartışılacaktır. Diğer komplikasyonlar (14,16);
Alloimmünizasyon: Minör kan grup antijenlerine karşı alloimmünizasyon, hastaların %20-30’unda görülür. En sık anti-E, anti-c ve anti-kell alloantikorları görülür. Gecikmiş hemoliz ve erken transfüzyon ihtiyacı ile bulgu verir. Nadiren çok sayıda bulunan alloantikorlardan dolayı uygun transfüze edilecek kan bulunamayabilir. Alloimmun hemolitik anemi nadir, ancak ciddi bir komplikasyondur. Düzenli transfüzyona geç yaşlarda başlayan hastalarda daha sık görülür.
Febril reaksiyon ve allerjik reaksiyonlar: Febril reaksiyonlar en sık görülen transfüzyon reaksiyonlarından biridir. Transfüzyonu izleyen 30. dakika ile birkaç saat içinde meydana gelir. Lökosit filtrelerinin kullanımı febril reaksiyonları önemli ölçüde azaltmıştır. Allerjik reaksiyonlar plazma proteinlerinden kaynaklanır, IgE aracılığıyla gelişir. Hafif veya ağır olabilir. Hafif reaksiyonlar, ürtiker, döküntü, kaşıntıya neden olabilirken, ağır reaksiyonlar stridor, bronkospazm, hipotansiyon veya ölümle sonuçlanabilir. Eritrositlerin yıkanması ile plazma proteinleri ortadan kaldırıldığından allerjik reaksiyonların önlenmesinde faydalı olabilir.
Transfüzyona bağlı akut akciğer hasarı: Genellikle transfüzyon sonrası ilk altı saatte ortaya çıkar. Takipne, taşikardi, siyanoz, dispne ve ateşle karakterizedir. Vericideki lökosit antikorlarının alıcıdaki lökosit antijenleri ile reaksiyonu sonucu oluşan küçük agregatlar pulmoner mikrosirkülasyonda tıkaçlara yol açar. Tedavide oksijen, steroid ve diüretik uygulanır. Ağır olgularda mekanik ventilasyon gerekebilir.
Greft Versus Host Hastalığı: İmmunsuprese hastada verici lenfositlerin, alıcı dokularına karşı geliştirdiği ağır bir immün yanıttır. Çok sayıda ve sürekli transfüzyon alan bu hastalarda GvHD, transplant öncesi transfüze edilen kanın 25 Gray ışınlanması ile önlenebilir. Özellikle akrabadan yapılacak transfüzyonlarda ve hematopoetik kök hücre transplantasyonu alacak hastalarda ışınlama yapılmalıdır.
Akut hemolitik reaksiyon: Transfüzyona başlanılmasından birkaç dakika sonra veya saatler içinde gelişen; ateş, titreme, sırt ve bel ağrısı, hemoglobinüri, solunum güçlüğü ve şok bulguları ile seyreden ağır ve ölümcül olabilecek bir komplikasyondur. Hasta tanımlanması, kanın tiplendirilmesi ya da coss-match (çapraz karşılaştırma) testlerinde yapılan hatalardan kaynaklanır. Bu nedenle; her transfüzyondan önce mutlaka yeni gelişmiş olabilecek antikorlara yönelik çapraz karşılaştırma testlerinin yapılması ve transfüzyondan önce en az iki tanıtıcı verinin doğrulanması önerilir. Böyle bir durum geliştiğinde; hemen transfüzyonun sonlandırılması, intravasküler volümü arttırmak için hidrasyonun sağlanması ve idrar çıkışının sağlanması için diüretiklerin verilmesi gereklidir. Hastanın vital bulgularının ve idrar çıkışının yakın takibi, ‘‘Yaygın Damar İçi Pıhtılaşma Sendromu’’ açısından hastaların izlemi yapılmalıdır. Transfüze edilen kanın ve
hastadan yeniden alınan kan örneğinin acilen konuşularak kan merkezine gönderilmesi ve tekrar incelemelerin yapılması gereklidir.
Geç hemolitik reaksiyon: Son transfüzyondan 5-14 gün sonra ortaya çıkan sarılık, hemoglobin düzeyinde ani düşme ile bulgu verir. Transfüzyon sırasında saptanmamış ya da yeni gelişen alloantikordan kaynaklanır.
Viral enfeksiyonların geçişi: Donörlerin taranması, ayrıntılı olarak sorgulanması ve gelişmiş serolojik testlerin uygulanması ile bu komplikasyon azaltılabilir. Hepatit A ve B aşıları ile periyodik olarak donörün serolojik testlerinin yapılması önemlidir. Gelişmiş kan bankacılığında özellikle HIV, Hepatit B-C, sifilis için donörlerin taraması yapılmaktadır. Ancak, vericinin pencere döneminde olması, hastalık yapıcı etkenin saptanamamasına neden olabilir. Ayrıca yeni ortaya çıkan ve önemi bilinmeyen enfeksiyon ajanları açısından tarama yapılmaması nedeniyle transfüzyonlara bağlı enfeksiyon riski her zaman vardır (14,16).
2. Splenektomi: Dalak hem bozulmuş yapıdaki hücreleri ortadan kaldıran bir temizleyici, hem de açığa çıkan demiri toksik olmayan şekilde biriktiren bir depo görevi görür. Masif splenomegali; lökopeni, trombositopeni ve artmış transfüzyon ihtiyacına sebep olur. Daha çok düzensiz transfüzyon alan küçük hastalarda görülür. Splenektomi için endikasyon, hipersplenizm nedeni ile giderek artan transfüzyon ihtiyacıdır. Hemoglobin düzeyinin 10 g/dl’de devam ettirilebilmesi için yıllık 200-250 ml/kg’dan fazla saf eritrosit süspansiyonu ihtiyacı olması, genellikle hipersplenizm olarak tanımlanır (16,25). Artmış transfüzyon ihtiyacını hipersplenizme bağlamadan ve splenektomi kararı vermeden önce, diğer nedenler (alloimmünizasyon, donör kanındaki hematokrit değerinin düşüklüğü gibi) araştırılmalıdır.
Splenektomi nedeniyle görülebilecek komplikasyonlar akut dönemde portal ven trombozu ya da daha sonraki dönemde de görülebilecek Diplococcus pneumonia, Haemophilus influenzae , Niesseria meningitidis enfeksiyonlarıdır. Splenektomiden en az 15 gün önce polivalan pnömokok aşısı, meningokok ve haemophilus influenza aşıları yapılmalı ve bu aşılar beş yılda bir tekrar edilmelidir. Splenektomi sonrası oral penisilin tedavisi (günde iki defa 250mg) genellikle enfeksiyon profilaksisi için
kullanılır. Penisilin profilaksisinin ne kadar sürdürüleceği net değildir. Splenektomi sonrası enfeksiyon riski yaş ile birlikte azalır, fakat kaybolmaz.
Splenektominin 5 yaşından sonra yapılması, splenektomiden 3-6 hafta önce (en az 15 gün önce) pnömokok, meningokok ve H. influenzae aşılarının yapılması ve splenektomi sonrası penisilin profilaksisi başlanması dalağın aynı zamanda bağışıklık sistemi için de önemli bir organ olması nedeniyle görülebilecek enfeksiyon risklerini azaltır (29-31).
Yıllar sonra bile ölümcül pnömokok sepsisi gelişebilir. Splenektomili hastalarda gelişecek yüksek ateş, kültür sonuçları çıkana kadar agresif olarak parenteral antibiyotiklerle tedavi edilmelidir (29). Splenektomi sonrası hastalarda lökositoz ve trombositoz görülebilir. Splenektomi sonrası görülebilecek önemli ve hayatı tehdit edici diğer bir komplikasyon ise pulmoner hipertansiyondur. Bu nedenlerle splenektomi endikasyonu konulurken dikkatli davranılmalıdır (32).
3. Demir şelasyon tedavisi: Talasemi majorlu hastalarda eritrosit transfuzyonları ve artmış intestinal demir emilimi nedeniyle demir birikimi olmaktadır (16). Bir ünite eritrosit süspansiyonu, yaklaşık 200 mg demir içerir. İnsan fizyolojisinde demir regülasyonu intestinal absorbsiyon düzeyinde olmaktadır ve fizyolojik bir ekskresyon mekanizması bulunmamaktadır (2). Bu nedenlerle talasemili hastalarda dokularda demir birikimi kaçınılmazdır. Hastalarda özellikle karaciğer, kardiak ve endokrin organlar başta olmak üzere demir yüklenmesi gelişir. Bu dokularda biriken demir oksijen radikallerinin oluşmasına neden olarak doku hasarlanması ve organ yetmezliklerine yol açmaktadır (2). Yeterli şelasyon alamayan hastalarda demir birikimine bağlı kardiak problemler hastaların hayatlarının ikinci dekadında erken kaybedilmesine neden olur (2,25).
Demir şelasyonuna, düzenli transfüzyonun ilk bir yılı dolduğunda ve/veya 12-15 transfüzyon sonrasında ve/veya serum ferritin 1000 ng/ml düzeyine ulaştığında başlanır (2, 33). Demir şelasyonu kararında karaciğer demir yoğunluğunun saptanması şart değildir. Demir birikimi ile ilişkili komplikasyonlardan kaçınmak için serum ferritin düzeylerinin 500 - 1000 ng/ml seviyelerinde sürdürülmesi hedeflenmelidir (2,16). Düzenli transfüzyon alan hastalarda serum ferritin düzeyi
500’ün altına indiğinde, şelatör toksisite bulguları gelişmedikçe şelatör dozu düşürülmeli ancak tedavi kesilmemelidir (30).
İdeal demir şelatörünün, Fe+3 afinitesi ve spesifisitesi yüksek, metabolizması yavaş, şelasyon etkinliği yüksek, doku penetrasyonu iyi olmalı, demirin geri salınımına izin vermemeli, negatif demir dengesini sağlamalı, sadece aşırı demiri uzaklaştırırken, demir bağımlı enzim sistemleriyle etkileşmemeli ve toksik olmamalıdır (16).
Desferoksamin (DFO): Streptomices pilosus isimli bakteriden geliştirilen bir
şelatördür (33). Desferoksamin taşınabilir bir pompa aracılığıyla 8-12 saatlik subkutan infüzyon ile uygulanan, demire yüksek afinitesi olan bir hegzavalan hidroksilamindir (34). Desferoksamin iki yolla etkili olur; birinci yol demiri bağlayarak ferrioksamin 4’e dönüştürüp demiri vücuttan atmak, ikinci yol serbest radikaller üzerinden demirin zararlı etkilerini azaltmaktır (2). Eritrositlerin yıkımı ile oluşan demir DFO’ya bağlanıp idrar ile atılırken, hepatositlerdeki demir ise DFO’ya bağlanıp gaita ile atılır (2,16). İlacın etkinliği dozuna, veriliş yoluna, demir moleküllerinin boyutuna, vücuttaki C vitamini düzeyine ve hastanın şelatör tedavisine uyumuna göre değişmektedir. Desferoksaminin yarılanma ömrü 8-10 dakika olup plazma klirensi çok hızlı olduğundan subkutan ya da uzun süreli infüzyon yoluyla uygulanabilir (16). Ağır demir birikimi olan hastalarda haftanın 7 günü, 24 saatlik infüzyonla ve iv kullanım ile daha etkili şelasyon sağlanabilir . Vitamin C demir depolarını mobilize ederek DFO ile daha fazla demir atılımını sağlamaktadır. Bu amaçla sadece DFO infüzyonuna başlamadan hemen önce 200 mg p.o alınır (34). Fakat, DFO infüzyonundan bağımsız C vitamini kullanılmasından mobilize olan demir serbest radikal reaksiyonu yapabileceğinden kaçınılmalıdır (2). Büyüme tamamlanana kadar 40 mg/kg/günün aşılmaması, büyüme tamamlandıktan sonra ise 50 mg/kg/günün geçilmemesi önerilir. İlacın 2 yaşından önce kullanımı önerilmez (2).
DFO’nun en sık görülen yan etkisi uygulama yerindeki eritem ve subkutan nodüllerdir. Özellikle yüksek dozlarda nörosensöriyel tipte işitme kaybı yapabilir (35). Görmede ilerleyici yetersizlik, gece körlüğü, renk körlüğü ve görme alanı kaybı tanımlanmıştır (36). Bu nedenle, hastaların düzenli olarak 6 ayda bir odiyometrik ve
oftalmolojik muayeneleri yapılmalıdır. Bundan başka iskelet toksisiteleri, anafilaksi, pulmoner fibrozis gibi yan etkileri bildirilmiştir. Bu yan etkilerin görüldüğü hastalar, genellikle yüksek dozda DFO kullanan veya düşük ferritin düzeyi olan bireylerdir. Bu nedenle DFO kullanan hastalar için, DFO terapötik indeks hesabın kullanılması önerilmektedir (37).
(Terapötik indeks: DFO ortalama günlük doz (mg/kg)/ferritin < 0,025 olmalı)
Öte yandan bazı mikroorganizmalar demir alımı için DFO’yu kullanabilmektedir (16). Örneğin Yersinia enterocolitica bu şekilde DFO’dan yararlanabilir. Normalde ciddi bir enfeksiyona neden olmayan Yersinia, DFO alan talasemili hastalarda fatal seyirli olabilir. Sebebi açıklanamayan ateş varlığında, sebep tanımlanıncaya kadar DFO tedavisinin sonlandırılması önerilmektedir (39).
Deferipron (DFP): İlk kullanıma giren oral demir şelatörü "Deferipron’dur".
1980’li yıllarda klinik çalışmaları başlamış ve 1990 sonlarında ruhsat almıştır.. Deferipron bidentate ve lipofilik bir şelatördür. Lipofilik oluşu doku penetransının daha iyi olmasını sağlar. Glukuronidasyonunu izleyerek başlıca renal yolla atılır (40). Etkisi esas olarak plazmadaki transferine bağlı olmayan demirin (NTBI) mobilizasyonu ve atılımı şeklindedir. 75-100 mg/kg/gün bölünmüş dozlarda uygulanır (16, 33).
Deferiponun yan etkileri olarak nötropeni, agranülositoz, eklemlerde özellikle diz, dirsek, ayak, el bileklerinde ağrı, şişme, sertlik, hareketlerde kısıtlanma, bulantı, baş dönmesi, kusma, ishal, karın ağrısı, çinko eksikliği görülebilir. Deferipronun en ciddi yan etkisi agranulositozdur. DFP alan olguların %0.5-1’inde idiosinkratik agranulositoz ve %5’inde nötropeni görülebilir (41). Haftalık düzenli kan sayımı ile absolü nötrofil sayım kontrolleri DFP’nin agranülositoz riski nedeniyle mutlaka yapılmalıdır (42) .
Kombinasyon Tedavi: Mekik hipotezinde intraselüler demir Deferipron tarafından şelate edildikten sonra plazmadaki güçlü bir şelatör olan DFO’ya transfer edilir. Transferrinden DFP ile alınan demir, DFO’ya götürülerek normalde DFO’nun etki etmediği yerlerden, sinerjistik etkiyle demirin atılmasını sağlar (43).
Uluslararası oral şelatörler komitesi tarafından haftada 7 gün DFP (80-120 mg/kg/gün, 3 dozda) ve 3 gece DFO (40-60 mg/kg/gün) ile yapılan kombinasyon tedavilerinin; kalp ve diğer organlardan demirin atılmasında hızlı, etkin ve güvenilir olduğu gösterilmiştir. Özellikle DFO’ya uyumsuz, DFP’nin tek başına etkin olmadığı, demir yükünün hızla azaltılması gereken hastalarda (kök hücre transplantasyonu öncesi ya da ağır kardiyak yükü olanlar) önerilmektedir (16).
Deferasiroks (DFX): Deferasiroks tridentat bir demir şelatörü olup, bir demir
molekülünü bağlamak için 2 molekül deferasiroks gerekmektedir (33). Oral alımından sonra yarılanma ömrü 8-16 saat olup, demirin büyük oranda dışkı ile atılımını sağlar (16,33). Deferasiroks oral efervesan tabletlerle sabah saatlerinde alınmaktadır. Genellikle önerilen 30 mg/kg/gün dozunda günde bir kez şeklinde uygulama ile negatif şelasyon sağlanmasıdır (44). Doz cevap alınamadığında 40 mg/kg’a kadar çıkarılabilir (33).
En sık görülen yan etkileri; deri döküntüsü (%10,8), serum kreatininde hafif artma (%38), gastrointestinal sistem (GİS) (%15,2) yakınmalarıdır (45).
Deferasirox’un diğer bir yan etkisi transaminazlarda yüksekliktir. Tekrarlayan kontrollerinde karaciğer fonksiyon testlerinde düzelme olmaması ve on katı gibi bir artış olması durumunda deferasirox dozunun 10 mg/kg azatılması önerilir (33,44). Ayrıca deferasirox tedavisi sırasında ciltte ürtiker tarzı döküntüler görülebilmekte olup, hafif olgular tedaviyi sonlandırmaya gerek olmaksızın kendiliğinden geriler. Daha ağır olgularda ise ilaç kesilip döküntü geçtikten sonra daha düşük dozlarda başlanıp, yavaş yavaş doz arttırılması önerilir (16,33,44).
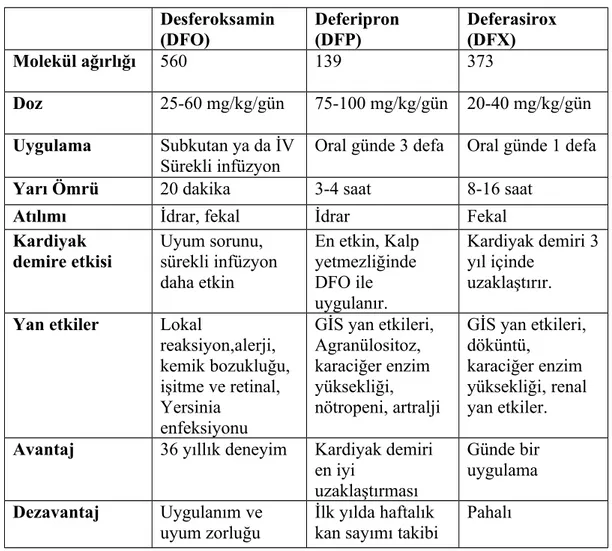
Dünyada ve ülkemizde ruhsatlı olarak üç demir şelatörü kullanılmaktadır: desferoksamin, deferipon ve deferasirox. Tablo 1 de demir şelatör ilaçlarının özellikleri özetlenmiştir (34) .
Tablo 1. Demir şelatör ilaçların özellikleri (30) Desferoksamin (DFO) Deferipron (DFP) Deferasirox (DFX) Molekül ağırlığı 560 139 373 Doz 25-60 mg/kg/gün 75-100 mg/kg/gün 20-40 mg/kg/gün Uygulama Subkutan ya da İV Sürekli infüzyon
Oral günde 3 defa Oral günde 1 defa
Yarı Ömrü 20 dakika 3-4 saat 8-16 saat
Atılımı İdrar, fekal İdrar Fekal
Kardiyak demire etkisi Uyum sorunu, sürekli infüzyon daha etkin En etkin, Kalp yetmezliğinde DFO ile uygulanır. Kardiyak demiri 3 yıl içinde uzaklaştırır. Yan etkiler Lokal
reaksiyon,alerji, kemik bozukluğu, işitme ve retinal, Yersinia enfeksiyonu GİS yan etkileri, Agranülositoz, karaciğer enzim yüksekliği, nötropeni, artralji GİS yan etkileri, döküntü, karaciğer enzim yüksekliği, renal yan etkiler. Avantaj 36 yıllık deneyim Kardiyak demiri
en iyi uzaklaştırması Günde bir uygulama Dezavantaj Uygulanım ve uyum zorluğu İlk yılda haftalık kan sayımı takibi
Pahalı
Kardiyak Disfonksiyonu Olan Hastalarda Şelasyon Tedavisi: Talasemili hastalarda; yoğun etkili bir şelasyon tedavisi ile özellikle erken dönemde (kalp yetersizliği bulguları gelişmeden önce) daha iyi yanıt alınmakta ve ileri evre hastaların bile aritmi ve kalp yetersizliği bulguları düzelebilmektedir. Ağır kalp yetersizliği olan hastalarda; DFO 50-60 mg/kg/gün dozunda 24 saat sürekli infüzyon ve 75-100 mg/kg dozunda DFP ile kombine edilir. DFO 24 saat sürekli olarak verilmesinin sebebi; DFO kesilmesinden sonra, labil demirde ani yükselmeye bağlı kardiyak toksisitenin artabileceği endişesidir (46,47).
4. Vitamin ve eser elementler:
Vitamin C: Demir metabolizması ve şelasyon tedavisinde vitamin C’nin rolü karışık ve ters etkilidir. Özellikle C vitamini düşük olanlarda, C vitamini uygulanması DFO’nun demir atıcı etkisini arttırır. Ferritinin hemosiderine dönüşüm hızını geciktirir ve demirin şelasyon için daha uygun formda kalmasına izin verir. Ancak bağırsaklardan demir emilimini ve demirin yarattığı lipit peroksidasyonunu arttırır (48,49). Özellikle demir yükü fazla olan hastalarda vitamin C uygulanmasından sonra kardiyak fonksiyonların bozulduğu gözlenmiştir (50). Bundan dolayı özellikle yüksek demir yükü olan hastalar, kendi başlarına vitamin C almamaları konusunda uyarılmalıdır.
Vitamin-E: Antioksidandır, lipit membranları serbest oksijen radikallerinden korur. Vitamin-E takviyesi ile demir aracılı membran hasarı azaltılır (51).
Folik asit: Yetersiz transfüzyon uygulanan ya da transfüzyon almayan hastalarda artmış inefektif eritropoez nedeniyle kullanımı artmıştır. Folik asit eksikliğinde anemi daha ağırlaşabilir. Etkili transfüzyon uygulanan hastalarda nadiren folik asit eksikliği gelişir (52).
Çinko: Özellikle yüksek doz DFO uygulanması sırasında eser elementlerin eksikliği görülebilir (54).
5. Kök hücre transplantasyonu: Kök hücre transplantasyonu talasemi majorlü hastalar için günümüzdeki tek küratif tedavidir. HLA tam uygun kardeş vericisi mevcut hastalarda, ciddi komplikasyonlar gelişmeden kemik iligi transplantasyonu erken dönemde yapılırsa sonuçlar yüz güldürücüdür. Bütün beta talasemi major hastalarda tanı sonrası sağlıklı kardeşi varsa doku grupları (HLA) araştırılmalı, donörü olma olasılığı değerlendirimelidir. Transplantasyon için en uygun verici HLA uygun kardeş olup, kök hücre kaynağı olarak kemik iliği tercih edilir.
Kök hücre transplantasyonunda başarı oranı %58-91 arasında bildirilmektedir (55).
Transplantasyon sonrası dönemde hastanın demir yükü düzenli olarak takip edilmelidir. Bu dönemde artık hasta düzenli transfüzyon almamasına rağmen, transplantasyon sonrası dönemde doku demiri yüksek kalmaya devam etmekte ve komplikasyonlara neden olabilmektedir. Bu olgularda şelasyon ya da flebotomi düşünülmelidir (56).
7. Gen tedavisi: Talasemide ümit vaat eden bir tedavi yöntemidir. Sağlam genin hematopoetik kök hücrelere lentiviral ajanlarla transferi ile hayvan modellerinde başarılı gen nakilleri bildirilmiştir (59). Talasemi hastalarında β globin geni transfeksiyonu ile ilgili çalışmalar deneysel düzeyde devam etmektedir (57).
8. Prenatal tanı ve talasemi önleme programı: Hemoglobinopatili çocuk doğumları, her iki eşin de taşıyıcı olduğu ailelerin saptanması ve bu çiftlerin hamileliklerin erken devresinde prenatal tanı yaptırmaları için belirli merkezlere başvurmalarının sağlanması ile önlenebilir. Bu nedenle ülkemizde hemoglobinopati insidansının yüksek olduğu bölgeler ve tüm büyük şehirler başta olmak üzere evlenecek çiftlerin talasemi ve orak hücreli anemi için taranması önerilmektedir. Moleküler düzeyde prenatal tanı, genetik mutasyonun bilinmediği durumlarda yapılamaz. Bu nedenle, prenatal tanı isteyen aileler gebelikten önce genetik danışma almalı ve ailedeki özgün hastalığın tanısı için gereken tetkikler yapılmalıdır (58).
9. Komplikasyonların izlem ve tedavisi:
Demir birikimi: Tekrarlayan kan transfüzyonları, inefektif eritropoez ve gastrointestinal sistem demir emiliminin artması sonucu vücutta demir birikimi gelişir (60,61).
Demir depolanması ilk olarak kemik iliği ve retiküloendotelyal sistem (RES) hücrelerinde gerçekleşir. Retiküloendotelyal sistem hücrelerinin demir depolama kapasiteleri aşılınca, demir makrofajlardan plazmaya salınmaya başlanır (62). Aşırı demir yükü olan durumlarda, transferinin demir taşıma kapasitesi dolar ve transferrine bağlı olmayan demir (NTBI) oluşur. Transferine bağlı demirin hücre içine girişi engellenir ancak serbest demirin hücre içine girişi devam eder ve bu durum labil demir havuzunun aşırı genişlemesine yol açarak oksiradikal oluşumunu
katalize eder. Oksiradikaller, lipidler, nükleik asitler ve proteinler gibi tüm hücresel komponentleri hasarlandırarak hücre nekrozu ve fibrozise neden olur (2,16,63).
Hepsidin karaciğerden sentezlenen ve demir dengesini ayarlayan bir hormondur. Vücuttaki demir miktarının artması hepsidin sentezini arttırır. Artan hepsidin düzeyi; hepsidin reseptörü olan ferroportine bağlanır ve ferroportin hücre yüzey reseptör sayısı azalır (65). Böylece; hücre içine demir alınımı, intestinal demir alınımı ve makrofajlardan demir salınımı azalır. Sağlıklı bireylerde demir fazlalığında hepsidin sentezinin artması gerekirken, talasemi majorda bu mekanizma tersine çalışır. İnefektif eritropoezde apoptozise uğrayan eritroid prekürsörlerinden salınan büyüme faktörleri; GDF15 ve TWSG1’in talasemili hastalarda arttığı ve hepsidin sentezi azalttığı gösterilmiştir. Düzenli transfüzyonla inefektif eritropoezin baskılanması ile hepsidin sentezi artmaktadır (64,65,66).
Karaciğerde, diğer parankimal organlarda ve miyokard hücrelerinde demir birikimi bu dokularda hasara ve fonksiyon kayıplarına neden olur. Kalp yetmezliği yeterli şelayon tedavisi almayan hastalardaki başlıca ölüm nedenidir. Ayrıca hepatik demir yüklenmesine bağlı, transaminaz yüksekliği, fibrozis, uzun dönemde siroz ve hepatoselüler karsinom talasemi hastalarında demir birikim ile ilgili komplikasyonlardır (67). Bu hastalarda büyüme geriliği (25-33%), hipogonadizm (%35-55), hipoparatiroidizm (%4), hipotiroidizm (%9-11), diabetes mellitus (%6-10) gibi endokrin bozukluklar da sık olarak görülmektedir (68).
Demir birikimi ve MRG: Karaciğer ve kalp demir birikiminin non-invazif belirlenmesinde MRG en önemli yöntemdir (69,70). Doku demir birikimini değerlendirmeye yönelik MRG yöntemleri iki gruba ayrılabilir: sinyal yoğunluğu oranı yöntemleri ve relaksometri yöntemleri. Relaksometri yöntemleri daha uzun sürer, ancak relaksayon mekanizmalarının yer aldığı zaman alanının daha iyi örneklemesini sağlayarak daha kesin sonuçlar verir. T2* MRG’de demir birikimi orta bölgesel manyetik alan düzensizliklerinden köken alan bir relaksasyon parametresidir (70). Miyokardiyal demirin doğrudan ölçülmesi, kalp yetmezliği gelişmeden önce birikimin saptanması ve tedavi edilmesine olanak sağlar. Bu amaçla kardiyovasküler T2* MRG kullanılabilmektedir. T2* MRG ile miyokardiyal demir birikimi, ventrikül işlevleri ve ejeksiyon fraksiyonu (EF) hesaplanabilir (71).
Hepatik komplikasyonlar: Karaciğer, demir homeostazında önemli rol oynar. Biriken fazla demir ilkin Kuppfer hücrelerinde birikir. Ancak artan transfüzyon ihtiyacıyla artan demir birikimi hepatik parankim hücrelerine taşar ve fibrozise ve siroza sebep olur (72). Lipid peroksidasyonunun organel membranlara hasar vermesi, lizozomal frajilitenin artması, mitokondriyal oksidatif metabolizma azalması, mikrozomal enzimlerin bozulması da karaciğer hasarına sebep olabilir (16,62,63). Talasemi hastalarında viral hepatitler de karaciğer hasarlanmasına neden olur. Talasemi majorlü hastalarda karaciğerde demir birikimi olması nedeniyle kronik Hepatit C (HCV) enfeksiyonu daha ağır seyreder. Bu nedenle HCV enfeksiyonu olan talasemi hastalarında demir birikimi kontrolü daha da etkin yapılmalıdır (2,16). Hepatit B (HBV) de HCV gibi kan transfüzyonu ile bulaşabildiğinden talasemi major hastaları risk altındadır. Talasemi tanısı konulur konulmaz hasta HBV açısından taranmalı ve bulaş yoksa yaşı ne olursa olsun transfüzyona başlamadan önce aşılanmalıdır. Hastalar yıllık olarak hepatit bulaşı açısından değerlendirilmeli, serum transaminazlarında yükselmeler dikkate alınmalıdır.
Büyüme geriliği: Talasemi majör hastalarının %30-50‘sinde büyüme geriliği görülmektedir. Kronik anemi, hipersplenizm, demir yükü, DFO toksisitesi, puberte gecikmesi, hipogonodizm, karaciğerde demir birikimi, büyüme hormonu eksikliği veya direnci, beslenme bozuklukları, genetik predispozisyon büyümeyi negatif yönde etkiler (73). Yeterli tedavi almayan hastaların olduğu ülkelerde, kronik anemi ve beslenme bozuklukları büyüme geriliğinin temel sebebi iken, iyi tedavi alan hastaların bulunduğu ülkelerde şelasyon tedavisinin yeterli yapılamamasına bağlı demir yükü büyüme geriliğinin olası nedenidir.
Büyüme hormon eksikliği düşünülen hastalarda tanı amaçlı tek sefer büyüme hormonu ölçümlerinin, büyüme hormonu geceleri daha çok ve pulsatil salınan bir hormon olduğundan yeri yoktur. Büyüme hormon uyarı testleri yapılmalı ve en az iki testte büyüme hormon pik değerinin 10 ng/ml altında olduğunun gösterilmesi gerekmektedir. IGF-1 ve IGFBP-3 düzeyleri de tanıda yardımcı olabilir. Ancak büyüme hormonunun uzun dönem kullanımı ve final boya katkısı konusunda yeterli çalışma bulunmamaktadır (74,75).
Pubertede gecikme ve hipogonadizm: Gecikmiş puberte, kızlarda 13, erkeklerde 14 yaşında puberte bulgularının başlamamasıdır. Kızlarda genelde meme gelişimi pubertenin ilk bulgusu olmakta ve bunu pubik ve aksiler kıllanma takip etmektedir. Erkeklerde ise testis volumünün 4 ml’ye ulaşması ve bunu pubik ve aksiler kıllanmanın yanında yüz ve vücudun diğer yerlerinde tüylenmede artış ve peniste büyüme takip etmektedir. Hipogononadizm ise 16 yaşına kadar erkeklerde testis volumünün 4 ml’nin altında olması, kızlarda meme gelişiminin olmamasıdır. Puberte gecikmesine hipotalamus, hipofiz ve gonadlarda demir birikimi yol açar. Ön hipofiz bezi serbest radikal osidatif strese ve demir birikimine diğer organlara göre daha hassastır. Eğer hipofiz ve hipotalamus gonadlardan daha fazla etkilenirse hipogonodotropik hipogonodizm, gonadlar daha fazla etkilenirse hipergonodotropik hipogonodizm ortaya çıkar. Talasemi hastalarında hipogonodizmin diğer olası nedenleri; kronik karaciğer hasarı, kronik hipoksi, diabetes mellitus ve çinko eksikliğidir (73).
Osteoporoz ve osteopeni: Osteoporoz, kemik mineral yoğunluğunun azalması, kemikteki protein örgüsünün seyrelmesidir. Talasemili hastalarda osteoporoz/osteopeni birçok farklı nedene bağlı olarak gelişebilir. İnefektif eritropoez nedeniyle kemik iliğinin genişlemesi ve buna bağlı kortikal kemikte incelme, hemokromatozis, hipogonadizm, gecikmiş puberte, şelasyon tedavisinin yan etkisi, parathormon-D vitamini aksının bozulması nedeniyle osteoporoz veya osteopeni görülebilir (2,16,25). Bu nedenle hastaların kemik dansitesi dual enerji x-ray absorbsiyometre (DEXA) ile değerlendirilmelidir (76). Puberteden itibaren başlatılan DEXA taramalarıyla osteopenilerin erken yakalanması mümkün olmuş ve zamanında tedavinin düzenlenmesi ile yaşam kalitesi ve morbidite üzerine olumlu katkılar gözlenmiştir (77).
Osteopeni progresif ve ilerleyici bir hastalıktır ve önlemek tedavinin temelini oluşturur. Sigara içilmemesi, kalsiyumdan zengin diyet ve düzenli egzersiz mutlaka önerilmeli ve hipogonodizm tedavi edilmelidir. Oral kalsiyum preperatları ya da bifosfonatlar kullanılabilir. Alendronat, pamindronat, zolendronat tedavilerinin kemik mineral yoğunluğunu arttırdığı gösterilmiş olmakla birlikte bu ilaçların kırık
riskini azalttığı yönünde etkinliğini göstermek için daha büyük talasemik populasyonlarda daha fazla kontrollü çalışma yapılmalıdır (77).
Hipotiroidi: Uygun şelasyon tedavisi alan hastalarda hipotiroidi nadirdir. Görülme sıklığı %6-16’dır (78). Talasemi majorlü hastalarda tiroid bezinde demir birikimine bağlı hipotiroidi daha sık görülmektedir. Hastaların çoğunda primer tiroid disfonksiyonu görülür, sekonder hipotiroidizm nadiren hipofiz bezinin demir aracılı hasarı nedeniyle oluşur (79). Serum ferritin konsantrasyonu ile tiroid fonksiyon bozukluğu arasında kuvvetli bir ilişki saptanmıştır (80). Subklinik hipotiroidi asemptomatiktir. Orta veya ağır hipotiroidide, büyüme geriliği, kilo artışı, konstipasyon, okul performansında gerileme, kalp yetmezliği, perikardiyal efüzyon görülebilir.
12 yaşından itibaren tiroid fonksiyonlarının yıllık takibi yapılmalıdır. Serbest T4 ve TSH mutlak bakılması gereken parametrelerdir. TSH yüksek, sT4 düşük olan hastalara L-tiroksin tedavisi başlanmalıdır. Sekonder hipotiroidide ise TSH’nın normal sT4’ün düşük olabileceği akılda tutulmalıdır.(81,82). Bu olguların yakından izlenmesi önerilmektedir. Erken dönemde tiroid fonksiyon testi bozukluğu olan hastalar yoğun şelasyon tedavisiyle geri döndürülebilir (82).
Hipoparatiroidi: Demir yükü ve/veya aneminin geç komplikasyonudur. Hastalarda genellikle parastezi yakınmasına neden olur. Daha ağır olgularda ise karın ağrısı, hafıza bozukluğu, tetani, letarji, konvülziyon, nöbet veya kalp yetmezliği görülebilir (2,85).
Patogenezde artmış demir yükünün paratiroid bezinde serbest radikallerin artmasına, mitokondriyal ve lizozomal membran hasarına sebep olarak paratiroid bezinde toksik etki yapması sonucu PTH sekresyonunu bozduğu ileri sürülmektedir (83). Uygun ve yeterli şelasyon tedavisi alan olgularda hipoparatiroidi sıklığı daha azdır. Hastalarda düşük kalsiyum ve yüksek fosfat düzeyleri mevcuttur. Parathormon düzeyleri düşük veya normal, 1.25 dihidroksikolekalsiferol (vitamin D) düzeyi ise düşük saptanır. Ağır hipokalsemi ile birlikte tetani olması durumunda intravenöz kalsiyum önerilir. Sonrasında oral vitamin D tedavisi başlanmalıdır. Tedavinin
komplikasyonu olan hiperkalsemi açısından dikkatli olunmalıdır. Orta derecede hipokalsemide kalsitriol tercih edilmelidir (2,84).
Diabetes mellitus (DM): Talasemi hastalarında DM görülme sıklığı %2.3-24 arasındadır (2,87,88). Yapılan çalışmalarda diabetin pankreas β hücrelerinde demir birikimine bağlı hasarlanma nedeniyle geliştiği görülmüştür (87). Son dönemlerde yapılan birçok çalışmada DM’nin uzun süreli hiperinsülinemi ve insülin rezistansının sebep olduğu kronik insülin sekresyonuna bağlı beta hücre ölümü sebebiyle geliştiğine dair veriler sunulmuştur (89). Diabetes mellitus olmayan talasemi majorlü hastalarda ve normal kan şekeri olan hastalarda açlık plasma insülin seviyeleri ve insülin rezistans indeksleri yüksek bulunmuştur (90). Bu durum DM öncesi insülin rezistansı geliştiğini göstermiştir.
Kardiak komplikasyonlar: Düzenli kan transfüzyonları yapılmadan önce hastalarda yüksek debili kalp yetmezliği gelişmekteydi. Aneminin yanı sıra, uzamış doku hipoksisi, oksijen affinitesi yüksek anormal hemoglobin tiplerinin olması ve transfüze edilen kandaki 2,3 difosfogliserad düşüklüğü, yüksek debili kalp yetmezliğine katkıda bulunan diğer faktörlerdi (86).
Talasemi majorlü hastalarda ölüm sebeplerinin başında kardiyak hemosiderozis ve buna bağlı olarak gelişen ritm bozuklukları ve tedaviye dirençli kalp yetmezliği gelmektedir. Demir birikimi öncelikle ventriküler miyokardda, sonra atriyal miyokardda ve daha sonra iletim sisteminde olmaktadır. Kalpte demir birikmesi hipertrofiye, genişlemeye ve miyokardiyal fibrozise yol açmaktadır. Miyokardda demir birikiminden dolayı oluşan kalp yetmezliği genellikle 20’li yaşlarda görülür. Ölümlerin %70’i demir fazlalığının yol açtığı kardiyak dekompansasyona bağlıdır (91). Kardiyak disfonksiyonun temel belirleyicisi demir yüküdür. Hafif kardiyak disfonksiyonu olanlarda genellikle perinükleer alanlarla sınırlıdır ve birkaç lif hücresi etkilenir. Belirgin kardiyak disfonksiyonu olan hastalarda demir depolanması genellikle çok sayıda miyokard lif hücresini etkiler (92).
Kardiyak yetmezliğin belirtilerinden biri EKG‘de PR mesafesinde uzamadır. T dalgası anormallikleri geç bir bulgudur. Daha ileri yaşlarda ve demir yükü fazla
olanlarda daha çok görülmektedir (93). Ritm bozuklukları sıklıkla ikinci dekadda atriyal ekstrasistollerle başlamaktadır. İkinci dekadın ortalarında ventriküler ekstasistoller ortaya çıkabilir ve sıklığı giderek artar (94). Dirençli aritmilerle birlikte EF’de azalma varsa bu bir yıl içinde semptomatik kardiyak yetersizliğin belirgin olarak artacağının işareti olarak kabul edilir.. Klinik bulgu verdikten sonra ise kalpte geri dönüşümsüz değişiklikler oluştuğu için hastalar sıklıkla kısa sürede kaybedilmektedir (95). Tanının subklinik evrede konulması oldukça değerli olacaktır. Bu nedenle 10 yaşını geçmiş tüm hastalarda düzenli aralıklarla telekardiyografi, ekokardiyografi, 24 saatlik ekokardiyografi monitorizasyonu, egzersiz radyonükleid sineanjiografi, yıllık kardiyak T2* MRG ile kardiyak durum değerlendirilmelidir (70,96,97).
e.Talasemili hastalarda demir yükünün tespit edilmesi:
1. Serum ferritin düzeyi: Vücut demir birikimi serum ferritin düzeyi ile değerlendirilebilir. Ferritin ölçümü, kolay olması, invazif bir yöntem olmaması, seri ölçümlere olanak vermesi sebebiyle demir yükü birikiminin değerlendirilmesi amacıyla yaygın olarak kullanılmaktadır (41). Genellikle demir depoları ile orantılıdır. Beklenenden yüksek ferritin düzeyleri karaciğer hasarı, inflamasyon sırasında görülürken, düşük ferritin düzeyleri C vitamini eksikliğinde görülür (98). Sürekli yüksek ferritin düzeyleri kötü prognozla ilişkilidir (99,100). Şelasyon tedavisi altında sıklıkla hızlı azalma gösterir (101). Serum ferritin değeri 2500 ng/ml’nin altında olduğu durumda kardiyak komplikasyonların azaldığı görülmüştür. Fakat talasemi hastalarında hedef, ferritin düzeyinin 1000 ng/ml’nin altında olmasıdır (2,16,33,34).
2.Karaciğer demir yoğunluğu: Vücut demirinin büyük bölümü karaciğerde depolandığından, karaciğer demir yoğunluğunun, vücut demir yükünün en güvenilir göstergesi olduğuna inanılır.
Karaciğer demir konsantrasyonu üç farklı yöntemle tespit edilebilir; biyopsi, T2* MRG ve biomagnetic liver susceptometry (BLS).
Karaciğer biyopsi preperatında demirin atomik absorbsiyon veya emisyon spektrometri (AAS, AES) ile kimyasal ölçümü sağlanabilir. Orta veya şiddetli
karaciğer fibrozisi varlığında, fibrotik bantlara düşen biyopsi örneğinde demir yanıltıcı olarak düşük bulunabilir. İşlemin diğer bir dezavantajı; invaziv-ağrılı bir işlem olması ve kanama gibi komplikasyon riski olmasıdır (16,98).
BLS demir yüklenmesi olanlarda stabil bir magnetik alan içinde oluşan magnetik akım değişikliği sonucu SQUID (superconducting quantum interference device) sensör tarafından algılanan bir voltaj oluşturur.Karaciğer demir yükü tayini için başarılı bir yöntemdir ancak pahalı olması ve kullanımının pratik olmaması sebebiyle pek tercih edilmemektedir (102).
Karaciğer demir içeriği MRG yöntemiyle kolayca ve invaziv bir işlem gerektirmeden ölçülebilir.Karaciğer R2 MRG bulgularına göre karaciğer demir yükünün tespiti;
Normal: >6,3 ms, hafif birikim: 2,7-6,3 ms, orta birikim: 1,4-2,7 ms, ağır birikim: < 1,4 ms olarak kabul edilir.
3. Kardiyak demirinin tayini: Kardiyak demir yükü tespitinde kullanılan endomiyokardiyal biyopsi; oldukça invaziv bir yöntem olup, komplikasyon riski yüksektir. Demirin kalp içinde homojen olmayan dağılımından dolayı doğru sonuç vermeyebilir (16,98).
Kalp demir birikiminin non-invazif belirlenmesinde MRG en önemli yöntemdir. Miyokardiyal demirin doğrudan ölçülmesi, kalp yetmezliği gelişmeden önce birikimin saptanması ve tedavi edilmesine olanak sağlar. Bu amaçla kardiyovasküler T2* MRG kullanılabilmektedir. T2* MRG ile miyokardiyal demir birikimi, ventrikül işlevleri ve ejeksiyon fraksiyonu (EF) hesaplanabilir. Kardiak MRG’de T2* değerinin 20 ms’nin üzerinde olması klinik derecede önemli bir demir birikimi olmadığını gösterir. Kardiak MRG’de T2* 15-20 ms arasında ise hafif derecede demir birikimi, 8-14 ms arası altında ise orta düzeyde kardiak demir birikimi olarak değerlendirilir. Altı ms’nin altında ise %50 ihtimalle bir yıl içinde kalp yetmezliği gelişebilmektedir (97). Kalp demir birikiminin saptanmasında kardiak T2* MRG altın standart olup, 10 yaşın üzerindeki hastalarda yılda bir kez önerilmektedir, ancak yakın zamandaki çalışmalarda daha erken dönemde de kardiak demir birikiminin gelişebileceği ve tetkike uyum gösterebilen hastalardan daha erken dönemde de istenebileceğine dair kanıtlar bulunmaktadır (103).