T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ MİKROBİYOLOJİ
ANABİLİM DALI
Prof. Dr. Feriha ÇİLLİ
MYCOBACTERIUM TUBERCULOSIS SUŞLARININ DUYARLILIK
TESTİNDE KULLANILAN SENSİTİTRE MYCOTB PANEL
YÖNTEMİNİN PERFORMANSININ AGAR PROPORSİYON YÖNTEMİ
İLE KARŞILAŞTIRILMASI
UZMANLIK TEZİ
Dr. Fatma Kamer VARICI BALCI
TEZ DANIŞMANI
Prof. Dr. Cengiz ÇAVUŞOĞLU
ii
TEŞEKKÜR
Uzmanlık eğitimimde emeği geçen Tıbbi Mikrobiyoloji Anabilim Dalı’ndaki tüm öğretim üyelerine, tez çalışmamda bilgisi ve desteğiyle yanımda olan danışmanım Prof. Dr. Cengiz ÇAVUŞOĞLU’na, teknik yardımlarından dolayı mikobakteriyoloji laboratuvarında çalışan teknisyen arkadaşlarıma, uzmanlık eğitimim ve öncesinde destek ve sevgisiyle hep yanımda olan sevgili eşim Dr. Mustafa Koray Balcı ve tüm aileme içtenlikle teşekkür ederim.
iii
İÇİNDEKİLER
KISALTMALAR ... v TABLO DİZİNİ ... vi RESİM DİZİNİ ... vi ŞEKİL DİZİNİ ... vii ÖZET ... viii SUMMARY ... ix 1. GİRİŞ VE AMAÇ ... 1 2. GENEL BİLGİLER ... 2 2.1. Tarihçe ... 22.2. Mycobacterium tuberculosis’in Genel Özellikleri ... 3
2.3. Bulaş Yolu ve İmmünopatogenezi ... 5
2.4. Epidemiyoloji ... 7 2.4.1. Dünya’da Tüberküloz ... 7 2.4.2. Türkiye’de Tüberküloz ... 10 2.5. Tüberküloz Tanısı ... 12 2.5.1. ARB mikroskopi . ... 12 2.5.2. Mikobakteri Kültürü. ... 14
2.5.3. Nükleik Asit Amplifikasyon Testleri ... 16
2.6. Latent M.tuberculosis Enfeksiyonunun Tanısı ... 16
2.6.1. Tüberkülin Deri Testi ... 16
2.6.2. IFN-γ Salınım Testleri (IFN-γ Release Assays; IGRAs) ... 17
2.7. İlaç Duyarlılık Testi ... 18
iv
2.8.1. İlk Seçenek Antitüberküloz İlaçlar ... 23
2.8.2. İlk Seçenek Tamamlayıcı Antitüberküloz İlaçlar ... 25
2.8.3. İkinci Seçenek Antitüberküloz İlaçlar ... 26
2.8.4. Yeni Antitüberküloz İlaçlar ... 27
2.9. İlaç Direncinin Önemi ... 28
3.GEREÇ VE YÖNTEM ... 30
3.1. Materyalin toplanması ve çalışılması ... 30
3.2. Yöntem ... 30
3.2.1. 7H10 Agar Proporsiyon Yöntemi ... 30
3.2.2.Sensititre MycoTB Plak Yöntemi ... 31
3.2.3.Anti-TB İlaçların Hazırlanması ... 35
3.3. İstatistiksel analiz ... 35
4. BULGULAR ... 36
5. TARTIŞMA VE SONUÇ... 41
6. KAYNAKLAR ... 45
v
KISALTMALAR
AIDS : Acquired Immune Deficiency Syndrome (Edinilmiş Bağışıklık Yetmezliği Sendromu)
AMI : Amikasin
APY : Agar Proporsiyon Yöntemi ARB : Asidoresistan Basil
BCG : Bacille Calmette-Guerin BOS : Beyin Omurilik Sıvısı BT : Bilgisayarlı Tomografi
CDC : Centers for Disease Control and Prevention (Hastalık Önleme ve Kontrol Merkezi)
CFU : Colony Forming Units (Koloni Oluşturan Birim)
CLSI : Clinical and Laboratory Standarts Institute (Klinik ve Laboratuvar Standartları Kurumu)
CYC : Sikloserin
ÇİD-TB : Çoklu ilaca dirernçli- Tüberküloz
DOTS : Directly Observed Therapy Strategy (Doğrudan Gözetim Altında Tedavi Stratejisi)
DSÖ : Dünya Sağlık Örgütü
ETB : Etambutol
ETH : Etiyonamid
FDA : Food and Drug Administration (Amerikan Gıda ve İlaç Dairesi) HIV : Human Immunodeficiency Virus (İnsan Bağışıklık Yetmezlik Virüsü)
INH : İzoniyazid
KAN : Kanamisin
LJ : Löwenstein Jensen
M.bovis : Mycobacterium bovis
M.tuberculosis : Mycobacterium tuberculosis
MGIT : Mycobacterium Growth Indicator Tube MIK : Minimal İnhibitör Konsantrasyon MTBK : Mycobacterium tuberculosis kompleks
v MXF : Moksifloksasin
OADC : Oleik asit-Albumin-Dekstroz-Katalaz
OFL : Ofloksasin
PAS : Para-aminosalisilik asit
PPD : Purified Protein Derivative (Saflaştırılmış Protein Derivesi) PZA : Pirazinamid
RFB : Rifabutin
RIF : Rifampisin
STR : Streptomisin
TB : Tüberküloz
vi
TABLO DİZİNİ
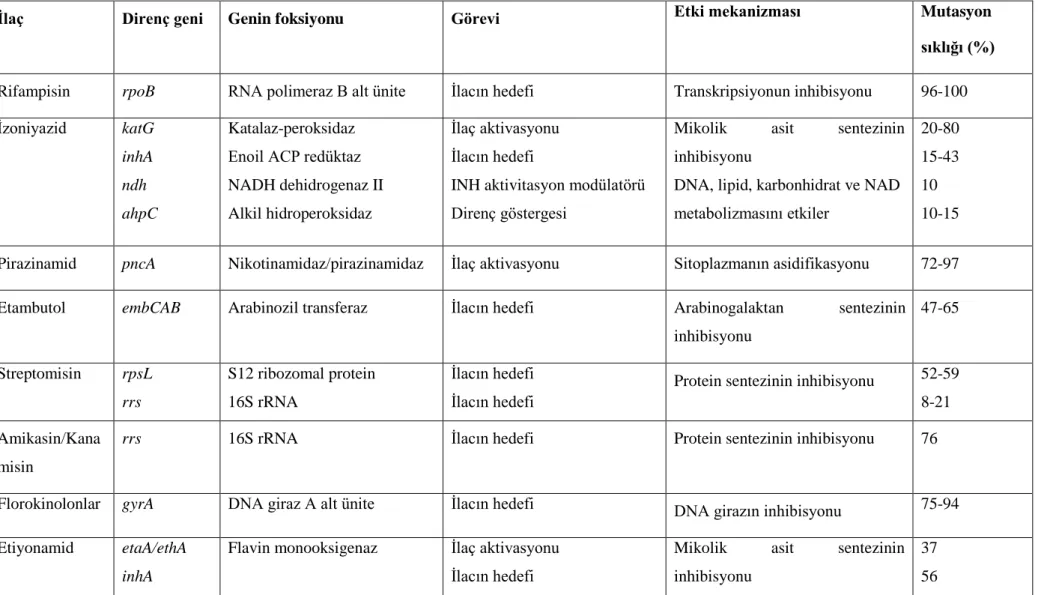
Tablo 1. Mycobacterium tuberculosis’de ilaç direncinin mekanizmaları ... 29
Tablo 2. Çok büyük hata ve büyük hata saptanan izolatların sayıları ve dağılımı ... 38
Tablo 3. Anti-TB ilaçların uyum yüzdeleri ... 39
Tablo 4. Birinci ve ikinci seçenek anti-TB ilaçların duyarlılık, özgüllük, uyum yüzdeleri
ve p değerleri ... 39
Tablo 5. Çalışmaya alınan 100 M.tuberculosis suşunun Sensititre MycoTB panel
yöntemi ve agar proporsiyon yöntemi sonuçları ... 40
RESİM DİZİNİ
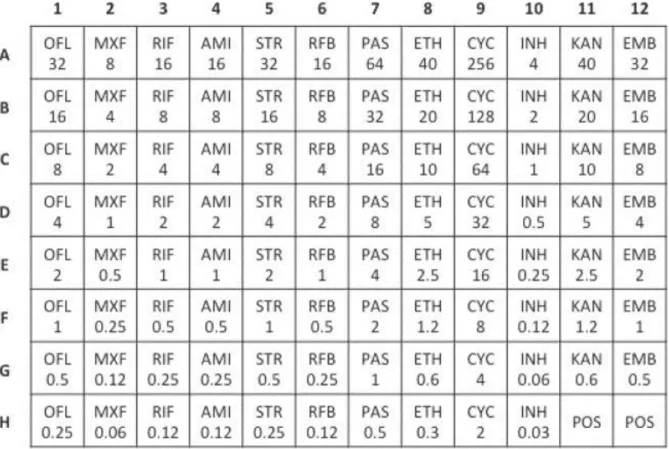
Resim 1. Sensititre MycoTB Panelleri……… 32
vii
ŞEKİL DİZİNİ
Şekil 1. ARB ile boyanmış M.tuberculosis basillerinin görünümü ... 3
Şekil 2. M.tuberculosis kolonilerinin Löwestein Jensen besiyerinde görünümü ... 4
Şekil 3.M.tuberculosis hücre duvar yapısı ... 5
Şekil 4. 1990-2013 yılında tüberküloza bağlı ölüm sayıları. ... 8
Şekil 5. Yeni olgulardaki ÇİD-TB olgu yüzdeleri ... 9
Şekil 6. Daha önce tedavi alan hastalardaki ÇİD-TB olgu yüzdeleri ... 9
Şekil 7. Türkiye ve DSÖ Avrupa Bölgesi’nde TB İnsidans Hızları, 2002-2010 ... 11
Şekil 8. Türkiye ve DSÖ Avrupa Bölgesi’nde TB Nokta Prevalans Hızları, 2002-2010 ... 11
Şekil 9. İnokulumun 10-2 ve 10-4 dilüsyonlarının ilaçlı ve ilaçsız agar bazlı besiyerlerine inokülasyonu. ... 20
Şekil 10. 7H10 agar proporsiyon yöntemi ile yapılan duyarlılık testinin değerlendirilmesi ... 21
Şekil 11. Sensititre MycoTB plağında antibiyotik içermeyen pozitif kontrol çukurlarının gösterilmesi ... 33
Şekil 12. Sensititre MycoTB plağında MIK’lerin saptanması. ... 33
Şekil 13. Sensititre MycoTB plağında antibiyotiklerin ve konsantrasyonlarının (μg/ml) şematik gösterimi ... 34
viii
ÖZET
Giriş ve Amaç: Tüberküloz, enfeksiyöz bir etkene bağlı ölüm nedenleri arasında dünyada halen ilk sıralarda yer almaktadır. Çoklu ilaca dirençli tüberküloz (ÇİD-TB) ve yaygın ilaca dirençli tüberküloz (YİD-TB) olgularındaki artış Mycobacterium tuberculosis’de ilaç duyarlılığını belirlemek için hızlı, kolay uygulanabilen ve standardize yöntemlerin geliştirilmesine ihtiyaç oluşturmuştur. İlaç duyarlılığının hızlı ve doğru bir şekilde belirlenip, hastalara uygun tedavinin planlanması tüberküloz kontrol programlarının temel hedeflerinden biridir. Bu çalışmanın amacı Sensititre MycoTB plak yöntemini doğruluk, sonuçların alınması için gerekli olan inkübasyon süresi ve kullanım kolaylığı açısından altın standart agar proporsiyon yöntemi (APY) ile karşılaştırmak ve APY’nin yerine kullanılabilecek kadar etkin bir yöntem olup olmadığını belirlemektir.
Gereç ve Yöntem: Çalışmada, Ege Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Mikobakteriyoloji Laboratuvarı kültür koleksiyonunda bulunan 36’sı farklı direnç paternlerine sahip, 64’ü tüm birinci seçenek ilaçlara duyarlı toplam 100 M.tuberculosis suşu kullanıldı. Tüm M.tuberculosis suşlarında rifampisin (RİF), izoniyazid (INH), etanbutol, streptomisin, ofloksasin, moksifloksasin, amikasin, rifabutin, para-aminosalisilik asit, etiyonamid, sikloserin ve kanamisin ilaç duyarlılıkları APY ve Sensititre MycoTB plak yöntemiyle belirlendi. APY CLSI’da tanımlandığı şekilde, Sensititre MycoTB plak yöntemi üreticinin tanımladığı şekilde yapıldı. Veri analizinde SPSS 20.0 paket programı kullanıldı. Sonuçlar %95 güven aralığında değerlendirilip, duyarlılık, özgüllük hesaplandı. p <0,05 değeri istatistiksel olarak anlamlı kabul edildi.
Bulgular: Çalışmada test edilen tüm antibiyotiklerin uyum yüzdeleri % 95’le %100 arasında, özgüllükleri % 95’le %100 arasında ve duyarlılıkları %86’yla %100 arasında değişmektedir. Antibiyotiklerin uyum yüzdeleri, özgüllükleri, duyarlılıkları sırasıyla RIF için % 99; %99; %100 , INH 0.2 µg/ml için %98; %97.2; %100, INH 1 µg/ml için % 98; %97.4; % 100, STR için %99; %99; %100, ETB için % 96;% 97; %89, OFL için % 97;% 97; %100, MXF için %95; %95; %100, AMI için %100; %100; %100, RFB için % 97; %97; %100, PAS için % %96; %96; 100, ETH için %96; %98;% 86, CYC için %98; %98; %100, KAN için % 97;% 97; %100 olarak bulunmuştur. Tüm antibiyotikler %95 güven aralığında olup, p değeri p<0.001 olarak istatiksel olarak anlamlı saptanmıştır. Çalışma sonucunda izolatların 14’ünde
viii
APY ile 16’sında ise Sensititre MycoTB plak yöntemiyle ÇİD (INH ve RİF direnci birlikte) saptanırken, izolatların hiçbirinde YİD [ÇİD ek olarak TB tedavisinde kullanılan herhangi bir florokinolona ve parenteral ikinci-basamak antitüberküloz ilaçlardan (amikasin, kanamisin ve kapreomisin) herhangi birisine direnç gelişmesi] saptanmamıştır.
Sonuç: Sonuç olarak elde ettiğimiz verilere bakarak; inkübasyon süresinin 14 gün olması, uyum %95-100, özgüllük %95-100, duyarlılık %86-100, p <0.001 saptanmasıyla Sensititre MycoTB plak yönteminin altın standart kabul edilmiş APY yerine kullanılabilecek kadar etkin bir yöntem olduğu sonucuna varılmıştır.
Anahtar kelimeler: Mycobacterium tuberculosis, agar proporsiyon yöntemi, Sensititre MycoTB, ilaç duyarlılık testi
ix
SUMMARY
Introduction and aim: Tuberculosis is still one of the most common mortal enfectious disesase around the World. Due to increase of multidrug-resistant (MDR) M.tuberculosis and extensively drug-resistant (XDR) tuberculosis cases, fast, easy and standardised methods need to be developed to determine drug resistance in M.tuberculosis. Determining drug resistance rapid and correctly, and starting appropriate medication is one of the main goals of tuberculois control programmes. Aim of this study is to compare the Sensititre MycoTB plate method to the gold standard agar proportion method (APM) fort the parameters: precision, incubation time for results and simplicity. We also aimed to determine if the Sensititre MycoTB plate method is effective enough to be used instead of the APM.
Materials and Method: 36 isolates with different resistance patterns and 64 isolates sensitive to all first line agents, a total of 100 M.tuberculosis isolates stored in culture collection of Microbiology Department Laboratory, Ege University School of Medicine, were used. Rifampin, isoniazid, ethambutol, streptomycin, ofloxacin, moxifloxacin, amikacin, rifabutin, para-aminosalicylic acid, ethionamide, cycloserine and kanamycin drug sensitivities of all isolates were determined by the APM and the Sensitirre MycoTB plate method. As defined in APM CLSI, Sensititre MycoTB plate method was used as instructed in producers manuel. SPSS 20.0 package programme is used for data analysis. Results are assessed in %95 confidence interval and sensitivity and specificity are defined. P<0,05 accepted statistically significant.
Results: All antibiotics used had % agreement categorical between 95 to 100 %, specificity between 95 to 100%, sensitivity between 86 to 100 %. In order, % agreement categorical, specificity, sensitivities of drugs are; RIF %99;% 99;% 100, INH 0.2 µg/ml %98; %97.2;% 100, INH 1 µg/ml %98;% 97.4;% 100, STR %99;% 99;% 100, EMB %96;% 97;% 89, OFL %97; %97;% 100, MXF %95;% 95;% 100, AMI %100;% 100;% 100, RFB %97;% 97; %100, PAS %96;% 96;% 100, ETH %96; %98;% 86, CYC %98;% 98;% 100, KAN %97; %97; %100. All antibiotics were in %95 agreement categorical and p value was <0,001, statistically significant. MDR was detected in 14 of isolates by the APM and 16 of isolates by the Sensititre MycoTB plate method. None of the isolates had XDR [In addition to MDR resistance aganist any fluoroquinolones and at least one of the second-line injectable drugs (amikacin, kanamycin or capreomycin)]
ix
Conclusion: According to results, with an incubatioan period of 14 days, 95 to 100% agreement, 95 to 100 % specificity, 86 to 100 % sensitivity and p<0,001 we could state that the Sensititre Myco TB method is effective enough to be used instead of the gold standard APM.
Keywords: Mycobacterium tuberculosis, agar proportion method, Sensititre MycoTB, drug susceptibility testing
1
1. GİRİŞ VE AMAÇ
Tüberküloz tüm dünyada enfeksiyoz etkene bağlı hastalıklar arasında halen önemli bir ölüm nedenidir. Dünya nüfusunun yaklaşık 1/3’ü M.tuberculosis ile enfektedir. Dünya Sağlık Örgütü’nün (DSÖ) verilerine göre her yıl yakşalık dokuz milyon insan tüberküloz hastalığına yakalanmakta ve bu hastaların yaklaşık 2 milyonu ölmektedir. Tüberküloz, gelişmekte olan ülkelerdeki önlenebilir yetişkin ölümlerinin % 26’sından sorumludur (1).
ÇİD-TB ve YİD-TB sayısındaki artış M.tuberculosis’de ilaç duyarlılığını belirlemek için standartize, kullanışlı ve hızlı yöntemlerin geliştirilmesine olan ihtiyacı artırmıştır. Etkisiz tedaviye ve direnç gelişimine yol açabildiğinden dolayı gecikmiş duyarlılık sonuçları morbidite/mortalite artışına neden olabilmektedir (2).
Hızlı tanının yanı sıra, ilaç direncinin hızlı ve doğru bir şekilde belirlenmesi tüberküloz kontrol programlarının ana hedeflerindendir. CDC mikobakteriyoloji laboratuvarı; örnek kabulünden en geç 30 gün sonra M. tuberculosis için, ilk seçenek ilaç duyarlılık sonuçlarının bildirmesini önermektedir. Bu amaçla son yıllarda M.tuberculosis’de hızlı duyarlılık sonuçları eldesi için çeşitli ticari duyarlılık test yöntemleri geliştirilmektedir (3).
Ulusal Tüberküloz Tanı Laboratuvarları ağı, çalışma usul ve esaslarına dair tebliğde; örneğin laboratuvara kabul edilmesinden itibaren en geç 30 gün içinde ilaç duyarlılık testlerinin sonuçlarının tetkiği isteyen hekim, kurum veya kuruluşa bildirilmesi istenmekte ve ağa katılan akredite Mikobakteriyoloji Laboratuvarlarının bu koşulları sağlaması beklenmektedir (4).
Bu çalışmada amaç, altın standart agar proporsiyon yöntemiyle, yeni geliştirilen Sensititre MycoTB plak yöntemini; doğruluk, sonuçların alınması için gerekli olan inkübasyon süresi, kullanım kolaylığı açısından karşılaştırmak, Sensititre MycoTB plak yönteminin kullanılan APY’nin yerine kullanılabilecek kadar etkin bir yöntem olup olmadığını belirlemek ve elde edilen veriler eşliğinde Sensititre MycoTB plak yöntemini rutin uygulamaya sokmaktır.
2
2. GENEL BİLGİLER
2.1. Tarihçe
Günümüzden 5000-7000 yıl öncesinde Mısır ve Güney Amerika’da bulunan mumyaların vertebra lezyonlarında (Pott hastalığı), Mycobacterium tuberculosis DNA’sının izlerine rastlanılmış, böylece bu mikroorgizmanın uzun zamandan beri insanda hastalık yaptığı gösterilmiştir (5, 6).
Hipokrat (M.Ö. 460-377) öksürük, kanlı balgam ve ateşle tarif ettiği bu hastalığı, tükenme anlamına gelen ‘phthisis’ olarak isimlendirmiştir (7). Scrofula (Kralın şeytanı), Pott hastalığı, tabes mesenterica, lupus vulgaris, beyaz veba hastalığın değişik klinik formları için kullanılan isimlerden bazılarıdır (8).
Alman bilim adamı Robert Koch tüberkülozdan ölen bir hastanın akciğerindeki lezyonlarda basili göstermiş ve 1882 yılında Berlin Fizyoloji Derneğinde tüberkülozun M. tuberculosis tarafından oluşturulduğunu kanıtlamıştır (9).
Florence B. Seibert, 1930’lu yıllardan sonra “old” tüberkülini saflaştırmış ve elde edilen saflaştırılmış protein türevi (PPD) ile tüberküloz enfeksiyonunun varlığı saptanmaya başlanmıştır. Albert Calmette ve Camille Guerin isimli araştırıcılar 1921 yılında Fransa’da ilk tüberküloz aşısını Bacillus Calmette-Guerin (BCG)’i geliştirmişler ve aşı İkinci Dünya Savaşı’ndan sonra tüm dünyada yaygın olarak kullanılmaya başlanmıştır (10-12).
Tüberküloz tarihinde 1944’de streptomisinin, 1952’de izoniyazidin, 1946’da para-aminosalisilikasitin ve 1966’da rifampisinin bulunması ile yeni bir dönem başlamıştır. Kombine tedavinin uygulanmasıyla tüberküloz tedavi edilebilir bir hastalık haline gelmiştir (10, 13). Antibiyotik tedavisinin başlamasından sonra tüberküloz özellikle gelişmiş ülkelerde olmak üzere sürekli bir düşme eğilimi göstermiştir. Ancak dünyanın az gelişmiş bölgelerinde tüberküloz, yaygınlığını ve ciddiyetini hep korumuştur. 1980’lerde HIV/AIDS olgularının ortaya çıkışı,gelişmiş ülkelerde tüberkülozun yeniden artmaya başlamasına ve özellikle ÇİD-TB’nin neden olduğu enfeksiyonların yaygınlaşması, sağlık otoritelerinin dikkatinin hastalık üzerinde yeniden yoğunlaşmasına neden olmuştur (14, 15).
3
2.2. Mycobacterium tuberculosis’in Genel Özellikleri
Mycobacterium tuberculosis, Actinomycetales takımı içinde Mycobacteriaceae ailesinde Mycobacterium cinsi içinde yer alır. Mycobacterium tuberculosis hareketsiz, sporsuz, 0.2-0.6 x 1-10 µm boyutlarında aerob çomakçıktır (15).
Kültürde, Löwestein Jensen (LJ) besiyerinde tipik olarak krem rengi, pürtüklü, kuru, sert koloniler oluşturur (Şekil 2). Yavaş ürer, 12-24 saatte bir bölünür. Standart kültür ortamında ortalama 10-15 günde gözle görünür koloni oluşturmaktadır. Laboratuvarda, kültürlerinde saptanabilir üreme için 8 hafta kadar uzun bir süreye gereksinir (15, 16).
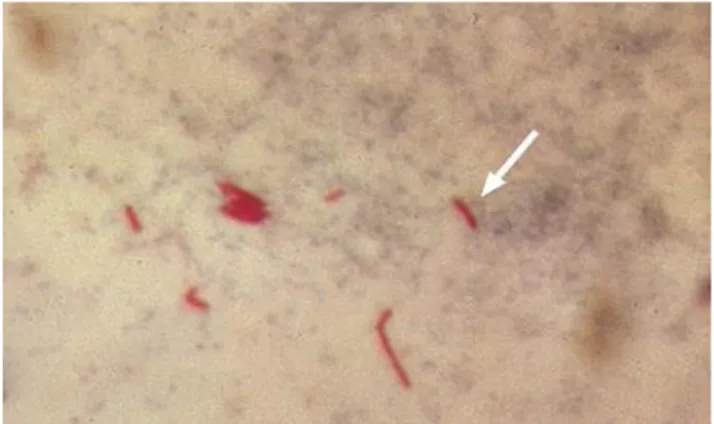
Hücre duvarı lipit içeriği bakımından zengindir. Bu nedenle alkol, asit, alkali ve kuru ortama karşı direnç gösterir. Gram boyasıyla boyanmaz. Mikobakteriler fenol içinde çözündürülen bazik fuksinin yoğun eriyikleri ile [Kinyoun veya Ehrlich- ZiehlNeelsen (EZN) yöntemleri ile] boyandıklarında aldıkları boyayı %3’lük asit alkolle renksizleştirme işleminden sonra bırakmazlar. Bu özelliklerinden dolayı asidoresistan basiller (ARB) olarak da adlandırılırlar. Aside dirençlilik özellikleri, laboratuvar tanısında kullanılan önemli bir kriterdir. Kinyoun veya EZN boyama yönteminde renk giderme işleminden sonra zeminin boyanabilmesi için zıt boya olarak metilen mavisi kullanılır ve mikroskopik incelemede tüberküloz basilleri mavi zeminde kırmızı çomakçıklar şeklinde görülürler (Şekil 1) (15, 17).
4
Şekil 2. M.tuberculosis kolonilerinin Löwestein Jensen besiyerinde görünümü
Mycobacterium tuberculos’in hücre duvarı kompleks bir yapıya sahiptir. Mycobacterium tuberculosis’in hücre duvarının geçirgenliğinin çok az olmasında, hücre kuru ağırlığının neredeyse %60’ını oluşturan lipidden zengin olması çok önemli rol oynar (18, 19).
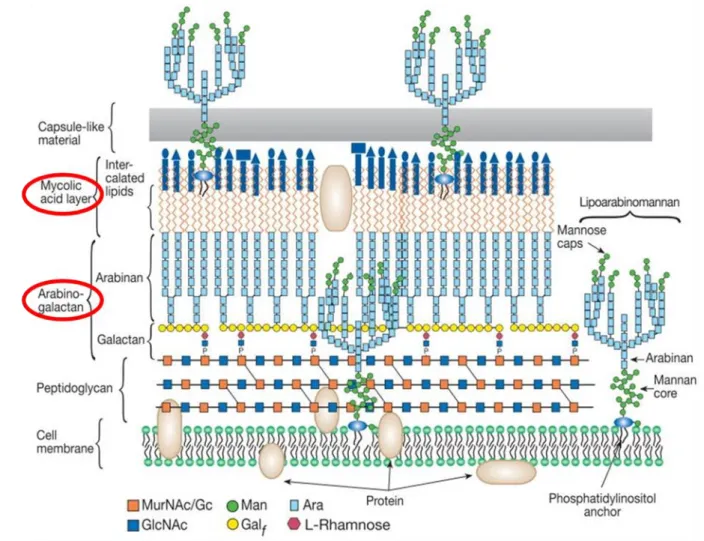
Biyokimyasal çalışmalarda, mikobakteri hücre duvar iskeletinin üç makromolekülden oluştuğu gösterilmiştir. Bunlar peptidoglikan, arabinogalaktan ve mikolik asitlerdir. Bu üçlü yapı ‘mikololik-arabinogalaktan-peptidoglikan’ kompleksi olarak adlandırılır (18, 19).
Mikolik asitler, siklopropan halkalarından oluşan ve uzun alkil yan zincirleri taşıyan moleküller olup hücre yüzeyinin hidrofobisitesini arttıran esas moleküllerdir. Mycobacterium tuberculosis’te en baskın mikolik asit formu, alfa-mikolik asitlerdir. Mikolik asitler, trehaloz gibi şekerlere bağlandığında kord faktörü oluştururlar. Kord faktör olarak da bilinen trehaloz-6,6’-dimikolatın, konak hücre membran sistemlerine toksik etkili, akciğerde granulom oluşumunu indükleyen immünostimulatuvar özellikte bir molekül olduğu gösterilmiştir (20).
Hücre duvarındaki diğer serbest glikolipitler olan fosfatidil inozitol mannozid (PIM), lipomannan (LM) ve lipoarabinomannan (LAM) sitoplazmik membranla ilişkili şekilde dış ortama doğru uzanır. Hücre duvarının en dışında bakteriye şeklini veren hücre duvarına bütünlük ve sertlik kazandıran peptidoglikan yapı bulunmaktadır (15, 20).
Lipomannan ve LAM’ın öncü molekülü olarak bilinen PIM’in de konağın granulomatöz yanıtının ortaya çıkışında rol alan ayrıca fagositik olmayan hücrelere basilin bağlanmasını sağlayan bir adezin molekül olarak davrandığı gösterilmiştir (18, 19).
Son yıllarda yapılan araştırmalar, M.tuberculosis’in hücre duvarında, protein ve polisakkaritlerden (glukan, arabinomannan, mannan) oluşan bir kapsülün ve gram negatif bakterilerdeki gibi hidrofilik moleküllerin geçişine izin veren porinlerin (OmpATb)
5
bulunduğunu göstermiştir. Ayrıca yakın zamanda, hücre zarında; aminoglikozid ve tetrasiklin direnciyle ilişkili olarak, Tap ve P55; izoniyazid direnciyle ilişkili EfpA ve kinolon direnciyle ilişkili LfrA pompa proteinlerinin varlığı gösterilmiştir (20).
Şekil 3. Mycobacterium tuberculosis hücre duvar yapısı
2.3. Bulaş Yolu ve İmmünopatogenezi
Mycobacterium tuberculosis’in bilinen tek kaynağı insandır (16).
Tüberkülozun toplumda asıl bulaşma yolu inhalasyondur. Hasta bireylerin öksürük, hapşırık gibi yollarla çıkardıkları akciğer sekresyonları sırasında oluşan damlacık partikülleri içinde dışarı atılır. Konakla M.tuberculosis’in etkileşimi bulaştırıcı hastaların çıkardığı, içinde mikroorganizmaların bulunduğu damlacık partiküllerinin solunmasıyla başlar. İnhalasyonla alınan basillerin çoğu üst solunum yollarında yakalanıp siliyer mukoza hücreleri tarafından dışarı atılırken, küçük bir bölümü (genellikle <%10) alveollere ulaşır. Hava yolu ile bulaşta,
6
içinde az sayıda canlı basil içeren ve havada birkaç saat asılı kalabilen 1-5 µm büyüklüğündeki damlacık partikülleri önemli rol oynar. Bunlar, alveollere ulaşır ve enfeksiyon başlar (21, 22).
Tüberküloz basilinin akciğerde enfeksiyon oluşturması basilin virülansına ve bakteriyi fagosite eden alveoler makrofajın mikrobisidal yeteneğine bağlıdır. Eğer basil bu ilk savunmaya karşı canlı kalmayı başarabilirse alveoler makrofajlar içinde çoğalmaya başlar. Tüberküloz basili yavaş çoğalan bir mikroorganizmadır. Alveoler makrofaj içinde ortalama 25-32 saatte bir bölünür. Bilinen bir endotoksini veya ekzotoksini bulunmamaktadır. Bu nedenle tüberküloz enfeksiyonuna karşı konak yanıtı hemen gelişmez. Basil, yeterli hücresel immünite gelişene kadar çoğalmaya devam eder (21, 23).
Makrofajların mikobakterilerle invazyonu büyük oranda bakteri hücre duvarının makrofaj yüzeyinde bulunan kompleman reseptörleri, mannoz reseptörü, immünglobülin GFcγ reseptörü, tip A çöpçü reseptörler gibi çeşitli makrofaj yüzey moleküllerine bağlanmasıyla olur. Basilin C3b gibi C3 aktivasyon ürünleriyle opsonizasyonuna yol açan kompleman aktivasyonu fagositozu artırır. Bir fagozom oluştuktan sonra M.tuberculosis’in içinde canlı kalabilmesi, veziküler protonadenozin trifosfat toplanamaması nedeniyle oluşan asidifikasyondaki azalmaya bağlıdır. Bir dizi kompleks olay, bakteri hücre duvar glikolipiti, lipoarabinomannan (LAM) tarafından oluşturulur. LAM hücre içi Ca++
artışını inhibe eder. Böylece fagozom-lizozom füzyonuna yol açan Ca++/kalmudilin yolağı zarar görür ve basil
fagozom içinde canlı kalabilir. Basil, fagozom olgunlaşmasını durdurmakta başarılı olursa daha sonra makrofaj içinde çoğalmaya başlar ve sonunda makrofaj parçalanır ve içindeki basiller serbest kalır (21-23).
Hücresel immun yanıt, M.tuberculosis’in neden olduğu primer enfeksiyonun sınırlandırılmasında ve latent enfeksiyonun kontrolunda çok etkin rol oynamaktadır. Ancak bu yanıt, basilin vücuttan eradikasyonunu sağlayamamaktadır. Basiller uyur fazda başta akciğer ve lenf nodları olmak üzere çeşitli organ ve dokulara ait hücrelerde (bronşiyal hücreler, tip 2 pnömositler, adipoz hücreler) varlıklarını sürdürmektedir. Bilindiği gibi M.tuberculosis’le enfekte kişilerin %10’unda latent enfeksiyonun reaktivasyonu sonucu aktif tüberküloz ortaya çıkmaktadır (16, 19).
Tüberkülozun gelişiminde kilit olayın, Th1 yanıtının Th2’ye dönüşümü olduğu açık olarak bilinmekle birlikte bu dönüşüme yol açan faktörler ve sitokin profili net olarak bilinmemektedir. Tüberkülozun çeşitli semptomları (ateş, kilo kaybı, doku hasarı) aslında
7
koruyucu olan Th1 yanıtının başlıca sitokinlerinden biri olan TNF-α’nın patolojik etkisi sonucu ortaya çıkmaktadır (16, 19).
Bunlar göz önüne alındığında, toplumu tüberkülozdan korumanın en etkili yolu tüberkülozlu hastaların tanısının mümkün olduğunca erken konulması ve hastalara etkili tedavinin uygulanmasıdır (21).
2.4. Epidemiyoloji
2.4.1. Dünya’da Tüberküloz
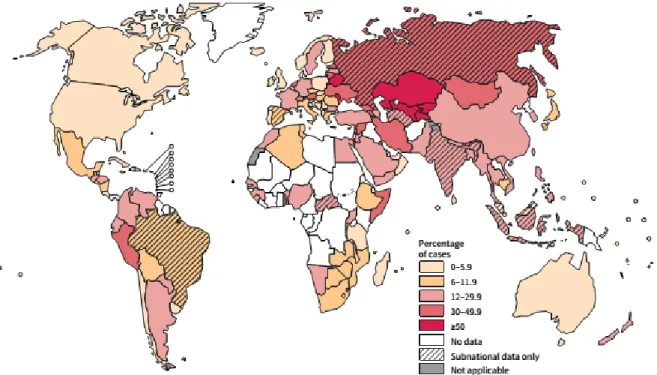
2013 yılında Dünya Sağlık Örgütü (DSÖ) tarafından yaklaşık 9 milyon kişide tüberküloz geliştiği, 2 milyon insanının tüberkülozdan öldüğü ve bunların 360,000’inin HIV pozitif olduğu bildirilmiştir (Şekil 4). DSÖ bu tüberküloz vakalarının yarıdan fazlasının (%56) Kuzey-Doğu Asya ve Batı Pasifik’te, dörtte birinin Afrika’da olduğunu bildirmiştir. Nüfusa oranla en yüksek vaka ve ölüm oranları Afrika bölgesinde saptanmıştır. Hindistan ve Çin’de sırasıyla toplam vakaların %24 ve %11’inden sorumludur.2013 yılında tüberküloz gelişen 9 milyon insanın tahmini 1,1 milyonunun (%13) HIV pozitif olduğu, HIV’e bağlı tüberküloz ölümlerinin son on yıl içinde düştüğünü bildirmiştir (1).
Bunun yanında DSÖ tüberküloz kontrolünde ‘Milenyum Gelişme Hedefi’ belirlemektedir. Buna göre DSÖ, yayma pozitif olguların %70’inin saptanmasını, bu olguların % 85’inin başarıyla tedavi edilmesini, 2015 yılına kadar dünyada tüberküloz insidansının azalmaya başlatılması ve durdurulmasını, 1990 yılı ile kıyaslandığında 2015 yılına kadar prevalans ve ölüm oranlarının yarıya indirilmesini hedeflemektedir. Bu hedef çerçevesinde, dünya çapında TB insidansı 2000 ve 2013 yılları arasında yılda ortalama yaklaşık % 1.5 oranında düştüğünü saptamıştır. Küresel olarak, 1990 ve 2013 yılları arasında TB ölüm oranının % 41 oranında düştüğünü, TB prevalans oranının da tahmini % 45 oranında düştüğü bildirilmiştir (1).
Dünyada tüberküloz hastalarının %80’inin bulunduğu 22 ülke, ‘Yüksek Olgu Yükü’ olan ülkeler olarak adlandırılmaktadır. Bu ülkeler; Hindistan, Çin, Endonezya, Nijerya, Bangladeş, Pakistan, Etyopya, Güney Afrika, Filipinler, Kenya, Kongo Demoktatik Cumhuriyeti, Rusya Federasyonu, Vietnam, Tanzanya, Brezilya, Uganda, Tayland, Mozambik, Zimbabve, Myanmar, Afganistan ve Kamboçya’dır. En çok hastanın olduğu beş ülke ise; Hindistan, Çin, Endonezya, Nijerya, Güney Afrika’dır (1).
8
1980’lerin sonu ve 1990’ların başı boyunca sanayileşmiş ülkelerde bildirilen tüberküloz olgularının sayısında artış görülmüştür. Bu artış büyük oranda tüberküloz prevalansının yüksek olduğu ülkelerden alınan göç; HIV enfeksiyonu, şehirlerde artan sefalet, evsizlik, ilaç kullanımı gibi sosyal sorunlar ve tüberküloz hizmetlerinin kaldırılması ile ilişkiliydi. Geçen birkaç yıl boyunca sanayileşmiş uluslarda bildirilen olgu sayısı tekrar azalmaya başladı veya sabit kaldı. Birleşik Devletler’de etkili kontrol programlarının yürürlüğe sokulmasıyla birlikte 1993’de yeniden düşüş başladı (24).
1993’te DSÖ, ‘Tüberkülozu Durdurmak İçin Küresel Plan’ (Global Plan to Stop Tuberculosis) adlı projesi çerçevesinde ‘Doğrudan Gözetim Altında Tedavi Stratejisi’ni [Directly Observed Therapy Strategy (DOTS)] uygulamaya geçirmiş, yayılan tüberkülozu kontrol altına almayı hedeflemiştir (24).
2013 yılında dünya çapında çoklu ilaca dirençli TB (ÇİD-TB) olgularının yeni vakalarda oranı % 3.5, tedavi almış vakalarda % 20.5 olarak saptanmıştır (Şekil 5, 6). Dünya genelinde yaklaşık 480,000 ÇİD-TB olgusu olduğu tahmin edilmektedir. ÇİD-TB hastaların yaklaşık % 9.0’unun yaygın ilaç dirençli TB (YİD-TB) olduğu bildirilmiştir. Saptanan ÇİD-TB olgularının yarıdan fazlası Çin, Hindistan ve Rusyada’dır. Dünyanın bazı bölgelerinde yüksek direnç oranları ve uygunsuz tedavi halen önemli endişe kaynağıdır (1).
Şekil 4. 1990-2013 yılında tüberküloza bağlı ölüm sayıları (World Health Organization. Global Tuberculosis Control: World Health Organization Report 2014’ten alınmıştır)
9
Şekil 5. Yeni olgulardaki ÇİD-TB olgu yüzdeleri (World Health Organization. Global Tuberculosis Control: World Health Organization Report 2014’ten alınmıştır)
Şekil 6. Daha önce tedavi alan hastalardaki ÇİD-TB olgu yüzdeleri (World Health Organization. Global Tuberculosis Control: World Health Organization Report 2014’ten
10 2.4.2. Türkiye’de Tüberküloz
Türkiye, tüberküloz insidansının orta düzeyde olduğu ülkeler arasında yer almaktadır. Sağlık Bakanlığı Verem Savaş Daire Başkanlığı’nca, Türkiye’de Verem Savaşı 2012 Raporu’na göre Türkiye’nin 2010 yılı TB mortalite hızı yüz binde 3,1; nokta prevalans hızı yüz binde 24; insidans hızı yüz binde 28 olarak verilmiştir (42).
Küresel TB Kontrolü 2011 Raporuna göre 2008 yılında 200’den fazla ÇİD-TB vakası raporlayan ülkeler içinde tedavi başarısı sıralamasında Türkiye ikinci sırada yer almaktadır. Türkiye’nin 2008 yılı ÇİD-TB olgu sayısı 263 olup bu hastalarda 24. ay tedavi başarısı oranı % 68,4’tür (42).
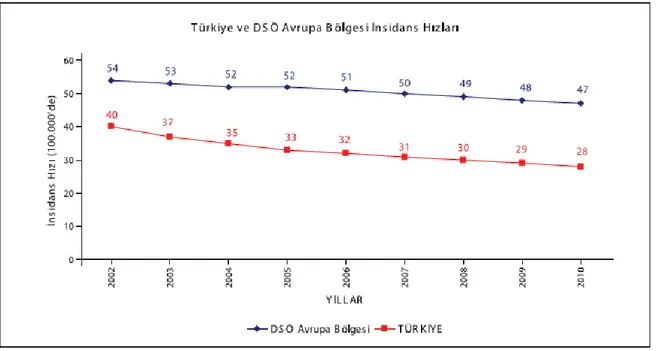
Türkiye’de TB insidans hızı 2002 yılında yüz binde 40 iken 2010 yılında yüz binde 28’e düşmüştür. Türkiye’nin içinde yer aldığı DSÖ-Avrupa Bölgesi’nde ise 2010 yılı insidans hızı yüz binde 47’dir (Şekil 7) (42).
Türkiye’nin TB nokta prevalans hızı 2002 yılında yüz binde 38 iken 2010 yılında yüz binde 24’e düşmüştür. Türkiye’nin içinde yer aldığı DSÖ-Avrupa Bölgesi’nde ise 2010 yılı nokta prevalans hızı yüz binde 63’tür (Şekil 8) (42).
Küresel TB Kontrolü 2011 Raporunda, Türkiye’nin 2010 yılı TB olgularında HIV prevalansı %0-4 aralığında verilmiştir (42).
Türkiye’de 2010 yılında toplam 16.551 tüberküloz hastası verem savaşı dispanserleri kayıtlarına girmiştir. Toplam olgu hızı yüz binde 24’den yüz binde 22,5’e (-%6,4) düşüş göstermiştir. Olgu hızının yaş gruplarına dağılımı incelendiğinde, 15-24 yaş grubundan başlayarak yükseldiği, 65 ve üzeri yaşlarda en yüksek düzeye (yüz binde 39,4) ulaştığı görülmektedir. Toplam 16.551 hastada yeni olguların oranı %91,7 (15.183) iken önceden tedavi görmüş olguların oranı %8,3’tür (1.368) (42).
İlaç duyarlılık testi yapılan toplam 4.965 hastanın sonuçları incelendiğinde; %19,5’inde (975) en az bir ilaca direnç saptanmıştır. En yüksek oranlarda direncin %13,3 ile izoniyazide karşı (660/4.965) geliştiği görülmüştür. İlaç duyarlılık testi yapılan 4.965 olgunun 250’sinin (%5) çok ilaca dirençli ( TB) olduğu tespit edilmiştir. İlaç direç testi yapılanlarda ÇİD-TB oranı yeni olgularda %2,5 (110) iken, önceden tedavi görmüş olgularda %22,8 (140) olarak saptanmıştır (42).
11
Şekil 7. Türkiye ve DSÖ Avrupa Bölgesi’nde TB İnsidans Hızları, 2002-2010 (Sağlık Bakanlığı Verem Savaş Daire Başkanlığı Türkiye’de Verem Savaşı 2012 Raporu’ndan
alınmıştır)
Şekil 8. Türkiye ve DSÖ Avrupa Bölgesi’nde TB Nokta Prevalans Hızları, 2002-2010 (Sağlık Bakanlığı Verem Savaş Daire Başkanlığı Türkiye’de Verem Savaşı 2012
12 2.5. Tüberküloz Tanısı
Aktif tüberküloz tanısı solunum yolu örneklerinde veya diğer vücut sıvılarında M. tuberculosi’in üretilmesiyle konur. Her ne kadar yeni moleküler tanı yöntemleri geliştirilmiş olsa da tüberküloz tanısında mikroskopi ve "altın standart" olan kültür yaygın olarak kullanılmaktadır. Ayrıca tedavinin etkinliğini izlemek ve aktif tüberkülozun çevreye bulaşını engellemek için kısa sürede sonuç veren yöntemlere ihtiyaç vardır (25, 26).
2.5.1. ARB mikroskopi
Asidorezistan boyanma özelliği mikobakterilerin hücre duvarını çevreleyen ince mumsu tabakadan kaynaklanmaktadır. Boyama işleminin ilk aşamasında kullanılan primer boya (örn; karbol fuksin) mikobakterilerin hücre duvarına penetre olarak basilinin yüksek lipit içerikli hücre duvarına ve asidorezistan boyayı asit-alkolle renksizleştirme işleminden sonra bırakmaz. Diğer bakteriler ise bırakarak renklerini kaybeder. Renksizleştirmeden sonra mikroskobik incelemeyi kolaylaştıracak konturu sağlamak için zemin zıt boyalarla boyanır. Mikroskopik inceleme için ışık mikroskopu veya floresan mikroskop kullanılabilir (15, 17).
Asidorezistan boyama yöntemi ile boyanmış preparatların incelenmesi klinik örneklerde ve kültürde mikobakterilerin varlığını göstermede en kolay, en ucuz ve en hızlı yöntemlerden biridir. Tüberküloz basilinin yüksek lipit içerikli hücre duvarı gram gibi sıvı bazlı boyaların penetrasyonunu engeller (16, 28).
Ön tanı çoğu kez doku (örn., lenf düğümü biyopsisi) veya balgam gibi klinik örneğin mikroskopik incelemesinde ARB görülmesine dayanarak konur. Hızlı ve ucuz bir yöntem olmasına karşın, kültürle doğrulanmış akciğer tüberkülozu olgularında ARB mikroskopinin duyarılılığı (%40-60) göreceli olarak düşüktür. Büyük sayılarda klinik örnek kabul eden çok sayıda modern laboratuvar auramine-rhodamine boyası ve floresan mikroskopiyi kullanır (22). Karbol fuksin veya florokrom boyalar mikobakteriyel hücre duvarındaki mikolik asite bağlanırlar. Karbol fuksin boyama ile hazırlanan yaymalar immersiyon objektifinde (100X), florokrom boyama ile hazırlanan yaymalar ise 25X veya 45X objektiflerde incelenir. Bu nedenle lam üzerinde birim zamanda taranan alan karbol fuksin boyamada florokrom boyamadan daha az, inceleme için gerekli olan süre ise daha fazladır (28).
Floresan boyamada ARB benzer morfoloji gösterir ancak kullanılan primer boyaya bağlı olarak sarı-yeşil veya sarı-portakal floresans izlenir. Ölü basiller florokrom boyalarla boyanabilir. Bu nedenle kültür negatif örneklerin yaklaşık %10 kadarı yayma pozitif olabilir.
13
Bu nedenle tedavi etkinliği değerlendirilirken florokrom boyamada basil saptanması mutlaka tedavi başarısızlığı anlamına gelmez ve bu durumda karbol fuksin boya ile doğrulama gerekir. Florokrom ile boyanmış preparat daha sonra karbol fuksinle boyanabilir ancak tersi geçerli değildir (29). Kinyoun veya Ziehl-Neelsen bazik fuksin boyasıyla boyanmış örneklerin ışık mikroskopisi daha zaman alıcı olmasına rağmen sonuçlar tatmin edicidir (22, 27).
Standart konsantrasyon teknikleri kullanıldığında rutin mikroskobik incelemde ARB saptanabilmesi için balgamın mililitresinde yaklaşık 10.000 basil (104
/mL) bulunması gerekmektedir. Yaygın hastalığı olan hastaların klinik örneklerinde bol miktarda mikobakteri olduğundan kültür ile mikroskopi arasında iyi bir korelasyon olmasına karşın, minimal bir hastalığı olanlarda veya hastalığı daha az ilerlemiş olanlarda pozitif yayma ve pozitif kültür arasındaki korelasyon %25-40’dır. Kültürde üremeyen organizmalar da boyanabildiğinden kültür, yaymadan daha önce negatifleşir. Devam eden tedaviyle basillerin ölmesiyle balgamda çıkarılan basil sayısı azalır. Bu nedenle tedavi sırasında balgamdaki basil sayısı tedaviye yanıtın izlenmesinde önemlidir. Basil sayısının azalması tedaviye yanıtı, azalmaması ise ilaç direncini düşündürür (29).
Karbol fuksin boyamada ARB’ler kırmızı renkte boyanırken, kullanılan zıt boyaya göre zemin yeşil veya mavi renkte boyanır. Ziehl Neelsen ve Kinyoun teknikleri teorik olarak aynıdır ancak deneyimler Ziehl Neelsen yönteminin özellikle bazı hızlı üreyen mikobakterileri saptamada daha duyarlı olduğunu göstermektedir (28). Bu özellik mikobakteri hücre duvarını çevreleyen kalın mumsu kapsülden kaynaklanmaktadır. Sıvı karbol fuksinin mumsu tabakadan geçebilmesi için kapsülün yumuşatılması gerekir. Bu Ziehl Neelsen yönteminde -güneş ışığı altında eriyen parafin filim gibi- ısıyla sağlanır. Boya ısıyla yumuşamış kapsülü geçerek hücre duvarına bağlanır; daha sonra bakteri hücre duvarı soğuduğunda mumsu tabaka yeniden sertleşir ve bağlanan boyayı asit alkolle yapılan renksizleştirme işleminden korur. Kinyoun boyamada ise boyanın mumsu kapsülden geçmesini artırmak için yüzey aktif bir ajan kullanılır. Bu durumda mumsu tabakanın yeniden oluşması tam olmadığından renksizleştirme işlemi sırasında bağlanan boyanın önemli bir kısmı uzaklaşır. Özellikle mumsu tabakası ince olan birçok hızlı üreyen mikobakteri renksizleştirme işlemine çok daha duyarlıdır. Bu drumda HCl’in daha seyreltik (%1) kullanılması bu sorunu çözebilir. Hızlı üreyenler dışında, florokorom boya ile karbol fuksin boyanın performansı arasında bir fark yoktur. Florokrom boyamada, karbol fuksin boyama ile karşılaştırıldığında, birim zamanda çok daha fazla alan tarandığından duarlılığı daha yüksek ve kullanımı daha kolaydır. Bu nedenle örneklerin ilk incelemesi florokrom boya ile yapılır,
14
ardından kuşkulu örnekler karbol fuksin yöntemle tekrar boyanarak doğrulaması yapılır (26, 27, 29).
2.5.2. Mikobakteri Kültürü
Kesin tanı, klinik örnekten M.tuberculosis’in izolasyonu ve identifikasyonuna veya türe özgü DNA dizilerinin nükleik asit amplifikasyon testleriyle tanımlanmasına dayanarak konur. Örnekler yumurta veya agar bazlı besiyerlerine (örn. Löwenstein Jensen ve Middlebrook 7H10) ekilerek 37oC’de inkübe (Middlebrook besiyeri için %5 CO2’li ortamda) edilebilir (22,
26).
Mycobacterium tuberculosis ve diğer bir çok mikobakteri türü yavaş ürediğinden, üremenin saptanması için 4-8 hafta süre gerekebilir. Her ne kadar üreme zamanı, koloni pigmentasyonu ve morfolojisi temel alınarak M.tuberculosis’in ön tanımlaması yapılabilse de mikobakterilerin tür düzeyinde tanımlanması için geleneksel olarak çeşitli biyokimyasal testler kullanılmaktadır. Modern, iyi donanımlı laboratuvarlarda katı besi yeri kullanılarak yapılan izolasyonun yerini sıvı bazlı kültür sistemleri kullanılarak yapılan izolasyon, biyokimyasal testlerle yapılan identifikasyonun yerini ise moleküler yöntemlerle yapılan tür tanımlaması almıştır. Bu yeni yöntemlerle bakteriyolojik doğrulama için gereken süre 2-3 haftaya inmiştir (22).
Kullanılan kültür ortamları
Rutin mikobakteriyoloji laboratuvarlarında kullanılan besiyerleri katı ve sıvı olmak üzere iki grupta toplanır. Üreme süresini kısalttığı ve mikobakterilerin izolasyon oranını artırdığından tüm dünyada sıvı besiyerlerine bir yöneliş vardır (28, 29).
Katı besiyeri
Bir çok mikobakteri türünün üremesini sağladığından katı besiyerleri dünyada yaygın olarak kullanılmaktadır. Hazırlanmış katı besiyerleri buzdolabında saklanabilir. Yumurta temelli ve agar temelli olmak üzere dünyada yaygın olarak kullanılan iki tip katı besiyeri bulunmaktadır (28).
15 Yumurta bazlı besiyerleri
En yaygın olarak kullanılan yumurta bazlı besiyeri olan Löwenstein-Jensen (LJ) en eski besiyerlerinden biridir. Kontaminan bakteri ve mantarların üremesini engelleyen malaşit yeşili içeren LJ selektif bir besiyeridir. LJ üretme ve duyarlılık testi amacıyla yaygın olarak kullanılmasına karşın besiyerinin yüzeyinin küçük olması nedeniyle kolonilerin sayılması güçtür. Yumurta temelli besiyerinde M.tuberculosis kompleks ve diğer bir çok mikobakteri üreyebilir ancak nontüberküloz mikobakterilerde verim düşüktür. Sıvı besiyeriyle karşılaştırıldığında mikobakteriler LJ besiyerinde çok daha yavaş ürer. Ortalama üreme süresi daha uzun olduğundan inkübasyon protokolleri 8 haftaya kadar uzatılır (28-30).
Agar-bazlı besiyerleri
Middlebrook 7H10 agar ve Middlebrook 7H11 agar mikobakterilerin üretilmesinde yaygın olarak kullanılan iki besiyeridir. Güç üreyen ve INH’a dirençli M.tuberculosis suşlarının üremesine yardımcı olduğu için kazein hidrolizat içeren 7H11 agar daha çok kullanılır. Hazırlandıktan sonra buzdolabında 4-6 hafta saklanabilir. Middlebrook agarlar bir kez otoklavlandıktan sonra tekrar ısıtılmamalıdır. Hazırlanan besiyerleri saklanırken güneş ışığından korunmalıdır (28-30).
Agar temelli besiyerleri plaklara döküldüğü için koloni morfolojisinin değerlendirilmesi ve koloni sayımı daha kolaydır. Kontamine olduğunda mikobakteri kolonilerini kurtarmak mümkün olabilir. Klinik örneklerden mikobakterileri izole ederken besiyerini daha selektif hale getirmek için kontaminan mikroorganizmaların üremesini engelleyen çeşitli antibakteriyel ve antifungal ilaçlar eklenebilir. Üretme süresi LJ’den daha kısadır ve M.tuberculosis kompleks’in üremesi için 6 hafta süre yeterlidir (28-30).
Üretme süresi sıvı besiyerlerinden daha uzundur ve LJ besiyerinden daha pahalıdır. Laboratuvarda hazırlaması zordur, raf ömrü kısadır ve M.tuberculosis kompleks’in optimal üremesi için CO2 inkübatörüne gereksinim vardır (28, 29, 31).
Sıvı besiyerleri
Mikobakterilerin üremesini saptamak için sıvı besiyerleri 1980’den itibaren kullanılmaya başlanmıştır. Sıvı besiyerinde M.tuberculosis kompleks ve diğer bir çok nontüberküloz mikobakterinin üremesi daha kısa bir sure içinde olur ve üreme oranı daha yüksektir. Sıvı besiyerlerinin raf ömrü uzundur, oda ısısında saklanabilir ve inkübasyon için ek CO2
16
gerekmez. Yavaş üreyen mikobakteriler için ortalama üreme süresi 12-16 gün ve inkübasyon süresi 6 haftadır. M.tuberculosis için ortalama izolasyon ve duyarlılık testi süresi toplamı 4 haftadır. Pozitiflik oranında artma ve üreme süresinde kısalma sağladığından CDC, primer izolasyon ve ilaç duyarlılık testleri için ticari sıvı besiyerlerinin kullanılmasını önermektedir (28-30).
Sıvı besiyerleri, ilave edilen antimikrobiyaller (polimiksin B, amfoterisin B, nalidiksik asit, trimetoprim, azlosilin) ile selektif hale getirilir. Bu antimikrobiyaller gram pozitif ve gram negatif bakterilerin ve mantarların çoğuna karşı etkilidir. Sıvı besiyerleri katı besiyerlerine göre çok daha kolay kontamine olduğundan örneklerin işlenmesi sırasında dekontaminasyon işlemleri çok daha dikkatli yapılmalıdır (28-30).
2.5.3. Nükleik Asit Amplifikasyon Testleri
Mikobakterilerin nükleik asitlerini çoğaltma temeline dayanan bazı test sistemleri bulunmaktadır. Bu sistemler birkaç saat gibi kısa bir süre içinde kültüre yakın bir yüksek duyarlılık ve özgüllükte tüberküloz tanısına izin vermektedir. Bu sistemler en çok ARB pozitif örnekleri olan bir hastada tüberküloz tanısının hızlı doğrulamasında yararlıdır ancak ARB negatif pulmoner veya ekstrapulmoner tüberküloz tanısında da kullanılmaktadır (22).
2.6. Latent M.tuberculosis Enfeksiyonunun Tanısı 2.6.1. Tüberkülin Deri Testi
Robert Koch, 1891’de konsantre sıvı kültür ortamında tüberkülozlu hastalara subkutanöz olarak enjekte edildiğinde, deri reaksiyonu oluşmasına yol açan ve daha sonra eski tüberkülin [“old tuberculin” (OT)] olarak adlandırılan M.tubeculosis komponentlerini keşfetti. 1932’de Seibert ve Munday bu ürünü amonyum sülfat presipitastonu ile saflaştırarak tüberkülinin saflaştırılmış protein derivesi [tuberculin purified protein derivative (PPD)] olarak bilinen aktif bir protein fraksiyonu ürettiler. 1941’de Seibert ve Glenn tarafından uluslararası standart olarak seçilen PPD-S geliştirildi. Daha sonra DSÖ ve UNICEF PPD’nin (RT23) bol miktarda üretilmesine destek olarak yaygın kullanımını sağladı. PPD’nin en önemli kısıtlılığı farklı mikobakteri türlerinde bulunan oldukça korunmuş çok sayıda protein içermesinden dolayı mikobakteriyel tür özgüllüğünün olmamasıdır. Ek olarak derideki reaksiyonun
17
yorumlanmasının subjektif olması, ürünün bozulması, üretilen partiler arasında değişkenlikler olması PPD’nin yararını kısıtlar (10, 11, 22, 32, 33).
Tüberkülin-PPD ile deri testi (TDT) latent M.tuberculosis enfeksiyonunu (LTBE) taramak için en yaygın olarak kullanılan testtir. Göreceli olarak duyarlılık ve özgüllüğünün düşük olması, latent enfeksiyon ve aktif hastalık arasında ayırım yapamaması nedeniyle testin aktif tüberküloz tanısında kullanım değeri sınırlıdır. Tüberküloz gelişme olasılığı çok yüksek olan bağışıklık sistemi baskılanmış bireylerde yanlış negatif reaksiyonlar sıktır. Nontüberküloz mikobakteri enfeksiyonlarına ve BCG aşısına bağlı yanlış-pozitif reaksiyonlar olabilir (32, 33).
2.6.2. IFN-γ Salınım Testleri (IFN-γ Release Assays; IGRAs)
Son yıllarda tüberküloza oldukça spesifik ESAT-6 ve CFP-10 antijenleri ile uyarılmaya yanıt olarak T hücrelerinden salınan IFN-γ’yı ölçen, iki in vitro test ticari olarak kullanıma sunuldu. QuantiFERON-TB Gold® (Cellestis Ltd., Carnegie, Australia) IFN-γ’yı ölçen bir tam kan enzyme–linked immunosorbent assay (ELISA) ve T-SPOT.TB® (Oxford Immunotec, Oxford, UK) bir enzyme–linked immunospot (ELISpot) testidir (22).
IGRA’lar BCG aşısına ve nontüberküloz mikobakterilerle duyarlılanmaya bağlı olarak daha az çapraz reaksiyon verdiklerinden, TDT’den daha özgüldürler. IGRA’lar ayrıca aktif tüberküloz (LTBE yerine kullanılarak) için en az TDT kadar duyarlı görünmektedirler. Bu testler düşük insidanslı bölgelerde, temas araştırmasında, M.tuberculosis ile karşılaşmayı TDT’den daha iyi göstermesine karşın, bir altın standart olmadığından LTBE için tanısal duyarlılık direkt olarak hesaplanamaz (22).
Düşük insidanslı ve gelir düzeyinin yüksek olduğu, BCG aşısına bağlı çapraz reaksiyonların TDT’nin kullanımını ve değerlendirilmesini olumsuz olarak etkileyebildiği bölgelerde yüksek özgüllüğü ve diğer potansiyel avantajlarından dolayı, LTBE tanısı için IGRA’ların TDT’nin yerini alması kuvvetli bir olasılık gibi görünmektedir. Şimdiye kadar rutin uygulamada yapılan direkt karşılaştırmalı çalışmalar ELISpot’da belirsiz sonuç oranlarının tam kan ELISA’dan daha düşük, tanısal duyarlılığın ise muhtemelen daha yüksek olduğunu desteklemektedir. Yapılmakta olan çalışmalarda temas araştırmasında, tüberküloz hastalığı kuşkulu kişilerde, sağlık çalışanlarında, HIV ile enfekte bireylerde, iatrojenik olarak bağışıklık sistemi baskılanmış bireylerde ve çocuklarda bu testlerin performansı değerlendirilmektedir (22).
18 2.7. İlaç Duyarlılık Testi
Genellikle izoniyazid, rifampisin ve etambutol duyarılılığı ilk M.tuberculosis izolatında test edilmelidir. Bu ilaçlardan bir veya daha fazlasına karşı direnç saptanırsa veya hasta başlangıç tedavisine yanıt vermezse ya da tedavinin tamamlanmasından sonra nüks görülürse, ek olarak genişletilmiş duyarlılık testi zorunludur (29, 30).
Duyarlılık testleri direkt (klinik örnekten) veya indirekt (mikobakteri kültürlerinden) olarak katı veya sıvı besiyerinde yapılabilir. En hızlı sonuç sıvı besiyerinde yapılan duyarlılık testinde elde edilmektedir ve ortalama bildirim süresi 3 haftadır. Katı besiyerinde yapılan direkt duyarlılık testlerinde 8 haftadan daha uzun bir süre sonuç alınamayabilir. Rifampisin ve izoniyazid direncinden sorumlu olduğu bilinen genetik mutasyonların hızlı tanımlanması için moleküler yöntemler geliştirilmiştir (28-30).
Antitüberküloz ilaç duyarlılık testleri
Mycobacterium tuberculosis kompleks (MTBK)’in (M.tuberculosis, M.bovis, M.pinnipedii, M.caprae, M.microti, M.africanum, M.canettii) duyarlılık testleri proporsiyon yöntemi veya standart yöntemlerle eşdeğer olduğu düşünülen yöntemlerle yapılır. ABD’de uzun yıllardır Middlebrook 7H10 agar kullanılarak yapılan proporsiyon yöntemi standart yöntem olarak kabul edilmektedir. Amerikan Halk Sağlığı Servisi Middlebrook 7H10 agar besiyerinin kullanıldığı agar proporsiyon yöntemini önermektedir (28-30).
Antitüberküloz ilaçların kritik konsantrasyonu uluslararası anlaşmayla kararlaştırılmış olup daha önce ilaçla karşılaşmamış M.tuberculosis “vahşi suşları”nın %95’ini inhibe eden aynı zamanda tedaviye yanıt vermeyen hastalardan soyutlanıp dirençli olarak kabul edilen M.tuberculosis suşlarını inhibe etmeyen en düşük ilaç konsantrasyonu olarak tanımlanmıştır. Löwenstein-Jensen, Middlebrook 7H10 ve 7H11’de yapılan proporsiyon yöntemlerinde ve ticari duyarlılık test sistemlerinde kullanılan antitüberküloz ilaçların eşdeğer kritik konsantrasyonları belirlenmiştir. Her laboratuvar MTBK’in duyarlılık testlerini kullandığı test yöntemindeki kritik konsantrasyonlarla yapmalıdır. Primer antitüberküloz ilaçların (INH, RİF, EMB, PZA) kritik konsantrasyonlarının kullanıldığı in vitro duyarlılık testlerinin sonuçları bu ilaçların tüberkülozlu hastalardaki klinik etkinliğiyle uyumludur (28-30, 34).
Agar proporsiyon yöntemi ve ticari duyarlılık yöntemlerinde test edilen ilacın tek bir kritik konsantrasyonu ‘’breakpoint’’ değeri olarak belirtilse de, laboratuvarlar ek olarak INH’ın
19
daha yüksek konsantrasyonlarını da test edebilirler. İlacın kritik konsantrasyonu izolatın dirençli olup olmadığını belirler. Buna karşın INH’ın ilave daha yüksek konsantrasyonu klinisyene tedavi rejimine karar vermesinde yardımcı olabilecek bilgiler sağlayabilir (28-30).
INH’ın iki konsantrasyonunun kullanılması ilaç direncinin düzeyi hakkında bilgi verir. CDC Tüberküloz Eliminasyonu Danışma Komitesi INH için iki konsantrasyon bakılmasını önermektedir. Ancak bir INH konsantrasyonu test edilecekse ilacın düşük kritik konsantrasyonu kullanılmalıdır (28-30).
MTBK’in agar proporsiyon yöntemiyle duyarlılık testi hızlı bir yöntem değildir. Duyarlılık testi için ticari sıvı duyarlılık testi yönteminin kullanılması sonuç alınma süresini kısaltmaktadır. CDC mikobakteriyoloji laboratuvarlarının örnek kabulünden 15-30 gün sonra MTBK için ilk seçenek ilaç duyarlılık sonuçlarını bildirmelerini önermektedir. İdeal olarak MTBK’nin izolasyonundan 7-14 gün sonra duyarlılık testi sonuçları belli olmalıdır (3).
PZA tüberküloz tedavisinde 1. basamak ilaçlardandır. PZA direnci insidansı oldukça düşüktür ve PZA direncinin görülmediği bölgelerde diğer 1. basamak ilaçlara duyarlı kökenlere bu ilaç için duyarlılık gerekmeyebilir. BACTEC 460 TB sistemi duyarlılık testi PZA duyarlılığı için referans yöntemdir (35).
Hızlı test sonuçları standart yöntem olan agar proporsiyon ile elde edilen sonuçlarla korelasyon göstermelidir. Laboratuvarlar, besiyeri ve ilaç performansının bir lottan diğerine değişmediği, besiyeri ve ilaç lotlarının uzun zaman sürecinde istikrarlı sonuçlar sağladığı sıvı besiyeri temelli sistemler seçmelidir. Hızlı yöntemle elde edilen şüpheli sonuçlar agar proporsiyon yöntemiyle doğrulanmalıdır. Yeni yöntemlerle yeni antimikobakteriyel ilaçların in-vitro duyarlılığı değerlendirilirken agar proporsiyon yöntemi standart olarak kullanılır (35). MTBK’in duyarılılık testinde kullanılan primer ilaçların tüm paneli INH’ın yüksek ve düşük konsantrasyonları, RİF, EMB ve PZA’dan oluşmaktadır. Bu, klinisyene tüm dünyada hastaların çoğunda kulanılan dörtlü tedavi için gerekli olan bilgiyi verir. PZA’nın ve yanı sıra INH’ın yüksek konsantrasyonunun da panelde olması, direnç saptandığında dörtlü tedavinin etkinliği konusunda hazır bilgi sağlar. Ayrıca primer ilaçların tüm panelinin kullanılması sadece INH’a dirençli kökenlerde gereksiz ikinci seçenek ilaç duyarlılık testlerinden kaçınmak için gerekli olan bilgiyi sağlayabilir (29, 31, 35).
20
İkinci seçenek ilaçların test edilmesi gerektiğinde laboratuvarlar klinisyene ek ilaç duyarlılık sonuçlarını parça parça bildirmekten kaçınmalıdırlar. INH’ın sadece düşük konsantrasyonlarını test eden laboratuvarlar INH’a düşük konsantrasyonda dirençli herhangi bir MTBK izolatında INH’ın yüksek konsantrasyonunu da test etmelidir. Bir MTBK izolatı RİF’e ya da birinci seçenek ilaçlardan herhangi iki tanesine dirençli olarak saptandığında tüm ikinci seçenek ilaçlar ve EMB’nin yüksek konsantrasyonları da test edilmelidir. Bu testleri kendileri yapamayan laboratuvarlar izolatları en kısa süre içinde referans laboratuvarlara yollamalıdır. Epidemiyolojik hikayeye dayanarak yüksek ÇİD veya YİD-TB olma ihtimali olan hastaların klinik örneklerinden elde edilen izolatların birinci-basamak antitüberküloz ilaç duyarlılık testleri yanısıra ikinci-basamak antitüberküloz ilaç duyarlılık testleri de yapılmalıdır (35).
Agar proporsiyon yöntemi standardize edilmiş inokulumun çeşitli dilüsyonlarının (10-2
ve 10-4) eşit miktarlarda test edilecek ilacı içeren ve içermeyen agar bazlı besiyerlerine inokülasyonu ile gerçekleştirilir (Şekil 9) (28).
Şekil 9. İnokulumun 10-2 ve 10-4 dilüsyonlarının ilaçlı ve ilaçsız agar bazlı besiyerlerine inokülasyonu
Testin değerlendirilebilmesi için ilaç içermeyen kontrol besiyerinde sayılabilir kolonilerin gözlenmesi gerekir. İlaç içeren besiyerindeki koloni sayısı (CFU) ilaçsız besiyerindeki kolonilerle karşılaştırılıp yüzde (%) olarak ifade edilir. İlaç içeren besiyerinde üreyen MTBK’in koloni sayısı ilaçsız besiyerinde üreyen koloni sayısının %1’inden fazla ise test edilen kökenin bu ilaca dirençli olduğu kabul edilir (Şekil 10) (28).
21
Şekil 10. 7H10 agar proporsiyon yöntemi ile yapılan duyarlılık testinin değerlendirilmesi
Hızlı ticari yöntemler; dirençli mikroorganizmaları mümkün olduğu kadar erken saptayabilmek için, hastalardan izole edilen MTBK izolatlarının testi için daha kısa inkübasyonlu ticari duyarlılık test sistemleridir. FDA tarafından onay almış ticari olarak hızlı ticari yöntemler BACTEC 460, BACTEC MGIT 960 ve ESP II’dir (29).
BACTEC MGIT 960 SIRE Kit yöntemi 4-13 günlük kalitatif bir testtir. Test ilaç içeren tüple ilaç içermeyen (Üreme Kontrolü) tüpteki M.tuberculosis izolatının üremesinin karşılaştırılmasını temel alır. BACTEC MGIT 960 cihazı sürekli olarak tüplerdeki artan floresansı izler. Duyarlılık sonucunun belirlenmesi için cihaz tarafından kontrol tüpündeki floresans ile, ilaç içeren tüpteki floresansın analizi karşılşatırılır. BACTEC MGIT 960 cihazı bu sonuçları otomatik olarak yorumlar ve duyarlı veya dirençli sonucu verir (36, 37).
Moleküler yöntemler
Mycobacterium tuberculosis’de RIF ve INH direncinin saptanmasında kullanılan
moleküler yöntemler
Son on yıl içinde M.tuberculosis’de ilaç direncinin moleküler mekanizmalarının anlaşılmasından sonra hızlı ilaç direnci saptanmasına yönelik moleküler uygulamalar geliştirilmiştir (35).
Moleküler direnç göstergelerinin saptanması için minimal bir üreme yeterlidir. Bu yöntemlerle günler, haftalar süren duyarlılık testleri saatler içinde tamamlanabilmektedir. Ayrıca bu teknikler otomasyona izin vermekte ve laboratuvar tehlikelerini azaltmaktadır. Özellikle RİF ve INH direncini saptayan yöntemler klinik tanı laboratuvarlarında giderek artan oranlarda kullanılmaktadır (35).
22
Günümüzde direnç saptanmasında INNO-LİPA RIF TB. (Innogenetics NV, Zwijndrecht, Belgium) ve GenoType MTBDR (Hain Lifescience GmbH, Nehren, Germany) gibi ters hibridizasyon testleri ile DNA dizi analizi rutin uygulamalarda yaygın olarak kullanılan yöntemlerdir (1).
DNA dizi analizi mutasyonların saptanmasında en dolaysız ve güvenilir yöntemdir. Dizi analizi ile bilinen mutasyonların yanı sıra önceden bilinmeyen mutasyonlar da saptanabilmektedir. INH direncinde olduğu gibi mutasyonların dağınık ve büyük segmentler halinde olduğu durumlarda her izolat için birden fazla sayıda dizi analizi gerekebildiğinden kolay uygulanabilir bir yöntem değildir. Buna karşın rpoB gibi yoğun ve çok kısa segmentte sınırlı olan direnç genlerinin saptanmasında DNA dizi analizi rutin uygulama için uygun bir tekniktir (38).
Günümüzde DNA dizi analizi amacıyla yaygın olarak Sanger’in zincir sonlandırma temeline dayanan dideoksinükleotid yöntemi kullanılmaktadır. Zincir sonlandırma yöntemi manuel ve otomatize sistem olarak kullanılabilmektedir. Ayrıca son yıllarda pyrosequencing olarak adlandırılan yeni geliştirilen bir DNA dizi analizi yöntemi de kullanıma girmiştir (35, 38).
PCR-Revers hibridizasyon testinde DNA izolasyonunun ardından hedef gen, biyotinle işaretlenmiş özgül primerler kullanılarak PCR ile çoğlatılır ve nitrosellülöz şerit üzerine yerleştirilmiş özgül problarla hibridize edilir. Oluşan bant paternlerine göre testin sonucu değerlendirilir (29, 35, 38).
Manuel ve otomatize olarak uygulanabilen ters hibridizasyon testleri moleküler yöntemler için asgari koşulların bulunduğu laboratuvarlarda sorunsuz olarak kullanılabilmekte ve testler 6 saat içinde sonuçlanmaktadır. Bu testler çok sayıda klinik çalışmada değerlendirilmiş hızlı, duyarlı ve özgül bulunmuştur. Bu yararlarına karşılık ters hibridizasyon testleri hedefledikleri gen bölgesi dışındaki dirence yol açan mutasyonları saptayamamaktadırlar. Ayrıca bu testlerle nadir görülen ve dirence yol açmayan sessiz ve nötral mutasyonlar da saptanarak yanlış pozitif sonuçlar elde edilebilmektedir. Bu nedenle özgül mutasyonları gösteren bant paternleri dışında saptanan direnç paternlerinin nadir de olsa fenotipik olarak dirence yol açmayabileceği bilinmeli ve test sonuçları daima fenotipik yöntemlerle doğrulanmalıdır (35, 38).
23 2.8. Tüberküloz Tedavisinde Kullanılan İlaçlar
Tüberküloz tedavisinde kullanılan ilaçlar birinci seçenek ve ikinci seçenek ilaçlar olarak sınıflandırılmaktadır. En etkili olanlar birinci seçenek zorunlu antitüberküloz ilaçlardır ve herhangi bir kısa süreli tedavi rejiminin gerekli komponentleridir. Bu kategorideki dört ilaç rifampisin, izoniyazid, etambutol ve pirazinamiddir (22).
Rifabutin, rifapentin ve streptomisin kabul edilebilir toksisitelerinin yanısıra oldukça etkili olan birinci seçenek tamamlayıcı ilaçlardır (22).
İkinci seçenek antitüberküloz ilaçlar klinik olarak birinci seçenek ilaçlardan daha az etkilidir ve çok daha sık, şiddetli reaksiyonlara yol açmaktadırlar. Para-aminosalisilik asit (PAS), etiyonamid, sikloserin, amikasin, kanamisin ve kapreomisin daha eski ilaçlardır. Birinci seçenek ilaçlara dirençli veya intoleran tüberkülozlu hastalardaki olumlu deneyimler, levofloksasin ve moksifloksasinin gibi florokinolonların çoklu ilaca dirençli antitüberküloz tedavi rejimlerine önemli ekler olduğunu desteklemektedir; bu nedenle bu ilaçlar günümüzde ikinci seçenek ilaç listesine eklenmiştir (22).
2.8.1. İlk Seçenek Antitüberküloz İlaçlar Rifampisin :
En önemli ve potent antitüberküloz ajan olarak kabul edilen rifampisin Streptomyces mediterranei’nin semisentetik bir türevidir. Rifampisin hem hücre içi hem de hücre dışındaki basillere karşı bakterisidal aktiviteye sahiptir. Rifampisin DNA’ya bağımlı RNA polimeraz enzimine özgül olarak bağlanıp inhibe ederek RNA sentezini engeller (22).
Rifampisin direnci RNA polimeraz geninin β altünitesini (rpoB) değiştiren spontan nokta mutasyonları sonucunda ortaya çıkar. Yapılan çalışmalarda rifampisine dirençli suşların %96’sında genin 81-bp’lik merkezi kor bölgesinde yanlış okuma mutasyonları olduğu saptanmıştır. En sık görülen mutasyon S531L mutasyonudur. Bu mutasyonların %75’i , RNA polimeraz-β alt ünitesinin 516. , 526. , 531. pozisyonlarında bulunan aminoasitlerin başka aminoasitlerle değişimine yol açar. Rifampisine dirençli suşların çok büyük bir bölümünde İzoniyazid direnci de bulunmaktadır (22, 38, 39).
24 İzoniyazid :
İzoniyazid, rifampisinden sonra kullanımdaki en iyi ilaç olarak kabul edilmektedir. İzoniyazid organizmanın dirençli olmaması durumunda tüm antitüberküloz tedavi rejimlerinde bulunmalıdır. Bu ajan ucuzdur, kolayca üretilir, dünya genelinde bulunabilir, mikobakteriler için oldukça selektifdir ve iyi tolere edilir; hastaların sadece %5’inde yan etki görülür. Hücreye kolayca geçen suda eriyen küçük bir molekül olan izoniyazid izonikotinik asidin hidrazididir. İzoniyazidin vahşi tip (tedavi edilmemiş) M.tuberculosis suşları için minimal inhibitör konsantrasyonları (MİK) <0.1 µg/ ml’dir (22).
Etki mekanizması katalaz-peroksidaz gibi oksijene bağımlı yolaklar aracılığıyla hücre duvarı mikolik asit sentezinin inhibisyonuyladır. İzoniyazid ön ilaçtır, mikroorganizmanın katG geni tarafından kodlanan katalaz-peroksidaz enzimiyle aktive olur. Aktive olmuş INH, inhA geni tarafından kodlanan ve hücre duvarı mikolik asit sentezinde görev yapan NADH enoil ACP redüktaz enzimini inhibe ederek etkisini gösterir. İzoniyazid hem hücre içindeki hem de hücre dışındaki; dinlenmedeki basillere karşı bakteriyostatik, hızlı çoğalan basillere karşı bakterisidal etki gösterir (39, 40).
İzoniyazide dirençli suşların çoğunda ya katalaz peroksidaz geni (katG) ya da inhA olarak bilinen iki-gen lokusunun promoter bölgesinde amino asit değişiklikleri vardır. Yüksek düzey izoniyazid direncine yol açan katG genindeki mutasyonları ayrıca katalaz peroksidaz aktivitesindeki azalmayla ilişkilidir. Düşük düzey izoniyazid direnciyle ilişkli inhA geninin promoter bölgedeki mutasyonlar ise hedefin üretiminde artışa yol açar (39, 40).
Etambutol:
Etilendiaminin bir türevi olan etambutol yalnız mikobakterilere etkili, suda eriyen bir bileşiktir. İlk seçenek ilaçlar içinde M.tuberculosis’e en az etkili ilaç etambutoldür (22).
Etambutol standart dozlarda M.tuberculosis’e bakteriyostatik etki gösterir. Primer etki mekanizması, arabinozun hücre duvarında yer alan arabinogalaktan içinde polimerizasyonuna aracılık eden bir arabinoziltransferazı ihbibe etmek gibi görünmektedir (22).
Mycobacterium tuberculosis’de etambutol direnci en çok arabinoziltransferazı kodlayan üç genden oluşan embCAB operonundaki yanlış okuma mutasyonlarıyla ilişkilidir. Dirençli suşların yaklaşık %70’inde bu mutasyonlar bulunmaktadır. En sık saptanan mutasyon embB’nin 306. kodondaki mutasyondur (38, 39).
25 Pirazinamid:
Bir nikotinik asit türevi olan pirazinamid tüberkülozun kısa süreli tedavisinde kulanılan önemli bir bakterisidal ilaçtır (22).
Pirazinamid aslında sadece M.tubercluosis’i kapsayan dar antimikrobiyal aktivite spektrumuyla izoniyazide benzer. İlaç, fagositlerin içinde asidik koşullarda veya kazeöz granülomların içinde bulunan metabolizması yavaşlamış organizmalara karşı bakterisidal etkilidir; sadece pH 6’nın altında etkilidir. Pirazinamidin tüberküloz basili tarafından aktif formu olan pirazinoik asite dönüştürülen bir ön ilaç olduğu düşünülmektedir. Bu bileşiğin hedefinin yağ asiti sentez geni (fasI) olduğu düşünülmektedir (22).
Pirazinamid direncinin önemli bir bölümüne pirazinamidaz aktivitesinin kaybına yol açan pncA genindeki mutasyonlar yol açar (38).
2.8.2. İlk Seçenek Tamamlayıcı Antitüberküloz İlaçlar Streptomisin:
Streptomyces griseus’dan izole edilen bir aminoglikozit olan streptomisin sadece IM ve IV olarak uygulanabilir. Toksisitesi, yeterli BOS düzeylerinin elde edilmesindeki güçlükler ve parenteral uygulamanın zorluklarından dolayı Birleşik Devletler’de tüberkülozda en az kullanılan ilk seçenek tamamlayıcı ilaçtır. Buna karşın düşük maliyetinden dolayı streptomisin gelişmekte olan ülkelerde sıkça kullanılmaktadır (22).
Streptomisin ribozomal fonksiyonları bozarak protein sentezini inhibe etmektedir. Streptomisin ribozomun 30S alt ünitesinde yerleşmiş olan rpsL genin kodladığı S12 proteini ve rrs geninin kodladığı 16SrRNA’ya etki eder. Her iki proteinin de streptomisinin ribozomal proteinlere bağlanmasıyla ilişkili olduğuna inanılmaktadır (38).
Streptomisine dirençli M.tuberculosis suşlarının yaklaşık % 50’sinde S12 proteinini kodlayan rpsL, %20’sinde ise 16S rRNA’yı kodlayan rrs geninde mutasyon tanımlanmaktadır (38).
Rifabutin:
Rifabutin, M.tuberculosis’e karşı etkinlik de dahil olmak üzere rifampisin ile bir çok ortak özellikleri olan bir semisentetik rifamisin spiropiperidil türevidir. Rifabutin ayrıca rifampisine dirençli bazı M.tuberculosis suşlarına da etkilidir. Bugüne kadar, rifabutinin en yararlı olduğu durumlar yaygın MAC enfeksiyonunun proflaksisi ve ilaca dirençli tuberküloz tedavisidir.