T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ÜROLOJİ ANABİLİM DALI
ROBOT YARDIMLI LAPAROSKOPİK RADİKAL PROSTATEKTOMİ SONRASI ÜRİNER KONTİNANS VE EREKTİL FONKSİYONA ETKİ
EDEN FAKTÖRLER UZMANLIK TEZİ Dr. FUAD İSMAYİLOV TEZ DANIŞMANI PROF.DR.ERDAL APAYDIN İZMİR 2017
II
ÖNSÖZ
Uzmanlık eğitimim süresince eğitimime olan katkılarından dolayı anabilim dalı başkanımız sayın Prof. Dr. Bülent Semerci'ye, Tez konusu seçimimde ve tezimin tüm aşamalarında yardımlarını esirgemeyen tez danışmanım sayın Prof.Dr.Erdal Apaydın ve Uzm.Dr.Fuat Kızılay‘a, Bilgi ve deneyimlerini benimle paylaşmaktan mutluluk duyan değerli ve saygıdeğer hocalarım Sayın Prof. Dr. İbrahim Cüreklibatır, Sayın Prof. Dr. Oktay Nazlı, Sayın Prof. Dr. Ceyhun Özyurt, Sayın Prof. Dr. Erdal Apaydın, Sayın Prof. Dr. Çağ Çal, Sayın Prof. Dr. Barış Altay, Sayın Prof.Dr.Burak Turna ve Sayın Doç. Dr. Adnan Şimşir'e teşekkürlerimi ve saygılarımı sunarım. Asistanlığım boyunca sevinç ve kederlerimizi birlikte yaşadığımız, bana hep destek olan tüm asistan arkadaşlarıma, özellikle de Dr.Kasım Emre Ergün ve Dr.Tuncer Bahçeci‘ye sonsuz teşekkürlerimi sunarım.
Dr.Fuad İSMAYİLOV
III
ÖZET
Giriş ve amaç: Robot yardımlı radikal prostatektomi (RYRP), dünya çapında robotik sistemlerin uygulanmasından sonra hızla gelişen cerrahi tekniklerden birisidir. Ameliyat sahasında daha iyi görüntü imkanı, daha keskin apikal diseksiyon sağlaması, uzun bir üretral uzunluğun muhafaza edilmesi, sinir koruma sağlama imkanı, insizyonel morbiditenin az olması, kan trasfüzyon ihtiyacının az olması ve erken iyileşme, robotik tekniği radikal prostatektomi için oldukça uygulanabilir bir yöntem haline getirmiştir. Çalışmamızda kliniğimizde lokalize prostat kanseri nedeniyle RYRP operasyonu yapılan hastalarda ameliyat sonrası üriner kontinans ve erektil fonksiyonlara etki eden faktörleri değerlendirmeyi amaçladık.
Gereç ve Yöntem: Çalışmamıza Mart 2012 ile Ocak 2017 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Üroloji Anabilim Dalında evre 1 prostat kanseri tanısı alan ve RYRP yapılan 439 hasta dahil edildi. Hastaların yaş, operasyon öncesi PSA (prostat-spesifik antijen), prostat ağırlıkları, prostat adenokarsinomu gleason skoru, ameliyat süresi, transperitoneal posterior ve anterior cerrahi yaklaşımı, cerrahi sınır ve ekstraprostatik yayılım durumu kaydedildi. Poliklinik takipleri ve telefonla görüşme yolu ile hastaların operasyon sonrası takipte kontinans ve erektil fonksiyon durumları sorgulandı ve kaydedildi. Verilerin istatiksel analizi SPSS 17.0 programı ile gerçekleştirildi.
Bulgular: Kontinans ile ilgili gruplar arasında yaş, preoperatif PSA, prostat hacmi, ameliyat süresi, postoperatif gleason skoru, cerrahi sınır ve ekstraprostatik yayılım durumu, anterior ve posterior yaklaşım açısından istatistiksel olarak anlamlı fark saptanmadı (p>0.05).
Erektil fonksiyon ile ilgili gruplar arasında prostat hacmi, ameliyat süresi, postoperatif gleason skoru, cerrahi sınır ve ekstraprostatik yayılım durumu açısından istatistiksel olarak anlamlı fark saptanmazken (p>0.05) ,yaş (p<0.001) , preoperatif PSA (p=0.042) ve cerrahi teknik (p<0.001) açısından karşılaştırılmasında istatistiksel olarak anlamlı fark saptandı.
Sonuç: Çalışmamızda prostat kanseri nedeniyle RYRP uygulanan hastalarda ameliyat sonrası üriner kontinansa hasta ve hastalıkla ilgili faktörlerin anlamlı etkisi
IV
bulunmadığını, erektil fonksiyonlara ise hasta yaşı, preoperatif PSA değeri, ameliyat tekniğininin anlamlı olarak etki ettiğini saptadık.
Anahtar kelimeler: robot yardımlı radikal prostatektomi; inkontinas; erektil disfonksiyon.
V
ABSTRACT
Background and aim: Robotic assisted radical prostatectomy (RARP) is one of the rapidly developing surgical techniques after the application of robotic systems worldwide. Better visualization of the surgery field, a sharper apical dissection, preserving a longer urethral length, the possibility of providing nerve protection, the lack of incisional morbidity, the less need for blood transfusion, and early healing have made the robotic approach an applicable method for radical prostatectomy. We aimed to evaluate the factors affecting postoperative urinary continence and erectile function in patients underwent RARP due to localized prostate cancer in our clinic.
Materials and Methods: The study included 439 patients who underwent robotic assisted laparoscopic radical prostatectomy for stage I prostate cancer diagnosis at Ege University Faculty of Medicine Urology Department between March 2012 and January 2017. Patients' age, preoperative PSA value, prostate weights, postoperative tumor gleason score, operation time, transperitoneal posterior and anterior surgical approach, surgical margin and extraprostatic dissemination status were recorded. Continence and erectile function status of the patients were recorded during follow-up after the outpatient clinic and telephone interview. Statistical analysis of the data was performed with the SPSS 17.0 program.
Results: There was no statistically significant difference for continence rates according to age, preoperative PSA, prostate volume, operation time, postoperative gleason score, surgical margin and extraprostatic extension status according to anterior and posterior approach (p> 0.05).
On the other hand there was no statistically significant difference for erectile function among the patients in terms of prostate volume, operation time, postoperative gleason score, surgical margin and extraprostatic extension (p>0.05), while there was a statistically significant difference in terms of age (p<0.001), preoperative PSA (p=0.042) according to surgical approach technique.
Conclusion: In our study, we found that postoperative urinary continence was not affected by the patient and disease-related factors while erectile function was
VI
affected by patient age, preoperative PSA value and operation technique in patients who underwent RARP due to prostate cancer.
Key words: robot assisted radical prostatectomy; incontinence; erectile dysfunction.
VII
İÇİNDEKİLER
ÖNSÖZ ... II ÖZET ... III ABSTRACT ... V TABLO, ŞEKİL VE RESİM DİZİNİ ... X
1.GENEL BİLGİLER ... 1
1.1. Prostat Embriyolojisi, Histolojisi, Anatomisi ve Fizyolojisi ... 1
1.1.1. Embriyoloji ... 1 1.1.2. Histoloji ... 1 1.1.3. Prostat Anatomisi ... 2 1.1.4. Fizyoloji ... 4 1.2. Prostat kanseri ... 5 1.2.1. Epidemiyoloji ... 5
1.2.2. Risk Faktörleri ve Etiyoloji ... 6
1.2.2.1. Yaş ... 6
1.2.2.2. Irk ve Etnik Köken... 7
1.2.2.3. Genetik ve Ailesel yatkınlık ... 7
1.2.2.4. İnflamasyon, İnfeksiyon ve Cinsel Yolla Bulașan Hastalıklar .. 8
1.2.2.5. İdrar Reflüsü, Kimyasal ve Fiziksel Travma ... 8
1.2.2.6. Diyet ... 9 1.2.2.7. Yağlar ve Kolesterol ... 9 1.2.2.8. D Vitamini ve Kalsiyum ... 9 1.2.2.9. Alkollü İçecekler ... 10 1.2.2.10. Obezite ... 10 1.2.2.11. Soya ... 10 1.2.2.12. Domates ve Ürünleri ... 10 1.2.2.13. Yeșil Çay ... 10
VIII 1.2.2.14. Beslenme Biçimi ... 11 1.2.2.15. Tütün ... 11 1.2.2.16. Vazektomi ... 11 1.2.2.17. Otoimmünite ... 11 1.2.2.18. Hormonlar ... 11 1.2.3. Patoloji ... 12
1.2.3.1. Atipik Asiner Proliferasyon (ASAP) ... 12
1.2.3.2. Prostatik İntraepitelyal Neoplazi (PIN) ... 12
1.2.3.3. Prostat Karsinomları ... 13
1.2.4. Klinik Semptomlar... 17
1.2.5. Tanı ... 17
1.2.5.1. Parmakla Rektal Muayene (PRM) ... 17
1.2.5.2. Prostat Spesifik Antijen (PSA) ... 18
1.2.5.3. Prostat Spesifik Membran Antijen ... 22
1.2.5.4. TRUS Eşliğinde Prostat Biyopsisi ... 22
1.2.6. Evreleme ... 23
1.2.6.1. T Evresi ... 25
1.2.6.2. N Evresi ... 26
1.2.7. Prostat Kanserinin Tedavisi ... 28
1.2.7.1. Lokalize Prostat Kanserinde Tedavi Seçenekleri ... 28
2. GEREÇ VE YÖNTEM ... 37
2.1. Robot Yardımlı Laparoskopik Radikal Prostatektomi Prosedürü ... 38
2.1.1. Ameliyat öncesi hazırlık ve Hasta Pozisyonu ... 38
2.1.2. Port Yerleştirme ... 38
2.2. Transperitoneal Anterior Yaklaşım ... 39
2.2.1. Prostatın Ekspozürü ... 39
IX
2.2.3. Mesane Boynu Diseksiyonu ... 40
2.2.4. Seminal Vezikül Diseksiyonu ... 41
2.2.5. Posterior Planın Geliştirilmesi ... 42
2.2.6. Nörovasküler Demetin Korunması ... 43
2.2.7. Pedikül Kontrolü ... 44
2.2.8. Üretranın Kesilmesi ... 44
2.2.9. Vezikoüretral Anastamoz ... 45
2.2.10. Robotun Çıkartılması ve Yara Kapanması ... 46
3. BULGULAR... 47
4. TARTIŞMA ... 52
5. SONUÇ ... 57
X
TABLO, ŞEKİL VE RESİM DİZİNİ
Tablo 1. Prostat Adenokarsinomlarının Klinik TNM Evrelemesi Tablo 2. Postoperatif İnkontinans ve Erektil Disfonksiyon Sıklığı
Tablo 3. Hastaların yaş, PSA, prostat ağırılığı, operasyon süresi ve klinik Gleason skoru açısından karşılaştırılması
Tablo 4. Cerrahi Prosedürün, Cerrahi Sınırın ve Ekstraprostatik Yayılımın İnkontinansa Etkisi
Tablo 5. Hastaların yaş, PSA, prostat ağırılığı, ameliyat süresi ve klinik Gleason skoru açısından karşılaştırılması
Tablo 6. Cerrahi Prosedürün, Cerrahi Sınırın ve Ekstraprostatik Yayılımın Erektil Disfonsiyona Etkisi
Şekil 1. Prostat Bezinin Bölgeleri
Şekil 2. Prostat Kanseri Patolojik Gleason Paterni Resim 1. Da Vinci Robotik Sistemi
Resim 2. Robot yardımlı radikal prostatektomide portların yerleşimi Resim 3. Retzius boşluğunun ortaya konulup prostatın ortaya çıkarılması Resim 4. Derin ven pleksusunun bağlanması
Resim 5. Mesane boynunun disseksiyonu ve kesilmesi
Resim 6. Duktus deferens ve seminal veziküllerin diseksiyonu Resim 7. Nörovasküler demetin diseksiyonu
Resim 8. Üretranın kesilmesi
1
1. GENEL BİLGİLER
1.1 Prostat Embriyolojisi, Histolojisi, Anatomisi ve Fizyolojisi
1.1.1 Embriyoloji
Prostat ilk kez gelişimin 12. haftasında görülür. Dihidrotestosteron (DHT) etkisi ile urogenital sinustan gelişir. Mezonefrik kanal girişinin alt ve üst kısmındaki üretral epitel tomurcuklarından gelişir. Bu tomurcuklar 11. haftanın sonunda beş ayrı grup halinde gelişir ve 16. haftada gelişim tamamlanır. Sonra tomurcuklar dallandıktan sonra ürogenital sinüs etrafında farklılaşmış olan mezenkimal hücreler ile birleşirler ve sonrasında prostatik kapsülü oluştururlar. Tomurcuklar, verumontanumun her iki kenarında ürogenital sinüsün arka tarafında iki yoldan şekillenir ve bunlar sonradan prostatı şekillendirmek üzere mezenşime hareket ederler. Alt tomurcuklar endodermal orijinli prostatın dış zonunu şekillendirir. Üst iki tomurcuk prostatın iç zonunu oluşturur. Üretra bu iki zon üretra etrafında konsantrik daireler şeklinde gelişir. Bu zonun dış tarafı boyunca uzun, dallanmış kanallar gerçek prostat bezinin kalın dış tabakasını oluşturur. Merkez kısım ise küçük prostatik utrikulu oluşturan küçük müllerian kanal kalıntıları gibi mukozal-submukozal bez ve ejakülatuvar kanalları içerir. Fetal gelişimin 14. haftasında yaklaşık %70 oranında duktal yapılardan oluşan prostat, mezonefrik ve paramezonefrik mezenşimden doğan stromal komponentler ile çevrelenmiştir. Gelişimin 5. ayında geniş bir skuamöz metaplazi başlar, 36. haftada en üst düzeye ulaşır ve sonra durmaya başlar. Doğumdan sonra skuamöz metaplazideki azalma ve oluşan sekresyonlar yaşamın 3. ayında fetal prostat boyutunda azalma ile sonuçlanır. 1.1.2 Histoloji
Prostat bezi sayıları 15 ile 30 arasında değişen boşaltıcı duktuslar aracılığı ile prostatik üretraya drene olan 30-50 kadar bileşik tübüloalveolar bezlerin bir araya gelmesi ile oluşur. Bezler 3 konsantrik tabaka şeklinde düzlenmiştir. Mukozal, submukozal ve periferal bezler. Mukozal bezler direkt üretraya drene olurken submukozal ve periferal bezler prostatik sinüslara drene olurlar. Santral, periferal, transizyonel ve periüretral zonlardan oluşur.
2
Bütün bez, biraz düz kas lifleri içeren fibroelastik kapsül ile çevrelidir. Kapsül içinde yoğun bir ven ağı bulunur. Stroma periferde kapsül ile devam eder. Fibroelastik stroma içerisinde düz kas lifleri de bulunur. Bu lifler ejekülasyon sırasında kasılarak salgının dışarı akmasını sağlar. Salgı alveolları ve tübülleri oldukça düzensiz olup, büyüklük ve şekil bakımından da oldukça farklılık gösterir. Alveoller geniş lümene sahiptir. Sitoplazmada çok miktarda salgı granülleri, lizozomlar, lipid damlacıkları görülür.
Prostat salgısı ince kıvamlı süt benzeri bir sıvı olup hafifçe asidiktir. Özellikle fibrinolizin olmak üzrere proteolitik enzimlerden zengindir. Fibrinolizin semenin pıhtılaşmasına engel olur. Fazla miktarda prostatik asit fosfataz (PAF) içerir. Prostat kanserinde (PK) bu enzim artar. Ayrıca sitrik asit ve PSA da salgılar. PK‘de PSA artar. Salgı içerisinde sıklılkla sferikal veya ovoid şekilli sert prostatik cisimcikler görülür. Yoğunlaşmış salgılar olan bu cisimcikler kalsifiye olabilirler ve prostat taşları (corpora amylacea) olarak bilinirler.
1.1.3 Prostat Anatomisi
Prostat bezi ovoid şekilli olup, ağırlığı 18-20 gr, boyutları 3x3x2cm‘dir. Anterior, posterior ve lateral yüzeylere sahiptir. Altta dar apeks, üstte geniş tabanı mevcuttur. Kollojen, elastin, yoğun düz kas yapısından oluşan kapsül ile çevrilidir. Düz kasın mikroskobik bantları kapsülün posterior yüzeyinden Denonvilliers fasyası ile birleşmek üzere uzanırlar. Gevşek areolar doku Denonvilliers fasyası ile rektum arasında ince bir plan oluşturur. Prostat bezinin anterior ve anterolateral yüzeyinde kapsül endopelvik fasyanın visseral uzantısı ile karışır. Apekse doğru puboprastatik ligamanlar prostatı pubik kemiğe asmak üzere anteriora doğru uzanırlar.
Lateralde prostat, levotar ani‘nin pubokoksik kısımı ile komşudur. Pariyetal ve visseral endopelvik fasyanın birleştiği yerin altında pelvik fasya ve prostat kapsülü birbirinden ayrılır, arada oluşan boşluğu yağlı areolar doku ve dorsal ven kompleksinin lateral bölümü doldurur. Kavernozal sinirler lateral prostatik fasya içinde posterolateralde seyrederler. Prostat apeksi çizgili üretral sfinkter ile devam eder. Üretra prostat uzunluğu boyunca seyreder ve anterior yüzünde prostata en yakındır. Transizyonel epitel ile döşelidir. Prostatın tüm büyük glandüler elementleri prostatik üretraya verumontanumun üzerinden açılır.
3
Prostat bezi transizyonel, santral ve periferik zona ayrılmıştır (Şekil 1).Preprostatik ve prostatik üretrayı biribirinden ayıran açıdan transizyonel zonun kanalları ortaya çıkar ve preprostatik sfinkterin altından geçerek sfinkterin lateral ve posterior yüzeylerinde seyreder. Transizyonel zon prostatın %5-10‘unu olşturur.
Santral zonun kanalları ejekülatuar kanalların açılma bölgesinin çevresinden çepeçevre olarak ortaya çıkar. Santral zon prostatın %25‘ini oluşturur. Bu zon Wolf kanallarından kaynaklanmıştır.
Periferal zon , prostat bezinin %70‘ni oluşturur ve bezin posterior ve lateral bölümlerini sarar.
Prostat bezinin yaklaşık 1/3‘ü nonglandüler anterior fibromüsküler stromaya bağlıdır. Bu bölge normalde mesane boynundan çizgili sfinktere kadar uzanır. Prostat santral bir sulkus ile ayrılmış iki lateral lobdan ve orta lobdan oluşmaktadır.
Şekil 1. Prostat Bezinin Bölgeleri. A) Prostat bezi geçiş zonu, B) Merkezi zon, C) Periferal zon ve D) Anterior fibromüsküler stroma
Prostatın arteriyel dolaşımı inferior vezikal arterden köken alır. Beze yaklaşıldıkça bu arter iki ana dala ayrılır. İlk ana dal olan üretral arterler, prostatovezikal bileşkeyi posterolateralden penetre eder ve üretraya dik olarak içe doğru seyrederler. Mesane boynuna saat 1 ile 5 pozisyonunda ve 7 ile 11 pozisyonunda yaklaşırlar ve en büyük dallar posteriorda lokalizedir. Sonra üretrayı,
4
periüretral bezleri ve transizyonel zonu beslemek için üretraya paralel olarak kaudale dönerler. Bu nedenle bu arterler benign prostatik hiperplazide adenomun temel arterleridir. Bu bezler rezeke veya enüklüe edildiğinde mesane boynunda,özellikle saat 4 ve 8 hizasında ciddi kanamalar ortaya çıkabilir.
Kapsüler arter prostatik arterin ikinci ana dalıdır.Bu arter prostatik kapsülün üzerinde de dallara ayrılır.Bu arterin büyük bir kısmı kavernöz sinirlerle beraber prostatın posterolateralinde seyreder ve pelvik diyaframda sonlanır. Kapsüler arterin dalları prostatı dik olarak delerler. Prostatın venöz drenajı periprostatik pleksusta çok yoğundur.
Lenfatik drenaj primer olarak obturator ve internal ilak nodlardır.
Pelvik pleksustan gelen sempatik ve parasempatik inervasyon prostata kavernöz sinirler aracılığıyla ulaşır. Sinirler kapsüler arterin dallarını takip ederek glandüler ve stromal elemanlara dal verir. Parasempatik sinirler asinuslarda sonlanırlar ve sekresyonu başlatırlar. Sempatik sinirler ise kapsülün ve stromanın düz kaslarının kontraksiyonuna neden olurlar.
1.1.4 Fizyoloji
Semen sıvısının %30‘u prostat sıvısından oluşmaktadır. Prostatik sıvının içinde sitrat, çinko, kalsiyum, kolesterol, spermin, asit fosfataz ve başka bazı proteazlar vardır. Prostatik kas dokusu sempatik sinirlerin kontrolündedir ve bunların uyarılması seminal sıvının üretra içine ejekülasyonu sırasında mesane boynunun kapatılmasını sağlarlar. Ejakulasyon sonrası ilk 5 dk içinde semen semisolid jel kıvamını alır, sonraki 5-20 dk da da viskoz sıvı kıvamına gelir. Prostattan salgılanan PSA‘nın da semendeki bu değişime katkısı vardır. Prostatik sıvının pH‘ı: 7.5dir (Alkali). Semene süt görünümünü verir. Salgıladığı enzimlerle semen sıvısını önce pıhtılaştırır, daha sonra ise pıhtılaşmanın erimesini sağlar (likefasiyon). Prostat salgısının fertilizasyonda çok büyük önemi vardır. Kadın vajinası asidiktir. Spermlerin bu asidik ortamda tahrip olmasını, ortamı alkali hale getirerek önler. Semeni önce pıhtılaştırarak, koitus sonrasında kadın üreme sisteminde tutunmasını sağlar. Ancak bu esnada spermlerin hareketi kısıtlıdır. Daha sonra ise pıhtılaşmanın erimesini sağlayarak spermlere hareketlilik kazandırır. Çinko, bakteriostatik işlev
5
görür. Prostat epitelyumundan salgılanan PSA Tripsin hem de kimotripsin benzeri enzimatik etkisi vardır (1,2).
1.2 Prostat kanseri
1.2.1 Epidemiyoloji
Dünya genelinde, prostat kanseri her iki cins birarada ele alındığında dördüncü, sadece erkekler ele alındığında ise ikinci en yaygın kanser türüdür (3). International Agency for Research on Cancer / Dünya Sağlık Örgütü, GLOBOCAN verilerine göre, 2012 yılında dünyada 1.1 milyon kişiye (erkeklerde konulan kanser tanılarının %15‘i) prostat kanseri tanısının konulduğu hesaplanmıştır (3). İnsidans, ülkeler hatta bölgeler arasında önemli farklılıklar göstermekle birlikte, olguların %70‘ini gelişmiş bölgeler oluşturur (3). İnsidans hızı sırasıyla, Avustralya/Yeni Zellanda, Kuzey Amerika, Batı ve Kuzey Avrupa‘da yüksektir (3). Bu sonuç, gelişmiş bölgelerdeki, PSA incelemeleri ve prostat biyopsilerinin yaygın kullanımından kaynaklanmaktadır (4). Tanıya yönelik testlerin yoğun olarak kullanıldığı ülkelerde insidansın doğal olarak yükselmesine en iyi örnek ABD‘dir. ABD prostat kanserinin erken tanısına yönelik programların en yoğun kullanıldığı ülkelerden biridir ve dolayısı ile en yüksek insidans rakamlarına sahip ülkedir (4).
İnsidans daha az gelişmiş Karayipler, Güney Afrika ve Güney Amerika‘da da göreceli olarak yüksek bulunmuştur. Buna karşılık Asya‘da, özellikle doğu ve orta-güney Asya‘da, düşük bulunmuştur (3).
2012 yılında prostat kanserinden dünyada 307.000 ölüm gerçekleştiği hesaplanmıştır (3). Bu değer, erkeklerde tüm mortalitenin %6‘sına karşılık gelmektedir (3). PSA testinin etkisi daha az olduğu için, mortalite oranları arasındaki farklılık bölgeler ve ülkeler arasında insidansa göre daha az değişkenlik göstermektedir. Gelişmiş ülkelere göre, az gelişmiş ülkelerde daha yüksek mortalite hızı gözlenmektedir. Gelişmiş ülkelerdeki daha düşük mortalite, çoğunlukla agresif tanı ve tedavi yöntemlerinin yaygın kullanımına bağlanmaktadır (4). Siyahların yaygın olduğu toplumlarda, Karayipler ve alt Sahra Afrika‘sında yüksek; Amerika ve Okyanusya‘da orta, Asya‘da özellikle güney-orta Asya‘da çok düşük mortalite hızları hesaplanmıştır (3).
6
Prostat kanseri prevalansı geçmişten günümüze çoğunlukla prostatektomi, radikal sistektomi ve otopsi çalışmalarından elde edilen verilerle saptanmıştır (4). Sistoprostatektomi örneklerinde %25-40 oranında prostat kanseri odaklarına rastlanmıştır (5-7). Ayrıca, prostat kanser önleme denemeleri (Prostate Cancer Prevention Trial, PCPT) toplumlarda prostat kanserinin yüksek prevalansına işaret etmektedir. Bu denemeler sonunda normal rektal muayene bulguları ve normal PSA düzeyleri olan olguların %15‘inde kanser saptanmıştır (8).
Türkiye Cumhuriyeti Sağlık Bakanlığı Sağlık İstatistikleri, 2013 yıllığında verilen Türkiye Halk Sağlığı Kurumu verilerine göre, 2009 yılında ülkemizde prostat kanseri insidansı 36.1/100000‘dir (9). Bu oran erkeklerde görülen tüm kanserlerin %11.8‘ini oluşturmaktadır (9). Geçmiş yılların verileri incelendiğinde insidans 2009 yılı hariç giderek artış göstermiştir. İnsidans (100.000‘de, Dünya Standart Nüfusu) sırası ile 2002‘de 11.5, 2003‘de 14, 2004‘de 24.9, 2005‘de 28.6, 2006‘da 28.9, 2007‘de 32.3 ve 2008‘de 37.6 olarak hesaplanmıştır (9).
Üroonkoloji Derneği önderliğinde, Haziran 2008 - Haziran 2009 aralığında yapılan ilk ulusal, çok merkezli, prospektif epidemiyolojik çalışma, prostat kanserinin ülkemizdeki gerçek durumunu ortaya koymuştur (10). Çalışma sonuçlarına göre prostat kanserinin ülkemizde tüm yaş gruplarını içeren, yaşa göre düzenlenmiş insidans hızı 35/100.000‘dir. Bölgeler arasında en yüksek insidans hızı İstanbul‘da (43.7/100.000) ve en düşük Edirne‘de (17.7/100.000) saptanmıştır. Tanı sırasında ortanca yaş 68, ortalama PSA düzeyi 10ng/mL‘dir. Hastaların %54.4‘ü T1c evresindedir ve çoğunluğunda ürolojik yakınmalar saptanmıştır. Tanı yöntemi %87.8 olguda transrektal ultrason eşliğinde biyopsi ile konulmuştur. Olguların %4‘ünde aile öyküsü gözlemlenmiştir (10). Bu çalışmadaki veriler, GLOBOCAN harita ve hesaplamaları göz önüne alınarak, ülkemizin dünyada orta-yüksek prostat kanseri insidansına sahip ülkeler arasında yer aldığını söyleyebiliriz.
1.2.2 Risk Faktörleri ve Etiyoloji 1.2.2.1 Yaş
Prostat kanseri yaşlanma ile ilgili bir hastalıktır. Elli yaşın altında tanı nadirdir. Otopsi verilerine dayanarak, yaşlanma ve prostat kanseri arasında bağlatıya dikkat çeken Franks‘ın 1954 yılındaki klasik çalışması, 6. ve 7. dekatta olguların 1/3‘ünde, 8. dekatta hemen hemen yarısında, 9. dekatta 2/3‘ünde ve 10. dekatta ise
7
neredeyse tüm olgularda latent olarak tanımladığı prostat kanseri odaklarından bahseder (11). Bu, günümüzde halen geçerliliğini koruyan bir varsayımdır ve daha sonraki çalışmalarda da benzer oranlar saptanmıştır. Nadiren 50-55 yaş altında tanı konulan prostat kanserleri ise başka bir boyutta ele alınmalıdır. Çoğunlukla 50 yaş altında PSA testi yapılmadığı için, bu olgular semptomatik olgulardır veya insidental olarak PSA testi ve/veya rektal muayene ile biyopsiye yönlendirilirler. Bir bölümü ise aile öyküsü nedeniyle test yapılan olgulardır. Batı literatüründe ―erken başlangıçlı-early onset‖ ve ―genç-young age‖ prostat kanseri tabirleri iki farklı grubu tanımlama eğilimindedir. Genç prostat kanserli olgular, ileri yaşta görülen kanserlere göre farklı biyolojik ve genetik özelliklere sahiptir. Çoğunluğunda düşük dereceli ve evreli kanserler olup, sağkalımları erken başlangıçlı kanserlerden daha iyidir. Erken başlangıçlı prostat kanserleri ise, genç yaşta görülen kanserlerin bir alt grubu olup aileseldir. Ayrıca, hastalık daha agresif seyreder ve kansere özgü sağ kalım daha düşüktür (12).
1.2.2.2 Irk ve Etnik Köken
Prostat kanseri Afrika kökenli Amerikalılarda en yüksek, yerli Asyalılarda ise en düşük insidansa sahiptir. Irk kimliği, bireyin prostat kanseri riskinin güçlü bir belirleyicisi olup, batılı ülkelere göçle beraber bu risk artar (13). En düşük oranlar ise Amerikan ve Alaska yerlilerinde görülmektedir. Mortalitede kökene göre farklılıklar göstermektedir. En yüksek oran yine siyahlardadır. Bu grubu sırasıyla, beyazlar, İspanyol orijinliler, Amerikan ve Alaska yerlileri ile Asyalılar ve Pasifik adaları kökenliler izlemektedir. Asya dünya üzerinde en düşük insidansa sahip ülkeleri barındırır ancak son yıllarda bir artış eğilimine girdiği görülmektedir. Akdeniz bölgesinde de göreceli olarak düşük insidans bildirilmiştir.
Irk ve etnik kökene göre görülen bu farklılıkların nedeni tam anlaşılamamakla birlikte, genetik temelli olduğu düşünülmektedir. Aynı ırktan ama değişik coğrafik bölgelerde yaşayan gruplar arasındaki farklılıklarda, genetik yatkınlıktaki değişkenlikler ve çevresel etkenlerin rolü olduğu bilinmektedir (14).
1.2.2.3 Genetik ve Ailesel yatkınlık
Herediter prostat kanseri, tüm olguların %10‘nundan daha azını oluşturmaktadır. Birinci derece akrabalarında prostat kanseri görülen bireylerdeki yaşam boyu risk 2-3 kat, yine birinci derece akrabalarında iki ve daha fazla birey
8
etkilenmiş ise bu risk 5-11 kat artış göstermektedir. Herediter formda olan prostat kanseri sporadik forma göre yaklaşık 6-7 yıl daha erken ortaya çıkmaktadır. Otozomal dominant, otozomal resesif ve X‘e bağlı olmak üzere üç tip kalıtım paterni gözlemlenmiş, bu da bize birden fazla genin prostat kanserinin kalıtımında katkısı olduğunu göstermiştir. Prostat kanseri risk genlerinin arasında en kritik olan 8q24 bölgesidir. Aile temelli linkaj (bağlantı) analizine ve genom boyu ilişkilendirme [genome-wide association studies (GWAS)] çalışmalarınadayanarak; RNASEL (HPC1), PCAP, HPCX, CAPB, HPC20, MSR1, ELAC2, HSD3B, NBS1, CHEK2 gibi birçok prostat kanseri yatkınlık genleri tespit edilmiştir (15-17).
1.2.2.4 İnflamasyon, İnfeksiyon ve Cinsel Yolla Bulașan Hastalıklar
İnfeksiyöz ajanlar, idrar reflüsü, spermatozoalar, kimyasal ve fiziksel travmalar, beslenme yoluyla gelen karsinojenler, östrojenler ve prostat antijenlerine karşı immün yanıt oluşması enflamasyona yol açabilir (18). Prostatta akut veya kronik enflamasyon alanlarının çoğunluğuna eşlik eden atrofik epitel ve/veya fokal epitelyal atrofi alanları gözlenir (19). Fokal epitelyal atrofi alanları yaşlanan prostatta da yaygındır ve periferik zonun önemli bir bölümünü sarar (20,21). Fokal atrofi lezyonlarında normal epiteldekinden farklı olarak proliferasyonda olan epitel hücrelerinin oranı fazladır (19). Bu alanlar için Proliferatif İnflamatuvar Atrofi (PIA) tanımı kullanılmaktadır (19). Morfolojik çalışmalarda atrofik epitelle adenokarsinom arasında geçiş alanları gözlenmiştir (22,23). Bu geçiş alanları yüksek dereceli prostatik intraepitelyal neoplazide (PIN) daha sıktır (19).
Cinsel yolla bulaşan hastalıklar, prostat kanserinde olası risk faktörlerindendir (24). Bu yıllardan itibaren yapılan çalışmalarda, human papillomavirüs, sitomegalovirüs, herpes simpleks virüs, Epstein-Barr virüs, human herpes virüs, BK virüs, JC virüs, klamidya, mikooplazma, üreaplazma, trichomonas, neisseria, treponema, Propionibakterium acnes, xenotropic murine leukemia virus-ilişkili virüs ve Kandida albikans gibi ajanların yol açtığı infeksiyonlar ile prostat kanseri arasındaki ilişki olabileceğinden kuşkulanılmıştır (25).
1.2.2.5 İdrar Reflüsü, Kimyasal ve Fiziksel Travma
İdrar içindeki kimyasallara bağlı iritasyonun, kronik inflamasyon sürecinin başlamasını tetikleyebileceği öne sürülmüştür. Reflü sonucu idrar içindeki çeşitli kimyasallardan özellikle ürik asidin enflamasyonu tetikleyici olduğu ileri
9
sürülmüştür (18). Korpora amilasealar, prostat taşlarının kronik enflamasyon ve inatçı infeksiyon yoluyla kanser oluşumunda rol oynayabileceği belirlenmiştir. Sık ejakülasyonların korpora amilasea oluşumunu azaltarak fayda sağlayabileceği düşünülmektedir (18). Ejakülasyon sıklığının prostat kanserinden koruyucu bir etkisinin olduğu yönünde veriler mevcuttur (26-28). Ayrıca spermatozoaların retrograd olarak prostata ulaşmasının, enflasyon ve PIA lezyonları ile birlikteliği gözlenmiştir (18).
1.2.2.6 Diyet
Epidemiyolojik çalışmalar, kırmızı et, hayvansal yağlar ile prostat kanseri insidans ve mortalitesi arasında bir ilişki çağrıştırmıştır. Bu gıdalar pişirilirken, ısı etkisiyle oluşan heterosiklik aminlerin rolü üzerinde durulmaktadır.
1.2.2.7 Yağlar ve Kolesterol
Japonlar geleneksel olarak az yağ içeren bir diyete sahiptir ve Japonya‘da prostat kanseri insidansının düşük olduğu iyi bilinir. Batıda yaygın olan hayvansal yağlardan zengin bir beslenme tarzına geçiş yapan Japonlarda prostat kanseri insidansında artış gözlenmiştir (29).
1.2.2.8 D Vitamini ve Kalsiyum
D vitamini ve prostat kanseri arasında bir ilişki olabileceği kuşkusu aşağıda sıralanan gözlemlere dayandırılmıştır (26):
– Güneşin az olduğu kuzey ülkelerinde insidans yüksektir,
– Hastalık D vitamini eksikliğinin daha yaygın olduğu yaşlılarda sıktır,
– Amerikada yaşayan Afrikalılarda yüksek insidans ve mortalite gözlenir. Varsayıma göre ciltlerindeki melanin ultraviyoleyi bloke eder ve D vitamini sentezini azaltır,
– Süt ve süt ürünlerinden zengin beslenenlerde prostat kanseri riski daha yüksektir,
– D vitamini kaynağı olan deniz ürünlerinden zengin beslenen Japonlarda prostat kanseri insidansı düşüktür.
10 1.2.2.9 Alkollü İçecekler
Alkol tüketiminin prostat kanseri riskini artırdığı veya kırmızı şaraptaki antioksidan etkinin riski azalttığı yönündeki ilk bilgilerin aksine, son dönemde yayınlanan daha kapsamlı çalışmaların sonuçları, bu hastalığın oluşumunda belirgin rolü olmadığını düşündürmüştür (30-32).
1.2.2.10 Obezite
Obezite prostat kanseri için önemli risk faktörleri arasında sayılmaktadır (33). Obezite agresif tümörler ve tedavi sonrası nüks ile ilişkilidir. Bir çalışma vücut kitle indeksi artışı ile yüksek dereceli kanserin ilişkili olması yanında, metastatik ve fatal kanser riskinin de arttığına dikkati çekmiştir (34). Vücut kitle indeksi (BMI) arttıkça prostat kanseri mortalitesi artmaktadır (35).
1.2.2.11 Soya
Soya ürünlerindeki biyolojik olarak en aktif isoflavonlar genistein, daidzein, equol ve glycetin‘dir. Pre-klinik çalışmalar bu isoflavonların hücre siklusunu ve apoptozu düzenleyen genlere etkili olabileceğini belirlemiştir. Bazı hayvan modellerinde prostat karsinogenezisini inhibe ettiği görülmüştür. Ayrıca anti-oksidan etkileri olduğu, DNA tamirinde rol oynadıkları, östrojen ve androjen sinyal yolaklarında antagonizma gösterdikleri ve anjiogenezi ve metastazları inhibe edebileceklerine dair öngörüler vardır (36).
İsoflavonların prostat kanserinden koruyucu etkilerine dair epidemiyolojik yorumlar ise çoğunlukla bu ürünlerin çok tüketildiği Asya ülkelerinde kanser insidansının düşük olmasına dayanır.
1.2.2.12 Domates ve Ürünleri
Likopen insan plazmasında en yaygın olan karotenoiddir. Güçlü bir oksijen baskılayıcıdır. Yıllardır likopen tüketiminin prostat kanseri riskinin azalttığı öne sürülmektedir.
1.2.2.13 Yeșil Çay
Yeşil çayın sık tüketildiği coğrafyalarda prostat kanseri insidansının düşük olduğu bilinmektedir. Yeşil çay içindeki ‗catechin‘lerin koruyucu etkisi olduğu düşünülmektedir.
11 1.2.2.14 Beslenme Biçimi
Asya ve Akdeniz tipi beslenme prostat kanserinden koruyucu olabilir. Batılı tipi beslenme (yüksek kalorili, hayvansal gıdalar ve yağdan zengin) prostat kanseri açısından risklidir. ‗Healty Eating Index‘ 2010 kriterlerine uygun bir diyetin (özetle sebze, meyve, tam tahıl ürünleri, bakliyat, daha sağlıklı olan bitkisel yağlardan zengin; et ve diğer hayvansal gıdaların yaklaşık 1/4‘ünü oluşturduğu) prostat kanseri riskini azalttığı öne sürülmüştür (37).
1.2.2.15 Tütün
Sigara ve prostat kanseri riski arasındaki ilişkiyi inceleyen çalışmalar çelişkili sonuçlar ortaya koymuştur. İleri evrede tanı ve prostat kanserine bağlı mortaliteyi arttırdığına dair bulgular rapor edilmiştir (38).
1.2.2.16 Vazektomi
Vazektominin prostat kanseri riskini arttırdığı, zaman içerisinde bu riskin daha da arttığı, dolayısı ile erken yaşta vazektomi olanların daha fazla risk taşıdığını öne süren çalışmalara karşın, takip eden çalışmalar bu bulguları desteklememiştir (39-45).
1.2.2.17 Otoimmünite
Puberteye kadar prostat gelişim tamamlanmadığı için, bazı prostat antijenleri için immün tolerans gelişmemiş olabilir. Prostatik yapının bozulması sonucu bu antijenlerin ortaya çıkması, bir otoimmün reaksiyonu tetikleyebilir (18). Kronik prostatitli hastalarda PSA‘ya karşı hücresel immünite reaksiyonu gösterilmiştir (46). 1.2.2.18 Hormonlar
Androjenler prostatın gelişimimi, maturasyonu ve işlevlerinin sürdürülmesi için gereklidir. Prostat içerisinde primer etkin androjen dihidrotestosteron (DHT)‘dur. Dihidrotestosteron, prostat içerisinde 5α-redüktaz tarafından, testosteron katalize edilerek oluşturulur. Daha sonra dihidrotestosteron androjen reseptörüne bağlanarak nükleusa geçişi sağlanır. İki ayrı genin ürünü olan, 2 farklı 5α-redüktaz izoenzimi mevcuttur. Tip I daha çok karaciğer ve deride (az miktarda prostatta) bulunurken, tip II ise prostatta yaygın olan formudur. Prostat ve eksternal genital yapının gelişimi için mutlak gerekli olan tip II 5α-redüktaz prostat kanseri için korucuyu olduğu saptanmıştır. Ancak karsinogenez için gerekli androjen etkisinin zamanı, süresi ve düzeyi halen bilinmemektedir (26). Yüksek serum androjen
12
düzeylerinin prostat kanseri sebebi olabileceği öne sürülmüştür. Kanser insidansının yüksek olduğu Afrika kökenli Amerikalılarda, genç yaşlarda serum testosteron düzeyinin beyazlara göre %15 daha yüksek olduğu bulunmuştur (47). Japonlarda ise daha düşük testosteron düzeyleri saptanmıştır (48).
1.2.3 Patoloji
1.2.3.1 Atipik Asiner Proliferasyon (ASAP)
Biyopsilerin %2.5–5‘inde kesin tanı için yeterli sitolojik ve arkitektürel özellikleri taşımayan, ancak adenokarsinom açısından şüpheli küçük bezler saptanır (49). Bu problem çoğu kez odağın küçük olması nedeni ile doğar. İğne biyopsilerinde %0.4 ile %23.4 arasında rapor edilmektedir (50-58), ortalama rakam %5.5‘tür. Karsinom tanısının yapılamadığı, ancak karsinom olasılığının bulundugu anlamına gelir ve terminolojik olarak ―atipik küçük asiner proliferasyon‖a tercih edilmelidir. Nedeni raporda açıklanmalı ve tekrar biyopsisi önerilmelidir.
1.2.3.2 Prostatik İntraepitelyal Neoplazi (PIN)
İlk kez 1960 yılında Mostofi tarafından tanımlanmıştır ve 1986 yılında Mc Neal ve Bostwick tarafından kesin kriterleri belirlenmiştir. PIN, prostat kanserleri için öncül lezyon olarak kabul edilmektedir. Düşük dereceli ve yüksek dereceli olarak ikiye ayrılmıştır. Düşük dereceli PIN'ın belirgin risk oluşturmaması nedeniyle patoloji raporlarında artık belirtilmez iken yüksek dereceli PIN (HG-PIN) kanser öncüsü lezyon olarak kabul edilmektedir(59). HG-PIN, stromal invazyon göstermeyen, bazal hücre tabakası korunmuş benign bezlerde küçük büyütmede hiperkromazi ile dikkati çeken ve daha büyük büyütmede sitolojik atipi ve belirgin çekirdekçik gösteren proliferatif lezyondur. HG-PIN tanısı sonrası prostat kanseri gelişme riski %19-21 olarak bildirmiştir. İğne biyopsisi sonrası HG-PIN bulunması kanserin prostat dokusundaki lokalizasyonunu göstermez ancak tüm prostat dokusunda kanser bulunma riskinin yüksek olduğunu gösterir. HG-PIN saptanan hastaların bir yıl sonra yapılan biyopsilerinde %16-44.6 oranında kanser saptanmaktadır. Özellikle üçten fazla odakta HG-PIN saptanan olgularda riskin yüksek olduğu gösterilmiştir, bu nedenle patoloji raporlarında HG-PIN olup olmadığı ve var ise odak sayısı mutlaka belirtilmelidir(60).
13 1.2.3.3 Prostat Karsinomları
1.2.3.3.1 Adenokarsinom
Prostat kanserlerinin %98‘i adenokarsinomadır (61) .Genellikle beyazdır ve normal prostatdan ayırımı zordur. Halbuki,transizyonel zondan meydana gelenler daha sarı renkli olup, bunların seçilmesi daha kolaydır.
Adenokarsinomların histolojik teşhisi arkitektürüne ve hücre yapısına göre yapılmaktadır. İyi diferansiye adenokarsinomlarda mikroasiner yapılarda proliferasiyon olmakla beraber lümeni döşeyen hücrelerin bazal tabakası yoktur. Belirgin nukleol içerir. Hücrede hiperkromazi-atipi aşikar ise nükleolu görmeden de teşhis konulabilir. Perinöral invazyon da teşhis için iyi bir kriterdir. Sinirlerin yarısının fazlasının etrafında glandüler yapım mevcutsa adenokarsinom teşhisi için yeterlidir.Şüpheli durumlarda ve metastazın primerini göstermek için PSA‘nın immunohistokimyasal boyanması ile kesin teşhis konulabilir.
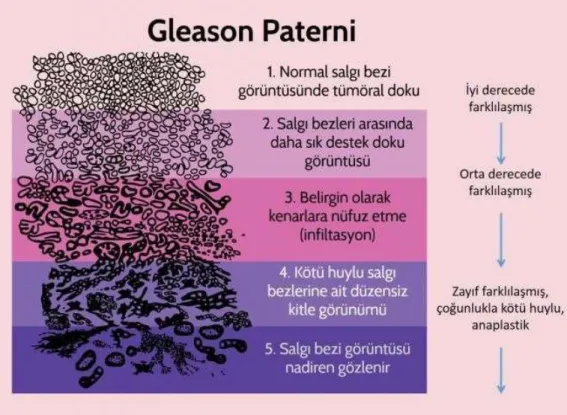
Prostat kanseri heterojen bir yapı gösterdiğinden, aynı tümörde iki veya daha fazla "grade" bir arada bulunur. Gleason gradeleme sistemi, hücrelerdeki değişikliklerden ziyade tümöral glandların yapısal özelliklerini temel alır. Buna göre prostat kanseri 5 "grade" ayrılır.
Gleason Derecelendirme (Grade) Sistemi
Gleason derecelendirme metodu diğerleri derecelendirme sistemleri arasında en yaygın olarak kabul edilen sistemdir. Küçük büyütmede tanınan glandüler patterne dayanır, sitolojik özellikler göz ardı edilir. Patternler 1‘den 5‘e kadar numaralandırılır; 1 en iyi, 5 en kötü diferansiasyon derecesi anlamındadır.
Patern 1: Uniform, yakın düzenlenme gösteren, benign bezlere benzer oval-yuvarlak orta boy bezlerin oluşturduğu iyi sınırlı nodül yapısı.
Patern 2: İyi sınırlı, orta boy neoplazik bezlerin yer yer çevreye uzanım gösterdiği çeşitli şekil ve boyutta bezlere benzer orta boy bezler şeklindedir.
Patern 3: İnfiltratif, çeşitli boyut ve şekillerde bezler, 1 ve 2 paterndeki bezlerden küçük, aynı veya daha büyük bezler arada belirgin stromal alan mevcuttur
Patern 4: İnfiltratif, iç içe geçmiş bezler, kötü sınırlı lümeni belirli olmayan küçük bezler, geniş kriptoform yapılar görülür.
14
Patern 5: Glandüler farklılaşma olmaksızın, kordonlar, tek tek hücreler, ortalarında nekroz olan solid kriptiform yapılar.
—En sık birinci ve ikinci arkitektürel yapılar belirlenir ve bunlara 1‘den 5‘e dek birer derece verilir. Hem birincil hem de ikincil dereceler prognozda anlamlıdır. Bu nedenle her ikisi toplanır ve ―Gleason skor‖u elde edilir. ―Gleason skor‖, ―Gleason toplam‖ ve ―Gleason kombine grade‖ birbiriyle sinonim terimlerdir. Karışıklıkları engellemek için skor ve grade‘lerin ayrı ayrı belirtilerek formül şeklinde yazılması önerilir: Prostatik adenokarsinom, Gleason # + # = # şeklinde yazılır
— Ancak radikal prostatektomilerde ikincil grade %5‘in altında ve birincilden daha düşük değer ise göz ardı edilir. Buna göre bir tümör >%95 oranda Gleason pattern 4 ve <%5 oranda Gleason 3 ise skor 4+4 = 8 olarak belirlenir.
— Tümörde sadece tek bir arkitektürel pattern varsa, birincil ve ikincil patternler aynı kabul edilir ve skor derecenin 2 ile çarpımıyla bulunur.
Dolayısı ile bir tümörün Gleason skoru yapısal özelliğine göre 2‘den 10‘a kadar herhangi bir değer olabilir. Gleason skor 2 (1+1 = 2) tümör, uniform olarak pattern 1 alanlardan oluşur, skor 10 (5+5 = 10) ise tamamen undiferansiye prostat karsinomunu gösterir (Şekil 2).
15
Şekil 2.Prostat Kanseri Patolojik Gleason Paterni
1.2.3.3.2 Musinöz Adenokarsinom.
Bütün prostat kanserlerinin %0.4‘ünü oluşturur. Digerlerinden ayırmak için PSA, CEA, ve PAP boyaları gereklidir. Bu tümörlerin biyolojik davranışı agresiftir, musinoz olmayan prostat kanseri gibi kemik metaztazları yapmaya eğilimlidir. 1.2.3.3.3 Duktal Tip Adenokarsinom
Prostat adenokarsinomlarının %0.4–0.8‘i prostatik duktuslardan gelişir (62-63). Bu tümörler geniş periüretral duktuslardan köken aldıklarında en sık veru montanum ve çevresinde izlenirler. Üretrada lümene doğru ekzofitik lezyon oluşturabilir, obstrüktif semptomlara yol açarlar. Rektal incelemede saptanamayabilirler. Diğer duktal adenokarsinomlar ise prostatın periferinde yerleşir ve asiner tip prostat karsinomuyla bir arada miks formda izlenir. Santralde lokalize olanlara da periferal asiner adenokarsinomlar eşlik edebilir.
Duktal adenokarsinomlar genellikle papiller veya kribriform yapılardan oluşurlar, daha nadiren yüksek psödostratifiye kolumnar hücrelerle döşeli tek tek bezler izlenir. Sitoplazma çoğunlukla amfofilik, zaman zaman şeffaftır. Tümör
16
hücreleri PSA ve PSAP eksprese eder. Çoğu olgu ileri evrede yakalanır ve agresif klinik seyir izler. Davranımı Gleason 4+4 = 8 asiner kansere benzer, bu nedenle Gleason skor 4+4 = 8 şeklinde derecelendirilmelidir (64).
1.2.3.3.4 Skuamöz Karsinom
Prostat karsinomlarının %0.6‘dan azı skuamöz morfolojidedir, adenoskuamöz karsinom daha da nadirdir. Skuamöz karsinomlar periüretral prostat asinuslarından, adenoskuamöz karsinom ise daha ziyade transizyonel zondan köken alır. Üriner obstrüksiyon en sık bulgudur. Konvansiyonel adenokarsinomlardan hormon ve/veya radyoterapi sonrası gelişebilmektedirler. Skuamöz karsinomda saf skuamöz komponent varken adenoskuamöz karsinom skuamöz+glandüler komponentten oluşur. Skuamöz komponent genellike PSA ve PSAP negatif, yüksek molekül ağırlıklı sitokeratin pozitiftir.
Hem skuamöz, hem de adenoskuamöz karsinomda prognoz oldukca kötüdür. Skuamöz tümörler androjen deprivasyon tedavisine dirençlidir, adenoskuamöz tipte olanlarda hormon tedavisine ilk aşamada yanıt alınabilir.
1.2.3.3.5 Küçük Hücreli Karsinom
Kendine özgü histolojik, immünohistokimyasal ve klinik özellikleri vardır, akciğerin küçük hücreli karsinomuna benzer. PSA ve PSAP negatiftir. Özellikleri Gleason pattern 5 prostatik asiner karsinomdan farklıdır, bu nedenle küçük hücreli karsinomlarda Gleason sistemi kullanılmamalıdır.
Prognozu son derece kötüdür. Ortalama yaşam 2 yılın altındadır. Cushing, uygunsuz ADH salınımı gibi paraneoplastik sendromlar ortaya çıkabilmektedir. 1.2.3.3.6 Adenoid Kistik / Bazal Hücreli Karsinom
Prostat bazal hücrelerinden gelişir. Genellikle üriner obstrüksiyon ile gelen yaşlı hastalardır. Periferal palizatlanma gösterebilen bazaloid oval veya yuvarlak hücre yuvalarından meydana gelir. İnfiltratif pattern, ekstraprostatik uzanım, perinöral invazyon, nekroz ve stromal dezmoplazi ile benign bazal hücre hiperplazisinden ayrılır. Nadir, lokal agresif tümörlerdir. Uzak metastaz bildirilmiştir.
17 1.2.3.3.7 Transizyonel Hücreli Kanserler
Prostat kanserlerinin %1-5'ini oluşturur. Prostatın primer transizyonel hücreli kanserinde hemen daima stroma invazyonu görülür. Hastaların çoğu T3 ve T4 evresinde tanı almaktadır. Hastaların %20'sinde uzak metastazlar olup en sık kemik, akciğer ve karaciğere metastaz yapmaktadır. Adenokarsinomun tersine bu tipte kemik metastazları osteolitik yapıdadır.
1.2.3.3.8 Malign Mezenkimal Tümörler
Bütün prostat tümörlerinin %0.1-0.2‘sini oluşturur. Çoğu leimyosarkom veya rabdomyosarkomdur. Rabdomyosarkom prostatın en sık görülen mezenkimal tümürü olup özellikle çocukluk çağında görülür. Leimyosarkom yetişkinlerde prostatın en sık görülen sarkomudur.
1.2.4 Klinik Semptomlar
PSA taramasının sık kullanılmasının bir sonucu olarak hastaların çoğu hastalığa özgü belirtilerin olmadığı erken evrelerde tespit edilmektedir (65,66). Lokalize hastalık da hastalığa özgü belirtiler çoğunlukla yoktur. Belirtilerin olması lokal ileri veya metastatik hastalık varlığını düşündürür. Lokal ileri hastalıkda; tümörün mesane boynu, üretra, ejakulator kanallar, seminal veziküller ve kavernöz sinirlere yayılmasına bağlı obstrüktif veya irritatif alt uriner sistem semptomları (AÜSS), hemospermi, ejakulat hacminde azalma ve erektil işlev bozukluğu görülebilir. Böbrek yetmezliğine neden olan üreter tıkanıklığı meydana gelebilir. İskeletin, kemik iliğinin, pelvik lenf nodlarının veya periüreteral lenfatiklerin tutulmasına bağlı ağrı, kemik ağrısı, anemi, alt ekstremite ödemi veya retroperitoneal fibroz gibi durumlar ortaya çıkabilir. Patolojik kırıklar, paraneoplastik sendromlar, DIK (Dissemine İntrvasküler Koagulopati) daha nadir görülen durumlardır (67,68). 1.2.5 Tanı
1.2.5.1 Parmakla Rektal Muayene (PRM)
1994 yılında Food and Drug Administration (FDA) asemptomatik erkeklerde prostat kanserini saptamak amacıyla PRİ (Parmakla Rektal İnceleme) ile PSA testinin kullanımını onaylamıştır. Erken evre prostat kanserlerinde fizik muayene bulguları eğer varsa sadece PRİ anormalliği ile sınırlıdır. Endure alanlar, sertlik prostat kanseri varlığını şüphelendirir. Ama bu bulgular prostat inflamasyonu
18
(özellikle granulamatöz prostatit), BPH veya prostat taşları nedeniyle de olabilir. PRİ değerlendirmesi de zordur. Tek başına kullanıldığında kanser vakalarının %24-35‘i atlanabilmektedir. PRİ ile saptanan vakaların %50‘den fazlası ileri patolojik evrede ve yüksek derecelidir (69,70). Anormal bir PRİ genellikle biyopsi yapılmasını gerektirir.
1.2.5.2 Prostat Spesifik Antijen (PSA)
Prostat spesifik antijen (PSA), ideal bir tümör belirtecinin sahip olması gereken birçok özelliğe sahip olmadığı halde, günümüzde en çok kullanılan onkolojik belirteç olma özelliğini sürdürmektedir. Öncelikle prostat dokusu ve seminal sıvıda izole edilmiş olmasına karşın, daha sonra yapılan çalışmalarda tükürük salgısı, pankreas ve meme dokularında da tespit edilmiştir. PSA‘nın temel biyolojik fonksiyonu semenin sıvılaştırılmasıdır.
PSA tek zincirden oluşan, glikoprotein yapısında bir moleküldür. Doku kallikrein ailesinin bir üyesi olan PSA (hK3 olarak da adlandırılmaktadır), serin proteaz aktivitesine sahiptir (71). Yapısında 237 amino asit bulunan PSA‘nın molekül ağırlığı 34 kDa‘dur. PSA‘yı kodlayan gen 19. kromozomun uzun kolunda bulunmaktadır (72).
PSA, 261 amino asitten oluşan bir prepro-protein olarak prostat epitel hücreleri tarafından sentezlenir. On yedi amino asit içeren öncül dizinin ayrılması ile 244 amino asitlik inaktif proPSA (pPSA) oluşur (73). ProPSA‘nın human kallikrein 2 (hK2) tarafından bölünmesi ile olgun, aktif PSA (237 amino asit) oluşur (73,74).
Prostatik duktus epitel hücresinde sentezlenen pPSA egzositoz yoluyla seminal lümene salınır. Seminal lümen içerisinde proPSA, aktif PSA‘ya dönüşür. Seminal sıvı içerisinde aktif PSA proteolize uğrayarak inaktif PSA‘ya (iPSA) dönüşebilir. Normalde aktif ve inaktif PSA‘nın çok az bir kısmı, epitel hücresi, bazal hücre ve bazal membran tabakalarını aşarak dolaşıma karışır (71). PSA‘nın serumdaki konsantrasyonu, seminal sıvıdaki konsantrasyonundan yaklaşık olarak 100 kat daha düşüktür (75). Bazal hücrelerin kaybolduğu, bazal membran bütünlüğünün bozulduğu ve normal lümelli yapının tahrip olduğu prostat hastalıkları (prostat kanseri, prostatit, benign prostat hiperplazisi) ya da prostat manipülasyonu (prostat masajı, prostat biyopsisi) varlığında PSA çok daha yüksek oranlarda kana karışır. Prostat kanserinde serum PSA değerinin normalden daha yüksek ölçülmesi, artmış
19
PSA üretiminin değil, dolaşıma prostat yapısındaki tahribattan ötürü daha çok PSA salınmasının sonucudur (71).
Total PSA‘nın yarılanma ömrünü, Oesterling ve arkadaşları 3,2±0,1 gün, Stamey ve arkadaşları ise 2,2±0,8 gün olarak hesaplamıştır (76,77). Buna göre radikal prostatektomi gibi prostat kanserini tedavi etmek üzere uygulanan girişimlerden sonra PSA‘nın serum seviyesinin ölçülemeyecek düzeye gelmesi birkaç hafta sürebilir. Serbest PSA‘nın yarılanma ömrünün 2 saat olduğu ve boyutunun daha küçük olması nedeniyle böbrekler tarafından elimine edildiği bilinmektedir (77,78).
PSA değerinde 4-10 μg/L aralığında değişen fizyolojik bir varyasyon olabileceğini belirtmişlerdir.PSA ölçümü için günün hangi saatinde kan örneği alındığı serum seviyesini etkileyecek önemli bir parametre olarak kabul edilmemiştir (79).
Prostat spesifik antijen üretimi androjenlerin etkisi altındadır (80). Ergenlik sürecinde, luteinizan hormon ve testosterondaki artışa paralel olarak, serumda PSA ölçülebilir seviyeye gelmektedir. Serum PSA değeri, yaş, cinsiyet ve prostat hacmine göre değişkenlik gösterir. Siyah ırkta bazal PSA değerinin daha yüksek olduğu gösterilmiştir (81).
Prostat biyopsisi, sistoskopi, üretral kateter uygulanması, prostat cerrahisi, rektal muayene gibi durumlarda da PSA seviyelerinde yükselme görülebilmektedir. Rektal muayenede PSA seviyelerinde küçük bir miktar artış gösterilmişse de bunun klinik önemi yoktur. Ejakulasyon, serum PSA düzeyinde artışa neden olmaktadır. Ejakülasyon sonrası PSA yüksekliği 48-72 saat sürebilir.
1.2.5.2.1 PSA İzoformları
Dolaşıma karışan PSA serbest ve kompleks (proteaz inhibitörlerine bağlanmış) formlarda bulunur. Total serum PSA değerinin %65-95‘ini kompleks PSA, %5-35‘lik kısmını ise serbest PSA oluşturur. PSA‘nın serumda bağlı bulunduğu temel proteaz inhibitörü α1-antikimotripsindir (AKT) (82). Alfa2-makroglobulin (A2M) ve α1-proteaz inhibitörü (API) PSA‘nın AKT‘den daha düşük oranda bağlandığı diğer proteaz inhibitörleridir (83,84). Katalitik olarak aktif olan PSA, proteinler ile kompleks oluşturmaz ve serbest formda (sPSA) dolaşımda bulunur. Serbest PSA‘nın
20
3 ana bileşeni bulunmaktadır. Bunlar inaktif PSA (iPSA), çeşitli öncül proPSA formları ve benign PSA‘dır (bPSA). İnaktif PSA, yapısı ve bütünlüğü bozulmamış PSA molekülüdür. Benign PSA ise, benign prostat hiperplazisi olan hastalardan izole edilmiş olan PSA formudur (85). Serbest/total PSA oranı, PSA‘nın bir tarama testi olarak prostat kanserine özgüllüğünü arttırmak ve gereksiz biyopsileri engellemek için rutin klinik pratikte kullanılmaktadır. pPSA yüzdesi, total PSA değeri 2-10 ng/mL arasında iken, kanser yakalama oranını arttırabilmektedir. Prostat kanserine özgüllük oranı serbest PSA yüzdesinden daha yüksektir.
1.2.5.2.2 PSA Türevleri
PSA türevleri, PSA‘nın prostat kanseri için özgüllüğünü arttıracak yöntemlerin (yaşa göre PSA, PSA hızı, PSA dansitesi) başında gelmektedir.
1.2.5.2.3 PSA Dansitesi
Prostat spesifik antijen dansitesi, total PSA değerinin prostat hacmine bölünmesiyle elde edilen değerdir. PSA değeri 4-10 ng/mL arasında olan ve rektal muayenesinde anormallik saptanmayan hastalarda, PSA dansitesinin 0.15‘den yüksek olması, prostat kanseri ihtimalini arttıran bir bulgu olarak kabul edilmiştir (86,87).
1.2.5.2.4 PSA Hızı
Prostat kanseri olan hastalarda, serum PSA düzeyinin, prostat kanseri olmayanlara göre daha hızlı yükseldiği tespit edilmiştir. Bu bulguya paralel olarak, serum PSA düzeyindeki artışın bir yılda 0.75 ng/mL‘den fazla olması, yüksek prostat kanseri riski ile ilişkilendirilmiştir (88). PSA hızının kanser tanısında doğru bir şekilde kullanılabilmesi için, serum PSA düzeyindeki değişimin en azından 18 aylık bir süre boyunca izlenmiş olmasının önemi vurgulanmıştır (89).
1.2.5.2.5 Yaşa göre PSA
Yaşa göre PSA değerleri, genç hastalarda PSA‘nın duyarlılığını, yaşlı hastalarda ise PSA‘nın özgüllüğünü arttırmak amacı ile kullanılmıştır (90). Böylelikle, genç hastalarda daha düşük PSA değerlerinde kanser tanısı koymak mümkün olmuştur. Yaşlılarda eşik değerin daha yüksek olması, genel sağ kalıma etkisi olmayacak kanserlerin tanısına yönelik girişimleri azaltmayı amaçlamıştır.
21 1.2.5.2.6 Serbest/Total PSA oranı
Serbest PSA yüzdesi, PSA değeri 4-10 ng/ml arasında olan bireylerde prostat kanseri riskini öngörebilmek için kullanılabilir. Serbest PSA yüzdesi ile kanser riski arasında ters bir orantı bulunmaktadır. Prostat kanseri riskinin, serbest PSA yüzdesi %15‘in altında olanlarda nispeten daha yüksek, %25‘in üstünde ölçülen kişilerde ise nispeten daha düşük olduğu kabul edilmektedir.
1.2.5.2.7 Prostat Sağlık Endeksi (Prostate Health Index-PHI)
Prostat sağlık endeksi (PHI), total PSA, serbest PSA yüzdesi ve [-2] proPSA düzeyini hesaba katarak, prostat kanseri riskini öngörmek için rutin pratikte kullanılmakta olan bir serum testidir. Yaşı 50 ve üzerinde olan, total PSA değeri 4-10 ng/ml arasında değişen ve kanser düşündüren parmakla rektal muayene bulgusu bulunmayan hastalarda, PHI testi ile benign hastalık-kanser ayrımının verimli bir şekilde yapılabileceği öngörülmüştür. Genel olarak değerlendirildiğinde; PHI değeri 0-24.9, 25-34.9, 35-54 ve ≥55 olan hastalarda prostat kanseri tespit edilme ihtimali sırasıyla, %11, %18.1, %32.7 ve %52.1 olarak hesaplanmıştır.
Enflamasyon, serbest PSA yüzdesini azaltabilir ve bu da prostat kanseri ile prostatit arasındaki ayrımı güçleştirebilir. Ancak, PSA değeri 4-10 ng/ml arasında olup, anormal parmakla rektal muayene bulgusu bulunmayan hastalarda [-2]proPSA ve PHI ile kronik histolojik enflamasyon ile kanser ayrımının yüksek bir doğruluk oranı ile yapılabildiği saptanmıştır (91).
PHI skoru 0-20.9 arasında çıkanlar düşük, 21-39.9 arasında çıkanlar orta, 40 ve üzerinde sonuçlananlar ise yüksek risk kategorisine dahil edilmektedir. PHI skoruna göre orta veya yüksek risk atfedilen olguların multiparametrik prostat MR‘ı (mp-MRI) ile radyolojik açıdan daha detaylı bir şekilde değerlendirilmeleri gerekli olabilmektedir. Bu doğrultuda; PHI testine göre yüksek risk grubunda olup, mp-MR incelemesinde yüksek olasılıkla kanser düşündüren lezyon (PI-RADS skoru 4 ya da 5) tespit edilmiş olan hastalarda; biyopsi ile örnekleme neticesinde %85 oranında prostat kanseri tanısına varılmıştır.
22
1.2.5.3 Prostat Spesifik Membran Antijen (PSMA)
Prostat spesifik membran antijen, prostat hücrelerinin yüzeyinde bulunan protein yapısında bir moleküldür ve prostat kanseri geliştiği takdirde neoplastik hücreler tarafından üretimi artar. Güncel çalışmalarda, PSMA‘nın prostat kanseri tanısı, evrelendirilmesi ve tedavisinde (teranostik uygulamalar; tedavi ajanı ile bu ajanın etkisini tanımlamaya yarayan tanısal yöntemin birlikteliğine verilen addır) kullanımı araştırılmaktadır. Özellikle, radyoaktif ajan olarak Galyum-68 ile işaretlenmiş PSMA‘nın kullanıldığı PET-BT ile; tedavi öncesi evrelendirme ve kesin tedavi sonrası PSA tekrarının aydınlatılması konularında başarılı sonuçlar elde edilmektedir. PSMA pozitifliği ile yüksek tümör evresi, androjenden bağımsız tümör progresyonu, metastatik yayılım ve PSA tekrarı arasında ilişki kuran çalışmalar bulunmaktadır (92).
1.2.5.4 TRUS Eşliğinde Prostat Biyopsisi
PSA testinin ilk kullanılmaya başladığı yıllardan itibaren birçok klinisyen biyopsi kararı vermek için PSA‘nın bir eşik değere göre yükselmiş olmasını baz almışlardır. Bu eşik değeri uzun yıllar 4 ng/ml olarak kabul edilmiştir. Bu eşik değerinin üzerinde prostat kanser varlığı %30‘dur. Daha sonraki yıllarda geliştirilen değişik PSA türevleri (yaşa göre PSA, PSA dansitesi, PSA hızı, serbest PSA vb.) biyopsi kararı vermede kullanılmıştır. Biyopsi kararı alınırken PRİ, PSA seviyesi, PSA türevleri, hastanın kendine ait riskleri (yaş, siyah ırk, ailesel yatkınlık) ve varsa daha önceki negatif biyopsiler göz önüne alınmalıdır (79).
Sınırda PSA yüksekliği durumunda hemen biyopsi kararı verilmemelidir. PSA birkaç hafta sonra aynı yöntem ile standart şartlarda (ejakulasyon ve üriner infeksiyon olmamalı) tekrarlanmalıdır (93,94). Asemptomatik hastalarda PSA seviyelerini düşürmek için ampirik antibiyotik tedavisi kullanılmamalıdır (95).
Ultrasonografi rehberliğinde alınan biyopsiler standart yaklaşımdır. Transrektal yol biyopsilerin çoğunda kullanılan yaklaşımdır, ama bazı ürologlar perineal yaklaşımı kullanmaktadır. Her iki yöntemin kanser saptama oranları benzerdir (96,97). Altılı biyopsiler artık yeterli değildir. Apeksten bazale uzak lateral ve lateral periferal zon örneklenmelidir. Ayrıca PRİ ve TRUS‘taki anormal alanlardan da biyopsi alınmalıdır. Tahmini 30-40 gr‘lık bir prostat için 8‘den fazla kor biyopsi alınmalıdır. Önerilen ise 10-12 kor biyopsi alınmasıdır (98). On iki kordan fazla
23
örnek alınması ilk biyopside tümör saptanma oranlarını anlamlı seviyede arttırmamaktadır (99,100). TURP prostat kanser saptanması amacıyla kullanılmamalıdır (101).
Tekrar biyopsi endikasyonları; artan veya yüksek kalmaya devam eden PSA, şüpheli PRİ (kanser riski %5-30) (102,103), atipik küçük asiner proliferasyon (ASAP, kanser riski %40) (104), birçok biyopsi alanında (>3) yüksek dereceli prostatik intra epitelyal neoplazi (YDPIN) varlığı (%30 tümör riski) (104,105), YDPİN alanının hemen komşuluğunda birkaç atipik gland varlığı (%50 risk) olarak bildirilmiştir (106). Bir veya iki prostat biyopsi alanında YDPİN varlığı artık tekrar biyopsi endikasyonu değildir (107). Yapılan 10-12 kor negatif biyopsi sonrasında hala prostat kanser riski varsa yapılacak prostat biyopsisini yönlendirmek için mültiparametrik MRG ile değerlendirme yapılabilir çünkü TRUS anterior, apikal ve santral lezyonları göstermede yetersizdir (108).
EAU kılavuzları da ilk biyopside genişletilmiş şemada biyopsi yapılmasını (en az 10 ideali 12), TRUS eşliğinde veya transperineal olarak her 5 mm‘de bir örnekleyecek şekilde alınan transperineal saturasyon biyopsilerini (20‘den fazla kor, ek periferal ve transizyonel zon biyopsileri) tekrar biyopside önermektedir (109,110). Saturasyon biyopsisi ile tümör saptanma oranları daha önceki biyopsilerde alınan kor sayısına bağlı olmakla beraber %30-43 arasında değişmektedir (92). Saturasyon biyopsisi transperineal yöntemle uygulanabilir ve %38‘lik ek bir tümör saptanma oranı sağlar. Önemli bir dezavantajı %10 sıklıkla görülen üriner retansiyondur (111).
En güncel olarak multiparametrik MRG ile saptanmış şüpheli alanlardan TRUS rehberliğinde alınan biyopsilerin TRUS biyopsinin tanısal doğrulunu arttırdığı ileri sürülmüştür (112). Güncel bir derlemede MRG rehberliğinde hedeflenmiş biyopsinin standart biyopsiden daha az kor sayısı ile aynı sayıda klinik anlamlı tümörü saptayabildiği belirtilmiştir (113). Ancak MRG rehberliğinde hedeflenmiş biyopsilerin yaygınlaşması için yeterli deneyim ve becerilerin gelişmesi ve de maliyetlerin daha ucuzlaması gerekmektedir.
1.2.6 Evreleme
Ultrason kılavuzluğunda alınan biyopsi ile prostat kanseri tanısı konduktan sonra amaç hastalığı doğru bir şekilde evrelenirmektir. Prostat kanserinin klinik
24
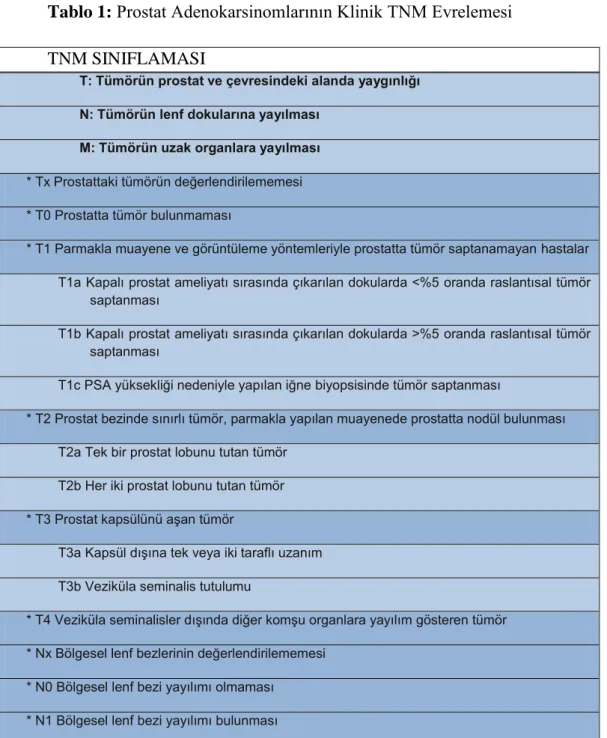
evrelemesinde prognozu öngörmek ve uygun tedavi hakkında karar vermek amacıyla hastalığın yaygınlığını ölçmek için tedavi öncesi parametreler kullanılır. Bunlar serum PSA ve türevleri, PRİ, biyopsi ile saptanmış tümörün Gleason skoru, pozitif kor sayısı ve korlardaki tümör uzunluğu ve görüntülemedir (114). Düşük riskli lokalize hastalıkta görüntüleme gerekli değildir (115). EAU kılavuzlarına göre ek görüntüleme eğer hastanın tedavi tipini değiştirecekse yapılmalıdır (115). Başlangıçtaki evrelemede pozitron emisyon tomografisi (PET) kullanılmamalıdır (115). Prostat kanser evrelemesi AJCC‘nin TNM evreleme sistemine göre yapılmaktadır (Tablo 1).
Tablo 1: Prostat Adenokarsinomlarının Klinik TNM Evrelemesi TNM SINIFLAMASI
T: Tümörün prostat ve çevresindeki alanda yaygınlığı N: Tümörün lenf dokularına yayılması
M: Tümörün uzak organlara yayılması * Tx Prostattaki tümörün değerlendirilememesi * T0 Prostatta tümör bulunmaması
* T1 Parmakla muayene ve görüntüleme yöntemleriyle prostatta tümör saptanamayan hastalar T1a Kapalı prostat ameliyatı sırasında çıkarılan dokularda <%5 oranda raslantısal tümör
saptanması
T1b Kapalı prostat ameliyatı sırasında çıkarılan dokularda >%5 oranda raslantısal tümör saptanması
T1c PSA yüksekliği nedeniyle yapılan iğne biyopsisinde tümör saptanması
* T2 Prostat bezinde sınırlı tümör, parmakla yapılan muayenede prostatta nodül bulunması T2a Tek bir prostat lobunu tutan tümör
T2b Her iki prostat lobunu tutan tümör * T3 Prostat kapsülünü aşan tümör
T3a Kapsül dışına tek veya iki taraflı uzanım T3b Veziküla seminalis tutulumu
* T4 Veziküla seminalisler dışında diğer komşu organlara yayılım gösteren tümör * Nx Bölgesel lenf bezlerinin değerlendirilememesi
* N0 Bölgesel lenf bezi yayılımı olmaması * N1 Bölgesel lenf bezi yayılımı bulunması
25
* Mx Uzak organ yayılımının değerlendirilememesi * M0 Uzak organ yayılımı olmaması
* M1 Uzak organ yayılımı olması
M1a Bölgesel olmayan lenf bezine yayılım M1b Kemiklere yayılım olması
M1c Diğer uzak organlara yayılım bulunması
1.2.6.1 T Evresi
İlk değerlendirme aşaması tümörün lokal evresinin (T1,2 ve T3-4) belirlenmesidir. Çünkü tedavi kararını değiştirebilir. PRİ bulguları ile tümör evresi arasındaki korelasyon %50‘den azdır (116). Sıklıkla tümör evresi daha düşük algılanır. Daha detaylı T evrelemesi eğer doğrudan tedavi kararını etkileyecekse yapılmalıdır. Geçmişte, görüntüleme ile ekstrakapsüler yayılımı veya seminal vezikül invazyonu olan hastaları doğru olarak belirlemek mümkün olmamakta idi. Yıllarca PSA, PRİ ve Gleason skoru baz alınarak oluşturulan nomogramlar prostat dışına yayılım ve seminal vezikül tutulum olasılığını öngörmek ve sinir koruyucu cerrahi yapılıp yapılamayacağını ve lenfadenektomi gerekliliğini belirlemek için kullanılmıştır. Serum PSA seviyeleri tümör evresi ile artar, ancak patolojik evrenin öngörülmesindeki doğruluk oranı düşüktür. Prostat iğne biyopsisindeki kanserli doku yüzdesi ve pozitif kor sayısındaki artış pozitif cerrahi sınır, seminal vezikül tutulumu ve organa sınırlı olmayan hastalığın güçlü bir öngörücüsüdür (117,118). Serum PSA, Gleason skor ve T evresi birlikte kullanıldığında tek başlarına olduğundan daha fazla son patolojiyi öngörebilmektedir (119,120). Günümüzde ise orta ve yüksek riskli hastalarda hastalığın prostatın dışına yayılıp yayılmadığını göstermede görüntüleme daha değerlidir. TRUS ile tümörlerin sadece %60‘ı görülebilmektedir. İzoekojenite nedeniyle %40‘ı görüntülememektedir. Organ sınırlılığını öngörmede PRİ‘den üstün değildir (121,122). Ekstrakapsüler yayılımını gösterme doğruluğu %37-83 arasında değişmektedir. Multifokal hastalığı göstermedeki duyarlılık ve özgüllüğü %40-50 arasındadır. TRUS‘a renkli veya güçlü doppler, kontrast ve üç boyutlu görüntüleme eklenmesi sayesinde vaskülaritesi artmış alanları gösterebilir ve tümör tespitini arttırabilir, ama henüz evrelemeye ek katkıları gösterilememiştir (123). TRUS yapana bağımlı olması ve T2-3 tümörleri birbirlerinden ayıramaması nedeniyle rutin evrelemede önerilememektedir (124). Kontrastlı mültidetektör bilgisayarlı tomografi
26
(BT) ve PET/BT lokal evrelemede sınırlı role sahiptir. Özgüllük yüksek olsa da kanser gland dışına çıkmadığı takdirde saptanması mümkün olmamaktadır (123). Rutin evrelemede BT kullanılmamalıdır (115). BT uygulamalarını PSA>20 ng/ml GS ≥8 veya lokal ileri (cT3/4) hastalara sınırlamak pozitif çıkma olasılığı olan hastaları atlama oranlarını %1‘in altına indirirken, toplam tetkik oranını ise %25 azaltacaktır (125). MRG orta ve yüksek riskli prostat kanserli hastaların lokal evrelemesinde umut veren bir görüntüleme yöntemidir (115). Görüntülemede 1.5 Tesla‘lık (T) manyetik alan yeterli olsa da 3 T ile üç boyutlu çözünürlükte ilerleme olmuştur. MRG 1.5 T ile görüntü kalitesini arttırmak için endorektal koil (bobin) kullanımı eksternal koil kullanımı ile karşılaştırıldığında evrelendirmenin doğruluğunu %59-68‘dan %77-83‘e çıkarmıştır. Üç T‘da endorektal koil gerekmeyip lokal evrelemedeki doğruluğu %67-93 arasındadır ve okuyucuya göre değişebilmektedir (123). Düşük duyarlılık nedeniyle lokal evrelemede düşük risk grubundaki hastalarda mültiparametrik MRG (mp-MEG) kullanımı önerilmemektedir (115). En son ve güncel olarak MRG ekstraprostatik yayılım yerini ve dolayısıyla sinir koruma yapılıp yapılmayacağını göstermede doğru bir şekilde kullanılmıştır. Aktif izleme alınacak hastalarda daha iyi risk tanımlanması için mültiparametrik MRG kullanımına artan bir ilgi vardır (123).
1.2.6.2 N Evresi
Lenf nodu evrelemesi doğrudan tedavi kararını etkileyecekse yapılmalıdır. Yüksek PSA değerleri, T2b-3 hastalık, kötü farklılaşmış tümör ve perinöral invazyon varlığı lenf nodu tutulumu olasılığını arttırır.
Pelvik lenf nodu diseksiyonu lenf nodu tutulumunu belirlemede altın standarttır. Prostat kanserinin lenf nodu evrelemesinde kullanılan konvansiyonel yöntemler kontrastlı BT ve MRG‘dir. Saokar ve arkadaşları MRG‘nin lenf nodlarını belirlemede daha iyi yumuşak doku çözünürlüğü ve lenf nodlarını damarlardan ayırmadaki başarısı nedeniyle BT‘den daha üstün olduğunu öne sürmüşlerdir (126). Her iki yöntemde de lenf nodu tutulum şüphesi lenf nodunun boyutlarına göre değerlendirilir. En sık kullanılan eşik değer kısa çapın 10 mm‘den uzun olmasıdır. Anlamlı lenf nodu büyüklüğü için önerilen kısa çap için önerilen eşik değerleri 8-15 mm arasında değişmektedir. Düşük eşik değerler duyarlılığı arttırırken özgüllüğü düşürmekte, büyük eşik değerler ise duyarlılığı azaltırken özgüllüğü arttırmaktadır.