T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
AKUT PANKREATİTLİ HASTALARDA
IL-6 VE CRP DÜZEYLERİ İLE
HASTALIK AKTİVİTESİ ARASINDAKİ İLİŞKİ
UZMANLIK TEZİ
Dr. Nuh BEREKATOĞLU
TEZ DANIŞMANI
Prof. Dr. Vedat GÖRAL
TEŞEKKÜR
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’na başta olmak üzere, İç Hastalıkları A.B.D Başkanımız Prof. Dr. M. Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Vedat GÖRAL, Prof. Dr. Orhan AYYILDIZ, Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Kendal YALÇIN, Prof. Dr. Alpaslan TUZCU, Doç. Dr. Muhsin KAYA, Doç. Dr. Ali Kemal KADİROĞLU, Yrd. Doç. Dr. Hasan KAYABAŞI, Yrd. Doç. Dr. M.Ali KAPLAN, Yrd. Doç. Dr. Ali İNAL’a teşekkürlerimi sunuyorum.
Tezimin her aşamasında ve asistanlık süresi boyunca desteklerini esirgemeyen sayın hocam Prof. Dr. Vedat GÖRAL’a, tezimde emekleri geçen Prof. Dr. Nuriye METE, Prof. Dr. Ömer SATICI ve Uz. Dr. Feyzullah UÇMAK’a, Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D, Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D, Göğüs Hastalıkları ve Tüberküloz A.B.D, Radyoloji A.B.D başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan her zaman büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına,
Asistanlık süresi boyunca desteklerini esirgemeyen sevgili dostlarım ve sevgili aileme özellikle Hülya ablama sonsuz teşekkürlerimi sunuyorum.
İÇİNDEKİLER Bölüm Sayfa No TEŞEKKURLER 1 İÇİNDEKİLER 2 SİMGELER VE KISALTMALAR 4 ŞEKİLLER VE TABLOLAR 5 1. GİRİŞ VE AMAÇ 7 2. GENEL BİLGİLER 8 2.1. Pankreas Anatomisi 8 2.2. Pankreas bölümleri 9 2.3. Pankreas damarları 10 2.4. Pankreas lenfatikleri 11 2.5. Pankreas sinirleri 11 2.6. Pankreas kanalları 11 2.7. Pankreas fizyolojisi 12 2.8. Akut Pankreatit 13 2.8.1. Tanım 15 2.8.2. Etyoloji 15 2.8.3. Patogenez 22 2.8.4. Patofizyoloji 29 2.8.5. Klinik 33 2.8.6. Tanı 34 2.8.6.1. Laboratuvar 34
2.8.6.2. Radyoloji ve diğer testler 36
2.8.7. Evreleme 41 2.8.8. Tedavi 40 2.8.9. Komplikasyonlar 47 2.8.9.1. Lokal komplikasyonlar 47 2.8.9.2. Sistemik komplikasyonlar 49 2.8.10. Prognoz 50 3.İNTERLÖKİN 50 3.1. İnterlökin-6 50
4. GEREÇ VE YÖNTEM 51 5. BULGULAR 52 6. TARTIŞMA 58 7. ÖZET 62 8. SUMMARY 64 9. KAYNAKLAR 66
SİMGELER VE KISALTMALAR
AP: Akut Pankreatit
APACHE-II: Akut fizyolojik ve kronik sağlık değerlendirmesi
CRP: C- reaktif protein
IL: İnterlökin
USG: Ultrasonografi
CT: Komputerize tomografi
CTŞS: Komputerize tomografi şiddet skoru MRCP: Manyetik resonans kolanjiopankreatografi ERCP: Endoskopik Retrograt Kolanjio-Pankreatografi EUS: Endoskopik Ultrasonografi
CFTR: Kistik fibrozis transmembran conductan regülatör PAR-2: Protease activated receptor
TRVP-1: Transient receptor potential vanilloid TAP: Trypsin activation peptide
ARDS: Akut respiratuvar distress sendromu
TNF: Tümör nekrozis faktör
PLA2: Fosfolipaz A2
SIRS: Sistemik inflamatuvar yanıt sendromu PSTI: Pankreatik sekretuvar tripsin inhibitörü
SPINK1: Serine proteaz inhibitör, Kazal tip 1 DIC: Dissemine intravasküler koagülasyon
ŞEKİLLER
Şekil 1: Pankreasın anatomik konumu 8
Şekil 2: Pankreasın bölümleri 10
Şekil 3: Pankreasın arterleri 11
Şekil 4: Pankreasın venleri 11
Şekil 5: Pankreasın kanalları 12
Şekil 6: Alkolün AP patogenezindeki rolü 19
Şekil 7: Akut pankreatit patogenezinde sitokinlerin rolü 24
Şekil 8: Akut pankreatitde hücresel orijinli mediatörler 25
Şekil 9: Akut pankreatit patogenezi 26
Şekil 10: Akut pankreatitisde Gray-Turner ve Cullen arazı 34
Şekil 11: AP’de CT’de pankreas başında nekrotik kitle mevcut 38
Şekil 12: AP’de CT’de pankreasda ödem ve şişlik mevcut 38
TABLOLAR
Tablo 1: Akut pankreatit etyolojisi 16
Tablo 2: Akut pankreatit sebebini bulmak için yaklaşım önerisi 17
Tablo 3: 48 saatte şiddetli AP atağı belirliyicileri 32
Tablo 4: Hiperamilazemi ve hiperamilazüri nedenleri 35
Tablo 5: Ranson kriterleri 41
Tablo 6: APACHE-II skor sistemi 42
Tablo 7: Glasgow (Imrie) Kriterleri 44
Tablo 8: Balthazar CT şiddet indeksi 45
Tablo 9: Korelasyon 54
Tablo 10: Grup istatistik 55
Tablo 11: Ranson skoru ve CRP korelasyon 56 Tablo 12: APACHE II ve CRP korelasyon 56
1. GİRİŞ VE AMAÇ
Akut pankreatit (AP), pankreas enzimlerinin pankreas içinde aktifleşmesi ve pankreas dokusunun kendisini sindirmesidir (otodijesyon). Akut pankreatit tanısı 1992’de Atlanta sempozyumun da konulan kriterlerle karın ağrısı ve serum amilaz veya lipaz seviyelerinin normalin 3 katı olmasıyla konur. Bu sempozyuma göre akut pankreatit hafif hastalık, şiddetli hastalık olmak üzere ikiye ayrılır. Akut pankreatit % 70-80 hafif, % 20-30 şiddetli olarak görülmektedir. Bu tablo hafif intertisyel ödemden ağır hemorajik gangren ve nekroza kadar gidebilen geniş bir klinik tablo sergiler.
Etyolojide ülkeler arasında farklılıklar olmakla birlikte olguların yaklaşık % 70-80’ nin de safra kesesi taşları ve alkol sorumlu tutulmaktadır. Batı ülkelerinde alkol AP etiyolojisinde ilk sırayı alırken, ülkemizde biliyer nedenler ilk sıradadır.
Akut pankreatitte klinik şiddeti ve prognozu belirlemek için çeşitli skorlama sistemleri kullanılmaktadır. Akut pankreatite özgü bir skorlama sistemi olan Ranson, hastaların basvuru anı ve 48. saatteki bazı klinik ve laboratuvar bulguların değerlendirilmesine dayanır. APACHE II ise daha genel bir skorlama sistemidir; ilk basvurudan itibaren hastaların bazı fizyolojik işlevleri ve genel saglık durumlarına göre 24 saat ara ile değerlendirilmelerini sağlar. Balthazar sınıflaması anatomik yapıları daha iyi tanımlar ve pankreatik inflamasyon, nekroz gibi komplikasyonları ortaya koyabilir. Endojen inflamatuvar mediyatörlerin AP patogenezinde önemli rolleri vardır. Bunların en iyi bilinenlerinden biri olan interlökin-6 (IL-6) inflamasyona ve travmaya erken tepki olarak ortaya çıkar ve başta C-reaktif protein (CRP) olmak üzere karaciğerde akut faz proteinlerinin yapılmasın sağlar. Organizmanın inflamasyona erken tepkisini belirlemek için IL-6 düzeyini, akut faz yanıtı belirlemek için serum CRP düzeyini ölçmek yararlı olacaktır.
Akut pankreatit (AP), önemli morbidite ve mortaliteye yol açtığından yukarıdaki skorlama ve inflamatuvar mediyatörler sayesinde akut pankreatit şiddetinin önceden belirlenmesiyle, doğru tedavi ve yoğun bakım sonucu mortalite azalmaktadır. Bu çalışmada ki amacımız Ranson, APACHE II ve Balthazar
skorlamaları ile inflamatuvar mediyatörlerden CRP ve IL-6 karşılaştırılmalarının istatiksel olarak anlamlı olup olmadığını araştırmaktır.
2. GENEL BİLGİLER 2.1. Pankreasın Anatomisi
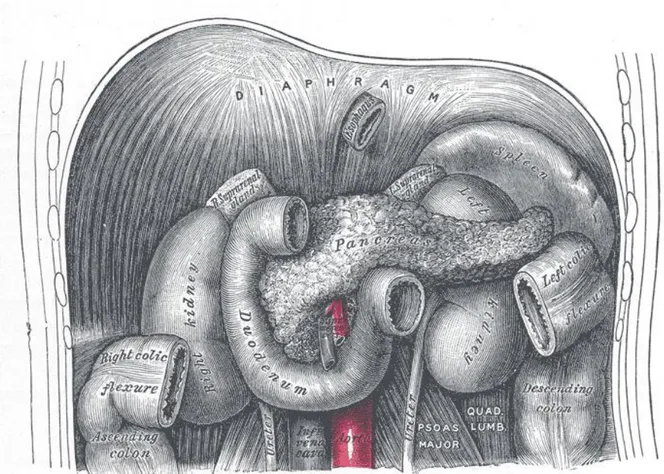
Pankreas karın arka duvarında 1. ve 2. lomber vertebra hizasnda, çoğunlukla hareketsiz, retroperitoneal yerleşimli bir organdır. Erişkin insanda pankreas bezi 80-90 gr ortalama 15-20 cm uzunluğunda, 3 cm eninde ve 1-1.5 cm kalınlığındadır. Midenin arkasında, sağında duedonum, solunda dalak olmak üzere retroperitonda transvers olarak uzanr (1). (Şekil 1)
Şekil 1: Pankreasın anatomik konumu
2.2. Pankreasın bölümleri
Pankreas anatomik olarak baş, uncinate process, boyun, gövde ve kuyruk olarak 5 bölüme ayrılır (2). (Şekil 2)
Baş: Duodenum kavsi içinde, ikinci lomber vertebranın hemen sağında yer alır. Koledok kanalının son kısmı genellikle pankreas başının içinden geçer. Pankreas başının arkasında distal koledok, sağ böbreğin damarları, vena kava inferior yer alır. Yukarıda portal venden, aşağıda mezenterik vene uzanan hayali bir plan pankreas baş kısmını boyun kısmından ayırır.
Processus Uncinatus: Portal ven ve superior mezenterik damarların arkasında, aort ve inferior vena kavanın önünde yer alır. Sagital kesitte uncinate process superior mezenterik arter ile aort arasında, sol renal venin üzerinde, duodenumun 3. ve 4. parçasının altındadır. Uncinate process her insanda olmayabilir veya superior mezenterik damarları tamamen çevreleyebilir.
Boyun: Pankreasın görece daralmış bir kısmı olup, üstte pilor ve duodenum birinci kısmı, altta vena porta, superior mezenterik ven ve splenik ven bulunur. Genişliği ortalama 2cm’dir.
Gövde: Pankreasın gövdesi superior mezenterik damarların solunda yer alır ve duodenumun 4. kıtası, Treitz ligamanı, bazı jejunal anslar, transvers kolonun sol tarafı ile komşudur. Gövdenin üst kenarı sağda çöliak aks ve hepatik arter, solda splenik damarlarla komşudur. Gövdenin ön yüzü omental bursanın arka duvarının pankreas ve mide yüzeyini ayıran çift peritoneal tabakası ile örtülüdür. Bu tabakanın aynı zamanda transvers mezokolon ile de komşuluğu vardır ve iki tabakaya ayrılır; bir yaprağı ön yüzü, diğeri inferior yüzü kaplar. Arka yüzeyi aort, superior mezenterik arter çıkışı, diafragmanın sol krusu, sol adrenal, perirenal fasya, sol böbrek damarları, sol böbrek ve splenik ven ile komşudur.
Kuyruk: Splenorenal ligamanın içinde yer alır. Dalak hilusuna kadar uzanır ve görece mobildir.
Şekil 2: Pankreasın bölümleri
2.3. Pankreasın damarları
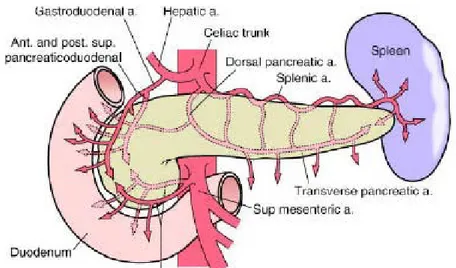
Pankreas arteriyel kan akımını ana hepatik arter, superior mezenterik arter ve splenik arterden almaktadır. Superior pankreatikoduodenal arter gastroduodenal arterin, inferior pankreatikoduodenal arter, superior mezenterik arterin bir dalıdır. Splenik arter, pankreasın üst kenarı boyunca organa pek çok küçük dallar verir. (Şekil 3)
Pankreasın venleri arterlere parelel olarak seyreder. Üst pankreatikoduodenal ven, vena portaya, alt pankreatikoduodenal ven superior mezenterik vene dökülür (3). (şekil 4)
Şekil 3: Pankreas arterleri
Şekil 4: Pankreas venleri 2.4. Pankreasın lenfatikleri
Lenfatik sistem parankim içinde interlobüler alandan başlayıp küçük kanalcıkları oluşturarak önce pankreas yüzeyine, buradan da bölgesel lenf bezlerine ulaşmaktadır. Lenf kanalları, sıklıkla damarlara paralel olarak seyrederler. Pankreas başının ana lenfatikleri önce ön ve arka pankreatoduodenal lenf bezlerine, daha sonra ise pankreas başının alt bölümündeki lenf bezlerine, barsak lenf kanallarına ve
ardından da jukstaaortik ve aort çevresi lenf bezlerine ulaşırlar. Pankreastan çıkan bazı lenfatik kanallar ise direkt olarak lomber lenfatik kanallara, sisterna şiliye veya duktus torasikusa açılabilmektedir.
2.5. Pankreasın sinirleri
Sempatik ve parasempatik sistem tarafından innerve edilir. Sinirler genelikle varacakları yere damarları takip ederek gider. Çöliak ganglion hem sempatik hem de parasempatik innervasyon merkezidir (3).
2.6. Pankreasın kanalları
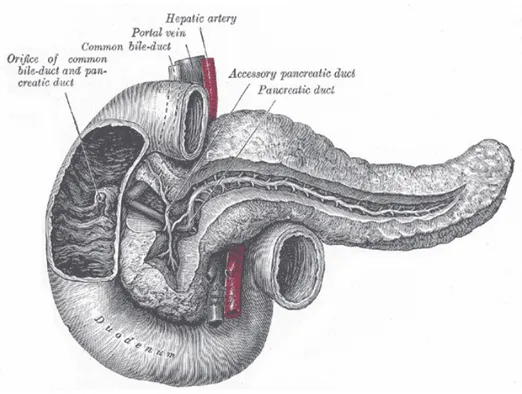
Pankreasın ana kanalı olan Wirsung, organın kuyruk kısmından başlayıp, sağa doğru gövde, boyun ve baş kısmını geçerek Papilla Vateri’ye ulaşır. (Şekil 5) Yaklaşık 15-20cm uzunluğunda 3-3.5mm çapındadır ve 15-20 kanalcık, bu kanala açılır. Santorini olarak isimlendirilen aksesuar kanal ise baş kısmını drene eder ve daha kısadır. %60 vakada her iki kanal duodenuma açılır. % 30 vakada Wirsung kanalı tüm sekresyonları taşır ve Santorini kör uçla sonlanır, % 10 vakada Santorini tüm sekresyonları taşır, Wirsung küçük veya yoktur (3, 4).
2.7. Pankreasın fizyolojisi
Pankreas hem ekzokrin, hemde endokrin salgı yapan bir bezdir. Organın endokrin sekresyonu (insülin, glukagon ve somatostatin) yaşamın devam etmesi için gerekli olup Langerhans adacıklarından salgılanır. Adacıklar morfoloji ve boyanma özellikleriyle birbirinden ayrılan üç tip hücreden oluşur.
• BETA hücreleri: Adacıkların % 60-80’ ini oluşturur ve insülin salgılarlar. • ALFA hücreleri: Adacıkların %10-20’ sini oluşturur ve glukagon salgılarlar.
• DELTA hücreleri: Adacıkların yaklaşık %10’ unu oluşturur. Gastrin ve somatostatin salgılarlar (5).
Pankreasın temel ekzokrin salgı ünitesi asinüstür ve günde ortalama 1500-2000 ml berrak, izotonik ve alkali (pH: 8.0- 8.3) ekzokrin salgısı vardır. Bu salgı 20’den çok sindirim enzimini içinde bulundurur. Ekzokrin salgıdaki başlıca katyonlar Na+ ve K+ olup plazma konsantrasyonlarıyla aynıdır. Başlıca anyonlar ise Cl- ve Mg+ dur. Ekzokrin salgının akım hızı artıkça HCO3- konsantrasyonu artarkan, Cl- azalır. Pankreastan salgılanan bu ekzokrin salgıdaki bikarbonat iyonları, mideden duodenuma boşalan asitli kimusun nötralize edilmesinde de önemli rol oynar. Ekzokrin pankreas salgısı bazal koşullarda 0.3 mg/ml protein içerir. Bu proteinlerin %90’ını enzimler ve proenzimler oluşturur. Pankreas ekzokrin salgısı temel üç besin maddesinin sindirimini sağlayan enzimleri içerir: protein, karbonhidrat ve yağların sindirimi. Proteolitik enzimler; tripsin, kimotripsin, karboksipolipeptidaz, ribonükleaz ve deoksiribonükeaoz’dan ibarettir. Bunların içinde en fazla miktarda olan tripsindir. Tripsin ve kimotripsin proteinleri peptidlere parçalar. Karboksipolipeptidaz peptidleri karboksi ucundan ayırarak aminoasitleri parçalar. Nükleazlar ise nükleik asitleri parçalar. Karbonhidratları parçalayan enzim amilazdır. Bu enzim karbonhidratları parçalayarak disakkaritleri ve az miktarda trisakkaritleri oluşturur. Pankreasın yağ sindiriminden sorumlu enzim ise lipaz, kolesterol esteraz ve fosfolipazdır. Proteolitik enzimler pankreas hücrelerinde sentez edildiklerinde inaktif formdadır. Bunlar intestinal kanala salgılandıktan sonra aktif duruma geçerler. Pankreas salgılarındaki proteolitik enzimlerin barsağa dökülünceye kadar aktif duruma geçmemeleri önemlidir. Çünkü tripsin ve öteki enzimler pankresın kendisini
sindirebilir. Pankreas asinuslarına proteolitik enzimleri sekrete eden hücreler aynı zamanda tripsin inhibitörü adı verilen maddeyi de salgılarlar. Öteki proteolitik enzimlerinde aktivasyonu tripsinle olduğu için tripsin inhibitörü tümünün aktivasyonunu engeller. Bununla beraber pankreas ağır şekilde hasara uğrar veya kanalı tıkanırsa, pankreasın haraplanan kısmında çok miktarda enzim birikir. Bu durumda tripsin inibitörü yetersiz kalır ve pankreas salgısı aktive olup, birkaç saat içinde tüm pankreası sindirebilir, sonuçta akut pankreatit gelişir (6). Akut pankreatitte daha etkin mekanizmanın aktive olmuş pankreatit enzimlerden çok aktif hale geçmiş lökositlerden salınan oksidan moleküler olduğu düşünülmektedir. Lökositlerden ortaya çıkan mediyatörler ve sitokinler tahrip edicidir. Sitokinler düşük molekül ağırlıklı proteinlerdir. Normal dokularda bulunmaz. Dış kaynaklı bir uyarı, hücreyi sitokin üretmek için uyarır. Ortaya çıkan sitokin kendisinin ve diğer bazı sitokinlerin üretimini arttırır. Akut pankreatitte rol aynadığı düşünülen sitokinler, interlökin-6 (6) ve TNF ( tümör nekroz faktör) alfadır. Ayrıca 1, IL-2, IL-10, NO (nitrik oksid) ve serbest radikaller, akut pankreatittin ilerlemesinde rol alırlar. IL-6 ve TNF-alfa infeksiyon ve inflamasyona ilk cevap olarak ortaya çıkar. Akut pankreatitte görülen ateş, hipotansiyon, yaygın damar içi pıhtılaşma, şok gibi lokal ve sistemik bir çok bulgudan sorumludurlar. Bu lökosit ürünleri damar duvarına doğrudan etki ederek damar duvarı geçirgenliğini arttırıp ödem ve trombüs oluşumuna yol açarlar. Bu da pankreas mikrosirkülasyonunu bozar. Pankreatitin derecesi ile mikrosirkülasyonunu düzeltmeye yönelik olarak dekstranla hemodülusyonun asinüslarda nekrozu azalttığı ileri sürülmüştür. Deneysel çalışmalarda pankreatitte bu sitokinler etkinliğinin azaltılması veya oluşumunun engellenmesi ile uzak organ işlev bozukluğu azaltılabilmiş, sağkalım uzamıştır (7). Pankreasın ekzokrin salgısı, sinirsel ve hormonal mekanizmalarla kontrol edilir. Sinirsel uyarılardan Nervus Vagus sorumludur. Direkt vagal uyarı enzimden zengin düşük volüm pankreatik salgıya neden olur. N.vagus aynı zamanda mideden asit salınımı yoluyla indirekt olarak egzokrin salgı üzerine etki eder. Hormonal kontrolde, sekretin ve kolesistokinin temel olarak rol alır. Bu iki hormonun dışında gastrin, pankreatik polipeptid, glukagon gibi diğer bazı hormonlar da az miktarada etkiye sahiptir.
2.8. Akut Pankreatit 2.8.1. Tanım
Akut pankreatit(AP), pankreas enzimlerinin pankreas içinde aktifleşmesi ve pankreas dokusunun kendisini sindirmesidir (otodijesyon). AP, pankreasın önemli hastalıklarından biridir. AP, 1992 Uluslararası Akut pankreatit sempozyumuna göre, bölgesel dokularda ve diğer bazı organlarda değişiklikle karakterize, pankreasın akut inflamasyonudur (8, 9). Bu sempozyuma göre akut pankreatit ikiye ayrılır hafif hastalık, şiddetli hastalık. Sıklığı ülkelere göre değişmekte ve yaşla ile artmaktadır. Mortalite oranı %10-15, şiddetli hastalıkta %30 oranındadır. İlk haftada ölüm multiorgan sistem yetmezliğinden, daha sonraki dönemde infeksiyondan ölüm olur. Siyah ırkta, beyazlara göre 3 kat daha sık görülmektedir. Erkeklerde, kadınlara göre daha sık görülmektedir. Erkeklerde en sık sebep alkol, kadınlarda biliyer sistem hastalıklarıdır. Hastalığın görülme yaşı, etyolojiye göre (30-66 yaş) değişmektedir. Ülkemiz için sağlıklı istatistiklere ulaşmak bu konuda pek olası değildir, fakat Amerika Birleşik Devletleri’nde her yıl yaklaşık 300.000 yeni olgunun ortaya çıktığı bildirilmektedir (A.B.D. nüfusu yaklaşık 300 milyon). Genel olarak bu olguların %10’u ile 20’sinde seyir ciddi olmaktadır (10, 11).
2.8.2. Etyoloji
Birçok sebep suçlansa da, %10-30 vakada sebep bulunamayabilir. AP etyolojisi tablo 1 de özetlenmiştir. AP sebebi için tavsiye edilen yol, Tablo 2’de belirtilmiştir.
Tablo 1: Akut Pankreatit Etyolojisi
1. Safra taşları 2. Alkolizm 3. Travma -Künt Travma
-Delici kesici aletle oluşmuş travma -Cerrahi girişimlere bağlı oluşmuş travma 4. Otoimmun
5. Enfeksiyonlar (virüs, bakteri, parazit) 6-İlaçlar -Kortikosteroidler -Tetrasiklin -Azatiopirin -Sülfonamitler -Klorotiazid -Östrojenler -Furosemid 7-Metabolik nedenler -Hiperlipidemi -Hiperparatroidi 8- Duktal obstrüksiyon 9-İskemi 10-Diğer nedenler 11-İdiyopatik
Tablo 2: AP sebebini bulmak için yaklaşım önerisi (12). Anamnez
Safra taşı hikayesi Alkol kullanımı Aile öyküsü İlaç kullanımı
Bilinen viral bir sebebin veya prodromal semptomların olması Başlangıç Araştırma
Plazma pankreatik enzim düzeyi Karaciğer fonksiyon testleri Safra kesesi USG
Takipte Önerilen
Açlık plazma lipidleri Araştırmalar
Açlık plazma Ca++ seviyesi Viral antikor titreleri Biliyer USG tekrarı MRCP
CT (Helical veya multislice pankreas protokolu) İleri Araştırmalar
İleri USG EUS
Otoimmün markerları
ERCP (safra kristalleri ve pankreas sitoloji) ERCP (safra ve pankreas sitolojisi)
Oddi sfinkter manometrisi
Pankreas fonksiyon testleri (kronik pankreatit ayırıcı tanısı için) Genetik analiz (aile öyküsü, tekrarlayan AP, Herediter Pankreatit varlığında)
1) Biliyer sistem hastalıkları (%38): Safra taşının safra kanallarına düşmesi, oddi sfinkterinde geçici tıkanma yapması suçlanmaktadır. Taşın AP yapma riski, taşın büyüklüğü ile ters orantılıdır. Okkült mikrolithiazis, idiopatik pankreatitis vakalarının bir çoğundan sorumludur. Anormal anatomi de (koledokal kist, jukstapapiller divertikül gibi), AP ile birliktedir (12). Safra taşları ve pankreatit arasındaki ilişki müşterek kanal teorisi ile açıklanmasına rağmen safra taşının pankreatik enflamasyonu başlatma mekanizması tam olarak aydınlatılamamıştır. Müşterek safra kanal teorisine göre distal tıkanıklık sonucu pankreatik duktal sisteme safra reflüsü geliştiği ve bunun pankreatik enzimleri aktive ederek veya doğrudan pankreatik enzimlere etki ederek pankreatite yol açtığı ileri sürülmüştür. Ancak safra taşı hastalarının yalnızca %3-7’sinde pankreatit gelişmekte ve akut pankreatit olgularının sadece %17’sinde koledokolitiazis saptanabilmektedir. Acosta ve Ledesma akut pankreatit geçiren hastaların dışkılarında safra taşlarını sık saptamaları nedeniyle safra taşı migrasyonunun ve papillada geçici tıkanmaların önemli rol oynadığını ileri sürmüşlerdir. Bu araştırıcılara göre safra kesesi içindeki taşların sayılarının birden çok olması, taşların boyutlarının küçük, sistik kanalın geniş olması ve ortak kanalın 5 mm’den uzun olması akut pankreatit yönünde risk olarak kabul edilmektedir. Safra taşı pankreatitlerin patogenezinde duodenal reflü ve pankreatik kanalın taş ile tıkanmasının da rol oynadıgı ileri sürülmekte ise de bu teoriler pek kabul görmemistir. Senniger ve arkadaslarının eş zamanlı biliyer ve pankreatik tıkanıklığın daha önemli olduğunu ileri sürmüşlerdir (13, 14, 15).
2) Alkol (%35): Her ne kadar alkolün hangi mekanizma ile akut pankreatite neden oldugu kesin olarak bilinmesede, alkol major bir AP sebebidir. Alkol bağımlısı kişilerin %10’un dan azında AP gelişir (12). Kronik alkolizm ile hastalık arasında belirgin bir ilişki vardır. Bu ilişkiyi açıklamaya çalısan teoriler şunlardır. (Şekil 6) 1. Pankreatik sıvının extravazasyonu ve oddi sfinkterinde gelişen parsiyel obstrüksiyonla pankreasın ekzojen salgısının artması, dolayısıyla pankreas kanalı içindeki basıncın artması ve sonuçta da makromoleküllere karşı duktal geçirgenligin artması patogenezde yer almaktadır. Öte yandan midede asit salgısının artışına bağlı olarak asidifiye doudenumda sekretin salgının uyarılması ve bu hormonun da pankreasa etkisi ile bikarbonat ve sudan zengin salgının artışına neden olması alkolik pankreatite rol oynar (13, 16).
2. Kronik alkolizm pankreasta protein tıkaçlarının oluşmasına yol açtığı ve bunlarında kanalda tıkanmalara yol açarak pankreatite neden oldukları bildirilmektedir (13, 16).
3. Alkol bazı insanlarda geçici hipertrigliseridemiye neden olur ve pankreatik lipaz ve lipoprotein lipazının trigliseritlere etkisi ile sitoksik serbest yağ asitleri ve lizolesitin oluşur. Sonuçta pankreatik asiner hücrelerde ve kapiller endotelinde kimyasal irritasyon gelişir. Ayrıca hayvan çalışmalarında serbest yağ asitlerinin pankreasa izole olarak perfüzyonunun pankreasta ödem ve hemorajiye neden olduğu gösterilmiştir (16).
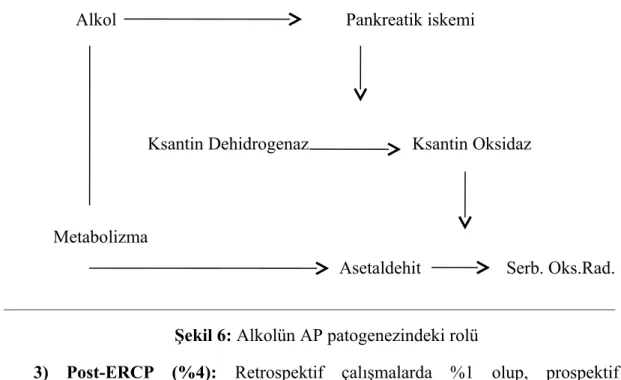
4. Alkol, serbest oksijen radikallerinin oluşmasına neden olabilir (Şekil 6). Aşırı alkol alımı sistemik dolaşıma herhangi bir etki yapmaksızın pankreatik kan akımını azaltmaktadır. Pankreas iskemisi asiner hücrelerdeki inaktif ksantin dehidrogenazı aktif ksantin oksidaza dönüştürmekte ve bu enzim çeşitli substratlara, özellikle alkolün oksidasyon ürünü olan asetaldehite etki ederek serbest oksijen radikallerinin oluşmasına neden olmaktadır. Bu maddeler hücre ve lizozomların membranlarındaki fosfolipitlere etki ederek lizozomal enzimlerin açığa çıkmasına, dolayısıyla hücre bütünlüğünün bozulmasına yol açar (16, 17, 18).
____________________________________________________________________ Alkol Pankreatik iskemi
Ksantin Dehidrogenaz Ksantin Oksidaz
Metabolizma
Asetaldehit Serb. Oks.Rad.
______________________________________________________________________________________
Şekil 6: Alkolün AP patogenezindeki rolü
3) Post-ERCP (%4): Retrospektif çalışmalarda %1 olup, prospektif çalışmalarda en azından %5 oranında risk olduğu gösterilmiştir (12). Bu olgularda da pankreatit gelişiminin nedeni pankreatik kanala reflü, obstruksiyon ve duktal
hipertansiyon gibi gözükmektedir. Yalnızca sfinkterotomi yapılan olgularda pankreatitin bu sıklıkta görülmediği akılda tutulmalıdır. ERCP’nin özellikle şiddetli pankreatit olgularında tıkayıcı patolojinin bertaraf edilmesi için erken dönemde etkin olarak kullanıldığı ve her ne kadar girişimsel de olsa, cerrahi travmayla asla karşılaştırılamayacak ölçüde minör bir morbidite ve mortalite yükünün olduğu unutulmamalıdır.
4) Travma (%1.5): Abdominal travma, %17 vakada amilaz ve lipaz seviyelerinde artışa, %5 oranında da AP’e neden olur. Genelde penetre travmalar da (bıçak, kurşun v.s), künt travmalara göre daha sık oluşur (12). Künt travmalar, pankreasda ezilmeye ve duktal hasara yol açar.
5) İlaçlar (%1.4): Genelde hafif AP tablosu oluşturur. Kesin AP yapan ilaçlar: azotiopürin, sulfonamidler, sulindak, valproik asit, didanosine, metildopa, östrojen, furosemid, 6-merkaptopürin, pentamidin, 5-ASA bileşikleri bileşikleri, kortikosteroidler, octreotid bu grup da yer alan ilaçlardır. Muhtemel ilaçlar ise: Klortiazid, hidroklorotiazid, methandienon, metronidazol, nitrofurantoin, fenformin, piroksikam, prokainamid, colaspase, klortalidon, kemoterapötik ilaçlar (asparaginaz gibi), simetidin, sisplatin, cytosine arabinoside, difenoksilat ve etakrinik asit (12, 19, 20).
6) İnfeksiyon: Birçok infeksiyon, AP’e neden olur ve genelde hafif seyirlidir. Viral sebepler (kabakulak, EBV, coxsackie virusu, echo viruslar, varisella zoster ve kızamık virusu), bakteriyel sebepler (mycoplazma pnömoni, salmonella, campylobacter ve mycobacterium tüberkülozis) AP’e neden olur. Ascariazis yumurtalarının duodenal papilladan geçmesi de AP’e neden olabilir. AIDS’de de AP oluşabilir, bu genelde fırsatçı enfeksiyonlara bağlıdır (12).
7) Herediter Pankreatitis (%<1.4): Katyonik tripsinojen gen mutasyonuna neden olan, otozomal dominat hastalık ile beraberdir. Eğer yeterli miktarda mutant enzim intrasellüler olarak aktive olursa, aktive katyonik tripsin, AP’de trigger rolü oynar (21).
8) Hiperkalsemi (%<1): Hiperkalsemiye neden olan hiperparatroidizm, aşırı doz Vit D alınımı, familial hipokalsiürik hiperkalsemi, TPN v.s gibi durumlar sonucunda, kalsiyum taşlarının pankreasta intraduktal presipitasyonu, kalsiyumun
bazı pankreas enzimlerini aktif hale getirmesi ve asiner hücrelerde sentez ve sekresyon fazındaki etkileri sonucu pankreatit gelişir (22).
9) Pankreasde gelişme anormalikleri (%<1): Pankreatik divisium ve anular pankreas, bu grubta yer alır
10) Hipertrigliseridemi (%<1): Serum trigliserid seviyesi 1000 mgr/dl’i geçince görülebilir. AP, genelde, Tip 1 ve Tip V hiperlipidemi ile birliktedir (12).
11) Tümör (%<1): Pankreatik kanalın pankreatik duktal karsinoma, ampuller karsinoma, kolanjiokarsinoma veya metastatik tümörlerinde, obstrüksiyonu sonucu oluşabilir.
12) Toksinler (%<1): Organofosfor insektisidler, pankreasın ekzokrin sekresyonunda, aşırı stimülasyona neden olarak AP oluşturabilir.
13) Postoperatif sebepler (%<1): Bazı cerrahi işlemler sonucu oluşabilir. Safra yolları, özellikle Oddi sfinkteri üzerinde yapılan ameliyatlar. Kolesistektomi sonrası görülen akut pankreatit ataklarının nedeni, büyük olasılıkla ameliyat sırasında koledoğa kaçan ve oradan da Oddi sfinkterine giden bir taştır. Transduodenal sfinkterotomi veya sfinkteroplasti yapılan hastalarda, pankreas kanalının hasar görmesi veya tıkanması sıklıkla akut pankreatitte neden olmaktadır. Duodenal ülser nedeniyle subtotal gastrektomi ve Billroth 2 tipi gastrojejunostomilerin çok yapıldığı 1940–1960 yılları arasında, postoperatif pankreatitler oldukça yüksek oranda görülmekteydi. Gerek pankreasa penetre olmuş ülsere girişim, gerekse gastrojejunostomi kaçakları akut pankreatit nedeni olabilmekteydi. Splenektomi esnasında pankreas kuyruğunun yaralanması akut pankreatiti başlatan bir neden olabilir (23).
14) Biliyer sistemin gelişme anomalileri (%<1): Biliyer kanal kistlerinde, rekürrent AP oluşabilir.
15) Otoimmun pankreatit: Giderek daha iyi tanınan bir AP türüdür. Primer sklerojen kolanjitis, retroperitoneal fibrozis, Riedel thyroiditisi, primer biliyer siroz ve Sjögren sendromu gibi otoimmün bozukluklarda ortaya çıkar. Bu hastalarda IgG4 ve ANA artar. CT’de ve MR’da, pankreasda diffüz veya fokal genişleme, peripankreatik lenf bezlerinde büyüme, pankreasda kalsifikasyon, peripankreatik sıvı birikimi saptanır. MRCP’de pankreatik kanalda striktür, sklerozan kolanjitis benzeri
lezyonlar saptanır. EUS’da, pankreatik eko yapısında değişimle birlikte genişleme, fokal mass saptanır. ERCP’de distal koledokta striktür, intrahepatik kanallarda irregüler daralma, pankreatik kanalda diffüz irregüler daralma, proksimal pankreatik kanalda fokal striktür saptanır. Bazen pankreatik karsinoma ile karışabilir
16) İdiopatik (%10): Bazı bilinmeyenler, mutasyonlar ve genetik anormallikler, bu grubta yer alabilir.
2.8.3. Patogenezi
Akut pankreatit (AP), pankreas enzimlerinin pankreas içinde aktifleşmesi ve pankreas dokusunun kendisini sindirmesidir (otodijesyon). Normalde, pankreasın yaptığı ve depolayıp sekrete ettiği sindirim enzimleri, duodenuma inaktif olarak ulaşır. Duodenumda tripsinojen, brush border’da bulunan enterokinazlar aracılığıyla, aktif tripsine çevrilir. Tripsin de, diğer inaktif proteazları aktif hale çevirir. Bu proteolitik enzimler membrana bağlı organellerde saklanarak sitoplazmadan ayrı tutulur (24)
Klasik olarak AP patogenezinde bazı mekanizmalar ileri sürülmüştür. Bunlar, pankreas kanalının obstrüksiyonu, entero-pankreatik reflü ve intrasellüler proteazların aktivasyonudur. Akut pankreatit patogenezinde ilk basamak, asiner hücreler içinde tripsinojenin tripsine çevrilmesidir (8,25). Bu olayda, pankreatik katepsin B rol oynar. İnvitro ortamda pankreatik katepsin B’nin tam inhibisyonu, tripsinojen aktivasyonunu engeller. Tripsin, proenzimlerin (tripsinojen, elestaz, fosfolipaz A2, kallikrein ve karboksipeptidazların inaktif prekürsörleri) dönüşümünü katalize eder, ayrıca, kinin ve kompleman sistemlerini de aktive eder. Aktif enzimler, pankreasda interstisyel aralığa, peritona ve bazen damarların içine geçer, pankreasda otodijesyon başlar ve daha fazla aktif enzimlerin salınımına neden olur. Normalde az miktarda tripsinojen spontan olarak pankreas içinde aktive olur, fakat intrapankreatik mekanizmalar aktif tripsini ortamdan uzaklaştırır. PSTI (pankreatik sekretuvar tripsin inhibitörü) tripsin aktivitesinin %20’sini inaktifleyip bağlar. Tripsini ortamdan uzaklaştıran diğer mekanizmalar, mezotripsin, enzim Y ve tripsin’in kendisidir. Pankreas, ayrıca, alfa-1-antitripsin, alfa-2- makroglobulin gibi nonspesifik antiproteazları içerir. Deneysel pankreatitde, tripsinin aktivasyonu 10 dak. içinde oluşur ve aşırı miktarda tripsin ve artmış TAP (tripsinojen aktive edici peptid)
pankreas içinde birikir. Plazma, idrar ve assitteki TAP konsantrasyonu, pankreatik inflamatuvar cevap ile korelasyon gösterir, en yüksek değerler asiner hücre nekrozu ve intrapankreatik kanamada saptanır.
AP’de tripsinojen aktivasyonunda 2 mekanizma rol oynamaktadır. 1) co-lokalizasyon teorisi 2) tripsinojenin otoaktivasyonu. Co-co-lokalizasyon teorisinde, intraasiner hücrelerde sindirim enzimlerinin aktivasyonu, lizozomal enzimlerle (cathepsin B) başlatılmaktadır. Çünkü deney hayvanlarında yapılan çalışmalarda, lizozomal enzimin ilavesi sindirim enzimlerini aktive etmekte, katepsin B veya tripsinin inhibisyonu, tripsinojen aktivasyonunu engellemektedir. İkinci teori; tripsinojen aktivasyonu normalde düşük pH’da oluşur ve sekretuvar blok oluştuğunda patolojik hale dönüşür. PSTI (pankreatik sekretuvar tripsin inhibitörü), ki yeni adı SPINK1 (serine proteaz inhibitör, Kazal tip 1), tripsin aktivitesi düşük olunca, SPINK1 tripsini inhibe eder, tripsin ve diğer enzimlerin pankreas dokusu içinde aşırı otoaktivasyonunu engeller. Aşırı tripsinojen otoaktivasyonunda, SPINK1 inhibitör kapasitesi bozguna uğramakta ve tripsin aktivitesi artmaktadır. Normalde toplumda %2 oranında SPINK1 mutasyonları bulunmaktadır. SPINK1 mutasyonları, özellikle, familyal ve kronik pankreatitle daha yakından ilgilidir. Ayrıca, son zamanlarda prematüre tripsin aktivasyonunun, akut pankreatitte önemli rol oynadığı ileri sürülmektedir.
Bu bulgulara göre, AP’de erken dönemlerde, pankreas içinde uygunsuz ve prematüre bir şekilde tripsinojenin tripsine aktivasyonu olmakta, sonuçta peritona, plazma ve idrara TAP salınımı olmaktadır. Böylece, plazma TAP konsantrasyonu, AP’de en iyi ve erken markerdır. TAP, 7-10 aminoasitli bir peptid olup, hızlı bir şekilde idrara geçer, bu yüzden semptomların başlamasından sonraki ilk 24-48 saatte anlamlıdır (24).
Safra taşı ile ilgili akut pankreatit patogenezi, tam olarak bilinmemektedir. Safra taşı pankreatitisini başlatan faktörler, safranın pankreas kanalına reflüsü veya pankreatik kanalın taş veya ödeme sekonder olarak obstrüksiyonu gibi faktörlerdir (26). Ortak kanal durumunda, safra taşı duodenal papillayı tıkar.
Ayrıca, Oddi sfinkteri disfonksiyonunda (hasarı), safra, pankreatik kanala reflü olmakta ve AP oluşmaktadır. Safra taşına bağlı pankreatitisde popüler bir görüşe göre, distal koledokta impakt olmuş taş, pankreatik kanalı tıkar ve pankreatik kanal basıncını artırır. Bu süretle, pankreatik kanal ve asiner hücrelerde hasar yapar. Benzer şekilde, pankreatik kanalın bağlanması, şiddetli nekrotizan pankreatitise neden olur. Duktal sistemin dekompresyonu ise, 3 gün içinde şiddetli inflamasyon ve asiner hücre nekrozisinin ilerlemesini önler (27).
Burada, enzimden zengin pankreas sekresyonu pankreas içine kaçar. Asiner hücrede ayrı kompartmanlarda bulunan lizozomal enzimler (hidrolazlar: katepsin B) ile sindirim enzimleri karşı karşıya gelir (co-lokalizasyon). Lizozomal enzim bulunduran organellerin bütünlüğünün bozulması veya hücre içi protein trafiğinin aksaması veya her 2 enzimi ayrı ayrı bulunduran organellerin füzyonu sonucu oluşur. İnaktif proteazları aktifleştirme yeteneği olan katepsin B sayesinde, proteazlar aktifleşir ve doku hasarı başlar. Sonra, damar duvarı hasarı, kanama, ödem, peripankreatik yağ nekrozu gelişir. Bunu inflamasyon süreci takip eder. İnflamasyon alanına inflamatuvar hücreler yerleşir, çeşitli inflamatuvar mediatörler salınır (IL-1, 6, 8, TNF-alfa, PAF) ve bir hücre yıkım süreci potansiyelize edilir. 6 ve IL-8 seviyeleri, pankreatitisin şiddeti ile korelasyon gösterir. Ayrıca, oksidatif stress (serbest oksijen radikalleri) pankreas mikrosirkülasyonun bozulması, hasar ve nekrozu artırır. Açığa çıkan lipaz ve ko-lipaz, intersitisyel aralığa geçerek yağ
nekrozuna neden olur. TNF salınımı, konakçıda sistemik komplikasyonlara neden olur. TNF, kapiller sızıntıya, daha sonra ateş ve serbest oksijen radikallerinin salınımına neden olur. Serbest oksijen radikallerinin dolaşıma geçerek, akciğer hasarı ve ARDS’e neden olur. AP patofizyolojisi; a) mikrosirkülatuvar hasar, b) lökosit kemoatraksiyonu, c) sitokin salınımı, d) oksidatif stress ve e) bakteriyel translokasyondan oluşur. Pankreatik enzimlerin salınımı, vasküler endotel, interstisyum ve asiner hücrelerde hasar yapar. Vazokonstriksiyon, kapiller staz, oksijen satürasyonunda azalma, progresif iskemi, gibi mikrosirkülatuvar değişiklikler, experimental pankreatitisde erken dönemde oluşur.
Bu anormallikler, vasküler permeabilite artışına ve pankreas bezinde ödeme
neden olur. Vasküler hasar, lokal mikrosirkulatuvar değişikliklere ve pankreatik hasarın artmasına neden olur. Hasarlı pankreatik dokunun reperfüzyonu, serbest oksijen radikallerinin ve inflamatuvar sitokinlerin dolaşıma salınımına, bu da daha fazla hasara neden olmaktadır.İnsan veya hayvan pankreatitisin erken safhasında, kompleman aktivasyonu ve sonradan ortaya çıkan C5a salınımı, PMN lökositler veya makrofajların olaya katılması, önemli rol oynar. Th1 tip CD4+ T hücreler erken safhada makrofaj aktivasyonunu indükler. Aktif granülosit ve makrofajlar, proinflamatuvar sitokinleri (IL-1, IL-6, IL-8, TNF-alfa), araşidonik asit metabolitleri (prostaglandinler, PAF ve lökotrienler), proteolitik ve lipolitik enzimler ve reaktif oksijen metabolitleri salgılar (28, 29). Bu maddeler, pankreatik mikrosirkülasyonu etkiler ve vasküler permeabiliteyi artırıp, trombozis, kanama ve pankreatik nekroza neden olur (Resim 2, 3). Pankreatik hasarın erken dönemlerinde, proinflamatuvar
sitokinler (IL-1, IL-6, IL-8 ve TNF-alfa) doku makrofajlarından salınır, nötrofil aktivasyonu makrofajlardan ve endoteliyal hücrelerden IL-8 salınımı ve endoteliyal hücrelerden PAF salınımı sonucu oluşur. Geç dönemlerde, T-helper hücrelerden sitokin salınımı (IL-2, IFN-alfa) inflamatuvar cevaba katılır (Şekil 8).
Barsaklardan bakterinin sistemik dolaşıma translokasyonu, normalde olmamakta ve immünolojik, bakteriolojik ve morfolojik komponentleri olan kompleks bir bariyer, buna engel olmaktadır (30). Akut pankreatitis esnasında bu bariyer kırılmakta, böylece lokal ve sistemik infeksiyonlara neden olmaktadır. Enterik bakterilerin barsak bariyerinden penetrasyonu, hipovolemi ve barsaklarda pankraeatitise bağlı arteryovenöz şantların olmasına sekonder gelişir. Gerçekten, deney hayvanlarında oluşturulan pankreatitisde, luminal E. coli, mezenterik lenf bezleri ve uzak organlara geçebilmektedir.
Genelde safra taşlı hastaların %3-7’sinde AP gelişmektedir. ABD’de safra taşları %3-35 oranında AP’e neden olmaktadır. Daha ziyade 5 mm’den küçük taşlar AP’e sebep olmaktadır. Safra taşına bağlı AP gelişme riski erkeklerde kadınlara göre daha fazladır. Fakat safra taşına bağlı AP, kadınlarda sıktır. Çünkü safra taşı kadınlarda daha sıktır. Kolesistektomi ve koledok taşlarının alınması, AP insidansını azaltmaktadır. AP’deki doku hasarı, proteolizis (tripsin ve kimotripsin aracılığyla), lipolizis (lipaz ve fosfolipaz aracılığıyla) ve damar duvarı harabiyeti (elastaz ile) sonucu oluşmaktadır. AP, ekzokrin pankreas bezinin harabiyetidir.
Deneysel olarak, pankreatik kanala, enfekte veya pankreatik enzimlerle karışık safra reflüsü oluşturulduğunda (entero-pankreatik reflü), pankreatik hasara neden olmaktadır. Safra ve pankreatik enzim karışımı, ana pankreatik kanalın geçirgenliğini artırmakta ve lokal pankreatik parenkimal inflamasyona neden olmaktadır. Ortak kanal teorisi, biraz problematiktir, çünkü pankreas kanal basıncı değişmez
şekilde, safra kanalı basıncından fazladır. Duodenumdan safra reflüsü, cerrahi sfinkteroplasti veya endoskopik sfinkterotomi yapılmış vakalarda kolayca pankreatitis oluşturmamaktadır. Buna rağmen, pankreatik kanalın bağlanması ve tümörleri her zaman AP’e neden olmamaktadır.
Deneysel olarak, nekrotik pankreatik dokulardan salınan bazı faktörler, intakt pankreatik asiner hücrelerini harab etmektedir. Bu faktörlerden en önemlisi, lizolesitin’dir. Lizolesitin, pankreatik PLA2 (fosfolipaz A2)’nin aktivasyonu sonucu oluşur. Yani, tripsin ve PLA2, akut nekrotizan pankraetitte önemli rol oynamaktadır.
Alkol, ABD’de %30 oranında AP’e neden olmaktadır. Günde 100 gr’dan fazla ve uzun yıllar alkol kullanımı, pankreasda protein plaklarının oluşumuna, bu da histolojik değişikliklere neden olur. Pankreatik enzimlerin prematüre aktivasyonundan dolayı, alkol kullanımından 3-5 yıl sonra ilk AP atağı başlar. Alkol genelde kronik pankreatite neden olmaktadır. Kronik alkolik hastalarda akut pankreatit atağı olsa bile, altta kronik hastalık yatmaktadır. Az bir kısım hastada alkole bağlı AP, alkol kullanımına devam edilse bile, kronikleşme göstermemektedir. Kronik alkolik hastaların yaklaşık %10’unda AP atağı gelişir. Alkol kullanımından 10-20 yıl sonra kronik pankreatit gelişmektedir. Alkole bağlı AP patogenezi net olarak belli değildir. Oddi sfinkterinde relaksasyon ile birlikte duodenal muhtevanın pankreas kanalı içine reflüsü, Oddi sfinkterinde spazm ile birlikte safranın pankreas kanalına geçmesi, pankreas kanalı permeabilitesinin artması, aniden büyük miktarlarda enzim salınımı, gibi hipotezler mevcuttur. Alkol, pankreas enzimleri aracılığıyla, lizozomal ve sindirim enzimlerinin sentezini artırır. Diğer bir teori de, kronik alkol alınımı pankreatik sıvıda protein konsantrasyonunu artırır, bu da küçük kanalları tıkar ve etanol veya metabolitlerinden birisi direkt olarak asiner hücrelerde hasar yapar (toksik-metabolik hipotez). Neden bazı insanlarda alkoloik KC hastalığı, alkolik nöropati veya alkolle ilişkili diğer hastalıklar gelişirken, kronik alkoliklerin sadece %10’undan azında alkolik pankreatitis gelişmektedir? Muhtemelen yeni bulunan, CFTR, PRSS1 (katyonik tripsinojen) ve SPINK1’de önemli gen mutasyonlarının saptanması, bunu açıklayabilmektedir (24).
Herediter pankreatitis’de, genetik mutasyonlar (katyonik trisinojen gen) mevcuttur (31). Mutant tripsin, lizise karşı dirençlidir. Böylece tripsin, aktif olarak kalmakta ve pankreasda otodijesyona neden olmakta, akut pankreatit ataklarına
neden olmaktadır. Bu hastalarda, ileriki yıllarda önemli derecede pankreas kanseri gelişme riski fazladır. Akut pankreatitde diğer bir moleküler patojenik mekanizma, kistik fibrozis transmembran conductan regülatör (CFTR) gendeki mutasyondur (32). CFTR mutasyonu, idiopatik kronik pankreatit ve akut rekkürant pankreatitte, en azından bir allelde herhangi bir yerde %2-37 oranında saptanmaktadır. Benzer şekilde pankreatik divisiumla birlikte olan rekkürant akut pankreatitde, aynı oranlar saptanır. Buna karşılık, akut biliyer pankreatitis ve kronik alkolik pankreatitisde CFTR mutasyon sıklığı (ort. %0-5), genel populasyona göre fazla değildir. CFTR mutasyonlarının, nasıl akut pankreatitise neden olduğu tam olarak bilinmemektedir. Muhtemelen, mutasyonlar daha fazla konsantre asidik pankreatik sıvısı oluşturmakta, bu da duktal obstrüksiyona veya asiner hücre fonksiyon bozukluğuna neden olmaktadır. CFTR mutasyonlarının diagnostik, prognostik ve terapötik anlamı tam olarak bilinmemektedir.
Hipertrigliseridemi’de, serum TG seviyesinin 1000 mg/dl’nin yukarısında olması, AP atağını presipite eder. 500-1000 mg arasında olsa bile, bazen, AP atağını indükliyebilir. Muhtemelen, serbest yağ asitlerinin salınımı, pankreatik asiner hücrelerde veya kapiller endotelde hasar yapar. Hipertrigliseridemi, %1-4 oranında AP’e neden olur. Bu ilişki daha ziyade, çocuklarda herediter lipoprotein metabolizması bozukluğu ve şiddetli hipertrigliseridemide görülür. Bu çocuklar, homozigot lipoprotein lipaz eksikliği veya APO-CII eksikliğine sahiptir.
Hiperkalsemide, kalsiyumun pankreas kanalında Ca birikimi ve pankreatik parenkimada kalsiyumun tripsinojeni aktifleştirmesi rol oynar. Primer hiperparatroidizmde % 0.5 oranında AP gelişir. Diğer hiperkalsemi yapan durumlarda da AP nadiren gelişebilir. İlaçlar, allerjik reaksiyon veya direkt toksik etki ile (diüretikler, sulfonamidler) oluşur. Steroid ile ilişki zayıftır. ACE inhibitörlerine bağlı pankreatitis, pankreasda anjioödem sonucu oluşur. Otoimmün pankreatitis son zamanlarda tanımlanan, otoimmün kökenli bir hastalık olup, serum gama globülin veya IgG düzeyinde artma, otoantikor mevcudiyeti (ANA, AMA, RF), lenfoplazmositik infiltrasyonla birlikte fibrotik değişiklikler, pankreasda diffüz büyüme, ana pankreatik kanalda diffüz irregüler daralma ve steroid tedavisine yanıt ile karakterizedir. Bazen pankreatik karsinoma ile karışabilir.
2.8.4. Patofizyoloji
Akut pankreatitis (AP), pankreas dokusunda ödem, inflamasyon, değişik derecede hücre hasarı ve ölüm, apoptozis, nekrozis ve hücresel ultrastriktürel yapıda bozukluk gibi bir çok patobiyolojik olay oluşur (33). Bu olayları 3 aşamada incelemek gerekir.
a) Pankreatik asiner hücrelerdeki olaylar: Uzun yıllar pankreatiti başlatan major patolojik olay, proenzim tripsinojenin aktif tripsine dönüşümünden sorumlu olan, sindirim enzimlerinin uygunsuz intrasellüler proteolitik aktivasyonu idi. İntrasellüler enzim aktivasyonu için, asiner hücre içinde düşük pH’a ihtiyaç vardır. Deney hayvanlarında, yüksek doz serulein veya karbakol ile tedavi, sindirim enzimlerinin proteolitik aktivasyonuna neden olur. Bu olaya, vakuolar ATPase ilave olur, asiner hücrelerdeki vakuolar ATPase, membran kompartmanlarına transloke olur. Bu translokasyonlar, enzimleri aktive eder, asidifikasyonuna neden olur. Yani, vakuolar ATPase’ın inhibitörleri, sindirim enzim aktivasyonunu engeller. Vakuolar ATPase, sindirim sistemi aktivasyonunda anahtar rolü oynar, enzim aktivasyonu da, AP’deki birçok mekanizmada önemli rol oynar.
Tripsinin pankreasdaki etkilerinden birisi, PAR-2 (protease activated receptor) aktive etmek olup, PAR ailesinin 4 üyesi vardır. PAR-2, tripsin tarafından aktive edilir. Farelerde ve ratlarda PAR-2’nin farmakolojik aktivasyonu, farelerde genetik olarak PAR-2’nin delesyonu, tripsin aracılı PAR-2 aktivasyonuna neden olur. Pankreasda patolojinin şiddetinin azalmasına neden olur. Yani PAR-2’nin protektif etkisi vardır.
Tripsinin diğer bir etkisi, ICAM-1’i upregüle eder. ICAM-1 intravasküler alandan lökositlerin inflame alana transportunda anahtar rolü oynar. ICAM-1’in upregülasyonu, dokularda lökosit infiltrasyonunda artışa neden olur, ayrıca pankreatik mikrosirkülasyonda perfüzyonun azalmasına neden olur. Asiner hücrelerden küçük miktarlarda aktif tripsin salınımı, pankreasda daha az, daha fazla tripsin salınımı ise pankreas ve diğer dokularda daha fazla harabiyete neden olur.
Pankreatik parenkimal hücrelerde hücre hasarı/hücre ölümünden sorumlu aracı, intrasellüler Ca++ seviyesidir. Kalıcı ve potansiyel hasar, Ca++ seviyesinde artma ile birliktedir. Konjuge safra asitlerinin, spesifik transportörler ile hücreye girmesi,
AP’e neden olur. Safra asitlerinin intrasellüler Ca++ etkisi, inositol 1,4,5-trifosfat reseptör aracılı Ca++ salınımının aktivasyonu ve endosarkoplazmik reticulum Ca++ ATPase inhibisyonu ile regüle edilir (SERCA). Artmış intrasellüler Ca++ seviyeleri, intrasellüler sindirim sisteminin enzimlerinin aktivasyonu ile beraber olup, asiner hücrelerde mitokondrial depolirazisyona, hücre hasarına ve hücre ölümünde aktivasyona neden olur. Mitokondrialara etki ile ATP yapımı azalır, hücre nekroza yatkın hale gelir. Safra asitleri, plazma membran katyonik kanalları etkiliyerek, hücreye girişi depolarize eder, asinuslarda apikal lümeninde Clˉ sekresyonunu azaltır.
Enzim sinyal sistem (fosfatidilinositol 3-kinase), agonist stimülasyon esnasında SERCA’yı inhibe eder. Agonist stimülasyon esnasında SERCA inhibisyonu, büyük miktarda ve daha uzamış, artmış intrasellüler Ca++ konsantrasyonuna neden olur. Gerçekten, fosfatidilinositol 3-kinaz inhibisyonu ve bu enzimin spesifik izoformlarında genetik delesyon, experimental pankreatite neden olur. Ayrıca, asiner hücre nüklear faktör kB, protein kinaz C (δ ve ε) spesifik izoformları ile aktive edilir. Bu olaylar ne kadar basit görünse de, AP mekanizmasında asiner hücrelerde erken patobiyolojik olaylar, inflamatuar olaylar ve hücre ölümünde merkezi rol oynar (24).
b) Pankreatik vasküler cevap: Pankreas dokusundaki iskemik olaylar, vasküler değişikliklere ve AP’e neden olur. Kontrast CT ile yapılan çalışmalarda, intrapankreatik ve extrapankreatik vazospazmda aşırı artma saptanmıştır. Anjiografi ve kontrast CT ile elde edilen vazospazm bulguları, küçük ve orta çaplı damarlarda saptanmış ve pankreasda perfüzyonun azalmasına neden olur. Mortalite, vazospazmın derecesi ile orantılı bulunmuştur (33). Başka bir çalışmada, NO sentazın izoformu (NOS), endotelial NOS, experimental pankreatitisde, aktif bulunmuştur. eNOS aktivasyonu, pankreasda kan akımında artmaya neden olmuştur. eNOS aktivasyonu yokluğunda, artmış kan akımı bloke edilir, pankreatitis şiddeti artar. Bu çalışmalar, AP’de vasküler regülasyonun önemli olduğunu gösterir.
c) AP’de nöral katılım: AP’de olaya santral ve periferal nöral mekanizmalar iştirak eder. Bir çalışmada, ratlarda serulein’e bağlı pankreatitde, santral intrasisternal TRH uygulanması, hastalığın şiddetinde düzelme sağlamıştır. Bu etki, İ.V yolla TRH verilmesinde sağlanmamıştır. TRH’nın santral uygulanması, NO’e bağlı mekanizmaların etkisiyle pankreatik kan akımının artmasına neden olur.
Muhtemelen santral mekanizmalar, efferent vagus ve pankreatik eNOS aracılığı ile pankreatitisin şiddetini regüle eder.
Pankreatitisde nöral santral mekanizmalar, ödem ve inflamatuvar cevabın oluşmasında da rol oynar. İmmün modülatuar etkili nörotransmitter vazoaktif intestinal peptidler, VİP’in 2 subtip reseptörünü (VPAC1-R ve VPAC2-R (R: reseptör) etkiler. Nörojenik mekanizmalar, ödemden de sorumludur. Sensorial nöronların stimülasyonu, substans P’nin salınımına ve pankreatik dolaşımda postkapiller venüler nörokinin 1 reseptörlerine bağlanmaya, sonuçta inflamatuar hücreleri takiben interstisyel boşluğa plazma extravazasyonuna, ödeme neden olur. TRVP-1 (transient receptor potential vanilloid), bu yolun afferent (veya santral) komponenti için gereklidir. Capsaicin, bu reseptörün agonistidir, oysa capsazepine bu yolun antagonisti dir. Deney hayvanlarında seruleine bağlı pankreatitde, capsaicin verilmesi, pankreatik ödeme neden olurken, capsazepine verilmesi ödem ve inflamatuar infiltrasyonu azaltmaktadır.
Alkolik Pankreatitisin Mekanizması: Alkol, akut ve kronik pankreatitin major sebebidir. Mekanizma çok az bilinmektedir. Sadece alkol alışkanlığı olanların %15’inde pankreatitis gelişmektedir. Alkol, pankreas hastalığı oluşumunda, sensitize edici faktör olarak etki etmektedir. Bu yüzden, genetik ve çevresel faktörler de, AP gelişiminde rol oynar. Farelerde yapılan çalışmalarda, alkol kullanımı viral pankreatitisi stimüle eder. Farelerde human coxsackie virus B3, pankreatitise neden olur. Pankreatitisin şiddeti, verilen virus dozu ile ilgilidir. Daha önemlisi, düşük doz viral infeksiyon minimal hasar yaparken, ancak alkol verilen farelerde şiddetli pankreatite neden olur. Aynı şekilde alkol verilen farelerde rejenerasyonda gecikme olurken, alkol verilmeyenlerde daha kolay rejenerasyon oluşur.
Otoimmün Pankreatitis: Giderek daha iyi tanınan bir AP türüdür. Primer sklerojen kolanjitis, retroperitoneal fibrozis, Riedel thyroiditisi, primer biliyer siroz ve Sjögren sendromu gibi otoimmün bozukluklarda ortaya çıkar. Bu otoimmün hastalıklarda, Japonya’da %35-56, Avrupa çalışmalarında %16 oranında ortaya çıkar. Bu hastalarda IgG4 ve ANA artar. CT’de ve MR’da, pankreasda diffüz veya fokal genişleme, peripankreatik lenf bezlerinde büyüme, pankreasda kalsifikasyon, peripankreatik sıvı birikimi saptanır. MRCP’de pankreatik kanalda striktür, sklerozan kolanjitis benzeri lezyonlar saptanır. EUS’da, pankreatik eko yapısında değişimle
birlikte genişleme, fokal mass saptanır. ERCP’de distal koledokta striktür, intrahepatik kanallarda irregüler daralma, pankreatik kanalda diffüz irregüler daralma, proksimal pankreatik kanalda fokal striktür saptanır. Mikroskopik incelemede, periduktal alanda lenfoplazmositik hücre infiltrasyonu bulunur. Bu, kronik pankreatitte bulunmaz. Ayrıca, periduktal fibrozis ve venulitis bulunur. %40 oranında granülositik epitelyal lezyon bulunur. Bu vakalar, yüksek oranda inflamatuar barsak hastalığı ile birliktedir.Steroid tedavisine iyi cevap verirler. 30-40 mgr/gün başlanır. Her 1-2 haftada bir, 5 mgr/gün azaltılır. Tedavi öncesi, tedavide ve tedavi sonrası IgG4 seviyeleri ölçülür. Tedaviye cevap veren vakalarda, CT’de pankreas büyümesinde normale dönüş saptanır. IgG4 seviyelerinde düşme saptanır. Biliyer ve pankreatik kanal lezyonu olanlarda IgG4 seviyelerinde düşme olmayabilir (24).
Tablo 3: 48 saatte şiddetli AP atağı belirleyicileri (12).
_____________________________________________________________ Başlangıç Klinik olarak şiddetli tablonun bulunması
Vücut kitle indeksi (BMI) >30 olması
PA akciğer grafisinde plevral efüzyon varlığı APACHE II skoru > 8 olması
24 saat sonra Klinik olarak şiddetli tablonun bulunması APACHE II skoru > 8 olması
Glasgow skoru 3 veya daha fazla
Devam eden organ yetmezliği özellikle multipl CRP > 150 mgr/dl
48 saat sonra Klinik olarak şiddetli tablonun bulunması Glasgow skoru > 3 veya daha fazla CRP > 150 mgr/dl olması
48 saat devam eden organ yetmezliği
Multipl veya progresif organ yetmezliği bulunması
2.8.5. Klinik
AP, hafif (%70-80) veya şiddetli (%20-30) olabilir (34, 35). Hafif AP, minimal organ disfonksiyonu ve tam iyileşme ile karakterizedir. Şiddetli AP, pankreas da nekroz ile birlikte olup, organ yetmezliği ve/veya lokal komplikasyonlar ile birliktedir. AP’de ana semptom aniden başlayan karın ağrısıdır. Genelde, daimi ve sıkıntı verici vasıfta, üst karında, bazen epigastriumda, sol veya sağ tarafa yayılabilir. Ağır bir ziyafet sonrası veya aşırı yemek sonrası başlar. Ağrı süresi değişik olup, genelde bir günden fazladır. Yemek yeme ile ve süpin pozisyonda uzanmakla artar. Sol yan tarafa yatmakla, açlıkta, ağrı azalır. Ağrıya, iştahsızlık, bulantı, kusma v.s eşlik eder. Hafif pankreatitli olgularda ağrı genellikle 1-3 gün devam eder ve daha uzun süren ağrı pankreatitin ciddi olduğunu gösteren önemli bir bulgudur. Pankreasın retroperitoneal yerleşimi nedeniyle başlangıçta şiddetli ağrıya rağmen, abdominal hassasiyet ve defans yoktur. Atipik AP, bazen yanlış teşhis edilir. AP vakalarında en azından %80 vakada tanı konulmalıdır.
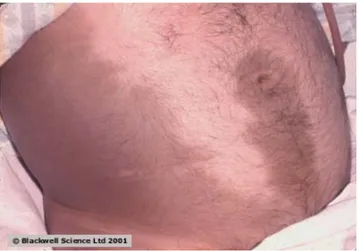
FM: Hastalığın şiddetine göre farklı bulgular oluşur. Ateş (%76), taşikardi (%65), abdominal hassasiyet ve distansiyon, barsak seslerinde hipoaktifleşme, az oranda sarılık (%28) saptanır. %10 vakada görülen dispne, inflamasyon sonucu diafragma irritasyonu veya respiratuvar distress sendromuna bağlıdır. Şiddetli vakalarda, %10 vakada hemodinamik instabilite, %5 vakada hematemez-melena saptanır. Şiddetli nekrotizan pankreatitde, az bir oran da Cullen belirtisi (göbek etrafında hemoperitoneum sonrası mavimsi renk), Gray-Turner belirtisi (retroperitoneal kan birikimi) oluşabilir (Şekil 10). Fokal subkutanöz yağ nekrozu sonucu eritematöz deri nodülleri saptanabilir. Nadiren, şiddetli pankreatitlerde Purtscher retinopati (retinada iskemik hasar sonrası, retina damarlarındaki hücrelerinin aglutinasyonu ve kompleman aktivasyonu sonucu) oluşabilir. Geçici veya kalıcı körlüğe neden olabilir.
Şekil 10: Akut pankreatitisde Gray-Turner ve Cullen arazı
2.8.6. Tanı
Anamnez ve fizik muayene sonucu akut pankreatit tanısı genellikle akla gelse de birçok hastalıkta benzer bulgular vardır. Bu nedenle tanıyı doğrulamak için labaratuvar testleri ve abdominal görüntüleme yöntemleri gereklidir. Tanıda kullanılan yöntemler şunlardır:
2.8.6.1. Laboratuvar
Amilaz: Akut pankreatit tanısında en çok kullanılan testtir. Hassasiyeti %75-92 ve özgünlüğü %20-60’dır. Amilaz ilk 24 saatte yükselir, 3-5 gün yüksek kalabilir (36). Daha uzun süreli yükseklik psödokist veya pankreatik apse lehinedir. Amilaz düzeyi ile hastalığın prognozu arasında bir ilişki yoktur. Alkole bağlı formlarda amilaz düzeyi normal olabileceği gibi hipertrigliseridemili hastalarda normal ya da düşük bulunabilir. Amilaz tayini ucuz ve pratik bir teknik olmasına rağmen pankreas dokusuna özgünlüğü zayıftır. Pankreas dışında tükrük bezi, over, meme, akciğer, karaciğer ve ince barsak gibi organlarda da amilaz bulunmaktadır. Akut pankreatit dışında hiperamilazemi ye neden olan birçok hastalık vardır
Akut pankreatitli hastalarda serum amilazında önce yükselen idrar amilazı, 10 güne kadar yüksek kalabildiğinden değerli bir bulgudur. Daha hassas ve spesifik belirleyiciler araştırıldığında idrar amilazı ve amilaz klirensininn serum klirensine oranı bu şeçeneklerden birisi olarak gündeme gelmiştir. Hastaların periton ve plevral sıvılarında amilaz değeri seruma göre 4-5 kat yüksek olabilir (37).
Tablo 4 : Hiperamilazemi ve hiperamilazüri nedenleri
___________________________________________________________________ Pankreatik hastalıklar 1. Pankreatit ve komplikasyonları a. Pankreatik psödokist b. Pankreatik asit c. Pankreatik apse 2. Pankreatik travma
3. Pankreatik karsinoma ve kronik duktal tıkanıklık Diğer abdominal hastalıklar
1. Bilyer sistem hastalıkları: kolesistit, koledokolitiyazis 2. İntraabdominal hastalıklar
a. Perfore veya penetre peptik ülser d. Peritonit
b. İntestinal obstrüksiyon veya enfarkt e. Aort anevrizması
c. Rüptüre ektopik gebelik f. Kronik karaciğer hastalığı g. Postoperatif hiperamilazemi
Pankreas dışı hastalıklar
1. Renal yetmezlik 5. Tümör hiperamilazemisi
2. Tükrük bezi hastalıkları a. Akciğer kanseri
a. Kabakulak b. Özefagus kanseri
b. Taşlar c. Meme ve over kanseri
c. Radyasyon sialoadeniti 6. Diyabetik ketoasidoz d. Maksillofasiyal cerrahi 7. Hamilelik
3. Renal transplantasyon 8. Yanıklar
4. İlaçlar 9. Makroamilazemi
Serum Lipazı: Pankreas vücuttaki lipazın ana kaynağı olması sebebiyle amilazdan daha güvenilirdir. Sensivitesi %85-100 oranındadır. Serum lipazı semptomların başlamasından 4-8 saat içinde yükselmeye başlar ve 8-14 gün sonrasında normale döner. Serum lipaz yüksekliği amilaz yüksekliğinden daha uzun süre yüksek kaldığı için klinik tanısı geç konan hastalarda daha yararlı bir parametredir (36).
KC enzimleri: Alkalen fosfataz, AST ve ALT seviyeleri, safra taşına bağlı pankreatitde bakılmalıdır. ALT seviyesinin 100 U/L olması, safra taşına bağlı pankreatitisi düşündürür.
CRP: İnflamasyona cevap olarak KC’de oluşturulur. İlk 24-48 saatte bakılmalıdır. CRP akut faz reaktanı olup, AP’e spesifik değildir. CRP’nin >150 mg/dl olması, şiddetli pankreatitisi düşündürür. Spesivitesi %73, sensitivitesi %71 olup, uzun süreli yükseklik, pankreas nekrozunu işaret edebilir (38).
Ca++, kolesterol ve trigliseridler: AP etyolojisi ve komplik asyonları açısından
bakılmalıdır. AP’li hastaların 1/3’ünde geçici hipokalsemi görülür. Şiddetli AP’de çok düşük seviyelerde de görülebilir (<7mg/dl). Tetani veya miyokard depresyonu nadiren görülür. Kalsiyumun düşmesi yağ nekrozu alanlarında sekestrasyonuna ya da gelişen hipoalbüminemiye bağlıdır. Ancak deiyonize kalsiyum da düşer. Bu nedenle yağ nekrozlarındaki sekestrasyon olayı tam olarak açıklayamaz (12).
Serum elektrolitler, BUN, kreatinin, glikoz: Elektrolit embalansı, böbrek yetmezliği ve pankreatik endokrin disfonksiyon açısından bakılır.
Kan sayımı: Htc değerinin %47’den fazla olması, nekrotizan pankreatit lehinedir. Lökositozis varlığı, inflamasyon veya infeksiyon lehinedir.
Diğer bazı göstergeler: TAP (trypsin activation peptide), polimorfonuklear elastaz, interleukin-6 ve fosfolipaz A2 gibi testler, rutinde pahallı ve her laboratuar laboratuarda olmaması nedeniyle, bazı özel durumlarda bakılmalıdır.
Arteryel kan gazı: Dispneik AP’li hastada bakılmalıdır. 2.8.6.2. Radyoloji ve diğer testler
PA Akciğer Grafisi: Plevral efüzyon, özellikle solda, diffüz infiltrasyon veya atelektazi saptanır.
Abdominal Radyografi: AP’de sınırlı bir role sahiptir. Batında serbest hava (perforasyon), duodenal C-loop’da hava, peripankreatik yapılarda iltihabi hasar sonucu sentinel loop ve cut-off belirtileri, pankreas lojunda kalsifikasyonlar (kronik
pankreatit lehine) saptanabilinir.
Abdominal USG: Faydalı bir başlangıç teşhis aracıdır. Hastalığın şiddetini yansıtmaz. Safra taşları, safra yolları ve pankreas yapısı hakkında bilgi verir. Sensitivitesi %70-80 civarındadır. Hafif AP’de pankreas dokusu normal olarak görülebilir. Genelde AP’de pankreasda diffüz genişleme, baş ve corpusda fokal genişleme, AP’deki lokal komplikasyonlar varsa saptanır. Doppler USG, venöz tromboz ve psödoanevrizma formasyonu gibi vasküler komplikasyonlar hakkında bilgi verir.
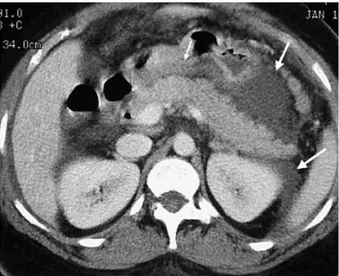
Abdominal CT: Kontrastlı CT, AP’i saptamada daha yararlıdır. Hafif pankreatitisde (özellikle yaşlılarda pankreatik mass düşünülmüyorsa) gerekmeyebilir. Semptomların başlamasından 72 saat sonra CT gerekmeyebilir. Şiddetli pankreatitis ve AP’in lokal komplikasyonlarını (psödokist, apse, nekrotik doku, venöz tromboz, psödoanevrizma ve kanama) göstermede oldukça başarılı başarılıdır. CT’de AP lehine tipik bulgular; pankreasda fokal veya diffüz genişleme, parenkimde heterojenite, pankreasın kenarlarında irregüler veya kaba kontur manzarası, peripankraetik yağ dokusunda bulanık görünüm, fasial yüzeylerde kalınlaşma, intraabdominal veya retroperitoneal sıvı koleksiyonları şeklindedir (Şekil 11, 12, 13). AP’de CT, Balthazar sınıflamasına göre (Şekil5) prognoz hakkında bilgi verir (39, 40). AP’den ölüm ve infeksiyon, Grade A ve B’de hiç yokken, Grade C-E arasnda ise yüksektir. Grade E’li hastalarda, infeksiyon şansı %50, ölüm ise %50 civarındadır. Spiral CT, pankreasın nekrozu ve yaygınlığı hakkında bilgi verir.
Şekil 11: AP’de CT’de pankreas başında nekrotik kitle mevcut.
Şekil 13: AP’de axial CT’de pankreas ve retroperitoneal dokuda ödem.
MR: CT’e mükemmel bir alternatif yöntemdir. Genelde CT’e benzer bulgular verir. MRCP: AP’de biliyer veya pankreatik yollarda obstrüksiyon saptandığında uygulanmalıdır. Her ne kadar ERCP kadar sensitif değilse de, noninvazif, güvenilir ve hızlı bir tanı metodudur.
EUS: Pankreatik ve biliyer kanallar hakkında bilgi verir. Şiddetli pankreatitisde, mikrolithiaziste ve biliyer çamur varlığını, ayrıca periampuller lezyonları gösterir. Rekkürent idiopatik pankreatitlerde, özel merkezlerde, sekretin-EUS uygulanması, papilla bölgesindeki outflowda obstrüksiyon vakalarında yararlı olabilir.
ERCP: Özellikle şiddetli biliyer (safra taşı) pankreatit ve beraberinde kolanjit bulunan vakalarda, erken ERCP oldukça güvenilir ve yararlıdır. Sfinkterotomi ile bilikte taş ekstraksiyonu yapılması, AP’nin şiddetinde, hastanede yatış süresinde, komplikasyon oranında ve mortalitede azalmaya neden olur. Şiddetli ve tekrarlayan AP’de ERCP uygulanması, mikrolithiazis, pankreatik divisium, annüler pankreas, periampuller duodenal divertikül, pankreatik kanalda striktür, ampuller tümör, intraduktal müsin salgılayan tümörler, koledokosel gibi patolojiler hakkında bilgi verir. CT önderliğinde aspirasyon biyopsisi: Şiddetli nekrotizan AP’de, infekte nekrozis ve steril nekrozun ayırıcı tanısında kullanılır. İnfeksiyon bulguları varsa CT’de düşük ekolu alanlardan aspirasyon yapılmalı, gerekirse haftada bir tekrarlanmalıdır. Alınan numune bir saat içinde gönderilmeli ve derhal işleme konulmalıdır. Alınan nümune, hemen kültür ve antibiyogram işlemine tabi tutulmalıdır. Eğer gram boyama bakteri
ve fungusu gösteriyorsa, infekte nekrozis için cerrahi debridmant uygulanmalıdır. Histoloji: AP genelde hafif ve şiddetli olmak üzere, 2 gruba ayrılır. Hafif vakalarda interstisyel ödem ve hemoraji ile nekroz olmaksızın iltihabi infiltrasyon saptanır. Şiddetli vakalarda, aşırı nekroz ve inflamasyon, beraberinde pankreasda şiddetli bozukluk ve multiorgan yetmezliği vardır. Cerrahide, peripankreatik yağ dokusunda nekroz, birçok vakada arteryel trombozis, panlobüler infarkta kadar uzanan nekroz, kanama ve gangrenöz doku saptanır.
Diğer testler: Herediter ve idiopatik rekküran pankreatitlerde, birçok genetik anomaliler saptandığından, katyonik tripsinojen gen mutasyonları, CTFR gen mutasyonları v.s uygun vakalarda bakılmalıdır. Çöliak/süperior mezenterik anjiografi, kanama, tromboz veya psödoanevrizma düşünülen vakalarda uygulanabilir, ancak rutinde uygulamak zordur.
Ayırıcı Tanı: AP birçok hastalıkla karışabilir. Bunlardan başlıcaları; Abdominal künt veya penetre travma
Akut batın ve gebelik Biliyer kolik Kolanjitis, Kolesistit Koledokolithiazis, kolelithiazis Divertikülitis Duodenal ülser Amfizem Amfizematöz kolesistit Akut gastritis Hiperamilazemi durumları İntestinal perforasyon İntraabdominal sepsis Mezenter arter trombozu Myokard infarktüsü Omental torsiyon
2.8.7. Evreleme
Birçok evreleme sistemleri mevcut olup, hepsinin hem avantajları, hem de dezavantajları vardır. Evrelemede RANSON (Tablo 3). APACHE II, Balthazar, Atlanta, Glasgow kriterleri kullanılmaktadır.
RANSON kriterleri: Hastalık semptomlarının başladığı, ilk 48 saat içinde uygulanmalıdır. Sensitivitesi %75, spesivitesi %77’dir.
Tablo 5: Ranson kriterleri (41)
İlk Başvuruda
Yaş >55
Lökosit sayısı >16.000 /mm3
Glikoz >200 mg/dl (D.Mellitus yoksa) LDH >350 IU/L
AST >250 U/L
48 Saat Sonra
Htc ’in %10’dan düşük olması BUN > 5 mg/dl
Ca < 8 mg/dl PaO2 <60 mmHg Baz açığı > 4 mEq/L Sıvı sekestrasyonu > 6L